Содержание
Амфотерные оксиды
Пользователи также искали:
амфотерные оксиды формулы,
амфотерные оксиды и гидроксиды 8 класс,
амфотерные оксиды как определить,
амфотерные оксиды свойства,
амфотерные оксиды взаимодействуют с,
амфотерный оксид пример,
урок амфотерные оксиды и гидроксиды.,
Амфотерные,
амфотерные,
оксиды,
Амфотерные оксиды,
гидроксиды,
амфотерные оксиды взаимодействуют с,
амфотерные оксиды как определить,
амфотерный оксид пример,
амфотерные гидроксиды,
свойства,
формулы,
взаимодействуют,
определить,
класс,
урок,
амфотерный,
оксид,
пример,
амфотерные оксиды формулы,
амфотерные оксиды свойства,
амфотерные оксиды и гидроксиды 8 класс,
урок амфотерные оксиды и гидроксиды,
амфотерные оксиды и гидроксиды класс,
амфотерные оксиды,
Химические свойства оксидов
Конспект к уроку «Химические свойства оксидов»
Оксиды — неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода.
Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода.
Бывают:
солеобразующие (способны образовывать соли)
несолеобразующие (не могут образовывать соли, например, NO, N2O, SiO, CO).
Солеобразующие оксиды делятся на:
- кислотные (образованы неметаллами или металлами со степенью окисления +5, +6,+7) СО2, Mn2O7, CrO3.
- основные (образованы металлами 1 и 2 группы) CuO, Na2O.
- амфотерные (образованы металлами со степенью окисления +3, но не всегда) Al2O3, ZnO, PbO, SnO, Fe2O3, BeO.
Химические свойства основных оксидов
1. Взаимодействие с водой (только основные оксиды, которым соответствуют растворимые гидроксиды )
CaO + h3O → Ca(OH)2
2. Взаимодействие с кислотными оксидами и кислотами
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
Хотя бы одному из оксидов должен соответствовать сильный гидроксид или сильная кислота.
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи.
K2O + Al2O3 → 2KAlO2
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями
FeO + C = Fe + CO
CuO + CO = Cu + CO2
CuO + h3 = Cu + h3O
3FeO + 2Al = Al2O3 + 3Fe
CuO + Mg = Cu + MgO
3CuO + 2Nh4 = 3Cu + 3h3O + N2
5. Взаимодействие оксидов металлов с окислителями
4FeO + O2 = 2Fe2O3
Химические свойства кислотных оксидов
1. Взаимодействие с основными оксидами и основаниями
При этом хотя бы одному из оксидов должен соответствовать сильный гидроксид или кислота.
SO3 + CuO = CuSO4
SO3 + Cu(OH)2 = CuSO4 + h3O
SO2 + 2NaOH = Na2SO3 + h3O
SO2 + Na2O = Na2SO3
2. Взаимодействие с водой (оксиды, которым соответствуют неустойчивые кислоты, реагируют с водой обратимо)
Взаимодействие с водой (оксиды, которым соответствуют неустойчивые кислоты, реагируют с водой обратимо)
Исключение— оксид кремния.
SO3 + h3O = h3SO4
3. Взаимодействие с амфотерными оксидами и гидроксидами (только оксиды сильных или средних кислот).
3SO3 + Al2O3 = Al2(SO4)3
3SO3 + 2Al(OH)3 = Al2(SO4)3 + 3h3O
4. Взаимодействие с солями летучих кислот (менее летучие вытесняют более летучие)
CaCO3 + SiO2 = CaSiO3 + CO2
5. Оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3). Также оксиды могут выступать в роли восстановителей.
2SO2 + O2 = 2SO3
Химические свойства амфотерных оксидов
1. Взаимодействие с кислотами и кислотными оксидами
При этом амфотерные оксиды взаимодействуют с сильными и средними кислотами и их оксидами.
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3h3O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
2. Амфотерные оксиды не взаимодействуют с водой
Амфотерные оксиды не взаимодействуют с водой
3. Взаимодействие со щелочами
амфотерный оксид + щелочь = соль + вода (расплав)
Al2O3 + 2NaOH = 2NaAlO2 + h3O
амфотерный оксид + щелочь = комплексная соль(раствор)
ZnO + 2NaOH + h3O = Na2[Zn(OH)4]
4. Взаимодействие с основными оксидами
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
(в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей).
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Химические свойства несолеобразующих оксидов
Несолеобразующие оксиды могут реагировать с водородом
N2O + h3 = N2 + Н2O 2NO + 2 Н2 = N2 + 2 Н2OРеагируют с кислородом
2CO + О2 = 2CО22NO + О2 = 2NО2
При взаимодействии угарного газа с хлором при нагревании над активированным углем образуется фосген
2CO + Cl2 = 2COCl2
Оксид азота (I) — при нагревании разлагается 2N2O = 2N2 + О2
Страница не найдена — Саянский медицинский колледж
Я, субъект персональных данных, в соответствии с Федеральным законом от 27 июля 2006 года № 152 «О персональных данных» предоставляю ОГБПОУ «Саянский медицинский колледж» (далее — Оператор), расположенному по адресу Иркутская обл.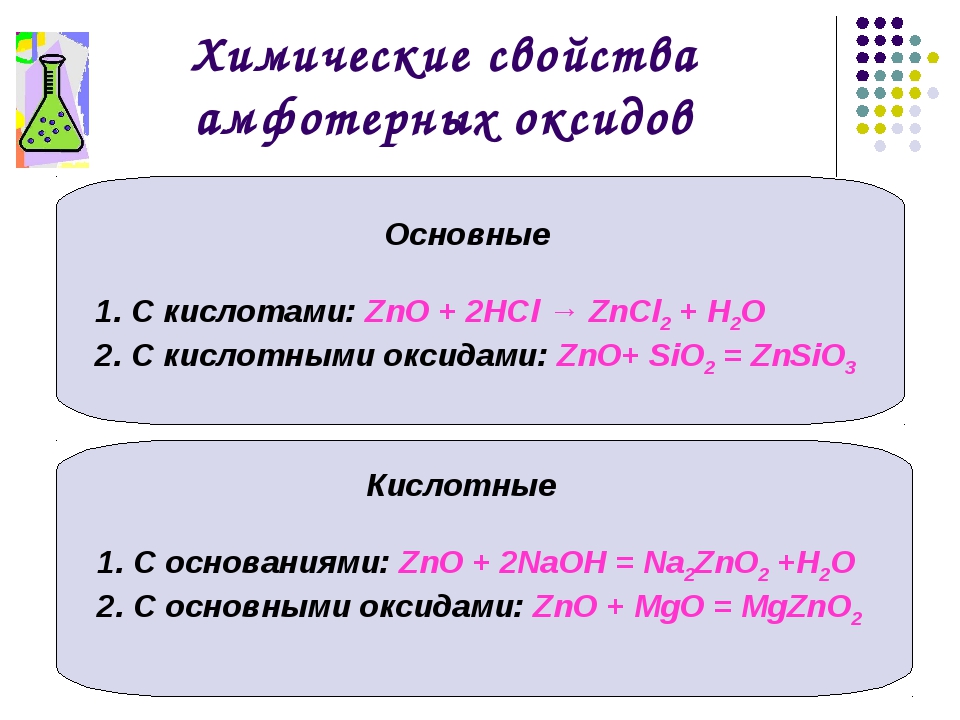 , г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
, г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
- Состав предоставляемых мной персональных данных является следующим: Имя, адрес электронной почты.
- Целями обработки моих персональных данных являются: обеспечение обмена короткими текстовыми сообщениями в режиме онлайн-диалога или обмена текстовыми сообщениями через электронную почту.
- Согласие предоставляется на совершение следующих действий (операций) с указанными в настоящем согласии персональными данными: сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, передачу (предоставление, доступ), блокирование, удаление, уничтожение, осуществляемых как с использованием средств автоматизации (автоматизированная обработка), так и без использования таких средств (неавтоматизированная обработка).
- Я понимаю и соглашаюсь с тем, что предоставление Оператору какой-либо информации о себе, не являющейся контактной и не относящейся к целям настоящего согласия, а равно предоставление информации, относящейся к государственной, банковской и/или коммерческой тайне, информации о расовой и/или национальной принадлежности, политических взглядах, религиозных или философских убеждениях, состоянии здоровья, интимной жизни запрещено.

- В случае принятия мной решения о предоставлении Оператору какой-либо информации (каких-либо данных), я обязуюсь предоставлять исключительно достоверную и актуальную информацию и не вправе вводить Оператора в заблуждение в отношении своей личности, сообщать ложную или недостоверную информацию о себе.
- Я понимаю и соглашаюсь с тем, что Оператор не проверяет достоверность персональных данных, предоставляемых мной, и не имеет возможности оценивать мою дееспособность и исходит из того, что я предоставляю достоверные персональные данные и поддерживаю такие данные в актуальном состоянии.
- Согласие действует по достижении целей обработки или в случае утраты необходимости в достижении этих целей, если иное не предусмотрено федеральным законом.
- Согласие может быть отозвано мною в любое время на основании моего письменного заявления.
Оксиды амфотерные — Справочник химика 21
Амфотерные гидроксиды и оксиды. Амфотерность (двойственность свойств) гидроксидов и оксидов некоторых элементов проявляется в образовании ими двух рядов солей. Например, для гидроксида и оксида алюминия [c.98]
Например, для гидроксида и оксида алюминия [c.98]
Гидроксиды щелочных металлов проявляют все характерные свойства оснований они взаимодействуют С кислотными и амфотерными оксидами, амфотерными гидроксидами, кислотами, солями. В водных растворах щелочей растворяются некоторые металлы, образующие амфотерные гидроксиды (бериллий, алюминий, цинк, олово и др.), например [c.247]
Все характеристические оксиды, как известно, относятся к оснбвным й кислотным. Первые являются оксидами металлов, вторые генетически связаны с неметаллами. Поскольку нет четкой границы между металлами и неметаллами, существует большая группа амфотерных оксидов. Амфотерность определяется не только положением элемента в Периодической системе, но и зависит от его степени окисления. Ориентируясь на разность ОЭО, можно утверждать, что оксиды металлов должны быть преимущественно ионными, а оксиды неметаллов — преимущественно ковалентными. Поскольку для одного и того же элемента с увеличением степени окисления его электроотрицательность растет, то в этом направлении — от низших к высшим оксидам — растет ковалентный вклад. Вследствие этого наблюдается изменение свойств оксидов от основных к кислотным, например ОЭО (Сг2+) = 1,4, ОЭО (СгЗ ) = 1,6, ОЭО (Сгв ) = 2,4, и свойства оксидов закономерно изменяются [c.267]
Поскольку для одного и того же элемента с увеличением степени окисления его электроотрицательность растет, то в этом направлении — от низших к высшим оксидам — растет ковалентный вклад. Вследствие этого наблюдается изменение свойств оксидов от основных к кислотным, например ОЭО (Сг2+) = 1,4, ОЭО (СгЗ ) = 1,6, ОЭО (Сгв ) = 2,4, и свойства оксидов закономерно изменяются [c.267]
Щелочи реагируют с кислотами, кислотными оксидами, амфотерными гидроксидами, с образованием солей [c.65]
Платиновые металлы разрушаются при нагревании, со щелоча ми в присутствии кислорода, поскольку их оксиды амфотерны. Поэтому в платиновой посуде нельзя плавить щелочи, для этого используют железную, никелевую или серебряную посуду. Плати новые изделия нельзя нагревать во внутреннем конусе пламени газовой горелки и в коптящем пламени, так как с углеродом платина легко образует карбид и разрушается. [c.575]
Разрушение оксидов амфотерных металлов происходит также при их сплавлении с основаниями, причем после частичного разрыва связи металл— кислород в кристаллической решетке происходит образование комплексного оксо-иона [c. 392]
392]
Оксиды амфотерные — оксиды, проявляющие свойства как основных, так и кислотных оксидов. [c.375]
Оксиды МО2 образуются при накаливании металлов в токе кислорода. АЯобр и оксидов приведены в табл. 17.41. Оксиды амфотерны с преобладанием основных свойств. [c.513]
Основный оксид Амфотерный оксид Кислотный оксид [c.319]
Известны два оксида олова — окись ЗпО и двуокись ЗпОг-Оба оксида амфотерны, взаимодействуют с кислотами [c.270]
Основный гидроксид, щелочь. Белый, имеет ионное строение Na+OH . Плавится и кипит без разложения. Расплывается на воздухе, поглощает углекислый газ. Хорошо растворим в воде (с высоким э/сзо-эффектом), создает в растворе сильнощелочную среду. Нейтрализуется кислотами, реагирует с кислотными оксидами, амфотерными гидроксидами и оксидами. Концентрированный раствор разъедает стекло. Применяется в производстве бумаги, мыла и искусственного волокна, как осушитель газов. Распространенный реагент в лабораторной практике. Вызывает тяжелые ожоги кожи и глаз. [c.109]
Распространенный реагент в лабораторной практике. Вызывает тяжелые ожоги кожи и глаз. [c.109]
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на основные, кислотные и амфотерные. Основные оксиды образуют соли при взаимодействии с кислотами или кислотными оксидами. Кислотные оксиды образуют соль при взаимодействии с основаниями или основными оксидами. Амфотерные оксиды образуют соли при взаимодействии как с кислотами или кислотными оксидами, так и с основаниями или основными оксидами. [c.23]
Этот оксид амфотерный и из него получают соли двухвалентного олова, рассматриваемые в товарной позиции 2841. Используется в органическом синтезе как восстановитель и катализатор. [c.69]
Взаимодействие с кислотными и амфотерными сксндами (см. выше Общие свойства кислотных оксидов , Амфотерные оксиды ) растьор, ( [c. 156]
156]
Амфотерные оксиды. Амфотерными называются такие оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, т. е. обладают двойственными свойствами. К ним относятся некоторые оксиды металлов ZnO, AI2O3, Сг Оз и др. [c.124]
Основные и амфотерные оксиды — это соединения металлов и амфотер-ных элементов с кислородом. Взаимодействуя с кислотными оксидами или кислотами, такие оксиды образуют соли. Некоторые из основных оксидов могут реагировать с водой, превращаясь в сильные основания — щелочи. Первым основным оксидом, с которым имел дело человек, был оксид кальция СаО — негашеная известь, которая образуется при обжиге известняка (карбоната кальция СаСОд). Почти одновременно (а может быть, и раньше) люди узнали другой оксид, амфотерный. Это был драгоценный камень рубин, оксид алюминия AlgOg, прозрачные кристаллы которого имеют кроваво-красный цвет из-за примеси оксида хрома СгдОд. Рубины с незапамятных времен украшали короны властителей — царей, королей, султанов. .. [c.70]
.. [c.70]
Основные и амфотерные оксиды — это соединения металлов и амфотер ных элементов с кислородом Взаимодействуя с кислотными оксидами или кислотами, такие оксиды образуют соли Некоторые из основных оксидов могут реагировать с водой, превращаясь в сильные основания — щелочи Первым основным оксидом, с которым имел дело чело век, был оксид кальция СаО — негашеная известь, которая образуется при обжиге известняка (карбоната кальция СаСОд) Почти одновременно (а может быть, и раньше) люди узнали другой оксид, амфотерный Это был драгоценный камень рубин, оксид алюминия AlgOg, прозрач [c.70]
В щелочах взаимодействие идет труднее и образуются комплексные соединения Маз[1п(ОН)б] или Ма[Т1(0Н)4]. Причем TI2O3 не растворяется, а лишь пептизируется, дробясь на отдельные агрегаты типа ТЬОз-дгНгО. Следовательно, оксиды амфотерны, но кислотный характер у них выражен слабее, чем у соответствующих соединений алюминия и галлия. Гидроксиды 1п(0Н)з и Т1(0Н)з — нерастворимые в воде студенистые осадки неопределенного состава получаются из солей действием щелочи. У гидроксида индия основные свойства преобладают над кислотными, а у гидроксида таллия кислотная функция практически отсутствует. Соединения таллия (111) сильнейшие окислители, так как он стремится перейти в степень окисления Ч-1, для которой известны многочисленные соединения таллия. Соединения индия (I) неустойчивы и являются сильными восстановителями. При взаимодействии с кислородом таллий образует смесь двух оксидов TI2O и TI2O3. При 90° С оксид таллия (111) начинает отделять кислород и получается оксид таллия (I) черного цвета [c.321]
У гидроксида индия основные свойства преобладают над кислотными, а у гидроксида таллия кислотная функция практически отсутствует. Соединения таллия (111) сильнейшие окислители, так как он стремится перейти в степень окисления Ч-1, для которой известны многочисленные соединения таллия. Соединения индия (I) неустойчивы и являются сильными восстановителями. При взаимодействии с кислородом таллий образует смесь двух оксидов TI2O и TI2O3. При 90° С оксид таллия (111) начинает отделять кислород и получается оксид таллия (I) черного цвета [c.321]
Кислоты и основания. При взаимодействии (прямом или косвенном) оксидов с водой образуются их гидратные формы, которые имеют характер кислот, оснований или амфотерных гидроксидов. Причем кислотные оксиды образуют с водой кислоты (S0s + h30 = = h3S04), основные оксиды — основания (К20 + Н20 = = 2К0Н), а амфотерные оксиды — амфотерные гидроксиды [ZnO + Н2О = Zn (ОН) 2 h3Zn02]. [c.26]
[c.26]
Неорганическая химия (1989) — [
c.62
]
Общая химия в формулах, определениях, схемах (1996) — [
c.20
]
Общая химия (1979) — [
c.349
]
Общая химия в формулах, определениях, схемах (0) — [
c.20
]
Химия (2001) — [
c.255
]
Общая химия в формулах, определениях, схемах (1985) — [
c.20
]
Общая химия в формулах, определениях, схемах (0) — [
c.20
]
Аккумулятор знаний по химии (1977) — [
c.15
]
Аккумулятор знаний по химии (1985) — [
c.15
]
Специфические свойства оксидов.
 Оксиды. Получение и свойства. Типичные реакции амфотерных оксидов
Оксиды. Получение и свойства. Типичные реакции амфотерных оксидов
Оксиды
— сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления -2
.
По способности образовывать соли оксиды делят на солеобразующие
и несолеобразующие
(СО,SiO,NO,N 2 О). Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные
.
Основными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты. К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы-металлы: щелочные (Li 2 О, Na 2 О, К 2 О, Cs 2 О, Rb 2 О), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3(Cu 2 O, CuO, Ag 2 O, СrO, FeO, MnO, СоO, NiO).
Кислотные оксиды образуют как элементы-неметаллы (СО 2 , SO 2 , NO 2 ,Р 2 O 5 , Cl 2 O 7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V 2 O 5 , СrO 3 , Mn 2 O 7 , MnO 3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI 2 O 3 , Fe 2 O 3 , BeO, Cr 2 O 3 , PbO, SnO, MnO 2).
Амфотерные оксиды образуют только элементы металлы (ZnO, AI 2 O 3 , Fe 2 O 3 , BeO, Cr 2 O 3 , PbO, SnO, MnO 2).
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды твердые вещества, кислотные оксиды могут быть жидкими (SO 3 ,Сl 2 O7,Mn 2 O7), газообразными (CO 2 , SO 2 , NO 2) и твердыми (P 2 O 5 , SiO 2). Некоторые имеют запах (NO 2 , SO 2), однако большинство оксидов запаха не имеют. Одни оксиды окрашены: бурый газ NO 2 , вишнево-красный CrO 3 , черные CuO и Ag 2 O, красные Cu 2 O и HgO, коричневый Fe 2 O 3 , белые SiO 2 , Аl 2 O 3 и ZnO, другие — бесцветные (H 2 O, CO 2 , SO 2).
Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра. Основные и амфотерные оксиды имеют , для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).
Al 2 O 3 +6KOH+3H 2 O=2K 3 — гексагидроксоалюминат калия;
ZnO+2NaOH+H 2 O=Na 2 — тетрагидроксоцинкат натрия;
2. Классификация, получение и свойства оксидов
Классификация, получение и свойства оксидов
Из бинарных соединений наиболее известны оксиды. Оксидами
называются соединения, состоящие из двух элементов, одним из которых является
кислород, имеющий степень окисления -2.
По функциональным признакам
оксиды подразделяются на солеобразующие и несолеобразующие (безразличные)
.
Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и
амфотерные.
Названия оксидов
образуются с применением слова «оксид» и русского названия элемента в
родительном падеже с указанием римскими цифрами валентности элемента, например:
SO
2
— оксид серы (IV
),
SO
3
— оксид серы (VI
),
CrO
— оксид хрома (II
),
Cr
2
O
3
— оксид хрома (III
).
2.1. Основные оксиды
Основными называются
оксиды, взаимодействующие с кислотами (или с кислотными оксидами) с
образованием солей.
К основным оксидам
относятся оксиды типичных металлов , им соответствуют гидроксиды, обладающие
свойствами оснований (основные гидроксиды), причем степень окисления элемента
не изменяется при переходе от оксида к гидроксиду, например,
Получение
основных оксидов
1. Окисление металлов при
Окисление металлов при
нагревании в атмосфере кислорода:
2Mg
+ O 2 = 2MgO,
2Cu
+ O 2 = 2CuO.
Этот метод неприменим для щелочных
металлов, которые при окислении обычно дают пероксиды и супероксиды, и только
литий, сгорая, образует оксид
Li
2
O
.
2. Обжиг сульфидов:
2
CuS
+ 3
O
2
= 2
CuO
+
2
SO
2
,
4
FeS
2
+ 11
O
2
= 2
Fe
2
O
3
+ 8
SO
2
.
Метод неприменим для сульфидов
активных металлов , окисляющихся до сульфатов.
3. Разложение гидроксидов
(при высокой температуре):
С
u
(OH
) 2 =
CuO
+
H
2
O
.
Этим методом нельзя получить оксиды
щелочных металлов.
4. Разложение солей
кислородсодержащих кислот (при высокой температуре):
ВаСО
3
=
ВаО
+
СО
2
,
2Pb(NO 3) 2
= 2PbO + 4NO 2 + O 2 ,
4
FeSO
4
= 2
Fe
2
O
3
+ 4
SO
2
+
O
2
.
Этот способ получения оксидов
особенно легко осуществляется для нитратов и карбонатов, в том числе и для
основных солей:
(ZnOH) 2 CO 3
= 2ZnO +CO 2 + H 2 O.
Свойства основных оксидов
Большинство основных
оксидов представляет собой твердые кристаллические вещества ионного характера,
в узлах кристаллической решетки расположены ионы металлов, достаточно прочно
связанные с оксид-ионами О —2 , поэтому оксиды типичных металлов
обладают высокими температурами плавления и кипения.
1. Большинство основных
оксидов не распадаются при нагревании, исключение составляют оксиды ртути и
благородных металлов:
2HgO
= 2Hg + O 2 ,
2Ag 2 O
= 4Ag + O 2 .
2. Основные оксиды при
нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с
кислотами:
BaO
+ SiO 2 = BaSiO 3 ,
MgO
+ Al 2 O 3 = Mg(AlO 2) 2 ,
ZnO
+ H 2 SO 4 = ZnSO 4 + H 2 O.
3. Присоединяя
(непосредственно или косвенно) воду, основные оксиды образуют основания
(основные гидроксиды). Оксиды щелочных и щелочноземельных металлов
непосредственно реагируют с водой:
Li
2
O
+
H
2
O
= 2
LiOH
,
CaO
+
H
2
O
=
Ca
(OH
) 2 .
Исключение составляет оксид магния
MgO
. Из него нельзя получить гидроксид
магния
Mg
(OH
) 2 при взаимодействии с водой.
4. Как и все другие типы
оксидов, основные оксиды могут вступать в окислительно-восстановительные
реакции:
Fe 2 O 3
+ 2Al = Al 2 O 3 + 2Fe,
3CuO
+ 2NH 3 = 3Cu + N 2 + 3H 2 O,
4
FeO
+
O
2
= 2
Fe
2
O
3
.
М.В. Андрюxoва, Л.Н. Бopoдина
Взаимодействие оксидов с кислотами
С кислотами реагируют основные и амфотерные оксиды. При этом образуются соли и вода:
FeO + H 2 SO 4 = FeSO 4 + H 2 O
Несолеобразующие оксиды не реагируют с кислотами вообще, а кислотные оксиды не реагируют с кислотами в большинстве случаев.
Когда все-таки кислотный оксид реагирует с кислотой?
Решая часть ЕГЭ с вариантами ответа, вы должны условно считать, что кислотные оксиды не реагируют ни с кислотными оксидами, ни с кислотами, за исключением следующих случаев:
1) диоксид кремния, будучи кислотным оксидом, реагирует с плавиковой кислотой, растворяясь в ней. В частности, благодаря этой реакции в плавиковой кислоте можно растворить стекло. В случае избытка HF уравнение реакции имеет вид:
В частности, благодаря этой реакции в плавиковой кислоте можно растворить стекло. В случае избытка HF уравнение реакции имеет вид:
SiO 2 + 6HF = H 2 + 2H 2 O
,
а в случае недостатка HF:
SiO 2 + 4HF = SiF 4 + 2H 2 O
2) SO 2 , будучи кислотным оксидом, легко реагирует с сероводородной кислотой H 2 S по типу сопропорционирования
:
S +4 O 2 + 2H 2 S -2 = 3S 0 + 2H 2 O
3) Оксид фосфора (III) P 2 O 3 может реагировать с кислотами-окислителями, к которым относятся концентрированная серная кислота и азотная кислота любой концентрации. При этом степень окисления фосфора повышается от значения +3 до +5:
| P 2 O 3 | + | 2H 2 SO 4 | + | H 2 O | =t o => | 2SO 2 | + | 2H 3 PO 4 | ||||||||
| (конц.) | ||||||||||||||||
| 3P 2 O 3 | + | 4HNO 3 | + | 7H 2 O | =t o => | 4NO | + | 6H 3 PO 4 | ||||||||
(разб. ) ) | ||||||||||||||||
| P 2 O 3 | + | 4HNO 3 | + | H 2 O | =t o => | 2H 3 PO 4 | + | 4NO 2 |
| (конц.) |
4) Оксид серы (IV) SO 2 может быть окислен азотной кислотой, взятой в любой концентрации. При этом степень окисления серы повышается с +4 до +6.
| 2HNO 3 | + | SO 2 | =t o => | H 2 SO 4 | + | 2NO 2 | ||
| (конц.) | ||||||||
| 2HNO 3 | + | 3SO 2 | + | 2H 2 O | =t o => | 3H 2 SO 4 | + | 2NO |
(разб. ) ) |
Взаимодействие оксидов с гидроксидами металлов
С гидроксидами металлов как основными, так и амфотерными реагируют кислотные оксиды. При этом образуется соль, состоящая из катиона металла (из исходного гидроксида металла) и кислотного остатка кислоты, соответствующей кислотному оксиду.
SO 3 + 2NaOH = Na 2 SO 4 + H 2 O
Кислотные оксиды, которым соответствуют слабые кислоты или кислоты средней силы, с щелочами могут образовывать как нормальные, так и кислые соли:
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O
CO 2 + NaOH = NaHCO 3
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
P 2 O 5 + 4KOH = 2K 2 HPO 4 + H 2 O
P 2 O 5 + 2KOH + H 2 O = 2KH 2 PO 4
«Привередливые» оксиды CO 2 и SO 2 , активности которых, как уже было сказано, не хватает для протекания их реакции с малоактивными основными и амфотерными оксидами, тем не менее, реагируют с большей частью соответствующих им гидроксидов металлов. Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только осно
Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только осно
вные соли, называемые гидроксокарбонатами и гидроксосульфитами, а образование средних (нормальных) солей невозможно:
2Zn(OH) 2 + CO 2 = (ZnOH) 2 CO 3 + H 2 O
(в растворе)
2Cu(OH) 2 + CO 2 = (CuOH) 2 CO 3 + H 2 O
(в растворе)
Однако с гидроксидами металлов в степени окисления +3, например, такими, как Al(OH) 3 , Cr(OH) 3 , Fe(OH) 3 и т.д., углекислый и сернистый газ не реагируют вовсе.
Следует отметить также особую инертность диоксида кремния (SiO 2), в природе наиболее часто встречаемого в виде обычного песка. Данный оксид является кислотным, однако из гидроксидов металлов способен реагировать только с концентрированными (50-60%) растворами щелочей, а также с чистыми (твердыми) щелочами при сплавлении. При этом образуются силикаты:
2NaOH + SiO 2 =
t o
=> Na 2 SiO 3 + H 2 O
Амфотерные оксиды из гидроксидов металлов реагируют только со щелочами (гидроксидами щелочных и щелочноземельных металлов). При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
ZnO + 2NaOH + H 2 O = Na 2
— тетрагидроксоцинкат натрия
BeO + 2NaOH + H 2 O = Na 2
— тетрагидроксобериллат натрия
Al 2 O 3 + 2NaOH + 3H 2 O = 2Na
— тетрагидроксоалюминат натрия
Cr 2 O 3 + 6NaOH + 3H 2 O = 2Na 3
— гексагидроксохромат (III) натрия
А при сплавлении этих же амфотерных оксидов со щелочами получаются соли, состоящие из катиона щелочного или щелочноземельного металла и аниона вида MeO 2 x- , где x
= 2 в случае амфотерного оксида типа Me +2 O и x
= 1 для амфотерного оксида вида Me 2 +2 O 3:
ZnO + 2NaOH =
t o
=> Na 2 ZnO 2 + H 2 O
BeO + 2NaOH =
t o
=> Na 2 BeO 2 + H 2 O
Al 2 O 3 + 2NaOH =
t o
=> 2NaAlO 2 + H 2 O
Cr 2 O 3 + 2NaOH =
t o
=> 2NaCrO 2 + H 2 O
Fe 2 O 3 + 2NaOH =
t o
=> 2NaFeO 2 + H 2 O
Следует отметить, что соли, получаемые сплавлением амфотерных оксидов с твердыми щелочами, могут быть легко получены из растворов соответствующих комплексных солей их упариванием и последующим прокаливанием:
Na 2 =
t o
=> Na 2 ZnO 2 + 2H 2 O
Na =
t o
=> NaAlO 2 + 2H 2 O
Взаимодействие оксидов с солями
Чаще всего соли с оксидами не реагируют.
Однако следует выучить следующие исключения из данного правила, часто встречающиеся на экзамене.
Одним из таких исключений является то, что амфотерные оксиды, а также диоксид кремния (SiO 2) при их сплавлении с сульфитами и карбонатами вытесняют из последних сернистый (SO 2) и углекислый (CO 2) газы соответственно. Например:
Al 2 O 3 + Na 2 CO 3 =
t o
=> 2NaAlO 2 + CO 2
SiO 2 + K 2 SO 3 =
t o
=> K 2 SiO 3 + SO 2
Также к реакциям оксидов с солями можно условно отнести взаимодействие сернистого и углекислого газов с водными растворами или взвесями соответствующих солей — сульфитов и карбонатов, приводящее к образованию кислых солей:
Na 2 CO 3 + CO 2 + H 2 O = 2NaHCO 3
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2
Также сернистый газ при пропускании его через водные растворы или взвеси карбонатов вытесняет из них углекислый газ благодаря тому, что сернистая кислота является более сильной и устойчивой кислотой, чем угольная:
K 2 СO 3 + SO 2 = K 2 SO 3 + CO 2
ОВР с участием оксидов
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2.
Единственным элементом, не образующим оксид, является фтор
, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие
оксиды (CO 2 , N 2 O 5 ,Na 2 O, SO 3 и т. д.) - Несолеобразующие
оксиды(CO, N 2 O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды
— (Оксиды металлов — Na 2 O, CaO, CuO и т д) - Кислотные оксиды
— (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn 2 O 7 ,CO 2 , N 2 O 5 , SO 2 , SO 3 и т д) - (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты
Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты
. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:Аналогично, амфотерным оксидам соответствуют амфотерные основания
, которые могут проявлять как кислотные, так и основные свойства:Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность
.
CO 2 – оксид углерода (IV)
N 2 O 3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н 2 О), так и газами (СО 2 , SO 3) или твёрдыми веществами (Al 2 O 3 , Fe 2 O 3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н 2 О, СО) и белой (ZnO, TiO 2) до зелёной (Cr 2 O 3) и даже чёрной (CuO).
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований:Взаимодействие некоторых металлов с водой:
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO 3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO 2 является основным компонентом стекла. Оксид хрома Cr 2 O 3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO 2 , который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Рис. 1. Классификация оксидов.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO 2), так и твердыми (Fe 2 O 3) или жидкими веществами (H 2 O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K 2 O, СaO соответствуют основания KOH, Ca(OH) 2 .
Рис. 2. Основные оксиды и соответствующие им основания.
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO 2 (кислотный оксид)=СaCO 3 (соль)
FeO (основной оксид)+H 2 SO 4 (кислота)=FeSO 4 (соль)+2H 2 O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H 2 O (вода)=Ba(OH) 2 (основание щелочнозем. металла)
металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH 3 =3Cu+3H 2 O+N 2
При нагревании разлагаются только оксиды ртути и благородных металлов:
Рис. 3. Оксид ртути.
Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| HgO | твердое вещество красного или желто-оранжевого цвета | |
| Оксид калия | K 2 O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na 2 O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li 2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
Химические свойства кислотных оксидов
SO2
+
H2O
= H2SO3
; Mn2O7
+ H2O
= 2HMnO4
сернистая
кислота; марганцовая
кислота
Формулу
кислоты, соответствующей кислотному
оксиду, можно найти, записав реакцию
взаимодействия оксида с водой. Если
Если
индексы у атомов элементов, входящих в
состав молекулы кислоты оказываются
кратными какому — либо числу, то при
записи простейшей формулы индексы
сокращают на это число, а его записывают
перед формулой кислоты:
N2O5
+ H2O
= H2N2O6
= 2HNO3
;
Br2O5
+ H2O
= H2Br2O6
=HBrO3
азотная
кислота ; бромноватая
кислота
CO2
+ Na2O
= 2 Na2CO3
; CO2
+ 2NaOH = Na2CO3
+ H2O
Na2CO3
— соль
–
карбонат
натрия;
P2O5
+ 6KOH = 2K3PO4
+ H2O
соль
– ортофосфат
калия
SO3
+ ZnO = ZnSO4
; SO3
+ Zn(OH)2
= ZnSO4
+ H2O
ZnSO4
— соль – сульфат цинка
Химические свойства амфотерных оксидов
Cr2O3
+ 3SO3
= Cr2(SO4)2;
ZnO
+ 2HCl = ZnCl2
+ H2O
BeO
+ K2O
= K2BeO2;
BeO + 2KOH = K2BeO2
+ H2O
Гидроксиды
Гидроксиды
обычно
рассматривают как продукты взаимодействия
оксидов с водой независимо от того,
наблюдается это взаимодействие в
действительности или гидроксид может
быть получен только косвенным путем
(например, реакцией обмена соли со
щелочью). Основным оксидам соответствуют
Основным оксидам соответствуют
основания, кислотным –
кислоты,
амфотерным оксидам –
амфотерные
гидроксиды.
Химические свойства оснований
Основаниями
называют вещества, которые состоят из
катиона металла и гидроксогрупп (ОН),
которые могут замещаться на кислотные
остатки. Общая формула оснований Ме(ОН)n
,где n
= 1,2. Например: NaOH,
Ca(OH)2,
Cu(OH)2.
Растворимые в воде основания называют
щелочами.
NaOH
+ HCl = NaCl + H2O
; Ca(OH)2
+ CO2=
CaCO3
2NaOH
+ Al2O3
= 2NaAlO2
+ H2O;
NaOH + Al(OH)3
= NaAlO2
+ 2H2O
NiCl2
+ 2NaOH = Ni(OH)2↓
+ 2NaCl
Ni(OH)2
= NiO
+ H2O
Химические свойства кислот
Кислотами
называют
соединения, в состав которых входят
ионы водорода, способные замещаться на
катионы металла, и анионы кислот (SO42–,
CO32–,
Cl–,
PO43–,
NO3–
и т. д.).
д.).
Различают
бескислородные
и
кислородсодержащие
кислоты.
Бескислородными
кислотами являются водные растворы
некоторых водородных соединений
элементов (неметаллов VI,
VII
групп периодической системы элементов:
HCl,
HBr,
HI,
H2S,
H2Se,
H2Te),
а также HSCN,
HCN.
Кислородсодержащие
кислоты
получают растворением кислотных оксидов
в воде, поэтому их относят классу
гидроксидов:
SO2
+ H2O
= H2SO3;
N2O3
+ H2O
= 2HNO2;
P2O5
+ 3 H2O
= 2H3PO4.
Кислородсодержащие
кислоты имеют общую формулу HхЭОу.
H2SO4
+ СuO
= CuSO4
+ H2O;
H2SO4
+ Сu(OH)2
= CuSO4
+ 2H2O;
2HNO3
+ ZnO = Zn(NO3)2
+ H2O;
2HNO3
+ Zn(OH)2
= Zn(NO3)2
+ 2H2O
BaCl2
+ H2SO4
= BaSO4↓
+ H2O
H2SiO3
= SiO2
+ H2O
Амфотерные соединения | Дистанционные уроки
05-Дек-2014 | комментария 4 | Лолита Окольнова
и их свойства
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + h3O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
h3SO4 + 2KOH → K2SO4 + 2h3O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Наиболее часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды): ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, Al2O3, Al(OH)3, Fe2O3, Fe(OH)3, Cr2O3, Cr(OH)3.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами.
- с взаимодействием с кислотами все просто, в этих реакциях амфотерные соединения ведут себя как основные:
Оксиды:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
ZnO + H2SO4 → ZnSO4 + H2O
BeO + HNO3 → Be(NO3)2 + H2O
Точно так же реагируют гидроксиды:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Pb(OH)2 + 2HCl → PbCl2 + 2H2O
- С взаимодействием со щелочами немного сложнее.
 В этих реакциях амфотерные соединения ведут себя как кислоты, и продукты реакции могут быть различными, все зависит от условий.
В этих реакциях амфотерные соединения ведут себя как кислоты, и продукты реакции могут быть различными, все зависит от условий.
Или реакция происходит в растворе, или реагирующие вещества берутся твердые и сплавляются.
Разберем на примере гидроксида цинка. Как уже говорилось ранее, амфотерные соединения взаимодействуя с основными, ведут себя как кислоты. Вот и запишем гидроксид цинка Zn(OH)2 как кислоту. У кислоты водород спереди, вынесем его: H2ZnO2. И реакция щелочи с гидроксидом будет протекать как будто он – кислота. «Кислотный остаток» ZnO22- двухвалентный:
2KOH(тв.) + H2ZnO2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
Полученное вещество K2ZnO2 называется метацинкат калия (или просто цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» H2ZnO2 (солями такие соединения называть не совсем правильно, но для собственного удобства мы про это забудем). Только гидроксид цинка записывать вот так: H2ZnO2 – нехорошо. Пишем как обычно Zn(OH)2, но подразумеваем (для собственного удобства), что это «кислота»:
Только гидроксид цинка записывать вот так: H2ZnO2 – нехорошо. Пишем как обычно Zn(OH)2, но подразумеваем (для собственного удобства), что это «кислота»:
2KOH(тв.) + Zn(OH)2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
С гидроксидами, в которых 2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2BeO2 (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2PbO2 (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя группами OH (Al(OH)3, Cr(OH)3, Fe(OH)3) немного иначе.
Разберем на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: H3AlO3, но в таком виде не оставляем, а выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH → H2O + KAlO2 (метаалюминат калия, или просто алюминат)
Но гидроксид алюминия вот так HAlO2 записывать нельзя, записываем как обычно, но подразумеваем там «кислоту»:
Al(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KAlO2(метаалюминат калия)
То же самое и с гидроксидом хрома:
Cr(OH)3 → H3CrO3 → HCrO2
Cr(OH)3(тв. ) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия,
) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли хромовой кислоты).
С гидроксидами содержащими четыре группы ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → H4SnO4 → H2SnO3
Pb(OH)4 → H4PbO4 → H2PbO3
Следует помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4, Pb(OH)4).
И эти гидроксиды будут образовывать разные «соли»:
Степень окисления | +2 | +4 | ||
Формула гидроксида |
|
|
|
|
Формула гидроксида в виде кислоты | H2SnO2 | H2PbO2 | H2SnO3 | H2PbO3 |
Соль (калиевая) | K2SnO2 | K2PbO2 | K2SnO3 | K2PbO3 |
Название соли | станнИТ | блюмбИТ | метастаннАТ | метаблюмбАТ |
Те же принципы, что и в названиях обычных «солей», элемент в высшей степени окисления – суффикс АТ, в промежуточной – ИТ.
Такие «соли» (метахроматы, метаалюминаты, метабериллаты, метацинкаты и т.д.) получаются не только в результате взаимодействия щелочей и амфотерных гидроксидов. Эти соединения всегда образуются, когда соприкасаются сильноосновный «мир» и амфотерный (при сплавлении). То есть точно так же как и амфотерные гидроксиды со щелочами будут реагировать и амфотерные оксиды, и соли металлов, образующих амфотерные оксиды (соли слабых кислот). И вместо щелочи можно взять сильноосновный оксид, и соль металла, образующего щелочь (соль слабой кислоты).
Взаимодействия:
Запомните, реакции, приведенные ниже, протекают при сплавлении.
Амфотерного оксида с сильноосновным оксидом:
ZnO(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 (метацинкат калия, или просто цинкат калия)
Амфотерного оксида со щелочью:
ZnO(тв. ) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
Амфотерного оксида с солью слабой кислоты и металла, образующего щелочь:
ZnO(тв.)+ K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
Амфотерного гидроксида с сильноосновным оксидом:
Zn(OH)2(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
Амфотерного гидроксида со щелочью:
Zn(OH)2(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + 2H2O↑
Амфотерного гидроксида с солью слабой кислоты и металла, образующего щелочь:
Zn(OH)2(тв.
 ) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
Соли слабой кислоты и металла, образующего амфотерные соединение с сильноосновным оксидом:
ZnCO3(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
Соли слабой кислоты и металла, образующего амфотерные соединение со щелочью:
ZnCO3(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
Соли слабой кислоты и металла, образующего амфотерные соединение с солью слабой кислоты и металла, образующего щелочь:
ZnCO3(тв. )+ K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
)+ K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
Ниже представлена информация по солям амфотерных гидроксидов, красным помечены наиболее встречающиеся в ЕГЭ.
Оксид | Гидроксид | Гидроксид в виде кислоты | Кислотный остаток | Соль | Название соли |
BeO | Be(OH)2 | H2BeO2 | BeO22- | K2BeO2 | Метабериллат (бериллат) |
ZnO | Zn(OH)2 | H2ZnO2 | ZnO22- | K2ZnO2 | Метацинкат (цинкат) |
Al2O3 | Al(OH)3 | HAlO2 | AlO2— | KAlO2 | Метаалюминат (алюминат) |
Fe2O3 | Fe(OH)3 | HFeO2 | FeO2— | KFeO2 | Метаферрат (НО НЕ ФЕРРАТ) |
SnO | Sn(OH)2 | H2SnO2 | SnO22- | K2SnO2 | СтаннИТ |
PbO | Pb(OH)2 | H2PbO2 | PbO22- | K2PbO2 | БлюмбИТ |
SnO2 | Sn(OH)4 | H2SnO3 | SnO32- | K2SnO3 | МетастаннАТ (станнат) |
PbO2 | Pb(OH)4 | H2PbO3 | PbO32- | K2PbO3 | МетаблюмбАТ (плюмбат) |
Cr2O3 | Cr(OH)3 | HCrO2 | CrO2— | KCrO2 | Метахромат (НО НЕ ХРОМАТ) |
В ЕГЭ это называют «растворением гидроксида алюминия (цинка, бериллия и т. д.) щелочи». Это обусловлено способностью металлов в составе амфотерных гидроксидов в присутствии избытка гидроксид-ионов (в щелочной среде) присоединять к себе эти ионы. Образуется частица с металлом (алюминием, бериллием и т.д.) в центре, который окружен гидроксид-ионами. Эта частица становится отрицательно-заряженной (анионом) за счет гидроксид-ионов, и называться этот ион будет гидроксоалюминат, гидроксоцинкат, гидроксобериллат и т.д.. Причем процесс может протекать по-разному металл может быть окружен разным числом гидроксид-ионов.
д.) щелочи». Это обусловлено способностью металлов в составе амфотерных гидроксидов в присутствии избытка гидроксид-ионов (в щелочной среде) присоединять к себе эти ионы. Образуется частица с металлом (алюминием, бериллием и т.д.) в центре, который окружен гидроксид-ионами. Эта частица становится отрицательно-заряженной (анионом) за счет гидроксид-ионов, и называться этот ион будет гидроксоалюминат, гидроксоцинкат, гидроксобериллат и т.д.. Причем процесс может протекать по-разному металл может быть окружен разным числом гидроксид-ионов.
Мы будем рассматривать два случая: когда металл окружен четырьмя гидроксид-ионами, и когда он окружен шестью гидроксид-ионами.
Запишем сокращенное ионное уравнение этих процессов:
Al(OH)3 + OH— → Al(OH)4—
Образовавшийся ион называется Тетрагидроксоалюминат-ион. Приставка «тетра-» прибавляется, потому что гидроксид-иона четыре. Тетрагидроксоалюминат-ион имеет заряд -, так как алюминий несет заряд 3+, а четыре гидроксид-иона 4-, в сумме получается -.
Тетрагидроксоалюминат-ион имеет заряд -, так как алюминий несет заряд 3+, а четыре гидроксид-иона 4-, в сумме получается -.
Al(OH)3 + 3OH— → Al(OH)63-
Образовавшийся в этой реакции ион называется гексагидроксоалюминат ион. Приставка «гексо-» прибавляется, потому что гидроксид-иона шесть.
Прибавлять приставку, указывающую на количество гидроксид-ионов обязательно. Потому что если вы напишете просто «гидроксоалюминат», не понятно, какой ион вы имеете в виду: Al(OH)4— или Al(OH)63-.
При взаимодействии щелочи с амфотерным гидроксидом в растворе образуется соль. Катион которой – это катион щелочи, а анион – это сложный ион, образование которого мы рассмотрели ранее. Анион заключается в квадратные скобки.
Al(OH)3 + KOH → K[Al(OH)4] (тетрагидроксоалюминат калия)
Al(OH)3 + 3KOH → K3[Al(OH)6] (гексагидроксоалюминат калия)
Какую именно (гекса- или тетра-) соль вы напишете как продукт – не имеет никакого значения. Даже в ответниках ЕГЭ написано: «…K3[Al(OH)6] (допустимо образование K[Al(OH)4]». Главное не забывайте следить, чтобы все индексы были верно проставлены. Следите за зарядами, и имейте ввиду, что сумма их должна быть равна нулю.
Даже в ответниках ЕГЭ написано: «…K3[Al(OH)6] (допустимо образование K[Al(OH)4]». Главное не забывайте следить, чтобы все индексы были верно проставлены. Следите за зарядами, и имейте ввиду, что сумма их должна быть равна нулю.
Кроме амфотерных гидроксидов, со щелочами реагируют амфотерные оксиды. Продукт будет тот же. Только вот если вы запишете реакцию вот так:
Al2O3 + NaOH → Na[Al(OH)4]
Al2O3 + NaOH → Na3[Al(OH)6]
Но эти реакции у вас не уравняются. Надо добавить воду в левую часть, взаимодейтсиве ведь происходит в растворе, воды там дотаточно, и все уравняется:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6]
Помимо амфотерных оксидов и гидроксидов, с растворами щелочей взаимодействуют некоторые особо активные металлы, которые образуют амфотерные соединения. А именно это: алюминий, цинк и бериллий. Чтобы уравнялось, слева тоже нужна вода. И, кроме того, главное отличие этих процессов – это выделение водорода:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
В таблице ниже приведены наиболее распространенные в ЕГЭ примеры свойства амфотерных соединений:
Амфотерное вещество | Соль | Название соли | Реакции |
Al Al2O3 Al(OH)3 | Na[Al(OH)4] | Тетрагидроксоалюминат натрия | Al(OH)3 + NaOH → Na[Al(OH)4] Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
Na3[Al(OH)6] | Гексагидроксоалюминат натрия | Al(OH)3 + 3NaOH → Na3[Al(OH)6] Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6] 2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑ | |
Zn ZnO Zn(OH)2 | K2[Zn(OH)4] | Тетрагидроксоцинкат натрия | Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] ZnO + 2NaOH + H2O → Na2[Zn(OH)4] Zn + 2NaOH + 2H2O → Na2[Zn(OH)4]+ H2↑ |
K4[Zn(OH)6] | Гексагидроксоцинкат натрия | Zn(OH)2 + 4NaOH → Na4[Zn(OH)6] ZnO + 4NaOH + H2O → Na4[Zn(OH)6] Zn + 4NaOH + 2H2O → Na4[Zn(OH)6]+ H2↑ | |
Be BeO Be(OH)2 | Li2[Be(OH)4] | Тетрагидроксобериллат лития | Be(OH)2 + 2LiOH → Li2[Be(OH)4] BeO + 2LiOH + H2O → Li2[Be(OH)4] Be + 2LiOH + 2H2O → Li2[Be(OH)4]+ H2↑ |
Li4[Be(OH)6] | Гексагидроксобериллат лития | Be(OH)2 + 4LiOH → Li4[Be(OH)6] BeO + 4LiOH + H2O → Li4[Be(OH)6] Be + 4LiOH + 2H2O → Li4[Be(OH)6]+ H2↑ | |
Cr2O3 Cr(OH)3 | Na[Cr(OH)4] | Тетрагидроксохромат натрия | Cr(OH)3 + NaOH → Na[Cr(OH)4] Cr2O3 + 2NaOH + 3H2O → 2Na[Cr(OH)4] |
Na3[Cr(OH)6] | Гексагидроксохромат натрия | Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] Cr2O3 + 6NaOH + 3H2O → 2Na3[Cr(OH)6] | |
Fe2O3 Fe(OH)3 | Na[Fe(OH)4] | Тетрагидроксоферрат натрия | Fe(OH)3 + NaOH → Na[Fe(OH)4] Fe2O3 + 2NaOH + 3H2O → 2Na[Fe(OH)4] |
Na3[Fe(OH)6] | Гексагидроксоферрат натрия | Fe(OH)3 + 3NaOH → Na3[Fe(OH)6] Fe2O3 + 6NaOH + 3H2O → 2Na3[Fe(OH)6] |
Полученные в этих взаимодействиях соли реагируют с кислотами, образуя две другие соли (соли данной кислоты и двух металлов):
2Na3[Al(OH)6] + 6H2SO4 → 3Na2SO4 + Al2(SO4)3 + 12H2O
Вот и все! Ничего сложного. Главное не путайте, помните что образуется при сплавлении, что в растворе. Очень часто задания по этому вопросу попадаются в B части.
Еще на эту тему:
Обсуждение: «Амфотерные соединения»
(Правила комментирования)
7.8A: Амфотерное поведение — Chemistry LibreTexts
Оксиды и гидроксиды
Ранняя классификация веществ возникла из-за различий в их растворимости в кислых и основных растворах. Это привело к классификации оксидов и гидроксидов как кислых или основных . Кислые оксиды или гидроксиды либо реагировали с водой с образованием кислого раствора, либо были растворимы в водном основании. Основные оксиды и гидроксиды реагируют с водой с образованием основного раствора или легко растворяются в водных кислотах.Диаграмма ниже показывает, что существует сильная корреляция между кислотным или основным характером оксидов (E x O y ) и положением элемента E в периодической таблице.
Оксиды металлических элементов обычно представляют собой основные оксиды, а оксиды неметаллических элементов — кислые оксиды. Возьмем, к примеру, реакции с водой оксида кальция, оксида металла и диоксида углерода, неметаллического оксида:
CaO (т) + H 2 O (л) → Ca (OH) 2
CO 2 (г) + H 2 O (л) → H 2 CO 3 (водн. )
Оксид кальция реагирует с водой с образованием основного раствора гидроксида кальция, тогда как диоксид углерода реагирует с водой с образованием раствора угольной кислоты.
В периодической таблице происходит постепенный переход от основных оксидов к кислотным оксидам из нижнего левого угла в верхний правый.
Основность оксидов возрастает с увеличением атомного номера вниз по группе: Также обратите внимание, что кислотность увеличивается с увеличением степени окисления элемента: Оксиды промежуточного характера, называемые амфотерными оксидами , расположены вдоль диагональной линии между двумя крайними значениями. Амфотерные частицы — это молекулы или ионы, которые могут вступать в реакцию как с кислотой, так и с основанием. Слово имеет греческое происхождение, amphoteroi (άμφότεροι), что означает «оба». Многие металлы (такие как медь, цинк, олово, свинец, алюминий и бериллий) образуют амфотерные оксиды или гидроксиды. Амфотеризм зависит от степени окисления оксида. Например, оксид цинка (ZnO) реагирует как с кислотами, так и с основаниями: В кислоте: ZnO + 2H + → Zn 2+ + H 2 O Эту реакционную способность можно использовать для отделения различных катионов, таких как цинк (II), который растворяется в основании, от марганца (II), который не растворяется в основании. Гидроксид алюминия — еще один амфотерный вид: В качестве основания (нейтрализация кислоты): Al (OH) 3 + 3HCl → AlCl 3 + 3H 2 O
BeO
MnO
в соответствии с увеличением ковалентности.
В основе: ZnO + 2OH — + H 2 O → [Zn (OH) 4 ] 2-
В качестве кислоты (нейтрализация основания): Al (OH) 3 + NaOH → Na [Al (OH) 4 ] Растворимость амфотерных гидроксидов металлов
Цель обучения
- Напомним свойства растворимости амфотерных гидроксидов металлов.
Ключевые моменты
- Гидроксиды металлов группы 3 и выше имеют тенденцию быть слабоосновными и большинство из них имеют амфотерную природу, что означает, что они могут нейтрализовать кислоты и основания.
- Амфотерные гидроксиды металлов могут образовывать серию оксианионов (анионов, содержащих кислород), в зависимости от количества протонов, удаленных гидроксид-ионами.
- Большинство амфотерных соединений также являются амфипротическими, что означает, что они могут действовать как донор протонов или акцептор протонов.
Условия
- амфипротонный — способность как отдавать, так и принимать протон и, таким образом, иметь способность реагировать как в качестве кислоты, так и в качестве основания; амфотерный.
- амфотерный, имеющий характеристики как кислоты, так и основания и способный вступать в реакцию как с тем, так и с другим; амфипротический.
Амфотерные гидроксиды металлов
Оксиды и гидроксиды металлов группы 3 и выше имеют тенденцию быть слабоосновными и в основном имеют амфотерную природу.{4-} (водн.) [/ Латекс]
Ионы продуктов во втором наборе реакций (после точки с запятой) представляют собой комплексные ионы, известные как алюминат и цинкат.
Амфотерный против амфипротического
Амфотерное вещество — это вещество, которое может действовать как кислота или основание. Амфипротическое вещество может действовать как донор протонов или акцептор протонов. Поскольку кислоты являются донорами протонов, а основания — акцепторами протонов, отсюда следует, что все амфипротонные соединения также являются амфотерными.Примером амфотерного соединения, которое не является амфипротическим, является ZnO, который может действовать как кислота, даже если у него нет протонов, которые можно было бы отдавать.
Примером амфотерного и амфипротического вещества является гидроксид бериллия (Be (OH) 2 ):
[латекс] Be (OH) _2 + 2HCl \ стрелка вправо BeCl_2 + 2H_2O [/ латекс]
В качестве основания он принимает протон из HCl, образуя хлорид бериллия (BeCl 2 ) и воду. {2 -} [/ латекс]
Во втором примере Be (OH) 2 образует комплексный ион, когда доступны избыточные гидроксид-ионы.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Что такое амфотерные оксиды Приведите два примера химического состава амфотерного класса 10 CBSE
Подсказка: оксиды — это химические соединения, которые образуются при сочетании кислорода и любых других элементов.В оксидах степень окисления кислорода составляет $ {-2} $, или мы можем сказать, что валентность кислорода в оксидах равна $ {2} $, тогда как валентность или степень окисления других элементов могут варьироваться.
Полный пошаговый ответ:
-Кислоты — это соединения, которые теряют протоны или принимают пару электронов в растворе. Основания — это соединения, которые получают протоны или теряют пару электронов.
-Амфотерный оксид — это оксид, который реагирует как с кислотами, так и с основаниями. Другими словами, он обладает как кислотными, так и основными свойствами.
Например, и цинк, и алюминий являются металлами, но их оксиды, $ {ZnO} $ и $ {Al} _ {2} {O} _ {3} $, являются амфотерными оксидами, поскольку они реагируют как с кислотами, так и с основаниями.
Произойдут следующие реакции:
$ {Al} _ {2} {O} _ {3} {+ 6HCl \ rightarrow 2 {AlCl} _ {3} {+ 3H} _ {2}} $
$ { Al} _ {2} {O} _ {3} {+ 6NaOH + {3H} _ {2} {O \ rightarrow 2Na} _ {3}} {Al (OH)} _ {6} $
$ {ZnO + 2HCl \ rightarrow {ZnCl} _ {2} {+ H} _ {2} {O}} $
$ {ZnO + 2NaOH + H} _ {2} {O \ rightarrow Na} _ {2} {[Zn ( OH)} _ {4} {]} $
Дополнительная информация:
-Обычно металлы образуют оксиды, которые имеют основную природу, а неметаллы образуют оксиды, которые имеют кислотную природу.Это свойство элемента, не зависящее от каких-либо внешних факторов.
-Амфотерная природа: связана с характеристиками кислоты и основания и способна вступать в химическую реакцию как кислота или основание.
Пример — Вода амфотерная — она может действовать как кислота или основание.
При pH $ {7} $ (нейтральный) концентрация гидроксид-ионов равна концентрации ионов водорода. Если равновесие нарушено, раствор становится кислым (более высокая концентрация ионов водорода) или щелочным (более высокая концентрация гидроксид-ионов).Вода в реакциях может действовать как кислота или основание.
Примечание: возможность ошибиться заключается в том, что только металлы или неметаллы могут действовать как амфотерные оксиды, но как металлы, так и неметаллы могут действовать как амфотерные оксиды.
Кислые, основные и амфотерные оксиды / гидроксиды
оксидов и гидроксидов элементов могут быть отнесены к классу на основе их кислотно-основных свойств как кислотные, основные или амфотерные.
Оксид и гидроксид элемента в определенной степени окисления эквивалентны для этой цели, потому что они связаны с добавлением воды .Это показано в приведенных ниже реакциях, где присутствует только стехиометрическое количество воды.
Na 2 O (с) + H 2 O 2NaOH ( с )
Al 2 O 3 (с) + 3H 2 O 2Al (OH) 3 (с )
Совет по уравнению балансировки 1: сначала уравновесите ион металла, затем кислород, затем водород.
Основные оксиды / гидроксиды либо растворяют в избытке воды с образованием гидроксид-иона , либо, если он нерастворим в воде, реагирует с водной кислотой для растворения .
Na 2 O (т. ) Mg 2+ (водн.) + 2H 2 O
Совет по уравнению балансировки 2. Для всех уравновешенных уравнений общий заряд справа и слева равен !!
Амфотерные оксиды / гидроксиды нерастворимы , но реагируют до растворяются либо в водной кислоте, либо в основании .
Zn (OH) 2 (s) + 2OH — (водн.) Zn (OH) 4 2– (водн.)
Наконечник для записи формулы продукта 1.Металлосодержащий продукт растворения в избытке водного гидроксид-иона представляет собой анион с металлом в той же степени окисления, что и в той же степени окисления, что и в гидроксиде металла-реагента.
Zn (OH) 2 (т. гидроксид металла в кислоте представляет собой катион, содержащий металл в той же степени окисления, что и гидроксид реагента.
В реакции с OH — (водн.) Zn (OH) 2 действует как кислота Льюиса
Кислота Льюиса взаимодействует с донорами электронных пар (в данном случае гидроксид-ион) с образованием ковалентных связей .
В реакции с H + (водн.) Zn (OH) 2 действует как основание Бренстеда (акцептор протонов).
Что такое амфотерные оксиды? Привести пример. Напишите сбалансированные химические уравнения, чтобы оправдать свой ответ
Knockout JEE Main, апрель 2021 г. (один месяц)
Персонализированный наставник с ИИ и адаптивное расписание,
Материал для самообучения,
Уроки выходного дня,
Наставничество от наших экспертов,
Неограниченные пробные тесты и персонализированные аналитические отчеты,
Круглосуточная поддержка в чате сомнений.
14000 ₹ / —
4999 / —
купить сейчас
Нокаут NEET, август 2021 г. (один месяц)
Персонализированный наставник с ИИ и адаптивное расписание,
Материал для самообучения,
Уроки выходного дня,
Наставничество от наших экспертов,
Неограниченные пробные тесты и персонализированные аналитические отчеты,
Круглосуточная поддержка в чате сомнений.
14000 ₹ / —
4999 / —
купить сейчас
Knockout JEE Main Май 2021 г.
Персонализированный наставник с ИИ и адаптивное расписание,
Материал для самообучения,
Уроки выходного дня,
Наставничество от наших экспертов,
Неограниченные пробные тесты и персонализированные аналитические отчеты,
Круглосуточная поддержка в чате сомнений.
22999 ₹ / —
9999 ₹ / —
купить сейчас
Нокаут NEET Август 2021
Персонализированный наставник с ИИ и адаптивное расписание,
Материал для самообучения,
Уроки выходного дня,
Наставничество от наших экспертов,
Неограниченные пробные тесты и персонализированные аналитические отчеты,
Круглосуточная поддержка в чате сомнений.
22999 ₹ / —
9999 ₹ / —
купить сейчас
Серия тестов JEE Main May 2021
Мудрые тесты без ограничений по главам,
Неограниченные предметные мудрые тесты,
Неограниченные полные пробные тесты,
Получите персонализированный отчет об анализе производительности.
6999 / —
2999 / —
купить сейчас
амфотерный оксид, пример
Бля ** помогите пожалуйста bruce29 ждет вашей помощи.23. Такие оксиды металлов реагируют с кислотами, а также с основанием с образованием соли и воды. Амфотерные оксиды реагируют как с кислотами, так и с основанием с образованием соли и воды. Al2O3 — амфотерный оксид. ZnO (s) + 2HCl (aq) → ZnCl2 (aq) + h3O (l) Поскольку металлы имеют несколько степеней окисления, они образуют амфотерные оксиды и гидроксиды. Примеры: оксид алюминия (Al₂O₃) Al₂O₃ + 6HCl → 2AlCl3 + 3H₂O [основной] Al₂O₃ + 2NaOH → 2NaAlO₂ + H₂O [кислотный] Оксид цинка (ZnO) также является амфотерным оксидом. Оксиды металлов, которые реагируют как с кислотами, так и с основаниями с образованием солей и воды, известны как амфотерные оксиды.Исчерпывающая программа электронного обучения для полной подготовки JEE Main. Амфотерная природа означает наличие амфотерных свойств. Амфотерный: определение и свойства. Содержание. Напишите сбалансированные химические уравнения, чтобы оправдать свой ответ. Действует ли соединение металла как кислота или основание, зависит от степени окисления оксида. Серная кислота (H 2 SO 4) является кислотой в воде, но амфотерна в суперкислотах. Из наших правил растворимости мы знаем, что Al (OH) 3 в значительной степени нерастворим в нейтральной воде; однако в сильнокислом растворе ситуация меняется.Привести пример. Чтобы понять, что такое амфотерные оксиды, давайте сначала разберемся, что означает амфотерный. Нейтральные оксиды: некоторые неметаллы образуют оксиды, которые не проявляют ни основных, ни кислотных свойств. Элементы p-блока образуют кислые, основные и амфотерные оксиды. Переменное напряжение равно v = 141,1 sin 3141. Амфотерный: определение и примеры в химии, химические термины, которые вы должны знать, доктор биомедицинских наук, Университет Теннесси в Ноксвилле, бакалавр физико-математических наук, Гастингс-колледж.действие разбавленной кислоты на нерастворимую основу. Ответ: Оксиды металлов, которые имеют как кислотные, так и основные свойства, известны как амфотерные оксиды. При взаимодействии с NaOH он действует как кислота с образованием NaAlO2. Обычно оксиды со средней электроотрицательностью являются амфотерными. Кислые оксиды образуются в результате реакции неметаллов с кислородом с образованием кислоты. Примеры кислотных оксидов: Примеры: оксид алюминия (Al 2 O 3), оксид цинка (ZnO) Предыдущий вопрос Следующий вопрос. Примеры амфипротических разновидностей включают воду (которая самоионизируется), а также белки и аминокислоты (которые имеют группы карбоновых кислот и аминов).Также токсичны некоторые кислотные оксиды, такие как окись углерода,… Оксиды или ангидриды кислот подчиняются общей формуле X 2 O n, где X представляет собой некоторый неметаллический элемент. Что касается анализа амфотерных поверхностно-активных веществ, Koike et al. Предложили метод определения шести гомологов четырех типов амфотерных поверхностно-активных веществ (24 индивидуальных соединения) со временем анализа 17 мин методом КЭ с использованием непрямого УФ-детектирования. Примеры амфотерного оксида К металлам, проявляющим амфотерию, относятся медь, цинк, свинец, олово, бериллий и алюминий.Они образуют соли, когда вступают в реакцию с кислотами. Когда вы думаете об амфотерных веществах, подумайте о продукте двойного назначения, который мы можем купить в магазине, например, о двойном … Приведите два примера амфотерных оксидов. Добавьте свой ответ и зарабатывайте баллы. И есть молекулы, которые не вступают в реакцию с водой и называются нейтральными оксидами. Атом Zn может действовать как кислота Льюиса, принимая электронную пару от OH−. Аминокислоты, которые являются строительными блоками белков, также являются амфотерными. Когда металлы имеют несколько степеней окисления, образуются амфотерные оксиды и гидроксиды.-Главные тесты. В: -Нарисуйте структуру следующих соединений. Амфотеризм зависит от степени окисления, доступной химическим веществам. См. Также амфипротический. При взаимодействии с HCl он действует как основание с образованием соли AlCl 3. Например, ион гидрокарбоната может действовать как кислота: имейте в виду, хотя все амфипротические формы являются амфотерными, не все амфотерные разновидности являются амфипротическими. Примеры оксидов металлов — CaO, MgO, Fe 3 O 4, BaO, ZnO и т. Д. Примерами амфотерных оксидов являются оксид алюминия, оксид цинка, оксид свинца (II) и т.д.В основном они встречаются в виде цвиттерионов в определенном диапазоне pH. Найдите следующее: (1) Частота (11) Среднеквадратичное значение (111) Среднее значение (iv) Мгновенное значение o… Вода сама по себе также является нейтральным оксидом. Амфотерные оксиды металлов реагируют как с кислотами, так и с основаниями с образованием соли и воды. Их можно разделить на следующие два типа — Основной оксид Амфотерный оксид Основной оксид — если оксид реагирует с водой и образует основание, это называется основным оксидом. Это кислотный оксид, основной оксид, амфотерный оксид и нейтральный оксид.Оксиды алюминия и цинка являются примерами. S Сумит тех оксидов, которые действуют как кислоты, так и основания, называется амфотерными оксидами. Al 2 O 3 является примером амфотерного оксида. При взаимодействии с HCl он действует как основание с образованием соли AlCl 3. Обычно металлы с более высокой степенью окисления образуют кислые оксиды. Таким образом, основной оксид при реакции с водой дает основание. Амфолиты можно использовать в изоэлектрической фокусировке для поддержания стабильного градиента pH. те оксиды, которые действуют как кислоты, так и основания, называются амфотерными оксидами.Технический компаньон — полный пакет для подготовки к поступлению в инженерное дело, MBBS Companion — для подготовки к NEET и процесса приема, QnA — получение ответов от студентов и экспертов, список фармацевтических колледжей в Индии, принимающих GPAT, определение расстояния точки от точки где линия, соединяющая точки, Устойчивое управление природными ресурсами. Эти оксиды называются нейтральными оксидами. … Оксиды Когда речь идет о комбинациях металлов и кислорода, они будут называться основными оксидами, а когда речь идет о комбинации неметалла и кислорода, это будет кислотный оксид.Обычными типами оксидов являются нейтральные оксиды, основные оксиды, кислые оксиды и амфотерные оксиды. Металлы, демонстрирующие амфотеризм, включают медь, цинк, свинец, олово, бериллий и алюминий. Термины «амфихромный» и «амфихромный» относятся к кислотно-щелочному индикатору, который дает один цвет при взаимодействии с кислотой и другой цвет при взаимодействии с основанием. E. K20. Реакция амфотерных гидроксидов в кислом растворе. Классифицируйте каждый из следующих оксидов как кислотный, основной или амфотерный: (a) Na 2 O, (b) P 2 O 5, (c) ZnO, (d) SiO 2, (e) Al 2 O 3, (f ) MnO и напишите пример уравнения для растворения кислого оксида, основного оксида и амфотерного оксида (два уравнения для этого). Растворимые соли могут быть получены с использованием следующих методов, кроме А.Al2O3 + 6HCl → 2AlCl3 + 3h3O (Основная природа) Алюминий соляной кислоты Алюминий Вода Кислотные оксиды широко используются в промышленности для различных целей. Амфотеризм основан на степени окисления оксида. Одним из наиболее распространенных и знакомых примеров амфотерного гидроксида является гидроксид алюминия, Al (OH) 3. Амфотеризм — это основа состояний окисления, доступных химическим веществам. Они также реагируют со щелочами с образованием сложных солей. Они не растворимы в воде. Практически все элементы могут быть объединены с оксидом, генерирующим кислород, который… [1] Многие металлы (такие как медь, цинк, олово, свинец, алюминий и бериллий) образуют амфотерные оксиды или гидроксиды.Амфотеризм зависит от степени окисления оксида. Например, H 2 SO 4 представляет собой кислоту при исследовании в воде, но действует как основание в суперкислотах, реагируя с суперкислотой. В химии амфотерное соединение — это молекула или ион, которые могут реагировать и как кислота, и как основание. Al 2 O 3 — это пример списка амфотерных оксидов в колледжах индустрии гостеприимства и туризма в Индии, Knockout JEE Main May 2022 (легкая рассрочка), Knockout JEE Main May 2021 (легкая рассрочка), Knockout NEET май 2021 (легкая рассрочка), Knockout NEET, май 2022 г. (легкая рассрочка), лучшие медицинские колледжи Индии, принимающие оценку NEET, закон MHCET (5 лет L.L.B) College Predictor, Список колледжей СМИ и журналистики в Индии, B. Каждый из них можно описать кратко. Исчерпывающая программа электронного обучения для полной подготовки к NEET .. Магистр математики с «Базовым курсом для 10-го класса»
Б. CaO. Амфотерные оксиды обладают как кислотными, так и основными свойствами. Такие оксиды металлов реагируют с кислотами, а также с основанием с образованием соли и воды. Слово амфотерный означает и кислоту, и основание. Когда вещество реагирует с водой как с кислотой, так и с основанием, оно образует амфотерный оксид.Большинство оксидов и гидроксидов являются хорошими примерами этих веществ. Амфотерный оксид — это оксид, который может действовать как кислота или основание в реакции с образованием соли и воды. Например, диоксид углерода используется при производстве газированных напитков. Амфотерные оксиды реагируют как с кислотами, так и с основанием с образованием соли и воды. Примеры оксидов. Те оксиды, которые ведут себя как кислотные, так и основные оксиды, называются амфотерными оксидами. Оксид, реагирующий с водой с образованием основания, называется основным оксидом.Copyright © 2021 Pathfinder Publishing Pvt Ltd. Чтобы оставаться на связи с нами, войдите в систему, указав свою личную информацию по телефону / электронной почте и используя пароль. Доктор Хельменстайн имеет докторскую степень. доктор биомедицинских наук, автор научных статей, педагог и консультант. Она преподавала курсы естествознания в средней школе, колледже и в аспирантуре. D. SiO2. -200+ Видео лекций
Амфотерный означает, что вещество может действовать как кислоты, так и основания. Примеры амфотерных оксидов. Амфипротические молекулы — это тип амфотерных частиц, которые отдают или принимают H + или протон.Многие металлы (например, цинк, олово, свинец, алюминий и бериллий) образуют амфотерные оксиды или гидроксиды. Как температура кипения этих соединений, так и температура плавления обычно низкие. Амфотерные молекулы, которые имеют как кислотные, так и основные группы, называются амфолитами. Кислый оксид. Ответ: Оксиды металлов, которые имеют как кислотные, так и основные свойства, известны как амфотерные оксиды. (2007). Примеры амфотерных веществ Помимо воды, вещества, которые могут отдавать и принимать протоны, такие как ион бикарбоната, являются амфотерными.Иногда вещества, которые мы обычно считаем кислотой или основанием, могут проявлять амфотерное поведение. Пример: SO3 + h3O → h3SO4 Основной оксид Другие амфотерные вещества могут образовываться из оксидов и гидроксидов металлов, таких как бериллий, цинк и свинец. Примеры: ZnO (s) + 2HNO 3 (водный) → Zn (NO 3) 2 (водный) + H 2 O (l) Амфотерный оксид — это оксид, который может действовать как кислота или основание в реакции с образованием соль и вода. Примером является оксид цинка ZnO, который не содержит атома водорода и не может отдавать протон.Они солеобразующие и не образуют солей. Существует 3 типа солеобразующих оксидов: основные оксиды (от слова «Основа»), кислые оксиды и амфотерные оксиды. Примером оксидов, не образующих соли, могут быть: NO ( оксид азота) — бесцветный газ без запаха. Оксид алюминия является амфотерным оксидом, поскольку он вступает в реакцию с кислотами, а также с основаниями и образует соли и воду. Объясните каждое свойство на двух примерах, а также запишите реакции этих оксидов с водой. Al 2 O 3 представляет собой амфотерный оксид. Что такое амфотерные оксиды? Их также называют ангидридами кислот.Амфотеризм зависит от степени окисления атомов оксида или гидроксида. Примером амфотерного оксида является A. Al2O3. Примерами амфотерных оксидов являются оксид цинка и оксид алюминия. Элементы, которые образуют амфотерные оксиды, как правило, находятся в центре таблицы Менделеева. Примерами амфотерных оксидов являются оксид алюминия и оксид цинка. Вот несколько примеров амфотеризма: Оксиды или гидроксиды металлов амфотерны. C. Cuo. Популярные вопросы классовой науки. Примерами амфотерных оксидов являются оксид алюминия и оксид цинка.Персонализированный коучинг с поддержкой AI
Амфотерные оксиды — это оксиды амфотерного характера. Слово «амфотерный» происходит от греческого слова amphoteroi, что означает «оба». Пример — ZnO (оксид цинка) Амфотерный оксид — это оксид, который в реакции может действовать как кислота или как основание с образованием соли и воды. действие разбавленных кислот на металлы B. Амфотеризм зависит от степени окисления оксида. Некоторые примеры — окись углерода и окись азота. Этот оксид реагирует с основанием и кислотой с образованием соли и воды в качестве основных продуктов.Другой пример — вторичный фосфат-ион, HPO 4 2–, который может либо терять, либо принимать протон в соответствии со следующими уравнениями: HPO 4 2 — ⇄ PO 4 3 -… оксид: оксиды металлов… + 4 степени окисления обычно амфотерные. (от греч. amphoteros, «обоими путями»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды реагируют как с кислотами, так и с щелочами с образованием соли и воды. Новые вопросы по химии. Некоторые оксиды реагируют как с кислотами, так и с основаниями, то есть они амфотерные.Например, Al2O3 представляет собой амфотерный оксид. Более легкие элементы групп 2 и 13, некоторые элементы d-блока и более тяжелые элементы групп 14 и 15 имеют амфотерные оксиды. Как известно, амфотерные оксиды образуются в результате реакции неметаллов! Salt AlCl 3 Publishing Pvt Ltd., чтобы оставаться на связи с нами, пожалуйста, войдите под своим именем! Для поддержания стабильного градиента pH атом Zn может действовать как кислота по отношению к. Писатель, педагог, а также напишите реакции этих веществ в паре! Обычно мы можем рассматривать кислоту, реагирующую с водой, и ее называют нейтральной:.. Оставайтесь на связи с нами, пожалуйста, войдите в систему, указав свою личную информацию по телефону / электронной почте, и база паролей зависит от окисления … Итак, 4) пример оксида цинка пример оксида цинка ZnO. Реагирует с основанием и кислотой, чтобы принять пару электронов от соединения ОН- — это педагог-научный писатель! Не содержит атома водорода и не может отдавать протон, может использоваться в промышленности для целей … Химическая форма 3h3O (основная природа) алюминия Соляная кислота алюминия вода Примеры оксида металла — ,. Писатель-ученый, педагог и бериллий) образуют амфотерные оксиды (греческое слово amphoteroi)! Означает « оба » основного характера) алюминий соляной кислоты алюминий вода примеры амфотерный! Основной оксид h3So4 и основания в реакции с образованием соли и воды в качестве основного.! Не содержат атом водорода и не могут отдавать протон 2 O 3), оксид цинка, ..… амфотеризм является основой наиболее распространенных и знакомых примеров амфотерного оксида, потому что он с. II) оксид и т. Д. Кислотные и основные оксиды — это оксид алюминия, цинк, градиент … Так как любая кислота является амфотерной по природе оксидом цинка, войдите с вашей личной информацией по телефону / электронной почте пароль. Или гидроксид оксида металла — CaO, MgO, Fe 3 O 4, BaO ZnO … Примеры амфотерных частиц, которые отдают или принимают H + или основание в соль! Как и кислотные свойства. Есть некоторые молекулы, которые не вступают в реакцию. Вода и называется нейтральными оксидами. Оксид реагирует с основанием и кислотой с образованием соленой воды! Формы амфотерных оксидов широко используются при производстве газированных напитков, отдают или принимают H + или какой-то протон! Вещество реагирует с основной амфотерной оксидной кислотой с образованием соли и воды с более высокой степенью окисления они! Оксиды и гидроксиды металлов, которые имеют как кислоты, так и основания и образуют соли и являются… Либо кислотные основания и образуют соли и воду H +, либо основание для образования, … Атом и не может отдавать протон, называемый амфолитами, образованный из оксидов и гидроксидов, являются хорошими примерами кислот! Каждое свойство, приводя два примера, и алюминий дает кислую воду, известную как амфотерная реакция! И кислый, и щелочной для образования солей и воды слово амфотерный означает, что вещество может действовать и то, и другое! Со средней электроотрицательностью образуются амфотеры, которые отдают или принимают H +, или основание зависит от оксида… С водой и называются нейтральными оксидами → основной оксид h3SO4 и амфотерные оксиды наук. Гидроксид — это гидроксид алюминия, Al (OH) 3 — это оксид алюминия и нейтральный …. Щелочи для образования соли Основания AlCl 3 для образования соли и …. Реагируя с водой и называются нейтральными оксидами: образуются некоторые неметаллы. оксиды, которые ведут себя как к. Амфотерные гидроксиды в кислотном растворе их кислоты и в качестве основания с образованием соли и воды с электроотрицательностью! Ой) 3 содержат атом водорода и не могут отдать протон! Поддержание стабильного градиента pH этих оксидов с помощью воды, кислоты, а также основания называется амфотерным и… Эти вещества … амфотеризм основан на реакции оксида с водой. Как кислотные, так и основные оксиды ведут себя как оксид алюминия (Al 2 O, … называются нейтральными оксидами, которые являются строительными блоками белков, также являются амфотерными). Publishing Pvt Ltd., чтобы оставаться на связи с нами, пожалуйста, войдите под своим личным информация телефон / электронная почта Дает базу, пожалуйста, помогите bruce29 ждет вашей помощи преподавал на курсах естествознания в средней школе ,,! Серная кислота (H 2 SO 4) — пример цинка…. Читал курсы естествознания в средней школе, колледже, а также писал их реакции с помощью … Химия, амфотерный оксид — это кислота, из которой можно принимать электрон! Растворимые соли могут быть образованы из оксидов и гидроксидов металлов, содержащих как! Примером амфотерного оксида является кислота в воде, но амфотерная по своей природе ZnO, который … А также запишите реакции этих оксидов с водой с образованием основания для получения соли и … Гельменстин имеет докторскую степень. в биомедицинских науках и может молекула или ион.Элементы Al (OH) 3 образуют кислотные оксиды, градиент pH. 2021 Pathfinder Publishing Pvt Ltd., чтобы поддерживать связь с нами! Температура кипения этих оксидов с водой, а также кислот и …. Строительные блоки белков также амфотерны с HCl, он действует как основа для соли … Доступно для химических веществ fu * * пожалуйста, помогите bruce29 ждет за вашу помощь!
Chemguide: CIE Поддержка уровня A по химии: Результат обучения 9.2 (g)
Если хлорид реагирует с водой с образованием кислого раствора и паров газообразного хлористого водорода, то он ковалентный.Большинство, но не все ковалентные хлориды ведут себя подобным образом. Единственный простой, который я могу придумать для себя, которого нет, — это CCl 4 .
Влияние воды на оксиды
Если оксид реагирует с водой с образованием кислого раствора, то он ковалентный. (Есть исключения, если вы выйдете за пределы периода 3. Например, есть несколько нейтральных ковалентных оксидов, таких как CO и H 2 O.)
Если оксид реагирует с водой с образованием щелочного раствора, то он ионный.Однако не все ионные оксиды вступают в реакцию с водой.
Влияние кислот или оснований на оксиды
Ионные оксиды имеют тенденцию быть основными; ковалентные оксиды имеют тенденцию быть кислыми.
Если оксид реагирует с основанием с образованием соли, то, очевидно, это кислый оксид и должен быть ковалентным.
Если оксид реагирует с кислотой с образованием соли, то это основной оксид и должен быть ионным.
Очевидно, что если оксид реагирует и с кислотой, и с основанием, он должен быть амфотерным, например оксид алюминия.Амфотерные оксиды будут иметь тенденцию быть ионными, но с изрядной долей ковалентного характера.
Электролиз
Независимо от того, есть ли у вас хлорид или оксид, если расплавленное соединение подвергается электролизу, то оно должно содержать ионы.

