Содержание
Урок №16. Атомно-молекулярное учение — ХиМуЛя
Атомно-молекулярное
учение развил и впервые применил в химии великий русский ученый Ломоносов.
Сущность учения Ломоносова можно свести к следующим положениям.
§
Все
вещества состоят из «корпускул» (так Ломоносов называл молекулы).
§
Молекулы
состоят из «элементов» (так Ломоносов называл атомы).
§
Частицы
— молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел
есть результат движения их частиц.
§
Молекулы
простых веществ состоят из одинаковых атомов, молекулы сложных веществ из
различных атомов.
Атомистическое
учение в химии применил английский ученый Джон Дальтон. В своей основе учение
Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше,
поскольку Дальтон впервые пытался установить атомные массы известных тогда
элементов. Однако Дальтон отрицал существование молекул у простых веществ, что
по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые
вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов»
(в современном понимании — молекул). Отрицание Дальтоном существования молекул
Отрицание Дальтоном существования молекул
простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в
химии окончательно утвердилось лишь в- середине XIX в. Молекула — это
наименьшая частица данного вещества, обладающая его химическими свойствами.
Химические свойства молекулы определяются ее составом и химическим строением.
Атом — наименьшая частица химического элемента, входящая в состав молекул
простых и сложных веществ. Химические свойства элемента определяются строением
его атома. Отсюда следует определение атома, соответствующее современным
представлениям: атом — это электронейтральная частица, состоящая из
положительно заряженного атомного ядра и отрицательно заряженных электронов.
Согласно современным представлениям из молекул состоят вещества в газообразном
и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества,
кристаллическая решетка которых имеет молекулярную структуру.
Основные
положения атомно-молекулярного учения можно сформулировать так:
§
Существуют
вещества с молекулярным и немолекулярным строением.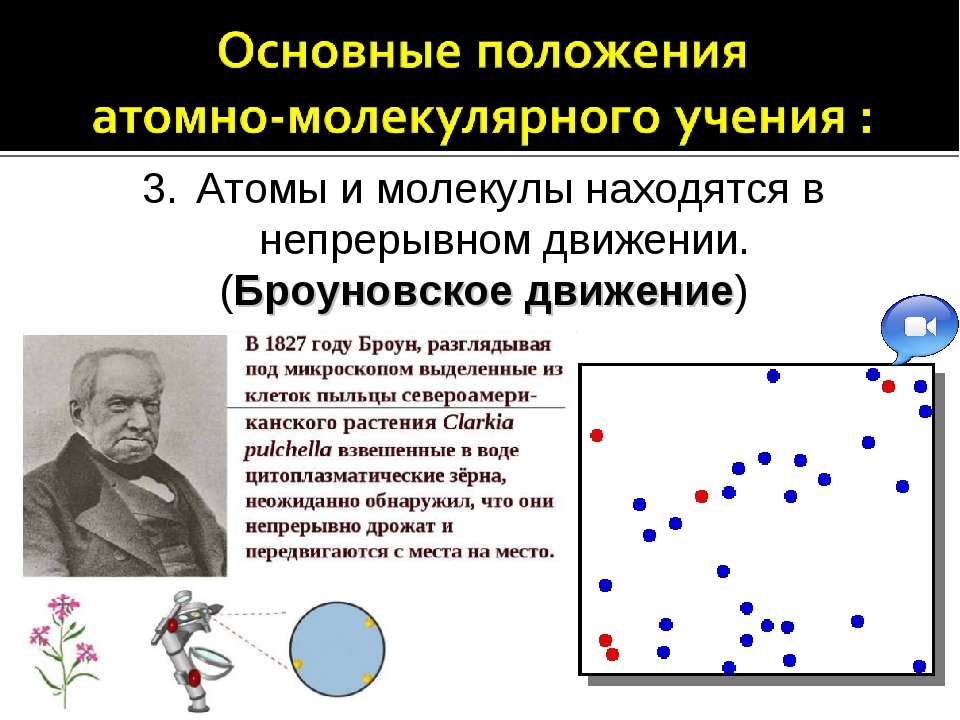
§
Между
молекулами имеются промежутки, размеры которых зависят от агрегатного состояния
вещества и температуры. Наибольшие расстояния имеются между молекулами газов.
Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где
промежутки между молекулами значительно меньше. В твердых веществах промежутки
между молекулами еще меньше, поэтому они почти не сжимаются.
§
Молекулы
находятся в непрерывном движении. Скорость движения молекул зависит от
температуры. С повышением температуры скорость движения молекул возрастает.
§
Между
молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей
степени эти силы выражены в твердых веществах, в наименьшей — в газах.
§
Молекулы
состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
§
Атомы
одного вида отличаются от атомов другого вида массой и свойствами.
§
При
физических явлениях молекулы сохраняются, при химических, как правило,
разрушаются.
§
У
веществ с молекулярным строением в твердом состоянии в узлах кристаллических
решето находятся молекулы. Связи между молекулами, расположенными в узлах
Связи между молекулами, расположенными в узлах
кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества
с молекулярным строением, как правило, имеют низкие температуры плавления.
§
У
веществ с немолекулярным строением в узлах кристаллических решеток находятся
атомы или другие частицы. Между этими частицами существуют сильные химические
связи, для разрушения которых требуется много энергии. Поэтому вещества с
немолекулярным строением имеют высокие температуры плавления.
Объяснение
физических и химических явлений с точки зрения атомно-молекулярного учения.
Физические и химические явления получают объяснение с позиций
атомно-молекулярного учения. Так, например, процесс диффузии объясняется
способность молекул (атомов, частиц) одного вещества проникать между молекулами
(атомами, частицами) другого вещества. Это происходит потому, что молекулы
(атомы, частицы) находятся в непрерывном движении и между ними имеются
промежутки. Сущность химических реакций заключается в разрушении химических
связей между атомами одних веществ и в перегруппировке атомов с образованием
других веществ.
Атомно-молекулярное учение
2. Эпоха классической химии
В начале 20-го века американский химик Гильберт Ньютон Льюис, когда преподавал студентам Гарварда, чтобы представлять электроны вокруг атомов, стал символически изображать их точками. Его ученики отдавали предпочтение этим рисункам, что стимулировало его в этом направлении. Из этих лекций Льюис отметил, что элементы с определенным количеством электронов, по-видимому, обладают особой стабильностью. Этот феномен был отмечен немецким химиком Ричардом Абеггом в 1904 году, на который Льюис ссылался как на «закон валентности Абега» ныне широко известный как правило Абегга. Льюису казалось, что как только вокруг ядра образуется ядро из восьми электронов, слой заполняется и начинается новый слой. Льюис также отметил, что различные ионы с восемью электронами также, по-видимому, обладают особой стабильностью. Исходя из этих взглядов, он предложил «правило восьми» или «правило октета»: ионы или атомы с заполненным слоем из восьми электронов обладают особой стабильностью.
Более того, заметив, что куб имеет восемь углов, Льюис представил себе атом как имеющий восемь сторон, доступных для электронов, подобно углу куба. Впоследствии, в 1902 году, он разработал концепцию, в которой кубические атомы могут соединяться на своих сторонах, образуя кубически структурированные молекулы.
Другими словами, электронно-парные связи образуются, когда два атома имеют общую границу, как в структуре С ниже. Это приводит к разделению двух электронов. Аналогично, заряженные ионные связи образуются при переносе электрона из одного куба в другой, не разделяя ребра A. промежуточное состояние B, в котором разделяется только один угол, также было постулировано Льюисом.
Следовательно, двойные связи образуются при совместном использовании грани между двумя кубическими атомами. Это приводит к разделению четырех электронов.
В 1913 году, работая заведующим кафедрой химии в Калифорнийском университете в Беркли, Льюис прочитал предварительный набросок статьи английского аспиранта Альфреда Лаука Парсона, который посещал Беркли в течение года. В этой статье Парсон предположил, что электрон – это не просто электрический заряд, но и небольшой магнит или «Магнетон», как он его называл, и более того, что химическая связь возникает в результате совместного использования двух электронов между двумя атомами. А уже это, согласно Льюису, означало, что связывание происходит, когда два электрона образуют общий край между двумя полными кубами.
В этой статье Парсон предположил, что электрон – это не просто электрический заряд, но и небольшой магнит или «Магнетон», как он его называл, и более того, что химическая связь возникает в результате совместного использования двух электронов между двумя атомами. А уже это, согласно Льюису, означало, что связывание происходит, когда два электрона образуют общий край между двумя полными кубами.
Исходя из этих взглядов, в своей знаменитой статье 1916 года «Атом и молекула» Льюис ввел «структуру Льюиса» для представления атомов и молекул, где точки представляют электроны, а линии – ковалентные связи. В этой статье он разработал концепцию электронно-парной связи, в которой два атома могут делиться от одного до шести электронов, образуя таким образом единственную электронную связь, одинарную, двойную, или тройную связь
По словам самого Льюиса:
Более того, он предположил, что атом имеет тенденцию образовывать ион, получая или теряя некоторое количество электронов, необходимых для завершения куба. Таким образом, структуры Льюиса показывают каждый атом в структуре молекулы, используя его химический символ. Линии рисуются между атомами, которые связаны друг с другом; иногда вместо линий используются пары точек. Избыточные электроны, образующие одиночные пары, представляются в виде пар точек и помещаются рядом с атомами, на которых они находятся:
Таким образом, структуры Льюиса показывают каждый атом в структуре молекулы, используя его химический символ. Линии рисуются между атомами, которые связаны друг с другом; иногда вместо линий используются пары точек. Избыточные электроны, образующие одиночные пары, представляются в виде пар точек и помещаются рядом с атомами, на которых они находятся:
Подводя итог своим взглядам на новую модель связи, Льюис утверждает:
На следующий год, в 1917 году, тогда ещё неизвестный американский инженер-химик по имени Лайнус Полинг изучал в Орегонском сельскохозяйственном колледже метод соединения «крючком и ушком» Дальтона, который в то время был актуальным описанием связей между атомами. Каждый атом имел определенное количество «крючков», которые позволяли ему прикрепляться к другим атомам, и определенное количество «ушек», которые позволяли другим атомам прикрепляться к нему. Химическая связь возникла, когда «крючок» и «ушко» соединились. Однако Л. Полинг не был удовлетворен этим архаичным методом и обратился за новым методом к недавно возникшей области знаний — квантовой физике.
В 1927 году немецкие физики Фриц Лондон и Вальтер Гайтлер применили методы квантовой механики для исследования насыщаемых, нединамических сил притяжения и отталкивания, т. е. их обработка валентной связи этой проблемы в их совместной работе была знаковой в том, что она привела химию к квантовой механике. Их работа оказала влияние на Л. Полинга, который только что получил докторскую степень и посетил В. Гайтлера и Ф. Лондона в Цюрихе на стипендии Гуггенгейма.
Впоследствии, в 1931 году, опираясь на работу В. Хайтлера и Ф. Лондона и на теории, найденные в знаменитой статье Г. Льюиса, Полинг опубликовал свою новаторскую статью «Природа химической связи», в которой он использовал квантовую механику для расчета свойств и структур молекул, таких как углы между связями и вращение вокруг связей. На основе этих концепций Л. Полинг разработал теорию гибридизации для учета связей в молекулах, таких как CH 4, в которой четыре гибридизованные орбитали sp 3 перекрываются орбиталями водорода 1s, образуя четыре σ-связи. Эти четыре связи имеют одинаковую длину и прочность, что дает молекулярную структуру, как показано ниже:
Эти четыре связи имеют одинаковую длину и прочность, что дает молекулярную структуру, как показано ниже:
Благодаря этим уникальным теориям, Л. Полинг получил в 1954 году Нобелевскую премию по химии. Примечательно, что он был единственным человеком, который когда-либо выиграл две неразделенные Нобелевские премии, получив ещё Нобелевскую премию мира в 1963 году.
В 1926 году французский физик Жан Перрен получил Нобелевскую премию по физике за убедительное доказательство существования молекул. Он сделал это, вычислив число Авогадро с помощью трех различных методов, каждый из которых включали жидкофазные системы. Во-первых, он использовал мыльную эмульсию гиммигута, во-вторых, проводя экспериментальные работы по броуновскому движению, и в-третьих, подтверждая теорию Эйнштейна о вращении частиц в жидкой фазе.
Атомно-молекулярное учение Основные положения атомно-молекулярного учения
Таким образом, основные положения атомно-молекулярного учения можно сформулировать следующим образом [c. 17]
17]
Основные положения атомно-молекулярного учения [c.7]
Основные положения атомно-молекулярного учения можно сформулировать так [c.7]
Основные положения атомно-молекулярного учения закономерно изменялись в процессе его исторического развития. [c.11]
ОСНОВНЫЕ ПОЛОЖЕНИЯ АТОМНО-МОЛЕКУЛЯРНОГО УЧЕНИЯ [c.12]
Основные положения атомно-молекулярного учения Ломоносова изложены в работе Элементы математической химии (1741 г.) этим учением пронизаны и многие другие его работы. [c.12]
Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся исследованием газов. Тогда-то и последует каскад открытий простых веществ водород, кислород, азот, хлор. А несколько позже газы помогут установить те законы, которые принято называть основными законами химии. Они и позволят сформулировать основные положения атомно-молекулярного учения. [c.14]
[c.14]
Именно по такой схеме построена тема Первоначальные химические понятия после накопления фактов осуществляется обобщение, формулирование основных положений атомно-молекулярного учения, которое затем применяется в течение вводного курса. Наглядно это можно выразить схемой 3.2. При ее рассмотрении видно, как осторожно и последовательно формируются представления, как тесно связаны они между собой системой логических связей. По единому направлению стрелок можно заключить, что логическая последовательность введения понятий не нарушается. Возражение вызывает лишь место обобщающего урока. Основные положения атомно-молекулярного учения — это более широкое обобщение, чем типы химических реакций. Поэтому разумнее его провести в самом конце темы. [c.216]
Теория химического строения была сформулирована А. М. Бутлеровым в 1861 г. А. М. Бутлеров исходил из материалистических представлений, основанных на атомно-молекулярном учении. Открытию теории предшествовала большая экспериментальная работа по изучению свойств и реакционной способности органических молекул. Сущность этой теории заключается в следующих основных положениях. [c.167]
Сущность этой теории заключается в следующих основных положениях. [c.167]
Большой вклад в развитие атомно-молекулярного учения внесли крупнейшие русские и зарубежные ученые М. В. Ломоносов, Лавуазье, Пруст, Дальтон, Авогадро, Канниццаро, Берцелиус, Д. И. Менделеев, А. М. Бутлеров. Окончательно атомно-молекулярное учение утвердилось как научная теория в середине XIX в. Рассмотрим его основные положения. [c.13]
В чем состоят основные положения атомно-молекулярного учения Каково их обоснование [c.29]
В XVII—XVIII вв. атомизм приобрел механический характер. По сравнению с. предыдущим он был несколько более конкретным, но все же в большой мере оставался абстрактным н мало связанным с экспериментом. Выдающимися представителями здесь были Р. Бойль, который положил атомистику в основу своих химических представлений и объяснял асе химические превращения соединением и разъединением атомов М. В. Ломоносов, он сформулировал основные положения атомно-молекулярного учения.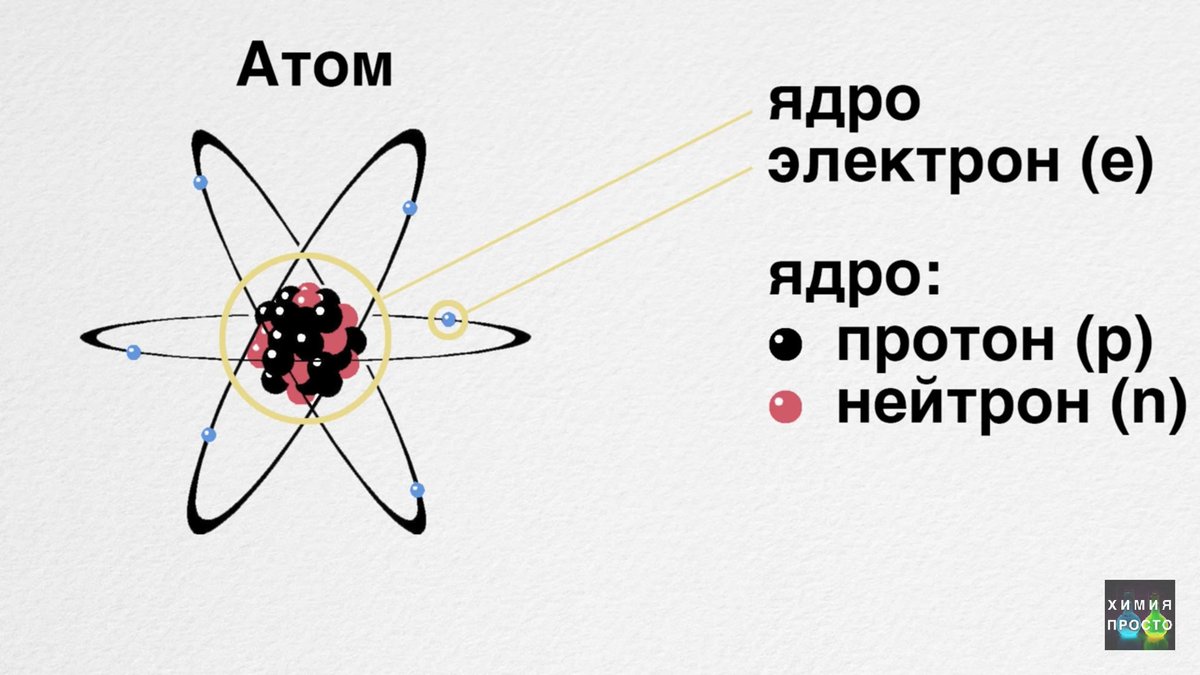 И. Ньютон объяснял взаимодействия атомов при помощи гравитационных сил с использованием атомно-молекулярного учения. [c.11]
И. Ньютон объяснял взаимодействия атомов при помощи гравитационных сил с использованием атомно-молекулярного учения. [c.11]
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М. В. Ломоносов. Основные положения этого учения изложены в работе Элементы математической химии (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям. [c.10]
С созданием основных положений атомно-молекулярного учения в химии все чаще возникало стремление установить взаимосвязь между различными свойствами атомов и молекул. Если создание Дальтоном атомной теории привело к широкому изучению и экспериментальному определению атомных весов, то введение понятия о молекуле привело не только к развитию методов определения молекулярных весов, но и к изучению свойств составляющих молекулу атомов (атомные объемы, изоморфизм, валентность). [c.52]
Основные положения атомно-молекулярного учения. М. В. Ломоносов как основоположник атомно-молекулярного учения. Атомный вес. Молекулярный вес. Грамм-атом, грамм-молекула. Закон сохранения массы веществ, открытый М. В. Ло.моносовым. Постоянство состава вещества. Объяснение основных законов химии с точки зрения атомномолекулярного учения. Закон Авогадро. Грамм-молекулярный объем газообразных веществ. [c.11]
М. В. Ломоносов как основоположник атомно-молекулярного учения. Атомный вес. Молекулярный вес. Грамм-атом, грамм-молекула. Закон сохранения массы веществ, открытый М. В. Ло.моносовым. Постоянство состава вещества. Объяснение основных законов химии с точки зрения атомномолекулярного учения. Закон Авогадро. Грамм-молекулярный объем газообразных веществ. [c.11]
Молекула каждого сложного вещества имеет постоянный атомный состав, т. е. всегда состоит из одних и тех же атомов различных элементов. Вес каждого атома, образующего моле] улу, тоже постоянен. Поэтому остается постоянным и весовое отношение между элементами, образующими сложное вещество. Таким образом, закон постоянства состава вещества может быть иыведен с помощью основных положений атомно-молекулярного учения. [c.25]
Дальнейшие количественные исследования Дальтона и открытие закона кратных отношений, исследование объемных отношений газов в зависимости от температуры, давления, количеств реагирующих веществ (Дальтон, Гей-Люссак, Авогадро и др. ) и позволили создать атомно-молекулярное учение, основные положения которого и были приняты на международном конгрессе химиков в Карлсруэ. [c.13]
) и позволили создать атомно-молекулярное учение, основные положения которого и были приняты на международном конгрессе химиков в Карлсруэ. [c.13]
Вопросы для самопроверки 1. В чем суть ленинского определения материи 2. Каковы основные положения атомно-молекулярного учения Что означают понятия элемент, атом, молекула вещество 3. Что такое атомная масса элемента, в каких единицах она измеряется Какие методы определения атомных масс элементов известны 4. Что называется относительной плотностью газа Какова зависимость между молекулярной массой газа и его плот- [c.8]
И только в начале XIX столетия английский ученый Джон Дальтон возвращается к атомам как наименьшим частицам материи и вводит в науку этот термин. Этому предшествовали работы таких замечательных ученых, как Р. Бойль (в книге Химик-скептик он нанес сокрушительный удар по представлениям алхимиков), Дж. Пристли и К. В. Шееле (открытие кислорода), Г. Кавендиш (открытие водорода), А. Л. Лавуазье (попытка составить первую таблицу простых веществ), М. В. Ломоносов (основные положения атомно-молекулярного учения, закон сохранения массы), Ж. л. Пруст (закон постоянства состава) и многие другие. [c.3]
Л. Лавуазье (попытка составить первую таблицу простых веществ), М. В. Ломоносов (основные положения атомно-молекулярного учения, закон сохранения массы), Ж. л. Пруст (закон постоянства состава) и многие другие. [c.3]
Авторы сочли необходимым включить во введение основные понятия химии, положения атомно-молекулярного учения, стехиометрические.законы, классы неорганических соединений и их номенклатуру, хотя эти раз- делы химии и входят в программу восьмилетней школы. Поскольку данный материал известен учащимся, то он изложен в основном не в историческом плане, а сразу с позиций атомно-молекулярного учения и в несколько расширенном объеме по сравнению со школьным курсом. [c.3]
Современные комментарии основных положений атомно-молекулярного учения [c.14]
Основное содержание атомно-молекулярного учения. Основы атомно-молекулярного учения впервые были изложены Ломоносовым. В 1741 Г4 в одной из своих первых работ — Элементы математической химии — Ломоносов сформулировал важнейшие положения созданной им так называемой корпускулярной теории строения вещества. [c.19]
В 1741 Г4 в одной из своих первых работ — Элементы математической химии — Ломоносов сформулировал важнейшие положения созданной им так называемой корпускулярной теории строения вещества. [c.19]
Число Авогадро. Равное число грамм-молекул различных газов при одинаковой температуре и одинаковом давлении занимает равный объем. Согласно закону Авогадро, в равных объемах различных газов при одинаковых условиях содержится одинаковое ч-исло молекул. Следовательно, одна грамм-молекула любого газа содержит одно и то же число молекул. Это число называется числом Авогадро. По наиболее точным измерениям это число Авогадро равно 6,023-10 . Оно определено различными методами (измерение вязкости газов, коэффициента диффузии, электропроводности электролитов и др.). Совпадение результатов, полученных многими методами, служит доказательством справедливости закона Авогадро и основных положений атомно-молекулярного учения. [c.23]
Наибольшее развитие атомистика (учение об атомах) получила в работах М. В. Ломоносова, создавшего стройное атомно-молекулярное учение. Его основные положения, [c.27]
В. Ломоносова, создавшего стройное атомно-молекулярное учение. Его основные положения, [c.27]
Атомно-молекулярное учение развил и впервые применил в химии М. В. Ломоносов. Основные положения его учения изложены в работе Элементы математической химии (1741) и ряде других . [c.4]
Атомно-молекулярное учение — это учение о строе 1ии вещества из атомов и молекул, основными положениими которого являются [c.8]
После принятия основных положений атомно-моле-куляриого учения прошло более 100 лет. Можно ли считать, что за эти годы все утверждения атомно-молекулярного учения остались верными и неизменными Конечно же, нет. [c.14]
Создакке теории химического строения А. М. Бутлеровым (1861 г.) и открытие Периодически и аакина химических элементов (1869 г.) венчало становление классической химии как науки. На предлагаемой схеме мы стремились наглядно представить основные этапы развития атомно-молскулярно-го учения. Как видно, в 1661-1810 гг. лидирующее положение в разработке атомистических представлений занимали английские ученые. Эстафету они передали ученым Франции и Швеции, которые в 1803-1861 гг. внесли наиболее существенный вклад в создание и развитие атомно-молекулярного учения. В 1861-1881 гг. основная роль в разработке этого учения принадлежит ученым России, Г олландии и Г ермании. После открытия электрона (1897 г.) лидирующее положение вновь заняли английские з ченые, но в этот период ученые других стран также сыграли важную роль в разработке атомно-молекулярной теории. [c.69]
Как видно, в 1661-1810 гг. лидирующее положение в разработке атомистических представлений занимали английские ученые. Эстафету они передали ученым Франции и Швеции, которые в 1803-1861 гг. внесли наиболее существенный вклад в создание и развитие атомно-молекулярного учения. В 1861-1881 гг. основная роль в разработке этого учения принадлежит ученым России, Г олландии и Г ермании. После открытия электрона (1897 г.) лидирующее положение вновь заняли английские з ченые, но в этот период ученые других стран также сыграли важную роль в разработке атомно-молекулярной теории. [c.69]
Атомно-молекулярное учение (History of molecular theory)
2. Эпоха классической химии.
(The era of classical chemistry)
В начале 20-го века американский химик Гилберт Ньютон Льюис, когда он преподавал в Гарварде, чтобы представлять электроны вокруг атомов, стал символично изображать их точками. его учеников отдали предпочтение эти рисунки, что стимулировало его в этом направлении. этих лекций Льюис отметил, что элементы с определенным количеством электронов, по-видимому, имеют особую устойчивость. этот феномен отметил немецкий химик Ричард Aberham в 1904 году, Льюис, который называют «законом валентности из Абега» сегодня широко известно как правило Абегга. Льюис, казалось, сразу вокруг ядра образуется ядро из восьми электронов, слой заполнен и новый слой. Льюис также отметил, что различные ионы с восьми электронов также, кажется, обладают особой стабильности. на основе этих представлений он предложил «правило восьми» или «правило октета»: ионов или атомов с заполненной слой из восьми электронов имеют особую устойчивость.
его учеников отдали предпочтение эти рисунки, что стимулировало его в этом направлении. этих лекций Льюис отметил, что элементы с определенным количеством электронов, по-видимому, имеют особую устойчивость. этот феномен отметил немецкий химик Ричард Aberham в 1904 году, Льюис, который называют «законом валентности из Абега» сегодня широко известно как правило Абегга. Льюис, казалось, сразу вокруг ядра образуется ядро из восьми электронов, слой заполнен и новый слой. Льюис также отметил, что различные ионы с восьми электронов также, кажется, обладают особой стабильности. на основе этих представлений он предложил «правило восьми» или «правило октета»: ионов или атомов с заполненной слой из восьми электронов имеют особую устойчивость.
Кроме того, учитывая, что куб имеет восемь углов, Льюис представлял себе атом как имеющую восемь сторон, которые доступны для электронов, как в углу Куба. впоследствии в 1902 году, он разработал концепцию, в которой кубические атомы могут быть соединены по бокам, образуя купеческий структурированных молекул.
Другими словами, электрон-парные ассоциации формируются, когда два атома имеют общую границу, а в структуре ниже. это приводит к разделению двух электронов. одинаково заряженные ионные связи образуются путем перевода электрона из одного куба в другой, не разделяя края A. промежуточное состояние B, который разделяет только один угол, он также постулировал Льюиса.
Следовательно, двойная связь образуется за счет обмена между двумя атомами кубическую. это приводит к отрыву четырех электронов.
В 1913 году, работая заведующим кафедрой химии в Университете Калифорнии, Беркли, Льюис прочел предварительный вариант статьи на английском аспирант Альфред сельского священника, который приехал в Беркли в течение года. В этой статье, священник предположил, что электрон-это не только электрический заряд, но и небольшой магнит или «Магнетон», как он назвал это, и, тем более, что химическая связь возникает в результате обмена двух электронов между двумя атомами. И это, по словам Льюиса, означает, что связывание происходит, когда два электрона образуют общее ребро между двух кубиков.
Исходя из этих взглядов, в своей знаменитой статье 1916 (Года 1916) «Атом и молекула» Льюис ввел «структуру Льюиса» для представления атомов и молекул, где точками показаны электроны и линии-ковалентные связи. В этой статье он разработал концепцию электронно-пара автобусов, в которых два атома могут делить одного до шести электронов, образующих единый схема подключения, одинарный, двойной или тройной связи
По словам Льюиса:
Кроме того, он предположил, что атом имеет тенденцию к образованию ионов приобретает или теряет определенное количество электронов, необходимое для завершения куб. поэтому Льюис структура показывает каждый атом в структуре молекулы, используя его химический символ. на линии между атомами, которые соединены друг с другом, иногда вместо линий пары очков. избыток электронов, образующих единый пары представлены в виде пары очков и находятся рядом с атомами, на которых они расположены:
Обобщая свои взгляды на новую модель коммуникации, Льюис утверждает:
В следующем году, в 1917 году, тогда еще неизвестного американского инженера и химик по имени Лайнус Полинг учился в Орегонский сельскохозяйственный колледж метод соединения «крючком и ушком» Дальтона, который в то время был фактическим описание связей между атомами. каждый атом имеет определенное количество «крючков», что позволило ему присоединить другие атомы, и определенное количество «ушек», которые позволяют другие атомы, чтобы прикрепить к нему. химическая связь возникает тогда, когда «крючок» и «ушко» подключен. но Л. Полинг не был удовлетворен таким архаичным способом и попросил новый метод в недавно развивающейся области знаний — квантовой физики.
каждый атом имеет определенное количество «крючков», что позволило ему присоединить другие атомы, и определенное количество «ушек», которые позволяют другие атомы, чтобы прикрепить к нему. химическая связь возникает тогда, когда «крючок» и «ушко» подключен. но Л. Полинг не был удовлетворен таким архаичным способом и попросил новый метод в недавно развивающейся области знаний — квантовой физики.
В 1927 году немецкие физики Фриц Лондон и Walter Heitler применил методы квантовой механики для исследования насыщаемости, номера-динамических сил притяжения и отталкивания, т. е. их валентную связь лечение этой проблемы в их совместной работе было знаменательно тем, что оно принесло химии к квантовой механике. их работа повлияла Л. Полинга, который только что получил докторскую степень и посетил В. Heitler и Ф. в Лондоне в Цюрих на стипендию Гуггенхайма.
Впоследствии, в 1931 году, опираясь на работу В. Гитлер и Ф. в Лондоне и по теории нашли в знаменитой статье Г. Льюис, Полинг опубликовал свою новаторскую статью «природа химических связей», в котором он используется в квантовой механике для расчета свойств и структуры молекул, таких как углы между связями и вращения об отношениях.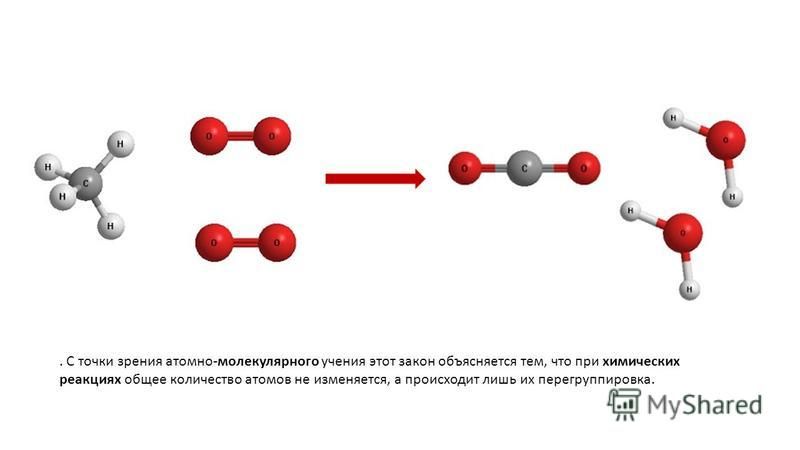 на основе этих понятий Л. Полинг разработал теорию гибридизации для учета связей в молекулах, таких как CH 4 (Гл. 4), в котором четыре орбитали gibridizatsiya sp 3 (СП 3) перекрывания орбиталей водорода 1s, образуя четыре σ-связи. Эти четыре облигации имеют одинаковую длину и прочность, что дает молекулярную структуру, как показано ниже:
на основе этих понятий Л. Полинг разработал теорию гибридизации для учета связей в молекулах, таких как CH 4 (Гл. 4), в котором четыре орбитали gibridizatsiya sp 3 (СП 3) перекрывания орбиталей водорода 1s, образуя четыре σ-связи. Эти четыре облигации имеют одинаковую длину и прочность, что дает молекулярную структуру, как показано ниже:
Благодаря этим уникальным теории Л. Полинг получил в 1954 году Нобелевская премия по химии. Примечательно, что он был единственным человеком, кто когда-либо получил две Нобелевские премии, получить еще одну Нобелевскую премию мира в 1963 году.
В 1926 году французский физик Жан Перрен получил Нобелевскую премию по физике за убедительное доказательство существования молекул. он сделал это, вычисляя число Авогадро, используя три различных метода, каждый из которых включал в жидкофазной системе. во-первых, он используется мыльная эмульсия последние вечера лета, во-вторых, при проведении опытно-экспериментальной работы по броуновскому движению, и в-третьих, подтверждающие Эйнштейна теория о вращении частиц в жидкой фазе.
Секретная шпаргалка по химии. 2.1. Атомно-молекулярное учение | Репетитор Богунова В.Г.
1985 год. Советский Союз. Я — молодая, стройная аспирантка в одном из НИИ РАМН полностью поглощена тайнами генной инженерии и молекулярной биологии. В один прекрасный день мне позвонили близкие люди и попросили поработать с девочкой Инной, выпускницей средней школы, золотой медалисткой, которая приехала из глубокой провинции покорять столичные медицинские ВУЗы. Времени до экзаменов совсем мало — чуть больше месяца. Пришлось заниматься каждый день по много часов. В то время у меня еще не было опыта работы репетитором. За плечами только Университет и небольшая педпрактика в школе. Но было желание вложить в свою первую ученицу все свои знания и опыт. Наша работа увенчалась успехом — Инна поступила в Первый Ленинградский медицинский институт им. И.П. Павлова!
Сегодня я — известный репетитор, разработала результативную методику системно-аналитического изучения химии и биологии, написала огромное количество учебной и методической литературы, подготовила в медицинские ВУЗы целую армию учеников, уже учу их детей, но свою первую ученицу Инну и наши занятия вспоминаю с теплыми чувствами до сих пор. Вам интересно узнать, кем стала хрупкая девочка Инна из далекой провинции? Я обязательно расскажу вам об этом в конце статьи.
Вам интересно узнать, кем стала хрупкая девочка Инна из далекой провинции? Я обязательно расскажу вам об этом в конце статьи.
Помню, с какими трудностями я столкнулась в самом начале своей репетиционной практики — много учебников и сборников задач, но нет никакой системы, нет конструкции, скелета, по которому преподаватель мог бы объяснить учебный материал, а ученик освоить его и повторять при необходимости. И я написала серию учебников «Конспекты репетитора по химии» (3 тома) и «Конспекты репетитора по биологии» (9 томов). Мои труды в 1995 году зарегистрированы в Российском Авторском Обществе при Президенте РФ. Сегодня я решила начать публикацию статей, в основе которых будут положены отдельные главы моих учебников. Надеюсь, статьи помогут ученикам 8-11 классов, которые готовятся к ОГЭ и ЕГЭ по химии и биологии.
Атомно-молекулярное учение
Одной из основ химии, описывающей строение вещества, является атомно-молекулярная теория. Основателями представлений об атомно-молекулярном строении вещества считают древнегреческих философов Левкиппа (500-428 г. до н.э.) и его ученика Демокрита (460-370 г. до н.э.).
до н.э.) и его ученика Демокрита (460-370 г. до н.э.).
Левкипп полагал, что вещество можно делить до тех пор, пока не образуются мельчайшие неделимые частицы. Он считал, что вещество образуется, когда сталкиваются и связываются между собой в различных соотношениях движущиеся в пустоте частицы.
Демокрит назвал эти частицы атомами (греч. «atomos» — неделимый) и высказал предположение о том, что различие веществ вызвано различием форм, размеров и положения в пространстве атомов, их образующих.
В середине XVII в. атомно-молекулярная теория была впервые подтверждена экспериментально Р.Бойлем и Э.Мариоттом в работах по изучению газов и в основном сформулирована М.В.Ломоносовым в 1741 г. в работе «Элементы математической химии».
Основные положения атомно-молекулярного учения
1. Все вещества состоят из «корпускул» (молекул).
2. Молекулы состоят из «элементов» (атомов).
3. Частицы (молекулы и атомы) находятся в непрерывном движении. Тепловое состояние тел — есть результат движения этих частиц.
4. Молекулы простых веществ состоят из одинаковых, сложных — из различных атомов.
В 1808 г. английский ученый Д. Дальтон в работе «Новая система химической философии» изложил основные положения химической атомистики.
1. Впервые определил соединительные массы (эквиваленты) известных тогда элементов.
2. Для обозначения атомов ввел значки — кружки, в которых помещались другие условные знаки.
3. Отрицал существование молекул у простых веществ, полагал, что простые вещества состоят только из атомов, а сложные вещества — из «сложных атомов».
В 1814 г. шведский химик Я. Берцелиус предложил буквенные химические знаки.
В 1860 г. на международном съезде химиков в г. Карлсруэ были приняты определения понятий атома и молекулы.
Атом
Атом (лат. atomos — неделимый) — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Массы атомов малы: масса атома водорода m(H) = 1,674•10-24 г, кислорода m(O) = 2,667•10-23 г, углерода m(C) = 1,993•10-23 г.
Атомы элементов могут существовать в свободном состоянии и в соединении с атомами того же элемента или атомами других элементов, образуя молекулы.
Молекула
Молекула (лат. moles — масса) — наименьшая частица простого или сложного вещества, обладающая его основными химическими свойствами. По числу входящих в молекулу атомов различают двухатомные, трехатомные и т.д. молекулы. Если число атомов в молекуле велико — это макромолекула (молекулы белка, нуклеиновых кислот).
Химический элемент
Химический элемент — это вид атомов с определенным зарядом ядра.
В настоящее время известно 118 элементов, около 90 из которых существуют в природе, а остальные получены искусственно путем ядерных реакций. Названия и символы элементам с порядковыми номерами от 104 до 109 были присвоены комиссией ИЮПАК в 1995 г.
В 2006 г. российские и американские ученые получили 118-й – сверхтяжелый элемент периодической таблицы Д.И. Менделеева. В распространенном заявлении сотрудников Ливерморской лаборатории им. Лоуренса (Калифорния) и Объединенного института ядерных исследований (г. Дубна) говорится, что эксперименты по синтезу 118-го элемента проводились на дубнинском ускорителе элементарных частиц в 2005 году. Ядро нового элемента образовалось в результате бомбардировки ядер атомов калифорния ядрами изотопа кальция. Элемент под номером 118 — благородный газ, имеющий временное название унуноктий («одно-одно-восьмий»). Он имеет атомную массу 294 и «живет» десятитысячные доли секунды.
Лоуренса (Калифорния) и Объединенного института ядерных исследований (г. Дубна) говорится, что эксперименты по синтезу 118-го элемента проводились на дубнинском ускорителе элементарных частиц в 2005 году. Ядро нового элемента образовалось в результате бомбардировки ядер атомов калифорния ядрами изотопа кальция. Элемент под номером 118 — благородный газ, имеющий временное название унуноктий («одно-одно-восьмий»). Он имеет атомную массу 294 и «живет» десятитысячные доли секунды.
Наибольшее распространение в природе имеют элементы малой атомной массы: в космосе — водород и гелий, в живых организмах — водород, кислород, азот и углерод, в земной коре — кислород, кремний, алюминий и железо. Вне Земли в пределах, досягаемых для наблюдения, не обнаружены элементы, отличающихся от тех, которые уже открыты.
Вы внимательно прочитали статью и, тем самым, сделали первый шаг в сложном пути подготовки к экзамену по химии. Впереди вас ждет много нужных, важных и увлекательных публикаций с теоретическими материалами и решенными задачами. А сейчас выполняю обещание — рассказать о том, как сложилась судьба моей первой ученицы Инны. Читайте ее отзыв-воспоминание о работе со мной, и вы все поймете сами.
Впереди вас ждет много нужных, важных и увлекательных публикаций с теоретическими материалами и решенными задачами. А сейчас выполняю обещание — рассказать о том, как сложилась судьба моей первой ученицы Инны. Читайте ее отзыв-воспоминание о работе со мной, и вы все поймете сами.
Инна Шейнер, известный ведущий геронтолог США (Тампа, Флорида)
«Я помню, как это было трудно и сколько эмоций возникает, когда тебя впервые называют студентом. Наша профессия интернациональна, она не имеет границ. Как быстро идет время. Кажется, совсем недавно я готовилась к поступлению у Богуновой Валентины Георгиевны. С того времени прошло тридцать три года. Но и сейчас я с большой теплотой вспоминаю о своем первом настоящем Учителе!
Химия и биология даются очень трудно. Методика Богуновой строится на заинтересованности в предмете, и уважительном отношении к ученику. При таком подходе все становится понятным. Помню, как после первого самостоятельного решения сложной задачи я шла окрыленной и уверенной в своих силах.
Такой настрой сохранялся во мне все время, по мере усложнения материала. К концу обучения я могла решать очень сложные задачи. Знания, которые она смогла вложить в мою голову, помогли мне поступить в (тогда еще Ленинградский) медицинский институт имени академика Павлова.
В 1992 году, я выиграла грант и поехала в США. В Америке смогла блестяще пересдать экзамены, пройти резидентуру и получить место на кафедре университета. Я до сих пор с теплотой вспоминаю Валентину Георгиевну и ее наставления»
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Основные положения атомно-молекулярной теории | Подготовка к ЦТ и ЕГЭ по химии
Основные положения атомно-молекулярной теории
Первый определил химию как науку М. В. Ломоносов. Он считал, что химия должна строиться на точных количественных данных –“на мере и весе”. Ломоносов создал учение о строении вещества, заложил основу атомно-молекулярной теории.
Оно сводится к следующим положениям, изложенным в работе “Элементы математической химии”:
- Каждое вещество состоит из мельчайших, далее физически неделимых частиц (Ломоносов называл их корпускулами, впоследствии они были названы молекулами).
- Молекулы находятся в постоянном, самопроизвольном движении.
- Молекулы состоят из атомов (Ломоносов назвал их элементами).
- Атомы характеризуются определенным размером и массой.
- Молекулы могут состоять как из одинаковых, так и различных атомов.

Молекула – это наименьшая частица вещества, сохраняющая его состав и химические свойства. Молекула не может дробиться дальше без изменения химических свойств вещества. Между молекулами вещества существует взаимное притяжение, различное у разных веществ. Молекулы в газах притягиваются друг к другу очень слабо, тогда как между молекулами жидких и твердых веществ силы притяжения относительно велики. Молекулы любого вещества находятся в непрерывном движении. Этим явлением объясняется, например, изменение объема веществ при нагревании.
Атомами называются мельчайшие, химически неделимые частицы, из которых состоят молекулы. Атом – это наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами.
При химических реакциях атомы не возникают и не исчезают, а образуют молекулы новых веществ. Элемент следует рассматривать как вид атомов с одинаковым зарядом ядра.
Химические свойства атомов одного и того же химического элемента одинаковы, такие атомы могут отличаться только массой. Разновидности атомов одного и того же элемента с различной массой, называются изотопами.
Разновидности атомов одного и того же элемента с различной массой, называются изотопами.
Поэтому, разновидностей атомов больше, чем химических элементов.
Необходимо различать понятия “химический элемент” и “простое вещество”.
Вещество – это определенная совокупность атомных и молекулярных частиц в любом из трех агрегатных состояний. Химический элемент – это общее понятие об атомах с одинаковым зарядом ядра и химическими свойствами. Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя.
Простые вещества – это вещества, состоящие из атомов одного и того же химического элемента. Один и тот же элемент может образовывать несколько простых веществ.
Далее приведено современное изложение основных положений атомно-молекулярного учения:
- Все вещества состоят из атомов.
- Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).

- При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
- При физических явлениях молекулы сохраняются, при химических – разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
Атомно-молекулярное учение и основные химические законы.

АТОМНО — МОЛЕКУЛЯРНОЕ УЧЕНИЕ И ОСНОВНЫЕ ХИМИЧЕСКИЕ ЗАКОНЫ.
Период с 1200 по 1700 г. в истории химии принято называть алхимическим. Движущей силой алхимии в течение пяти веков являлся бесплодный поиск некоего философского камня, превращающего благородные металлы в золото. Однако, несмотря на всю абсурдность основной идеи, алхимия накопила богатейший арсенал определенных знаний и практических приемов, позволяющих осуществлять многообразные химические превращения. В начале XVIII в. накопленные знания приобретают практическую важность, что связано с началом интенсивного развития металлургии и с необходимостью объяснить сопутствующие процессы горения, окисления и восстановления. Перенесение интересов в актуальную практическую сферу человеческой деятельности позволило ставить и решать задачи, приведшие к открытию основных законов химии, и способствовало становлению химии как науки.
Исключительное значение для развития химии имела научная теория горения, созданная М. В. Ломоносовым в результате опытов по прокаливанию металлов в запаянных стеклянных сосудах (ретортах). Русский ученый установил, что если сосуд, содержащий металл, взвесить до и после прокаливания, не вскрывая его, то масса остается без изменений. При нагревании же металла во вскрытой реторте масса увеличивается за счет его соединения с воздухом, проникающим в сосуд. Эти наблюдения позволили сделать вывод, который в настоящее время формулируется следующим образом:
В. Ломоносовым в результате опытов по прокаливанию металлов в запаянных стеклянных сосудах (ретортах). Русский ученый установил, что если сосуд, содержащий металл, взвесить до и после прокаливания, не вскрывая его, то масса остается без изменений. При нагревании же металла во вскрытой реторте масса увеличивается за счет его соединения с воздухом, проникающим в сосуд. Эти наблюдения позволили сделать вывод, который в настоящее время формулируется следующим образом:
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Это положение, получившее название закона сохранения массы, является следствием всеобщего естественного закона сохранения материи и движения, сформулированного М.В. Ломоносовым как всеобщий естественный закон: «Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько присоединится к другому: так, ежели где убудет несколько материи, то умножится в другом месте. Сей всеобщий естественный закон простирается и в самые правила движения». При этом под материей М.В. Ломоносов фактически понимал вещество, а под мерой его количества – массу.
Сей всеобщий естественный закон простирается и в самые правила движения». При этом под материей М.В. Ломоносов фактически понимал вещество, а под мерой его количества – массу.
Следующим шагом в развитии химии явилось установление положения о постоянстве состава веществ:
Каждое химически чистое соединение независимо от способа его получения имеет вполне определенный состав (Ж. Пруст, 1801 г.).
Например, оксид углерода (IV) можно получить по любой из указанных ниже реакций:
В химически чистом образце этого оксида всегда содержится и . Отклонение от указанного состава свидетельствует о присутствии примесей. Утверждение, обратное положению о постоянстве состава веществ: каждому определенному составу отвечает только одно химическое соединение, неверно. Действительно, диметиловый эфир и этиловый спирт имеют одинаковый химический состав — , но отличаются друг от друга структурой молекул, т. е. порядком соединения в них атомов (изомеры).
е. порядком соединения в них атомов (изомеры).
Установление закона сохранения массы и положения о постоянстве состава позволило приписать атомам химических элементов строго определенную массу. Значения масс атомов, выраженные в обычно используемых единицах массы (абсолютная атомная масса ), очень малы, поэтому применять их в повседневной практике крайне неудобно. Например, масса атома углерода равна:
В связи с этим была введена особая единица – атомная единица массы (а.е.м.):
Тогда значение атомной массы любого элемента может быть выражено в а.е.м.
Одновременно в химии пользуются относительными атомными массами. Относительной атомной массой элемента называется отношение массы атома к (1/12) массе атома углерода. Обозначается относительная атомная масса элемента символом , где r – начальная буква слова relative – относительный. Важно, что в отличие от величины величина безразмерна. Связь между величинами и дается соотношением:
Связь между величинами и дается соотношением:
По аналогии для однозначной характеристики молекул вводится понятие абсолютной и относительной молекулярной массы.
Относительной молекулярной массой вещества называется отношение массы молекулы вещества к 1/12 массы атома углерода.
Значение абсолютной молекулярной массы определяется соотношением:
Кроме рассмотренных величин в химии применяют особую величину – количество вещества , которое определяется числом структурных частиц (атомов, молекул или других частиц) этого вещества и выражается в молях (моль).
Моль равен количеству вещества, содержащего столько же структурных частиц данного вещества, сколько атомов содержится в углероде массой 12 г.
Для удобства расчетов, проводимых на основании химических реакций и учитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится молярная масса вещества.
Молярная масса вещества представляет собой отношение его массы к количеству вещества:
где m – масса в граммах, ⋎ — количество вещества в молях, M – молярная масса в г/моль – постоянная величина для каждого данного вещества.
Значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента.
Определение, данное молю, опирается на число структурных частиц, содержащихся в 12 г углерода. Было установлено, что указанная масса углерода содержит атомов этого элемента. Следовательно, любой химический индивид количеством 1 моль содержит структурных частиц (атомов или молекул).
Число было определено в начале XIX в. итальянским ученым А. Авогадро и носит название постоянной Авогадро. Оценка величины стала возможной после установления закона Авогадро (1811 г. ).
).
В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро следует, что два газа одинаковых объёмов при одинаковых условиях, хотя и содержат одинаковое число молекул, имеют неодинаковые массы: масса одного газа во столько раз больше массы другого, во сколько раз относительная молекулярная масса первого больше, чем относительная молекулярная масса второго, т.е. плотности газов относятся как их относительные молекулярные массы:
где – плотность газа (г/л), – относительная молекулярная масса, – относительная плотность одного газа по другому, – индекс, указывающий формулу газа, по отношению к которому проведено определение. Например, — относительная плотность газа по водороду, – относительная плотность газа по воздуху (в этом случае говорят о средней относительной молекулярной массе смеси газов – воздуха; она равна 29).
С помощью значения относительной плотности газа была определена относительная молекулярная масса и уточнен состав молекул многих веществ, находящихся в газообразном состоянии.
Независимая оценка значения молярной массы может быть проведена на основании обобщенного уравнения Клапейрона – Менделеева:
где p – давление газа в замкнутой системе, V – объем системы, m – масса газа, R – молярная газовая постоянная, равная , T – абсолютная температура.
Итак, почти через полвека представления М.В. Ломоносова о молекулах (корпускулах) как о наименьших частицах простых и сложных веществ вновь возрождаются в трудах А. Авогадро. Однако в начале XIX в. эти воззрения не получили должного признания: даже крупные химики того времени Д. Дальтон и И. Берцелиус отрицали возможность существования молекул, состоящих из нескольких одинаковых атомов. Прошло ещё полвека, прежде чем на I Международном съезде химиков, состоявшемся в Карлсруэ (Германия) в сентябре 1860 г., были окончательно приняты основные химические представления (понятия об атомах и молекулах), зародившиеся в виде философского учения в Древней Греции (Левкипп, Демокрит, Эпикур), впервые развитые в виде научной концепции М.В. Ломоносовым, подтвержденные опытами Ж. Пруста, Д. Дальтона, Ж. Гей-Люссака и окончательно сформулированные в трудах А. Авогадро и его ученика С. Канниццаро.
Прошло ещё полвека, прежде чем на I Международном съезде химиков, состоявшемся в Карлсруэ (Германия) в сентябре 1860 г., были окончательно приняты основные химические представления (понятия об атомах и молекулах), зародившиеся в виде философского учения в Древней Греции (Левкипп, Демокрит, Эпикур), впервые развитые в виде научной концепции М.В. Ломоносовым, подтвержденные опытами Ж. Пруста, Д. Дальтона, Ж. Гей-Люссака и окончательно сформулированные в трудах А. Авогадро и его ученика С. Канниццаро.
Таким образом, основные положения атомно-молекулярного учения можно сформулировать следующим образом:
1. Все вещества состоят из молекул.
2. При физических явлениях молекулы сохраняются, при химических разрушаются.
3. Молекулы веществ состоят из атомов; при химических реакциях атомы в отличие от молекул сохраняются.
4. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
| < Предыдущая | Следующая > |
|---|
атомов и молекул
Кэрри Робачек, Элементарная школа Cold Spring, Cold Spring, Миннесота, основана на оригинальном задании из книги Дженис ВанКлив «204 Sicky, Gloppy, Wacky & Wonderful Experiments», стр. 52.
Профиль автора
Сводка
В рамках введения в Периодическую таблицу элементов учащиеся познакомятся с идеей атомов, молекул и химических реакций. Физические манипуляции с зефиром (атомами) и зубочистками (связками) создадут визуальное представление молекулярной структуры воды.Второй шаг требует, чтобы студенты создали вторую молекулу, используя аналогичные материалы и используя Периодическую таблицу в качестве ориентира.
Цели обучения
Студенты смогут отобразить и описать понятие атома. (знание / понимание)
(знание / понимание)
Студенты смогут отображать и описывать концепцию молекулы и связей. (знание / понимание)
Студенты будут использовать Периодическую таблицу элементов в качестве справочного пособия. (понимание)
Студенты самостоятельно создадут вторую молекулярную модель по своему выбору.(заявление)
Контекст использования
6 класс.
Возможно полное обучение в классе (30 учеников) с табличным пространством для создания моделей.
Перед этими практическими занятиями необходимо время для объяснения Периодической таблицы элементов.
Атомы и молекулы в настоящее время не входят в нашу учебную программу по естествознанию, но я намерен включить их в нашу группу по изучению окружающей среды. Мы тесно сотрудничаем с нашим местным водосборным районом и DNR для проведения экологических исследований, проводимых вокруг наших местных озер и рек.
Предмет : Химия: Общая химия: Связи и молекулы, атомная структура, элементы и периодическая таблица
Тип ресурса : Мероприятия: Классные занятия
Уровень класса : Средний (6-8)
Описание и учебные материалы
Урок 1 — Структурированная практика
1) Раздайте несколько мисок цветного зефира, как миниатюрного, так и обычного размера, на рабочие столы учащихся. Купите смешанные пакеты пастельных тонов зефира (зеленого, желтого, розового) и пакеты белого цвета.
Купите смешанные пакеты пастельных тонов зефира (зеленого, желтого, розового) и пакеты белого цвета.
2) Раздайте зубочистки по каждому столу.
3) Раздайте достаточно ламинированных копий Периодической таблицы элементов, чтобы их можно было использовать в качестве ссылок на каждом рабочем столе.
4) Вместе со студентами создайте на доске ключ, чтобы определить, какой цвет и размер зефира представляют какие атомы. {розовый = углерод (C), маленький белый = кислород (O), большой белый = водород (H), зеленый = натрий (Na), зеленый = хлор (Cl) и т. д.}
5) Создайте рабочий лист, чтобы ученики записали одно или все из следующего:
а.нарисуйте изображение молекулы на листе бумаги цветными карандашами
б. обозначить атомы на чертеже
c. назовите вновь созданную молекулу
d. перечислить номер каждого типа атома
е. рассчитать молекулярную массу, используя Периодическую таблицу элементов
6) Соберите рабочие листы учащихся, чтобы проверить точность перед уроком 2.
7) Поручите студентам прийти на следующий день в класс с молекулой, которую они хотели бы создать.Попросите их поискать в Интернете молекулярную структуру по своему выбору.
Урок 2 — Практика под руководством / Самостоятельная работа
1) Повторите шаги 1-3, указанные выше.
2) Удалите ключ из класса, который назначал атомам цвета зефира из предыдущего урока. Разрешите учащимся переименовывать цвета зефира в соответствии с индивидуальными потребностями.
3) Попросите учащихся выполнить те же шаги, что и в Уроке 1, для создания модели и снова записать свои данные на листе, использованном на предыдущем уроке.
Учебные заметки и советы
В зависимости от предшествующего знания Периодической таблицы, вы могли бы заняться другими концепциями, такими как: химическая реакция, химическое изменение, реагенты, продукты и закон сохранения вещества.
Вы можете использовать кнопки или глину для представления атомов, а также зубочистки или средства для чистки посуды для обозначения связей.
Я еще не занимался этим заданием в классе, но практиковался дома. На самом деле мне повезло больше, когда модель осталась вместе, когда зефир стал тверже.
Оценка
Рабочий лист урока 1 будет записан как оценка за участие.
Рабочий лист и модель урока 2 будут записаны как оценка успеваемости.
Стандарты
6 класс, II.Физическая наука, A.1-2-3, (материя состоит из мелких частиц)
Ссылки и ресурсы
Атом в учебной программе по химии: фундаментальная концепция, модель обучения или эпистемологическое препятствие?
AAAS. Project 2061: Benchmarks, Американская ассоциация развития науки, доступно по адресу http://www.project2061.org/tools/benchol/bolframe.htm (по состоянию на март 2002 г.), 1993.
P.K. Арлин. Когнитивное развитие в зрелом возрасте: пятая стадия ?. Психология развития 11 (5): 602–606, 1975.
Google Scholar
г. Бакалар. Философия нет: философия научного разума . Нью-Йорк: Orion Press, 1968 (оригинальное французское издание опубликовано в 1940 году).
Google Scholar
Р. Бен-Цви, Б.-С. Эйлон и Дж. Зильберштейн. Податлив ли атом меди? Журнал химического образования 63 (1): 64–66, 1986.
Google Scholar
W.H. Брок. История химии Фонтана . Лондон: Fontana Press, 1992.
Google Scholar
Р. Червеллати и Д. Перуджини. Понимание концепции атомной орбиты итальянскими старшеклассниками. Журнал химического образования 58 (7): 568–569, 1981.
Google Scholar
М.T.H. Чи, Дж.Д. Слотта и Н. де Леу. От вещей к процессам; Теория концептуальных изменений для изучения научных концепций. Обучение и инструктаж 4: 27–43, 1994.
Google Scholar
Г. Клэкстон. Минитеории: предварительная модель для изучения науки, глава 3. В: П.Дж. Блэк и А.М. Лукас (ред.), Дети Неформальные идеи в науке, стр. 45–61. Лондон: Рутледж, 1993.
Google Scholar
Д.Кро, Р. Амуру, М. Шастретт, М. Файоль, Ж. Лебер и М. Маурин. Представления студентов-первокурсников о строении вещества и понятиях кислот и оснований. Европейский журнал естественнонаучного образования 8 (3): 305–313, 1986.
Google Scholar
Департамент образования и занятости / Управление по вопросам квалификации и учебных программ. Наука: Национальная учебная программа для Англии . Лондон: DfEE / QCA, 1999.
Google Scholar
Р. Драйвер. Концепции студентов и изучение науки. International Journal of Science Education 11 (специальный выпуск): 481–490, 1989.
Google Scholar
Р. Драйвер, Дж. Лич, П. Скотт и К. Вуд-Робинсон. Понимание молодыми людьми научных концепций: значение исследований для разных возрастов при планировании учебной программы. Исследования в области естественнонаучного образования 24: 75–100, 1994.
Google Scholar
Р. Драйвер, Дж. Лич, Р. Миллар и П. Скотт. Молодые люди Образы науки. Buckingham: Open University Press, 1996.
.
Google Scholar
R. Duit, W.-M. Рот, М. Коморек и Дж. Уилберс. Концептуальные изменения с анализом дискурса для понимания познания в разделе «Хаотические системы: к интегративной перспективе обучения в науке». Международный журнал естественнонаучного образования 20 (9): 1059–1073, 1998.
Google Scholar
К. Флеминг. Понимание студентами первого курса университета химической связи, доклад, представленный на конференции ASERA ’94, Хобарт, июль 1994 г.
D.C. Finster. Развивающая инструкция: Часть 1. Модель интеллектуального развития Перри. Журнал химического образования 66 (8): 659–661, 1989.
Google Scholar
K. Gadd and S. Gurr. Батский университет 16–19: химия . Уолтон-он-Темз: Thomas Nelson and Sons Ltd, 1994.
Google Scholar
П.Дж. Гарнетт, П.Дж. Гарнетт и М.В. Хаклинг. Альтернативные концепции студентов в химии: обзор исследований и их значение для преподавания и обучения. Исследования в области естественнонаучного образования 25: 69–95, 1995.
Google Scholar
J.K. Гилберт. Объяснение с помощью моделей. В: M. Ratcliffe (Ed.), ASE Guide to Secondary Science Education . Лондон: Стэнли Торнс, 1998.
.
Google Scholar
J.K. Гилберт, Р.Дж. Осборн и П.Дж. Феншем. Детская наука и ее последствия для обучения. Научное образование 66 (4): 623–633, 1982.
Google Scholar
Дж.К. Гилберт, К. Бутлер и М. Резерфорд, Маргарет. Модели в пояснениях, часть 1: Лошади для тренировок? Международный журнал естественнонаучного образования 20 (1): 83–97, 1998.
Google Scholar
R.J. Гиллеспи. Связь без орбиталей. Химическое образование : 103–106, 1996.
А. Голдхаммер. Переводчик Предисловие к Bachelard, Gaston, The New Scientific Spirit. Бостон: Beacon Press, 1984 (оригинальное французское издание, опубликованное в 1934 году).
Google Scholar
А.К. Гриффитс и К. Престон. Заблуждения учащихся 12-х классов относительно фундаментальных характеристик атомов и молекул. Журнал исследований в области преподавания естественных наук 29 (6): 611–628, 1992.
Google Scholar
Л. Гросслайт, К. Унгер, Э. Джей и К.Л. Смит. Понимание моделей и их использование в науке: концепции учащихся средних и старших классов и экспертов. Журнал исследований в области преподавания естественных наук 28 (9): 799–822, 1991.
Google Scholar
А.Г. Харрисон и Д.Ф. Treagust. Ментальные модели атомов и молекул учащихся средних школ: значение для преподавания химии. Естественное образование 80 (5): 509–534, 1996.
Google Scholar
А.Г. Харрисон и Д.Ф. Treagust. Изучение атомов, молекул и химических связей: пример использования нескольких моделей в химии 11 класса. Естественное образование 84: 352–381, 2000.
Google Scholar
П. Хьюсон и М. Хьюсон. Роль концептуального конфликта в концептуальном изменении и дизайне научного обучения. Преподавание 13: 1–13, 1984.
Google Scholar
Дж. Хадсон. История химии . Бейзингстоук: MacMillan, 1992.
Google Scholar
П.М. Джонсон и Р. Готт. Конструктивизм и свидетельства детских идей. Научное образование 80 (5): 561–577, 1996.
Google Scholar
П. Джонсон. Прогресс в понимании детьми «базовой» теории частиц: продольное исследование. Международный журнал естественнонаучного образования 20 (4): 393–412, 1998a.
Google Scholar
П.Джонсон. Понимание детьми изменений состояния, связанных с состоянием газа, Часть 1: Кипящая вода и теория частиц. Международный журнал естественнонаучного образования 20 (5): 567–583, 1998b.
Google Scholar
Р. Джусти и Дж. Гилберт. История и философия науки через модели: некоторые проблемы в случае «атома». Международный журнал естественнонаучного образования 22 (9): 993–1009, 2000.
Google Scholar
Д.А. Крамер. Постформальные операции? Необходимость дальнейшей концептуализации. Человеческое развитие 26: 91–105, 1983.
Google Scholar
А. Машхади. Понимание квантовой физики учащимися физики продвинутого уровня, доклад, представленный на ежегодной конференции Британской ассоциации образовательных исследований, Оксфорд, сентябрь 1994 г.
Р. Миллар и Дж. Осборн (ред.). После 2000: научное образование для будущего .Лондон: Королевский колледж, Лондон: Педагогическая школа, 1998.
Google Scholar
Дж. Моррис. GCSE Химия . Лондон: Collins Educational, 1991.
.
Google Scholar
Э.Ф. Мортимер. Концептуальное изменение или концептуальное изменение профиля? Наука и образование 4: 267–285, 1995.
Google Scholar
Н.Нерсесян. Конструирование и обучение: роль «методов абстракции» в создании и изучении физики, глава 2. В: R. Duschl and R. Hamilton (Eds.), Философия науки, когнитивная психология и педагогическая теория и практика , стр. 48–68. Олбани, Нью-Йорк: SUNY Press, 1992.
Google Scholar
М. Ниаз. От катодных лучей до альфа-частиц и кванта действия: рациональная реконструкция структуры атома и ее значение для учебников химии. Научное образование 82 (5): 527–552, 1998.
Google Scholar
Дж. Д. Новак и Д. Мусонда. Двенадцатилетнее лонгитюдное исследование научного концептуального обучения. Американский журнал исследований в области образования 28 (1): 117–153, 1991.
Google Scholar
Дж. Нуссбаум и С. Новик. Альтернативные рамки, концептуальный конфликт и приспособление: к принципиальной стратегии обучения. Преподавание 11: 183–200, 1982 г.
Google Scholar
Оксфордская научная программа. Материалы и модели . Оксфорд: Oxford University Press, 1993.
Google Scholar
Дж. Петри и Х. Ниддерер. Путь обучения квантовой атомной физике на уровне старших классов. Международный журнал естественнонаучного образования 20: 1075–1088, 1998.
Google Scholar
М. Поланьи. Личные знания: к посткритической философии . Чикаго: University of Chicago Press, 1962, исправленная версия (первоначально опубликовано в 1958 году).
Google Scholar
K.R. Поппер. Объективное знание: эволюционный подход (исправленное издание). Оксфорд: Издательство Оксфордского университета, 1979 г. (оригинальное издание, 1972 г.).
Google Scholar
G.J. Познер, К. Страйк, П. Хьюсон и В.А.Гертцог. Адаптация научной концепции: к теории концептуального изменения. Научное образование 66 (2): 211–227, 1982.
Google Scholar
Л. Ренстрём, Б. Андерссон и Ф. Мартон. Представления студентов о материи. Журнал педагогической психологии 82 (3): 555–569, 1990.
Google Scholar
Г.И. Сакхейм и Д. Lehman. Химия для медицинских наук , 7-е изд. Нью-Йорк: Macmillan, 1994.
.
Google Scholar
E.R. Scerri. Модель электронной конфигурации, квантовая механика и редукция. Британский журнал философии науки 42: 309–325, 1991.
Google Scholar
E.Р. Шерри. Успешно ли аксиоматизирована Периодическая таблица? Erkenntnis 47: 229–243, 1997.
Google Scholar
Э. Шерри. О природе химии. Educación Quimica 10 (2): 74–78, 1999.
Google Scholar
H.-J. Шмидт. Ярлык как скрытый убедитель: концепция нейтрализации химиков. Международный журнал естественнонаучного образования 13 (4): 459–471, 1991.
Google Scholar
H.-J. Шмидт. Относится ли периодическая таблица к химическим элементам. School Science Review 80 (290): 71–74, 1998.
Google Scholar
М. Шайер и П. Адей. На пути к преподаванию естественных наук: когнитивное развитие и учебный план . Оксфорд: Образовательные книги Heinemann, 1981 (представлено).
Google Scholar
Дж.П. Смит, А.А. ди Сесса и Дж. Рошель. Переосмысление заблуждений: конструктивистский анализ знаний в переходный период. The Journal of Learning Sciences 3 (2): 115–163, 1993.
Google Scholar
Дж. Соломон. Знакомство с энергией — в школе и обществе . Лондон: Falmer Press, 1992.
.
Google Scholar
J.-P. Сук.Историческая эпистемология Гастона Бачелара и ее значение для естественнонаучного образования. Мышление: Философский журнал для детей 6 (4): 8–13, 1988.
Google Scholar
Х. Ставриду и К. Соломониду. Концептуальная реорганизация и построение концепции химической реакции в среднем образовании. Международный журнал естественнонаучного образования 20 (2): 205–221, 1998.
Google Scholar
К.А. Страйк и Г.Дж. Познер. Концептуальное изменение взгляда на обучение и понимание, Глава 13. В: L.H.T. Вест и А.Л. Пайнс (ред.), , Когнитивная структура и концептуальные изменения, , стр. 211–231. Лондон: Academic Press Inc., 1985.
.
Google Scholar
К.А. Страйк и Г.Дж. Познер. Ревизионистская теория концептуальных изменений, глава 5. В: R.A. Душль и Р.Дж. Гамильтон (ред.), Философия науки, когнитивная психология и педагогическая теория и практика .Олбани, Нью-Йорк: State University of New York Press, 1992.
Google Scholar
К.С. Табер. Непонимание ионной связи. Химическое образование 31 (4): 100–103, 1994.
Google Scholar
К.С. Табер. Аналогия для обсуждения прогресса в изучении химии. Обзор школьной науки 76 (276): 91–95, 1995a.
Google Scholar
К.С. Табер. Развитие понимания студентов: пример стабильности и лабильности когнитивной структуры. Исследования в области науки и технологического образования 13 (1): 87–97, 1995b.
Google Scholar
К.С. Табер. Хлор — это оксид, тепло вызывает плавление молекул, а натрий плохо реагирует с хлором: обзор базовых знаний одного уровня химии. Обзор школьной науки 78 (282): 39–48, 1996a.
Google Scholar
К.С. Табер. Существуют ли атомы? Химическое образование 33 (1): 28, 1996b.
Google Scholar
К.С. Табер. Понимание химической связи — развитие студентов уровня ‘Понимание концепции химической связи. Кандидат наук. диссертация, Университет Суррея, 1997a.
К.С. Табер. Понимание студентами ионной связи: молекулярное или электростатическое мышление? Обзор школьной науки 78 (285): 85–95, 1997b.
Google Scholar
К.С. Табер. Разделение ядерного притяжения: или я не могу думать о физике в химии. Международный журнал естественнонаучного образования 20 (8): 1001–1014, 1998a.
Google Scholar
К.С. Табер. Альтернативная концептуальная основа химического образования. Международный журнал естественнонаучного образования 20 (5): 597–608, 1998b.
Google Scholar
К.С. Табер. Альтернативные концептуальные основы в химии. Химическое образование 36 (5): 135–137, 1999.
Google Scholar
К.С. Табер. Бросить вызов химическим заблуждениям в классе?: Проект стипендий Королевского общества учителей химии 2000–2001, представленный на ежегодной конференции Британской ассоциации образовательных исследований 2000 года, Университет Кардиффа, суббота, 9 сентября 2000 г. — доступен через линию образования по адресу http: // www.leeds.ac.uk/educol/, 2000a.
К.С. Табер. Лекция 2000 г. Исследовательской группы химического образования: Молярные и молекулярные концепции исследования изучения химии: на пути к синтезу, представленная в виде пленарной лекции на совещании «Разнообразие преподавания химии» , организованном группой высшего образования RSC совместно с Исследовательской группой химического образования. в Университете Ланкастера, 5 сентября 2000 г. — доступно через образовательную линию по адресу http://www.leeds.ac.uk/educol/ или на веб-сайте Королевского химического общества по адресу http: // www.rsc.org/lap/rsccom/dab/educ002.htm.
К.С. Табер. Множественные структуры?: Свидетельства многообразия концепций в индивидуальной когнитивной структуре. Международный журнал естественнонаучного образования 22 (4): 399–417, 2000c.
Google Scholar
К.С. Табер. В поисках оптимального уровня упрощения: пример учения о тепле и температуре. Физическое образование 35 (5), 320–325, 2000d.
Google Scholar
К.С. Табер. Уроки химии для университетов ?: Обзор конструктивистских идей. Университетское химическое образование , 4 (2): 26–35 2000e, доступно на http://chemistry.rsc.org/uchemed/uchemed.htm.
Google Scholar
К.С. Табер. Несоответствие между предполагаемыми предшествующими знаниями и представлениями учащегося: типология препятствий к обучению. Образовательные исследования 27 (2): 159–171, 2001a.
Google Scholar
К.С. Табер. Зыбучие пески: пример концептуального развития как конкуренции между альтернативными концепциями. Международный журнал естественнонаучного образования 23 (7): 731–753, 2001b.
Google Scholar
К.С. Табер. Построение структурных концепций химии: некоторые соображения из исследований в области образования. Исследования и практика химического образования в Европе 2 (2): 123–158, 2001c, доступно по адресу http: // www.uoi.gr/conf_sem/ cerapie /
Google Scholar
К.С. Табер. Заблуждения в химии: профилактика, диагностика и лечение? (2 тома). Лондон: Королевское химическое общество, 2002a.
Google Scholar
К.С. Табер. Концептуализация кванты — освещение основного состояния понимания студентами атомных орбиталей. Образование: исследования и практика в Европе Химия 3 (2): 145–158, 2002b.
Google Scholar
К.С. Табер. Составление кванты — исследование границ понимания студентами молекулярных орбиталей. Химическое образование: исследования и практика в Европе 3 (2), 159–173, 2002c.
Google Scholar
К.С. Табер. Медиация ментальных моделей металлов: признание приоритета предшествующего обучения учащегося. Естествознание (в печати).
К.С. Табер и Р. Колл. Химическая связь, глава 9. В: J.K. Гилберт (общий ред.), Химическое образование: научно-исследовательская практика . Kluwer Academic Publishers BV, в печати.
К.С. Табер и М. Уоттс. Тайная жизнь химической связи: студенческие антропоморфные и анимистические ссылки на связь. Международный журнал естественнонаучного образования 18 (5): 557–568, 1996.
Google Scholar
П.Тагард. Концептуальные революции . Princeton University Press, Oxford, 1992.
Google Scholar
G.C. Уотерстон. Переводчик Предисловие к книге Бачелар, Гастон, Философия Нет: Философия научного разума. Нью-Йорк: Orion Press, 1968.
.
Google Scholar
Д.М. Уоттс и Д. Бентли. Гуманизация и феминизация школьной науки: возрождение антропоморфного и анимистического мышления в конструктивистском научном образовании. Международный журнал естественнонаучного образования 16 (1): 83–97, 1994.
Google Scholar
Д.М. Уоттс и Дж. Гилберт. Загадки в школьной науке: представления студентов о словах, связанных с наукой. Исследования в области науки и технологического образования 1 (2): 161–171, 1983.
Google Scholar
М. Уоттс и К.С. Табер. Объяснительный гештальт сущности: представления студентов о «естественном» в физических явлениях. Международный журнал естественнонаучного образования 18 (8): 939–954, 1996.
Google Scholar
Т. Вайтман в сотрудничестве с П. Грином и П. Скоттом. Конструирование смысла и концептуальные изменения в обстановке классной комнаты: тематические исследования о мелкой природе материи . Лидс: Центр исследований в области естественных наук и математического образования — проект «Обучение детей в науке», 1986.
Google Scholar
Обучение детей младшего возраста атомно-молекулярной теории
Potvin, P., & Хасни, А. (2014b). Интерес, мотивация и отношение к науке и технологиям на уровнях K-12
: систематический обзор 12-летних исследований в области образования. Исследования в области естественнонаучного образования, 50 (1),
85–129.
Шварц, К. В., Райзер, Б. Дж., Дэвис, Э. А., Кеньон, Л., Ахер, А., Фортус, Д.,… Крайчик, Дж. (2009). Разработка последовательности обучения
для научного моделирования: обеспечение доступности и значимости научного моделирования для
учащихся.Журнал исследований в области преподавания естественных наук, 46 (6), 632–654.
Зиглер Р. С. (1996). Новые умы: процесс изменения мышления детей. Нью-Йорк: Oxford
University Press.
Зиглер Р. С. (1998). Детское мышление (3-е изд.). Река Верхнее Седл: зал Прентис.
Зиглер Р. С. (2000). Возрождение обучения детей. Развитие ребенка, 71 (1), 26–35. https: // doi.
орг / 10.1111 / 1467-8624.00115.
Зиглер Р. С. (2005).Детское обучение. Американский психолог, 60 (8), 769–778. https://doi.org/10.1037/0003-
066X.60.8.769.
Зиглер Р. С. (2006). Микрогенетический анализ обучения. В W. Damon, R. M. Lerner, D. Kuhn, & R. S. Siegler
(Eds.), Handbook of Children’s Psyology, Vol. 2: Познание, восприятие и язык (6-е изд., Стр. 464–510).
Хобокен: Вили.
Зиглер Р. С. (2007). Когнитивная изменчивость. Наука о развитии, 10 (1), 104–109. https: // doi.
org / 10.1111 / j.1467-7687.2007.00571.x.
Зорге, К. (2007). Что происходит? Взаимосвязь возраста и пола с отношением к науке от начальной до
средней школы. Педагог по естествознанию, 16 (2), 33–37.
Соуза Д. (2001). Как мозг учится. Таузенд-Оукс: Корвин.
Стейн, М., Ларраби, Т. Г., и Барман, К. Р. (2008). Исследование распространенных убеждений и заблуждений в физической
науке. Журнал элементарного научного образования, 20 (2), 1–11.
Тай, Р. Т., Лю, К. К., Мальтийский, А. В., и Фан, X. Т. (2006). Раннее планирование карьеры в науке. Наука,
312 (5777), 1143–1144.
Томсон, С. (2011). Проблемы австралийского образования. Исследования, разработки, 25 (2), 1–5.
Томсон, С., Вернерт, Н., Андервуд, К., и Николас, М. (2008). TIMSS 2007: более пристальный взгляд на
математики и естественных наук в Австралии. Камберуэлл: Австралийский совет по исследованиям в области образования.
Томсон, С., Де Бортоли, Л., и Бакли, С. (2013). PISA 2012: насколько Австралия оценивает. Camberwell:
Австралийский совет исследований в области образования.
Томсон, С., Вернерт, Н., О’Грейди, Э., и Родригес, С. (2016). TIMSS 2015: первый взгляд на результаты Австралии.
Camberwell: Австралийский совет образовательных исследований.
Треагуст, Д. Ф., Вон, М., Петерсен, Дж., И Винн, Г. (2015). Подготовка учителей естественных наук в Австралии: инициативы
и задачи по повышению качества преподавания.Журнал педагогического образования естественных наук, 26 (1), 81–98.
Титлер Р. (2009). Перспективы начального естественнонаучного образования: обзор, заказанный Шведским национальным агентством по образованию
, Мельбурн: DeakinUniversity.
Титлер Р. и Осборн Дж. (2012). Отношение и стремление студентов к науке. В Б. Дж. Фрейзере, К. Г. Тобине и
К. Дж. МакРобби (ред.), Второй международный справочник по естественнонаучному образованию (стр. 597–625). Дордрехт:
Springer.
Титлер Р. и Петерсон С. (2000). Деконструкция обучения в естественных науках — ответы детей младшего возраста на последовательность
в классе, посвященную испарению. Исследования в области естественнонаучного образования, 30 (4), 339–355.
Венвилл, Г., Ренни, Л., Хэнбери, К., и Лонгнекер, Н. (2013). Ученые размышляют о том, почему они выбрали
для изучения науки. Исследования в области естественно-научного образования, 43 (6), 2207–2233. https://doi.org/10.1007/s11165-013-9352-3.
Восняду С. (2002). Ментальные модели в концептуальном развитии.В Л. Маньяни и Н. Дж. Нерсесян (ред.),
Рассуждения, основанные на моделях (стр. 353–368). Бостон: Спрингер.
Восняду, С. (2012). Переосмысление классического подхода к концептуальным изменениям: предубеждения, заблуждения
и синтетические модели. В книге Б. Дж. Фрейзера, К. Г. Тобина и К. Дж. МакРобби (ред.), Второй международный справочник
по естественнонаучному образованию (стр. 119–130). Дордрехт: Спрингер.
Vo s n i a d ou, S. ( 2013 ). M o d e l b a s ed r e a s o n i n g и n d t e l e a r n i n g o f c o u n t er — i n t u i t iv e s c i e n c e c o n c e p t s.Infancia y
Aprendizaje, 36 (1), 5–33. https://doi.org/10.1174/021037013804826519.
Восниаду, С., Скопелити, И. (2014). Концептуальный переход от рамочной теории к стороне забора. Наука и
Образование, 23 (7), 1427–1445. https://doi.org/10.1007/s11191-013-9640-3.
Ваннелл Р. и Тобиас С. (2015). Улучшение математического и естественнонаучного образования в сельских районах Австралии: отчет о практике
. Австралийский и международный журнал сельского образования, 25 (2), 91.
Уиллингем, Д. Т. (2008). Спросите ученого-когнитивиста: что такое практика, соответствующая развитию? Американский
Педагог, 32 (2), 34–39.
Уайзер, М., и Смит, К. Л. (2008). Изучение и преподавание материи в классах K-8: когда следует вводить молекулярную теорию atomic-
. В S. Vosniadou (Ed.), Международный справочник по исследованиям концептуальных
изменений (стр. 205–239). Нью-Йорк: Рутледж.
Res Sci Educ
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
атомов, молекул и ионов | CPD
Молекулы — важнейшие строительные блоки жизни.Без молекул воды жизнь на Земле не существовала бы. Всем живым организмам необходимы белковые молекулы для структуры и функционирования. Поэтому понимание того, как атомы объединяются в молекулы, является ключом к пониманию происхождения жизни.
В вашем классе
Загрузите инструкции, сетку и карточки с подсказками для четырехстрочного воспроизведения атомов, молекул и ионов в формате MS Word или pdf.
Загрузите инструкции, сетку и карточки с подсказками для четырехстрочного воспроизведения атомов, молекул и ионов с веб-сайта Education in Chemistry: rsc.li / 2WayTn8
Что нужно знать студентам
Атомы, молекулы и ионы — все это примеры частиц, которые студенты могут встретить в 11–14 лет. Но эти термины часто неправильно используются в средствах массовой информации и в повседневном языке, что приводит к путанице учащихся всех возрастов в выборе правильного термина.
Студенты должны понимать, что:
- Частицы могут быть атомами , молекулами или ионами .
- Атомы — одиночные нейтральные частицы.
- Молекулы представляют собой нейтральные частицы, состоящие из двух или более атомов, связанных вместе.
- Ион — положительно или отрицательно заряженная частица.
Идеи для вашего класса
Идея о том, что мир состоит из крошечных частиц, является древней. Вы могли начать исследование атомов с идей Демократа (400 г. до н.э.), который считал, что вся материя во Вселенной состоит из крошечных неделимых твердых объектов.Он назвал эти объекты atoma или «неделимые единицы». В начале -х годов века Дальтон нашел доказательства, подтверждающие теорию Демократа, и предположил, что атомы представляют собой твердые сферы. Различные сферы составляли разные элементы.
Одна из ключевых проблем для студентов, изучающих атомы, заключается в том, что атомы малы. Действительно, очень маленький. Это затрудняет студентам концептуальное представление об атомах, поскольку их нельзя увидеть, потрогать или исследовать напрямую. Хорошей отправной точкой для знакомства с атомами и демонстрации их небольшого размера будет попросить учащихся разбить кусок графита (элемент углерода) на как можно больше мелких кусочков.Независимо от того, на сколько кусочков ученики разбивают графит, они никогда не получат ни одного атома углерода. Вы можете предложить ученикам с высшим образованием измерить размер отдельного атома, используя этот эксперимент из Практической физики.
Одна из ключевых проблем для студентов, изучающих атомы, заключается в том, что атомы малы. Действительно, очень маленький. Это затрудняет студентам концептуальное представление об атомах, поскольку их нельзя увидеть, потрогать или исследовать напрямую. Хорошей отправной точкой для знакомства с атомами и демонстрации их небольшого размера будет попросить учащихся разбить кусок графита (элемент углерода) на как можно больше мелких кусочков.Независимо от того, на сколько кусочков ученики разбивают графит, они никогда не получат ни одного атома углерода. Вы можете предложить ученикам с высшим образованием измерить размер отдельного атома, используя этот эксперимент из Практической физики (bit.ly/2Km5cgt).
Когда атомы объединяются, образуются молекулы . Для нескольких элементов, когда атомы этого элемента объединяются, образуется молекула этого элемента, например H 2 и O 2 . Когда объединяются атомы некоторых различных элементов, может образоваться молекула соединения, например H 2 O.В серии 11–14 «Как обучать элементам и соединениям» описываются различные стратегии обучения элементам и соединениям, а также распространенные заблуждения, которые могут иметь ученики.
Когда атомы объединяются, образуются молекулы . Для нескольких элементов, когда атомы этого элемента объединяются, образуется молекула этого элемента, например H 2 и O 2 . Когда объединяются атомы некоторых различных элементов, может образоваться молекула соединения, например H 2 O. Как учить элементы и соединения (rsc.li / 2W6MKut) в серии 11–14 описывает различные стратегии обучения элементам и соединениям, а также распространенные заблуждения, которые могут иметь ученики.
Диаграммы частиц могут использоваться, чтобы помочь учащимся визуализировать разницу между атомом, молекулой элемента и молекулой соединения. Фактически, даже Дальтон в 1800-х годах предложил серию диаграмм для представления элементов и соединений, известных в то время. Использование цвета помогает в дальнейшем различать типы атомов.Диаграммы Венна помогают учащимся организовать свое понимание различных типов частиц, как описано в разделе «Атомы, элементы, молекулы, соединения и смеси».
Диаграммы частиц могут использоваться, чтобы помочь учащимся визуализировать разницу между атомом, молекулой элемента и молекулой соединения. Фактически, даже Дальтон в 1800-х годах предложил серию диаграмм для представления элементов и соединений, известных в то время (рис. 1). Использование цвета помогает в дальнейшем различать типы атомов.Диаграммы Венна помогают учащимся организовать свое понимание различных типов частиц, как описано в разделе «Атомы, элементы, молекулы, соединения и смеси» (rsc.li/2wzLsxS).
Атом или молекула может потерять или получить электрон (ы) с образованием иона . На этом уровне учащимся нужно только знать, что ион — это положительно или отрицательно заряженная частица. Однако, возможно, на этом этапе стоит познакомить студентов с электроном. Когда атом / молекула получает отрицательно заряженный электрон (ы), образуется отрицательный ион.Когда атом / молекула теряет отрицательно заряженный электрон (ы), образуется положительный ион. Последний пункт — это то, с чем студенты часто сталкиваются позже в учебе. Введение электрона сейчас, до того, как студенты познакомятся с другими субатомными частицами, может помочь внедрить идею о том, что потеря электронов приводит к образованию положительно заряженного иона, и может помочь уменьшить путаницу в дальнейшем.
Из-за переплетения терминов атом, ион и молекула при описании различных частиц неудивительно, что студенты запутались.Использование игр и элемента соревнования может быть полезным для внесения некоторого разнообразия в необходимую студенческую практику. Одна из таких игр основана на классической игре Connect 4. Вы можете скачать инструкции, примерную сетку и игровые карточки ниже.
Распространенные заблуждения
По мере того, как учащиеся развивают свое понимание химической связи, они часто называют ионные соединения молекулами или ссылаются на межмолекулярные силы при объяснении свойств ионных соединений.Чтобы избежать этих неправильных представлений, важно ввести и подчеркнуть правильное использование терминов ион и молекула с самого начала в химических исследованиях студента.
Молекула — это нейтральная частица, состоящая из определенного количества атомов, связанных вместе. Частица вещества — это молекула, а не атомы, составляющие молекулу. Напротив, ионные соединения состоят из неопределенного числа ионов в фиксированном соотношении. Частица ионного вещества остается ионом.Использование практических моделей может помочь студентам понять эти сложные концепции — например, TIMSTAR MO84200 для молекул и Molymod MKO-127-27 для ионных структур. Вы можете дополнительно изучить использование химических моделей и их ограничения в разделе «Использование молекулярных моделей» и в серии «7 простых правил для преподавания естественных наук».
Молекула — это нейтральная частица, состоящая из определенного количества атомов, связанных вместе. Частица вещества — это молекула, а не атомы, составляющие молекулу.Напротив, ионные соединения состоят из неопределенного числа ионов в фиксированном соотношении. Частица ионного вещества остается ионом. Использование практических моделей может помочь студентам понять эти сложные концепции — например, TIMSTAR MO84200 для молекул и Molymod MKO-127-27 для ионных структур. Вы можете дополнительно изучить использование химических моделей и их ограничения в разделе «Использование молекулярных моделей» (rsc.li/2wAsOpA) и в серии «7 простых правил для преподавания естественных наук» (rsc.li/2XmwHKr).
Другие заблуждения, которые могут быть у учащихся, обсуждаются в книге За пределами видимости: Заблуждения учащихся об основных химических идеях (rsc.li / 2WBsd5L), в том числе то, что атомы имеют общие свойства объемного материала, а молекулы имеют разные свойства в разных состояниях.
Переход к 14–16
В 14–16 учеников знакомят с субатомными частицами и тем, как они определяют природу атомов и ионов. Затем студенты переходят к изучению разницы между природой сил, существующих между атомами, молекулами и ионами, которые они используют для объяснения физических свойств ионных и ковалентных соединений.
Ресурс «Почему атомы образуют ионы» позволяет учащимся оценить их понимание атомов, ионов и ионных соединений и позволяет учителю выявить любые заблуждения.
Ресурс «Почему атомы образуют ионы» (rsc.li/2Kptsyq) позволяет учащимся оценить их понимание атомов, ионов и ионных соединений и позволяет учителю выявить любые заблуждения.
Очков на вынос
- Частицы могут быть атомами, молекулами или ионами.
- Термин «молекула» часто используется неправильно для обозначения любого типа химического соединения.Молекула — это нейтральная частица, состоящая из двух или более атомов, связанных вместе.
- Будьте осторожны со своим родным языком, особенно когда говорите о соединениях, образующихся в ходе химических реакций. Сделайте различие между каждым типом частиц явным. Дайте учащимся возможность систематизировать свое понимание различных типов частиц с помощью диаграмм Венна.
- Хорошее понимание различных типов частиц поможет студентам, когда они изучают структуру и связь в возрасте 14–16 лет.
Физические атомы Модели атомов в наборе состоят из пластиковых сфер, которые соединяются с помощью магнитов: металлические наконечники на концах резиновых рычагов (прозрачные для ионных связей, белые для ковалентных связей) представляют собой свободные электроны от этого атома, что упрощает работу электронов. дети, чтобы быстро визуализировать.Плоские магнитные узлы на атомах показывают, сколько электронов может принять этот атом. Магнитная система дает четкое представление о том, как работает связывание: энергия высвобождается для образования связей, а энергия требуется для разрыва связей. Дети испытывают легкость соединения атомов (образование связей) и усилия по разъединению атомов (разрыв связей) с помощью магнитных соединителей. Атомы различаются по размеру в зависимости от атомной массы, в то время как гибкость резиновых рукавов демонстрирует, что связи не жесткие. На каждом атоме напечатан символ элемента, а физические модели в Happy Atoms позволяют детям визуализировать одинарные, двойные и тройные связи — то, что вы не сможете сделать без использования мелких деталей в системе моделирования шариком и палкой! | Приложение Приложение Happy Atoms использует камеру на вашем смартфоне или планшете (продается отдельно) для сканирования созданной молекулы и анализа ее на основе размера, формы и маркировки каждого атома, а также относительного положения каждого атома относительно друг друга, чтобы определить идентичность молекулы.После обнаружения молекулы приложение представляет информацию о ней: ее состав, систематическое название, использование, свойства, структуру и многое другое. Приложение распознает до 10 000 молекул и предоставляет подробную информацию о 150 молекулах и общую информацию об остальных. На карте World of Molecules хранятся детские открытия, а персонажи приложения — Харпер и Анди — сопровождают детей в их химическом приключении, подбадривая их и прося помощи в их исследованиях.Эта цифровая платформа предоставляет детям игровую среду для изучения химии. Требуется планшет или смартфон под управлением iOS 8 (или новее) или Android 4.4 (или новее, с 1 ГБ ОЗУ, двухъядерным процессором и камерой), в комплект не входит. | Что внутри Happy Atoms: вводный набор включает 17 моделей атомов, которые представляют 6 различных элементов: 8 атомов водорода, 3 атома углерода, 2 атома азота, 2 атома кислорода, 1 атом натрия и 1 атом хлора.Шесть элементов, представленных в этом наборе, являются одними из наиболее распространенных и важных атомов, о которых учащийся должен узнать, когда они создают основу для изучения химии. В набор также входит приложение Happy Atoms (бесплатно для загрузки в App Store, из Google Play или в магазине Kindle), плакат с периодической таблицей, который можно использовать как коврик для сканирования, и руководство по быстрому запуску, которое помогает детям использовать Happy Atoms. прямо сейчас, предлагая некоторые начальные эксперименты и рекомендации, чтобы познакомить их с системой Happy Atoms. |
Атомы и молекулы Научные станции 5-го класса
Эти научные станции по атомам и молекулам включают восемь различных научных станций, где студенты углубляют свое понимание атомов и молекул, в том числе структуры и свойств материи. Основное внимание уделяется научному стандарту нового поколения для пятого класса 5-PS1-1.
Что входит в научные станции для пятого класса
На этих научных станциях учащиеся изучают атомы и молекулы, материю и Периодическую таблицу.Студенты моделируют атом, исследуют растворимые растворы, сортируют молекулы, элементы и многое другое!
Научные станции содержат интересные материалы для пятиклассников с новыми словами и концепциями в простых в использовании интерактивных станциях. Они созданы, чтобы помочь учащимся понять, как атомы и молекулы существуют в окружающей нас материи. Студенты также узнают о решениях и Периодической таблице.
Стандарты NGSS для 5-PS1-1
Научные стандарты нового поколения написаны как «трехмерные.«Три измерения: ожидаемые результаты работы , основная дисциплинарная идея и научные и инженерные практики / пересекающиеся концепции .
Группа научных станций по атомам и молекулам занимается следующими стандартами:
- Ожидаемые характеристики 5-PS1-1. Разработайте модель, описывающую, что материя состоит из частиц, которые слишком малы, чтобы их можно было увидеть.
- Основная идея дисциплины 5-PS1.A: Структура и свойства материи — учащиеся понимают, как существуют частицы, которые слишком малы, чтобы их можно было увидеть, и которые можно обнаружить различными способами.
- Наука и инженерная практика : Разработайте модель для описания явлений. (5-PS1-1)
- Общие концепции : Масштаб, пропорции и количество: Природные объекты существуют от очень маленьких до безмерно больших. (5-PS1-1)
Плакаты с большими идеями с атомами и молекулами
Плакаты с большими идеями есть на всех наших научных станциях. Эти плакаты сосредоточены на ключевых деталях. Они станут отличным украшением вашей научной стены. Только НАБОР из всех станций «Атомы и молекулы» поставляется с плакатами с большой идеей.
Словарные карточки
Включены два набора словарных карточек. В одном наборе есть только слово и определение. Другой набор включает изображение.
Эти словарные карточки также можно использовать в качестве девятого центра, где учащиеся сопоставляют слово, картинку и определение. Только НАБОР из всех станций «Атомы и молекулы» поставляется со словарными карточками.
Дифференцированные ответы для каждой научной станции
Как и все научные станции, научные станции по атомам и молекулам имеют различные способы взаимодействия учащихся со станцией.Каждая станция включает пять различных способов реагирования на опыт, полученный на станции:
- вопросы с краткими ответами
- вопросы с заполнением пустых полей без банка слов
- вопросы с заполнением пустых полей с банком слов
- карточки задач с короткими ответами
- карточки задач с множественным выбором
Все варианты похожи друг на друга, но требуют разного уровня независимости. Заполнение бланка является самым простым и идеально подходит для ваших учеников, которым сложно читать.Краткий ответ является наиболее сложным, так как он требует от студентов построения собственных ответов без особой поддержки.
Выберите формат, который лучше всего подходит для вашего класса и учащихся. Студентам также рекомендуется использовать свои карточки с заданиями для научных журналов. Ключи ответов включены.
Некоторые задания также включают в себя лист действий или рабочий лист в дополнение к дифференцированным ответам. Этот рабочий лист представляет собой «работу» станции, в то время как дифференцированные ответы требуют от студентов широкого размышления о теме и концепции.
Отрывки для чтения
Все станции, кроме станций Watch и Play, включают отрывки для чтения. Большинство отрывков для чтения необязательны, но они укрепляют базовые знания учащихся и закрепляют ключевые концепции.
Отрывки для чтения бывают двух форматов. Вы увидите версии всех этих форматов на фотографиях ниже. Обе версии имеют одинаковый текст, но разные макеты.
- На всю страницу с розовой рамкой
- Две колонки без рамки
Компоненты Google Classroom
Все наши научные станции пятого класса поставляются с компонентами, легко интегрируемыми с Google Classroom.Google Формы и Google Slides включены для большинства станций.
- Форма Google ™ ️ с отрывком для чтения и дифференцированными вопросами доступна для станций «Наблюдать», «Исследовать», «Диаграмма», «Читать», «Моделировать», «Изучать» и «Сортировать».
- Google Slides ™ ️ с инструкциями и рабочими листами доступны для исследования, построения диаграмм, модели, исследования, сортировки.
Для большинства практических действий по-прежнему требуются физические компоненты, но мы предоставили инструкции и листы записей в Google Slides. .
Посмотреть видео об атомах и молекулах
Станция WATCH включает два видео. Учащиеся смотрят видео, а затем отвечают на вопросы о том, что они узнали в видео. В каждом видео есть дифференцированные вопросы, а также форма Google со ссылкой на видео и вопросами. Станция WATCH a Video идеально подходит для дистанционного обучения.
Играть в игру
Станция PLAY в 5-м классе отличается от других наших классов. Он не содержит видеоигр. Хотя игры были увлекательными, мы обнаружили, что технологии препятствуют обучению.
Вместо этого мы создали настольную игру, поиск слов и кроссворд. В настольной игре есть карточки с вопросами и игровой лист. Учащиеся перемещаются по настольной игре, отвечая на вопросы.
Кроссворды и головоломки для поиска слов включают словарные слова и понятия из этого модуля. И кроссворд, и головоломка для поиска слов доступны в печатном и цифровом форматах. Цифровой формат обеспечивает немедленную обратную связь.
Исследовать свойства материи
На этой станции исследования материи
студенты читают о материи и проводят расследование, чтобы определить, состоят ли воздух и другие невидимые нами предметы из материи.Учащиеся взвешивают предметы до и после изменения, чтобы увидеть, изменилась ли масса.
Ниже приведено изображение отрывка для чтения и карточки с короткими ответами с ответами учащихся в научном журнале.
Диаграмма периодической таблицы
На этой диаграмме станция
, студенты работают с Периодической таблицей. Им дают копию Периодической таблицы элементов и раскрашивают так, чтобы она выглядела как предоставленный образец. После раскраски ученики разрезают головоломку и снова складывают ее.
Ниже приводится отрывок для чтения и краткие ответы на вопросы для схемы станции.
Читайте о Matter Everywhere
На этой станции чтения
, студенты читают о материи, атомах и молекулах. Вы можете увидеть отрывок для чтения ниже.
Как и многие научные станции, отрывок для чтения включает в себя дифференцированные ответы. Станция Read отлично подходит для дистанционного обучения. Он включает ссылку на форму Google с отрывком для чтения и дифференцированными ответами.
Модель атома
Это построение атомной станции
вкусный! На этой станции студенты строят атом, используя M&M.Также включены инструкции по использованию помпонов, если вам нужна непищевая версия упражнения.
В этом упражнении учащиеся моделируют несколько различных атомов и записывают количество протонов и электронов. Они также рисуют атом на своем листе для записей.
Перед построением атома учащиеся читают о компонентах атомов, чтобы получить базовые знания. После задания студенты могут ответить на вопросы на одной из прилагаемых рабочих листов или в своих научных журналах.
Изучите решения
В научной станции Explore
студенты исследуют, что происходит, когда сахар становится частью раствора и когда он отделяется от раствора.
Для этого эксперимента требуется несколько дней, в ходе которого учащиеся исследуют, как раствор изменяется после нагревания и испарения.
Как и все наши научные станции, эта поставляется с отрывком для чтения, заданием, листами для записей и дифференцированными вопросами.
Сортировка молекул, элементов или обоих
В этой научной станции «Сортировка молекул и элементов»
, студенты читают об атомах и молекулах. Затем они сортируют материал по трем категориям: элемент, молекула или и то, и другое.
Сортировка поставляется с цветными картами, которые вы видите ниже. Он также поставляется с черно-белым листом вырезания и вставки, в дополнение к отрывку для чтения и дифференцированным вопросам.
Затем студенты отвечают на вопросы о сортировке в своих научных журналах, на прилагаемых листах или в Google From ™ ️.
Как приобрести станции по изучению атомов и молекул пятого класса
Станции по изучению атомов и молекул доступны в системе «Учителя платят учителям».
Другие научные станции 5-х классов
Мы разрабатываем дополнительные научные станции 5-х классов. Вот что мы сделали на данный момент.
Физические науки
Сохраните это на Pinterest!
Возможно, вас заинтересует. . .
.

 Такой настрой сохранялся во мне все время, по мере усложнения материала. К концу обучения я могла решать очень сложные задачи. Знания, которые она смогла вложить в мою голову, помогли мне поступить в (тогда еще Ленинградский) медицинский институт имени академика Павлова.
Такой настрой сохранялся во мне все время, по мере усложнения материала. К концу обучения я могла решать очень сложные задачи. Знания, которые она смогла вложить в мою голову, помогли мне поступить в (тогда еще Ленинградский) медицинский институт имени академика Павлова. 
