Содержание
Кристаллические решетки атомные — Справочник химика 21
Атомные решетки. В кристаллических решетках атомного типа каждый узел пространственной решетки представлен нейтральным атомом. Все атомы размещены на одинаковом расстоянии друг от друга. Число близлежащих атомов, окружающих калмаксимальной валентности данного элемента. Атомную структуру имеют алмаз, графит, твердый кремний [51]п, твердый бор [В]п, карборунд 51С, германий и др. На рис. 18 изображены атомные кристаллические решетки алмаза и графита. Как видно из рис 18, а, атомы углерода в алмазе располагаются по узлам двух кубических решеток, вставленных одна в другую. Каждый атом углерода непосредственно соединен с четырьмя другими на довольно близком одинаковом расстоянии. Расстояние между центрами соседних атомов углерода 1,54 А, что обусловливает большую плотность и наибольшую твердость кристалла алмаза, отсутствие свобод- [c.73]
Укажите, какая кристаллическая решетка (атомная, молекулярная, ионная, металлическая) реализуется в следующих твердых веществах [c. 58]
58]
Чем отличаются вещества с кристаллической решеткой молекулярного типа от веществ с кристаллической решеткой атомного типа (примеры) [c.51]
Элементарные металлоиды — вещества, построенные из атомов промежуточных элементов. Характеризуются прочными кристаллическими решетками атомного типа (преимущественно нелетучи и тугоплавки) и наличием полупроводниковых свойств. [c.36]
Между различными классами элементарных веществ нет резких границ, и многие элементарные вещества обладают промежуточными свойствами. Так, например, узлы кристаллической решетки металла галлия образованы не положительно заряженными ионами, а двухатомными молекулами низкотемпературное видоизменение олова характеризуется кристаллической решеткой атомного типа и наличием полупроводниковых свойств эти свойства обнаруживаются в твердом состоянии у таких элементарных окислителей, как селен и астат белое видоизменение металлоида фосфора характеризуется летучестью, и непрочностью кристаллической решетки молекулярного типа элементарные металлоиды висмут и полоний обладают металлической электропроводностью. Таким образом, границы между элементарными металлами и металлоидами и между элементарными металлоидами и окислителями до известной степени условны. [c.37]
Таким образом, границы между элементарными металлами и металлоидами и между элементарными металлоидами и окислителями до известной степени условны. [c.37]
Кремний. В большинстве соединений кремний находится в степени окисления ( + IV), значительно реже ( — IV). В свободном виде кремний Si-темно-серое кристаллическое вещество, очень твердое, хрупкое и тугоплавкое. Кристаллическая решетка-атомная, связи Si—Si очень прочные, химическая активность кремния мала. В особых условиях можно получить так называемый аморфный кремний в виде белого порошка, его реакционная способность выше. [c.152]
Ковалентные связи существуют и в атомных кристаллических решетках. Атомные решетки образуются у относительно немногих веществ в твердом состоянии. Типичным примером атомной решетки служит алмаз—одна из форм существования в свободном виде элемента углерода (рис. 23). В атомной решетке алмаза каждый атом углерода связан четырьмя ковалентными связями (см.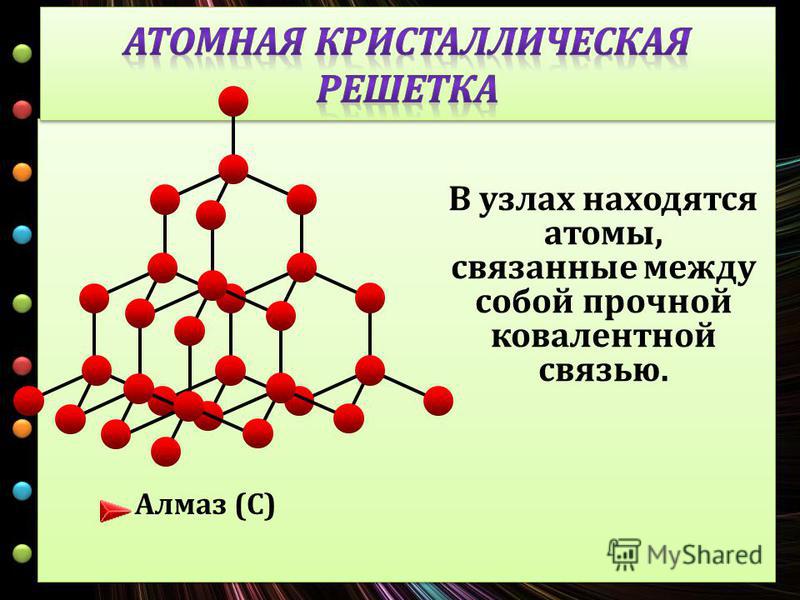 белые кружки на рисунке), т. е. он образует четыре общих электронных пары с четырьмя соседними атомами углерода. Поэтому алмаз н все другие вещества, имеющие атомную кристаллическую решетку, например 51С и Ввысокими температурами плавления и кипения. Такие вещества часто объединяют групповым названием алмазоподобные еещества. [c.114]
белые кружки на рисунке), т. е. он образует четыре общих электронных пары с четырьмя соседними атомами углерода. Поэтому алмаз н все другие вещества, имеющие атомную кристаллическую решетку, например 51С и Ввысокими температурами плавления и кипения. Такие вещества часто объединяют групповым названием алмазоподобные еещества. [c.114]
Для каждого из перечисленных ниже веществ укажите тип кристаллической решетки (атомная, [c.30]
Прочность обычных поликристаллических материалов (порошков, покрытий, сплавов и т. п.) всегда значительно ниже теоретической из-за наличия дефектов кристаллической решетки атомных масштабов (дислокаций), а также трешин, включений, ступенек на поверхности и т. д. [412, 425, 426]. [c.229]
Рассмотрим прохождение через кристалл пучка рентгеновских лучей с длиной волны Л (рис. 1.71). Ввиду значительной проникающей способности рентгеновского излучения большая часть его проходит через кристалл. Некоторая доля излучения отражается от плоскостей, в которых расположены атомы, составляющие кристаллическую решетку (атомные плоскости рь Pi, Рз, Ра). Отраженные лучи интерферируют друг с другом, в результате чего происходит их взаимное усиление или погашение. Очевидно, что результат интерференции зависит от разности хода O лучей, отраженных от соседних параллельных плоскостей. Усиление излучения происходит в том случае, когда 8 равно целому числу длин волн, тогда отраженные волны находятся в одинаковой фазе. Как видно из рис. 1.71, луч Si, [c.151]
Некоторая доля излучения отражается от плоскостей, в которых расположены атомы, составляющие кристаллическую решетку (атомные плоскости рь Pi, Рз, Ра). Отраженные лучи интерферируют друг с другом, в результате чего происходит их взаимное усиление или погашение. Очевидно, что результат интерференции зависит от разности хода O лучей, отраженных от соседних параллельных плоскостей. Усиление излучения происходит в том случае, когда 8 равно целому числу длин волн, тогда отраженные волны находятся в одинаковой фазе. Как видно из рис. 1.71, луч Si, [c.151]
Синтез углеводородов относится к реакциям спаривания и распаривания электронов. Здесь пригодны катализаторы, образующие связи между атомом поверхности и реагирующими молекулами. Учитывая, что твердые вещества имеют кристаллические решетки атомные или молекулярные, металлические или ионные, можно установить, какие из них будут работать под давлением. [c.99]
В сплавах — фаза, представляющая собой нреим.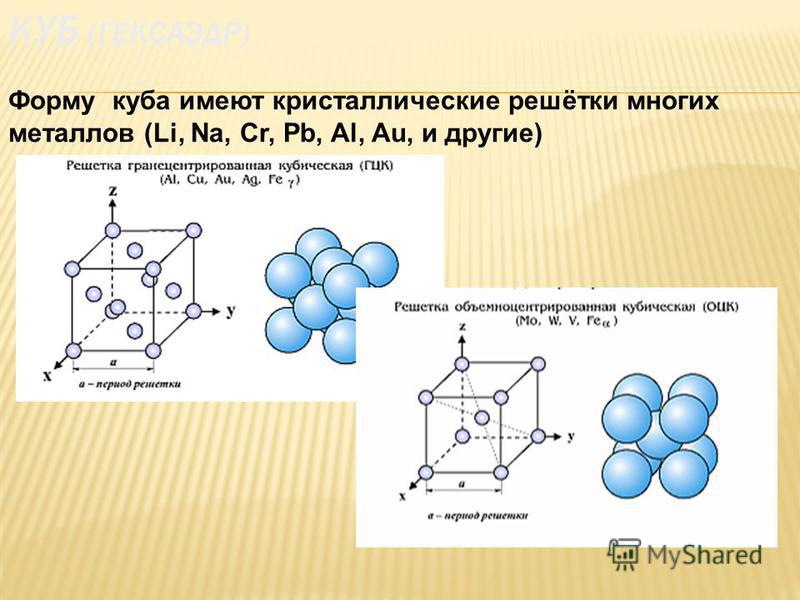 низкотемпературный твердый раствор. В сплавах на основе мономорфных хим. элементов (нанр., в сплаве медь — цинк) А.-ф. образуется из расплава. В сплавах на основе полиморфных хим. элементов (напр., в сплаве марганец — кремний) А.-ф. образуется преим. при понижении т-ры из бета-фазы (рис.), за исключением сплавов на основе железа, где образуется из гамма-фазы (см. Диаграмма состояния железо — углерод). Концентрационный интервал существования А.-ф. зависит гл. обр. от электронной структуры, тина кристаллической решетки, атомного диаметра, валентности и т-ры плавления исходных компонентов. Если компоненты обладают близкими физико-хим. св-вами и имеют идентичную кристаллическую структуру. [c.53]
низкотемпературный твердый раствор. В сплавах на основе мономорфных хим. элементов (нанр., в сплаве медь — цинк) А.-ф. образуется из расплава. В сплавах на основе полиморфных хим. элементов (напр., в сплаве марганец — кремний) А.-ф. образуется преим. при понижении т-ры из бета-фазы (рис.), за исключением сплавов на основе железа, где образуется из гамма-фазы (см. Диаграмма состояния железо — углерод). Концентрационный интервал существования А.-ф. зависит гл. обр. от электронной структуры, тина кристаллической решетки, атомного диаметра, валентности и т-ры плавления исходных компонентов. Если компоненты обладают близкими физико-хим. св-вами и имеют идентичную кристаллическую структуру. [c.53]
Ответ. 1) Алмаз и графит имеют одинаковый состав — Соо, но отличаются по свойствам алмаз очень тверд, поскольку имеет кристаллическую решетку атомного типа графит имеет слоистую структуру, поэтому он значительно мягче алмаза. 2) Оксиды кремния и углерода имеют похожие формулы ЗЮг и СО2.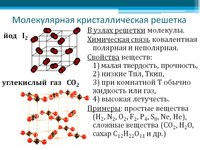 Первое вещество очень тугоплавко, поскольку имеет кристаллическую решетку типа алмаза, а второе вещество при обычных условиях — газ, поскольку в твердом состоянии оксид углерода имеет молекулярную решетку со слабым взаимодействием между молекулами. [c.6]
Первое вещество очень тугоплавко, поскольку имеет кристаллическую решетку типа алмаза, а второе вещество при обычных условиях — газ, поскольку в твердом состоянии оксид углерода имеет молекулярную решетку со слабым взаимодействием между молекулами. [c.6]
Вещества, построенные из атомов промежуточных элементов, — элементарные металлоиды (бор, углерод, кремний, фосфор, германий, мышьяк, сурьма, теллур). Характеризуются проч-ггымн кристаллическими решетками атомного типа (преимущественно нелетучи и тугоплавки) и наличием полупроводниковых свойств. [c.111]
Физические и химические свойства. Хотя олово и свинец и представляют собой металлы, в свободном состоянии типичные для металлов свойства выражены у них довольно слабо. Кристаллическое олово существует в разных полиморфных видоизменениях. Низкотемпературное видоизменение, называемое серым оловом, характеризуется кристаллической решеткой атомного, т. е. неметаллического, 1нпа. Видоизменение, называемое белым оловом, устойчивое п])н телятературе выше 13,2°С, характеризуется кристаллической решеткой металлического типа. Видоизменения олова сильно отличаются друг от друга по плотности — серое олово имеет значительно меньшую плотность (5,75 г/см ). В связи с этим при охлаждении обычное белое олово переходит в серое, наблюдается значительное увеличение объема и разрушение оловянных изделий (наиболее ннтенсивгюе нри сильных морозах ниже — 30°С). Значения физических свойств олова и свинца ириведены в табл, 41. [c.340]
Видоизменения олова сильно отличаются друг от друга по плотности — серое олово имеет значительно меньшую плотность (5,75 г/см ). В связи с этим при охлаждении обычное белое олово переходит в серое, наблюдается значительное увеличение объема и разрушение оловянных изделий (наиболее ннтенсивгюе нри сильных морозах ниже — 30°С). Значения физических свойств олова и свинца ириведены в табл, 41. [c.340]
Рассматривая ответы учащихся на вторые вопросы обоих вариантов задапай, подчеркивают такие черты сходства в строении алмаза и графита, как наличие в их кристаллических решетках атомных связей. У алмаза кристаллическая решетка типично атомная, тетраэдрическая, у графита между атомами углерода, расположенными в одной плоскости, атомные связи, а между атомами углерода разных плоскостей связи, похожие на металлическую. Электроны, осуществляющие такие связи, находятся в общем пользовании не двух атомов, а всех атомов данного слоя. Таким отличием в строении алмаза и графита объясняется отличие в свойствах этих двух веществ.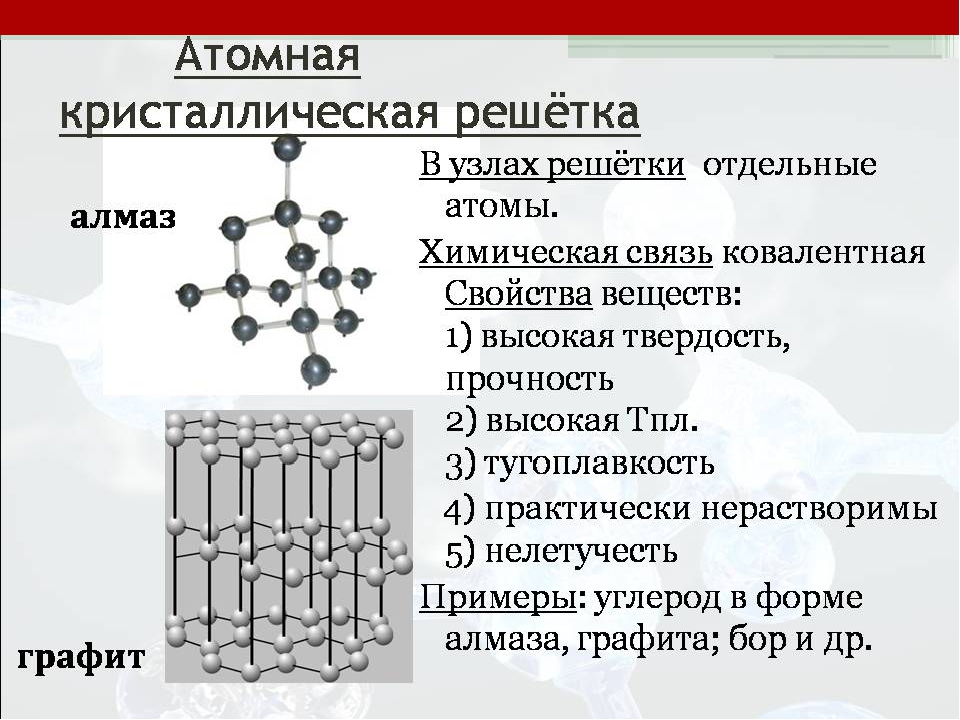 Подобно металлам, графит имеет серый цвет, обладает слабым металлическим блеском, электрической проводимостью. Однако графит отличается от алмаза и такими свойствами, как мягкость, способность отщеплять с поверхности плоские чешуйки, разделяться на атомные слои. Это свойство графита не может бьпь объяснено металлическим характером связей между атомными слоями, так как металлические связи весьма прочны. Исследование внутренней структуры графита показало, что слои атомов в нем удалены друг от друга на значительно большее расстояние, чем атомы в одном слое. Можно считать, что в отличие [c.133]
Подобно металлам, графит имеет серый цвет, обладает слабым металлическим блеском, электрической проводимостью. Однако графит отличается от алмаза и такими свойствами, как мягкость, способность отщеплять с поверхности плоские чешуйки, разделяться на атомные слои. Это свойство графита не может бьпь объяснено металлическим характером связей между атомными слоями, так как металлические связи весьма прочны. Исследование внутренней структуры графита показало, что слои атомов в нем удалены друг от друга на значительно большее расстояние, чем атомы в одном слое. Можно считать, что в отличие [c.133]
виды, свойства, определение простым языком
Определение кристаллической решетки
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном.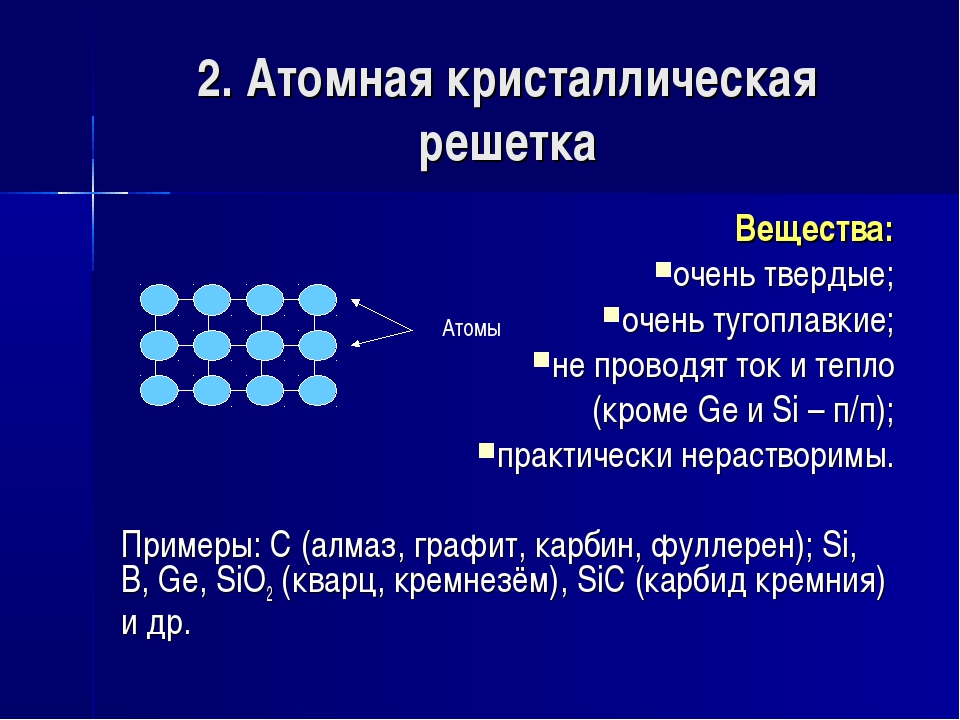 Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку.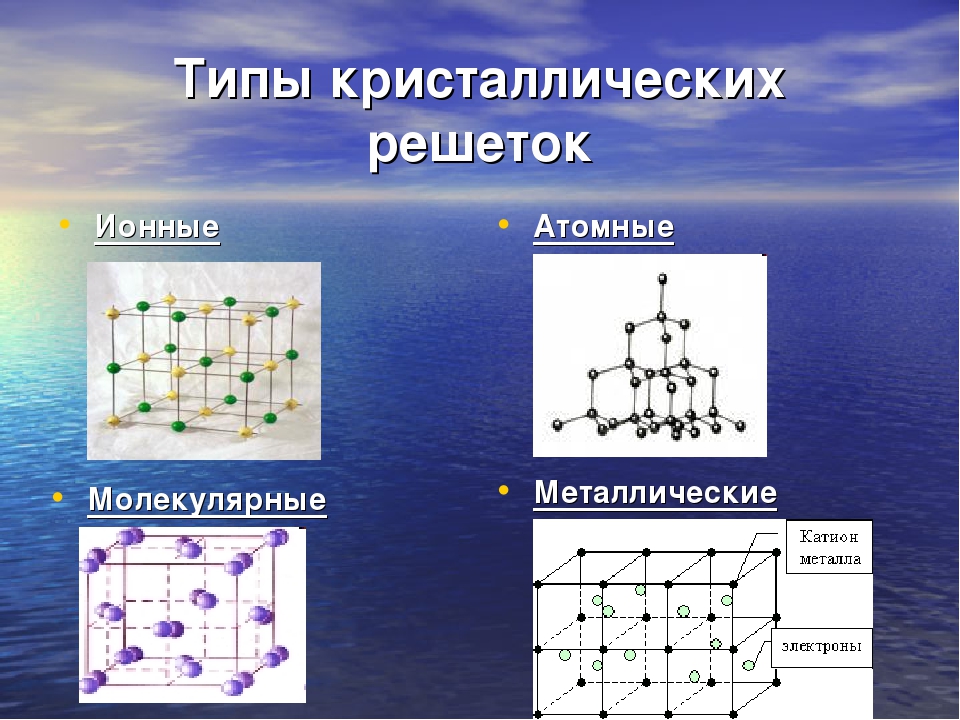 А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул.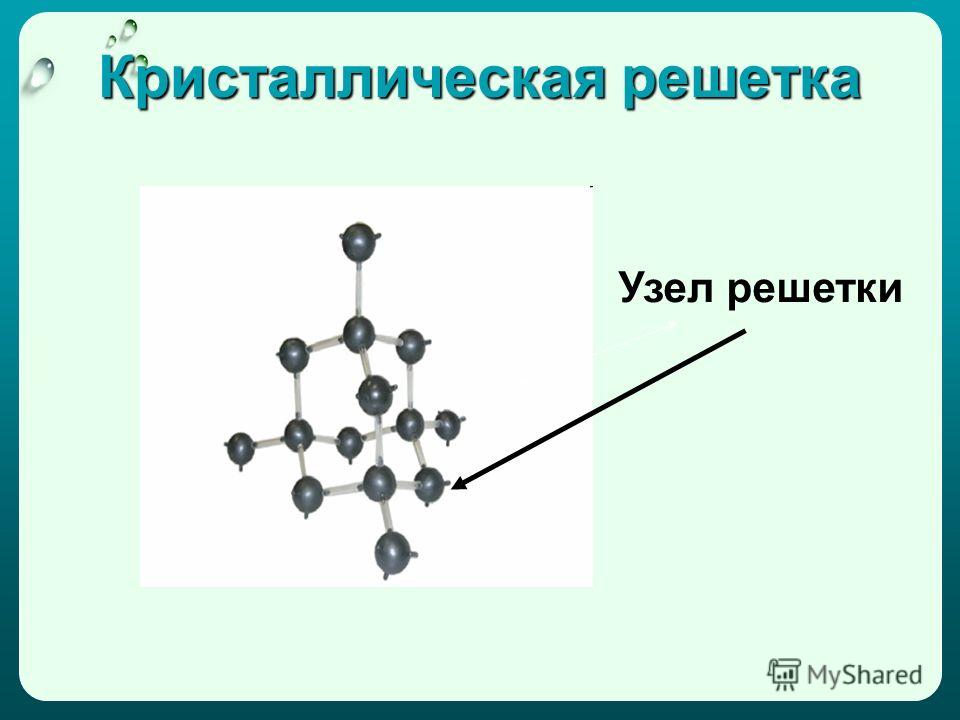 Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.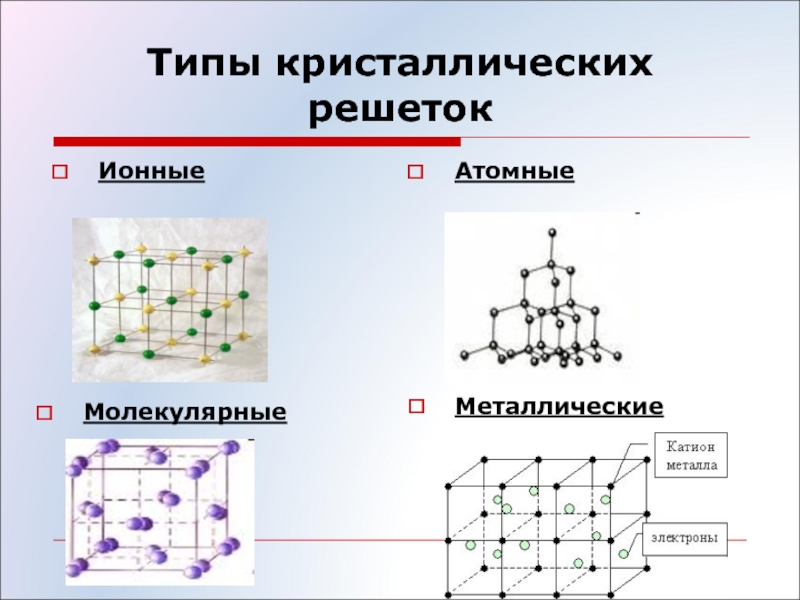
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Раскрыта загадка аморфности стекла — Газета.Ru
Уникальные свойства стекла, которое не является ни твёрдым телом, ни очень вязкой жидкостью, получили своё объяснение. Атомы твердеющего стекла просто не успевают занять свои «правильные» позиции в кристалле, запирая друг друга в 20-гранные группировки.
Стекло известно человечеству уже не первое тысячелетие. Сначала люди научились добывать и использовать природные стекла, к которым относится, например, янтарь и горный хрусталь вулканического происхождения. Затем древние мастера научились и самостоятельно получать силикатные стекла сплавлением смеси кварцевого песка (SiO2), соды (Na2CO3) и извести (CaO). В результате получается химический комплекс с составом Na2OCaO6SiO2.
Сначала люди научились добывать и использовать природные стекла, к которым относится, например, янтарь и горный хрусталь вулканического происхождения. Затем древние мастера научились и самостоятельно получать силикатные стекла сплавлением смеси кварцевого песка (SiO2), соды (Na2CO3) и извести (CaO). В результате получается химический комплекс с составом Na2OCaO6SiO2.
Процесс получения различных стекол в течение тысяч лет был скорее искусством, доступным отдельным мастерам, однако в новое время появилась единая методология получения различных видов стекол, существующая уже несколько столетий.
Тем не менее, как устроено стекло и в чём причина его уникальных механических свойств, учёные до сих пор не понимают.
Жаркие дебаты, касающиеся природы и механизма возникновения стеклообразного состояния твердых тел, продолжаются и поныне.
Школьная программа классифицирует стекло как твердое вещество в аморфном состоянии, но, чем стеклообразное состояние отличается от жидкости, пояснить может далеко не каждый кандидат химических наук. Связано это, прежде всего, с тем, что до сих пор никому не удалось экспериментально показать, какую же структуру имеет стекло на самом деле.
Связано это, прежде всего, с тем, что до сих пор никому не удалось экспериментально показать, какую же структуру имеет стекло на самом деле.
В отличие от кристаллических твердых тел, где все атомы упакованы в упорядоченную кристаллическую решетку, в стеклообразном состоянии такой дальний порядок расположения атомов отсутствует. С другой стороны, нельзя стекло назвать и сверхвязкой жидкостью, обладающей лишь ближним порядком — взаимным упорядочением только соседних молекул и атомов. Дифракционные методы исследования, успешно применяемые для исследования структуры твердых тел, показали, что для стекол характерно наличие так называемого среднего порядка упорядочения атомов — на расстояниях, лишь немногим превышающих межатомные.
Все эти работы позволили выяснить, что в стекле каждая такая локальная группировка атомов содержит одну-две ячейки. Они подобны ячейкам кристаллической решетки, однако искажены друг относительно друга. Кроме того, многие специалисты склоняются к тому, что многокомпонентные стекла — такие, например, как щелочноборатные стекла M2O / B2O3 (М — атом щелочного металла), — являются химически неоднородными и содержат в своей структуре несколько различных типов группировок, различающихся взаимным расположением и количеством задействованных в них атомов. К сожалению, отсутствие дальнего порядка в структуре стекол делает невозможным их тщательное исследование с помощью дифракционных методов анализа, а потому уже почти полвека методы математического моделирования остаются единственным оружием ученых в этой области.
К сожалению, отсутствие дальнего порядка в структуре стекол делает невозможным их тщательное исследование с помощью дифракционных методов анализа, а потому уже почти полвека методы математического моделирования остаются единственным оружием ученых в этой области.
Кристаллическая решетка
Существует огромное количество кристаллических структур. Их объединяет главное свойство кристаллического состояния вещества – закономерное положение атомов в кристаллической рештке. Одно и то же вещество может кристаллизоваться…
Читать дальше
С термодинамических позиций стекло — не что иное, как метастабильная фаза твердого вещества, сильно затянувшийся процесс застывания. При переходе веществ из жидкого состояния в твердое, кристаллическое, происходит понижение внутренней энергии системы, сопровождающееся значительным выделением тепла.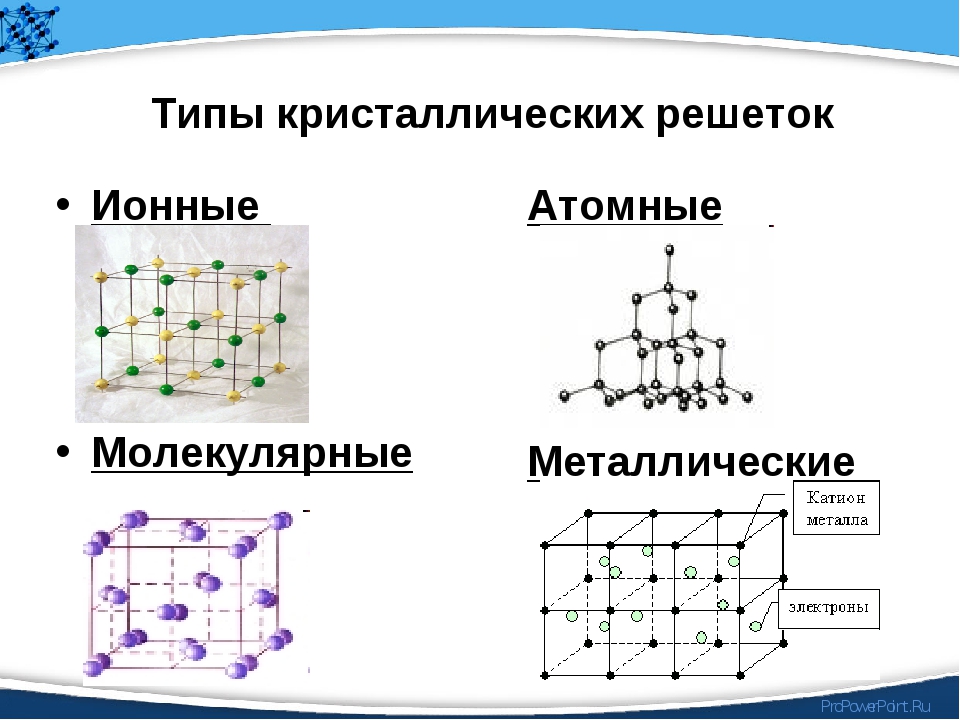 Образовывать упорядоченную кристаллическую решетку «выгодно» с энергетических позиций, и именно она — минимум внутренней энергии в кристаллическом состоянии — обуславливает существование большинства твердых тел.
Образовывать упорядоченную кристаллическую решетку «выгодно» с энергетических позиций, и именно она — минимум внутренней энергии в кристаллическом состоянии — обуславливает существование большинства твердых тел.
При кристаллизации стекла этот минимум не достигается — атомы в структуре вещества не успевают занять свои кристаллографические позиции.
Однако физические свойства материала — его прочность и стабильность во времени — позволили многим ученым заключить, что структура стекла поддерживается неким локальным минимумом внутренней энергии этого материала, достигаемым еще до формирования кристаллической структуры.
Иначе говоря, атомы в стекле отказываются даже очень медленно сползаться к своим кристаллографическим позициям, как это можно было бы предположить, рассматривая стекло как просто переохлажденную и очень вязкую жидкость. На деле они просто оказываются «заперты» в тех положениях, где оказались при охлаждении из исходного расплава. Их дальнейшее смещение к «настоящему» минимуму энергии потребовало бы перехода через энергетический «перевал», а на такой переход энергию брать неоткуда.
close
100%
Ещё полвека назад сразу несколько теоретиков, включая бристольского профессора физики Чарльза Фрэнка, предположили, что запирание атомов в структуре стекла происходит из-за формирования ими взаимопроникающих икосаэдрических группировок — 20-гранных объёмных фигур с пятикратной симметрией. К сожалению, отсутствие прямых методов исследования до сих пор не позволяло подтвердить эти выводы экспериментально.
Теперь сотрудникам того же Бристольского университета под руководством Падди Рояла при поддержке коллег из Японии и Австралии удалось показать, что образование структуры стекла действительно приводит к формированию икосаэдрических группировок атомов. Соответствующая статья принята к публикации в Nature Materials.
Правда, свой эксперимент ученые поставили не на стеклах, а на модельной системе, где вместо атомов использовались частицы коллоидного геля, взвешенные в полимерной матрице. При повышенной температуре такой гель ведет себя как жидкость, а при понижении температуры переходит в твердое состояние благодаря феномену так называемой динамической блокировки, когда локальная структура частиц геля препятствует дальнейшему их движению. Собственно, такая запертость частиц в пространстве и есть не что иное, как локальный минимум внутренней энергии геля.
Собственно, такая запертость частиц в пространстве и есть не что иное, как локальный минимум внутренней энергии геля.
Хотя подобный гель является довольно упрощенной моделью твердеющего стекла, процессы, сопровождающие формирование его динамически заторможенной структуры, во многом должны быть схожи с процессами затвердевания стекла.
Конфокальная микроскопия
Приставка «кон-» во многих языках означает сопряжение, соединение связь. У объектива оптического микроскопа существует две плоскости – фокальная, куда помещается рассматриваемый объект и, сопряженная ей, конфокальная, куда объект…
Читать дальше
Применение модельной системы понадобилось ученым для того, чтобы организовать прямое наблюдение за его частицами, выстраивающимися в структуру. Для этого ими был применен один из видов оптической микроскопии — конфокальная микроскопия, позволяющий наблюдать за системой микрометровых коллоидных частиц сразу в трех измерениях.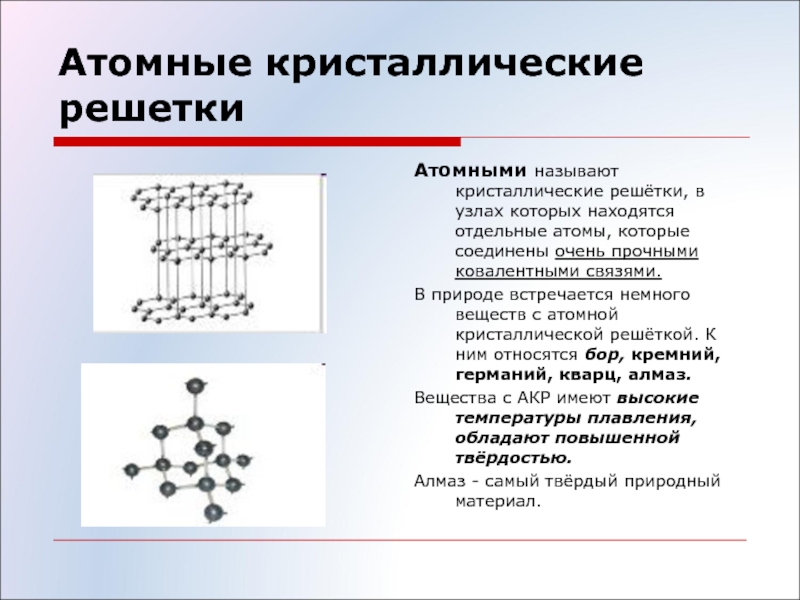
Обработав снимки и видеозаписи, ученые пришли к выводу что динамически заторможенная структура затвердевшего геля действительно формируется из икосаэдрических фигур, имеющих пятикратную симметрию.
Роял полагает, что его работа может лечь в основу создания долгожданной завершенной теории стеклообразного состояния, развитие которой в дальнейшем может привести к появлению методов получения многих подобных материалов.
В интервью журналу New Scientist он пояснил, какими преимуществами могут обладать подобные материалы. Например, многие металлы, полученные в стеклообразном состоянии, могут оказаться намного более привлекательными конструкционными материалами, чем самые дорогие и сложные современные сплавы.
Многие из наших читателей знают об успехе японских специалистов, добившихся необычайной пластичности обычной стали путём создания у последней наноразмерной волокнистой структуры. Если же получить сталь, вовсе лишенную напряжений на межзеренных границах кристаллитов, то такой материал будет, вероятно, на порядки устойчивее к действию разного рода нагрузок.
Окажется ли он прозрачным, как стекло, предсказывать Роял не берется.
Тест » Кристаллические решетки «
Кристаллические решетки
Вариант 1
В узлах кристаллической решетки меди находятся
атомы 3) молекулы
ионы 4) атомы и ионы
В узлах кристаллической решетки алмаза находятся
атомы 3) молекулы
ионы 4) атомы и ионы
Ионную кристаллическую решетку имеет вещество:
KBr 2) Br2 3) HBr 4) Br2O7
Наиболее высокую температуру плавления имеет вещество:
H2O 2) SO3 3) KBr 4) CI2
Кристаллическая решетка хлорида натрия NaCI:
атомная 3) металлическая
молекулярная 4) ионная
Какие из приведенных утверждений верны?
А.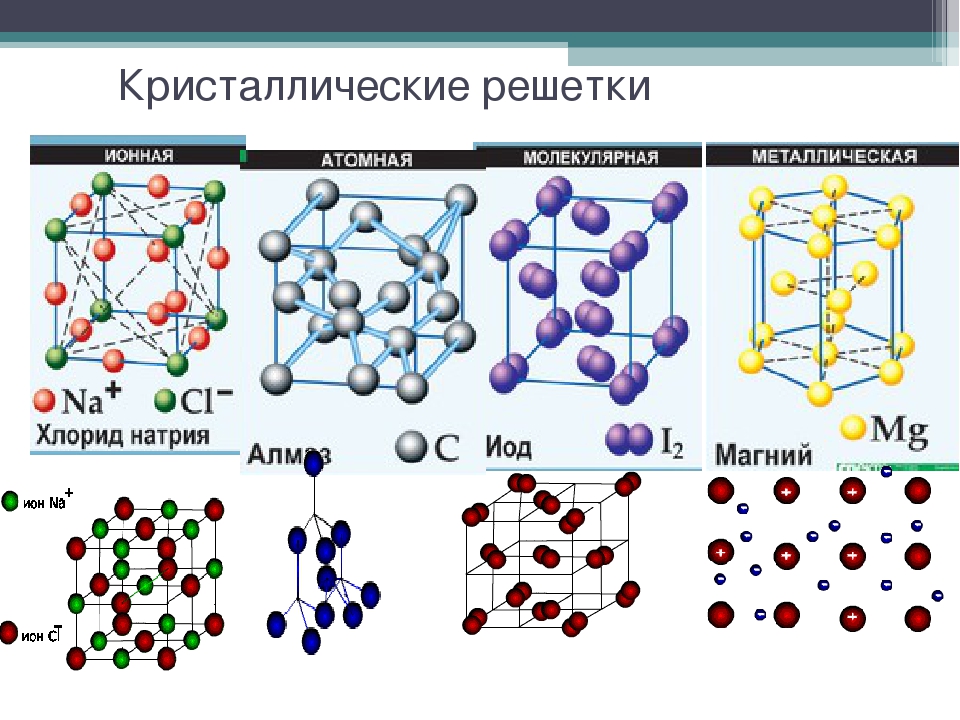 Вещества с молекулярной решеткой имеют низкие температуры плавления.
Вещества с молекулярной решеткой имеют низкие температуры плавления.
Б. Большинство веществ с металлической решеткой обладают электропроводимостью.
1) верно только А
2) верно только Б
3) верны А и Б
4) оба утверждения неверны
Вещества с атомной кристаллической решеткой
очень твердые и тугоплавкие
хрупкие
легкоплавкие
проводят электрический ток
В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку?
KBr; O2; CO2 3) SiO2; CuBr2; S
FeCI3; BaS; NaI 4) HCI; KF; H2O
Перечислите свойства, характеризующие вещество с молекулярной кристаллической решеткой___________________________________
___________________________________________________________
Кристаллические решетки
Вариант 2
1. В узлах кристаллической решетки поваренной соли находятся
В узлах кристаллической решетки поваренной соли находятся
атомы 3) молекулы
ионы 4) атомы и ионы
В узлах кристаллической решетки углекислого газа находятся
атомы 3) молекулы
ионы 4) атомы и ионы
Металлическую кристаллическую решетку имеет вещество:
ZnCI2 2) ZnO 3) Zn 4) ZnS
Наиболее высокую температуру плавления имеет вещество:
O2 2) CaCI2 3) NH3 4) CO2
Кристаллическая решетка водорода Н2:
атомная 3) металлическая
молекулярная 4) ионная
Какие из приведенных утверждений верны?
А. Вещества с атомной кристаллической решеткой имеют низкие температуры плавления.
Б. Вещества с ионной кристаллической решеткой являются газообразными веществами.
1) верно только А
2) верно только Б
3) верны А и Б
4) оба утверждения неверны
Вещества с молекулярной кристаллической решеткой
имеют высокие температуры плавления
хорошо растворяются в полярных растворителях
являются летучими соединениями
имеют высокую твердость
В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку?
CaO; NaI; MgS 3) C; HCI; K3N
BaCI2; H2O; CO2 4) H2; AICI3; SO2
Перечислите свойства, характеризующие вещество с атомной кристаллической решеткой___________________________________
___________________________________________________________
Онлайн урок: Кристаллическое состояние веществ по предмету Химия 8 класс
Кристаллические решётки бывают:
- молекулярные
- атомные (атомно- ковалентные)
- ионные
- металлические (атомно- металлические)
Остановимся на характеристике основных типов кристаллических решеток и установим зависимость от них свойств веществ.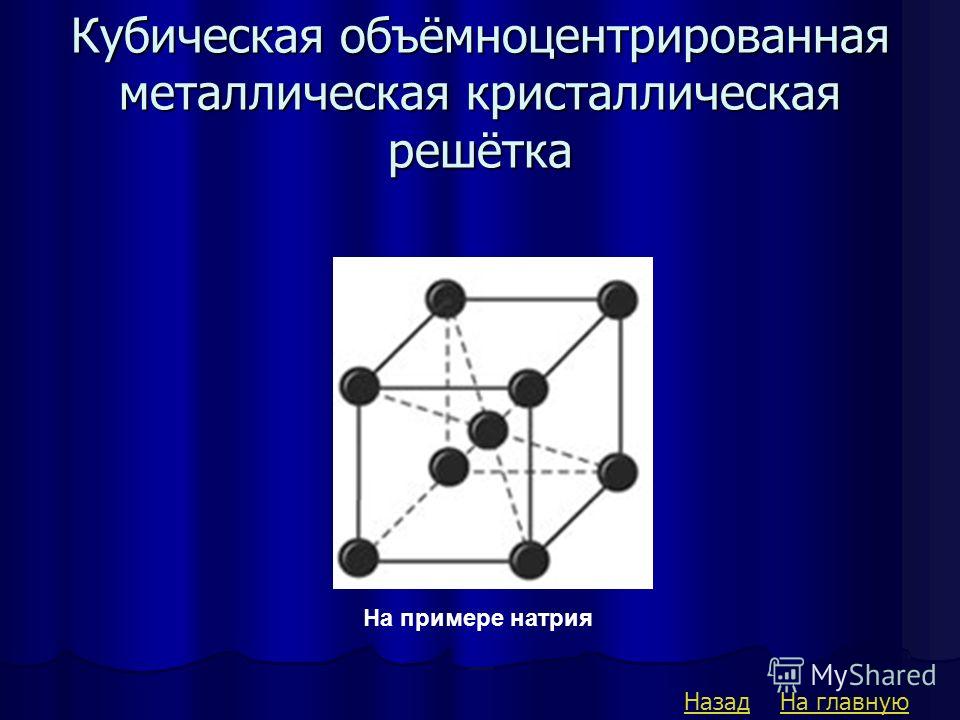
Молекулярные кристаллические решетки– это решетки, в узлах которых расположены молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия.
Примером вещества с молекулярной кристаллической решеткой может служить кристаллический оксид углерода (IV) CO2 – «сухой лед».
С помощь сухого льда кулинары делают забавные представления, ведь он совершенно безопасен для здоровья!
Рассмотрим модель его кристаллической решетки.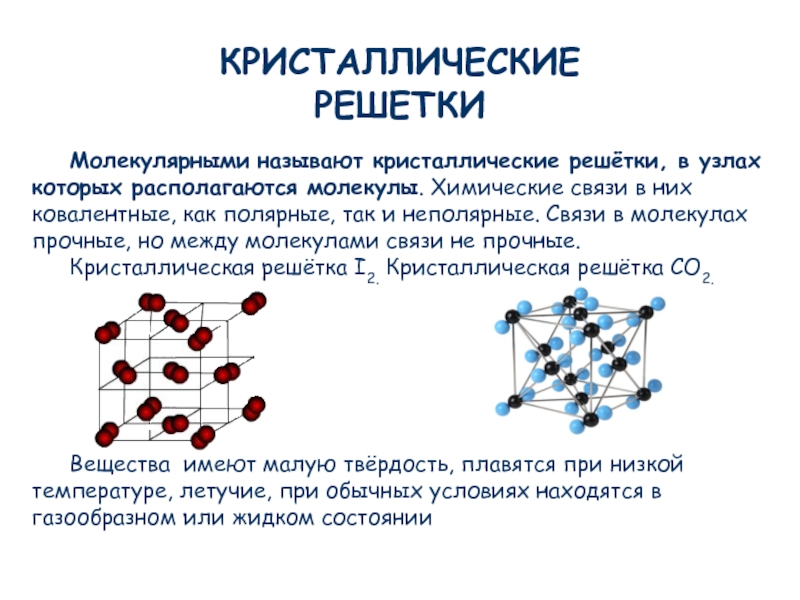
В ее узлах находятся молекулы.
Многие вещества в твердом состоянии имеют молекулярную кристаллическую решетку, особенно органические (например, белки, углеводы, полимеры).
Атомы в их молекулах связаны прочными ковалентными связями.
Молекулы же в кристаллах стянуты слабыми межмолекулярными силами, которые легко разорвать.
Поэтому кристаллы с молекулярной решеткой обладают малой твердостью, легкоплавкие, летучие.
Молекулярные вещества легко переходят из одного агрегатного состояния в другое.
Примером может служить сублимация йода.
Сублимация – возгонка, переход из твердого состояния не в жидкое, а сразу в газообразное.
Йод – это твёрдый (при нормальных условиях) неметалл темно-фиолетового цвета.
При нагревании йод не плавится, а возгоняется: сразу переходит в газообразное состояние.
У меня есть дополнительная информация к этой части урока!
Закрыть
Тот же эффект можно наблюдать и с сухим льдом. Если положить на стол кусочек сухого льда, то он не плавится, а сразу же испаряется (то есть переходит в газообразное состояние).
Интересно то, что он при этом начинает бегать по поверхности. Происходит это потому, что между кристаллом и столом образуется слой углекислого газа, который и толкает этот кристалл в разные стороны.
Если ненадолго взять его в руку, мы почувствуем небольшой холод, но жидкости не будет. Именно поэтому это вещество и назвали «сухой лёд».
Однако получить эти вещества в жидком виде всё же возможно. Эти жидкости существуют при повышенном давлении. Хотя термин «повышенное давление» в данном случае понятие весьма растяжимое и вовсе не означает большущие гидравлические прессы размером со шкаф. Например, жидкий йод можно легко получить в пробирке, нагревая его кристаллы, но при этом охлаждая горлышко пробирки. В таком случае пары йода не будут выходить из пробирки, а будут опять оседать на ней в виде кристаллов, и в итоге в пробирке образуется повышенное давление паров йода.
Атомные кристаллические решетки – решетки, в которых расположены атомы, стянутые в кристалле прочными ковалентными связями.
Атомных кристаллов сравнительно немного.
Примерами таких твердых веществ служат как простые вещества: алмаз, кремний; так и сложные вещества: карбид кальция, сульфид цинка, диоксид кремния и др.
Так, например, кристалл алмаза имеет форму тетраэдра.
Следовательно, структурную его единицу представляет тетраэдр.
В центре его ячейки расположен атом углерода, прочно связанный с четырьмя другими атомами углерода с помощью электронных пар.
Все связи одинаковы, как и углы, образующиеся между атомами.
Именно благодаря ковалентным связям атомные кристаллы имеют высокую твёрдость и температуру плавления.
Именно тот факт, что в алмазе каждый атом связан четырьмя ковалентными связями, и объясняет столь высокую его твёрдость.
Ионные кристаллические решетки – это решетки, в узлах которых расположены ионы с противоположными зарядами.
Связь между ионами осуществляется за счет электростатических сил притяжения.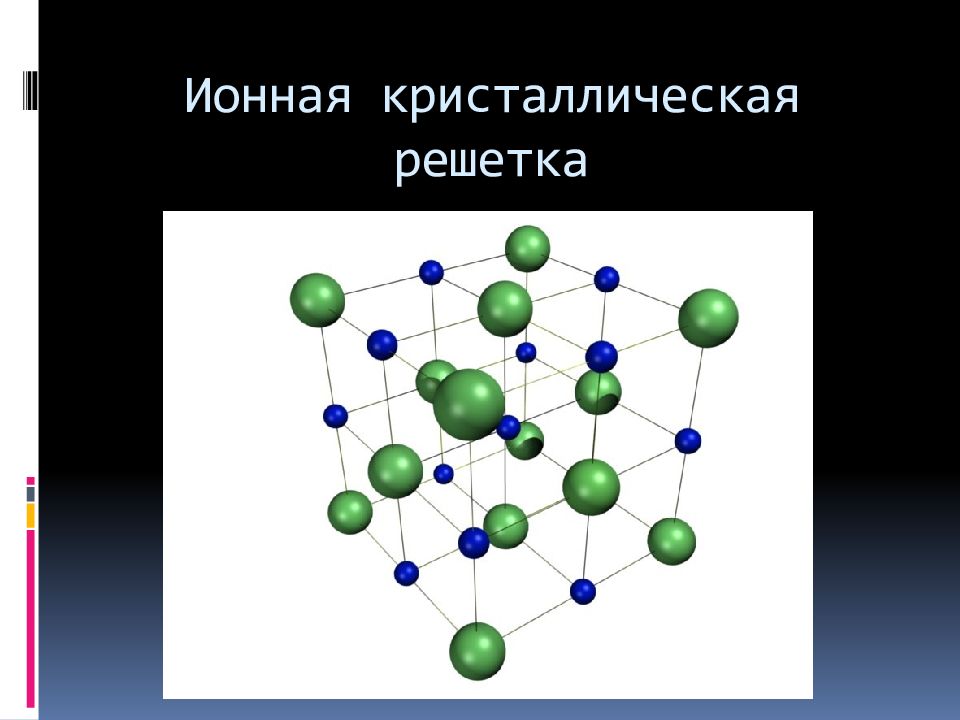
Типичный представитель веществ с такой решеткой – поваренная соль (схематичное изображение решетки поваренной соли есть выше в этом уроке).
Ионные кристаллические решетки характерны для многих соединений с ионной связью. Это соли щелочных и щелочно-земельных металлов, щёлочи.
Ионные кристаллы отличаются высокой твердостью и температурой плавления, малой летучестью. По физическим свойствам они сходны с атомными кристаллами.
Металлические кристаллические решетки присущи простым веществам – металлам. Подробно они будут рассмотрены позже.
Многие простые и сложные вещества имеют кристаллическую структуру.
Для них характерны закономерное расположение частиц в трехмерном пространстве и строгая правильная геометрическая форма кристаллов. Свойства таких веществ зависят не только от строения образующих их атомов и характера их химической связи, но и от кристаллической структуры веществ.
Определить тип кристаллической решетки вещества поможет таблица:
| Металл | Неметалл | Тип кристаллической решетки | Свойства веществ с этим типом кристаллической решетки | |
1, 2, 3 гр главных п/г | не 1, 2, 3 гр главных п/г | ||||
Простые вещества | — | — | С (алмаз и графит) Р (черный фосфор) | Атомная | Твердые, тугоплавкие, нерастворимые или слаборастворимые. Диэлектрики или полупроводники |
+ | + | — | Металлическая | Твердые, пластичные, нерастворимые. Проводники | |
— | — | + |
Молекулярная | Непрочные, летучие, жидкие и твердые, растворимые в большинстве. Диэлектрики | |
Сложные вещества | — | — | + | ||
— | + | — | Атомная | Твердые, тугоплавкие, нерастворимые или слаборастворимые. Диэлектрики или полупроводники | |
+ | — | — | Ионная | Твердые, тугоплавкие, растворимые. Проводники или полупроводники | |
Выводы:
- Если вещество состоит из одного металла, то решетка металлическая.
- Если в составе вещества нет металла, либо оно органическое, то решетка молекулярная. Исключение составляют С (алмаз и графит) и Р (черный фосфор), имеющие атомную решетку.
- Если в составе вещества есть металл 1, 2, 3 групп главных подгрупп, то решетка ионная.
- Если в составе вещества есть металл не из 1, 2, 3 групп главных подгрупп, то решетка атомная.
 Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).
Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).
Исходя из сказанного выше составим обобщающую таблицу:
Характеристика решетки | Металлическая | Атомная | Ионная | Молекулярная |
(атомно- металлическая) | (атомно- ковалентная) | |||
Состав узла решетки | Атом металла и электрон | Атомы, связанные ковалентной полярной и неполярной связью | Атомы, связанные ионной связью | Молекулы с слабыми связями |
Тип связи между структурами решетки | Металлическая | Ковалентная | Ионная
| Водородная |
Частично ковалентная | Ковалентная полярная и неполярная | |||
Прочность связи | умеренно прочная | Очень прочная | Умеренно прочная | Непрочная |
Агрегатное состояние | Твердые, пластичные, металлы и сплавы | Твердые, тугоплавкие | Твердые, тугоплавкие | Летучие (имеют запах) |
Жидкие | ||||
Твердые | ||||
Температура плавления | Высокая | Высокая | Высокая | Низкая |
Электропроводность | Проводники | Диэлектрики и полупроводники | Проводники и полупроводники | Диэлектрики |
Растворимость в воде | Нерастворимы | Нерастворимы или полурастворимы | Растворимы | Растворимы в большинстве |
Металл | Да | Металл в составе вещества | Нет | |
Состав | Простые вещества | Сложные вещества | Простые вещества неметаллы и сложные в-ва | |
Металлы | Металлы | Неметаллы | ||
побочных групп | 1, 2, 3 групп главных подгрупп | с неметаллами | ||
с неметаллами (в том числе оксиды), щелочами, солями | ||||
кремниевая кислота (исключение) | все кислоты за исключением кремниевой | |||
благородные газы | ||||
органические вещества | ||||
двухатомные молекулы за исключением ранее преречисленных | ||||
Пример | Al, Cu, Mn, Fe, Zn | Н2SiO3, SiO2, B, Al2O3, C (алмаз и графит), Р (черный фосфор) | NaCl, KNO3, Na3PO4, K2SO4 | NH3, H2O, Cl2, CO2, N2, J2, Br2, P (красный и белый фосфор) |
[PDF] Тест: « Типы кристаллических решёток»
Download Тест: « Типы кристаллических решёток».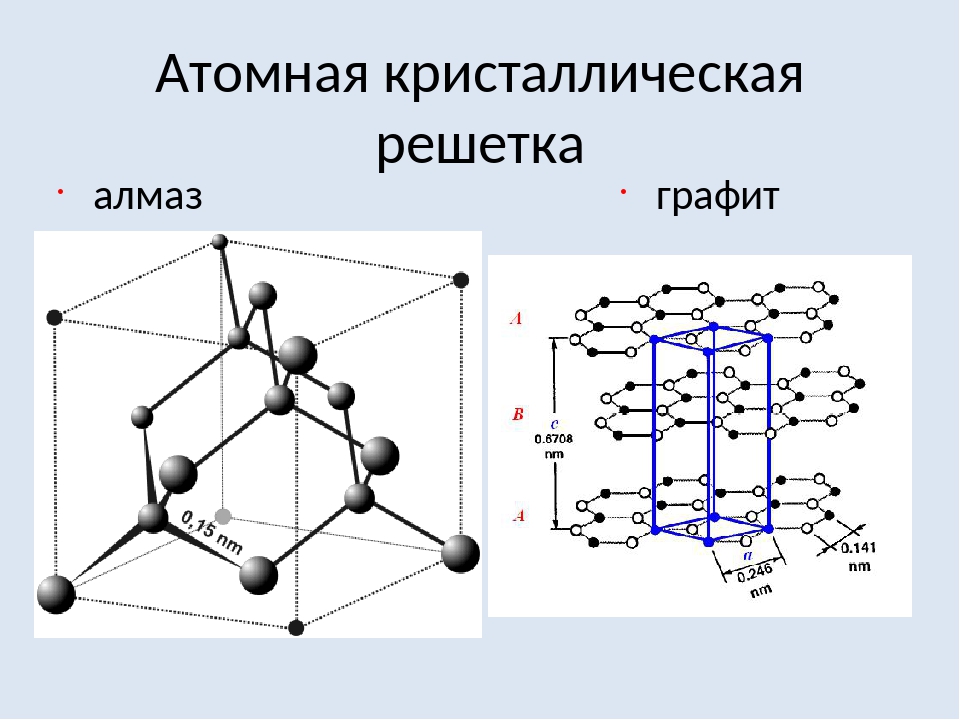 ..
..
Вариант 1 Тест: « Типы кристаллических решёток» 1.В узлах разных кристаллических решеток могут находиться 1.Атомы 2. Электроны 3.Протоны 4.Ионы 5.Молекулы 2.Выберите вещества, имеющие атомную кристаллическую решетку. 1Графит 3.Алмаз 2.Сульфат меди 4.Оксид кремния 3.Выберите вещества, имеющие ионную кристаллическую решетку: 1. оксид кремния 2.хлорид натрия 3.гидроксид калия 4.сульфат алюминия 4.Атомная кристаллическая решётка характерна для: a). алюминия и графита б). серы и йода в). оксида кремния и хлорида натрия г). алмаза и бора 5) Изотопами являются: а). этан и этен б). О16 и О17 в). натрий и калий г). графит и азот 6) Вещества, имеющие металлическуюую кристаллическую решётку, как правило: a). тугоплавки и хорошо растворимы в воде б). легкоплавки и летучи в). Тверды и электропроводны г). Теплопроводны и пластичны 8. Какой тип кристаллической решётки у следующих широко используемых в быту веществ: 1.вода, 2.уксусная кислота (Ch4COOH), 3.сахар (C12h32O11), 4.алмаз? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки? 9 По формулам приведённых веществ: NaBr, C2h3 — определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ. 10.выберите признаки характерные для веществ с молекулярнойой кристаллической решёткой: 1. В узлах кристаллической решётки находятся нейтральные атомы 2. Это летучие вещества 3. Основным агрегатным состоянием — является твердое состояние вещества 4. Это тугоплавкие вещества 5. В узлах кристаллической решётки находятся полярные и неполярные молекулы 6. Частицы в узлах кристаллической решетке связаны друг с другом ковалентной связью 7. Данные вещества не растворяются в воде 8. Это ковкие и пластичные вещества 9. В узлах кристаллической решётки находятся положительные и отрицательные ионы 10. Это твёрдые и прочные вещества 11. Это непрочные вещества 12. Частицы в узлах кристаллической решетке связаны друг с другом ионной связью 13. Эти вещества имеют металлический блеск 14. В узлах кристаллической решётки находятся нейтральные атомы и положительные ионы металла 15. Частицы в узлах кристаллической решетке связаны друг с другом силами межмолекулярного взаимодействия 16. Представителями являются соли 17.
10.выберите признаки характерные для веществ с молекулярнойой кристаллической решёткой: 1. В узлах кристаллической решётки находятся нейтральные атомы 2. Это летучие вещества 3. Основным агрегатным состоянием — является твердое состояние вещества 4. Это тугоплавкие вещества 5. В узлах кристаллической решётки находятся полярные и неполярные молекулы 6. Частицы в узлах кристаллической решетке связаны друг с другом ковалентной связью 7. Данные вещества не растворяются в воде 8. Это ковкие и пластичные вещества 9. В узлах кристаллической решётки находятся положительные и отрицательные ионы 10. Это твёрдые и прочные вещества 11. Это непрочные вещества 12. Частицы в узлах кристаллической решетке связаны друг с другом ионной связью 13. Эти вещества имеют металлический блеск 14. В узлах кристаллической решётки находятся нейтральные атомы и положительные ионы металла 15. Частицы в узлах кристаллической решетке связаны друг с другом силами межмолекулярного взаимодействия 16. Представителями являются соли 17. Представителями являются простые вещества неметаллы, в обычном состоянии являющиеся газами 18. Данные вещества хорошо растворяются в воде 19. Растворимость этих веществ зависит от полярности химической связи 20. Данные вещества имеют низкую температуру кипения 21. Частицы в узлах кристаллической решетке связаны друг с другом металлической связью 22. Представителями являются твердые, тугоплавкие неметаллы 23. Данные вещества способны проводить электрический ток
Представителями являются простые вещества неметаллы, в обычном состоянии являющиеся газами 18. Данные вещества хорошо растворяются в воде 19. Растворимость этих веществ зависит от полярности химической связи 20. Данные вещества имеют низкую температуру кипения 21. Частицы в узлах кристаллической решетке связаны друг с другом металлической связью 22. Представителями являются твердые, тугоплавкие неметаллы 23. Данные вещества способны проводить электрический ток
Вариант 2 Тест: « Типы кристаллических решёток» 1.Среди перечисленных веществ выберите вещества, которые имеют кристаллическое строение. 1.воск 2.алмаз 3.каменная соль 4.»сухой лед» 2.В узлах разных кристаллических решеток могут находиться 1.атомы 2.электроны 3.протоны 4.ионы 5.молекулы 3. Аллотропией называется: 1. существование для атомов одного и того же элемента нескольких устойчивых изотопов 2. способность атомов элемента образовывать несколько сложных веществ с атомами другого элемента 3. существование нескольких сложных веществ, молекулы которых имеют одинаковый состав, но различное химическое строение 4. существование нескольких простых веществ, образованных атомами одного и того же элемента 5) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка: а). молекулярная б). атомная в). ионная г). металлическая 6) Вещества, имеющие молекулярную кристаллическую решётку, как правило: a). тугоплавки и хорошо растворимы в воде б). легкоплавки и летучи в). Тверды и электропроводны 7. Какой тип кристаллической решётки у следующих широко используемых в быту веществ: 1.калийное удобрение (KCl), 2.речной песок (SiO2) – температура плавления 1710 0C, 3.аммиак (Nh4), 4.поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки? 8 По формулам приведённых веществ: SiC, CS2 — определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ. 9.выберите признаки характерные для веществ с ионной кристаллической решёткой: 1.
существование нескольких простых веществ, образованных атомами одного и того же элемента 5) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка: а). молекулярная б). атомная в). ионная г). металлическая 6) Вещества, имеющие молекулярную кристаллическую решётку, как правило: a). тугоплавки и хорошо растворимы в воде б). легкоплавки и летучи в). Тверды и электропроводны 7. Какой тип кристаллической решётки у следующих широко используемых в быту веществ: 1.калийное удобрение (KCl), 2.речной песок (SiO2) – температура плавления 1710 0C, 3.аммиак (Nh4), 4.поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки? 8 По формулам приведённых веществ: SiC, CS2 — определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ. 9.выберите признаки характерные для веществ с ионной кристаллической решёткой: 1.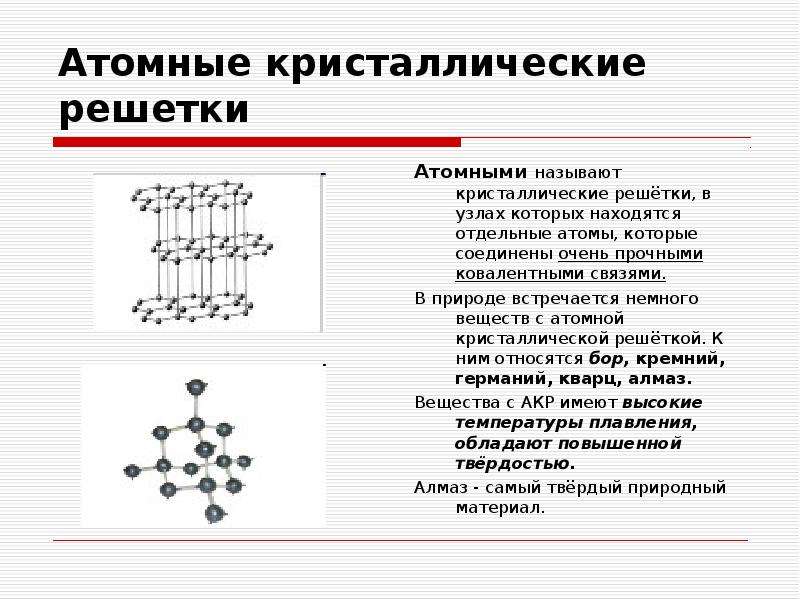 В узлах кристаллической решётки находятся нейтральные атомы 2. Это летучие вещества 3. Основным агрегатным состоянием — является твердое состояние вещества 4. Это тугоплавкие вещества 5. В узлах кристаллической решётки находятся полярные и неполярные молекулы 6. Частицы в узлах кристаллической решетке связаны друг с другом ковалентной связью 7. Данные вещества не растворяются в воде 8. Это ковкие и пластичные вещества 9. В узлах кристаллической решётки находятся положительные и отрицательные ионы 10. Это твёрдые и прочные вещества 11. Это непрочные вещества 12. Частицы в узлах кристаллической решетке связаны друг с другом ионной связью 13. Эти вещества имеют металлический блеск 14. В узлах кристаллической решётки находятся нейтральные атомы и положительные ионы металла 15. Частицы в узлах кристаллической решетке связаны друг с другом силами межмолекулярного взаимодействия 16. Представителями являются соли 17. Представителями являются простые вещества неметаллы, в обычном состоянии являющиеся газами 18.
В узлах кристаллической решётки находятся нейтральные атомы 2. Это летучие вещества 3. Основным агрегатным состоянием — является твердое состояние вещества 4. Это тугоплавкие вещества 5. В узлах кристаллической решётки находятся полярные и неполярные молекулы 6. Частицы в узлах кристаллической решетке связаны друг с другом ковалентной связью 7. Данные вещества не растворяются в воде 8. Это ковкие и пластичные вещества 9. В узлах кристаллической решётки находятся положительные и отрицательные ионы 10. Это твёрдые и прочные вещества 11. Это непрочные вещества 12. Частицы в узлах кристаллической решетке связаны друг с другом ионной связью 13. Эти вещества имеют металлический блеск 14. В узлах кристаллической решётки находятся нейтральные атомы и положительные ионы металла 15. Частицы в узлах кристаллической решетке связаны друг с другом силами межмолекулярного взаимодействия 16. Представителями являются соли 17. Представителями являются простые вещества неметаллы, в обычном состоянии являющиеся газами 18. Данные вещества хорошо растворяются в воде 19. Растворимость этих веществ зависит от полярности химической связи 20. Данные вещества имеют низкую температуру кипения 21. Частицы в узлах кристаллической решетке связаны друг с другом металлической связью 22. Представителями являются твердые, тугоплавкие неметаллы 23. Данные вещества способны проводить электрический ток
Данные вещества хорошо растворяются в воде 19. Растворимость этих веществ зависит от полярности химической связи 20. Данные вещества имеют низкую температуру кипения 21. Частицы в узлах кристаллической решетке связаны друг с другом металлической связью 22. Представителями являются твердые, тугоплавкие неметаллы 23. Данные вещества способны проводить электрический ток
Т-8 вариант 2 1. В узлах кристаллической решетки поваренной соли находятся 1) атомы 3) молекулы 2) ионы 4) атомы и ионы 2. В узлах кристаллической решетки углекислого газа находятся 1) атомы 3) молекулы 2) ионы 4) атомы и ионы 3. Металлическую кристаллическую решетку имеет вещество: 1) ZnCl2 2) ZnO 3) Zn 4) ZnS 4. Наиболее высокую температуру плавления имеет вещество: 1) O2 2) CaCl2 3) NH3 4) CO2 5. Кристаллическая решетка водорода H2: 1) атомная 3) металлическая 2) молекулярная 4) ионная 6. Какие из приведенных утверждений верны? А. Вещества с атомной кристаллической решеткой имеют низкие температуры плавления. Б. Вещества с ионной кристаллической решеткой являются газообразными веществами. 1) верно только А 2) верно только Б 3) верны А и Б 4) оба утверждения неверны 7. Вещества с молекулярной кристаллической решеткой 1) имеют высокие температуры плавления 2) хорошо растворяются в полярных растворителях 3) являются летучими соединениями 4) имеют высокую твердость 8. В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку? 1) CaO; NaI; MgS 3) C; HCl; K3N 2) BaCl2; H2O; CO2 4) H2; AlCl3; SO2 9. Перечислите свойства, характеризующие вещество с атомной кристал- лической решеткой. _________________________________________________________________ | |
Т-8 вариант 3 1. 1) атомы и ионы 3) ионы 2) атомы 4) молекулы 2. В узлах кристаллической решетки алмаза находятся 1) атомы и ионы 3) ионы 2) атомы 4) молекулы 3. Ионную кристаллическую решетку имеет вещество: 1) Br2O5 2) KBr 3) Br 4) HBr 4. Наиболее высокую температуру плавления имеет вещество: 1) Cl2 2) H2O 3) SO3 4) KBr 5. Кристаллическая решетка хлорида натрия NaCl: 1) ионная 3) молекулярная 2) атомная 4) металлическая 6. Какие из приведенных утверждений верны? А. Вещества с молекулярной решеткой имеют низкие температуры плавления. Б. Большинство веществ с металлической решеткой обладают электро- проводимостью. 1) оба утверждения неверны 2) верно только А 3) верно только Б 4) верны А и Б 7. 1) проводят электрический ток 2) очень твердые и тугоплавкие 3) хрупкие 4) легкоплавкие 8. В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку? 1) HCl; KF; H2O 3) FeCl3; BaS; NaI 2) KBr; O2; CO2 4) SiO2; CuBr2; S 9. Перечислите свойства, характеризующие вещество с молекулярной кристал- лической решеткой. ______________________________________________________________________ | Т-8 вариант 4 1. В узлах кристаллической решетки поваренной соли находятся 1) атомы и ионы 3) ионы 2) атомы 4) молекулы 2. В узлах кристаллической решетки углекислого газа находятся 1) атомы и ионы 3) ионы 2) атомы 4) молекулы 3. Металлическую кристаллическую решетку имеет вещество: 1) ZnS 2) ZnCl2 3) ZnO 4) Zn 4. 1) CO2 2) O2 3) CaCl2 4) NH3 5. Кристаллическая решетка водорода H2: 1) ионная 3) молекулярная 2) атомная 4) металлическая 6. Какие из приведенных утверждений верны? А. Вещества с атомной кристаллической решеткой имеют низкие температуры плавления. Б. Вещества с ионной кристаллической решеткой являются газообразными веществами. 1) оба утверждения неверны 2) верно только А 3) верно только Б 4) верны А и Б 7. Вещества с молекулярной кристаллической решеткой 1) имеют высокую твердость 2) имеют высокие температуры плавления 3) хорошо растворяются в полярных растворителях 4) являются летучими соединениями 8. В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку? 1) H2; AlCl3; SO2 3) BaCl2; H2O; CO2 2) CaO; NaI; MgS 4) C; HCl; K3N 9. лической решеткой. _________________________________________________________________ |
Т-8 вариант 5 1. В узлах кристаллической решетки меди находятся 1) молекулы 3) атомы 2) атомы и ионы 4) ионы 2. В узлах кристаллической решетки алмаза находятся 1) молекулы 3) атомы 2) атомы и ионы 4) ионы 3. Ионную кристаллическую решетку имеет вещество: 1) HBr 2) Br2O5 3) KBr 4) Br 4. Наиболее высокую температуру плавления имеет вещество: 1) KBr 2) Cl2 3) H2O 4) SO3 5. Кристаллическая решетка хлорида натрия NaCl: 1) металлическая 3) атомная 2) ионная 4) молекулярная 6. Какие из приведенных утверждений верны? А. плавления. Б. Большинство веществ с металлической решеткой обладают электро- проводимостью. 1) верны А и Б 2) оба утверждения неверны 3) верно только А 4) верно только Б 7. Вещества с атомной кристаллической решеткой 1) легкоплавкие 2) проводят электрический ток 3) очень твердые и тугоплавкие 4) хрупкие 8. В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку? 1) SiO2; CuBr2; S 3) KBr; O2; CO2 2) HCl; KF; H2O 4) FeCl3; BaS; NaI 9. Перечислите свойства, характеризующие вещество с молекулярной кристал- лической решеткой. ______________________________________________________________________ | Т-8 вариант 6 1. 1) молекулы 3) атомы 2) атомы и ионы 4) ионы 2. В узлах кристаллической решетки углекислого газа находятся 1) молекулы 3) атомы 2) атомы и ионы 4) ионы 3. Металлическую кристаллическую решетку имеет вещество: 1) Zn 2) ZnS 3) ZnCl2 4) ZnO 4. Наиболее высокую температуру плавления имеет вещество: 1) NH3 2) CO2 3) O2 4) CaCl2 5. Кристаллическая решетка водорода H2: 1) металлическая 3) атомная 2) ионная 4) молекулярная 6. Какие из приведенных утверждений верны? А. Вещества с атомной кристаллической решеткой имеют низкие температуры плавления. Б. Вещества с ионной кристаллической решеткой являются газообразными веществами. 1) верны А и Б 2) оба утверждения неверны 3) верно только А 4) верно только Б 7. 1) являются летучими соединениями 2) имеют высокую твердость 3) имеют высокие температуры плавления 4) хорошо растворяются в полярных растворителях 8. В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку? 1) C; HCl; K3N 3) CaO; NaI; MgS 2) H2; AlCl3; SO2 4) BaCl2; H2O; CO2 9. Перечислите свойства, характеризующие вещество с атомной кристал- лической решеткой. _________________________________________________________________ |
Т-8 вариант 7 1. В узлах кристаллической решетки меди находятся 1) ионы 3) атомы и ионы 2) молекулы 4) атомы 2. В узлах кристаллической решетки алмаза находятся 1) ионы 3) атомы и ионы 2) молекулы 4) атомы 3. 1) Br 2) HBr 3) Br2O5 4) KBr 4. Наиболее высокую температуру плавления имеет вещество: 1) SO3 2) KBr 3) Cl2 4) H2O 5. Кристаллическая решетка хлорида натрия NaCl: 1) молекулярная 3) ионная 2) металлическая 4) атомная 6. Какие из приведенных утверждений верны? А. Вещества с молекулярной решеткой имеют низкие температуры плавления. Б. Большинство веществ с металлической решеткой обладают электро- проводимостью. 1) верно только Б 2) верны А и Б 3) оба утверждения неверны 4) верно только А 7. Вещества с атомной кристаллической решеткой 1) хрупкие 2) легкоплавкие 3) проводят электрический ток 4) очень твердые и тугоплавкие 8. В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку? 1) FeCl3; BaS; NaI 3) HCl; KF; H2O 2) SiO2; CuBr2; S 4) KBr; O2; CO2 9. лической решеткой. ______________________________________________________________________ | Т-8 вариант 8 1. В узлах кристаллической решетки поваренной соли находятся 1) ионы 3) атомы и ионы 2) молекулы 4) атомы 2. В узлах кристаллической решетки углекислого газа находятся 1) ионы 3) атомы и ионы 2) молекулы 4) атомы 3. Металлическую кристаллическую решетку имеет вещество: 1) ZnO 2) Zn 3) ZnS 4) ZnCl2 4. Наиболее высокую температуру плавления имеет вещество: 1) CaCl2 2) NH3 3) CO2 4) O2 5. Кристаллическая решетка водорода H2: 1) молекулярная 3) ионная 2) металлическая 4) атомная 6. Какие из приведенных утверждений верны? А. температуры плавления. Б. Вещества с ионной кристаллической решеткой являются газообразными веществами. 1) верно только Б 2) верны А и Б 3) оба утверждения неверны 4) верно только А 7. Вещества с молекулярной кристаллической решеткой 1) хорошо растворяются в полярных растворителях 2) являются летучими соединениями 3) имеют высокую твердость 4) имеют высокие температуры плавления 8. В каком ряду перечислены вещества, имеющие ионную кристаллическую решетку? 1) BaCl2; H2O; CO2 3) H2; AlCl3; SO2 2) C; HCl; K3N 4) CaO; NaI; MgS 9. Перечислите свойства, характеризующие вещество с атомной кристал- лической решеткой. _________________________________________________________________ |
Кристаллическая решетка: определение и структура — видео и стенограмма урока
Структура кристаллической решетки
Когда мы смотрим на структуру кристаллической решетки, помните о схемах расположения каждой точки, а также об их симметрии. Участки кристаллической решетки просматриваются только под микроскопом и невидимы невооруженным глазом. Чтобы увидеть эти структуры, мы должны взять кристалл (твердый объект), поместить его под микроскоп и рассмотреть узлы кристаллической решетки.
Участки кристаллической решетки просматриваются только под микроскопом и невидимы невооруженным глазом. Чтобы увидеть эти структуры, мы должны взять кристалл (твердый объект), поместить его под микроскоп и рассмотреть узлы кристаллической решетки.
Здесь показана структура кристаллической решетки.Вспомните, что кристаллическая решетка — это расположение атомов в кристалле (черные и белые точки на изображении — это ваши атомы). Такое расположение можно определить как пересечение трех параллельных плоскостей. Итак, если мы разрежем эту диаграмму на три части, вы увидите три разных плоскости. Когда эти плоскости пересекаются друг с другом, в результате получается трехмерная сеть с гранями. Думайте о каждом лице как о параллельном прямоугольнике.
Симметрия
Вы же не думаете, что я забуду о симметрии нашего друга, не так ли? Конечно, нет; Фактически, эти коробки (или грани) вносят вклад в симметрию структуры кристаллической решетки.Каждый блок содержит информацию о симметрии, необходимую для обеспечения трансляционной кристаллической структуры.
Трансляционная симметрия возникает, когда объект перемещается (или перемещается) на определенное расстояние в определенном месте. Например, вы хотите построить деревянный пол с рисунком. Вы кладете один кусок дерева по диагонали через каждые 20 дюймов. Этот стиль дерева с определенным рисунком имеет определенное расстояние (20 дюймов) и направление (диагональ).
Классификация
Кристаллические решетки можно разделить на одноатомные и многоатомные.Эта классификация основана на типе атомов, присутствующих на поверхности в решетчатой структуре. Если для создания грани (или прямоугольника) используется только один тип атома, это одноатомный . Многоатомная кристаллическая решетка содержит более одного типа атомов, используемых для создания грани.
Если мы посмотрим на структуру кристаллической решетки поваренной соли (NaCl) — решетка (а) и алмаза — решетка (б), мы увидим, что обе они имеют разные структуры решетки. Одно лицо в поваренной соли состоит из красных и зеленых точек.Это означает, что присутствует более одного типа атомов. Следовательно, эта структура многоатомна. В структуре алмазной решетки есть только одна цветная точка (синяя). Эта структура одноатомна.
Типы структур кристаллической решетки
Существует 14 различных типов кристаллических решеток. Каждый тип уникально описывает геометрическую симметрию кристалла.В частности, эти типы кристаллических решеток называются решетками Браве . Решетка Браве просто описывает разные типы трех разных решеток, которые могут быть созданы для данного кристалла.
Каждый из 14 типов решеток подразделяется на 7 кристаллических систем. Думайте о каждой системе как о группе структур кристаллической решетки (решетки Браве), которые однозначно описывают геометрическую симметрию кристалла. Приведены таблицы, в которых перечислены семь систем и их структуры.Если мы вернемся к нашему примеру с поваренной солью, как вы думаете, к какому типу кристаллической системы она принадлежит? Верно! Поваренная соль (NaCl) относится к системе кубической решетки.
Кристаллическая решетка является основой структуры твердого объекта.В следующий раз, когда вы будете поливать пищу солью или чистить этот сверкающий алмаз, вспомните об упорядоченной структуре кристаллической решетки, использованной для создания этого объекта.
Краткое содержание урока
Большинство твердых объектов содержат крошечные переплетенные кристаллы. Кристалл представляет собой твердый материал, который содержит атомы или группы атомов, образующие высокоупорядоченную структуру. Эта структурная схема является трехмерной. Кристаллическая решетка описывает расположение этих атомов в кристалле и характеризуется трансляционной симметрией.Если на поверхности кристаллической решетки присутствует один тип атома, он называется одноатомным . Наличие более одного типа атомов означает, что структура решетки состоит из многоатомных атомов . Существует 14 различных типов кристаллических решеток, называемых решетками Браве . Каждая из этих решетчатых структур подразделяется на семь кристаллических систем.
Ключевые термины для кристаллической решетки
- Кристалл : твердое вещество, содержащее атомы или группы атомов, расположенные в упорядоченной структуре
- Кристаллическая решетка : расположение атомов в кристаллических формах с трансляционной симметрией
- Одноатомный : только один тип атомов в решетке
- Многоатомный : более одного типа атомов в решетке
- Bravais Lattices : 7 кристаллических систем, состоящих из 14 различных типов кристаллических решеток
Результаты обучения
Завершите этот урок, чтобы успешно выполнить следующие задачи:
- Опишите кристаллическую решетку
- Покажите, как формируются кристаллические решетки
- Подробное описание различных типов кристаллических решеток
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Основы кристаллографии | Химический приборостроительный комплекс
Основы кристаллографии
Q1.Что такое кристалл?
Q2. Что такое кристаллическая структура?
Q3. Что такое элементарная ячейка и решетка?
Q4. Как расположение атомов помогает определить кристаллическую структуру?
1 кв. Что такое кристалл?
A1. Кристалл состоит из вещества, которое образовано из упорядоченного трехмерного расположения атомов, молекул или ионов. Это можно представить как укладку кирпичей в стену (напоминая двумерное упорядоченное расположение кирпичей!).
| 2D упорядоченное расположение кирпичей | 3D упорядоченное расположение атомов |
Q2. Что такое кристаллическая структура?
A2. Кристаллическая структура — это уникальное расположение атомов, молекул или ионов в кристалле. Он состоит из мотива, который представляет собой набор атомов, расположенных определенным образом, и решетки. Мотивы расположены на точках решетки, которая представляет собой массив точек, периодически повторяющихся в трех измерениях.Точки можно представить как образующие идентичные крошечные коробки, называемые элементарными ячейками , которые заполняют пространство решетки.
Длины краев элементарной ячейки и углы между ними называются параметрами решетки .
В природе часто наблюдается, что один элемент / молекула может существовать в различных кристаллических структурах на основе различий в периодическом расположении атомов друг относительно друга. Это свойство материалов иметь более чем одну форму или кристаллическую структуру называется полиморфизмом .
Пример полиморфизма, который легко увидеть в нашей повседневной жизни, — это углерод; он существует как алмаз и графит, из которых алмаз является самым твердым материалом, который используется в режущих инструментах, а также в ювелирных изделиях. Однако графит — мягкий материал, который находит применение в наших карандашах и смазках. На рисунках ниже показаны фундаментальные различия в том, как атомы расположены в трехмерных массивах в алмазе и графите, которые оба состоят из одного и того же элемента углерода.
| Атомы углерода в алмазе | Атомы углерода в графите |
Q3.Что такое элементарная ячейка и решетка? Есть ли какая-либо классификация элементарных ячеек и решеток на основе расположения атомов?
A3. Элементарная ячейка является наименьшим строительным блоком кристалла и представляет собой репрезентативную единицу повторяющихся мотивов в кристаллической структуре.
Решетка — геометрическая основа всех кристаллов. Решетку можно рассматривать как регулярное и бесконечное расположение точек / атомов, в котором каждая точка / атом имеет одинаковое окружение.Это одинаково применимо в одно-, двух- и трехмерном пространстве.
Решетки в трех измерениях имеют три некопланарных постоянных решетки (как коробка из-под обуви!), Обозначенные векторами трансляции a, b, и c (иногда упоминается как x, y , и z соответственно для трех вершин, обращенных перпендикулярно друг другу), и угол между тремя вершинами bc, ac, и ab , обозначенный как α (альфа) , β (бета) и g (гамма) соответственно.
Начнем с двумерной решетки, которую можно рассматривать как сетку , как показано ниже.
Двумерная решетка, изображенная как сетка
Сеточная решетка — это массив точек (показанных розовыми точками!). Эта чистая решетка (вверху) представляет собой двойную вращательную симметрию относительно каждой розовой точки (представляющей положение атома).
При выборе элементарной ячейки соблюдается универсальное кристаллографическое соглашение; Элементарная ячейка — это наименьшая повторяющаяся единица, для которой ее разграничивающие векторы параллельны или совпадают с важными направлениями симметрии в решетке.На рисунке выше a и b — возможная элементарная ячейка, но она не дает информации о симметрии решетки, если рассматривать ее изолированно. Однако a` и b` (зеленые) совпадают с линиями симметрии (зеркальными) в сетке, поэтому это предпочтительнее.
Трехмерные решетки (также известные как решетки Браве) можно представить себе как образованные путем регулярной укладки сетей. Есть 14 способов сделать это, как показано ниже:
Элементарные ячейки 14 решеток Браве (трехмерные решетки)
Каждая решетка представлена элементарной ячейкой, очерченной тремя векторами a, b, и c .В соответствии с соглашением эти векторы выбираются так, чтобы они оба образовывали параллельный трубопровод наименьшего объема в решетке и были параллельны важным направлениям симметрии в решетке или совпадали с ними, так что не все обычные элементарные ячейки являются примитивными. В трех измерениях мы встречаем элементарные ячейки, центрированные на паре противоположных граней, центрированные по телу или центрированные на всех гранях.
Подробнее читайте в книге, указанной в справочнике.
Ссылка: Определение структуры методом рентгеновской кристаллографии, М.F.C. Лэдд и Р.А. Палмер, 3-е издание, Plenum Press, Нью-Йорк.
4 кв. Как различное расположение атомов в элементарной ячейке и решетке помогает в определении кристаллической структуры соединения?
A4. Из-за разного расположения атомов в элементарной ячейке рентгеновские лучи имеют разные формы дифракции. Каждая структура имеет уникальную картину дифракции рентгеновских лучей (сравнимую с отпечатками пальцев человека), которая дает информацию об определенном пространственном расположении атомов в элементарной ячейке и решетке.Это, в свою очередь, дает информацию о кристаллической структуре.
Следующий раздел >> Состояния материи
Справка по викторине: основы металлов
Используйте поиск, чтобы быстро найти ответы на вопросы — откройте окно поиска (ctrl + f), затем введите ключевое слово из вопроса для навигации по вам в соответствии с этими терминами в материале курса
Атомная связь
Материя, как мы ее знаем, существует в трех общих состояниях. Эти три состояния — твердое, жидкое и газообразное.Атомные или молекулярные взаимодействия, происходящие внутри вещества, определяют его состояние. В этой главе мы будем иметь дело в первую очередь с твердыми телами, потому что твердые тела имеют наибольшее значение при инженерных приложениях материалов. Жидкости и газы будут упомянуты только для сравнения.
Твердое вещество удерживается вместе силами, возникающими между соседними атомами или молекулами. Эти силы возникают из-за различий в электронных облаках атомов. Другими словами, валентные электроны или электроны на внешней оболочке атомов определяют их притяжение для своих соседей.Когда физическое притяжение между молекулами или атомами материала велико, материал удерживается вместе. Молекулы в твердых телах тесно связаны между собой. Когда притяжение слабее, вещество может быть в жидкой форме и свободно течь. В газах практически отсутствуют силы притяжения между атомами или молекулами, а их частицы могут свободно перемещаться независимо друг от друга.
Типы связей в материале определяются тем, как силы удерживают материю вместе.На Рисунке 1 показано несколько типов облигаций, их характеристики перечислены ниже
a. Ионная связь — в этом типе связи один или несколько электронов полностью передаются от атома одного элемента к атому другого, и элементы удерживаются вместе силой притяжения из-за противоположной полярности заряда.
г. Ковалентная связь — связь, образованная общими электронами. Электроны разделяются, когда атому нужны электроны для завершения своей внешней оболочки, и он может делиться этими электронами со своим соседом.Тогда электроны являются частью обоих атомов, и обе оболочки заполнены.
г. Металлическая связь — в этом типе связи атомы не разделяют и не обмениваются электронами для связи друг с другом. Вместо этого многие электроны (примерно по одному на каждый атом) более или менее свободно перемещаются по металлу, так что каждый электрон может взаимодействовать со многими неподвижными атомами.
г. Молекулярная связь — когда электроны нейтральных атомов проводят больше времени в одной области своей орбиты, временный слабый заряд будет существовать.Молекула будет слабо притягивать другие молекулы. Иногда это называют ван-дер-ваальсовыми или молекулярными связями.
эл. Водородная связь — эта связь аналогична молекулярной связи и возникает из-за легкости, с которой атомы водорода готовы отдать электрон атомам кислорода, фтора или азота.
Таблица 1: Пример материалов и их связей
Тип связи не только определяет, насколько хорошо материал удерживается вместе, но также определяет, какими микроскопическими свойствами обладает материал.Такие свойства, как способность проводить тепло или электрический ток, определяются свободой движения электронов. Это зависит от типа соединения. Знание микроскопической структуры материала позволяет нам предсказать, как этот материал будет вести себя в определенных условиях. И наоборот, материал может быть изготовлен синтетически с заданной микроскопической структурой, чтобы получить свойства, желательные для определенных технических приложений.
Рисунок 1: Типы связывания
Порядок в микроструктурах
Твердые тела обладают большим межатомным притяжением, чем жидкости и газы.Однако свойства твердых материалов, используемых в инженерных целях, сильно различаются. Свойства материалов зависят от их межатомных связей. Эти же связи также определяют пространство между конфигурациями атомов в твердых телах. Все твердые вещества можно разделить на аморфные или кристаллические.
Аморфные
Аморфные материалы не имеют регулярного расположения своих молекул. Такие материалы, как стекло и парафин, считаются аморфными. Аморфные материалы обладают свойствами твердых тел.Они имеют определенную форму и объем и медленно распространяются. У этих материалов также отсутствуют четко определенные точки плавления. Во многих отношениях они напоминают жидкости, которые очень медленно текут при комнатной температуре.
Кристаллический
В кристаллической структуре атомы расположены в трехмерном массиве, называемом решеткой. Решетка имеет правильную повторяющуюся конфигурацию во всех направлениях. Группа частиц из одной части кристалла имеет точно такое же геометрическое соотношение, что и группа из любой другой части того же кристалла.
Общие кристаллические структуры
В металлах и во многих других твердых телах атомы расположены в регулярные массивы, называемые кристаллами. Кристаллическая структура состоит из атомов, расположенных по схеме, которая периодически повторяется в трехмерной геометрической решетке. Это повторение вызывают силы химической связи. Именно этот повторяющийся паттерн определяет такие свойства, как прочность, пластичность, плотность (описанная в следующих главах), проводимость (свойство проводить или передавать тепло, электричество и т. Д.).) и форма.
В общем, три наиболее распространенных основных кристаллических структуры, связанные с металлами: (а) объемно-центрированная кубическая, (б) гранецентрированная кубическая и (в) гексагональная плотноупакованная. На рисунке 2 показаны эти три шаблона.
Объемно-центрированный кубический
В объемно-центрированном кубическом (ОЦК) расположении атомов элементарная ячейка состоит из восьми атомов в углах куба и одного атома в центре тела куба.
Гранецентрированный кубик
В гранецентрированном кубическом (FCC) расположении атомов элементарная ячейка состоит из восьми атомов в углах куба и одного атома в центре каждой из граней куба. .
Гексагональная плотноупакованная
В гексагональной плотноупакованной структуре (HCP) элементарная ячейка состоит из трех слоев атомов. Верхний и нижний слои содержат шесть атомов в углах шестиугольника и по одному атому в центре каждого шестиугольника. Средний слой содержит три атома, расположенных между атомами верхнего и нижнего слоев, отсюда и название — плотно упакованные.
Рисунок 2: Общие типы решеток
Большинство диаграмм структурных ячеек для форм железа BCC и FCC нарисованы так, как если бы они были одного размера, как показано на рисунке 2, но это не так.В устройстве BCC структурная ячейка, которая использует только девять атомов, намного меньше.
Металлы, такие как α-железо (Fe) (феррит), хром (Cr), ванадий (V), молибден (Mo) и вольфрам (W), обладают ОЦК-структурой. Эти ОЦК-металлы обладают двумя общими свойствами: высокой прочностью и низкой пластичностью (что допускает остаточную деформацию). Металлы FCC, такие как γ-железо (Fe) (аустенит), алюминий (Al), медь (Cu), свинец (Pb), серебро (Ag), золото (Au), никель (Ni), платина (Pt) и торий (Th), как правило, имеет более низкую прочность и более высокую пластичность, чем металлы с ОЦК.Структуры HCP обнаружены в бериллии (Be), магнии (Mg), цинке (Zn), кадмие (Cd), кобальте (Co), таллии (Tl) и цирконии (Zr).
Если бы вы взяли небольшой кусок обычного металла и исследовали его под микроскопом, вы бы увидели структуру, аналогичную изображенной на рисунке 3 (а). Каждая из световых областей называется зерном или кристаллом, то есть областью пространства, занимаемой непрерывной кристаллической решеткой. Темные линии, окружающие зерна, — это границы зерен. Зернистая структура относится к расположению зерен в металле, причем зерно имеет определенную кристаллическую структуру.Граница зерна относится к внешней области зерна, которая отделяет его от других зерен.
Граница зерен представляет собой область несоответствия между зернами и обычно имеет ширину от одного до трех атомных диаметров. Границы зерен разделяют кристаллические области с различной ориентацией (поликристаллические), в которых кристаллическая структура идентична. Рисунок 3 (b) представляет четыре зерна разной ориентации и границы зерен, которые возникают на границах раздела между зернами.
Рисунок 3: Зерна и границы (а) Микроскопический (б) Атомный
Очень важной характеристикой металла является средний размер зерна.Размер зерна определяет свойства металла. Например, меньший размер зерна увеличивает прочность на разрыв и имеет тенденцию к увеличению пластичности. Для улучшения свойств ползучести при высоких температурах предпочтительно использовать зерна большего размера. Ползучесть — это остаточная деформация, которая увеличивается со временем при постоянной нагрузке или напряжении. С повышением температуры ползучесть становится все легче.
Еще одним важным свойством зерен является их ориентация. Рисунок 4 (а) представляет случайное расположение зерен, при котором ни одно направление внутри зерен не совпадает с внешними границами металлического образца.Эта случайная ориентация может быть получена путем поперечной прокатки материала. Если бы такой образец был достаточно прокатан в одном направлении, он мог бы развить структуру с ориентированными зернами в направлении прокатки, как показано на рисунке 4 (b). Это называется предпочтительной ориентацией. Во многих случаях предпочтительная ориентация очень желательна, но в других случаях она может быть очень вредной. Например, предпочтительная ориентация урановых тепловыделяющих элементов может привести к катастрофическим изменениям размеров во время использования в ядерном реакторе.
Рисунок 4: Ориентация зерен
(a) Случайно (b) Предпочтительно
Важная информация в этой главе резюмируется ниже.
Типы связей и их характеристики
- Ионная связь — Атом с одним или несколькими электронами полностью переносится от одного элемента к другому, и элементы удерживаются вместе силой притяжения из-за противоположной полярности заряжать.
- Ковалентная связь — Атом, которому нужны электроны для завершения своей внешней оболочки, делит эти электроны со своим соседом.
- Металлическая связь — Атомы не разделяют и не обмениваются электронами для связи друг с другом. Вместо этого многие электроны (примерно по одному на каждый атом) более или менее свободно перемещаются по металлу, так что каждый электрон может взаимодействовать со многими неподвижными атомами.
- Молекулярная связь — Когда нейтральные атомы претерпевают смещение центров своего заряда, они могут слабо притягивать другие атомы со смещенными зарядами. Иногда это называют облигацией Ван-дер-Ваальса.
- Водородная связь — Эта связь аналогична молекулярной связи и возникает из-за легкости, с которой атомы водорода замещают свой заряд.
Порядок в микроструктурах
- Аморфные микроструктуры не имеют четко определенных точек плавления и упорядоченного расположения частиц.
- Кристаллические микроструктуры расположены в трехмерных массивах, называемых решетками.
Типы решеток
- Кристаллическая структура состоит из атомов, расположенных по схеме, которая периодически повторяется в трехмерной геометрической решетке.
- Объемно-центрированная кубическая структура — это расположение атомов, в котором элементарная ячейка состоит из восьми атомов в углах куба и одного атома в центре тела куба.
- Гранецентрированная кубическая структура — это расположение атомов, в котором элементарная ячейка состоит из восьми атомов в углах куба и одного атома в центре каждой из шести граней куба.
- Гексагональная плотноупакованная структура — это структура атомов, в которой элементарная ячейка состоит из трех слоев атомов. Верхний и нижний слои содержат шесть атомов в углах шестиугольника и по одному атому в центре каждого шестиугольника. Средний слой состоит из трех атомов, расположенных между атомами верхнего и нижнего слоев.
- Металлы, содержащие ОЦК-структуры, включают феррит, хром, ванадий, молибден и вольфрам. Эти металлы обладают высокой прочностью и низкой пластичностью. Металлы, содержащие структуры FCC, включают аустенит, алюминий, медь, свинец, серебро, золото, никель, платину и торий. Эти металлы обладают низкой прочностью и высокой пластичностью.
- Металлы, содержащие структуры HCP, включают бериллий, магний, цинк, кадмий, кобальт, таллий и цирконий. Металлы HCP не так пластичны, как металлы FCC.
Зернистая структура и граница
- Зерно — это область пространства, занятая сплошной кристаллической решеткой.
- Зернистая структура — это расположение зерен в металле с зерном, имеющим определенную кристаллическую структуру.
- Граница зерна — это внешняя область зерна, которая отделяет его от других зерен.
- Ползучесть — это остаточная деформация, которая увеличивается со временем при постоянной нагрузке или напряжении.
- Малый размер зерна увеличивает прочность на разрыв и пластичность.
Полиморфизм — это свойство или способность металла существовать в двух или более кристаллических формах в зависимости от температуры и состава. Этим свойством обладает большинство металлов и металлических сплавов. Уран — хороший пример металла, проявляющего полиморфизм. Металлический уран может существовать в трех различных кристаллических структурах. Каждая структура существует в определенной фазе, как показано на рисунке 5.
Рисунок 5: Кривая охлаждения для нелегированного урана
1. Альфа-фаза, от комнатной температуры до 663 ° C
2.Бета-фаза от 663 ° C до 764 ° C
3. Гамма-фаза от 764 ° C до точки плавления 1133 ° C
Альфа-фаза
Альфа (α) фаза стабильна при комнатной температуре и имеет кристаллическую систему, характеризующуюся тремя неравными осями под прямым углом.
В альфа-фазе свойства решетки различаются по осям X, Y и Z. Это потому, что регулярное повторяющееся состояние атомов отличается. Из-за этого условия при нагревании фаза расширяется в направлениях X и Z и сжимается в направлении Y.На рисунке 6 показано, что происходит с размерами (Å = ангстрем, одна стомиллионная часть сантиметра) элементарной ячейки альфа-урана при нагревании.
Как показано, нагревание и охлаждение альфа-фазы урана может привести к резким изменениям размеров и большим деформациям металла. Таким образом, чистый уран используется не в качестве топлива, а только в сплавах или соединениях.
Рис. 6 Изменение альфа-урнана при нагревании от 0 до 300 ° C
Бета-фаза
Бета (β) -фаза урана возникает при повышенных температурах.Эта фаза имеет тетрагональную (имеющую четыре угла и четыре стороны) структуру решетки и является довольно сложной.
Гамма-фаза
Гамма (γ) фаза урана образуется при температурах, превышающих температуры, необходимые для стабильности бета-фазы. В гамма-фазе структура решетки является ОЦК и при нагревании расширяется одинаково во всех направлениях.
Дополнительные примеры
Два дополнительных примера полиморфизма перечислены ниже.
1. Нагревание чугуна до 907 ° C вызывает переход железа с BCC (альфа, феррит) в форму FCC (гамма, аустенит).
2. Цирконий является HCP (альфа) до 863 ° C, где он переходит в форму BCC (бета, цирконий).
Свойства одной полиморфной формы одного и того же металла будут отличаться от свойств другой полиморфной формы. Например, гамма-железо может растворять до 1,7% углерода, тогда как альфа-железо может растворять только 0,03%.
Сплавы
Сплав представляет собой смесь двух или более материалов, по крайней мере, один из которых является металлом. Сплавы могут иметь микроструктуру, состоящую из твердых растворов, где вторичные атомы вводятся в качестве замещающих или межузельных атомов в кристаллическую решетку.Сплав также может быть кристаллом с металлическим соединением в каждой точке решетки. Кроме того, сплавы могут состоять из вторичных кристаллов, встроенных в первичную поликристаллическую матрицу. Этот тип сплава называется композитным (хотя термин «композит» не обязательно означает, что материалы компонентов являются металлами).
Общие характеристики сплавов
Сплавы обычно прочнее чистых металлов, хотя обычно они обладают пониженной электрической и теплопроводностью.Прочность — важнейший критерий, по которому судят о многих конструкционных материалах. Поэтому сплавы используются для инженерного строительства. Сталь, вероятно, самый распространенный конструкционный металл, является хорошим примером сплава. Это сплав железа и углерода с другими элементами, придающими ему определенные желаемые свойства.
Как упоминалось в предыдущей главе, иногда материал может состоять из нескольких твердых фаз. Прочность этих материалов повышается за счет превращения твердой структуры в форму, состоящую из двух чередующихся фаз.Когда рассматриваемый материал представляет собой сплав, можно закалить металл из расплавленного состояния с образованием вкрапленных фаз. Тип и скорость закалки определяют окончательную структуру твердого тела и, следовательно, его свойства.
Нержавеющая сталь типа 304
Нержавеющая сталь типа 304 (содержащая 18-20% хрома и 8-10,5% никеля) используется в баках реакторов для производства трития, трубопроводах технологической воды и исходных технологических теплообменниках. Этот сплав устойчив к большинству видов коррозии.
Состав общих технических материалов
Широкий спектр конструкций, систем и компонентов, используемых в общей промышленности, изготовлен из самых разных материалов. Многие материалы представляют собой сплавы с основным металлом — железом, никелем или цирконием. Выбор материала для конкретного применения основан на многих факторах, включая температуру и давление, которым будет подвергаться материал, устойчивость материалов к определенным типам коррозии, ударную вязкость и твердость материалов, а также другие свойства материала.
Нержавеющая сталь широко используется в различных системах. Существует около 40 стандартных типов нержавеющей стали и множество других специализированных типов под различными торговыми наименованиями. Изменяя виды и количество легирующих элементов, сталь можно адаптировать к конкретным применениям. Нержавеющие стали классифицируются как аустенитные или ферритные в зависимости от структуры их решетки. Аустенитные нержавеющие стали, включая 304 и 316, имеют гранецентрированную кубическую структуру атомов железа с углеродом в твердом растворе внедрения.Ферритные нержавеющие стали, включая тип 405, имеют объемно-центрированную кубическую решетку железа и не содержат никель. Ферритные стали легче сваривать и изготавливать, и они менее подвержены коррозионному растрескиванию под напряжением, чем аустенитные нержавеющие стали. Они обладают умеренной устойчивостью к другим видам химического воздействия.
Другими металлами, которые могут использоваться в некоторых критических областях, являются инконель и циркалой. Состав этих металлов и различных типов нержавеющей стали приведен в Таблице 2 ниже.
Таблица 2: Типичный состав стандартных технических материалов
[HR] Микроскопические дефекты
Микроскопические дефекты обычно классифицируются как точечные, линейные или межфазные дефекты.
1. Точечные дефекты имеют атомные размеры.
2. Линейные дефекты или дислокации обычно имеют длину в несколько атомов.
3. Межфазные дефекты больше линейных дефектов и возникают на двумерной площади.
Точечные дефекты
Точечные дефекты кристаллов можно разделить на три основные категории дефектов.Они проиллюстрированы на рисунке 7.
1. Вакансионные дефекты возникают из-за отсутствия атома в позиции решетки. Дефект вакансионного типа может возникать из-за несовершенной упаковки во время процесса кристаллизации или из-за повышенных тепловых колебаний атомов, вызванных повышенной температурой.
2. Дефекты замещения возникают из-за примеси, присутствующей в позиции решетки.
3. Межузельные дефекты возникают из-за того, что примесь, расположенная в межузельном узле, или один из атомов решетки находится в межузельном положении, а не в его решеточной позиции.Промежуточное положение относится к местоположениям между атомами в структуре решетки.
Примеси внедрения, называемые модификаторами сетки, действуют как точечные дефекты в аморфных твердых телах. Наличие точечных дефектов может повысить или снизить ценность материала для инженерного строительства в зависимости от предполагаемого использования.
Рисунок 7: Точечные дефекты
Линейные дефекты
Рисунок 8: Линейные дефекты (дислокации)
Линейные дефекты называются дислокациями и возникают только в кристаллических материалах.Дислокации могут быть краевыми, винтовыми или смешанными, в зависимости от того, как они искажают решетку, как показано на рисунке 8. Важно отметить, что дислокации не могут заканчиваться внутри кристалла. Они должны заканчиваться краем кристалла или другой дислокацией, или они должны замыкаться сами на себя.
Краевые дислокации представляют собой дополнительный ряд или плоскость атомов в кристаллической структуре. Дефект может проходить по прямой линии на всем протяжении кристалла или по неправильной траектории.Он также может быть коротким, простираясь только на небольшое расстояние в кристалл, вызывая скольжение на одно атомное расстояние вдоль плоскости скольжения (направление движения краевого дефекта).
Скольжение происходит, когда кристалл подвергается напряжению, и дислокация движется через кристалл, пока не достигнет края или не будет остановлена другой дислокацией, как показано на рисунке 9. Позиция 1 показывает нормальную кристаллическую структуру. Положение 2 показывает силу, приложенную с левой стороны, и противодействующую силу, приложенную с правой стороны.Позиции с 3 по 5 показывают, как конструкция скользит. Позиция 6 показывает окончательно деформированную кристаллическую структуру. Скольжение одной активной плоскости обычно составляет порядка 1000 атомных расстояний, и для получения податливости требуется проскальзывание во многих плоскостях.
Винтовые дислокации могут быть образованы разрывом кристалла параллельно направлению скольжения. Если винтовая дислокация прослеживается на всем протяжении всей цепи, это покажет картину проскальзывания, аналогичную картине винтовой резьбы. Рисунок может быть левым или правым.Для этого необходимо, чтобы некоторые из атомных связей постоянно переформировывались, так что кристалл после получения имеет почти такую же форму, что и раньше.
Рисунок 9: Скольжения
Ориентация дислокаций может варьироваться от чистого края до чистого винта. В какой-то промежуточный момент они могут обладать характеристиками как кромки, так и винта. Важность дислокаций основана на легкости, с которой они могут перемещаться через кристаллы.
Дефекты интерфейса
Дефекты интерфейса существуют под углом между любыми двумя гранями кристалла или кристаллической формы.Эти дефекты обнаруживаются на свободных поверхностях, границах доменов, границах зерен или межфазных границах. Свободные поверхности — это границы раздела между газами и твердыми телами. Границы домена относятся к интерфейсам, где электронные структуры различны с обеих сторон, заставляя каждую сторону действовать по-разному, хотя с обеих сторон существует одинаковое атомное расположение. Границы зерен существуют между кристаллами с одинаковой структурой решетки, которые имеют разную пространственную ориентацию. Поликристаллические материалы состоят из множества зерен, разделенных расстоянием, обычно равным нескольким атомным диаметрам.Наконец, межфазные границы существуют между областями, где материалы существуют в разных фазах (то есть, ОЦК рядом со структурами ГЦК).
Макроскопические дефекты
Трехмерные макроскопические дефекты называются объемными дефектами. Обычно они возникают в гораздо большем масштабе, чем микроскопические дефекты. Эти макроскопические дефекты обычно появляются в материале во время очистки от его необработанного состояния или в процессе изготовления.
Самый распространенный дефект в объеме возникает из-за попадания инородных частиц в основной материал.Эти частицы второй фазы, называемые включениями, редко используются, поскольку они значительно изменяют структурные свойства. Примером включения могут быть частицы оксида в чистом металле или кусочек глины в структуре стекла.
К другим объемным дефектам относятся газовые карманы или усадочные полости, обычно встречающиеся в отливках. Эти промежутки ослабляют материал и, следовательно, защищены от них во время изготовления. Обработка и ковка металлов могут вызвать трещины, которые действуют как концентраторы напряжений и ослабляют материал.Любые дефекты сварки или соединения также могут быть классифицированы как объемные дефекты.
Важная информация в этой главе кратко изложена ниже.
Полиморфизм
- Полиморфизм — это свойство или способность металла существовать в двух или более кристаллических формах в зависимости от температуры и состава.
- Металл может существовать в трех фазах или кристаллических структурах.
- Фазы металлического урана:
- Альфа — от комнатной температуры до 663 ° C
- Бета — от 663 ° C до 764 ° C
- Гамма — от 764 ° C до 1133 ° C
- Альфа-фаза предотвращает образование чистого урана используется в качестве топлива из-за свойств расширения.
Сплавы
- Сплав представляет собой смесь двух или более материалов, по крайней мере, один из которых является металлом.
- Микроструктуры сплавов
- Твердые растворы, в которых вторичные атомы введены в качестве замещающих или межузельных атомов в кристаллическую решетку.
- Кристалл с металлическими связями
- Композиты, в которых вторичные кристаллы встроены в первичную поликристаллическую матрицу.
- Сплавы обычно прочнее чистых металлов, хотя сплавы обычно имеют меньшую электрическую и теплопроводность, чем чистые металлы.
- Двумя желательными свойствами нержавеющей стали типа 304 являются коррозионная стойкость и высокая прочность.
Микроскопические дефекты
- Точечные дефекты находятся в диапазоне размеров отдельных атомов.
- Линейные (дислокационные) дефекты обычно имеют длину в несколько атомов. Неровности линий могут быть краевыми, винтовыми или смешанными, в зависимости от искажения решетки. Недостатки линий не могут заканчиваться внутри кристалла; они должны заканчиваться на краю кристалла или другой дислокации или закрываться сами собой.
- Межфазные дефекты больше, чем дефекты линий, и возникают на двумерной области. Межфазные дефекты существуют на свободных поверхностях, границах доменов, границах зерен или межфазных границах.
- Скольжение возникает, когда кристалл подвергается напряжению, и дислокации проходят через кристалл, пока не достигнут края или не будут остановлены другой дислокацией.
Макроскопические дефекты
- Объемные дефекты — это трехмерные дефекты.
- Инородные частицы, входящие в состав первичного материала (включения), являются наиболее частым дефектом в объеме
- Газовые карманы
- Усадочные полости
- Дефекты сварки или соединения
Определение напряжения
Когда металл подвергается нагрузке ( сила), он искажается или деформируется, независимо от того, насколько прочен металл или легкая нагрузка. Если нагрузка небольшая, искажение, вероятно, исчезнет при снятии нагрузки
. Интенсивность или степень искажения называется напряжением.Если деформация исчезает и металл возвращается к своим первоначальным размерам после снятия нагрузки, деформация
называется упругой деформацией. Если деформация исчезает, а металл остается деформированным, тип деформации называется пластической деформацией. Подробнее о штамме мы поговорим в следующей главе.
Когда к металлу прилагается нагрузка, сама атомная структура деформируется, сжимается, деформируется или растягивается в процессе. Атомы, составляющие металл, расположены в определенном геометрическом узоре
, специфичном для этого конкретного металла или сплава, и поддерживаются в этом узоре за счет межатомных сил.При таком расположении атомы находятся в состоянии минимальной энергии, и
стремятся оставаться в этом состоянии. Над металлом нужно работать (то есть нужно добавлять энергию), чтобы исказить атомный узор. (Работа равна силе, умноженной на расстояние, на которое перемещается сила
.)
Напряжение — это внутреннее сопротивление или противодействие материала искажающим эффектам внешней силы или нагрузки. Эти противодействующие силы стремятся вернуть атомы в их нормальное положение.
Полное развиваемое сопротивление равно внешней нагрузке.Это сопротивление известно как стресс.
Хотя невозможно измерить интенсивность этого напряжения, можно измерить внешнюю нагрузку и площадь
, к которой она приложена. Напряжение (я) можно приравнять к нагрузке на единицу площади или силе (F), приложенной к площади поперечного сечения (A) перпендикулярно силе, как показано в уравнении
(2-1).
Напряжение = σ = F / A (2-1)
где:
s = напряжение (фунты на кв. Дюйм или фунты силы на дюйм 2)
F = приложенная сила (фунты силы на дюйм 2)2)
A = площадь поперечного сечения (дюйм 2)
Типы напряжений
Напряжения возникают в любом материале, который подвергается нагрузке или приложенной силе. Существует много типов напряжений, но все они могут быть классифицированы по одной из шести категорий: остаточные напряжения
, структурные напряжения, напряжения давления, напряжения течения, термические напряжения и усталостные напряжения.
Остаточное напряжение
Остаточное напряжение возникает из-за производственных процессов, которые создают напряжения в материале.Сварка оставляет в свариваемых металлах остаточные напряжения. Напряжения, связанные со сваркой, обсуждаются далее в этом модуле.
Структурное напряжение
Структурные напряжения — это напряжения, возникающие в элементах конструкции из-за веса, который они поддерживают. Вес обеспечивает нагрузки. Эти напряжения обнаруживаются в фундаментах и каркасах зданий, а также в деталях машин.
Напряжения давления
Напряжения давления — это напряжения, возникающие в сосудах, содержащих материалы под давлением.Нагрузка обеспечивается той же силой, что и давление.
Напряжения потока
Напряжения потока возникают, когда масса текущей жидкости вызывает динамическое давление на стенку трубы. Сила удара жидкости о стену действует как нагрузка. Этот тип напряжения может проявляться неустойчиво при колебаниях расхода. Гидравлический удар является примером переходного напряжения течения.
Термические напряжения
Термические напряжения существуют всякий раз, когда в материале присутствуют градиенты температуры.Разные температуры вызывают разное расширение и подвергают материалы внутреннему напряжению. Этот тип напряжения особенно заметен в механизмах, работающих при высоких температурах и охлаждаемых холодной жидкостью.
Усталостные напряжения
Усталостные напряжения возникают из-за циклического приложения напряжения. Напряжения могут быть вызваны вибрацией или термоциклированием.
Важность всех напряжений возрастает, когда поддерживающие их материалы имеют дефекты. Дефекты, как правило, добавляют материалу дополнительную нагрузку.Кроме того, когда нагрузки циклические или нестационарные, напряжения могут сильнее влиять на материал. Дополнительные напряжения, связанные с дефектами и циклическими нагрузками, могут превышать напряжение, необходимое для разрушения материала.
Типы приложенного напряжения
Интенсивность напряжения в теле компонента выражается как один из трех основных типов внутренней нагрузки. Они известны как растяжение, сжатие и сдвиг. На рисунке 1 показаны различные типы стресса. Математически существует только два типа внутренней нагрузки, поскольку растягивающее и сжимающее напряжение можно рассматривать как положительную и отрицательную версии одного и того же типа нормальной нагрузки.
Однако в механической конструкции реакция компонентов на два условия может быть настолько различной, что лучше и безопаснее рассматривать их как отдельные типы.
Как показано на рисунке 1, плоскость растягивающего или сжимающего напряжения лежит перпендикулярно оси действия силы, от которой оно исходит. Плоскость касательного напряжения лежит в плоскости силовой системы, из которой оно исходит. Важно, чтобы эти различия
были достаточно ясными как в уме, так и в способах выражения.
Рисунок 10: Типы приложенного напряжения
Растягивающее напряжение
Растягивающее напряжение — это тип напряжения, при котором два участка материала по обе стороны от плоскости напряжения имеют тенденцию разъединяться или удлиняться, как показано на рисунке 1 (а) .
Напряжение сжатия
Напряжение сжатия является обратным напряжению растяжения. Соседние части материала имеют тенденцию давить друг на друга через типичную плоскость напряжения, как показано на рисунке 1 (b).
Напряжение сдвига
Напряжение сдвига существует, когда две части материала имеют тенденцию скользить друг по другу в любой типичной плоскости сдвига при приложении силы, параллельной этой плоскости, как показано на Рисунке 1 (c).
Оценка механических свойств производится по трем основным типам напряжений. Поскольку растягивающие и сжимающие нагрузки создают напряжения, действующие поперек плоскости, в направлении, перпендикулярном (нормальном) к плоскости, растягивающие и сжимающие напряжения называются нормальными напряжениями. Сокращенные обозначения следующие.
Для растягивающих напряжений: «+ S N » (или «S N ») или «σ» (сигма)
Для сжимающих напряжений: «-S N » или «-σ» (минус сигма)
Способность материала реагировать на сжимающее напряжение или давление называется сжимаемостью .Например, металлы и жидкости несжимаемы, а газы и пары сжимаемы. Напряжение сдвига равно силе, деленной на площадь поверхности, параллельную направлению, в котором действует сила, как показано на рисунке 1 (c).
Два типа напряжения могут присутствовать одновременно в одной плоскости, при условии, что одно из напряжений является напряжением сдвига. При определенных условиях в материале могут одновременно присутствовать различные комбинации основных типов напряжений. Примером может служить корпус реактора во время работы.Стена испытывает растягивающее напряжение в различных местах из-за температуры и давления жидкости, действующей на стену. Напряжение сжатия прикладывается снаружи к другим участкам стены из-за внешнего давления, температуры и сжатия опор, связанных с резервуаром. В этой ситуации растягивающие и сжимающие напряжения считаются главными напряжениями. Если присутствует, напряжение сдвига будет действовать под углом 90 ° к главному напряжению.
Деформация
Определение деформации
При использовании металла в машиностроении определенное состояние напряжения обычно существует в значительном объеме материала.Реакция атомной структуры проявится в макроскопическом масштабе. Следовательно, всякий раз, когда к металлу прикладывается напряжение (независимо от того, насколько оно маленькое), должно происходить пропорциональное изменение размеров или искажение.
Такое пропорциональное изменение размеров (интенсивность или степень деформации) называется деформацией и измеряется как общее удлинение на единицу длины материала из-за некоторого приложенного напряжения. Уравнение 2-2 иллюстрирует эту пропорцию или искажение.
Деформация = ε = δ / L (2-2)
где:
ε = деформация (дюйм./ дюйм)
δ = общее удлинение (дюйм)
L = исходная длина (дюйм)
Типы деформации
Деформация может иметь две формы; упругая деформация и пластическая деформация.
Упругая деформация
Упругая деформация — это временное изменение размеров, которое существует только при приложении исходного напряжения и исчезает сразу после снятия напряжения. Упругая деформация также называется упругой деформацией. Приложенные напряжения заставляют атомы в кристалле перемещаться из положения равновесия.Все атомы смещаются на одинаковую величину и по-прежнему сохраняют свою относительную геометрию. Когда напряжения снимаются, все атомы возвращаются в исходное положение, и остаточная деформация не происходит.
Пластическая деформация
Пластическая деформация (или пластическая деформация) — это изменение размеров, которое не исчезает при снятии инициирующего напряжения. Обычно это сопровождается некоторой упругой деформацией.
Явление упругой деформации и пластической деформации в материале называется упругостью и пластичностью соответственно.
При комнатной температуре большинство металлов обладают некоторой эластичностью, которая проявляется при малейшем напряжении. Обычно они также обладают некоторой пластичностью, но это может не проявиться до тех пор, пока напряжение не будет заметно увеличено. Величина пластической деформации, когда она действительно возникает, вероятно, будет намного больше, чем величина упругой деформации для данного приращения напряжения. Металлы, вероятно, будут демонстрировать меньшую эластичность и большую пластичность при повышенных температурах. Некоторые чистые нелегированные металлы (особенно алюминий, медь и золото) демонстрируют небольшую эластичность, если она вообще имеется, при напряжении в отожженном (нагретом и затем медленно охлажденном для предотвращения хрупкости) состоянии при комнатной температуре, но действительно демонстрируют заметную пластичность.Некоторые нелегированные металлы и многие сплавы обладают заметной эластичностью при комнатной температуре, но не пластичностью.
Напряженное состояние непосредственно перед началом проявления пластической деформации известно как предел пропорциональности или предел упругости и определяется уровнем напряжения и соответствующим значением упругой деформации. Предел пропорциональности выражается в фунтах на квадратный дюйм. Для интенсивностей нагрузки, превышающих предел пропорциональности, деформация состоит как из упругих, так и из пластических деформаций.
Как упоминалось ранее в этой главе, деформация измеряет пропорциональное изменение размеров без приложения нагрузки.Такие значения деформации легко определяются и перестают быть достаточно точными только тогда, когда пластическая деформация становится доминирующей.
Когда металл подвергается деформации, его объем остается постоянным. Следовательно, если объем остается постоянным при изменении размера на одной оси, тогда размеры по крайней мере еще одной оси должны измениться. Если одно измерение увеличивается, другое должно уменьшаться. Есть несколько исключений. Например, деформационное упрочнение включает поглощение энергии деформации в структуре материала, что приводит к увеличению в одном измерении без смещения уменьшения в других измерениях.Это приводит к уменьшению плотности материала и увеличению объема.
Если к материалу приложена растягивающая нагрузка, материал будет вытягиваться по оси нагрузки (перпендикулярно плоскости растягивающего напряжения), как показано на Рисунке 2 (а). И наоборот, если нагрузка сжимающая, осевой размер уменьшится, как показано на рисунке 2 (b). Если объем постоянный, должно произойти соответствующее поперечное сжатие или расширение. Это поперечное изменение будет иметь постоянную связь с осевой деформацией.Отношение или отношение поперечной деформации к осевой называется коэффициентом Пуассона по имени его первооткрывателя. Обычно обозначается буквой ν.
Деформация кубических структур
Может ли материал пластически деформироваться при низких приложенных напряжениях, зависит от его структуры решетки. Плоскостям атомов легче скользить друг по другу, если эти плоскости плотно упакованы. Поэтому решетчатые структуры с плотноупакованными плоскостями допускают большую пластическую деформацию, чем неупакованные.Кроме того, структуры кубической решетки позволяют легче проскальзывать, чем некубические решетки. Это происходит из-за их симметрии, которая обеспечивает плотную упаковку плоскостей в нескольких направлениях. Большинство металлов состоит из объемно-центрированных кубических (ОЦК), гранецентрированных кубических (ГЦК) или гексагональных плотноупакованных (ГПУ) кристаллов, которые более подробно обсуждаются в Модуле 1, Структура металлов. Кубическая гранецентрированная кристаллическая структура будет легче деформироваться под нагрузкой перед разрушением, чем объемно-центрированная кубическая структура.
ОЦК-решетка хоть и кубическая, но не плотно упакована и образует прочные металлы. α-железо и вольфрам имеют форму ОЦК. Решетка FCC имеет кубическую форму, плотно упакована и образует более пластичные материалы. γ-железо, серебро, золото и свинец имеют структуру FCC. Наконец, решетки ГПУ плотно упакованы, но не кубические. Металлы HCP, такие как кобальт и цинк, не так пластичны, как металлы FCC.
Рис. 11: Изменение формы цилиндра под нагрузкой
Важная информация в этой главе кратко изложена ниже.
- Напряжение — это внутреннее сопротивление материала искажающим воздействиям внешней силы или нагрузки.
Напряжение = σ = F / A
- Три типа напряжения
- Растягивающее напряжение — это тип напряжения, при котором два участка материала по обе стороны от плоскости напряжения имеют тенденцию разъединяться или удлиняться.
- Напряжение сжатия противоположно растягивающему. Соседние части материала имеют тенденцию прижиматься друг к другу.
- Напряжение сдвига возникает, когда две части материала имеют тенденцию скользить друг по другу при приложении силы, параллельной этой плоскости.
- Сжимаемость — это способность материала реагировать на сжимающее напряжение или давление.
- Деформация — это пропорциональное изменение размеров, или интенсивность, или степень деформации материала, находящегося под напряжением.
Деформация = ε = δ / L
- Пластическая деформация — это изменение размеров, которое не исчезает при снятии инициирующего напряжения.
- Пропорциональный предел — это величина напряжения непосредственно перед точкой (порогом), в которой начинает появляться пластическая деформация, или уровень напряжения и соответствующее значение упругой деформации.
- Два типа деформации:
- Упругая деформация — это временное изменение размеров, которое существует только при приложении исходного напряжения и исчезает сразу после снятия напряжения.
- Пластическая деформация (пластическая деформация) — это изменение размеров, которое не исчезает при снятии инициирующего напряжения.
- Гранецентрированные кубические кристаллические структуры γ-железа легче деформируются под нагрузкой перед разрушением, чем объемноцентрированные кубические структуры α-железа.
Закон Хука
Если металл находится под небольшим напряжением, имеет место временная деформация, предположительно разрешенная упругим смещением атомов в пространственной решетке. Снятие напряжения приводит к постепенному возвращению металлу первоначальной формы и размеров. В 1678 году английский ученый Роберт Гук провел эксперименты, в ходе которых были получены данные, которые показали, что в диапазоне упругости материала деформация пропорциональна напряжению. Удлинение стержня прямо пропорционально растягивающей силе и длине стержня и обратно пропорционально площади поперечного сечения и модулю упругости.
Экспериментальный закон Гука может быть задан уравнением (2-3).
δ = P l / A E (2-3)
Эта простая линейная зависимость между силой (напряжением) и удлинением (деформацией) была сформулирована с использованием следующих обозначений.
P = усилие, создаваемое удлинением стержня (фунт-сила)
l = длина стержня (дюймы)
A = площадь поперечного сечения стержня (дюймы 2)
δ = общее удлинение стержня (дюймы)
E = постоянная упругости материала, называемая модулем упругости или модулем Юнга (фунт-сила / дюйм. 2 )
Величина E, отношение единичного напряжения к единичной деформации, представляет собой модуль упругости материала при растяжении или сжатии и часто называется модулем Юнга.
Ранее мы узнали, что растягивающее напряжение или просто напряжение приравнивается к нагрузке на единицу площади или силе, приложенной к площади поперечного сечения, перпендикулярной силе, измеренной в фунтах-силах на квадратный дюйм.
σ = P / A (2-4)
Мы также узнали, что деформация при растяжении или удлинение стержня на единицу длины определяется следующим образом:
ε = δ / l (2-5)
Таким образом , условия описанного выше эксперимента адекватно выражаются законом Гука для упругих материалов.Для материалов при растяжении деформация (ε) пропорциональна приложенному напряжению σ.
ε = σ / E (2-6)
, где
E = модуль Юнга (фунт-сила / дюйм 2 )
σ = напряжение (фунт / кв. Дюйм)
ε = деформация (дюйм / дюйм)
Модуль Юнга (модуль упругости)
Модуль Юнга (иногда называемый модулем упругости, что означает «мера» упругости) является чрезвычайно важной характеристикой материала. Это численная оценка закона Гука, а именно отношения напряжения к деформации (мера сопротивления упругой деформации).Для расчета модуля Юнга напряжение (в любой точке) ниже пропорционального предела делится на соответствующую деформацию. Его также можно рассчитать как наклон прямолинейного участка кривой напряжения-деформации. (Расположение на кривой напряжение-деформация будет обсуждаться позже.)
E = Модуль упругости = напряжение / деформация = фунт / кв. Дюйм. Дюйм = фунт / кв. Дюйм
или
E = σ / ε (2-7)
Теперь мы видим, что модуль Юнга можно легко рассчитать при условии, что напряжение и соответствующее удлинение или деформация единицы были определены с помощью испытания на растяжение, как описано ранее.Деформация (ε) — это число, представляющее отношение двух длин; следовательно, мы можем сделать вывод, что модуль Юнга измеряется в тех же единицах, что и напряжение (σ), то есть в фунтах на квадратный дюйм. В таблице 1 приведены средние значения модуля упругости E для нескольких металлов, используемых в промышленности. Предел текучести и предел прочности будут обсуждаться более подробно в следующем разделе ниже.
Таблица 1: Свойства обычных конструкционных материалов Пример:
Каково удлинение 200 дюймов алюминиевой проволоки с 0.01 квадратный дюйм площади, если он выдерживает вес 100 фунтов?
Решение:
δ = Pl / AE (2-8)
= (100 фунтов) (200 дюймов) / (0,01 дюйма 2 ) (1,0 x 10 7 фунтов / дюйм 2 )
δ = 0,2 дюйма
Модули упругости
Модули упругости , относящиеся к поликристаллическому материалу, — это модуль упругости Юнга, модуль упругости при сдвиге и объемный модуль упругости.
Модуль упругости
Модуль упругости Юнга — это модуль упругости для напряжения при растяжении и сжатии, который обычно оценивается с помощью испытаний на растяжение.Модуль упругости Юнга подробно обсуждается выше.
Модуль упругости при сдвиге
Модуль упругости при сдвиге получен при кручении цилиндрического испытательного образца. Его символ — G.
Объемный модуль
Объемный модуль упругости — это упругая реакция на гидростатическое давление и равностороннее растяжение или объемная реакция на гидростатическое давление и равностороннее растяжение. Это также свойство материала, которое определяет упругую реакцию на приложение напряжения.
Испытания на растяжение (нагрузку) и кривые растяжения
Для определения несущей способности и величины деформации перед разрушением образец материала обычно испытывают с помощью теста на растяжение . Это испытание заключается в приложении постепенно увеличивающейся силы натяжения на одном конце отрезка материала. Другой конец закрепляется на жесткой опоре, так что образец медленно разрывается. Испытательная машина оснащена устройством для индикации и, возможно, записи величины силы на протяжении всего испытания.Одновременно производятся измерения увеличивающейся длины выбранного участка в середине образца, называемого измерительной длиной. Измерения нагрузки и удлинения обычно прекращают вскоре после начала пластической деформации; однако всегда записывается достигнутая максимальная нагрузка. Точка разрушения — это точка разрушения материала из-за пластической деформации. После того, как образец был разорван и извлечен из машины, сломанные концы соединяют вместе, и производятся измерения теперь увеличенной измерительной длины и среднего диаметра минимального поперечного сечения.Средний диаметр минимального поперечного сечения измеряется только в том случае, если используемый образец является цилиндрическим.
Табличные результаты в конце теста состоят из следующего.
а. обозначение испытуемого материала
б. исходные размеры поперечного сечения образца в пределах измерительной длины
c. исходная калибровочная длина
д. серия частых считываний, определяющих нагрузку и соответствующий размер измерительной длины
e. конечный средний диаметр минимального сечения
ф.конечная длина колеи
г. описание внешнего вида поверхностей излома (например, чашка-конус, волчье ухо, диагональ, начало)
График результатов строится на основе табличных данных. Некоторые испытательные машины оснащены приставкой для автографов, которая рисует график во время теста. (Оператору не нужно записывать какие-либо показания нагрузки или удлинения, кроме максимума для каждого из них.) Оси координат на графике представляют собой деформацию для оси x или шкалу абсцисс и напряжение для оси y или шкалу ординат.Ордината для каждой точки, нанесенной на график, находится путем деления каждой из табличных нагрузок на исходную площадь поперечного сечения образца; соответствующая абсцисса каждой точки находится путем деления увеличения измерительной длины на исходную измерительную длину. Эти два расчета производятся следующим образом.
Напряжение = нагрузка / площадь исходного поперечного сечения = P / A
o = фунт / кв. Дюйм или фунт / дюйм 2 (2-9)
Деформация = (мгновенная расчетная длина — исходная) / исходная расчетная длина = удлинение / исходная расчетная длина (2-10)
= (L — L
o) / L o = дюймы на дюйм x 100 = удлинение в процентах (2-11)
Рассчитанные здесь напряжения и деформации иногда являются называется «инженерное напряжение и деформация».«Они не являются истинными напряжениями и деформациями, которые можно вычислить на основе площади и расчетной длины, которые существуют
для каждого приращения нагрузки и деформации. Например, истинная деформация — это натуральный логарифм удлинения (ln (L / Lo)), а истинное напряжение — это P / A, где A — площадь. Последние значения обычно используются для научных исследований, но инженерные значения полезны для определения значений несущей способности материала. Ниже предела упругости инженерное напряжение и истинное напряжение практически идентичны.
Графические результаты, или диаграмма «напряжение-деформация», типичного испытания на растяжение для конструкционной стали показаны на рисунке 3. Отношение напряжения к деформации или градиент графика «напряжение-деформация» называется модулем упругости или Модуль упругости. Наклон части кривой, где напряжение пропорционально деформации (между точками 1 и 2), называется модулем Юнга, и применяется закон Гука.
Следующие наблюдения проиллюстрированы на рисунке 3: Рисунок 3: Типичная кривая напряжения-деформации пластичного материала
Закон Гука применяется между точками 1 и 2.
Закон Гука становится спорным между пунктами 2 и 3, и напряжение увеличивается быстрее.
Область между точками 1 и 2 называется эластичной областью. Если снять напряжение, материал вернется к своей исходной длине.
Точка 2 — это предел пропорциональности (PL) или предел упругости, а точка 3 — это предел текучести (YS) или предел текучести.
Область между точками 2 и 5 известна как пластиковая область, потому что материал не вернется к своей исходной длине.
Точка 4 — это точка предела прочности, а точка 5 — точка разрушения, в которой происходит разрушение материала.
На рис. 3 представлена кривая напряжения-деформации, типичная для пластичного материала, где прочность мала, а пластическая область велика. Материал будет выдерживать большее напряжение (деформацию) перед разрушением.
На рис. 4 представлена кривая напряжения-деформации, типичная для хрупкого материала, где пластическая область мала, а прочность материала высока.
Рис. 4: Типичная кривая напряжения-деформации хрупкого материала
Испытание на растяжение предоставляет три описательных факта о материале.Это напряжение, при котором начинается наблюдаемая пластическая деформация или «податливость»; предел прочности при растяжении или максимальная интенсивность нагрузки, которую можно нести при растяжении; и относительное удлинение или деформация (степень растяжения материала) и соответствующее процентное уменьшение площади поперечного сечения, вызванное растяжением. Также можно определить точку разрыва или перелома.
Важная информация в этой главе кратко изложена ниже.
- Закон Гука гласит, что в диапазоне упругости материала деформация пропорциональна напряжению.Он измеряется с помощью следующего уравнения:
δ = Pl / AE
- Модуль Юнга (модуль упругости) — это отношение напряжения к деформации или градиент графика «напряжение-деформация». Он измеряется с помощью следующего уравнения:
E = σ / ε
Объемный модуль упругости
- Объемный модуль упругости — это упругая реакция на гидростатическое давление и равностороннее растяжение или объемная реакция на гидростатическое давление и равностороннее растяжение.Это также свойство материала, которое определяет упругую реакцию на приложение напряжения.
- Точка разрушения — это точка разрушения материала из-за пластической деформации.
- Пластичный материал деформируется (удлиняется) больше, чем хрупкий материал, как показано на рисунках в тексте. Кривые напряжения-деформации, обсуждаемые в этой главе для пластичных и хрупких материалов, продемонстрировали, как каждый материал будет реагировать на напряжение и деформацию.
- На рисунках 3 и 4 показаны конкретные точки для пластичного и хрупкого материала соответственно.Закон Гука применяется между точками 1 и 2. Область упругости находится между точками 1 и 2. Область пластичности находится между точками 2 и 5.
Прочность
Прочность — это способность материала сопротивляться деформации. Прочность компонента обычно определяется исходя из максимальной нагрузки, которую можно выдержать до того, как разрушение станет очевидным. Если при простом растяжении остаточная деформация (пластическая деформация), которая имеет место в компоненте до разрушения, несущая способность в момент окончательного разрыва, вероятно, будет меньше максимальной нагрузки, поддерживаемой при более низкой деформации, поскольку нагрузка наносится на значительно меньшую площадь поперечного сечения.При простом сжатии нагрузка при разрыве будет максимальной, применимой на значительно увеличенной площади по сравнению с площадью поперечного сечения без нагрузки.
Эту неясность можно преодолеть, используя номинальное значение напряжения для растяжения и сдвига. Это определяется путем деления соответствующей максимальной нагрузки на исходную площадь поперечного сечения компонента. Таким образом, прочность материала — это максимальное номинальное напряжение, которое он может выдержать. Номинальное напряжение упоминается при цитировании «прочности» материала и всегда определяется типом напряжения, например пределом прочности на растяжение, пределом прочности при сжатии или пределом прочности на сдвиг.
Для большинства конструкционных материалов трудность определения прочности на сжатие может быть преодолена путем замены значения прочности на сжатие значением прочности на разрыв. Эта замена является безопасным предположением, поскольку номинальная прочность на сжатие всегда больше номинальной прочности на разрыв, поскольку эффективное поперечное сечение увеличивается при сжатии и уменьшается при растяжении.
Когда к металлу прикладывается сила, слои атомов внутри кристаллической структуры перемещаются по отношению к соседним слоям атомов.Этот процесс называется скольжением. Границы зерен имеют тенденцию предотвращать скольжение. Чем меньше размер зерна, тем больше площадь границы зерна. Уменьшение размера зерна в результате холодной или горячей обработки металла замедляет скольжение и, таким образом, увеличивает прочность металла. Холодная и горячая обработка обсуждаются в следующей главе.
Предел прочности на разрыв
Рис. 3: Кривая деформации-деформации для типичного пластичного материала
Предел прочности на разрыв (UTS) — это максимальное сопротивление разрушению.Это эквивалентно максимальной нагрузке, которую может выдержать один квадратный дюйм площади поперечного сечения, когда нагрузка прилагается как простое натяжение. Он выражается в фунтах на квадратный дюйм.
UTS = максимальная нагрузка / площадь исходного поперечного сечения = P
max / A o = psi
Если доступна полная инженерная кривая напряжение-деформация, как показано на рисунке 3, предел прочности при растяжении отображается как значение координаты напряжения в самой высокой точке кривой. Материалы, которые сильно удлиняются перед разрушением, подвергаются такому значительному уменьшению площади поперечного сечения, что материал будет нести меньшую нагрузку на заключительных этапах испытания (это было отмечено на рисунках 3 и 4 уменьшением напряжения непосредственно перед разрывом). .Заметное уменьшение поперечного сечения называется «сужением». Предел прочности на разрыв часто сокращают до «прочности на разрыв» или даже до «предела». Иногда используется термин «максимальная сила», но он может вводить в заблуждение и поэтому не используется в некоторых дисциплинах.
Предел текучести
Рис. 5: Кривая напряжения-деформации типичного хрупкого материала
Ряд терминов был определен с целью определения напряжения, при котором начинается пластическая деформация. Чаще всего для этой цели используется предел текучести.Предел текучести определяется как напряжение, при котором возникает заданная величина остаточной деформации. Графическая часть ранних стадий испытания на растяжение используется для оценки предела текучести. Для определения предела текучести заданная величина остаточной деформации устанавливается вдоль оси деформации графика справа от начала координат (ноль). Это обозначено на Рисунке 5 как Точка (D). Rev. 0
Прямая линия проведена через точку (D) Рис. 5 Типичная кривая напряжения-деформации хрупкого материала с тем же наклоном, что и начальный участок кривой напряжения-деформации.Точка пересечения новой линии и кривой деформации проецируется на ось напряжений. Значение напряжения в фунтах на квадратный дюйм — это предел текучести. Это обозначено на рисунке 5 как точка 3. Этот метод построения графика выполняется с целью вычитания упругой деформации из общей деформации, оставляя предварительно определенное «постоянное смещение» в качестве остатка. Когда указывается предел текучести, следует указывать величину смещения, использованную при определении. Например, «Предел текучести (при 0.Смещение 2%) = 51 200 фунтов на кв. Дюйм ».
Примеры предела текучести
Ниже приведены некоторые примеры предела текучести металлов.
Алюминий от 3,5 x 104 до 4,5 x 104 фунтов на кв. Дюйм
Нержавеющая сталь от 4,0 x 104 до 5,0 x 104 фунтов на кв. Дюйм
Углеродистая сталь от 3,0 x 104 до 4,0 x 104 фунтов на кв. Дюйм
Альтернативные значения
Иногда вместо предела текучести используются альтернативные значения . Некоторые из них кратко описаны ниже.
• Предел текучести , определяемый методом делителя, предполагает наличие наблюдателя с парой разделителей, наблюдающего за видимым удлинением между двумя контрольными отметками на образце.Когда происходит видимое растяжение, нагрузка в этот момент записывается, и рассчитывается напряжение, соответствующее этой нагрузке.
• Мягкая сталь при испытании на растяжение часто демонстрирует особую характеристику, известную как предел текучести. Если построена кривая напряжение-деформация, наблюдается падение нагрузки (или иногда постоянная нагрузка), хотя деформация продолжает увеличиваться. В конечном итоге за счет деформации металл упрочняется, и при дальнейшем деформировании нагрузка возрастает. Верхняя точка на S-образной части кривой, где начинается текучесть, известна как верхний предел текучести, а точка минимума — это нижний предел текучести.Это явление очень неприятно при некоторых операциях глубокой вытяжки листовой стали. Сталь продолжает удлиняться и становиться тоньше в тех местах, где начинается пластическая деформация, оставляя неприглядные углубления, называемые растяжными деформациями или «червями».
• Предел пропорциональности определяется как напряжение, при котором кривая напряжения-деформации сначала отклоняется от прямой линии. Ниже этого предельного значения напряжения отношение напряжения к деформации является постоянным, и говорят, что материал подчиняется закону Гука (напряжение пропорционально деформации).Пропорциональный предел обычно не используется в спецификациях, потому что отклонение начинается настолько постепенно, что наверняка возникнут разногласия относительно точного напряжения, при котором линия начинает изгибаться.
• Предел упругости ранее определялся как напряжение, при котором начинается пластическая деформация. Этот предел не может быть определен из кривой напряжения-деформации. Метод определения предела должен включать последовательность слегка увеличивающихся нагрузок с промежуточной полной разгрузкой для обнаружения первой пластической деформации или «остаточного схватывания».«Как и пропорциональный предел, его определение вызвало бы споры. Однако предел упругости используется как описательный, качественный термин.
Во многих ситуациях предел текучести используется для определения допустимого напряжения, которому может подвергаться материал. Для компонентов, которые должны выдерживать высокое давление, таких как те, которые используются в реакторах с водой под давлением (PWR), этот критерий неадекватен. Чтобы охватить эти ситуации, теория отказа максимального напряжения сдвига была включена в Кодекс ASME (Американское общество инженеров-механиков) по котлам и сосудам под давлением, раздел III, Правила строительства сосудов под давлением для ядерных реакторов.
Пластичность
Относительное удлинение, указанное при испытании на растяжение, определяется как максимальное удлинение измерительной длины, деленное на исходную расчетную длину. Измерение определяется, как показано на Рисунке 6.
Рисунок 6: Измерение Elogation после разрушения
Процентное удлинение = конечная измерительная длина — начальная расчетная длина / начальная расчетная длина (2-13)
= (L
x — L o / L o ) = дюймов на дюйм x 100 (2-14)
Уменьшение площади — это пропорциональное уменьшение площади поперечного сечения образца для испытания на растяжение в плоскости разрушения, измеренной после разрушения.
Процент уменьшения площади (RA) =
площадь исходного поперечного сечения — минимальная конечная площадь / площадь исходного поперечного сечения (2-15)
= (A
0 — A min ) / A o = уменьшение площади / исходная площадь = кв. Дюйм / кв. Дюйм x 100 (2-16)
Уменьшение площади указывается как дополнительная информация (в процентах удлинения) о деформационных характеристиках материала. Эти два показателя используются в качестве показателей пластичности, способности материала растягиваться при растяжении.Поскольку удлинение не является равномерным по всей длине измерительного прибора и наибольшее в центре шейки, относительное удлинение не является абсолютной мерой пластичности. (Из-за этого при измерении удлинения в процентах всегда следует указывать измерительную длину.) Уменьшение площади, измеряемое при минимальном диаметре шейки, является лучшим индикатором пластичности.
Пластичность чаще определяется как способность материала легко деформироваться при приложении растягивающего усилия или как способность материала противостоять пластической деформации без разрыва.Пластичность также можно рассматривать с точки зрения изгибаемости и разрушаемости. Пластичные материалы перед разрушением деформируются. Отсутствие пластичности часто называют хрупкостью. Обычно, если два материала имеют одинаковую прочность и твердость, более желателен тот, который имеет более высокую пластичность. Пластичность многих металлов может измениться при изменении условий. Повышение температуры увеличивает пластичность. Снижение температуры вызовет снижение пластичности и переход от пластичного к хрупкому поведению.Облучение также снизит пластичность.
Холодная обработка также снижает пластичность металлов. Холодная обработка выполняется в температурном диапазоне и в течение определенного промежутка времени для получения пластической деформации, но не для снятия деформационного упрочнения. Незначительное добавление примесей к металлам, преднамеренное или непреднамеренное, может оказать заметное влияние на переход от пластичного к хрупкому поведению. Нагрев холодно обработанного металла до температуры, при которой атомы металла возвращаются в свое равновесное положение или выше, увеличит пластичность этого металла.Этот процесс называется отжигом .
Пластичность желательна при высоких температурах и давлении в реакторных установках из-за дополнительных напряжений на металлах. Высокая пластичность в этих применениях помогает предотвратить хрупкое разрушение.
Ковкость
Рисунок 7: Податливая деформация цилиндра при равномерном осевом сжатии
Если пластичность — это способность материала легко деформироваться при приложении растягивающего усилия, пластичность — это способность металла проявлять большую деформацию или пластическая реакция при воздействии сжимающей силы.Равномерная сжимающая сила вызывает деформацию, как показано на рисунке 7. Материал сжимается в осевом направлении под действием силы и расширяется в боковом направлении. Сдерживание из-за трения на контактных поверхностях вызывает осевое напряжение снаружи. Силы растяжения действуют по окружности с боковым расширением или увеличением обхвата. Пластический поток в центре материала также вызывает напряжение.
Следовательно, критерий разрушения (то есть предел пластической деформации) для пластического материала, скорее всего, будет зависеть от растягивающего, а не сжимающего напряжения.Изменение температуры может изменить как режим пластического течения, так и режим разрушения.
Прочность
Рисунок 8: Испытательное оборудование по Шарпи
Качество, известное как вязкость , описывает реакцию материала на внезапные удары. Он определяется как работа, необходимая для деформации одного кубического дюйма металла до его разрушения. Вязкость измеряют с помощью теста Шарпи или теста Изода.
В обоих этих тестах используется образец с надрезом. Расположение и форма насечки стандартные.Точки опоры образца, а также удар молотка должны постоянно зависеть от места надреза.
Испытания проводятся путем установки образцов, как показано на Рисунке 8, и позволяя маятнику известного веса упасть с заданной высоты. Максимальная энергия, развиваемая молотком, составляет 120 фут-фунтов в тесте Изода и 240 фут-фунт в тесте Шарпи. При правильной калибровке машины энергия, поглощенная образцом, может быть измерена по восходящему колебанию маятника после того, как он разрушил образец материала, как показано на рисунке 9.Чем больше энергии поглощается образцом, тем меньше будет качание маятника вверх и тем прочнее будет материал.
Рис. 9: Испытание на вязкость материала
Показатели вязкости являются относительными и применимы только для случаев, когда используются именно этот тип образца и метод нагружения. Образец другой формы даст совершенно другой результат. Насечки ограничивают деформацию небольшим объемом металла, что снижает ударную вязкость. Фактически, именно форма металла в дополнение к составу материала определяет ударную вязкость материала.
Твердость
Твердость — это свойство материала, которое позволяет ему противостоять пластической деформации, проникновению, вдавливанию и царапинам. Следовательно, твердость важна с инженерной точки зрения, поскольку сопротивление износу из-за трения или эрозии паром, маслом и водой обычно увеличивается с увеличением твердости.
Испытания на твердость служат важной потребности в промышленности, даже если они не измеряют уникальное качество, которое можно назвать твердостью. Тесты носят эмпирический характер, основаны на экспериментах и наблюдениях, а не на фундаментальной теории.Его главная ценность — это устройство для проверки, способное обнаруживать определенные различия в материалах, когда они возникают, даже если эти различия могут быть неопределенными. Например, две партии материала с одинаковой твердостью могут быть, а могут и не быть одинаковыми, но если их твердость различна, материалы определенно не похожи.
Было разработано несколько методов испытания на твердость. Чаще всего используются программы Brinell, Rockwell, Vickers, Tukon, Sclerscope и файлы test. Первые четыре основаны на испытаниях на вдавливание, а пятое — на высоте отскока металлического молотка с алмазным наконечником.Тест файла устанавливает характеристики того, насколько хорошо файл прикусывает материал.
В результате множества испытаний были подготовлены сравнения с использованием формул, таблиц и графиков, которые показывают взаимосвязь между результатами различных испытаний на твердость конкретных сплавов. Однако между любыми двумя методами нет точной математической связи. По этой причине результат одного типа испытания на твердость, преобразованный в показания другого типа, должен иметь обозначение «преобразовано из» (например, «352 Бринелля преобразовано из Rockwell C-38»).
Еще одно удобное преобразование — это преобразование твердости по Бринеллю в предел прочности на разрыв. Для закаленной и отпущенной стали предел прочности (psi) примерно в 500 раз превышает число твердости по Бринеллю (при условии, что прочность не превышает 200000 psi).
Как сплавы влияют на физические свойства
Никель является важным легирующим элементом. В концентрациях менее 5% никель повысит ударную вязкость и пластичность стали без повышения твердости. При добавлении в этих небольших количествах твердость не повышается, потому что не образует карбидов, твердых соединений с углеродом.
Хром в стали образует карбид, упрочняющий металл. Атомы хрома также могут занимать определенные места в кристаллической решетке, что будет иметь эффект увеличения твердости, не влияя на пластичность. Добавление никеля усиливает действие хрома, давая сталь повышенной твердости и пластичности.
Медь очень похожа на никель по своему воздействию на сталь. Медь не образует карбид, но увеличивает твердость, замедляя движение дислокаций.
Молибден образует сложный карбид при добавлении в сталь. Благодаря структуре карбида он значительно упрочняет сталь, но также сводит к минимуму увеличение зерна. Молибден усиливает желаемые свойства никеля и хрома.
Нержавеющие стали — это легированные стали, содержащие не менее 12% хрома. Важной характеристикой этих сталей является их устойчивость ко многим коррозионным условиям.
Важная информация в этой главе кратко изложена ниже.
• Прочность — это способность материала сопротивляться деформации. Увеличение скольжения снизит прочность материала.
• Предел прочности на разрыв (UTS) — это максимальное сопротивление разрушению.
• Предел текучести — это напряжение, при котором возникает заданная величина остаточной деформации.
• Пластичность — это способность материала легко деформироваться при приложении растягивающего усилия или способность материала выдерживать пластическую деформацию без разрыва.Повышение температуры увеличивает пластичность. Пластичность снижается при более низких температурах, холодной обработке и облучении. Пластичность желательна при высоких температурах и давлении.
• Ковкость — это способность металла проявлять большую деформацию или пластическую реакцию при воздействии сжимающей силы.
• Вязкость описывает реакцию материала на внезапные удары. Он определяется как работа, необходимая для деформации одного кубического дюйма металла до его разрушения.
• Твердость — это свойство материала, которое позволяет ему противостоять пластической деформации, проникновению, вдавливанию и царапинам.
Термическая обработка
Термическая обработка крупных компонентов из углеродистой стали проводится с целью использования кристаллических дефектов и их эффектов и, таким образом, получения определенных желаемых свойств или условий.
Во время производства, изменяя скорость охлаждения ( закалка ) металла, размер зерна и структура зерна контролируются.Характеристики зерна контролируются для получения различных уровней твердости и прочности на разрыв. Как правило, чем быстрее охлаждается металл, тем меньше размер зерна. Это сделает металл более твердым. По мере увеличения твердости и предела прочности термообработанной стали ударная вязкость и пластичность снижаются.
Скорость охлаждения, используемая при закалке, зависит от метода охлаждения и размера металла. Равномерное охлаждение важно для предотвращения деформации. Обычно стальные детали закаливают в масле или воде.
Из-за кристаллической структуры нержавеющей стали типа 304 в баке реактора (установка по производству трития) термообработка не подходит для повышения твердости и прочности.
Сварка может вызвать внутренние напряжения, которые останутся в материале после завершения сварки. В нержавеющих сталях типа 304 кристаллическая решетка гранецентрированная кубическая (аустенит). Во время высокотемпературной сварки температура окружающего металла может достигать 500–1000 ° F. В этой области температур аустенит превращается в объемноцентрированную кубическую решетчатую структуру (бейнит).Когда металл остынет, области, окружающие сварной шов, содержат некоторое количество исходного аустенита и некоторое количество вновь образованного бейнита. Проблема возникает из-за того, что «коэффициент упаковки» (PF = объем атомов / объем элементарной ячейки) не такой же для кристаллов FCC и для кристаллов BCC.
Образовавшийся бейнит занимает больше места, чем исходная решетка аустенита. Это удлинение материала вызывает в нем остаточные сжимающие и растягивающие напряжения. Напряжения при сварке можно минимизировать, используя сварку радиатора, которая приводит к более низким температурам металла, и отжиг.
Отжиг — еще один распространенный процесс термообработки компонентов из углеродистой стали. Во время отжига компонент медленно нагревается до повышенной температуры и выдерживается там в течение длительного периода времени, а затем охлаждается. Процесс отжига проводится для получения следующих эффектов.
а. для смягчения стали и повышения пластичности
b. для снятия внутренних напряжений, вызванных предыдущими процессами, такими как термообработка, сварка или механическая обработка
c. для улучшения зеренной структуры
Холодная и горячая обработка
Пластическая деформация, которая выполняется в температурном диапазоне и в течение такого интервала времени, при котором деформационное упрочнение не снимается, называется холодной обработкой.Получены обширные знания о структуре холоднодеформированного состояния. На ранних стадиях пластической деформации скольжение происходит в основном по первичным плоскостям скольжения, и дислокации образуют компланарные массивы. По мере деформации происходит поперечное скольжение. Холоднодеформированная структура формирует области с высокой плотностью дислокаций, которые вскоре превращаются в сетки. Размер зерна уменьшается с деформацией при низкой деформации, но вскоре достигает фиксированного размера. Холодная обработка снижает пластичность.
Горячая обработка относится к процессу, при котором металлы деформируются выше их температуры рекристаллизации, и деформационное упрочнение не происходит.Горячая обработка обычно выполняется при повышенных температурах. Однако свинец подвергается горячей деформации при комнатной температуре из-за его низкой температуры плавления. С другой стороны, молибден подвергается холодной деформации при деформации даже при красном нагреве из-за его высокой температуры рекристаллизации.
Сопротивление металлов пластической деформации обычно падает с температурой. По этой причине большие массивные секции всегда подвергаются горячей ковке, прокатке или экструзии. Металлы демонстрируют отчетливо вязкие характеристики при достаточно высоких температурах, а их сопротивление течению увеличивается при высоких скоростях формования.Это происходит не только потому, что это характерно для вязких веществ, но и потому, что скорость рекристаллизации может быть недостаточно высокой.
Коррозия
Коррозия — это износ материала из-за взаимодействия с окружающей средой. Это процесс, при котором атомы металла покидают металл или образуют соединения в присутствии воды и газов. Атомы металла удаляются из структурного элемента до тех пор, пока он не выйдет из строя, или оксиды накапливаются внутри трубы, пока она не закупорится.Все металлы и сплавы подвержены коррозии. Даже благородные металлы, такие как золото, в некоторых средах подвержены коррозионному воздействию.
Коррозия металлов — естественный процесс. Большинство металлов не являются термодинамически стабильными в металлической форме; они хотят подвергнуться коррозии и вернуться к более стабильным формам, которые обычно встречаются в рудах, например к оксидам. Коррозия является основной проблемой для ядерных реакторных установок. Коррозия происходит постоянно по всей реакторной установке, и ей подвержен каждый металл.Хотя эту коррозию невозможно устранить, ее можно контролировать.
Общая коррозия
Общая коррозия с участием воды и стали обычно возникает в результате химического воздействия, при котором поверхность стали окисляется с образованием оксида железа (ржавчины). Многие системы и компоненты завода изготовлены из железа.
Некоторые стандартные методы, связанные с выбором материала для защиты от общей коррозии, включают:
- Использование коррозионно-стойких материалов, таких как нержавеющая сталь и сплавы никеля, хрома и молибдена.(Имейте в виду, что коррозия является электрохимической по своей природе, а коррозионная стойкость нержавеющих сталей является результатом поверхностных оксидных пленок, которые мешают электрохимическому процессу.)
- Использование защитных покрытий, таких как краски и эпоксидные смолы.
- Нанесение металлических и неметаллических покрытий или футеровки на поверхность, которая защищает от коррозии, но позволяет материалу сохранять свою структурную прочность (например, сосуд высокого давления из углеродистой стали с облицовкой из нержавеющей стали в качестве футеровки).
Гальваническая коррозия
Гальваническая коррозия возникает, когда два разнородных металла с разными потенциалами находятся в электрическом контакте в электролите. Это также может иметь место с одним металлом с неоднородностями (различиями) (например, примесными включениями, зернами разного размера, различием в составе зерен или различиями в механическом напряжении). Между разными металлами существует разница в электрическом потенциале, которая служит движущей силой для электрического тока, протекающего через корродирующий агент или электролит.Этот ток приводит к коррозии одного из металлов. Чем больше разность потенциалов, тем больше вероятность гальванической коррозии. Гальваническая коррозия вызывает ухудшение только одного из металлов. Менее стойкий, более активный становится участком анодной (отрицательной) коррозии. Более сильный, благородный — катодный (положительный) и защищенный. Если бы не было электрического контакта, оба металла равномерно подверглись бы воздействию коррозионной среды. Тогда это будет называться общей коррозией.
Для любого конкретного носителя можно составить список, располагая металлы последовательно от наиболее активных или наименее благородных до пассивных или наиболее благородных. Гальванический ряд для морской воды обсуждается в Справочнике по основам химии.
Гальваническая коррозия имеет особое значение при выборе конструкции и материалов. Выбор материала важен, потому что разные металлы контактируют друг с другом и могут образовывать гальванические элементы. Дизайн важен для сведения к минимуму различных условий потока и возникающих в результате областей накопления коррозии.Незакрепленные продукты коррозии важны, потому что они могут быть доставлены в активную зону реактора и облучены.
В некоторых случаях электрохимическая коррозия может быть полезной на предприятии. Например, если к дну стального резервуара для воды прикрепить кусочки цинка, цинк станет анодом, и он подвергнется коррозии. Сталь в резервуаре становится катодом, и на нее не влияет коррозия. Этот метод известен как катодная защита. Защищаемый металл вынужден стать катодом, и он будет корродировать гораздо медленнее, чем другой металл, который используется в качестве расходуемого анода.
Локальная коррозия
Локальная коррозия определяется как избирательное удаление металла путем коррозии на небольших участках или участках поверхности металла, контактирующих с коррозионной средой, обычно с жидкостью. Обычно это происходит, когда небольшие локальные сайты атакуются с гораздо большей скоростью, чем остальная часть исходной поверхности. Локальная коррозия возникает, когда коррозия сочетается с другими деструктивными процессами, такими как напряжение, усталость, эрозия и другие формы химического воздействия.Локальные механизмы коррозии могут причинить больше повреждений, чем любой из этих деструктивных процессов по отдельности. Существует много различных типов локальной коррозии. Точечная коррозия, коррозионное растрескивание под напряжением, коррозия под напряжением хлорида, коррозия под действием едкого напряжения, коррозия под напряжением на первичной стороне, вмятины на трубке теплообменника, отходы и межкристаллитная агрессивная коррозия подробно описаны в Справочнике по основам химии.
Коррозионное растрескивание под напряжением
Одной из наиболее серьезных металлургических проблем и одной из основных проблем ядерной промышленности является коррозионное растрескивание под напряжением (SCC).SCC — это тип межкристаллитной коррозии, которая возникает на границах зерен под действием растягивающего напряжения. Он имеет тенденцию распространяться, когда напряжение открывает трещины, которые подвержены коррозии, которые затем подвергаются дальнейшей коррозии, ослабляя металл за счет дальнейшего растрескивания. Трещины могут следовать межзерновым или трансгранулярным путям, и часто существует тенденция к ветвлению трещин.
Трещины образуются и распространяются примерно под прямым углом к направлению растягивающих напряжений при уровнях напряжения, намного меньших, чем те, которые требуются для разрушения материала в отсутствие агрессивной среды.По мере того, как растрескивание проникает дальше в материал, оно в конечном итоге уменьшает поддерживающее поперечное сечение материала до точки разрушения конструкции из-за перегрузки.
Напряжения, вызывающие растрескивание, возникают в результате остаточной холодной обработки, сварки, шлифования, термической обработки или могут применяться извне во время эксплуатации и, чтобы быть эффективными, должны быть растягивающими (в отличие от сжатия).
SCC возникает в металлах, подверженных воздействию окружающей среды, где, если бы напряжение не присутствовало или было на гораздо более низком уровне, не было бы никакого повреждения.Если бы конструкция, подвергающаяся тем же напряжениям, находилась в другой среде (не вызывающей коррозии для этого материала), разрушения не было бы. Примерами SCC в атомной промышленности являются трещины в системах трубопроводов из нержавеющей стали и стержнях клапанов из нержавеющей стали.
Наиболее эффективные средства предотвращения SCC: 1) правильное проектирование; 2) снижение стресса; 3) удаление критически важных веществ в окружающей среде, таких как гидроксиды, хлориды и кислород; 4) и избегание застойных участков и щелей в теплообменниках, где может концентрироваться хлорид и гидроксид.Низколегированные стали менее восприимчивы, чем высоколегированные, но они подвержены SCC в воде, содержащей ионы хлора. Однако на сплавы на основе никеля не действуют хлорид- или гидроксид-ионы.
Примером сплава на основе никеля, устойчивого к коррозионному растрескиванию под напряжением, является инконель. Инконель состоит из 72% никеля, 14-17% хрома, 6-10% железа и небольшого количества марганца, углерода и меди.
Хлоридная коррозия под напряжением
Одной из наиболее важных форм стресс-коррозии, которая имеет значение в атомной промышленности, является хлоридная коррозия под напряжением .Хлоридная коррозия под напряжением — это тип межкристаллитной коррозии, которая возникает в аустенитной нержавеющей стали при растягивающем напряжении в присутствии кислорода, хлорид-ионов и высокой температуры.
Считается, что это начинается с отложений карбида хрома по границам зерен, которые оставляют металл открытым для коррозии. Эта форма коррозии контролируется за счет поддержания низкого содержания хлорид-ионов и кислорода в окружающей среде и использования низкоуглеродистых сталей.
Едкая коррозия под напряжением
Несмотря на обширную квалификацию инконеля для конкретных применений, с трубами из инконеля возник ряд проблем с коррозией.Повышенная стойкость инконелю к коррозионному растрескиванию под воздействием каустика может быть достигнута путем его термообработки при температуре от 620 ° C до 705 ° C, в зависимости от температуры предварительной обработки раствора. Другие проблемы, которые наблюдались при использовании инконеля, включают в себя излишки, вмятины на трубках, точечную коррозию и межкристаллитную атаку.
Важная информация в этой главе кратко изложена ниже.
Закалка
- Изменение скорости охлаждения (закалки) металла контролирует размер зерен и структуру зерен.
- Характеристики зерна контролируются для получения различных уровней твердости и прочности на разрыв.
- Повышение твердости и прочности на разрыв термически обработанной стали; снижается вязкость и пластичность.
Сварка
- Создает сжимающие и растягивающие напряжения
- Напряжения минимизируются за счет использования сварки с радиатором и отжига
Отжиг
- Смягчает сталь и улучшает пластичность
- Снимает внутренние напряжения
- Коррозия — это естественное разрушение металла, при котором атомы металла покидают металл или образуют соединения в присутствии воды или газов.Общая коррозия может быть сведена к минимуму за счет использования коррозионно-стойких материалов и добавления защитных покрытий и футеровки.
- Гальваническая коррозия возникает, когда разнородные металлы существуют при разных электрических потенциалах в присутствии электролита. Гальваническую коррозию можно уменьшить за счет тщательного проектирования и выбора материалов с учетом разнородных металлов и использования расходуемых анодов.
- Локальная коррозия может быть особенно разрушительной в присутствии других разрушающих сил, таких как напряжение, усталость и другие формы химического воздействия.
Концерн
Другой формой коррозионного растрескивания под напряжением является водородное охрупчивание . Хотя охрупчивание материалов принимает различные формы, водородное охрупчивание высокопрочных сталей имеет наиболее разрушительный эффект из-за катастрофического характера трещин, когда они возникают. Водородное охрупчивание — это процесс, при котором сталь теряет пластичность и прочность из-за крошечных трещин, возникающих в результате внутреннего давления водорода (H 2 ) или газообразного метана (CH 4 ), образующихся на границах зерен.В циркониевых сплавах водородная хрупкость вызывается гидрированием циркония. В ядерных реакторах термин «водородная хрупкость» обычно относится к охрупчиванию циркониевых сплавов, вызванному гидрированием циркония.
Источники водорода
Источники водорода, вызывающие охрупчивание, были обнаружены при производстве стали, при обработке деталей, при сварке, при хранении или герметизации газообразного водорода и связаны с водородом в качестве загрязнителя в окружающей среде, который часто является побочный продукт общей коррозии.Последнее касается атомной отрасли. Водород может образовываться в результате реакций коррозии, таких как ржавление, катодная защита и гальваника. Водород также может быть добавлен к охлаждающей жидкости реактора для удаления кислорода из систем охлаждающей жидкости реактора.
Водородное охрупчивание нержавеющей стали
Рис. 10: Водородное охрупчивание
Как показано на Рис. 10, водород диффундирует по границам зерен и соединяется с углеродом (C), который легирован железом, с образованием газообразного метана.Метан не подвижен и собирается в небольших пустотах по границам зерен, где создает огромное давление, которое вызывает трещины. Водородная хрупкость является основной причиной того, что теплоноситель реактора поддерживается на нейтральном или основном pH на установках без алюминиевых компонентов.
Если металл находится под высоким растягивающим напряжением, может произойти хрупкое разрушение. При обычных комнатных температурах атомы водорода поглощаются металлической решеткой и диффундируют через зерна, стремясь собираться во включениях или других дефектах решетки.Если напряжение вызывает растрескивание в этих условиях, путь является межкристаллитным. При высоких температурах поглощенный водород имеет тенденцию собираться на границах зерен, и в этом случае растрескивание под напряжением становится межкристаллитным. Считается, что растрескивание мартенситных и дисперсионно-упрочненных стальных сплавов является формой водородного коррозионного растрескивания под напряжением, которое возникает в результате попадания в металл части атомарного водорода, который образуется в следующей реакции коррозии.
3 Fe + 4 H 2 O → Fe 3 O 4 + 4 H 2
Водородное охрупчивание не является постоянным условием.Если растрескивания не происходит и условия окружающей среды изменяются так, что водород не образуется на поверхности металла, водород может повторно диффундировать из стали, так что пластичность восстанавливается.
Для решения проблемы водородного охрупчивания особое внимание уделяется контролю количества остаточного водорода в стали, контролю количества поглощения водорода при обработке, разработке сплавов с улучшенной стойкостью к водородному охрупчиванию, разработке покрытий или покрытий с низким или нулевым охрупчиванием. и ограничение количества водорода, вводимого на месте (на месте) в течение срока службы детали.
Водородное охрупчивание циркониевых сплавов
Водородное охрупчивание — проблема циркония и циркониевых сплавов, которые часто используются в качестве материалов оболочки для ядерных реакторов. Цирконий реагирует с водой следующим образом.
Zr + 2 H 2 O → ZrO 2 + 2H 2 ↑
Часть водорода, образующегося при коррозии циркония в воде, соединяется с цирконием с образованием отдельной фазы гидрида циркония (ZrH 1.5 ) тромбоциты.Затем металл становится хрупким (снижается пластичность) и легко ломается. В пластинках гидрида циркония начинают образовываться трещины, которые распространяются по металлу. Циркалой-2 (сплав циркония), который использовался в качестве оболочки твэла, может поглощать до 50% образующегося при коррозии водорода и подвержен водородному охрупчиванию, особенно вблизи поверхности. Исследования, проведенные в Westinghouse, Batelle и других местах, показали, что никель в циркалое-2 ответственен за улавливание водорода.Это привело к разработке циркалоя-4, который содержит значительно меньше никеля, чем циркалой-2, и менее подвержен охрупчиванию. Кроме того, введение ниобия в циркалой-4 дополнительно снижает степень поглощения водорода.
Важная информация в этой главе кратко изложена ниже.
Водородное охрупчивание
Условиями, необходимыми для водородного охрупчивания стали, является присутствие водорода, растворенного в воде, и углерода в стали.Водород, растворенный в воде, поступает из:
- Производство стали
- Обработка деталей
- Сварка
- Хранение или локализация газообразного водорода
- Связанный с водородом в качестве загрязнителя в окружающей среде, который часто является побочным продуктом общего коррозия
Водородное охрупчивание является результатом водород, который диффундирует по границам зерен и соединяется с углеродом с образованием газообразного метана. Газообразный метан собирается в небольших пустотах вдоль границ зерен, где он создает огромное давление, которое вызывает трещины и снижает пластичность стали.Если металл находится под высоким растягивающим напряжением, может произойти хрупкое разрушение.
Циркалой-4 менее подвержен водородному охрупчиванию, чем циркалой-2, потому что:
- Циркалой-4 содержит меньше никеля
- Введение ниобия в циркалой-4 снижает степень поглощения водорода металлом.
Geos 306, Лекция 9, Кристаллография I
Geos 306, Лекция 9, Кристаллография I
Геос 306, лекция 9
Кристаллография — элементарные ячейки
Определение кристалла и минерала
- W&B определяет кристалл как: «Гомогенное химическое соединение с регулярным и периодическим расположением атомов.”
- Компания W&B определяет минерал как: «Минерал — это химическое соединение природного происхождения. Большинство минералов кристаллические ».
- Кляйн определяет минерал как: «Минерал — это встречающееся в природе однородное твердое вещество с определенным (но обычно не фиксированным) химическим составом.
и высокоупорядоченное атомное расположение. Обычно он образуется в результате неорганических процессов ».
Периодичность
- До сих пор мы исследовали короткодействующих расположений атомов как
найдено в кристаллах.Мы сосредоточились на связывании атомов и согласованных многогранниках. Теперь мы рассмотрим аранжировки дальнего действия . - Большинство кристаллов состоит из ограниченного и простого числа компонентов ,
Например. SiO 2 , Mg 2 SiO 4 .
Это связано с тем, что кристалл состоит из набора относительно небольшого числа атомов, которые все демонстрируют поступательную периодичность, так что полная энергия набора атомов
которые составляют кристалл, сведены к минимуму. - Как следствие, используя концепцию согласованных многогранников,
существует ограниченное количество способов упаковать атомы вместе , чтобы
образуют твердое тело. Например, кремнезем SiO 2 . Использование правил Полинга
мы обнаруживаем, что каждый Si при окружающих условиях скоординирован до 4 О, и каждый О скоординирован
до 2 Si’s. Следовательно, возможное количество различных кристаллических фаз
SiO 2 ограничены способами, которыми мы можем упаковать эти соединенные углом
тетраэдры вместе.В настоящее время открыто около 50 различных фаз кремнезема. Большинство из них синтетические, но некоторые из них — минералы.
Вот три примера минералов.
- Соединения с одинаковой химической формулой, но с разной кристаллической структурой называются полиморфами .
Мы также можем сказать, что это разные фазы, разные виды или разные минералы; каждый из этих способов сказать, что это правильно.
Так, например, минералы кварц,
кристобалит,
и тридимит представляют собой полиморфы SiO 2 , потому что каждый имеет отличную кристаллическую структуру.Было бы неправильно называть «полиморфы кварца», вместо этого мы бы сказали «полиморфы кремнезема или SiO 2 ».
Каждый из этих минералов считается фазой SiO 2 . У каждого есть свой собственный структурный мотив, образец симметрии и структуры атомного уровня, который уникален. - Но в кристалле порядка 10 24 атомов. Итак
узоров склеивания повторяются снова и снова. - Следовательно, в трехмерном кристаллическом твердом теле конкретный объем пространства был определен как элементарная ячейка .Элементарная ячейка представляет собой параллелепипед с формой, характерной для кристалла, и содержит целое число химических формул.
- В идеале, содержимое каждой элементарной ячейки в точности идентично и повторяется снова и снова путем перевода в трех измерениях.
Поскольку элементарная ячейка содержит целое число химических формул, то она содержит целое число атомов,
и, таким образом, свойство поступательной периодичности гарантирует, что химическая формула минерала будет состоять из целых чисел, например SiO 2 .В кварце в элементарной ячейке 3 атома Si и 6 атомов O, Si 3 O 6 . Запишем формулу как SiO 2
потому что атомы Si и O находятся в этом соотношении, и определяют Z = 3, где Z = количество формульных единиц в элементарной ячейке.
В элементарной ячейке кристобалита находится 4 атома Si и 8 атомов O, Si 4 O 8 , Z = 4.
В элементарной ячейке кристалла тридимита, извлеченного из метеорита, было 12 атомов Si и 24 атома O.
В каждом из этих трех примеров отношение Si к O дает формулу SiO 2 .Формула должна начислять баланс,
иначе у минерала был бы электрический заряд, который был бы огромным из-за 10 24 атомов в кристалле.
Однако не разные количества SiO 2 в каждой элементарной ячейке отличает один полиморф от другого. Дело в том, что атомы устроены по-разному. - Различные минералы с разным составом могут иметь одинаковую кристаллическую структуру.
Например, кальцит CaCO 3 имеет ту же структуру, что и родохрозит MnCO 3 .Мы говорим, что эти минералы изоструктурны .
Изоструктурные минералы часто обладают схожими свойствами, и, хотя и не всегда, часто между ними существует химический твердый раствор.
Элементарные ячейки изоструктурных минералов имеют одинаковую форму, но могут отличаться по размеру. - Используйте список минералов IMA, чтобы проиллюстрировать примеры полиморфов и изоструктурных групп.
Элементарная ячейка
- Рене-Жюст Гаюи ввел понятие «молекулы intégrantes» (т.е. современная элементарная ячейка)
в трактате «Traité de Minéralogie» (1801).
Он заметил, как кальцит раскалывается на ромбоэдрические формы, и что все различные формы кристаллов, наблюдаемые в кальците, могут быть построены из таких единиц. - Форма элементарной ячейки определяется 6 параметрами: a, b, c, a, b,
грамм. Мы выбрали
угол будет началом координат, а три ребра определяют векторы
а,
b, c отрезков a, b, c.Эти края не обязательно должны быть под углом 90 °.
друг от друга так а, б
а также
g определяют углы между краями, с
∠ bc = α, ∠ ac = β и ∠ ab = γ.
Обратите внимание, что выделенные жирным шрифтом буквы a, b, c, представляют векторы,
в то время как нормальные буквы a, b, c обозначают длины векторов. - Это похоже на трехмерную декартову систему координат. В трехмерной декартовой системе у вас есть три оси, длина которых равна
к 1, и каждый из них находится на 90 ° друг от друга.Итак, в декартовой системе a = b = c = 1, α = β = γ = 90 °.
В кристаллах мы имеем более общую систему, гибко выбираемую в соответствии с направлениями и длинами периодичности, проявляемой в кристалле. - Форма элементарной ячейки связана с симметрией кристалла и определяет шесть кристаллических систем.
Изображение с микроскопа
http://leggeo.unc.edu/Petunia/IgMetAtlas/minerals/calcite.UX.html
| Система | a | б | c | ∠ до н.э. = α | ∠ ac = β | ∠ ab = γ |
| кубический | а | а | а | 90 | 90 | 90 |
| шестиугольник | а | а | c | 90 | 90 | 120 |
| четырехугольный | а | а | c | 90 | 90 | 90 |
| ромбический | а | б | c | 90 | 90 | 90 |
| моноклинический | а | б | c | 90 | β | 90 |
| триклинический | а | б | c | α | β | γ |
- Изучение кристаллов упрощается тем, что все, что нам действительно нужно сделать
изучить и понять элементарную ячейку и ее содержимое.Что делает это таким привлекательным, так это то, что мы можем измерить эти вещи.
В минералогических исследованиях мы обычно измеряем химический состав с помощью электронного микрозонда,
и мы измеряем параметры элементарной ячейки и положения атомов с помощью дифракции рентгеновских лучей.
Эти две характеристики, химия и кристаллография, определяют минерал. - Многие другие свойства минерала получены в результате изучения химии и систематики параметров клеток.
Например, сжимаемость минерала получается просто путем нахождения
выяснить, как объем его элементарной ячейки уменьшается с давлением.Кроме того,
сжимаемость минерала напрямую связана с тем, насколько быстрые сейсмические волны
может распространяться через кристалл. Итак, мы моделируем сейсмические свойства.
глубоких недр земли путем изучения параметров элементарной ячейки минералов
при высоком давлении. - Примеры элементарных ячеек, которые можно просмотреть с помощью XtalDraw:
кубический
шестиугольный
тетрагональный,
орторомбический
моноклинический и
триклиническая. - Примеры кристаллических структур минералов с разной симметрией, которые можно просмотреть с помощью XtalDraw:
кубический
шестиугольный
тетрагональный,
орторомбический
моноклинический и
триклиническая.
Атомные системы координат
- Определим угол элементарной ячейки как начало координат. Это
угол, определяющий углы a, b,
и г.
Векторы a , b , c определяют основу нашего
система координат, называемая прямым базисом ,
, который обеспечивает способ описания реального пространства . - Атомы расположены внутри элементарной ячейки как дробные координаты, [ xyz ].
Начало a , b и c имеют значение координаты 0, определяя точку, называемую началом координат, в [0,0,0].Конечные точки a , b и c имеют значение координаты 1.
Точка, которая находится на полпути вдоль вектора a , находится в координате [1/2 0 0]. - Например, кварц, имеющий гексагональную симметрию и параметры ячейки a = 4,9137 Å,
c = 5,4047 Å. Постройте схему кристаллической структуры кварца, используя
шаблон элементарной ячейки. Визуализируйте атомы
в виде кругов или сфер, где Si меньше О. Поместите координату z (1 десятичный знак
достаточно хорошо) рядом с атомом.Попробуйте нарисовать облигации.
| атом | Икс | у | z |
| Si | 0,4697 | 0 | 0 |
| Si | 0 | 0,4697 | 2/3 |
| Si | 0,5303 | 0,5303 | 1/3 |
| O | 0,4133 | 0,2672 | 0.1188 |
| O | 0,2672 | 0,4133 | 0,5479 |
| O | 0,7328 | 0,1461 | 0,7855 |
| O | 0,5867 | 0,8539 | 0,2145 |
| O | 0,8539 | 0,5867 | 0,4521 |
| O | 0,1461 | 0,7328 | 0.8812 |
Зоны
- Зона — это направление в кристалле, которое можно определить тремя целыми числами,
[uvw], или как вектор, u a + v b + w c - Каждый край кристалла можно описать как зону.
- Это просто векторы, которые полезны для определения направления, в котором
вы смотрите на кристалл. - Например, найдите направления [100], [010], [-1-10] и [210] в кварце.
Самолеты
- Любые 3 точки определяют плоскость.Три угла любой элементарной ячейки кристалла определяют решетку
самолет. Все грани любого кристалла параллельны таким плоскостям. Лица
которые наблюдаются, по сути, являются самыми медленно растущими плоскостями в кристалле.
Например, куб или октаэдр. - Каждая плоскость имеет идентифицирующий набор целочисленных координат, которые определяют
данный самолет, ( hkl ). (Обратите внимание, что эти скобки круглые (), а скобки для зоны квадратные [].)
Эти координаты представляют собой вектор, который
перпендикулярна плоскости и задана в системе координат, которая
обозначается как обратное пространство , поскольку плоскость пересекает
х, у ,
а также
z оси на a / h , b / k и c / l . - Дифракция рентгеновских лучей описывается относительно плоскостей кристалла, поэтому мы обсудим плоскости более подробно в следующих нескольких лекциях.
Чтение:
Венк и Булах, Глава 3
Кляйн, Глава 5
Нессе, Глава 2
Кристаллические структуры — Мягкая материя
Запись Эмили Редстон, AP 225, осень 2011 г.
Кристаллические материалы характеризуются повторяющимися (или периодическими) массивами атомов на больших атомных расстояниях. Обычно мы думаем об этих материалах в контексте твердых тел, хотя бывают и жидкие кристаллы.Кристаллизация — это процесс формирования кристаллических структур; атомы будут располагаться в повторяющейся трехмерной структуре после затвердевания. Говорят, что система отображает дальний порядок. Если твердое тело не имеет дальнего порядка, оно считается аморфным. Кристаллическая структура материала — это уникальный способ пространственного расположения атомов, ионов или молекул. Существует чрезвычайно большое количество различных кристаллических структур, имеющих дальний порядок.Некоторые из них являются относительно простыми структурами (например, для металлов), в то время как другие могут быть чрезвычайно сложными (например, для керамических и полимерных материалов). При описании кристаллических структур полезно рассматривать атомы как твердые сферы с четко определенными радиусами. Мы называем это атомной моделью твердых сфер, где сферы, представляющие ближайшие соседние атомы, касаются друг друга. Термин решетка используется для описания трехмерного массива точек, совпадающих с положениями атомов.
При описании кристаллических структур часто удобно подразделить структуру на небольшие повторяющиеся элементы, называемые элементарными ячейками.Обычно мы выбираем элементарную ячейку так, чтобы она отражала симметрию кристаллической структуры (обычная элементарная ячейка). Элементарная ячейка — это небольшая структура, которая повторяется путем трансляции через кристалл; если элементарные ячейки сложены вместе в трех измерениях, они описывают объемное расположение атомов в кристалле. Таким образом, элементарная ячейка является основной структурной единицей кристаллической структуры. Элементарная ячейка описывается параметрами ее решетки, которые представляют собой длины краев ячейки и углы между ними.Используя эти параметры, мы можем определить 14 решеток Браве в трехмерном пространстве, которые описывают геометрическое расположение точек решетки. 32 кристаллографические точечные группы описывают вращательную и зеркальную симметрию элементарной ячейки. Чтобы описать полную симметрию кристалла (включая операции трансляционной симметрии), мы должны рассмотреть 230 пространственных групп.
Рис. 1. Решетка ГПУ (слева) и решетка ГЦК (справа). Контур каждой соответствующей решетки Браве показан красным.Буквы указывают, какие слои совпадают. В ГПУ-матрице есть два слоя «А», где все сферы находятся в одинаковом положении. Все три слоя в стеке ГЦК разные. Обратите внимание, что наложение ГЦК может быть преобразовано в наложение ГПУ путем перемещения самой верхней сферы, как показано пунктирной линией. (http://en.wikipedia.org/wiki/Close-packing_of_equal_spheres)
Многие кристаллические структуры основаны на плотной упаковке атомов, которую мы описываем с помощью твердых сфер. На рисунке 1 показаны две наиболее распространенные кристаллические структуры: кубическая гранецентрированная (ГЦК) и гексагональная плотноупакованная (ГПУ).Эти структуры особенно важны для коллоидной упаковки и важны, потому что они имеют максимально возможную плотность упаковки. Обе структуры начинаются с гексагонального листа атомов, который мы видим на рисунке 1, но они различаются тем, как мы складываем эти листы друг на друга. Назовем позиции этого первого слоя A. Мы видим, что есть два возможных положения, в которых можно разместить еще один лист поверх этого, который называется B (атомы размещаются на треугольных пространствах, обращенных вниз) и C (атомы размещаются на треугольных пространствах, обращенных вверх. пробелы).
fcc = ABCABCA … штабелирование
hcp = ABABABA … штабелирование
Рисунок 2 показывает красивую анимацию того, как генерируется hcp. И в ГЦК, и в ГПУ каждый атом имеет двенадцать ближайших соседей, поэтому мы говорим, что координационное число равно 12. Фактор упаковки атомов (APF) обеих структур равен 0,74.
Список литературы
[1] Каллистер, Уильям Д. Материаловедение и инженерия: введение . Нью-Йорк: Джон Вили и сыновья, 2007.
[2] http: //en.wikipedia.org / wiki / Close-Packing_of_equal_spheres
[3] Spaepen, Frans. Прикладная физика 282: твердые тела: структура и дефекты . Гарвардский университет
Для более глубокого изучения кристаллических структур можно обратиться к Структура материалов Сэмюэля М. Аллена и Эдвина Л. Томаса.
Ключевое слово в ссылках:
Фазовое поведение и структура новой коллоидной модельной системы чашеобразных частиц
Единичных ячеек
Единичные ячейки
Единичные ячейки:
Простейший повторяющийся блок в кристалле
Строение твердых тел можно описать так, как если бы они были
объемные аналоги куска обоев.Обои имеют
регулярный повторяющийся дизайн, который простирается от одного края до
Другие. Кристаллы имеют похожий повторяющийся дизайн, но в этом случае
конструкция простирается в трех измерениях от одного края твердого тела
к другому.
Однозначно можно описать кусок обоев по
указание размера, формы и содержимого простейшего
повторяющийся блок в дизайне. Мы можем описать трехмерный
кристалл, указав размер, форму и содержимое
простейший повторяющийся блок и способ, которым эти повторяющиеся блоки складываются
сформировать кристалл.
Простейшая повторяющаяся единица в кристалле называется единицей .
сотовый . Каждая элементарная ячейка определяется точками решетки
точки в пространстве, вокруг которых частицы могут свободно колебаться в
кристалл.
Структуры элементарной ячейки для различных солей являются
показано ниже.
В 1850 году Огюст Браве показал, что кристаллы можно разделить.
на 14 элементарных ячеек, которые соответствуют следующим критериям.
- Элементарная ячейка — простейшая повторяющаяся единица в
кристалл. - Противоположные грани элементарной ячейки параллельны.
- Край элементарной ячейки соединяет эквивалентные точки.
14 элементарных ячеек Бравэ показаны на рисунке ниже.
Эти элементарные ячейки делятся на семь категорий, которые различаются
три длины края элементарной ячейки ( a , b и c )
и три внутренних угла (a, � и g), как показано в таблице
ниже.
Семь категорий элементарных ячеек Браве
Мы остановимся на категории кубических, в которую входят три
типы элементарных ячеек простые
кубическая, объемно-центрированная кубическая и гранецентрированная кубическая показаны
на рисунке ниже.
Эти элементарные ячейки важны по двум причинам. Первый
количество металлов, ионных твердых частиц и интерметаллических соединений
кристаллизуются в кубических элементарных ячейках. Во-вторых, относительно легко
делать расчеты с этими элементарными ячейками, потому что край ячейки
все длины одинаковы, а углы ячеек равны 90.
Простая кубическая элементарная ячейка — простейшая повторяющаяся
агрегат в простой кубической конструкции. Каждый угол элементарной ячейки равен
определяется точкой решетки, в которой атом, ион или молекула могут
можно найти в кристалле. По соглашению край элементарной ячейки
всегда соединяет равнозначные точки. Каждый из восьми углов
поэтому элементарная ячейка должна содержать идентичную частицу. Другой
частицы могут присутствовать на краях или гранях элементарной ячейки,
или внутри тела элементарной ячейки.Но минимум, который должен быть
для того, чтобы элементарная ячейка была классифицирована как простая кубическая,
восемь эквивалентных частиц на восьми углах.
Объемно-центрированная кубическая элементарная ячейка является самой простой
повторяющийся блок в объемно-центрированной кубической структуре. Снова,
есть восемь одинаковых частиц на восьми углах
ячейка. Однако на этот раз есть девятая идентичная частица
в центре тела элементарной ячейки.
Гранецентрированная кубическая элементарная ячейка также начинается с
одинаковые частицы на восьми углах куба.Но это
структура также содержит такие же частицы в центрах
шесть граней элементарной ячейки, всего 14 одинаковых решеток
точки.
Гранецентрированная кубическая элементарная ячейка — простейшая повторяющаяся
агрегат в кубической плотноупакованной структуре. Фактически наличие
гранецентрированных кубических элементарных ячеек в этой структуре объясняет, почему
структура известна как кубических наиболее плотно упакованных.
Единичные ячейки: A
Трехмерный график
Точки решетки в кубической элементарной ячейке могут быть описаны в
условия трехмерного графа.Потому что все три ячейки-края
длины одинаковые в кубической элементарной ячейке, неважно, какие
ориентация используется для a , b и c
топоры. Ради аргумента, мы определим ось и как
вертикальная ось нашей системы координат, как показано на
рисунок ниже.
Затем ось b будет описывать движение поперек фронта.
элементарной ячейки, а ось c будет представлять движение
к задней части элементарной ячейки.Кроме того, мы произвольно
определить нижний левый угол элементарной ячейки как начало координат
(0,0,0). Координаты 1,0,0 указывают точку решетки, которая
на расстоянии одного края ячейки от исходной точки вдоль трассы и
ось. Точно так же 0,1,0 и 0,0,1 представляют точки решетки, которые
смещены на одну длину края ячейки от начала координат по b
и c осей соответственно.
Представление об элементарной ячейке как о трехмерном графике
позволяет описать структуру кристалла с
на удивление мало информации.Мы можем указать
структура хлорида цезия, например, всего из четырех частей
информации.
- CsCl кристаллизуется в кубической элементарной ячейке.
- Длина края элементарной ячейки 0,4123 нм.
- В координатах 0,0,0 находится ион Cl — .
- В координатах
1 / 2,1 / 2,1 / 2.
Поскольку край ячейки должен соединять эквивалентные точки решетки,
наличие иона Cl — в одном углу устройства
ячейка (0,0,0) подразумевает присутствие иона Cl — в
каждый уголок клетки.Координаты 1 / 2,1 / 2,1 / 2 описывают
точка решетки в центре ячейки. Потому что нет
другая точка в элементарной ячейке, которая находится на расстоянии одного края ячейки
по этим координатам это единственный ион Cs + в
сотовый. Таким образом, CsCl представляет собой простую кубическую элементарную ячейку Cl — .
ионы с Cs + в центре тела клетки.
Элементарные ячейки: NaCl и ZnS
NaCl должен кристаллизоваться в кубическом массиве плотнейшей упаковки Cl —.
с ионами Na + в октаэдрических дырках между
плоскости ионов Cl — .Мы можем перевести эту информацию
в модель элементарной ячейки для NaCl, помня, что
гранецентрированная кубическая элементарная ячейка — простейшая повторяющаяся единица в
кубическая структура плотнейшей упаковки.
В гранецентрированной кубической единице есть четыре уникальных положения.
клетка. Эти позиции определяются координатами: 0,0,0;
0,1 / 2,1 / 2; 1 / 2,0,1 / 2; и 1 / 2,1 / 2,0. Наличие частицы
в одном углу элементарной ячейки (0,0,0) требуется наличие
эквивалентная частица на каждом из восьми углов устройства
клетка.Поскольку край элементарной ячейки соединяет эквивалентные точки,
наличие частицы в центре нижней грани
(0,1 / 2,1 / 2) подразумевает наличие эквивалентной частицы в
центр верхней грани (1,1 / 2,1 / 2). Точно так же наличие
частицы в центре граней 1 / 2,0,1 / 2 и 1 / 2,1 / 2,0
элементарная ячейка подразумевает эквивалентные частицы в центрах
1 / 2,1,1 / 2 и 1 / 2,1 / 2,1 грани.
На рисунке ниже показано, что в корпусе есть октаэдрическое отверстие.
центр гранецентрированной кубической элементарной ячейки, в координатах
1 / 2,1 / 2,1 / 2.Любая частица в этот момент касается частиц в
центры шести граней элементарной ячейки.
Другие октаэдрические дырки в гранецентрированной кубической элементарной ячейке
находятся на краях ячейки, как показано на рисунке ниже.
Если ионы Cl — занимают узлы решетки
гранецентрированная кубическая элементарная ячейка и все октаэдрические дырки
заполненная ионами Na + , мы получаем элементарную ячейку, показанную на
рисунок ниже.
Таким образом, мы можем описать структуру NaCl в терминах
Следующая информация.
- NaCl кристаллизуется в кубической элементарной ячейке.
- Длина края ячейки 0,5641 нм.
- На позициях 0,0,0 находятся ионы Cl — ;
1 / 2,1 / 2,0; 1 / 2,0,1 / 2; и 0,1 / 2,1 / 2. - На позициях находятся ионы Na + .
1 / 2,1 / 2,1 / 2; 1 / 2,0,0; 0,1 / 2,0; и 0,0,1 / 2.
Размещение иона Cl — в этих четырех положениях подразумевает
наличие иона Cl — на каждой из 14 решеток
точки, которые определяют гранецентрированную кубическую единицу. Размещение Na +
ион в центре элементарной ячейки (1 / 2,1 / 2,1 / 2) и на трех
уникальные края элементарной ячейки (1 / 2,0,0; 0,1 / 2,0; и 0,0,1 / 2)
требуется эквивалентный ион Na + в каждом октаэдре.
отверстие в элементарной ячейке.
ZnS кристаллизуется в виде кубического массива плотнейшей упаковки S 2-
ионы с ионами Zn 2+ в тетраэдрических дырках.Модель S 2-
ионы в этом кристалле занимают те же позиции, что и Cl —
ионы в NaCl. Единственная разница между этими кристаллами — это
расположение положительных ионов. На рисунке ниже показано, что
тетраэдрические дырки в гранецентрированной кубической элементарной ячейке находятся в
углы элементарной ячейки с такими координатами, как 1 / 4,1 / 4,1 / 4. An
атом с этими координатами коснется атома в этом углу
а также атомы в центрах трех граней, которые образуют
этот угол.Хотя без
трехмерная модель, четыре атома, окружающие эту дыру
расположены к углам тетраэдра.
Поскольку углы элементарной кубической ячейки идентичны,
должно быть четырехгранным отверстием в каждом из восьми углов
гранецентрированная кубическая элементарная ячейка. Если ионы S 2- занимают
решетки гранецентрированной кубической элементарной ячейки и Zn 2+
ионы упакованы во все остальные тетраэдрические отверстия, мы получаем
элементарная ячейка ZnS показана на рисунке ниже.
Таким образом, структуру ZnS можно описать следующим образом.
- ZnS кристаллизуется в кубической элементарной ячейке.
- Длина края ячейки 0,5411 нм.
- На позициях 0,0,0 находятся ионы S 2-;
1 / 2,1 / 2,0; 1 / 2,0,1 / 2; и 0,1 / 2,1 / 2. - Есть ионы Zn 2+ на позициях
1 / 4,1 / 4,1 / 4; 1 / 4,3 / 4,3 / 4; 3 / 4,1 / 4,3 / 4; и 3 / 4,3 / 4,1 / 4.
Обратите внимание, что только половина тетраэдрических отверстий занята в
этот кристалл, потому что есть два тетраэдрических отверстия на каждые S 2-
ион в наиболее плотно упакованном массиве этих ионов.
Единичные ячейки: измерение
Расстояние между частицами
Никель — один из металлов, кристаллизующихся в кубической форме.
плотноупакованная структура. Если учесть, что атом никеля
имеет массу всего 9,75 x 10 -23 г и ионный радиус
всего 1,24 x 10 -10 м, это замечательное достижение
уметь описать структуру этого металла. Очевидное
вопрос: откуда мы знаем, что никель упаковывается в кубический
плотноупакованная структура?
Единственный способ определить структуру вещества на атомной
масштаб — использовать зонд еще меньшего размера.Один из многих
полезные зонды для изучения материи в этом масштабе
электромагнитное излучение.
В 1912 году Макс ван Лауэ обнаружил, что рентгеновские лучи, попавшие в
поверхность кристалла дифрагировала на узоры, похожие на
узоры, возникающие при прохождении света через очень узкую
щель. Вскоре после этого Уильям Лоуренс Брэгг, который только что
получил степень бакалавра физики в Кембридже,
объяснил результаты ван Лауэ с помощью уравнения, известного как Брэгга.
уравнение , которое позволяет рассчитать расстояние между
плоскости атомов в кристалле от картины дифракции
рентгеновские лучи известной длины волны.
n
= 2 d sin T
Диаграмма дифрагирования рентгеновских лучей на металлическом никеле
предполагает, что этот металл упаковывается в кубическую элементарную ячейку с
расстояние между плоскостями атомов 0,3524 нм. Таким образом
длина края ячейки в этом кристалле должна составлять 0,3524 нм. Знаю это
никель кристаллизуется в кубической элементарной ячейке недостаточно. Мы все еще
нужно решить, простая ли это кубическая, объемно-центрированная кубическая,
или кубическая гранецентрированная элементарная ячейка.Это можно сделать, измерив
плотность металла.
Единичные клетки: определение
Элементарная ячейка кристалла
Атомы на углах, краях и гранях элементарной ячейки
совместно используется более чем одной элементарной ячейкой, как показано на рисунке ниже.
Атом на грани делится на две элементарные ячейки, поэтому только половина
атом принадлежит каждой из этих ячеек. Атом на ребре — это
разделяют четыре элементарные ячейки, а атом в углу разделяет
восемь элементарных ячеек.Таким образом, только четверть атома на ребре
и одна восьмая часть атома в углу может быть назначена каждому из
элементарные ячейки, которые разделяют эти атомы.
Если никель кристаллизовался в простой кубической элементарной ячейке, то
будет атом никеля на каждом из восьми углов ячейки.
Потому что только одна восьмая из этих атомов может быть отнесена к данному
элементарной ячейке, каждая элементарная ячейка в простой кубической структуре будет иметь
один чистый атом никеля.
Простая кубическая структура:
8 углов x 1/8 = 1 атом
Если бы никель образовывал объемно-центрированную кубическую структуру,
быть двумя атомами на элементарную ячейку, потому что атом никеля в центре
тела не было бы разделено с другими элементарными ячейками.
Объемно-центрированная кубическая структура:
(8 углов x 1/8) + 1 тело = 2 атома
Если никель кристаллизовался с гранецентрированной кубической структурой,
шесть атомов на гранях элементарной ячейки дадут три
чистые атомы никеля, всего четыре атома на элементарную ячейку.
Гранецентрированная кубическая структура:
(8 углов x 1/8) + (6 граней x 1/2) = 4 атома
Поскольку они имеют разное количество атомов в элементарной ячейке,
каждая из этих структур будет иметь разную плотность. Давайте
поэтому рассчитайте плотность никеля на основе каждого из этих
структуры и длина кромки элементарной ячейки для никеля, приведенная в
предыдущий раздел: 0,3524 нм. Для этого нам нужно знать
объем элементарной ячейки в кубических сантиметрах и масса
одиночный атом никеля.
Объем ( V ) элементарной ячейки равен
длина края ячейки ( a ) в кубе.
V = a 3 = (0,3524
нм) 3 = 0,04376 нм 3
Так как 10 9 нм в метре и 100 см в
метр, в сантиметре должно быть 10 7 нм.
Таким образом, мы можем преобразовать объем элементарной ячейки в см 3
следующим образом.
Массу атома никеля можно рассчитать по атомной
вес этого металла и число Авогадро.
Плотность никеля, если он кристаллизовался в простой кубической форме.
структура, следовательно, будет 2,23 г / см 3 , до трех
значимые фигуры.
Простая кубическая структура:
Потому что в элементарной ячейке было бы вдвое больше атомов, если бы
никель кристаллизовался в объемно-центрированной кубической структуре,
плотность никеля в этой структуре была бы вдвое больше.
Объемно-центрированная кубическая структура:
В гранецентрированной ячейке будет четыре атома на элементарную ячейку.
кубическая структура и плотность никеля в этой структуре будет
быть в четыре раза больше.
Гранецентрированная кубическая структура:
Экспериментальное значение плотности никеля 8,90 г / см 3 .
Напрашивается очевидный вывод, что никель кристаллизуется в
гранецентрированная кубическая элементарная ячейка и, следовательно, имеет кубическую
плотноупакованная структура.
Элементарные ячейки: расчет
Металлический или ионный радиус
Можно найти оценки радиусов большинства атомов металлов. Где
откуда эти данные? Откуда мы знаем, например, что
радиус атома никеля 0,1246 нм?
Никель кристаллизуется в гранецентрированной кубической элементарной ячейке с
длина края ячейки 0,3524 нм для расчета радиуса никеля
атом.
Показана одна из граней гранецентрированной кубической элементарной ячейки.
на рисунке ниже.
Согласно этому рисунку диагональ на лицевой стороне
элементарная ячейка в четыре раза больше радиуса атома никеля.
Теорема Пифагора утверждает, что диагональ через
прямоугольный треугольник равен сумме квадратов другого
стороны. Таким образом, диагональ на поверхности элементарной ячейки равна
связаны с длиной края элементарной ячейки следующим уравнением.
Извлечение квадратного корня из обеих частей дает следующее
результат.
Теперь подставим в это уравнение соотношение между
диагональ на грани этой элементарной ячейки и радиус
атом никеля:
Решение для радиуса атома никеля дает значение
0,1246 нм:
Аналогичный подход можно использовать для оценки размера
ион. Начнем с того, что длина края ячейки в
хлорид цезия составляет 0,4123 нм для расчета расстояния между
центры ионов Cs + и Cl — в
CsCl.
CsCl кристаллизуется в простой кубической элементарной ячейке Cl —
ионов с ионом Cs + в центре тела
ячейку, как показано на рисунке ниже.
Прежде чем мы сможем вычислить расстояние между центрами
ионы Cs + и Cl — в этом кристалле,
однако мы должны признать справедливость одного из простейших
предположения об ионных твердых телах: положительные и отрицательные ионы
которые образуют эти соприкасающиеся кристаллы.
Таким образом, можно предположить, что диагональ тела
элементарная ячейка CsCl эквивалентна сумме радиусов двух
Cl — ионы и два иона Cs + .
Трехмерный эквивалент теоремы Пифагора
предполагает, что квадрат диагонали на теле
куб — это сумма квадратов трех сторон.
Извлечение квадратного корня из обеих частей этого уравнения дает
следующий результат.
Если длина края ячейки в CsCl составляет 0,4123 нм, диагональ
поперек тела в этой элементарной ячейке составляет 0,7141 нм.
Сумма ионных радиусов Cs + и Cl —
ионов составляет половину этого расстояния, или 0,3571 нм.
Если бы у нас была оценка размера либо Cs +
или ион Cl — , мы могли бы использовать результаты для расчета
радиус другого иона. Ионный радиус Cl —
ion равен 0.181 нм. Подставляя это значение в последнее уравнение
дает значение 0,176 нм для радиуса Cs +
ион.
Результаты этого расчета находятся в разумном согласии.
со значением 0,169 нм, известным для радиуса Cs +
ион. Несоответствие этих значений отражает тот факт, что
ионные радиусы варьируются от кристалла к кристаллу. Табличные
значения являются средними результатами ряда расчетов
этот тип.
.

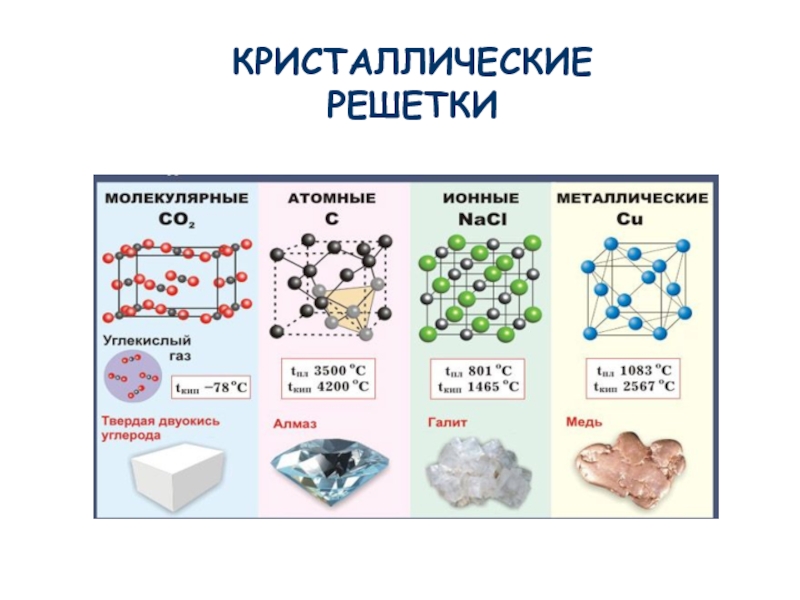

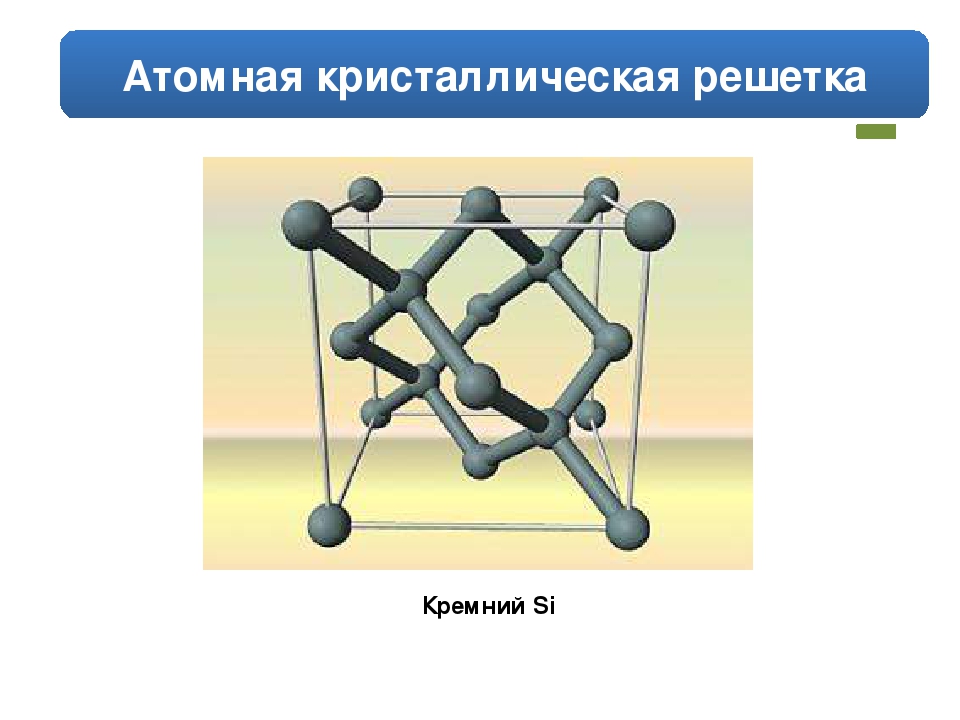 Кристаллическая решетка хлорида натрия NaCl:
Кристаллическая решетка хлорида натрия NaCl: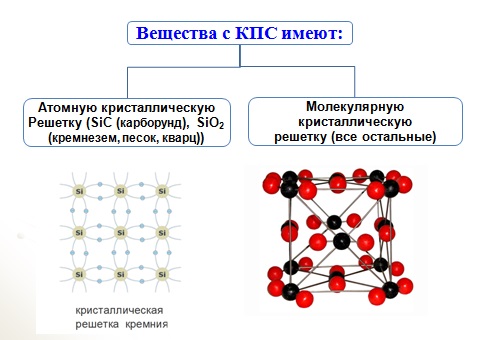

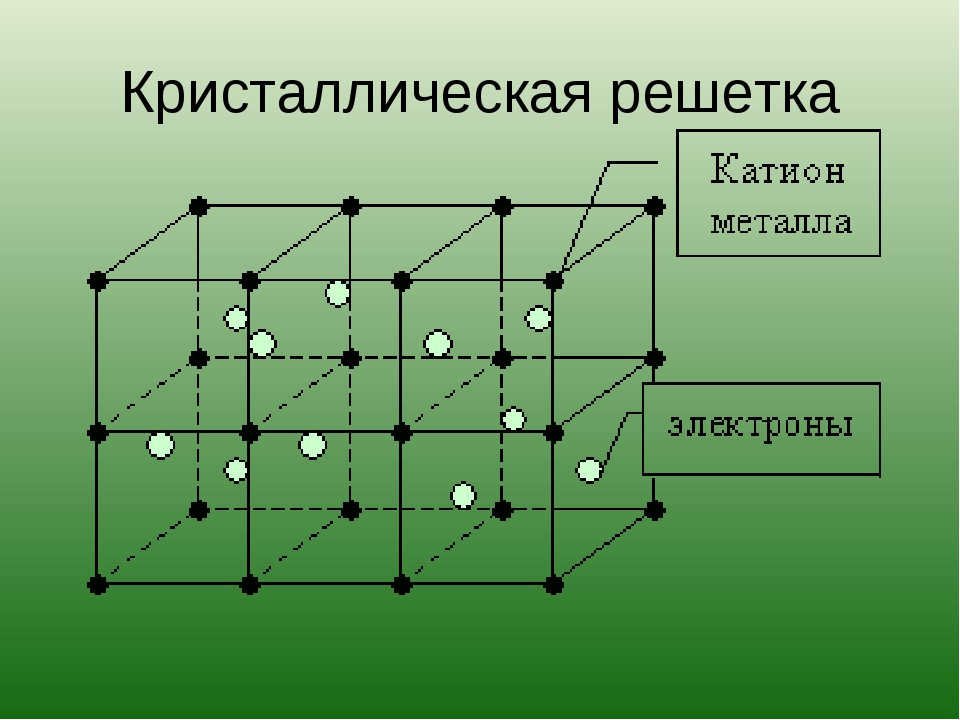 В узлах кристаллической решетки меди находятся
В узлах кристаллической решетки меди находятся Вещества с атомной кристаллической решеткой
Вещества с атомной кристаллической решеткой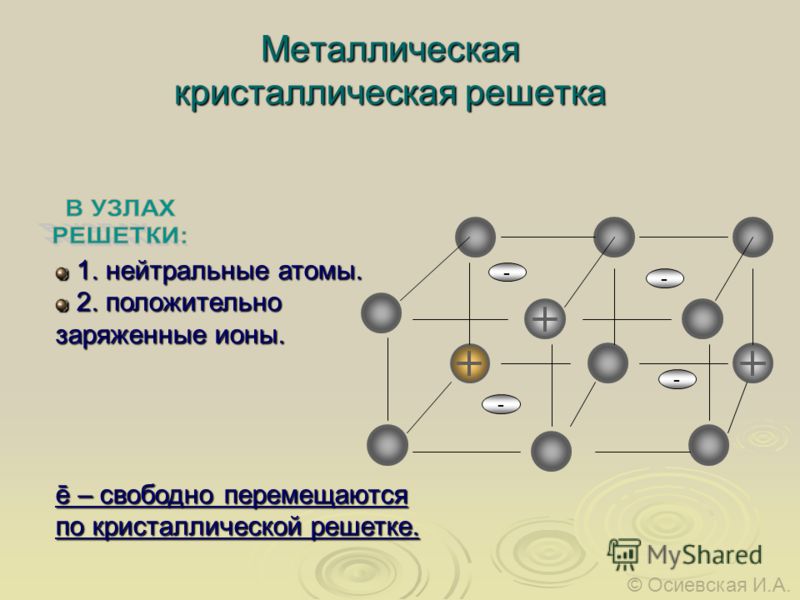 Наиболее высокую температуру плавления имеет вещество:
Наиболее высокую температуру плавления имеет вещество:  Перечислите свойства, характеризующие вещество с атомной кристал-
Перечислите свойства, характеризующие вещество с атомной кристал- Вещества с молекулярной решеткой имеют низкие температуры
Вещества с молекулярной решеткой имеют низкие температуры В узлах кристаллической решетки поваренной соли находятся
В узлах кристаллической решетки поваренной соли находятся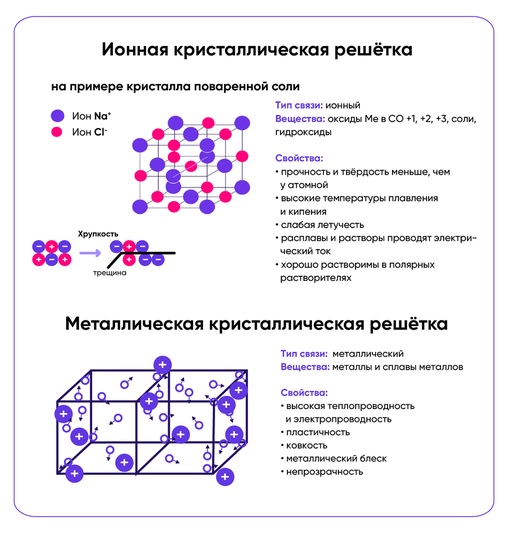 Вещества с молекулярной кристаллической решеткой
Вещества с молекулярной кристаллической решеткой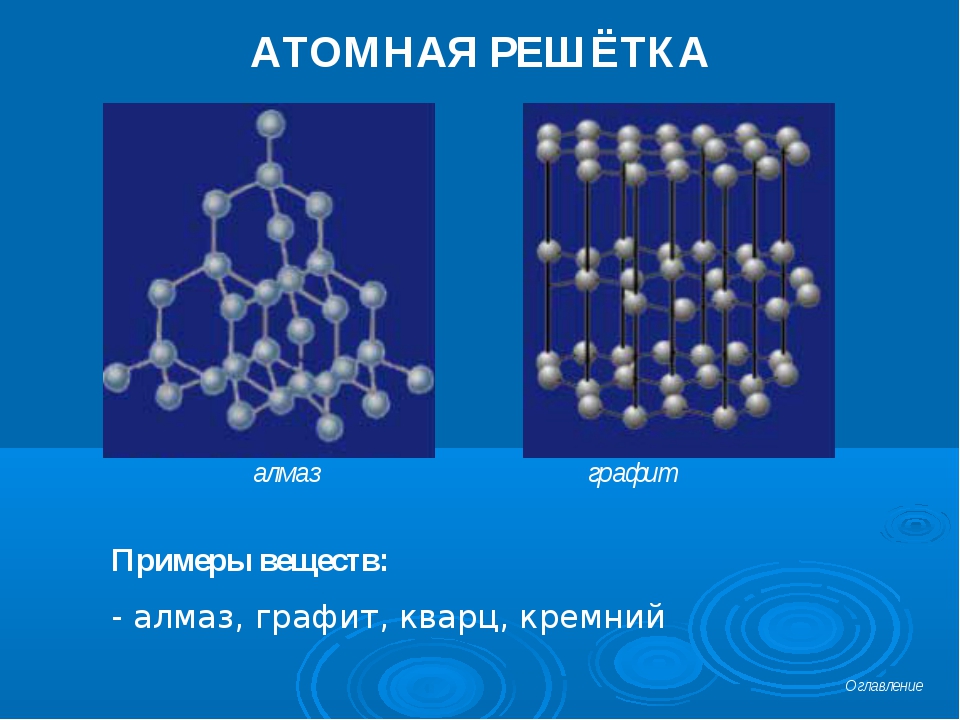 Ионную кристаллическую решетку имеет вещество:
Ионную кристаллическую решетку имеет вещество: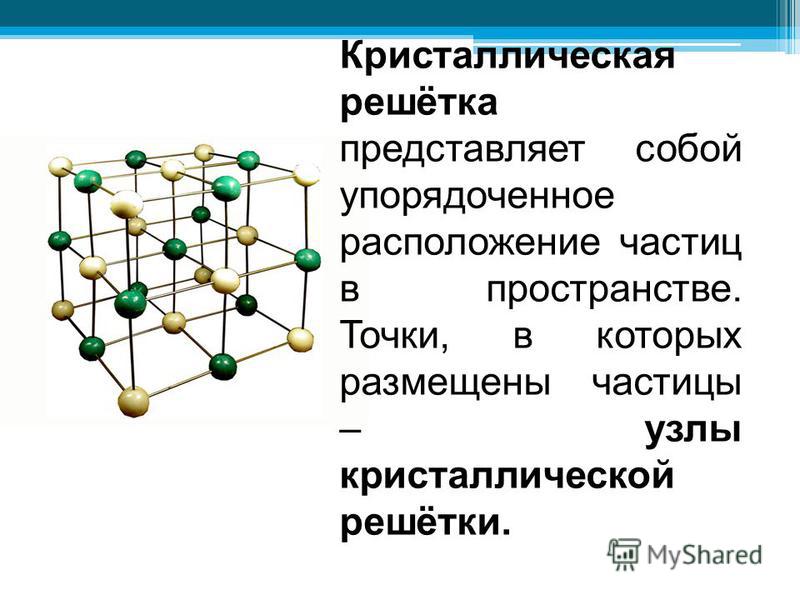 Перечислите свойства, характеризующие вещество с молекулярной кристал-
Перечислите свойства, характеризующие вещество с молекулярной кристал-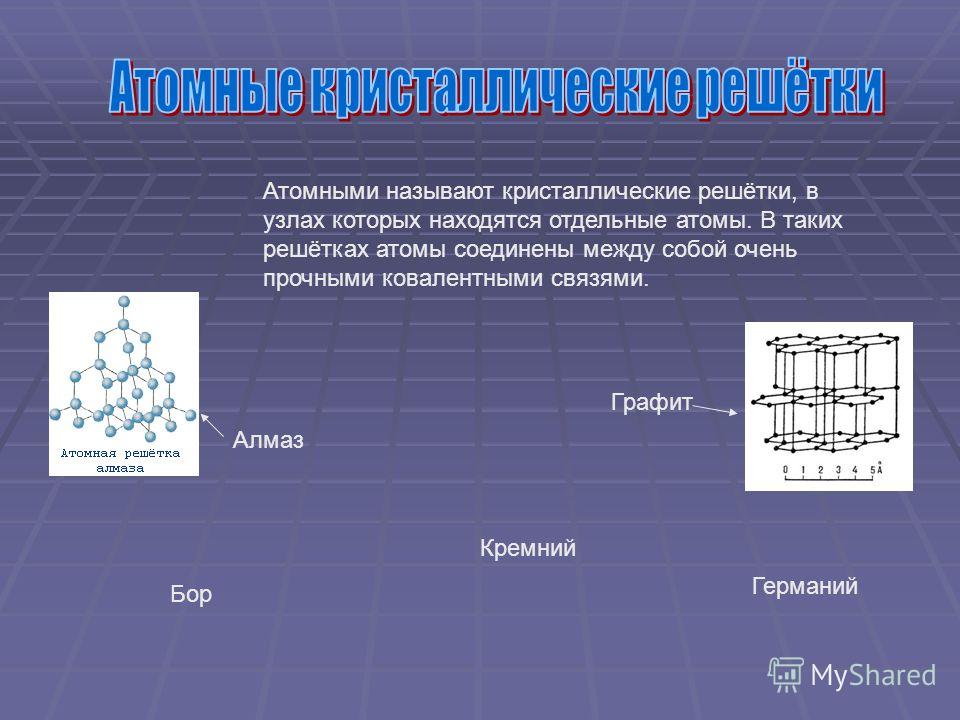 Вещества с атомной кристаллической решеткой имеют низкие
Вещества с атомной кристаллической решеткой имеют низкие