Содержание
ICSC 0183 — АЗОТНАЯ КИСЛОТА
ICSC 0183 — АЗОТНАЯ КИСЛОТА
| АЗОТНАЯ КИСЛОТА | ICSC: 0183 |
| СЕЛИТРЯНОЙ СПИРТ | Ноябрь 2016 |
| CAS #: 7697-37-2 | |
| UN #: 2031 | |
| EINECS #: 231-714-2 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск взрыва при контакте с несовместимыми веществами. См. Химические Опасности. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск взрыва при контакте с несовместимыми веществами. См. Химические Опасности. | НЕ допускать контакта с несовместимыми материалами: См. Химические Опасности | Использовать большое количество воды, двуокись углерода. НЕ использовать порошок, пену. В случае пожара: охлаждать бочки и т.д. распыляя воду. Не допускать контакта вещества с водой. |
| ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. Ощущения жжения. Сбивчивое дыхание. Затрудненное дыхание. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Может потребоваться искусственное дыхание. Немедленно обратиться за медицинской помощью. Полусидячее положение. Может потребоваться искусственное дыхание. Немедленно обратиться за медицинской помощью. |
| Кожа | Боль. Окрашивание кожи в желтый цвет. Серьезные ожоги кожи. | Защитные перчатки. Защитная одежда. Фартук. | Надевать защитные перчатки при оказании первой помощи. Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. Немедленно обратиться за медицинской помощью . |
| Глаза | Покраснение. Боль. Сильные ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). Немедленно обратиться за медицинской помощью. |
| Проглатывание | Ожоги в полости рта и горле. Ощущение жжения за грудиной. Боль в животе. Рвота. Шок или сильная слабость. Ощущение жжения за грудиной. Боль в животе. Рвота. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Ничего не давать пить. НЕ вызывать рвоту. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Покинуть опасную зону! Проконсультироваться со специалистом! Индивидуальная защита: костюм химической защиты, включая автономный дыхательный аппарат. НЕ засыпать древесными опилками или другими горючими абсорбентами. Вентилировать. Собрать подтекающую жидкость в герметичные контейнеры. Осторожно нейтрализовать остаток при помощи карбоната натрия. Затем смыть большим количеством воды. |
Согласно критериям СГС ООН
ОПАСНО
Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от горючих веществ, восстановителей, оснований, органических химических веществ и пищевых продуктов и кормов. Прохладное место. Хранить сухим. Хранить в хорошо проветриваемом помещении. Хранить только в оригинальной упаковке. | |
| УПАКОВКА | |
| Небьющаяся упаковка. Поместить бьющуюся упаковку в небьющийся контейнер. Не перевозить с продуктами питания и кормами для животных. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| АЗОТНАЯ КИСЛОТА | ICSC: 0183 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: HNO3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
TLV: 2 ppm как TWA; 4 ppm как STEL. EU-OEL: 2.6 mg/m3, 1 ppm как STEL |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Поэтому крайне важны отдых и медицинское наблюдение.IARC considers mists of strong inorganic acid to be carcinogenic (group 1). However there is no information available on the carcinogenicity of other physical forms of this substance. Therefore no classification for carcinogenicity under GHS has been applied. NEVER pour water into this substance; when dissolving or diluting always add it slowly to the water. При превышении предельной допустимой концентрации запах не является достаточным предупреждающим признаком. Промойте загрязненную одежду большим количеством воды ввиду опасности возгорания |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: O, C; R: 8-35; S: (1/2)-23-26-36-45; Примечание: B |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Азотная кислота — ООО «Химпродукт»
Азотная кислота представляет собой бесцветную едкую жидкость.
Азотная кислота – это минеральная кислота, которую называют спиртом нитра и аква фортис, что означает сильную воду. Дымящаяся азотная кислота названа из-за паров, выделяемых кислотой, когда она соединяется с влажным воздухом. Дымящаяся азотная кислота является высококонцентрированной и обозначается красной дымящей азотной кислотой или белой дымящей азотной кислотой. Красная дымящаяся азотная кислота, как следует из названия, выделяет красновато-коричневый дым при контакте с воздухом. Цвет исходит от диоксида азота, который выделяется на воздухе.
Концентрация азотной кислоты большинства коммерческих марок составляет от 50% до 70%.
Свойства: бесцветная жидкость; очень коррозийная; плотность 1,503 г / л; замерзает при –42 ° С; температура кипения при 83 ° С; полностью смешивается с водой.
Азотная кислота – сильный окислитель, пожароопасным окислителем. Выглядит как бесцветная или слегка желтоватая жидкость, которая смешивается с водой и закипает при температуре 86 ℃ (187 ℉). Азотная кислота (aqua fortis) используется для химического синтеза, взрывчатых веществ и производства удобрений, а также в металлургии, травлении, гравировании и флотации руды.
Применение азотной кислоты
Азотная кислота – важный исходный материал для производства удобрений и химикатов. В разбавленном виде ее используют для растворения и травления металлов. Также азотка – важный материал для изготовления взрывчатки.
Концентрированную азотную кислоту в соединении с серной кислотой используют для нитрования органических соединений. Комбинация азотной и серной кислоты применяется для превращения простого хлопка в нитрат целлюлозы.
Азотную кислоту используют в процессе мокрой пластины в качестве добавки к разработчикам сульфата железа, чтобы улучшить цвет изображения амбротипов и ферротипов. Она также добавляется для понижения рН серебряной ванны для коллодионных пластинок.
Она также добавляется для понижения рН серебряной ванны для коллодионных пластинок.
Азотная кислота является одним из наиболее широко используемых промышленных химикатов. Он используется в производстве удобрений, взрывчатых веществ, красителей, синтетических волокон и многих органических и неорганических нитратов; и как обычный лабораторный реагент.
Главным использованием азотной кислоты является производство удобрений, причем примерно три четверти азотной кислоты уходит для этого. Аммиачная селитра является предпочтительным азотным удобрением из-за ее простоты в производстве, экономичности и высокого содержания азота, которое составляет 35%. Азотная кислота также может быть использована для подкисления фосфоритов для производства азотно-фосфорных удобрений.
Азотная кислота является сильным окислителем, что делает ее полезной во взрывчатых веществах и в качестве ракетного топлива. Азотная кислота широко используется в металлургии. Азотная кислота используется для травления стальных и латунных поверхностей при обработке металла.
Опасность для человека
Является сильным окислителем, эта кислота может вступать в бурные реакции с мощными восстановителями. Многие реакции нитрования органики дают взрывоопасные продукты. Кислота очень агрессивно воздействует на кожу, вызывая серьезные травмы. Концентрированная кислота (68,8 мас.%) является умеренно агрессивной для кожи. Кислота может разлагаться при нагревании или фотохимически, выделяя токсичный газообразный диоксид азота.
Угроза здоровью
Азотная кислота является едким веществом, вызывающим желтые ожоги кожи. Он разъедает ткани организма, превращая сложные белки в желтое вещество, называемое ксантопротеиновой кислотой. Проглатывание кислотой может привести к жжению и коррозии желудка. Доза 5–10 мл может быть смертельной для человека.
Пожароопасность
Негорючее, само вещество не горит, но может разлагаться при нагревании с образованием едких и / или токсичных паров. Пары могут накапливаться в закрытых помещениях (подвал, резервуары, бункерные / цистерны и т. Д.). Вещество будет реагировать с водой, выделяя едкие и / или токсичные газы и сточные воды. При контакте с металлами может выделяться горючий газообразный водород. Контейнеры могут взорваться при нагревании или загрязнении водой.
Д.). Вещество будет реагировать с водой, выделяя едкие и / или токсичные газы и сточные воды. При контакте с металлами может выделяться горючий газообразный водород. Контейнеры могут взорваться при нагревании или загрязнении водой.
Хранение
Хранить в хорошо вентилируемом месте в плотно закрытой/герметичной упаковке.
Купить азотную кислоту
Компания Химпродукт предлагает купить азотную кислоту в Украине с наших складов в городах Киев, Харьков, Днепр, Одесса и Львов.
Подробную информацию, а также цену азотной кислоты Вы можете узнать у наших менеджеров по телефонам:
+ 38 (098) 882-15-15 (Viber, Telegram, WhatsApp)
+ 38 (093) 880-15-15
+ 38 (066) 306-10-50
+ 38 (044) 228-08-72
либо задать вопрос на email: sales@chem. com.ua
com.ua
Также заказать азотную кислоту Вы можете на нашем сайте chem.ua
Отправка заказов по Украине осуществляется службами доставки и собственным транспортом.
Азотная кислота ХЧ
СПЕЦПРЕДЛОЖЕНИЯ
Принимаем заявки на поставку Гипохлорита натрия марки А по ГОСТ 11086-76 в автоцистернах по 23 тонны.
Азотная кислота — сильная одноосновная кислота, представляющая собой бесцветную или слегка желтоватую жидкость с удушливым запахом. Неограниченно растворима в воде.
Азотная кислота химически чистая (ХЧ) представляет собой продукт получаемый методом абсорбции водой нитрозных газов, образующихся при окислении аммиака кислородом воздуха в присутствии катализатора.
Область применения:
1. в лабораторной практике в качестве реактива
2. в производстве красителей и лекарств
в производстве красителей и лекарств
3. в полиграфической промышленности для травления печатных форм
4. в военной промышленности для синтеза различных веществ
5. в ювелирном деле как основной способ опрелеления золота в золотом сплаве
Азотная кислота ХЧ в канистрах по 28 кг, 14 кг и в мелкой таре по 1,2 кг постоянно в наличии на складе в г. Саратове. По вопросам приобретения необходимо связаться по телефонам (8452) 33-85-11, 33-85-17, 25-24-51.
Качественные характеристики на Азотную кислоту ХЧ ГОСТ 4461-77 представлены в таблице:
НАИМЕНОВАНИЕ ПОКАЗАТЕЛЕЙ | НОРМА по ГОСТ 4461-77
|
1. Массовая доля азотной кислоты , %, не менее | 65,0 |
2. Массовая доля остатка после прокаливания в виде сульфатов , %, не более | 0,0005 |
3. | 0,000001 |
4. Массовая доля сульфатов, %, не более | 0,0001 |
5. Массовая доля хлоридов , %, не более | 0,00003 |
6. Массовая доля железа, %, не более | 0,00002 |
7. Массовая доля фосфатов, %, не более | 0,00002 |
8. Массовая доля тяжелых металлов , %, не более | 0,00002 |
Код ТН ВЭД 2808000000. Кислота азотная; кислоты сульфоазотные. Товарная номенклатура внешнеэкономической деятельности ЕАЭС
Позиция ТН ВЭД
|
Позиция ОКПД 2
Таможенные сборы — ИМПОРТ
| Базовая ставка таможенной пошлины | 5% реш.  54 54 |
| Акциз | Не облагается |
| НДС | 20% |
Рассчитать контракт
Урок №33.
 Азотная кислота. Строение молекулы. Свойства разбавленной азотной кислоты
Азотная кислота. Строение молекулы. Свойства разбавленной азотной кислоты
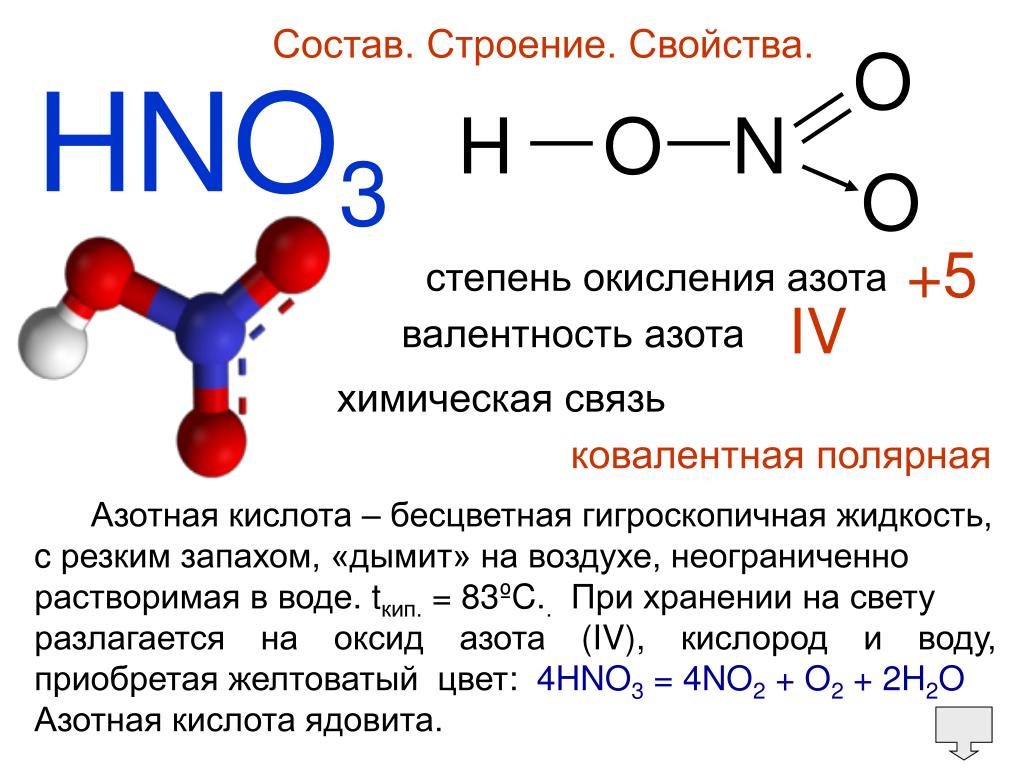
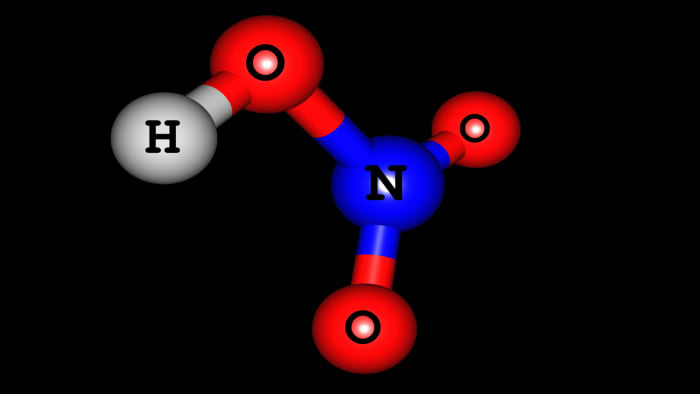
HNO3 — Азотная кислота
химические формулы
Опытным путём доказано, что в молекуле
азотной кислоты между двумя атомами кислорода и атомом азота две химические
связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а
валентность равна IV.
Физические
свойства
Азотная кислота HNO3 в чистом
виде — бесцветная жидкость с резким удушливым запахом, неограниченно
растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3. В
небольших количествах она образуется при грозовых разрядах и присутствует в
дождевой воде.
Под действием света азотная кислота частично
разлагается с выделением NО2 и
за cчет
этого приобретает светло-бурый цвет:
N2 + O2грозовыеэл.разряды→ 2NO
2NO +
O2 → 2NO2
4НNО3свет→ 4NО2↑(бурый
газ) + 2Н2О + О2
Азотная кислота
высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке
обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты,
Эти газы очень ядовиты,
так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие
органические вещества. Бумага и ткани разрушаются вследствие окисления
образующих эти материалы веществ. Концентрированная азотная кислота вызывает
сильные ожоги при длительном контакте и пожелтение кожи на несколько
дней при кратком контакте. Пожелтение кожи
свидетельствует о разрушении белка и выделении серы (качественная реакция на
концентрированную азотную кислоту – жёлтое окрашивание из-за выделения
элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То
есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с
концентрированной азотной кислотой в резиновых перчатках.
Химические свойства азотной кислоты
Для азотной кислоты характерны свойства: общие с другими кислотами и специфические:
ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ
1. Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный.
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3—
Изменение цветов индикаторов в кислотах
2. Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3— → 2K+ + 2NO3— + H2O
K2O + 2H+ → 2K+ + H2O
3. Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3— + Na+ + OH— → Na+ + NO3— + H2O
H+ + OH— → H2O
4. Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3— + 2Na+ + СO32- → 2Na+ + 2NO3— + H2O + CO2
2H+ + СO32- → H2O + CO2
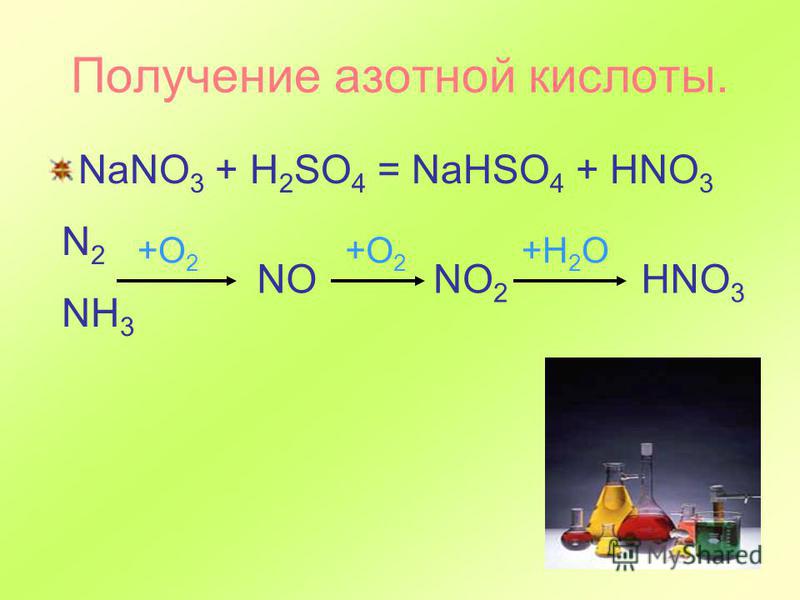
Получение
1.
Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
2.
Промышленный способ
Осуществляется в три этапа:
a)
Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 →
4NO + 6H2O (Условия: катализатор – Pt,
t = 500˚С)
б) Окисление
кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в)
Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O
↔ 4HNO3
или
3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
Тренажёр «Получение азотной кислоты»
Применение
- в производстве минеральных удобрений;
- в военной промышленности;
- в фотографии — подкисление
некоторых тонирующих растворов; - в станковой графике — для
травления печатных форм (офортных досок, цинкографических типографских
форм и магниевых клише).
- в производстве взрывчатых и
отравляющих веществ
Вопросы
для контроля:
№1. Степень окисления атома азота в
молекуле азотной кислоты
a. +4
b.
+3
c.
+5
d.
+2
№2. Атом азота в молекуле азотной
кислоты имеет валентность равную —
a.
II
b.
V
c.
IV
d.
III
№3. Какими физическими свойствами
характеризуют чистую азотную кислоту?
a. без цвета
b.
не имеет запаха
c.
имеет резкий раздражающий запах
d.
дымящая жидкость
e.
окрашена в жёлтый цвет
№4. Установите соответствие между
исходными веществами и продуктами реакции:
a) NH3 + O2 | 1) |
b) KNO3 + H2SO4 | 2) NO2 + О2 + H2O |
c) HNO3 | 3) |
d) NO + O2 | 4) KHSO4 + HNO3 |
№5. Расставьте коэффициенты методом
Расставьте коэффициенты методом
электронного баланса, покажите переход электронов, укажите процессы окисления
(восстановления; окислитель (восстановитель):
NO2 + О2 + H2O
↔ HNO3
ХиМиК.ru — АЗОТНАЯ КИСЛОТА — Химическая энциклопедия
АЗОТНАЯ КИСЛОТА HNO3, мол. м. 63,016, бесцв. жидкость
(см. табл.). Сильная одноосновная к-та (рКа —1,64). Молекула
имеет плоскую структуру (длины связей в нм):
Твердая азотная кислота образует две кри-сталлич. модификации-с моноклинной и
ромбич. решетками. Конц. к-та малоустойчива, при нагр. или под действием
света частично разлагается: 4HNO3 -> 4NO2 + 2H2O
+ O2; образующийся NO2 окрашивает к-ту в бурый цвет
и придает ей специ-фич. запах.
СВОЙСТВА АЗОТНОЙ КИСЛОТЫ И LE КРИСТАЛЛОГИДРАТОВ
|
Показатель
|
HNO3
|
Моногидрат
|
Тригидрат
|
|
Плотн.
|
1,513
|
_
|
_
|
|
Т. пл., °С ……..
|
-41,59 (82.6)*
|
-37,62
|
-18,47
|
|
|
10,47
|
17,50
|
29109
|
|
|
39.1
|
—
|
—
|
|
|
-174,1 (_ 134,9)**
|
-473,5
|
-1056,1
|
|
С°р (300 КХ Дж/(моль*К)
|
109,9 (54,22)**
|
182
|
325
|
|
|
-33.68
|
-19.82
|
-8,92
|
|
S0298, Дж/(моль*К) .
|
155,6 (266,9)**
|
217
|
344
|
* Т-ра кипения. ** Для газа при 298 К.
Рис. 1. Схема производства азотной кистолы под единым давлением (0,65-0,70
МПа): 1-воздушный фильтр; 2-реактор каталитич. очистки отходящего газа;
очистки отходящего газа;
3-камера сгорания; 4-воздушный компрессор; 5-газовая турбина; 6-редуктор;
7-электродвигатель; 8-промежут. холодильник; 9-котел-утилизатор; 10 -экономайзер;
11-поролитовый фильтр; 12-смеситель NH3 и воздуха; 13- подогреватель
воздуха; 14-испарителъ NH3; 15-аппарат для окисления NO; 16-контактный
аппарат для окисления NH3; 17 — холодильник-конденсатор; 18
— абсорбц. колонна; 19-подогреватель отходящего газа.
Азотная кислота смешивается с водой во всех соотношениях. В водных р-рах практически
полностью диссоциирует на Н+ и NO—3. Образует
с водой азеотропную смесь (68,4% по массе HNO3; т. кип. 120,7°С,
d2041,41),
моно- и тригидраты. Для водных р-ров d204составляет
1,0543 (10%-ная к-та), 1,1150 (20%-ная), 1,3100 (50%-ная), 1,4134 (70%-ная),
1,4826 (90%-ная). Для 49,94%-ного р-ра парциальное давление HNO3 и
воды составляет (в Па) соотв. 47,91 и 1030,75, для 69,7%-ного-383,04 и
47,91 и 1030,75, для 69,7%-ного-383,04 и
388,36, для 96,48%-ного-5531,47 и 14,63. Азотная кислота ограниченно раств. в эфире.
Азотная кислота — сильный окислитель. Под действием азотной кислоты металлы (за исключением
Pt, Rh, Ir, Nb, Zr, Та, An) превращаются в нитраты или оксиды, сера энергично
окисляется в H2SO4, фосфор-в Р2О5,
орг. соед. окисляются и нитруются. Стойкость конструкц. материалов к азотной кислоте
определяется св-вами поверхностных оксидных пленок. В разб. азотной кислоте стойки
хромо-никелевые стали, Ti, в концентрированной-чистый Аl, высококремнистый
чугун, хромо-никель-кремниевые стали. Титан в среде конц. азотной кислоты, содержащей
растворенные оксиды азота, приобретает пирофорные св-ва. В азотной кислоте любой
концентрации стойки стекло, кварц, фторопласт-4.
Рис. 2. Схема производства азотной кислоты с двумя ступенями давления (окисление
NH3 при 0,35 МПа, абсорбция МО2 при 0,8 МПа): 1-фильтр
воздуха; 2-воздушный компрессор; 3- компрессор нитрозного газа; 4 -газовая
турбина; 5 -паровая турбина; 6-смеситель NH3 и воздуха; 7-контактный
аппарат для окисления NH3; 8-котел-утилизатор; 9-конденсатор;
10-насос; 11-подогреватель отходящего газа; 12 -холодильник-конденсатор;
13-сепаратор; 14-абсорбц. колонна; 15-испаритель NH3.
колонна; 15-испаритель NH3.
Для практич. целей используют 30-60%-ные водные р-ры азотной кислоты или 97-99%-ные
(конц. азотная кислота). Смесь концентрированных азотной и соляной к-т (соотношение
по объему 1 :3) наз. царской водкой; она растворяет даже благородные металлы.
Смесь HNO3концентрации ок. 100% и H2SO4концентрации ок. 96% при их соотношении по объему ок. 9:1 наз. меланжем.
Пром. методы получения разб. HNO3 включают след. стадии:
получение NO, окисление его до NO2, абсорбцию NO2водой, очистку отходящих газов (содержащих в осн. N2) от оксидов
азота. Осн. способ получения NO заключается в окислении NH3кислородом воздуха в присут. катализатора: 4МН3 + 5О2
-> 4NO + 6Н2О + 907,3 кДж. Катализатор-сетка из сплавов Pt (80-95%)
с металлами платиновой группы. В СССР используется двухступенчатый катализатор
(первая ступень-платиновые сетки, вторая-оксидный неплатиновый катализатор),
позволяющий сократить кол-во загружаемой платины на 40-60%. Потери Pt при
Потери Pt при
одноступенчатом катализаторе, в осн. из-за мех. уноса, составляют (г Pt
на 1 т HNO3): 0,05 при 0,1 МПа, 0,1 при 0,4 МПа, 0,15 при 0,7
МПа. При использовании двухступенчатого катализатора потери Pt снижаются
на 15-25%.
Окисление NO (2NO + О2 ->2NO2 + 124 кДж) протекает
в газовой фазе при охлаждении нитрозного газа (полученного на стадии окисления
NH3) до 160-250°С; ниже 100°С идет димеризация (2NO2
-> N2O4 + 56,9 кДж/моль). Абсорбцию NO2водой (3NO2 + H2O->2HNO3 + NO + + 136,2
кДж/моль) осуществляют в тарельчатых колоннах со значит. межтарелочными
объемами. Отходящий газ содержит 0,02-0,15% по объему оксидов азота, 2-5%
О2 и N2; при содержании остаточных оксидов азота
более 0,02% проводят их каталитич. восстановление до N2. В случае
восстановления аммиаком (кат. -оксиды А1 и V; 250-300СС) происходят
-оксиды А1 и V; 250-300СС) происходят
р-ции:
3NO + 2NH3 -> 2,5N2 + ЗН2О 3NO2
+ 4NH3 -> 3,5N2 + 6H2O
Отходящий газ очищают также на алюмопалладиевом кат. (т-ра начала р-ции
350-500°С) с использованием в кач-ве восстановителя прир. газа:
СН4 + 2О2 -> СО2 + 2Н2О
+ 802 кДж СН4 + 2NO2 -> N2 + 2H2O
+ СО2 + 868 кДж СН4 + 4NO -> 2N2 + 2Н20
+ СО2 + 1160кДж
Установки по произ-ву разб. HNO3 (см. рис. 1 и 2) характеризуются
высокой производительностью (350-1400 т/сут), полнотой использования теплоты
хим. р-ций, экономным расходованием сырья и вспомогат. материалов.
Конц. азотную кислоту получают двумя осн. способами. Первый заключается в ректификации
тройных смесей, содержащих HNO3, воду и к. -л. водоотнимающее
-л. водоотнимающее
в-во, обычно H2SO4 или Mg(NO3)2.
В результате получают пары 100%-ной HNO3, к-рые конденсируют,
и водные р-ры водоотнимающего агента. Последние упаривают и возвращают
в произ-во. Второй способ основан на р-ции: 2N2O4M
+ + 2Н2О(ж) + О2(г)->4НNO3(ж) + 78,8 кДж
(«ж»-жидкость, «г»-газ). При давлении ок. 5 МПа и использовании чистого
О2 образуется 97-98%-ная HNO3, содержащая до 30%
по массе растворенных оксидов азота. Азотную кислоту получают разгонкой этого р-ра.
При 0,7-1,0 МПа и использовании воздуха образуется 80-85%-ная HNO3
и азеотропная смесь азотной кислоты с водой. Жидкий N2O4 получают
гл. обр. путем растворения NO2, содержащегося в нитрозном газе,
80-100%-ной HNO3 с послед. разгонкой этого р-ра и конденсацией
жидкого N2O4.
Азотную кислоту особой чистоты производят ректификацией 97-98,5%-ной HNO3
в аппаратуре из силикатного или кварцевого стекла. Содержание примесей
в такой к-те менее 1 * 10-6% по массе.
Метод получения азотной кислоты, основанный на взаимод. N2 и О2
воздуха
выше 2200°С (N2 + О2 -> 2NO + 180,6 кДж) с послед.
быстрым охлаждением NO, его окислением и абсорбцией NO2водой,
распространения пока не получил.
Осн. кол-во разб. HNO3 расходуется в произ-ве NH4NO3
и
сложных минер. удобрений, нитратов Na, К, Са и др., в гидрометаллургии.
Конц. к-та используется при получении ВВ, H2SO4,
H3PO4, ароматич. нитросоединений, красителей, входит
в состав ракетного топлива. Азотная кислота используется также для травления металлов,
полупроводниковых материалов и др.
Произ-во азотной кислоты взрывоопасно из-за использования в нем горючих и взрывоопасных
в-в — NH3 и прир. газа. Под действием азотной кислоты воспламеняются бумага,
масло, древесина, уголь. При попадании на кожу она вызывает ожоги. Аммиак,
пары HNO3, оксиды азота токсичны. ПДК паров HNO3
и оксидов азота 2 мг/м3 (в пересчете на NO2). Произ-во
азотной кислоты в развитых кап. странах ок. 22 млн. т (1982).
===
Исп. литература для статьи «АЗОТНАЯ КИСЛОТА»: Справочник азотчика, под ред. Н. А. Симулина [и др.], т.
2, М., 1969; А трощен ко В. И., Каргин С. И., Технология азотной кислоты,
М., 1970; Производство азотной кислоты в агрегатах большой единичной мощности,
под
ред. В. М. Олевского, М., 1985. А. А. Солоха.
Страница «АЗОТНАЯ КИСЛОТА» подготовлена по материалам химической энциклопедии.
Еще по теме:
Азотная Кислота (С Чем Взаимодействует, Применение)
Это бесцветная жидкость с резким удушливым запахом, являющаяся сильным одноосновным окислителем и электролитом. При температуре -41°С превращается в твердое кристаллическое вещество, при концентрациях азота 97-99% дымит на воздухе.
При температуре -41°С превращается в твердое кристаллическое вещество, при концентрациях азота 97-99% дымит на воздухе.
Смешивается с водой во всех соотношениях, при этом почти полностью диссоциирует на ионы и образует азеотропную смесь. При нагревании и на свету начинает разлагаться на оксид азота и воду, приобретая при этом бурую окраску. Чем выше температура и концентрация реагента, тем быстрее идет разложение.
Проявляет химические свойства окислителя, при этом азот может восстанавливаться до степени окисления от +5 до -3. Глубина восстановления зависит от концентрации кислоты и природы восстановителя. К примеру, концентрированный реагент не взаимодействует с такими металлами, как железо, алюминий, хром, золото, платина, натрий, иридий, так как на их поверхности образуется защитная пленка, не позволяющая окисляться дальше. С остальными металлами кислота реагирует с выделением бурого газа.
Разбавленный реагент взаимодействует с щелочноземельными металлами, цинком и железом с окислением до аммиачной селитры или аммиака. С другими металлами и неметаллами проявляет взаимодействие с образованием оксида азота.
С другими металлами и неметаллами проявляет взаимодействие с образованием оксида азота.
Смесь одного объема азотной кислоты с тремя объемами соляной называется «царской водкой». Это соединение способно растворять металлы, в том числе платину и золото. Его сильные окислительные свойства обусловлены образующимися хлоридом нитрозила и атомарным хлором.
Где применяется азотная кислота?
Этот реагент является одним из наиболее востребованных во многих отраслях промышленности. В частности, он используется для производства комбинированных и азотных удобрений (аммиачной, натриевой, калиевой и кальциевой селитры, нитрофоски, нитрофоса), взрывчатых веществ (тринитротолуола и пр.), ракетной техники, различных сернокислых солей и органических красителей.
В цветной и черной металлургии применяется для травления и растворения металлов, разделения серебра и золота. В органическом синтезе широко используют соединение серной и концентрированной азотной кислоты – «нитрующей смеси».
Также материал применяют для изготовления полупродуктов для получения искусственных красителей и других химикатов, в химической и полиграфической промышленностях. Он используется и при гальванизации, хромировании и никелировании деталей, в электротехнической и молочной отраслях.
Где приобрести?
Мы реализуем высококачественные химпрепараты по самым выгодным ценам. Убедитесь в этом: просто нажмите на кнопку «заказать» рядом с фотографией товара и введите ваши контакты. Мы свяжемся с вами в ближайшее время для уточнения деталей.
Азотная кислота
Азотная кислота производится из аммиака и является ключевым химическим веществом при производстве удобрений.
Использование азотной кислоты
Азотная кислота (80%) в основном используется в производстве удобрений. 96% из них используется для производства нитрата аммония и нитрата аммония кальция. Относительно небольшое количество нитрата аммония используется для изготовления взрывчатых веществ.
Некоторое количество азотной кислоты используется для производства промежуточных продуктов в полимерной промышленности, особенно при производстве гександиовой кислоты (адипиновой кислоты) для производства полиамидов и ТДИ (толуолдиизоцианат или метилбензолдиизоцианат) и динитробензола из ряда реагентов, используемых для производства полиуретанов.Нитробензол используется для производства анилина, который является ключевым реагентом для создания красителей.
Рисунок 1 Использование азотной кислоты.
Годовое производство азотной кислоты
1. 2014, Grand View Research, 2016
Производство азотной кислоты
Производство азотной кислоты включает две стадии:
а) окисление аммиака
б) абсорбция образующихся оксидов азота
(а) Окисление аммиака
Эта часть процесса включает окисление аммиака до монооксида азота (оксида азота):
Условия, способствующие образованию продуктов при подходящей для реакции скорости реакции:
- высокое давление
- избыток воздуха
- катализатор
- при такой высокой температуре, которая соответствует практически достижимым скоростям реакции, эффективности катализатора и рабочему давлению
Большинство заводов работают с:
- умеренное давление (10-13 атм)
- кислород (воздух)
- Сплав платины и родия в качестве катализатора
- температура при ок.
 1200 K
1200 K
Основное преимущество высокого давления состоит в том, что оно существенно уменьшает размер необходимого оборудования и трубопроводов и, следовательно, ведет к снижению капитальных затрат.
По возможности, аммиак производится на том же участке. Его фильтруют для удаления любых примесей, а затем смешивают с фильтрованным сжатым воздухом, чтобы получить смесь, содержащую примерно 10% аммиака и 90% воздуха. Точная пропорция избытка воздуха зависит от рабочего давления и температуры в установке.
Затем смесь пропускают через один или несколько конвертеров параллельно, каждый из которых содержит серию сеток катализатора из 90% платины / 10% родия, включенных параллельно, при 975–1225 К — обычно 1200 К в реакторе с неподвижным слоем.Происходит не менее 96% конверсии аммиака.
Рис. 2 Сетка из платино-родиевого сплава, установленная в конвертере.
С любезного разрешения Johnson Matthey.
Родий добавлен к платине для придания прочности сетке и уменьшения потерь платины, что является важным экономическим фактором (потеря 0,4 г на 1000 кг полученной азотной кислоты). Это происходит из-за «горячих точек» на марле.
Это происходит из-за «горячих точек» на марле.
Недавно было обнаружено, что вязаная сетка увеличивает эффективность преобразования и продлевает срок службы катализатора.
Рис. 3 Платиново-родиевая проволока сплетена для изготовления трикотажной сетки.
С любезного разрешения Johnson Matthey.
Необходимо проявлять осторожность, чтобы свести к минимуму окисление аммиака до азота за счет еще более экзотермической реакции, чему способствует высокое давление и перегретый катализатор:
Горячие газы, выходящие из конвертеров, используются либо для подъема перегретого пара, либо для нагрева выхлопных газов из абсорбционной башни (ов). Пар может использоваться для выработки энергии в паровой турбине, которая затем может приводить в действие воздушный компрессор (ы).
Горячие газы выходят из секции пароподъема / теплообмена при температуре около 425 К.
(b) Поглощение оксидов азота
Газы дополнительно охлаждаются до температуры ниже 315 К.
Добавляют воздух и снова сжимают газы (обычно 7-12 атм). Температура повышается примерно до 435 К и требует дальнейшего охлаждения примерно до 310 К. Дополнительное сжатие и охлаждение способствует реакциям, смещая следующие равновесия вправо:
Затем газы проходят через одну или несколько колонн, чтобы встретить поток воды, который обычно течет в направлении, противоположном газу.Здесь окисление монооксида азота продолжается и происходит абсорбция с образованием азотной кислоты:
|
В процессах, где значительное количество NO X остается в газообразных отходящих потоках, они проходят через катализатор (платина или родий на силикоалюминате, соединения титана или ванадия) с топливом, таким как водород или метан. Оксиды азота восстанавливаются до азота. Например:
Оксиды азота восстанавливаются до азота. Например:
Температура, при которой реакция наиболее эффективна, зависит от топлива. Для водорода это примерно 450 К. Для метана оно намного выше, примерно 750 К.
Кислота из абсорбционных башен обычно содержит 56-60% азотной кислоты по массе, но может производиться до примерно 68% по массе. Примерно 99% кислоты требуется для производства, например, органических нитросоединений для производства взрывчатых веществ и красителей.Азотная кислота и вода образуют азеотропную смесь с максимальной температурой кипения 395 K, содержащую около 68% азотной кислоты по массе; таким образом, концентрированную кислоту нельзя получить перегонкой водного раствора. Концентрированная серная кислота используется для поглощения воды, а затем при перегонке этой смеси получается концентрированная азотная кислота. Чистая азотная кислота кипит при 359 К.
Дата последнего изменения: 9 декабря 2016 г.
Азотная кислота — молекула месяца — ноябрь 2007 г.

азотная кислота — молекула месяца — ноябрь 2007 г. — версия только в формате HTML
Два химических процесса, косвенно приведших к Первой мировой войне
Азотная кислота (HNO 3 ) — чрезвычайно важное химическое вещество, используемое при производстве удобрений и взрывчатых веществ.Он производится из аммиака с помощью процесса Оствальда, который был разработан в 1902 году немецким химиком Вильгельмом Оствальдом (внизу слева), получившим Нобелевскую премию по химии в 1909 году. Этот процесс взаимодействует вместе O 2 и аммиаком NH 3 . при 850 ° C и давлении 5 атмосфер с помощью платиновых и родиевых катализаторов для получения газа NO. Затем он окисляется до NO 2 , который затем растворяется в воде с образованием HNO 3 .
| Азотная кислота |
Процесс Оствальда был открыт как раз во время Первой мировой войны, и он во многом способствовал увеличению продолжительности этой войны. Это связано с тем, что раньше в Германии не было собственных месторождений нитратов, из которых можно было бы производить азотную кислоту, необходимую для производства взрывчатых веществ, используемых в артиллерийских снарядах, таких как тротил и нитроглицерин. Фактически, большая часть нитратов была доступна только из гуано , который представляет собой помет рыбоядных морских птиц и в больших количествах встречается на островах у побережья Перу. Когда начались боевые действия, судоходные пути в Германию через Атлантику были заблокированы, и Германии требовался новый метод производства азотной кислоты.
Это связано с тем, что раньше в Германии не было собственных месторождений нитратов, из которых можно было бы производить азотную кислоту, необходимую для производства взрывчатых веществ, используемых в артиллерийских снарядах, таких как тротил и нитроглицерин. Фактически, большая часть нитратов была доступна только из гуано , который представляет собой помет рыбоядных морских птиц и в больших количествах встречается на островах у побережья Перу. Когда начались боевые действия, судоходные пути в Германию через Атлантику были заблокированы, и Германии требовался новый метод производства азотной кислоты.
По совпадению, снова незадолго до начала Первой мировой войны другой немецкий химик, Фриц Габер, нашел метод превращения инертного газообразного азота из воздуха в аммиак. К 1913 году немецкий химический гигант BASF (Badische Aniline und Soda Fabrik) имел завод в Людвигсхафен-Оппау, Германия, производящий аммиак с производительностью 30 метрических тонн в день. Несомненно, процесс Габера-Боша по превращению N 2 в NH 3 в сочетании с процессом Оствальда по превращению NH 3 в азотную кислоту позволил Германии продолжить производство взрывчатых веществ и продлил войну на многие годы. Некоторые говорят, что без этих двух химических процессов Первой мировой войны вообще бы не было.
Некоторые говорят, что без этих двух химических процессов Первой мировой войны вообще бы не было.
Свойства азотной кислоты
При комнатной температуре безводная азотная кислота 100% -ной чистоты является жидкостью, но при температуре ниже -41 ° C становится бесцветным белым твердым веществом и кипит при 83 ° C. То, что мы называем «концентрированной азотной кислотой», на самом деле представляет собой раствор 68% по весу HNO 3 в воде (16M раствор), и часто имеет бледно-желтый цвет в результате фотохимического разложения, которое выделяет NO 2 .При растворении еще большего количества NO 2 в чистом материале образуется красная «дымящая» азотная кислота, которая является чрезвычайно мощным кислотным и окисляющим агентом, используемым в полупроводниковой промышленности для очистки кремниевых пластин. Кислота царская водка (примерно 3 объема HCl на 1 объем HNO 3 ) содержит свободный Cl 2 и нитрозилхлорид (NOCl). Эта мощная кислота атакует даже инертные металлы, золото и платину, благодаря способности Cl — стабилизировать комплексы AuCl 4 — и PtCl 6 2- .
Эта мощная кислота атакует даже инертные металлы, золото и платину, благодаря способности Cl — стабилизировать комплексы AuCl 4 — и PtCl 6 2- .
Взрывное начало
Как отмечалось выше, одним из важных применений азотной кислоты является производство различных органических нитросоединений, особенно взрывчатых веществ, таких как тринитротолуол (ТНТ), нитроцеллюлоза, нитроглицерин, гексоген и тэн (последние два являются компонентами Semtex ). Например, нитроглицерин (взрывчатый компонент динамита) получают путем добавления азотной и серной кислот к глицерину в очень тщательно контролируемых условиях.Нитрующим агентом является ион NO 2 + , который может присоединяться к органическим цепям и кольцам, давая молекулу с высокой потенциальной энергией. Эти молекулы часто напряжены, и, поскольку они содержат встроенный запас кислорода и азота, они легко разлагаются (взрывным образом) с образованием CO 2 и N 2 , очень быстро выделяя много тепла.
Нитраты
Однако самое большое (80%) использование азотной кислоты — это производство нитрата аммония, NH 4 NO 3 .Он входит в состав многих рецептов пороха и сам по себе является важным взрывчатым веществом, но в основном используется в качестве сельскохозяйственных удобрений. Он также является родоначальником многих других нитратов (соединений, содержащих ион NO 3 — ), которые очень редко встречаются в природных породах, поскольку их высокая растворимость в воде означает, что любые отложения просто вымываются. Хотя такие нитратные удобрения принесли человечеству огромную пользу, увеличив урожайность на бедных почвах, в последнее время они получили много плохой прессы.Это, опять же, связано с их высокой растворимостью, что означает, что избыток нитратов легко смывается потоками. Там они продолжают свою работу по стимулированию роста растений, особенно водорослей, которые беспрепятственно размножаются, образуя удушающие массы. Дыхание масс водорослей расходует кислород в воде, задыхая все остальные растения и животные (см. Фото справа).
Дыхание масс водорослей расходует кислород в воде, задыхая все остальные растения и животные (см. Фото справа).
… и нитриты
Нитриты (соединения, содержащие ион NO 2 —), с другой стороны, производятся из азотистой кислоты (HNO 2 ), которая является очень слабой кислотой по сравнению с ее близким родственником, азотной кислотой.Например, нитрит натрия, NaNO 2 (E250) и нитрит калия, KNO 2 (E249) используются в качестве консерванта в некоторых мясных продуктах, таких как бекон, ветчина, колбаса, солонина, вяленая говядина, сосиски и т. Д. и некоторые рыбные продукты. Ионы нитрита (NO 2 — ) в этом мясе подавляют рост бактерии ( Clostridium botulinum ), которая вызывает смертельное пищевое отравление, известное как ботулизм. Их также используют, потому что они фиксируют ярко-красный цвет свежего мяса (в виде диазокрасителя), который в противном случае быстро потускнел бы до неприятного коричневого.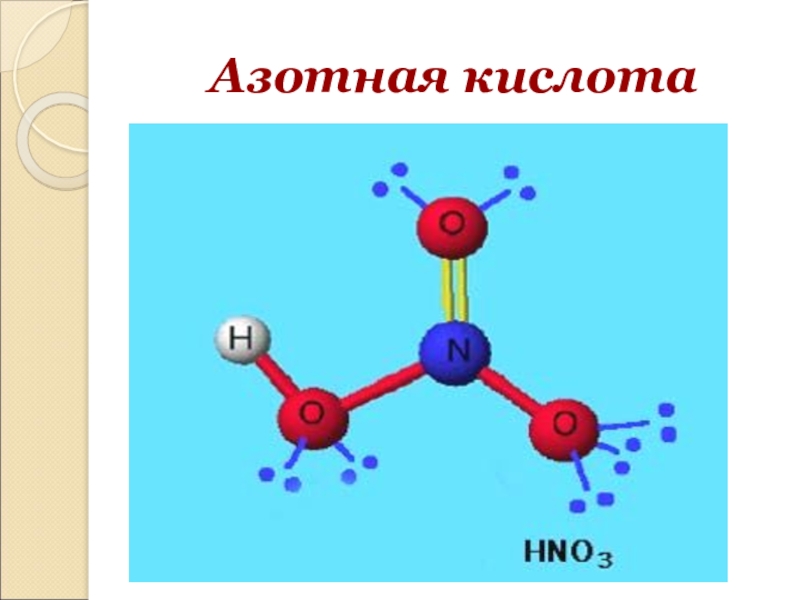 Это означает, что мясо на полках супермаркетов, которое выглядит свежим и новым, на самом деле может быть старше нескольких дней и просто «окрашено» в красный цвет с помощью нитрита!
Это означает, что мясо на полках супермаркетов, которое выглядит свежим и новым, на самом деле может быть старше нескольких дней и просто «окрашено» в красный цвет с помощью нитрита!
Однако в настоящее время существуют разногласия относительно токсичности этих нитритных добавок, поскольку известно, что при жарке или варке мяса, подвергнутого нитритной сушке, они могут образовывать нитрозамины (соединения, содержащие группы -NH-NO-), которые относятся к числу самые сильные известные канцерогенные агенты. Противоположный аргумент состоит в том, что удаление нитритных консервантов приведет к эпидемиям пищевых отравлений.Результатом этого противоречия стало снижение допустимой концентрации нитритов в мясных продуктах, однако еще предстоит доказать, что нитриты вызывают рак у животных.
Разное интересные факты об азотной кислоте
- Синтез азотной кислоты впервые был зарегистрирован около . 800 г. н.э. алхимиком Джабиром ибн Хайяном, также известным как Гербер.

- Он также известен как: aqua fortis и spirit of nitre .
- Азотная кислота является компонентом кислотных дождей, когда газы NOx растворяются в водяном паре облаков.
- Азотная кислота также используется в качестве окислителя при производстве нейлона.
- Если вы пролили концентрированную азотную кислоту на кожу, она пожелтеет из-за реакции с протеиновым кератином.
- Художница Аллела Корнелл покончила жизнь самоубийством в 1946 году, выпив азотную кислоту.
Библиография
- Молекулы , стр.У. Аткинс (W.H. Freeman and Co, Нью-Йорк, 1987).
- Основы химии, Брэди и Холум (Wiley, New York, 1988).
- Википедия
Вернуться на страницу «Молекула месяца». [DOI: 10.6084 / m9.figshare.5249101]
Азотная кислота — Энциклопедия Нового Света
| Азотная кислота | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Общее | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Систематическое название | Азотная кислота | Спирит Фортис | Кислота Салпетра | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярная формула | HNO 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| УЛЫБКИ | [N +] (= O) (OH) [O-] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Концентрация кислотного иона | (1 N) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная масса | 63. 01 г / моль 01 г / моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | Прозрачная бесцветная жидкость | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7697-37-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность и фаза |
Азотная кислота (химическая формула HNO 3 ) равна единице важнейших неорганических кислот.Алхимики восьмого века назвали его aqua fortis (сильная вода), aqua valens, (сильная вода) или духом селитры. Это очень едкая и токсичная кислота, которая может вызвать серьезные ожоги. Бесцветные в чистом виде, более старые образцы имеют тенденцию приобретать желтый оттенок из-за накопления оксидов азота. Азотная кислота смешивается с водой во всех пропорциях, образуя гидраты при низкой температуре. Эта кислота является обычным лабораторным реагентом и важным промышленным товаром.Он в основном используется для производства нитрата аммония (NH 4 NO 3 ) для удобрений. Он также используется для производства взрывчатых веществ (таких как нитроглицерин), нитрохлопка или пушечного хлопка, пластмасс и красителей. ИсторияСамое раннее известное письменное описание метода синтеза азотной кислоты принадлежит алхимику Джабиру ибн Хайяну (Геберу). Там написано:
Позднее голландский химик Иоганн Рудольф Глаубер первым получил азотную кислоту путем перегонки селитры с серной кислотой, или купоросного масла, как он это называл. Aqua regia (лат. «Королевская вода») — одно из химикатов, придуманных древними учеными. Это очень едкий дымящийся раствор желтого или красного цвета. Смесь образуется путем смешивания концентрированной азотной и соляной кислоты, обычно в объемном соотношении один к трем. Это один из немногих реагентов, способных растворять золото и платину, так называемые королевские или благородные металлы — отсюда и название «королевская вода». Эффективность царской водки частично объясняется наличием хлора и нитрозилхлорида.Царская водка используется в травлении и некоторых аналитических процессах, а также в лабораториях для очистки стеклянной посуды от органических и металлических соединений. Физические свойства Лабораторный реагент азотная кислота содержит только 68 процентов HNO по весу. Эта концентрация соответствует смеси с постоянным кипением HNO 3 с водой, имеющей атмосферное давление 68,4 процента по весу и кипящей при 121,9 ° C.
, что означает, что безводную азотную кислоту следует хранить при температуре ниже 0 ° C во избежание разложения. Двуокись азота (NO 2 ) остается растворенной в азотной кислоте, окрашивая ее в желтый или красный цвет при более высоких температурах.В то время как чистая кислота имеет тенденцию выделять белые пары при контакте с воздухом, кислота с растворенным диоксидом азота выделяет красновато-коричневые пары, что дает общее название «красная дымящая кислота» или «дымящая азотная кислота».
Химические свойства Азотная кислота образуется в результате реакции пятиокиси азота (N 2 O 3 ) и диоксида азота (NO 2 ) с водой. Если раствор содержит более 86 процентов азотной кислоты, он обозначается как дымящаяся азотная кислота . Азотная кислота — это сильная одноосновная кислота, мощный окислитель, который также нитрирует многие органические соединения, и одноосновная кислота, потому что диссоциация только одна. Кислотные свойстваАзотная кислота, как типичная кислота, реагирует со щелочами, основными оксидами и карбонатами с образованием солей, наиболее важной из которых является нитрат аммония. Из-за своей окислительной природы азотная кислота (за некоторыми исключениями) не выделяет водород при реакции с металлами, и образующиеся соли обычно находятся в более высоком окисленном состоянии. По этой причине можно ожидать сильной коррозии, и ее следует защищать с помощью соответствующего использования коррозионно-стойких металлов или сплавов. Азотная кислота — сильная кислота с кислотной константой диссоциации (pK a ) -2: в водном растворе она полностью ионизируется в нитрат-ион NO 3 — и гидратированный протон, известный как гидроний.
Окислительные свойстваАзотная кислота является сильным окислителем, о чем свидетельствует ее большой положительный эффект. E ◦ значения.
Являясь сильным окислителем, азотная кислота бурно реагирует со многими неметаллическими соединениями, и реакции могут быть взрывоопасными. Конечные продукты могут варьироваться в зависимости от концентрации кислоты, температуры и используемого восстановителя.Реакция происходит со всеми металлами, за исключением ряда драгоценных металлов и некоторых сплавов. Реакции с металламиАзотная кислота растворяет большинство металлов, включая железо, медь и серебро, обычно с высвобождением низших оксидов азота, а не водорода. Он также может растворять благородные металлы с добавлением соляной кислоты.
Кислотные свойства имеют тенденцию преобладать с разбавленной кислотой в сочетании с преимущественным образованием оксид азота (NO).
Поскольку азотная кислота является окислителем, водород (H) образуется редко. Только магний (Mg) и кальций (Ca) реагируют с холодной, разбавленной азотной кислотой с образованием водорода:
Реакции с неметалламиРеакция с неметаллическими элементами, за исключением кремния и галогена, обычно окисляет их до самых высоких степеней окисления как кислоты с образованием диоксида азота для концентрированной кислоты и оксида азота для разбавленной кислоты.
или
ПассивацияХотя хром (Cr), железо (Fe) и алюминий (Al) легко растворяются в разбавленной азотной кислоте, концентрированная кислота образует слой оксида металла, который защищает металл от дальнейшего окисления, что называется пассивацией. . Синтез и производство Азотная кислота получается путем смешивания диоксида азота (NO 2 ) с водой в присутствии кислорода или воздуха для окисления азотистой кислоты, также образующейся в результате реакции. Первый процесс представляет собой каталитическую реакцию в газовой фазе — первичный процесс окисления аммиака до азотной кислоты при температуре около 900 ° C на платино-родиевом катализаторе.
Второй этап — быстрое окисление оксида азота до диоксида азота. Это относительно медленная реакция, т.е.е., этап, определяющий скорость в последовательности реакций.
Наконец, диспропорционирование NO 2 в воде дает одну молекулу оксида азота на каждые две молекулы азотной кислоты. .
Для получения чистой азотной кислоты, которая является бесцветной и кипит при 83 ° C. В лаборатории азотная кислота может быть получена из нитрата меди (II) или путем реакции примерно равных масс нитрата калия (KNO 3 ) с 96-процентной серной кислотой (H 2 SO 4 ) и перегонкой. эту смесь при температуре кипения азотной кислоты 83 ° C до тех пор, пока в реакционном сосуде не останется только белая кристаллическая масса, гидросульфат калия (KHSO 4 ). Полученная красная дымящая азотная кислота может быть превращена в белую азотную кислоту. Обратите внимание, что в лабораторных условиях необходимо использовать цельностеклянное оборудование, в идеале цельную реторту, потому что безводная азотная кислота разрушает пробку, резину и кожу, и утечки могут быть чрезвычайно опасными.
Растворенные NO x легко удаляются при пониженном давлении при комнатной температуре (10-30 мин. при 200 мм рт. ст. или 27 кПа). Полученная белая дымящаяся азотная кислота имеет плотность 1,51 г / см³. Эту процедуру также можно выполнить при пониженном давлении и температуре за один этап, чтобы получить меньше газообразного диоксида азота. Кислота также может быть синтезирована путем окисления аммиака, но продукт разбавляется водой, также образующейся в ходе реакции.Однако этот метод важен для производства нитрата аммония из аммиака, полученного в процессе Габера, поскольку конечный продукт может быть получен из азота, водорода и кислорода в качестве единственного исходного сырья. Белая дымящаяся азотная кислота, также называемая 100-процентной азотной кислотой или WFNA, очень близка к безводной азотной кислоте. Одной из спецификаций дымящейся азотной кислоты является то, что она содержит максимум 2 процента воды и максимум 0,5 растворенного NO 2 . Красная дымящая азотная кислота, или RFNA, содержит значительные количества растворенного диоксида азота (NO 2 ), в результате чего раствор приобретает красновато-коричневый цвет.В одной формулировке RFNA указано как минимум 17 процентов NO 2 , в другой — 13 процентов NO 2 . В любом случае, ингибированная дымящая азотная кислота (IWFNA или IRFNA) может быть получена путем добавления от 0,6 до 0,7 процента фтороводорода HF. Этот фторид добавляют для защиты от коррозии в металлических резервуарах (фторид создает слой фторида металла, который защищает металл). ИспользуетОбычно азотная кислота используется в качестве лабораторного реагента при производстве взрывчатых веществ, включая нитроглицерин, тринитротолуол (TNT) и циклотриметилентринитрамин (RDX), а также удобрения, такие как нитрат аммония. Также в методах ICP-MS и ICP-AES азотная кислота (с концентрацией от 0,5 до 2,0%) используется в качестве матричного соединения для определения следов металлов в растворах. Для такого определения требуется сверхчистая кислота, поскольку небольшие количества ионов металлов могут повлиять на результат анализа. Он находит дополнительное применение в металлургии и рафинировании, поскольку вступает в реакцию с большинством металлов, а также в органическом синтезе. В сочетании с соляной кислотой он образует царскую водку, один из немногих реагентов, способных растворять золото и платину. Азотная кислота — компонент кислотных дождей. Азотная кислота — мощный окислитель, и реакции азотной кислоты с такими соединениями, как цианиды, карбиды и металлические порошки, могут быть взрывоопасными. Реакции азотной кислоты со многими органическими соединениями, такими как скипидар, являются бурными и гиперголичными (т. Е. Самовоспламеняющимися). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с протеиновым кератином. Эти желтые пятна при нейтрализации становятся оранжевыми. Одно из применений IWFNA — это окислитель в ракетах на жидком топливе. Азотная кислота используется в колориметрическом тесте для различения героина и морфина. Азотная кислота также используется в школьных лабораториях для проведения экспериментов по тестированию хлоридов. В образец добавляют раствор нитрата серебра и азотную кислоту, чтобы увидеть, остался ли белый осадок хлорида серебра. Меры предосторожностиАзотная кислота является опасным химическим веществом, и с ней следует обращаться с учетом ее коррозионных и окислительных свойств.Избегайте контакта с кислотой и используйте средства защиты, особенно средства защиты глаз. При попадании на кожу он может вызвать пожелтение, а большие количества или концентрации могут вызвать смертельные ожоги. Не вдыхайте пары, выделяющиеся при смешивании с металлами или органическими соединениями — эффект может быть отсроченным, но все же фатальным. Держитесь подальше от красно-коричневых паров! Азотная кислота сама по себе не горит, но окисляет органические вещества и делает их легко воспламеняемыми. Связанные темыПримечания
Ссылки
Внешние ссылкиВсе ссылки получены 5 декабря 2018 г. Кредиты Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия История этой статьи с момента ее импорта в Энциклопедию Нового Света : Примечание. могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия. Быстрый рост новых атмосферных частиц за счет конденсации азотной кислоты и аммиакаStanier, C.O., Хлыстов, А. Ю. и Пандис, С. Н. Зарождение ядер во время исследования качества воздуха в Питтсбурге: описание и связь с ключевыми метеорологическими параметрами, параметрами газовой фазы и аэрозоля. Aerosol Sci. Технол . 38 , 253–264 (2004). ADS Google Scholar Yao, L. et al. Образование новых частиц в атмосфере из серной кислоты и аминов в мегаполисе Китая. Наука 361 , 278–281 (2018). ADS Google Scholar Кулмала, М., Керминен, В.-М., Петяя, Т., Динг, А. Дж. И Ван, Л. Конверсия атмосферного газа в частицы: почему явления НПФ наблюдаются в мегаполисах? Фарадей Обсудить . 200 , 271–288 (2017). ADS Google Scholar Höpfner, M. et al. Частицы нитрата аммония, образовавшиеся в верхних слоях тропосферы из наземных источников аммиака во время азиатских муссонов. Нат. Geosci . 12 , 608–612 (2019). ADS Google Scholar Williamson, C.J. et al. Большой источник ядер конденсации облаков из-за образования новых частиц в тропиках. Nature 574 , 399–403 (2019). ADS Google Scholar Межправительственная группа экспертов по изменению климата (МГЭИК). Изменение климата 2013: основы физических наук (Cambridge Univ. Press, 2013). McMurry, P.H. et al. Критерий образования новых частиц в богатой серой атмосфере Атланты. J. Geophys. Res. Д 110 , D22S02 (2005). ADS Google Scholar Kulmala, M. et al. Прямые наблюдения за зарождением атмосферных аэрозолей. Наука 339 , 943–946 (2013). ADS Google Scholar Gordon, H. et al. Причины и важность образования новых частиц в современной и доиндустриальной атмосфере. J. Geophys. Res. Д 122 , 8739–8760 (2017). ADS Google Scholar Riipinen, I. et al. Вклад органических веществ в рост атмосферных наночастиц. Нат.Geosci . 5 , 453–458 (2012). ADS Google Scholar Пирс, Дж. Р. и Адамс, П. Дж. Эффективность образования ядер облачной конденсации из сверхмелкозернистых частиц. Атмос. Chem. Phys . 7 , 1367–1379 (2007). ADS Google Scholar Куанг, К., Макмерри, П. Х. и Маккормик, А.V. Определение образования ядер облачной конденсации по измеренным событиям образования новых частиц. Geophys. Res. Lett . 36 , L09822 (2009). ADS Google Scholar Апте, Дж. С., Брауэр, М., Коэн, А. Дж., Эззати, М. и Поуп, К. А. Окружающие PM 2,5 сокращают продолжительность жизни в глобальном и региональном масштабе. Environ. Sci. Technol. Lett . 5 , 546–551 (2018). CAS Google Scholar Chen, G., Wang, W.-C. И Чен, Ж.-П. Реакция циркуляции на региональное воздействие климата аэрозолей летом над Восточной Азией. Клим. Dyn . 51 , 3973–3984 (2018). Google Scholar Керминен, В.-М. И Кулмала, М. Аналитические формулы, связывающие «реальную» и «кажущуюся» скорость нуклеации и концентрацию числа ядер для событий атмосферной нуклеации. J. Aerosol Sci . 33 , 609–622 (2002). ADS Google Scholar Такахама С., Виттиг А. Е., Вайенас Д. В., Дэвидсон К. И. и Пандис С. Н. Моделирование суточных колебаний нитратов во время исследования качества воздуха в Питтсбурге. J. Geophys. Res. Д 109 , Д16С06 (2004). ADS Google Scholar Xu, W. et al. Изменения в химическом составе аэрозолей с 2014 по 2016 годы зимой в Пекине: выводы из масс-спектрометрии аэрозолей высокого разрешения. J. Geophys. Res. Д 124 , 1132–1147 (2019). ADS Google Scholar Макмерри, П. Х. Образование фотохимического аэрозоля из SO 2 : теоретический анализ данных камеры смога. J. Colloid Interface Sci . 78 , 513–527 (1980). ADS Google Scholar Киркби, Дж.и другие. Ионно-индуцированное зарождение чистых биогенных частиц. Природа 533 , 521–526 (2016). ADS Google Scholar Stolzenburg, D. et al. Быстрый рост наночастиц органических аэрозолей в широком диапазоне температур тропосферы. Proc. Natl Acad. Sci. США 115 , 9122–9127 (2018). ADS Google Scholar O’Dowd, C.D. et al. Образование морских аэрозолей в результате выбросов биогенного йода. Nature 417 , 632–636 (2002). ADS Google Scholar Kirkby, J. et al. Роль серной кислоты, аммиака и галактических космических лучей в зародышеобразовании атмосферного аэрозоля. Nature 476 , 429–433 (2011). ADS Google Scholar Контканен, Дж., Олениус, Т., Кулмала, М. и Рийпинен, И. Изучение потенциала теории нанокелера для описания роста атмосферных молекулярных кластеров органическими парами с использованием моделирования кластерной кинетики. Атмос. Chem. Phys . 18 , 13733–13754 (2018). ADS Google Scholar Lu, K. et al. Быстрая фотохимия в зимней дымке: последствия для стратегий уменьшения загрязнения. Environ. Sci. Технол . 53 , 10676–10684 (2019). ADS Google Scholar Yli-Juuti, T. et al. Модель кислотно-основной химии в росте наночастиц (MABNAG). Атмос. Chem. Phys . 13 , 12507–12524 (2013). ADS Google Scholar Letzel, M. O. et al. Пример LES по вентиляции пешеходного уровня в двух районах Гонконга. Meteorol. З. (Берл.) 21 , 575–589 (2012). Google Scholar Manninen, H. E. et al. Измерения ионного спектрометра EUCAARI на 12 европейских площадках — анализ событий образования новых частиц. Атмос. Chem. Phys . 10 , 7907–7927 (2010). ADS Google Scholar Pierce, J. R. et al. Количественная оценка летучести вторичных органических соединений в сверхмелкозернистых частицах во время нуклеации. Атмос. Chem. Phys . 11 , 9019–9036 (2011). ADS Google Scholar Ge, C., Zhu, C., Francisco, J. S., Zeng, X. C. & Wang, J. Молекулярная перспектива глобального моделирования NH 3 в верхних слоях атмосферы из замерзающих облаков. Proc. Natl Acad. Sci. США 115 , 6147–6152 (2018). ADS Google Scholar Liu, L. et al. Роль азотной кислоты в образовании новых частиц в атмосфере. Phys. Chem. Chem. Phys . 20 , 17406–17414 (2018). CAS Google Scholar Duplissy, J. et al. Влияние ионов на образование бинарных частиц серная кислота-вода: 2. Экспериментальные данные и сравнение с классической теорией нуклеации, нормированной на QC. J. Geophys. Res. Д 121 , 1752–1775 (2016). ADS Google Scholar Dias, A. et al. Равномерность температуры в камере CERN CLOUD. Аэрозоль Измер. Тех . 10 , 5075–5088 (2017). Google Scholar Schnitzhofer, R. et al. Характеристика органических загрязнителей в камере CLOUD в ЦЕРНе. Aerosol Meas. Техн . 7 , 2159–2168 (2014). Google Scholar Jokinen, T. et al. Измерение серной кислоты и нейтральных кластеров в атмосфере с помощью CI-APi-TOF. Атмос. Chem. Phys . 12 , 4117–4125 (2012). ADS Google Scholar Junninen, H. et al. Масс-спектрометр высокого разрешения для измерения ионного состава атмосферы. Атмос. Измер. Тех . 3 , 1039–1053 (2010). CAS Google Scholar Eisele, F. & Tanner, D. Измерение концентрации H 2 SO 4 и метансульфоновой кислоты в газовой фазе и оценка H 2 SO 4 производство и потери Атмосфера. J. Geophys. Res. Д 98 , 9001–9010 (1993). ADS Google Scholar Pfeifer, J. et al. Измерение содержания аммиака, аминов и йода с помощью масс-спектрометрии с химической ионизацией протонированной воды. Атмос. Измер. Тех . https://doi.org/10.5194/amt-2019-215 (2019). Kürten, A., Rondo, L., Ehrhart, S. & Curtius, J. Характеристики источника коронарных ионов для измерения серной кислоты методом химической ионизационной масс-спектрометрии. Атмос. Измер. Тех . 4 , 437–443 (2011). Google Scholar Tröstl, J. et al. Роль низколетучих органических соединений в начальном росте частиц в атмосфере. Природа 533 , 527–531 (2016). ADS Google Scholar Breitenlechner, M. et al. PTR3: инструмент для изучения жизненного цикла реактивного органического углерода в атмосфере. Анал. Chem . 89 , 5824–5831 (2017). CAS Google Scholar Gautrois, M. & Koppmann, R. Диффузионная техника для производства газовых эталонов для атмосферных измерений. J. Chromatogr. А 848 , 239–249 (1999). CAS Google Scholar Wang, M. et al. Реакции стабилизированных атмосферными твердыми частицами промежуточных продуктов Criegee приводят к образованию высокомолекулярных компонентов аэрозоля. Environ. Sci. Технол . 50 , 5702–5710 (2016). ADS Google Scholar Lopez-Hilfiker, F. D. et al. Новый метод онлайн-анализа состава газа и частиц: описание и оценка входного отверстия фильтра для газов и аэрозолей (FIGAERO). Атмос. Измер. Тех . 7 , 983–1001 (2014). Google Scholar Штольценбург Д., Штайнер Г. и Винклер П.M. Поезд прямого доступа к памяти для прецизионных измерений динамики аэрозолей на суб-10 нм. Атмос. Измер. Тех . 10 , 1639–1651 (2017). Google Scholar Муи, У., Май, Х., Даунард, А. Дж., Сайнфелд, Дж. Х. и Флаган, Р. С. Разработка, моделирование и определение характеристик классификатора радиально встречных ионов и аэрозолей (ROMIAC). Aerosol Sci. Технол . 51 , 801–823 (2017). ADS Google Scholar Wimmer, D. et al. Характеристики счетчиков частиц на основе диэтиленгликоля в диапазоне размеров менее 3 нм. Атмос. Измер. Тех . 6 , 1793–1804 (2013). Google Scholar Май, Х. и Флаган, Р. С. Сканирующий анализ данных прямого доступа к памяти I. Передаточная функция классификации. Aerosol Sci. Технол . 52 , 1382–1399 (2018). ADS Google Scholar Май, Х., Конг, В., Сайнфельд, Дж. Х. и Флаган, Р. С. Анализ данных сканирования прямого доступа к памяти II. Интегрированный отклик прибора DMA-CPC и инверсия данных. Aerosol Sci. Технол . 52 , 1400–1414 (2018). ADS Google Scholar Jurányi, Z. et al. 17-месячная климатология концентрации ядер конденсации облаков на высокогорном участке Юнгфрауйох. J. Geophys. Res. Д 116 , Д10204 (2011). ADS Google Scholar Tröstl, J. et al. Быстрое и точное измерение в диапазоне размеров менее 20 нм с использованием сканирующего измерителя подвижности частиц. J. Aerosol Sci . 87 , 75–87 (2015). ADS Google Scholar Wiedensohler, A. et al. Спектрометры размера подвижных частиц: гармонизация технических стандартов и структуры данных для облегчения высококачественных долгосрочных наблюдений за распределением количества атмосферных частиц по размерам. Атмос. Измер. Тех . 5 , 657–685 (2012). CAS Google Scholar Сайнфелд, Дж. Х. и Пандис, С. Н. Атмосферная химия и физика 2-е изд. (John Wiley & Sons, 2006). Денби, К. Г. и Денби, К. Г. Принципы химического равновесия: с приложениями в химии и химической инженерии (Cambridge Univ. Press, 1981). Мозуркевич М. Константа диссоциации нитрата аммония и ее зависимость от температуры, относительной влажности и размера частиц. Атмос. Environ. А 27 , 261–270 (1993). ADS Google Scholar Lehtipalo, K. et al. Многокомпонентное образование новых частиц из серной кислоты, аммиака и биогенных паров. Sci. Adv . 4 , eaau5363 (2018). ADS Google Scholar Клегг, С. Л. и Сайнфельд, Дж. Х. Термодинамические модели водных растворов, содержащих неорганические электролиты и дикарбоновые кислоты, при 298,15 К. 1. Кислоты как недиссоциирующие компоненты. J. Phys. Chem. А 110 , 5692–5717 (2006). CAS Google Scholar Клегг, С. Л. и Сайнфельд, Дж. Х. Термодинамические модели водных растворов, содержащих неорганические электролиты и дикарбоновые кислоты, при 298,15 К. 2. Системы, включающие равновесие диссоциации. J. Phys. Chem. А 110 , 5718–5734 (2006). CAS Google Scholar Wang, M. et al. Быстрый рост новых атмосферных частиц за счет конденсации азотной кислоты и аммиака: информационные ресурсы. https: // doi.org / 10.5281 / zenodo.3653377 (2020). Xiao, S. et al. Сильное образование новых атмосферных частиц зимой в городском Шанхае, Китай. Атмос. Chem. Phys . 15 , 1769–1781 (2015). ADS Google Scholar Иида, К., Штольценбург, М. Р., Макмерри, П. Х. и Смит, Дж. Н. Оценка темпов роста наночастиц на основе зависимых от размера заряженных фракций: Анализ событий образования новых частиц в Мехико. J. Geophys. Res. D Атмосферы 113 , D05207 (2008). ADS Google Scholar Mordas, G. et al. О работе сверхтонкого CPC TSI 3786 на водной основе и сравнении с другими моделями TSI (TSI 3776, TSI 3772, TSI 3025, TSI 3010, TSI 3007). Aerosol Sci. Технол . 42 , 152–158 (2008). ADS Google Scholar Lehtipalo, K. et al. Влияние кислотно-щелочной кластеризации и ионов на рост атмосферных наночастиц. Нат. Коммуна . 7 , 11594 (2016). ADS Google Scholar Dal Maso, M. et al. Измерения гранулометрического состава аэрозолей на четырех полевых станциях Северной Европы: идентификация, анализ и анализ траектории новых всплесков образования частиц. Tellus B Chem.Phys. Метерол . 59 , 350–361 (2007). ADS Google Scholar Dal Maso, M. et al. Образование и рост свежих атмосферных аэрозолей: данные о распределении размеров аэрозолей за восемь лет из SMEAR II, Хюютяля, Финляндия. Boreal Environ. Res . 10 , 323–326 (2005). Google Scholar Komppula, M. et al. Наблюдения за образованием новых частиц и их распределением по размерам на двух разных высотах и в окрестностях в субарктической зоне на севере Финляндии. J. Geophys. Res. D Атмосферы 108 (D9), 4295 (2003). ADS Google Scholar Vehkamäki, H. et al. События образования атмосферных частиц на измерительной станции Värriö в финской Лапландии 1998-2002 гг. Атмос. Chem. Phys . 4 , 2015–2023 (2004). ADS Google Scholar Dal Maso, M. et al.События образования аэрозольных частиц на двух сибирских станциях в бореальном лесу. Boreal Environ. Res . 13 , 81–92 (2008). Google Scholar Hussein, T. et al. Наблюдение за региональным образованием новых частиц в атмосфере города. Tellus B Chem. Phys. Метерол . 60 , 509–521 (2008). ADS Google Scholar Pikridas, M. et al. Формирование in situ и пространственная изменчивость числовой концентрации частиц в европейском мегаполисе. Атмос. Chem. Phys . 15 , 10219–10237 (2015). ADS Google Scholar Hamed, A. et al. Зарождение и рост новых частиц в долине реки По, Италия. Атмос. Chem. Phys . 7 , 355–376 (2007). ADS Google Scholar Хама, С. М., Корделл, Р. Л., Кос, Г. П., Вейерс, Э. и Монкс, П. С. Характеристики гранулометрического состава субмикронных частиц в двух городских районах Лестера. Атмос. Res . 194 , 1–16 (2017). CAS Google Scholar Гао, Дж., Чай, Ф., Ван, Т., Ван, С. и Ван, В. Распределение частиц по размерам и образование новых частиц: новые характеристики в период особой борьбы с загрязнением в Пекине. J. Environ. Sci . 24 , 14–21 (2012). CAS Google Scholar Wang, Z. et al. Характеристики регионального образования новых частиц в городской и региональной фоновой среде на Северо-Китайской равнине. Атмос. Chem. Phys . 13 , 12495–12506 (2013). ADS Google Scholar Yue, D. et al. Характеристики гранулометрического состава и образования новых частиц летом в Пекине. J. Geophys. Res. D Атмосфера 114 , D00G12 (2009). Google Scholar Zhang, Y. et al. Характеристика образования новых частиц и вторичных аэрозолей в летнее время в Пекине, Китай. Tellus B Chem. Phys. Метерол . 63 , 382–394 (2011). ADS Google Scholar Man, H. et al.Сравнение дневного и ночного роста новых частиц на суперсайте HKUST в Гонконге. Environ. Sci. Технол . 49 , 7170–7178 (2015). ADS Google Scholar An, J. et al. Характеристики событий образования новых частиц в Нанкине, Китай: влияние водорастворимых ионов. Атмос. Окружающая среда . 108 , 32–40 (2015). ADS Google Scholar Herrmann, E. et al. Аэрозоли и нуклеация в восточном Китае: первые выводы с новой станции SORPES-NJU. Атмос. Chem. Phys . 14 , 2169–2183 (2014). ADS Google Scholar Yu, H. et al. Зарождение и рост частиц размером менее 3 нм в загрязненной городской атмосфере мегаполиса в Китае. Атмос. Chem. Phys . 16 , 2641–2657 (2016). ADS Google Scholar Peng, J. et al. Субмикронные аэрозоли на тринадцати различных участках в Китае: распределение по размерам, образование новых частиц и соответствующий вклад в образование ядер облачной конденсации. Атмос. Chem. Phys . 14 , 10249–10265 (2014). ADS Google Scholar Kanawade, V. et al. Редкие случаи образования новых частиц в полусельском районе Гаданки в тропической южной Индии. Атмос. Окружающая среда . 94 , 264–273 (2014). ADS Google Scholar Mönkkönen, P. et al. Измерения в сильно загрязненном азиатском мегаполисе: наблюдения за распределением количества аэрозолей по размерам, модальными параметрами и событиями нуклеации. Атмос. Chem. Phys . 5 , 57–66 (2005). ADS Google Scholar Kuang, C. et al. Улучшенный критерий образования новых частиц в различных атмосферных средах. Атмос. Chem. Phys . 10 , 8469–8480 (2010). ADS Google Scholar Iida, K. et al. Вклад ионно-индуцированного зародышеобразования в образование новых частиц: методология и ее применение в атмосферных наблюдениях в Боулдере, штат Колорадо. J. Geophys. Res. D Атмосферы 111 , D23201 (2006). ADS Google Scholar Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка вашего браузера для приема файлов cookieСуществует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie? Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт ICSC 0183 — АЗОТНАЯ КИСЛОТА (> 70% в воде)ICSC 0183 — АЗОТНАЯ КИСЛОТА (> 70% в воде)
Смотрите также:
Токсикологические сокращения
Концентрация азотной кислоты | KBRОбработка кислоты требует современных технологий. Будь то концентрирование, очистка или восстановление азотной кислоты, наши индивидуальные установки удовлетворяют особым требованиям, сочетая самые современные технологии с хорошо зарекомендовавшими себя материалами.Технологии азотной кислоты PLINKE от KBR могут использоваться для концентрирования, очистки и извлечения азотной кислоты. KBR уже поставила установки для широкого спектра применений и поэтому может разрабатывать индивидуальные решения, соответствующие самым современным технологическим процессам, для применения в любой точке мира. Мы также разрабатываем новые приложения нашей технологии и управляем лабораторией с пилотными установками, которые позволяют нам разрабатывать и масштабировать такие новые приложения очень надежно и эффективно для наших клиентов.Основываясь на более чем 70-летнем опыте в области кислотной обработки, KBR предлагает индивидуальные решения для нужд клиентов.
Технологии PLINKE от KBR могут использоваться в различных областях:
KBR проектирует небольшие установки, на которых рекуперируются всего несколько сотен килограммов кислоты в час, вплоть до установок мирового масштаба. Предварительное концентрирование азотной кислоты NAPC® Предварительное концентрирование слабой азотной кислоты NAPC ® используется для концентрирования кислоты до примерно 68 мас.% HNO3. Процесс NAPC ® удаляет воду из разбавленной азотной кислоты путем ректификации без использования экстрактивных агентов. Максимальная концентрация при ректификации составляет около 68 мас.% Азотной кислоты, поскольку двухкомпонентная смесь азотной кислоты и воды образует азеотропную смесь на этом уровне концентрации. Азотная кислота высокой концентрации с серной кислотой NACSAC® NACSAC ® используется для производства азотной кислоты высокой концентрации (до 99 мас.%) Либо из отработанной, либо из свежей азотной кислоты.В этом процессе серная кислота служит экстрактивным агентом, который разбавляется в NAC ® и повторно концентрируется в прилагаемом SAC ® , образуя замкнутый цикл. Рабочее давление колонки NAC ® является атмосферным, а соответствующая установка SAC ® работает под вакуумом. Энергетические потребности обычно покрываются исключительно за счет косвенной теплопередачи. По возможности восстанавливается дополнительное тепло. Установка SAC ® предназначена для испарения воды и минимизации потерь серной кислоты.Конденсат из SAC ® представляет собой дистиллированную воду, которая содержит небольшое количество серной кислоты. Эту воду можно использовать для сопутствующей абсорбции NOx или в других процессах соответственно. Извлеченная серная кислота с концентрацией около 85 мас.% Является оптимальной для использования в качестве экстрагирующего агента, но при желании можно использовать и другие концентрации. Вместо замкнутого контура с NACSAC ® , NAC ® может работать автономно, используя свежую подачу серной кислоты, которая будет утилизирована или использована в других приложениях. Азотная кислота высокой концентрации с раствором нитрата магния MAGNAC® MAGNAC ® используется для производства азотной кислоты высокой концентрации (до 99 мас.%) Из свежей слабой азотной кислоты. В качестве экстракта используется раствор нитрата магния. Колонка NAC ® работает при атмосферном давлении, а соответствующая установка для повторного концентрирования нитрата магния работает в условиях вакуума. Конденсат из концентратора рассола нитрата магния представляет собой дистиллированную воду, которая содержит только следы азотной кислоты.Эта вода часто используется в качестве питательной воды для производства слабой азотной кислоты из аммиака, что резко снижает количество очищаемых стоков и сводит к минимуму потери азотной кислоты. Технология PLINKE MAGNAC ® от KBR — это наиболее эффективное решение для производства высококонцентрированной азотной кислоты из слабой азотной кислоты. Предварительная обработка отработанных кислот в блоке стабилизации / разложении STABОтработанные кислоты, полученные в результате процессов нитрования, такие как нитроцеллюлоза (NC), нитроглицерин (NG), пента (PETN), гексоген (RDX), октоген (HMX), NTO , 2-EHN и нитрогуанидин (NiGu) содержат высокие уровни органических веществ, которые могут вызвать проблемы безопасности процесса и эксплуатации. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 1; Группа упаковки по ООН: I
1; Группа упаковки по ООН: I

 2
2 
 Массовая доля мышьяка , %, не более
Массовая доля мышьяка , %, не более Продукция химической и связанных с ней отраслей промышленности (Группы 28-38)
Продукция химической и связанных с ней отраслей промышленности (Группы 28-38) ..
..
 , г/см3 …….
, г/см3 ……. .
. 1200 K
1200 K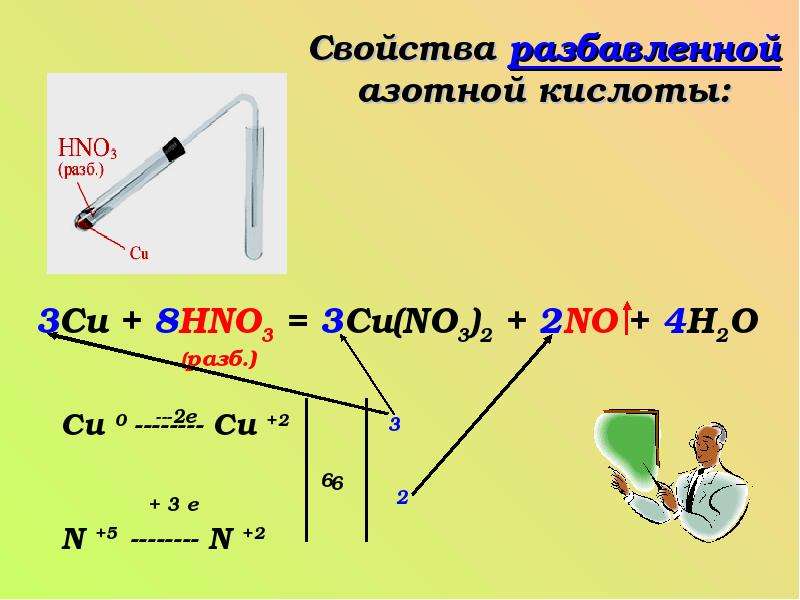
 Д.
Д.
 Продукт (декагидрат сульфата натрия) назван «глауберова соль» в память о нем.
Продукт (декагидрат сульфата натрия) назван «глауберова соль» в память о нем.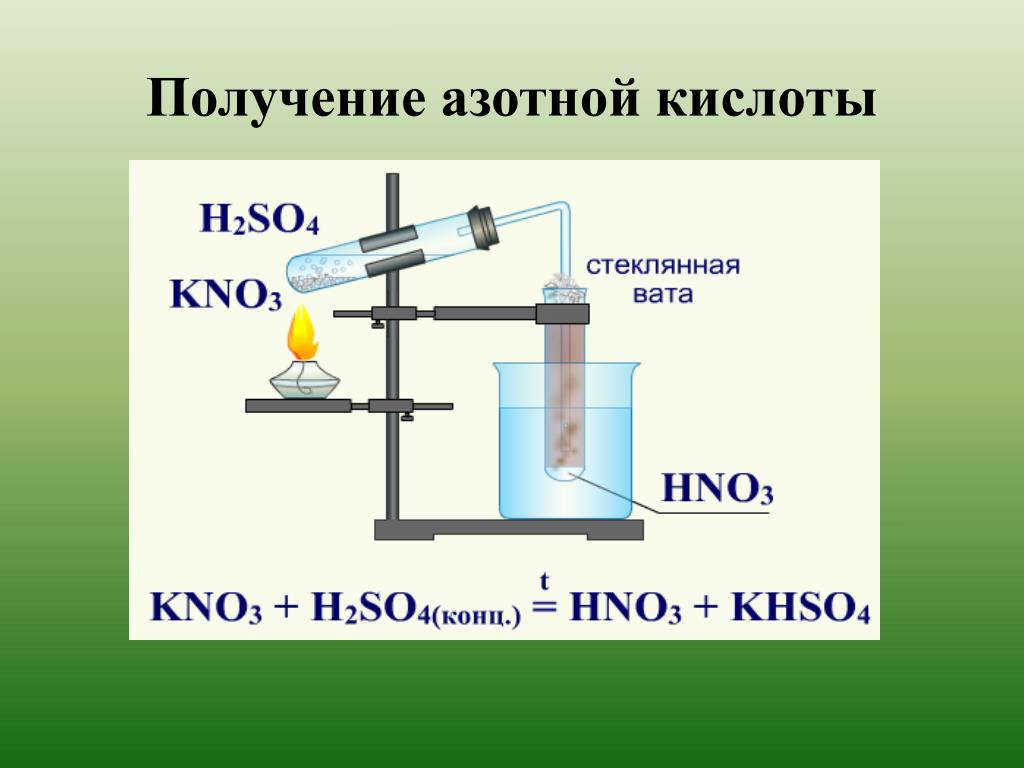 Чистая безводная азотная кислота (100%) представляет собой бесцветную жидкость с плотностью 1522 кг / м 3 при 25 ° C, которая затвердевает при -41.6 ° C с образованием белых кристаллов и кипит при 86 ° C. При кипячении на свету даже при комнатной температуре происходит частичное разложение с образованием диоксида азота по реакции:
Чистая безводная азотная кислота (100%) представляет собой бесцветную жидкость с плотностью 1522 кг / м 3 при 25 ° C, которая затвердевает при -41.6 ° C с образованием белых кристаллов и кипит при 86 ° C. При кипячении на свету даже при комнатной температуре происходит частичное разложение с образованием диоксида азота по реакции: Известны два твердых гидрата: моногидрат (HNO 3 .H 2 O) и тригидрат (HNO 3 .3H 2 O).
Известны два твердых гидрата: моногидрат (HNO 3 .H 2 O) и тригидрат (HNO 3 .3H 2 O). Дымящаяся азотная кислота характеризуется как белая дымящая азотная кислота и красная дымящая азотная кислота, в зависимости от количества присутствующего диоксида азота.
Дымящаяся азотная кислота характеризуется как белая дымящая азотная кислота и красная дымящая азотная кислота, в зависимости от количества присутствующего диоксида азота. ион, H 3 O + .
ион, H 3 O + . Как правило, окислительные реакции происходят в основном с концентрированной кислотой, что способствует образованию диоксида азота (NO 2 ).
Как правило, окислительные реакции происходят в основном с концентрированной кислотой, что способствует образованию диоксида азота (NO 2 ).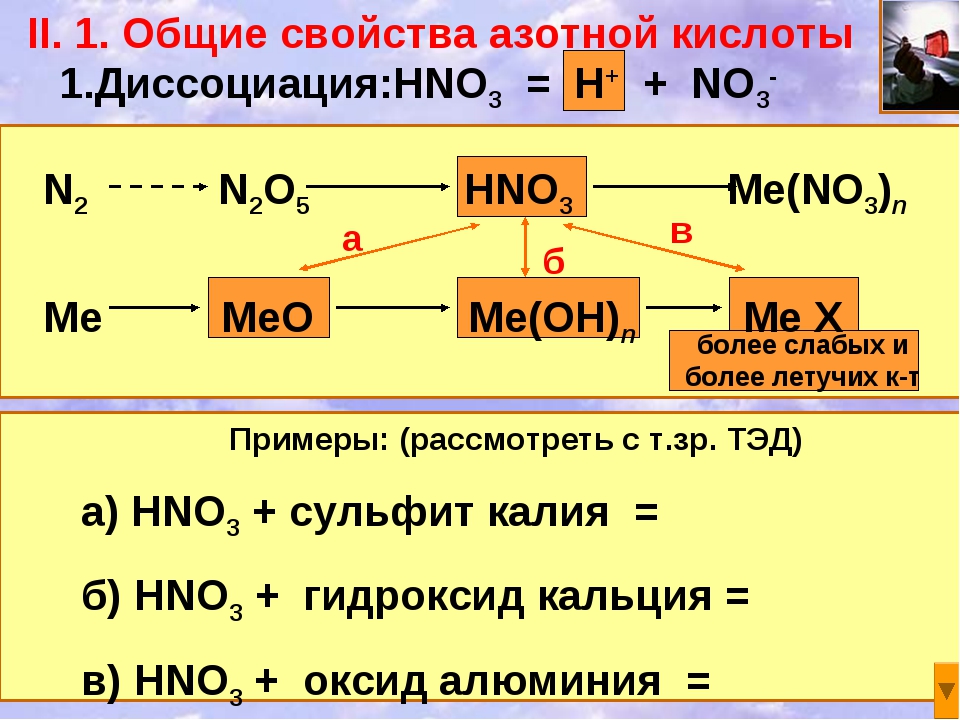 ) + H 2 (г)
) + H 2 (г)  Разбавленная азотная кислота может быть сконцентрирована перегонкой до 68% кислоты, которая представляет собой азеотропную смесь с 32% воды. Дальнейшее концентрирование включает перегонку с серной кислотой, которая действует как дегидратирующий агент. В лабораторных условиях такая перегонка должна проводиться во всех стеклянных аппаратах при пониженном давлении, чтобы предотвратить разложение кислоты. Также следует избегать использования резиновых и пробковых фитингов, так как азотная кислота разъедает эти материалы. Растворы азотной кислоты товарного качества обычно содержат от 52 до 68 процентов азотной кислоты.Промышленное производство азотной кислоты осуществляется по технологии Оствальда, названной в честь Вильгельма Оствальда.
Разбавленная азотная кислота может быть сконцентрирована перегонкой до 68% кислоты, которая представляет собой азеотропную смесь с 32% воды. Дальнейшее концентрирование включает перегонку с серной кислотой, которая действует как дегидратирующий агент. В лабораторных условиях такая перегонка должна проводиться во всех стеклянных аппаратах при пониженном давлении, чтобы предотвратить разложение кислоты. Также следует избегать использования резиновых и пробковых фитингов, так как азотная кислота разъедает эти материалы. Растворы азотной кислоты товарного качества обычно содержат от 52 до 68 процентов азотной кислоты.Промышленное производство азотной кислоты осуществляется по технологии Оствальда, названной в честь Вильгельма Оствальда.