Содержание
Составьте формулы двух изомеров и двух гомологов для вещества C5h22.
1. Определите объём сероводорода (h3S), который образуется при взаимодействии 12,8 г. серы с водородом.
2. Определите массу осадка, образующегося при
…
взаимодействии хлорида железа (II) с раствором, содержащим 33,6 г. гидроксида калия.
3.Определите объём аммиака (Nh4), который образуется при взаимодействии 11,2 г. азота с водородом.
4.Определите массу осадка, образующегося при взаимодействии 3,36 л. углекислого газа [оксид углерода (IV)] с раствором гидроксида кальция.
5.Определите массу сероводорода (h3S), который образуется при взаимодействии серы с 1,12 л. водорода.
6.Определите массу осадка, образующегося при взаимодействии силиката натрия с раствором, содержащим 21,9 г. соляной кислоты.
7.Определите массу аммиака (Nh4), который образуется при взаимодействии 11,2 л. водорода с азотом.
Пожалуйста;)
Определи формулы неизвестных реагентов в схеме последовательных превращений и запиши соответствующие уравнения реакций.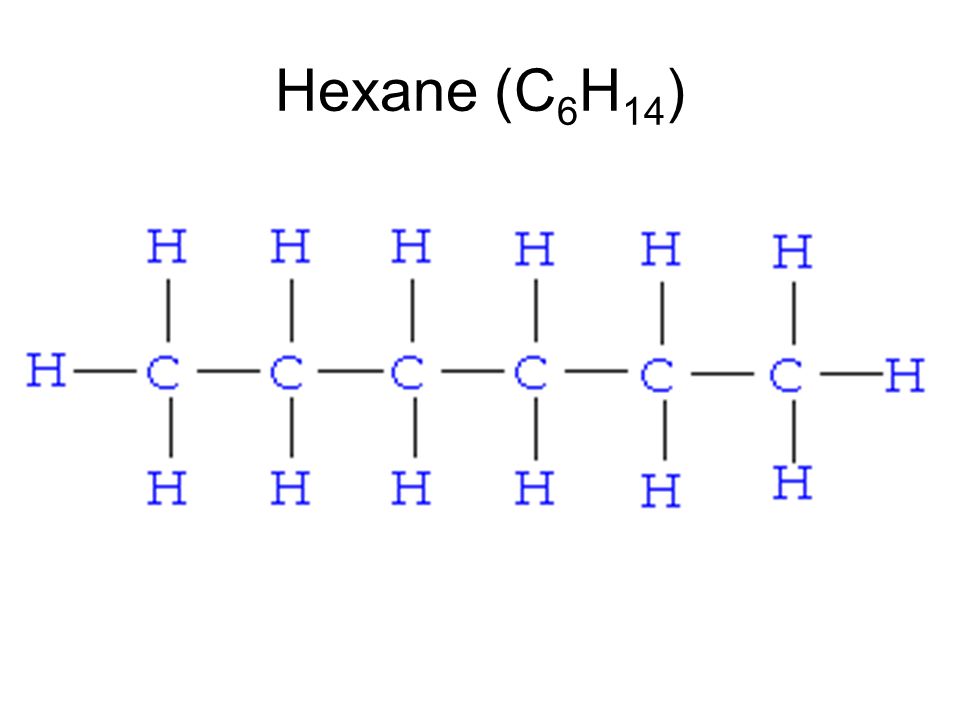
1.Выберете два оксида, которые НЕ реагируют с серной кислотой
1.CuO
2.SiO
3.CrO
4.ZnO
5.CO
2. Выберете 2 вещества, которые реагируют с оксидом углерод
…
а (IV)
1.MgO
2.O2
3.HNO3 (конц)
4.SiO2
5.Ba(OH)2
3. Выберите два оксида, которые реагируют с раствором щелочей
1. Оксид магния
2. Оксид азота (ll)
3. Оксил фосфора (v)
4. Оксид цинка
5. Оксид железа (ll)
задача 2, химия, помогите решить
ПОМОГИТЕ! ПРОШУ!1. Напишите уравнение реакции муравьиной кислоты с никелем!(2 балла)2. Запишите реакцию нейтрализации между уксусной кислотой и гидрок
…
сидом магния! (2p)Назовите продукты реакции! (1p)
напишите уравнение реакций по такой схеме :
натрий-оксид натрия-гидроксид натрия-сульфат натрия-сульфат бария-гидроксид бария
Определи формулы неизвестных реагентов в схеме последовательных превращений и запиши соответствующие уравнения реакций.
Сколько г Мg и S потребуется для получения 112 г сульфида магния? а) 24 г, 32 г 6) 12 г, 16 г в) 6 г, 8 г) 48 г, 64 г д) 96 г, 128 г С ОБЬЯСНЕНИЯМИ
И разбавленная, и концентрированная серная кислота реагирует со всеми веществами ряда:
()2,,
3,3,
3,,2
И разбавленная, и концентрированная серная кислота реагирует со всеми веществами ряда:
()2,,
3,3,
3,,2
|
1. |
Общие формулы |
1 вид — рецептивный |
лёгкое |
1 Б. |
Надо соотнести общую формулу и гомологический ряд углеводородов. |
|
2. |
Названия углеводородов |
2 вид — интерпретация |
лёгкое |
1 Б. 
|
Требуется назвать углеводород по формуле. |
|
3. |
Определения понятий |
2 вид — интерпретация |
лёгкое |
1 Б. |
Отрабатываются знания основных понятий темы. |
|
4. |
Реакции углеводородов |
2 вид — интерпретация |
среднее |
1 Б. 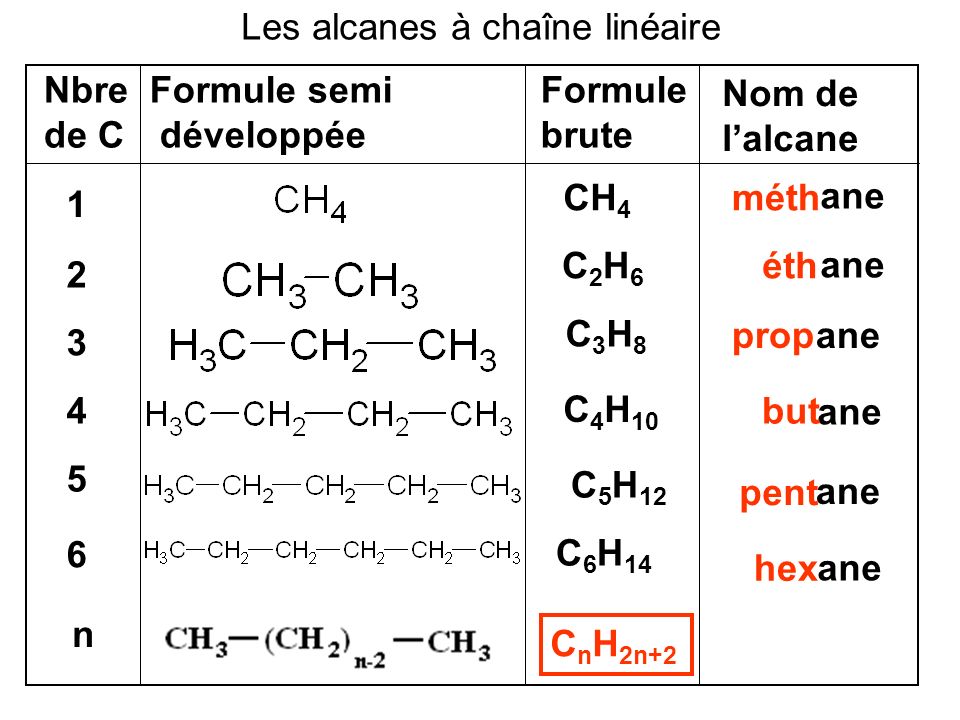
|
Требуется определить, какие типы реакций характерны веществу, формула которого приведена. |
|
5. |
Химические свойства |
2 вид — интерпретация |
среднее |
2 Б. |
Выбираются формулы веществ, с которыми может реагировать углеводород. |
|
6. 
|
Расставь коэффициенты |
2 вид — интерпретация |
среднее |
2 Б. |
Тренируется умение расставлять коэффициенты в уравнениях реакций горения алканов. |
|
7. |
Выбери формулу |
2 вид — интерпретация |
среднее |
2 Б. 
|
Тренируется умение выбирать формулы веществ определённого гомологического ряда. |
|
8. |
Число атомов водорода |
3 вид — анализ |
сложное |
3 Б. |
Закрепляется знание общих формул углеводородов и умение их использовать для определения числа атомов углерода в молекуле. |
|
9. 
|
Выбери гомологи |
3 вид — анализ |
сложное |
4 Б. |
Отрабатывается умение анализировать молекулярные формулы и выбирать формулы веществ гомологического ряда. |
Урок 2. предельные углеводороды — алканы — Химия — 10 класс
Химия, 10 класс
Урок № 2. Предельные углеводороды – алканы
Перечень вопросов, рассматриваемых в теме: урок посвящён предельным углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека. В ходе урока школьники познакомятся с представителями данного класса органических веществ.
В ходе урока школьники познакомятся с представителями данного класса органических веществ.
Глоссарий
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся друг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Группа функциональная – группа атомов, определяющая наиболее характерные химические свойства вещества и его принадлежность к определенному классу.
Галогенирование – замещение одного или нескольких атомов водорода на галоген.
Дегидрирование – отщепление атомов водорода за счет отщепления связи С-Н.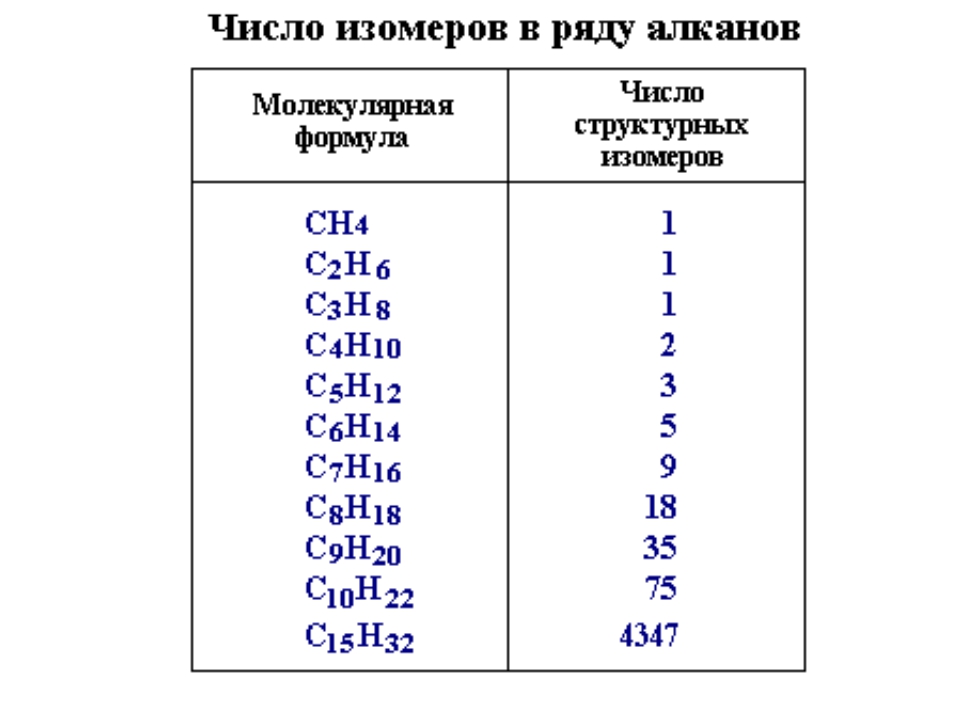
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Изомеризации реакция – характерна для алканов, протекает под влиянием катализаторов и при нагревании, вещества превращаются в разветвленные, без изменения состава молекулы.
Крекинг – процесс термического или каталитического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул на молекулы с меньшим числом атомов углерода. Чаще всего при этом образуются алкан и алкен.
Парафины – исторически сложившееся название, отражающее их малую химическую активность.
Цепная реакция – реакция, в ходе которой исходные вещества вступают в цепь превращений с участием промежуточных активных частиц и их регенерацией в каждом элементарном акте реакции.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Алканы – это углеводороды, в молекулах которых атомы углерода соединены между собой только простыми (одиночными) ковалентными связями. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,187 нм. При этом оси четырех sр3-гибридных орбиталей оказываются направленными к вершинам тетраэдра, угол равен 109°28′.
Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,187 нм. При этом оси четырех sр3-гибридных орбиталей оказываются направленными к вершинам тетраэдра, угол равен 109°28′.
Метан является родоначальником ряда предельных углеводородов (алканов). Их состав выражается общей формулой CnH2n+2. По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса — ан путём добавления к соответствующему корню от названия углеводорода.
Наращивание углеродной цепи на один атом углерода ведёт к увеличению состава на группу СН2 (гомологическая разность). При этом химические свойства и строение веществ одинаковы. Такие ряды называют гомологическими рядами, их члены по отношению друг к другу являются гомологами.
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета.
Электронное строение алканов определяет инертный характер алканов. При комнатной температуре С1-C4 — газы, C5-C15 — жидкости, C16 и следующие — твердые вещества; нерастворимы в воде. С увеличением числа атомов углерода в молекуле возрастает температура кипения и плавления.
При комнатной температуре С1-C4 — газы, C5-C15 — жидкости, C16 и следующие — твердые вещества; нерастворимы в воде. С увеличением числа атомов углерода в молекуле возрастает температура кипения и плавления.
По химическим свойствам алканы – инертные вещества. Они вступают только в реакции замещения, протекающие с разрывом связей C-H. Протекают эти реакции в жестких условиях (высокая температура, освещенность).
Реакция галогенирования алканов протекает по радикально — цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
В разработке теории цепных реакций большую роль сыграли труды академика, лауреата Нобелевской премии Н.Н. Семёнова.
Еще одно подтверждение малоактивных свойств алканов — на них не действуют сильные окислители. При пропускании метана через растворы перманганата калия (KMnO4, Br2(H2O) бромной воды) никаких изменений не наблюдается.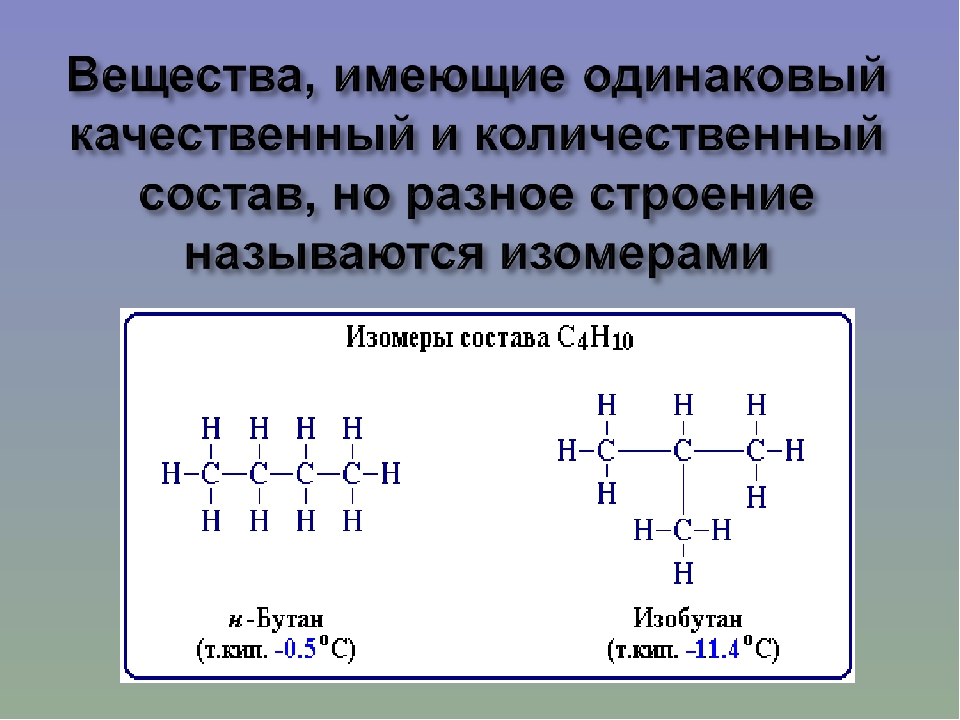 Не действует на алканы и концентрированная серная кислота.
Не действует на алканы и концентрированная серная кислота.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи о получении метана
Сколько граммов карбида алюминия требуется для получения 5,6 л (н. у.) метана с помощью реакции гидролиза? Ответ округлите до целых.
Ответ: 12г
Решение:
1.Запишем уравнение реакции
Al4C3+12H2O→3CH4+4Al(OH)3
2.Рассчитаем количество вещества метана
ν(СН4) = 5.6 /22.4 = 0.25 (моль)
3.Составим пропорцию, приняв за х количество вещества карбида алюминия:
0,25/3 = х/1
x = 0,083 (моль).
4. Определяем массу карбида алюминия
m(Al4C3) = 0.083 · 144 = 12 (г)
- Определение формул гомологов.
Подчеркните формулы алканов, которые должны в итоге образовать линию из трех веществ (она может быть как по прямой, так и по диагонали)
C2H4 | CH4 | C5H12 |
C3H4 | C6H6 | C3H8 |
C10H22 | C5H10 | C8H18 |
Решение:
- Определяем в каких ячейках находятся алканы, т.
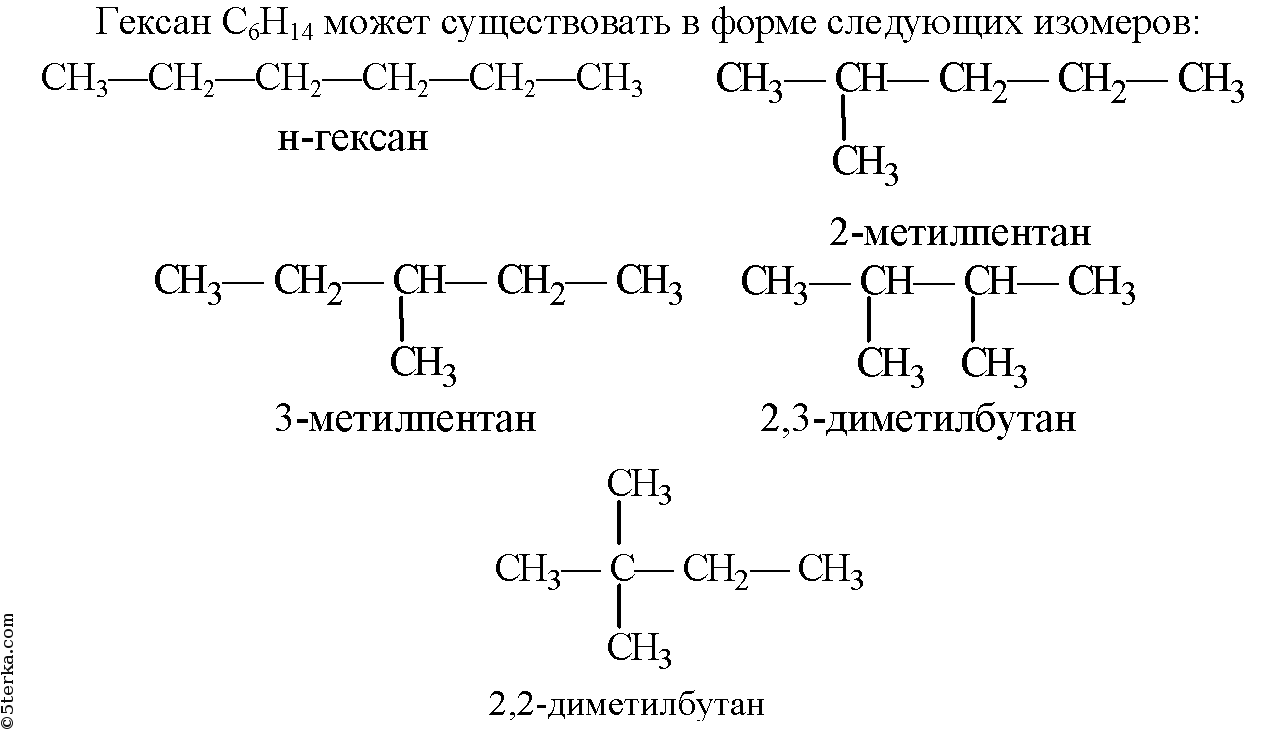 е. вещества, соответствующие общей формуле CnH2n+2
е. вещества, соответствующие общей формуле CnH2n+2
C2H4 | CH4 | C5H12 |
C3H4 | C6H6 | C3H8 |
C10H22 | C5H10 | C8H18 |
- После подсчета получается, что алканы находятся только в одной вертикальной линии.
C2H4 | CH4 | C5H12 |
C3H4 | C6H6 | C3H8 |
C10H22 | C5H10 | C8H18 |
Самостоятельная работа по теме Алканы (10 класс)
Самостоятельная работа: «Алканы»
Вариант 1
Задание 1.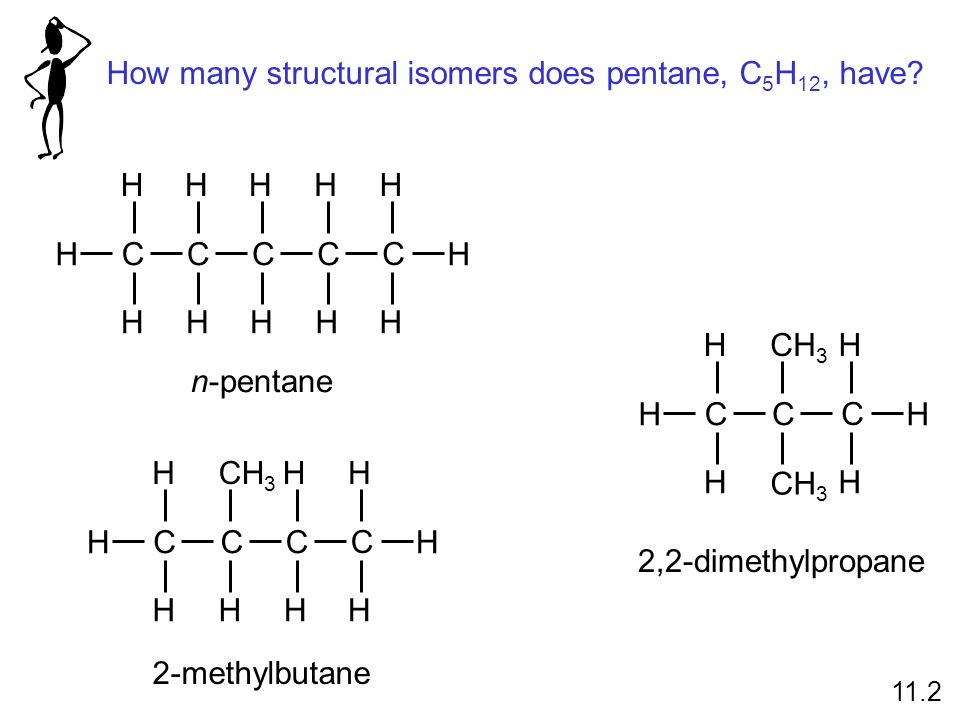 Выберите из предложенных веществ те, которые относятся к насыщенным углеводородам и назовите их: C2H6; C3H7; C2h5; C5h22; C4H8; С4h20.
Выберите из предложенных веществ те, которые относятся к насыщенным углеводородам и назовите их: C2H6; C3H7; C2h5; C5h22; C4H8; С4h20.
Задание 2. Дайте определения следующим понятиям: гомологи; алканыЗадание 3. Составьте структурные формулы углеводородов: а) 2-метилпентана, б) 3-хлоргексана, в) 2,3-диметилпентана, г) Ch4−CH(Br)−CH(Ch4)2.
Задание 4. Составьте структурные формулы изомеров, имеющих молекулярную формулу C3H7Br
Задание 5. Определите молекулярную формулу неизвестного алкана, молярная масса которого равна 44 г/моль. Запишите его структурную формулу.
Самостоятельная работа: «Алканы»
Вариант 2
Задание 1. Выберите из предложенных веществ те, которылое относятся к насыщенным углеводородам и назовите их: C2h3; C3H8; C2h5; C5h22; C4H8; С6h24.
Задание 2. Дайте определения следующизхъпонятиям: изомерия; алканыЗадание 3. Составьте структурные формулы углеводородов: а) 2-метилбутана, б) 2-хлорэтана, в) 2,2,3-триметилпентана, г) Ch3−CH(Ch4)−Ch4.
Задание 4. Составьте структурные формулы изомеров, имеющих молекулярную формулу C2h5Br2
Составьте структурные формулы изомеров, имеющих молекулярную формулу C2h5Br2
Задание 5. Определите молекулярную формулу неизвестного алкана, молярная масса которого равна 58 г/моль. Запишите его структурную формулу.
Самостоятельная работа: «Алканы»
Вариант 3
Задание 1. Выберите из предложенных веществ те, которые относятся к насыщенным углеводородам и назовите их: Ch5; C3H8; C2h5; C5h20; C4h20; С6H6.
Задание 2. Дайте определения следующим понятиям: изомеры; гомологический ряд
Задание 3. Составьте структурные формулы углеводородов: а) 2-метилбутана, б) 2-хлорэтана, в) 2,2,3-триметилпентана, г) CH(Ch4)2−Ch4−(Ch4)2.
Задание 4. Составьте структурные формулы изомеров, имеющих молекулярную формулу C2h5Cl2
Задание 5. Определите молекулярную формулу неизвестного алкана, молярная масса которого равна 86 г/моль. Запишите его структурную формулу.
Самостоятельная работа: «Алканы»
Вариант 4
Задание 1. Выберите из предложенных веществ те, которые относятся к насыщенным углеводородам и назовите их: C2H6; C3H8; C2h5; C5h22; C4H8; С4h22.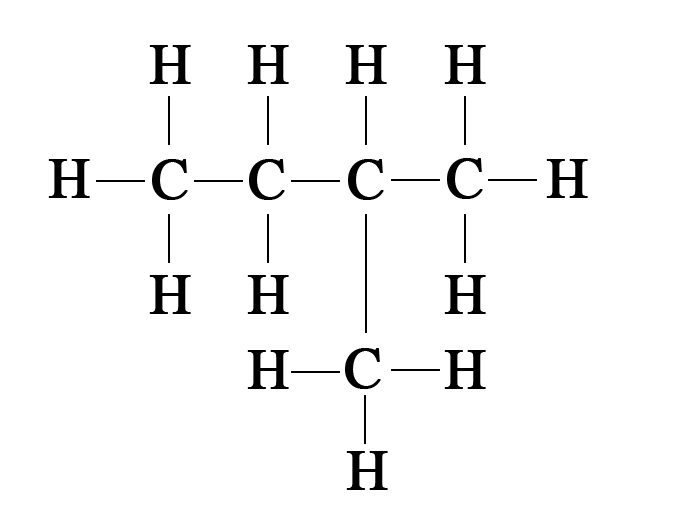
Задание 2. Дайте определения следующим понятиям: гомологи; изомерия
Задание 3. Составьте структурные формулы углеводородов: а) 2-метилпентана, б) 2-бромпропана, в) 2,3-диметилпентана, г) Ch3Cl−CH(Ch4) − Ch4.
Задание 4. Составьте структурные формулы изомеров, имеющих молекулярную формулу C6h24
Задание 5. Определите молекулярную формулу неизвестного алкана, молярная масса которого равна 72 г/моль. Запишите его структурную формулу.
Приложенные файлы
Алканы. Получение, свойства и применение
1. Алканы. Получение, свойства и применение
Алканы — углеводороды с
общей формулой Cnh3n+2
в молекулах которых имеются
только одинарные связи.
3. Гомологи
Гомологический ряд
— это
ряд химических соединений, принадлежащих к
одному классу веществ и отличающихся по составу на
определённое число повторяющихся структурных
единиц -СН2 — (гомологическую разность).
-СН2 – метиленовая группа.
4. Гомологический ряд алканов
Ch5
C2H6
C3H8
C4h20
C5h22
C6h24
C7h26
C8h28
C9h30
C10h32
5.
 Изомеры
Изомеры
Изомерия
—
явление
существования
химических
соединений
одинаковых
по
качественному и количественному составу и
молекулярной массе, но различающихся по
строению или расположению атомов в
пространстве и, вследствие этого, по свойствам.
6. Номенклатура алканов
Алгоритм составления названий органических соединений
(3)
(4)
(5)
(6)
(7)
СН3 – СН – СН 2 – СН2 – СН2 – СН – СН2 – СН3
|
|
(2) СН 2
СН 2 – СН2 – СН3
|
(8)
(9)
(10)
(1) СН3
Данное вещество называется: 3-метил-7-этилдекан
1. Выбирают наиболее длинную (главную) цепь и нумеруют ее, начиная с того конца, к которому
ближе радикал (заместитель, обозначен желтым цветом).
2. Название строится в следующей последовательности: префикс + корень + суффикс.
а) Префикс состоит из цифры, указывающей на номер углеродного атома, возле которого стоит
радикал, и названия самого радикала.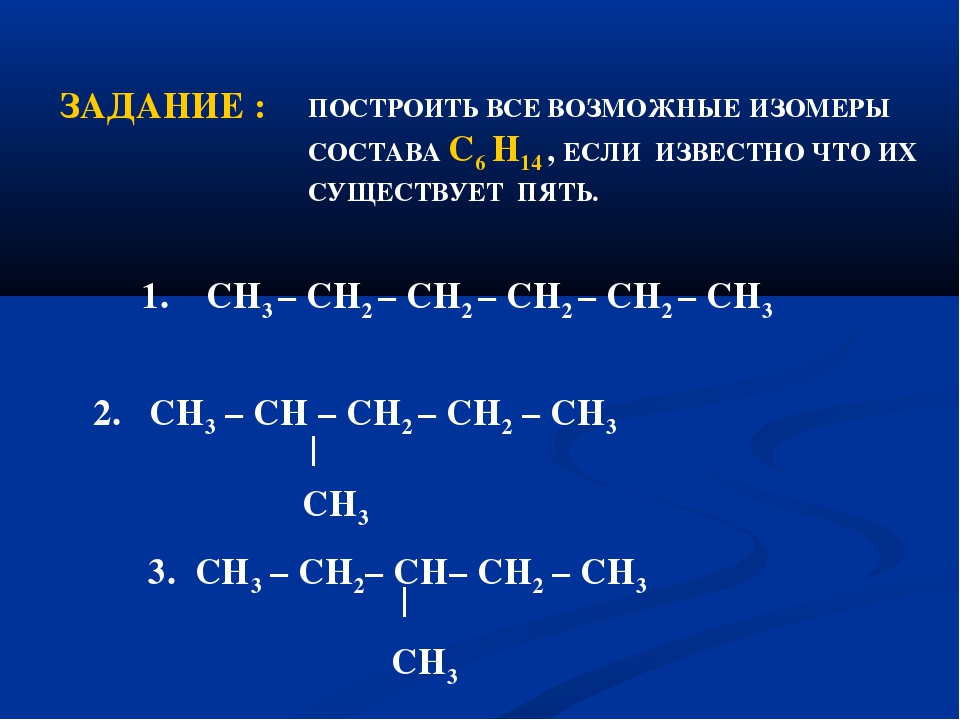 Например: 3-метил… Если молекула содержит
Например: 3-метил… Если молекула содержит
несколько одинаковых радикалов, то после перечисления всех цифр, указывающих их
местоположение, к названию радикала добавляют числовую приставку (ди – два, три – три,
тетра – четыре).
Например: 2,3-диметил…, или 3,4,5-триэтил…
б) Корень – название неразветвлённого алкана с таким же количеством атомов углерода, как в
выбранной нами главной цепи.
в) Суффикс – у алканов суффикс «ан».
Физические свойства алканов
Ch5…C4h20
C5h22…C15h42
C16h44…
Газы (без запаха)
Жидкости
Твердые вещества
(имеют запах)
(без запаха)
t кипения и t плавления увеличиваются
Алканы – бесцветные вещества, легче воды,
плохо растворяются в воде.
8. Физические свойства метана
Газ, без цвета и запаха, почти в 2 раза легче
воздуха, малорастворим в воде, вызывает
асфиксию при содержании в воздухе более 20%.
При смеси с кислородом 1:2 взрывается (с
воздухом 1:10).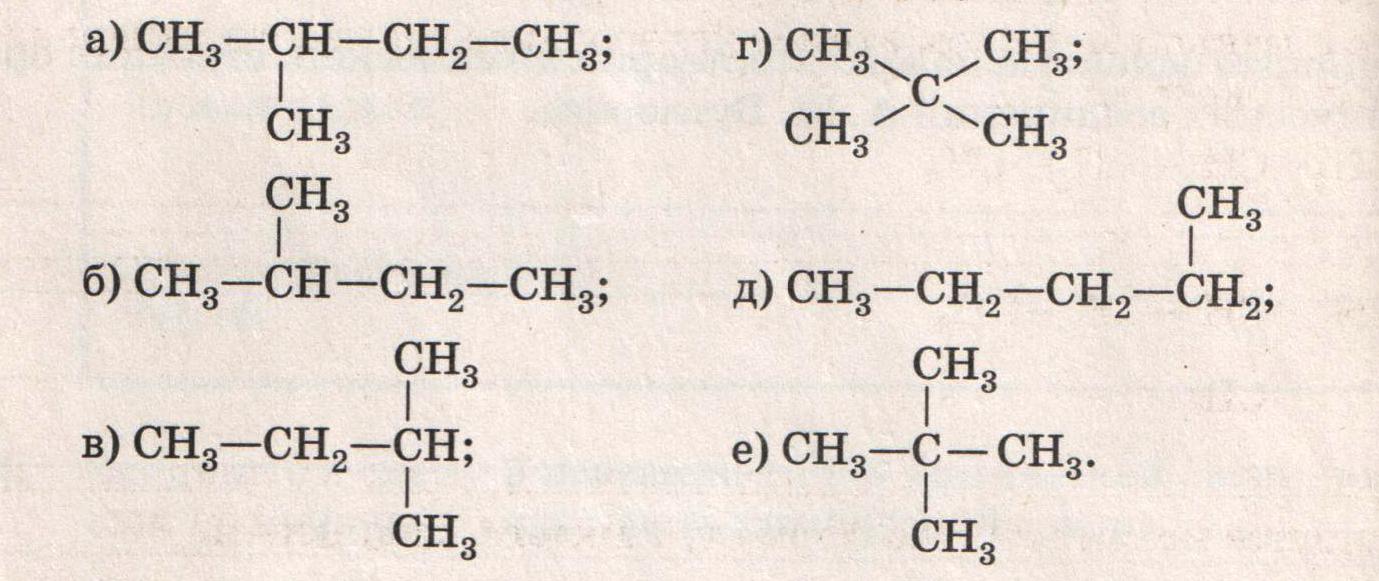
9. Получение
1) Восстановление галогенпроизводных (в присутствии
Pd)
Ch4Cl + h3 → Ch5 + HCl
2Ch4I + 2Na → C2H6 + 2NaI (реакция (синтез)
Вюрца)
2) Сплавление ацетата натрия с твердым гидроксидом
натрия (реакция Дюма)
Ch4COONa + NaOH → Ch5 + Na2CO3
3) Синтез Фишера – Тропша (соли железа и кобальта)
– синтез-газ
nCO + (2n+1)h3 → Cnh3n+2 + nh3O
10. Получение метана
1. В промышленности:
а) из природного газа;
б) синтез из оксида углерода (II) и водорода (из синтез-газа):
CO + 3h3
Ch5↑ + h30.
Ni, 300 °C
2. В лаборатории:
а) гидролиз карбида алюминия:
Al4C3 + 12h3O
3Ch5↑ + 4Al(OH)3;
б) сплавление солей уксусной кислоты (ацетатов) со щелочами:
Ch4COOH (тв.) + NaOH (тв.)
t
Ch5↑+ Na2CO3.
11. Химические свойства
1) Галогенирование
Ch5 + Cl2 → Ch4Cl (хлорметан) + HCl
Ch4Cl + Cl2 → Ch3Cl2 (дихлорметан) + HCl
Ch3Cl2 + Cl2 → CHCl3 (трихлорметан) + HCl
CHCl3 + Cl2 → CCl4 (тетрахлорметан) + HCl
12.
 Цепная реакция
Цепная реакция
Цепная реакция — химическая реакция, в
которой появление свободного радикала или
атома
вызывает
большое
число
(цепь)
последовательных превращений.
Реакции замещения у алканов
1) Галогенирование (действие галогенов):
СН3–СН3 + Сl2
hν
Ch3Cl–Ch4 + HCl.
ЗАПОМНИ! Реакция начинается при освещении и носит радикально-цепной
характер.
2) Нитрование (реакция Коновалова):
NO2
Ch4
CH
Ch4
Ch4
+ HNO3
Ch4
C
Ch4 + h3O.
Ch4
ЗАПОМНИ! Реакция нитрования происходит при нагревании и приводит
к образованию нитросоединений.
14. Химические свойства метана
2) Горение
Ch5 + 2O2 → CO2 + 2h3O + Q
3) Разложение (при нагревании без доступа к воздуху)
Ch5 → C + 2h3 (t > 1000 °C)
15. Химические свойства метана
4) Крекинг
2Ch5 → C2h3 + 3h3 — при 1500 °C
5) Нитрование (реакция Коновалова)
Ch5 + HNO3 → Сh4NO2 + h3O
16.
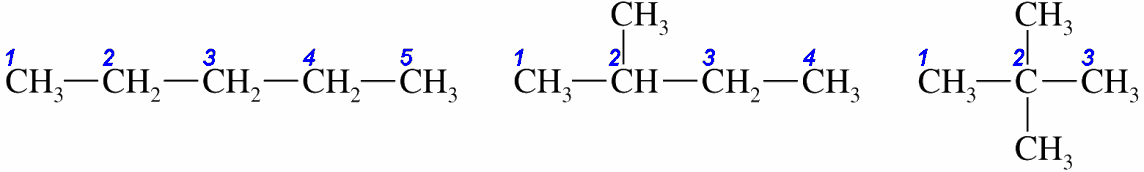 Химические свойства метана
Химические свойства метана
6) Дегидрирование (t > 1500 °C, Ni)
Ch4-Ch4 → Ch3=Ch3 + h3 (этан → этен)
7) Изомеризация
17. В промышленности широко применяется каталитическое окисление алканов, в результате которого получаются разнообразные
2) Каталитическое окисление алканов
В промышленности широко применяется каталитическое окисление
алканов, в результате которого получаются разнообразные
кислородосодержащие соединения: спирты, карбоновые кислоты,
альдегиды, кетоны и т. п.
С4Н10
2СН3СООН + 2Н2О
18. Реакции разложения алканов
1. Пиролиз
При сильном нагревании без
доступа воздуха происходит полное
разложение алканов на простые
вещества.
t
Ch5
C + 2h3.
2. Крекинг – разложение больших
молекул
на молекулы с меньшим количеством
атомов углерода:
C16h44
гексадекан
t
C8h28
октан
+ C8h26.
октен
Запомни!
Предельные углеводороды
не вступают в реакции
присоединения.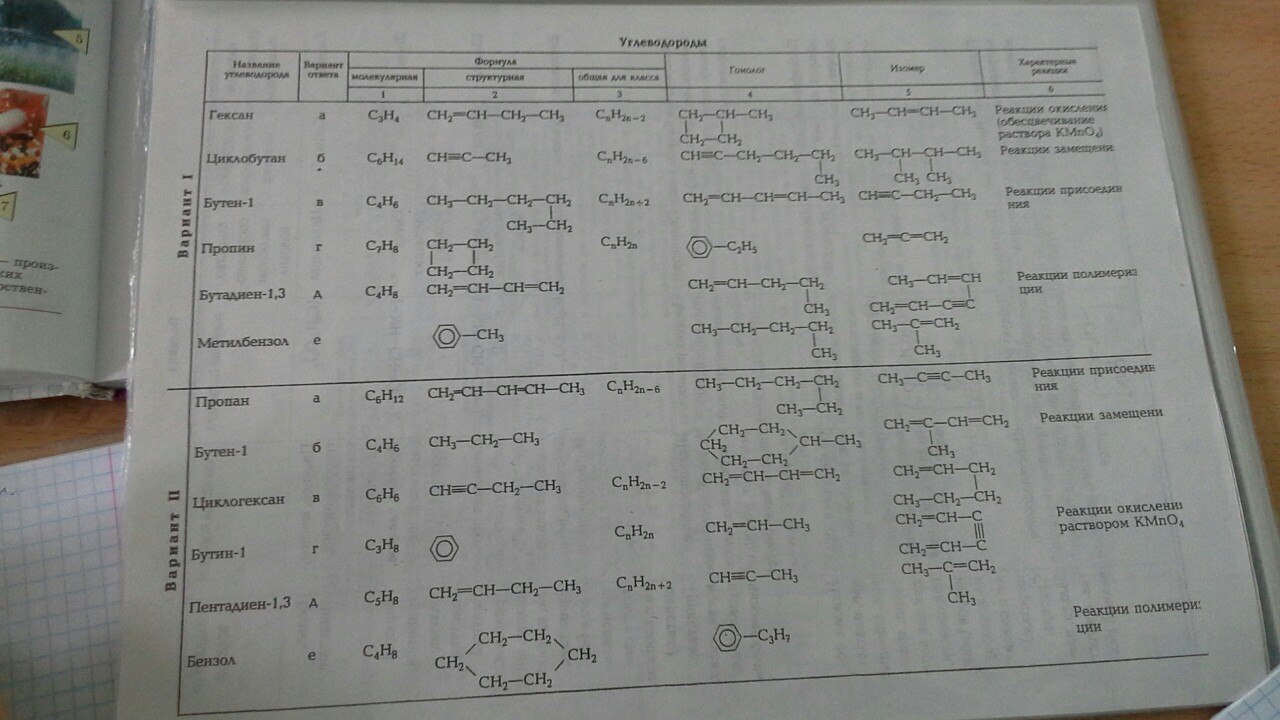 Для них
Для них
характерны реакции замещения,
окисления и разложения.
Алканы не обесцвечивают раствор
перманганата калия и бромную
воду.
20. Применение гомологов метана
21. Применение метана
22. Решите цепочку превращений
C → Ch5 → Ch4Cl →C2H6→ C2H5Cl
23. Какие птицы помогали шахтёрам? Канарейки очень чувствительны к содержанию в воздухе метана. Эту особенность использовали в своё
Как алканы
влияют на климат?
Какие птицы
помогали шахтёрам?
Канарейки очень чувствительны к
содержанию в воздухе метана. Эту
особенность использовали в своё время
шахтёры, которые, спускаясь под
землю, брали с собой клетку с
канарейкой. Если пения давно не было
слышно, значит, следовало
подниматься наверх
как можно
быстрее.
Метан считается одним из
парниковых газов и остается
предметом активных обсуждений
и исследований в связи с
проблемами глобального
изменения климата.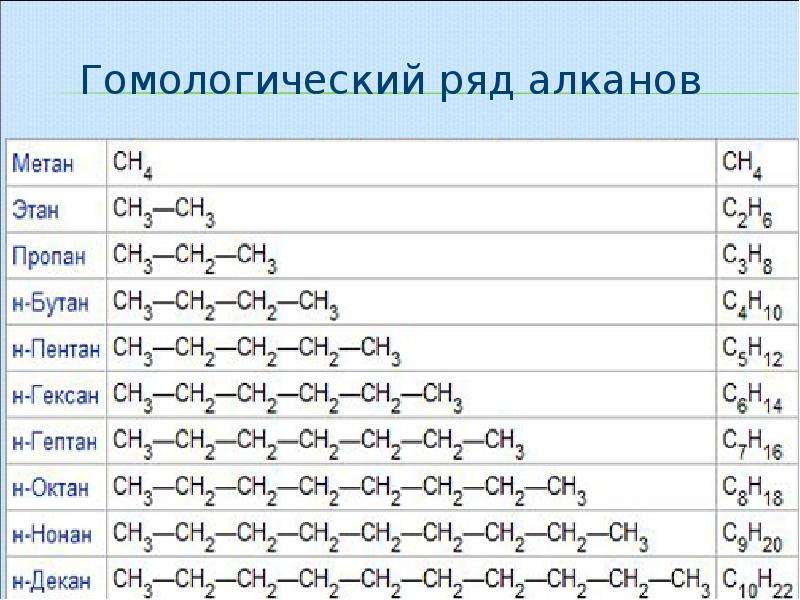
Тема урока «Гомологи и изомеры алканов «
ГБОУ РК «Керченская специализированная школа-интернат с углубленным
изучением отдельных предметов»
Конспект урока по химии:
Тема урока «Гомологи и изомеры алканов «
Выполнила:
Учитель химии
Дорогинина С.О
Керчь-2015
Тема урока «Гомологи и изомеры алканов «
Цель:
организация деятельности учащихся, направленной на прочное усвоение знаний по строению, номенклатуре, изомерии алканов.
Задачи урока:
Обучающие:
дать понятие класса алканов, их общую формулу, гомологический ряд, рассмотреть строение метана и sp3-гибридизацию;
способствовать усвоению гомологии, изомерии и номенклатуры, характерной для класса алканов;
проверить уровень усвоения учебного материала по теме урока.

Воспитывающие:
воспитывать мировоззрение и единую химическую картину мира;
воспитывать дисциплинированность, ответственное отношение к учебному труду;
вырабатывать личностные качества: аккуратности, внимательности при заполнении тетрадей, точности ответов;
показать тесную связь химии с жизнью;
формировать умение работать самостоятельно.
Развивающие:
развивать творческую активность и самостоятельность учеников, показав пути самостоятельного освоения материала;
развивать умения выделять главное, существенное;
развивать химически грамотную речь, образное и логическое мышление;
развивать объективную самооценку.
Ход урока
I. Организационный момент. (2 мин)
1.Организация внимания и порядка в классе, взаимное приветствие, проверка присутствующих, проверка готовности класса к уроку.
2. Подведение учащихся к теме урока.
— что изучает Органическая химия — изучает углеводороды и их производные.
— Какие соединения мы называем углеводородами — орг. соединения, состоящие из двух элементов — углерода и водорода
— напишите общую формулу предельных углеводородов
— почему они называются предельными
— написать формулы метана — молекулярную, структурную, электронную
СМОТРИМ ФРАГМЕНТ СТРОЕНИЕ АЛКАНОВ
Целеполагание
Посмотрите первые 5 пунктов плана и сформулируйте цель урока.
Определение. Формула.
Строение.
Гомологический ряд.
Изомерия.
Номенклатура. .
3. Объяснение темы.
АЛКАНЫ – это насыщенные углеводороды, в молекулах которых атомы углерода соединены между собой только одинарной связью.
Сnh3n+2 n≥1
Лабораторная работа.
Моделирование молекул предельных углеводородов.
Оборудование: пластилин 2-х цветов, палочки.
В ходе работы заполняем таблицу. Лабораторную работу проводим парами.
Опыт 1.
Соберите шаростержневую модель молекулы метана. На шарике, имитирующем атом углерода, наметьте четыре равноудалённые друг от друга точки и вставьте стержни, к которым присоединены водородные шарики. Получили модель молекулы метана. Сделайте пять одинаковых моделей. (слайд №10)
Отнимите от каждой из двух молекул по 1 атому водорода и соедините остатки (радикалы) вместе. Получили модель молекулы этана. Сделайте 2-ю такую же модель. (слайд №11)
Если отнять от этана молекулу водорода, то получим радикал – этил. К этилу присоединим радикал метил и получим пропан.
При соединении между собой двух этилов образуется молекула бутана. (слайд №12)
Отнимем от молекулы бутана один водород, и на его место присоединим радикал метил. Получили ещё один гомолог – пентан. (слайд №13,14)
Метан, этан, пропан, бутан, пентан и т. д. – гомологи.
Гомологи – вещества, сходные по строению и свойствам, но отличающиеся друг от друга по составу на одну или несколько групп – СН2 – .
Опыт 2.
Возьмём модель молекулы пентана.
Н Н Н Н Н
| | | | |
Н – С – С – С – С – С – Н пентан С5Н12
| | | | |
Н Н Н Н Н
Отнимем группу СН3 – и присоединим её на место Н у второго атома С. Получим
Н Н Н Н
| | | |
Н – С – С – С – С – Н С5Н12
| | | |
Н НСН Н Н
|
Н
Отнимем ещё одну группу СН3 – и присоединим её опять у второго атома С
на место второго атома Н. Получим:
Н
|
Н НСН Н
| | |
Н – С – С – С – Н С5Н12
| | |
Н НСН Н
|
Н
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но разные строение и свойства.
Назовём эти вещества:
Алгоритм
составления названий органических веществ.
Выбрать в молекуле самую длинную цепочку углеродных атомов.
Пронумеровать цепочку с того конца, к которому ближе разветвление молекулы.
Основа названия – название углеводорода с тем же числом углеродных атомов, что и в самой длинной цепи.
Перечислить перед основой названия все заместители основной цепи с указанием номеров углеродных атомов, при которых они стоят. Если одинаковых заместителей несколько, перед их названиями ставят приставки ди-, три-, тетра- и т. д.
Отделить запятыми все цифры друг от друга, буквы от цифр – дефисом. Если при одном углеродном атоме имеется не один, а два заместителя, его цифру повторить в названии дважды.
Углеводороды нормального строения обозначают буквой н, например:
Н Н Н Н Н
| | | | |
Н – С – С – С – С – С – Н С5Н12 н-пентан
| | | | |
Н Н Н Н Н
Н Н Н Н
| | | |
Н – С – С – С – С – Н С5Н12 2-метилбутан
| | | |
Н НСН Н Н
|
Н
Н
|
Н НСН Н
| | |
Н – С – С – С – Н С5Н12 2,2 –диметилпропан
| | |
Н НСН Н
|
Н
Заключение Итак, мы изучили пространственное строение предельных углеводородов, узнали, что такое гомологи, изомеры, научились их называть.
Проверим наши знания. (слайд №17,18)
Дан ряд формул веществ. Выберите из них гомологи и изомеры.
Например, гомологи 1,3,4. изомеры 1 и 5, 3 и 7.
СН3 – СН2 – СН2– СН2– СН2– СН3
СН3 – СН– СН2 – СН3
|
СН3
СН3
|
СН3 – С– СН2 – СН3
|
СН3
СН3 – СН2 – СН2 – СН2 – СН3
5. СН3 – СН– СН– СН3
| |
СН3 СН3
6. СН3
|
СН3 – С– СН3
|
СН3
Ответы: Гомологи 1и 4, 3 и 6
Изомеры 1,3 и 5; 2, 4 и 6
Названия алканов и алкильных заместителей
Строение
атом углерода находится в 1-ом валентном состоянии sp3 ;
четыре σ-связи углерода направлены в пространстве под углом 109°28′;
молекула метана СН4 – имеет форму правильного тетраэдра;
длина углеродной связи — 0,154 нм.
ЗАКРЕПЛЕНИЕ Написание структурных формул.
Сначала записывают открытую цепь, затем нумеруют атомы углерода и расставляют заместители. В заключение дописывают атомы водорода, чтобы каждый атом углерода оказался четырехвалентным. Рассмотрим на примере 2,5,6-триметилоктан.
Смотрите документ
4. Закрепление темы
1. Напишите структурные формулы следующих веществ:
а) 2,3 – диметилбутана,
б) 2,4 – диметил — 3 – этилпентана
в) н – пентана
2. Если вы усвоили номенклатуру алканов, то сможете самостоятельно назвать каждый из них. Перепишите в тетрадь структурные формулы алканов, приведенные в задании и назовите эти вещества.
Тест на тему: «Алканы»
5. Подведение итогов урока
Вернутся к плану урока, посмотреть 1-5 пунктов, ответить на вопросы
— достигли ли мы поставленной цели?
— что нового на уроке узнали?
— что было интересным?
6. Домашнее задание
Параграф 8 тестовые задания стр 34
Гомологи и изомеры алканов
1. Алканы – это алифатические (ациклические), насыщенные углеводороды, в которых все валентности атомов углерода, не затраченные на образование простых С – С связей, насыщены атомами водорода.
2. Общая формула алканов – Сnh3n+2
В таблице представлены некоторые представители ряда алканов и их радикалы.
Формула | Название | Название радикала |
Ch5 | метан | — Ch4 метил |
C2H6 | этан | — C2H5 этил |
C3H8 | пропан | — C3H7 пропил |
C4h20 | бутан | — C4H9 бутил |
C4h20 | изобутан | изобутил |
C5h22 | пентан | пентил |
C5h22 | изопентан | изопентил |
C5h22 | неопентан | неопентил |
C6h24 | гексан | гексил |
C7h26 | гептан | гептил |
C10h32 | декан | децил |
Тренажёр «Гомологический ряд алканов»
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп — СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -)
3. Строение:
Основные характеристики:
пространственное строение – тетраэдрическое
sp3 – гибридизация,
‹ HCH = 109 ° 28
Углеродная цепь — зигзаг (если n ≥ 3)
σ – связи (свободное вращение вокруг связей)
длина (-С-С-) 0,154 нм
энергия связи (-С-С-) 348 кДж/моль
Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации
угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10-9м).
Образование молекулы метана
а) электронная и структурная формулы;
б) пространственное строение
Строение молекулы этана С2Н6
Строение молекулы пропана С3Н8 – цепь зигзагообразная
Тренажёр «Состав и строение алканов»
4. Изомерия – характерна СТРУКТУРНАЯ изомерия цепи с С4
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.
Сравнительная характеристика гомологов и изомеров
Урок химии «Алкены. Строение. Гомологический ряд этилена. Номенклатура. Изомерия алкенов»
Цель урока:
- выработка умений самостоятельно применять
знания об алканах, применять их в новых условия. - изучить строение алкенов; выявить их
существенные отличия от алканов; рассмотреть
виды изомерии алкенов; основываясь на
особенностях строения, спрогнозировать
химические свойства алкенов.
Задачи урока:
Образовательные:
- формирование знаний школьников о непредельных
углеводородах и об алкенах как самостоятельном
классе этих веществ, а также об особенностях их
электронного строения, изомерии, номенклатуры,
физических свойств; - показать место и значение алкенов среди
углеводородов и в жизни человека;
Развивающие:
- развивать умение учащихся на основе
теоретических знаний сравнивать, анализировать,
обобщать, логически рассуждать, устанавливать
взаимосвязь строения и свойств веществ. - развивать внимание, познавательный интерес
учащихся к предмету путем формирования мотивов
деятельности и использования разнообразных форм
работы (коллективная, индивидуальная, парная).
Воспитательные:
- воспитывать желание учиться активно, с
интересом, прививать сознательную
дисциплинированность, четкость и
организованность в работе.
Форма проведения: урок-игра.
Тип урока: урок формирования новых знаний.
Оборудование:
1. Комплект для построения шаростержневых
моделей молекул.
2. Раздаточный материал:“судовой журнал”
3. Презентация: “Алкены. Строение.
Гомологический ряд этилена. Номенклатура.
Изомерия алкенов”.
Ход урока
(слайд №1)
Любой человек, невзирая на возраст любит
путешествовать. Вот и я Вас приглашаю совершить
вместе со мной путешествие на прекрасном
лайнере. Я – “капитан”, Вы – пассажиры. Нам
нужен штурман, который будет моим помощником. Его
мы можем выбрать по количеству жетонов за
отгаданный кроссворд.
Сегодня вместо тетрадей вы будете работать с
“судовым журналом”, который у Вас на столах.
Итак, начинаем. Чтобы определить — кто поведёт
карабль? Небоходимо ответить на вопросы кроссворда:
(слайд №2-10)
- Процесс выравнивания S и P электронных облаков
- Гомолог метана, формула которого C4H10.
- Основной компонент болотного газа
- Вещества относящиеся к одному классу, но
отличающиеся друг от друга на одну или несколько
групп -CH2 - Вещество получаемое в процессе дегидратации
этилового спирта - Частица несущая один не спаренный электрон
- Вещества имеющие одинаковое число атомов, одну
и ту же молекулярную массу, но различное
химическое строение - Ученый, который получил этан из
галогеннопроизводных предельных углеводород с
металлическим натрием:
По итогам назначается Штурман.____________
Учитель: Итак, карабль готов к выходу в
плаванье. Отдать швартовый!
Учитель ставит перед штурманом задачу: на
протяжении всего нашего плаванья следить за
курсом, за правильные ответы учащимся выдавать
жетоны.
Учитель: (слайд №11)
Штурман, что у нас по курсу?
Штурман:
1. Форватор основных понятий.
Как нам его преодалеть?
Учитель: Чтобы выйти из бухты необходимо
ответить на вопросы в “судовом журнале”
Работа учащихся на местах:
1. Вопрос в “судовом журнале” (слайд №12) Ответ
(слайд №13)
— Из перечисленных веществ, выпишите формулы
предельных УВ и дайте им названия:
C4H8, Ch5, C5h22, C2h5, C3H6, C7h26, C8h28, C8h26, C5h20 .
!!!! Один учащийся тем временем решает задачу у
доски на вывод химической формулы:
Задача. Выведите молекулярную формулу УВ, если
известно, что массовая доля углерода в данном
веществе составляет 87,5%, массовая доля водорода
– 14,3%. Плотность данного вещества по водороду
равна 14. (Ответ: C2h5)
Все вещества, которые вы выписали, относят к
классу алканов. Давайте дадим характеристику
класса, ответив на вопрос 2.
2. Вопрос в “судовом журнале”
Заполните таблицу, отвечая на вопросы:
- Какова общая формула алканов?
- Какой тип гибридизации характерен для атомов
углерода у алканов? - Чему равен валентный угол?
- Форма молекул алканов?
- Виды связи?
- Длина связи С – С?
- Виды изомерии?
Ответ (слайд №14)
| Признаки | Предельные УВ (насыщенные, алканы) |
| 1. Общая формула | CnH2n+2 |
| 2. Тип гибридизации | sp3 |
| 3. Валентный угол | 109о28 |
| 4. Форма молекулы | тетраидрическая |
| 5. Виды связей | — связь |
| 6. Длина связи | 0,154 нм |
| 7. Виды изомерии | Структурная: изомерия углеводородного скелета |
Учитель: Штурман, что у нас дальше по курсу?
Ответ (слайд №15)
2. Море классов органических соединений.
Учитель:
1. Будет ли УВ, формулу которого была выведена
в задаче относится к предельным УВ? Почему? — Не
отвечает общей формуле алканов
2. Является ли данный УВ насыщенным? — Данный
УВ не является насыщенным
Данный УВ используют широко для обработки
фруктов и овощей, чтобы ускорить их созревание.
Сегодня его широко применяют для получения
многих видов пластмасс. Это этилен.
Учитель: Как вы думаете, какую тему урока
мысегодня будем изучать? Ответ (слайд №16)
Записать тему в “судовой журнал”
Тема: “Алкены. Строение. Гомологический
ряд этилена. Номенклатура. Изомерия алкенов”
Постановка целей урока
Сообщение учащегося об истории открытия и
истории названия этилена.
Ответ (слайд №17)
Впервые этилен был получен в 1669 г. немецким
химиком Иоганном Иоахимом Бехером (1635–1682)…
случайно! В одном из опытов он вместо добавления
к нагретому купоросному маслу
(концентрированной серной кислоте) еще одной его
порции в рассеянности прилил винный спирт
(этанол), который находился рядом в стакане. Бехер
увидел сильное вспенивание раствора с
выделением неизвестного газа, похожего на метан
СН4. В отличие от метана новый газ горел коптящим
пламенем и обладал слабочесночным запахом. Бехер
установил, что его “воздух” более химически
активен, чем метан. Так был открыт этилен С2Н4,
образующийся по реакции:
Современники не смогли по достоинству оценить
открытие учёного. Ведь Бехер не только
синтезировал новый углеводород, но и впервые
применил химический катализатор в процессе
реакции. До этого в научной практике применялись
только биологические катализаторы природного
происхождения – ферменты. Этилен более 100 лет
после его открытия не имел собственного
названия.
В конце ХVIII века выяснилось, что при
взаимодействии с хлором “газ Бехера”
превращается в маслянистую жидкость; после чего
его назвали олефином, что значит рождающий масло.
Затем это название распространилось на все
углеводороды, которые имели подобное этилену
строение. И только в середине XIX в. “газ Бехера”
получил название “этилен”, которое дал ему А.М.
Бутлеров. Это название и осталось в химии до
наших дней.
Работа учащихся на местах: Вопрос в
“судовом журнале”
1. Выразить строение этилена структурной
формулой, если согласно теории А.М.Бутлерова
углерод в органических соединениях
четырёхвалентен.
Ответ (слайд №18)
2. Лабораторный опыт № 1: Собрать
шаростержневую модель молекулы этилена,
ответить на ряд вопросов, заполнив таблицу:
- Сколько сигма-связей в молекуле этена? Ответ
(слайд №19) - В состоянии какого типа гибридизации находятся
атомы углерода в этом соединении? - Сколько гибридных и негибридных орбиталей в
атоме углерода в sp2- гибридном состоянии? - Как расположены гибридные орбитали в
пространстве? - Каков будет угол связи?
- Какая из связей более прочная: сигма- или
пи-связь? Ответ (слайд №20)
3. Характеристика двойной связи. Ответ
(слайд №21)
Сделать вывод о характере двойной связи:
а) двойная связь является сочетанием сигма- и
пи-связей, различающихся своей прочностью.
б) наличие пи-связи (более слабой) объясняет
высокую химическую активность алкенов.
Учитель:
Ответив на вопросы, мы двигаемся дальше по
курсу. Штурман, что у нас дальше по курсу?
Ответ (слайд №22)
4. Рифы химических формул
Задание классу: в “судавом журнале”
Гомологический ряд алкенов.
1. Составить молекулярные формулы первых семи
представителей ряда этена Ответ (слайд № 23). Существует
ли алкен с одним атомом углерода?
Номенклатура алкенов.
2. Назовите непредельный углеводород. (слайд
№24,25)
Запомни!!! (слайд №26)
Названия одновалентных радикалов алкенов:
-СН=СН2 (винил) –СН2–СН=СН2 (аллил
)
Изомерия. (Предложить учащимся ответить на
вопросы)
1. Какие виды изомерии характерны для алкенов?
— изомерия углеродного скелета. Ответ (слайд №
27)
— изомерия положения двойной связи. Ответ (слайд
№ 28)
— межклассовая изомерия. Ответ (слайд № 29)
Лабораторный опыт № 2: (слайд № 30)
а) заменить в шаростержневой модели молекулы
этилена два атома водорода на 2 атомыа хлора по
вариантам.
б) возможно свободного вращения атомов
углерода при двойной связи?
в) сравнить полученные вещества и ответить на
вопрос:Может ли молекула одной конфигурации
свободно превратиться в молекулу другой
конфигурации ?
Это два разных вещества, изомерных друг другу.
(слайд № 31)
Данный вид изомерии обусловлен не разным
порядком соединения атомов в молекулах, а
различным расположением атомов в пространстве.
Это один из видов пространственной
изомерии – геометрическая изомерия.
Если замещающие группы в изомере находятся по
одну сторону плоскости двойной связи, то будет цис-изомер
(цис- от лат.- по эту сторону), если они
находятся по разные стороны – транс-изомер (транс-
от лат. – через, по разные стороны).
Эти изомеры отличаются физическими и
химическими свойствами.
Вывод:
- для алкенов характерна пространственная (цис-,
транс) изомерия. - цис-транс-изомерия возникает только в том
случае, если каждый из атомов углерода, связанных
двойной связью, соединён с разными атомами или
группами атомов.
Учитель: Давайте заполним таблицу в “судовом
журнале”
| Тип изомерии | Виды изомерии |
| l Структурная изомерия | 1 углеродного скелета |
| 2 положения двойной связи | |
| 3 межклассовая | |
| ll Пространственная изомерия | 1 цис-изомерия |
| 2 транс-изомерия |
Физические свойства алкенов. Ответ (слайд
№ 32)
Изменение физических свойств происходит вслед
за возрастанием Mr веществ.
По физическим свойствам алкены близки к
алканам, т.к. их молекулы также практически
неполярны. С воздухом этилен образует
взрывоопасные смеси. Жидкие алкены имеют
неприятный специфический запах.
Распространение в природе. В
отличие от предельных УВ алкены в природе, как
правило, не встречаются, что объясняется их
высокой химической активностью. Этилен может
входить в состав природного и попутного газов,
правда содержание его невелико (0,5- 4%).
Газообразные алкены выделяют из газов
нефтепереработки, а также из газов
коксообразования угля.
Учитель: Штурман, что у нас дальше по курсу?
Ответ (слайд №33.34)
5. Залив знаний
Чтобы преодалеть это испатание нам необходимо
ответить на ряд вопросов.
1. Какое вещество является лишним? Почему?(слайд
№35)
| А) 3-метилпентен-1 | Г) 2-метил-4-этилгексен-2 | Ж) циклогексан |
| Б) 2,2-диметил-3-этилгептен-3 | Д) 3-метилпентен-2 | З) цис-изомер-гексен-2 |
| В) 2-метилоктен-2 | Е) 3-метилгексен-2 | И) гексан |
Ответ (слайд №36) Какое вещество является
лишним? Почему? — И) гексан
2. Какие вещества являются изомерами? Почему? (слайд
№37)
Ответ (слайд №38) Какие вещества являются
изомерами? Почему? — 1) А и Д; 2) В и Г.
3. Вставьте в текст соответствующие слова и
символы из скобок (слайд №39)
Алкенами называются УВ, содержащие в молекуле
одну…. (одинарную, двойную, тройную) связь и
имеющие общую формулу …. (СnН2n+2, СnН2n, СnН2n-2). Длина
углерод-углеродной связи в этилене ….(больше,
меньше), чем в этане, и равна ….(0,154 нм, 0,120 нм,
0,134 нм)
Ответ (слайд №40)
Алкенами называются УВ, содержащие в молекуле
одну…. (одинарную, двойную, тройную) связь
и имеющие общую формулу …. (СnН2n+2 СnН2n СnН2n-2). Длина
углерод-углеродной связи в этилене ….(больше,
меньше), чем в этане, и равна ….(0,154 нм, 0,120 нм,
0,134 нм)
6. Порт
Учитель: (слайд №41)
Итак, мы подошли в конечный пункт нашего
путешествия – порт.
Давайте подведём итог нашему путешествию,
ответив вопросы в “судовам журнале”:
(слайд №42)
то мы узнали в ходе путешествия?
(поднимите смайлик)
Учащиеся отвечают на вопросы, учитель считает
количество жетонов и выставляет оценки за урок.
(слайд №43) Домашнее задание
Учитель: Домашнее задание у вас находится в
“судовом журнале”
1. Параграф 7
2. Напишите структурные формулы веществ:
| а) 3-метилпентен-1 | б) 2,2-диметил-3-этилгептен-3 | в) 2-метилоктен-2 |
| г) 2-метил-4-этилгексен-2 | д) 3-метилпентен-2 | е) 3-метилгексен-2 |
| ж) циклогексан | з) цис-изомер-гексен-2 |
(слайд №44) Спасибо за внимание!
Технологическая карта урока.
% PDF-1.4
%
1 0 объект
>
эндобдж
2 0 obj
>
эндобдж
3 0 obj
>
эндобдж
4 0 объект
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
эндобдж
5 0 obj
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
эндобдж
6 0 obj
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
эндобдж
7 0 объект
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
эндобдж
8 0 объект
>
поток
конечный поток
эндобдж
9 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -14 Тс
14.25 26,7256 тд тдж
ET
Q
Q
конечный поток
эндобдж
10 0 obj
>
эндобдж
11 0 объект
>
эндобдж
12 0 объект
>
поток
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода
endcodespacerange
32 начало
конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
эндобдж
13 0 объект
>
/ FontDescriptor 11 0 R
/ BaseFont / WHNHJA + TimesNewRoman, полужирный
/ Вт [3 [250] 17 [250] 19 [500] 20 [500] 21 [500] 26 [500] 27 [500] 29 [333] 36 [722] 38 [722] 39 [722] 46 [777] ] 48 [943] 49 [722] 50 [777] 57 [722] 66 [500] 68 [500] 70 [443] 72 [443] 74 [500] 75 [556] 76 [277] 79 [277] 80 [833] 81 [556] 82 [500] 85 [443] 86 [389] 87 [333] 90 [722] 92 [500]]
>>
эндобдж
14 0 объект
>
эндобдж
15 0 объект
>
поток
конечный поток
эндобдж
16 0 объект
>
поток
конечный поток
эндобдж
17 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -14 Тс
480.75 26,7256 тд тдж
ET
Q
Q
конечный поток
эндобдж
18 0 объект
>
поток
конечный поток
эндобдж
19 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -14 Тс
14,25 45,4756 тд тдж
ET
Q
Q
конечный поток
эндобдж
20 0 объект
>
поток
конечный поток
эндобдж
21 0 объект
>
поток
конечный поток
эндобдж
22 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -14 Тс
511,5 45,4756 тд тдж
ET
Q
Q
конечный поток
эндобдж
23 0 объект
>
поток
конечный поток
эндобдж
24 0 объект
>
поток
конечный поток
эндобдж
25 0 объект
>
поток
конечный поток
эндобдж
26 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -14 Тс
541.5 771,4756 тд тдж
ET
Q
Q
конечный поток
эндобдж
27 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
0 0 мес.
0 0 л
S
Q
Q
конечный поток
эндобдж
28 0 объект
>
эндобдж
29 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
20,25 57,75 м
591,75 57,75 л
S
Q
Q
конечный поток
эндобдж
30 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
20,25 753 м
591,75 753 л
S
Q
Q
конечный поток
эндобдж
31 0 объект
>
поток
конечный поток
эндобдж
32 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
42 95.4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
33 0 объект
>
эндобдж
34 0 объект
>
поток
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода
endcodespacerange
61 начало
конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
эндобдж
35 0 объект
>
/ FontDescriptor 33 0 R
/ BaseFont / OODRTX + TimesNewRoman
/ Вт [3 [250] 8 [833] 12 [333] 14 [563] 15 [250] 16 [333] 17 [250] 19 [500] 20 [500] 21 [500] 22 [500] 23 [500] ] 24 [500] 25 [500] 26 [500] 27 [500] 28 [500] 29 [277] 34 [443] 36 [722] 37 [666] 38 [666] 39 [722] 42 [722] 43 [722] 44 [333] 48 [889] 49 [722] 50 [722] 51 [556] 53 [666] 55 [610] 56 [722] 58 [943] 68 [443] 69 [500] 70 [443] ] 71 [500] 72 [443] 73 [333] 74 [500] 75 [500] 76 [277] 77 [277] 78 [500] 79 [277] 80 [777] 81 [500] 82 [500] 83 [500] 84 [500] 85 [333] 86 [389] 87 [277] 88 [500] 89 [500] 90 [722] 91 [500] 92 [500] 93 [443] 177 [500]]
>>
эндобдж
36 0 объект
>
эндобдж
37 0 объект
>
поток
конечный поток
эндобдж
38 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
60 95.4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
39 0 объект
>
поток
конечный поток
эндобдж
40 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
159 95,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
41 0 объект
>
поток
конечный поток
эндобдж
42 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
177 95,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
43 0 объект
>
поток
конечный поток
эндобдж
44 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
42 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
45 0 объект
>
поток
конечный поток
эндобдж
46 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
60 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
47 0 объект
>
поток
конечный поток
эндобдж
48 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
159 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
49 0 объект
>
поток
конечный поток
эндобдж
50 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
177 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
51 0 объект
>
поток
конечный поток
эндобдж
52 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
29,25 74,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
53 0 объект
>
поток
конечный поток
эндобдж
54 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
42 74.`0D
% PDF-1.4
%
1 0 объект
>
эндобдж
2 0 obj
>
эндобдж
3 0 obj
>
эндобдж
4 0 объект
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
эндобдж
5 0 obj
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
эндобдж
6 0 obj
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
эндобдж
7 0 объект
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
эндобдж
8 0 объект
>
поток
конечный поток
эндобдж
9 0 объект
>
поток
конечный поток
эндобдж
10 0 obj
>
поток
конечный поток
эндобдж
11 0 объект
>
поток
конечный поток
эндобдж
12 0 объект
>
поток
конечный поток
эндобдж
13 0 объект
>
поток
конечный поток
эндобдж
14 0 объект
>
поток
конечный поток
эндобдж
15 0 объект
>
поток
конечный поток
эндобдж
16 0 объект
>
поток
конечный поток
эндобдж
17 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
1.1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS0 гс
0 0 мес.
0 0 л
S
Q
Q
конечный поток
эндобдж
18 0 объект
>
эндобдж
19 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS0 гс
20,25 57,75 м
591,75 57,75 л
S
Q
Q
конечный поток
эндобдж
20 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS0 гс
20,25 753 м
591,75 753 л
S
Q
Q
конечный поток
эндобдж
21 0 объект
>
поток
конечный поток
эндобдж
22 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
42 95,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
23 0 объект
>
эндобдж
24 0 объект
>
эндобдж
25 0 объект
>
поток
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода
endcodespacerange
57 начало
конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
эндобдж
26 0 объект
>
/ FontDescriptor 24 0 R
/ BaseFont / BTGZPK + TimesNewRoman
/ Вт [3 [250] 11 [333] 12 [333] 14 [563] 15 [250] 16 [333] 17 [250] 19 [500] 20 [500] 21 [500] 22 [500] 23 [500] ] 24 [500] 25 [500] 26 [500] 27 [500] 28 [500] 29 [277] 34 [443] 36 [722] 37 [666] 38 [666] 39 [722] 42 [722] 43 [722] 44 [333] 48 [889] 51 [556] 55 [610] 56 [722] 58 [943] 68 [443] 69 [500] 70 [443] 71 [500] 72 [443] 73 [333] ] 74 [500] 75 [500] 76 [277] 78 [500] 79 [277] 80 [777] 81 [500] 82 [500] 83 [500] 84 [500] 85 [333] 86 [389] 87 [277] 88 [500] 89 [500] 90 [722] 91 [500] 92 [500] 93 [443] 177 [500]]
>>
эндобдж
27 0 объект
>
эндобдж
28 0 объект
>
поток
конечный поток
эндобдж
29 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
60 95.4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
30 0 объект
>
поток
конечный поток
эндобдж
31 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
68,25 95,9854 тд тдж
ET
Q
Q
конечный поток
эндобдж
32 0 объект
>
поток
конечный поток
эндобдж
33 0 объект
>
поток
конечный поток
эндобдж
34 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
72,75 95,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
35 0 объект
>
поток
конечный поток
эндобдж
36 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
81.75 95,9854 тд тдж
ET
Q
Q
конечный поток
эндобдж
37 0 объект
>
поток
конечный поток
эндобдж
38 0 объект
>
поток
конечный поток
эндобдж
39 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
159 95,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
40 0 объект
>
поток
конечный поток
эндобдж
41 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
177 95,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
42 0 объект
>
поток
конечный поток
эндобдж
43 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
185.25 95,9854 тд тдж
ET
Q
Q
конечный поток
эндобдж
44 0 объект
>
поток
конечный поток
эндобдж
45 0 объект
>
поток
конечный поток
эндобдж
46 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
189,75 95,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
47 0 объект
>
поток
конечный поток
эндобдж
48 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
198,75 95,9854 тд тдж
ET
Q
Q
конечный поток
эндобдж
49 0 объект
>
поток
конечный поток
эндобдж
50 0 объект
>
поток
конечный поток
эндобдж
51 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
42 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
52 0 объект
>
поток
конечный поток
эндобдж
53 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
60 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
54 0 объект
>
поток
конечный поток
эндобдж
55 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
68,25 111,7354 тд тдж
ET
Q
Q
конечный поток
эндобдж
56 0 объект
>
поток
конечный поток
эндобдж
57 0 объект
>
поток
конечный поток
эндобдж
58 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
72,75 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
59 0 объект
>
поток
конечный поток
эндобдж
60 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
81,75 111,7354 Тд Тдж
ET
Q
Q
конечный поток
эндобдж
61 0 объект
>
поток
конечный поток
эндобдж
62 0 объект
>
поток
конечный поток
эндобдж
63 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
159 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
64 0 объект
>
поток
конечный поток
эндобдж
65 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
177 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
66 0 объект
>
поток
конечный поток
эндобдж
67 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
185,25 111,7354 тд тдж
ET
Q
Q
конечный поток
эндобдж
68 0 объект
>
поток
конечный поток
эндобдж
69 0 объект
>
поток
конечный поток
эндобдж
70 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
189.75 111.1934 Td Tj
ET
Q
Q
конечный поток
эндобдж
71 0 объект
>
поток
конечный поток
эндобдж
72 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
198.75 111,7354 тд тдж
ET
Q
Q
конечный поток
эндобдж
73 0 объект
>
поток
конечный поток
эндобдж
74 0 объект
>
поток
конечный поток
эндобдж
75 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
29,25 74,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
76 0 объект
>
поток
конечный поток
эндобдж
77 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
42 74,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
78 0 объект
>
поток
конечный поток
эндобдж
79 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
42 166.6934 Td Tj
ET
Q
Q
конечный поток
эндобдж
80 0 объект
>
поток
конечный поток
эндобдж
81 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
60 166.6934 тд тдж
ET
Q
Q
конечный поток
эндобдж
82 0 объект
>
поток
конечный поток
эндобдж
83 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
159 166.6934 тд тдж
ET
Q
Q
конечный поток
эндобдж
84 0 объект
>
поток
конечный поток
эндобдж
85 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
177 166.6934 тд тдж
ET
Q
Q
конечный поток
эндобдж
86 0 объект
>
поток
конечный поток
эндобдж
87 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
42 182.4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
88 0 объект
>
поток
конечный поток
эндобдж
89 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
60 182.4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
90 0 объект
>
поток
конечный поток
эндобдж
91 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
159 182.4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
92 0 объект
>
поток
конечный поток
эндобдж
93 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
177 182,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
94 0 объект
>
поток
конечный поток
эндобдж
95 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
29.25 131,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
96 0 объект
>
поток
конечный поток
эндобдж
97 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
42 131,4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
98 0 объект
>
поток
конечный поток
эндобдж
99 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
280,5 131,9854 Тд Тдж
ET
Q
Q
конечный поток
эндобдж
100 0 объект
>
поток
конечный поток
эндобдж
101 0 объект
>
поток
конечный поток
эндобдж
102 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
285 131.4434 тд тдж
ET
Q
Q
конечный поток
эндобдж
103 0 объект
>
поток
конечный поток
эндобдж
104 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
42 146,2354 тд тдж
ET
Q
Q
конечный поток
эндобдж
105 0 объект
>
поток
конечный поток
эндобдж
106 0 объект
>
поток
конечный поток
эндобдж
107 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
46,5 145,6934 тд тдж
ET
Q
Q
конечный поток
эндобдж
108 0 объект
>
поток
конечный поток
эндобдж
109 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
63.75 146,2354 тд тдж
ET
Q
Q
конечный поток
эндобдж
110 0 объект
>
поток
конечный поток
эндобдж
111 0 объект
>
поток
конечный поток
эндобдж
112 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
68,25 145,6934 тд тдж
ET
Q
Q
конечный поток
эндобдж
113 0 объект
>
поток
конечный поток
эндобдж
114 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -8,4 Тс
85,5 146,2354 Тд Тдж
ET
Q
Q
конечный поток
эндобдж
115 0 объект
>
поток
конечный поток
эндобдж
116 0 объект
>
поток
конечный поток
эндобдж
117 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
90 145.6934 Td Tj
ET
Q
Q
конечный поток
эндобдж
118 0 объект
>
поток
конечный поток
эндобдж
119 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS1 GS
/ F0 -12 Тс
42 237.9434 тд тдж
ET
Q
Q
конечный поток
эндобдж
120 0 объект
>
поток
q
1 0 0-1 0 792 см -100 Тлз
q
q 117 0 0-49,5 60 276,75 см / I0 Do Q
Q
Q
конечный поток
эндобдж
121 0 объект
>
поток
xю8DQOb] e9I] eRN: 13O’I $ I $ I $ I $ I $ I $ IjG7` | 901×0`CO [xX
_! », j / xƓV0q5oƗa
3.2: Алканы и изомеры алканов
Цели
После заполнения этого раздела вы сможете:
- изобразите структуру Кекуле, конденсированную структуру и сокращенную структуру каждого из первых десяти алканов с прямой цепью.
- называют каждый из первых десяти алканов с прямой цепью, учитывая его молекулярную формулу, структуру Кекуле, конденсированную структуру или сокращенную структуру.
- объясняют разницу в структуре между алканами с прямой и разветвленной цепью и иллюстрируют разницу на подходящем примере.
- объясняют, почему количество возможных изомеров для данной молекулярной формулы увеличивается с увеличением количества атомов углерода.
- изобразить все возможные изомеры, которые соответствуют данной молекулярной формуле типа C n H 2n + 2 , где n ≤ 7.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте следующие ключевые термины.
- Алкан с разветвленной цепью
- Конституционный или структурный изомер
- гомологическая серия
- изомер
- углеводород насыщенный
- Алкан с прямой цепью (или нормальный алкан)
Учебные заметки
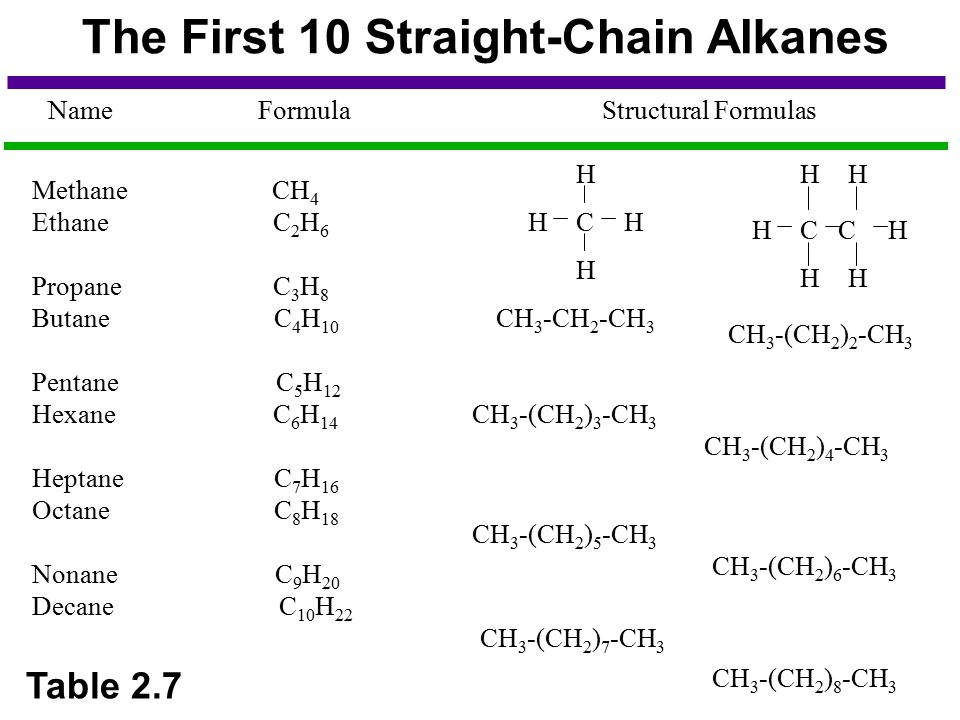
Серия соединений, в которой последовательные члены отличаются друг от друга единицей CH 2 , называется гомологической серией.Таким образом, серии CH 4 , C 2 H 6 , C 3 H 8 . . . C n H 2n + 2 , является примером гомологического ряда.
Важно сохранить в памяти названия первых 10 алканов с прямой цепью (т.е. от CH 4 до C 10 H 22 ). Вы будете использовать эти имена неоднократно, когда начнете учиться получать систематические названия большого количества разнообразных органических соединений. Вам не нужно запоминать возможное количество изомеров для алканов, содержащих более семи атомов углерода.При необходимости такая информация доступна в справочниках. Рисуя изомеры, будьте осторожны, чтобы не обмануть себя, думая, что вы можете нарисовать больше изомеров, чем предполагалось. Помните, что каждый изомер можно нарисовать несколькими разными способами, и вы можете случайно подсчитать один и тот же изомер более одного раза.
Алканы — это органические соединения, которые полностью состоят из одинарных атомов углерода и водорода и лишены каких-либо других функциональных групп. Алканы часто называют насыщенными углеводородами, потому что они имеют максимально возможное количество атомов водорода на один углерод.В разделе 1.7 было показано, что молекула алкана, этана, содержит сигма-связь C-C. При добавлении большего количества сигма-связи C-C могут быть образованы более крупные и сложные алканы. Метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются началом ряда соединений, в которых любые два члена в последовательности отличаются на один атом углерода и два атома водорода, а именно звено CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологическим рядом.Члены такой серии, называемые гомологами , обладают свойствами, которые изменяются регулярным и предсказуемым образом.
Рисунок 25.3.1: Три простейших алкана
Метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются началом ряда соединений, в которых любые два члена в последовательности различаются одним атомом углерода и двумя атомами водорода, а именно единицей CH 2 .Рассмотрим ряд на рис. 25.3.3. Последовательность начинается с C 3 H 8 , и на каждом шаге вверх по серии добавляется блок CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологическим рядом. Члены такой серии, называемые гомологами , обладают свойствами, которые изменяются регулярным и предсказуемым образом.
Рисунок 25.3.2: Члены гомологического ряда.Каждая последующая формула включает на один атом углерода и на два атома водорода больше, чем предыдущая формула.
Гомологический ряд позволяет записать общую формулу для алканов: C n H 2 n + 2 . Используя эту формулу, мы можем написать молекулярную формулу для любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Молекулярные формулы
Алканы — это простейшее семейство углеводородов — соединения, содержащие только углерод и водород. Алканы содержат только углерод-водородные связи и одинарные углерод-углеродные связи. Первые шесть алканов следующие:
Таблица \ (\ PageIndex {1} \): Молекулярные формулы для малых алканов
| метан | СН 4 |
| этан | С 2 В 6 |
| пропан | С 3 В 8 |
| бутан | С 4 В 10 |
| пентан | С 5 В 12 |
| гексан | С 6 В 14 |
Вы можете определить формулу любого из алканов, используя общую формулу C n H 2n + 2
Изомерия
Все алканы, содержащие 4 или более атомов углерода, демонстрируют структурную изомерию, что означает наличие двух или более различных структурных формул, которые вы можете нарисовать для каждой молекулярной формулы.Изомеры (от греческого isos + meros , что означает «состоящие из одних и тех же частей») — это молекулы, которые имеют одинаковую молекулярную формулу, но имеют другое расположение атомов в пространстве. Алканы с 1-3 атомами углерода, метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ,) не существуют в изомерных формах, потому что есть только один способ расположить атомы в каждой формуле так, чтобы каждый атом углерода имел четыре связи. Однако C 4 H 10 имеет более чем возможную структуру.Четыре атома углерода могут быть вытянуты в ряд для образования бутана или разветвления банки для образования изобутана. Эти два соединения имеют разные свойства — например, бутан кипит при -0,5 ° C, а изобутан — при -11,7 ° C.
бутан изобутан
Аналогично молекулярная формула: C 5 H 12 имеет три возможных изомера. Соединение в крайнем левом углу — пентан, потому что все пять атомов углерода в нем находятся в непрерывной цепи. Соединение в середине — изопентан; подобно изобутану, он имеет одно ответвление CH 3 от второго атома углерода непрерывной цепи.Соединение в правом углу, обнаруженное после двух других, было названо неопентаном (от греческого neos , что означает «новый»). Хотя все три имеют одинаковую молекулярную формулу, они имеют разные свойства, включая точки кипения: пентан, 36,1 ° C; изопентан, 27,7 ° С; и неопентан, 9,5 ° С.
пентан изопентан неопентан
Из структур, показанных выше, бутан и пентан называются нормальными алканами или алканами с прямой цепью , что указывает на то, что все они содержат одну непрерывную цепочку атомов углерода и могут быть представлены формулой проекции, в которой атомы углерода находятся в прямой цепи. линия.Другие структуры, изобутан, изопентан и неопентан, называются алканами с разветвленной цепью. По мере увеличения количества атомов углерода в акане количество возможных изомеров также увеличивается, как показано в таблице ниже.
Таблица \ (\ PageIndex {2} \): Количество изомеров углеводородов
| Молекулярная формула | Количество структурных изомеров |
|---|---|
| Канал 4 | 1 |
| C 2 H 6 | 1 |
| C 3 H 8 | 1 |
| C 4 H 10 | 2 |
| C 5 H 12 | 3 |
| C 6 H 14 | 5 |
| C 7 H 16 | 9 |
| C 8 H 18 | 18 |
| C 9 H 20 | 35 |
| C 10 H 22 | 75 |
| C 14 H 30 | 1858 |
| C 18 H 38 | 60 523 |
| C 30 H 62 | 4,111,846,763 |
Аканес можно представить по-разному.На рисунке ниже показаны некоторые из различных способов представления бутана с прямой цепью. Чаще всего химики называют бутан конденсированной структурой CH 3 CH 2 CH 2 CH 3 или n -C 4 H 10 , где n означает нормальный прямой алкан.
Обратите внимание, что многие из этих структур подразумевают только склеивающие соединения и не указывают какую-либо конкретную геометрию. Две нижние структуры, называемые «мячом и клюшкой» и «заполнением пространства», действительно показывают трехмерную геометрию бутана.Поскольку четырехуглеродная цепь в бутане может изгибаться по-разному, группы могут свободно вращаться вокруг связей C – C. Однако это вращение не меняет идентичности соединения. Важно понимать, что изгиб цепи , а не не изменяет идентичность соединения; все следующие элементы представляют собой одно и то же соединение, бутан:
Номенклатура прямых алканов основана на количестве содержащихся в них атомов углерода. Количество атомов углерода обозначается префиксом, а суффикс -ан добавляется, чтобы указать, что молекулы являются алканами.Префикс для трех атомов углерода — prop, поэтому при добавлении -ane имя IUPAC для C 3 H 8 — пропан. Точно так же префикс для шести — шестнадцатеричный, поэтому название изомера с прямой цепью C 6 H 14 называется гексаном. Первые десять приставок следует запомнить, потому что эти названия алканов положены в основу наименования многих других органических соединений.
9.2.1
Молекулярная формула | Префикс | Краткая структурная формула | Имя |
|---|---|---|---|
| Канал 4 | Мет | СН 4 | метан |
| C 2 H 6 | Eth | Канал 3 Канал 3 | этан |
| C 3 H 8 | Опора | Канал 3 Канал 2 Канал 3 | пропан |
| C 4 H 10 | Но | Канал 3 Канал 2 Канал 2 Канал 3 | бутан |
| C 5 H 12 | Пент | Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 | пентан |
| C 6 H 14 | шестигранник | Канал 3 (Канал 2 ) 4 Канал 3 | гексан |
| C 7 H 16 | Hept | Канал 3 (Канал 2 ) 5 Канал 3 | гептан |
| C 8 H 18 | октябрь | Канал 3 (Канал 2 ) 6 Канал 3 | |
| C 9 H 20 | Не | Канал 3 (Канал 2 ) 7 Канал 3 | нонан |
| C 10 H 22 | декабрь | Канал 3 (Канал 2 ) 8 Канал 3 | декан |
Пример \ (\ PageIndex {1} \): изомеры цепи в пентане
Пентан, C 5 H 12 , имеет три цепных изомера.Если вы думаете, что можете найти какие-то другие, это просто искаженные версии приведенных ниже. Если сомневаетесь, сделайте несколько моделей.
Упражнения
1) Укажите все изомеры для C 6 H 14 O, которые содержат гексан с прямой цепью и группу ОН.
2) Изобразите все возможные изомеры следующих соединений.
a) C 6 H 14 (Всего пять)
б) C 3 H 6
c) C 3 H 8 O
d) C 4 H 8 O 2 , который содержит карбоновую кислоту.
e) C 3 H 9 N
Решения
1)
2)
в)
г)
д)
Упражнения
Вопросы
Q3.2.1
Укажите все изомеры гексанола с прямой цепью.
Решения
S3.2.1
Авторы и авторство
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Пределы детонации в смесях кислорода и гомологичных углеводородов по JSTOR
Abstract
Параметры детонации определены для смесей топливо + кислород для давления и температуры окружающей среды в 1 дюйм (2.Трубка диаметром 54 см) с инициирующим ударом от детонирующей стехиометрической смеси водорода и кислорода. Пределы детонации в молярных процентах топлива составляют: метан 8,25 и 55,80 н-пропан 2,50 и 42,50 н-бутан 2,05 и 37,95 неопентан 1,50 и 33,00 пропилен 2,50 и 50,00 Эти данные сопоставлены с сопоставимыми результатами для систем кислород + этан и кислород + этилен, полученный в других исследованиях, с целью установления поведения в гомологическом ряду соединений. Для всех составов распространение детонации полезно соотнести с произведением Маха γ M2.Когда данные преобразуются на основе гомологии, обнаруживаются далеко идущие корреляции для различных молекул углеводородов. Это говорит о том, что структура молекул топлива имеет только второстепенное влияние. При предельных значениях обеднения топлива предельное поведение можно интерпретировать с точки зрения повышения критической температуры, которое может быть связано с критической скоростью начального механизма крекинга. Вблизи пределов богатого топлива более вероятным кажется, что стабильность зависит от конденсации (углеродсодержащих) твердых веществ из смеси продуктов крекинга.
Информация об издателе
Королевское общество — это самоуправляемое товарищество многих самых выдающихся ученых мира, представляющих все области науки, техники и медицины, и старейшая научная академия, которая постоянно существует. Основная цель Общества, отраженная в его учредительных документах 1660-х годов, заключается в признании, продвижении и поддержке передового опыта в науке, а также в поощрении развития и использования науки на благо человечества.Общество сыграло роль в некоторых из самых фундаментальных, значительных и изменяющих жизнь открытий в истории науки, и ученые Королевского общества продолжают вносить выдающийся вклад в науку во многих областях исследований.
Что такое гомологичная серия? (с изображением)
Гомологическая серия относится к органическим молекулам или соединениям, имеющим сходную молекулярную формулу, что обуславливает сходные химические свойства соединений.По мере увеличения молекулярного размера соединения в пределах гомологического ряда физические свойства также постепенно изменяются. Основное различие между соединениями такого ряда — добавление лишнего углерода и дигидрогруппы Ch3.
У многих различных типов соединений есть гомологические ряды.Наиболее распространенный ряд включает алканы, простые эфиры и спирты; другие гомологические серии включают алкены или олефины, алкины и карбоновые кислоты. Алканы — это соединения, которые содержат только углерод и водород, связанные одинарными связями. Простые эфиры представляют собой соединения, которые имеют функциональную группу простого эфира, состоящую из кислорода, связанного либо с двумя алканами, либо с двумя арильными соединениями, обозначенными как R-O-R ‘. R и R ‘относятся к разным алканам или арильным соединениям.
Спирты содержат функциональную группу, состоящую из кислорода, связанного с водородом (-ОН), а алкены имеют функциональную группу из углерода, связанного двойной связью с другим углеродом (C = C).Алкины похожи на алкены, хотя функциональная группа состоит из молекулы углерода с тройной связью с другой молекулой углерода. Карбоновые кислоты — это кислоты, которые содержат по крайней мере одну карбоксильную группу (-COOH).
Составы в серии будут различаться единицей Ch3 и определенной молекулярной массой.Алкановый ряд начинается с метана с молекулярной формулой Ch5 и массой 16,04. Следующее соединение — этан с формулой C2H6 и массой 30,07. Далее следуют бутан, формула C4h20 и масса 58,12, и пентан, формула C5h22 и масса 72,15. Как видно, этан содержит на один углерод и на два водорода больше, чем метан, и имеет массу на 14 больше, чем метан. То же самое происходит между этаном и бутаном, бутаном и пентаном.
Физические свойства этих соединений также постепенно изменяются по мере увеличения размеров молекул.Обычно по мере увеличения длины углеродной цепи способность соединения растворяться в воде уменьшается, хотя это также зависит от химической природы функциональной группы, поскольку некоторые функциональные группы более растворимы в воде, чем другие. По мере того как углеродные цепи в гомологическом ряду становятся длиннее, температура кипения соединения изменяется. Хотя во многих случаях она увеличивается, но если углеродная цепь начинает разветвляться, температура кипения начинает снижаться. Это лишь одно из исключений, обнаруженных в физических изменениях.
Изомеры C6h24
Построение изомеров C 4 H 8: Существует три возможных изомера с формулой C 4 H 8.т.е. 1-бутен, 2-бутен и изобутилен. Их можно построить, как показано ниже. И 1-бутен, и 2-бутен имеют линейное расположение атомов углерода. Но они различаются положением двойной связи. Следовательно, они называются позиционными изомерами.
16 января 2012 г. · Геометрические изомеры против структурных изомеров. Изомеры — это разные соединения с одинаковой молекулярной формулой. Существуют различные типы изомеров. Изомеры в основном можно разделить на две группы: конституционные изомеры и стереоизомеры.Конституционные изомеры — это изомеры, в молекулах которых связь атомов различается.
Химия Органическая химия Назовите пять изомеров C 6 H 14. Назовем все возможные изомеры C6h24. Введение в концепцию
01 мая 2002 г. · Объемные свойства смеси Гексан C6h24 + C6h24O 2-метилпентан-1-ол (LB2730, VMSD1112). … Избыточные мольные объемы н-гексана с некоторыми изомерами гексанола при …
Сколько спиртов являются структурными изомерами с формулой: C 5 H 11 OH? (а) 5 (б) 6 (в) 7 (г) 8 (д) 9 12.Какая связь между показанными структурами? (a) структурные изомеры (b) геометрические изомеры (c) конформационные структуры (d) идентичные структуры (e) оптические изомеры 13. Какое из следующих утверждений относительно конформаций является …
Химия Органическая химия Назовите пять изомеров C 6 H 14. Назовем все возможные изомеры C6h24. Введение в концепцию
изомеров гексана с разветвленной цепью и назвать первый изомер. Изомер 1 Изомер 2. Название изомера 1….

 Полимеры — методическая рекомендация. Химия, 8–9 класс.
Полимеры — методическая рекомендация. Химия, 8–9 класс.