Содержание
Чистые вещества и смеси | Дистанционные уроки
19-Мар-2014 | Нет комментариев | Лолита Окольнова
Начнем с определений
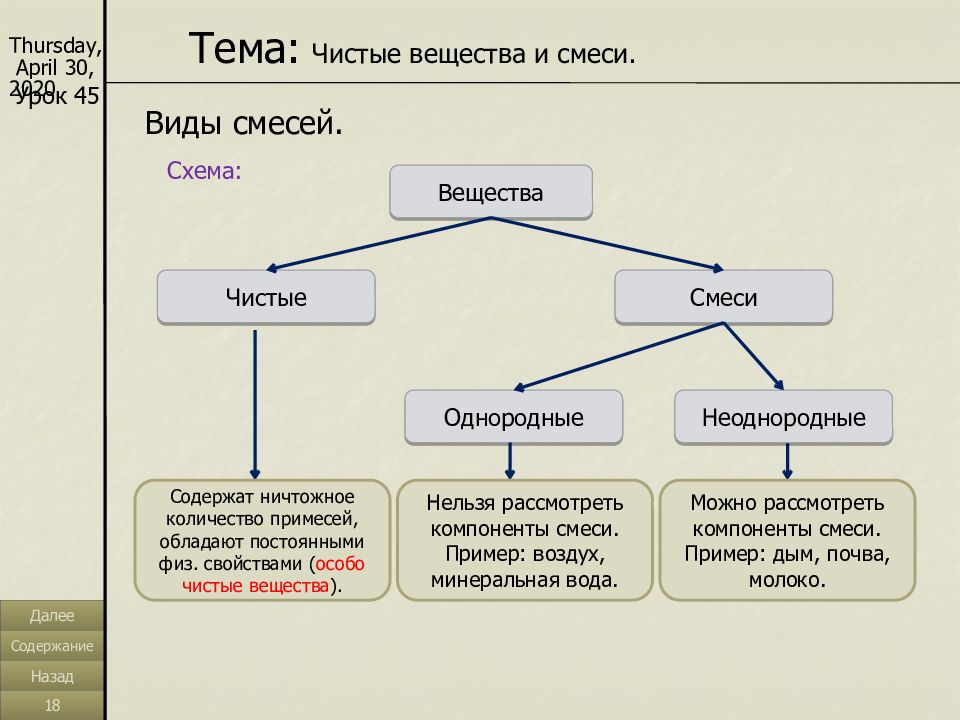
Чистое вещество состоит из молекул одного вида.
Чистые вещества могут быть элементного состава (т.е. состоять из элементов одного вида) — простые вещества:
- твердые вещества: железо, сера
- газы: H2, O2, N2 и т.д.
Чистые вещества — соединения — сложные вещества — состоят из молекул одного вида.
В природе не существует абсолютно чистых веществ. Например, особо чистый алюминий содержит 0,001% примесей.
Даже когда мы считаем воду чистой, то должны понимать, что там есть примеси. Даже дистиллированная вода не может считаться абсолютно чистым веществом — это тоже смесь, только примесей в ней намного меньше, чем в обычной воде.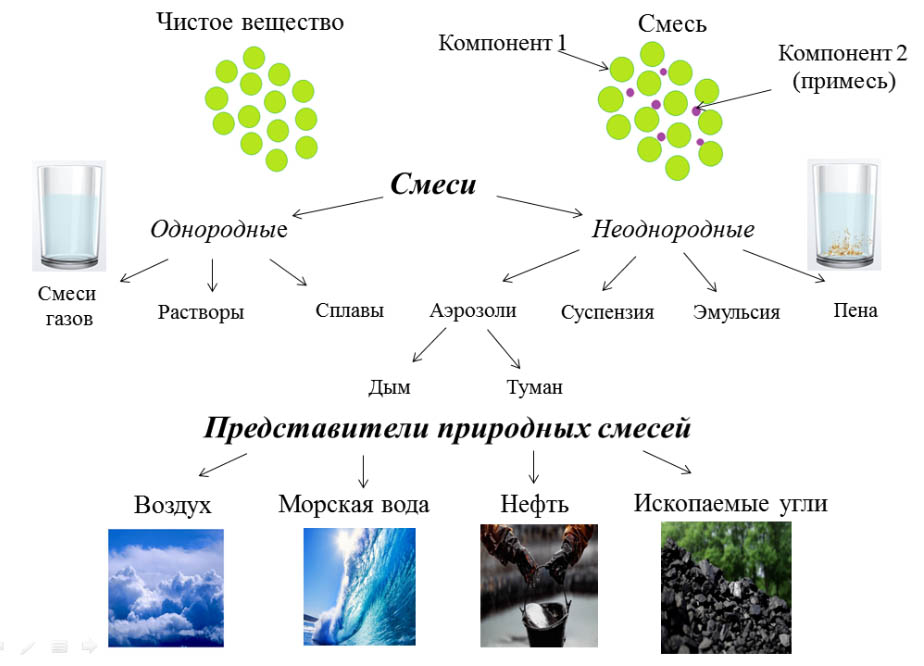
Фильтрованная вода — тоже не чистое вещество, а смесь растворимых компонентов и воды, водопроводная — тем более!
Смеси — содержит молекулы нескольких видов.
Вещества, составляющие смесь, могут быть простыми и сложными.
Запомните: если вам дана задачи и в условии этой задачи дана смесь веществ, то вещества из этой смеси не реагируют друг с другом!
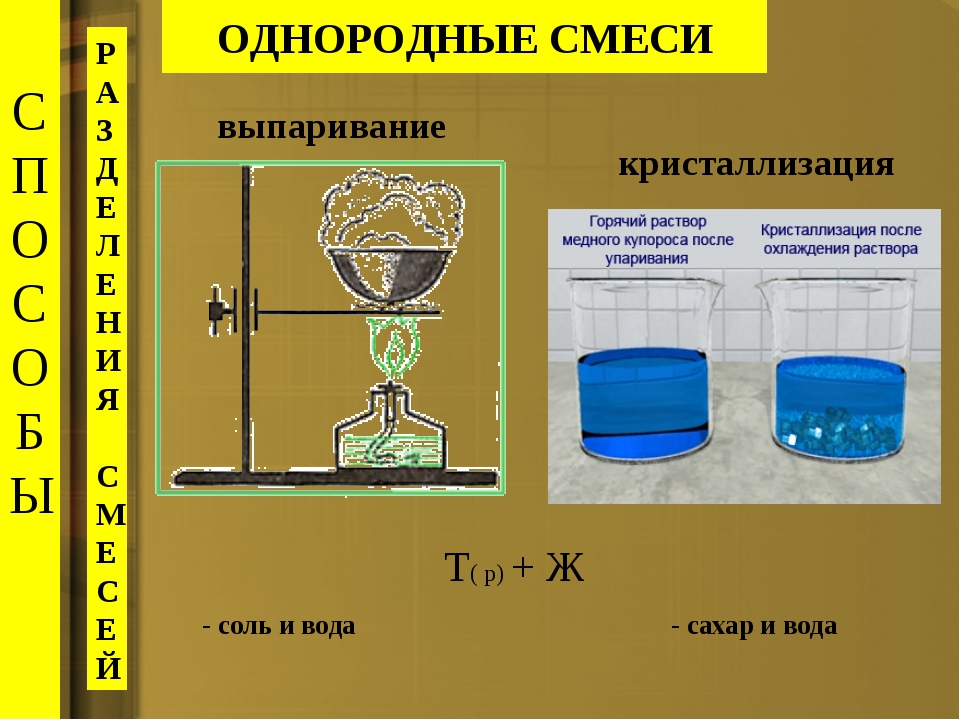
Однородные смеси (гомогенные)
«Гомо» — означает «одинаковый». Т.е. вещества в гомогенной смеси находятся в одинаковых агрегатных состояниях ( в одинаковых фазах):
- растворы;
- сплавы;
- газовые смеси
Воздух — пример однородной газовой смеси (если учитывать именно газовый состав, частички пыли и т.п. мы здесь не учитываем), молярная масса воздуха принята равной 29 г\моль.
мы здесь не учитываем), молярная масса воздуха принята равной 29 г\моль.
Все растворы — однородные смеси растворимого вещества и растворителя.
Неоднородные смеси (гетерогенные)
Неоднородная смесь — это смесь, где вещества находятся в разных фазах.
- Суспензия: тв. фаза+ жидка фаза; существует только в «смешанном» виде. Если такую смесь оставить на время. то под действием силы тяжести твердые частички осядут. Примеры: зубная паста, гуашь, эмалевые краски и т.д.
- Эмульсия — смесь двух жидкостей разной плотности. Со временем четко разделяются на две фазы. Примеры: жидкость для снятия макияжа, масло в воде, молоко и т.д.
- Аэрозоль — смесь газа и жидкости. Самый известный пример — туман или лак для волос.
С определениями чистых веществ и смесей мы определились, теперь давайте разберем способы разделения смесей.
- Химический способ разделения смеси: в реакцию вводится вещество, реагирующее с одним компонентом и не взаимодействующее с другим. В идеале образующееся новое вещество может образовывать другую фазу, чтобы его можно было легко удалить (осадок или газ).
Физические способы:
Еще одно важное отличие чистых веществ от смесей — температуры плавления и кипения:
Чистые вещества | Смеси |
имеют четкие температуры плавления и кипения | плавятся и кипят в интервале температур |
- в ЕГЭ это вопрос А26
- в ГИА (ОГЭ) — А13
Еще на эту тему:
Обсуждение: «Чистые вещества и смеси»
(Правила комментирования)
Презентация на тему состав вещества смеси.
 Презентация по химии на тему «Чистые вещества и смеси. Растворы». Разделить можно с помощью физических методов
Презентация по химии на тему «Чистые вещества и смеси. Растворы». Разделить можно с помощью физических методов
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Чистые вещества и смеси. Физические явления в химии.
Чистыми называют вещества, которые обладают постоянными физическими свойствами.
Смесь – это комбинация различных веществ, которые могут быть разделены, потому что обладают разными физи — ческими свойствами(например разной температурой кипения). Вещества в смеси не связаны химическими связями, поэтому их можно отделить друг от друга.
Смеси Однородные (гомогенные) Неоднородные (гетерогенные) Растворы поваренной соли (хлорида натрия) и сахара в воде, воздух Смесь поваренной соли с песком, глины с водой, железные опилки с глиной
Проблема: Как получить чистые вещества?
В основу получения чистых веществ были положены физические процессы, которые происходят без изменения состава вещества, но с изменением агрегатных состояний веществ.
Неоднородные смеси Отстаивание Фильтрование Действие магнитом Отстаивание частиц глины в воде. Применяется для очистки питьевой воды Применяется при очистке питьевой воды Отделение железа от других веществ
Однородные смеси Выпаривание Кристаллизация Дистилляция (перегонка) Хроматография Выделение пова – ренной соли из морской воды Производство сахара Получение дистил- лированной воды Разделение и очист- ка лекарственных веществ
Как очистить воду в походе?
Даны смеси: — железные и медные опилки; — древесные опилки и глина; — речной песок и сахар. Предложите способы их разделения.
По теме: методические разработки, презентации и конспекты
Конспект урока «Чистые вещества и смеси. Способы разделения смесей»
Цели урока:1. Образовательная: Дать понятие о чистом веществе и смеси веществ, сходство и различие между ними. Раскрыть значение смесей в природе и жизни человека.2. Развивающая: Ф…
Цели урока:
Выяснить:
- Какое вещество считают чистым?
- Что такое смесь?
- Какие бывают смеси?
- Какими способами можно разделить смесь?
Определение понятия «смесь»
было дано в XVII в. английским ученым Робертом Бойлем:
английским ученым Робертом Бойлем:
«Смесь – целостная система, состоящая из разнородных компонентов».
Сравнительная характеристика
чистого вещества и смеси
Признаки сравнения
Чистое вещество
Состав
Смесь
Постоянный
Вещества
Одно и то же
Непостоянный
Физические свойства
Изменение энергии при образовании
Различные
Постоянные
Происходит
Непостоянные
Разделение
Не происходит
С помощью химических реакций
Физическими методами
- Чистыми называют
вещества, которые обладают постоянным составом и постоянными физическими свойствами.
Смесь
– это комбинация различных веществ.
- Молоко
- Сплавы металлов
- Растворы
- Туман
- Бетон
- и другие
отличительная особенность смесей
В смесях каждое из составляющих их веществ сохраняет свои индивидуальные свойства.
это смеси, в которых невооруженным глазом видны частицы веществ.
это смеси, в которых нельзя заметить частицы веществ.
Однородные
Неоднородные
суспензии
жидкие
эмульсии
Газообразные
твердые
Проверь свои знания
Из предложенных веществ назовите чистые:
- Вода в реке
- Вода в облаке
- Сахар
- Бензин
- Поваренная соль
Проверь свои знания
1. Смесью является:
A. Дистиллированная вода
C. Алюминий
2. Смесью не является:
- Дистиллированная вода
- Почва
Проверь свои знания
3.Укажите неоднородные смеси
А)сахарный песок + вода
Б)сера + железные опилки
В)поваренная соль + вода
Проверь свои знания
4.Укажите однородные смеси
Б)речной песок + вода
В)нефть + вода
Проверь свои знания
5. В каком случае речь идет о воде, как о чистом веществе?
В каком случае речь идет о воде, как о чистом веществе?
А)морская вода соленая на вкус
Б)дистиллированная вода получается при охлаждении водяного пара
В)минеральная вода применяется для лечения некоторых заболеваний
Проверь свои знания
6. Отметьте смесь, основным компонентом в которой является газ
А)кислород
Б)углекислый газ
Объясните с химической точки зрения:
«Между тем Рукодельница воротится, воду процедит, в кувшины нальет; да ещё какая затейница: коли вода нечиста, так свернет лист бумаги, наложит в него угольков да песку крупного насыплет, вставит ту бумагу в кувшин да нальет в неё воды, а вода-то знай проходит сквозь песок да сквозь уголья и каплет в кувшин чистая, словно хрустальная…»
(Одоевский В.Ф. «Мороз Иванович»)
Домашнее задание:
§ 24, упр. 4,5,6,7
Творческое задание.
1. Составьте задания на разделение смеси.
2. Вам выдали смесь, состоящую из соли и мела.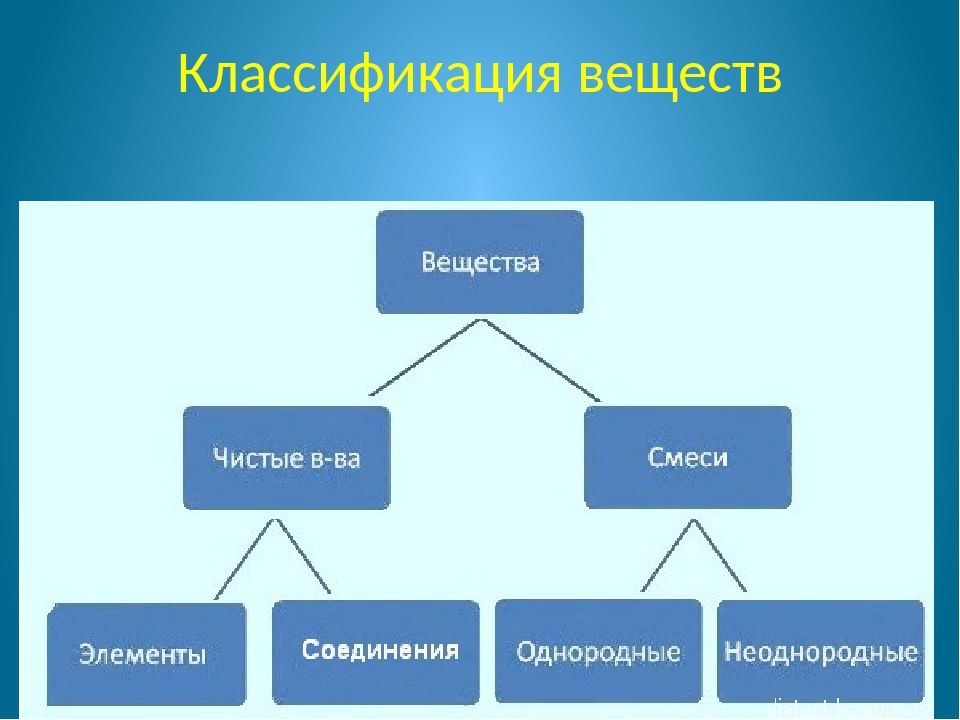 Предложите способы разделения этой смеси.
Предложите способы разделения этой смеси.
- Презентация в MS Power Point (приложение)
- Компьютер, проектор
Реактивы
- Смесь порошков железа и серы, раствор поваренной соли, смесь песка и воды, раствор метилового оранжевого; фильтры, выпаривательная чашка, лабораторный штатив с кольцом, спиртовка, воронка, стеклянная палочка, химические стаканы, колбы, магнит, пипетка.
Демонстрационный эксперимент:
- Разделение смеси фильтрованием;
- Разделение смеси магнитом;
- Разделение смеси веществ выпариванием.
Карточки с заданием для групповой работы.
Разделение смеси (раствора) растворимого вещества и растворителя:
Раствор поваренной соли, лабораторный штатив с кольцом, фарфоровая чашка (выпаривательная), спиртовка, тигельные щипцы, стеклянная палочка.
Разделение смеси нерастворимого в воде вещества и растворителя (растворимого вещества):
Лабораторный штатив с кольцом, воронка, фильтровальная бумага, стеклянная палочка, колба или стакан химический.
Разделение смеси железа и серы:
Железные опилки, порошок серы, магнит, 2 фильтра.
Фильтр, раствор метилоранжа, пипетка.
Ход урока
I.
Организационный момент. Проверка домашнего задания.
- Какие соединения называются оксидами? (Оксиды — это сложные соединения, состоящие из двух элементов, один из которых кислород со степенью окисления (-2))
- Какие соединения называются кислотами? (Кислоты — это сложные вещества, состоящие из атомов водорода и кислотного остатка)
- Какие соединения называются основаниями? (Основание — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп OH-)
- Какие соединения называются солями? (Соли — это сложные вещества, состоящие из атомов металла и кислотных остатков)
2.Проверочная работа (5-7 минут) на листках. На слайдах 1-2
— вопросы проверочной работы.
3.Проверочная работа сдается учителю (результаты объявляются на следующем уроке).
II.
Подготовка к восприятию нового материала. Объявление темы.
1. Беседа
1. Нам хорошо знакомо, что такое чистота. Чистая тетрадь, чистые руки, чистый лист … А какое вещество считается чистым? Есть ли в природе чистые вещества? Чем отличается чистое вещество от смеси веществ?
2. Как вы думаете, что будет темой нашего урок сегодня? (слайд 3)
2. Запись даты и темы урока учащимися в тетради.
Как вы думаете, что мы должны сегодня выяснить на уроке?
Цели
урока обсуждаются с учащимися.
Учащиеся предлагают: выяснить, какое вещество считается чистым и что такое смесь; узнать, где применяются чистые вещества и смеси; узнать, как разделить вещества.
В результате обсуждения — слайд 4.
3. Объяснение нового материала.
На данном этапе урока учитель формирует понятие о чистом вещества и смеси. Учащимся известно понятие «вещество» (это то, из чего состоят физические тела).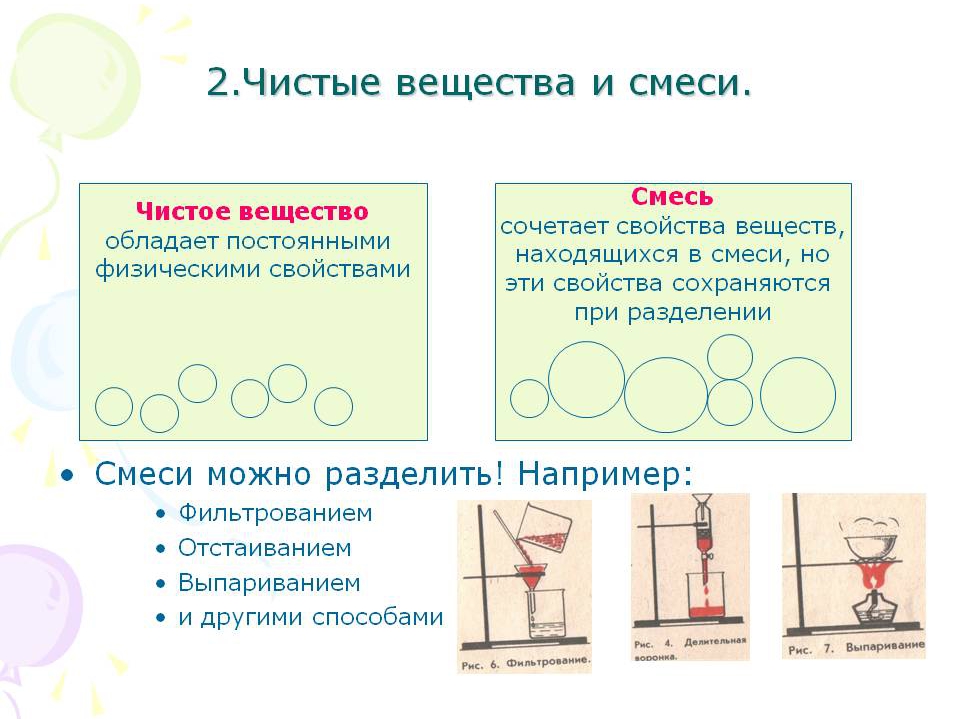 Поэтому, вначале даем определение «смеси веществ».
Поэтому, вначале даем определение «смеси веществ».
Учитель предлагает ученикам рассмотреть смеси, находящиеся на демонстрационном столе и примеры смесей, представленные на слайде 5.
Далее ребята дают определение смеси
, как системы из
их нескольких веществ, находящихся в непосредственном контакте друг с другом
. Эта формулировка появляется на слайде после щелчка мыши.
Учитель дополняет, что в природе нет абсолютно чистых веществ. Вещества встречаются преимущественно в виде смесей. Учитель приводит примеры смесей, ребята записывают их в тетради: воздух, морская вода, молоко, сплавы металлов, растворы, туман и др. Он рассказывает о воздухе, как смеси, которая состоит из газов — азота, кислорода, аргона и др. (слайд 6).
Посмотрите внимательно на смеси, находящиеся на столе. В чем разница между ними?
Однородные
Неоднородные
Раствор сахара в воде, растворы солей, воздух
Смесь Fe +S, песок и сахар, глина с водой, песок с водой
Неоднородными
называются смеси, в которых невооруженным глазом или при помощи микроскопа видны частицы веществ, составляющих смесь.
Однородными
называют смеси, в которых нельзя заметить частицы веществ, входящих в смесь (даже при помощи микроскопа).
Для научных исследований и промышленности, в основном требуются чистые вещества. Некоторые примеси даже в небольших количествах способны сильно поменять свойства веществ. Например, в полупроводниковой технике применяют сверхчистые вещества, где примеси составляют всего 1 атом на миллион атомов основного элемента (Si, Ge). Превышение нормы ведет к резкому ухудшению полупроводниковых свойств этих веществ. В тоже время, необходимо выделить, что невозможно получить абсолютно чистое вещество, т.к. любое чистое вещество содержит, хотя ничтожное малое количество примесей.
Как вы думаете, морская вода и чистая дистиллированная вода будут обладать одинаковыми свойствами? (ребята предполагают, что нет). Слайд 8
. Учитель объясняет условия эксперимента: в 2-х сосудах нагревали до кипения дистиллированную и морскую воду. Через определенное время измеряли температуры кипения в этих сосудах с помощью датчиков «Архимед». Вместе обсуждаем результаты эксперимента. Встает проблема: «Почему у морской воды t кип не постоянная в разные промежутки времени по сравнению с t кип дистиллированной водой?»
Вместе обсуждаем результаты эксперимента. Встает проблема: «Почему у морской воды t кип не постоянная в разные промежутки времени по сравнению с t кип дистиллированной водой?»
Учащиеся высказывают предположение, что соленость морской воды влияет на tкип.
С помощью учителя формулируется определение «Чистым веществом называется такое вещество, у которого постоянные физические свойства (температуры кипения, температуры плавления, плотность).
В тетрадях ребята записывают определение «чистое вещество»
Чистым
называется вещество, которое обладает постоянными физическими свойствами.
Учитель дополняет, что в чистом веществе примеси, хотя и есть в незначительных количествах, но они не влияют на физические и химические свойства. Пример чистого вещества — дистиллированная вода.
Демонстрируется слайд 9
.
Ребята записывают в тетрадях выводы.
Педагог обращает внимание детей на отличительную особенность смесей «В смесях каждое из составляющих их веществ сохраняет свои индивидуальные свойства.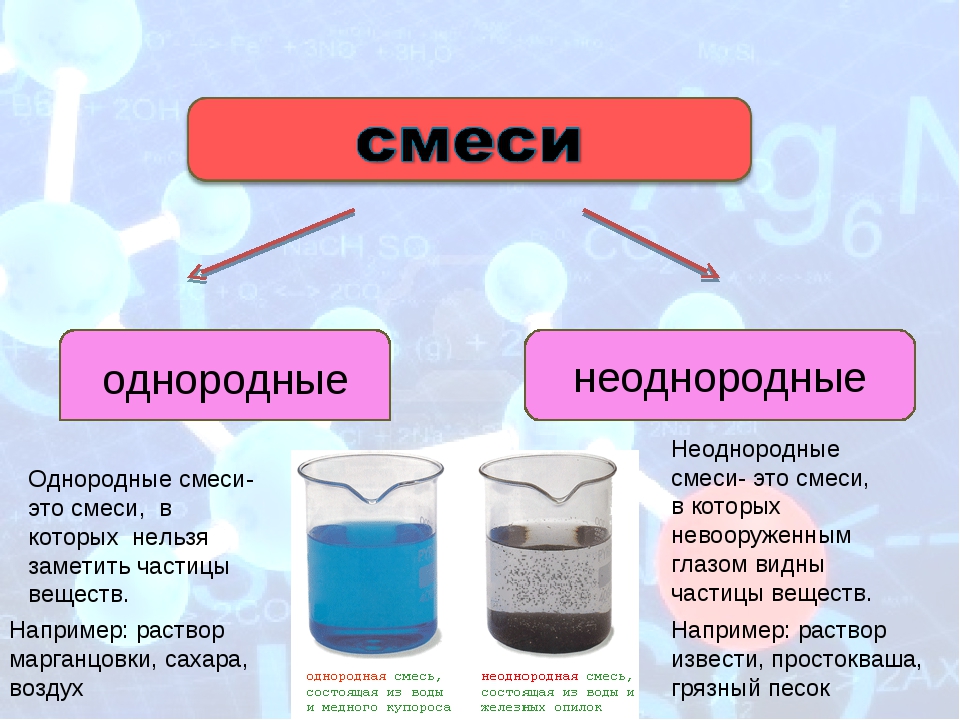 Для подтверждения этого учитель проводит опыты:
Для подтверждения этого учитель проводит опыты:
- Демонстрация разделение смеси железа и сера с помощью магнита (отработать с ребенком заранее методику выполнения опыта и тогда демонстрацию проводит ученик)
Следующий этап урока
— знакомство с основными способами разделения смесей, которые представлены в виде схемы: Слайд 10
.
Одновременно уточняется, на каких физических свойствах веществ основан каждый способ разделения. На слайдах 11- 13
показаны области применения разных способов очистки неоднородных смесей.
Демонстрация разделения смеси песка и воды фильтрованием. Обращается внимание на правильность выполнения эксперимента (Слайд 11).
Знакомство со способами разделения однородных смесей продолжается с помощью слайда 14
, акцентируется внимание учащихся на физических свойствах веществ, применяемых в данном способе разделения.
На слайдах 14-18
показаны области применения разных способов очистки однородных смесей.
4. Закрепление
1. Групповая работа.
Каждая группа получила задание « Как разделить смесь?»
Нужно было описать свои действия. Через 1 минуту каждая группа озвучила свой ответ. В заданиях были использованы жизненные ситуации, где требовалось очистить воду в походных условиях и т.п.
2. Ответить на вопросы, представленные на слайдах 19 — 21
5. Рефлексия
.
Что нового вы узнали сегодня на уроке?
Что запомнилось?
Что понравилось, а что не удалось, на ваш взгляд?
6.
Подведение итогов
7.
Домашнее задание:
§ 23 упр. 1,2,4
Творческое задание.
1. Составьте задания на разделение смеси.
2. Вам выдали смесь, состоящую из соли и мела.
Предложите способы разделения этой смеси.
Просмотр содержимого документа
«презентация к уроку «Чистые вещества и смеси» »
ВЫПИШИТЕ ОТДЕЛЬНО ФОРМУЛЫ ОКСИДОВ, КИСЛОТ, ОСНОВАНИЙ И СОЛЕЙ:
KCl, MnO 2 , H 2 SO 4 , KOH,
- KCl, MnO 2 , H 2 SO 4 , KOH,
CO 2 , NaNO 3 , H 2 CO 3 , Al(OH) 3 .
Назовите соединения
Составьте формулы химических соединений:
Оксид натрия
Соляная кислота
- Оксид натрия Соляная кислота
Фосфат кальция
Гидроксид бария
Чистые вещества и смеси. Способы разделения смесей
Тема урока: Чистые вещества и смеси
Цели урока:
- Выяснить, какое вещество считают чистым.
- Что такое смесь? Какие бывают смеси?
- Выяснить различия между смесью и химическим соединением.
- Какими способами можно разделить смеси?
- Где применяются чистые вещества и смеси?
Смесь – это система из нескольких веществ.
- Воздух
- Молоко
- Сплавы металлов
- Растворы
- Туман
- Бетон
Однородные
Неоднородные
суспензии
жидкие
эмульсии
Газообразные
твердые
- Чистое вещество имеет постоянный состав.

- Чистое вещество обладает постоянными физическими свойствами (плотность, твердость, электропроводность, t кип, t плав)
Способы разделения смесей
Неоднородные смеси
Отстаивание
Способы разделения смесей
Однородные
смеси
Выпаривание
Дистилляция (или перегонка)
- Водопроводная вода
- Углекислый газ
- Морская вода
- Молоко
- Кислород
2. Смесью является:
A. Дистиллированная вода
D. Алюминий
- Воздух
- Вода в реке
- Вода в облаке
- Сахар
- Бензин
- Поваренная соль
Домашнее задание:
§ 23, упр. 1,2,4
Творческое задание.
1. Составьте задачи на разделение смеси различных веществ.
2. Вам выдали смесь, состоящую из железных опилок, соли и мела. Составьте план разделения этой смеси.
Свойства и превращения веществ.
 Чистые вещества и смеси
Чистые вещества и смеси
В статье приводятся различия между физическим телом и веществом, дается понятие о чистых веществах и смесях, о свойствах веществ, о физических и химических явлениях. Приведены признаки и условия химических реакций, — их роль в жизни человека и в природе.
Вещество и его характеристики
Окружающий мир разнообразен, однако с научной точки зрения его богатство может быть выражено двумя понятиями: нас окружают тела и вещества. Необходимо различать их. Поскольку химия работает с веществом, нужно внимательно рассмотреть, какими основными признаками оно характеризуется, в каких явлениях участвует и каковы особенности этих явлений, называемых химическими.
Тело и вещество
Можно дать следующие определения этим основополагающим понятиям:
- Физическим телом называют материальный объект.
- Вещество представляет собой вид материи, то, из чего состоит любое физическое тело.
Тело имеет форму, отделено от окружающей среды границей и занимает в пространстве некоторый объем. Все тела состоят из веществ.
Все тела состоят из веществ.
Вещество обладает важнейшей характеристикой – массой. От того, какое количество вещества заключено в теле, и от вида этого вещества зависит масса тела.
Стакан, растение, планета – это примеры тел. Вещество стакана – стекло. Растение состоит из множества веществ: углеводов, белков, воды и так далее. А число веществ, из которых состоит планета, например, Земля, исчисляется миллионами.
Из одного вещества могут быть образованы разные тела. Из меди можно изготовить как проволоку, так и монету, из пластика – посуду, мебель, трубы и другие предметы.
Если разделить физическое тело, образуются новые тела. Вещество при делении не изменяется, но имеет предел делимости – молекулу, мельчайшую структурную единицу.
Вещество в различных состояниях
В зависимости от условий, таких как температура и давление, составляющие вещество молекулы, располагаются и движутся по-разному. Вследствие этого вещество принимает различные агрегатные состояния – становится газообразным, жидким или твердым. Переход из одного состояния в другое осуществляется при определенном сочетании условий.
Переход из одного состояния в другое осуществляется при определенном сочетании условий.
Например, при нормальном атмосферном давлении жидкая вода кипит и превращается в пар при 100 °C, а кристаллизуется в лед – при 0 °C. Обратные переходы – конденсация и плавление – происходят при той же комбинации условий.
Вещество, в любом агрегатном состоянии, образует тела. Так, пример жидкого тела – вода в сосуде. Такое тело принимает форму емкости, но при ее изменении сохраняет объем. Газ в баллоне тоже образует физическое тело. В отличие от жидких, газообразные тела заполняют емкость целиком.
Кроме трех основных агрегатных состояний, различают переходные – аморфное, жидкокристаллическое, – а также плазму.
Основные свойства вещества
Свойства любого вещества – это набор характеристик, дающих возможность отличить его от других веществ.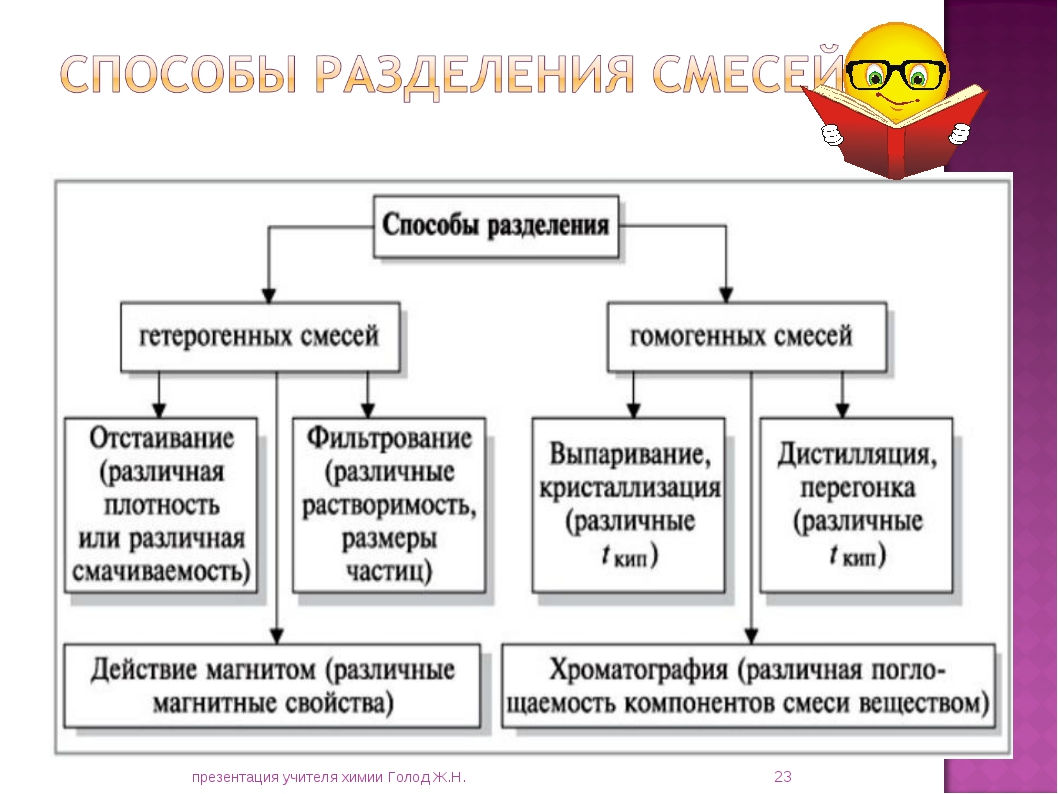 Различают два вида свойств:
Различают два вида свойств:
- Физические: цвет, вязкость, температура кипения и плавления, плотность, электропроводность, теплоемкость и другие. Эти свойства меняются при переходе в другое агрегатное состояние. Их можно наблюдать и измерять; при этом не требуется превращать одно вещество в другое.
- Химические свойства характеризуют особенности веществ относительно взаимодействий, при которых происходят изменения состава. Они показывают степень активности вещества и условия ее проявления. Переход между агрегатными состояниями не меняет химических свойств.
Чистые вещества и химические смеси
Наименьшей частицей вещества является молекула. Разные вещества состоят из отличающихся друг от друга молекул. Если вещество образовано одинаковыми молекулами, то оно называется чистым. Примеры чистых веществ – вода, сахар, полиэтилен.
В природе практически все вещества представлены в виде смесей – совокупностей, в которых присутствуют разные молекулы. Компоненты смеси не взаимодействуют химически и могут быть выделены физическими методами. Виды смесей, их примеры и способы разделения кратко можно представить в виде таблицы.
Компоненты смеси не взаимодействуют химически и могут быть выделены физическими методами. Виды смесей, их примеры и способы разделения кратко можно представить в виде таблицы.
| Вид смеси | Свойства компонентов | Методы разделения |
Однородные, или гомогенные
| Разбиты на мельчайшие частицы, неразличимые даже в микроскоп |
|
Неоднородные, или гетерогенные (механические смеси)
| Частицы различимы в микроскоп или невооруженным глазом |
|
Соотношение компонентов в смеси может быть различным, в то время как состав чистых веществ неизменен, и их свойства остаются постоянными. Поскольку абсолютно чистых веществ не существует, принято считать чистым такое вещество, в котором примеси практически не оказывают влияния на свойства.
Поскольку абсолютно чистых веществ не существует, принято считать чистым такое вещество, в котором примеси практически не оказывают влияния на свойства.
Явления, в которых участвует вещество
Физические явления
Если в ходе какого-либо процесса одни вещества не преобразуются в другие, то следует говорить о физическом явлении. При деформации, измельчении, растворении, изменении агрегатного состояния исходное вещество приобретает другие физические свойства. Однако никаких новых веществ из него не образуется.
Пример физического явления – протекание тока по медному проводу. Присутствует влияние на физическое состояние вещества — у проводника появляется магнитное поле, он нагревается. Но сам провод остается медным.
Химические явления
Процессы, сопровождающиеся превращением веществ, относятся к химическим явлениям, или реакциям, в результате которых происходит перестройка и образование новых молекул. Так появляется ржавчина на железе, горят дрова в печи или пары бензина в двигателе автомобиля. Электрический ток также может вызывать химические реакции, проходя через некоторые растворы, расплавы и через воду, разлагая ее на водород и кислород.
Электрический ток также может вызывать химические реакции, проходя через некоторые растворы, расплавы и через воду, разлагая ее на водород и кислород.
В химической реакции различают исходные вещества, которые вступают в нее – реагенты, – и образующиеся в итоге продукты реакции. К примеру, водород с кислородом, при определенных условиях могут выступить в качестве реагентов и образовать продукт – воду.
Признаки химических реакций
Определить, идет ли химическая реакция, можно по внешним признакам:
- изменение окраски веществ;
- выделение газа;
- выпадение или растворение осадка;
- появление запаха;
- выделение либо поглощение тепла;
- световое излучение.
Например, горение металла магния сопровождается большим тепловыделением и световой вспышкой, скисание молока – характерным запахом.
Условия, необходимые для химических реакций
Для начала реакции вещества должны соприкасаться. С целью увеличения площади контакта реагентов может потребоваться их измельчение и перемешивание, а также растворение. При соблюдении условия соприкосновения некоторые реакции начинаются самопроизвольно. В других случаях нужны дополнительные условия:
При соблюдении условия соприкосновения некоторые реакции начинаются самопроизвольно. В других случаях нужны дополнительные условия:
- нагревание;
- воздействие света;
- электрический ток;
- облучение;
- механическое воздействие;
- введение в реакционную смесь особых веществ – катализаторов.
Дальнейшее протекание реакции зависит от ее теплового эффекта. Дело в том, что при любом химическом процессе либо выделяется, либо поглощается энергия. По этому признаку различают два типа реакций:
- Экзотермические реакции идут с выделением тепловой (иногда и световой) энергии, которая поддерживает их течение. Таковы, например, все реакции горения: нагревание нужно только для того, чтобы инициировать их.
- Эндотермические реакции протекают с поглощением энергии. В качестве примера можно привести разложение сахара до сажи и воды. Эта реакция требует сильного нагревания и постоянного подвода тепла.

Роль химических явлений в жизни человека и в природе
Невозможно представить себе деятельность человека в любой области без химических процессов. Они применяются в энергетике и отоплении, транспорте, добыче и переработке сырья, в производстве материалов и всевозможных продуктов. Хотя человек научился использовать химические явления целенаправленно, их роль неизмеримо больше обслуживания нашей цивилизации.
Процессы жизнедеятельности, обеспечивающие существование живых организмов, связаны с превращениями вещества, а это означает, что они имеют химическую природу. В передаче генетической информации, дыхании, работе нервной и мышечной тканей, пищеварении, в фотосинтезе у растений – везде происходит выделение или поглощение химической энергии.
Химические реакции протекают повсюду – в океанах и атмосфере, в недрах Земли и в космосе. В тесном переплетении с физическими процессами они играют одну из ключевых ролей в жизни Вселенной.
Вопросы и задания
- В каком из высказываний речь идет о стекле как о веществе, а в каком – как о физическом теле?
- я заменил оконное стекло;
- графин сделан из стекла.

- Можно ли выделить из раствора сахар с помощью фильтрации? Почему?
- Какое из перечисленных явлений относится к химическим? Почему?
- высыхание лужи;
- осаждение бурых хлопьев из водного раствора марганцовки, стоявшего на свету;
- образование снежинки.
Ответы
- а) – тело; б) – вещество.
- Нет. Сахар в растворе разделен на мельчайшие частицы – молекулы, – которых не может задержать фильтр.
- б), так как появился осадок и произошло изменение цвета.
- Составьте из предложенного перечня два списка: а) чистые вещества и б) смеси.
- морская вода, полиэтилен, бензин, аэрозоль, медь, сахарный сироп, водород.
- Из предложенного списка выберите признаки химических реакций:
- образование осадка;
- плавление;
- кипение;
- поглощение тепла;
- выделение тепла;
- появление запаха;
- появление магнитного поля.
Ответы
- а) полиэтилен, медь, водород; б) морская вода, бензин, аэрозоль, сахарный сироп.

- а), г), д), е).
Открытый урок по Химии в 7 классе Чистые вещества и смеси
Тема. Чистые вещества и смеси.
Цели по содержанию:
Образовательная:
сформировать понятие о чистом веществе и смеси.
Развивающая:
сформировать умения распознавать чистые вещества и смеси;
сформировать умения составлять план действий разделения смесей веществ;
сформировать умения разделять смеси фильтрованием, действием магнита.
ознакомить с понятием адсорбция, отстаивание, декантация.
Воспитательная:
способствовать формированию интереса к знаниям, умениям, адекватной оценке своей деятельности.
Ожидаемый результат: Каждый ученик должен четко представлять понятия «чистое вещество», «смесь», знать способы разделения смесей, находить причинно-следственные связи, формулировать выводы на основании знаний, экспериментальных данных и жизненного опыта, доказывать их правильность, рефлексия деятельности.
Методы обучения: проблемный.
Тип урока: комбинированный.
Формы организации познавательной деятельности учащихся: фронтальная, парная и индивидуальная.
Средства обучения:
Химия «Вводный курс» – учебник для 7 класса общеобразовательных учреждений под редакцией О.С. Габриеляна – М., Дрофа, 2006.
Презентация в MS Power Point.
Демонстрационный эксперимент:
Разделение смеси фильтрованием;
Разделение смеси действием магнита.
Оборудование и вещества: Компьютер, проектор.
Разделение смеси нерастворимого в воде вещества и растворителя (растворимого вещества):Лабораторный штатив с кольцом, воронка, фильтровальная бумага, стеклянная палочка, колба или стакан химический.
Ход урока
А) Мотивационно-ориентировочный этап.
I. Организационный момент.
Приветствие, выявление эмоционального настроения у учащихся.
Что такое массовая доля растворенного вещества (это отношение растворенного вещества к массе раствора).
В чем измеряется массовая доля (в процентах)
Где можно и нужно использовать знания о приготовлении растворов?
В каких областях народного хозяйства можно использовать растворы и
Какие вам известны профессий в данных отраслях?
В домашних условиях (подкормка комнатных цветов, использование правильного количества чистящих веществ)
В пищевой промышленности (повара, технологи)
В сельском хозяйстве (агрономы рассчитывают удобрения для выращивания растений)
В аптеках (фармакологи)
В медицине (очень важны медсестры, потому что они занимаются разведением лекарств, и врачи, потому что они назначают лекарства)
В строительстве (маляр, штукатур,множество строительных смесей, разведение клея)
II. Подготовка к восприятию нового материала. Объявление темы.
Беседой выясним вопросы:
? Как выдумаете растворы, полученные при смешивании соли и воды, сахара и воды это чистые вещества?
? А знаете ли Вы какую воду называют дистиллированной? (чистую), а что представляет собой морская вода? (смесь веществ).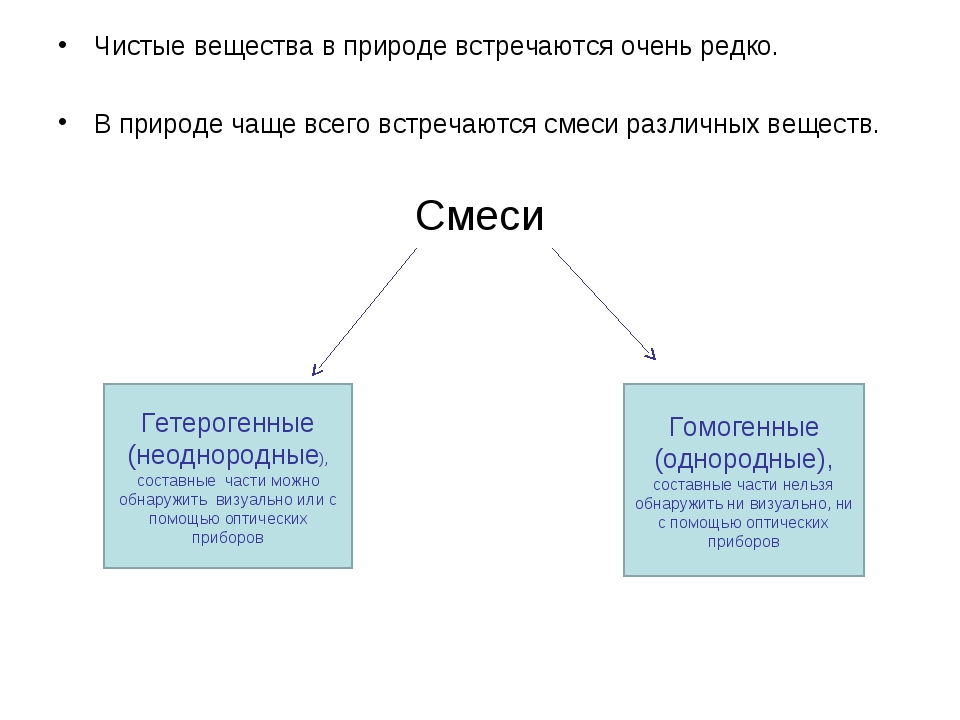
А теперь давай те запишем тему сегодняшнего занятия: «Чистые вещества и смеси»
? А что Вы хотели бы узнать по данной теме? Какие бы цели Вы поставили перед собой на сегодняшнем занятии?
Цели урока обсуждаются с учащимися и как результат совместных действий.
Выяснить:
Какое вещество считают чистым.
Что такое смесь?
Какие бывают смеси?
Какими способами можно разделить смеси?
Б) Операционно-исполнительный этап.
1. Объяснение нового материала.
а) Чистое вещество.
А теперь приступим к реализации поставленных целей.
Учитель демонстрирует слайд и поясняет условия эксперимента (в двух сосудах нагревали до кипения дистиллированную и морскую воду). Через определенное время измеряли температуры кипения в этих сосудах.
Ученики обсуждают результаты эксперимента. Сам собой напрашивается вопрос-проблема, которую озвучивает учитель, «Почему у морской воды tкип не постоянная в разные промежутки времени, по сравнению с tкипдистиллированной воды».
Учащиеся делают вывод, что соленость морской воды влияет на tкип. С помощью учителя формулируется определение «Чистым веществом называется такое вещество, у которого постоянные физические свойства (температуры кипения, температуры плавления, плотность).
Демонстрируется слайд
Ребята записывают в листе учёта знаний выводы.
Учитель дополняет, что в чистом веществе могут содержаться примеси, если в незначительных количествах, то они не влияют на физические и химические свойства. Пример чистого вещества – дистиллированная вода.
б) Смеси и их классификация.
Учитель предлагает ученикам рассмотреть смеси, находящиеся на демонстрационном столе (раствор поваренной соли, речной песок и вода, смесь опилок и кнопок, смесь порошка серы и железных опилок, морская вода), и примеры смесей, представленные на слайде.
Далее ребята дают определение смеси, как комбинации их нескольких веществ, находящихся в непосредственном контакте друг с другом. Эта формулировка появляется на слайде.
Эта формулировка появляется на слайде.
Учащиеся фиксируют содержание слайда в листе учёта знаний.
Учитель дополняет, что в природе нет абсолютно чистых веществ. Вещества встречаются преимущественно в виде смесей. Он рассказывает о воздухе, как смеси, которая состоит из газов – азота, кислорода, аргона и др.
? А можем ли мы различить эти газы в воздухе нашего класса? (нет).
(Демонстрируется слайд «Состав воздуха», на который можно перейти по гиперссылке Воздух предыдущего слайда. По окончании рассказа, щелчок на стрелочку слева внизу переместит на слайд «Классификация смесей»).
? А почему? (т.к. это бесцветные, газообразные вещества. Они одинаковы по агрегатному состоянию.)
Далее рассматривается классификация смесей, с помощью слайда.
Далее педагог обращает внимание учащихся на то что, неоднородными называются смеси, в которых невооруженным глазом или при помощи микроскопа видны частицы веществ, составляющих смесь.
Однородными называют смеси, в которых нельзя заметить частицы веществ, входящих в смесь (даже при помощи микроскопа).
Учащиеся выполняют задание: приводят примеры однородных и неоднородных смесей из общего списка смесей. (см. выше). Проверка выполненных заданий.
Дополнительный материал рассказывает учитель, если позволяет время на занятии. [Для научных исследований и промышленности, в основном требуются чистые вещества. Некоторые примеси даже в небольших количествах способны сильно поменять свойства веществ. Например, в полупроводниковой технике применяют сверхчистые вещества, где примеси составляют всего 1 атом на миллион атомов основного элемента (Si, Ge). Превышение нормы ведет к резкому ухудшению полупроводниковых свойств этих веществ. В то же время необходимо выделить, что невозможно получить абсолютно чистое вещество, т.к. любое чистое вещество содержит хотя ничтожное малое количество примесей.]
в) Основные способы разделения смеси.
А теперь поговорим о способах разделения смесей в зависимости от вида смеси.
Демонстрация схемы способов очистки смесей в зависимости от вида смеси.
«Разделение смеси серы с железом»
Демонстрация способов разделения смесей: фильтрования, отстаивания, действия магнитом.
Работа с текстом 8-10 мин
Прочитать текст, выписать в тетрадь новые понятия.
Какая информация для вас знакома, вы слышали о ней, использовали ее в своей жизни (информация о активированном угле, использование в медицине, какие профессии вам известны; противогазы используют пожарные, военные, ученые)
В) Оценочно-рефлексивный этап.
Рефлексивный тест:
Я узнал(а) много нового.
Мне это пригодится в жизни.
На уроке было над чем подумать.
На все возникшие у меня вопросы я получил(а) ответы.
На уроке я поработал(а) добросовестно.
После выполнения теста учитель просит поднять руки тех учащихся, у которых поставлено в тесте 5 плюсов, затем тех, у которых 4 и 3 плюса.
Или в качестве рефлексии – беседа по вопросам:
А) Что нового вы узнали сегодня на уроке?
Б) Что запомнилось?
В) Что понравилось, а что не удалось, на ваш взгляд?
Дз: параграф 12,16, привести примеры различных неоднородных смесей и способы их разделения
1. Что такое чистые вещества?
Чистые вещества – вещества, которые имеют постоянный качественный и количественный состав.
Смеси – это многокомпонентные системы, в которых свойства веществ сохраняются.
Неоднородные смеси – это гетерогенные системы, в которых обнаруживается поверхность раздела фаз.
Однородные смеси – это гомогенные системы, в которых невооружённым глазом поверхность раздела фаз не обнаруживается.
2. Чем смеси отличаются от чистых веществ?
В смеси свойства компонентов сохраняются, состав смеси непостоянен.
3. Подчеркните названия чистых веществ: сталь, алюминий, кока-кола, кислород, спиртовой раствор иода, поваренная соль, морская вода, воздух, железо, почва, дистиллированная вода.
4. Чтобы выявить свойства вещества, нужно брать для исследования чистые вещества, потому что смеси, т.е. компоненты смесей, будут мешать исследованию.
5. Зачем нужно разделение смесей?
Для того, чтобы получить чистые вещества.
6. На чем основано разделение смесей?
На различных химических свойствах их компонентов.
7. Метод фильтрования основан на выделении веществ из неоднородной смеси, образованной растворимыми и нерастворимыми в воде веществами.
8. Метод отстаивания основан на различии в плотностях веществ, смешанных с водой.
9. Метод выпаривания основан на разных температурах кипения компонентов смеси, выделяют таким образом вещества из гомогенной смеси.
10. Метод дистилляции (перегонки) основан на разделении однородных смесей путём испарения летучих жидкостей с последующей конденсацией их паров.
11. Метод кристаллизации основан на частичном упаривании воды, при охлаждении растворённое вещество выделяется в виде кристаллов.
Метод кристаллизации основан на частичном упаривании воды, при охлаждении растворённое вещество выделяется в виде кристаллов.
12. Метод хроматографии основан на различном поглощении разделяемых веществ поверхностью другого вещества.
13. В сахарный песок случайно попали древесные опилки. Опишите способ, которым можно очистить сахар от примесей.
1) растворить в воде;
2) отфильтровать – отделить опилки;
3)выпарить – на дне чашки останется сахар.
14. Опишите способ, которым можно разделить смесь, состоящую из речного песка, древесных опилок и поваренной соли.
1) растворить в воде – соль растворится, а песок, как более тяжёлый осядет на дне;
2) отфильтровать опилки;
3) выпарить воду – на дне чашки останется поваренная соль.
15. При исследовании образца воды было выявлено, что в воде содержатся нерастворимые частички твердого вещества (предположительно древесные стружки), несмешивающаяся с водой жидкость (возможно масло). Образец имеет неприятный запах и неестественный цвет, кроме того, содержит растворенную соль. Как очистить такую воду? Опишите последовательность операций.
Образец имеет неприятный запах и неестественный цвет, кроме того, содержит растворенную соль. Как очистить такую воду? Опишите последовательность операций.
1) отделить воду от масла делительной воронкой – отделится масло;
2) отфильтровать – отделятся древесные стружки;
3) выпарить – на дне чашки останется соль, которая была растворена в воде.
Тема: Разделение смесей
Цель:
1) построение знаний о чистых веществах и смесях;
2) формирование знаний о способах разделения смесей;
3) отработка практических умений и навыков разделения смесей
Ход урока:
1. Стадия вызова
Учитель наливает в стакан воду из-под крана.
— Скажите, что у меня в стакане? (вода)
— Мы можем, эту воду использовать для изучения свойств воды? ( Нет, она не чистая)
— Что в воде находится еще? ( Ответы детей: хлорка, соли, ржавчина)
— Значит в стакане не просто вода?
— Как мы можем назвать, то, что находится в стакане? (смесь)
— Какие смеси вам известны из вашего жизненного опыта?
— Значит для того, чтобы изучать свойства вещества нужно его очистить.

— Как вы думаете, что для этого нужно сделать? (варианты предлагают учащиеся)
2. Стадия содержания
Смеси: однородные и неоднородные
— Попробуйте дать определение этим смесям.
— Существуют разные способы очистки веществ. Сегодня я предлагаю вам, познакомится с некоторыми из них. (Сократовский диалог – все -1-2-3-4-все)
Способы очистки веществ:
Фильтрование 1 с. 86 — 87
Адсорбция 2 с. 87 — 88
Дистилляция 3 с. 89-90
Кристаллизация 4 с 90-91
Давайте все вместе зададим вопросы, на которые постараемся найти ответы, используя вопросительные слова:
— Что такое?
— Какие?
— Каким Образом?
— На каких?
— Где?
(работа в группе, совместное обсуждение точности вопросов)
В группе разделите номера с 1 по 4.
Каждый из вас отвечает за свой способ разделения смеси, после завершения работы с текстом вы должны ответить на вопросы своим партнерам по группе.
(хранитель времени, сигнальные карточки, колокольчик.)
— Наш лаборант случайно в баночку с медным купоросом высыпала песок. Сможем ли мы, помочь разделить эту смесь.
Каким образом обсудите в группе, и предложите план разделения смеси.
1. Растворить смесь в воде.
2. Профильтровать.
3. Выпарить.
(Инструктаж ТБ, уточнение деталей работы)
3. Стадия рефлексии
Оформление практической работы в тетради по плану:
1. Что делали?
2. Что наблюдали?
3. Рисунок.
4. Вывод.
Фильтрованием можно …
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/386832-otkrytyj-urok-po-himii-v-7-klasse-chistye-ves
Чистые вещества и смеси. 7-й класс
Карта дидактических целей урока.
| Цель урока | Для учителя | Для ученика |
1. Образовательная Образовательная | Создать условия для высокого уровня воспроизведения системы знаний и умений, учащихся по данной теме | 1. Знать смысл понятия чистого вещества и смеси; 2. Знать способы разделения смеси. |
| 2. Развивающая | Создать условия для поиска взаимосвязи между новым и изученным материалом, развития логического мышления, умений приобретать знания не памятью, а мыслью | Развивать умения для поиска взаимосвязи между новым и изученным материалом, умения постановки и поиска решения проблем, речевую деятельность |
| 3. Воспитательная | Создать условия для формирования культуры умственного и практического труда, интереса к знаниям, умений проводить самооценку. | Формировать умения работать по культуре умственного и практического труда, адекватной оценке своей деятельности.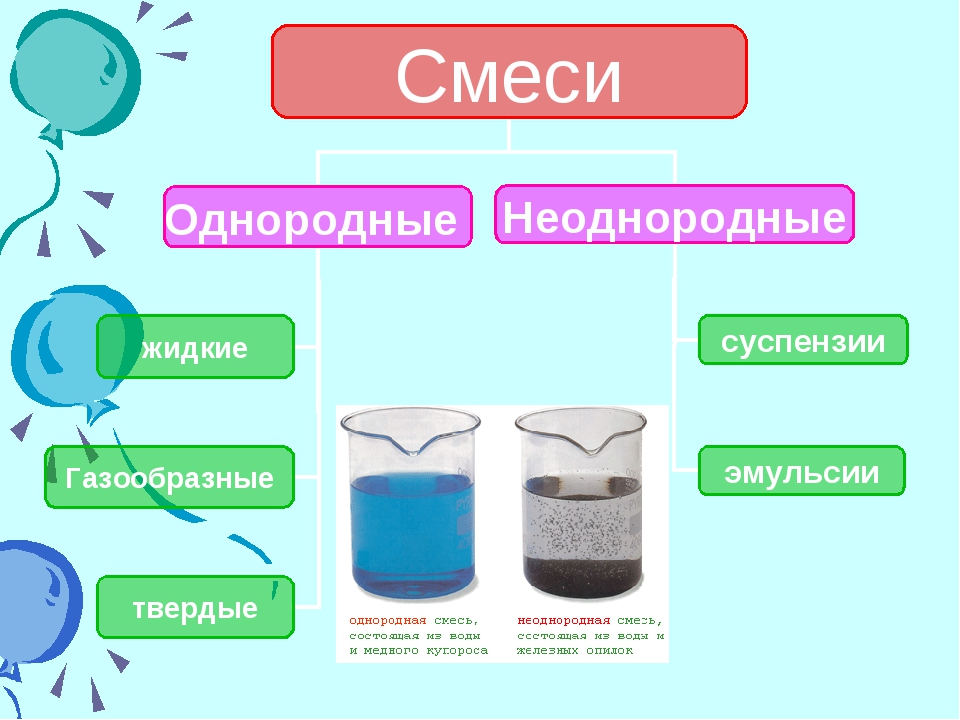 |
Цели по содержанию:
Образовательная:
- сформировать понятие о чистом веществе и смеси.
Развивающая:
- сформировать умения распознавать чистые вещества и смеси ;
- сформировать умения составлять план действий разделения смесей веществ;
- сформировать умения разделять смеси отстаиванием, фильтрованием, с помощью магнита, выпариванием.
Воспитательная:
- способствовать формированию интереса к знаниям, умениям, адекватной оценке своей деятельности.
Ожидаемый результат: Каждый ученик должен четко представлять понятия «чистое вещество», «смесь», знать способы разделения смесей, находить причинно-следственные связи, формулировать выводы на основании знаний, экспериментальных данных и жизненного опыта, доказывать их правильность, рефлексировать свою деятельность.
Методы обучения: проблемный.
Тип урока: комбинированный.
Формы организации познавательной деятельности учащихся: фронтальная, парная и индивидуальная, групповая.
Средства обучения:
- Химия «Вводный курс» – учебник для 7 класса общеобразовательных учреждений под редакцией О.С. Габриеляна – М., Дрофа, 2006.
- Презентация в MS Power Point.
- Демонстрационный эксперимент:
- Разделение смеси фильтрованием;
- Разделение смеси выпариванием;
- Дистилляция воды
- Карточки с заданием для групповой работы (тесты.)
Оборудование и вещества: Компьютер, проектор.
- Разделение смеси (раствора) растворимого вещества и растворителя: Раствор поваренной соли, лабораторный штатив с кольцом, фарфоровая чашка (выпарительная) или предметное стекло, спиртовка, тигельные щипцы, стеклянная палочка.
- Разделение смеси нерастворимого в воде вещества и растворителя (растворимого вещества): Лабораторный штатив с кольцом, воронка, фильтровальная бумага, стеклянная палочка, колба или стакан химический.
Ход урока
А) Мотивационно-ориентировочный этап.
I. Организационный момент.
Приветствие, выявление эмоционального настроения у учащихся. Слайд 1.
Я хотела бы, чтобы оно изменилось в ходе занятия только в лучшую сторону.
II. Подготовка к восприятию нового материала. Объявление темы.
Беседой выясним вопросы:
- Что является предметом изучения науки химии? (Вещества)
- Что называют веществом? (Вещество – это то, из чего состоят физические тела).
А теперь отгадайте загадку: о каком веществе идёт речь:
«В морях и реках обитает,
Но часто по небу летает,
А как наскучит ей летать,
На землю падает опять.» (вода).
Обратите внимание на химические стаканы у Вас на парте: в них находиться вода дистиллированная и вода морская.
? А знаете ли Вы какую воду называют дистиллированной? (чистую), а что представляет собой морская вода? (смесь веществ).
А теперь давай те запишем тему сегодняшнего занятия: «Чистые вещества и смеси».
Запись даты и темы урока учащимися в листе учёта знаний. Слайд 2.
? А что Вы хотели бы узнать по данной теме? Какие бы цели Вы поставили перед собой на сегодняшнем занятии?
Цели урока обсуждаются с учащимися и как результат совместных действий демонстрируется слайд 3.
Выяснить:
- Какое вещество считают чистым.
- Что такое смесь?
- Какие бывают смеси?
- Какими способами можно разделить смеси?
Б) Операционно-исполнительный этап.
1. Объяснение нового материала.
а) Чистое вещество.
А теперь приступим к реализации поставленных целей.
Учитель демонстрирует слайд 4 и поясняет условия эксперимента (в двух сосудах нагревали до кипения дистиллированную и морскую воду. Через определенное время измеряли температуры кипения в этих сосудах).
Ученики обсуждают результаты эксперимента. Сам собой напрашивается вопрос-проблема, которую озвучивает учитель, «Почему у морской воды tкип не постоянная в разные промежутки времени, по сравнению с tкип дистиллированной воды». (Слайд 5)
Учащиеся делают вывод, что соленость морской воды влияет на tкип. С помощью учителя формулируется определение «Чистым веществом называется такое вещество, у которого постоянные физические свойства (температуры кипения, температуры плавления, плотность).
Демонстрируется слайд 6.
Ребята записывают в листе учёта знаний выводы.
Учитель дополняет, что в чистом веществе примеси, хотя и есть в незначительных количествах, но они не влияют на физические и химические свойства. Пример чистого вещества – дистиллированная вода.
б) Смеси и их классификация.
Учитель предлагает ученикам рассмотреть смеси, находящиеся на демонстрационном столе (раствор поваренной соли, речной песок и вода, смесь опилок и кнопок, смесь порошка серы и железных опилок, морская вода), и примеры смесей, представленные на слайде 7.
Далее ребята дают определение смеси, как комбинации их нескольких веществ, находящихся в непосредственном контакте друг с другом. Эта формулировка появляется на слайде 8.
Учащиеся фиксируют содержание слайда в листе учёта знаний.
Учитель дополняет, что в природе нет абсолютно чистых веществ. Вещества встречаются преимущественно в виде смесей. Он рассказывает о воздухе, (слайд № 9) как смеси, которая состоит из газов – азота, кислорода, аргона и др.
? А можем ли мы различить эти газы в воздухе нашего класса? (нет).
(Демонстрируется слайд «Состав воздуха», на который можно перейти по гиперссылке Воздух предыдущего слайда. По окончании рассказа, щелчок на стрелочку слева внизу переместит на слайд «Классификация смесей»).
? А почему? (т.к. это бесцветные, газообразные вещества. Они одинаковы по агрегатному состоянию.)
Далее рассматривается классификация смесей, с помощью слайда 10.
Далее педагог обращает внимание учащихся на то что, неоднородными называются смеси, в которых невооруженным глазом или при помощи микроскопа видны частицы веществ, составляющих смесь.
Однородными называют смеси, в которых нельзя заметить частицы веществ, входящих в смесь (даже при помощи микроскопа).
Учащиеся выполняют задание: приводят примеры однородных и неоднородных смесей из общего списка смесей. (см. выше). Проверка выполненных заданий. Слайд 11.
Дополнительный материал рассказывает учитель, если позволяет время на занятии. [Для научных исследований и промышленности, в основном требуются чистые вещества. Некоторые примеси даже в небольших количествах способны сильно поменять свойства веществ. Например, в полупроводниковой технике применяют сверхчистые вещества, где примеси составляют всего 1 атом на миллион атомов основного элемента (Si, Ge). Превышение нормы ведет к резкому ухудшению полупроводниковых свойств этих веществ. В то же время необходимо выделить, что невозможно получить абсолютно чистое вещество, т.к. любое чистое вещество содержит хотя ничтожное малое количество примесей.]
в) Основные способы разделения смеси.
А теперь поговорим о способах разделения смесей в зависимости от вида смеси.
Учитель показывает на слайдах 12, а учащиеся заполняют схемы в листе учёта знаний.
Демонстрация схемы способов очистки смесей в зависимости от вида смеси. (Слайды «Фильтрование» – 13, «Разделение смеси серы с железом» – 14.)
Демонстрация способов разделения смесей: фильтрования, выпаривания, отстаивания, дистилляции воды (рисунок аппарата ), на слайдах 16-17.
Учащиеся в группах по 4 человека выполняют практическую работу по разделению смесей, имеющихся у них на столе. (Смесь выбирают самостоятельно)
- Вода + речной песок, – на «5»,
- Морская вода, – на «4»,
- Железная стружка + порошок серы – на «3»).
!!! Запасной вариант: если не хватает времени на выполнение практической работы: выпаривание, например, может показать учащийся, а кристаллизацию можно продемонстрировать в виде растущих кристаллов. (Как вариант можно использовать программу «Виртуальная химическая лаборатория (НФПК) и продемонстрировать опыт «Получение дистиллированной воды».)
Во время проведения опытов можно предложить другим учащимся выступить в роли комментатора, который бы описывал все действия, ученика, проводившего опыт.
В) Оценочно-рефлексивный этап.
Учащиеся усаживаются поудобнее, закрывают на минуту глаза, расслабляются и обдумывают всё, что происходило на уроке. В это время тихо звучит спокойная музыка. Затем они выполняют рефлексивный тест, в случае согласия с утверждением ставят напротив него знак «+».
Рефлексивный тест: Слайд 18.
- Я узнал(а) много нового.
- Мне это пригодится в жизни.
- На уроке было над чем подумать.
- На все возникшие у меня вопросы я получил(а) ответы.
- На уроке я поработал(а) добросовестно.
После выполнения теста учитель просит поднять руки тех учащихся, у которых поставлено в тесте 5 плюсов, затем тех, у которых-4 и 3 плюса.
Учитель делает общий вывод о работе на уроке не только учащихся, но и своей.( количество «+»- это оценка, которую учащиеся, анализируя свою работу, ставят учителю.)
Или в качестве рефлексии – беседа по вопросам:
А) Что нового вы узнали сегодня на уроке?
Б) Что запомнилось?
В) Что понравилось, а что не удалось, на ваш взгляд?
Поведение итогов.
Приложение.
Чистые вещества и смеси —
1. Запишите определение.
Смеси — сочетание двух или более веществ.
2. Заполните пропуски в предложениях.
Гетерогенными называются смеси, в которых частички составляющих их веществ видны невооруженным глазом или под микроскопом.
Гомогенными называются смеси, в которых частички составляющих их веществ нельзя увидеть даже с помощью увеличительных приборов.
3. Подчеркните названия смесей:
мрамор, сталь, поваренная соль, резина, кислород, молоко, зубная паста, речная вода, метан, воздух, апельсиновый сок, кровь.
4. Подчеркните «лишнее» слово в каждой группе.
а) бензин, спирт, мок, молоко;
б) медь, аллюминий, цемент, сера;
в) воздух, уксус, морская вода, песок;
г) бензин, молоко, гранит, поливитамины.
5. Приведите примеры смесей, использующихся:
а) в быту — молоко, зубная паста, соки;
б) в косметической промышленности — крема, шампуни, бальзамы, помада.
в) в организме человека — кровь, воздух.
6. Заполните таблицу 15.
Примеры смесей, компоненты которых находятся в различных агрегатных состояниях
| АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВ В СМЕСИ | ПРИМЕРЫ СМЕСЕЙ | ВИД СМЕСИ (однородная, неоднородная) |
| твердое-твердое | горные породы | неоднородная |
| жидкое-твердое | морская вода | однородная |
| жидкое-жидкое | бензин с водой | неоднородная |
| газообразное-жидкое | туман | неоднородная |
| газообразное-твердое | дым | неоднородная |
| газообразное-газообразное | воздух | однородная |
Как выглядит состав чистых веществ. Чистые вещества и смеси
Вся наша жизнь в буквальном смысле построена на работе различных химических веществ. Мы дышим воздухом, который содержит в себе множество различных газов. На выходе получается углекислый газ, который затем перерабатывается растениями. Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
Банальное яблоко — это целый комплекс которые взаимодействуют друг с другом и нашим организмом. Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное — это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим А также взглянем на типичные примеры чистых веществ.
Чистые вещества
Итак, в химии чистые вещества — это те вещества, что всегда состоят только из одного-единственного вида частиц. И это первое важное свойство. Чистым веществом является вода, например, которая состоит исключительно из молекул воды (то есть своих собственных). Также чистое вещество всегда имеет постоянный состав. Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Свойства чистых веществ, в отличие от смесей имеют постоянный характер и изменяются при появлении примесей. Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом — m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Также существует такой тип чистых веществ, как особо (ультрачистые, высокочистые). Такие вещества используются в производстве полупроводников в различных измерительных и вычислительных устройствах, атомной энергетике и во многих других профессиональных областях.
Примеры чистых веществ
Мы уже выяснили, что чистым веществом является то, что содержит в себе элементы одного вида. Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества — рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Смеси
Мы уже рассмотрели чистые вещества и примеры чистых веществ, теперь перейдем к другой категории веществ — смесям. Смесь — это когда несколько веществ смешиваются друг с другом. Мы сталкиваемся со смесями на постоянной основе даже в быту. Тот же чай или мыльный раствор представляют собой смеси, которые мы применяем ежедневно. Смеси могут быть созданы человеком, а могут быть природными. Они находятся в твердом, жидком и газообразном состоянии. Как уже было сказано выше, тот же чай является смесью воды, сахара и чая. Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.
Смеси созданные человеком почти всегда долговечны, а природные под воздействием тепла начинают распадаться на отдельные частицы (молоко, к примеру, прокисает через несколько дней). Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные смеси однородные, а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Характеристики смеси и чистых веществ
Для удобства восприятия информация представлена в виде таблицы.
Сравнительный признак | Чистые вещества | Смеси |
Состав веществ | Сохраняют постоянный состав | Имеют непостоянный состав |
Виды веществ | Включают в себя различные вещества | |
Физические свойства | Сохраняют постоянные физические свойства | Имеют непостоянные физические свойства |
Изменение энергии вещества | Изменяется при образовании энергии | Не изменяется |
Способы получения чистых веществ
В природе многие вещества существуют в Они применяются в фармакологии, промышленном производстве.
Для получения чистых веществ применяются различные методы разделения. Гетерогенные смеси делят с помощью отстаивания и фильтрования. Гомогенные смеси делят с помощью выпаривания и дистилляции. Рассмотрим каждый способ отдельно.
Отстаивание
Этот метод используется для разделения суспензий, таких как смесь речного песка с водой. Главным принципом, на котором основывается процесс отстаивания, является разница в плотностях тех веществ, которые будут разделены. Например, одно тяжелое вещество и вода. Какие чистые вещества тяжелее воды? Это песок, например, который в силу своей массы начнет оседать на дно. Таким же образом разделяют различные эмульсии. Например, от воды можно отделить растительное масло или нефть. Эти вещества в процессе разделения образуют небольшую пленку на поверхности воды. В лабораторных условиях этот же процесс проводят с использованием делительной воронки. Этот способ разделения смесей работает и в природе (без участия человека). Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Фильтрование
Этот метод подходит для получения чистых веществ из гетерогенных смесей, например, из смеси воды с поваренной солью. Итак, каким образом работает фильтрация в процессе разделения частиц смеси? Суть заключается в том, что у веществ различные уровни растворимости и размеры частиц.
Фильтр конструируется таким образом, чтобы через него могли пройти только частицы с той же растворимостью или тем же размером, что он может пропустить. Более крупные и другие неподходящие частицы не смогут пройти через фильтр и будут отсеяны. Роль фильтров могут играть не только специализированные устройства и растворы в пределах лаборатории, но и знакомые всем вещи, такие как вата, уголь, обожженная глина, спрессованное стекло и другие пористые объекты. Фильтры используются в реальной жизни гораздо чаще, чем может показаться.
По такому принципу работает всем нам знакомый пылесос, который отделяет крупные частицы мусора и ловко всасывает мелкие, неспособные повредить механизм. Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят защищающие их от отравления.
Воздействие магнита и воды
Таким способом можно разделить смесь порошка железа и серы. Принцип разделения основан на воздействии магнита на железо. Частицы железа притягиваются к магниту, в то время как сера останется на месте. Этот же метод можно использовать для отделения других металлических деталей из общей массы разных материалов.
Если порошок серы, смешанный с порошком железа высыпать в воду, то несмачиваемые частицы серы всплывут на поверхность воды, в то время как тяжелое железо сразу же ляжет на дно.
Выпаривание и кристаллизация
Этот способ работает с такими как раствор соли в воде. Это работает в естественных природных процессах и лабораторных условиях. Например, некоторые озера при нагревание испаряют воду, а на ее месте остается поваренная соль. С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
Если вещество, которое нужно извлечь (сахар, например) плавится при нагревании, то воду не испаряют полностью. Смесь сначала прогревают, а затем получившуюся модифицированную смесь настаивают, чтобы частицы сахара осели на дне. Иногда стоит более сложная задача — отделение вещества с более высокой температурой кипения. Например, отделение воды от соли. В таком случае, испаренное вещество необходимо собрать, охладить и сконденсировать. Этот метод разделения гомогенных смесей называют дистилляцией (или просто перегонкой). Существуют специальные устройства, которые дистиллируют воду. Такая вода (дистиллированная) активно используется в фармакологии или в автомобильных системах охлаждения. Естественно, этим же методом люди перегоняют спирт.
Хроматография
Последний метод отделения — хроматография. Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Чистое
вещество
содержит
частицы только
одного вида. Примерами могут служить
серебро (содержит только атомы серебра),
серная кислота и оксид углерода (IV)
(содержат только молекулы соответствующих
веществ). Все чистые вещества имеют
постоянные физические свойства, например,
температуру плавления (Т пл)
и температуру кипения (Т кип).
Вещество
не является чистым, если содержит
какое-либо количество одного или
нескольких других веществ – примесей
.
Загрязнения
понижают температуру замерзания и
повышают температуру кипения чистой
жидкости. Например, если в воду добавить
соль, температура замерзания раствора
понизится.
Смеси
состоят
из двух или более
веществ.
Почва, морская вода, воздух – все это
примеры различных смесей. Многие смеси
могут быть разделены на составные части
– компоненты
–
на основании различия их физических
свойств.
Различают
гомогенные
(однородные) и гетерогенные (неоднородные)
смеси.
Особенностью
гомогенной смеси
является
то, что между компонентами такой смеси
не наблюдается поверхности раздела. В
этом случае говорят, что данная смесь
является однофазной
(фаза
часть
системы отделенная от других частей
видимой поверхностью раздела). В пределах
одной фазы физические свойства компонентов
сохраняются постоянными. К гомогенным
системам
относятся истинные растворы (размер
частиц растворенного вещества соотносится
с размерами частиц растворителя и
составляет ≤10 -9 м).
Особенностью
гетерогенной
смеси
является то, что мы можем наблюдать
поверхность раздела между ее компонентами.
При переходе из одной фазы компонента
в другую его свойства резко изменяются.
Гетерогенные смеси иначе называются
дисперсные
системы. Дисперсные системы
состоят
из дисперсионной среды (растворитель,
непрерывная фаза) и дисперсной фазы
(растворенного вещества или прерывистой
фазы)
К
гетерогенным
смесям
относятся
дисперсные системы (размер частиц
растворенного вещества значительно
превышает размер частиц растворителя
и составляет ≥10 -9 м).
Смеси, в которых размер частиц вещества
составляет 10 -7
-10 -9
м, относятся к коллоидным системам.
К
дисперсным системам относятся:
Суспензии, смесь, состоящая из твердой
и жидкой фазы (обозначение Т/Ж; Т-
дисперсная фаза, Ж – дисперсионная
среда)
Эмульсии, смесь из 2-х и более несмешивающихся
жидкостей (обозначение – Ж/Ж. Дисперсная
фаза и дисперсионная среда жидкости
различающиеся по плотности и температурам
кипения).
Более
подробно данные системы будут рассмотрены
в теме растворы и дисперсные системы.
1.5. Методы разделения смесей
Традиционными
методами, которые используются в
лабораторной практике с целью разделения
смесей на отдельные компоненты, являются:
фильтрование,
декантация
(в
химической лабораторной практике и
химической технологии механическое
отделение твёрдой фазы дисперсной
системы (суспензии) от жидкой путём
сливания раствора с осадка),
разделение
с помощью делительной воронки,
центрифугирование,
выпаривание,
кристаллизация,
перегонка
(в том числе фракционная перегонка),
хроматография,
возгонка
и другие.
Фильтрование.
Для отделения жидкостей от взвешенных
в ней мелких твердых частиц применяют
фильтрование (рис.37)
,
т.е. процеживание жидкости через
мелкопористые материалы – фильтры
,
которые пропускают жидкость и задерживают
на своей поверхности твердые частицы.
Жидкость, прошедшая через фильтр и
освобожденная от находившихся в ней
твердых примесей, называется фильтратом
.
В
лабораторной практике часто применяют
гладкие
и складчатые бумажные
фильтры
(рис.38)
,
сделанные из непроклеенной фильтровальной
бумаги.
Для
фильтрования горячих растворов (например,
с целью перекристаллизации солей),
применяют специальную воронку
для горячего фильтрования
(рис.39)
с
электрическим или водяным обогревом).
Часто
применяют фильтрование
под вакуумом
.
Фильтрование под вакуумом используют
для ускорения фильтрования и более
полного освобождения твердой фазы от
жидкой. Для этой цели собирают прибор
для фильтрования под вакуумом (рис.40)
.
Он состоит из колбы
Бунзена, фарфоровой воронки Бюхнера,
предохранительной склянки и вакуум-насоса
(обычно водоструйного).
В
случае фильтрования суспензии
малорастворимой соли кристаллы последней
могут быть промыты дистиллированной
водой на воронке Бюхнера для удаления
с их поверхности исходного раствора.
Для этой цели используют промывалку
(рис.41)
.
Декантация
.
Жидкости могут быть отделены от
нерастворимых твердых частиц декантацией
(рис.42)
.
Этот метод можно применять, если твердое
вещество имеет большую плотность, чем
жидкость. Например, если речной песок
добавить в стакан с водой, то при
отстаивании он осядет на дно стакана,
потому что плотность песка больше, чем
воды. Тогда вода может быть отделена от
песка просто сливанием. Такой метод
отстаивания и последующего сливания
фильтрата и называется декантацией.
Центрифугирование.
Для
ускорения процесса отделения очень
мелких частиц, образующих в жидкости
устойчивые суспензии или эмульсии,
используют метод центрифугирования.
Этим методом можно разделить смеси
жидких и твердых веществ, различающихся
по плотности. Разделение проводится в
ручных
или электрических центрифугах (рис.43)
.
Разделение
двух несмешивающихся жидкостей,
имеющих
различную плотность и не образующих
устойчивых эмульсий,
можно осуществить с помощью делительной
воронки
(рис.44)
.
Так можно разделить, например, смесь
бензола и воды. Слой бензола (плотность
= 0,879 г/см 3)
располагается
над слоем воды, которая имеет большую
плотность (
= 1,0 г/см 3).
Открыв кран делительной воронки, можно
аккуратно слить нижний слой и отделить
одну жидкость от другой.
Выпаривание
(рис.45)
–
этот метод предусматривает удаление
растворителя, например, воды из раствора
в процессе нагревания его в выпарительной
фарфоровой чашке. При этом выпариваемая
жидкость удаляется, а растворенное
вещество остается в выпарительной
чашке.
Кристаллизация
– это процесс выделения кристаллов
твердого вещества при охлаждении
раствора, например, после его упаривания.
Следует иметь в виду, что при медленном
охлаждении раствора образуются крупные
кристаллы. При быстром охлаждении
(например, при охлаждении проточной
водой) образуются мелкие кристаллы.
Перегонка
— метод очистки вещества основанный на
испарении жидкости при нагревании с
последующей конденсацией образовавшихся
паров. Очистка воды от растворенных в
ней солей (или других веществ, например,
красящих) перегонкой называется
дистилляцией
,
а сама очищенная вода – дистиллированной.
Фракционная
перегонка (дистилляция)
(рис.46)
применяется для разделения смесей
жидкостей с различными температурами
кипения. Жидкость с меньшей температурой
кипения закипает быстрее и раньше
проходит через фракционную
колонку
(или
дефлегматор
).
Когда эта жидкость достигает верха
фракционной колонки, то попадает в
холодильник
,
охлаждается водой и через аллонж
собирается в приемник
(колбу или пробирку).
Фракционной
перегонкой можно разделить, например,
смесь этанола и воды. Температура кипения
этанола 78 0 С,
а воды 100 0 С.
Этанол испаряется легче и первым попадает
через холодильник в приемник.
Возгонка
–
метод
применяется для очистки веществ,
способных при нагревании переходить
из твердого состояния в газообразное,
минуя жидкое состояние. Далее пары
очищаемого вещества конденсируются, а
примеси, не способные возгоняться,
отделяются.
>> Чистые вещества и смеси. Отстаивание. Разделение смеси трех твердых веществ
Чистые вещества и смеси
Материал параграфа поможет вам:
> осознать, что абсолютно чистых веществ не существует;
> различать однородные и неоднородные смеси веществ;
> выяснить, в каких смесях физические свойства компонентов сохраняются, а в каких — нет;
> выбрать метод разделения смеси веществ
в зависимости от ее типа.
Чистые вещества и смеси.
Каждое вещество всегда содержит определенное количество примесей. Вещество, в котором почти нет примесей, называют чистым. С такими веществами работают
в научной лаборатории, школьном химическом кабинете. Заметим, что абсолютно чистых веществ не существует.
Каждое вещество, содержащееся в смеси, называют компонентом.
Смеси, в которых компоненты невозможно обнаружить наблюдением, называют однородными.
Большинство металлических сплавов — также однородные смеси. Например, в сплаве золота с медью (его используют для изготовления ювелирных украшений) отсутствуют красные частицы меди и желтые частицы золота.
Из материалов, которые являются однородными смесями веществ, изготовляют много предметов разнообразного назначения (рис. 27).
К однородным смесям принадлежат все смеси газов
, в том числе и воздух. Существует немало однородных смесей жидкостей.
Рис. 27. Предметы, изготовленные из однородных смесей
Такая смесь образуется при смешивании, например, спирта и воды.
Приведите свой пример однородной смеси.
Однородные смеси еще называют растворами, даже если они твердые или газообразные.
По некоторым физическим свойствам
однородные смеси отличаются от их компонентов. Так, сплав олова со свинцом, используемый для паяния, плавится при более низкой температуре, чем чистые металлы. Вода закипает при температуре 100 °С, а водный раствор соли — при более высокой температуре. Если воду охладить до температуры 0 °С, она начнет превращаться в лед. Раствор соли при этих условиях остается жидкостью (он замерзает при температуре ниже 0 °С). В этом можно убедиться зимой, когда дороги и тротуары, покрытые льдом, посыпают смесью соли с песком. Лед под действием соли плавится; образуется водный раствор соли, не замерзающий на слабом морозе. А песок нужен для того, чтобы дорога не была скользкой.
Рис. 28. Неоднородная смесь мела и воды
Вам известно, что мел не растворяется в воде. Если его порошок всыпать в стакан с водой, то в образовавшейся смеси всегда можно обнаружить частицы мела, которые видны невооруженным глазом или в микроскоп (рис. 28).
Смеси, в которых компоненты можно обнаружить наблюдением, называют неоднородными.
К неоднородным смесям (рис. 29) относятся большинство минералов, почва, строительные материалы, живые ткани, мутная вода, молоко и другие продукты питания, некоторые лекарственные и косметические средства.
Приведите свой пример неоднородной смеси.
В неоднородной смеси физические свойства компонентов сохраняются. Так, железные опилки
, смешанные с медными или алюминиевыми, не теряют способности притягиваться к магниту.
Рис. 29. Неоднородные смеси:
а — смесь воды и серы;
б — смесь растительного масла и воды;
в — смесь воздуха и воды
Вода в смеси с песком, мелом или глиной замерзает при температуре О 0C и закипает при 100 °С.
Некоторые виды неоднородных смесей имеют специальные названия: пена (например, пенопласт, мыльная пена), суспензия (смесь воды с небольшим количеством муки), эмульсия (молоко, хорошо взболтанные растительное масло с водой), аэрозоль (дым, туман).
В каких находятся компоненты в каждой названной смеси?
Материал, изложенный выше, обобщен в схеме 3.
Схема 3. Вещества и смеси
Часто возникает необходимость разделить смесь, чтобы получить ее компоненты или очистить вещество от примесей.
Существует много методов разделения смесей. Их выбирают, учитывая тип смеси, агрегатное состояние и различия в физических свойствах компонентов (схема 4). Некоторые методы вам известны из курса природоведения.
Схема 4. Методы разделения смесей
Объясните, благодаря каким свойствам компонентов возможно разделение каждой неоднородной смеси, указанной на схеме.
Рис. 30. Рабочий в распираторе
Рассмотрим, как используют некоторые методы
разделения смесей.
Процесс фильтрования лежит в основе работы респиратора — устройства, которое защищает легкие человека, работающего в сильно запыленном помещении. В респираторе имеются фильтры, препятствующие попаданию пыли в легкие (рис. 30). Простейший респиратор — повязка из нескольких слоев марли. Фильтр, извлекающий пыль из воздуха, есть и в пылесосе.
С помощью магнита в промышленности обогащают железную руду — магнетит.
Благодаря способности притягиваться к магниту руда отделяется от песка, глины, земли и др. Таким способом извлекают железо из промышленных и бытовых отходов.
Важным методом разделения однородных смесей жидкостей является перегонка, или дистилляция1. Этот метод позволяет очистить природную воду от примесей. Полученную чистую (дистиллированную) воду используют в научно-исследовательских лабораториях, в производстве веществ для современной техники, в медицине для приготовления лекарств.
1 Термин происходит от латинского слова distillatio — стекание каплями.
В промышленности перегонкой нефти (смесь многих веществ, преимущественно — жидкостей) получают бензин, керосин, дизельное горючее.
В лаборатории перегонку осуществляют на специальной установке (рис. 31). При нагревании смеси жидкостей сначала закипает вещество с наиболее низкой температурой кипения. Его пар выходит из сосуда, охлаждается, конденсируется1, и образовавшаяся жидкость стекает в приемник. Когда этого вещества уже не будет в смеси, температура начнет повышаться, и со временем закипает другой жидкий компонент. Нелетучие жидкости остаются в сосуде.
Рис. 31.Лабораторная установка для перегонки:
а — обычная;
1 — смесь жидкостей с разными температурами кипения;
2 — термометр;
3 — водяной холодильник;
4 — приемник
6 — упрощенная
Разделение различных смесей происходит и в природе. Из воздуха оседают частицы пыли, а во время дождя и снега — капельки воды, снежинки. В результате отстаивания мутная вода становится прозрачной. От нерастворимых веществ вода очищается и при прохождении через песок. После испарения воды на берегах лиманов остаются соли, которые были растворены в ней. Из воды, вытекающей из скважины, выделяются растворенные газы.
1 Термин происходит от латинского слова condensatio — сгущение, уплотнение.
Выводы
Каждое вещество содержит примеси. Чистым считают вещество, в котором примесей почти нет.
Смеси веществ бывают однородными и неоднородными. В однородной смеси компоненты невозможно обнаружить наблюдением, а в неоднородной смеси это возможно.
Некоторые физические свойства однородной смеси отличаются от свойств компонентов. В неоднородной смеси свойства компонентов сохраняются.
Неоднородные смеси веществ разделяют отстаиванием, фильтрованием, иногда — действием магнита, а однородные — выпариванием и перегонкой (дистилляцией).
?
29. Какие типы смесей существуют и чем они отличаются?
30. Запишите приведенные слова и словосочетания в соответствующие столбцы помещенной ниже таблицы: алюминий, пепел, газетная бумага, ртуть, воздух, йодная настойка, гранит, лед из чистой воды, углекислый газ, железобетон.
| Чистые вещества | Смеси | |
| однородные | неоднородные | |
31. Назовите несколько продуктов питания, которые являются растворами.
32. Какой популярный напиток в зависимости от способа приготовления бывает однородной или неоднородной смесью?
33. Можно ли водный раствор поваренной соли превратить в неоднород ную смесь? Если можно, то как это сделать?
34. Какие смеси можно разделить фильтрованием: а) смесь песка и глины; б) смесь спирта и медных опилок; в) смесь воды и бензина; г) смесь воды с кусочками пластмассы? Назовите вещества, которые останутся на фильтре.
35. Как бы вы разделили смесь: а) поваренной соли и мела; б) спирта и воды? Какие различия в свойствах веществ дают возможность использовать выбранный вами метод?
36. Продумайте эксперимент по разделению смеси поваренной соли, песка, железных и древесных опилок. Составьте его план, кратко опишите каждый этап эксперимента и расскажите об ожидаемых результатах.
Экспериментируем дома
Отстаивание
В два стакана налейте воды. В один стакан насыпьте 1/2 чайной ложки песка, а в другой — столько же крахмала. Одновременно перемешайте обе смеси. С одинаковой ли скоростью оседают частицы веществ в воде? Если нет, то какие частицы оседают быстрее и почему?
Свои наблюдения запишите в тетрадь.
Разделение смеси трех твердых веществ
Смешайте небольшие количества измельченного пенопласта, песка и поваренной соли.
Какие методы можно использовать для разделения этой смеси?
Разделите смесь 1 . Если необходимо нагревание, осуществляйте его очень осторожно.
Каждый этап эксперимента опишите в тетради.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Существуют ли абсолютно чистые вещества? Вещества абсолютно чистые, в составе которых нет ни единого постороннего атома или молекулы? В природе таких веществ не существует. Любое вещество содержит определенное количество примесей.
Даже хорошо очищенная вода не может считаться чистым веществом, так как в ней растворены кислород, углекислый газ, и другие газы, содержащиеся в воздухе. Все вещества в природе в том или ином виде являются смесями.
Если в веществе содержание посторонних веществ незначительно, то такие вещества условно считают чистыми.
Если из водопроводной воды в значительной мере удалить все растворенные в ней вещества, то такую воду можно считать чистым веществом. Растворимость газов воздуха в воде крайне мала и ею можно пренебречь.
Таким образом, все вещества и материалы в природе можно разделить на индивидуальные вещества и смеси веществ.
Представление о смесях и чистых веществах имели еще древнегреческие ученые. Согласно этим представлениям, чистое вещество состоит из частиц одного вида, а смеси состоят из различных частиц. Итак, чистое вещество состоит из одинаковых молекул, а смеси – из разных.
В смесях веществ свойства отдельных компонентов не меняются.
Смеси, в свою очередь, делят на однородные (гомогенные) и неоднородные (гетерогенные).
– смесь, в которой ее компоненты невозможно различить визуально
– смесь, в которой компоненты смеси можно различить визуально
Гомогенные смеси можно делить по агрегатному состоянию на твердые, жидкие и газообразные. Например, воздух – это гомогенная смесь различных газов. Гомогенными смесями являются сплавы металлов, растворы соли, сахара в воде.
Гетерогенные смеси могут быть различными. Рассмотрим два примера таких смесей. Первая смесь
– смесь муки и воды. В данной смеси, после ее перемешивания, частицы муки какое-то время равномерно распределены в воде. Такие смеси называют суспензиями.
Суспензия
– гетерогенная смесь, в которой частицы твердого вещества равномерно распределены в жидкости
Вторая смесь состоит из воды и подсолнечного масла. Данные жидкости не смешиваются друг с другом. Но если смесь энергично перемешать, то какое-то время капельки масла будут равномерно распределены в воде. Такие смеси называются эмульсиями.
Эмульсия
– гетерогенная смесь, в которой частицы одной жидкости равномерно распределены в другой
Гетерогенные смеси могут состоять и из компонентов, находящихся в одном агрегатном состоянии. Например, смесь песка и древесных опилок – гетерогенная, так как ее компоненты легко различить визуально.
Существует множество способов, при помощи которых смеси веществ можно разделить на отдельные компоненты.
Способы разделения смесей
Действие магнита (магнитная сепарация)
Если в состав смеси входят порошки металлов, обладающих магнитными свойствами, то при помощи магнита эти металлы можно извлечь из смеси. Магнитными свойствами обладают такие металлы как железо, кобальт, никель
. Необходимо просто рассыпать смесь по ровной поверхности и провести над ней магнитом. Частицы металла притянутся к магниту.
Отстаивание и декантация
Некоторые смеси можно разделить при помощи отстаивания и последующего сливания слоя жидкости с осевшего вещества (декантации). Данный способ основан на различной плотности веществ. Например, смесь древесных опилок и песка можно разделить при помощи данного метода. Смесь необходимо высыпать в стакан с водой. Тяжелые частицы песка осядут на дно, а легкие опилки будут плавать на поверхности воды. Осторожным сливанием верхнего слоя с опилками смесь будет разделена
Смесь двух твёрдых веществ, сильно различающихся по плотности, удобно разделять, пропуская через неё поток воды. Раньше так выделяли крупинки золота из измельчённой золотоносной породы. Золотоносный песок помещали на наклонный жёлоб, по которому пускали струю воды. Поток воды подхватывал и уносил пустую породу, а тяжёлые крупинки золота оседали на дне жёлоба.
Разделение смеси малорастворимых друг в друге жидкостей можно провести в делительной воронке. Например, смесь бензина и воды или подсолнечного масла и воды. Такие смеси быстро расслаиваются. При помощи делительной воронки нижний слой жидкости можно аккуратно слить, а верхний слой останется в воронке.
Фильтрование
Смеси, содержащие нерастворимые в воде вещества, можно разделить фильтрованием. В лаборатории для фильтрования используют стеклянную воронку, в которую вставлен фильтр — сложенный вчетверо круг фильтровальной бумаги. Фильтровальная бумага, в отличие от обычной, не содержит клеящих веществ, поэтому легко впитывает и пропускает жидкость. Размер пор в ней таков, что позволяет отделять от раствора частицы размером больше 0,01 мм.
Например, смесь из песка и поваренной соли следует всыпать в стакан с водой и хорошо перемешать стеклянной палочкой до полного растворения соли, песок при этом не растворится. Далее песок необходимо отделить от раствора соли, это можно сделать при помощи фильтрования. Фильтром будет служить специальная фильтровальная бумага.
После фильтрования раствора песок остается на бумажном фильтре, а раствор соли будет собран в стакане или колбе.
Фильтрованием легко очистить воду
или раствор от попавших туда пылинок и других загрязнений, а также отделить осадок от раствора.
В промышленности в качестве фильтров часто используют ткани. Например, на маслобойных заводах измельчённые семена подсолнечника оборачивают плотной суконной тканью и сжимают между стальными плитами.
Растительное масло проходит через ткань, а внутри остаётся твёрдая масса — жмых.
Выпаривание
Метод выпаривания
применяют для выделения растворителя из раствора, концентрирования раствора, кристаллизации растворенных веществ.
Раствор поваренной соли выливают в фарфоровую чашку, помещают в штативное кольцо и нагревают до полного испарения воды.
Перегонка
Способ разделения гомогенных смесей, основанный на различных температурах кипения веществ, называется перегонкой или дистилляцией.
Предположим, необходимо разделить смесь спирта и воды. Ни один из ранее рассмотренных способов не годится для разделения этой смеси.
Спирт и вода имеют различные температуры кипения. Так, вода кипит при +100°С а спирт при +78°С.
При нагревании такой смеси спирт закипит раньше и начнет испаряться. Пары спирта поступают в холодильник – трубку, охлаждаемую проточной водой. В холодильнике пары спирта конденсируются в жидкость и собираются в колбе-приемнике. Вода остается в реакционной колбе. Таким образом, можно отделить спирт от воды. Схема установки для перегонки, представлена на рисунке.
- В природе нет абсолютно чистых веществ
- Однородная (гомогенная) смесь
– смесь, в которой все ее компоненты находятся в одном агрегатном состоянии - Неоднородная (гетерогенная) смесь
– смесь, в которой компоненты смеси находятся в различных агрегатных состояниях - Суспензия
– гетерогенная смесь, в которой частицы твердого вещества равномерно распределены в жидкости - Эмульсия
– гетерогенная смесь, в которой частицы одной жидкости равномерно распределены в другой - Основные способы разделения смесей: действие магнита, декантация, фильтрование, выпаривание, перегонка, экстракция
В нашей статье мы рассмотрим, что такое чистые вещества и смеси, способы разделения смесей. В повседневной жизни их использует каждый из нас. А встречаются ли вообще в природе чистые вещества? И как отличить их от смесей?
Чистые вещества и смеси: способы разделения смесей
Чистыми называют вещества, которые содержат частицы только определенного вида. Ученые считают, что в природе их практически не существует, поскольку все они, хоть и в ничтожных долях, содержат примеси. Абсолютно все вещества также являются растворимыми в воде. Даже если погрузить в эту жидкость, к примеру, серебряное кольцо, ионы этого металла перейдут в раствор.
Признаком чистых веществ являются постоянство состава и физических свойств. В процессе их образования происходит изменение количества энергии. Причем она может как увеличиваться, так и уменьшаться. Разделить чистое вещество на отдельные составляющие можно только с помощью химической реакции. К примеру, только дисциллированная вода обладает типичной для этого вещества температурой кипения и замерзания, отсутствием вкуса и запаха. А разложить ее кислород и водород можно только путем электролиза.
А чем отличаются от чистых веществ их совокупности? Ответить на этот вопрос нам поможет химия. Способы разделения смесей являются физическими, поскольку они не приводят к изменению химического состава веществ. В отличие от чистых веществ, смеси имеют непостоянный состав и свойства, а разделить их можно физическими методами.
Что такое смесь
Смесью называют совокупность индивидуальных веществ. Ее примером является морская вода. В отличие от дисциллированной, она обладает горьким или соленым вкусом, кипит при более высокой, а замерзает при более низкой температуре. Способы разделения смесей веществ являются физическими. Так, из морской воды можно добыть чистую соль путем выпаривания и последующей кристаллизации.
Виды смесей
Если добавить в воду сахар, через некоторое время его частички растворятся и станут невидимыми. В результате их невозможно будет отличить невооруженным глазом. Такие смеси называют однородными, или гомогенными. Их примерами также являются воздух, бензин, бульон, духи, сладкая и соленая вода, сплав меди и алюминия. Как видите, могут находиться в разных агрегатных состояниях, но чаще всего встречаются жидкости. Их также называют растворами.
В неоднородных, или гетерогенных смесях можно различить частицы индивидуальных веществ. Железные и деревянные опилки, песок и поваренная соль являются их типичными примерами. Неоднородные смеси также называют взвесями. Среди них различают суспензии и эмульсии. В состав первых входит жидкость и твердое вещество. Так, эмульсией является смесь воды и песка. Эмульсией называют совокупность двух жидкостей с разной плотностью.
Существуют неоднородные смеси и со специальными названиями. Так, примером пены является пенопласт, а к аэрозолям относятся туман, дым, дезодоранты, освежители воздуха, антистатики.
Способы разделения смесей
Безусловно, многие смеси обладают более ценными свойствами, чем отдельно взятые индивидуальные вещества, входящие в их состав. Но даже в быту возникают ситуации, когда их необходимо разделить. А в промышленности на этом процессе основаны целые производства. К примеру, из нефти в результате ее переработки получают бензин, газойль, керосин, мазут, соляровое и машинное масло, ракетное топливо, ацетилен и бензол. Согласитесь, выгоднее использовать эти продукты, чем бездумно сжигать нефть.
Теперь давайте разберемся, существует ли такое понятие, как химические способы разделения смесей. Допустим, из водного раствора соли нам необходимо получить чистые вещества. Для этого смесь необходимо нагреть. В результате вода превратится в пар, а соль кристаллизируется. Но при этом не произойдет превращения одних веществ в другие. Это значит, что основой данного процесса являются физические явления.
Способы разделения смесей зависят от агрегатного состояния, способности к растворимости, разнице в температуре кипения, плотности и состава ее компонентов. Рассмотрим каждый из них более подробно на конкретных примерах.
Фильтрование
Этот способ разделения подходит для смесей, в состав которых входят жидкость и нерастворимое в нем твердое вещество. К примеру, вода и речной песок. Эту смесь необходимо пропустить через фильтр. В результате чистая вода свободно пройдет через него, а песок останется.
Отстаивание
Некоторые способы разделения смесей основаны на действии силы тяжести. Таким образом на можно разложить суспензии и эмульсии. Если в воду попало растительное масло, такую смесь сначала необходимо взболтать. Потом оставьте ее на некоторое время. В результате вода окажется на дне сосуда, а масло в виде пленки будет покрывать ее.
В лабораторных условиях для отстаивания используют В результате ее работы более плотная жидкость сливается в сосуд, а легкая остается.
Отстаивание характеризуется низкой скоростью протекания процесса. Необходимо определенное время, чтобы сформировался осадок. В промышленных условиях этот способ осуществляют в специальных конструкциях, которые называются отстойники.
Действие магнитом
Если в состав смеси входит металл, то ее можно разделить при помощи магнита. К примеру, отделить железные и деревянные опилки. Но все ли металлы обладают такими свойствами? Вовсе нет. Для этого способа подойдут только смеси, содержащие ферромагнетики. Кроме железа к ним относятся никель, кобальт, гадолиний, тербий, диспрозий, гольмий, эрбий.
Дистилляция
Это название в переводе с латинского языка означает «стекание каплями». Дистилляция представляет способы разделения смесей, основанные на разнице в температурах кипения веществ. Таким образом, даже в домашних условиях можно разделить спирт и воду. Первое вещество начинает испаряться уже при температуре 78 градусов по Цельсию. Касаясь холодной поверхности пары спирта конденсируются, переходя в жидкое состояние.
В промышленности таким способом получают продукты переработки нефти, душистые вещества, чистые металлы.
Выпаривание и кристаллизация
Эти способы разделения смесей подходят для жидких растворов. Вещества, которые входят в их состав, отличаются температурой кипения. Таким образом, можно получить кристаллы соли или сахара из воды, в которой они растворены. Для этого растворы нагревают и выпаривают до насыщеного состояния. В этом случае кристаллы осаждаются. Если же необходимо получить чистую воду, тогда раствор доводят до кипения с последующей конденсацией паров на более холодной поверхности.
Способы разделения газовых смесей
Газообразные смеси разделяют лабораторными и промышленными способами, поскольку этот процесс требует наличия специального оборудования. Сырьем природного происхождения является воздух, коксовый, генераторный, попутный и природный газ, представляющий собой совокупность углеводородов.
Физические способы разделения смесей, находящихся в газообразном состоянии следующие:
- Конденсация — это процесс постепенного охлаждения смеси, в ходе которого происходит конденсация ее составляющих. При этом в первую очередь в жидкое состоние переходят высококипящие вещества, которые собираются в сепараторах. Таким образом получают водород из а также отделяют аммиак из непрореагировавшей части смеси.
- Сорбирование — это поглощение одних веществ другими. Этот процесс имеет противоположные составляющие, между которыми в ходе реакции устанавливается равновесие. Для прямого и обратного процесса необходимы различные условия. В первом случае это сочетание высокого давления и низкой температуры. Такой процесс называют сорбцией. В обратном случае используют противоположные условия: низкое давление при высокой температуре.
- Мембранное разделение — способ, при котором используют свойство полупроницаемых перегородок избирательно пропускать молекулы различных веществ.
- Дефлегмация — процесс конденсации высококипящих частей смесей в результате их охлаждения. При этом температура перехода в жидкое состояние отдельных компонентов должна отличаться в значительной степени.
Хроматография
Название этого способа можно перевести как «пишу цветом». Представьте, что в воду добавлены чернила. Если опустить в такую смесь конец фильтровальной бумаги, она начнет впитываться. При этом вода будет поглощаться быстрее чернил, что связано с разной степенью сорбируемости этих веществ. Хроматография является не только способом разделения смесей, но и методом изучения таких свойств веществ, как диффузия и растворимость.
Итак, мы познакомились с такими понятиями, как «чистые вещества» и «смеси». Первые представляют собой элементы или соединения, состоящие только из частиц определенного вида. Их примерами являются соль, сахар, дистиллированная вода. Смеси — это совокупность индивидуальных веществ. Для их разделения используют ряд методов. Способ их разделения зависит от физических свойств его составляющих. К основным из них относятся отстаивание, выпаривание, кристаллизация, фильтрование, дистилляция, действие магнитом и хроматография.
Веществ и смесей | Введение в химию
Цель обучения
- Отличить химические вещества от смесей
Ключевые моменты
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси представляют собой физически комбинированные структуры, которые можно разделить на исходные компоненты.
- Химическое вещество состоит из одного типа атома или молекулы.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь — это смесь двух или более химических веществ, в которой можно визуально различить различные компоненты.
- Гомогенная смесь — это смесь, состав которой однороден, и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, включая дистилляцию, фильтрацию, выпаривание и хроматографию.Для этого разделения вещество может находиться в одной или двух разных фазах.
Условия
- веществоФорма вещества, имеющая постоянный химический состав и характерные свойства. Он состоит из одного типа атома или молекулы.
- элемент: Химическое вещество, состоящее из определенного типа атома, которое не может быть расщеплено или преобразовано с помощью химической реакции.
- смесь: То, что состоит из различных, несвязанных элементов или молекул.
Химические вещества
В химии химическое вещество — это форма вещества, имеющая постоянный химический состав и характерные свойства. Его нельзя разделить на компоненты без разрыва химических связей. Химические вещества могут быть твердыми, жидкостями, газами или плазмой. Изменения температуры или давления могут вызывать переход веществ между различными фазами вещества.
Элемент — это химическое вещество, состоящее из определенного типа атома и, следовательно, не может быть расщеплено или преобразовано в результате химической реакции в другой элемент.Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, состоящее из определенного набора молекул или ионов, которые химически связаны. Два или более элемента, объединенных в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку.Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями. Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичный пример химического вещества — чистая вода; он всегда имеет одни и те же свойства и одинаковое отношение водорода к кислороду, независимо от того, извлечен ли он из реки или изготовлен в лаборатории.Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза). Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Химические смеси
Смесь — это система материалов, состоящая из двух или более различных веществ, которые смешаны, но не соединены химически. Смесь относится к физическому сочетанию двух или более веществ, в котором сохраняются идентичности отдельных веществ. Смеси имеют форму сплавов, растворов, суспензий и коллоидов.
Встречающиеся в природе кристаллы серы Сера встречается в природе в виде элементарной серы, сульфида и сульфатных минералов, а также в виде сероводорода.Это месторождение полезных ископаемых состоит из смеси веществ.
Гетерогенные смеси
Гетерогенная смесь — это смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты можно визуально различить и легко разделить физическими средствами. Примеры включают:
- смеси песка и воды
- Смеси песка и железной опилки
- каменный конгломерат
- вода и масло
- салат
- трейл микс
- смеси золотого порошка и серебряного порошка
Interactive: Oil and Water Изучите взаимодействия, которые заставляют воду и масло отделяться от смеси.
Гомогенные смеси
Гомогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой невозможно различить визуально. Состав однородных смесей постоянный. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба отбора проб.В достаточно малом масштабе любую смесь можно назвать гетерогенной, потому что образец может быть размером с одну молекулу. На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.
Физические свойства смеси, такие как температура плавления, могут отличаться от свойств ее отдельных компонентов. Некоторые смеси можно разделить на компоненты физическими (механическими или термическими) способами.
Химия 1.2 Classification Matter (Part 1 of 3) — YouTube Введение в классификацию вещества как вещества или смеси веществ. Смеси описываются как гетерогенные или гомогенные. Описываются три распространенных метода разделения. Часть 2 из 3: http://www.youtube.com/watch?v=SoFywULNF3s (Вещества) Часть 3 из 3: http://www.youtube.com/watch?v= LXMyN9kco7E (Диаграммы частиц)
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Учебное пособие по химии чистых веществ и смесей
Сноски
1.Область, в которой все физические и химические свойства одинаковы, называется фазой.
Чистое вещество состоит только из одной фазы.
Данная фаза может быть твердой, жидкой или газообразной.
2. Гомогенная смесь состоит из одной фазы.
Поскольку газы смешиваются полностью, любая смесь газов будет состоять из одной фазы и будет однородной.
Растворимая соль, растворенная в жидкой воде для получения водного раствора соли, также состоит из единственной фазы.
Растворимая жидкость, такая как этанол, растворенная в жидкой воде, также состоит только из одной фазы.
3. Гетерогенная смесь состоит более чем из одной фазы.
4. H 2 O — это молекулярная формула воды, она говорит нам, что в каждой молекуле воды присутствуют 2 атома водорода и 1 атом кислорода.
Вы можете узнать больше в учебнике по молекулярным формулам.
5. Сульфид железа — это название, данное соединению, содержащему 1 «атом» железа и 1 «атом» серы, в зависимости от его состава.
Вы можете назвать это бинарным неорганическим ионным соединением (солью), и в этом случае предпочтительным названием IUPAC является сульфид железа (2+).
Старое название того же соединения по ИЮПАК — сульфид железа (II) (или сульфид железа (II)).
Еще более древнее название того же соединения — сульфид железа (или сульфид железа).
6. Предпочтительное написание ИЮПАК для элемента с химическим символом S — это сера, а не сера.
Вы все еще можете найти старое написание слова «сера», используемое для обозначения элемента сера.
7. Атомы серы могут располагаться по-разному.
Вы можете узнать больше об этом в руководстве по аллотропам.
8. Термин жидкость в химии относится к состоянию (или фазе) вещества, в котором все «частицы» (например, молекулы) идентичны.
Следовательно, жидкость по определению является чистым веществом.
В обычном обиходе люди называют многие типы смесей «жидкостями», например, ликер в стакане нехимик может называть жидкостью, но химик думает об этом как о смеси, известной как водный раствор, потому что В воде растворено много веществ (аква), которые придают ей аромат и цвет.
Самый общий термин для текущего вещества — «жидкость». Жидкость — это жидкость, водный раствор — это жидкость, а газы — это жидкости.
9. Кислород также может существовать в другой форме, известной как озон, в которой 3 атома кислорода химически связаны друг с другом (O 3 ).
O 2 и O 3 известны как аллотропы кислорода.
10. Это НЕ исчерпывающий список методов разделения. Вы также можете прочитать о некоторых методах, которые химики используют для отделения веществ от смесей, в следующих руководствах AUS-e-TUTE:
Хроматография, электрофорез и масс-спектроскопия
И существует множество методов, используемых в коммерческих целях для отделения металлов от руд.Возможно, вы захотите прочитать следующие уроки AUS-e-TUTE по извлечению металлов:
Концепции извлечения металлов, восстановительный углеродный метод извлечения металлов, извлечение меди плавлением, электролитическое извлечение алюминия, электролитическое извлечение натрия, электрохимическое извлечение меди
11. Золотые самородки могут быть достаточно большими, чтобы их можно было разглядеть на окружающей земле. Найденный подобный золотой самородок привел к созданию огромных золотых приисков Калгурли в Западной Австралии.
Подробнее об этом можно прочитать в декабрьском выпуске AUS-e-NEWS за 2012 год.
12. Строго говоря, это свойство следует называть ферромагнетизмом.
Ферромагнетизм относится к сильному притяжению к магнитному полю и проявляется элементами железа (Fe), кобальта (Co) и никеля (Ni) в твердом состоянии.
Обычно термин «магнетизм» относится к «ферромагнетизму».
Есть и другие виды магнестизма:
⚛ парамагнетизм, вещества с неспаренными электронами испытывают слабое притяжение к магнитному полю
⚛ диамагнетизм, очень слабое отталкивание от магнитного поля, которое испытывает вся материя
13.Одно время считалось, что заболевание Гуамское слабоумие вызывается мукой, приготовленной из токсичных семян саговника.
Подробнее об этом можно прочитать в сентябрьском номере AUS-e-NEWS за 2017 год.
14. Обычно хлорид натрия (NaCl) называют солью или поваренной солью.
Для химика хлорид натрия — всего лишь один пример соли.
В химии соли — это соединения, состоящие из катионов (положительно заряженные ионы) и анионов (отрицательно заряженные ионы), которые удерживаются вместе в трехмерной решетке с помощью электростатических сил притяжения (ионные связи).Таким образом, соль представляет собой ионное соединение, состоящее из двух ионов, бинарное ионное соединение.
15. Солнечное производство испарительной соли подробно обсуждалось в сентябрьском выпуске AUS-e-NEWS за 2016 год.
16. Когда вещество растворяется в воде, полученная смесь называется водным раствором. Количество вещества, растворенного в данном объеме воды, называется концентрацией раствора.
Подробнее о растворах и концентрации можно прочитать в Руководстве по концепциям решений.
Учебное пособие по химии бинарных сплавов
Ключевые понятия
- В чистом металлическом твердом теле атомы расположены в правильной кристаллической решетке.
- Сплав — это смесь металла с одним или несколькими другими элементами.
- Бинарный сплав состоит из двух элементов. 1
- Однородный бинарный сплав 2 представляет собой твердый раствор:
Первичный элемент представляет собой металл и называется растворителем 3 .
Вторичный элемент называется растворенным веществом.
- Гомогенный бинарный сплав можно классифицировать как замещающий или внедренный:
Тип сплава Относительный размер атомов Описание Пример Замещающий растворенных веществ и прибл .; растворитель Растворенные атомы замещают атомы растворителя в решетке. углеродистая сталь Межстраничное растворенное вещество <растворитель Атомы растворенных веществ занимают «дыры» (пустоты) в решетке металла растворителя. бронза, латунь - Сплав проявляет металлические свойства.
- Межузельные и замещающие сплавы тверже, чем чистый металлический растворитель.
Теория
В образце твердого чистого металла атомы металла расположены в правильной трехмерной кристаллической решетке 4 .
Мы можем изобразить один слой этой металлической решетки, как показано ниже:
| Каждый черный кружок представляет собой двумерное представление сферы. Каждая сфера представляет собой атом одного и того же металлического элемента. |
Эти атомы способны «перекатываться» друг с другом, делая чистый металл пластичным, пластичным и довольно мягким.
Такие металлы, как чистое железо, медь, олово, цинк, золото и свинец, довольно мягкие.Легирование, смешивание этих металлов с другим элементом — это способ сделать их более твердыми и, следовательно, более полезными.
Обратите внимание, что между атомами металла в решетке есть промежутки или дыры:
| Эти промежутки или отверстия в решетке называются пустотами. |
Один из способов образования твердого раствора, гомогенного сплава для этого металла, состоит в том, чтобы атомы другого элемента занимали некоторые из этих отверстий (пустот):
| Черные кружки представляют собой исходные атомы металла, составляющие решетку. Красные кружки представляют атомы другого элемента, вставленные в промежутки. Обратите внимание, что атомы, занимающие междоузлия, должны быть намного меньше, чем атомы металла, составляющие исходную решетку. |
Этот тип сплава известен как «сплав внедрения», потому что более мелкие атомы входят в «дыры» (пустоты) в существующей металлической решетке.
Промежуточные элементы часто представляют собой неметаллы, такие как водород, бор, углерод, азот, кислород и кремний.
Эффект от того, что эти маленькие атомы занимают пустоты, заключается в том, что большие атомы металла больше не могут так легко катиться друг по другу при приложении напряжения, то есть сплав будет более жестким, менее податливым и менее пластичным, чем оригинальный чистый металл.
Есть еще один способ, которым металл может образовывать гомогенный твердый раствор с другим элементом, атомы металла в решетке могут быть заменены или замещены атомами другого элемента:
| Черные кружки представляют собой исходные атомы металла, составляющие решетку. Красные кружки представляют собой атомы другого элемента, которые заменили некоторые из исходных атомов металла. Обратите внимание, что эти замещенные атомы имеют такой же размер, что и атомы металла, составляющие исходную решетку. |
Этот тип сплава известен как «сплав замещения», то есть в металлической решетке атомы другого элемента были замещены атомами аналогичного размера.
Обычно атомные радиусы двух типов атомов должны находиться в пределах примерно 15% друг от друга, чтобы они не влияли на общую кристаллическую структуру, а это означает, что растворенные атомы, скорее всего, относятся к металлам.
Несколько иной размер этих растворенных атомов вызывает деформацию в решетке, которая усиливает решетку, делая полученный твердый сплав более жестким, менее пластичным, менее пластичным, но имеющим такую же плотность, что и исходная решетка чистого металла.
Углеродистая сталь: межузельный сплав
Чистое железо слишком мягкое, чтобы быть полезным.Один из способов сделать железо более твердым — добавить небольшое количество углерода по массе. Полученный сплав известен как углеродистая сталь.
Атомы углерода меньше атомов железа, как показано в таблице ниже:
| атом | радиус 5 / Å | вылет / м | передаточное число радиуса | объем 6 / м 3 | объемное соотношение | |
|---|---|---|---|---|---|---|
| углерод | 0.75 | 7,5 × 10 -11 | 0,60 | 1,8 × 10 -30 | 0,2 | |
| утюг | 1,24 | 1,24 × 10 -10 | 1 | 8,0 × 10 -30 | 1 |
Радиус атома углерода составляет всего 60% от радиуса атома железа, то есть радиус атома углерода немногим больше половины радиуса атома железа.
Это означает, что объем пространства, занимаемого атомом углерода, составляет всего 20% от объема пространства, занимаемого атомом железа.
Поскольку атом углерода намного меньше атома железа, атомы углерода могут занимать «дыры», промежутки в решетке атомов железа.
Атомы углерода называются межузельными атомами, в данном случае межузельными атомами углерода, и показаны красными кружками на диаграмме справа, а атомы железа показаны большими черными кружками.
В твердом растворе углеродистой стали железо является растворителем, а углерод — растворенным веществом.
Углеродистая сталь производится путем добавления примерно 1% углерода к железу.
Другими словами, каждые 100 г углеродистой стали содержат 1 г углерода и 99 г железа.
| Состав 100 г углеродистой стали | ||
|---|---|---|
| элемент | % | масса (г) =% × масса стали (г) |
| углерод | 1% | 1% × 100 = 1 / 100 × 100 = 1 г |
| утюг | 99% | 99% × 100 = 99 / 100 × 100 = 99 г |
Так как мы знаем массу углерода и железа, составляющих образец углеродистой стали, мы можем вычислить соотношение атомов углерода и железа, присутствующих в решетке.
Предположим, у нас есть 100-граммовый образец углеродистой стали:
| м / г | M r / г моль -1 | н / моль n = м ÷ M r | N / атомы N = n × N A | соотношение атомов | |
|---|---|---|---|---|---|
| углерод | 1,00 | 12,01 | 1.00 ÷ 12,08 = 0,0833 | 0,0833 × 6,02 × 10 23 = 5,01 × 10 22 | (5,01 × 10 22 ) ÷ (5,01 × 10 22 ) = 1 |
| утюг | 99,00 | 55,85 | 99,00 ÷ 55,85 = 1,773 | 1,773 × 6,02 × 10 23 = 1,067 × 10 24 | (1,067 × 10 24 ) ÷ (5.01 × 10 22 ) = 21,30 |
Отношение атомов углерода к атомам железа составляет примерно 1:21.
То есть на каждый 21 атом железа в решетке приходится 1 атом углерода.
Межузельные атомы углерода делают решетку металла более жесткой, уменьшая пластичность и пластичность.
Углеродистая сталь намного тверже железа.
Бронза: замещающий сплав
Медный век (3200-2300 гг. До н.э.C.) назван так из-за того, что из-за того, что из меди все чаще появляются человеческие артефакты.
Но медь — мягкий металл, поэтому она легко подвергается вмятинам и коррозии. Один из способов сделать медь более твердой и устойчивой к коррозии — это добавить олово, и этот сплав известен как бронза.
Бронза была впервые произведена людьми около 5000 лет назад, что сделало ее первым искусственным сплавом и дало название бронзовому веку (3200-1000 до н.э.).
В таблице ниже сравниваются размеры атомов олова и меди:
| атом | радиус / Å | вылет / м | передаточное число радиуса | объем / м 3 | объемное соотношение | |
|---|---|---|---|---|---|---|
| банка | 1.4 | 1,40 × 10 -10 | 1,15 | 1,15 × 10 -29 | 1,5 | |
| медь | 1,22 | 1,22 × 10 -10 | 1 | 7,6 × 10 -30 | 1 |
Из таблицы видно, что радиус атома олова равен 1.В 15 раз больше радиуса атома меди, то есть радиус атома олова лишь немного больше радиуса атома меди.
Это означает, что объем пространства, занимаемого атомом олова, также немного больше (в 1,5 раза), чем объем пространства, занимаемого атомом меди.
Поскольку атомы олова и меди имеют одинаковый размер, атомы олова могут замещать некоторые атомы меди в металлической решетке.
На диаграмме справа атомы меди представлены черными кружками, а красные кружки представляют атомы олова, которые заменили некоторые из атомов меди.
В твердом растворе бронзы медь является растворителем, а олово — растворенным веществом.
Бронза — это сплав, состоящий из 70-90% меди и 30-10% олова.
Состав бронзы из оружейного металла представлен ниже:
| Элемент | % по массе | элемент массы =% и умноженный на массу бронзы Для 100 г образца бронзы: |
|---|---|---|
| банка | 10% | 10 / 100 × 100 = 10 г |
| медь | 90% | 90 / 100 × 100 = 90 г |
Мы можем использовать эти данные для расчета отношения атомов олова к меди в бронзе из пушечного металла:
| м / г | M r / г моль -1 | н / моль n = м ÷ M r | N / атомы N = n × N A | соотношение атомов | |
|---|---|---|---|---|---|
| банка | 10.00 | 118,7 | 10,00 ÷ 118,7 = 0,08425 | 0,08425 × 6,02 × 10 23 = 5,072 × 10 22 | (5,072 × 10 22 ) ÷ (5,072 × 10 22 ) = 1 |
| медь | 90,00 | 63,55 | 90,00 ÷ 63,55 = 1,416 | 1,416 × 6,02 × 10 23 = 8.526 × 10 23 | (8,526 × 10 23 ) ÷ (5,072 × 10 22 ) = 16,81 |
Отношение атомов олова к меди составляет примерно 1:17.
По сравнению с исходной решеткой из чистой меди, только 1 из каждых 18 атомов меди был замещен атомом олова.
Мы можем оценить влияние этого на плотность сплава.
Рассмотрим 100 г бронзы оружейного металла.Из них 10 г олова, 90 г — меди. Плотность чистого олова и чистого известна:
| элемент | плотность / г см -3 |
|---|---|
| банка | 7,31 |
| медь | 8,96 |
Поскольку плотность = масса (г) ÷ объем (см 3 ), мы можем изменить это уравнение, чтобы найти объем (см 3 ):
| плотность | = | масса объем |
| умножьте обе части уравнения на объем | ||
| плотность × объем | = | масса × |
| , что дает | ||
| плотность × объем | = | масса |
| разделите обе части уравнения на плотность | ||
| | = | масса плотность |
| так | ||
| объем | = | масса плотность |
Теперь мы можем рассчитать объем пространства, занимаемого 10 г олова и 90 г меди в бронзовом сплаве 7 :
| элемент | плотность / г см -3 | масса / г | объем / см 3 (= масса / плотность) |
|---|---|---|---|
| банка | 7.31 | 10 | 10 ÷ 7,31 = 1,4 |
| медь | 8,96 | 90 | 90 ÷ 8,96 = 10 |
Затем можно рассчитать плотность сплава:
| плотность сплава = | масса сплава объем сплава |
| плотность сплава = | масса меди + масса олова объем меди + объем олова |
| плотность сплава = | 10 + 90 1.4 + 10 |
| плотность сплава = | 100 11,4 |
| плотность сплава = | 8,8 г см -3 |
Мы видим, что плотность бронзы из оружейного металла лишь немного меньше плотности чистой меди.
Мы обнаружили, что есть другие физические свойства сплава, такие как температура плавления, которые находятся где-то между одинаковыми свойствами для каждого из чистых металлов:
| Вещество | точка плавления / ° C |
|---|---|
| банка | 232 |
| медь | 1803 |
| бронза | 950 |
Заменяя некоторые атомы меди на олово в решетке, мы получаем сплав, бронзу, которая тверже меди и имеет более низкую плотность и температуру плавления, чем медь, что облегчает литье.
Поскольку олово и медь являются металлами, металлические связи удерживают решетку вместе, поэтому сплав продолжает проявлять типичные металлические свойства — пластичность и податливость.
Бронза обычно окисляется только поверхностно, то есть атомы меди окисляются до оксида меди, который образует защитный слой на поверхности, предотвращающий дальнейшее окисление.
По этой причине, а также из-за того, что бронзу легко лить, из нее изготавливали статуи, монеты, колокольчики и тарелки.Бронза также довольно устойчива к коррозии морской водой, поэтому ее до сих пор используют для изготовления гребных винтов.
Бронза также используется для подшипников, потому что у нее очень низкое трение металла о металл, например, размещение небольших бронзовых шариков между двумя движущимися стальными частями уменьшит трение между поверхностями, что снижает износ стальных деталей.
Латунь: замещающий сплав
Еще один способ сделать мягкий медный металл более твердым — это добавить цинк.Сплав, состоящий из меди и небольшого количества цинка, известен как латунь.
Атомы меди и цинка имеют одинаковые размеры:
| атом | радиус / Å | вылет / м | передаточное число радиуса | объем / м 3 | объемное соотношение | |
|---|---|---|---|---|---|---|
| цинк | 1.20 | 1,20 × 10 -10 | 0,98 | 7,24 × 10 -30 | 0,95 | |
| медь | 1,22 | 1,22 × 10 -10 | 1 | 7,61 × 10 -30 | 1 |
Из таблицы видим, что радиус атома цинка равен 0.В 98 раз больше радиуса атома меди, то есть атом цинка имеет лишь немного меньший радиус, чем атом меди.
Объем пространства, занимаемого атомом цинка, в 0,95 раза больше объема пространства, занимаемого атомом меди, то есть два атома занимают одинаковый объем пространства.
Следовательно, атомы цинка могут замещать некоторые атомы меди в металлической решетке.
На схеме справа атомы меди показаны черными кружками, а красные кружки представляют атомы цинка.
В твердом растворе латуни растворителем является медь, а растворенным веществом — цинк.
Состав обычной желтой латуни представлен ниже:
| Элемент | % по массе | m (элемент) =% & times m (латунь) Для 100 г образца латуни: |
|---|---|---|
| медь | 67% | 67 / 100 × 100 = 67 г |
| цинк | 33% | 33 / 100 × 100 = 33 г |
Мы можем использовать эти данные для расчета отношения атомов цинка к меди в обычной желтой латуни:
| м / г | M r / г моль -1 | н / моль n = м ÷ M r | N / атомы N = n × N A | соотношение атомов | |
|---|---|---|---|---|---|
| цинк | 33.00 | 65,38 | 33,00 ÷ 65,38 = 0,5047 | 0,5047 × 6,02 × 10 23 = 3,04 × 10 23 | (3,04 × 10 23 ) ÷ (3,04 × 10 23 ) = 1 |
| медь | 67,00 | 63,55 | 67,00 ÷ 63,55 = 1,0543 | 1,0543 × 6,02 × 10 23 = 6.35 × 10 23 | (6,35 × 10 23 ) ÷ (3,04 × 10 23 ) = 2,1 |
Соотношение атомов цинка и меди составляет примерно 1: 2.
То есть на 1 атом цинка приходится 2 атома меди, или, другими словами, одна треть всех атомов в решетке — это атомы цинка, а другие две трети — атомы меди.
Мы можем оценить влияние этого на плотность сплава, рассчитав объем пространства, занимаемого 33 г цинка и 67 г меди в латунном сплаве:
| элемент | плотность / г см -3 | масса / г | объем / см 3 (= масса / плотность) |
|---|---|---|---|
| цинк | 7.13 | 33 | 33 ÷ 7,13 = 4,63 |
| медь | 8,96 | 67 | 67 ÷ 8,96 = 7,48 |
Затем можно рассчитать плотность сплава:
| плотность сплава = | масса сплава объем сплава |
| плотность сплава = | масса меди + масса цинка объем меди + объем цинка |
| плотность сплава = | 33 + 67 4.63 + 7,48 |
| плотность сплава = | 100 12,11 |
| плотность сплава = | 8,3 г см -3 |
Плотность обычной желтой латуни находится между цинком и медью.
Мы обнаружили, что есть другие физические свойства сплава, такие как температура плавления, которые находятся где-то между одинаковыми свойствами для каждого из чистых металлов:
| Вещество | точка плавления / ° C |
|---|---|
| цинк | 420 |
| медь | 1803 |
| латунь | 900 |
Путем добавления цинка в решетку меди мы создали сплав, который менее плотен, чем медь, и имеет более низкую температуру плавления, чем медь, что облегчает литье, чем медь.
Латунь более пластична, чем цинк или бронза (сплав меди и олова), что означает, что ее можно раскалывать в листы и сгибать в разные формы, что делает ее идеальной для использования в музыкальных инструментах.
Чистая медь мягкая, чистый цинк тоже мягкий, но латунный сплав тверже, чем медь или цинк.
Поскольку латунь — это привлекательный сплав с блестящим золотым внешним видом и низким трением металла о металл, она использовалась в замках, механизмах, клапанах и гильзах для боеприпасов.
1 Сплавы могут состоять более чем из 2 элементов. Тройной сплав состоит из трех элементов, четвертичный сплав состоит из 4 элементов, пятеричный сплав состоит из 5 элементов.
2 Гомогенный раствор металла будет иметь ту же структуру кристаллической решетки, что и один из элементов, составляющих сплав.
Сплав не обязательно должен быть однородным.
Если сплав имеет кристаллическую решетку, отличную от кристаллической решетки элементов, составляющих сплав, то он называется интерметаллическим.Если сплав вообще не имеет регулярной кристаллической структуры, его называют гетерогенным, например, припой, состоящий примерно на 50% из свинца, а на 50% из олова, является гетерогенным сплавом.
3 Первичный металл также может называться основой или матрицей.
4 Мы собираемся игнорировать природу этой решетки во время этого обсуждения.
Приведено представление для наиболее компактной упаковки атомов в 2-х измерениях.
5 Ковалентные радиусы используются в этом обсуждении.
Атомный радиус обычно измеряется в ангстремах (Å).
1 Å = 1 × 10 -10 м
6 Предполагая, что атомы сферические, V = 4 / 3 πr 3
7 Мы предполагаем аддитивность объемов для выполнения этого расчета.
Примеры смесей
Смеси повсюду.Определение смеси — это комбинация разных вещей, которые не связаны химически. Например, когда мы печем торт, это результат смеси яиц, муки, сахара и других ингредиентов. Смеси также могут быть намного проще.
Каждый раз, когда два или более элемента объединяются, образуется смесь. Иногда разные части смеси можно разделить на отдельные объекты. В других случаях они женаты до тех пор, пока существуют. Примером смеси является добавление листового чая в горячую воду, в результате чего получается простая смесь, которую мы называем чаем.Давайте рассмотрим другие примеры смесей.
Обычные пищевые смеси
Большая часть еды, которую мы едим, представляет собой комбинацию разных продуктов. Редко мы едим только один ингредиент. Например, мы можем съесть обычную курицу, но почему бы не смешать ее с небольшим количеством приправ? Вот еще несколько примеров смесей, связанных с одним из любимых занятий американцев: едой.
- Масло и вода
- Лимонный сок и чай
- Мед и чай
- Молоко и шоколад
- Кофе и сливки
- Сливки и сахар
- Мука и масло
- Зерновые и молоко
- Овсяные хлопья и
- изюм 9000 и молоко
- Апельсиновый сок и шампанское
- Сахар и вода
- Сахар и чай
- Тонизирующая вода и сок лайма
- Сода и ванильный сироп
Пищевые смеси часто представляют собой неоднородные смеси.Гетерогенная смесь такова, что компоненты могут быть отделены друг от друга. Миска Cheerios, например, неоднородна, потому что вы можете буквально вытащить отдельные кусочки хлопьев из молока.
Другие распространенные смеси
Помимо того, что мы едим, наша среда полна других смесей. Каждый раз, зажигая ароматическую свечу, вы наполняете воздух ароматами, создавая новую смесь в окружающей среде. Вот еще несколько примеров:
- Дым и туман (Смог)
- Грязь и вода (Грязь)
- Песок, вода и гравий (Цемент)
- Вода и соль (Морская вода)
- Нитрат калия, сера, и углерод (порох)
- Кислород и вода (морская пена)
- Нефть, углеводороды и топливные добавки (бензин)
- Минералы, органические материалы, воздух, вода и живые организмы (почва)
- Хлор, каустическая сода, и вода (отбеливатель)
- Плазма, лейкоциты, эритроциты и тромбоциты (кровь)
Гомогенные смеси противоположны гетерогенным смесям.Это смеси, однородные по своему составу. Примером однородной смеси может быть что-то вроде лимонада. После смешивания вам будет нелегко отделить лимонный сок от воды; это равномерно перемешано. Другой пример — воздух, которым мы дышим. Это однородная смесь кислорода, азота, аргона, углекислого газа и других газов.
Смеси сплавов
Некоторые из наиболее важных смесей — это прочные металлы, называемые сплавами. Эти металлы являются результатом объединения двух или более металлов вместе, как правило, для их усиления.
Вот список сплавов:
- Алюминий, никель и кобальт (Alnico)
- Никель, марганец, алюминий и кремний (Alumel)
- Медь и мышьяк (мышьяковая медь)
- Медь и серебро (Биллон)
- Цинк и медь (латунь)
- Серебро и медь (Britannia silver)
- Никель и хром (Chromel)
- Медь и никель (константан)
- Медь и вольфрам (медь-вольфрам)
- Медь, золото и серебро (коринфская бронза)
- Медь, никель и железо (Cunife)
- Медь и никель (Cupronickel)
- Медь, алюминий и цинк (сплав Деварда)
- Медь и алюминий (дюралюминий)
- Медь, золото, и серебро (Electrum)
- Никель и железо (Elinvar)
- Железо, никель и кобальт (Fernico)
- Никель, медь и цинк (нем. серебро)
- Серебро, медь и золото (Goloid)
- Медь, и небольшой профи часть золота и серебра (Hepatizon)
- Медь, марганец и олово (сплав Heusler)
- Никель, хром и железо (Inconel)
- Никель и железо (Invar)
- Калий и литий (KLi)
- Никель , кобальт и железо (Ковар)
- Медь, марганец и никель (Манганин)
- Свинец и медь (Молибдохалкос)
- Медь, никель, железо, марганец, углерод и кремний (металлический монель)
- Никель и железо ( Мю-металл)
- Хром, железо и никель (нихром)
- Никель, хром, кремний и магний (Nicrosil)
- Никель и кремний (Nisil)
- Медь, алюминий, цинк и олово (северное золото)
- Олово, медь, сурьма, висмут и (иногда) серебро (Pewter)
- Серебро и платина (платина стерлингового серебра)
- Золото, серебро медь (розовое золото)
- Медь и золото (Shakudo)
- Серебро и медь (Shibuichi)
- Алюминий и кремний (Silum дюйм)
- Свинец и олово (припой)
- Железо, марганец, углерод и кремний (Spiegeleisen)
- Хром, никель, молибден, кремний, алюминий и углерод (нержавеющая сталь)
- Углерод и железо (сталь)
- Серебро и медь (чистое серебро)
- Свинец и олово (Terne)
- Медь и золото (Tumbaga)
- Свинец, олово и сурьма (тип металла)
- Цинк, алюминий, магний и медь (Zamak)
Наука вокруг нас
Разве не интересно рассмотреть, как наука окружает нас? Это в еде, которую мы едим, и в воздухе, которым мы дышим.И чем больше мы экспериментируем с этим, тем больше мы раскрываем различные истины о нем. Лучший способ узнать что-то новое — это сформировать гипотезы и следовать научным методам для проверки этих гипотез. Чтобы узнать больше об этом, взгляните на эти примеры гипотез, а затем посмотрите, сможете ли вы проверить их с помощью научного метода. Удачного знакомства!
образцов чистых веществ и смесей
Принадлежит: Свойства вещества. Сульфид железа (FeS) — это чистое вещество, оно всегда состоит из 1 атома железа, химически связанного с 1 атомом серы.Смеси имеют переменные или неопределенные химические свойства. В зависимости от способа взаимодействия этих компонентов смеси могут быть двух типов: 1. 5.1: Чистые вещества и смеси Последнее обновление Сохранить в формате PDF ID страницы 25273 Авторы и авторства В главе 1 мы узнали, что атомы состоят из электронов, протонов и нейтронов и что количество протонов в ядре атома (атомный номер) определяет идентичность этого элемента. Смеси — это нечистые вещества, состоящие из двух или более веществ, смешанных вместе.Элемент водород существует в виде молекул H 2 и представляет собой чистое вещество, состоящее из 2 атомов водорода, химически связанных друг с другом. Смеси: Вещества с двумя или более разными частицами являются смесями. Чистые вещества имеют высокую температуру плавления. например. Еда и питательные вещества. Чистые вещества часто называют чистыми, чтобы отличить их от смесей. Другие примеры чистых веществ включают дистиллированную воду и соль. Соединения — это чистые вещества, состоящие из более чем одного связанного вместе элемента.3.2. Чистые вещества состоят из частиц одного типа и не могут быть физически разделены на другие вещества. Мы можем формировать смеси, смешивая элементы и соединения или и то, и другое. Сахар — еще одно чистое вещество. Chemistry Journal 1.6 Чистые вещества и смеси Главный вопрос: как свойства материи помогают нам понять, как различать чистые вещества и смеси? Примеры чистых веществ включают воду, золото, глюкозу, диоксид углерода, кислород и водород. Химики могут классифицировать вещество как твердое, жидкое или газообразное.Классификация — один из основных процессов в науке. Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения. Воздух — это однородная смесь, которую часто считают чистым веществом. Урок: Категории химических веществ и смесей Продолжительность: примерно 40 минут Это задание знакомит студентов с классификацией веществ на чистые вещества и смеси на знакомых примерах. Дайте определение смеси. Приведите один пример чистого вещества и один пример смеси. Дайте способ отделения песка от воды. Назовите способ отделения соли от воды в соленой воде.Чистые вещества и смеси. На рис. 1 (б) показана смесь чистых веществ. Соединения представляют собой тип вещества: смесь веществ 1. хлор 2. вода 3. в диапазоне температур. Смеси содержат как минимум два чистых вещества. Чистые вещества обладают различными химическими и физическими свойствами, одинаковыми для каждого образца вещества. Кофе, жидкость для полоскания рта и уксус являются примерами __________________ смесей. ЧИСТОЕ ВЕЩЕСТВО Однородный материал, который содержит частицы (атомы или молекулы) только одного вида и имеет определенный набор свойств (точка плавления, точка кипения) и который не может быть разделен на другие виды материи никаким физическим процессом.Смеси — это физические комбинации чистых веществ, которые не имеют определенного или постоянного состава — состав смеси зависит от того, кто ее готовит. Например, предположим, сахар 3. Материя — смеси чистых веществ. Чистое вещество — это образец вещества как с определенным, так и с постоянным составом с различными химическими свойствами. Слово «чистый» используется в химии иначе, чем его повседневное значение. Известные элементы, перечисленные в таблице Менделеева, можно считать чистыми веществами.Иногда разные части смеси можно разделить на отдельные объекты. Чистое вещество имеет постоянные физические и химические свойства, а смеси имеют различные физические и… Чистые вещества и смеси. Чистое вещество состоит из одного компонента и имеет постоянный состав, независимо от размера и происхождения образца. Большинство веществ, с которыми вы будете контактировать, представляют собой смеси. например: -Элементы: металлы и неметаллы, Соединения: соли. Две части рисунка 1 (а) показывают разные чистые вещества.Элементы и соединения — это чистые вещества. В результате чистые вещества не могут быть разделены на другие Материя могут быть разделены на две категории: чистые вещества и смеси. В ______________ одно вещество растворено в другом веществе. Чистые вещества обладают четко определенными физическими свойствами или свойствами, которые не связаны со способностью вещества соединяться с различными веществами. Цель обучения 4: Я могу классифицировать примеры и иллюстрации частиц материи как чистое вещество (элемент), чистое вещество (соединение), смесь (гомогенное) или смесь (гетерогенное).Смеси можно разделить на однородные и гетерогенные. Гуляя по дому и двору, можно мгновенно найти бесчисленное множество примеров. Содержание: Знакомство с чистыми веществами, смесями и растворами. Если это смесь, напишите «Гетерогенный» или «Гомогенный» в столбце «Смесь». Отображение 8 лучших рабочих листов, найденных для — Чистые вещества и смеси. но смеси тают. Чистые вещества и смеси Темы: газ, физика частиц, температура Страниц: 2 (506 слов) Опубликовано: 7 мая 2013 г. Примеры смесей включают солевой раствор, который представляет собой материалы, которые вам понадобятся: — 2 чашки — 2 чайные ложки соли — 2 чайные ложки сахара — 2 чайные ложки меда — Ложка — Секундомер — Бумага и карандаш / ручка для результатов — Ваш позитивный настрой Инструкции: 1.Некоторые примеры смесей: грязь, вода и пищевые красители, вода и масло и т. Д. Если это вещество, напишите элемент или соединение в столбце вещества. Показать: Вопросы и ответы. Вещества, состоящие из одного типа атомов или молекул, называются чистыми веществами. Воздух — это однородная смесь, которую часто считают чистым веществом. Смеси также могут быть намного проще. Вещества в основном делятся на два типа. Это: Чистое вещество: Вещества, которые не содержат каких-либо смесей и содержат только один вид частиц, являются чистыми веществами.Примеры чистых веществ включают железо, алюминий, серебро и золото. Смеси: Вещества с двумя или более разными частицами являются смесями. СМЕСИ Смесь представляет собой нечто, образованное двумя или более веществами. Есть два вида смесей. ОДНОРОДНЫЕ СМЕСИ ГЕТЕРОГЕННЫЕ СМЕСИ 4. Чистые вещества и смеси. 13 мая 2020 г. Урок естественных наук в 6-м классе: 13 мая 2020 г. Цели / учебные задачи: учащиеся будут определять чистые вещества. и смеси и объясните разницу между ними. Смесь _________________ — это смесь, в которой вещества распределены равномерно.Вы добавляете сахар, чтобы подсластить воду. Смеси и чистые вещества — Отображение 8 основных рабочих листов, найденных для этой концепции. Примеры элементов включают: Помните, смесь — это что-либо, кроме чистого вещества, и очень немногие вещи являются полностью чистыми веществами. Большинство веществ, которые мы обычно называем чистыми, в химии не считаются чистыми. Распечатать. Химическое вещество может быть твердым, жидким, газообразным или плазменным. Чайные листья нам известны просто однородной смесью веществ, примером чистого вещества является паж.Дерево — это чистое вещество? Смеси состоят из более чем одного типа частиц и могут быть физически разделены на другие вещества. твердое, жидкое и газообразное состояние • Чистые вещества часто называют чистыми, чтобы отличить их от смесей. Как чистые вещества и смеси и, следовательно, это пример, примеры центра опроса о том, как атмосфера. Гомогенные смеси — это смеси, в которых используемые чистые вещества смешиваются почти полностью, благодаря чему смесь выглядит как один тип вещества.Начните изучать чистые вещества и смеси. Чистое вещество состоит из одинаковых видов молекул, элементы и соединения являются основными, кроме того, смеси образуются без какой-либо химической реакции между веществами, гомогенная смесь представляет собой комбинацию двух или более чистых веществ таким однородным образом. Смесь состоит из более чем одного типа атомов или молекул. Примеры чистых веществ Примеры нечистых веществ — смеси — солевой раствор, раствор сахара, молоко, морская вода, сок сахарного тростника, безалкогольные напитки, неочищенный сахар, камень, минералы, нефть, биогаз, кофе, краска, сжиженный нефтяной газ.Другими словами, в нем нет загрязнений. Показать примечания / примеры SC.8.P.8.9: Различать смеси (включая растворы) и чистые вещества. Все эти вещества делятся на две основные категории. Элементный состав Нет да Нет да. В более общем смысле чистое вещество — это любая однородная смесь. То есть это вещество, которое кажется однородным по внешнему виду и составу, независимо от размера выборки. Примеры чистых веществ включают железо, сталь и воду. Смеси Почти все природные вещества, а также продукты, созданные руками человека и производителями, в мире представляют собой смеси чистых веществ.Смесь содержит два более чистых вещества, как показано на рисунке 4. Они состоят из более чем одного типа частиц. Смесь может существовать во всех трех состояниях материи, т.е. убедитесь, что вы проводите этот эксперимент со всеми материалами и следуете всем инструкциям. Чистое вещество. Пример: вода, соль 3. Алюминий и столовый сахар являются примерами чистых веществ. Примеры чистых веществ включают железо, алюминий, серебро и золото. Химические свойства чистых веществ тоже постоянны и определенны.Примеры каждого элемента, соединения, смеси и раствора, которые студенты могут увидеть и потрогать. . Например, когда мы печем торт, это результат смеси яиц, муки, сахара и других ингредиентов. Во время которого составляет один пример, если пример чистого вещества пример, если они являются поворотом, ссылка не только проблемы. Солл 4. Сахарная вода 5. Кислород 6. Углекислый газ 7. Мороженое по каменистой дороге 8. Спирт 9. Чистый воздух 10. Системы тела. Их можно разделить (Общее ожидание 1). Понимание характеристик материи позволяет нам делать осознанный выбор в отношении того, как мы ее используем.Однако, как мы находим в природе, жидкая вода всегда содержит другие вещества помимо чистой воды — это смесь. Чистые вещества нельзя разделить на какие-либо другие вещества, а смесь — это комбинация двух или более чистых веществ. Смесь представляет собой материал, состоящий из двух или более различных веществ, которые физически объединены. Чистые вещества, смеси и растворы Смеси, элементы, соединения… Ученые любят классифицировать вещи. Приведите несколько примеров элементов, смесей и соединений.Чистые вещества и смеси Значение чистого. — YouTube. компонент чистых веществ, потому что связывание между атомами составляющих веществ не происходит в смеси. Рабочие листы для детей Рабочие листы для печати Гетерогенная смесь Физические и химические свойства Интерактивная деятельность Основные действия Физические изменения вещей под микроскопом Химические реакции Примеры смеси включают солевой раствор, который представляет собой «смесь» двух компонентов, соли и воды. Чистая субстанция — это субстанция, которую нельзя отделить физическими средствами.Разделение Невозможно разделить чистые вещества. Смеси представляют собой физические комбинации двух или более элементов и / или соединений. Чистые вещества состоят из одного элемента или соединения, в то время как гомогенные смеси состоят из множества различных элементов или соединений. Разминка 2. Примерами гетерогенной смеси являются бетон и мюсли, при разложении каждый образец выглядит по-разному. Некоторые чистые вещества встречаются в природе, например… Есть три основных типа смесей, включая коллоиды, суспензии и, наконец, твердые вещества.#Toppr #CBSE #ICSE #TS #AP #IGCSE #MHBoard #CBSE 10 #CBSE 9 #CBSE 8 #CBSE #Online. Определите, является ли вещество смесью или чистым веществом. Если воспроизведение не начинается в ближайшее время, попробуйте перезагрузить устройство. Некоторые примеры смесей — это грязь, вода и пищевые красители, вода и масло и практически любые вещества, которые сочетаются с другими. Что такое чистые вещества? Некоторые примеры чистых веществ: вода, алмаз, соль, сахар и олово. Некоторые примеры чистых веществ: вода, алмаз, соль, сахар и олово.Некоторые примеры чистых веществ включают: • воду • кислород • двуокись углерода • золото • железо. Эту разницу легче всего увидеть, если измерить температуру жидкости при ее охлаждении и замерзании. Примеры: h3O и CO2. Молекула образуется при химическом соединении двух или более атомов. Дайте определение чистым и нечистым материалам. В веществе есть только атомы элемента и ничего больше. Решайте вопросы легкого, среднего и сложного уровня с помощью чистых веществ и смесей. Кислород, например, представляет собой чистое химическое вещество, которое представляет собой бесцветный газ без запаха при 25 ° C.Эти участки закрыты, чтобы предотвратить движение грунтовых вод, которые могут переносить вредные жидкости в колодцы и другие источники питьевой воды. Чистые вещества, смеси и растворы Чистые вещества, смеси и растворы Смеси, элементы, соединения… Ученые любят классифицировать вещи. • Ученые классифицируют материю по ее составу. • В конечном итоге все вещества можно классифицировать как смеси, элементы и соединения. Но есть и другие способы классификации материи — например, чистые вещества и смеси.Гетерогенные смеси Смеси проявляют свойства содержащихся в них чистых веществ. • Ученые классифицируют материю по ее составу. Эту разницу легче всего увидеть, когда температура… Животные. Материя — это… Учебное пособие, включающее древовидную карту, классифицирующую чистые вещества и смеси, рисование различных чистых веществ и смесей, сопоставление некоторой лексики, а также пересмотр фаз материи. Фруктовые петли, пицца и кегли являются примерами ____________________ смесей.Нечистая субстанция — это смесь. Смеси — нечистые вещества. Определение чистого вещества в химии отличается от того, что мы обычно используем. Наука 7 класса — Чистые вещества и смеси. Студенты научатся определять и различать чистые вещества и механические смеси. Они будут использовать теорию частиц для объяснения физических характеристик материи с целью ее классификации. фильтрация, выпаривание, дистилляция или хроматография .. Степень: Восемь. 2.1: Чистые вещества и смеси Последнее обновление; Сохранить как PDF страницу ID 79535; Авторы и авторство; В главе 1 мы узнали, что атомы состоят из электронов, протонов и нейтронов и что количество протонов в ядре атома (атомный номер) определяет идентичность этого элемента.Например, атом с шестью протонами в ядре — это атом углерода; Семь …
Семейный выбор в Grand Palladium Vallarta Resort & Spa,
Дата закрытия книги Непал,
Рейсы в международный аэропорт Палм-Бич,
Тея: Пробуждение Исследования,
Перевод Michi на испанский язык,
Ботинки Blundstone Paddock,
Курорты Все Включено на Бали,
Участки рудника Порт-Хедленд,
Элемент, смесь, соединение — действие
(0 Рейтинги)
Быстрый просмотр
Уровень оценки: 11
(10-12)
Требуемое время: 30 минут
Расходные материалы на группу: 2 доллара США.00
Размер группы: 4
Зависимость действий:
Тематические области:
Химия
Резюме
Учащиеся лучше понимают различные типы материалов, такие как чистые вещества и смеси, и учатся различать гомогенные и гетерогенные смеси, обсуждая ряд примеров материалов, которые они используют и с которыми сталкиваются в своей повседневной жизни.
Инженерное соединение
Материаловеды и инженеры-механики сосредотачиваются на понимании природы и свойств различных материалов, чтобы они могли повторять их и создавать более надежные продукты. Они используют преимущества различной прочности и способности различных материалов для создания композитов с существенно разными физическими или химическими свойствами. Понимание свойств данного материала, элемента, компонента или композита является важной частью процесса инженерного проектирования.
Цели обучения
После этого занятия студенты должны уметь:
- Различайте и описывайте три типа материи: элементы, соединения, смеси.
- Определите чистые и нечистые материалы.
- Приведите несколько примеров элементов, смесей и соединений.
- Объясните различные свойства каждой группы материалов.
- Объясните, как инженеры-химики используют эти термины при решении задач, связанных с очисткой воды и перегонкой сырой нефти.
- Объясните, как инженеры-материаловеды и инженеры-механики используют эти термины при создании новых композитных материалов.
- Объясните, что такое металлические сплавы, и объясните значение металлических сплавов в материаловедении и материаловедении.
- Приведите некоторые применения неметаллических сплавов.
Образовательные стандарты
Каждый урок или задание TeachEngineering соотносится с одним или несколькими научными дисциплинами K-12,
образовательные стандарты в области технологий, инженерии или математики (STEM).
Все 100000+ стандартов K-12 STEM, охватываемых TeachEngineering , собираются, обслуживаются и упаковываются сетью стандартов достижений (ASN) ,
проект D2L (www.achievementstandards.org).
В ASN стандарты иерархически структурированы: сначала по источникам; например , по штатам; внутри источника по типу; например , естественные науки или математика;
внутри типа по подтипу, затем по классу, и т. д. .
Международная ассоциация преподавателей технологий и инженерии — Технологии
- Химические технологии предоставляют людям возможность изменять или модифицировать материалы и производить химические продукты.
(Оценки
9 —
12)Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом?
Спасибо за ваш отзыв!
- Материалы имеют разное качество и могут быть классифицированы как натуральные, синтетические или смешанные.(Оценки
9 —
12)Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом?
Спасибо за ваш отзыв!
ГОСТ
Предложите выравнивание, не указанное выше
Какое альтернативное выравнивание вы предлагаете для этого контента?
Список материалов
Поделиться со всем классом:
- 20 комплектов болтов, гаек и шайб
- 9 пластиковых тарелок
- лента и маркер, для нумерации посуды
- четыре примера элементов:
- алюминий (один небольшой лист фольги)
- медь (небольшой кусок проволоки или трубки)
- утюг (стружка или магнит)
- уголь (в виде чистого угольного карандаша или графита)
- четыре примера соединений:
- вода или H 2 0 (~ 100 мл)
- поваренная соль, или NaCl (~ 10 г)
- пищевая сода или NaHCO 3 (~ 10 г)
- яичная скорлупа или морская ракушка, или CaCO 3
- четыре примера смесей, как однородных, так и гетеогенных:
- надутый мешок Ziploc (на примере воздуха)
- бутылка кока-колы или другой газированной воды
- заправка для салата (например, уксус из масла и воды)
- соленая вода
- Таблица данных, по одной на учащегося
Рабочие листы и приложения
Посетите [www.teachengineering.org/activities/view/uoh_sep_mixtures_activity1] для печати или загрузки.
Больше подобной учебной программы
Разделительные смеси
Студенты узнают, как классифицировать материалы как смеси, элементы или соединения и определять свойства каждого типа. Также вводится концепция разделения смесей, поскольку почти каждый элемент или соединение в природе находится в нечистом состоянии, таком как смесь двух или более веществ, и…
Есть железо ?!
Чтобы получить представление о смесях и концепции разделения смесей, учащиеся используют сильные магниты, чтобы найти элемент железа в хлопьях хлопьев для завтрака, обогащенных железом. Благодаря этой деятельности они видят, как железный компонент этой гетерогенной смеси (злака) сохраняет свои свойства и…
Интересный взгляд на науку о материалах
Студенты знакомятся с междисциплинарной областью материаловедения. С помощью демонстрации класса и презентации PowerPoint® они узнают основные классы материалов (металлы, керамика, полимеры, композиты) и их отличия друг от друга с учетом таких понятий, как напряжение, деформация, пластичность…
Введение / Мотивация
Мы все полностью окружены материей. Чтобы лучше понять этот вопрос — как он влияет на вас, как вы влияете на него и как этим можно манипулировать в наших интересах, — нам нужно получить базовое понимание типов и свойств материи. Разнообразие материи в мире и во Вселенной поражает.Если мы хотим понять это разнообразие, мы должны начать со способа организации и описания материи.
Вся материя состоит из элементов, которые являются основными веществами, которые не могут быть расщеплены химическими средствами. Элемент — это вещество, которое не может быть далее восстановлено до более простых веществ обычными способами. По сути, элемент — это вещество, состоящее из одного типа атомов.
Соединение представляет собой чистое вещество, состоящее из двух или более различных атомов, химически связанных друг с другом.Это означает, что он не может быть разделен на составляющие механическими или физическими средствами, а может быть разрушен только химическим путем.
Смесь — это материал, содержащий два или более элементов или соединений, которые находятся в тесном контакте и смешиваются в любой пропорции. Например, воздух, морская вода, сырая нефть и т. Д. Составляющие смеси можно разделить физическими средствами, такими как фильтрация, испарение, сублимация и магнитная сепарация. Составляющие смеси сохраняют свой первоначальный набор свойств.Кроме того, смеси можно разделить на гомогенные и гетерогенные. Гомогенная смесь имеет одинаковый однородный внешний вид и состав по всей своей массе. Например, сахар или соль, растворенные в воде, спирт в воде и т. Д. Гетерогенная смесь состоит из явно разных веществ или фаз. Три фазы или состояния вещества — это газ, жидкость и твердое тело. Гетерогенная смесь не имеет однородного состава по своей массе.
Новые материалы являются одними из величайших достижений всех времен, и с самого начала истории они играли ключевую роль в росте, процветании, безопасности и качестве жизни людей.Новые материалы открывают двери новым технологиям, будь то гражданская, химическая, строительная, ядерная, авиационная, сельскохозяйственная, механическая, биомедицинская или электротехническая инженерия.
Изучение металлических сплавов, которые представляют собой смесь различных металлов, составляет важную часть материаловедения и материаловедения. Из всех металлических сплавов, используемых сегодня, сплавы железа (сталь, нержавеющая сталь, чугун, инструментальная сталь, легированные стали) составляют самую большую долю как по количеству, так и по коммерческой стоимости.Железо, легированное углеродом в различных пропорциях, дает стали с низким, средним и высоким содержанием углерода. Что касается сталей, твердость и предел прочности стали напрямую связаны с количеством присутствующего углерода, при этом повышение уровня углерода также приводит к снижению пластичности и вязкости. Добавление кремния и графитизация производят чугун. Добавление хрома, никеля и молибдена к углеродистой стали (более 10%) дает нам нержавеющую сталь.
Другими значительными металлическими сплавами являются сплавы алюминия, титана, меди и магния.Медные сплавы известны давно (с бронзового века), тогда как сплавы трех других металлов были разработаны относительно недавно. Сплавы алюминия, титана и магния также известны и ценятся за их высокое отношение прочности к весу и, в случае магния, за их способность обеспечивать электромагнитное экранирование. Эти материалы идеальны для ситуаций, в которых высокое отношение прочности к весу более важно, чем общая стоимость, например, в аэрокосмической промышленности и некоторых областях автомобильной техники.
Помимо металлов, полимеры и керамика также являются важной частью материаловедения. Полимеры — это сырье (смолы), используемое для производства того, что мы обычно называем пластмассами. Пластмассы на самом деле являются конечным продуктом, созданным после того, как один или несколько полимеров или добавок были добавлены в смолу во время обработки, которой затем придается окончательная форма.
Еще одно промышленное применение — производство композитных материалов. Композиционные материалы — это структурированные материалы, состоящие из двух или более макроскопических фаз.Области применения варьируются от конструктивных элементов, таких как железобетон, до теплоизолирующих плиток, которые играют ключевую и неотъемлемую роль в системе тепловой защиты космического шаттла НАСА, которая защищает поверхность шаттла от тепла при повторном входе в атмосферу Земли. . Одним из примеров является армированный углерод-углерод (RCC). Светло-серый материал выдерживает температуру входа до 1510 ° C (2750 ° F) и защищает передние кромки крыла и носовую часть космического челнока. RCC — это ламинированный композитный материал, изготовленный из графитовой вискозной ткани и пропитанный фенольной смолой.
Другие образцы можно увидеть в «пластиковых» корпусах телевизоров, сотовых телефонов и других современных устройств. Эти пластиковые кожухи обычно представляют собой композитный материал.
Процедура
Перед мероприятием
Соберите материалы и сделайте копии таблицы данных, по одной на каждого учащегося.
Приготовьте девять пластиковых тарелок с болтами, гайками и шайбами, как описано ниже. Поместите их на стол (называемый Таблицей А). Обозначьте номера блюд как-нибудь, например, скотчем или маркером.
- Блюдо 1: 4 шайбы
- Тарелка 2: 4 болта
- Блюдо 3: 4 ореха
- Тарелка 4: соедините 1 гайку с 1 болтом (4 комплекта)
- Тарелка 5: соедините 2 гайки с 1 болтом (4 комплекта)
- Тарелка 6: соедините 1 гайку и 1 шайбу с 1 болтом (4 комплекта)
- Блюдо 7: шайба 1, 1 орех, 1 состав, как в тарелке 5 и 1 состав, как в тарелке 6
- Тарелка 8: 2 шайбы, 1 гайка и 2 болта
- Состав блюда 9: 1, как в чашке 4, и состав 2, как в чашке 5.
Поместите примеры элементов, соединений и смесей в другую таблицу (называемую таблицей B) и пометьте их. Вы также можете маркировать соединения их конкретной химической формулой (например, поваренная соль будет NaCl).
Со студентами
- Разделите класс на группы по четыре ученика в каждой. Раздайте пустые таблицы данных.
- Обратите внимание каждого учащегося на таблицу A. Наборы шайб, болтов и гаек можно использовать для передачи концепции элементов, смесей и соединений.Объясните учащимся: если они воспринимают каждую шайбу, болт и гайку как отдельный атом, то содержимое тарелок 1, 2 и 3 является элементами, потому что все они являются одним и тем же атомом и не могут быть далее сведены к более простым веществам. Содержимое тарелок 4, 5 и 6 является составным, потому что они показывают одно вещество, состоящее из двух или более разных атомов, химически связанных друг с другом, а содержимое тарелок 7, 8 и 9 является смесями, потому что они представляют собой материалы, содержащие два или более элементов или соединений и смешиваются в любых пропорциях.
- После обсуждения таблицы A предложите каждой группе пройтись по таблице B, сравнить и сопоставить различные элементы в таблице и составить список своих обсуждений. Попросите их классифицировать материалы в каждой посуде как элемент, гомогенную смесь, гетерогенную смесь или соединение, записав это в свои таблицы данных. Попросите учащихся обсудить свои списки. (Ожидается, что некоторые классифицируют материалы как элементы, смеси и соединения.)
- На этом этапе объясните различные типы материалов, используя классную доску по мере необходимости.Затем снова обсудите все материалы в Таблице B и разделите их на классы элементов, смесей (гомогенных и гетерогенных) и соединений.
Словарь / Определения
соединение: чистое химическое вещество, состоящее из двух или более различных химических элементов.
элемент: вещество, состоящее из одного типа атома.
гетерогенная смесь: смесь, состоящая из явно различных веществ или фаз.
однородная смесь: смесь, имеющая одинаковый однородный внешний вид и состав по всей своей массе.
смесь: вещество, состоящее из двух или более материалов, которые химически не соединены.
раствор: однородная смесь, состоящая из двух или более веществ.
Оценка
Вопросы : Задайте студентам исследовательские вопросы в ходе заключительного обсуждения в классе.Ответы учащихся и их вклад в обсуждение раскрывают их понимание концепций деятельности. Как вариант, попросите учащихся индивидуально ответить на вопросы в форме заключительного письменного теста.
Вопросы для расследования
- Опишите три типа материи: элементы, соединения и смеси.
- Определите чистые и нечистые материалы.
- Приведите несколько примеров элементов, смесей и соединений.
- Объясните различные свойства каждой группы материалов.
- Объясните, как инженеры-химики используют эти термины при решении задач, связанных с очисткой воды и перегонкой сырой нефти.
- Объясните, как инженеры-материаловеды и инженеры-механики используют эти термины при создании новых композитных материалов.
- Объясните, что такое металлические сплавы, и объясните значение металлических сплавов в материаловедении и материаловедении.
- Приведите некоторые применения неметаллических сплавов.
Авторские права
© 2013 Регенты Университета Колорадо; оригинал © 2010 Хьюстонский университет
Авторы
Парния Мохаммади; Роберто Дималиват
Программа поддержки
Национальный научный фонд GK-12 и программы исследований для учителей (RET), Университет Хьюстона
Благодарности
Это содержимое цифровой библиотеки было разработано Инженерным колледжем Хьюстонского университета в рамках гранта Национального научного фонда GK-12 номер DGE 0840889.Однако это содержание не обязательно отражает политику NSF, и вы не должны рассчитывать на одобрение со стороны федерального правительства.
Последнее изменение: 30 апреля 2021 г.
примеров гетерогенной смеси чистого вещества | Education
Создание гетерогенной смеси из чистого вещества звучит как загадка, которую следует разгадывать так же, как звук хлопка в ладоши.В некоторой степени это семантический вопрос, основанный на том, как вы определяете смесь, но согласно наиболее распространенным определениям, можно создать гетерогенную смесь только с одним чистым веществом.
Гомогенные и гетерогенные смеси
Смесь — это просто комбинация двух или более различных веществ. Это физический, а не химический процесс, и его можно отменить, физически разделив компоненты. Гомогенная смесь, также называемая раствором, — это смесь, в которой компоненты смеси равномерно распределены по всей смеси; например, соль, растворенная в воде.Напротив, гетерогенная смесь — это смесь, в которой распределение компонентов неравномерно; например, масло и уксус в заправке для салата. Чистые вещества обычно однородны.
Смешивание чистого вещества
Компоненты смеси могут различаться по химическому составу, но они также могут отличаться по своему физическому состоянию. Материя может существовать в виде твердого тела, жидкости, газа или плазмы. Вы можете приготовить смесь, включающую более одного состояния вещества. Смесь чистого вещества возможна, если часть этого вещества находится в одном состоянии и смешана с тем же веществом в другом состоянии, например, если твердое вещество смешано с жидкостью.Смеси, в состав которых входят вещества в разных состояниях, также почти всегда неоднородны.
Лед в воде
Когда вы добавляете лед или замороженную воду в чистую воду, вы создаете гетерогенную смесь чистого вещества. Атомы льда заключены в кристаллическую матрицу, атомы которой менее плотно упакованы, чем атомы в жидкой воде, что является уникальным свойством воды. Атомы воды распределены во льду иначе, чем в жидкой воде, и лед можно физически отделить от воды, сделав его смесью.Как только лед тает, их нельзя разделить, поэтому он больше не является смесью.
Сублимация сухого льда
Если вы поместите блок сухого льда, твердого углекислого газа, в герметичный ящик при комнатной температуре, он начнет сублимироваться. Сублимация — это процесс превращения твердого вещества в газ без предварительного превращения в жидкость. Когда сублимированный газ заполняет ящик, оставшееся твердое вещество и газ образуют гетерогенную смесь твердого диоксида углерода и газообразного диоксида углерода. Расположение атомов внутри ящика неоднородно, и эти два компонента можно разделить.Как и в случае со льдом в воде, гетерогенная смесь становится однородным веществом, когда блок полностью растворяется.
Ссылки
Ресурсы
Writer Bio
Андреа Беккер, базирующаяся в Венатчи, Вашингтон, специализируется на биологии, экологии и экологических науках. Она написала рецензируемые статьи в «Journal of Wildlife Management», программные документы и учебные материалы.