Содержание
Сложное вещество
Сложное вещество – это вещество, состоящее из атомов двух и более разных химических элементов. Согласно принципам систематической номенклатуры, химическая формула сложного вещества разделяется на условно электроположительную (катион) и условно электроотрицательную (анион) составляющие. Первая составляющая ставится в формуле слева, а вторая – справа. Название сложного вещества читается справа налево, то есть вначале называется его электроотрицательная составляющая в именительном падеже, а затем электроположительная – в родительном. При этом в случае одноэлементной электроотрицательной составляющей используется суффикс –ид, а в случае многоэлементарной – суффикс –ат.
Классификация сложных веществ:
Бинарные соединения
В формулах бинарных соединений, состоящих из металла и неметалла, на первом месте всегда стоит металл (как более электроположительный элемент): K2S, CaCl2, CrO3, AlP, Cr2O3, ScF3.
В формулах соединений, не содержащих атомы металлов, на первом месте помещается элемент с меньшей электроотрицательностью. Порядок увеличения электроотрицательности определяется практическим рядом:
Rn, Xe, Kr, B, Si, C, As, P, H, Te, Se, S, At, I, Br, Cl, N, O, F
Например, H2O, CS2, Cl3N, C2H6, AsI3, NO2, OF2. Исключение составляют некоторые соединения азота с водородом, для которых оставлено традиционное написание формул: HN3, N2H4 (но для кислоты HN3).
Бинарные соединения:
- Галогениды;
- Оксиды;
- Халькогениды;
- Нитриды;
- Водородные соединения азота;
- Фосфиды;
- Карбиды;
- Гидриды;
- Интерметаллиды.
Многоэлементарные соединения:
- Гидроксиды;
- Кислоты;
- Соли;
Автор: Тикавый В.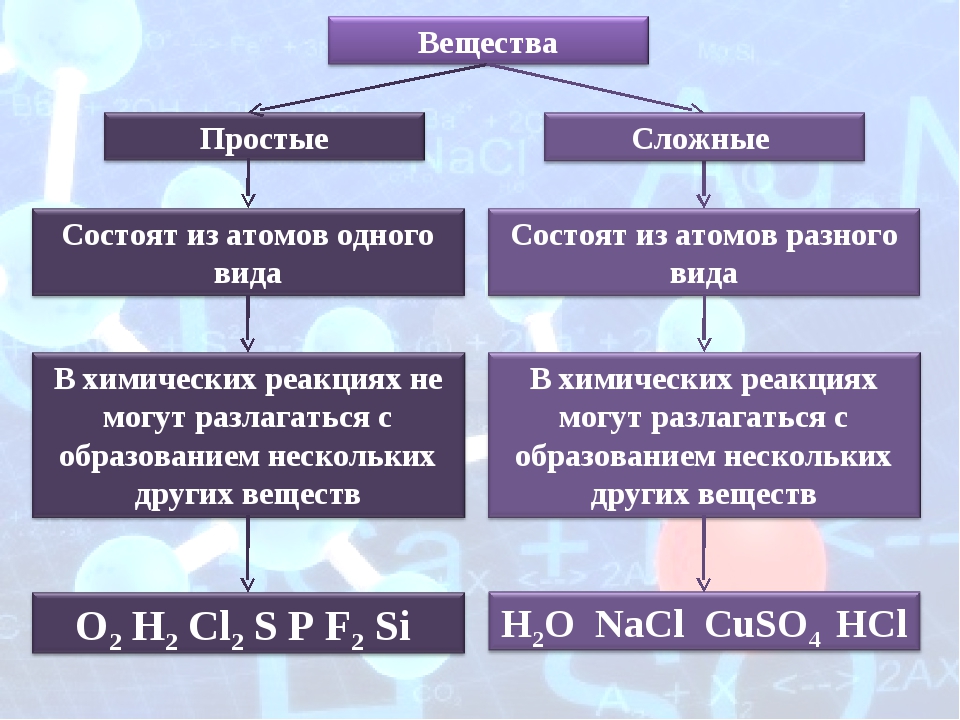 Ф.
Ф.
Источник: Общая химия в формулах, определениях, схемах., под редакцией Тикавого В.Ф.,1987 год
Дата в источнике: 1987 год
Сложные вещества — это… Что такое Сложные вещества?
- Простые вещества
- Горячеводский
СЛОЖНЫЕ РЕАКЦИИ — химические реакции, в которых конечные продукты получаются из исходных через промежуточные вещества. Образование каждого из промежуточных веществ называется элементарной стадией сложной реакции. К сложным реакциям относятся, напр., цепные реакции … Большой Энциклопедический словарь
Сложные эфиры — Сложный эфир карбоновой кслоты. R и R обозначают любую алкильную или арильную группу Сложные эфиры производные оксокислот (как карбоновых так и минеральных) Rk … Википедия
Сложные тиоэфиры — Общая структура сложных тиоэфиров Сложные тиоэфиры органические соединения, содержащие функциональную группу C S CO C и являющиеся сложными эфирами тиолов и карб … Википедия
сложные реакции — химические реакции, в которых конечные продукты получаются из исходных через промежуточные вещества.
 Образование каждого из промежуточных веществ называется элементарной стадией сложных реакций. К сложным реакциям относятся, например, цепные… … Энциклопедический словарь
Образование каждого из промежуточных веществ называется элементарной стадией сложных реакций. К сложным реакциям относятся, например, цепные… … Энциклопедический словарьСложные реакции — такие Реакции химические, элементарные акты которых различны. В противоположность С. р. элементарные акты простых реакций не отличаются один от другого природой участвующих в них веществ, а лишь, возможно, направлением превращения, если… … Большая советская энциклопедия
Сложные белки — (протеиды, холопротеины) двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы простетическая группа. При гидролизе сложных белков, кроме свободных аминокислот, освобождается… … Википедия
Простые вещества — Аллотропная модификация углерода алмаз (в материнской породе) Простые вещества вещества, состоящие исключительно из атомов одного химического элемента (из гомоядер … Википедия
Неорганические вещества — Неорганические вещества это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
высокочистые вещества — [highly purified materials] простые (химические элементы) и сложные вещества, содержат примесей от 10 6до 10 8 мас.
 %, но ≤10 3 мас. %. Такие вещества играют важную роль в полупроводниковой промышленности, атомной энергетике, волоконной оптике … Энциклопедический словарь по металлургии
%, но ≤10 3 мас. %. Такие вещества играют важную роль в полупроводниковой промышленности, атомной энергетике, волоконной оптике … Энциклопедический словарь по металлургииЭФИРЫ СЛОЖНЫЕ — ЭФИРЫ СЛОЖНЫЕ, вещества из класса органических соединений, которые образуются в результате реакции между СПИРТАМИ и КИСЛОТАМИ … Научно-технический энциклопедический словарь
Смотреть что такое «Сложные вещества» в других словарях:
Различия между смесями веществ и сложными веществами
Купить неорганические реактивы, inorganic chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены неорганические реактивы —
категории: ;
Купить органические соединения, реактивы, organic chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены органические соединения, реактивы —
реактивы Карла Фишера для волюметрии, реактивы HYDRANAL, органические растворители, органические кислоты, органические соли и соединения, категории: reagents for Karl Fischer volumetry, other reagents HYDRANAL, organic solvents, organic acids, organic salts and compounds, ; , , , , органические соединения, органические соли,
реактивы Карла Фишера для волюметрии
Подробнее.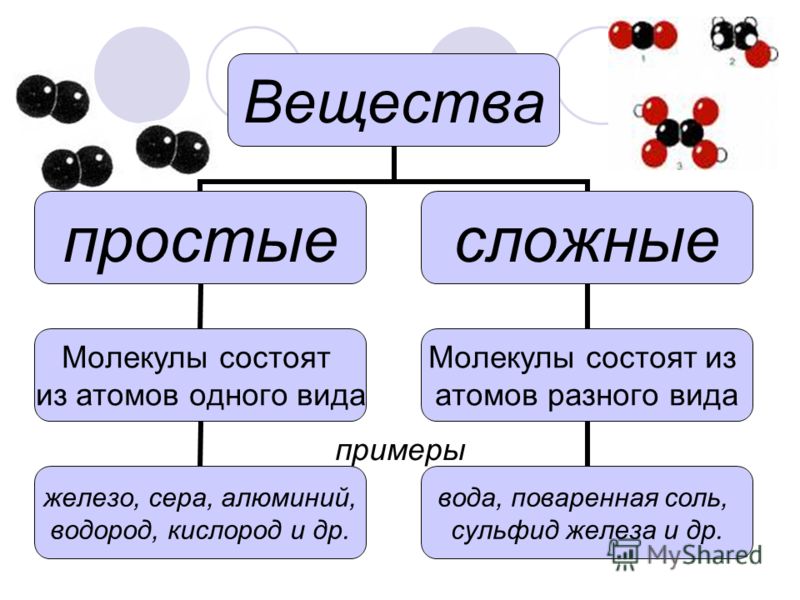 ..
..
Купить реактивы карла фишера для волюметрии — reagents for Karl Fischer volumetry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Использование реактивов Гидранал позволяет определить воду в составе химических реактивов, пищевых продуктов, фармацевтическихпрепаратов. Содержание воды влияет на множество химических и физических параметров выпускаемой продукции. Реактивы Карла Фишера произв…
органические растворители
Подробнее…
Купить органические растворители (organic solvents) в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить органический растворитель в Санкт-Петербурге по выгодной цене. Компания ХИМСНАБ-СПБ предлагает следующую фасовку растворителей: п/э или стеклянная бутылка 1 литр; п/э канистра 10 литров; п/э канистра 5 литров; стеклянный флакон 1 литр, бочка, и бочка, 250 кг. Реактивы и растворители. ..
..
органические кислоты
Подробнее…
Купить органические кислоты — organic acids в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Органические вещества, проявляющие кислотные свойства (кислоты их кислые соли и средние соли содержатся во многих товарах. Благодаря наличию свободных кислот и кислых солей многие продукты и их водные вытяжки обладают кислой реакцией.
К ним относятся карбоновые кислоты, содержа…
Купить химические реактивы, chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены химические реактивы —
вода, неорганические реактивы, органические соединения, реактивы, растворы, особо чистые вещества, категории: water, inorganic chemicals, organic chemicals, solutions, highly purified substances, ; дистиллированная вода, вода (УФ-ВЭЖХ) для аналитики, бидистиллированная вода, вода для молекулярной биологии, , , , ,
неорганические реактивы
Подробнее. ..
..
Купить неорганические реактивы — inorganic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Неорганическое соединение, как правило, представляет собой химическое соединение, которое не имеет связей СН , то есть соединение, которое не является органическим соединением
Химические соединения, реагенты и реактивы находят свое применение в различных областях: научные-исследов…
органические соединения, реактивы
Подробнее…
Купить органические реактивы — organic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить органический реактив в Санкт-Петербурге по выгодной цене. химические реактивы химические реактивы химические реактивы хим. реактивы продукцию chemicals химические реактивы, chemicals вода, неорганические реактивы, органические реактивы, растворы, особо чистые вещества особо чистые веще. ..
..
растворы
Подробнее…
Купить растворы — solutions в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. В каталоге ХИМСНАБ-СПБ представлен большой выбор готовых специальных растворов различного назначения: буферные растворы, растворы для заполнения, очистки и хранения электродов, стандартные растворы для кондуктометров, реактивы карла фишера для кулонометрии.
Купить раствор в Санкт-Петербурге по выгодной цене: …
особо чистые вещества
Подробнее…
Купить особо чистые вещества (ультрачистые вещества) в Санкт-Петербурге, в компании Химснаб-СПБ, телефон +7-812-337-18-93. В высокочистых веществах содержатся примесей в незначительном количестве, что они не влияют на основные специфические свойства веществ. Свойства особо чистых веществ используют для создания новых приборов, устройств и технологических процессов. Они находят применени…
Свойства особо чистых веществ используют для создания новых приборов, устройств и технологических процессов. Они находят применени…
Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категориях: химические реактивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качестно продукции.
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания «Химснаб-СПБ» осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента.
Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строгое соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании «Химснаб-СПБ». Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах производить дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ имеет многолетний опыт работы на рынке химической продукции и лабораторного оборудования. Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.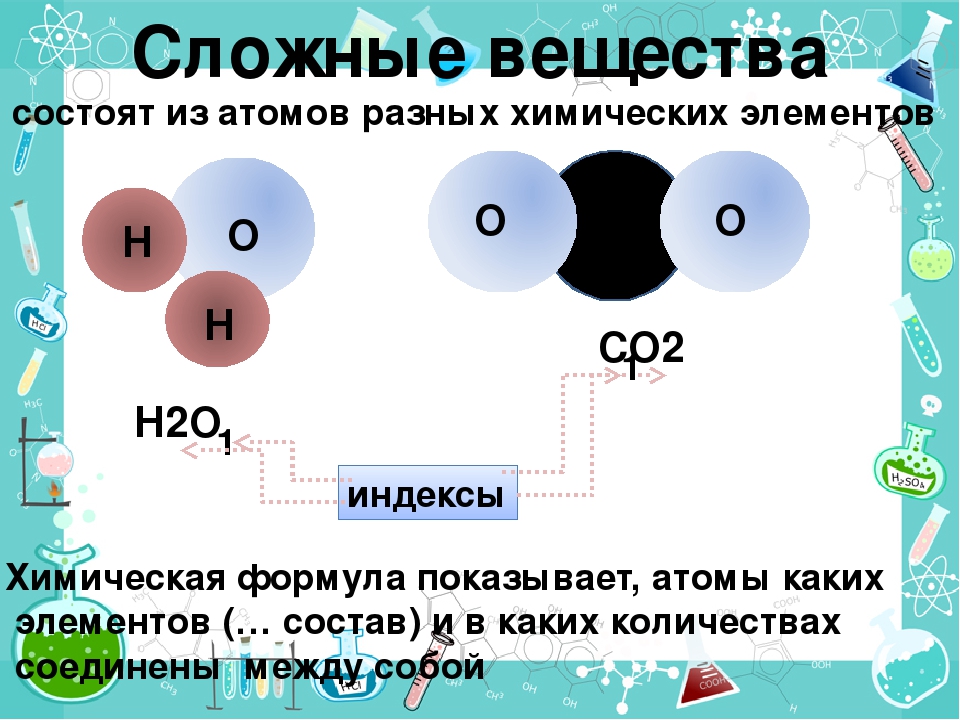
Предствленная информация на страницах данного интернет-сайта и в каталоге продукции носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Для получения подробной информации о наличии и стоимости указанных товаров и (или) услуг,обращайтесь к менеджерам отдела продаж: форма обратной связи, e-mail, телефон.
Реализация продукции для сельского хозяйства, химической, строительной, нефтегазовой, металлургической, текстильной, кожевенной, и других отраслей промышленности.
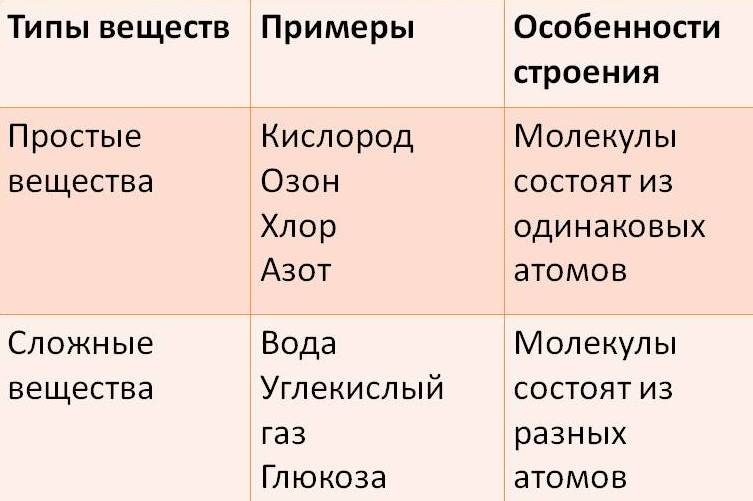
§ 1.5. Простые и сложные вещества. Аллотропы. Вещества и смеси.
В предыдущей главе было сказано, что образовывать связи друг с другом могут не только атомы одного химического элемента, но также атомы разных элементов. Вещества, образованные атомами одного химического элемента, называют простыми веществами, а вещества, образованные атомами разных химических элементов, — сложными. Некоторые простые вещества имеют молекулярное строение, т.е. состоят из молекул. Например, молекулярное строение имеют такие вещества, как кислород, азот, водород, фтор, хлор, бром, йод. Каждое из этих веществ образовано двухатомными молекулами, поэтому их формулы можно записать как O2, N2, H2, F2, Cl2, Br2 и I2 соответственно. Как можно заметить, простые вещества могут иметь одинаковое название с элементами, их образующими. Поэтому следует четко различать ситуации, когда речь идет о химическом элементе, а когда о простом веществе.
Некоторые простые вещества имеют молекулярное строение, т.е. состоят из молекул. Например, молекулярное строение имеют такие вещества, как кислород, азот, водород, фтор, хлор, бром, йод. Каждое из этих веществ образовано двухатомными молекулами, поэтому их формулы можно записать как O2, N2, H2, F2, Cl2, Br2 и I2 соответственно. Как можно заметить, простые вещества могут иметь одинаковое название с элементами, их образующими. Поэтому следует четко различать ситуации, когда речь идет о химическом элементе, а когда о простом веществе.
Нередко простые вещества имеют не молекулярное, а атомное строение. В таких веществах атомы могут образовывать друг с другом связи различных типов, которые подробно будут рассмотрены чуть позже. Веществами подобного строения являются все металлы, например, железо, медь, никель, а также некоторые неметаллы — алмаз, кремний, графит и т.д. Для данных веществ обычно характерно не только совпадение названия химического элемента с названием им образованного вещества, но также идентичны запись формулы вещества и обозначения химического элемента.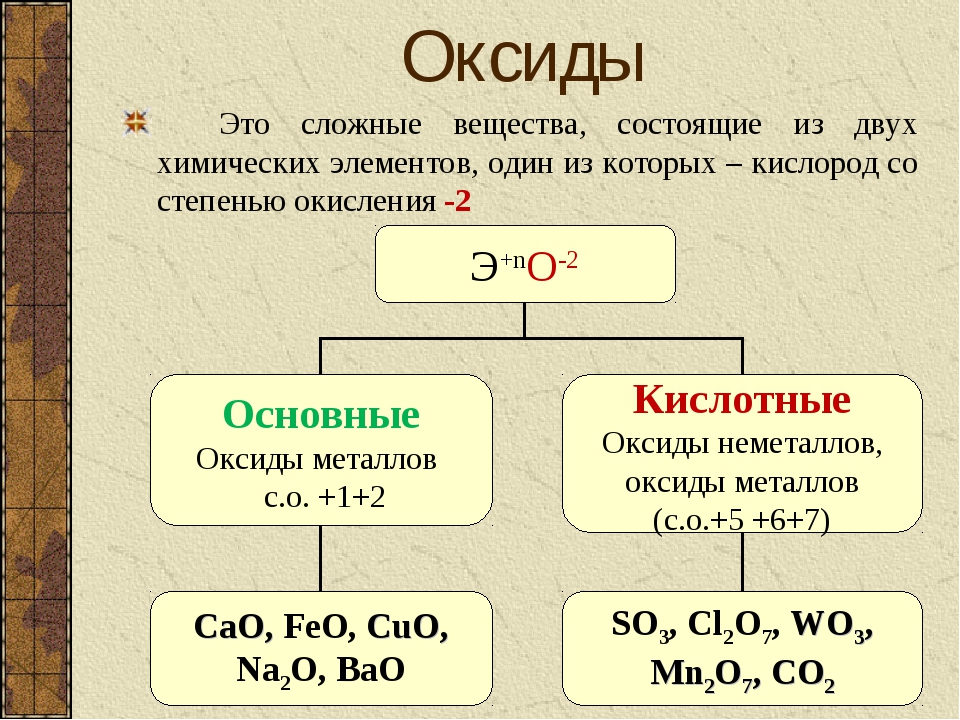 Например, химические элементы железо, медь и кремний, имеющие обозначения Fe, Cu и Si, образуют простые вещества, формулы которых Fe, Cu и Si соответственно. Существует также небольшая группа простых веществ, состоящих из разрозненных атомов, никак не связанных между собой. Такие вещества являются газами, которые называют, ввиду их крайне низкой химической активности, благородными. К ним относятся гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn).
Например, химические элементы железо, медь и кремний, имеющие обозначения Fe, Cu и Si, образуют простые вещества, формулы которых Fe, Cu и Si соответственно. Существует также небольшая группа простых веществ, состоящих из разрозненных атомов, никак не связанных между собой. Такие вещества являются газами, которые называют, ввиду их крайне низкой химической активности, благородными. К ним относятся гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn).
Поскольку только известных простых веществ насчитывается около 500, то логично вытекает вывод о том, что для многих химических элементов характерно явление, называемое аллотропией.
Аллотропия – явление, когда один химический элемент может образовывать несколько простых веществ. Разные химические вещества, образованные одним химическим элементом, называют аллотропными модификациями или аллотропами.
Так, например, химический элемент кислород может образовывать два простых вещества, одно и которых имеет название химического элемента – кислород. Кислород как вещество состоит из двухатомных молекул, т.е. формула его O2. Именно данное соединение входит в состав жизненно необходимого нам воздуха. Другой аллотропной модификацией кислорода является трехатомный газ озон, формула которого O3. Несмотря на то что и озон, и кислород образованы одним химическим элементом, их химическое поведение весьма различно: озон отличается намного большей активностью по сравнению с кислородом в реакциях с теми же веществами. Кроме того, данные вещества отличаются друг от друга по физическим свойствам уже как минимум из-за того, что молекулярная масса озона больше, чем у кислорода в 1,5 раза. Это приводит к тому, что его плотность в газообразном состоянии также больше в 1,5 раза.
Кислород как вещество состоит из двухатомных молекул, т.е. формула его O2. Именно данное соединение входит в состав жизненно необходимого нам воздуха. Другой аллотропной модификацией кислорода является трехатомный газ озон, формула которого O3. Несмотря на то что и озон, и кислород образованы одним химическим элементом, их химическое поведение весьма различно: озон отличается намного большей активностью по сравнению с кислородом в реакциях с теми же веществами. Кроме того, данные вещества отличаются друг от друга по физическим свойствам уже как минимум из-за того, что молекулярная масса озона больше, чем у кислорода в 1,5 раза. Это приводит к тому, что его плотность в газообразном состоянии также больше в 1,5 раза.
Многие химические элементы склонны образовывать аллотропные модификации, отличающиеся друг от друга особенностями строения кристаллической решетки. Так, например, на рисунке 5, вы можете видеть схематичные изображения фрагментов кристаллических решеток алмаза и графита, которые являются аллотропными модификациями углерода.
Рисунок 5. Фрагменты кристаллических решеток алмаза (а) и графита (б)
Кроме того, углерод может иметь и молекулярное строение: такая структура наблюдается у такого типа веществ, как фуллерены. Вещества данного типа образованы молекулами углерода сферической формы. На рисунке 6 представлены 3D модели молекулы фуллерена с60 и футбольного мяча для сравнения. Обратите внимание на их интересное сходство.
Рисунок 6. Молекула фуллерена С60 (а) и футбольный мяч (б)
Сложные вещества — это вещества, которые состоят из атомов разных элементов. Они так же, как и простые вещества, могут иметь молекулярное и немолекулярное строение. Немолекулярный тип строения сложных веществ может быть более разнообразен, нежели у простых. Любые сложные химические вещества могут быть получены либо прямым взаимодействием простых веществ, либо последовательностью их взаимодействий друг с другом. Важно осознавать один факт, который заключается в том, что свойства сложных вещества как физические, так и химические сильно отличаются от свойств простых веществ, из которых они получены.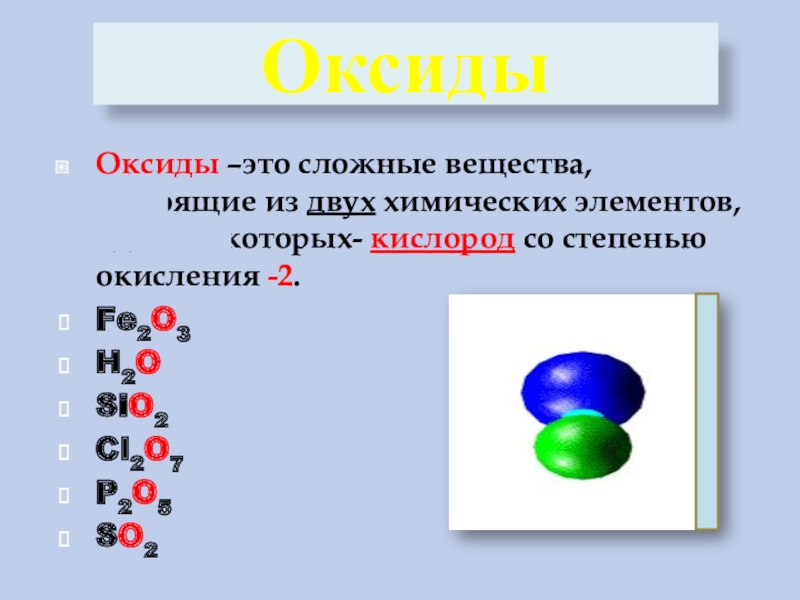 Например, поваренная соль, имеющая форуму NaCl и представляющая собой бесцветные прозрачные кристаллы, может быть получена взаимодействием натрия, являющегося металлом с характерными для металлов свойствами (блеск и электропроводность), с хлором Cl2 — газом желто-зеленого цвета.
Например, поваренная соль, имеющая форуму NaCl и представляющая собой бесцветные прозрачные кристаллы, может быть получена взаимодействием натрия, являющегося металлом с характерными для металлов свойствами (блеск и электропроводность), с хлором Cl2 — газом желто-зеленого цвета.
Серная кислота H2SO4 может быть образована серией последовательных превращений из простых веществ — водорода H2, серы S и кислорода O2. Водород — газ легче воздуха, образующий с воздухом взрывчатые смеси, сера — твердое вещество желтого цвета, способное гореть, и кислород — газ чуть тяжелее воздуха, в котором могут гореть многие вещества. Серная кислота, которая может быть получена из данных простых веществ, представляет собой тяжелую маслянистую жидкость, обладающая сильными водоотнимающими свойствами, из-за которых обугливает многие вещества органического происхождения.
Очевидно, что помимо индивидуальных химических веществ, бывают также и их смеси.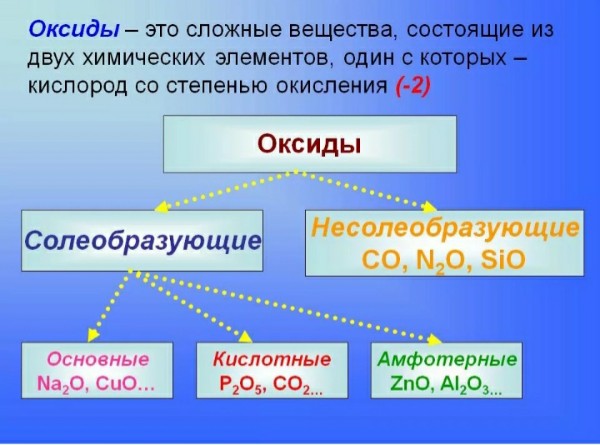 Преимущественно именно смесями различных веществ образован мир вокруг нас: сплавы металлов, продукты питания, напитки, различные материалы, из которых состоят окружающие нас предметы.
Преимущественно именно смесями различных веществ образован мир вокруг нас: сплавы металлов, продукты питания, напитки, различные материалы, из которых состоят окружающие нас предметы.
Например, воздух, которым мы дышим, состоит в основном из азота N2 (78%), жизненно необходимого нам кислорода (21%), оставшийся же 1% приходится на примеси других газов (углекислый газ, благородные газы и др.).
Смеси веществ разделяют на гомогенные и гетерогенные. Гомогенными смесями называют такие смеси, у которых нет границ раздела фаз. Гомогенными смесями являются смесь спирта и воды, сплавы металлов, раствор соли и сахара в воде, смеси газов и т.д. Гетерогенными смесями называют такие смеси, у которых имеется граница раздела фаз. К смесям такого типа можно отнести смесь песка и воды, сахара и соли, смесь масла и воды и др.
Вещества, из которых состоят смеси, называют компонентами.
Смеси простых веществ в отличие от химических соединений, которые могут быть получены из этих простых веществ, сохраняют свойства каждого компонента.
Простые и сложные вещества
1. Простыми называются вещества, которые состоят из атомов одного химического элемента (О2, Н2, Na, Al)
2. Сложными называются вещества, которые состоят из нескольких химических элементов (H2O, CuSO4)
3. Оксиды — сложные вещества, которые состоят из атомов двух химических элементов, один из которых кислород со степенью окисления -2.
4. Основные оксиды — оксиды, которым соответствуют основания (CaO — Ca(OH)2)
5. Кислотные оксиды — оксиды, которым соответствуют кислоты (P2O5 — H3PO4, Mn2O7 — HMnO4)
6. Амфотерные оксиды — оксиды, проявляющие основные и кислотные свойства (Al2O3, BeO, ZnO, Cr2O3)
7. Несолеобразующие оксиды — не проявляют ни основных ни кислотных свойств (N2O, NO, CO)
8. Кислоты — сложные вещества, которые состоят из атомов водорода и кислотных остатков
Кислоты — сложные вещества, которые состоят из атомов водорода и кислотных остатков
HCl — соляная кислота (хлороводородная) (хлориды)
HNO3 — азотная (нитраты)
H2SO4 — серная (сульфаты)
H3PO4 — фосфорная (фосфаты)
H2CO3 — угольная (карбонаты)
H2S — сероводородная (сульфиды)
H2SO3 — сернистая (сульфиты)
H2SiO3 — кремниевая (силикаты)
HF — фтороводородная (плавиковая) (фториды)
HBr — бромоводородная (бромиды)
HNO2 — азотистая (нитриты)
9. Основания — сложные вещества, которые состоят из катиона металла и гидроксид-ионов (NaOH, Fe(OH)3). Растворимые в воде основания называют щелочами.
10. Соли — сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков (NaCl, CuSO4)
Давайте порассуждаем вместе
1. Сульфат алюминия относят к классу:
Сульфат алюминия относят к классу:
1) оксидов
2) оснований
3) солей
4) кислот
Ответ: сульфат алюминия Al2(SO4)3 относят к классу солей, т.к. это сложное вещество, которое состоит из катионов металла алюминия и кислотных остатков сульфат-анионов.
2. Кислотой и щелочью соответственно являются вещества, формулы которых:
1) HCl, Cu(OH)2
2) HNO3, Ba(OH)2
3) NaCl, NaOH
4) H2SiO3, Fe(OH)2
Ответ: правильный ответ №2, т.к. HNO3 — это азотная кислота, а Ва(OH)2 — основание, которое хорошо растворяется в воде, значит является щелочью
3. Основному оксиду соответствует формула:
Основному оксиду соответствует формула:
1) SO3
2) NO2
3) MgO
4) P2O5
Ответ: MgO — основный оксид, т.к. ему соответствует основание Mg(OH)2
4. Амфотерным оксидом и кислотным оксидом соответственно явлются вещества:
1) Al2O3, SO2
2) NaOH, P2O5
3) ZnO, HCl
4) Zn(OH)2, H2SO4
Ответ: правильный ответ №1, т.к. Al2O3 — амфотерный оксид, а SO2 — кислотный оксид, ему соответствует сернистая кислота H2SO3
5. Нерастворимым основанием и солью соответственно являются вещества:
1) KOH, Ca(NO3)2
2) CaO, Na2CO3
3) Mg(OH)2, H2SO4
4) Fe(OH)3, AgBr
Ответ: правильный ответ №4, т.
к. Fe(OH)3 — нерастворимое основание, а AgBr — бромид серебра — соль
Простые и сложные вещества — HimHelp.ru
Химия занимается изучением превращений химических веществ (число известных к настоящему времени веществ более десяти миллионов), поэтому очень важна классификация химических соединений. Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. С проблемой классификации тесно связана проблема номенклатуры, т.е. системы названий этих веществ
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ (их, с учетом аллотропных модификаций, насчитывается около 400) и очень многочисленную группу сложных веществ.
Сложные вещества обычно делят на четыре важнейших класса: оксиды, основания (гидроксиды), кислоты, соли
Приведенная первичная классификация уже с самого начала оказывается несовершенной. Например, в ней нет места для аммиака, соединений металлов с водородом, азотом, углеродом, фосфором и т.д., соединений неметаллов с другими неметаллами и т.д.
Например, в ней нет места для аммиака, соединений металлов с водородом, азотом, углеродом, фосфором и т.д., соединений неметаллов с другими неметаллами и т.д.
Перед тем, как рассмотреть более детально каждый из классов неорганических соединений, целесообразно взглянуть на схему, отражающую генетическую связь типичных классов соединений
В верхней части схемы помещены две группы простых веществ — металлы и неметаллы, а также водород, строение атома которого отличается от строения атомов других элементов. На валентном слое атома водорода находится один электрон, как у щелочных металлов; в то же время, до заполнения электронного слоя оболочки ближайшего инертного газа — гелия — ему недостает также одного электрона, что роднит его с галогенами.
Волнистая черта отделяет простые вещества от сложных; он символизирует, что «пересечение» этой границы обязательно затрагивает валентные оболочки атомов в простых веществах, следовательно, любая реакция с участием простых веществ будет окислительно-восстановительной.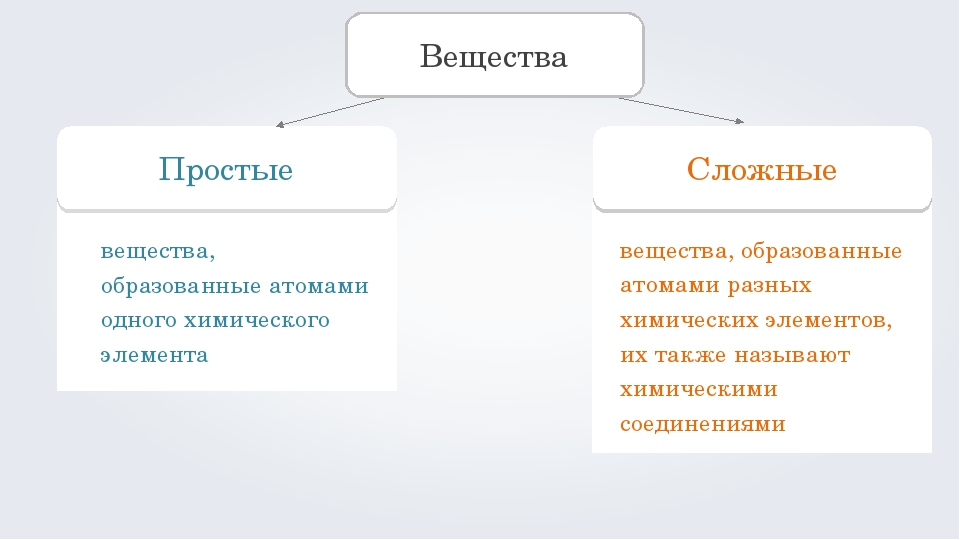
В левой части схемы под металлами помещены их типичные соединения — основные оксиды и основания, в правой части схемы помещены соединения, типичные для неметаллов, кислотные оксиды и кислоты. Водород, помещенный в верхней части схемы, дает очень специфический, идеально амфотерный оксид — воду Н2О, которая в комбинации с основным оксидом дает основание, а с кислотным — кислоту. Водород в сочетании с неметаллами образует бескислородные кислоты. В нижней части схемы помещены соли, которые, с одной стороны, отвечают соединению металла с неметаллом, а с другой — комбинации основного оксида с кислотным.
Приведенная схема до некоторой степени отражает и возможности протекания химических реакций — как правило, в химическое взаимодействие вступают соединения, принадлежащие разным половинам схемы.
Урок 4. Сложные вещества – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Органические и неорганические вещества
Подавляющее большинство химических веществ — это сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы.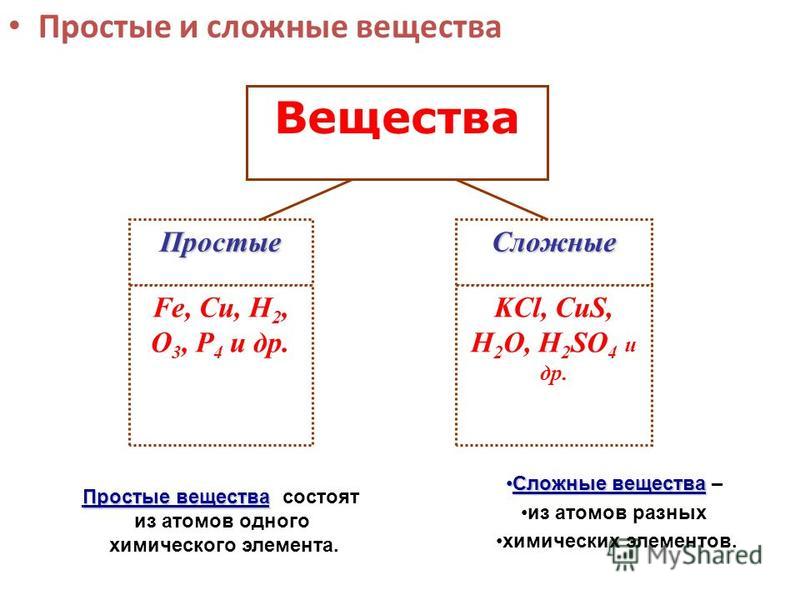 Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Простейшим органическим веществом является природный газ метан. Но вам, наверное, знакомы и такие органические вещества, как сахар (сахароза), уксусная и лимонная кислоты, спирт, крахмал, белки, жиры, пластмассы и т. д. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать при обычных условиях в различных агрегатных состояниях. Например, метан — газ, вода — жидкость, сахар — твердое вещество.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
- Сложными называются вещества, состоящие из атомов разных химических элементов.

- Каждое чистое вещество имеет определенный качественный и количественный состав.
- Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено.
- Сложные вещества имеют молекулярное или немолекулярное строение.
- Все сложные вещества делятся на органические и неорганические.
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Химические реакции железа с простыми и сложными веществами и его роль в жизнедеятельности человека
Железо — второй по распространенности металл на Земле. Он имеет среднюю химическую активность и используется людьми в самых разных сферах деятельности. Это металл с магнитными свойствами.
Распространение железа в природе
Многие минералы содержат железо — например, магнетит на 72% состоит из железа.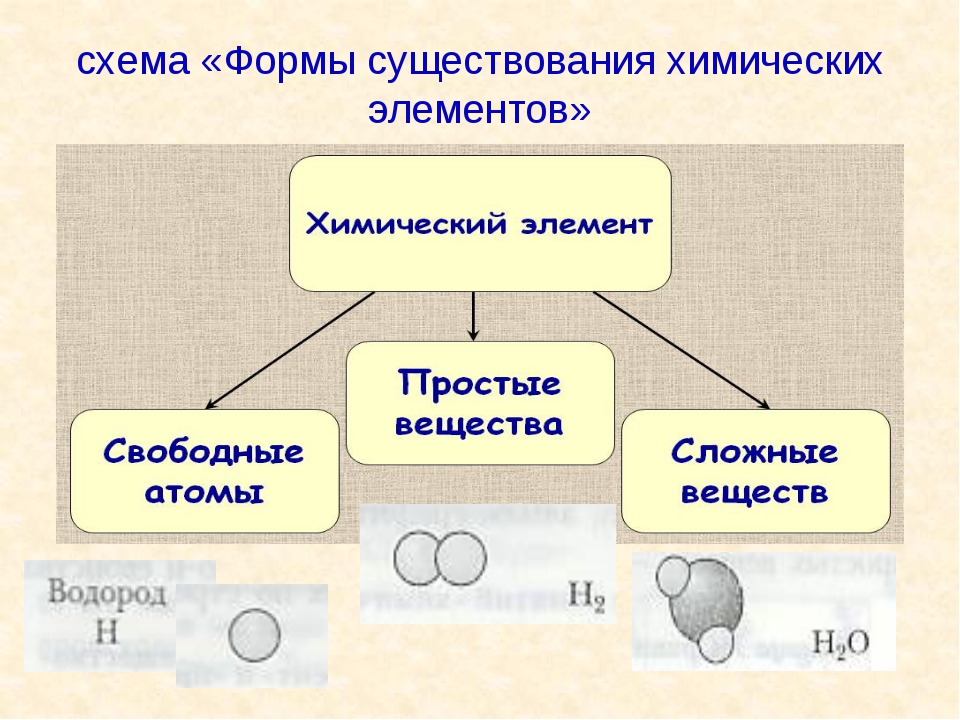 Этот минерал, известный как «магнитная железная руда», темно-серый (почти черный) и имеет характерный металлический блеск.Гематит — еще один минерал с высоким содержанием железа (до 70%). Этот элемент известен как «красная железная руда» и имеет темно-красный цвет с коричневым оттенком до серовато-красного.
Этот минерал, известный как «магнитная железная руда», темно-серый (почти черный) и имеет характерный металлический блеск.Гематит — еще один минерал с высоким содержанием железа (до 70%). Этот элемент известен как «красная железная руда» и имеет темно-красный цвет с коричневым оттенком до серовато-красного.
Лимонит — минерал с содержанием железа 85%. Этот элемент представляет собой кристаллогидрат желтого, реже коричневого цвета. Лимонит известен как «коричневая железная руда» и используется в качестве пигмента.
Сидерит — минерал, известный как «спатическая железная руда», с содержанием железа 35%. Структура элемента неоднородна и состоит из кристаллов серого, желтого и коричневого оттенков.
Пирит — минерал с содержанием железа 47%. Этот элемент имеет желто-золотистый оттенок из-за присутствующих в нем атомов серы.
Многие из перечисленных выше минералов используются для производства чистого железа. Железо присутствует в живых организмах и является важным компонентом клеток. Для правильного функционирования человеческого организма необходимо употреблять достаточное количество этого микроэлемента, что положительно сказывается на состоянии крови.
Для правильного функционирования человеческого организма необходимо употреблять достаточное количество этого микроэлемента, что положительно сказывается на состоянии крови.
Химические свойства железа
Железо обладает свойствами, типичными для других металлов (исключение составляют металлы в электрохимическом ряду справа от водорода). Железо вступает в реакцию с веществами разных классов, взаимодействует с кислородом, углеродом, фосфором, галогенами (бром, йод, фтор и хлор), а также с азотом. Это не все реакции железа — этот металл вступает в реакцию со многими элементами.
Чтобы получить оксид железа, металл обжигают, и продукты этой химической реакции зависят от пропорции участвующих элементов.Соответственно, свойства оксида железа различаются. Эта реакция может быть проведена только при высокой температуре.
Реакция между железом и азотом также возможна при нагревании. Химические реакции с железом и фосфором образуют фосфид, а также железо взаимодействует с серой, образуя сульфид (это происходит в результате реакции сочетания). Любая цепная реакция с железом и другими элементами требует особых условий — обычно высокие температуры, реже катализаторы.
Любая цепная реакция с железом и другими элементами требует особых условий — обычно высокие температуры, реже катализаторы.
Взаимодействие железа с галогенами часто используется в промышленности — реакция бромирования, хлорирования, фторирования и иодирования. Эта реакция происходит от присоединения атомов брома, хлора, фтора или йода к атомам железа с последующим образованием бромида, хлорида, фторида и йодида. При высокой температуре железо связывается с кремнием.
Разнообразные химические свойства железа привели к широкому применению металла в промышленности, что трудно представить без существования железа.
Щелкните здесь, чтобы увидеть удивительные эксперименты с железом.
Взаимодействие железа с комплексными веществами
Стоит обсудить взаимодействие железа с веществами, молекулы которых состоят как минимум из двух элементов. При взаимодействии раскаленного железа с водой происходит окислительная реакция, в результате которой образуется основной оксид.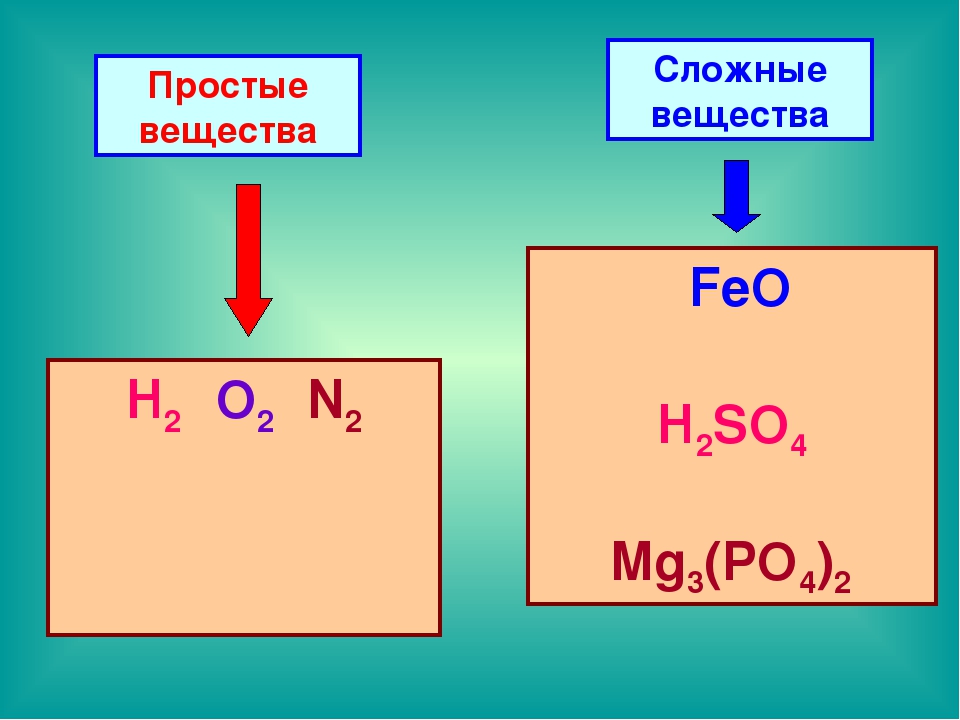 Результат взаимодействия будет зависеть от пропорций компонентов — если взять 4 моля воды и 3 моля железа, вы получите водород (газ с резким запахом) и железную огарку.
Результат взаимодействия будет зависеть от пропорций компонентов — если взять 4 моля воды и 3 моля железа, вы получите водород (газ с резким запахом) и железную огарку.
Также осуществляется реакция железа с солями и кислотами. Железо вытесняет водород из соединений за счет реакции замещения. Наблюдать это можно, добавив в железо кислоту. Например, когда вы смешиваете разбавленную серную кислоту и железо в одинаковых молярных пропорциях, водород и сульфат железа образуются в одинаковых молярных пропорциях.
Другой пример реакции вытеснения:
Взаимодействие с солями показывает, что железо обладает восстанавливающими свойствами.При использовании железа менее активный металл вытесняется из соли. Пример: если вы смешаете один моль железа и один моль сульфата меди, в результате получится чистая медь и сульфат железа в равных молярных пропорциях.
Железо и его значение для человеческого организма
Железо выполняет важные функции на клеточном уровне; этот элемент является основой гемоглобина, без которого транспортировка кислорода в крови от легких к нейронам головного мозга и ко всем тканям тела была бы невозможна. Железо влияет на кроветворение, и без него щитовидная железа не могла бы нормально работать. Железо регулирует иммунитет и участвует в межклеточном метаболизме, и без него многие ферменты в организме человека не образовались бы. Чтобы не страдать дефицитом железа, людям следует регулярно употреблять продукты, содержащие этот микроэлемент.
Железо влияет на кроветворение, и без него щитовидная железа не могла бы нормально работать. Железо регулирует иммунитет и участвует в межклеточном метаболизме, и без него многие ферменты в организме человека не образовались бы. Чтобы не страдать дефицитом железа, людям следует регулярно употреблять продукты, содержащие этот микроэлемент.
Как производится чугун для промышленности
Металл в основном производится из минералов — гематита и магнетита.Это достигается путем восстановления железа из его соединений углеродом в виде кокса. Процесс происходит в доменных печах при температуре 2000 ° C. Применяется также метод восстановления железа водородом — требуется специальная глина, которую смешивают с измельченной рудой и обрабатывают водородом из шахтной печи.
Железо широко распространено по всей планете и составляет до 5% земной коры. Считается, что большая часть ядра Земли состоит из железа.
| A | B |
|---|---|
| химическая реакция | Процесс, при котором вещества претерпевают химические и физические изменения, в результате которых образуются новые вещества с различными свойствами |
| реагент | вещество, которое вступает в химическую реакцию |
| продукт | вещество, полученное в результате химической реакции |
| химическое уравнение | выражение, которое используется для представления химических реакций |
| реакция синтеза | химическая реакция, в которой две или более простые вещества, которые объединяются, чтобы сформировать новое более сложное вещество |
| реакция разложения | химическая реакция, в которой простое вещество распадается на два или более простых вещества |
| реакция однократного замещения | химическая реакция в wh ich несоединенный элемент заменяет элемент, который является частью соединения |
| реакция двойной замены | химическая реакция, в которой разные ионы двух разных соединений заменяют друг друга |
| экзотермическая реакция | химическая реакция, в которой выделяется тепло |
| эндотермическая реакция | химическая реакция, в которой связано тепло |
| активированный комплекс | очень нестабильная структура, образующаяся, когда реагенты объединяются и перестраиваются с образованием продуктов |
| экзергоническая реакция | химическая реакция, которая протекает легко; спонтанная реакция |
| эндергоническая реакция | химическая реакция, которая не является спонтанной |
| кинетика | исследование скорости химических реакций |
| скорость реакции | мера того, насколько быстро реагенты превращаются в продукцию |
| теория столкновений | теория, которая связывает столкновения между частицами и скоростью реакции; скорость реакции зависит от таких факторов, как площадь поверхности концентрации |
| катализатор | вещество, которое увеличивает скорость химической реакции без изменения |
| Почему вещества вступают в химическую реакцию? | субстратов реагируют из-за уровня согласованности и выделяемой или выделяемой тепловой энергии |
Опишите, что такое химическое уравнение. | Выражения, в которых числа формулы используются для представления химической реакции. |
| Укажите закон сохранения массы и объясните ее роль в химических уравнениях. | ; масса остается постоянной и никогда не теряется; наблюдение, что масса остается постоянной в химической реакции |
| Что такое коэффициент? | коэффициент — это число перед формулой |
| В чем разница между h3O2 и 2h3O? | два или более вещества, которые объединяются в новое сложное вещество. |
| Опишите каждый из четырех типов химических реакций. Включите уравнение, показывающее общую форму для каждого. | реакция синтеза; двойная замена, одиночная замена и декомпозиция; синтез — это соединение двух или более простых веществ с образованием нового, более сложного вещества a + b = c разложение — это вещество, которое распадается на две или более более простые составляющие c = a + b одиночная замена несоединенный элемент, который заменяет элемент, который уже является частью соединения a + BX = AX + B двойная замена разные ионы в двух различных соединениях замещают друг друга AX + BY = AY + BX |
| Как может катализатор влиять на энергию активированного комплекса? | катализаторы могут изменять скорость реакции, и это дает другую более низкую энергетическую схему реакции. |
| Объясните, как содержание энергии продуктов реакции сравнивается с содержанием энергии реагентов, когда реакция является экзотермической | Реагенты должны заберитесь на вершину холма энергии, чтобы сформировать активированный комплекс.Энергия высвобождается в форме продуктов. |
| Используйте теорию столкновений, чтобы объяснить влияние на скорость реакции повышенной концентрации, катализаторов и увеличенной площади поверхности. | Поверхность вокруг, реакция в твердом теле может быть увеличена за счет разрушения твердого тела на более мелкие части, увеличивается столкновение между реагирующими частицами. Катализаторы увеличивают согласованность химической реакции, чем больше продуктов образуется за определенный промежуток времени. |
Назовите две причины, по которым столкновения между молекулами реагентов не могут быть эффективными при образовании продуктов. | вещества, которые вступают в химическую реакцию, являются реагентами, как только реагент входит в химическую формулу, на молекулы уже влияют в продуктах |
| В сбалансированном химическом уравнении | xx |
| Два или более вещества объединяются, образуя | a новая реакция синтеза более сложных веществ |
| В эндотермической реакции тепло составляет | тепло отбирается в реагирующие химические вещества и становится химической энергией в продуктах реакции |
| Энергия, необходимая для образования реагентов. продукты называется | активная энергия |
| Вещества слева от стрелки в химическом уравнении называются | coeffciebts |
| Способность атома вступать в химические реакции определяется | крайними электронами |
| Скорость химической реакции может быть увеличена за счет | увеличение площади поверхности |
| Добавление катализатора в реакцию увеличивает ее скорость на | снижает энергию активации |
| Вещества, образующиеся в результате химической реакции, называются | продукт |
| Число, записанное в перед химическим символом или формулой стоит коэффициент | |
В реакции ____ сложные вещества из более простых. | реакция разложения |
| Образование диоксида углерода при сгорании топлива является примером _____ реакции. | xx |
| В экзотермических реакциях продукты имеют ____ энергии, чем реагенты. | xx |
| Изучение скорости химической реакции ____ | кинестика |
| Теория ___ может использоваться для учета факторов, влияющих на скорость реакции. | да теория столкновений |
| термическое означает | тепло |
| ex означает | уйти или освободить |
| en означает | внутри или внутри |
| Какова взаимосвязь между расположением электроны в атоме и химические свойства атома? | Расположение электронов в атоме определяет легкость, с которой атом образует химические связи.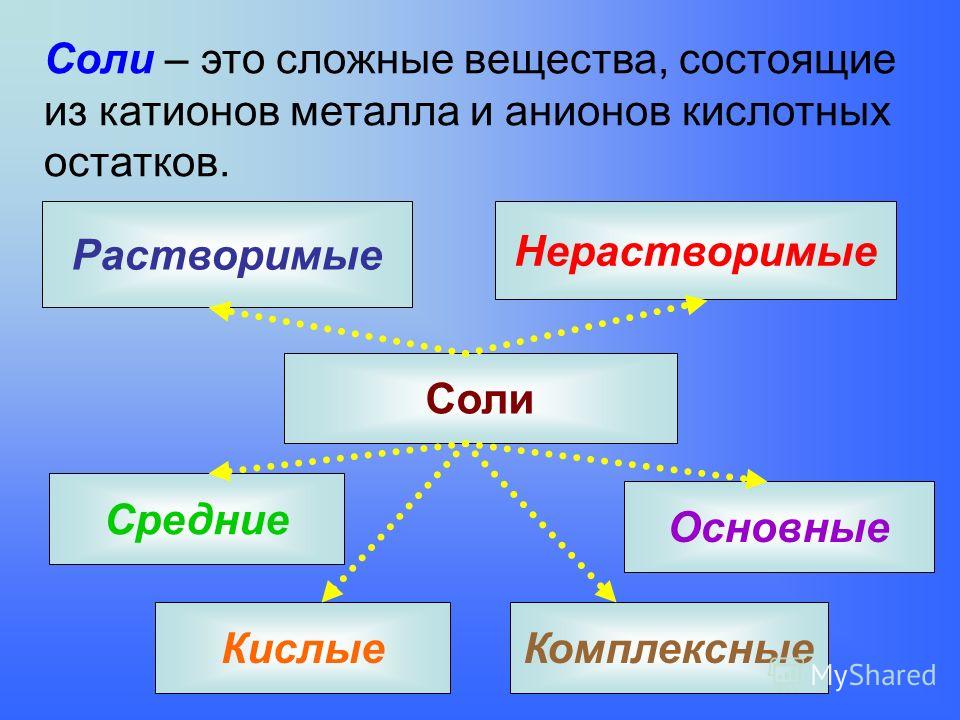 |
| Почему должно быть сбалансировано химическое уравнение? | количество атомов каждого элемента должно быть одинаковым с обеих сторон уравнения |
| Объясните, почему вы не можете изменить символы, формулы или индексы, чтобы сбалансировать химическое уравнение. | Изменение индекса означало бы изменение вещества; изменение формулы изменило бы все химическое уравнение; изменение символа приведет к изменению всего элемента |
| С какой стороны следует записать энергетический член в уравнении, представляющем эндотермическую реакцию? | xx |
| эндо означает | в |
| Как скорость реакции связана с теорией столкновений? | Все зависит от того, как быстро частицы сталкиваются. |
| Как теория столкновений объясняет влияние понижения температуры на скорость реакции? | повышение температуры — это увеличение скорости реакции |
| Вопрос | Ответ |
|---|---|
| Физическое изменение | Изменение, которое изменяет форму или внешний вид материала, но не превращает материал в другое вещество. |
| Химическое изменение | Изменение, при котором одно или несколько веществ объединяются или распадаются с образованием новых веществ. |
| Реагент | Вещество, вступающее в химическую реакцию. |
| Продукт | Вещество, образовавшееся в результате химической реакции. |
| Осадок | Твердое вещество, которое образуется из раствора во время химической реакции. |
| Экзотермическая реакция | Реакция, при которой выделяется энергия, обычно в виде тепла. |
| Эндотермическая реакция | Реакция с поглощением энергии. |
| Химическое уравнение | Краткий и простой способ показать химическую реакцию с помощью символов. |
| Закон сохранения массы | Принцип, согласно которому общее количество материи не создается и не разрушается во время каких-либо химических или физических изменений. |
| Открытая система | Система, в которой вещество может проникать в окружающую среду или выходить из нее. |
| Замкнутая система | Система, в которой любой материи разрешено входить или выходить. |
| Коэффициент | Число перед химической формулой в уравнении, которое указывает, сколько молекул или атомов каждого реагента и продукт участвуют в реакции. |
| Синтез | Химическая реакция, в которой два или более простых вещества объединяются с образованием нового, более сложного вещества. |
| Разложение | Химическая реакция, при которой соединения расщепляются на более простые продукты. |
| Замена | Реакция, в которой один элемент заменяет другой в соединении или когда два элемента в разных соединениях меняются местами. |
| Энергия активации | Минимальное количество энергии, необходимое для начала химической реакции. |
| Концентрация | Количество одного материала в определенном объеме другого материала. |
| Катализатор | Материал, повышающий скорость реакции за счет снижения энергии активации. |
| Фермент | Тип белка, который ускоряет химическую реакцию в живом организме; биологический катализатор, снижающий энергию активации реакций в клетках. |
| Ингибитор | Материал, снижающий скорость реакции. |
Закон сохранения массы впервые продемонстрировал французский химик __________. | Антуан Лавуазье |
| В уравненном уравнении образования аммиака из азота и водорода сумма коэффициентов равна? | шесть |
| В химическом уравнении стрелка читается как ________. | дает |
| Образование диоксида углерода при сжигании топлива является примером реакции __________. | синтез |
| Реакция, в которой водород и кислород производятся при пропускании электрического тока через воду, является примером разложения | |
| , реакция, в которой два соединения используются в качестве реагентов, и два соединения в качестве продуктов, наиболее вероятна. a | реакция двойного замещения |
| В сбалансированном химическом уравнении атомами являются ________. | консервативный |
| Вещество, присутствующее после реакции | продукт |
| Реакция, в которой вещества объединяются с образованием более сложного соединения? | реакция синтеза |
Принцип, согласно которому материя не создается и не разрушается во время химической реакции.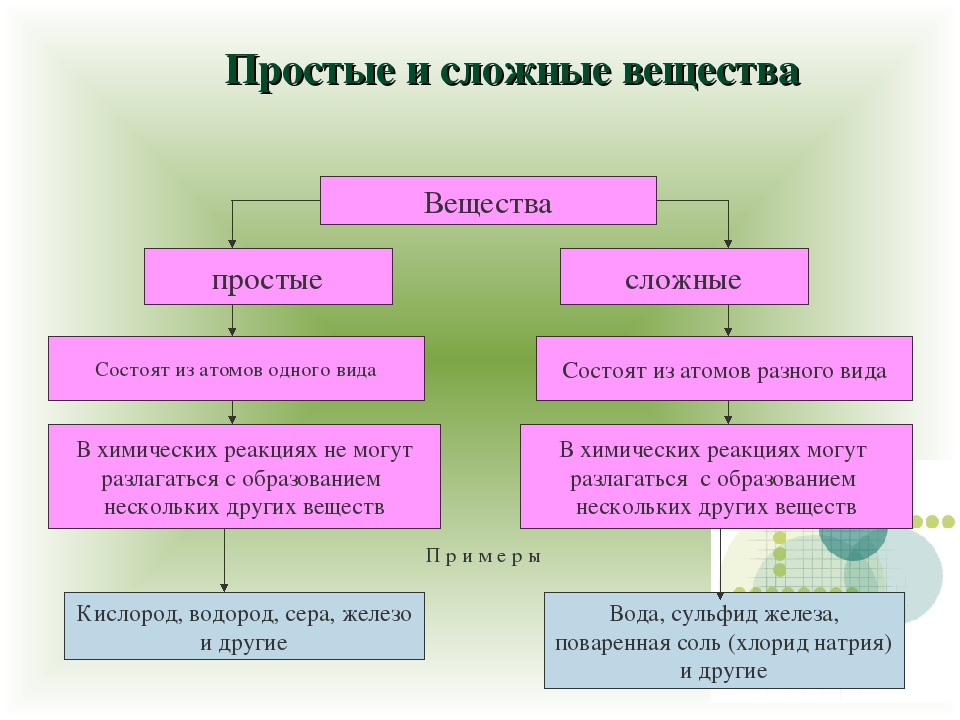 | сохранение массы |
| Реакция, в которой один элемент замещает другой в соединении. | реакция замещения |
| Вещество, присутствующее до реакции. | Реагент |
| Число, показывающее, сколько молекул вещества участвует в химической реакции. | коэфф. |
| Реакция, в которой соединения распадаются на более простые вещества. | реакция разложения |
| Для обозначения химических реакций используются символы и формулы. | химическое уравнение |
| При физическом изменении некоторые физические свойства вещества могут измениться, а химический состав ___________. | остается прежним |
| Другое название химического изменения — химическое вещество _________. | реакция |
| Способность реагировать с кислородом является примером ___________ свойства. | химический |
Вещества, вступающие в химическую реакцию, называются _____________.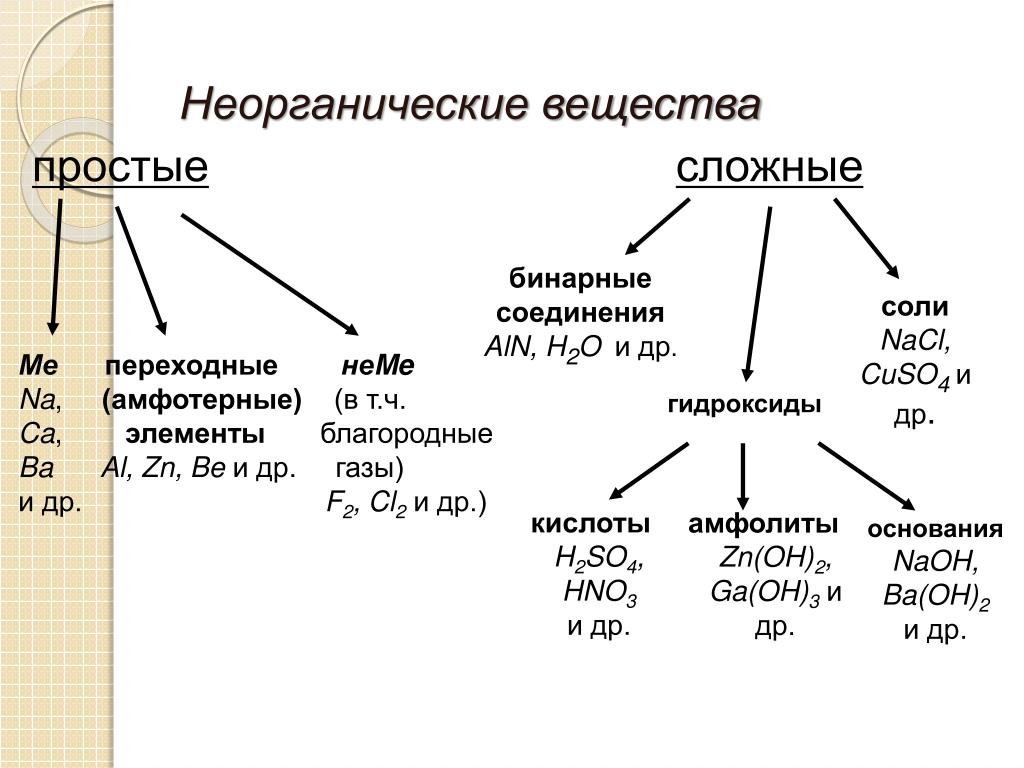 | реагенты |
| Вода кипит при 100 градусах Цельсия. Это пример какого типа собственности? | физический |
| В экзотермической реакции продукты имеют больше или меньше энергии, чем реагенты? | минус |
| Что из следующего не является физическим имуществом? температура плавления, состояние вещества, плотность, горючесть | воспламеняемость |
| Вещества, образующиеся в результате химической реакции, называются? | товаров |
| Химические реакции сопровождаются изменением ___________. | энергия |
| Химические реакции образуют новые вещества с новыми ___________. | свойства |
| В эндотермической реакции энергия _________. | абсорбировано |
| Осадок | твердое вещество, образованное из жидких реагентов во время химической реакции. |
| Эндотермическая реакция | реакция, в которой поглощается энергия.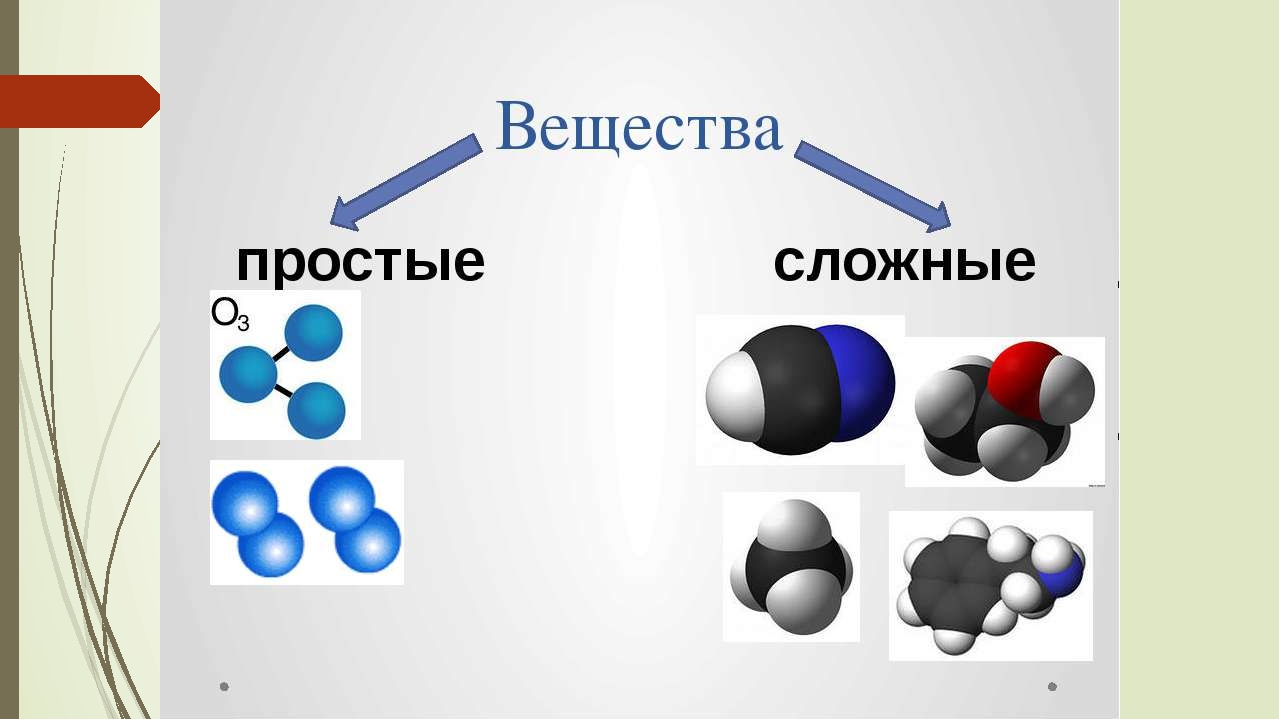 |
| Экзотермическая реакция | реакция, которая высвобождает энергию в виде тепла |
| материя | все, что имеет массу и занимает пространство |
| физическое изменение | любое изменение, которое изменяет вещество без его изменения в другое вещество |
| Какие изменения вызывают выпечка торта? | химический |
| Какой тип изменений вызывает сжигание журнала? | химический |
| Какой тип изменений вызывает замерзшая вода? | физический |
| Какие наблюдаемые изменения происходят при выпечке торта? | тесто поднимается |
| Какие наблюдаемые изменения происходят при сжигании бревна? | чернеет и осыпается |
| Какие наблюдаемые изменения происходят при замерзании воды? | становится твердым |
Кормление животных Процесс пищеварения Седьмой класс Наука
Пищеварение
После приема пищи пища переваривается, а затем поступает в различные части тела для роста, восстановления и других жизненно важных функций организма.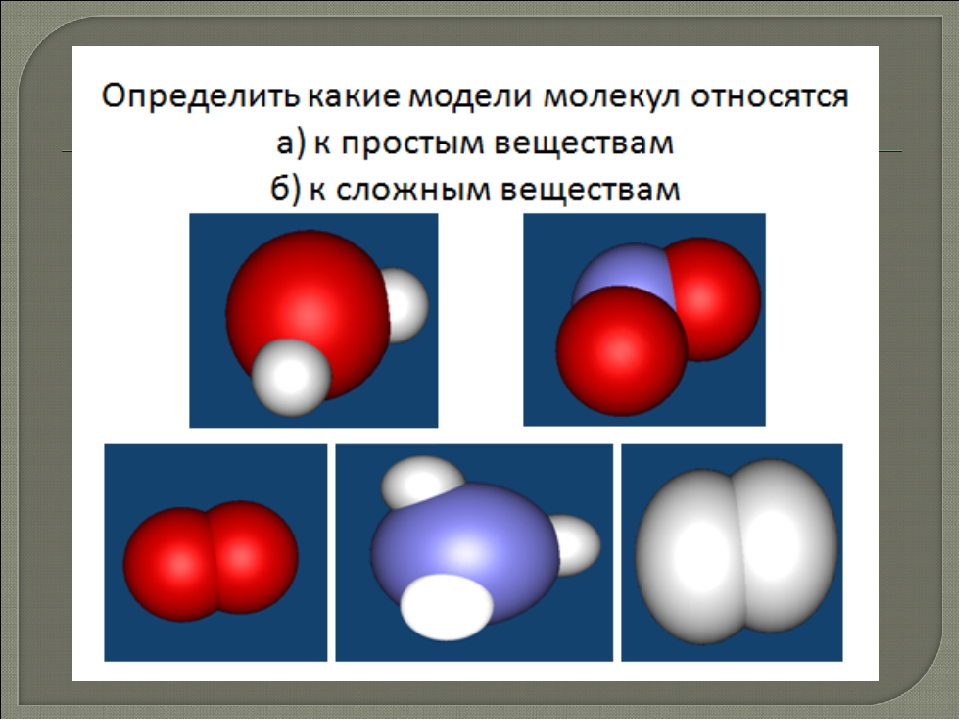
Пища, которую мы принимаем, в основном состоит из сложных веществ. Наш организм не может употреблять пищу в сложной форме. Итак, эти сложные вещества необходимо разбить на простые вещества, чтобы они могли усваиваться клетками тела. После этого клетки могут использовать такие простые вещества для различных целей, таких как рост и получение энергии, а также для получения энергии.
Процесс расщепления сложного компонента пищи на более простые вещества называется пищеварением. Процесс пищеварения различен у человека, травоядных животных, амеб, гидры и т. Д.Пищеварительные системы разных животных развивались в соответствии с различными диетическими потребностями этих животных. В случае амебы пищеварение внутриклеточное, , т.е. происходит внутри клетки. С другой стороны, пищеварение у сложных животных внеклеточное, , т.е. оно происходит вне клеток.
Ферменты помогают в расщеплении сложных молекул, таких как углеводы, белки, жиры и т. Д., На простые молекулы. Ферменты — это особые химические вещества, которые ускоряют химическую реакцию в процессе пищеварения.
Ферменты — это особые химические вещества, которые ускоряют химическую реакцию в процессе пищеварения.
Пищеварение у одноклеточных животных, таких как амеба, внутриклеточно. Как только амеба захватывает пищевую частицу, она образует пищевую вакуоль вокруг пищевой частицы. Пищеварительные ферменты секретируются в пищевых вакуолях. Пищеварение происходит внутри пищевых вакуолей. За этим следует всасывание и ассимиляция. После этого пищевая вакуоль прилипает к клеточной мембране с последующим выделением непереваренной пищи.
Вопрос 1. Что такое прием пищи?
Ответ: Прием пищи называется приемом пищи.
Вопросы 2: Что такое пищеварение?
Ответ: Разложение твердой и сложной пищи на простые и растворимые формы называется перевариванием.
Вопрос 3: Что такое абсорбция?
Ответ: Процесс попадания переваренной пищи в кровеносные сосуды кишечника называется абсорбцией.
Вопрос 4: Что вы понимаете под ассимиляцией?
Ответ: Преобразование поглощенной пищи в сложные вещества, такие как белки и витамины, необходимые организму, называется ассимиляцией.
Вопрос 5: Что вы понимаете под эгестией?
Ответ: Удаление шлаков из организма, время от времени из заднего прохода, называется очищением кишечника.
Вопросы 6: Каковы этапы питания животных?
Ответ: Есть пять этапов питания животных. Это прием внутрь, пищеварение, всасывание, ассимиляция и переваривание.
Вопросы 7: Что такое псевдоподии?
Ответ: Пальцевидные выросты на амебе называются псевдоподиями.
(Слово псевдоподия представляет собой комбинацию псевдоподий и стручок. Псевдо означает ложь, а стручок означает ступни. Единственное число псевдопозиций — это псевдоподиум)
Страница не найдена — Cefic-Lri
Программа Cefic-lri | Европейский совет химической промышленности
Условия использования | Политика конфиденциальности | Политика использования файлов cookie | Coockie Настройки
Настройки конфиденциальности
Решите, какие файлы cookie вы хотите разрешить.
Вы можете изменить эти настройки в любое время. Однако это может привести к тому, что некоторые функции станут недоступны. Для получения информации об удалении файлов cookie обратитесь к справочной функции вашего браузера.
Узнайте больше о файлах cookie, которые мы используем.
С помощью ползунка вы можете включать или отключать различные типы файлов cookie:
Этот сайт будет:
- Обязательно: запомните настройку разрешений для файлов cookie
- Обязательно: разрешите сеансовые файлы cookie
- Обязательно: собирайте информацию, которую вы вводите в контактные формы, информационный бюллетень и другие формы на всех страницах
- Обязательно: отслеживайте, что вы вводите в корзину
- Essential: подтвердите, что вы вошли в свою учетную запись пользователя
- Essential: запомните языковую версию, которую вы выбрали
Этого сайта не будет:
- Запомните свои данные для входа
- Функциональность: запомните настройки социальных сетей
- Функциональность: запомните выбранный регион и страну
- Аналитика: Отслеживайте посещенные вами страницы и выполненное взаимодействие
- Аналитика: Отслеживайте свое местоположение и регион в зависимости от вашего IP-номер
- Аналитика: отслеживайте время, проведенное на каждой странице
- Аналитика: Повышайте качество данных статистических функций
- Реклама: адаптируйте информацию и рекламу к вашим интересам на основе e.
 грамм. контент, который вы посещали ранее. (В настоящее время мы не используем файлы cookie для таргетинга или таргетинга.
грамм. контент, который вы посещали ранее. (В настоящее время мы не используем файлы cookie для таргетинга или таргетинга. - Реклама: собирайте личную информацию, такую как имя и местонахождение
Этот сайт будет:
- Обязательно: запомните настройку разрешений для файлов cookie
- Обязательно: разрешите сеансовые файлы cookie
- Обязательно: собирайте информацию, которую вы вводите в контактные формы, информационный бюллетень и другие формы на всех страницах
- Обязательно: отслеживайте, что вы вводите в корзину
- Essential: подтвердите, что вы вошли в свою учетную запись пользователя
- Essential: запомните выбранную языковую версию
- Функциональность: запомните настройки социальных сетей
- Функциональность: запомните выбранный регион и страну
Этого сайта не будет:
- Запомните данные для входа в систему
- Аналитика: отслеживайте посещенные страницы и выполненное взаимодействие
- Аналитика: отслеживайте свое местоположение и регион на основе вашего IP-номера
- Аналитика: отслеживайте время, проведенное на каждой странице
- Аналитика: повышение качества данных статистических функций
- Реклама: адаптация информации и рекламы к вашим интересам на основе e.
 грамм. контент, который вы посещали ранее. (В настоящее время мы не используем файлы cookie для таргетинга или таргетинга.
грамм. контент, который вы посещали ранее. (В настоящее время мы не используем файлы cookie для таргетинга или таргетинга. - Реклама: собирайте личную информацию, такую как имя и местонахождение
Этот сайт будет:
- Обязательно: запомните настройки разрешений для файлов cookie
- Обязательно: разрешите сеансовые файлы cookie
- Важно: собирайте информацию, которую вы вводите в контактные формы, информационный бюллетень и другие формы на всех страницах.
- Важно: отслеживайте, что вы вводите в корзину.
- Essential: подтвердите, что вы вошли в свою учетную запись пользователя
- Essential: запомните языковую версию, которую вы выбрали
- Функциональность: запомните настройки социальных сетейl Функциональность: запомните выбранный регион и страну
- Analytics: отслеживайте посещенные вами страницы и выполненное взаимодействие
- Аналитика: отслеживайте свое местоположение и регион на основе вашего IP-номера
- Аналитика: отслеживайте время, проведенное на каждой странице
- Аналитика: повышайте качество данных статистических функций
Этого сайта не будет:
- Запомните свои данные для входа в систему
- Реклама: используйте информацию для персонализированной рекламы с третьими сторонами
- Реклама: Разрешите вам подключаться к социальным сайтам
- Реклама: Идентифицируйте устройство, которое вы используете
- Реклама: Соберите личную информацию, такую как имя и расположение
Этот сайт будет:
- Обязательно: запомните настройки разрешений для файлов cookie
- Обязательно: разрешите сеансовые файлы cookie
- Важно: собирайте информацию, которую вы вводите в контактные формы, информационный бюллетень и другие формы на всех страницах.

- Важно: отслеживайте, что вы вводите в корзину.
- Essential: подтвердите, что вы вошли в свою учетную запись пользователя
- Essential: запомните языковую версию, которую вы выбрали
- Функциональность: запомните настройки социальных сетейl Функциональность: запомните выбранный регион и страну
- Analytics: отслеживайте посещенные вами страницы и выполненное взаимодействие
- Аналитика: отслеживайте свое местоположение и регион на основе вашего IP-номера
- Аналитика: отслеживайте время, проведенное на каждой странице
- Аналитика: повышайте качество данных статистических функций
- Реклама: используйте информацию для персонализированной рекламы с третьими сторонами
- Реклама: Позволяет подключаться t в социальные сети. l Реклама: идентификация устройства, которое вы используете
- Реклама: сбор личной информации, такой как имя и местонахождение
Этого сайта не будет:
- Запомните свои данные для входа
© Авторские права 2017 Cefic | Европейский совет химической промышленности. Все права защищены.
Все права защищены.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
8.3: Как написать сбалансированные химические уравнения
- Последнее обновление
- Сохранить как PDF
- Коэффициенты и индексы
- Уравновешивание химического уравнения
- Резюме
- Словарь
- Участники и авторства
Цели обучения
- Объясните роль индексов и коэффициентов в химических уравнениях.

- Уравновесить химическое уравнение, когда дано несбалансированное уравнение.
- Объясните роль Закона сохранения массы в химической реакции.
Несмотря на то, что химические соединения распадаются и новые соединения образуются в ходе химической реакции, атомы в реагентах не исчезают, и новые атомы не появляются, чтобы образовать продукты. В химических реакциях атомы никогда не создаются и не разрушаются. Те же атомы, которые присутствовали в реагентах, присутствуют в продуктах — они просто реорганизованы в разные структуры.В полном химическом уравнении две стороны уравнения должны присутствовать на сторонах реагента и продукта.
Коэффициенты и индексы
В химических уравнениях встречаются числа двух типов. Есть индексы, которые являются частью химических формул реагентов и продуктов, и есть коэффициенты, которые помещаются перед формулами, чтобы указать, сколько молекул этого вещества используется или производится.
Рисунок \ (\ PageIndex {1} \): Уравнения балансировки. Вы не можете изменить индексы в химической формуле, чтобы сбалансировать химическое уравнение; вы можете изменить только коэффициенты. Изменение индексов изменяет соотношение атомов в молекуле и получаемые в результате химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически разными веществами. H 2 O 2 разлагается на газ H 2 O и O 2 при контакте с металлической платиной, тогда как между водой и платиной такая реакция не происходит.
Вы не можете изменить индексы в химической формуле, чтобы сбалансировать химическое уравнение; вы можете изменить только коэффициенты. Изменение индексов изменяет соотношение атомов в молекуле и получаемые в результате химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически разными веществами. H 2 O 2 разлагается на газ H 2 O и O 2 при контакте с металлической платиной, тогда как между водой и платиной такая реакция не происходит.
Индексы являются частью формул, и как только формулы для реагентов и продуктов определены, индексы не могут быть изменены. Коэффициенты указывают количество каждого вещества, участвующего в реакции, и могут быть изменены, чтобы сбалансировать уравнение. Вышеприведенное уравнение показывает, что один моль твердой меди реагирует с двумя молями водного нитрата серебра с образованием одного моля водного нитрата меди (II) и двух атомов твердого серебра.
Уравновешивание химического уравнения
Поскольку идентичность реагентов и продуктов фиксирована, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов. Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {1} \).
Самым простым и наиболее полезным методом уравновешивания химических уравнений является «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к уравновешиванию химического уравнения с использованием этого метода.
Шаги по уравновешиванию химического уравнения
- Определите наиболее сложное вещество.
- Начиная с этого вещества, выберите элемент (ы), который присутствует только в одном реагенте и одном продукте, если это возможно. Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента (ов) с обеих сторон.
- Сбалансируйте многоатомные ионы (если они присутствуют по обе стороны химического уравнения) как единое целое.

- Уравновесить оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты.Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
- Подсчитайте количество атомов каждого вида по обе стороны уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \ (\ PageIndex {1} \): Горение гептана
Уравновешивание химического уравнения горения гептана (\ (C_7H_ {16} \))
\ [C_7H_ {16} (l) + O_2 (g) → CO_2 (g) + H_2O (g) \ nonumber \]
Решение
| 1. Определите наиболее сложное вещество. | Самая сложная субстанция — это вещество с наибольшим числом различных атомов, то есть \ (C_7H_ {16} \). Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. | |||||||||||||||
2. Настройте коэффициенты . | а. Поскольку одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 молекул, каждая из которых содержит 1 атом углерода, с правой стороны: C 7 H 16 (л) + O 2 (г) → 7 CO 2 (г) + H 2 O (г)
б. C 7 H 16 (л) + O 2 (г) → 7 CO 2 (г) + 8 H 2 O (г)
| |||||||||||||||
3. | В этой реакции не рассматриваются многоатомные ионы. | |||||||||||||||
4. Уравновесить остальные атомы . | Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: C 7 H 16 (л) + 11 O 2 (г) → 7 CO 2 (г) + 8H 2 O (г)
| |||||||||||||||
5. | Уравнение теперь сбалансировано, и дробных коэффициентов нет: с каждой стороны по 7 атомов углерода, 16 атомов водорода и 22 атома кислорода. Всегда проверяйте, сбалансировано ли химическое уравнение. |
Пример \ (\ PageIndex {2} \): сжигание изооктана
Сжигание изооктана (\ (C_8H_ {18} \))
\ [C_8H_ {18} (l) + O_2 (g) → CO_2 (g) + H_2O (g) \ nonumber \]
Решение
Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу наиболее сложного вещества, не всегда верно, но это хорошее место для начала.При сжигании любого углеводорода с кислородом образуется углекислый газ и вода.
1. Определите наиболее сложное вещество. | Самым сложным веществом является вещество с наибольшим числом различных атомов: C 8 H 18 . Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. | |||||||||||||||
2. Настройте коэффициенты . | а. Первый элемент, который появляется в реагентах только один раз, — это углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : C 8 H 18 (л) + O 2 (г) → 8 CO 2 (г) + H 2 O (г)
б. C 8 H 18 (л) + O 2 (г) → 8CO 2 (г) + 9 H 2 O (г)
| |||||||||||||||
3. | В этой реакции не рассматриваются многоатомные ионы. | |||||||||||||||
4. Уравновесить остальные атомы . | Теперь атомы углерода и водорода уравновешены, но у нас есть 25 атомов кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (\ (\ dfrac {25} {2} \)), чтобы сбалансировать атомы кислорода: C 8 H 18 (l) + \ (\ dfrac {25} {2} \) O 2 (g) → 8CO 2 (g) + 9H 2 O (г)
Уравнение теперь сбалансировано, но обычно мы пишем уравнения с целочисленными коэффициентами. 2 C 8 H 18 (л) + 25 O 2 (г) → 16 CO 2 (г) + 18 2 O (г) | |||||||||||||||
5. Проверьте свою работу. | Сбалансированное химическое уравнение содержит 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны.
Балансировка уравнений требует от вас некоторой практики, а также некоторого здравого смысла. |
Пример \ (\ PageIndex {3} \): Осаждение хлорида свинца (II)
Смешивают водные растворы нитрата свинца (II) и хлорида натрия. Продуктами реакции являются водный раствор нитрата натрия и твердый осадок хлорида свинца (II).Напишите сбалансированное химическое уравнение этой реакции.
Решение
| 1. Определите наиболее сложное вещество. | Наиболее сложным веществом является хлорид свинца (II). Pb (NO 3 ) 2 (водн.) + NaCl (водн.) → NaNO 3 (водн.) + PbCl 2 (s) | |||||||||||||||
2. | В реагентах содержится вдвое больше ионов хлора, чем в продуктах. Поставьте 2 перед NaCl, чтобы уравновесить ионы хлора. Pb (NO 3 ) 2 (водн.) + 2 NaCl (водн.) → NaNO 3 (водн.) + PbCl 2 (s)
| |||||||||||||||
3. | Нитрат-ионы все еще не сбалансированы. Поставьте 2 перед NaNO 3 . Результат: Pb (NO 3 ) 2 (водный) + 2NaCl (водный) → 2 NaNO 3 (водный) + PbCl 2 (с)
| |||||||||||||||
4. | Нет необходимости балансировать оставшиеся атомы, потому что они уже уравновешены. | |||||||||||||||
5. Проверьте свою работу. | Pb (NO 3 ) 2 (водн.) + 2NaCl (водн.) → 2NaNO 3 (водн.) + PbCl 2 (с.)
|
Упражнение \ (\ PageIndex {1} \)
Все ли химические уравнения сбалансированы?
- \ (2Hg (ℓ) + O_2 (g) \ rightarrow Hg_2O_2 (s) \)
- \ (C_2H_4 (г) + 2O_2 (г) → 2CO_2 (г) + 2H_2O (г) \)
- \ (Mg (NO_3) _2 (s) + 2Li (s) \ rightarrow Mg (s) + 2LiNO_3 (s) \)
- Ответ:
- да
- Ответ b:
- №
- Ответ c:
- да
Упражнение \ (\ PageIndex {2} \)
Уравновесите следующие химические уравнения.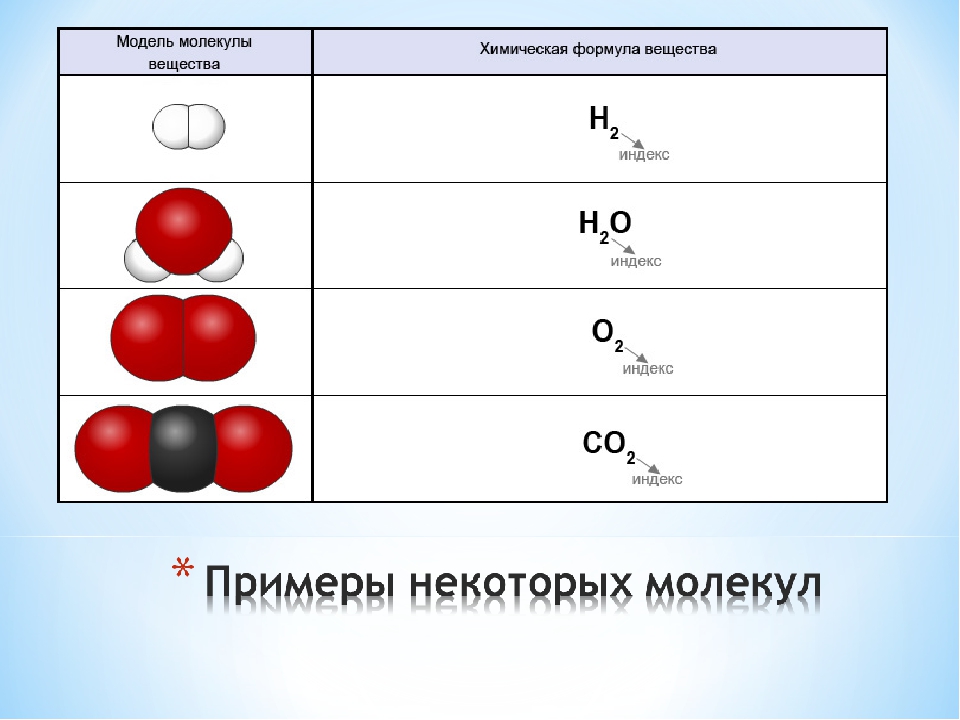
- N 2 (г) + O 2 (г) → NO 2 (г)
- Pb (NO 3 ) 2 (водный) + FeCl 3 (водный) → Fe (NO 3 ) 3 (водный) + PbCl 2 (s)
- C 6 H 14 (л) + O 2 (г) → CO 2 (г) + H 2 O (г)
- Ответ:
- N 2 (г) + 2O 2 (г) → 2NO 2 (г)
- Ответ b:
- 3Pb (NO 3 ) 2 (водный) + 2FeCl 3 (водный) → 2Fe (NO 3 ) 3 (водный) + 3PbCl 2 (s)
- Ответ c:
- 2C 6 H 14 (л) + 19O 2 (г) → 12CO 2 (г) + 14H 2 O (г)
Сводка
- Чтобы быть полезным, химические уравнения всегда должны быть сбалансированы.
 Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома с обеих сторон уравнения.
Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома с обеих сторон уравнения. - Коэффициенты в сбалансированном уравнении должны быть простейшим целочисленным отношением. В химических реакциях масса всегда сохраняется.
Словарь
- Химическая реакция: Процесс, в котором одно или несколько веществ превращаются в одно или несколько новых веществ.
- Реагенты: исходные вещества в реакции.
- Продукты: Материалы, присутствующие в конце реакции.
- Сбалансированное химическое уравнение: химическое уравнение, в котором количество атомов каждого типа равно на двух сторонах уравнения.
- Нижние индексы: Часть химических формул реагентов и продуктов, указывающая количество атомов предыдущего элемента.
- Коэффициент: небольшое целое число, которое появляется перед формулой в сбалансированном химическом уравнении.
Авторы и авторство
.

 Образование каждого из промежуточных веществ называется элементарной стадией сложных реакций. К сложным реакциям относятся, например, цепные… … Энциклопедический словарь
Образование каждого из промежуточных веществ называется элементарной стадией сложных реакций. К сложным реакциям относятся, например, цепные… … Энциклопедический словарь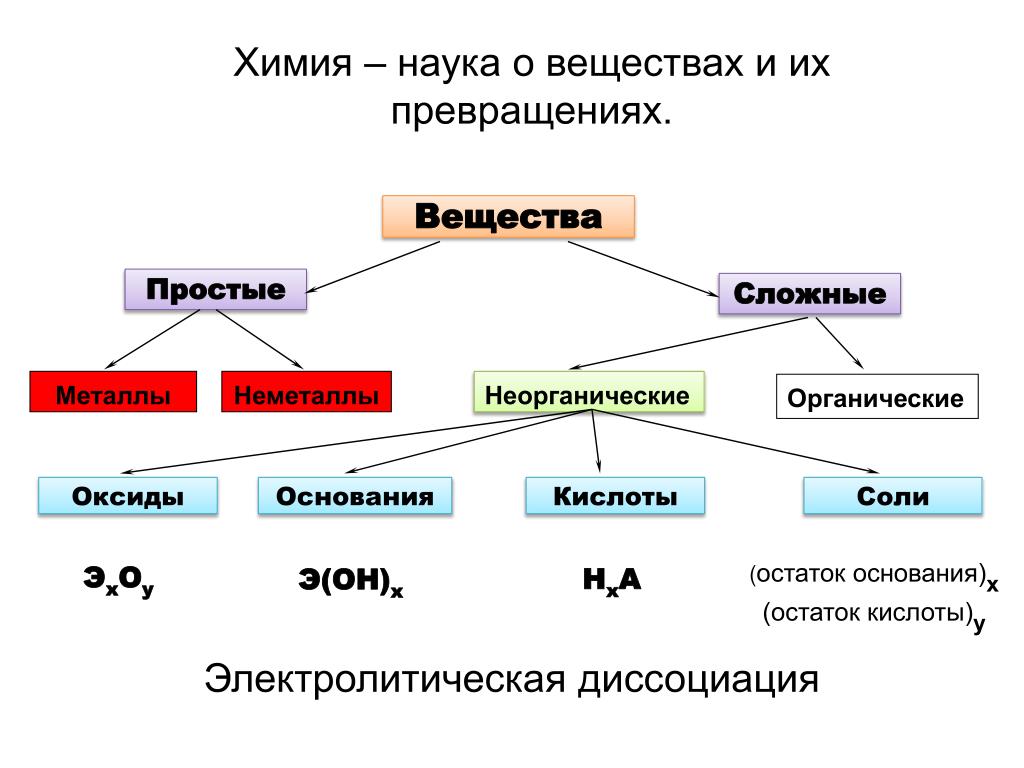 %, но ≤10 3 мас. %. Такие вещества играют важную роль в полупроводниковой промышленности, атомной энергетике, волоконной оптике … Энциклопедический словарь по металлургии
%, но ≤10 3 мас. %. Такие вещества играют важную роль в полупроводниковой промышленности, атомной энергетике, волоконной оптике … Энциклопедический словарь по металлургии к. Fe(OH)3 — нерастворимое основание, а AgBr — бромид серебра — соль
к. Fe(OH)3 — нерастворимое основание, а AgBr — бромид серебра — соль
 грамм. контент, который вы посещали ранее. (В настоящее время мы не используем файлы cookie для таргетинга или таргетинга.
грамм. контент, который вы посещали ранее. (В настоящее время мы не используем файлы cookie для таргетинга или таргетинга. грамм. контент, который вы посещали ранее. (В настоящее время мы не используем файлы cookie для таргетинга или таргетинга.
грамм. контент, который вы посещали ранее. (В настоящее время мы не используем файлы cookie для таргетинга или таргетинга.



 Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 H 2 молекул O, каждая из которых содержит 2 атома водорода, с правой стороны:
Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 H 2 молекул O, каждая из которых содержит 2 атома водорода, с правой стороны: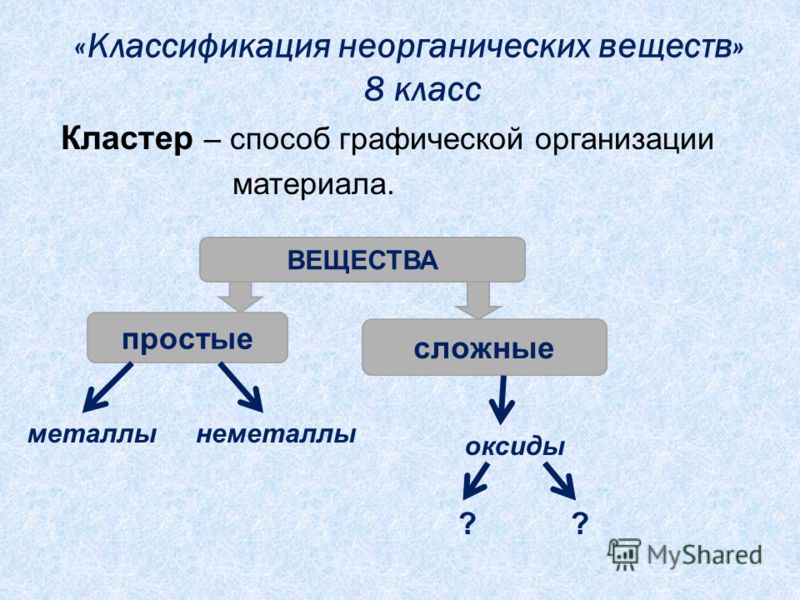 Уравновесить многоатомные ионы как целое .
Уравновесить многоатомные ионы как целое . Проверьте свою работу.
Проверьте свою работу.  Восемнадцать атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 O:
Восемнадцать атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 O: Уравновесить многоатомные ионы как целое .
Уравновесить многоатомные ионы как целое . Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2 :
Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2 : Если вы обнаружите, что используете очень большие коэффициенты или безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов.
Если вы обнаружите, что используете очень большие коэффициенты или безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов. Настройте коэффициенты .
Настройте коэффициенты . Уравновесить многоатомные ионы как целое .
Уравновесить многоатомные ионы как целое . Сбалансируйте оставшиеся атомы .
Сбалансируйте оставшиеся атомы . Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома с обеих сторон уравнения.
Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома с обеих сторон уравнения.