Содержание
Плотность и теплота сгорания простых газов
Плотность и теплота сгорания простых газов
Плотность и теплота сгорания простых газов
| Газ | Химическая формула | Молекулярная масса | Плотность, кг/м3 при P0=101.3 кПа, Т0=0°С | Теплота сгорания | |||
кДж/м3 при P0=101. 3 3кПа, Т0=0°С | кДж/3 при P0=101.3 кПа, Т0=0°С | ||||||
| высшая | низшая | высшая | низшая | ||||
| Водород | H2 | 2.016 | 0.08999 | 12770 | 10800 | 3050 | 2579 |
| Окись углерода | CO | 28. 011 011 | 1.25 | 12640 | 12640 | 3019 | 3019 |
| Метан | CH4 | 16.043 | 0.7168 | 39860 | 35840 | 9520 | 8560 |
| Этан | C2H6 | 30.07 | 1.3566 | 70420 | 63730 | 16819 | 15221 |
| Пропан | C3H8 | 44. 097 097 | 2.019 | 101740 | 93370 | 24299 | 22300 |
| Бутан | C4H10 | 58.124 | 2.60 | 133980 | 123770 | 31999 | 29560 |
| Пентан | C5H12 | 72.151 | 3. 221 221 | 158480 | 146340 | 37850 | 34951 |
| Этилен | C2H4 | 28.05 | 1.26 | 65200 | 60100 | 15572 | 14354 |
| Пропилен | C3H8 | 42.08 | 1.88 | 93900 | 87500 | 22427 | 20898 |
| Бутилен | C4H8 | 56. 11 11 | 2.5022 | 124000 | 115200 | 29615 | 27514 |
| Ацетилен | C2H2 | 26.038 | 1.1707 | 58910 | 56900 | 14070 | 13590 |
| Азот | N2 | 28.016 | 1.2505 | — | — | — | — |
| Кислород | O2 | 32 | 1. 429 429 | — | — | — | — |
| Двуокись углерода | CO2 | 44.011 | 1.9768 | — | — | — | — |
| Двуокись серы | SO2 | 64.07 | 2.9266 | — | — | — | — |
| Сероводород | H2S | 34. 082 082 | 1.5392 | 25460 | 23490 | 6081 | 5610 |
| Воздух сухой (без CO2) | — | 28.96 | 1.2928 | — | — | — | — |
| Водяной пар | H2O | 18.016 | 0.768 | — | — | — | — |
Наиболее важными параметрами являются номинальное и минимальное давление газа на
входе в аппарат при работающей горелке.
Номинальное давление газа — это давление, при
котором аппараты выдают заявленную мощность, при более низких давлениях газа
аппараты будут сохранять работоспособность, но, естественно, не будут выдавать
полную мощность.
Минимальное давления газа — это минимально
возможное давление газа, при котором газовые аппараты будут сохранять
работоспособность.
Ниже приведены значения номинального давления газа для газовых плит, колонок и
котлов:
| № п/п | Тип газового прибора | Номинальное давление газа, КПа |
| 1 | Газовая плита | 1. 5 5 |
| 2 | Газовая колонка с пьезоэлектрическим поджигом | 1.3 |
| 3 | Газовая колонка с электрическим поджигом | 1.3 |
| 4 | Настенные газовые котлы | 1.3 |
| 5 | Напольные газовые котлы с атмосферными горелками | 1.8 |
| Примечание | |
|---|---|
Точное значение минимально допустимого давления газа на входе можно узнать |
В отечественных газовых сетях низкого давления транспортирующих природный газ
«нормальным» считается давление от 3.0 до 1.0 кПа то есть максимально допустимое
давление газа перед газовым прибором, например, газовой плитой не должно превышать
3.0 кПа, минимальное давление газа не должно быть ниже 1.0 кПа.
Теплота сгорания вещества — Справочник химика 21
Под теплотой сгорания понимают то количество теплоты, которое выделяется при полном сгорании одного моля вещества до высших окислов при данных условиях (Р, Т). Сгорание называется полным, когда углерод, водород, азот, сера, хлор и бром, входящие в соединение, превращаются соответственно в диоксид углерода, жидкую воду, молекулярный азот, диоксид серы и галогеноводородную кислоту. Теплоту сгорания веществ определяют сжи- [c.209]
Теплота сгорания веществ, состав которых непостоянен (нефть, каменный уголь, древесина и др. ), может определяться по данным элементного состава, для чего можно использовать эм лирическую формулу Д. И. Менделеева. [c.122]
), может определяться по данным элементного состава, для чего можно использовать эм лирическую формулу Д. И. Менделеева. [c.122]
Теплота сгорания топлива. Важнейшей характеристикой топлива является теплота сгорания. Теплотой сгорания вещества называют тепловой эффект реакции окисления кислородом элементов, входящих в состав этого вещества до образования высших оксидов. Теплоту сгорания обычно относят к стандартному состоянию (давление 101 кПа), одному молю топлива и температуре 298,15 К и назначают стандартной теплотой сгорания. [c.381]
Для углерода недостаточно применять обозначение (кр.), поскольку кристаллический углерод может существовать в двух различных модификациях -в виде алмаза или графита.] Требуется выяснить, будет ли в этой реакции выделяться теплота, которую следует учесть при конструировании реактора. Подобный синтез никогда не проводился (и, по-видимому, никогда не будет осуществлен), но тем не менее можно получить ответ на поставленный вопрос, используя данные о теплотах некоторых легко осуществляемых реакций. Теплотой сгорания вещества, содержащего С, N, О и Н, называется теплота реакции данного вещества (в расчете на его одномолярное количество) с достаточным количеством кислорода, продуктами которой являются СО2, N2 и жидкая Н2О. Теплоты сгорания легко поддаются измерению и исторически были первыми теплотами реакций, измерявшимися и табулируемыми систематически. Подробные таблицы теплот сгорания можно найти в специальных термохимических справочниках. Теплоты сгорания метана и алмаза равны [c.92]
Теплотой сгорания вещества, содержащего С, N, О и Н, называется теплота реакции данного вещества (в расчете на его одномолярное количество) с достаточным количеством кислорода, продуктами которой являются СО2, N2 и жидкая Н2О. Теплоты сгорания легко поддаются измерению и исторически были первыми теплотами реакций, измерявшимися и табулируемыми систематически. Подробные таблицы теплот сгорания можно найти в специальных термохимических справочниках. Теплоты сгорания метана и алмаза равны [c.92]
Закон Гесса и его следствия не могут быть использованы для расчета тепловых эффектов процессов, если мы не условимся, какой смысл вкладывать в понятия теплота образования и теплота сгорания вещества. [c.165]
Из проведенного рассмотрения ясно, что в расчетах теплот (АЯ) основным источником ошибок является неточное определение теплот сгорания веществ (или рассчитываемых по ним теплот образования). При нахождении А0°, Кр, Кн, х появляются дополнительные ошибки из-за неточности определения энтропий. [c.71]
[c.71]
В предыдущих разделах через АЯс обозначали теплоту сгорания вещества до высших оксидов (например, СО2, Н2О). При высокотемпературном [c.122]
Закон Гесса и его следствия не могут быть использованы, если мы не условимся, какой смысл вкладываем в понятия теплота образования и теплота сгорания вещества. [c.12]
Недостатком этого метода является невысокая точность рассчитанных значений теплот образования, так как их величина гораздо меньше теплот сгорания веществ. Расчет теплот образования по разности больших величин может вносить большую ошибку в их значение. [c.69]
Теплоты образования рассчитывают по теплотам сгорания веществ или с помощью различных эмпирических методов. Абсолютные значения энтропий рассчитывают по уравнению [c.215]
Низшую (Qh) и высшую (Qb) теплоты сгорания вещества, имеющего брутто-формулу jH.AN,i, можно определить по уравнениям [c.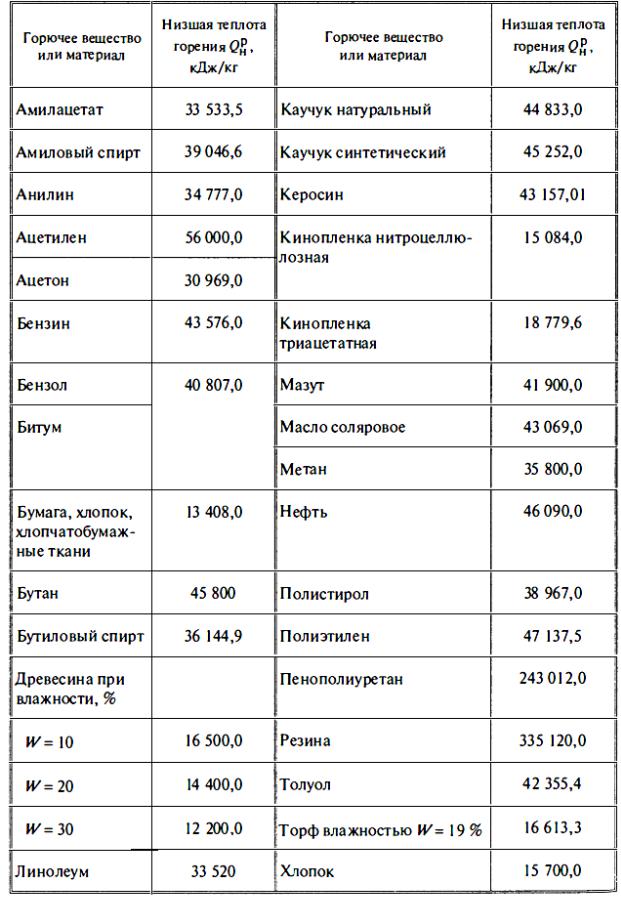 424]
424]
Для удобства сопоставления экспериментальных данных и последующих расчетов экспериментальные теплоты сгорания веществ относят обычно к стандартным условиям, т. е. к процессу, в котором как исходные вещества, так и продукты сгорания находятся в стандартном (термодинамически устойчивом при данной температуре) состоянии при давлении 1 агм. Что касается температуры, то в подавляющем большинстве современных термохимических работ, литературных источников и справочников теплоты сгорания относят к 25° С (298,15° К). Теплоту сгорания, относящуюся к стандартным условиям при 298,15°К (25°С), обозначают символом [c.15]
Часто применяется калориметр, в котором для проведения реакции служит толстостенный, герметически закрывающийся металлический сосуд — калориметрическая бомба. В подобных калориметрах определяют обычно теплоты сгорания веществ. В сосуд помещают пробу вещества и кислород под давлением. Реакция в смеси инициируется искрой, создаваемой электрическим [c. 52]
52]
Теплота сгорания вещества — количество тепла, которое выделяется при полном сгорании 1 г или 1 моль вещества и охлаждении продуктов сгорания до начальной температуры опыта. При полном сгора- [c.151]
Взять навеску органического вещества с известной теплотой сгорания. Вещество не брикетировать. Поместить в мешочек, опустить в мешочек запальную проволоку и проводить опыт. 2. Рассчитать теплоту сгорания вспомогательных материалов по уравнению (У,44). [c.155]
Теплотой сгорания называется теплота (кДж), выделяющаяся при полном сгорании 1 моль вещества в токе кислорода. Теплоты сгорания веществ определяют калориметрически или приближенно рассчитывают по формуле Д. П. Коновалова [c.45]
Вычислите тепловой эффект реакции гидрирования толуола, если извест ны теплоты сгорания веществ [c.7]
Теплота сгорания и теплотворная способность топлива. Важнейшими характеристиками топлива являются теплота сгорания и теплотворная способность. Теплотой сгорания вещества называют тепловой эффект реакции окисления кислородом входящих в состав этого вещества элементов до образования высших оксидов. Теплоту сгорания обычно относят к стандартным условиям 298,15 К, давлению 101 кПа, одному молю топлива и называют стандартной теплотой сгорания. [c.351]
Теплотой сгорания вещества называют тепловой эффект реакции окисления кислородом входящих в состав этого вещества элементов до образования высших оксидов. Теплоту сгорания обычно относят к стандартным условиям 298,15 К, давлению 101 кПа, одному молю топлива и называют стандартной теплотой сгорания. [c.351]
АНс. ещ теплота сгорания вещества. [c.85]
Обозначения —теплота сгорания вещества АВ, q —теплота его образования из простых веществ А и В, а q K q —теплота сгорания этих простых веществ. [c.16]
Определите тепловой эф([)ект реакции в стандартных условиях, ес- П известны теплоты сгорания веществ, [c.6]
Важное практическое значение имеет реакция горения веществ в атмосфере. При горении вещества взаимодействуют с кислородом, в процессе чего выделяется большое количество энергии в виде теплоты и света и образуются высшие оксиды элементов. Количество энергии, выделяющейся при полном сгорании одного моля соединения, называется теплотой сгорания вещества. [c.47]
Количество энергии, выделяющейся при полном сгорании одного моля соединения, называется теплотой сгорания вещества. [c.47]
Составьте термохимические уравнения, которые включают молярную теплоту сгорания вещества, пользуясь следующими данными о теплоте сгорания 1 г каждого из указанных ниже веществ [c.321]
По стандартным теплотам сгорания веществ рассчитайте Д№29 системы [c.123]
Теплоту сгорания вещества можно выразить в расчете на грамм или на моль. Для того чгобм рассчитать молярную теплоту сгорания (приводимую обычно в кДж/моль) из полученных вами экспериментальных данных, сначала нужно иайти эт величину в расчете на грамм. [c.205]
Не меньшую опасность представляют смазочное масло и продукты его разложения. Эти вещества также взрывоопасны в жидком кислороде, хотя, как было показано исследованиями, их чувствительность к различным импульсам значительно ниже чувствительности ацетилена.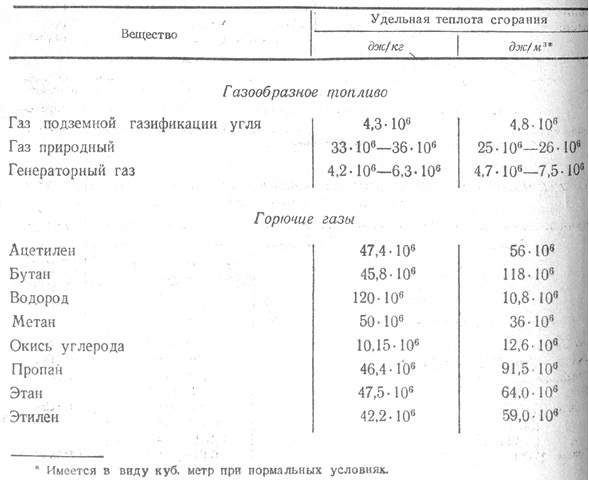 Однако это ни в коей мере не может оправдать ослабление к ним внимания, так как при неудовлетворительной очистке воздуха в блоке разделения может накопиться достаточно большое количество масла. Так, на одном из предприятий при промывке конденсатора было извлечено несколько сот граммов масла. Представление о силе взрыва такого количества масла может дать следующий подсчет. При взрывном разложении веществ максимально может выделиться количество энергии, равное теплоте сгорания вещества. Для масел эта величина составляет около 42 кдж1г. Если считать, что из всего извлеченного масла в реакции примет участие только 10% и коэффициент использования энергии составит 30%, то при взрыве выделится на каждые 100 г масла. [c.102]
Однако это ни в коей мере не может оправдать ослабление к ним внимания, так как при неудовлетворительной очистке воздуха в блоке разделения может накопиться достаточно большое количество масла. Так, на одном из предприятий при промывке конденсатора было извлечено несколько сот граммов масла. Представление о силе взрыва такого количества масла может дать следующий подсчет. При взрывном разложении веществ максимально может выделиться количество энергии, равное теплоте сгорания вещества. Для масел эта величина составляет около 42 кдж1г. Если считать, что из всего извлеченного масла в реакции примет участие только 10% и коэффициент использования энергии составит 30%, то при взрыве выделится на каждые 100 г масла. [c.102]
А. Н. Баратовым и В. В. Булановой был предложен расчетный метод оценки горючести, основанный на разности между теплотой сгорания вещества и минимальным запасом энергии, необходимым для распространения пламени по стехиометрической смеси с воздухом оцениваемого вещества в газообразном состоянии. Этот метод был развит, и предложено оценку производить следующим образом [c.17]
Этот метод был развит, и предложено оценку производить следующим образом [c.17]
Из закона Гесса следует, что тепловой эффект реакции равен разности мео. сду теплотами сгорания веществ, указанных в левой части уравнения, и теплотами сгорания веществ, указанных в правой части уравнения реакции (взятых, разумеется, с соответствующими стехнометрическимн коэффициентами). [c.198]
Так, для реакции (VI, 19), если АЯсгор, в, Ясгор Ясгор.д и Н°сгор.я обозначают теплоты сгорания веществ В, О, Р и R, тепловой эффект реакции [c.198]
В статье [ arrier, 1985] показано сходство, имеющееся между огненными штормами и определенными метеорологическими явлениями. Огненный шторм здесь описывается как «тепловой циклон» или «мезоциклон». Авторы считают его вихрем, создающим ветровую нагрузку (скорость ветра 20 — 50 м/с, или 70- 180 км/ч) и образующим конвективную колонку, возможно, высотой в 10 км. Такие штормы возникают в сильно насыщенной топливом городской среде от многочисленных небольших пожаров, которые сливаются в один пожар. Для полного развития огненному шторму может потребоваться полчаса через 2 ч достигается пик, а через 6 — 9 ч огненный шторм закончится. В типичном случае территория площадью 12 км будет сожжена дотла. В работе представляются вычисления для случая огненного шторма в Гамбурге. Предполагалось, что площадь, занятая штормом, равна приблизительно 12 км , а скорость выгорания выбиралась исходя из того, что около 160 кг/м горючего вещества полностью сгорает в течение 6 ч. Теплота сгорания вещества была задана равной 1,86 10 Дж/кг. Средний выброс тепла, таким образом, составлял 137 кВт/м . Температура на поверхности земли достигала 1000 К. Авторы утверждают, что для поддержания огненного шторма требуется минимальная площадь порядка 1,25 км . Парадоксально, что отсутствие начального ветра, по-видимому, способствует образованию огненного шторма. [c.163]
Для полного развития огненному шторму может потребоваться полчаса через 2 ч достигается пик, а через 6 — 9 ч огненный шторм закончится. В типичном случае территория площадью 12 км будет сожжена дотла. В работе представляются вычисления для случая огненного шторма в Гамбурге. Предполагалось, что площадь, занятая штормом, равна приблизительно 12 км , а скорость выгорания выбиралась исходя из того, что около 160 кг/м горючего вещества полностью сгорает в течение 6 ч. Теплота сгорания вещества была задана равной 1,86 10 Дж/кг. Средний выброс тепла, таким образом, составлял 137 кВт/м . Температура на поверхности земли достигала 1000 К. Авторы утверждают, что для поддержания огненного шторма требуется минимальная площадь порядка 1,25 км . Парадоксально, что отсутствие начального ветра, по-видимому, способствует образованию огненного шторма. [c.163]
С помощью данных, представленных в табл. 8.1—8.3, можно рассчитать 1) теплоемкость вещества при любой температуре в интервале 298,15—1000 К (для На504 при 298,15—700 К) 2) теплоту образования соединения в конденсированном состоянии 3) низшую и высшую теплоты сгорания вещества 4) иа менение энтальпии соединения при его нагревании или охлаждении 5) термодинамические параметры химической реакции при любой температуре от 298,15 до 1000 К (тепловой эффект, изменение энтропии, изменение энергии Гиббса,, термодинамическую константу равновесия, степени превращения компонентов). [c.423]
[c.423]
Стандартные теплоты сгорания веществ в газообразном состоянии ДЯ°2Э8и могут быть получены из стандартных теплот сгорания [c.18]
Определение теплот сгорания вспомогательных материалов органического вещества с известной теплотой сгорания. Вещество не брикетировать. Поместить в мешочек, опустить в мешочек запальную проволоку проводить опыт. Рассчитать теплоту сгорания вспомогательных материалов по уравнению (У1.40). [c.148]
В термохимических расчетах часто используют понятия теплота образования и теплота сгорания вещества. Теплотой образования называют тепловой эффект реакции образования 1 моля сложного вещества из простых веществ, наиболее устойчивых при н. у. Теплоты образования обычно приводят для стандартных условий (Я=1 атм, 7 =298К) и обозначают или ДЯ (см. табл. 3 приложения). Теплоты образования простых веществ при стандартных условиях принимаются равными нулю. [c.63]
Часто при термохимических расчетах пользуются табличными значениями теплот сгорания веществ. За стандартную тея готг/ сгорания принимается теплота, выделяющаяся при сгорании веществ в кислороде. Сжигание веществ проводят в таких условиях, что конечными продуктами реакции являются СОг (г.), НгО (ж.), N2, (г.), галогеноводороды и т.д. С теплотой сгорания связано второе следствие из закона Гесса [c.159]
За стандартную тея готг/ сгорания принимается теплота, выделяющаяся при сгорании веществ в кислороде. Сжигание веществ проводят в таких условиях, что конечными продуктами реакции являются СОг (г.), НгО (ж.), N2, (г.), галогеноводороды и т.д. С теплотой сгорания связано второе следствие из закона Гесса [c.159]
Водородное топливо — Что такое Водородное топливо?
Lh3 является самым экологически чистым видом моторного топлива, поэтому его перспективы очевидны
Водородное топливо
В Австралии на бурых углях в штате Виктория отрабатывается технология технология газификации угля с последующим выделением водорода, вернее удаления серы, ртути и двуокиси углерода (СО2).
В Норвегии — Nel Hydrogen отрабатывает технологию использования ВИЭ для высокотемпературного электролиза для разделения воды на водород и кислород, который будет выбрасываться в атмосферу.
Kawasaki Heavy Industries разрабатывает морской танкер — водородовоз для транспортировки жидкого водорода ( LH2).
Водород
Водород (H) является самым распространенным элементом на Земле, но в обычных условиях он не встречается ни в виде водорода H, ни в виде газообразного водорода (H2).
Благодаря своим характеристикам он легко вступает в реакцию с другими органическими соединениями с образованием, например, воды (H2O).
Во время этой реакции образования воды из водорода и воздуха выделяется энергия, которую можно использовать в качестве электричества.
Чтобы сделать эту реакцию полезной для промышленного производства электроэнергии, необходимо произвести водород, например из воды путем разделения атомов на кислород и водород посредством электролиза.
Есть другие технологии:
- использование газов, оставшихся от химических процессов, например метана, угля, нефти и биомассы.
Для производства водорода существуют разные способы, которые сильно различаются как с точки зрения экологичности, так и с точки зрения стоимости.
Экологичность — важный критерий производства водорода.
Чем больше оксидов углерода выделяется при производстве водорода, тем менее экологичным он будет считаться.
Для простоты каждый «сорт» произведенного по разным технологиям принято обозначать цветом, хотя правильнее — по углеродному следу.
Реакция взаимодействия водорода с кислородом происходит с выделением тепла.
Если взять 1 моль H2 (2 г) и 0,5 моль O2 (16 г) при стандартных условиях и возбудить реакцию, то согласно уравнению
Н2 + 0,5 О2= Н2О
после завершения реакции образуется 1 моль H2O (18 г) с выделением энергии 285,8 кДж/моль.
Для сравнения: теплота сгорания ацетилена — 1300 кДж/моль, пропана — 2200 кДж/моль.
1 м³ водорода весит 89,8 г (44,9 моль), поэтому для получения 1 м³ водорода будет затрачено 12832,4 кДж энергии.
1 кВт*ч = 3600 кДж, поэтому получим 3,56 кВт*ч электроэнергии.
Целесообразность перехода на водородное топливо можно оценить, сравнив имеющийся тариф на 1 кВт*ч электричества и, к примеру, стоимость 1 м³ газа или стоимость другого энергоносителя.
При сжигании водорода получается чистая вода.
То есть водородное топливо производится без вреда для окружающей среды, в отличие от газа или бензина.
Получение водорода
Для получения водорода используют химические методы, в тч реакции разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа.
Она проводится при высокой температуре:
СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж
-
1.Электролиз водных растворов солей:
2NaCl + 2H2O → h3↑ + 2NaOH + Cl2
-
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
h3O + C ⇄ h3 + CO
-
3.Из природного газа.
Конверсия с водяным паром: CH4 + H2O ⇄ CO + 3H2 (1000 °C) Каталитическое окисление кислородом: 2CH4 + O2 ⇄ 2CO + 4H2
-
4. Крекинг и реформинг углеводородов в процессе переработки нефти. -
5. Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
Zn + 2HCl → ZnCl2 + H2↑
-
6.Взаимодействие кальция с водой:
Ca + 2H2O → Ca(OH)2 + H2↑
-
7.Гидролиз гидридов:
NaH + H2O → NaOH + H2↑
-
8.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Zn + 2KOH + 2H2O → K2[Zn(OH)4] + h3↑
-
9 .С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e— → H2↑ + 2H2O
- Биореактор для производства водорода
Физические свойства
Газообразный водород может существовать в 2х формах (модификациях) — в виде орто — и пара-водорода.
В молекуле ортоводорода (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны).
Разделить аллотропные формы водорода можно адсорбцией на активном угле при температуре жидкого азота.
При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода.
При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25).
Без катализатора превращение происходит медленно, что дает возможность изучить свойства отдельных аллотропных форм.
Молекула водорода двухатомна — Н₂. При обычных условиях — это газ без цвета, запаха и вкуса.
Водород — самый легкий газ, его плотность во много раз меньше плотности воздуха. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре.
Как самые легкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому.
Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Химические свойства
Молекулы водорода Н₂ довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2=2Н — 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2 и с единственным неметаллом — фтором, образуя фтороводород:
F2+H2=2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении.
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н20
Записанное уравнение отражает реакцию восстановления — процесс, в результате которого от соединения отнимается кислород; вещества, отнимающие кислород, называются восстановителями (при этом они сами окисляются).
Реакция восстановления противоположна реакции окисления.
Обе эти реакции всегда протекают одновременно как 1 процесс: при окислении (восстановлении) одного вещества обязательно одновременно происходит восстановление (окисление) другого.
N2 + 3H2 → 2 NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2 HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + H2 → 2 HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O Fe2O3 + 3H2 → 2 Fe + 3H2O WO3 + 3H2 → W + 3H2O
Геохимия водорода
Водород — самый распространенный элемент, и все элементы образуются из него в результате термоядерных и ядерных реакций.
На Земле содержание водорода понижено по сравнению с Солнцем.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением.
Он мигрирует в верхние слои атмосферы и улетучивается в космос.
Применение кроме энергетики:
- для атомно-водородной сварки,
- в пищевой промышленности, как пищевая добавка E949- упаковочный газ, для производства маргарина из жидких растительных масел,
- химической промышленности — при производстве аммиака, мыла и пластмасс,
- в качестве ракетного топлива,
Энергетика
Водороду уделяется такое пристальное внимание не зря.
Подобно батареям, водород в основном используется как форма хранения энергии.
Они оба зависят от первичной энергии, такой как солнечная и ветровая, для зарядки или генерации, и при необходимости могут быть преобразованы в электричество.
Тем не менее, водород превосходит батареи по многим параметрам:
- более чистый производственный процесс,
- нулевое загрязнение после утилизации; более высокая плотность энергии.
Водород можно производить с помощью воды и электричества, а батареи часто зависят от токсичных материалов, таких как цинк, никель и марганец, которые оказывают неблагоприятное воздействие на окружающую среду при их добыче в открытых карьерах или на морском дне и после их утилизации.
При преобразовании водорода в электричество производится только вода и тепло.
Водород также имеет гораздо более высокую плотность энергии (33 кВт*ч / кг), чем батареи (около 1 кВт*ч / кг), и чем бензин и дизельное топливо (около 12 кВт*ч / кг), что делает его особенно выгодным для транспорта и в качестве мобильного энергоносителя
Пожароопасность и взрывоопасность
Водород при смеси с воздухом образует взрывоопасную смесь — гремучий газ.
Наибольшую взрывоопасность — при объемном отношении водорода и кислорода 2:1, или водорода и воздуха приближенно 2:5, так как в воздухе кислорода содержится примерно 21%.
Водород пожароопасен.
Удельная теплота сгорания топлива | Топливо
02.10.2020
Содержание
- Теория
- Теплотворная способность топлива
Для каждой категории горючего предусмотрен набор общих и уникальных свойств. В общую категорию входит удельная теплота сгорания топлива и уровень влажности, в то время как уникальные (специфические) свойства – это вязкость, концентрация серы и золы, плотность и так далее.
В процессе сгорания ГСМ происходит химическая реакция, являющаяся окислительной. При воздействии высокой температуры образовываются молекулы из кислорода и углерода, генерируя тем самым полезную энергию. Теплотворность различных видов топлива находится в разных пределах.
Теория
Экзотермическая реакция горения приводит к выделению тепловой энергии в определенном количестве, которое обозначают понятием «теплота сгорания топлива». Итоговые значения отличаются в зависимости от влажности и химического состава продукции.
Определение значение происходит с применением экспериментального или аналитического метода. Суть первого сводится к практическому мониторингу теплоты, которая выделилась вследствие термической реакции горения. Для этого используется специальное устройство – калориметр, позволяющий определить калорийность топлива. В устройстве предусмотрена бомба для сжигания и термостат. Если химический состав известен изначально, проводится вычисление теплоты сгорания топлива по формуле Менделеева.
Удельная теплота состоит из двух разновидностей.
- Высшая. Указывает на максимальное количество энергии, которое можно сгенерировать в результате полного и окончательного сгорания топлива, учитывая расходы на испарение содержащейся влаги.
- Низшая. Здесь значение меньше на величину тепла, расходуемого на конденсацию водяных паров, сгенерированных из влаги органического водорода и топлива. Пары в итоге превращаются в воду.
Существующая формула удельной теплоты сгорания топлива используется, чтобы определить качество продукции. Как правило, эксперты пользуются низшей удельной теплотой. Причина – важность для эксплуатационных и тепловых характеристик.
Теплотворная способность топлива
На изображении проиллюстрирована таблица, где приведены показатели удельной теплоты сгорания дизеля и бензина. Необходимо понимать, что бензин и солярка, наряду с нефтью и авиационным керосином, демонстрируют наиболее высокое тепловыделение.
Традиционные моторные виды топлива значительно превосходят по показателям значения для ацетона и спирта. В первой строке указана разновидность горючего, во второй – значения, выраженные в размерности МДж/кг.
| Бензин А-75 (ГОСТ2084-67) | 44,2 |
| Бензин авиационный Б-70 (ГОСТ 1012-72) | 44,1 |
| Бензин АИ-93(ГОСТ 2084-67) | 43,6 |
| Бензол | 40,6 |
| Дизельное топливо зимнее (ГОСТ 305-73) | 43,6 |
| Дизельное топливо летнее (ГОСТ 305-73) | 43,4 |
Таблица, приведенная выше, позволяет понять, у какого топлива теплота сгорания выше. Наилучшими показателями способен похвастаться авиационный бензин и горючее марки Б-70. Дизель, хоть и не на много, но уступает прямому конкуренту. Тем не менее, на практике заметить разницу в теплотворной способности дизельного топлива достаточно проблематично.
Одним из базовых отрицательных факторов выступает сернистость. В процессе сгорания выделяется сернистый газ, становящийся причиной ускоренного развития коррозии на металлических деталях двигателя и загрязнения окружающей среды. Это основная причина, почему производители активно стремятся уменьшить концентрацию серы.
Наличие золы и минеральных веществ в составе топлива также отрицательно сказывается на теплоте сгорания. Причина – уменьшение концентрации горючих веществ. Минеральная масса, выделяющаяся при горении минеральных веществ, впитывает тепловую энергию, постепенно понижая эффективность горючего.
Вычислите теплоту сгорания ацетилена C2h3, если теплота образования углекислого газа 393,5
1) Найдем энтальпию сгорания ацетилена, можно в справочнике подсмотреть, можно вычислить.
сH°(C₂H₂) = — Q/n
Минус — потому что тепло выделяется, энтальпия будет меньше нуля.
Q нам известно, рассчитаем n.
n = V/Vm = 53,6л/22,4л/моль = 2,4моль
Найдем энтальпию.
сH°(C₂H₂) = — 3118,8/2,4 = — 1299,5 кДж/моль(спр. — 1301,1 кДж, ну почти)))
Теперь, предположим, что ацетилен образуется из простых веществ.
2C + H₂ = C₂H₂ поставим тут циферку (1)
Как нам использовать данные нам теплоты? А просто, составим уравнения образования этих веществ из простых
С + O₂ = CO₂ fH°(CO₂) = -Q = — 393,5 кДж/моль *2
H₂ + 1/2O₂ = H₂O fH°(H₂O) = -Q = — 285.8 кДж/моль
Ну и нашу реакцию горения впишем тоже.
C₂H₂ + 5/2O₂ = 2CO₂ + H₂O сH° = -1299.5 кДж/моль *(-1)
Наша
задача привести эти уравнения к виду (1). А что там Гесс? А он говорит,
что с химическими уравнениями можно совершать алгебраические действия!
Так вот, путем линейных комбинаций приведем три наших уравнения к виду
(1)
Как это сделать? Очень просто. Глянем в левую часть уравнения (1)
там 2 углерода и один водород. Где эти данные есть? Верно! В уравнениях
образования CO₂ и H₂O Что от нас требуется, взять два атома углерода, а
в уравнении образования СО₂ всего один углерода, а Гесс не запрещает
использовать математику, так что же нам мешает домножить это уравнение
на 2? Ничего, домножим его на два(Соответственно энтальпия тоже
умножится на два) и получим:
2C + 2O₂ = 2CO₂
Потом, нам требуется
один водород, одна молекула и эта молекула есть! в уравнении образования
воды! И он там один!!! Все условия для нас. Ничего домножать не надо,
оставляем все без изменений
Теперь, нам в правой части нужен
ацетилен, а в уравнениях он есть только в левой части, а что там Гесс? А
он не запрещает умножать и делить, значит, просто домножим уравнение
сгорания ацетилена на (-1) и получим:
2CO₂ + H₂O = C₂H₂ + 5/2O₂, соответственно энтальпия умножится на минус один тоже.
Теперь, возьмем полученные уравнения в систему и получим:
2C + 2O₂ = 2CO₂, /\fH° = — 787кДж/моль
H₂ + 1/2O₂ = H₂O, /\fH° = -285.8кДж/моль
2CO₂ + H₂O = C₂H₂ + 5/2O₂, /\cH° = 1299.5 кДж/моль
Сложим полученные уравнения и получим:
2C + 2O₂ + H₂ + 1/2O₂ + 2CO₂ + H₂O = 2CO₂ + H₂O + C₃H₃ + 5/2O₂
Теперь помянем добрым словом математику и уничтожим то, что уничтожится)
2C + 2O₂ + H₂ + 1/2O₂ + 2CO₂ + H₂O = 2CO₂ + H₂O + C₃H₃ + 5/2O₂ я выделил, то, что уничтожится и получится.
2C + H₂ = C₂H₂
Энтальпию этой реакции найдем как сумму энтальпий реакций полученных линейной комбинацией.
/\fH°(C₂H₂) = кДж/моль в справочнике +227,4 кДж/моль, есть погрешность)))
Qобр = —/\fH°(C₂H₂) = -226.7 кДж, т.е. при образовании 1 моль ацетилена поглотится 226,7 кДж теплоты
Декарбонизация: тем ли мы путем идем? — Энергетика и промышленность России — № 3-4 (407-408) февраль 2021 года — WWW.EPRUSSIA.RU
Газета «Энергетика и промышленность России» | № 3-4 (407-408) февраль 2021 года
Переход к водородной энергетике обосновывается необходимостью снижения выбросов в атмосферу углекислого газа. Этот процесс называется декарбонизацией.
Известно, что увеличение концентрации углекислого газа в атмосфере Земли приводит к повышению средней температуры воздуха, то есть «глобальному потеплению».
Для стимулирования процесса декарбонизации Европейский Союз планирует принять так называемый «углеродный налог» на все импортируемые товары.
В июле прошлого года аналитики компании KPMG подсчитали вероятные потери российских экспортеров в случае введения сбора. При худшем сценарии он появится уже в 2022 году и коснется как прямых, так и косвенных выбросов. Тогда поставщики заплатят 50,6 млрд евро до 2030 года. При базовом сценарии налог введут в 2025 году и распространят только на прямые выбросы, это обойдется российским экспортерам в 33,3 млрд евро. Самый позитивный сценарий предполагает появление налога в 2028 году, в таком случае производители заплатят 6 млрд долларов.
При развитии водородной энергетики будут снижаться выбросы в атмосферу углекислого газа и увеличиваться выбросы водяного пара, поскольку в процессе реакции водорода и кислорода выделяется энергия и водяной пар.
Считается, что водяной пар безвреден для человека и окружающей среды.
Есть ли связь между водяным паром и парниковым эффектом?
Чем выше температура воздуха, тем большее количество водяного пара может содержаться в воздухе.
Влияет ли водяной пар, растворенный в воздухе, на климат и если влияет, то можно ли сравнить его влияние с влиянием углекислого газа?
Сжигание природного газа
Природный газ состоит из смеси предельных углеводородов, таких, как метан (СН4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10), пентан (С5Н12) и гексан (С6Н14), а также незначительного количества инертных газов.
Характеристики природного газа, такие, как плотность и теплота сгорания, с большой точностью могут быть определены с помощью характеристик первых четырех гомологов. Общая формула реакции предельных углеводородов с кислородом имеет следующий вид:
СnH(2n+2) + 0,5 (3n+1)O2 → nCO2 + (n+1) h3O,
где n — число молекул углерода и порядковый номер гомолога углеводорода.
Рассмотрим уравнения реакции горения четырех первых гомологов углеводородов С1, С2, С3 и С4, которые в атмосферных условиях находятся в газообразном состоянии.
При n=1
Ch5 + 2O2 → CO2 + 2 h3O
(т. е. 1 моль метана, соединяясь с 2 молями кислорода, образует 1 моль углекислого газа и 2 моля водяного пара).
При сжигании одного килограмма метана (СН4) выделяется 50 МДж тепловой энергии, а также 2,75 кг углекислого газа (СО2) и 2,25 кг водяного пара (Н2О), то есть выбросы водяного пара в атмосферу немного ниже, чем выбросы углекислого газа.
При n=2
C2H6 + 3,5O2 → 2CO2 + 3 h3O.
При сжигании одного килограмма этана (С2Н6) выделяется 47,8 МДж тепловой энергии, а также 2,93 кг углекислого газа (СО2) и 1,8 кг водяного пара (Н2О), то есть массовая доля водяного пара в продуктах сгорания этана меньше, чем при сжигании метана.
При n=3
C3H8 + 5O2 → 3CO2 + 4 h3O.
При n=4
C4h20 + 6,5O2 → 4CO2 + 5 h3O.
Из данных выражений видно, что при увеличении номера гомолога углеводорода для его полного окисления требуется больший объем кислорода, при этом выделяется больший объем углекислого газа и водяного пара, чем при сжигании метана. Объем выделяющегося при сжигании углеводородов СО2 пропорционален порядковому номеру гомолога, а водяного пара — n+1. При сжигании метана выделяется в два раза больше водяного пара, чем углекислого газа, а при увеличении доли «тяжелых» углеводородов в сжигаемом газе эта пропорция уменьшается.
Сжигание водорода и метана
Сравним количество выбросов в атмосферу парниковых газов при сжигании водорода и метана, который является основным компонентом природного газа.
При соединении двух молекул водорода с одной молекулой кислорода возникают две молекулы воды. Реакция соединения водорода и кислорода сопровождается выделением энергии.
2*Н2 + О2 → 2*Н2О + энергия (1)
При сжигании одного килограмма водорода (Н2) выделяется 120 МДж тепловой энергии и 9 кг водяного пара (Н2О).
При соединении одной молекулы метана с двумя молекулами кислорода возникают две молекулы воды и одна молекула углекислого газа. Реакция соединения метана и кислорода сопровождается выделением тепловой энергии.
СН4 + 2*О2 → 2*Н2О + СО2 +
тепловая энергия (2)
При сжигании одного килограмма метана (СН4) выделяется 50 МДж тепловой энергии, а также 2,75 кг углекислого газа (СО2) и 2,25 кг водяного пара (Н2О), то есть 5 кг парниковых газов.
Для получения 120 МДж тепловой энергии потребуется сжечь 2,4 кг метана. При этом в атмосферу попадет 6,6 кг углекислого газа и 5,4 кг водяного пара, то есть 12 кг парниковых газов.
Данные приведенных выше расчетов приведены в таблице 1.
Примечание: Учитывается только низшая теплота сгорания водорода и метана.
Из данного расчета видно, что при получении одинакового количества энергии суммарные выбросы парниковых газов при сжигании метана на 30% выше, чем при сжигании водорода.
При этом выбросы водяного пара при сжигании природного газа на 40% ниже, чем при сжигании водорода.
Из публикации Lindzen (1996) видно, что влияние водяных паров на парниковый эффект в 2,3 раза выше, чем влияние углекислого газа.
Если учесть этот факт, то парниковый эффект от сжигания 1 кг водорода будет соизмерим со сжиганием 2,4 кг метана. То есть при выделении одинакового количества энергии влияние водорода и метана на парниковый эффект соизмеримо.
Вместе с тем, по публикациям зарубежных средств массовой информации (СМИ) можно сделать вывод, что на увеличение парникового эффекта оказывает влияние только углекислый газ!
В Rick Panpaleo (2014) сообщается, что исследования, проведенные учеными из University of Miami Rosenstiel School of Marine and Atmospheric Science, подтвердили, что водяные пары в тропосфере — слой атмосферы, расположенный между поверхностью Земли и простирающийся на высоту 5–20 км — будут играть возрастающую роль в изменении климата в будущем.
Исследователи из Флориды сообщили, что увеличивающееся количество водяного пара в атмосфере вызвано человеческой деятельностью.
Если это так, то наряду с уменьшением выбросов в атмосферу углекислого газа необходимо контролировать и выбросы водяного пара.
Источники выбросов водяного пара
Как уже отмечалось выше, при использовании углеводородных газов, таких, как метан, этан, пропан и бутан, наряду с выбросами углекислого газа образуются водяные пары.
В тепловой и атомной энергетике рабочим телом, участвующим в выработке электрической и тепловой энергии, является водяной пар, для конденсации которого применяются различного типа градирни, а также прямоточное охлаждение водой из рек, озер и водохранилищ.
В 2008 году при проектировании и строительстве новых электростанций в России прямоточное охлаждение было запрещено.
Так называемые «мокрые» градирни являются источниками выбросов водяного пара в атмосферу.
Сократить выбросы водяного пара в энергетике позволяют «сухие» градирни, а также воздушные конденсационные установки (ВКУ).
Водород — топливо будущего
Как отмечалось выше, замещение природного газа водородом в качестве топлива не приводит к уменьшению парникового эффекта в случае, если пар, образующийся в результате сжигания водородсодержащего газа, не конденсировать.
Это относится и к топливным элементам, в которых электрическая энергия вырабатывается электрохимическим способом, поскольку на выходе из топливного элемента наряду с электрической энергией образуется водяной пар.
То есть при переходе к водородной энергетике надо стимулировать не только технологии, снижающие выбросы в атмосферу углекислого газа, но и водяного пара. И нашим ответственным лицам стоит задуматься о возможности введения ответного налога на продукцию, поставляемую в РФ, которая произведена на водородном топливе с выбросами водяного пара в атмосферу.
Топлива. Высшая теплотворная способность — таблица. (Удельная теплота сгорания). Приведенные в этой таблице величины соответствуют высшей теплотворной способности для сгорания при постянном давлении 1 bar и температуре 0oC. Высшая теплотворная способность (Higher Calorific Value = Gross Calorific Value = GCV) – количество теплоты, выделяемой при полном сгорании топлива, охлаждении продуктов сгорания до температуры топлива и конденсации водяного пара, образовавшегося при окислении водорода, входящего в состав топлива. Низшая теплотворная способность (Lower Calorific Value = Net Calorific Value = NCV) – количество теплоты, выделяемой при полном сгорании топлива без конденсации водяного пара.
цыкайкпцуп
| |||
% PDF-1.5
%
1 0 obj>
эндобдж
2 0 obj>
эндобдж
3 0 obj>
эндобдж
4 0 obj> поток
конечный поток
эндобдж
xref
0 5
0000000000 65535 ф
0000000016 00000 н.!
! 5 [«I» SH (Rd 2LEf (OW0UԢ% HA9BD
# «Ӑ4d * 2
[`8p @ h
_ZC_4} 1EC_4} E`q8X4A`q8X4U [, — U) 樻 G (Mmej {‘w-
Высшая и низшая теплотворная способность
Энергетическая ценность или теплотворная способность такие же, как , теплота сгорания , и может быть рассчитано на основе термодинамических значений или измерено в подходящем аппарате:
Известное количество топлива сжигается при постоянном давлении и стандартных условиях (0 ° C и 1 бар), а выделяющееся тепло улавливается известной массой воды в калориметр.Если измеряется начальная и конечная температуры воды, выделяемая энергия может быть рассчитана с использованием уравнения
H = ΔT mC p
где H = поглощенная тепловая энергия (в Дж), ΔT = изменение температуры (в ° C), m = масса воды (в г) и C p = удельная теплоемкость (4,18 Дж / г ° C для воды). Полученное значение энергии, разделенное на граммы сожженного топлива, дает содержание энергии (в Дж / г).
В процессе сгорания образуется водяной пар, и можно использовать определенные методы для рекуперации количества тепла, содержащегося в этом водяном паре, путем его конденсации.
- Высшая теплотворная способность (= Высшая теплотворная способность — GCV = Высшая теплотворная способность — HHV) — вода сгорания полностью конденсируется, а тепло, содержащееся в водяном паре, рекуперируется. Теплотворная способность — NCV = Нижняя теплотворная способность — LHV) — продукты сгорания содержат водяной пар, а тепло водяного пара не восстанавливается
В таблице ниже приведены валовая и чистая теплотворная способность ископаемого топлива, а также некоторых альтернативные виды биотоплива.
См. Также Теплота сгорания, ископаемые и альтернативные виды топлива — Энергосодержание и сжигание топлива — Выбросы углекислого газа
Для полной таблицы с более низкой теплотой сгорания LHV — поверните экран!
| Топливо | Плотность | Высокая теплотворная способность (HHV) (Высшая теплотворная способность — GCV) | Низкая теплотворная способность (LHV) Теплотворная способность — NCV) | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| при 0 ° C / 32 ° F, 1 бар | ||||||||||||||||||||||||||||||||||
| Газообразное топливо | [кг / м 3 ] | [г / футов 3 ] | [кВтч / кг] | [МДж / кг] | [БТЕ / фунт] | [МДж / м 3 ] | [БТЕ / фут 3 ] | [кВтч / кг] | [МДж / кг] | [БТЕ / фунт] | [МДж / м 3 ] | [ БТЕ / фут 3 ] | ||||||||||||||||||||||
| Ацетилен | 1.097 | 31,1 | 13,9 | 49,9 | 21453 | 54,7 | 1468 | |||||||||||||||||||||||||||
| Аммиак | 22,5 | 9690 | ||||||||||||||||||||||||||||||||
| Водород | 0,090 | 2,55 | 39,4 | 141,7 | 60920 | 12.7 | 341 | 33,3 | 120,0 | 51591 | 10,8 | 290 | ||||||||||||||||||||||
| Метан | 0,716 | 20,3 | 15,4 | 55,5 | 23874 | 39,8 | 1069 | 13 50,0 | 21496 | 35,8 | 964 | |||||||||||||||||||||||
| Природный газ (рынок США) * | 0,777 | 22,0 | 14,5 | 52.2 | 22446 | 40,6 | 1090 | 13,1 | 47,1 | 20262 | 36,6 | 983 | ||||||||||||||||||||||
| Городской газ | 18,0 | 483 | при 15 ° C / 60 ° F | |||||||||||||||||||||||||||||||
| Жидкое топливо | [кг / л] | | 9008 [кВтч / кг] | [МДж / кг] | [БТЕ / фунт] | [МДж / л] | [БТЕ / галлон] | [кВтч / кг ] | [МДж / кг] | [БТЕ / фунт] | [МДж / л] | [БТЕ / галлон] | | ||||||||||||||||||||||
| Ацетон | 0.787 | 2,979 | 8,83 | 31,8 | 13671 | 25,0 | 89792 | 8,22 | 29,6 | 12726 | 23,3 | 83580 | ||||||||||||||||||||||
| Бутан | 0,601 | 3,0 49,1 | 21109 | 29,5 | 105875 | 12,58 | 45,3 | 19475 | 27,2 | 97681 | ||||||||||||||||||||||||
| Бутанол | 0.810 | 10,36 | 37,3 | 16036 | 30,2 | 108359 | 9,56 | 34,4 | 14789 | 27,9 | 99934 | |||||||||||||||||||||||
| Дизельное топливо * | 0,846 | 12,62 | 12,62 | 45,6 | 19604 | 38,6 | 138412 | 11,83 | 42,6 | 18315 | 36,0 | 129306 | ||||||||||||||||||||||
| Диметиловый эфир (DME) | 0.665 | 2,518 | 8,81 | 31,7 | 13629 | 21,1 | 75655 | 8,03 | 28,9 | 12425 | 19,2 | 68973 | ||||||||||||||||||||||
| Этан | 0,572 | 2,1652 | 22313 | 29,7 | 106513 | 13,28 | 47,8 | 20550 | 27,3 | 98098 | ||||||||||||||||||||||||
| Этанол (100%) | 0.789 | 2,987 | 8,25 | 29,7 | 12769 | 23,4 | 84076 | 7,42 | 26,7 | 11479 | 21,1 | 75583 | ||||||||||||||||||||||
| Диэтиловый эфир (эфир) | 0,716 | 0,716 | 11,94 | 43,0 | 18487 | 30,8 | 110464 | |||||||||||||||||||||||||||
| Бензин (бензин) * | 0.737 | 2,790 | 12,89 | 46,4 | 19948 | 34,2 | 122694 | 12,06 | 43,4 | 18659 | 32,0 | 114761 | ||||||||||||||||||||||
| Газойль (топочный мазут) * | 0,84 | 11,95 | 43,0 | 18495 | 36,1 | 129654 | 11,89 | 42,8 | 18401 | 36,0 | 128991 | |||||||||||||||||||||||
| Глицерин | 1.263 | 4,781 | 5,28 | 19,0 | 8169 | 24,0 | 86098 | |||||||||||||||||||||||||||
| Мазут * | 0,98 | 3,710 | 11,61 | 41,81 | 41,81 | 146974 | 10,83 | 39,0 | 16767 | 38,2 | 137129 | |||||||||||||||||||||||
| Керосин * | 0,821 | 3.108 | 12,83 | 46,2 | 19862 | 37,9 | 126663 | 11,94 | 43,0 | 18487 | 35,3 | 126663 | ||||||||||||||||||||||
| Дизельное топливо * | 0,96 | 3,634 | 12 44,0 | 18917 | 42,2 | 151552 | 11,28 | 40,6 | 17455 | 39,0 | 139841 | |||||||||||||||||||||||
| СПГ * | 0.428 | 1,621 | 15,33 | 55,2 | 23732 | 23,6 | 84810 | 13,50 | 48,6 | 20894 | 20,8 | 74670 | ||||||||||||||||||||||
| СНГ * | 0,537 | 2,0 | 49,3 | 21195 | 26,5 | 94986 | 12,64 | 45,5 | 19561 | 24,4 | 87664 | |||||||||||||||||||||||
| Судовой газойль * | 0.855 | 3,237 | 12,75 | 45,9 | 19733 | 39,2 | 140804 | 11,89 | 42,8 | 18401 | 36,6 | 131295 | ||||||||||||||||||||||
| Метанол | 0,791 | 2,994 | 23,0 | 9888 | 18,2 | 65274 | 5,54 | 19,9 | 8568 | 15,8 | 56562 | |||||||||||||||||||||||
| Метиловый эфир (биодизель) | 0.888 | 3,361 | 11,17 | 40,2 | 17283 | 35,7 | 128062 | 10,42 | 37,5 | 16122 | 33,3 | 119460 | ||||||||||||||||||||||
| MTBE | 0,743 | 10116 | 2,8116 900 38,0 | 16337 | 28,2 | 101244 | 9,75 | 35,1 | 15090 | 26,1 | ||||||||||||||||||||||||
| Масла растительные (биодизель) * | 0.92 | 3,483 | 11,25 | 40,5 | 17412 | 37,3 | 133684 | 10,50 | 37,8 | 16251 | 34,8 | 124772 | ||||||||||||||||||||||
| Парафин (воск) * | 0,907 | 12,78 | 46,0 | 19776 | 41,4 | 148538 | 11,53 | 41,5 | 17842 | 37,4 | 134007 | |||||||||||||||||||||||
| Пентан | 0.63 | 2,385 | 13,50 | 48,6 | 20894 | 30,6 | 109854 | 12,60 | 45,4 | 19497 | 28,6 | 102507 | ||||||||||||||||||||||
| Нефтяная нафта * | 0,76 | 48,1 | 20679 | 34,9 | 125145 | 12,47 | 44,9 | 19303 | 32,6 | 116819 | ||||||||||||||||||||||||
| Пропан | 0.498 | 1.885 | 13,99 | 50,4 | 21647 | 25,1 | 89963 | 12,88 | 46,4 | 19927 | 23,1 | 82816 | ||||||||||||||||||||||
| 9078 Остаточное масло * | 0.991 | 0.991 | 41,8 | 150072 | 10,97 | 39,5 | 16982 | 39,2 | 140470 | |||||||||||||||||||||||||
| Смола * | 10.00 | 36,0 | 15477 | |||||||||||||||||||||||||||||||
| Скипидар | 0,865 | 3,274 | 12,22 | 44,0 | 18917 | 38,1 | 13655516 | Твердое топливо * | [кВтч / кг] | [МДж / кг] | [БТЕ / фунт] | [кВтч / кг] | [МДж / кг] | [БТЕ / фунт] | ||||||||||||||||||||
| Антрацитовый уголь | 9.06 | 32,6 | 14015 | |||||||||||||||||||||||||||||||
| Битуминозный уголь | 8,39 | 30,2 | 12984 | 8,06 | 29,0 | 9,11 | 32,8 | 14101 | ||||||||||||||||||||||||||
| Древесный уголь | 8.22 | 29,6 | 12726 | 7,89 | 28,4 | 12210 | ||||||||||||||||||||||||||||
| Кокс | 7,22 | 26,0 | 11178 | уголь) | 3,89 | 14,0 | 6019 | |||||||||||||||||||||||||||
| Торф | 4.72 | 17,0 | 7309 | |||||||||||||||||||||||||||||||
| Нефтяной кокс | 8,69 | 31,3 | 13457 | 8,19 | 29,516 | 8,19 | 29,516 | 8,19 | 29,5 | 12683 | ||||||||||||||||||||||||
| Полубитуминозный уголь | 6.78 | 24,4 | 10490 | |||||||||||||||||||||||||||||||
| Сера (ы) | 2,56 | 9,2 | 3955 | 2,52 | 9,2 | 2,52 | 9,2 | |||||||||||||||||||||||||||
| 0,701 | 4,50 | 16,2 | 6965 | 4,28 | 15,4 | 6621 | ||||||||||||||||||||||||||||
* Топливо, состоящее из смеси нескольких различных соединений, может различаться по качеству между сезонами и рынками.Приведены значения для топлива с заданной плотностью. Разница в качестве может давать значения нагрева в диапазоне от 5 до 10% выше или ниже заданного значения. Кроме того, твердые виды топлива будут иметь одинаковые вариации качества для разных классов топлива.
- 1 БТЕ (IT) / фунт = 2,3278 МДж / т = 2327,8 Дж / кг = 0,55598 ккал / кг = 0,000646 кВтч / кг
- 1 ккал / кг = 1 кал / г = 4,1868 МДж / т = 4186,8 Дж / кг = 1,8 БТЕ (IT) / фунт = 0,001162 кВтч / кг
- 1 МДж / кг = 1000 Дж / г = 1 ГДж / т = 238.85 ккал / кг = 429,9 БТЕ (IT) / фунт = 0,2778 кВт · ч / кг
- 1 кВт · ч / кг = 1547,7 Btu (IT) / фунт = 3,597 ГДж / т = 3597,1 кДж / кг = 860,421 ккал / кг
- 1 британская тепловая единица (ИТ) / фут 3 = 0,1337 британских тепловых единиц (ИТ) / галлон (жидкий эквивалент США) = 0,03531 британских тепловых единиц (ИТ) / л = 8,89915 ккал / м 3 = 3,7259×10 4 Дж / м 3
- 1 британская тепловая единица (IT) / галлон (американский жидкий) = 0,2642 британской тепловых единиц (ИТ) / л = 7,4805 британских тепловых единиц (ИТ) / фут 3 = 66,6148 ккал / м 3 = 2,7872×10 5 Дж / м 3
- 1 МДж / м 3 = 26.839 британских тепловых единиц / фут 3 = 3,5879 британских тепловых единиц на галлон (жидкие тепловые единицы США) = 0,94782 британских тепловых единицы (ИТ) / л = 239,01 ккал / м 3
- 1 ккал / м2 3 = 0,11237 британских тепловых единиц (IT) / фут 3 = 0,01501 британских тепловых единиц (ИТ) / галлон (жидких единиц США) = 0,003966 британских тепловых единиц (ИТ) / л = 4186,8 Дж / м 3
Химический состав, теплотворная способность и интенсивность выбросов CO2. ..
Контекст 1
… коксовый газ возникает как побочный продукт превращения угля в кокс. Здесь летучие компоненты кокса, которые выделяются во время коксования, подвергаются обширному кондиционированию перед тем, как они покинут коксовальную установку либо в виде частично очищенного газа, либо в виде газа с качеством газа для централизованного теплоснабжения, который будет использоваться на выходе либо в виде несмешанного газа, либо в смеси с газом. прочие газообразные побочные продукты.Доменный газ, также известный как топочный газ, образуется при плавке железной руды в доменной печи. С точки зрения объема производится большое количество этого газа, однако его удельная теплотворная способность или теплота сгорания относительно невысока. Верхний газ в основном используется для отопления в доменной печи доменного цеха и для топки коксовых печей. Любой оставшийся излишек затем используется либо на электростанции для производства электроэнергии, либо обогащается другими газами, имеющими более высокую теплотворную способность, а затем используется в качестве смешанного газа в печах повторного нагрева.Отходящий газ конвертера образуется во время конверсии жидкого чугуна в сырую сталь в конвертере. Отходящий газ конвертера может использоваться в энергетической сети завода либо в нагревательных печах, либо для восполнения смешанных газов, либо для выработки электроэнергии на электростанции. Как технологические газы, побочные газы имеют определенные характеристики и принципиально различаются по своему химическому составу, см. Рис. 2. В то время как окись углерода является основным источником теплотворной способности отходящих газов конвертера и топочного газа доменной печи, в коксовом газе. это водород, около 60% которого присутствует в виде молекулярного водорода и около 20% связано с углеродом с образованием метана.Эти изменения в составе приводят к очень разным характеристикам горения. В первую очередь это означает, что газы не взаимозаменяемы, что сужает диапазон использования. Эта проблема решалась разными способами. Наиболее распространенные решения — спроектировать оборудование для термообработки таким образом, чтобы различные побочные газовые продукты образовывались с составом, подходящим для использования в других частях производства …
Теплотворная способность различных видов топлива
Теплотворная способность топлива — это количество тепла, выделяющееся при его сгорании.Теплотворная способность, также называемая энергией или теплотой сгорания, является мерой плотности энергии топлива и выражается в энергии (джоулях) на указанное количество (, например, килограммов).
| Теплотворная способность | |
| Водород (H 2 ) | 120-142 МДж / кг |
|---|---|
| Метан (CH 4 ) | 50-55 МДж / кг |
| Метанол (CH 3 OH) | 22.7 МДж / кг |
| Диметиловый эфир — DME (CH 3 OCH 3 ) | 29 МДж / кг |
| Бензин / бензин | 44-46 МДж / кг |
| Дизельное топливо | 42-46 МДж / кг |
| Сырая нефть | 42-47 МДж / кг |
| Сжиженный углеводородный газ (СУГ) | 46-51 МДж / кг |
| Природный газ | 42-55 МДж / кг |
| Каменный каменный уголь (определение МЭА) | > 23.9 МДж / кг |
| Каменный каменный уголь (Австралия и Канада) | г. 25 МДж / кг |
| Полубитуминозный уголь (определение МЭА) | 17,4-23,9 МДж / кг |
| Полубитуминозный уголь (Австралия и Канада) | г. 18 МДж / кг |
| Бурый уголь / бурый уголь (определение МЭА) | <17,4 МДж / кг |
| Бурый уголь / бурый уголь (Австралия, электричество) | г.10 МДж / кг |
| Дрова сухие | 16 МДж / кг |
| Природный уран в LWR (нормальный реактор) | 500 ГДж / кг |
| Природный уран в LWR с рециркуляцией U и Pu | 650 ГДж / кг |
| Уран природный, в FNR | 28000 ГДж / кг |
| Уран с обогащением до 3,5%, в LWR | 3900 ГДж / кг |
Цифры по урану основаны на выгорании 3 из 45 000 МВтд / т.5% обогащенный U в LWR
МДж = 10 6 Дж, ГДж = 10 9 Дж
МДж в кВтч при КПД 33%: x 0,0926
Одна тонна нефтяного эквивалента (тнэ) равна 41,868 ГДж
Заметки и ссылки
Общие источники
Интернет-книга по химии NIST
Информация об электроэнергетике ОЭСР / МЭА (различные издания)
Международный газовый союз, Руководство по конверсии природного газа
| Как крупный международный издатель академических и исследовательских журналов Science Alert издает и разрабатывает названия в партнерстве с самыми престижные научные общества и издатели.Наша цель заключается в том, чтобы максимально широко использовать качественные исследования. аудитория. | ||||||
| Мы прилагаем все усилия, чтобы поддержать исследователей которые публикуют в наших журналах. Есть масса информации здесь, чтобы помочь вам публиковаться вместе с нами, а также ценные услуги для авторов, которые уже публиковались у нас. | ||||||
| 2021 цены уже доступны. Ты может получить личную / институциональную подписку перечисленных журналы прямо из Science Alert. В качестве альтернативы вы возможно, пожелает связаться с выбранным вами агентством по подписке. Направляйте заказы, платежи и запросы в службу поддержки. в службу поддержки клиентов журнала в Science Alert. | ||||||
| Science Alert гордится своей тесные и прозрачные отношения с обществом. В виде некоммерческий издатель, мы стремимся к самому широкому возможное распространение публикуемых нами материалов и на предоставление услуг высочайшего качества нашим издательские партнеры. | ||||||
| Здесь вы найдете ответы на наиболее часто задаваемые вопросы (FAQ), которые мы получили по электронной почте или через контактную форму в Интернете.В зависимости от характера вопросов мы разделили часто задаваемые вопросы на разные категории. | ||||||
| Азиатский индекс научного цитирования (ASCI) стремится предоставить авторитетный, надежный и значимая информация по освещению наиболее важных и влиятельные журналы для удовлетворения потребностей мировых научное сообщество.База данных ASCI также предоставляет ссылку к полнотекстовым статьям до более чем 25000 записей с ссылка на цитированные ссылки. | ||||||
пользователем B.D. Хонг и Э. Р. Слатик Примечание: Эта статья была первоначально опубликована в Energy Information Введение Уголь является важным источником энергии в Соединенных Штатах, и страна использует это ископаемое топливо для производства электроэнергии. Коэффициенты выбросов углекислого газа для углей США ранее были доступны из нескольких источников. Однако эти коэффициенты выбросов Коэффициенты выбросов EIA улучшат точность оценок выбросов углекислого газа, особенно на уровне штатов и регионов, поскольку они отражают разницу в соотношении углерода и теплосодержания в зависимости от вида угля и государства происхождения. Были разработаны два типа коэффициентов выбросов диоксида углерода. Во-первых, это основные коэффициенты выбросов, охватывающие различные марки угля в зависимости от государства происхождения. Эти основные коэффициенты выбросов считаются «фиксированными» в обозримом будущем, пока не будут получены более точные данные. Коэффициенты выбросов EIA не только позволят оценить выбросы углекислого газа более точно, чем раньше, Сжигание угля и двуокись углерода | ||||||||||
| Страна происхождения | Антрацит | Битумный | Полубитуминозный | бурый уголь | |
|---|---|---|---|---|---|
| Алабама | — | 224 | — | — | |
| Аляска | — | — | — | — | |
| Аризона | — | 8 | — | — | |
| Арканзас | — | 8 | — | — | |
| Калифорния | — | — | — | — | |
| Колорадо | — | 164 | 18 | — | |
| Грузия | — | 1 | — | — | |
| Айдахо | — | 2 | — | — | |
| Иллинойс | — | 332 | — | — | |
| Индиана | — | 51 | — | — | |
| Айова | — | 67 | 1 | — | |
| Канзас | — | 19 | — | — | |
| Кентукки: Восток | — | 486 | — | — | |
| Кентукки: Запад | — | 151 | — | — | |
| Луизиана | — | — | — | — | |
| Мэриленд | — | 13 | — | — | |
| Миссури | — | 86 | — | — | |
| Монтана | — | 6 | 23 | 2 | |
| Невада | — | 4 | — | — | |
| Нью-Мексико | — | 50 | — | — | |
| Северная Дакота | — | — | — | 16 | |
| Огайо | — | 228 | — | — | |
| Оклахома | — | 155 | — | — | |
| Орегон | — | — | 2 | — | |
| Пенсильвания | 523 | 679 | — | — | |
| Южная Дакота | — | — | — | 3 | |
| Теннесси | — | 271 | — | — | |
| Техас | — | — | — | 11 | |
| Юта | — | 104 | 2 | — | |
| Вирджиния | — | 169 | — | — | |
| Вашингтон | — | 181 | 36 | 4 | |
| Западная Вирджиния | — | 1 071 | — | — | |
| Вайоминг | — | 133 | 121 | 1 | |
| Итого . | 523 | 4,663 | 203 | 37 | |
Составлены распределения данных наблюдений по годам сбора и степени очистки (таблица FE2).Потому что даты
из образцов в диапазоне с 1900 по 1986 год, считалось, что изменения
в методах лабораторного анализа на протяжении многих лет могли повлиять на результирующие отношения содержания углерода к теплоте. Регресс
Анализ показал, что при значении R 2 всего 0,01 (Таблица FE3) год сбора пробы не был полезным фактором
объясняя вариацию в соотношении, хотя были небольшие изменения в соотношении с течением времени. (8) Это открытие показало, что образцы
данные из более ранних периодов времени могут быть объединены с более свежими образцами для получения коэффициентов выбросов углекислого газа.
Таблица FE2. Распределение наблюдений по годам
и степень очистки
| Год | Количество наблюдений | Процент от общего числа |
|---|---|---|
| 1900–1909 | 217 | 4,0 |
| 1910-1919 | 679 | 12,5 |
| 1920-1929 | 657 | 12.1 |
| 1930-1939 гг. | 772 | 14,2 |
| 1940-1949 | 744 | 13,7 |
| 1950–1959 | 1 043 | 19,2 |
| 1960-1969 | 557 | 10,3 |
| 1970–1979 | 339 | 6.2 |
| 1980-1986 | 418 | 7,7 |
| Итого | 5 426 | 100,0 |
| Степень очистки | ||
| Необработанный | 4,519 | 83,3 |
| Промытый | 847 | 15.6 |
| Частично промытый | 60 | 1,1 |
Из общего количества проб 83 процента составляли необработанный уголь, а оставшаяся часть была либо промыта, либо частично промыта. Очистка не должна
существенно влияет на соотношение содержания тепла и углерода в угле, поскольку в процессе удаляются в основном негорючие примеси.
Это было подтверждено дисперсионным анализом.Отмечались различия в соотношении содержания углерода к теплоте между промытыми и
частично промытый и необработанный уголь, но при значении R 2 0,06 различия мало объясняют различия в соотношениях. Следовательно,
не требовалось исправления данных для учета небольшого влияния очистки угля на коэффициенты выбросов.
Дисперсионный анализ использовался для проверки статистической значимости различий в соотношениях содержания углерода к теплоте по сортам угля и по государству происхождения в пределах сорта угля.Переменная непрерывного отклика (углекислый газ
коэффициент выбросов) был связан с классификационными переменными ранга и государства происхождения. Коэффициент выбросов углекислого газа был принят
быть линейной функцией параметров, связанных с рангом угля и государством происхождения. (9)
Статистический анализ (таблица FE3) показал, что: (1) существуют статистически значимые различия в выбросах диоксида углерода.
факторы как по сорту угля, так и по государству происхождения; (2) сорт угля и государство происхождения объясняют примерно 80 процентов
изменение коэффициентов выбросов диоксида углерода; и (3) государство происхождения в сочетании с категорией угля является немного более сильной объясняющей переменной, чем просто категория угля или государство происхождения.
Таблица FE3. Резюме статистического анализа
Коэффициенты выбросов углекислого газа по
Класс угля и государство происхождения
| Переменная | F Тест | R 2 | MSE | Корневой MSE |
|---|---|---|---|---|
| Год сбора | *** | 0,01 | 55,18 | 7,43 |
| Степень очистки | *** | 0.06 | 52,07 | 7,22 |
| Уголь Рейтинг | *** | 0,78 | 12,24 | 3,50 |
| Государство происхождения | *** | 0,81 | 10,78 | 3,28 |
| Государство происхождения Комбинировано | ||||
| с рейтингом угля | *** | 0.82 | 9,98 | 3,16 |
Коэффициенты выбросов углекислого газа по
Класс угля и государство происхождения
(арифметические) средние коэффициенты выбросов, полученные для отдельных образцов (при условии полного сгорания) (таблица FE4) (10) подтверждают давно признанный вывод о том, что антрацит выделяет наибольшее количество диоксида углерода на миллион БТЕ, за ним следует лигнит
полубитуминозный уголь и битуминозный уголь.Высокий коэффициент выбросов углекислого газа для антрацита отражает относительно небольшое содержание водорода в угле, что снижает его теплотворную способность. (11) В фунтах диоксида углерода на миллион британских тепловых единиц средний коэффициент по США составляет 227,4 для антрацита, 216,3 для бурого угля, 211,9 для полубитуминозного угля и 205,3 для битуминозного угля.
Таблица FE4. Средний выброс углекислого газа
Факторы для угля по классу и состоянию
Источник
| Страна происхождения | Антрацит | Битумный | Полубитуминозный | бурый уголь | |
|---|---|---|---|---|---|
| Алабама | — | 205.5 | — | — | |
| Аляска | — | — | а 214,0 | — | |
| Аризона | — | 209,7 | — | — | |
| Арканзас | — | 211.6 | — | б 213,5 | |
| Калифорния | — | — | — | в 216,3 | |
| Колорадо | — | 206,2 | 212,7 | — | |
| Грузия | — | 206.1 | — | — | |
| Айдахо | — | 205,9 | — | — | |
| Иллинойс | — | 203,5 | — | — | |
| Индиана | — | 203.6 | — | — | |
| Айова | — | 201,6 | г 207,2 | — | |
| Канзас | — | 202.8 | — | — | |
| Кентукки: Восток | — | 204,8 | — | — | |
| Кентукки: Запад | — | 203.2 | — | — | |
| Луизиана | — | — | — | б 213,5 | |
| Мэриленд | — | 210.2 | — | — | |
| Миссури | — | 201,3 | — | — | |
| Монтана | — | 209.6 | 213,4 | 220,6 | |
| Невада | — | 201,8 | — | — | |
| Нью-Мексико | — | 205.7 | e 208,8 | — | |
| Северная Дакота | — | — | — | 218,8 | |
| Огайо | — | 202.8 | — | — | |
| Оклахома | — | 205,9 | — | — | |
| Орегон | — | — | 210.4 | — | |
| Пенсильвания | 227,4 | 205,7 | — | — | |
| Южная Дакота | — | — | — | 217.0 | |
| Теннесси | — | 204,8 | — | — | |
| Техас | — | ф 204.4 | — | 213,5 | |
| Юта | — | 204,1 | 207,1 | — | |
| Вирджиния | — | 206.2 | — | — | |
| Вашингтон | — | 203,6 | 208,7 | 211.7 | |
| Западная Вирджиния | — | 207,1 | — | — | |
| Вайоминг | — | 206.5 | 212,7 | 215,6 | |
| В среднем по США | 227,4 | 205,3 | 211.9 | 216,3 | |
В целом коэффициенты выбросов углекислого газа самые низкие для угля, добываемого в штатах к востоку от реки Миссисипи (рисунок FE1),
где преобладающие угли являются битуминозными и поэтому имеют относительно низкие коэффициенты выбросов. Для сравнения: уголь
Месторождения на Западе в основном представляют собой полубитуминозные угли с относительно высокими коэффициентами выбросов.В широком смысле географический
различия отражают большую степень углефикации — процесса, который преобразовал завод
материал в уголь под воздействием тепла и давления — в угленосных районах на Востоке.
В Аппалачском угольном бассейне коэффициенты выбросов для битуминозного угля находятся в диапазоне от 202,8 фунтов диоксида углерода на
миллиона БТЕ в Огайо до 210,2 в Мэриленде. (12) Пенсильванский антрацит, который производится в небольших количествах, имеет самый высокий
коэффициент выбросов среди всех марок угля (227.4). Для угля бассейна Иллинойса, все битуминозного по рангу, коэффициенты выбросов относительно
униформа: от 203,2 в западном Кентукки до 203,6 в Индиане.
Рисунок FE1: Средние коэффициенты выбросов углекислого газа для угля по классам и государству происхождения
фунтов диоксида углерода на миллион британских тепловых единиц
К западу от реки Миссисипи коэффициенты выбросов для битуминозного угля составляют более 201 фунта углекислого газа на
миллионов британских британских тепловых единиц в Миссури, Айове и Неваде до более чем 209 в Аризоне, Арканзасе и Монтане.Около 16 процентов 1992 г.
Добыча угля к западу от Миссисипи представляла собой битуминозный уголь, добываемый в основном из Юты, Аризоны, Колорадо и Нью-Мексико.
Суббитуминозный уголь является преобладающим видом угля, добываемого к западу от реки Миссисипи, составляя 62 процента
общая добыча угля в регионе в 1992 году. Суббитуминозный уголь в бассейне Паудер-Ривер в Вайоминге, основной источник этого сорта угля,
имеет коэффициент выбросов 212,7 фунтов диоксида углерода на миллион британских тепловых единиц.Это то же самое, что и для полубитуминозного угля в Колорадо,
но немного ниже, чем в Монтане. Самый низкий коэффициент выбросов для полубитуминозного угля в штате Юта (207,1), а самый высокий — в
Аляска (214,0).
Коэффициент выбросов для лигнита из угольного региона побережья Мексиканского залива в Техасе, Луизиане и Арканзасе составляет 213,5 фунтов углерода.
диоксида на миллион британских тепловых единиц. Это на 1–3 процента ниже, чем коэффициенты выбросов для бурого угля в угольном регионе Форт-Юнион на севере.
Дакота, Южная Дакота и Монтана, а также бурый уголь в бассейне Паудер-Ривер в Вайоминге.Объем производства бурого угля в 1992 г.
для 22 процентов добычи угля к западу от реки Миссисипи, с двумя третями из Техаса и большей частью с севера
Дакота.
Все коэффициенты выбросов углекислого газа EIA для угля по классам и государству происхождения следует рассматривать как «фиксированные» в обозримом будущем.
будущее. Это связано с тем, что подробные данные анализа угля ежегодно не широко доступны, а также потому, что коэффициенты выбросов EIA, как
разработанные на основе файла анализа угля EIA, считаются эффективно отображающими взаимосвязь между углеродом и теплотой.
содержание различных U.С. угли. Однако основные коэффициенты выбросов будут пересмотрены, когда будет проведен достаточный дополнительный анализ угля.
данные накапливаются.
Коэффициенты выбросов углекислого газа по
Угледобывающий сектор и государство
Использование угля в потребляющих секторах и штатах различается по количеству, а также по рангу и государству происхождения. Следовательно, эмиссия
коэффициенты по потребляющим секторам в каждом государстве были получены путем взвешивания коэффициентов выбросов по сортам угля, а по государству происхождения — по
соответствующие суммы получены по секторам. (13) , (14) Для сравнения в данной статье приведены коэффициенты выбросов для 1980 и 1992 годов (таблица
FE5). Следует отметить, что количество угля, полученного в определенный год, может не равняться количеству, потребленному в течение этого года.
из-за добавления или снятия запасов. Более того, поскольку данные о происхождении и назначении угля доступны только для
распределение угля, коэффициенты выбросов EIA для потребления угля по секторам предполагают, что смесь угля, полученного в течение определенного года
был таким же, как и в том году.
Коэффициенты выбросов для потребления угля, связанного с сжиганием, основаны на предположении, что весь углерод в угле
превращается в двуокись углерода при горении. На самом деле очень небольшой процент углерода в угле не окисляется во время горения. Коэффициенты выбросов в таблице FE5 могут быть скорректированы для отражения неполного сгорания. (15)
На коксовых заводах уголь обугливается, а не сжигается для получения кокса, который используется при производстве чугуна из чугуна и стали.
промышленность.Хотя большая часть углерода в карбонизированном угле остается в коксе, небольшое количество остается в побочных продуктах, некоторые
из которых потребляются в качестве источников энергии, а другие — в качестве неэнергетического сырья. (16) Изучение исторических данных по коксовому заводу
показывает, что около 10 процентов углерода в коксующемся угле остается в побочных продуктах, не связанных с энергетикой. (17) Однако нет
В коэффициенты выбросов для коксовых заводов (таблица FE5) были внесены поправки на углерод, оставшийся в неэнергетических побочных продуктах, оставляя любые корректировки в соответствии с требованиями пользователя.
Таблица FE5. Средние коэффициенты выбросов углекислого газа для сектора и государства, потребляющего уголь, 1980 и 1992 гг.
| Государство | Сектор | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Электроэнергетика | Промышленное | Жилой / Коммерческий | Среднее значение по штату б | |||||||
| Коксующийся уголь a | Другой уголь | |||||||||
| 1980 | 1992 | 1980 | 1992 | 1980 | 1992 | 1980 | 1992 | 1980 | 1992 | |
| Алабама | 205.0 | 205,3 | 205,5 | 206,1 | 205,5 | 205,7 | 205,4 | 205,5 | 205,1 | 205,4 |
| Аляска | 214,0 | 214,0 | — | — | — | — | — | 214.0 | 214,0 | 214,0 |
| Аризона | 208,0 | 207,7 | — | — | 209,2 | 206,7 | — | 208,6 | 208,1 | 207,6 |
| Арканзас | 212.7 | 212,7 | — | — | 201,4 | 205,2 | 205,3 | 222,3 | 210,7 | 212,5 |
| Калифорния | — | — | 208,7 | — | 205.6 | 204,2 | 204,5 | 204,1 | 207,5 | 204,1 |
| Колорадо | 211,5 | 209,8 | 212,6 | — | 212,6 | 212,5 | 212.6 | 211,0 | 211,7 | 209,9 |
| Коннектикут | — | 204,9 | — | — | — | 204,7 | 226,1 | 220,2 | 226.1 | 205,2 |
| Делавэр | 206,0 | 206,9 | — | — | 205,9 | 207,4 | 221,8 | 221,1 | 206,0 | 207.0 |
| Округ Колумбия | — | — | — | — | 205,0 | — | 205,5 | 206,3 | 205,4 | 206,3 |
| Флорида | 204.0 | 204,4 | — | — | 204,2 | 205,1 | 205,0 | 205,7 | 204,0 | 204,5 |
| Грузия | 204.3 | 204,8 | — | — | 204,9 | 204,9 | 204,7 | 204,9 | 204,3 | 204,8 |
| Гавайи | — | — | — | — | — | 204.4 | — | — | — | 204,4 |
| Айдахо | — | — | — | — | 212,6 | 212.2 | 205,4 | 205,0 | 210,7 | 211,3 |
| Иллинойс | 207,1 | 206,2 | 205,2 | 206,5 | 204.2 | 203,7 | 203,9 | 203,9 | 206,7 | 205,9 |
| Индиана | 204,0 | 205,6 | 205,0 | 206.0 | 203,7 | 204,5 | 203,7 | 203,8 | 204,3 | 205,5 |
| Айова | 207,2 | 211.1 | — | — | 205,7 | 208,3 | 205,1 | 204,2 | 207,0 | 210,7 |
| Канзас | 209.2 | 210,9 | — | — | 201,9 | 205,3 | 202,2 | 202,9 | 209,0 | 210.8 |
| Кентукки | 204,0 | 204,1 | 204,6 | 206,3 | 205,4 | 205,4 | 204,6 | 204.6 | 204,1 | 204,2 |
| Луизиана | 212,7 | 212,9 | — | — | 203,9 | 210.9 | 201,3 | — | 212,1 | 212,8 |
| Мэн | — | — | — | — | 206.0 | 204,9 | 216,2 | 213,0 | 207,9 | 205,3 |
| Мэриленд | 206,6 | 207.0 | 205,9 | — | 206,1 | 208,4 | 210,6 | 211,7 | 206,3 | 207.1 |
| Массачусетс | 206,4 | 206,8 | — | — | 206,3 | 207,0 | 218.2 | 214,1 | 207,6 | 206,9 |
| Мичиган | 206,0 | 208,9 | 205,5 | — | 204.8 | 205,3 | 205,0 | 205,0 | 205,7 | 208,5 |
| Миннесота | 212,9 | 213.0 | — | — | 211,6 | 211,8 | 208,6 | 212,3 | 212.7 | 212,9 |
| Миссисипи | 204,7 | 204,5 | — | — | 204.0 | 204,6 | 202,6 | 227,4 | 204,7 | 204,5 |
| Миссури | 204.5 | 206,2 | 205,2 | — | 203,6 | 204,5 | 202,1 | 203.4 | 204,5 | 206,1 |
| Монтана | 213,9 | 213,5 | — | — | 211.2 | 211,4 | 205,6 | 213,3 | 213,7 | 213,5 |
| Небраска | 211.7 | 212,7 | — | — | 212,3 | 213,1 | 212,6 | 219.2 | 211,7 | 212,7 |
| Невада | 208,2 | 208,4 | — | — | 204.5 | 204,1 | 208,4 | 204,1 | 208,1 | 208,3 |
| Нью-Гэмпшир | 206.9 | 206,3 | — | — | 207,0 | 207,1 | 227.2 | 225,4 | 207,0 | 206,5 |
| Нью-Джерси | 206,6 | 206,6 | — | — | 218.3 | 207,3 | 227,2 | 227,1 | 207,1 | 206,8 |
| Нью-Мексико | 205.7 | 205,7 | — | — | 212,0 | 212,7 | 209.8 | 206,3 | 205,7 | 205,7 |
| Нью-Йорк | 205,7 | 206.1 | 205,5 | 206,1 | 206,9 | 207,0 | 218,9 | 218.0 | 206,3 | 206,5 |
| Северная Каролина | 205,6 | 205,8 | — | — | 204.8 | 205,7 | 204,9 | 206,2 | 205,6 | 205,8 |
| Северная Дакота | 218.8 | 218,8 | — | — | 218,8 | 218,3 | 218.5 | 216,8 | 218,8 | 218,6 |
| Огайо | 204,4 | 204.4 | 205,4 | 206,4 | 204,0 | 204,5 | 203,8 | 205.5 | 204,5 | 204,6 |
| Оклахома | 210,5 | 212,6 | — | — | 202.2 | 207,5 | 205,7 | 207,0 | 210,0 | 212.3 |
| Орегон | 212,7 | 212,9 | — | — | 212.7 | 211,5 | 205,6 | 204,1 | 212,5 | 212.8 |
| Пенсильвания | 206,1 | 206,2 | 205,7 | 206,1 | 207.9 | 208,5 | 221,2 | 219,7 | 206,4 | 206.7 |
| Род-Айленд | — | — | — | — | 210.0 | — | 223,9 | 227,4 | 217,2 | 227.4 |
| Южная Каролина | 204,9 | 205,0 | — | — | 205.0 | 205,3 | 204,8 | 205,3 | 204,9 | 205.0 |
| Южная Дакота | 218,1 | 218,8 | — | — | 210.5 | 212,7 | 212,0 | 212,8 | 217,6 | 217.9 |
| Теннесси | 204,0 | 204,0 | 210,2 | — | 204.8 | 205,5 | 204,5 | 204,6 | 204,1 | 204.2 |
| Техас | 213,0 | 212,9 | 209,8 | — | 212.3 | 212,3 | 213,7 | 211,0 | 212,8 | 212.9 |
| Юта | 204,1 | 204,3 | 210,8 | 205.6 | 205,2 | 204,1 | 204,1 | 204,1 | 205.7 | 204,4 |
| Вермонт | 205,7 | — | — | — | 207.8 | 212,2 | 227,4 | 227,4 | 216,0 | 216.8 |
| Вирджиния | 205,9 | 206,0 | 206,2 | 206.2 | 205,1 | 206,2 | 205,0 | 206,3 | 205.7 | 206,1 |
| Вашингтон | 208,7 | 209,3 | — | — | 206.3 | 205,8 | 204,3 | 206,9 | 208,3 | 209.1 |
| Западная Вирджиния | 206,9 | 207,0 | 205,3 | 206.7 | 205,4 | 206,6 | 205,0 | 210,2 | 206.6 | 207,0 |
| Висконсин | 207,0 | 209,9 | 205.4 | — | 205,5 | 206,1 | 205.8 | 204,9 | 206,8 | 209,5 |
| Вайоминг | 212.7 | 212,0 | — | — | 212.0 | 212,5 | 212,3 | 212,7 | 212.6 | 212,1 |
| Среднее значение по США b | 206,7 | 207,7 | 205.8 | 206,2 | 205,9 | 207,1 | 210.6 | 211,2 | 206,5 | 207,6 |
Сорт угля, потребляемого в Соединенных Штатах, существенно изменился за последние два десятилетия, отражая
переходит на западный суббитуминозный уголь с низким содержанием серы и бурый уголь, преимущественно для производства электроэнергии.Ожидаются дальнейшие изменения
в ближайшие годы, особенно в связи с поправками к Закону о чистом воздухе 1990 года, которые будут стимулировать переход от высокосернистых
Восточный битуминозный уголь к низкосернистому западному суббитуминозному углю.
Сдвиг в структуре потребляемых сортов угля становится очевидным, когда производство по сортам угля в 1980 году сравнивается с производством в
1992 г., поскольку большая часть продукции предназначалась для внутреннего потребления. (18) В 1980 году битуминозный уголь составлял 76 процентов от общего количества, но к 1992 году
его доля упала до 65 процентов.Напротив, доля полубитуминозного угля выросла с 18 процентов в 1980 году до 25 процентов в 1992 году.
в то время как доля бурого угля выросла с 6 до 9 процентов. Доля антрацита в оба года составляла около 1 процента. Потому что ниже
У обыкновенных углей относительно высокие коэффициенты выбросов углекислого газа, более широкое использование этих углей привело к общенациональному среднему уровню выбросов углекислого газа.
коэффициент выбросов диоксида вырастет с 206,5 фунтов на миллион британских тепловых единиц в 1980 году до 207,6 фунтов на миллион британских тепловых единиц в 1992 году.
Изменение состава добываемых марок угля отражает произошедшие крупные отраслевые и региональные сдвиги в потреблении угля.
в последние два десятилетия.Электроэнергетика доминирует в потреблении угля, и ее доля существенно выросла. Всего угля
потребление в 1992 году на долю электроэнергетики приходилось 87 процентов, по сравнению с 81 процентом в 1980 году, в основном за счет увеличения добычи угля для коммунальных предприятий.
потребление к западу от реки Миссисипи. (19) Доля низкосортных углей в электроэнергетике существенно выросла. (20) Объем суббитуминозного угля вырос с 24 процентов в 1980 году до 31 процента в 1992 году, а объем бурого угля вырос за этот период с 7 до 10 процентов.Напротив, доля битуминозного угля упала с 69 процентов в 1980 году до 58 процентов в 1992 году. Доля антрацита (около 1 процента) не изменилась.
Уголь, используемый для производства кокса, практически полностью битуминозный; менее 1 процента — антрацит. Лишь несколько штатов, в основном в
Аппалачи, поставка коксующегося угля. Коксохимическая промышленность, в которой наблюдается спад, составляет всего 4 процента от общего объема угля.
потребление в 1992 году по сравнению с 9 процентами в 1980 году.
Уголь всех марок используется в других промышленных и жилых / коммерческих секторах. (21) Прочие отрасли учтены
на 8 процентов от общего потребления угля в 1992 году, что немного меньше, чем в 1980 году. Однако коэффициент выбросов для этого сектора увеличился.
в значительной степени в течение периода, в основном из-за роста использования низкосортных углей на Западе, и способствовал увеличению выбросов
факторы для общего среднего показателя по стране. Жилой / коммерческий сектор составляет относительно небольшой компонент потребления угля,
около 1 процента от общего количества в 1980 и 1992 годах.
Как и в случае потребления угля по секторам, количество углекислого газа, выбрасываемого в результате полного сжигания угля в конкретном государстве — и
следовательно, коэффициент выбросов углекислого газа для этого государства — зависит от состава угля, потребляемого различными потребляющими секторами в
это государство в течение определенного года. Когда известна общая энергия в британских тепловых единицах от потребления угля государством (без разбивки
по потребляющим уголь секторам), средние по государству коэффициенты выбросов могут использоваться для оценки общего количества выбросов диоксида углерода.
государством.
Публикация по двуокиси углерода
Коэффициенты выбросов
Коэффициенты выбросов диоксида углерода
EIA по потребляющим секторам и штатам будут периодически обновляться, чтобы отражать
изменения в структуре потребления угля в США. EIA планирует сообщать об этих обновлениях в Ежеквартальном отчете по углю , Государственном энергетическом отчете
Отчет о данных и ежегодный выпуск «Выбросы парниковых газов в США» .
Статистика Удельные выбросы диоксида углерода из различных видов топлива Топливо не равно топливу — по крайней мере, с учетом выбросов углекислого газа.Горение лигнита выделяет Удельные выбросы диоксида углерода из различных видов топлива
|

