Содержание
Пожалуйста помогите уровнять реакцию Cr(OH)2+O2+h3O>Cr(OH)3
30 мл этанола (плотность 0,79 г / мл) нагревали с избытком серной кислоты ր бромида натрия. Из реакционной смеси удаляли 42,3 г брометана. Определите
…
массовую долю выходящего брометана.
Хімія, 9 клас, задача.
який об`эм газу видiлиться при взаимодии алюмiнiя з хлоридной кислотой масою 100 гр?Даю 20 баллов. Помогите, пожалуйста!
помогите пожалуйста
налий півсклянки води і насипте в неї пів чайної ложки питної соди. Суміж перемішайте ложкою або скляною паличкою. На смужку індикаторного паперу крап
…
ніть краплю отриманого розчину і зробіть висновок про pH розчину питної соди.pH=?У розчині питної соди…… середовище.
Помоги пожалуйста желательно с дано
при нагревании на воздухе двухвалентного металла массой 4.8 г образовался оксид массой 8.0 г определить металл
…
и написать формулу его оксида
В 40 г смеси оксидов бария и кремния добавили избыток воды масса воды которая отреагировала составляет 3,6г . Вычислите массовые част
Вычислите массовые част
…
ички оксидов в смеси
вычислите объём углекислого газа который необходим для преобразования 14г калия гидроксида на калий карбонат
Смешали 7% и 25% раствор одной и той же кислоты и получили 180 г 10% раствора. Вычислите массу исходного раствора с меньшей массовой долей кислоты. По
…
жалуйста, решите
b. Сульфат цинка образуется в результате реакции :А) ZnSO4 +KOH →Б) Zn + NaCl →В) ZnO + h3SO4 →Г) Zn + Na2SO4 →c. С какими из приведенных веществ може
…
т реагировать оксид серы (IV): HNO3, Cl2O7,h3O, NaOH, CO? Запишите уравнения реакций.1 Уравнение ___________________________________________________2 Уравнение____________________________________________________d. Запишите уравнение химической реакции нейтрализации между гидроксидом цинка исоляной кислотой ___________________________________________________5. Взаимосвязь между классами соединений называется генетической связью. Составьтеуравнения химических реакций, с помощью которых можно осуществить следующиепревращения:Al→ Al2O3 → AlCl3 → Al(OH)3 → Al2(SO4)3Помогите пожалуйстаЗаранее спасибо
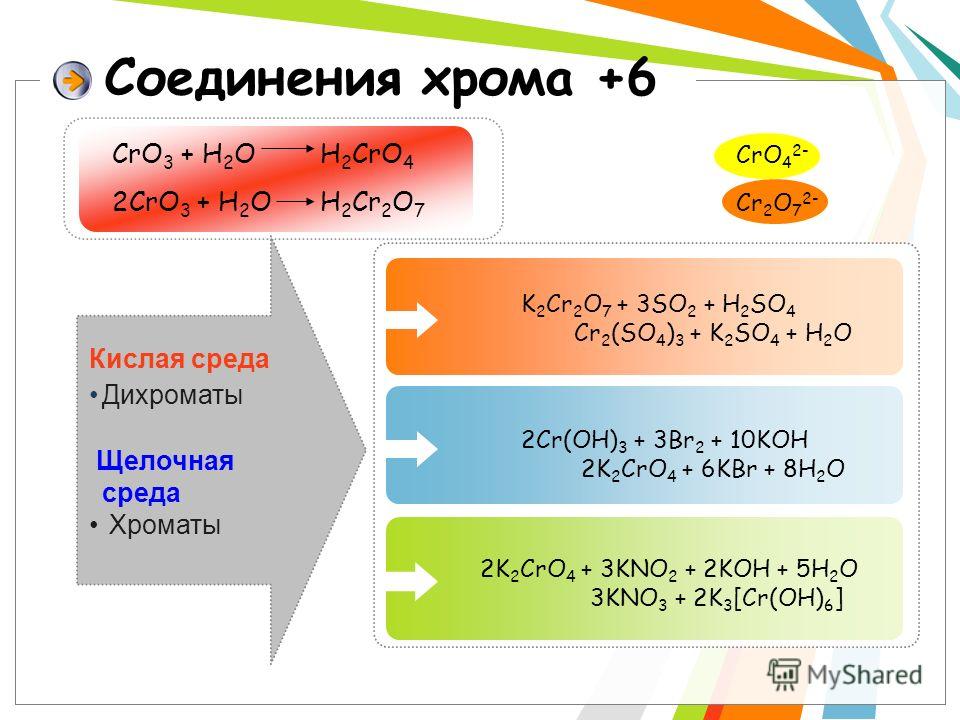
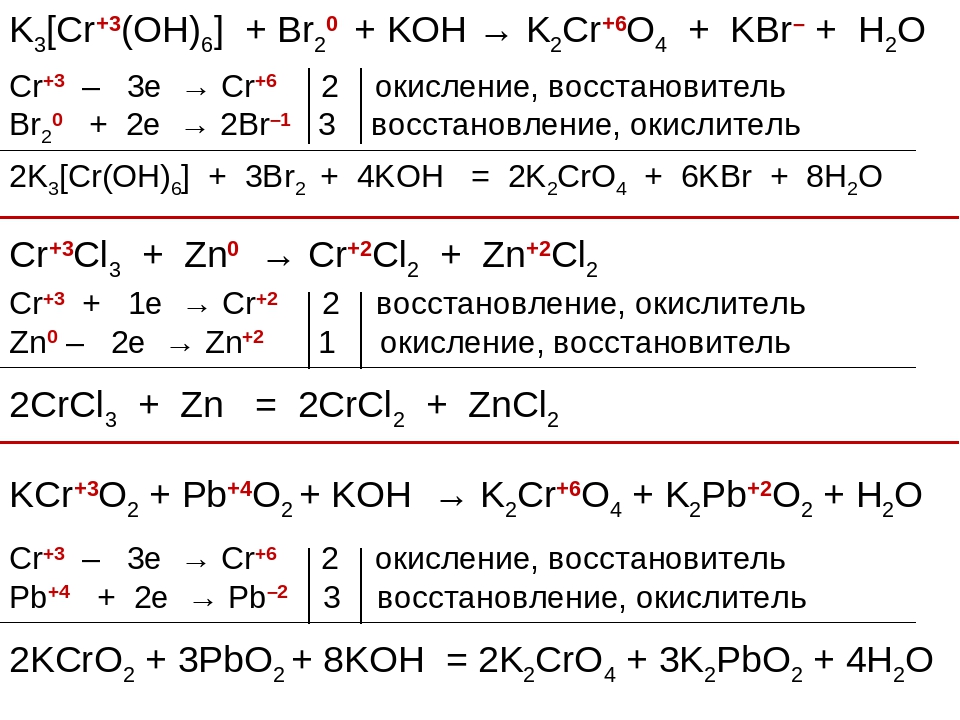
Гидроксид хрома (III) | CHEMEGE.
 RU
RU
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например, хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
CrCl3 + 3NH3 + 3H2O → Cr(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
K3[Cr(OH)6] + 3CO2 → Cr(OH)3↓ + 3KHCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например, хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
CrCl3 + 3KOH(недост) → Cr(OH)3↓ + 3KCl
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + CO2↑ + 6NaBr
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами. При этом образуются средние соли.
Например, гидроксид хрома (III) взаимодействует с соляной кислотой с образованием нитрата хрома (III):
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + 3HBr → CrBr3 + 3H2O
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот.
Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
2Cr(OH)3 + 3SO3 → Cr2(SO4)3 + 3H2O
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли. При этом гидроксид хрома (III) проявляет кислотные свойства.
Например, гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
4. Гидроксид хрома (III) разлагается при нагревании:
2Cr(OH)3 → Cr2O3 + 3H2O
5. Под действием окислителей в щелочной среде переходит в хромат.
Под действием окислителей в щелочной среде переходит в хромат.
Например, при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
2Cr(OH)3 + 3Br2 + 10KOH → 2K2CrO4 + 6KBr + 8H2O
| |||||
8.1: Уравновешивание окислительно-восстановительных реакций — Chemistry LibreTexts
Пример 2 — Базовое решение
Хромат-ион ( CrO 4 2- ) окисляет Fe (OH) 2 до Fe (OH) 3 . Ион CrO 4 2- восстанавливается до Cr (OH) 3 . Реакция протекает в растворе basic .
Как можно сбалансировать эту реакцию? В электронно-ионном методе мы выполняем серию из десяти шагов:
Шаг 1 : Запишите (несбалансированную) реакцию и определите элементы, которые подвергаются окислительно-восстановительному процессу.
- CrO 4 2- + Fe (OH) 2 → Cr (OH) 3 + Fe (OH) 3 (основной)
Шаг 2: Присвойте степени окисления каждому элементу с обеих сторон уравнения.
- CrO 4 2 — Cr = +6 O = -2
- Fe (OH) 2 Fe = +2 O = -2 H = +1
- Cr (OH) 3 Cr = +3 O = -2 H = +1
- Fe (OH) 3 Fe = +3 O = -2 H = +1
Этап 3 : Разделить реакцию на две полуреакции , уравновешивая окислительно-восстановительный элемент в каждой.
красный. Cr O 4 — → Cr (OH) 3 Хром восстанавливается
Cr O 4 — → Cr (OH) 3 Хром восстанавливается
вол. Fe (OH) 2 → Fe (OH) 3 Железо i с окисляется
Шаг 4 : Добавьте соответствующее количество электронов в каждую половину реакции. Электроны — это всегда реагентов в полуреакции восстановления и продукты в полуреакции окисления.
красный. CrO 4 2 — + 3 e — → Cr (OH) 3 Cr снижен с +6 до +3. Это добавляет 3 электрона.
вол. Fe (OH) 2 → Fe (OH) 3 + e — Fe окисляется от +2 до +3. Это удаляет 1 электрон.
Шаг 5 : Уравновесить заряд каждой полуреакции, добавив гидроксид-ионов, OH — . Поскольку эта реакция происходит в щелочном растворе, имеется достаточно ионов OH — для баланса заряда.
Поскольку эта реакция происходит в щелочном растворе, имеется достаточно ионов OH — для баланса заряда.
красный. CrO 4 2 — + 3 e — → Cr (OH) 3 + 5 OH — Обе части уравнения имеют суммарный заряд 5.
вол. Fe (OH) 2 + OH — → Fe (OH) 3 + e — Обе части уравнения имеют общий заряд 1-.
Этап 6 : Уравновесить атомы кислорода и водорода, добавив H 2 O к соответствующей стороне каждой полуреакции.
красный. CrO 4 2 — + 3 e — + 4 H 2 O → Cr (OH) 3 + 5 OH —
вол. Fe (OH) 2 + OH — → Fe (OH) 3 + e — Эта полуреакция уже сбалансирована.
Шаг 7 : Умножьте каждую половину реакции на соответствующий коэффициент, чтобы было равное количество электронов в качестве реагентов и продуктов.
красный. CrO 4 2 — + 3 e — + 4 H 2 O → Cr (OH) 3 + 5 OH —
вол. (Fe (OH) 2 + OH — → Fe (OH) 3 + e — ) x 3
Шаг 8: Объедините полуреакции в общее уравнение.
CrO 4 2- + 3 Fe (OH) 2 + 3 e — + 3 OH — + 4 H 2 O → Cr (OH) 3 + 3 Fe (OH ) 3 + 3 e — + 5 OH —
Шаг 9: Отменить O H — , электронов и H 2 O :
CrO 4 2- + 3 Fe (OH) 2 + 3 e — + 3 OH — + 4 H 2 O → Cr (OH) 3 + 3 Fe (OH) 3 + 3 e — + 5 OH —
Таким образом, общая сбалансированная реакция:
CrO 4 2- (водн. ) + 3 Fe (OH) 2 (с) + 4 H 2 O ( ℓ) → Cr (OH) 3 (с) + 3 Fe (OH) 3 (т.) + 2 OH — (водн.)
) + 3 Fe (OH) 2 (с) + 4 H 2 O ( ℓ) → Cr (OH) 3 (с) + 3 Fe (OH) 3 (т.) + 2 OH — (водн.)
Шаг 10: Проверьте свою работу, убедившись, что все элементов и зарядов сбалансированы.
Недавно приготовленный наногибрид Ni (OH) 2 @ Cr (OH) 3 для его биоэлектрокатализа
Ваняо Чжан получил степень бакалавра в 2011 году в Чжэцзинском педагогическом университете Цзиньхуа, провинция Чжэцзян, Китай, и в настоящее время работает над степенью магистра в области аналитической химии. в группе доктора Юцин Мяо. Его исследования сосредоточены на исследовательском биоэлектрокатализе наноматериалов на основе никеля в сторону малых молекул, таких как глюкоза, цистеин и т.д. пищевая инженерия в Dr.Группа Юцина Мяо. Его исследования сосредоточены на изучении комплексов висмута и их биологической оценке в отношении противоопухолевых, антипатогенных бактерий и т. Д.
Д.
Фенфен Ли получила степень магистра аналитической химии в начале 2013 года под руководством профессора Юкинг Мяо из Чжэцзянского педагогического университета, Китай. Ее исследовательские интересы связаны с электрокатализом и электроанализом на основе никеля.
Гуошэн Сун получил степень доктора философии в Университете Дунхуа, Шанхай, Китай, и в настоящее время работает в Шанхайском университете науки и технологий.Его исследования в основном связаны с разработкой новых неорганических наночастиц для доставки лекарств и фототермического преобразования.
Юн Шао получил степень доктора философии в области аналитической химии в Чанчуньском институте прикладной химии под руководством профессора Шаоцзюня Дуна в 2004 году. Затем он перешел на химический факультет Университета Луи Пастера во Франции в качестве постдокторского исследователя. В 2006 году он присоединился к группе профессора Терамаэ на химическом факультете Университета Тохоку в Японии в качестве научного сотрудника JSPS. С 2008 года он является профессором Института физической химии Чжэцзянского педагогического университета, его исследовательские интересы сосредоточены на разработке сенсоров на основе синтеза и приложений нуклеиновых кислот и функциональных материалов.
С 2008 года он является профессором Института физической химии Чжэцзянского педагогического университета, его исследовательские интересы сосредоточены на разработке сенсоров на основе синтеза и приложений нуклеиновых кислот и функциональных материалов.
Руичжоу Оуян в настоящее время является адъюнкт-профессором Шанхайского университета науки и технологий. Она получила степень доктора философии в области аналитической химии в Нанкинском университете, Нанкин, Китай, под руководством профессора Хуансянь Цзюй в 2008 году. После этого она поехала в Университет Теннесси, Ноксвилл, штат Теннесси, США, на трехлетнюю постдокторскую подготовку в качестве специалиста по исследованиям. постдокторант.В начале 2012 года она вернулась и устроилась на работу в нынешнем университете, занимаясь исследованиями и преподаванием, уделяя особое внимание исследованию и подготовке новых наноматериалов, включая наноразмерные гибридные металлы, полимеры с молекулярным отпечатком, металлоорганические каркасы и т. Д., Их применение в биологических исследованиях. , биоэлектрокатализ, биосенсинг, а также наноэлектрохимия.
Д., Их применение в биологических исследованиях. , биоэлектрокатализ, биосенсинг, а также наноэлектрохимия.
Лина Сю получила степень бакалавра в 2011 году в Университете Цзян Хань, Ухань, провинция Хубэй, Китай, и в настоящее время работает над получением степени магистра аналитической химии в рамках проф.Группа Юцина Мяо. Ее исследования в основном связаны с анализом тяжелых металлов в реальных образцах окружающей среды с использованием электрохимических сенсоров на основе биметаллических пленок.
Вэйвэй Ли получил степень бакалавра в 2012 году в Хэфэйском педагогическом университете, Китай, и в настоящее время работает над получением степени магистра аналитической химии в группе профессора Юцина Мяо. Ее исследования в основном касаются биоэлектрокатализа наноматериалов на основе никеля и их применения в реальных образцах сыворотки крови больных диабетом.
Юцин Мяо — профессор химии Шанхайского университета науки и технологий, Китай. Он получил степень магистра в Технологическом университете Наньян, Сингапур, и докторскую степень в Технологическом университете Ухань, Китай. Его исследовательские интересы лежат в области электроанализа и биосенсоров. Текущие исследования касаются самоадсорбции и ее наноструктур ультратонких ионов металлов (особенно Bi и Ni) с размером ниже нанометров; интерфейсный синтез и сборка наноструктур гидроксидов переходных металлов, их электрокаталитические и аналитические применения для биотиолов, фосфорорганических токсикантов, глюкозы и формальдегида.Исследование также сочетает в себе биомиметику и нанотехнологию для разработки тест-полосок или индикаторных полосок, наборов реагентов и электрохимических биосенсоров.
Он получил степень магистра в Технологическом университете Наньян, Сингапур, и докторскую степень в Технологическом университете Ухань, Китай. Его исследовательские интересы лежат в области электроанализа и биосенсоров. Текущие исследования касаются самоадсорбции и ее наноструктур ультратонких ионов металлов (особенно Bi и Ni) с размером ниже нанометров; интерфейсный синтез и сборка наноструктур гидроксидов переходных металлов, их электрокаталитические и аналитические применения для биотиолов, фосфорорганических токсикантов, глюкозы и формальдегида.Исследование также сочетает в себе биомиметику и нанотехнологию для разработки тест-полосок или индикаторных полосок, наборов реагентов и электрохимических биосенсоров.
Copyright © 2014 Elsevier B.V. Все права защищены.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.

Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
хром
хром
Хром, Cr 3+
Наиболее частая степень окисления: +3; +2 и +6 тоже существуют.
М.П. 1857 или
Б.P. 2672 o
Плотность 8,94 г / см 3
Характеристики: Серебристый, достаточно хрупкий металл. Подобен алюминию, но имеет несколько степеней окисления.
Характерные реакции Cr 3+ :
(Степень окисления +3 является наиболее стабильной.)
Аммиак водный:
Аммиак реагирует с ионом хрома (III) с осаждением серо-зеленого гидроксида хрома (III):
Cr 3+ (водн.) + 3NH 3 (водн.) + 3H 2 O (l) <==> Cr (OH) 3 (с) + 3NH 4 + (водн. )
)
Cr (OH) 3 лишь незначительно растворяется в избытке аммиака.При кипячении раствора гидроксид хрома (III) переосаждается.
Гидроксид натрия:
Сильные основания, такие как NaOH, также осаждают Cr (OH) 3 , но осадок растворяется в избытке гидроксида.
Cr 3+ (водн.) + 3OH — (водн.) <==> Cr (OH) 3 (s)
Cr (OH) 3 (s) + OH — (водный) <==> Cr (OH) 4 — (водный) (зеленый)
Перекись водорода:
В щелочном растворе перекись водорода окисляет Cr (III) до Cr (VI):
2Cr (OH) 4 — (водн.) + 3H 2 O 2 (водн.) + 2OH — (водн.) -> 2CrO 4 2- (водн.) + 8H 2 O (л)
Для подтверждения окисления добавление растворов Ba 2+ приводит к осаждению желтого хромат-иона CrO 4 2- в виде желтого хромата бария.
Нет реакции:
Класс — , SO 4 2-
Перейти в меню катионов
Пример балансировки окислительно-восстановительных уравнений в основании с использованием метода полуреакции
ПРИМЕР
Уравновешивание окислительно-восстановительных реакций с использованием метода полуреакции:
Уравновесите следующее уравнение окислительно-восстановительного потенциала, используя
метод полуреакции.
Шаг
# 1:
Cr (OH) 3 ->
CrO 4 2-ClO 3 —
-> Класс —
Шаг
# 2: (Не обязательно в этом примере)
Cr (OH) 3 ->
CrO 4 2-ClO 3 —
-> Класс —
Шаг
# 3:
Cr (OH) 3
+ H 2 O
-> CrO 4 2-ClO 3 —
-> Класс — + 3H 2 O
Шаг
# 4:
Cr (OH) 3
+ H 2 O
-> CrO 4 2- +
5H +ClO 3 —
+ 6H +
-> Класс — +
3H 2 O
Шаг
# 5:
Cr (OH) 3
+ H 2 O
-> CrO 4 2- +
5H + +
3e –ClO 3 —
+ 6H +
+ 6e —
-> Класс — +
3H 2 O
Шаг
# 6:
2 (Cr (OH) 3
+ H 2 O
-> CrO 4 2- +
5H + +
3e –)ClO 3 —
+ 6H +
+ 6e —
-> Класс — +
3H 2 Oили
2Cr (ОН) 3
+ 2H 2 O
-> 2CrO 4 2- +
10Н + +
6e –ClO 3 —
+ 6H +
+ 6e —
-> Класс — +
3H 2 O
Шаг
# 7:
2Cr (OH) 3 (т)
+ ClO 3 — (водн.)
->
2CrO 4 2- (водн.)
+ Cl — (водн.)
+ H 2 O (л)
+ 4H + (водн.)
Шаг
# 8: Потому что в правой части нашего уравнения есть 4 H + .
выше, мы добавляем 4 OH — к каждой стороне уравнения.
2Cr (ОН) 3
+ ClO 3 —
+ 4OH —
-> 2CrO 4 2- +
Класс — +
H 2 O + 4H +
+ 4OH —
Шаг
# 9: Объедините ионы 4 H + и ионы 4 OH — на
правая часть уравнения в форму 4 H 2 O.
2Cr (ОН) 3
+ ClO 3 —
+ 4OH —-> 2CrO 4 2- +
Класс — +
H 2 O + 4H 2 O
Шаг
# 10: Отменить
или объединить молекулы H 2 O.
2Cr (OH) 3 (т)
+ ClO 3 — (водн.)
+ 4OH — (водн.)
->
2CrO 4 2- (водн.) +
Cl — (водн.) +
5H 2 O (л)
Шаг
# 11: Атомы в нашем уравнении балансируют, и сумма зарядов в каждом
сторона -5.Наше уравнение сбалансировано правильно.
| |||||
Балансировка окислительно-восстановительной реакции
Балансировка окислительно-восстановительной реакции
Уравновесить следующую реакцию в среде basic .
Определите окислитель и
Восстановитель.
| Cr (OH) 3 (т) + ClO — (водн.) -> CrO 4 2- (водн.) + Cl — (водн.) |
|---|
Щелкните для сбалансированной реакции.
- Шаг 1
Определите степень окисления каждого вида в несбалансированной реакции.
Левая сторона Правая сторона Cr +3 +6 Класс +1 -1 Cr в Cr (OH) 3 окислен.Cl в ClO — снижается.
- Шаг 2
Напишите два отдельных уравнения, в одном используются только те вещества, которые участвуют
в восстановлении, а другой — с использованием только веществ, участвующих в окислении.
(В сбалансированном состоянии они называются уравнениями полуреакции.)Окисление: Cr (OH) 3 -> CrO 4 2- Восстановление: ClO — -> Класс — - Шаг 3
Сбалансируйте каждый вид атомов, кроме H и O, с помощью коэффициентов.
- В этих уравнениях они сбалансированы.
- Шаг 4
Уравновесить атомы кислорода с помощью H 2 O.
Окисление: Cr (OH) 3 + H 2 O -> CrO 4 2- Восстановление: ClO — -> ClO — -> ClO H 2 O - Шаг 5
Несмотря на то, что эта реакция происходит в основном растворе, уравновешивайте атомы H с помощью
с использованием ионов H + .На заключительном этапе мы введем ионы OH — .
Окисление: Cr (OH) 3 + H 2 O -> CrO 4 2- + 5 H + Восстановление: 0 81051 ClO9 2 H + -> Класс — + H 2 O - Шаг 6
Уравновешивайте заряд на каждой стороне реакции, добавляя электрона по мере необходимости.
Электроны появляются на правой части для полуреакции окисления.
Электроны появляются на левой части для полуреакции восстановления.Окисление: Cr (OH) 3 + H 2 O -> CrO 4 2- + 5 H + + 3 e — ClO — + 2 H + + 2 e — -> Cl — + H 2 O - Шаг 7
Умножьте полуреакции на простейший набор целых чисел так, чтобы
Получено электронов = потеряно электронов
Окисление: 2 [Cr (OH) 3 + H 2 O -> CrO 4 2- + 5 H + + 3 e — ] Редукция: 3 [ClO — + 2 H + + 2 e — -> Cl — + H 2 O] - Шаг 8
Объедините полуреакцию окисления с полуреакцией восстановления.
 Отмените электроны и равные количества любого вещества, которое появляется по обе стороны уравнения.
Отмените электроны и равные количества любого вещества, которое появляется по обе стороны уравнения.2 Cr (OH) 3 (т. + (водн.) + H 2 O (л) - Шаг 9
Добавьте достаточное количество ионов OH — (водн.) К по обе стороны реакции , чтобы нейтрализовали ионы H + (водн.).
Здесь мы добавляем по четыре иона OH — (водн.) С каждой стороны.
2 Cr (OH) 3 (т) + 3 ClO — (водн.) + 4 OH — (водн.) ->
2 CrO 4 2- (водн.) + 3 Класс — (водн.) + 4 H + (водн.) + 4 OH — (водн.) + H 2 O (л)Справа четыре H + объединяются с четырьмя ионами OH — , образуя четыре H 2 O.
2 Cr (OH) 3 (т) + 3 ClO — (водн.) + 4 OH — (водн.  ) ->
) ->
2 CrO 4 2- (водн.) + 3 Класс — (водн.) + 4 H 2 O (л) + H 2 O (л)Сбалансированная окислительно-восстановительная реакция:
2 Cr (OH) 3 (т.) + 3 ClO — (водн.) + 4 OH — (водн.) -> 2 CrO 4 2- (водн.) + 3 Cl — (водн.) + 5 H 2 O (л) ClO — — окислитель. Cr (OH) 3 — восстановитель. - Шаг 10
Убедитесь, что все атомы и заряды сбалансированы, и убедитесь, что все вещества имеют целочисленные коэффициенты в их простейших соотношениях.
Левая Правая Cr 2 2 Класс 3 3 O 13 13 заряд -7 -7 Левая сторона = Правая сторона
.

 (1 и равна 1/12 массы одного атома углерода-12)
(1 и равна 1/12 массы одного атома углерода-12) Начните с заглавной буквы в химическом символе и используйте нижний регистр для остальных букв: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
Начните с заглавной буквы в химическом символе и используйте нижний регистр для остальных букв: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.