{-}=2{Na}↖{0}+{Cl_2}↖{0}↑$
или
$2NaCl{→}↖{\text»электролиз»}2Na+Cl_2↑$
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Содержание
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). {+}$
{+}$
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
Суммарное уравнение:
$2H_2O+2Cl^{-}=H_2↑+Cl_2↑+2OH^{-}$.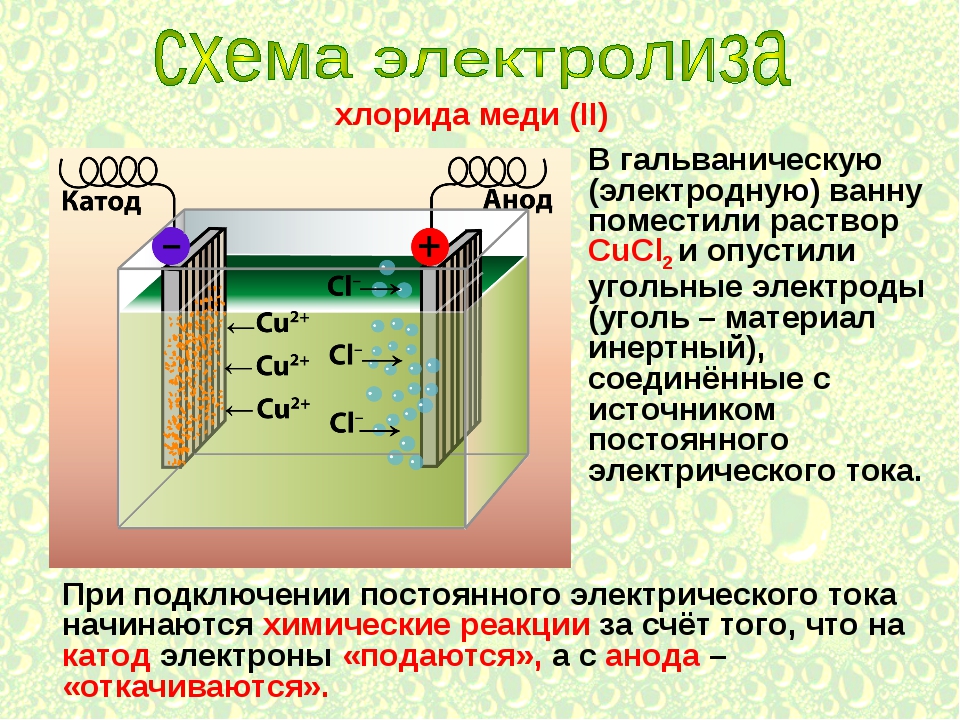 {-}+O_2↑+2H_2O$
{-}+O_2↑+2H_2O$
Суммарное молекулярное уравнение:
$2H_2O{→}↖{\text»электролиз»}2H_2↑+O_2↑$
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Электролиз солей
Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
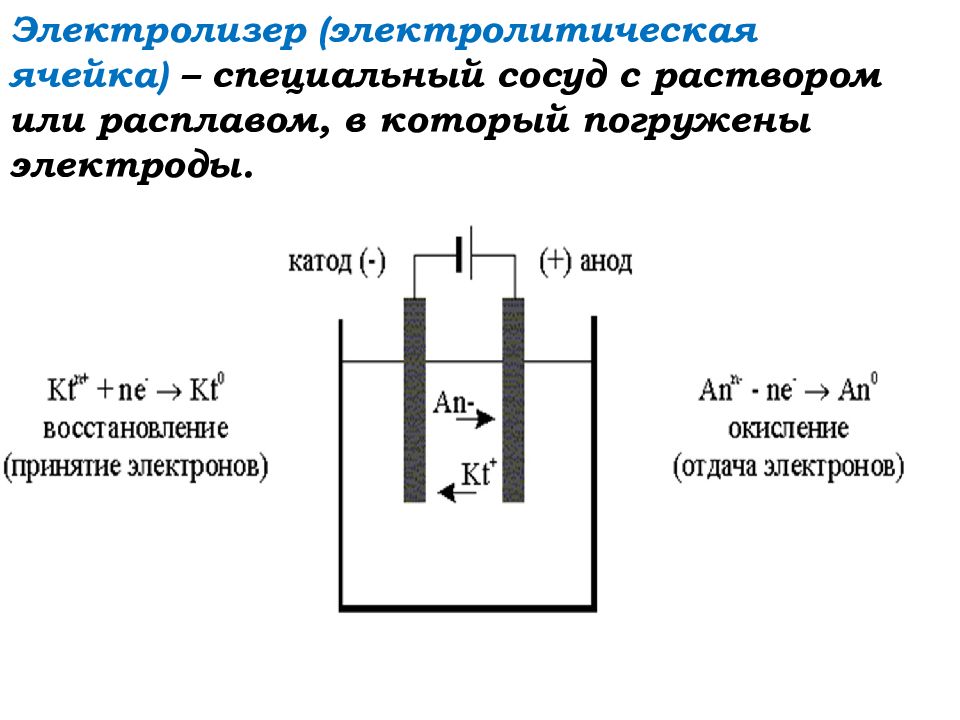
Электролизер
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав или водный раствор соли. Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
Электролиз расплава NaCl
При электролизе расплава NaCl на отрицательном электроде (катоде) происходит присоединение электронов ионом натрия Na+ и его восстановление. При этом вблизи электрода концентрация ионов Na+ уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na+.
Аналогично происходит миграция ионов Cl— к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl— -2e— → Cl20 |
| Катод | 2Na+ + 2e— → 2Na0 |
| 2Na+ + 2Cl— → 2Na0 + Cl20 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
электролизер Даунса
Сложнее протекает электролиз водных растворов электролитов.
Электролиз водного раствора NaCl
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl— -2e— → Cl20 |
| Катод | 2H2O + 2e— → H20 +2OH— |
| 2H2O + 2Cl— → H20 + Cl20 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu2+, Hg22+, Ag+, Hg2+, Pt2+ до Pt4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li+, Na+ … до Al3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn2+, Zn2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu2+, Ag+, Zn2+ сначала восстановится Ag+ (E = +0,79 В), затем Cu2+ (E = +0,337 В) и только потом Zn2+ (E = +0,76 В).
Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
- При электролизе бескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl— -2e— = Cl2
- При электролизе кислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e— = O2 + 4H+
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO32- + H2O -2e— = SO42- + 2H+
В таблице ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом | CuBr2 + H2O = Cu + Br2 + H2O K: Cu2+ + 2e— = Cu A: 2Br— -2e— = Br2 |
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом | K2SO4 + 2H2O = K2SO4 + 2H2 + O2 K: 2H2O +2e— = H2 + 2OH— A: 2H2O -4e— = O2 + 4H+ Т. |
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом | KI + H2O = 2KOH + H2 + I2 K: 2H2O +2e— = H2 + 2OH— A: 2I— -2e— = I2 |
| Водный раствор соли малоактивного металла с анодом из того же металла | CuSO4 K: Cu2+ + 2e— = Cu A: Cu — 2e— = Cu2+ |
Электролиз солей — количественные аспекты
Связь между количеством вещества, выделившегося при электролизе соли и количеством прошедшего через него электричества отражена в законах Фарадея.
1 закон Фарадея
Массы веществ (m), выделившихся на катоде или аноде (или образовавшиеся в катодном и анодном пространстве), пропорциональны количеству прошедшего через раствор или расплав электричества (Q):
m=kQ
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества.
2 закон Фарадея
Равные количества электричества в процессе электролиза выделяют эквивалентные количества различных веществ.
Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея.
m = ЭIt/F = ЭIt/96484,56, где
m – масса вещества,
Э – электрохимический эквивалент,
I – сила тока,
t – время электролиза.
Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом.
Задачи с решениями на составление уравнений электродных реакций, протекающих при электролизе, а также на применение законов Фарадея приведены в разделе Задачи к разделу Электролиз солей
Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий на электродах через расплав или раствор электролита.
Не путать с окислительно-восстановительными реакциями, где восстановителем или окислителем является то или иное вещество. В данном типе ОВ процессов восстановителем и окислителем являются электроды:
Катод – электрод , на котором происходит восстановление катионов (катод отдаёт электроны, катион принимает).
Анод – электрод , на котором происходит окисление анионов (анод принимает электроны, анион отдаёт электроны).
Анод бывает инертным (не влияет на протекание реакции), а бывает растворимый (переходит в среду реакции).
Как говорилось выше, электролиз может проходить как в растворах, так и в расплавах. Если в расплаве зачастую в электролизе участвует одно вещество, то в растворе их может быть несколько (если в воде растворяли несколько веществ), включая воду.
Разберём уравнения электролиза на примере NaCl (расплав, раствор):
Алгоритм:
1. Пишем уравнение электролитической диссоциации
2. Обозначаем, какие вещества будут участвовать в восстановлении или окислении на электродах.
3. Описываем процесс восстановления и окисления.
4. Пишем суммарное уравнение
Теперь разберём на примере NaCl:
1.NaCl(расплав)⇆Na++Cl—
2. ЗАПОМНИТЬ!!! К катоду притягиваются катионы, а к аноду притягиваются анионы.
В нашем случае в электролизе участвует всего одно вещество – расплав NaCl, поэтому конкуренции на электродах не будет.
3.Катод (-): Na++1e→Na
Анод (+): 2Cl—-2e→Cl2↑
4. NaCl(расплав) → Na+Cl2↑
Далее речь пойдёт о электролизе растворов. Чтобы говорить о нём, нужно знать электролиз воды:
2H2O→2H2↑+O2↑
Катод (-): 2H++2e→H2↑
Анод (+): 2O-2-4e→O2↑
Заметим, что если проходит электролиз раствора, то участвовать в процессах будет растворённое вещество ивода!!! В водных растворах имеется как минимум (!!!) два вещества – вода и растворённое вещество.
Чтобы понять , какой из металлов выиграет в конкуренции за восстановление на катоде, следует обратиться к электрохимическому ряду напряжений металлов.
|
|
|
|
|
|
|
|
|
|
|
|
Конкуренция существует и при окислении на аноде, рассмотрим в таблице.
|
|
|
|
|
|
Разберём на практике несколько примеров:
1. Пишем уравнение диссоциации хлорида цинка :ZnCl2⇌Zn2++2Cl—
Пишем уравнение диссоциации хлорида цинка :ZnCl2⇌Zn2++2Cl—
2. Катод (будут конкурировать ионы Zn2+
иH2O):
Zn2++2e→Zn↓
Анод (будут конкурировать ионы Cl—и H2O):
2Cl—-2e→Cl2↑
3. Суммарное уравнение:
ZnCl2+H2O→ Zn↓+Cl2↑
Из данного примера видим, что тут вода не участвовала в электролизе.
Ещё пример.
1. Раствор сульфата меди (II)
CuSO4⇌Cu2++SO42-
2. Катод (Ионы Cu2+выигрывают конкуренцию у H2O):
Cu2++2e→Cu↓
Анод (будут конкурировать ионыSO42-
и H2O):
2H2O+4e→O2↑+4H+
В растворе остались ещё H+ ионы, которые пойдут на образование молекулH2SO4.
3. Суммарное уравнение: 2CuSO4+2H2O→2Cu↓+O2↑+2H2
SO4
1.Раствор нитрата меди (II)
Cu(NO3
)2⇄Cu2++2NO3—
2. Катод (ионы Cu2+выигрывают конкуренцию у H2O)
Cu2++2e→Cu↓
Анод (H2Oвыигрывает конкуренцию у NO3—)
2H2O-4e→O2↑+4H+
3. Суммарное уравнение:
2Cu(NO3 )2+2H2O→2Cu↓+O2↑+4HNO3
1. Раствор хлорида калия
KCl⇄K++Cl—
2. Катод (H2Oвыигрывает конкуренцию у ионов K+)
2H2O+2e→H2↑+2OH—
Анод (ионы Cl—выигрывают конкуренцию у H2O)
2Cl—-2e→Cl2↑
3. Суммарное уравнение:
Суммарное уравнение:
Оставшиеся ионы K+и OH—образуют KOH
2KCl+2H2O→ H2↑+Cl2↑+2KOH
Решим несколько задач, где встречается электролиз:
1. При электролизе 1л раствора хлорида меди (II) на катоде выделилась медь массой 12,7г. Вычислите объем газа (н.у.), выделившегося на аноде, если плотность раствора близка к 1 г/мл
Ответ: 4,44 л.
2.При электролизе водного раствора нитрата серебра (I) на аноде выделилось 13,44л кислорода (н.у.). Определите массу выделившегося на катоде серебра, если выход серебра составил 90% от теоретически возможного, а выход кислорода — количественный.
Ответ: 233,3г.
3.При электролизе водного раствора хлорида цинка на катоде выделился цинк массой 68,25г, а на аноде — хлор объемом 28,22л (н.у.). Определите выход цинка, если выход хлора составил 90% от теоретически возможного.
Ответ: 75%.
Автор статьи: Симкин Егор Андреевич
Редактор: Харламова Галина Николаевна
Электролиз расплавов и растворов. Часть 1
Чтобы поделиться, нажимайте
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию). В середине страницы вы увидите текстовые условия заданий, а текстовые ответы представлены в конце страницы.
Задание 22
Установите соответствие между названием вещества и электролитическим способом получения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

НАЗВАНИЕ ВЕЩЕСТВА ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
А) кислород 1) водного раствора AgF
Б) сера 2) водного раствора K
2S
В) водород З) водного раствора HgBr
2
Г) калий 4) расплава KF
5) водного раствора CuCl
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) Na
2CO3 1) O2, H2, металл
Б) Cu(NO
3)2 2) Cl2, металл
В) AuCl
3 3) О2, металл
Г) BaCl
2 4) О2, H2
5) H
2, Cl2
6) H
2, металл
Запишите в таблицу выбранные цифры под соответствующими буквами.

Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) Na
3PO4 1) O2, H2
Б) KCl 2) Cu, O
2
В) CuBr
2 З) Cu, Br2
Г) Cu(NO
3)2 4) Cl2, H2
5) Cu, NO
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и возможным электролитическим способом получения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

НАЗВАНИЕ ВЕЩЕСТВА ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
А) кислород 1) раствора NaF
Б) фтор 2) расплава NaCl
В) натрий 3) расплава КF
Г) водород 4) раствора CuBr
2
5) раствора AuCl
3
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, которые выделяются на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) NaCl (р-р) 1) Na, Cl
2
Б) CuCl
2(p-p) 2) Cu, Cl2
В) NaCl (распл.
 ) 3) Cu, O2
) 3) Cu, O2
Г) Na
2SO4 (р-р) 4) H2, Cl2
5) H
2, O2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) K
2SO4 1) Cu, O2
Б) NaOH 2) O
2, Na
В) KBr 3) H
2, Br2
Г) CuSO
4 4) K, O2
5) K, Br
2
6) H
2, O2
Запишите в таблицу выбранные цифры под соответствующими буквами.

Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) Na
2SO4 1) Na, Cl2
Б) NaF 2) O
2, F2
В) NaCl 3) H
2, Cl2
Г) NaOH 4) H
2, O2
5) H
2, F2
6) Na, O
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) Mg(NO
3)2 1) металл, кислород
Б) Na
2SO4 2) металл, галоген
В) AgNO
3 З) металл, водород
Г) CuBr
2 4) водород, кислород
5) водород, галоген
б) кислород, галоген
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и электролитическим способом получения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
А) кислород 1) водного раствора AgF
Б) бром 2) водного раствора КВr
В) водород З) водного раствора HgCl
2
Г) калий 4) расплава KF
5)водного раствора CuCl
2
Запишите в таблицу выбранные цифры под соответствующими буквами.

Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) K
3PO4 1) O2, H2
Б) NaCl 2) Cu, O
2
В) CuBr
2 З) Cu, Br2
Г) Cu(NO
3)2 4) Cl2, H2
5) Cu, NO
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) Mg(NO
3)2 1) O2
Б) Ba(ClO
3)2 2) N2
В) NaCl 3) Cl
2
Г) CuSO
4 4) NO2
5) S
6) H
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, который образуется на инертном аноде в результате электролиза её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ
А) Na
2SO4 1) SO2
Б) Ca(NO
3)2 2) O2
В) ZnBr
2 3) NO2
Г) CuCl
2 4) Br2
5) Cl
2
6) H
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ ЭЛЕКТРОЛИЗА НА КАТОДЕ
А) CrCl
3 1) водород
Б) Cu(NO
3)2 2) металл
В) K
3PO4 3) металл и водород
Г) NaCl 4) кислород
5) хлор
6) азот
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и уравнением процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА
А) KCl 1) 2H
2O − 4ē → O2 + 4H+
Б) AlBr
3 2) 2H2O + 2ē → H2 + 2OH−
В) CuSO
4 3) 2Cl− − 2ē → Cl20
Г) AgNO
3 4) 2Br− − 2ē → Br20
5) 2SO
42− − 2ē → S2O82−
6) 2NO
3− − 2ē → 2NO2 + O2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) AlBr
3 1) Сl2
Б) Rb
2SO4 2) O2
В) Hg(NO
3)2 3) H2
Г) AuCl
3 4) Br2
5) SO
2
6) NO
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ
А) AgNO
3 1) водород
Б) K
2SO4 2) кислород
В) Mg(NO
3)2 3) серебро
Г) CuSO
4 4) калий
5) магний
6) медь
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) Rb
3PO4 1) O2, H2
Б) CsCl 2) Cu, O
2
В) CuBr
2 З) Cu, Br2
Г) Cu(NO
3)2 4) Cl2, H2
5) Cu, NO
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ
А) NaCl 1) калий
Б) AgNO
3 2) медь
В) KBr 3) хлор
Г) CuCl
2 4) водород
5) серебро
6) бром
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, который образуется на инертном аноде в результате электролиза её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) Na
2SO4 1) SO2
Б) Ca(NO
3)2 2) O2
В) ZnBr
2 3) NO2
Г) CuCl
2 4) Br2
5) Cl
2
6) H
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ
А) Na
2SO4 1) Ca
Б) Ca(NO
3)2 2) Na
В) ZnSO
4 3) H2
Г) CuCl
2 4) Zn, H2
5) Cu
6) CuO
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции,обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) AlBr
3 1) Cl2
Б) Rb
2SO4 2) O2
В) Hg(NO
3)2 3) H2
Г) AuCl
3 4) Br2
5) SO
2
6) NO
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза, которые выделяются на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) NaCl (р-р) 1) Na, Cl
2
Б) CuCl
2 (р-р) 2) Cu, Cl2
В) NaCl (распл.) 3) Cu, O
2
Г) Na
2SO4 (р-р) 4) H2, Cl2
5) Na, O
2
6) H
2, O2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) Al
2(SO4)3 1) Br2
Б) CsCl 2) O
2
В) Hg(NO
3)2 3) H2
Г) AuBr
3 4) Cl2
5) SO
2
6) NO
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) CaBr
2 1) NO2
Б) K
2SO4 2) Br2
В) Ca(NO
3)2 3) Cl2
Г) CuCl
2 4) O2
5) SO
2
6) H
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) Fe
2(SO4)3 1) SO2
Б) CuBr
2 2) O2
В) KI 3) H
2
Г) Ca(NO
3)2 4) Br2
5) I
2
6) NO
2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ
А) CuSO
4 1) водород
Б) K
2SO4 2) серебро
В) AgNO
3 3) медь
Г) CuBr
2 4) гидроксид калия
5) кислород
6) оксид серы (IV)
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ
А) Na
2SO4 1) Ca
Б) Ca(NO
3)2 2) Na
В) HgCl
2 3) H2
Г) CuCl
2 4) Hg
5) Cu
6) CuO
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые образуются на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) Na
2CO3 1) этан, углекислый газ, водород
Б) NaCl 2) натрий, кислород
В) CH
3COONa 3) метан, углекислый газ, водород
Г) NaOH 4) хлор, водород
5) водород, кислород
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) CuBr
2 1) H2, O2
Б) NaF 2) Na, F
2
В) KNO
3 3) H2, F2
Г) K
2S 4) K, S
5) Cu, Br
2
6) H
2, S
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) AuCl
3 1) H2, Cl2
Б) BaCl
2 2) H2, O2
В)K
2SO4 3) Au, Cl2
Г) Zn(NO
3)2 4) Ba, Cl2
5) Zn, O
2
6) Zn, H
2, O2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответы:
- 1224
- 4325
- 1432
- 1321
- 4215
- 6631
- 4434
- 4412
- 1224
- 1432
- 1131
- 2245
- 3211
- 3411
- 4221
- 3116
- 1432
- 4542
- 2245
- 3345
- 4221
- 4216
- 2421
- 2443
- 2452
- 3123
- 3345
- 5415
- 5116
- 3126
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Электролиз растворов
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Электролиз – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Электролизом называют химические реакции, которые протекают под действием электрического тока на электродах в растворах и расплавах электролитов.
Катодом называют отрицательно заряженный электрод. На его поверхности ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления катионов.
Анодом называют положительно заряженный электрод. На его поверхности происходит отдача электронов, т. е. реакция окисления.
Для установления продуктов электролиза водных растворов солей используют так называемый электрохимический ряд напряжений металлов, а также ряд восстановительной активности анионов.
Электрохимический ряд напряжений металлов:
Ряд восстановительной активности анионов:
Рассмотрим несколько примеров реакций электролиза, протекающих на инертных, т.е. не вступающих в какие-либо химические реакции, электродах.
Прогнозировать происходящие при электролизе водных растворов процессы можно с помощью ряда напряжений металлов и некоторых экспериментально обоснованных закономерностей.
Для катодных процессов существуют следующие закономерности:
1. Катионы металлов, стандартные электродные потенциалы которых выше, чем у водорода, т.е. расположенные в этом ряду правее его (Cu, Hg, Ag, Pt, Au), при электролизе полностью восстанавливаются на катоде в виде металла: Men+ + nе– → Me0.
2. Катионы металлов с малой величиной стандартного электродного потенциала (Li+, Na+, K+, Rb+, …, до Al3+ включительно) при электролизе на катоде не восстанавливаются, а вместо них восстанавливаются молекулы воды: 2H2O + 2e– → Н2 + 2ОН–.
3. Катионы металлов со стандартными электродными потенциалами меньше, чем у водорода, но больше, чем у алюминия (Mn2+, Zn2+, Cr3+, Fe2+, …, до H), при электролизе восстанавливаются на катоде одновременно с молекулами воды, т.е. одновременно идут два процесса:
При электролизе водных растворов кислот и щелочей на катоде всегда выделяется водород.
Для анодных процессов:
1. При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, в которых атомы неметаллов или металлов находятся в высшей степени окисления (NO3–, SO42–, PO43–, ClO4–, MnO4– и т.п.), а также фторид-ионов F– на аноде будут окисляться не анионы, а гидроксид-ионы и молекулы воды и выделяться кислород:
2. При электролизе хлоридов, бромидов, йодидов у анода будут разряжаться анионы и выделяться соответствующие галогены:
3. При электролизе анионов, содержащих неметалл в промежуточной степени окисления (SO32–, NO2– и др.), они сами окисляются на аноде:
Усвоение учебного материала по данной теме на ЕГЭ проводят с помощью заданий повышенного уровня сложности.
Пример 1. Установите соответствие между формулой вещества и продуктами, которые могут образовываться на катоде в результате электролиза его водного раствора.
Нитрат меди (II). Медь в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе она выделится на катоде в виде металла: Cu2+ + 2е– → Cu0. На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e– → О2 + 4Н+. Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Нитрат серебра. Серебро в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе оно выделится на катоде в виде металла: Ag+ + 1е– → Ag0. На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e– → О2 + 4Н+. Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Хлорид железа (II), FeCl2. Железо в ряду напряжений стоит после алюминия и до водорода. При электролизе на катоде восстанавливаются и металл, и молекулы воды, т. е. одновременно идут два процесса: Fe2+ + 2е– → Fe0; 2H2O + 2e– → Н2 + 2ОН–. На аноде будет выделяться хлор: 2Cl– – 2e– → Cl20.
Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Сульфат калия. Катион калия в ряду напряжений металлов стоит до алюминия. Поэтому катион калия при электролизе на катоде не восстанавливается, а вместо него восстанавливаются молекулы воды: 2H2O + 2e– → Н2 + 2ОН–. На аноде будут окисляться молекулы воды: 2H2O – 4e– → О2 + 4Н+.
Уравниваем процессы окисления и восстановления:
После сокращения получаем:
Ответ: А – 1; Б – 5; В – 6; Г – 2.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
| 1. Щёлочь – один из продуктов электролиза в водном растворе: | |
| 2. При электролизе водного раствора нитрата калия на аноде выделяется: | |
| 3. Водород образуется при электролизе водного раствора: | |
| 4. Реакция возможна между: | |
| а) Ag и K2SO4 (р-р) | |
| 5. При электролизе раствора иодида натрия у катода окраска лакмуса в растворе: | |
| 6. При электролизе водного раствора фторида калия на катоде выделяется: | |
| б) фтороводород | |
| 7. Электролиз 400 г 20 %-ого раствора поваренной соли был остановлен, когда на катоде выделилось 11,2 л (н.у.) газа. Степень разложения исходной соли (в %) составляет: | |
| 8. Провели электролиз 200 г 10 %-ого раствора сульфата хрома (III) до полного расходования соли (на катоде выделяется металл). Масса (в граммах) израсходованной воды составляет: | |
| 9. При электролизе расплава NaCl на катоде выделяется: | |
| г) нет верного ответа | |
| 10. При электролизе расплава CaCl2 на аноде выделяется: | |
| в) как Ca, так и Cl2 | г) нет верного ответа |
17.7 Электролиз — химия
Цели обучения
К концу этого раздела вы сможете:
- Описать электролитические ячейки и их связь с гальваническими элементами
- Выполнение различных расчетов, связанных с электролизом
В гальванических элементах химическая энергия преобразуется в электрическую. Обратное верно для электролитических ячеек. В электролитических ячейках электрическая энергия вызывает возникновение неспонтанных реакций в процессе, известном как электролиз .Зарядный электромобиль, изображенный в главе 18 «Введение» в начале этой главы, демонстрирует один из таких процессов. Электрическая энергия преобразуется в химическую энергию в аккумуляторе по мере его зарядки. После зарядки аккумулятор можно использовать для питания автомобиля.
В электролитических элементах используются те же принципы, что и в гальванических элементах. Мы рассмотрим три электролитических ячейки и количественные аспекты электролиза.
В расплавленном хлориде натрия ионы могут свободно перемещаться к электродам электролитической ячейки.{\ circ} = -4.0 \; \ text {V} \ end {array} [/ latex]
Источник питания (аккумулятор) должен обеспечивать минимум 4 В, но на практике применяемые напряжения обычно выше из-за неэффективности самого процесса.
Рисунок 1. При пропускании электрического тока через расплавленный хлорид натрия материал разлагается на металлический натрий и газообразный хлор. Необходимо следить за тем, чтобы продукты были разделены, чтобы предотвратить самопроизвольное образование хлорида натрия.
Электролизом можно разделить воду на водород и кислород.{\ circ} = -1,229 \; \ text {V} \ end {array} [/ latex]
Обратите внимание на то, что серная кислота не расходуется и объем произведенного газообразного водорода в два раза превышает объем произведенного газообразного кислорода. Минимальное подаваемое напряжение 1,229 В.
Рисунок 2. Вода разлагается на кислород и водород во время электролиза. Серная кислота была добавлена для увеличения концентрации ионов водорода и общего количества ионов в растворе, но не принимает участия в реакции. Объем собранного газообразного водорода в два раза больше объема собранного газообразного кислорода из-за стехиометрии реакции.{\ circ} = +1.229 \; \ text {V} \ end {array} [/ latex]
Эти значения предполагают, что вода должна окисляться на аноде, потому что потребуется меньший потенциал — использование реакции (ii) для окисления даст менее отрицательный потенциал ячейки. Когда эксперимент проводится, выясняется, что на аноде образуется хлор, а не кислород. Неожиданный процесс настолько распространен в электрохимии, что получил название перенапряжения. Перенапряжение — это разница между теоретическим напряжением ячейки и фактическим напряжением, необходимым для электролиза.{\ circ} = -2,71 \; \ text {V} \ end {array} [/ latex]
Реакция (v) исключена, потому что она имеет такой отрицательный восстановительный потенциал. В стандартных условиях реакция (iii) была бы предпочтительнее реакции (iv). Однако pH раствора хлорида натрия равен 7, поэтому концентрация ионов водорода составляет всего 1 × 10 -7 M . При таких низких концентрациях реакция (iii) маловероятна и происходит реакция (iv). {\ circ} = -2.186 \; \ text {V} [/ латекс]
По мере протекания реакции ионы гидроксида заменяют ионы хлорида в растворе. Таким образом, гидроксид натрия можно получить путем испарения воды после завершения электролиза. Гидроксид натрия ценен сам по себе и используется для таких вещей, как средство для чистки духовок, открывалка для слива, а также при производстве бумаги, тканей и мыла.
Гальваника
Важным применением электролитических ячеек является гальваника . Гальваника приводит к тонкому покрытию одного металла поверх проводящей поверхности.Причины нанесения гальванического покрытия включают повышение устойчивости объекта к коррозии, укрепление поверхности, получение более привлекательной отделки или очистку металла. Металлы, обычно используемые в гальванике, включают кадмий, хром, медь, золото, никель, серебро и олово. Обычные потребительские товары включают посеребренную или позолоченную посуду, хромированные автомобильные детали и ювелирные изделия. Мы можем получить представление о том, как это работает, исследуя, как производится посеребренная посуда (рис. 3).
Рисунок 3. Ложка, сделанная из недорогого металла, подключается к отрицательной клемме источника напряжения и действует как катод. Анод — серебряный электрод. Оба электрода погружены в раствор нитрата серебра. Когда через раствор пропускают постоянный ток, в конечном итоге металлическое серебро удаляется с анода и осаждается на катоде.
На рисунке анод состоит из серебряного электрода, показанного слева. Катод расположен справа и представляет собой ложку, которая изготовлена из недорогого металла.{-} \; {\ longrightarrow} \; \ text {Ag} (s) [/ latex]
Конечный результат — перенос металлического серебра с анода на катод. Качество объекта обычно определяется толщиной наплавленного серебра и скоростью наплавки.
Величина тока, который может протекать в электролитической ячейке, зависит от количества молей электронов. Количество молей электронов может быть связано с реагентами и продуктами с использованием стехиометрии. Напомним, что единицей СИ для тока ( I ) является ампер (А), что эквивалентно 1 кулону в секунду (1 А = 1 [латекс] \ frac {\ text {C}} {\ text {s }}[/латекс]).Общий заряд ( Q , в кулонах) равен
.
[латекс] Q = I \; \ times \; t = n \; \ times \; F [/ латекс]
Где t — время в секундах, n — количество молей электронов, а F — постоянная Фарадея.
Моли электронов могут быть использованы в задачах стехиометрии. Также может быть запрошено время, необходимое для внесения определенного количества металла, как во втором из следующих примеров.
Пример 1
Преобразование тока в моль электронов
В одном процессе, используемом для гальваники серебра, ток равен 10.23 А пропускали через электролитическую ячейку ровно за 1 час. Сколько молей электронов прошло через ячейку? Какая масса серебра была нанесена на катод из раствора нитрата серебра?
Раствор
Константу Фарадея можно использовать для преобразования заряда ( Q ) в моли электронов ( n ). { -}} = 0.{-}} \; \ times \; \ frac {107.9 \; \ text {g \; Ag}} {1 \; \ text {mol \; Ag}} = 41.19 \; \ text {g \; Ag} [/ латекс]
Проверьте свой ответ: исходя из стехиометрии, из 1 моля электронов получается 1 моль серебра. Было задействовано менее половины моля электронов и было произведено менее половины моля серебра.
Проверьте свои знания
Металлический алюминий можно получить из ионов алюминия электролизом. Какая будет половинная реакция на катоде? Какая масса металлического алюминия будет восстановлена, если ток 2?{-} \; {\ longrightarrow} \; \ text {Al} (s) [/ latex]; 7,77 моль Al = 210,0 г Al.
Пример 2
Время, необходимое для осаждения
В одном случае слой хрома толщиной 0,010 мм должен быть нанесен на деталь с общей площадью поверхности 3,3 м. 2 из раствора, содержащего ионы хрома (III). Сколько времени нужно, чтобы нанести слой хрома, если ток равен 33,46 А? Плотность хрома (металла) 7,19 г / см 3 .
Решение
Эта проблема связана с рядом рассмотренных ранее тем.Схема того, что необходимо сделать:
- Если можно определить общий заряд, необходимое время — это просто заряд, деленный на текущий
- Общий заряд может быть получен из необходимого количества Cr и стехиометрии
- Количество Cr может быть получено исходя из плотности и необходимого объема Cr
- Требуемый объем Cr равен толщине, умноженной на площадь
.
Постепенное решение и забота о единицах, требуемый объем Cr составляет
[латекс] \ text {volume} = (0.4 \; \ text {s} = 11.0 \; \ text {hr} [/ latex]
Проверьте свой ответ: В такой длинной задаче одной проверки, вероятно, недостаточно. Каждый из шагов дает разумное число, так что все, вероятно, правильно. Обратите особое внимание на преобразование единиц измерения и стехиометрию.
Проверьте свои знания
Какая масса цинка требуется для гальванизации верхней части листа железа размером 3,00 м × 5,50 м до толщины 0,100 мм цинка? Если цинк поступает из раствора Zn (NO 3 ) 2 и ток равен 25.5 А сколько времени займет гальванизация верха утюга? Плотность цинка 7,140 г / см 3 .
Ответ:
231 г Zn требуется 446 минут.
Электролиз — использование электричества для инициирования непредвиденного процесса. Электролитические ячейки — это электрохимические ячейки с отрицательными потенциалами ячейки (что означает положительную свободную энергию Гиббса), и поэтому они не являются спонтанными. Электролиз может происходить в электролитических ячейках путем включения источника питания, который подает энергию, заставляющую электроны течь в неспонтанном направлении.Электролиз проводится в растворах, которые содержат достаточно ионов для протекания тока. Если раствор содержит только один материал, например, при электролизе расплавленного хлорида натрия, легко определить, что окисляется, а что восстанавливается. В более сложных системах, таких как электролиз водного хлорида натрия, более одного вида могут быть окислены или восстановлены, и стандартные восстановительные потенциалы используются для определения наиболее вероятного окисления (полуреакция с наибольшим [наиболее положительным] стандартным восстановительным потенциалом ) и восстановления (полуреакция с наименьшим [наименее положительным] стандартным восстановительным потенциалом).Иногда из-за перенапряжения возникают неожиданные полуреакции. Перенапряжение — это разница между теоретическим потенциалом восстановления полуреакции и фактическим требуемым напряжением. Если он присутствует, приложенный потенциал должен быть увеличен, чтобы в электролитической ячейке могла произойти другая реакция. Полный заряд Q , который проходит через электролитическую ячейку, может быть выражен как ток ( I ), умноженный на время ( Q = It ), или как моль электронов ( n ), умноженная на постоянную Фарадея. ( Q = нФ).Эти отношения могут использоваться для определения таких вещей, как количество материала, используемого или образованного во время электролиза, как долго должна продолжаться реакция или какое значение тока требуется.
Химия: упражнения в конце главы
- Укажите реакцию на аноде, реакцию на катоде, общую реакцию и приблизительный потенциал, необходимый для электролиза следующих расплавов солей. Предположим, что стандартные состояния и стандартные восстановительные потенциалы в Приложении L такие же, как и при каждой из точек плавления.Предположим, что КПД равен 100%.
(а) CaCl 2
(б) LiH
(в) AlCl 3
(г) CrBr 3
- Какая масса каждого продукта производится в каждой из электролитических ячеек предыдущей задачи, если через каждую ячейку проходит общий заряд 3,33 × 10 5 Кл? Предположим, что напряжения достаточно для уменьшения.
- Сколько времени нужно, чтобы восстановить 1 моль каждого из следующих ионов с помощью указанного тока? Предположим, что напряжения достаточно для уменьшения.
(а) Al 3+ , 1,234 A
(б) Ca 2+ , 22,2 A
(в) Cr 5+ , 37,45 A
(г) Au 3+ , 3,57 А
- Ток в 2,345 А проходит через элемент, показанный на рисунке 2, в течение 45 минут. Какой объем водорода собирается при комнатной температуре, если давление составляет ровно 1 атм? Предположим, что напряжения достаточно для уменьшения. (Подсказка: водород — единственный газ, присутствующий над водой?)
- Металлическая деталь неправильной формы, изготовленная из определенного сплава, была оцинкована цинком с использованием раствора Zn (NO 3 ) 2 .При использовании силы тока 2,599 А для нанесения на деталь слоя цинка толщиной 0,01123 мм требовалось ровно 1 час. Какова была общая площадь поверхности детали? Плотность цинка 7,140 г / см 3 . Предположим, что КПД равен 100%.
Глоссарий
- электролиз
- Процесс, использующий электрическую энергию для возникновения несамопроизвольного процесса
- электролизер
- ячейка электрохимическая, в которой используется электролиз; электрохимическая ячейка с отрицательным потенциалом ячейки
- гальваника
- нанесение тонкого слоя одного металла поверх проводящей поверхности
- перенапряжение
- разность между теоретическим потенциалом и фактическим потенциалом в электролитической ячейке; «дополнительное» напряжение, необходимое для того, чтобы произошла некоторая несамопроизвольная электрохимическая реакция
Решения
Ответы на упражнения в конце главы по химии
2.(a) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Ca} & 69.1 \; \ text {g} \\ [0.5em] \ text {mass \; Cl} _2 & 122 \; \ text {g} \ end {array} [/ latex]; (б) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Li} & 23.9 \; \ text {g} \\ [0.5em] \ text {mass \; H} _2 & 3.48 \; \ text {g} \ end {array} [/ latex]; (c) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Al} & 31.0 \; \ text {g} \\ [0.5em] \ text {mass \; Cl} _2 & 122 \; \ text {g} \ end {array} [/ latex]; (d) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Cr} & 59.8 \; \ text {g} \\ [0.5em] \ text {mass \; Br} _2 & 276 \; \ text {g} \ end {array} [/ latex]
4. 0,79 л
Электролитические ячейки — Chemistry LibreTexts
Вольтаические элементы управляются спонтанной химической реакцией , в результате которой через внешнюю цепь образуется электрический ток. Эти элементы важны, потому что они являются основой для батарей, питающих современное общество. Но это не единственный вид электрохимической ячейки. В каждом случае обратная реакция не является спонтанной и требует для возникновения электрической энергии.
Введение
Общий вид реакции можно записать как:
\ [\ underset {\ longleftarrow \ text {Non spontaneous}} {\ overset {\ text {Spontaneous} \ longrightarrow} {\ text {Reactants} \ rightleftharpoons \ text {Products} + \ text {Электрическая энергия}}} \ ]
Можно построить ячейку, которая работает с химической системой, пропуская через систему электрический ток. Эти ячейки называются электролитическими ячейками . Электролитические элементы, как и гальванические элементы, состоят из двух полуэлементов: один является полуэлементом восстановления, а другой — полуэлементом окисления.Однако направление потока электронов в электролитических ячейках может быть изменено на противоположное по сравнению с направлением спонтанного потока электронов в гальванических ячейках, но определение катода и анода остается прежним, где восстановление происходит на катоде, а окисление происходит на аноде. . Поскольку направления обеих полуреакций поменялись местами, изменился знак, но не величина потенциала клетки.
Электролитические ячейки очень похожи на гальванические (гальванические) ячейки в том смысле, что оба требуют солевого моста, оба имеют катодную и анодную стороны, и оба имеют постоянный поток электронов от анода к катоду.Однако между двумя ячейками есть и разительные различия. Основные отличия указаны ниже:
Рисунок \ (\ PageIndex {1} \): Электрохимические ячейки. Гальванический элемент (слева) преобразует энергию, выделяемую в результате спонтанной окислительно-восстановительной реакции, в электрическую энергию, которую можно использовать для выполнения работы. Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, которые соединены внешней электрической цепью; Кроме того, второе соединение, которое позволяет ионам перемещаться между отсеками (показано здесь вертикальной пунктирной линией, обозначающей пористый барьер), необходимо для поддержания электрической нейтральности.Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электроэнергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.
| Электрохимический элемент (гальванический элемент) | Электролитическая ячейка |
|---|---|
| Гальванический элемент преобразует химическую энергию в электрическую. | Электролитическая ячейка преобразует электрическую энергию в химическую. |
| Здесь окислительно-восстановительная реакция является спонтанной и отвечает за производство электроэнергии. | Окислительно-восстановительная реакция не является спонтанной, и для ее инициирования необходимо подавать электрическую энергию. |
| Две полуячейки размещены в разных контейнерах и соединены соляным мостиком или пористой перегородкой. | Оба электрода помещены в одну емкость в растворе расплавленного электролита. |
| Здесь анод отрицательный, а катод положительный.Реакция на аноде является окислительной, а на катоде — восстановительной. | Здесь анод положительный, а катод отрицательный. Реакция на аноде является окислительной, а на катоде — восстановительной. |
| Электроны поставляются окисляющимися частицами. Они перемещаются от анода к катоду во внешней цепи. | Внешняя батарея питает электроны. Они входят через катод и выходят через анод. |
Ячейки электролитические
Чтобы объяснить, что происходит в электролитической ячейке, давайте рассмотрим разложение расплавленного хлорида натрия на металлический натрий и газообразный хлор. Реакция написана ниже.
———> Несамопроизвольно (электролитическая ячейка) | ||||
2 Na Cl (л) | 2 Na (с) | + | Класс 2 (г) | |
<--------- Самопроизвольное (электрохимическая ячейка) | ||||
Если расплавленный \ (NaCl _ {(l)} \) помещается в контейнер и вставляются инертные электроды \ (C _ {(s)} \), прикрепленные к положительной и отрицательной клеммам батареи, произойдет электролитическая реакция.- \]
Прогнозирование реакции электролиза
Существует четыре основных фактора, которые определяют, будет ли проводиться электролиз, даже если внешнее напряжение превышает расчетную величину:
- Перенапряжение или превышение напряжения иногда необходимо для преодоления взаимодействий на поверхности электрода.Чаще это случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, в то время как Pt (s) требует перенапряжения 0 В
- Может иметь место более одной электродной реакции, что означает, что может быть более одной полуреакции, оставляя две или более возможностей для реакции ячейки.
- Реагенты могут находиться в нестандартных условиях, что означает, что напряжение для полуэлементов может быть меньше или больше, чем количество в стандартных условиях.Например:
- Концентрация хлорид-иона = 5,5M, а не единица активности 1M. Это означает, что уменьшение хлорида = 1,31 В, а не 1,36 В
- Стандартное условие — иметь pH 4 в анодной полуячейке, но иногда в нестандартных состояниях pH может быть выше или ниже при изменении напряжения.
- Способность инертного электрода к электролизу зависит от реагентов в растворе электролита, в то время как активный электрод может работать сам по себе для проведения полуреакции окисления или восстановления.
Если учесть все четыре этих фактора, мы сможем успешно предсказать половинные реакции электрода и общие реакции при электролизе.
Упражнение \ (\ PageIndex {1} \)
Предскажите электродные реакции и общую реакцию, когда анод сделан из (а) меди и (б) платины.
Количественные аспекты электролиза
Майкл Фарадей в 1833 году обнаружил, что всегда существует простая взаимосвязь между количеством вещества, производимого или потребляемого на электроде во время электролиза, и количеством электрического заряда Q , который проходит через элемент.- \ rightarrow Ag \]
говорит нам, что когда 1 моль Ag + наносится на 1 моль Ag, с катода должен поступать 1 моль e —. Поскольку известно, что отрицательный заряд одного электрона составляет 1,6022 × 10 –19 Кл, мы можем умножить его на постоянную Авогадро, чтобы получить заряд на моль электронов. Эта величина называется Константа Фарадея , символ F :
.
F = 1,6022 × 10 –19 C × 6,0221 × 10 23 моль –1 = 9.-} \) и \ (Q \).
Часто в экспериментах по электролизу измеряется электрический ток, а не количество электрического заряда. Поскольку кулон определяется как количество заряда, которое проходит через фиксированную точку в электрической цепи, когда ток в один ампер течет в течение одной секунды, заряд в кулонах можно рассчитать, умножив измеренный ток (в амперах) на время (в секундах), в течение которого он течет:
\ [Q = It \]
В этом уравнении I представляет ток, а t представляет время.Если вы помните, что
кулон = 1 ампер × 1 секунда 1 C = 1 А с
можно настроить единицы времени для получения правильного результата. Теперь, когда мы можем предсказать полуреакции электрода и общие реакции при электролизе, также важно уметь рассчитывать количества потребляемых реагентов и произведенных продуктов. Для этих расчетов мы будем использовать постоянную Фарадея:
1 моль электрона = 96,485 C
заряд ( C ) = ток ( C / s ) x время (с)
( C / s ) = 1 кулон заряда в секунду = 1 ампер ( A )
Простое преобразование для любого типа задач:
- Преобразование любого заданного времени в секунды
- Возьмите заданный ток ( A, ) в секундах, [1 c = (A) / (s)]
- Наконец, используйте стехиометрическое преобразование 1 моль электрона = 96 485 C (постоянная Фарадея)
Пример \ (\ PageIndex {1} \)
Электролиз растворенного образца брома можно использовать для определения количества содержания брома в образце.- \]. Какую массу брома можно отложить за 3 часа при токе 1,18 А?
Решение :
3,00 часа x 60 мин / час x 60 сек / 1 мин x 1,18 C (A) /1 сек x 1 моль — / 96,485 C
= 0,132 моль —
Проблемы
1) Предсказать продукты электролиза, заполнив график:
Cl — , Br — , I — , H + , OH — , Cu 2+ , Pb 2+ , Ag +, K + , Na + ,
2) Рассчитайте количество электрического заряда, необходимого для пластины 1.386 моль Cr из кислого раствора K 2 Cr 2 O 7 согласно полууравнению
H 2 Cr 2 O 7 ( водн. ) + 12H + ( водн. ) + 12 e — → 2Cr ( s ) + 7 H 2 O ( л )
3) Пероксид водорода, H 2 O 2 , может быть получен электролизом холодной концентрированной серной кислоты. Реакция на аноде
2H 2 SO 4 → H 2 S 2 O 8 + 2H + + 2 e —
Когда полученная пероксидисерная кислота, H 2 S 2 O 8 , кипятится при пониженном давлении, она разлагается:
2H 2 O + H 2 S 2 O 8 → 2H 2 SO 4 + H 2 O 2
Рассчитайте массу перекиси водорода, образовавшейся при токе 0.893 потока за 1 час.
4) Электролиз растворенного образца холрида можно использовать для определения количества хлорида в образце. На катоде полуреакция восстановления равна Cl 2 + (водн.) + 2 e — -> 2 Cl — . Какую массу хлорида можно отложить за 6,25 часа током 1,11 А?
5) В электролитической ячейке электрод, на котором электроны входят в раствор, называется ______; химическое изменение, которое происходит на этом электроде, называется _______.
- анод, оксидирование
- анод, редуктор
- катод, окисление
- катод, редукция
- не может сказать, если мы не знаем, какие виды окисляются и восстанавливаются.
6) Как долго (в часах) должен поддерживаться ток 5,0 ампер на гальванической пластине 60 г кальция из расплавленного CaCl 2 ?
- 27 часов
- 8,3 часа
- 11 часов
- 16 часов
- 5.9 часов
- 7) Сколько времени в часах потребуется для гальваники 78 г платины из раствора [PtCl 6 ] 2 — при среднем токе 10 ампер при КПД электрода 80%?
- 8,4
- 5,4
- 16,8
- 11,2
- 12,4
8) Сколько фарадеев необходимо, чтобы восстановить 1,00 г алюминия (III) до металлического алюминия?
- 1.00
- 1,50
- 3,00
- 0,111
- 0,250
9) Найдите стандартный потенциал ячейки для электрохимической ячейки с помощью следующей реакции ячейки.
Zn (тв.) + Cu 2+ (водн.) → Zn 2+ (водн.) + Cu (т.)
ответов
1) . Cl — хлор H + водород
Cl — хлор Cu 2+ медь
I — йод H + H водород
2) 12 моль e — требуется для получения 2 моль Cr, что дает нам стехиометрическое соотношение S ( e — / Cr).Затем постоянную Фарадея можно использовать для определения количества заряда.
n Cr n e — Q
Q = 1,386 моль Cr × × = 8,024 × 10 5 C
3) Произведение силы тока и времени дает нам количество электричества: Q . Зная это, мы легко вычисляем количество электронов: n e -. Затем из первого полууравнения мы можем найти количество пероксидисерной кислоты, а второе приводит к n h3O2 и, наконец, к m h3O2 .
= 05666 × г H 2 O 2 = 0,5666 г H 2 O 2
4) 0,259 моль —
5) г
6) г
7) б
8) г
9) Напишите полуреакции для каждого процесса.
Zn (s) → Zn 2+ (водн.) + 2 e —
Cu 2+ (водн.) + 2 e — → Cu (т.)
Найдите стандартные потенциалы полуреакции восстановления.
E o восстановление Cu2 + = + 0,339 V
E o восстановление Zn2 + = — 0,762 В
Определите общий потенциал стандартной ячейки.
E o ячейка = + 1,101 V
Список литературы
- Петруччи и др. Общая химия: принципы и современные приложения. 9 изд. Река Аппер Сэдл, Нью-Джерси: Pearson / Prentice Hall, 2007.
- Кольбе, Германн. Электролиз органических соединений.Эдинбург: Э. и С. Ливингстон, 1947.
- Стюарт, A.T. «Электролиз воды». Производство водорода 2001 13 мая
- Также все упомянутые «внешние ссылки».
Авторы и авторство
- Jasmine Briones, Калифорнийский университет в Дэвисе 2012
17.2: Электролиз — Химия LibreTexts
Типичная электролитическая ячейка может быть изготовлена, как показано на рисунке \ (\ PageIndex {1} \). Два электрических проводника ( электродов ) погружены в жидкость, подлежащую электролизу.Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит. Жидкость, подлежащая электролизу, должна быть способна проводить электричество, поэтому обычно это водный раствор электролита или расплавленное ионное соединение. Электроды подключены проводами к батарее или другому источнику постоянного тока. Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, в то время как электрод, к которому они подводятся, имеет избыток электронов и отрицательный заряд.
Рисунок \ (\ PageIndex {1} \): электролитическая ячейка. Батарея откачивает электроны от анода (делая его положительным) в катод (делая его отрицательным). Положительный анод притягивает к себе анионы, а отрицательный катод притягивает к себе катионы. Электрический ток переносится электронами в проводе и электродах, но он переносится анионами и катионами, движущимися в противоположных направлениях в самой ячейке. Поскольку анод может принимать электроны, на этом электроде происходит окисление.Катод является донором электронов и может вызвать восстановление. из Википедии (кредит XXX).
Отрицательно заряженный электрод притягивает к себе положительные ионы (катионы) из раствора. Он может отдавать часть своих избыточных электронов таким катионам или другим частицам в жидкости, подвергаемой электролизу. Следовательно, этот электрод фактически является восстановителем. В любом электрохимическом элементе (электролитическом или гальваническом) электрод, на котором происходит восстановление , называется катодом .
Положительный электрод, с другой стороны, притягивает к себе отрицательные ионы (анионы). Этот электрод может принимать электроны от этих отрицательных ионов или других частиц в растворе и, следовательно, ведет себя как окислитель. В любой электрохимической ячейке анод является электродом, на котором происходит окисление . Простой способ запомнить, какой электрод — это то, что анод и окисление начинаются с гласных, в то время как катод и восстановление начинаются с согласных.
На следующем видео показан этот процесс в нейтральном водном растворе с некоторыми присутствующими электролитами.{-} (aq) \ rightarrow \ text {H} _2 (g) + \ text {Cl} _2 (g) + \ text {2H} _2 \ text {O} (l) \]
Чистая реакция [Уравнение \ (\ ref {3} \)] — это , обратная спонтанной комбинации H 2 ( г ) с Cl 2 ( г ) с образованием HCl ( водн ). Такой результат справедлив для электролиза в целом: электрического тока, подаваемого извне системы, вызывает несамопроизвольную химическую реакцию.
Хотя электролиз всегда обращает вспять спонтанную окислительно-восстановительную реакцию, результат данного электролиза не всегда может быть той реакцией, которую мы хотим.В водном растворе, например, всегда есть очень много молекул воды вблизи анода и катода. Эти молекулы воды могут отдавать электроны аноду или принимать электроны от катода так же, как это могут делать анионы или катионы. Следовательно, электролиз может окислять и / или восстанавливать воду вместо того, чтобы вызывать реакцию растворенного электролита. Примером этой проблемы является электролиз фторида лития LiF. {-} \]
Однако Li + — очень плохой акцептор электронов, и поэтому очень трудно заставить выполняться уравнение \ (\ ref {5} \).{-} \ label {8} \]
Общее уравнение можно получить, умножив Уравнение \ (\ ref {7 } \ ) на 2, добавив его к Уравнению \ (\ ref {8} \) и комбинируя H + с OH — для получения H 2 O:
\ [\ text {2H} _2 \ text {O} (l) \ rightarrow \ text {2H} _2 (g) + \ text {O} _2 (g) \]
На следующем видео показан процесс электролиза воды с использованием серной кислоты в качестве моста для передачи заряда. После завершения электролиза идентичность образующихся газов проверяется с помощью тестов на горючие шины.
Таким образом, этот электролиз обращает спонтанную комбинацию H 2 и O 2 с образованием H 2 O. При обсуждении окислительно-восстановительных реакций мы упоминаем несколько окислителей, например, которые достаточно сильны, чтобы окислять H 2 O. В то же время мы описываем восстановители, которые достаточно сильны для восстановления H 2 O, такие как щелочные металлы и более тяжелые щелочноземельные металлы. Как правило, такие вещества не могут быть получены электролизом водных растворов, поскольку вместо этого H 2 O окисляется или восстанавливается.Вещества, которые подвергаются спонтанной окислительно-восстановительной реакции с H 2 O, обычно получают электролизом расплавов солей или в каком-либо другом растворителе. Однако из этого правила есть некоторые исключения, потому что некоторые электродные реакции протекают медленнее, чем другие. Например, используя таблицу 11.5, мы можем предсказать, что H 2 O является лучшим восстановителем, чем Cl —.
Следовательно, мы ожидаем, что O 2 , а не Cl 2 , будет получен электролизом 1 M HCl, что противоречит уравнению \ (\ ref {1} \).Оказывается, что O 2 образуется больше , медленно , чем Cl 2 , и последний пузырится из раствора до того, как H 2 O может быть окислен. По этой причине Таблицу 1 из раздела Редокс-пары не всегда можно использовать для прогнозирования того, что произойдет при электролизе.
Электролиз | Безграничная химия
Прогнозирование продуктов электролиза
Электролиз — это способ разделения соединения путем пропускания через него электрического тока; продукты представляют собой ионы, входящие в состав соединения.
Цели обучения
Предсказать продукты реакции электролиза
Ключевые выводы
Ключевые моменты
- Основными компонентами электролитической ячейки являются электролит, постоянный ток и два электрода.
- Ключевой процесс электролиза — это обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь.
- Окисление ионов или нейтральных молекул происходит на аноде, а восстановление ионов или нейтральных молекул происходит на катоде.
Ключевые термины
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Что такое электролиз?
Чтобы предсказать продукты электролиза, нам сначала нужно понять, что такое электролиз и как он работает. Электролиз — это метод разделения связанных элементов и соединений путем пропускания через них электрического тока.Он использует постоянный электрический ток (DC), чтобы запустить в противном случае несамопроизвольную химическую реакцию. Электролиз очень важен с коммерческой точки зрения как стадия отделения элементов из природных источников, таких как руды, с использованием электролитической ячейки.
Основными компонентами, необходимыми для проведения электролиза, являются:
- Электролит: вещество, содержащее свободные ионы, которые являются переносчиками электрического тока в электролите. Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
- Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Обмен атомами и ионами
Ключевым процессом электролиза является обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь.Необходимые продукты электролиза находятся в физическом состоянии, отличном от состояния электролита, и могут быть удалены некоторыми физическими процессами.
Каждый электрод притягивает ионы противоположного заряда. Положительно заряженные ионы или катионы движутся к катоду, обеспечивающему электроны, который является отрицательным; отрицательно заряженные ионы или анионы движутся к положительному аноду. Вы могли заметить, что это противоположность гальванической ячейки, где анод отрицательный, а катод положительный.
На электродах электроны поглощаются или высвобождаются атомами и ионами. Те атомы, которые приобретают или теряют электроны, становятся заряженными ионами, которые переходят в электролит. Те ионы, которые приобретают или теряют электроны, становятся незаряженными атомами , отделяются от электролитом. Образование незаряженных атомов из ионов называется разрядкой. Энергия, необходимая для миграции ионов к электродам, и энергия, вызывающая изменение ионного состояния, обеспечивается внешним источником.{4 -} _ 6 [/ латекс]
Нейтральные молекулы также могут реагировать на любом электроде. Реакции электролиза с участием ионов H + довольно распространены в кислых растворах. В щелочных водных растворах реакции с участием гидроксид-ионов (OH — ) обычны. Окисленные или восстановленные вещества также могут быть растворителем, которым обычно является вода, или электродами. Возможен электролиз с участием газов.
Прогнозирование продуктов электролиза
Давайте посмотрим, как прогнозировать продукты.Например, на какие два иона распадется CuSO 4 ? Ответ: Cu 2+ и SO 4 2- . Давайте посмотрим на эту реакцию внимательнее.
Электролиз сульфата меди : два медных электрода помещают в раствор синего сульфата меди и подключают к источнику электрического тока. Ток включен на некоторое время.
Берем два медных электрода и помещаем их в раствор синего сульфата меди (CuSO 4 ) и включаем ток.- [/ латекс]
Мы только что видели электрический ток, используемый для расщепления CuSO 4 на составляющие ионы. Это все, что нужно для прогнозирования продуктов электролиза; все, что вам нужно сделать, это разложить соединение на составляющие ионы.
Электролиз хлорида натрия
Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия, которые дают разные продукты.
Цели обучения
Предсказать продукты электролиза хлорида натрия в расплавленных и водных условиях
Ключевые выводы
Ключевые моменты
- Металлический натрий и газообразный хлор могут быть получены электролизом расплавленного хлорида натрия.
- Электролиз водного раствора хлорида натрия дает водород и хлор, при этом водный гидроксид натрия остается в растворе.
- Причина различия в том, что восстановление Na + (E ° = –2,7 v) энергетически сложнее, чем восстановление воды (–1,23 v).
Ключевые термины
- анод : электрод электрохимической ячейки, на которой происходит окисление.
- катод : электрод электрохимической ячейки, на котором происходит восстановление.
Электролиз NaCl
Как мы уже говорили, электролиз — это прохождение постоянного электрического тока через ионное вещество, которое либо расплавлено, либо растворено в подходящем растворителе. Это приводит к химическим реакциям на электродах и разделению материалов. Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия. Вы можете подумать, что оба метода дадут вам одинаковые продукты, но это не так. Давайте рассмотрим каждый из методов, чтобы понять различные процессы.
Электролиз расплавленного NaCl
Если хлорид натрия расплавляется (выше 801 ° C), два электрода вставляются в расплав и через расплав соли пропускается электрический ток, после чего на электродах происходят химические реакции.
Электролизная ячейка для расплавленного хлорида натрия : Промышленная электролизная ячейка для производства металлического натрия и газообразного хлора из расплавленного NaCl. Жидкий натрий всплывает в верхнюю часть расплава над катодом и сливается в резервуар для хранения.{-} [/ латекс]
Общая реакция — это разложение хлорида натрия на элементы:
[латекс] 2 \ text {NaCl} \ rightarrow 2 \ text {Na} (\ text {s}) + {\ text {Cl}} _ {2} (\ text {g}) [/ latex]
Электролиз водного NaCl
Что происходит, когда у нас есть водный раствор хлорида натрия? Что ж, мы не можем забыть, что мы должны учитывать воду в уравнении. Поскольку вода может быть как окисленной, так и восстановленной, она конкурирует с растворенными ионами Na + и Cl —.Вместо производства натрия производится водород.
Электролиз водного раствора хлорида натрия : Электролиз водного раствора NaCl приводит к образованию водорода и хлорида. На аноде (A) хлорид (Cl-) окисляется до хлора. Ионоселективная мембрана (B) позволяет противоиону Na + свободно проходить через нее, но предотвращает диффузию анионов, таких как гидроксид (OH-) и хлорид. На катоде (C) вода восстанавливается до гидроксида и газообразного водорода. Чистый процесс представляет собой электролиз водного раствора NaCl на промышленно полезные продукты — гидроксид натрия (NaOH) и газообразный хлор.{-} (\ text {aq}) + {\ text {H}} _ {2} (\ text {g}) + \ frac {1} {2} {\ text {Cl}} _ {2} ( \ text {g}) [/ latex]
Восстановление Na + (E ° = –2,7 об.) Энергетически сложнее, чем восстановление воды (–1,23 об.), Поэтому в водном растворе будет преобладать последнее.
Вывести продукты электролиза расплава соли : Электролиз расплава соли дает элементы из соли. Итак, электролиз WCl4 дает W и Cl2.Ионы металлов получают электроны на отрицательном электроде, а неметаллы теряют их на положительном электроде.
Электролиз воды
Чистая вода не может подвергаться значительному электролизу без электролита, такого как кислота или основание.
Цели обучения
Вспомните свойства электролита, которые позволяют проводить электролиз воды
Ключевые выводы
Ключевые моменты
- Электролиз раствора серной кислоты или соли, такой как NaNO 3 , приводит к разложению воды на обоих электродах.
- На катоде появится водород, а на аноде появится кислород.
- Количество образующегося водорода в два раза превышает количество молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором.
Ключевые термины
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Чистая вода не может подвергаться значительному электролизу без добавления электролита.{-} [/ латекс]
E ° = -1,23 В
Умножение катодной реакции на 2, чтобы соответствовать количеству перенесенных электронов, дает это чистое уравнение после объединения ионов OH — и H + с образованием воды:
Сеть: [латекс] 2 {\ text {H}} _ {2} \ text {O} (\ text {l}) \ rightarrow 2 {\ text {H}} _ {2} (\ text {g} ) + {\ text {O}} _ {2} (\ text {g}) [/ latex]
E = -1,23 v
Водород появится на катоде, отрицательно заряженном электроде, где электроны входят в воду, и кислород появится на аноде, положительно заряженном электроде.Количество образовавшихся молей водорода в два раза больше количества молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором. Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза больше количества генерируемых молекул кислорода.
Иоганн Риттер, который изобрел первую электрохимическую ячейку, был одним из первых, кто открыл разложение воды электричеством.
Электролиз воды : Устройство, изобретенное Иоганном Вильгельмом Риттером для разработки электролиза воды.
Стехиометрия электролиза
Количество химического изменения, которое происходит при электролизе, стехиометрически связано с количеством электронов, проходящих через элемент.
Цели обучения
Предсказать, сколько кулонов потребуется для данной электрохимической реакции
Ключевые выводы
Ключевые моменты
- С точки зрения источника напряжения и цепи вне электродов, поток электронов обычно описывается в терминах электрического тока с использованием кулонов и ампер в единицах СИ.
- Требуется 96 485 кулонов, чтобы составить моль электронов, единицу, известную как фарадей (F).
- Эквивалентный вес вещества определяется как молярная масса, деленная на количество электронов, необходимых для окисления или восстановления каждой единицы вещества.
Ключевые термины
- кулонов : В Международной системе единиц производная единица электрического заряда; количество электрического заряда, переносимого током в 1 ампер, протекающим в течение 1 секунды.Символ: C.
- фарадей : количество электричества, необходимое для депонирования или высвобождения 1 грамма эквивалентного веса вещества во время электролиза; приблизительно 96 487 кулонов.
Стехиометрия электролитической ячейки
Степень химического изменения, происходящего в электролитической ячейке, стехиометрически зависит от количества молей электронов, проходящих через ячейку. С точки зрения источника напряжения и цепи за пределами электродов, поток электронов обычно описывается в терминах электрического тока с использованием единиц СИ в кулонах и амперах.Чтобы составить моль электронов, требуется 96 485 кулонов — единица, известная как фарадей (F).
Это соотношение было впервые сформулировано Майклом Фарадеем в 1832 году в форме двух законов электролиза:
- Вес веществ, образующихся на электроде во время электролиза, прямо пропорционален количеству электричества, которое проходит через электролит.
- Вес различных веществ, образованных при прохождении одного и того же количества электричества, пропорционален эквивалентному весу каждого вещества.- \ rightarrow \ text {V} [/ latex]).
Большинство стехиометрических задач, связанных с электролизом, могут быть решены без явного использования законов Фарадея. «Химия» в этих проблемах обычно очень элементарна; основные трудности обычно возникают из-за незнания основных электрических устройств:
- ток (в амперах) — это скорость переноса заряда: 1 ампер = 1 [латекс] \ frac {\ text {Coulombs}} {\ text {second}} [/ latex].
- (в ваттах) — это скорость производства или потребления энергии: 1 Вт = 1 [латекс] \ frac {\ text {Джоуль}} {\ text {second}} [/ latex]. -} = 1184 \ \ text {Coulombs} [/ latex]
1.5 часов эквивалентны 5400 секундам:
[латекс] \ frac {1184 \ \ text {Coulombs}} {5400 \ \ text {секунды}} = 0,22 \ \ text {Amps} [/ latex]
Электролиз растворов
ЭЛЕКТРОЛИЗ РЕШЕНИЙ
Эта страница посвящена электролизу водных растворов соединений. Большинство людей довольно часто сталкивались с этим на курсах химии для детей от 14 до 16 лет.
Основные идеи
Роль воды в электролизе водных растворов электролитов
Ситуация усложняется, когда вы электролизуете раствор, а не расплав, из-за присутствия воды.
Вода сама по себе является очень слабым электролитом, потому что она в очень небольшой степени расщепляется на ионы водорода и ионы гидроксида.
Примечание: Я, конечно, упрощаю это. Вы должны знать, что ион водорода не существует сам по себе в этих обстоятельствах — он фактически присоединяется к другой молекуле воды, чтобы дать ион гидроксония, H 3 O + . Это означает символ состояния (aq).
Это означает, что на каждый электрод может приходить более одного иона, и можно выбрать, какой из них будет разряжаться.
Например, если вы электролизовали раствор хлорида натрия, ионы натрия и ионы водорода (из воды) притягиваются к катоду, а ионы хлорида и ионы гидроксида (из воды) притягиваются к аноду.
Электрохимическая серия
В таблице ниже перечислены несколько металлов (и водород), показывающих их склонность к потере электронов. Чем отрицательнее значение E ° (обычно читается как «E-ноль»), тем левее находится положение равновесия.
Это означает, что чем больше отрицательное значение E °, тем больше у одного из этих элементов склонности к потере электронов и образованию своих ионов.
Это также означает, что что-то вроде лития будет иметь небольшую тенденцию собирать электроны для образования атомов после ионизации.
Напротив, что-то с положительным значением E ° будет неохотно терять электроны для образования ионов, но будет довольно легко заставить один из его ионов улавливать электроны, чтобы снова стать нейтральным элементом.
Итак, золото не будет очень реактивным, потому что у него очень положительное значение E °. Нелегко удалить электроны, чтобы получить ионы золота, но ионы золота снова легко превратить в металлическое золото.
Электрохимический ряд можно рассматривать как расширенный и слегка модифицированный ряд реактивности.
Все, что вам действительно нужно знать об электролизе, это:
Чем выше в электрохимическом ряду находится что-то в правой части равновесия, тем легче оно теряет электроны.
Чем ниже по электрохимическому ряду находится что-то в левой части равновесия, тем легче оно будет улавливать электроны.
Примечание: Для целей электролиза вам не нужно понимать, откуда берутся эти числа или к чему именно относится равновесие.
Если вы хотите узнать больше об электрохимических рядах, включая происхождение этих чисел, вы найдете их, перейдя по этой ссылке.Это вторая страница в серии страниц, посвященных окислительно-восстановительным потенциалам, и вам, вероятно, также потребуется прочитать первую страницу. Это не обязательно для перехода на остальную часть текущей страницы.
Подведение итогов
Я хочу подвести итоги этого, прежде чем подробно рассматривать конкретные примеры. Важно, чтобы вы запомнили шаблоны, приведенные в следующем фрагменте.
Что происходит на катоде?
Положительные ионы притягиваются к катоду, где они захватывают один или несколько электронов и разряжаются.
Либо металл осаждается, либо водород образуется из воды. Что вы получите, зависит от положения металла в электрохимическом ряду и, в некоторых случаях, от концентрации раствора.
Если металл ниже водорода в электрохимическом ряду (если он имеет положительное значение E °), то вы получите металл. К таким металлам относятся медь и серебро.
Если металл занимает высокое место в электрохимическом ряду (если он имеет довольно отрицательное значение E °), то вы получаете водород.К таким металлам относятся магний и натрий.
Металлы от, скажем, свинца до цинка в электрохимическом ряду более сложны. Что получится, зависит от концентрации раствора. Если раствор достаточно концентрированный, вы получите осаждение металла. Если раствор очень разбавлен на , вы получите водород. При промежуточных концентрациях вы можете получить и то, и другое.
Чем выше элемент в электрохимическом ряду, тем легче он теряет электроны и тем более неохотно забирает их обратно.Намного легче убедить медь взять обратно электроны, чтобы превратить ион в атом, чем, скажем, сделать то же самое с литием.
Что происходит на аноде?
Использование инертных электродов, таких как платиновый или угольный
Как правило, если у вас есть галоген, вы получите галоген. Со всеми другими распространенными анионами (отрицательными ионами) вы будете получать кислород из воды.
Но концентрация здесь играет роль.Например, если у вас есть концентрированный раствор хлорида натрия, на аноде будет в основном хлор. Чем больше и больше разбавленных растворов, тем меньше хлора и больше кислорода. Очень и очень разбавленные растворы будут давать в основном кислород.
Если анод не инертен
Сложность возникает, если анод не инертен, и мы рассмотрим пару примеров этого ниже.
Некоторые примеры
Электролиз раствора сульфата меди (II) угольными электродами
Медь ниже водорода в электрохимическом ряду, поэтому, используя приведенное выше резюме, можно предсказать, что медь будет выделяться на катоде.
Продолжая использовать приведенное выше резюме, можно предположить, что кислород будет выделяться на аноде, потому что галогена в нем нет.
Именно это и происходит.
На катоде
Ионы меди (II) и ионы водорода притягиваются к отрицательному катоду. В электрохимическом ряду медь находится ниже водорода, поэтому именно медь принимает электроны от катода.
Катод покрывается медью.
На аноде
Ионы сульфата и ионы гидроксида притягиваются к положительному аноду, но очень трудно убедить ионы сульфата отдать электроны.
Теперь все усложняется, потому что есть два способа описания анодной реакции в подобных случаях. Самый простой способ — представить это в терминах гидроксид-ионов.
Предполагая, что гидроксид-ионы разряжены
Кислород выделяется.
Проблема заключается в том, что в растворе сульфата меди (II) будет очень мало гидроксид-ионов. Вы можете обойти это, заметив, что реакция воды, в результате которой образуются ионы водорода и гидроксида, является равновесной. Когда вы разряжаете ионы гидроксида, равновесие смещается, чтобы заменить их.
Получение кислорода непосредственно из молекул воды
Общий эффект точно такой же, как если бы вы выпустили ионы гидроксида, и водное равновесие сместилось, чтобы заменить их.Сдвиг равновесия также будет производить ионы водорода. Они, конечно, будут отталкиваться от анода.
Так что же правильно?
Это почти наверняка зависит от pH раствора. В этом конкретном случае раствор сульфата меди (II) является умеренно кислым, что означает, что гидроксид-ионов даже меньше, чем в чистой воде, поэтому второе уравнение (вода), вероятно, будет более точным.
Примечание: Что вы делаете с этим для экзамена? Вам нужно выяснить, какую версию этих уравнений используют ваши экзаменаторы, и затем придерживаться ее во всем — не беспокойтесь о том, чтобы менять ее от примера к примеру.Вам необходимо проверить, какие из них они использовали в своих прошлых работах и какая форма их предпочтительнее в их схемах оценок. Вполне вероятно, что они примут то и другое, но вы должны быть уверены.
Подобные случаи
Любой раствор, содержащий сульфат-ионы (который включает разбавленную серную кислоту), будет вести себя так же на инертном аноде — будет выделяться кислород.
Нитрат-ионы также производят кислород. Вывести гидроксид-ионы из воды (или самой воды, если вы используете это уравнение) легче, чем из нитрат-иона.
Электролиз раствора хлорида натрия угольными электродами
Натрий значительно превосходит водород в электрохимическом ряду, поэтому, используя приведенное выше резюме, можно предсказать, что водород будет выделяться на катоде.
Продолжая использовать приведенное выше резюме, можно предсказать, что хлор (галоген) будет выделяться на аноде.
Оказывается, этот случай немного сложнее, потому что результат на аноде зависит от концентрации раствора.
На катоде
Прибывают ионы натрия и ионы водорода (из воды), но натрий настолько высок в электрохимическом ряду, что его ионы не разряжаются там, где есть какой-либо выбор.
Если вы электролизуете расплавленный хлорид натрия, то выбора нет — нужно разряжать ионы натрия. Но в решении у вас есть альтернатива. К сожалению, есть два разных взгляда на это, аналогично проблеме с анодом, описанной выше.
Предполагая, что ионы водорода разряжены
Выделяется водород.
Вы можете преодолеть тот факт, что в растворе не так много ионов водорода, помня, что когда вода ионизируется с образованием ионов водорода и гидроксид-ионов, это равновесие. По мере того, как ионы водорода разряжаются, больше воды расщепляется, чтобы заменить их.
Получение водорода непосредственно из молекул воды
Как и в случае с аналогичным анодным случаем, рассмотренным выше, как бы вы ни смотрели на него, общий эффект точно такой же.Вы получаете газообразный водород и образование гидроксид-ионов — вместе с ионами водорода, когда водное равновесие смещается, чтобы заменить высвобождаемые ионы водорода.
Итак, какое уравнение вам следует использовать?
Вы должны руководствоваться тем уравнением, которое используют ваши экзаменаторы в своих вопросах или в схемах выставления оценок. На практике они, скорее всего, примут и то, и другое.
Подобные случаи
Всякий раз, когда вы электролизуете соединение металла над водородом в электрохимическом ряду, и у вас выделяется водород, применяется тот же аргумент.Однако в некоторых случаях водород не выделяется при таких обстоятельствах, и мы рассмотрим их ниже.
На аноде
Ионы хлора и ионы гидроксида притягиваются к положительному аноду. На самом деле, ионы гидроксида немного легче разряжать, но в основном вы получаете хлор.
Если раствор хлорида натрия достаточно концентрированный, вы получите в основном хлор.
Если раствор хлорида натрия очень разбавлен, вы получите в основном кислород.
При промежуточных концентрациях вы получите смесь обоих.
Примечание: На этом уровне это то, что вам в основном просто необходимо принять. Не существует простого объяснения , которое я мог бы добавить, не делая эту длинную и часто сложную страницу еще хуже. Я думаю, очень маловероятно, что вам когда-либо придется объяснять причину этого на экзамене по химии на этом уровне.
Если вы столкнетесь с вопросами от экзаменаторов, которые, по-видимому, нуждаются в надлежащих объяснениях, не могли бы вы сообщить мне об этом по адресу, указанному на странице об этом сайте.Было бы полезно, если бы вы также могли точно сказать мне, что ваши экзаменаторы ожидают от вас.
Образование хлора определяется уравнением:
А образование кислорода задается одним из уравнений:
или:
Водные растворы бромидов и иодидов
В обоих случаях можно предположить, что на аноде вырабатывается бром или йод.Уравнения аналогичны разряду ионов хлора, описанному выше.
Электролиз раствора хлорида натрия с использованием ртутного катода
Это хороший пример случая, когда природа электрода имеет огромное значение.
Когда-то это был основной промышленный метод производства раствора гидроксида натрия, а также хлора и водорода, но он был в значительной степени заменен более экологически чистыми методами. В прошлом были серьезные примеры опасного загрязнения из-за утечки ртути в окружающую среду.
На катоде
Когда ионы натрия и ионы водорода попадают на ртутный катод, именно ионы натрия выделяются в виде металлического натрия. Он растворяется в ртути с образованием раствора, известного как «натриевая амальгама».
Амальгама натрия вытекает из электролизной ячейки и вступает в реакцию с водой, освобождая ртуть для рециркуляции через ячейку и производя раствор гидроксида натрия и водород.
На аноде
Хлор производится, как и следовало ожидать.
Электролиз раствора сульфата цинка угольными электродами
Я использую соединение цинка в качестве примера довольно неожиданных результатов, которые вы получаете при электролизе растворов соединений металлов от свинца до цинка в электрохимической серии.
Все они выше водорода в электрохимическом ряду, поэтому можно ожидать, что водород будет выделяться на катоде вместо металла. Это не то, что происходит при любой разумной концентрации растворов солей этих металлов.
На катоде
Ионы цинка захватывают электроны с катода, образуя атомы цинка, которые прикрепляются к катоду.
На аноде
Это еще один случай электролиза сульфата, и мы подробно рассмотрели его далее на странице, рассказывая об электролизе раствора сульфата меди (II).
Примечание: Опять же, нет быстрого и простого способа объяснить, почему разряжаются ионы цинка, а не ионы водорода, и очень маловероятно, что вас попросят объяснить это на экзамене на этом уровне.
Если вы хотите узнать больше, вы можете погуглить перенапряжение . Вы можете встретить такие фразы, как «большое перенапряжение водорода». Использование слова «перенапряжение» на самом деле ничего не объясняет. Все, что он на самом деле говорит, — это то, что водород труднее разрядить, чем можно было бы ожидать, исходя из его положения в электрохимическом ряду — и мы знаем это, потому что экспериментально в том случае, о котором мы говорим, вы получаете цинк, а не водород.
Итак, если вы хотите следить за этим (почти наверняка не требуется для экзаменов по химии на этом уровне), поищите объяснения, объясняющие, почему значение E ° водорода не применимо в реальной ситуации электролиза раствора сульфата цинка.
Электролиз раствора нитрата серебра с использованием серебряного анода
Это пример случая, когда вы используете электрод, который химически участвует в реакции.
На катоде
Если вы электролизуете раствор нитрата серебра с использованием серебра в качестве анода, серебро осаждается на любом материале, из которого сделан катод, как и следовало ожидать.
Может использоваться для серебряного покрытия.
На аноде
Но на аноде, вместо того, чтобы что-либо выходить из раствора, серебро из анода переходит в раствор в виде ионов серебра, оставляя электроны на аноде.
Анод теряет серебро, и чистое изменение — это просто перенос серебра с анода на катод.
Электролиз раствора сульфата меди (II) с использованием медного анода
Аналогичное изменение происходит при электролизе раствора сульфата меди (II) с помощью медных электродов.Медь осаждается на катоде, как и следовало ожидать, но вместо кислорода, выделяемого на аноде, ионы меди (II) переходят в раствор. Опять же, есть чистый перенос меди от анода к катоду.
Используется для очистки меди, и вы можете узнать больше об этом, прочитав часть страницы о меди. Вам не нужна вся страница — только раздел об очищении.
Практическая деталь
Конечно, вы можете электролизовать раствор, поместив его в химический стакан с двумя угольными электродами и подключив электроды к источнику постоянного тока, например батарее.
Тем не менее, вы можете захотеть собрать все выделяемые газы для проверки и, возможно, измерить их объем. В заключительной части этой страницы рассматриваются два простых устройства, которые позволят вам это сделать.
Сбор любых газов для проверки
Если у вас есть газы, исходящие от обоих электродов, вам необходимо держать их отдельно, а также собирать их. Это дешевый и простой способ сделать это.
Изначально обе маленькие пробирки заполнены любым раствором, который вы можете подвергать электролизу.Газы, выходящие из двух электродов, не смешиваются, и, если есть два газа, оба могут быть проверены отдельно.
Помимо газов, отчетливо видны любые осажденные на катоде металлы, а также любые растворы брома или йода, образующиеся на аноде. Раствор брома от бледного до средне-оранжевого цвета; Цвет раствора йода варьируется в зависимости от концентрации йода от оранжевого до темно-красного.
Примечание: Йод можно получить только при электролизе раствора йодида.Освободившийся йод фактически вступает в реакцию с непрореагировавшими ионами йодида с образованием растворимого иона I 3 —. Это вызывает появление красного цвета.
Сбор любых газов для их измерения
Самый простой способ — использовать U-образную трубку с боковым рычагом. Вы можете собирать и измерять объем выделяемых газов, собирая их над водой в перевернутые мерные цилиндры или в газовые шприцы.
Амперметр включен в схему, потому что, если вы измеряете выделяемые объемы, вы почти наверняка захотите узнать, какой ток протекает, чтобы производить какие-либо вычисления. Расчеты описаны на других страницах этого раздела.
Куда бы вы сейчас хотели пойти?
В меню «Электролиз». . .
В меню «Неорганическая химия».. .
В главное меню. . .
© Джим Кларк, 2017
Ячейки электролитические
электролитический
ЯчейкиГальванические элементы используют спонтанную химическую реакцию, чтобы управлять
электрический ток через внешнюю цепь. Эти клетки
важны, потому что они являются основой для батарей, питающих
современное общество. Но это не единственный вид электрохимического
клетка.Также возможно построить ячейку, которая работает на
химическая система, пропуская электрический ток через
система. Эти ячейки называются электролитическими ячейками .
Электролиз используется для запуска окислительно-восстановительной реакции в
направление, в котором это не происходит спонтанно.Электролиз
Расплавленный NaClИдеализированная ячейка для электролиза хлорида натрия
показано на рисунке ниже.Источником постоянного тока является
подключен к паре инертных электродов, погруженных в расплавленный натрий
хлористый. Поскольку соль нагревается до плавления, Na +
ионы текут к отрицательному электроду, и Cl —
ионы текут к положительному электроду.Когда ионы Na + сталкиваются с отрицательным электродом,
батарея имеет достаточно большой потенциал, чтобы заставить эти ионы
собирать электроны с образованием металлического натрия.Отрицательный электрод (катод) : Na + + e —
NaCl — ионы, которые сталкиваются с положительным электродом
окисляются до газа Cl 2 , который при этом выделяется
электрод.Положительный электрод (анод) : 2 класса —
Класс 2 + 2 —Чистый эффект от прохождения электрического тока через
расплав соли в этой ячейке должен разложить хлорид натрия на его
элементы, металлический натрий и газообразный хлор.Электролиз NaCl : Катод (-): Na + + e —
NaАнод (+): 2 класса —
Класс 2 + 2 —Потенциал, необходимый для окисления ионов Cl — до Cl 2
равно -1.36 вольт и потенциал, необходимый для восстановления Na +
ионов к металлическому натрию составляет -2,71 вольт. Аккумулятор, используемый для вождения
поэтому эта реакция должна иметь потенциал не менее 4,07
вольт.Этот пример объясняет, почему процесс называется электролиз .
Суффикс — lysis происходит от греческого корня, означающего
ослабить или разделить. Электролиз буквально использует электрический
ток, чтобы разделить соединение на его элементы.электролизный 2 NaCl ( л ) 2 Na ( л ) + Cl 2 ( г ) Этот пример также иллюстрирует разницу между гальваническими
ячейки и электролитические ячейки.Гальванические элементы используют данную энергию
отключается в результате спонтанной реакции на выполнение электромонтажных работ. Электролитический
клетки используют электрическую работу в качестве источника энергии, чтобы управлять
реакция в обратном направлении.Пунктирная вертикальная линия в центре рисунка выше
представляет собой диафрагму, удерживающую производимый газ Cl 2
на аноде от контакта с металлическим натрием
генерируется на катоде. Функция этой диафрагмы может быть
понять, обратившись к более реалистичному изображению
Показана коммерческая ячейка Дауна, используемая для электролиза хлорида натрия.
на рисунке ниже.Газообразный хлор, образующийся на графитовом аноде, вставленном в
дно этой ячейки пузырится сквозь расплавленный натрий
хлорид в воронку наверху ячейки. Натрий металлический, который
формы на катоде всплывают через расплав хлорида натрия
в натрийсборное кольцо, из которого периодически
осушен. Диафрагма, разделяющая два электрода, представляет собой
экран из железной сетки, предотвращающий взрывную реакцию,
произошло бы, если бы продукты реакции электролиза попали в
контакт.Сырье для ячейки Даунса представляет собой смесь 3: 2 по массе
CaCl 2 и NaCl. Эта смесь используется, потому что она имеет
температура плавления 580 o C, тогда как чистый хлорид натрия
должен быть нагрет до температуры более 800 o C, прежде чем он расплавится.Электролиз водного
NaClНа рисунке ниже показан идеализированный чертеж ячейки, в которой
водный раствор хлорида натрия подвергается электролизу.И снова ионы Na + мигрируют в сторону
отрицательный электрод и ионы Cl — мигрируют в сторону
положительный электрод. Но теперь есть два вещества, которые можно
восстановленные на катоде: ионы Na + и молекулы воды.Катод (-): Na + + e —
NaE o красный = -2.71 В 2 H 2 O + 2 e —
Н 2 + 2 ОН —E o красный = -0,83 V Потому что восстановить воду намного легче, чем Na +
ионов, единственным продуктом, образующимся на катоде, является газообразный водород.Катод (-): 2 H 2 O ( l ) + 2 e —
H 2 ( г ) + 2 OH — ( водн. )Есть также два вещества, которые могут окисляться при
анод: ионы Cl — и молекулы воды.Анод (+): 2 класса —
Класс 2 + 2 —E o ox = -1,36 V 2 H 2 O
O 2 + 4 H + + 4 e —E o ox = -1.23 В Потенциалы стандартного состояния для этих полуреакций таковы, что
близко друг к другу, что мы могли бы ожидать увидеть смесь Cl 2
и O 2 газ собирают на аноде. На практике единственный
Продукт этой реакции — Cl 2 .Анод (+): 2 класса —
Класс 2 + 2 —На первый взгляд кажется, что окислить воду легче ( E o ox
= -1.23 вольт), чем ионы Cl — ( E o ox
= -1,36 вольт). Однако стоит отметить, что ячейка
никогда не позволял достичь стандартных условий. Решение
обычно 25% NaCl по массе, что значительно снижает
потенциал, необходимый для окисления иона Cl — . PH
ячейка также держится очень высоко, что снижает окисление
потенциал для воды. Решающим фактором является явление, известное как
перенапряжение , то есть дополнительное напряжение, которое должно быть
применяется к реакции, чтобы заставить ее происходить со скоростью, с которой она
произошло бы в идеальной системе.В идеальных условиях потенциал 1,23 В является большим.
достаточно, чтобы окислить воду до газа O 2 . Под реальным
Однако в таких условиях может потребоваться гораздо большее напряжение, чтобы
инициировать эту реакцию. (Перенапряжение при окислении
воды может достигать 1 В.) Тщательно выбирая
электрод для максимального увеличения перенапряжения при окислении воды
а затем тщательно контролируя потенциал, при котором ячейка
работает, мы можем гарантировать, что в этом
реакция.Таким образом, электролиз водных растворов натрия
хлорид не дает таких же продуктов, как электролиз расплава
натрия хлорид. Электролиз расплавленного NaCl разлагает это
составить его элементы.электролизный 2 NaCl ( л ) 2 Na ( л ) + Cl 2 ( г ) Электролиз водных растворов NaCl дает смесь
водород и газообразный хлор и водный гидроксид натрия
решение.электролизный 2 NaCl ( водн. ) + 2 H 2 O ( л ) 2 Na + ( водн. ) + 2 OH — ( водн. )
+ H 2 ( г ) + Cl 2 ( г )Потому что потребность в хлоре намного превышает потребность
для натрия электролиз водного хлорида натрия является более
важный процесс с коммерческой точки зрения.Электролиз водного NaCl
Решение имеет два других преимущества. Производит газ H 2 .
у катода, который можно собирать и продавать. Он также производит
NaOH, который можно слить со дна электролитической
сотовый и продан.Пунктирная вертикальная линия на рисунке выше представляет
диафрагма, предотвращающая образование Cl 2 на аноде
в этой ячейке от контакта с NaOH, который
накапливается на катоде.Когда эта диафрагма снимается с
ячейка, продукты электролиза водного натрия
хлорида реагируют с образованием гипохлорита натрия, который является первым
шаг в приготовлении гипохлоритных отбеливателей, таких как
Хлорокс.Класс 2 ( г ) + 2 OH — ( водн. )
Cl — ( водн. ) + OCl — ( водн. ) + H 2 O ( l )
Электролиз воды
Стандартный аппарат для электролиза воды показан на
рисунок ниже.электролизный 2 H 2 O ( л ) 2 H 2 ( г ) + O 2 ( г) Пара инертных электродов заделана на противоположных концах
контейнер, предназначенный для сбора H 2 и O 2
газ выделяется в этой реакции.Затем электроды подключаются
к батарее или другому источнику электрического тока.Сама по себе вода является очень плохим проводником электричества. Мы
поэтому добавьте в воду электролит, чтобы получить ионы, которые могут
протекать через раствор, завершая тем самым электрическую
схема. Электролит должен быть растворим в воде. Следует также
быть относительно недорогим. Самое главное, он должен содержать ионы.
которые сложнее окислить или восстановить, чем вода.2 H 2 O + 2 e —
Н 2 + 2 ОН —E o красный
= -0.83 В2 H 2 O
O 2 + 4 H + + 4 e —E o ox = -1,23 V Следующие катионы восстанавливать труднее, чем вода: Li + ,
Rb + , K + , CS + , Ba 2+ ,
Sr 2+ , Ca 2+ , Na + и Mg 2+ .Два из этих катионов являются более вероятными кандидатами, чем другие
потому что они образуют недорогие растворимые соли: Na + и
К + .Ион SO 4 2- может быть лучшим анионом для
использовать, потому что это самый трудный для окисления анион. В
потенциал окисления этого иона до пероксидисульфат-иона равен
-2,05 вольт.2 СО 4 2-
S 2 O 8 2- + 2 e —E o вол = -2.05 В В водном растворе либо Na 2 SO 4
или K 2 SO 4 подвергается электролизу в аппарате
как показано на рисунке выше, H 2 газ собирается в одном
электрод и O 2 газ собирается на другом.Что было бы, если бы мы добавили такой индикатор, как бромтимол?
синий к этому аппарату? Бромтимоловый синий желтеет в кислой среде.
растворы (pH <6) и синий цвет в щелочных растворах (pH> 7.6).
Согласно уравнениям двух полуреакций
индикатор должен стать желтым на аноде и синим на
катод.Катод (-): 2 H 2 O + 2 e —
Н 2 + 2 ОН —Анод (+): 2 H 2 O
O 2 + 4 H + + 4 e —Закон Фарадея
Закон электролиза Фарадея можно сформулировать следующим образом.
количество вещества, потребляемого или производимого на одном из
электродов в электролитической ячейке прямо пропорционально
количество электричества, которое проходит через ячейку.Чтобы использовать закон Фарадея, мы должны признать
соотношение между током, временем и количеством электрического
заряд, протекающий по цепи. По определению один кулон
заряда передается, когда в течение 1 секунды протекает ток 1 А.1 C = 1 ампер
Пример: Чтобы проиллюстрировать, как можно использовать закон Фарадея, давайте
рассчитайте количество граммов металлического натрия, которое образуется при
катод при 10.Ток 0 ампер пропускается через расплавленный
натрия хлорид в течение 4.00 часов.Начнем с вычисления количества электрического заряда, который
протекает через ячейку.Прежде чем мы сможем использовать эту информацию, нам нужен мост между
эта макроскопическая величина и явление, происходящее на
атомный масштаб. Этот мост представлен постоянной Фарадея,
который описывает количество кулонов заряда, которое несет
моль электронов.Таким образом, число молей электронов, перенесенных при
144000 кулонов электрического заряда, протекающего через ячейку, могут быть
рассчитывается следующим образом.Согласно полученному уравнению реакции
происходит на катоде этой ячейки, мы получаем один моль натрия за
каждый моль электронов.Катод (-): Na + + e —
NaТаким образом, получаем 1.49 моль, или 34,3 грамма натрия в 4,00
часы.Последствия этого расчета следующие:
интересно. Нам пришлось бы проводить этот электролиз более чем
два дня, чтобы приготовить полкило натрия.Мы можем расширить общую схему
изложены в этом разделе, чтобы ответить на вопросы, которые могут показаться
невозможно на первый взгляд.Идентификация продуктов электролиза | Эксперимент
На этом практическом занятии студенты получают возможность попрактиковаться в проведении электролиза с использованием ряда растворов, определяя продукты, которые образуются на электродах.Они должны уметь связать свой практический опыт с теорией и научиться составлять простые ионные уравнения.
Классный эксперимент лучше всего проводить учениками, работающими парами или тройками. Каждому члену команды предстоит выполнить множество заданий.
Его следует проводить в хорошо вентилируемой лаборатории, поскольку в некоторых случаях могут образовываться значительные количества токсичного хлора, брома и йода, а также легковоспламеняющийся водород.
Оборудование
Аппарат
- Защита глаз
- Аппарат для электролиза (см. Примечание 1 и схему ниже)
- Графитовые электроды диаметром около 5 мм, 2 шт. (См. Примечание 2)
- Большая резиновая заглушка для электролизера с отверстиями для крепления графитовых электродов
- Маленькие пробирки для установки на электроды, x2
- Источник питания постоянного тока, 6 В
- Маленькая лампочка в патроне, 6В, 5Вт (опция)
- Поводки и зажимы «крокодилы»
- Шины деревянные
- Мелкие кусочки наждачной бумаги
- Полоски универсальной индикаторной бумаги
- Одноразовые пластиковые перчатки
- Зажим и подставка
Химические вещества
Доступ к следующим решениям, все примерно 0.Концентрация 5 M (см. Примечание 3):
- Бромид калия водный
- Йодид натрия водный
- Нитрат кальция водный
- Водный хлорид цинка (РАЗДРАЖАЕТ при этой концентрации)
- Нитрат меди водный
Примечания к оборудованию
- Представленный ниже аппарат для электролиза можно приобрести в готовом виде. Как вариант, его можно сделать из толстой стеклянной трубки диаметром 8–10 см, профессионально разрезанной на отрезки длиной около 12 см.Вместо этого можно использовать подходящую стеклянную бутылку с широким горлышком и отрезанным дном (как показано на схеме). Графитовые стержни должны быть надежно вставлены в отверстия резиновой заглушки на расстоянии 2–3 см друг от друга, в противном случае электролит может протечь на внешнюю проводку, что приведет к ее коррозии. После изготовления этого устройства должно хватить на несколько сеансов, но графитовые стержни, как правило, довольно быстро разрушаются, особенно если учащиеся используют напряжение, превышающее рекомендованное. Стержни со временем становятся тонкими и довольно легко ломаются, но они достаточно дешевы, чтобы их заменить.
Показать в полноэкранном режиме
- После электролиза нитрата меди (II) (предпочтительно в последний раз) на катоде образуется отложение меди. Перед повторным использованием ячеек его необходимо удалить. Для этого можно использовать погружение покрытой части электрода в небольшое количество 50% концентрированной азотной кислоты (КОРРОЗИОННОЕ) в небольшом химическом стакане. Необходимо надевать перчатки и защитные очки, а очистку вытяжного шкафа должен выполнять квалифицированный специалист.
- В зависимости от объема электролизного аппарата каждой группе студентов требуется достаточно раствора, чтобы покрыть электроды плюс около 2 см, чтобы полные пробирки с жидкостью можно было перевернуть над электродами.
Примечания по технике безопасности, охране труда и технике
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда пользуйтесь защитными очками.
- Эксперимент следует проводить в хорошо вентилируемой лаборатории, поскольку при этом могут образовываться значительные количества токсичного хлора, брома и йода, а также легковоспламеняющийся водород.
- Водный бромид калия, KBr (водный) — см. CLEAPSS Hazcard HC047b.
- Водный йодид натрия, NaI (водн.) — см. CLEAPSS Hazcard HC047b.
- Водный нитрат кальция, Ca (NO 3 ) 2 (водн.) — см. CLEAPSS Hazcard HC019B.
- Водный хлорид цинка, ZnCl 2 (водный), (РАЗДРАЖАЮЩИЙ в используемой концентрации) — см. CLEAPSS Hazcard HC108a.
- Водный раствор нитрата меди, Cu (NO 3 ) 2 (водный) — см. CLEAPSS Hazcard HC027B.
- 50% концентрированная азотная кислота, HNO 3 (водный), (КОРРОЗИОННОЕ) — см. CLEAPSS Hazcard HC067 и CLEAPSS Recipe Book RB061. Он используется для очистки электродов от меди и производится путем медленного добавления концентрированной азотной кислоты к равному объему воды.
- Хлор, Cl 2 (г), (ТОКСИЧНЫЙ) — см. CLEAPSS Hazcard HC022a.
- Бром, Br 2 (л), (ТОКСИЧНЫЙ) — см. CLEAPSS Hazcard HC015a.
- Йод, I 2 (s), (TOXIC) — см. CLEAPSS Hazcard HC054.
Процедура
- Создайте таблицу для таких результатов:
Бромид калия Йодид натрия Нитрат кальция Хлорид цинка Нитрат меди Лампы? Наблюдения Катод (-) Анод (+) Тест, использованный для продукта Катод (-) Анод (+) Идентификация сформированных продуктов Катод (-) Анод (+) - Зажмите электролизер и залейте достаточное количество первого электролита так, чтобы верхние части электродов были покрыты жидкостью примерно на 1-2 см.Заполните две пробирки одним и тем же электролитом. Надев перчатки, закройте по очереди концы каждой пробирки пальцем и переверните его над электродом так, чтобы воздух не попал внутрь (см. Диаграмму). Во время электролиза может потребоваться немного приподнять пробирки, чтобы убедиться, что электроды не полностью закрыты, что препятствует протеканию тока.
- Подключите цепь и отметьте полярность каждого электрода на пробке. Перед включением цепь следует проверить.
- Включить цепь, затем:
- Посмотрите, горит ли лампа.
- Обратите внимание на вещества, образующиеся на каждом электроде — газообразные, твердые или в растворе.
- Записывайте результаты после каждого наблюдения, а не после завершения всех экспериментов.
- Выполняйте электролиз только на время, достаточное для проведения необходимых наблюдений. Излишнее продление электролиза вызывает образование токсичных газов, таких как хлор и бром, в неприемлемо опасных количествах.Немедленно отключите ток, если это станет очевидным.
- После каждого электролиза отключите ток и извлеките пробирки из ячейки, чтобы проверить присутствующие газы, медленно поднимая их по очереди, чтобы дать стечь оставшемуся раствору, прежде чем закрыть конец пальцем. Проведите испытания газов в соответствии с инструкциями.
- (Необязательно). После извлечения пробирок из ячейки быстро слейте жидкость в раковину с большим количеством воды. Протрите каждый электрод кусочком универсальной индикаторной бумаги и обратите внимание на любые изменения цвета.
- Промойте ячейку большим количеством воды и вытрите снаружи бумажным полотенцем, прежде чем закрепить ее на месте и снова подключить источник питания. Важно подключать провода в соответствии с полярностью, указанной на заглушке.
- Повторите эксперимент с каждым из четырех других растворов, стараясь соблюдать порядок, указанный в таблице. Хлорид цинка и нитрат меди должны быть последними проверяемыми электролитами. Это потому, что они откладывают твердые частицы на катоде.Если сначала подвергнуть электролизу хлорид цинка, твердый осадок на катоде можно легко удалить с помощью наждачной бумаги или погружения конца электрода в немного разбавленной соляной кислоты в химическом стакане.
Учебные заметки
Электролиз водных растворов, а не расплавленных солей, легче и безопаснее для студентов, чтобы делать их самостоятельно. К сожалению, теория более сложна, потому что присутствие воды усложняет то, что студенты могут решить, являются ли продукты образующимися на электродах.
Следите за тем, чтобы учащиеся не пытались почувствовать прямой запах выделяемых паров галогенов. Важно, чтобы вы знали всех студентов, страдающих астмой или у которых может быть аллергическая реакция на эти токсичные газы. В этом контексте не позволяйте электролизу растворов галогенидов продолжаться дольше, чем это абсолютно необходимо.
При тестировании на водород или кислород горловину пробирки можно закрыть пальцем в перчатке, а пробирку перенести в центральную зону, где был установлен единственный открытый огонь, вдали от места проведения экспериментов.Здесь также можно хранить запасы разливов для испытаний.
Что касается водородного теста, студенты могут спросить, почему почти не слышно «хлопка» или «писка». Объясните, что чистый водород — а не смесь водорода и воздуха — проверяется, если пробирка была заполнена газом до ее удаления.
При проведении кислородного теста необходимо следить за тем, чтобы сырость у горловины пробирки не гасила «свечение», вызывая неудачу теста.
После завершения электролиза хлорида цинка или нитрата меди на катоде образуется металлический осадок.Перед повторным использованием ячейки ее необходимо очистить. Эти металлические отложения можно удалить с помощью наждачной бумаги. В качестве альтернативы можно использовать небольшое количество 50% концентрированной азотной кислоты (КОРРОЗИОННОЙ) в небольшом химическом стакане для удаления меди, при условии надевания перчаток и выполнения операции в вытяжном шкафу квалифицированным специалистом. Аналогичным образом разбавленная соляная кислота удаляет цинк.
Результаты и выводы
Бромид калия Йодид натрия Нитрат кальция Хлорид цинка Нитрат меди Лампы? Есть Есть Есть Есть Есть Наблюдения Катод (-) Бесцветный газ Бесцветный газ Бесцветный газ Беловато-серый твердый осадок Красновато-коричневый твердый осадок Анод (+) Оранжево-коричневый раствор; может немного оранжевого газа Темно-коричневый раствор Бесцветный газ Крошечные пузырьки, образующиеся на электроде: очень бледно-зеленый газ, но большая часть растворяется Бесцветный газ Тест, использованный для продукта Катод (-) Газ воспламеняется от горящей шины; может быть «писк» Газ воспламеняется от горящей шины; может быть «писк» Газ воспламеняется от горящей шины; писк Внешний вид порошка Внешний вид порошка Анод (+) Универсальная индикаторная бумага становится красной и беленой Превращает раствор крахмала в синий / черный Освобождает светящуюся шину Универсальная индикаторная бумага становится красной и беленой Освобождает светящуюся шину Идентификация сформированных продуктов Катод (-) Водород Водород Водород Цинк Медь Анод (+) Бром Йод Кислород Хлор Кислород Теоретические заметки
Катодные реакции:
KBr NaI Ca (NO 3 ) 2 : 2H 2 O (л) + 2e — → H 2 (г) + 2OH — (водн.)
ZnCl 2 Cu (NO 3 ) 2 : M 2+ (водн.) + 2e — → M (s)
Анодные реакции:
KBr NaI ZnCl 2 : 2X — (водн.) → X 2 (г / водн.) + 2e —
Ca (NO 3 ) 2 Cu (NO 3 ) 2 : 2H 2 O (л) → O 2 (г) + 4H + (водный) + 4e —
Для KBr NaI и Ca (NO 3 ) 2 студенты, вероятно, спросят, почему выделяется водород, а не металл.Затем студентов можно попросить представить, что произойдет, если один из этих металлов образуется, учитывая, что это происходит в присутствии воды. В результате реакции образуется водород в качестве одного из продуктов и гидроксид металла в качестве другого. Студенты с более высокими способностями могут познакомиться с концепцией электродных потенциалов и получить подробную информацию о вероятной реакции, происходящей на катоде, показанной ранее.
В частности, с хлором и с бромом студенты обнаружат, что индикаторная бумага побелена, а также имеет признаки кислотности.Йод обычно окрашивает бумагу в коричневый цвет.
Некоторые студенты могут спросить об относительных объемах газов, выделяемых на электродах. Хотя это практическое пособие не предназначено для исследования этого, им можно сказать следующее. Объемное соотношение газообразных водорода и хлора, образующихся при электролизе NaCl, фактически составляет 1: 1. На практике ничего подобного не наблюдается, потому что хлор плохо растворяется в водных растворах, и газ не начинает собираться, пока раствор электролита не станет им насыщен.
Менее продвинутых студентов можно попросить сконцентрироваться на простых наблюдениях, например, образуется ли газ? Какие изменения pH происходят на электродах? Главный принцип, который следует подчеркнуть, заключается в том, что проводимость электричества водными растворами обусловлена движением ионов (не электронов) и что они перемещаются к электродам с противоположным зарядом.
Мощность


 е. происходит разложение воды
е. происходит разложение воды