Содержание
Углерода (IV) оксид. Мини-справочник по химическим веществам (3340 веществ)
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Синонимы:
углекислый газ
углерода диоксид
Внешний вид:
бесцветн. газ
Брутто-формула (система Хилла): CO
2
Формула в виде текста: CO2
Молекулярная масса (в а.е.м.): 44,01
Температура возгонки (в °C): -78,5
Природные и антропогенные источники:
В атмосфере Земли содержится 3 000 000 000 тонн углекислого газа.
Атмосфера Венеры в основном состоит из углекислого газа.
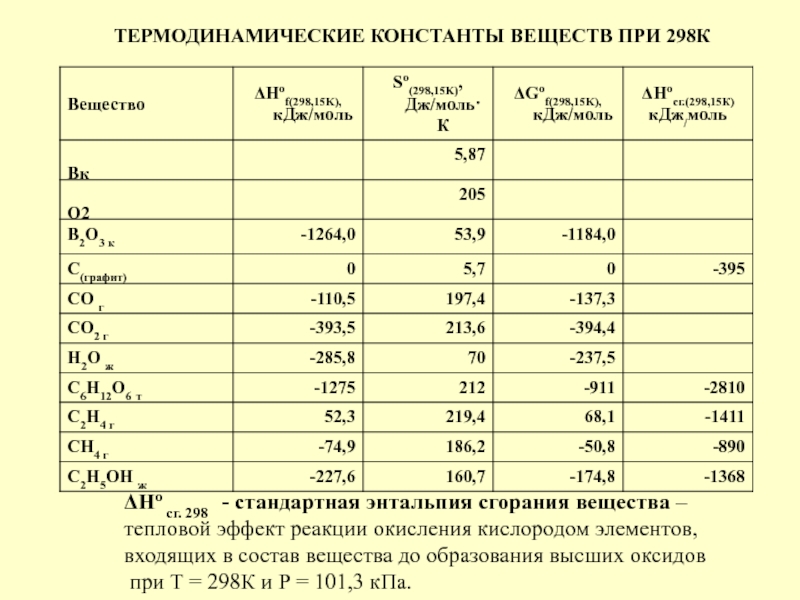
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-393,51 (г)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-394,38 (г)
Стандартная энтропия образования S (298 К, Дж/моль·K):
213,68 (г)
Стандартная мольная теплоемкость C
p (298 К, Дж/моль·K):
37,11 (г)
Энтальпия плавления ΔH
пл (кДж/моль):
8,37
Энтальпия возгонки ΔH
возг (кДж/моль):
25,23
Симптомы острого отравления:
При содержании в воздухе 3% у человека учащается дыхание, при 10% — наступает потеря сознания и быстрая смерть, при 20% — вызывает мгновенную потерю сознания.
Критическая температура (в °C):
31
Критическое давление (в МПа):
7,387
Критическая плотность (в г/см
3):
0,468
Дополнительная информация:
Способен задерживать инфракрасное излучение. Солнечный свет проходит сквозь атмосферу и нагревает поверхность земли, которая излучает инфракрасное излучение. Но при повышенном содержании углекислого газа в атмосфере тепло не уходит в космос, а нагревает атмосферу. Этот процесс получил название парникового эффекта.
Восстанавливается при 1000 С углем до оксида углерода (II).
- Девяткин В.В., Ляхова Ю.М. «Химия для любознательных, или о чем не узнаешь на уроке» Ярославль:Академия Холдинг, 2000 стр. 39, 40, 46-47, 62-63
- Иванова М.А., Кононова М.А. «Химический демонстрационный эксперимент» М.: Высшая школа, 1969 стр. 50-51
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 106
Источники информации:
Алф. указатель:
указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Каталог уникальных научных установок
Вакуумный насос НВЗ-300
Фирма-изготовитель:
Сумской насосный завод
Страна происхождения фирмы-изготовителя:
Украина
Год выпуска:
1984
Количество единиц:
1
Назначение, краткая характеристика: Оборудование для получения низкого давления в барокамере плазмотронов ВГУ-3 и ВГУ-4
Весы аналитические ВЛ-124В
Фирма-изготовитель:
ООО «НПП Госметр»
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2020
Количество единиц:
1
Назначение, краткая характеристика: Прибор для взвешивания образцов материалов до и после испытаний в потоках плазмы в ВЧ-плазмотронах ВГУ-3 и ВГУ-4
Внешний модуль АЦП-Е-270
Фирма-изготовитель:
L-Card
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2007
Количество единиц:
3
Назначение, краткая характеристика: Устройство для сбора и передачи данных измерений
Датчик давления АИР-10Д2
Фирма-изготовитель:
Элемер
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2014
Количество единиц:
2
Назначение, краткая характеристика: Прибор для измерения давления в барокамере плазмотона
Датчик давления АИР-20ДА/М2
Фирма-изготовитель:
Элемер
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2014
Количество единиц:
4
Назначение, краткая характеристика: Прибор для измерения давления в барокамере плазмотрона
Датчик давления АИР-20ДД/М2
Фирма-изготовитель:
Элемер
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2014
Количество единиц:
2
Назначение, краткая характеристика: Предназначен для измерения давления в барокамере плазмотрона
Лампа генераторная ГУ-66А
Фирма-изготовитель:
ООО «Вакуумный контур»
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2020
Количество единиц:
1
Назначение, краткая характеристика: Элемент системы для генерации и поддержания газового разряда в ВЧ-плазмотроне ВГУ-4
Пирометр Micron M770S
Фирма-изготовитель:
Raytek
Страна происхождения фирмы-изготовителя:
Соединённые Штаты Америки
Год выпуска:
2010
Количество единиц:
1
Назначение, краткая характеристика: Предназначен для измерений температуры поверхности материалов при испытаниях в потоках плазмы
Пирометр инфракрасный Кельвин 1200/175Д
Фирма-изготовитель:
ЗАО «Евромикс»
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2015
Количество единиц:
1
Назначение, краткая характеристика: Предназначен для измерений температуры поверхности материалов при испытаниях в потоках плазмы
Пирометр Кельвин-2100
Фирма-изготовитель:
ЗАО «Евромикс»
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2012
Количество единиц:
2
Назначение, краткая характеристика: Предназначен для измерений температуры поверхности материалов при испытаниях в потоках плазмы
Пирометр спектрального отношения Термоконт-ТЦ5С8М
Фирма-изготовитель:
АНО НТП «Термоконт»
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2020
Количество единиц:
1
Назначение, краткая характеристика: Прибор для измерения температуры поверхности образцов материалов при обтекании потоками плазмы в ВЧ-плазмотронах ВГУ-3 и ВГУ-4
Плазмотроны ВГУ-3 и ВГУ-4
Фирма-изготовитель:
ИПМех РАН
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
1988
Количество единиц:
1
Назначение, краткая характеристика: Высокочастотные газодинамические установки для получения высокоэнтальпийных потоков плазмы
Расходомер контроллер MKV-306
Фирма-изготовитель:
Bronkhorst
Страна происхождения фирмы-изготовителя:
Нидерланды
Год выпуска:
2013
Количество единиц:
2
Назначение, краткая характеристика: Прибор для измерения расхода газов в разрядных каналов плазмотронов ВГУ
Расходомер контроллер MKV-396
Фирма-изготовитель:
Bronkhorst
Страна происхождения фирмы-изготовителя:
Нидерланды
Год выпуска:
2014
Количество единиц:
1
Назначение, краткая характеристика: Прибор для измерений расхода газов в разрядном канале плазмотронов ВГУ
Спектрометр HR-400
Фирма-изготовитель:
Ocean Optics
Страна происхождения фирмы-изготовителя:
Соединённые Штаты Америки
Год выпуска:
2010
Количество единиц:
1
Назначение, краткая характеристика: Предназначен для регистрации излучения плазмы
Спектрометр SP-558 с оптическим детектором на ПЗС-матрице (OMA-V)
Фирма-изготовитель:
Acton Research
Страна происхождения фирмы-изготовителя:
Соединённые Штаты Америки
Год выпуска:
2000
Количество единиц:
1
Назначение, краткая характеристика: Предназначен для регистрации излучения плазмы
Термовизор
Фирма-изготовитель:
ООО ПК ЭЛГОРА
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2018
Количество единиц:
1
Назначение, краткая характеристика: Прибор для измерения поля температуры поверхности
Термовизор Тандем VS-415
Фирма-изготовитель:
ООО Компания «Си Эн Техно»
Страна происхождения фирмы-изготовителя:
Россия
Год выпуска:
2009
Количество единиц:
1
Назначение, краткая характеристика: Предназначен для измерения поверхности материалов при испытаниях в потоках плазмы
Карта сайта — Мордовский государственный университет им.
 Н.П. Огарева
Н.П. Огарева
Array
(
[0] => Array
(
[TEXT] => Университет
[LINK] => /ru/university/
[SELECTED] =>
[PERMISSION] => R
[ADDITIONAL_LINKS] => Array
(
)
[ITEM_TYPE] => D
[ITEM_INDEX] => 0
[PARAMS] => Array
(
)
[DEPTH_LEVEL] => 1
[IS_PARENT] =>
)
[1] => Array
(
[TEXT] => Образование
[LINK] => /ru/education/
[SELECTED] =>
[PERMISSION] => R
[ADDITIONAL_LINKS] => Array
(
)
[ITEM_TYPE] => D
[ITEM_INDEX] => 1
[PARAMS] => Array
(
)
[DEPTH_LEVEL] => 1
[IS_PARENT] =>
)
[2] => Array
(
[TEXT] => Наука и инновации
[LINK] => /ru/sci/
[SELECTED] =>
[PERMISSION] => R
[ADDITIONAL_LINKS] => Array
(
)
[ITEM_TYPE] => D
[ITEM_INDEX] => 2
[PARAMS] => Array
(
)
[DEPTH_LEVEL] => 1
[IS_PARENT] =>
)
[3] => Array
(
[TEXT] => Международные связи
[LINK] => /ru/international/
[SELECTED] =>
[PERMISSION] => R
[ADDITIONAL_LINKS] => Array
(
)
[ITEM_TYPE] => D
[ITEM_INDEX] => 3
[PARAMS] => Array
(
)
[DEPTH_LEVEL] => 1
[IS_PARENT] =>
)
[4] => Array
(
[TEXT] => Студенту
[LINK] => /ru/student/
[SELECTED] =>
[PERMISSION] => R
[ADDITIONAL_LINKS] => Array
(
)
[ITEM_TYPE] => D
[ITEM_INDEX] => 4
[PARAMS] => Array
(
)
[DEPTH_LEVEL] => 1
[IS_PARENT] =>
)
[5] => Array
(
[TEXT] => Абитуриенту
[LINK] => /ru/abiturs/
[SELECTED] =>
[PERMISSION] => R
[ADDITIONAL_LINKS] => Array
(
)
[ITEM_TYPE] => D
[ITEM_INDEX] => 5
[PARAMS] => Array
(
)
[DEPTH_LEVEL] => 1
[IS_PARENT] =>
)
[6] => Array
(
[TEXT] => Документы
[LINK] => /ru/university/documentation/
[SELECTED] =>
[PERMISSION] => R
[ADDITIONAL_LINKS] => Array
(
)
[ITEM_TYPE] => D
[ITEM_INDEX] => 6
[PARAMS] => Array
(
)
[DEPTH_LEVEL] => 1
[IS_PARENT] =>
)
[7] => Array
(
[TEXT] => Страница ректора
[LINK] => /ru/rector/
[SELECTED] =>
[PERMISSION] => R
[ADDITIONAL_LINKS] => Array
(
)
[ITEM_TYPE] => D
[ITEM_INDEX] => 7
[PARAMS] => Array
(
)
[DEPTH_LEVEL] => 1
[IS_PARENT] =>
)
)
|
Физические свойства углекислоты
Углекислота (СО2, двуокись углерода, диоксид углерода) – вещество с химическое формулой СО2 и молекулярной массой 44,011 г/моль, которое может существовать в четырёх фазовых состояниях – газообразном, жидком, твёрдом и сверхкритическом. Газообразное состояние СО2 носит общеупотребительное название «углекислый газ». При атмосферном давлении это бесцветный газ без цвета и запаха, при температуре +20 ?С плотностью 1,839 кг/м? (в 1,52 раза тяжелее воздуха), хорошо растворяется в воде (0,88 объёма в 1 объёме воды), частично взаимодействуя в ней с образованием угольной кислоты. Газообразный диоксид углерода ранее нередко хранили в стационарных газгольдерах. В настоящее время такой способ хранения не применяется; углекислый газ в необходимом количестве получают непосредственно на месте – путём испарения жидкой углекислоты в газификаторе. Далее газ можно легко перекачать по любому газопроводу под давлением 2-6 атмосфер. Жидкое состояние СО2 носит техническое название «жидкая углекислота» или просто «углекислота». Это бесцветная жидкость без запаха, средней плотностью 771 кг/м3, которая существует только под давлением 3 482…519 кПа при температуре 0…-56,5 град.С («низкотемпературная углекислота»), либо под давлением 3 482…7 383 кПа при температуре 0…+31,0 град.С («углекислота высокого давления»). Углекислоту высокого давления получают чаще всего путём сжатия углекислого газа до давления конденсации, при одновременном охлаждении водой. При небольшом и среднем потреблении углекислоты (высокого давления),т для её хранения и транспортировки используют разнообразные стальные баллоны (от баллончиков для бытовых сифонов до ёмкостей вместимостью 55 л). Самым распространенным является 40 л баллон с рабочим давление 15 000 кПа, вмещающим 24 кг углекислоты. За стальными баллонами не требуется дополнительный уход, углекислота сохраняется без потерь в течение длительного времени. Баллоны с углекислотой высокого давления окрашивают в чёрный цвет. При значительном потреблении, для хранения и транспортировки низкотемпературной жидкой углекислоты используют изотермические цистерны самой разнообразной вместимости, оснащённые служебными холодильными установками. Существуют накопительные (стационарные) вертикальные и горизонтальные цистерны вместимостью от 3 до 250 т, транспортируемые цистерны вместимостью от 3 до 18 т. При мгновенном снижении давления до атмосферного, происходящем при впрыске в специальную расширительную камеру (дросселировании), жидкий диоксид углерода мгновенно превращается в газ и тончайшую снегообразную массу, которую прессуют и получают диоксид углерода в твёрдом состоянии, который носит общеупотребительное название «сухой лёд». При атмосферном давлении это белая стекловидная масса плотностью 1 562 кг/м?, с температурой -78,5 ?С, которая на открытом воздухе сублимируется – постепенно испаряется, минуя жидкое состояние. Сухой лёд может быть также получен непосредственно на установках высокого давления, применяемых для получения низкотемпературной углекислоты, из газовых смесей, содержащих СО2 в количестве не менее 75-80%. Объёмная холодопроизводительность сухого льда почти в 3 раза больше, чем у водяного льда, и составляет 573,6 кДж/кг. Твёрдый диоксид углерода обычно выпускают в брикетах размером 200?100?20-70 мм, в гранулах диаметром 3, 6, 10, 12 и 16 мм, редко в виде тончайшего порошка («сухой снег»). При давлении свыше 7,39 кПа и температуре более 31,6 град.С диоксид углерода находится в так называемом сверхкритическом состоянии, при котором его плотность как у жидкости, а вязкость и поверхностное натяжение как у газа. Эта необычная физическая субстанция (флюид) является отличным неполярным растворителем. Сверхкритический CO2 способен полностью или выборочно экстрагировать любые неполярные составляющие с молекулярной массой менее 2 000 дальтон: терпеновые соединения, воски, пигменты, высокомолекулярные насыщенные и ненасыщенные жирные кислоты, алкалоиды, жирорастворимые витамины и фитостерины.
Техника безопасности По степени воздействия на организм человека газообразный диоксид углерода относится к 4-му классу опасности по ГОСТу 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности». Предельно допустимая концентрация в воздухе рабочей зоны не установлена, при оценке этой концентрации следует ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5%. При применении сухого льда, при использовании сосудов с жидкой низкотемпературной углекислотой должно обеспечиваться соблюдение мер безопасности, предупреждающих обморожение рук и других участков тела работника. |
3.6: Термохимия — Химия LibreTexts
Стандартная энтальпия образования определяется как изменение энтальпии, когда один моль вещества в стандартном состоянии (1 атм давления и 298,15 К) образуется из его чистых элементов в тех же условиях. .
Введение
Стандартная энтальпия образования — это мера энергии, выделяемой или потребляемой, когда один моль вещества создается при стандартных условиях из его чистых элементов. Условное обозначение стандартной энтальпии образования ΔH f .o (Реагенты)} \]
Это уравнение по существу утверждает, что стандартная энтальпия изменения образования равна сумме стандартных энтальпий образования продуктов минус суммы стандартных энтальпий образования реагентов .
Пример \ (\ PageIndex {1} \)
Дано простое химическое уравнение с переменными A, B и C, представляющими различные соединения:
\ (A + B \ leftrightharpoons C \)
и стандартные значения энтальпии образования:
- ΔH f o [A] = 433 кДж / моль
- ΔH f o [B] = -256 кДж / моль
- ΔH f o [C] = 523 кДж / моль
уравнение для стандартного изменения энтальпии образования выглядит следующим образом:
ΔH реакция o = ΔH f o [C] — (ΔH f o [A] + ΔH f o [B])
ΔH реакция o = (1 моль) (523 кДж / моль) — ((1 моль) (433 кДж / моль) + (1 моль) (- 256 кДж / моль) \)
Поскольку на каждый из A, B и C приходится по одному молью, стандартная энтальпия образования каждого реагента и продукта умножается на 1 моль, что исключает моль знаменателя:
ΔH реакция o = 346 кДж
Результат составляет 346 кДж, что является стандартным изменением энтальпии образования для создания переменной «C».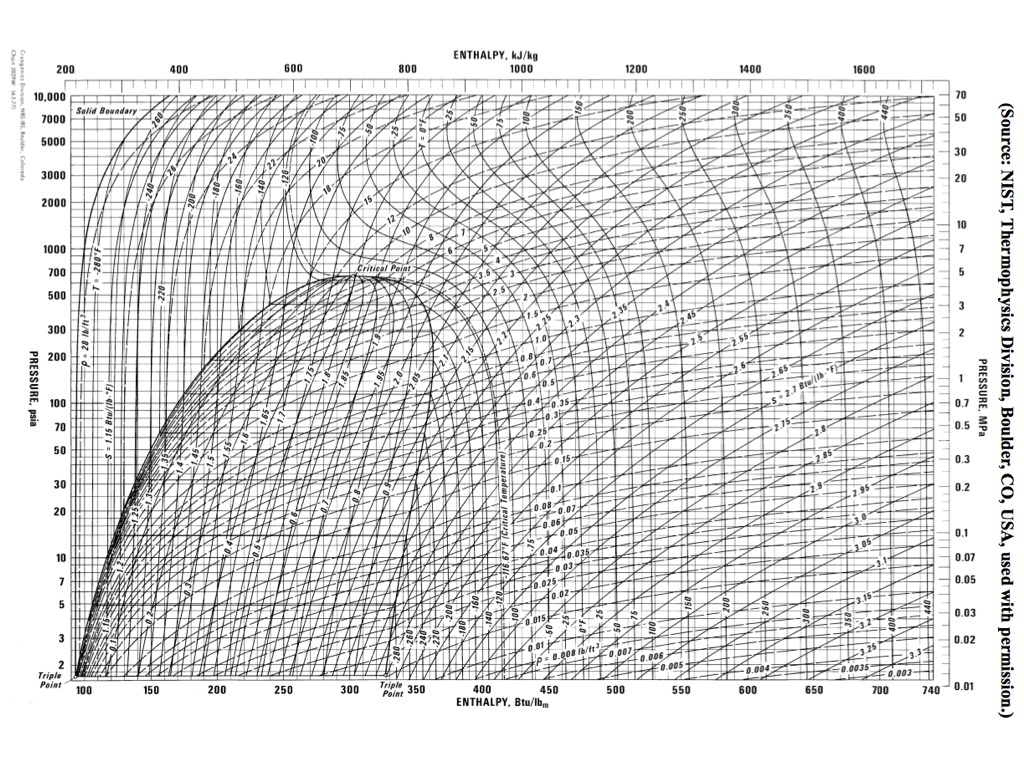
Стандартная энтальпия образования чистого элемента в эталонной форме, его стандартная энтальпия образования составляет ноль .
Углерод естественным образом существует в виде графита и алмаза. Разница энтальпий между графитом и алмазом слишком велика, чтобы у обоих была стандартная энтальпия образования, равная нулю. Чтобы определить, какая форма равна нулю, выбирается более устойчивая форма углерода. Это также форма с самой низкой энтальпией, поэтому графит имеет стандартную энтальпию образования, равную нулю.В таблице 1 приведены примерные значения стандартных энтальпий образования различных соединений.
| Соединение | ΔH f o |
|---|---|
| O 2 (г) | 0 кДж / моль |
| C (графит) | 0 кДж / моль |
| CO (г) | -110. 5 кДж / моль 5 кДж / моль |
| CO 2 (г) | -393,5 кДж / моль |
| H 2 (г) | 0 кДж / моль |
| H 2 O (г) | -241,8 кДж / моль |
| HF (г) | -271,1 кДж / моль |
| НЕТ (г) | 90,25 кДж / моль |
| НЕТ 2 (г) | 33.18 кДж / моль |
| N 2 O 4 (г) | 9,16 кДж / моль |
| SO 2 (г) | -296,8 кДж / моль |
| SO 3 (г) | -395,7 кДж / моль |
Все значения даны в единицах кДж / моль и физических условиях 298,15 К и 1 атм, называемых «стандартным состоянием». Это условия, при которых обычно задаются значения стандартных энтальпий образования.Обратите внимание, что хотя большинство значений стандартных энтальпий образования являются экзотермическими или отрицательными, есть несколько соединений, таких как NO (г) и N 2 O 4 (г), которые фактически требуют энергии из окружающей среды во время его формирование; эти эндотермические соединения обычно нестабильны.
Это условия, при которых обычно задаются значения стандартных энтальпий образования.Обратите внимание, что хотя большинство значений стандартных энтальпий образования являются экзотермическими или отрицательными, есть несколько соединений, таких как NO (г) и N 2 O 4 (г), которые фактически требуют энергии из окружающей среды во время его формирование; эти эндотермические соединения обычно нестабильны.
Пример \ (\ PageIndex {2} \)
Между Br 2 (л) и Br 2 (г) при 298,15 К какое вещество имеет ненулевую стандартную энтальпию образования?
Решение
Br 2 (l) — более устойчивая форма, что означает, что она имеет более низкую энтальпию; таким образом, Br 2 (l) имеет ΔH f = 0.Следовательно, Br 2 (г) имеет ненулевую стандартную энтальпию образования.
Примечание: элемент фосфор — уникальный случай. Контрольной формой фосфора является не самая стабильная форма, красный фосфор, а менее стабильная форма, белый фосфор.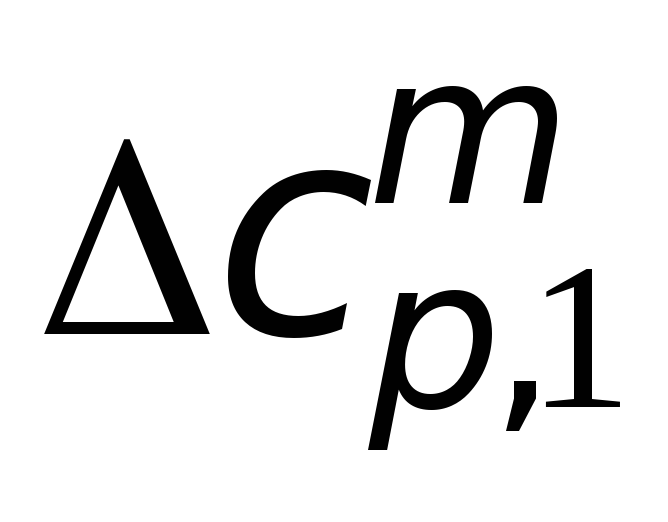 o (Реагенты)} \]
o (Реагенты)} \]
Подстановка уравнения для образования CO 2 дает следующее:
ΔH реакция o = ΔH f o [CO 2 (г)] — (ΔH f o [O 2 (г)] + ΔH f o [C (графит)]
Поскольку O 2 (г) и C (графит) находятся в наиболее элементарно стабильных формах, каждая из них имеет стандартную энтальпию образования, равную 0:
.
ΔH реакция o = -393.5 кДж = ΔH f o [CO 2 (г)] — ((1 моль) (0 кДж / моль) + (1 моль) (0 кДж / моль))
ΔH f o [CO 2 (г)] = -393,5 кДж
Пример \ (\ PageIndex {4} \)
Используя значения в приведенной выше таблице стандартных энтальпий образования, рассчитайте ΔH реакции o для образования NO 2 (г).
Решение
\ (NO_ {2 (g)} \) образуется из комбинации \ (NO _ {(g)} \) и \ (O_ {2 (g)} \) в следующей реакции:
\ (2НО (г) + O_ {2} (г) \ leftrightharpoons 2НО_ {2} (г) \)
Чтобы найти ΔH реакции o , используйте формулу для стандартного изменения энтальпии образования:
\ [\ Delta H_ {реакция} ^ o = \ sum {\ Delta H_ {f} ^ o (продукты)} — \ sum {\ Delta H_ {f} ^ o (Реагенты)} \]
Соответствующие стандартные значения энтальпии образования из таблицы 1 составляют:
- O 2 (г): 0 кДж / моль
- НЕТ (г): 90.
 о = -114,1 \; кДж \]
о = -114,1 \; кДж \]Закон Кирхгофа описывает энтальпию изменения реакции при изменении температуры. Как правило, энтальпия любого вещества увеличивается с температурой, что означает увеличение энтальпии как продуктов, так и реагентов. Общая энтальпия реакции изменится, если увеличение энтальпии продуктов и реагентов будет другим.
Закон Кирхгофа — энтальпия зависит от температуры
При постоянном давлении теплоемкость равна изменению энтальпии, деленному на изменение температуры.
\ [c_p = \ dfrac {\ Delta H} {\ Delta T} \ label {1} \]
Следовательно, если теплоемкости не меняются с температурой, то изменение энтальпии является функцией разницы в температуре и теплоемкости. Величина, на которую изменяется энтальпия, пропорциональна произведению изменения температуры и изменения теплоемкости продуктов и реагентов. Взвешенная сумма используется для расчета изменения теплоемкости, чтобы включить соотношение участвующих молекул, поскольку все молекулы имеют разную теплоемкость в разных состояниях.{T_f} c_ {p} dT \ label {2} \]
Если теплоемкость не зависит от температуры во всем диапазоне температур, то уравнение \ ref {1} можно приблизительно представить как
\ [H_ {T_f} = H_ {T_i} + c_ {p} (T_ {f} -T_ {i}) \ label {3} \]
с
- \ (c_ {p} \) — (предполагаемая постоянная) теплоемкость, а
- \ (H_ {T_ {i}} \) и \ (H_ {T_ {f}} \) — энтальпия при соответствующих температурах.
Уравнение \ ref {3} может применяться только к небольшим изменениям температуры (<100 K), потому что при больших изменениях температуры теплоемкость не является постоянной.Существует множество биохимических приложений, потому что это позволяет нам прогнозировать изменения энтальпии при других температурах, используя стандартные данные энтальпии.
Идеальная энтальпия диоксида углерода (CO2) в газе
Энтальпия идеального газа для диоксида углерода (CO2) — (Обновлено 18.01.09)
Идеальная энтальпия диоксида углерода в газе
(CO2)Энтальпия образования: -393,522
(кДж / кмоль)
Молекулярный вес: 44,01 (кг / кмоль)Темп. [K]
Энтальпия [кДж / кмоль]
Темп.[K]
Энтальпия [кДж / кмоль]
Темп. [K]
Энтальпия [кДж / кмоль]
Темп. [K]
Энтальпия [кДж / кмоль]
298
0
300
67
650
15310
1000
33432
1700
73492
310
443
660
15796
1020
34495
1720
74679
320
822
670
16284
1040
35589
1740
75867
330
1206
680
16774
1060
36687
1760
77056
340
1595
690
17267
1080
37789
1780
78248
350
1987
700
17761
1100
38894
1800
79442
360
2384
710
18258
1120
40005
1820
80636
370
2784
720
18757
1140
41120
1840
81832
380
3188
730
19258
1160
42238
1860
83030
390
3596
740
19760
1180
43060
1880
84229
400
4008
750
20265
1200
44484
1900
85429
410
4423
760
19771
1220
45613
1920
86631
420
4842
770
21280
1240
46744
1940
87833
430
4964
780
21790
1260
47880
1960
89037
440
5690
790
21801
1280
49017
1980
450
6119
800
22815
1300
50158
2000
460
6552
810
23330
1320
51302
2050
94471
470
6987
820
23848
1340
52449
2100
97500
480
7427
830
24366
1360
53599
2150
100534
490
7868
840
24887
1380
54752
2200
103575
500
8314
850
25409
1400
55907
2250
106620
510
8762
860
25932
1420
57063
2300
109671
520
9212
870
26457
1440
58222
2350
112727
530
9665
880
26983
1460
59384
2400
115788
540
10121
890
27512
1480
57547
2450
118855
550
10581
900
28041
1500
61714
2500
121926
560
11043
910
28571
1520
62882
2550
125004
570
11506
920
29103
1540
64053
2600
128085
580
11973
930
29636
1560
65226
2650
131169
590
12443
940
30171
1580
67403
2700
134256
600
12916
950
30706
1600
67580
2750
137349
610
13390
960
31243
1620
68759
2800
140444
620
13867
970
31781
1640
69939
2850
143544
630
14345
980
32321
1660
71122
2900
146645
640
14826
990
32862
1680
72306
3000
152862
Адаптировано из TEST
( т он
E xpert
S система
для Т гермодинамика)
< www.thermofluids.net >
С.Бхаттачарджи, Государственный университет Сан-Диего,Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.CO2: энтальпия сублимации, реакции и метаболизма
С. Ф. Зонтум и К. Джуэтт (под редакцией Р. Сандвика)
Введение
Оксиды углерода как нельзя более химически различны. Окись углерода (CO) — это полярный щелочной газ, который прочно связывается с металлами, а двуокись углерода (CO 2 ) — неполярный газ, который вступает в реакцию с водой. Окись углерода образуется, когда углеводороды сжигаются в ограниченном количестве кислорода, а двуокись углерода образуется, когда углеводороды сжигаются в избытке кислорода.Окись углерода — смертельный яд, тогда как углекислый газ необходим для метаболизма растений и животных.
Двуокись углерода — четвертый по распространенности газ в нашей атмосфере, и его концентрация постоянно увеличивается. Углекислый газ в атмосфере играет важную роль в поддержании температуры поверхности. Это один из «парниковых» газов, вызывающих глобальное потепление. Биологические процессы метаболизма, который производит углекислый газ, и фотосинтез, который потребляет углекислый газ, функционируют для поддержания уровня углекислого газа в нашей атмосфере.Промышленная революция изменила этот баланс. Концентрация углекислого газа увеличилась более чем на 30% до сегодняшнего значения 400 частей на миллион. Глобальные температуры повышаются.
В этом эксперименте основное внимание уделяется физическому свойству CO 2 — его энергосодержанию и химическому свойству CO 2 — его способности растворяться в воде, делая раствор кислым. Как и все молекулы, CO 2 хранит потенциальную энергию в молекулярных связях, которые удерживают кислород на углероде, и в межмолекулярных силах между молекулами.Мы будем измерять теплоту сублимации сухого льда, чтобы исследовать межмолекулярные силы между молекулами CO 2 .
Фазовые диаграммы ниже показывают стабильные формы соединений при различных давлениях P и температурах T. Линии описывают, когда две фазы находятся в равновесии, а тройная точка — это место, где все три фазы могут сосуществовать в равновесии. Например, тройная точка воды возникает при 0,01 o C и 0,006 атм. Для превращения льда непосредственно в пар парциальное давление воды должно быть ниже 0.006 атм. Поскольку мы живем при более высоком давлении (то есть при 1 атм), мы всегда видим, как тает лед, прежде чем он испарится в пар. Процесс превращения твердого вещества в жидкость называется плавлением (или плавлением). С другой стороны, тройная точка углекислого газа возникает при гораздо более высоком давлении и более низкой температуре, -57 o ° C и 5,11 атм. Мы называем твердый диоксид углерода «сухим льдом», потому что при нормальном атмосферном давлении он превращается непосредственно из твердого вещества в газ. Процесс превращения твердого вещества в газ называется сублимацией .И плавление, и сублимация требуют подвода тепла.
Фазовые диаграммы
Калориметрия
Когда твердое вещество нагревается, оно поглощает тепловую энергию, и его температура повышается. Когда достигается точка плавления вещества, добавление дополнительной тепловой энергии разрушает силы, удерживающие твердое тело вместе, и начинает образовываться жидкость. Устанавливается баланс между твердым телом и жидкостью, и по мере добавления тепловой энергии температура остается постоянной, в то время как количество твердого вещества уменьшается, а количество жидкости увеличивается.Тепло, поглощаемое при плавлении одного моля твердого вещества при постоянном давлении, называется молярной энтальпией плавления (Δ H fus ). Когда тепло поглощается, знак Δ H fus условно равен положительным . Реакции с поглощением тепла называются эндотермическими реакциями. Те, которые выделяют тепло, считаются экзотермическими.
На молекулярном уровне, когда лед поглощает тепло, происходит множество процессов: упорядоченный массив молекул в кристаллической решетке твердого тела распадается на набор подвижных, неупорядоченных молекул жидкой фазы.Молекулы воды во льду также теряют потенциальную энергию, связанную с межмолекулярными силами между молекулами, и приобретают кинетическую энергию движения. Между тем, температура воды, связанная со средней кинетической энергией движения, повышается по мере того, как молекулы движутся и колеблются быстрее.
Изменение внутренней энергии реакции Δ E rxn можно измерить, запустив реакцию в калориметре бомбы постоянного объема. При проектировании калориметра таким образом, чтобы тепло не поступало в окружающую среду, тепло, поглощаемое реакцией, должно равняться теплу, потерянному калориметром.Тепло, поглощаемое калориметром, можно измерить по теплоемкости калориметра ( C калориметр ), умноженной на изменение температуры.
Δ E rxn = — C калориметр Δ T
Таяние льда или сублимация углекислого газа — это не процесс постоянного объема, а процесс постоянного давления. Чтобы исследовать тепловые потоки в процессе постоянного давления, нам нужно будет определить новую форму внутренней энергии, называемую энтальпией, H .При постоянном давлении изменение энтальпии связано с изменением внутренней энергии за вычетом работы, совершаемой системой из-за изменения объема (Δ V ).
ΔH = ΔE + Δ (PV) = ΔE + PΔV
При постоянном давлении изменения энтальпии являются прямой мерой тепла, поглощаемого системой. Изменения энтальпии легче измерить, чем изменения внутренней энергии, потому что легче поддерживать постоянное давление, чем постоянный объем.
Схема калориметра постоянного давления
Δ H измеряется калориметром, где количество протекающего тепла отражается в изменении температуры известной массы воды.Фактически, единица энергии, калория, была определена как количество тепла, которое повысит температуру одного грамма чистой воды на один градус Цельсия. Хотя калория является удобной единицей энергии, научное сообщество теперь использует джоуль в качестве стандартной единицы энергии. (1 кал = 4,184 Дж) Предполагая отсутствие потерь тепла во время передачи, тепло реакции будет эквивалентно теплу, поглощаемому г г воды при повышении температуры Δ T градусов Цельсия, или
Δ H rxn = — г H 2 O (4.184 Дж / г H 2 O o C) Δ T
Это основное уравнение, описывающее калориметр с раствором , предназначенный для измерения изменения энтальпии во время процесса с постоянным давлением.
Энтальпия реакции (см. Закон Гесса в учебнике)
Иногда трудно или даже невозможно напрямую измерить энтальпию образования. В этом эксперименте мы будем определять энтальпию образования CO 3 2- (водн.) .
C (т) + 3/2 O 2 (г) + 2 e — → CO 3 2-
5 (водн.)
Прямое измерение путем сжигания C (s) в кислороде не даст нам карбоната, поэтому мы будем использовать косвенный метод. Согласно закону Гесса (сохранение энтальпии), если две или более реакций могут быть добавлены для получения итоговой реакции, Δ H для чистой реакции представляет собой просто сумму Δ H ‘ с для реакций, которые являются добавлено (энергия аддитивна).Рассмотрим следующие четыре реакции:
(1) 2H + (водн.) + 2e- → H 2 (г) Δ h2
(2) CO 3 2- (водн.) → C (т.) +3/2 O 2 (г) + 2e- Δ h3
(3) H 2 (г) + 1/2 O2 (г) → H 2 O (л) Δ h4
(4) C (с) + O 2 (г) → CO 2 (водн.) Δ h5
(5) 2H + (водн.) + CO 3 2- (водн.) → H 2 O (л) + CO 2 (водн.)
Δ H5 = Δ h2 + Δ h3 + Δ h4 + Δ h5
Вы измеряете Δ H 5 напрямую.Мы объединим это с литературными значениями теплоты образования H + (водн.) , H 2 O ( л ) и CO 2 (водн.) .
h3 (г) + 1/2 O 2 (г) (г) → H 2 O (л)
Δ h4 = Δ H f o (H 2 O (l)) = -285,83 кДж / моль
C (т.) + O 2 (г) (г) → CO 2 (водн.)
Δ h5 = Δ H f o (CO 2 (водн.)) = -413.80 кДж / моль
H 2 (г) → 2 H + (водн.) + 2 e-
-Δ h2 = 2 x (Δ H f o (H + (aq)) = 2 x 0 кДж / моль
Таким образом, вы сможете рассчитать Δ H 2 , которая представляет собой энтальпию образования CO 3 2- (водн.) реакция, записанная в обратном порядке.
Калориметрия бомбы
Не люблю эту бомбу
Как мы уже говорили выше, дневная норма калорий взрослого человека составляет около 3000 ккал / день.Для поддержания энергетического баланса средний взрослый человек потребляет шесть тонн твердой пищи в течение 40 лет, что составляет около 12,5 г / час. Обычно мы получаем треть нашей энергии из каждого основного пищевого вещества — углеводов, белков и жиров. Среднее энтальпийное содержание углеводов и белков примерно одинаково (4 ккал / г), а у жиров в среднем вдвое больше (9 ккал / г). Мы будем измерять калорийность пищи напрямую с помощью калориметра бомбы. Мы пропустим образец пищи весом один грамм в калориметре бомбы, определим ее теплоту сгорания и сравним ее с калорийностью, указанной на упаковке.
Экспериментальные процедуры
Часть 1 Энтальпия сублимации
Очистите, просушите и взвесьте калориметр (2 стакана из пенопласта, одна внутри другой — во внутренней чашке будет ряд отверстий, а также крышка с одним закрытым отверстием).
Заполните мерную колбу на 100 мл до метки дистиллированной водой, доведенной до комнатной температуры, и взвесьте ее. Осторожно поместите резиновую пробку с разрезными отверстиями на верхнюю часть высокоточного термометра .Осторожно вставьте термометр в мерную колбу и стабилизируйте термометр, прикрепив пробку с разрезным отверстием к кольцевой стойке с помощью зажима горелки Бунзена. Запишите стабильную температуру; это начальная температура воды.
После того, как вы взвесили калориметр и измерили стабильное показание температуры, возьмите кусочек CO 2 (от 2 до 10 граммов) с помощью пинцета, поместите его между двумя чашками и взвесьте всю сборку. Масса будет катиться вниз по мере того, как она сублимируется, поэтому через несколько секунд запишите массу, не беспокоясь о последней цифре, немедленно верните сборку на свою станцию, где ваш партнер подготовит термометр, чтобы вставить его через крышку. .Налейте 100 мл воды в чашки, закройте крышку и осторожно надавите, стараясь не пролить слишком много воды, когда она просочится в нижнюю чашку. Повторно взвесьте мерную колбу, чтобы определить массу перенесенной воды.
Даже если вы видите, что ваша система «дымит», «дым» не должен быть холодным на ощупь, поскольку газ CO 2 должен поглощать тепло воды, проходящей через нее. Осторожно покрутите чашки, снова убедившись, что обе чашки держатся вместе, насколько это возможно, и не снимайте крышку.Следите за перепадом температуры. Когда он стабилизируется и вы не почувствуете пузырьков в растворе, снова покрутите его и посмотрите в калориметр. Если облачно, вернитесь к вращению. Если ясно, запишите стабилизированную температуру.
Опорожните калориметр, а тщательно осушите чашки, крышку и термометр. Повторите эксперимент. Рассчитайте энтальпию.
Расчеты: Тепло, полученное CO 2 (Δ H sub ), равно теплу, выделяемому водой.Зная, что удельная теплоемкость воды составляет 4,184 Дж / г -1 C o , рассчитайте среднее Δ H sub / г CO 2 и среднее Δ H sub / моль CO 2 . Сравните с литературными данными.
Часть 2 Энтальпия реакции образования H 2 O и CO 2 из CO 3 2- и H +
Калориметр и термометр представляют собой две маленькие чашки одинакового размера без отверстий.Ополосните внутреннюю чашку калориметра дистиллированной водой и тщательно высушите чашку, крышку, термометр и мешалку.
- Получите по 100 мл каждого из 1,00 M раствора K 2 CO 3 и 3 M HCl в чистые, сухие, маркированные стаканы.
- Добавьте ровно 50,0 мл ваших растворов в каждую из двух мерных колб на 50 мл. Взвесьте оба. Загрузите в калориметр 50,0 мл 3 M HCl, затем повторно взвесьте мерную колбу.Поместите термометр в 50 мл раствора K 2 CO 3 и определите начальную температуру. Промойте термометр и соберите калориметр (термометр и крышку).
- Начните измерение температуры раствора HCl и запишите температуру каждые 15 секунд . После стабилизации температуры (три последовательных измерения) добавьте раствор K 2 CO 3 в умеренном темпе, чтобы он не пузырился (но в течение 10 секунд), затем снова накройте калориметр.Вращайте раствор, чтобы высвободить весь CO 2 , и продолжайте регистрировать температуру, пока она не станет примерно постоянной для нескольких измерений (в конце вы можете увидеть небольшое снижение из-за утечки тепла). Повторно взвесьте мерную колбу K 2 CO 3 на 50,0 мл, чтобы определить, сколько было перенесено.
Осторожно опорожните калориметр и очистите чашку, крышку и термометр. Сполосните чашку дистиллированной водой. Тщательно просушите все детали. Повторите эксперимент еще раз.Запишите свои данные в таблицу.
Расчеты: Предположим, что смесь двух растворов имеет ту же удельную теплоемкость, что и вода (4,184 Дж г -1 C o ), и выполните расчет, аналогичный Части 1, чтобы определить Δ H rxn , а затем Δ H rxn / моль CO 3 2-. (Это Δ H 5 .) Используйте закон Гесса, чтобы определить Δ H f для CO 3 2- ( Δ H 2 в обратном направлении).Сравните Δ H 2 с литературными данными.
Часть 3 Калориметрия бомбы
Выполните калориметрию бомбы на образце в какой-то момент во время лабораторного периода. Каждая пара учеников должна принести и подготовиться к анализу однородного образца сухой (или шоколадной) пищи с помощью калориметра бомбы. Отвешиваем один грамм +/- 0,0005 г. Измельчите (если он сухой) или разломите образец на мелкие кусочки (если это шоколад) и заполните чашу калориметра. В классе будут продемонстрированы процедуры использования калориметра-бомбы Парра.
Расчеты: Показания калориметра дадут вам кал / грамм. Помня, что калорийность пищи (Cal) на самом деле является ккал, сравните свои результаты со значением, указанным на упаковке.
Отчет
Заполните рабочий лист для лабораторного отчета. Вы должны четко показать все расчеты и сравнить ваши окончательные результаты с литературными данными.
Стандартная энтальпия образования и реакции
Стандартные состояния и стандартные изменения энтальпии
Стандартная энтальпия образования относится к изменению энтальпии, когда один моль соединения образуется из его элементов.\ ominus_f [/ латекс].
- Стандартное состояние газа — это гипотетическое состояние при давлении 1 бар; для жидкостей и твердых веществ — чистое вещество при давлении 1 бар; для элементов — наиболее стабильный аллотроп элемента; а для вещества в растворе (растворенного вещества) — концентрация при 1 М и 1 бар.
- Стандартная энтальпия образования — это изменение энтальпии, которое сопровождает образование одного моля соединения из его элементов. Стандартная энтальпия реакции возникает в системе, когда один моль вещества превращается в результате химической реакции.
Ключевые термины
- стандартное состояние : в химии контрольная точка, используемая для расчета свойств материала (чистого вещества, смеси или раствора) в различных условиях.
- стандартная энтальпия образования : изменение энтальпии, которое сопровождает образование одного моля соединения из его элементов со всеми веществами в их стандартных состояниях; также называется «стандартной теплотой образования».
- энтальпия раствора : тепловая связь с растворением определенного растворенного вещества в конкретном растворителе.
Стандартные состояния
В химии стандартное состояние материала, будь то чистое вещество, смесь или раствор, является точкой отсчета, используемой для расчета его свойств в различных условиях. В принципе, выбор стандартного состояния является произвольным, хотя Международный союз теоретической и прикладной химии (IUPAC) рекомендует стандартный набор стандартных состояний для общего использования. Принято стандартное давление 1 бар (101,3 кПа).
Строго говоря, температура не входит в определение стандартного состояния; стандартное состояние газа обычно выбирается равным 1 бар для идеального газа, независимо от температуры.Однако большинство таблиц термодинамических величин составляются при определенных температурах, чаще всего 298,15 К (ровно 25 ° C) или, что несколько реже, 273,15 K (точно 0 ° C).
Стандартные состояния атомных элементов даны в терминах наиболее стабильного аллотропа для каждого элемента. Например, белое олово и графит являются наиболее стабильными аллотропами олова и углерода соответственно. Поэтому они используются как стандартные состояния или ориентиры для расчетов различных термодинамических свойств этих элементов.\ ominus_f [/ латекс].
Графит : Графит является наиболее стабильным состоянием углерода и используется в термохимии для определения теплоты образования углеродных соединений.
Стандартная энтальпия образования
Стандартная энтальпия образования или стандартная теплота образования соединения — это изменение энтальпии, которое сопровождает образование одного моля соединения из его элементов в их стандартных состояниях. \ ominus_f = -394 \ text {кДж / моль} [/ латекс]
Обратите внимание, что стандартные энтальпии образования всегда указываются в единицах кДж / моль образовавшегося соединения.\ ominus _ {rxn} [/ latex] — это изменение энтальпии для данной реакции, рассчитанное на основе стандартных энтальпий образования для всех реагентов и продуктов. Изменение энтальпии не зависит от конкретного пути реакции, а только от общего уровня энергии продуктов и реагентов; энтальпия является функцией состояния и, как таковая, аддитивна. Чтобы рассчитать стандартную энтальпию реакции, мы можем просуммировать стандартные энтальпии образования реагентов и вычесть это из суммы стандартных энтальпий образования продуктов.\ ominus _f \ {\ text {реагенты} \} \\ {} & = & (- 962) — (- 75) = — 887 \ text {кДж / моль} \ end {array} [/ latex]
Как и следовало ожидать, стандартная энтальпия этой реакции горения является сильно экзотермической.
Расчет стандартной энтальпии реакции (∆H ° rxn) по стандартной теплоте образования (∆H ° f) : стандартная энтальпия реакции (∆H ° rxn), с участием этилена и кислорода в качестве реагентов для получения углерода диоксид и газообразная вода.
Закон Гесса
Закон Гесса суммирует изменения энтальпии для серии промежуточных стадий реакции, чтобы найти общее изменение энтальпии для реакции.
Цели обучения
Используйте закон Гесса для определения ΔH∘rxn
Ключевые выводы
Ключевые моменты
- Закон Гесса гласит, что стандартная энтальпия реакции — это сумма стандартных энтальпий промежуточных реакций, на которые может быть разделена общая реакция, каждая из которых протекает при одинаковой температуре.
- Изменение энтальпии для реакции не зависит от количества способов получения продукта, если начальные и конечные условия совпадают.
- Отрицательное изменение энтальпии для реакции указывает на экзотермический процесс, в то время как положительное изменение энтальпии соответствует эндотермическому процессу.
Ключевые термины
- Закон Гесса : гласит, что если общая реакция протекает в несколько стадий, ее стандартная энтальпия реакции является суммой стандартных энтальпий промежуточных реакций при той же температуре.
- закон сохранения энергии : утверждает, что общее количество энергии в любой изолированной системе остается постоянным; энергия не может быть создана или уничтожена, хотя она может менять формы.
Вывод закона Гесса
Закон Гесса — это взаимосвязь в области физической химии, названная в честь Жермена Гесса, русского химика и врача швейцарского происхождения. Этот закон гласит, что если реакция протекает в несколько стадий, то стандартная энтальпия реакции для всей реакции равна сумме стандартных энтальпий промежуточных стадий реакции, предполагая, что каждая стадия протекает при одинаковой температуре.
Закон Гесса вытекает непосредственно из закона сохранения энергии, а также его выражения в первом законе термодинамики. Поскольку энтальпия является функцией состояния, изменение энтальпии между продуктами и реагентами в химической системе не зависит от пути, пройденного от начального до конечного состояния системы. Закон Гесса можно использовать для определения общей энергии, необходимой для химической реакции, особенно когда реакцию можно разделить на несколько промежуточных стадий, которые легче охарактеризовать по отдельности.Отрицательное изменение энтальпии для реакции указывает на экзотермический процесс, в то время как положительное изменение энтальпии соответствует эндотермическому процессу.
Графическое представление закона Гесса : Суммарная реакция здесь представляет собой преобразование A в D, а изменение энтальпии для этой реакции равно ΔH. Однако мы можем видеть, что чистая реакция является результатом превращения A в B, который затем превращается в C, который, наконец, превращается в D. По закону Гесса чистое изменение энтальпии всей реакции равно сумма изменений энтальпии для каждого промежуточного превращения: ΔH = Δh2 + Δh3 + Δh4.
Расчет стандартных энтальпий реакции с использованием закона Гесса
[латекс] C (s) \ {\ text {graphite} \} \ rightarrow C (s) \ {\ text {diamond} \} \ quad \ quad \ Delta H_ {rxn} =? [/ Latex]
Превращение графита в алмаз требует чрезвычайно высоких температур и давлений, и поэтому нецелесообразно в лабораторных условиях. \ circ = -393.\ circ_ {rxn} = 1.89 \ text {кДж / моль} [/ латекс]
Урок Гесса : В этом уроке используются два метода определения теплоты реакции для данной реакции. Сначала рассматривается объединение реакций в соответствии с законом Гесса и их теплоты реакции, а затем обсуждается использование стандартных значений теплоты образования реагентов и продуктов для определения общей теплоты реакции.
Тепло растворения
Теплота растворения означает изменение энтальпии, когда растворенное вещество растворяется в растворителе.
Цели обучения
Определите теплоту раствора
Ключевые выводы
Ключевые моменты
- Энтальпия раствора или теплота растворения выражается в кДж / моль, и это количество тепловой энергии, которая выделяется или поглощается при образовании раствора.
- В сольватации есть три этапа: разрыв связей между молекулами растворенного вещества, разрыв межмолекулярного притяжения между молекулами растворителя и образование новых притягивающих связей растворенное вещество-растворитель.Энергия поглощается на первых двух шагах и высвобождается на последнем шаге.
- В зависимости от относительного количества энергии, необходимой для первоначального разрыва связей, а также от того, сколько выделяется при образовании связи растворенное вещество-растворитель, общая теплота раствора может быть либо эндотермической, либо экзотермической.
Ключевые термины
- теплота раствора : изменение энтальпии, связанное с растворением вещества в растворителе при постоянном давлении, приводящее к бесконечному разбавлению.
- сольватация : процесс притяжения и ассоциации молекул растворителя с молекулами или ионами растворенного вещества; также называется роспуском.
Теплота растворения, также называемая энтальпией растворения или энтальпией растворения, представляет собой изменение энтальпии, связанное с растворением растворенного вещества в растворителе при постоянном давлении, что приводит к бесконечному разбавлению. \ circ_ {sol} [/ latex] представляет собой сумму этих отдельных шагов.В зависимости от относительных знаков и величин каждой ступени общая теплота раствора может быть положительной или отрицательной и, следовательно, либо эндотермической, либо экзотермической. Это полностью зависит от того, было ли использовано больше энергии для разрыва связей растворенное вещество-растворенное вещество и растворитель-растворитель, или больше энергии было выделено при образовании связей растворенное вещество-растворитель.
Если при образовании связей выделяется больше энергии, чем используется для разрыва связей, общий процесс является экзотермическим, и ∆H sol является отрицательным.Если для разрыва связей используется больше энергии, чем выделяется при образовании связи растворенное вещество-растворитель, то весь процесс является эндотермическим, и ∆H sol является положительным.
Примеры
- Растворение хлорида натрия (поваренной соли) в воде эндотермическое. Это связано с тем, что количество энергии, используемой для разрыва взаимодействий водородных связей между молекулами воды, а также энергия, используемая для разрушения электростатического притяжения между ионами натрия и хлорида, больше, чем количество энергии, высвобождаемой при использовании нового растворенного вещества-растворителя. притяжения образуются между молекулами воды и водными ионами в растворе.
- Растворение гидроксида калия экзотермическое. Это связано с тем, что при образовании связей растворенное вещество-растворитель выделяется больше энергии, чем требуется для разрыва водородных связей в воде, а также ионных связей в КОН.
Растворение NaCl в воде : Растворение хлорида натрия в воде является эндотермическим. Образование притягивающей связи растворенное вещество-растворитель (экзотермическая стадия в процессе сольватации) показано пунктирными линиями.
Калькулятор таблиц CO2
- Дом
- Калькулятор
- Справка
- О двуокиси углерода
- Бесплатные гаджеты
- Видео с CO2
- Выбросы CO2
- Свяжитесь с нами
- Регистр
Таблицы энтальпии и энтропии углекислого газа
| Инженеры Edge
Связанные ресурсы: термодинамика
Таблицы энтальпии и энтропии диоксида углерода
Термодинамика
Теплопередача
Термодинамические свойства энтальпии и энтропийных таблиц насыщенного диоксида углерода для температур -50.От 0 до 31,0 ° C
Где:
v = Удельный объем
u = Удельная внутренняя энергия
h = Удельная энтальпия
s = Удельная энтропия
Темп. | Нажмите. | Энтальпия, кДж / кг | Энтропия, кДж / кг-К | ||||
Сб.Жидкость | исп. | Сб. Пар | Сб. Жидкость | исп. | Сб.Пар | ||
— 50,0 | 682,3 | — 19,96 | 339,73 | 319,77 | — 0,0863 | 1,5224 | 1.4362 |
–48 | 739,5 | — 16,00 | 336,38 | 320,38 | — 0,0688 | 1.4940 | 1.4252 |
–46 | 800,2 | — 12,02 | 332,98 | 320,96 | — 0,0515 | 1,4659 | 1.4144 |
–44 | 864,4 | — 8,03 | 329,52 | 321,49 | — 0,0342 | 1.4380 | 1.4038 |
— 42 | 932.5 | — 4,02 | 326,00 | 321,97 | — 0,0171 | 1.4103 | 1,3933 |
–40 | 1004.5 | 0,00 | 322,42 | 322,42 | 0,0000 | 1,3829 | 1,3829 |
–38 | 1080,5 | 4.04 | 318,78 | 322,82 | 0,0170 | 1,3556 | 1,3726 |
–36 | 1160,7 | 8,11 | 315.06 | 323,17 | 0,0339 | 1,3285 | 1,3624 |
–34 | 1245,2 | 12,19 | 311,28 | 323.47 | 0,0507 | 1,3016 | 1,3523 |
–32 | 1334,2 | 16,30 | 307,42 | 323,72 | 0.0675 | 1,2748 | 1,3423 |
–30 | 1427,8 | 20,43 | 303,48 | 323,92 | 0,0842 | 1.2481 | 1,3323 |
–28 | 1526,1 | 24.60 | 299,46 | 324,06 | 0,1009 | 1,2215 | 1.3224 |
–26 | 1629,3 | 28,78 | 295,35 | 324,14 | 0,1175 | 1,1950 | 1,3125 |
–24 | 1737.5 | 33,00 | 291,15 | 324,15 | 0,1341 | 1,1686 | 1,3026 |
–22 | 1850,9 | 37.26 | 286,85 | 324,11 | 0,1506 | 1,1421 | 1,2928 |
–20 | 1969,6 | 41,55 | 282.44 | 323,99 | 0,1672 | 1,1157 | 1,2829 |
–18 | 2093,8 | 45,87 | 277,93 | 323.80 | 0,1837 | 1.0893 | 1,2730 |
–16 | 2223,7 | 50,24 | 273,30 | 323,53 | 0.2003 | 1.0628 | 1,2631 |
–14 | 2359,3 | 54,65 | 268,54 | 323,19 | 0,2169 | 1.0362 | 1,2531 |
–12 | 2501,0 | 59,11 | 263,65 | 322,76 | 0,2334 | 1,0096 | 1.2430 |
–10 | 2648,7 | 63,62 | 258,61 | 322,23 | 0,2501 | 0,9828 | 1,2328 |
–8 | 2802.7 | 68,18 | 253,43 | 321,61 | 0,2668 | 0,9558 | 1,2226 |
–6 | 2963,2 | 72.81 | 248,08 | 320,89 | 0,2835 | 0,9286 | 1,2121 |
–4 | 3130,3 | 77,50 | 242.55 | 320,05 | 0,3003 | 0,9012 | 1.2015 |
— 2 | 3304,2 | 82,26 | 236,83 | 319.09 | 0,3173 | 0,8734 | 1,1907 |
0 | 3485,1 | 87,10 | 230,89 | 317,99 | 0.3344 | 0,8453 | 1,1797 |
2 | 3673,3 | 92,02 | 224,73 | 316,75 | 0,3516 | 0.8167 | 1,1683 |
4 | 3868,8 | 97,05 | 218,30 | 315,35 | 0,3690 | 0,7877 | 1.1567 |
6 | 4072,0 | 102,18 | 211,59 | 313,77 | 0,3866 | 0,7580 | 1,1446 |
8 | 4283.1 | 107,43 | 204,56 | 311,99 | 0,4045 | 0,7276 | 1,1321 |
10 | 4502,2 | 112.83 | 197,15 | 309,98 | 0,4228 | 0,6963 | 1,1190 |
12 | 4729,7 | 118,38 | 189.33 | 307,72 | 0,4414 | 0,6640 | 1,1053 |
14 | 4965,8 | 124,13 | 181,02 | 305.15 | 0,4605 | 0,6304 | 1.0909 |
16 | 5210,8 | 130,11 | 172,12 | 302,22 | 0.4802 | 0,5952 | 1.0754 |
18 | 5465,1 | 136,36 | 162,50 | 298,86 | 0,5006 | 0.5581 | 1.0588 |
20 | 5729,1 | 142,97 | 152,00 | 294,96 | 0,5221 | 0,5185 | 1.0406 |
22 | 6003,1 | 150,02 | 140,34 | 290,36 | 0,5449 | 0,4755 | 1.0203 |
24 | 6287.7 | 157,71 | 127,09 | 284,80 | 0,5695 | 0,4277 | 0,9972 |
26 | 6583,7 | 166.36 | 111,45 | 277,80 | 0,5971 | 0,3726 | 0,9697 |
28 | 6891,8 | 176,72 | 91.58 | 268,30 | 0,6301 | 0,3041 | 0,9342 |
30 | 7213,7 | 191,65 | 60,58 | 252.23 | 0,6778 | 0,1998 | 0,8776 |
31,0 | 7377,3 | 219,34 | 0,0 | 219,34 | 0.7680 | 0,0 | 0,7680 |
© Copyright 2000-2021, Engineers Edge, LLC www.engineersedge.com
Все права защищены
Отказ от ответственности
| Обратная связь | Реклама
| Контакты
Дата / Время:
.

 Жидкость, как и газ, абсолютно бесцветна, имеет слегка кислый привкус.
Жидкость, как и газ, абсолютно бесцветна, имеет слегка кислый привкус. Входит в состав атмосферы в среднем 0,035% по объёму. При резком охлаждении за счёт расширения (детандирование) СО2 способен десублимироваться – переходить сразу в твёрдое состояние, минуя жидкую фазу.
Входит в состав атмосферы в среднем 0,035% по объёму. При резком охлаждении за счёт расширения (детандирование) СО2 способен десублимироваться – переходить сразу в твёрдое состояние, минуя жидкую фазу. Низкотемпературную углекислоту, являющейся основной формой диоксида углерода для промышленного потребления, чаще всего получают по циклу высокого давления путём трехступенчатого охлаждения и дросселирования в специальных установках.
Низкотемпературную углекислоту, являющейся основной формой диоксида углерода для промышленного потребления, чаще всего получают по циклу высокого давления путём трехступенчатого охлаждения и дросселирования в специальных установках. Цистерны вертикального исполнения требуют строительства фундамента и используются преимущественно в условиях ограниченного пространства для размещения. Применение горизонтальных цистерн позволяет снизить затраты на фундаменты, особенно при наличии общей рамы с углекислотной станцией. Цистерны состоят из внутреннего сварного сосуда, изготовленного из низкотемпературной стали и имеющего пенополиуретановую или вакуумную теплоизоляцию; наружного кожуха из пластика, оцинкованной или нержавеющей стали; трубопроводов, арматуры и приборов контроля. Внутренняя и наружная поверхности сварного сосуда подвергаются специальной обработке, благодаря чему снижена до вероятность поверхностной коррозии металла. В дорогих импортных моделях наружный герметичный кожух выполнен из алюминия. Использование цистерн обеспечивает заправку и слив жидкой углекислоты; хранение и транспортировку без потерь продукта; визуальный контроль массы и рабочего давления при заправке, в процессе хранения и выдачи. Все типы цистерн оснащены многоуровневой системой безопасности.
Цистерны вертикального исполнения требуют строительства фундамента и используются преимущественно в условиях ограниченного пространства для размещения. Применение горизонтальных цистерн позволяет снизить затраты на фундаменты, особенно при наличии общей рамы с углекислотной станцией. Цистерны состоят из внутреннего сварного сосуда, изготовленного из низкотемпературной стали и имеющего пенополиуретановую или вакуумную теплоизоляцию; наружного кожуха из пластика, оцинкованной или нержавеющей стали; трубопроводов, арматуры и приборов контроля. Внутренняя и наружная поверхности сварного сосуда подвергаются специальной обработке, благодаря чему снижена до вероятность поверхностной коррозии металла. В дорогих импортных моделях наружный герметичный кожух выполнен из алюминия. Использование цистерн обеспечивает заправку и слив жидкой углекислоты; хранение и транспортировку без потерь продукта; визуальный контроль массы и рабочего давления при заправке, в процессе хранения и выдачи. Все типы цистерн оснащены многоуровневой системой безопасности. Предохранительные клапаны позволяют производить проверку и ремонт без остановки и опорожнения цистерны.
Предохранительные клапаны позволяют производить проверку и ремонт без остановки и опорожнения цистерны. Брикеты, гранулы и снег хранят не более 1-2 суток в стационарных заглублённых хранилищах шахтного типа, разбитых на небольшие отсеки; перевозят в специальных изотермических контейнерах с предохранительным клапаном. Используются контейнеры разных производителей вместимостью от 40 до 300 кг и более. Потери на сублимацию составляют, в зависимости от температуры окружающего воздуха 4-6% и более в сутки.
Брикеты, гранулы и снег хранят не более 1-2 суток в стационарных заглублённых хранилищах шахтного типа, разбитых на небольшие отсеки; перевозят в специальных изотермических контейнерах с предохранительным клапаном. Используются контейнеры разных производителей вместимостью от 40 до 300 кг и более. Потери на сублимацию составляют, в зависимости от температуры окружающего воздуха 4-6% и более в сутки. Нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов. Обладая подобными свойствами, сверхкритический диоксид углерода всё шире применяется в процессах экстракции, фракционирования и импрегнации органических и неорганических веществ. Он является также перспективным рабочим телом для современных тепловых машин.
Нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов. Обладая подобными свойствами, сверхкритический диоксид углерода всё шире применяется в процессах экстракции, фракционирования и импрегнации органических и неорганических веществ. Он является также перспективным рабочим телом для современных тепловых машин.


 Плавление твердой углекислоты происходит при температурах и давлениях, соответствующих тройной точке (t = -56,6 град. и р = 5,28 ата) или находящихся выше ее.
Плавление твердой углекислоты происходит при температурах и давлениях, соответствующих тройной точке (t = -56,6 град. и р = 5,28 ата) или находящихся выше ее. Теплопроводность углекислого газа при 0 град. составляет 0,012 ккал/м*час*град.С, а при температуре -78 град. она понижается до 0,008 ккал/м*час*град.С.
Теплопроводность углекислого газа при 0 град. составляет 0,012 ккал/м*час*град.С, а при температуре -78 град. она понижается до 0,008 ккал/м*час*град.С. , ккал/м*час*град.С.
, ккал/м*час*град.С.  Диэлектрическая постоянная жидкой углекислоты при 50 – 125 ати, находится в пределах 1,6016 – 1,6425.
Диэлектрическая постоянная жидкой углекислоты при 50 – 125 ати, находится в пределах 1,6016 – 1,6425.