Содержание
Эксплуатация, зарядка, хранение аккумуляторной батареи
23.12.2019
Содержание
1. Техническое отступление
2.Основные характеристики аккумуляторных батарей
2.1. Расход воды
2.2. Долговечность батареи
2.3. Рекомендации по эксплуатации
3. Терминология
4. Маркировка АКБ
5. Выбор и покупка АКБ
6. Установка АКБ
7. Рекомендации по эксплуатации и обслуживанию
7.1. Обслуживание АКБ в процессе эксплуатации
7.2. Продление жизни новой батарее
7.3. Зарядка аккумулятора зарядным устройством
8. Особенности эксплуатации АКБ в зимний период
8.1. Прикуривание от другого автомобиля
9. Особенности эксплуатации АКБ в летний период
10. Вопросы безопасности
11. Хранение аккумуляторной батареи
12. Приложения
12.1. Реанимация аккумулятора
12.2. Ещё несколько способов, основанных на использовании электрического тока
Скрыть содержание
1. Техническое отступление
Назначение автомобильной аккумуляторной батареи понятно каждому мало-мальски сведущему в технических вопросах автолюбителю. С первой ее функцией — обеспечением запуска двигателя — мы сталкиваемся каждый день. Есть и вторая — реже применяемая, но от того не менее значимая — использование в качестве аварийного источника питания при выходе из строя генератора. Кроме того, на современных автомобилях с инжекторным впрыском аккумулятор выполняет роль сглаживателя пульсаций напряжения, выдаваемого генератором. Из этого следует, что следует крайне осторожно относиться к отключению аккумулятора на работающем двигателе. Карбюраторному двигателю ничего не будет, а вот как поведёт себя компьютер, управляющий распределённым впрыском — одному богу известно… Можно загубить компьютер.
Все стартерные батареи, выпускаемые в настоящее время для автомобилей, являются свинцово-кислотными. В основу их работы заложен известный еще с 1858 г., и по сей день остающийся практически неизменным принцип двойной сульфатации.
Как наглядно видно из формулы, при разряде батареи (стрелка вправо) происходит взаимодействие активной массы положительных и отрицательных пластин с электролитом (серной кислотой), в результате чего образуется сульфат свинца, осаждающийся на поверхности отрицательно заряженной пластины и вода. В итоге плотность электролита падает. При зарядке батареи от внешнего источника происходят обратные электрохимические процессы (стрелка влево), что приводит к восстановлению на отрицательных электродах чистого свинца и на положительных — диоксида свинца. Одновременно с этим повышается плотность электролита.
Любая автомобильная батарея представляет из себя корпус — контейнер, разделенный на шесть изолированных ячеек — банок (см. рис.1).
Каждая банка является законченным источником питания напряжением порядка 2. 1 В. В банке находится набор положительных и отрицательных пластин, отделенных друг от друга сепараторами. Как известно из школьного курса физики, две разнозаряженные пластины уже сами по себе являются источником постоянного напряжения, параллельное же их соединение увеличивает ток. Последовательное соединение шести банок и дает батарею с напряжением порядка 12.6-12.8 В. Любая из пластин, как положительная, так и отрицательная, есть ни что иное, как свинцовая решетка, заполненная активной массой. Активная масса имеет пористую структуру с тем, чтобы электролит заходил в как можно более глубокие слои и охватывал больший ее объем. Роль активной массы в отрицательных пластинах выполняет свинец, в положительных — диоксид свинца.
1 В. В банке находится набор положительных и отрицательных пластин, отделенных друг от друга сепараторами. Как известно из школьного курса физики, две разнозаряженные пластины уже сами по себе являются источником постоянного напряжения, параллельное же их соединение увеличивает ток. Последовательное соединение шести банок и дает батарею с напряжением порядка 12.6-12.8 В. Любая из пластин, как положительная, так и отрицательная, есть ни что иное, как свинцовая решетка, заполненная активной массой. Активная масса имеет пористую структуру с тем, чтобы электролит заходил в как можно более глубокие слои и охватывал больший ее объем. Роль активной массы в отрицательных пластинах выполняет свинец, в положительных — диоксид свинца.
Вес залитой АКБ ёмкостью 55 Ач составляет около 16.5 кг. Эта цифра складывается из массы электролита — 5кг (что соответствует 4,5 л), массы свинца и всех его соединений — 10 кг, а также 1 кг, приходящегося на долю бака и сепараторов.
2. Основные характеристики аккумуляторных батарей
2. 0. Электродвижущая сила (ЭДС)
0. Электродвижущая сила (ЭДС)
Зависимость ЭДС (грубо говоря, напряжение на выводах аккумулятора) от плотности электролита выглядит так:
Е = 6 * (0,84 + р) , где Е — ЭДС аккумулятора , (В) р — приведенная к температуре 5°С плотность электролита , г/мл
2.1. Расход воды
Показатель, имеющий непосредственное отношение к степени обслуживаемости батареи. Определяется в лабораторных условиях. Батарея считается необслуживаемой, если она имеет очень низкий расход воды в эксплуатации. Необслуживаемые батареи не требуют доливки дистиллированной воды в течении года и более при условии исправной работы регулятора напряжения.
На расход воды прямое влияние оказывает процентное содержание сурьмы в свинцовых решетках пластин. Как известно, сурьма добавляется для придания пластинам достаточной механической прочности. Однако у каждой медали есть обратная сторона. Сурьма способствует расщеплению воды на кислород и водород, следствием чего является выкипание воды и снижение уровня электролита. В батареях предыдущего поколения содержание сурьмы доходило до 10%, в современных этот показатель снижен до 1.5 %.
В батареях предыдущего поколения содержание сурьмы доходило до 10%, в современных этот показатель снижен до 1.5 %.
Панацею от этой беды фирмы видят в освоении т.н. гибридной технологии — замене сурьмы в одной из пластин на кальций. Кальций в решетке является веществом нейтральным по отношению к воде, не снижая при этом механической прочности решеток. А потому разложения воды не происходит и уровень электролита остается неизменным.
Преимущества «кальциевых» АКБ — можно устанавливать в местах , не не требующих удобного доступа для обслуживания. Меньше вероятность выхода из строя из-за коррозии решеток электродов. Лучшие стартерные характеристики.
Недостаток «кальциевых» АКБ — при глубоких разрядах происходит образование нерастворимых солей кальция, и емкость АКБ необратимо теряется. Производители АКБ пытаются устранить этот недостаток добавлением в АКБ серебра и др. компонентов, результат пока окончательно не ясен.
2.2. Долговечность батареи
Средний срок службы современных АКБ при условии соблюдения правил эксплуатации — а это недопущение глубоких разрядов и перезарядов, в том числе по вине регулятора напряжения — составляет 4-5 лет.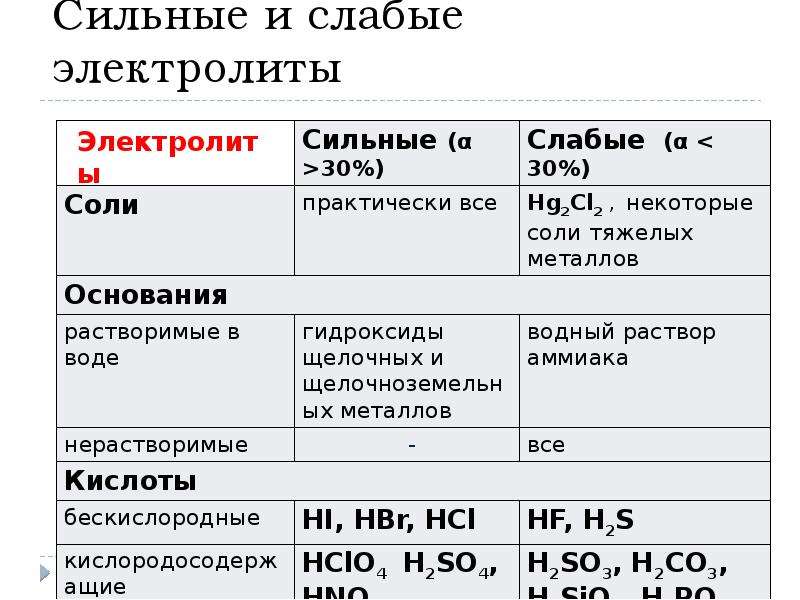
Наиболее губительными для батарей являются глубокие разряды. Оставленные на ночь включенными световые приборы, либо другие потребители способны разрядить ее до плотности 1.12 — 1.15 г/см3, т.е. практически до воды, что приводит к главной беде аккумуляторов — сульфатации свинцовых пластин. Пластины покрываются белым налетом, который постепенно кристаллизуется, после чего батарею практически невозможно восстановить. Отсюда вытекает главный вывод — необходимо постоянно следить за состоянием батареи, периодически замерять плотность электролита. Особенно актуально это в зимнее время. Следует отметить, что сульфатация в определенных пределах — явление нормальное и присутствует всегда. (Вспомните — на основе теории двойной сульфатации построен принцип работы батарей). Но при малом разряде и последующей зарядке батарея легко восстанавливается до исходного состояния. Это возможно и при глубоком разряде батареи, но только в том случае, если следом сразу, же последует заряд. Если же разряжать батарею длительное время, не давая ей «подпитки», то падение плотности, ниже критического значения неизбежно приводит к образованию кристаллов сульфата свинца, не вступающих в реакцию ни при каких обстоятельствах.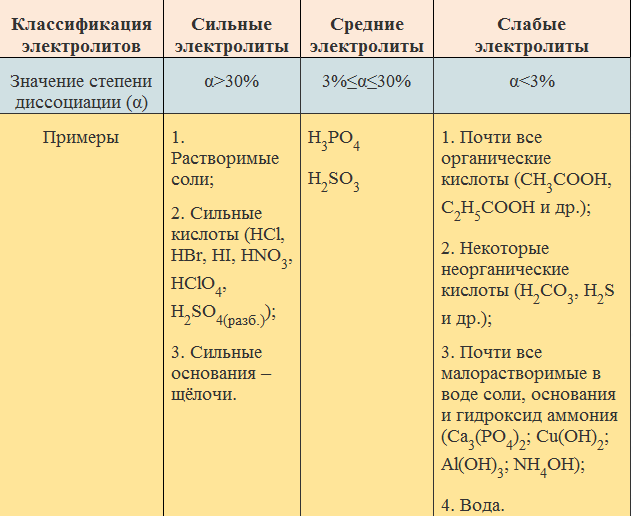 А это означает, что начался необратимый процесс сульфатации.
А это означает, что начался необратимый процесс сульфатации.
Не менее опасен для батареи и перезаряд. Это происходит при неисправном регуляторе напряжения. При этом электролит начинает «кипеть» — происходит разложение воды на кислород и водород, и понижение уровня электролита. Вот почему необходимо следить за зарядным напряжением. Естественно, это не составляет труда, если на панели приборов присутствует вольтметр. Ну а если его нет? В этом случае также можно довольно просто оценить зарядное напряжение. Для этого запустите и прогрейте двигатель, установив средние обороты и подключите тестер (в режиме вольтметра) между «+» и «массой» аккумуляторной батареи. Нормальный зарядный режим батареи обеспечивается в диапазоне 14±0.5В. Если напряжение меньше — стоит проверить натяжение ремня, надежность контактных соединений цепей системы электроснабжения. Если же это не помогает — неисправность нужно искать в регуляторе напряжения. Впрочем, точно также вина ложится на регулятор, если напряжение превышает 14. 5В.
5В.
В последнее время широкое распространение получили сепараторы карманного типа — т.н. конвертные сепараторы. Их название говорит за себя — в эти конверты помещают одноименно заряженные пластины. Такая конструкция увеличивает срок службы батареи, так как осыпающаяся в процессе эксплуатации активная масса остается в конверте, тем самым предотвращается замыкание пластин.
2.3. Рекомендации по эксплуатации
Батарея, не эксплуатировавшаяся в течении длительного времени (4-5 мес.) нуждается в подзарядке. Связано это с тем, что батареям свойственно такое явление, как саморазряд. На графиках рис.2,3 показаны характеризующие саморазряд величины для различных батарей. В первом случае — это снижение плотности от времени хранения, во втором — падение напряжения.
Впрочем, зачастую подзарядки требует и находящаяся в эксплуатации батарея. Плотность полностью заряженной батареи составляет 1.27- 1.28 г/см3, напряжение — 12.5 В. О степени разряженности батареи судят по плотности электролита. Чем ниже плотность электролита, тем сильнее батарея разряжена. Уменьшение плотности на 0.01 г/см3 по сравнению с номинальной означает, что батарея разрядилась примерно на 6 — 8%. Используя график (см. рис.4) можно оценить зависимость степени разряженности батареи от плотности. Степень разряженности определяют по той банке, в которой плотность электролита минимальная. Всем известна аксиома, тем не менее, позволим повторить ее еще раз — батарею, разряженную летом более чем на 50%, а зимой более чем на 25%, необходимо снять с автомобиля и зарядить. При этом следует помнить, что пониженная плотность зимой более опасна, т.к. кроме всего прочего может привести к замерзанию электролита. Так, при плотности электролита 1.2 г/см3 температура его замерзания составляет около -20°С.
Чем ниже плотность электролита, тем сильнее батарея разряжена. Уменьшение плотности на 0.01 г/см3 по сравнению с номинальной означает, что батарея разрядилась примерно на 6 — 8%. Используя график (см. рис.4) можно оценить зависимость степени разряженности батареи от плотности. Степень разряженности определяют по той банке, в которой плотность электролита минимальная. Всем известна аксиома, тем не менее, позволим повторить ее еще раз — батарею, разряженную летом более чем на 50%, а зимой более чем на 25%, необходимо снять с автомобиля и зарядить. При этом следует помнить, что пониженная плотность зимой более опасна, т.к. кроме всего прочего может привести к замерзанию электролита. Так, при плотности электролита 1.2 г/см3 температура его замерзания составляет около -20°С.
Также необходимо подзарядить батарею, если плотность в разных банках отличается более чем на 0.02 г/см3. Оптимальной является зарядка батареи током, равным 0.05 от ее ёмкости. Для батареи с ёмкостью 55 Ач эта величина составляет 2. 75 А. Чем меньше зарядный ток, тем глубже заряд. Однако не стоит впадать в крайность — при совсем низком токе батарея просто не «закипит», к тому же время зарядки будет несравнимо большим. Наоборот, при очень большом токе батарея «закипит» значительно быстрее, но при этом не успеет зарядиться на все 100%. Признаками окончания зарядки служит бурное выделение газа (т.н. «кипение») и неизменяющаяся на протяжении 1-2 часов плотность электролита.
75 А. Чем меньше зарядный ток, тем глубже заряд. Однако не стоит впадать в крайность — при совсем низком токе батарея просто не «закипит», к тому же время зарядки будет несравнимо большим. Наоборот, при очень большом токе батарея «закипит» значительно быстрее, но при этом не успеет зарядиться на все 100%. Признаками окончания зарядки служит бурное выделение газа (т.н. «кипение») и неизменяющаяся на протяжении 1-2 часов плотность электролита.
Для ориентировочной оценки времени, требуемого на зарядку батареи, можно воспользоваться следующим алгоритмом.
Первоначально, используя график (рис.4) необходимо определить степень разряженности батареи, исходя из реальной плотности АКБ, замеренной ареометром. Далее по степени разряженности определяем потерянную ёмкость (или ёмкость, которую необходимо принять батарее).
Затем, выбрав величину зарядного тока, вычисляем ориентировочное время зарядки по формуле:
Тут следует отметить, что не вся энергия идет на повышение ёмкости. КПД процесса составляет 60-80%, остальное тратится на нагрев, а также связанные с этим электрохимические процессы. Потому реальное время увеличивается примерно в полтора раза от расчетного (что и учитывается коэффициентом «1.5» в формуле).
КПД процесса составляет 60-80%, остальное тратится на нагрев, а также связанные с этим электрохимические процессы. Потому реальное время увеличивается примерно в полтора раза от расчетного (что и учитывается коэффициентом «1.5» в формуле).
Нужно сказать, что использование данного алгоритма оправдано лишь для облегчения процедуры, но ни в коей мере не избавляет от контроля за ходом зарядки. Процесс заряда, а особенно его окончание Вам необходимо контролировать самому, дабы не прозевать начало бурного кипения.
Другой вариант — использование для этих целей автоматических зарядных устройств, отличающихся тем, что зарядка идет при постоянном напряжении, но автоматически изменяющемся в зависимости от степени заряженности батареи токе. При этом зарядное устройство перестает давать ток, если батарея полностью заряжена. Принцип, используемый в подобных устройствах аналогичен зарядке от генератора на автомобиле.
Для примера определим время зарядки батареи ёмкостью 55 Ач током в 5А, плотность которой составляет 1. 25 г/см3. Как видно из графика, при данной плотности батарея разряжена на 25%, что означает потерю ёмкости на величину
25 г/см3. Как видно из графика, при данной плотности батарея разряжена на 25%, что означает потерю ёмкости на величину
Таким образом, примерное время зарядки
Каждодневным способом зарядки батареи является ее заряд от бортовой сети автомобиля (естественно, при условии исправности последней). При данном способе, во первых, невозможен перезаряд, а во-вторых, происходит постоянное перемешивание электролита и наиболее полное его проникновение во внутренние слои активной массы.
Однако было бы ошибочным полагать, что заряд батареи начинается сразу же после пуска двигателя и продолжается все время, пока двигатель в работе. Исследования показывают, что батарея начинает принимать заряд только после прогрева электролита до положительной температуры, что при эксплуатации в зимних условиях происходит примерно через час после начала движения. Именно этим и опасен довольно распространенный, по крайней мере, в нашем автомобильном городе, способ эксплуатации транспортных средств. Холодный запуск зимой с получасовым движением до работы, и затем редкие непродолжительные поездки на протяжении рабочего дня не дают прогреться электролиту и, следовательно, зарядиться Вашей батарее. Тем самым разряженность АКБ увеличивается изо дня в день и в итоге может привести к печальному результату. Из этого следует, что зимой необходимо проверять состояние АКБ и своевременно подзаряжать ее регулярно
Холодный запуск зимой с получасовым движением до работы, и затем редкие непродолжительные поездки на протяжении рабочего дня не дают прогреться электролиту и, следовательно, зарядиться Вашей батарее. Тем самым разряженность АКБ увеличивается изо дня в день и в итоге может привести к печальному результату. Из этого следует, что зимой необходимо проверять состояние АКБ и своевременно подзаряжать ее регулярно
Физические процессы, происходящие при пуске двигателя, отличаются от процессов при разряде батареи потребителями. При пуске участвует не весь объем активной массы и электролита, а лишь та ее часть, которая находится на поверхности пластин и соприкасающийся с поверхностью пластин электролит. Поэтому, после неудачной попытки запустить двигатель, следует подождать некоторое время для того, чтобы электролит перемешался, плотность его выровнялась, он проник в поры активной массы. Нормальный запуск двигателя при однократном вращении стартера в течении 10с забирает ёмкость 300А х 10с = 3000 Ас = 0. 83 Ач, что составляет около 1.5% от ёмкости аккумулятора.
83 Ач, что составляет около 1.5% от ёмкости аккумулятора.
При медленном же разряде участвуют не только поверхностные слои активной массы, но и глубинные, потому и разряд происходит более глубокий. Однако это не означает, что стартерные режимы не так губительны для батареи — стартером точно также можно разрядить батарею до критической величины.
Каковы же признаки выхода из строя батареи? Батарея не заряжается, плотность низкая и не повышается в процессе заряда. Большой саморазряд — батарея зарядилась, но не держит заряд. Можно попытаться потренировать батарею, однако если произошло осыпание активной массы пластин, либо кристаллизация сульфата свинца, то это уже не исправить.
Вообще, освоить способ оценки степени возможной разрядки батареи от каких-либо действий (в том числе и осознанных) не составит большого труда. Необходимо усвоить несколько истин и запомнить несколько цифр.
Батарея начинает принимать заряд лишь только после прогрева электролита до положительной температуры (как вы понимаете, при температуре воздуха -20°С температура электролита в батарее хранящегося на свежем воздухе автомобиля будет примерно такой же. )
)
Коэффициент полезного действия процесса зарядки составляет примерно 50%.
Каждый автомобильный генератор характеризуется следующими показателями:
ток отдачи генератора при работе двигателя на холостом ходу.
ток отдачи генератора при работе двигателя на номинальных оборотах.
Для ВАЗовских автомобилей эти цифры имеют следующие значения:
Таблица 1
Модель автомобиля…………………..2101-2106……2108-2109……2110
ток отдачи на холостом ходу…………….16………………24…………..35
ток отдачи на номинальных оборотах 42……………….55…………..80
Как видно из таблицы, на последних моделях автомобилей Волжского автозавода устанавливаются генераторы, имеющие характеристики тока отдачи, в два раза превосходящие по величине характеристики генераторов первых моделей.
И наконец, примерное потребление энергии автомобильными потребителями:
Таблица 2
потребитель……….ток, А (приблизительно)
зажигание. …………….2
…………….2
габариты……………….4
ближний свет…………9
дальний свет………..12
обогрев стекла……10-11
стеклоподьемник…20-30
вентилятор отопителя:
1-я скорость…………5-7
2-я скорость……….10-11
стеклоочистители…3-5
магнитола…………….5
ИТОГО……………….38-48
Таким образом, оставленные включенными габариты за три часа «съедят» 4А х 3ч= 12 Ач ёмкости батареи, что соответствует разряду приблизительно на 20%. Это не страшно для одного раза. Однако повторив это ещё раз, Вы уже рискуете не завести свою машину, особенно, если дело происходит зимой, т.к. разряд составит порядка 40% (тем более, что к тому же зимой батареи, как правило, эксплуатируются заряженными далеко не на 100%).
Аналогично можно прикинуть, что Вы имеете при продолжительной работе двигателя на холостом ходу. Как уже показано выше, ток отдачи генератора автомобиля ВАЗ-2108 на холостом ходу составляет 24А. Вычитаем из этой величины 2А, необходимые для обслуживания системы зажигания. Остается 22А. Используя таблицу 2, нетрудно прикинуть, что можно включать с тем, чтобы хоть немного досталось бы и аккумулятору (при этом помните про КПД зарядки, составляющий 50%).
Вычитаем из этой величины 2А, необходимые для обслуживания системы зажигания. Остается 22А. Используя таблицу 2, нетрудно прикинуть, что можно включать с тем, чтобы хоть немного досталось бы и аккумулятору (при этом помните про КПД зарядки, составляющий 50%).
Для владельцев иномарок с автоматической коробкой передач картина ещё более сложная. Обычно, стоя в пробке или на светофоре, Вы не переключаетесь на нейтраль, а давите ногой на тормоз. Это понижает обороты двигателя от стандартных 800-900 об./мин. до 600-700 об./мин., что, соответственно понизит ток, выдаваемый генератором, а стоп-сигналы добавят ещё пару ампер потребления тока. Да и обогрев заднего стекла у немцев, например, существенно мощнее, чем у отечественных автомобилей.
Следует знать, что зимние условия эксплуатации автомобиля в принципе очень тяжелы для аккумуляторной батареи. Наверняка будут полезны следующие данные. Результаты проводимых в ГДР исследований говорят о том, что при эксплуатации автомобиля в очень тяжелых условиях (испытания по так называемому режиму «город-зима-ночь») аккумулятор получает порядка 1Ач в час
3.
 Терминология
Терминология
Аккумуляторная батарея — один из основных элементов электрооборудования автомобиля, поскольку она накапливает и хранит электроэнергию, обеспечивает запуск двигателя в различных климатических условиях, а также питает электроприборы при неработающем двигателе.
Автомобильные свинцово-кислотные 12-вольтовые АКБ состоят из 6-ти последовательно соединенных элементов (банок), объединенных в общий корпус. Каждая банка имеет газоотвод, конструкции которого могут существенно отличаться.
Электролит представляет собой раствор серной кислоты в дистиллированной воде (для средней полосы России плотностью 1.27-1.28 г/см3 при t=+20°С). Кипение электролита — бурное выделение газа при электролитическом разложении воды с выделением кислорода и водорода. Это происходит во время заряда батареи.
Саморазряд — самопроизвольное снижение ёмкости АКБ при бездействии. Скорость саморазряда зависит от материала пластин, химических примесей в электролите, его плотности, от чистоты верхней части корпуса батареи и продолжительности ее эксплуатации.
Напряжение полностью заряженной аккумуляторной батареи без нагрузки (ЭДС — электродвижущая сила) должно находиться в пределах 12.6-12.9 В. Напряжение в бортовой сети автомобиля при работающем двигателе несколько выше, чем на клеммах АКБ, и должно находиться в пределах 14.0-14.2 В (0,2 В от крайних значений). Значение напряжения ниже 13.8 В ведет к недозаряду батареи, а выше 14.4В — к перезаряду, что одинаково пагубно сказывается на ее сроке службы.
Полярность аккумуляторной батареи — термин, определяющий расположение токосъемных выводов на ее корпусе. На зарубежных батареях полярность может быть прямой или обратной, т. е. ориентировка положительного и отрицательного выводов относительно корпуса может быть различной. По российскому стандарту (если смотреть со стороны выводов) отрицательный (-) должен располагаться справа, положительный (+) слева.
Емкость батареи — способность батареи принимать и отдавать энергию — измеряется в ампер-часах (Ач). Для оценки ёмкости батареи принята методика 20-ти часового разряда током 0.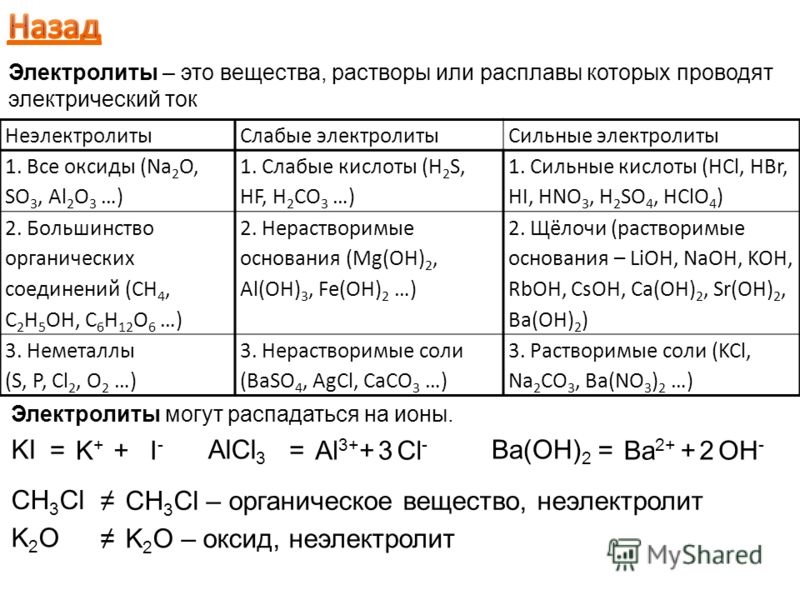 05С20 (т.е. током, равным 5% от номинальной ёмкости). Т.е., если ёмкость батареи 55Ач, то разряжая ее током 2.75 А, она полностью разрядится за 20 часов. Аналогично для батарей ёмкостью 60Ач полный 20-ти часовой разряд произойдет при чуть большем токе разряда — 3А.
05С20 (т.е. током, равным 5% от номинальной ёмкости). Т.е., если ёмкость батареи 55Ач, то разряжая ее током 2.75 А, она полностью разрядится за 20 часов. Аналогично для батарей ёмкостью 60Ач полный 20-ти часовой разряд произойдет при чуть большем токе разряда — 3А.
Данная характеристика определяет возможность питать потребителей в экстремальной ситуации (при отказе генератора). Характеризуется объемом активной массы.
Значение тока холодного старта при -18°С (по DIN) — Величина тока, которую батарея способна отдать при пуске двигателя при температуре -18°С. Наиболее важная характеристика, напрямую сказывающаяся на пуске двигателя. Ведь при -20°С ток, потребляемый стартером, составляет порядка 300А. (Для пуска в летнее время горячего двигателя этот же показатель равен 100-120А.) Значение стартового тока определяется конструкцией батареи, пластин, сепараторов. Сепараторы карманного типа без каких-либо других дополнений увеличивают напряжение батареи на 0.3В, одновременно улучшая стартовые характеристики. Чем ниже внутреннее сопротивление батареи, тем выше стартовый ток, тем надежнее пуск двигателя при низких температурах.
Чем ниже внутреннее сопротивление батареи, тем выше стартовый ток, тем надежнее пуск двигателя при низких температурах.
Резервная ёмкость — время, в течении которого батарея сможет обеспечить работу потребителей в аварийном режиме. Величина резервной ёмкости, выраженная в минутах, последнее время все чаще проставляется изготовителями батарей после значения тока холодного старта.
Корпус современных АКБ изготавливается из пластмассы, в большинстве случаев полупрозрачной, позволяющей контролировать уровень электролита.
Необслуживаемые батареи. Сразу следует оговориться, что этот термин не должен пониматься буквально и восприниматься как руководство к бездействию. Это название говорит об улучшенных потребительских свойствах батареи. Необслуживаемые АКБ требуют долива воды не чаще одного раза в год при условии использования их на автомобилях с исправным электрооборудованием и среднегодовым пробегом 15-20 тыс. км. Встречаются конструкции, исключающие всякое вмешательство на всем протяжении срока службы, но они особенно критичны к состоянию автомобильного электрооборудования.
Большинство необслуживаемых батарей выпускаются заводами-изготовителями, залитыми электролитом. Так как эти батареи имеют значительно меньший саморазряд, они могут храниться от 6 месяцев до 1 года без подзаряда. Саморазряд новых необслуживаемых батарей за 12 месяцев может составить до 50% от номинальной ёмкости.
4. Маркировка АКБ
На современные аккумуляторные батареи наносится следующая маркировка:
Некоторые батареи имеют такую маркировку:
Несмотря на то, что после ёмкости стоит значение 280А, цифра, интересующая нас и показывающая ток холодного старта по принятому у нас стандарту DIN равна 255А.
Обозначения основных характеристик на батареях различных производителей отличаются друг от друга. Большинство европейских производителей и значительная их часть в Азии руководствуются промышленным стандартом Германии DIN 43539 часть 2, который оговаривает два основных параметра: ёмкость батареи, измеряемую в ампер-часах (Ач) при +25°С, и ток стартерного разряда в амперах (А) при -18°С.
Батареи американских производителей испытываются по требованию американского стандарта SAE J537g, который включен в международный стандарт BCI и также вводит два основных параметра: резервную ёмкость, измеряемую в минутах при +27°С, и ток холодной прокрутки — в амперах при -18С. Стандарт SAE не предусматривает измерение ёмкости батареи в ампер-часах.
Первый рассматривает способность батареи к длительным разрядам меньшими токами, второй — разряд большими токами, но за меньший отрезок времени.
Пересчет значения тока стартерного разряда по европейскому стандарту DIN в ток холодной прокрутки по американскому стандарту SAE может производиться с помощью экспериментальных коэффициентов. Для батарей ёмкостью до 90Ач используется коэффициент 1.7, т. е. ISAE = 1.7 IDIN. Для батарей ёмкостью от 90 до 200 Ач используется коэффициент 1.6, т. е. ISAE = 1.6 IDIN.
В настоящее время в Европе наряду с немецким стандартом DIN введен новый единый стандарт En — 60095-1/93.
Кроме того, на необслуживаемых батареях проставляется соответствующая надпись. Чаще всего на русском, английском или немецком языке (либо на языке производителя, как например, на испанских батареях «Tudor»).
5. Выбор и покупка АКБ
Убедитесь, что выбираемая батарея соответствует конструктивным особенностям вашего автомобиля (ёмкость, место установки, способ крепления, полярность, форма и размер токосъемных выводов). Специализированные торговые фирмы имеют каталоги всего ассортимента, в которых систематизирована информация о модификациях и технических характеристиках.
Нецелесообразно на автомобиль с устаревшей системой электрооборудования устанавливать батарею, исключающую долив воды. Это приведет к сокращению ее срока службы или отказу.
Емкость батареи не должна существенно отличаться от указанной заводом-изготовителем автомобиля. Несоблюдение этого условия приводит к резкому сокращению службы, как батареи, так и стартера.
Очень неплохо знать рекомендуемую величину пускового тока для Вашего автомобиля. На многих (японских) автомобилях устанавливаются стартёры с редуктором. Это позволяет существенно уменьшить величину пускового тока, а значит существенно продлить жизнь Вашего аккумулятора.
Внимательно изучите текст гарантийного талона. Обратите особое внимание на те разделы, где перечислены: случаи, исключающие гарантийное обслуживание; адреса гарантийных мастерских; условия эксплуатации.
Маркировка аккумулятора должна иметь ссылку на стандарт (DIN, SAE, En или другие). В маркировке по стандарту SAE не указывается значение ёмкости в ампер-часах (Ач). Указание ёмкости в Ач в стандарте SAE – косвенный признак подделки. Наиболее подвержены подделкам дорогие аккумуляторы известных фирм-изготовителей, поэтому приобретать их лучше в торговых фирмах, заслуживающих доверие.
Большинство фирм-изготовителей кодирует дату выпуска АКБ. Современные необслуживаемые батареи допускают достаточно длительное хранение без существенной потери своих потребительских свойств, поэтому дата изготовления менее актуальна. Предпочтительнее приобретать залитый качественным заводским электролитом аккумулятор. Он готов к работе, легко поддается проверке. Не залитый сухозаряженный аккумулятор требует дополнительного времени и затрат на подготовку к эксплуатации.
Не спешите отдать деньги! Вы вправе требовать проверки аккумулятора. Первым делом сдерите с него защитную упаковочную пленку, какой бы красивой она ни была, и убедитесь, что корпус не поврежден – такое случается довольно часто. Затем попросите продавца измерить плотность электролита – она не должна быть ниже номинальной более чем на 0,02 г/см3 и одинаковой во всех банках, что соответствует примерно 80-процентной заряженности батареи. Последнюю проверку следует провести с нагрузочной вилкой – ее вольтметр должен показать 12.5–12.9 В при отключенной нагрузке, а при включенной – не опускаться в течение 10 секунд ниже 11В.
В случае отклонения от этих значений, батарея может оказаться частично или полностью непригодной к эксплуатации.
Если вам отказывают в проверке аккумулятора, не могут подтвердить качество товара сертификатом, гарантийным талоном, то лучше отказаться от покупки.
6. Установка АКБ
Перед установкой батареи обязательно полностью удалите с нее полиэтиленовую пленку. Газоотводные отверстия должны быть открытыми. Обратите внимание на правильность подключения. Клеммы АКБ рекомендуется зачистить и после закрепления смазать Литолом-24. Это делается для предохранения контактов от попадания влаги и окисления места контактов. Особенно это касается силовых проводов с медными (а не свинцовыми) наконечниками.
Очень важно уделить внимание проводам. Клеммы необходимо зачистить не только со стороны аккумулятора, но и с другой стороны. Место, куда крепится массовый провод (-) надо тоже тщательно зачистить от краски, масла и прочей грязи. Контакт затянуть туго. Это же касается клеммы на стартёре. Невнимание к проводам и контактам может очень сильно «выйти боком» зимой на морозе.
Батарея должна стоять на своём месте жёстко. Болтание её в крепёжных элементах недопустимо. Дополнительная вибрация скажется на долговечности батареи. Замыкание и осыпание пластин в банках чаще всего происходят именно из-за вибрации.
Обратите внимание, что на многих автомобилях батарея стоит довольно близко к выпускному коллектору. То есть летом ей будет довольно жарко, а это для батареи очень плохо! На «правильных» машинах предусмотрена термоизоляция АКБ от двигателя.
7. Рекомендации по эксплуатации и обслуживанию
Условия эксплуатации оказывают существенное влияние на срок службы аккумуляторной батареи. Частые запуски двигателя и поездки на короткие расстояния, неисправности электрооборудования (стартер, генератор, реле-регулятор), дополнительные потребители электроэнергии, несвоевременное обслуживание, ненадежное крепление батареи способны сильно сократить срок ее службы.
При продолжительном движении по трассе батарея может перезаряжаться (кипеть) — в городе с малыми пробегами и «пробками» она, как правило, разряжается (см. выше).
Генератор (при холостых оборотах двигателя) не обеспечивает работу большинства штатных потребителей, не говоря о дополнительных. Зимой ситуация усугубляется. К включенным габаритным огням, ближнему свету фар, стоп-сигналам, указателям поворота, аудиоаппаратуре добавляются обогрев заднего стекла и вентилятор отопителя. Ежедневный недозаряд батареи постепенно уменьшает ее ёмкость, что в итоге приводит к невозможности запуска двигателя стартером.
Отказ аккумуляторной батареи может быть вызван и током утечки в электрооборудовании автомобиля. Это происходит, когда при отключении всех потребителей один или часть из них остается включенным в электрическую цепь (неисправны выключатель или реле). Виновником может быть и сигнализация. После глубокого разряда АКБ может не восстановить свою первоначальную номинальную ёмкость. Батарея не сможет нормально работать, если для запуска двигателя требуется продолжительное включение стартера (неисправны системы питания, зажигания).
7.1. Обслуживание АКБ в процессе эксплуатации сводится к проверке и приведению в соответствие с требованиями: уровня и плотности электролита; чистоты и надежности крепления электрических соединений батареи с корпусом автомобиля, параметров электрооборудования, крепления батареи. Необходимо также следить за правильным натяжением ремня генератора, очищать и смазывать выводы и клеммы, содержать батарею в чистоте. Протирайте верхнюю поверхность водным раствором питьевой соды. Доведение плотности электролита до требуемой производится путем заряда батареи от стационарного зарядного устройства.
Значение зарядного тока в амперах (А) не должно превышать 1/10 ёмкости батареи (упрощенно).
7.2. Продление жизни новой батарее
Коротко об этом сказать трудно. В первую очередь, следует залить электролит, точно соответствующий не только климатической зоне, но и сезону эксплуатации. Если батарея будет работать только в теплое время года, то плотность электролита может быть 1.20 г/см3, а если до -15°С — 1.24 г/см3 и т.д. Такая точность, безусловно, снизит скорость сульфатации пластин, следовательно, увеличит долговечность батареи.
На срок службы АКБ значительно влияет средняя степень заряженности, которая зависит от исправности реле-регулятора. Необходимо, чтобы эта величина поддерживалась не ниже 75%.
справка:
Установлено, что отклонение регулируемого напряжения на 10…12% вверх или вниз от оптимального сокращает срок службы батареи в 2…2.5 раза.
Во-первых, отрегулируйте двигатель так, чтобы он легко заводился с пол-оборота. Это предохранит АКБ от глубокого разряда. При пуске двигателя стартером через аккумуляторную батарею проходит ток в несколько сот Ампер, что не способствует ее долговечности. Поэтому, чем легче пуск двигателя, тем лучше для АКБ: она прослужит дольше.
справка:
Сокращение времени работы стартера вдвое при шести-восьми ежедневных пусках повышает срок службы аккумуляторной батареи приблизительно в 1.5 раза.
Во-вторых, отрегулируйте при необходимости реле-регулятор, чтобы напряжение было в пределах 13.8…14.4В. Это одно из важнейших условий. В-третьих, никогда не позволяйте снизиться уровню электролита в банках ниже требуемого.
справка:
Несвоевременная доливка в аккумуляторы дистиллированной воды может снизить срок службы батареи на 30%.
Эти простые советы, продлят жизнь АКБ.
Кроме этого, специалисты советуют при наличии зарядного устройства при любой возможности (например, на ночь) ставить аккумуляторную батарею на подзарядку малым током — около 1…2А. Для этого можно АКБ не снимать с автомобиля. Только эта операция, если ее проделывать регулярно, не реже одного раза в месяц, увеличивает срок службы батареи, по крайней мере, на год.
7.3. Зарядка аккумулятора зарядным устройством
Ну а теперь как заряжать? Зарядные устройства бывают с ручной и автоматической регулировкой (Орион PW-270, Орион PW-320) или автоматические (все остальные зарядные устройства Орион). Перед зарядкой необходимо открыть все газовые каналы: вывернуть пробки, снять крышки банок.
При зарядке важны три параметра: напряжение, ток зарядки и время. Когда аккумулятор частично процентов на 25 разряжен, то начальный ток заряда при включении выпрямителя может резко скакнуть вверх. Отрегулируйте его на зарядный ток около 1/10 ёмкости аккумулятора или меньше (это общепринятое правило заряда кислотных батарей). Т.е., если у Вас батарея имеет маркировку 55Ah — выставляем ток около 5.5А.
Если необходимо зарядить батарею в кратчайшее время, можно выставить и больший ток. В соответствии с законом Вудбриджа который гласит: сила зарядного тока (в амперах) не должна превышать величину заряда (в ампер-часах), недостающего до полной ёмкости акуммулятора. При этом зарядное устройство должно автоматически снижать ток при повышении напряжения или выключаться при достижении порогового напряжения на батарее. В противном случае (если ЗУ этого не делает) необходимо непрерывно контролировать зарядный ток и напряжение в ручную.
Далее в процессе зарядки напряжение будет расти, а ток уменьшаться. Считается, если ток не уменьшается в течение последних 2-3 часов, то аккумулятор заряжен. Важно помнить, что нельзя вести заряд большим током более 25 часов. Электролит сильно нагреется и выкипит, пластины от нагрева может повести и они замкнут друг на друга. Обычно нормальное время полного заряда около 15 часов.
Иногда необходимо выровнять плотность небольшим током. Например, если плотность электролита в разных банках 1.23, 1.25. Включив зарядное устройство, устанавливаем ток зарядки порядка 1-2А. Данное значение у разных АКБ- разное и зависит от многих факторов: конструкции, пассивационного материала пластин, состояния батареи и т.д. Время такой зарядки до двух суток. Особенно это необходимо делать после того, как аккумулятор разряжен в ноль бесплодными попытками завести двигатель. При чём, делать это надо сразу, пока не началась сульфатация пластин.
Батареи, исключающие долив воды, должны заряжаться только устройствами с автоматическим поддержанием зарядного напряжения. Несоблюдение этого условия приведет к снижению их срока службы. Конкретные требования по режиму заряда, эксплуатации и обслуживанию должны быть изложены в инструкции или гарантийном талоне, прилагаемом к батареям.
В настоящее время разные производители обозначают разное напряжение окончания заряда. Как правило, оно составляет от 15 до 16В (для батарей устаревших конструкций, с применением в качестве пассивирующего материала сурьмы — меньше). На самом деле, порог ограничения напряжения автоматического зарядного устройства 15 или 16 вольт (для батареи с прописанными, для полного заряда, 16ю вольтами, например Varta) влияет только на время заряда последних 2-4% емкости.
Для доведения уровня электролита до нормы недопустимо использовать электролит! В аккумуляторную батарею доливают только дистиллированную воду. Не используйте воду сомнительного происхождения. При частом выкипании проверьте электрооборудование автомобиля.
Необходимо знать, что при сильном снижении уровня электролита внутри корпуса аккумулятора может образоваться опасная концентрация газовой смеси. Чтобы исключить вероятность взрыва, нельзя подносить к батарее открытое пламя (даже сигарету) и допускать искрение электроконтактов. Системы газоотвода некоторых современных батарей более взрывобезопасны. В средней полосе России АКБ не требуют корректировки плотности электролита при смене сезонов.
Перед зимней эксплуатацией автомобиля сделайте обслуживание не только аккумуляторной батареи (см. выше), но и систем, влияющих на запуск двигателя. Обязательно залейте моторное масло, соответствующее сезону. Для облегчения запуска двигателя в сильные морозы занесите батарею на несколько часов в теплое помещение.
Перед длительной зимней стоянкой также обслужите батарею, но не храните ее в теплом помещении, а оставьте на автомобиле со снятыми клеммами. Чем ниже температура, тем меньше скорость ее саморазряда.
Недопустимо оставлять на морозе разряженную батарею. Электролит низкой плотности замерзнет, и кристаллы льда приведут ее в негодность. Плотность электролита разряженного аккумулятора может снизиться до 1,09 г/см3, что приведет к его замерзанию уже при температуре -7°С. Для сравнения – электролит плотностью 1.28 г/см3 замерзает при t=-65°С.
Опрокидывание аккумуляторной батареи и слив электролита могут привести к замыканию пластин и выходу ее из строя.
Для борьбы с паразитными токами утечки введите себе привычку вытирать корпус батареи насухо от всякой нечисти. Если совсем в лом, то хотя бы делайте чистый круг вокруг плюсовой клеммы, чтобы разорвать паразитные электрические связи. Ну, а если Вы любите свою машину, то разведите немного соды в воде и протрите всю поверхность корпуса батареи и вытрете ее насухо. Все тряпки, которые прикасались к аккумулятору выбросить немедленно! А заодно проверите крепление батареи, уровень электролита и его плотность. Времени это займёт минут 10-15, а сэкономить может часы и кучу нервов.
8. Особенности эксплуатации АКБ в зимний период
Перво-наперво замерим плотность электролита во всех банках без исключения. Норма 1.27-1.28 г/см3. У Вас далеко не так? Значит, снимаем батарею и ставим на зарядку. И это однозначно! Ни в коем случае не пытаемся повысить плотность электролита добавлением концентрированной кислоты, какая бы низкая не была его плотность. Желаемого же результата — повышения ёмкости батареи при этом не произойдет.
Далее. Обязательно провести ревизию всех силовых проводов, клемм и контактов. Клеммы зачистить мелкой шкуркой. Контакты на АКБ тоже зачистить и затянуть. Можно затем смазать литолом, чтобы к контактам не попадала влага. С другой стороны силовых проводов так же провести ревизию контактов.
8.1. Прикуривание от другого автомобиля
Для российских автовладельцев нормальная ситуация, когда сосед просит «прикурить» его аккумулятор. Для этой нехитрой процедуры помимо автомобиля с заряженным аккумулятором, необходимы ещё и правильные провода. Не забываем, что по этим проводам у нас потечёт около 200 ампер!
На что нужно обратить внимание при покупке:
1. Толщина жилы медного провода. Сняв изоляцию с крокодила (зажима) можно увидеть саму жилу. Чем толще, тем лучше. Не обращайте внимание на толщину кабеля. Главное проводник тока, а не толщина изоляции.
2. Надежность крепления жилы к крокодилу провода прикуривателя. Медная жила д.б. облужена, затем обжата и припаяна. Если эти условия соблюдены, то потерь в месте соединения будет меньше. Все стартовые провода Орион 100% паяются.
3. Изоляция. Лучший вариант — морозоустойчивая резина или силикон. Зимой такие провода остануться эластичными.
4. Длинна проводов. Провода по длинне нужно выбирать не длинее, чем нужно.
5. Крокодилы (зажимы). При покупке обращайте внимание на толщину стали из которой они сделаны и силу пружины, а не габаритные размеры.
Чтобы не навредить сложным электронным системам вашей собственной машины, эта, казалось бы, элементарная процедура требует соблюдения строгой последовательности действий.
1. Соедините красный кабель с клеммой (+) на заряженном аккумуляторе.
2. Соедините другой конец красного кабеля с клеммой (+) на «севшем» аккумуляторе.
3. Соедините черный кабель с клеммой (-) на заряженном аккумуляторе.
4. Соедините другой конец черного кабеля с чистой точкой заземления на блоке двигателя или на шасси, главное — подальше от аккумулятора, карбюратора, топливных шлангов и т.п. В момент подсоединения будьте готовы к небольшой искре.
5. Следите, чтобы оба кабеля не касались движущихся деталей.
6. Попробуйте запустить автомобиль с «севшим» аккумулятором. Если двигатель не заведется, подождите несколько минут и повторите попытку. Если же заведется, дайте ему поработать несколько минут в таком положении. Если не заведется повторите попытку через 2-3 минуты.
7. При отсоединении кабеля следуйте описанной выше процедуре в обратной последовательности.
8.2 Запуск машины при помощи предпускового зарядного устройства Вымпел. Подключаете устройство, выставляете максимальный ток 18А, оживляете акумулятор в течении 10-15 мин. Затем не отключая зарядного устройства пробуете завести. Если не получилось повторяете попытку заново.
9. Особенности эксплуатации АКБ в летний перио
д
Не удивляйтесь, если однажды вам будет трудно или вообще не завести машину в жаркую погоду. Теплое время года — такое же испытание, как и холод. Тепло ускоряет химические процессы. Неисправности и дефекты электрической системы автомобиля или аккумулятора незамедлительно скажутся на состоянии батареи. Но, скорее всего, узнаете вы об этом в самый неподходящий момент. Например, ночью во время дождя, когда придется включить освещение, вентиляцию и стеклоочистители. Поэтому не расслабляйтесь. Лето — самый подходящий период для покупки нового аккумулятора.
Летом автомобилист не сразу заметит, что в аккумуляторе плотность электролита и его уровень в банках недостаточные. Но чем выше температура окружающей среды, тем активнее электрохимические процессы. В результате электролиза кислород вступает во взаимодействие с пластинами, а ставший свободным водород испаряется. Таким образом, из электролита исчезает вода. Как только уровень раствора оказывается ниже уровня пластин, начинается сульфатация пластин (сульфат свинца растворяется в электролите, а затем оседает на поверхности пластин уже в виде крупных нерастворимых кристаллов и происходит изоляция пластин от электролита). Емкость батареи уменьшается. Электрохимические реакции останавливаются. Аккумулятор выходит из строя.
Имейте в виду, что во время длительного хранения аккумулятора происходит саморазряд (снижение ёмкости). Оставлять батарею в разряженном состоянии не рекомендуется: в этом случае вода испаряется, и открываются пластины. А дальше все, как описано выше.
Саморазряд увеличивается от высокой температуры, грязи и электролита (воды) на крышке батареи. Еще одна причина возникновения паразитных токов — неодинаковая плотность электролита в разных банках и на разных уровнях. Это может произойти после доливки большого количества воды. Чтобы избежать неприятностей, зарядите аккумулятор или проедьте на машине, чтобы плотность раствора сравнялась. Есть еще один совет: доливайте дистиллированную воду в аккумулятор при работающем двигателе. Это обеспечит ее перемешивание с кислотой.
Ускорение электролиза способствует уплотнению активной массы. Этой “болезнью” страдают отрицательные пластины, активная масса которых во время эксплуатации постепенно уплотняется, а ее пористость уменьшается. Доступ электролита внутрь отрицательных пластин затрудняется, что снижает ёмкость батареи. К тому же уплотнение активной массы может сопровождаться образованием трещин и отслаиванием.
Пластины коробятся при увеличении силы зарядного тока, при коротком замыкании, понижении уровня электролита, частом и продолжительном включении стартера, когда батарея нагружается разрядным током большой силы. Чаще короблению подвержены положительные пластины, при этом в их активной массе образуются трещины, и она (активная масса) начинает выпадать из решеток.
Причиной выпадения активной массы из решеток пластин может стать длительная перезарядка, плохое крепление пластин, вибрация и т.д. Осыпающийся активный слой в конце-концов замыкает пластины, сокращает мощность и срок службы. В современных аккумуляторах пластины помещаются в конверт-сепараторы; осадок выпадает, но короткого замыкания удается избежать.
Летом вентиляционные отверстия забиваются пылью. Чтобы батарея не лопнула и не взорвалась следите за чистотой аккумулятора. Пробки заливных отверстий должны быть плотно закрыты.
Как сохранить свой аккумулятор летом?
Во-первых, следите за уровнем электролита и регулярно доливайте дистиллированную воду. Во-вторых, не оставляйте батарею незаряженной. В-третьих, следите за чистотой корпуса. В-четвертых, следите за состоянием электрической системы автомобиля. Неисправный стартер и генератор совершенно незаметно “подготовят” батарею к зиме и с первыми морозами она откажет.
Если вы планируете заменить аккумулятор, лучше не ждать до осени. В сезон выбор значительно меньше, цены выше, а желающих больше. В любом случае потребуется помощь подготовленного продавца-консультанта. Летом он сможет больше уделить вам времени.
10. Вопросы безопасности
Помните, что опасность возгорания кислорода и водорода, выделяющихся во время зарядки (а также после ее завершения), вполне реальна.
Хотя большинство серьезных производителей оборудуют крышки аккумуляторов ограничителями пламени, призванными предотвратить его попадание внутрь аккумулятора, подобная вероятность по-прежнему сохраняется.
Помните также, что искра возникает не только при отсоединении клеммы. Статического электричества от синтетической одежды может оказаться достаточно, чтобы вызвать взрыв.
Взрыв аккумулятора можно сравнить по мощности с выстрелом из ружья калибра 12мм. Результат представляет собой жуткое зрелище, и происходит это чаще, чем вы можете себе представить. При том, что взрыв, вероятно, не будет смертельным, он может серьезно травмировать вас, особенно лицо, так как осколки пластика разлетаются во все стороны. Поэтому всегда следует быть в защитных очках.
Если вдруг позарез понадобилось отсоединить аккумулятор на машине с работающим мотором (лучше, конечно, не подвергать свой автомобиль таким испытаниям), прежде надо включить как можно больше потребителей электроэнергии: печку, фары, противотуманки, «дворники». Если этого не сделать, то может сгореть регулятор напряжения, а следом откажет электрооборудование и в том числе — системы управления двигателем. А для начала загляните в инструкции: позволяет ли она вообще производить такую операцию. Ведь на автомобилях некоторых марок, напичканных современной аппаратурой, любое отключение аккумулятора выводит из строя сложные электронные системы.
11. Хранение аккумуляторной батареи
1.снимите аккумулятор с машины (оставьте на машине со снятыми клеммами), очистите от грязи, полностью зарядите.
2.при отсутствии возможности подзарядки во время хранения АКБ можно рекомендовать следующий способ. Электролит в аккумуляторе необходимо заменить 5-процентным раствором борной кислоты. Перед заменой электролита АКБ полностью заряжают, а затем сливают электролит в течение 15 минут. Затем ее сразу же промывают дважды дистиллированной водой, выдерживая воду по 20 минут. После промывки наливают раствор борной кислоты, заворачивают пробки с открытыми вентиляционными отверстиями, вытирают батарею и ставят на хранение. Саморазряд аккумуляторов с раствором борной кислоты практически отсутствует.
Справка
Для приготовления 5-процентного раствора борной кислоты необходимо в 1 литре дистиллированной воды, нагретой до 50…60°С, растворить 50г борной кислоты. Раствор заливают в аккумуляторы при температуре 20…30°С.
Хранить батарею надо при температуре не ниже 0°С, поскольку заливаемый 5-процентный раствор борной кислоты может замерзнуть. А для ввода такой батареи в действие из нее выливают раствор борной кислоты в течение 15…20 минут и сразу же заливают сернокислый электролит плотностью 1.38…1.40 г/см3 для нашей зоны. После 40-минутной пропитки пластин электролитом АКБ можно устанавливать на автомобиль, если плотность электролита не уменьшилась ниже 1.24…1.25 г/см3. Если она стала ниже, следует откорректировать плотность отбором слабого раствора и добавлением электролита плотностью 1.40 г/см
12. Приложения
12.1. Реанимация аккумулятора
Реанимация аккумулятора. Старый фирменный аккумулятор может послужить еще, если его правильно восстановить! Итак, начнём. Имеем на руках убитый или почти убитый аккумулятор.
Нам понадобятся некоторые материалы и инструменты:
1) Свежий электролит (номинальной + желательно повышенной плотности)
2) Дистиллированная вода.
3) Измеритель плотности электролита (ареометр). Например ареометр производства НПП «Орион CПб»
4) Зарядное устройство, способное обеспечить малые (0.05-0.4А) токи зарядки.
5) Маленькая клизма (простите, надо!) и пипетка для наливных целей.
6) Нагрузочная вилка. НПП «Орион СПб» производит 4 модели: от простых и дешевых НВ-01, НВ-02, до профессиональных НВ-03, НВ-04.
Для начала определимся с возможными неисправностями:
1) Засульфатированность пластин — ёмкость аккумулятора падает почти до нуля.
2) Разрушение угольных пластин — при зарядке электролит становится черным.
3) Замыкание пластин — электролит в одной из секций аккумулятора выкипает, секция греется. (Тяжелый случай, но иногда небезнадежный)
4) Перемёрзший аккумулятор — распухшие бока, электролит при заряде сразу вскипает (многочисленные замыкания пластин) — тут уж ничем не помочь, аминь, упокой Господь его душу!
Начнем с конца списка. (п.3) При замыкании пластин ни в коем случае не пытайтесь его заряжать! Начинаем промывку дистиллированной водой. Не бойтесь переворачивать и трясти аккумулятор, хуже уже не будет. Промывайте его до тех пор, пока не перестанет вымываться угольная крошка (надеюсь, этот момент наступит, иначе прекратите этот мазохизм). При промывке часто замыкание пластин устраняется, и мы переходим от пункта (3) к пункту (2). После промывки и вытряхивания всякого мусора из недр аккумулятора приступаем к пункту (1), а именно к устранению отложений солей на пластинах аккумулятора. Следуйте инструкциям к присадке. Мой опыт может отличаться от того, что вы прочтёте в инструкции. Далее я делаю так:
1) Заливаем аккумулятор электролитом номинальной плотности (1.28 г/см3).
2) Добавляем присадку, исходя из объёма аккумулятора (см. инструкцию)
3) Даём электролиту выдавить воздух из секций, а присадке — раствориться в течении 48 часов (!), при необходимости доливаем электролит до номинального уровня. Кстати, присадку можно растворить в электролите до заливки в аккумулятор, если, конечно, она хорошо растворяется.
4) Подключаем зарядное устройство (не забудьте снять пробки!). НО МЫ НЕ БУДЕМ ЕГО ЗАРЯЖАТЬ! НЕ СЕЙЧАС! Сначала мы будем гонять его по циклу «зарядка-разрядка», иначе «тренировка», то есть заряжать и разряжать его, пока не восстановится нормальная ёмкость. Выставляем ток зарядки в районе 0.1- 0.2 А и следим за напряжением на клеммах. Не давайте электролиту кипеть или нагреться! Если необходимо, уменьшите зарядный ток, пузырьки газа и перегрев разрушают аккумулятор! Заряжайте, пока напряжение на клеммах аккумулятора не достигнет 2.3 — 2.4В на каждую секцию, т.е. для 12-вольтового аккумулятора — 13.8-14.4 В.
5) Уменьшаем зарядный ток вдвое и продолжаем зарядку. Зарядку аккумулятора прекращаем, если в течении 2 часов плотность электролита и напряжение на клеммах остаются неизменными.
6) Доводим плотность до номинальной доливкой электролита повышенной плотности (1.4) или дистиллированной воды.
7) Разряжаем аккумулятор через лампочку током примерно в 0.5А до падения напряжения на клеммах до 1.7В на элемент. Для 12-вольтового аккумулятора эта величина составит 10.2В, для 6-вольтового 5.1 соответственно. Из имеющихся величин тока разряда и времени разряда вычисляем ёмкость нашего аккумулятора. Если она ниже номинальной (4 ампер-часа), то:
Повторяем цикл заряда с начала до тех пор, пока ёмкость аккумулятора не приблизится к номинальной.
9) Добавляем в электролит ещё немного присадки и закрываем отверстия аккумулятора. ВСЁ!!! Мы имеем на руках рабочий аккумулятор, который, иногда способен проработать дольше китайского!
Дальше обращаемся с аккумулятором, как положено.
12.2. Ещё несколько способов, основанных на использовании электрического тока.
Способ первый — простой. Электролит заменить дистиллированной водой и зарядить аккумулятор или батарею очень небольшим (примерно 0.01 ёмкости) током. При этом в банках степень сульфатации снижается и образуется электролит, который заменять не нужно. После двух часов зарядки ее прекращают на такое же время. А затем снова повторяют.
Доказано, что после одного-трех таких циклов степень сульфатации резко снижается.
Второй способ — наиболее трудоемкий, но в безвыходном положении его тоже можно применить. Он химический, включает следующие операции: заряд батареи в течение 2…3 часов, слив электролита из банок, двух-трехкратная их промывка дистиллированной водой, заправка 2.5-процентным (25 г на 1 л) раствором питьевой соды и выдержка в течение 2…3 часов, слив раствора, заправка 2…3-процентным раствором повареной соли, заряд батареи в течение 1ч, слив раствора, промывка 4-процентным раствором питьевой соды, полный (из расчета 150-процентной ёмкости) заряд батареи, третья промывка банок, заправка их электролитом, полный (150-процентной ёмкости) заряд батареи.
METTLER TOLEDO Весы для лаборатории, производства и торговли
Измерительные приборы — это оборудование, используемое для точного определения различных параметров исследуемых объектов. Наша компания занимается …
Измерительные приборы — это оборудование, используемое для точного определения различных параметров исследуемых объектов. Наша компания занимается производством и обслуживанием контрольно-измерительных приборов и весового оборудования для различных отраслей промышленности.
Предлагаем купить измерительные приборы для оптимизации технологических процессов, повышения производительности и снижения затрат. Точные инструменты позволят установить соответствие нормативным требованиям.
Мы осуществляем продажу измерительных приборов, предназначенных для исследовательской деятельности и научных разработок, производства продукции и контроля качества, логистики и розничной торговли. МЕТТЛЕР ТОЛЕДО предлагает следующие измерительные приборы для различных областей применения:
Лабораторное оборудование
Для научных и лабораторных исследований требуются высокоточные измерительные и аналитические приборы и системы. Они используются для взвешивания, анализа, дозирования, автоматизации химических процессов, измерения физических и химических свойств, концентрации газов, плотности, спектрального анализа веществ и рефрактометрии, химического синтеза, подготовки проб, реакционной калориметрии, анализа размеров и формы частиц. Специализированное программное обеспечение позволяет управлять процессами и получать наглядное отображение данных.
Лабораторное оборудование включают следующие системы:
Промышленное оборудование
Если вас интересуют промышленное измерительное оборудование, предлагаем купить подходящие системы для взвешивания, контроля продукции, решения логистических задач и транспортировки грузов. Используйте точные приборы для стандартного и сложного дозирования, взвешивания в сложных условиях и взрывоопасной среде. Обеспечьте точность результатов с помощью поверочных гирь и тестовых образцов. Подключение периферийных устройств к приборам позволит регистрировать результаты и параметры взвешивания. Программное обеспечение с понятным интерфейсом оптимизирует процессы посредством управления оборудованием с ПК.
Ассортимент промышленных контрольно-измерительных приборов и инструментов включает:
Весы для магазинов и оборудование для розничной торговли
В сфере розничной торговли продовольственными товарами необходимы измерительные приборы и оборудование для взвешивания и маркировки товаров. Используйте весы для решения типовых задач, печати чеков и быстрого взвешивания, разгружающего поток покупателей. В сложных ситуациях пригодятся специализированные весовые системы с нетребовательным обслуживанием и уходом. ПО и документация упростят настройку системы и обучение персонала.
Вниманию покупателей предлагаются следующее оборудование для торговли:
Как купить весы МЕТТЛЕР ТОЛЕДО?
Чтобы купить оборудование на нашем сайте, оформите запрос в режиме онлайн в соответствующем разделе. Уточните задачу, которая должна быть решена с помощью требуемого прибора. Укажите контактные данные: страну, город, адрес, телефон, e-mail, название предприятия. Заполненная форма направляется специалисту компании, который свяжется с вами для уточнения ключевых моментов.
Сеть представительств METTLER TOLEDO для обслуживания и сервисной поддержки распространена по всему миру. В России отдел продаж и сервиса расположен в Москве. Региональные представительства по продажам находятся также в Казани, Ростове-на-Дону, Самаре, Екатеринбурге, Красноярске, Уфе, Хабаровске, Новосибирске.
Отправьте отзыв, задайте вопрос специалисту, свяжитесь с конкретным отделом. Воспользуйтесь онлайн-формой обратной связи или позвоните по указанному телефону офиса в выбранном регионе. Консультанты ответят на каждое обращение и вышлют коммерческое предложение по индивидуальному запросу.
состав и свойства — Информация
Пластиковый корпус и два контакта для подключения проводов. Именно так представляется автомобильный аккумулятор большинству из современных владельцев авто. Однако чтобы эксплуатировать его максимально эффективно, безопасно и без неожиданных сюрпризов, о батарее стоит знать немного больше.
Сегодня речь пойдет о столь важной составляющей конструкции авто и мото аккумуляторов, как электролит. Он представляет собой раствор серной кислоты, которая считается, пожалуй, одним из ключевых химических соединений в мире. Это обусловлено широким спектром ее применения. Раствор серной кислоты продается под различными наименованиями, которые зависят от степени крепости, а также уровня чистоты. Приведем несколько распространенных примеров:
- Камерная кислота – раствор серной кислоты с водой в пропорции от 60:40 до 70:30.
- Башенная кислота – раствор с соотношением от 75:25 до 82:18.
- Купоросное масло с содержанием серной кислоты до 97%.
- 100% серная кислота – моногидрат.
Если говорить о максимальной крепости, получаемой способом выпаривания, то этот параметр может достигать 98,5%. Однако для заправки аккумуляторных батарей ключевое значение приобретает чистота растворов купоросного масла с химической точки зрения.
Отметим также, что концентрированной серной кислотой называется совершенно прозрачная жидкость, не имеющая ни цвета, ни запаха. Она обладает консистенцию легкого масла. Ее удельный вес составляет 1б84 при температуре 15°С. В ней содержится примерно 95% серной кислоты. Концентрат может смешиваться с водой в любой пропорции. Изготавливая электролит в бытовых условиях, следует помнить, что смешивание воды и кислоты вызывает выделение значительного количества тепла. Температура кипения концентрированной серной кислоты составляет 338 градусов Цельсия.
Интересным фактом из курса химии является сокращение объема раствора. Примечательно то, что при смешении двух объемов серной кислоты и воды, соответственно, их итоговый объем будет меньше, чем суммарный.
Также обратите внимание на то, что удельный вес или плотность электролита авто или мото аккумулятора имеет непосредственную зависимость от тех температур, при которых работают аккумуляторы. Так, при эксплуатации в условиях низких температур нужен более плотный электролит. А в жарких странах – напротив – плотность электролита сознательно снижается. Это объясняется тем, что при таких температурах существенно повышается химическая активность раствора.
В заключение отметим, что плотность электролита также зависит от того, в каких режимах эксплуатируется батарея. Так, данный параметр для тяговых аккумуляторов обычно составляет 1.26 кг\с м³ , пусковые и осветительные источники питания имеют плотность до 1.3 кг\с м³ и т.д. Для автомобильных аккумуляторных батарей эта характеристика читается нормой, когда составляет 1.28 кг\с м³ .
23.08.2013, 68464 просмотра.
Формула электролита / энергии, Electrolyte / Energy Formula, Pure Encapsulations, 340 граммов
Физическая активность играет важную роль в вашем общем здоровье. Он поддерживает сердечно-сосудистое благополучие, крепкие кости и многое другое. Однако, тело нуждается в питательной поддержке, чтобы функционировать эффективно.
Во время напряженных тренировок ‚ваше тело теряет электролиты. Эти электролиты включают хлорид, калий, натрий, магний и кальций. Они несут ответственность за поддержку функционирования мышц и поддержание вашей гидратации. Кроме того, вы можете тренироваться в течение более длительных периодов времени, пополняя запас электролитов, поскольку они могут снизить уровень напряжения, которое вы чувствуете. Аминокислота, известная как l-тирозин, может также повысить физическую выносливость и умственную концентрацию.
Кроме того, мальтодекстрин и глюкоза обеспечивают энергию, которую можно быстро использовать. Они могут отсрочить наступление усталости и помешать вашему организму использовать труднодоступные запасы гликогена. Альфа-кетоглутарат и яблочная кислота также могут повысить ваши энергетические уровни, благодаря их вовлечению в цикл Кребса.
Формула Электролит / Энергия от Pure Encapsulations является удобным источником электролитов и кофакторов. Он обладает освежающим натуральным лимонно-лаймовым вкусом, чтобы вдохновить вас пить больше!
Ваше тело также нуждается в питательных веществах, чтобы поддержать себя после тренировки. Витамин С может способствовать улучшению восстановления тканей, что позволит вам быстрее вернуться в игру. Этот витамин также защищает ваши мышцы от потенциально вредных свободных радикалов, которые могут генерироваться во время тренировок.
Смешайте одну мерную ложку с восемью-десятью унциями воды и пейте за 20 минут до тренировки в течение по крайней мере одного или двух часов. При рекомендуемом размере порции ‚каждый контейнер с формулой электролита / энергии Pure Encapsulations должен длиться около 20 дней.
Pure Encapsulation стремится разрабатывать и производить высококачественные гипоаллергенные пищевые добавки. Контроль качества в процессе разработки и производства имеет первостепенное значение. Все продукты Pure Encapsulation сделаны из самых биодоступных ингредиентов.
В качестве пищевой добавки принимайте 1 мерную ложку, смешанную с 8-10 унциями воды, за 20 минут до интенсивных упражнений или по указанию врача.
- Взломоустойчивый.
- Используйте только в том случае, если защитное уплотнение не повреждено.
- Если вы беременны, проконсультируйтесь с врачом перед приемом этого или любого другого продукта.
- Хранить в недоступном для детей месте.
- Хранить в закрытом виде в прохладном, сухом месте.
Эти утверждения не были оценены Управлением по контролю за продуктами и лекарствами (FDA). Эти продукты не предназначены для диагностики, лечения или лечения любых заболеваний или заболеваний. Пожалуйста, проконсультируйтесь с врачом перед началом любой программы упражнений или пищевых добавок или перед использованием этих или любых других продуктов во время беременности, или если у вас серьезное заболевание.
Электрический ток в электролитах — материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: носители свободных электрических зарядов в жидкостях.
Электролитом мы называем раствор (или расплав) вещества, через который может идти электрический ток; при этом исходное вещество проводником тока не является.
Например, кристаллы поваренной соли не проводят ток. Дистиллированная вода — тоже диэлектрик. Однако при растворении соли в воде получается среда, через которую ток отлично проходит! Следовательно, солёная вода будет электролитом (Вот почему запрещено купаться во время грозы — в водоёмах всегда растворено некоторое количество солей. При ударе молнии по воде пойдёт электрический ток).
Электролитами оказываются растворы солей, кислот и оснований. Прохождение тока через эти растворы означает, что в них имеются свободные заряды. Откуда же они там берутся, если ни в воде, ни в исходном веществе свободных зарядов не было?
Электролитическая диссоциация
Механизм, обеспечивающий появление свободных зарядов в электролите, называется электролитической диссоциацией. Мы ограничимся рассмотрением электролитической диссоциации в растворах.
Вообще, диссоциация — это распад молекулы на составные части под влиянием тех или иных факторов.В процессе электролитической диссоциации молекулы растворяемого вещества распадаются на положительные и отрицательные ионы в результате действия электрических сил со стороны молекул воды.
Многие свойства воды объясняются тем, что её молекулы являются полярными, то есть в электрическом отношении ведут себя как диполи (напомним, что диполь — это система двух одинаковых по модулю и противоположных по знаку зарядов, расположенных на небольшом расстоянии друг от друга). Полярность молекул обусловлена их геометрическим устройством (рис. 1 (изображение с сайта howyourbrainworks.net)).
Рис. 1. Молекулы воды
Угол, образованный линиями центров атома кислорода и двух атомов водорода, составляет примерно . Кроме того, электронные оболочки смещены в сторону кислорода. В результате центры положительных и отрицательных зарядов оказываются пространственно разделёнными: «минусы» преобладают в кислородной части молекулы воды, а «плюсы» — в водородной части.
Будучи диполями, молекулы воды создают вокруг себя электрическое поле и действуют электрическими силами как друг на друга, так и на молекулы примесей (притягиваясь друг к другу противоположно заряженными частями, молекулы воды создают весьма прочные связи. Вот почему столь велики удельная теплоёмкость и удельная теплота парообразования воды — на разрыв этих связей требуется значительная энергия).
Почему же соли, кислоты и основания распадаются в воде на ионы? Всё дело в том, что молекулы этих веществ также являются полярными. Давайте вернёмся к нашему примеру с растворением поваренной соли .
У атома натрия на внешнем электронном уровне находится один электрон. Он слабо связан с атомом и всегда готов покинуть место своего обитания. У атома хлора на внешнем электронном уровне семь электронов — одного как раз не хватает до полного комплекта. Атом хлора всегда готов захватить себе недостающий электрон.
Поэтому при образовании молекулы внешний электрон атома натрия уходит к атому хлора, и в результате молекула становится полярной — она состоит из положительного иона и отрицательного иона . Эта молекула схематически изображена на рис. 2 (атом хлора крупнее, чем атом натрия).
Рис. 2. Молекула
Иными словами, с электрической точки зрения молекула также оказывается диполем.
Взаимодействие двух сортов диполей — молекул и — как раз и вызывает процесс растворения.
На рис. 3 мы видим, как протекает этот процесс (изображение с сайта intro.chem.okstate.edu). Более крупные зелёные шарики изображают ионы хлора, более мелкие серые — ионы натрия.
Рис. 3. Электролитическая диссоциация: растворение в воде
Левая часть рисунка показывает ситуацию до начала растворения. Крупица соли в виде небольшого кубического кристаллика (Кристаллическая решётка поваренной соли имеет кубическую структуру. В вершинах куба в шахматном порядке, крест-накрест расположены атомы натрия и хлора) только что оказалась в воде.
Сразу же начинается «электрическая атака» со стороны молекул воды. Отрицательно заряженные (кислородные) части молекул обращаются к положительным ионам натрия, а положительные (водородные) части молекулы воды — к отрицательным ионам хлора. Молекулы начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
В конце концов эта связь становится настолько слабой, что удары соседних частиц, совершающих тепловое движение, разрушают молекулу . Она распадается на положительный ион и отрицательный ион .
В правой части рис. 3 мы видим результат такого распада: вырванные из кристаллической решётки ион хлора и ион натрия отправляются «в свободное плавание», окружённые прицепившимися к ним молекулами воды. Обратите внимание, что молекулы воды прилипли к отрицательному иону хлора своими положительными водородными частями, а к положительному иону натрия, наоборот, повернулись их отрицательные кислородные части.
Таким образом, при растворении соли в воде появляются свободные заряды: положительные ионы и отрицательные ионы (рис. 4). Это и является необходимым условием прохождения тока через раствор.
Рис. 4. Раствор в воде
Описанный выше процесс растворения совершенно аналогично протекает и в случае других примесей.Так, щёлочь распадается в водном растворе на положительные ионы калия и отрицательные ионы гидроксильной группы . Молекула серной кислоты при распаде даёт два положительных иона и отрицательно заряженный ион кислотного остатка В растворе медного купороса появляются положительные ионы меди и отрицательно заряженные ионы
Все ли молекулы растворяемого вещества распадутся на ионы? Это зависит от ряда условий.
Степенью диссоциации называется отношение числа распавшихся молекул к общему начальному числу молекул. При полном растворении вещества степень диссоциации равна .
Наряду с диссоциацией имеет место и обратный процесс: рекомбинация. А именно, две частицы противоположного знака могут встретиться и снова образовать нейтральную молекулу (рекомбинировать). С течением времени в растворе устанавливается состояние динамического равновесия: среднее число диссоциаций в единицу времени равно среднему числу рекомбинаций, в результате чего концентрация раствора остаётся неизменной (вспомните аналогичную ситуацию с насыщенным паром: при динамическом равновесии пара и жидкости среднее число вылетевших из жидкости молекул равно среднему числу молекул, вернувшихся обратно из пара в жидкость, так что концентрация насыщенного пара неизменна).
Процессы диссоциации-рекомбинации записываются в виде следующих уравнений, отражающих состояние динамического равновесия:
Изменение внешних условий может нарушить текущее динамическое равновесие и сместить его в ту или иную сторону. Например, при повышении температуры увеличивается скорость диссоциации, и концентрация положительных и отрицательных ионов в растворе возрастает.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
2. Отрицательные ионы — атомные или молекулярные кислотные остатки (например, или ), а также гидроксильная группа .
Второе отличие от металлов заключается в том, что носители свободных зарядов в электролите могут иметь заряд, равный по модулю как элементарному заряду , так и целому числу элементарных зарядов . Здесь — валентность атома или группы атомов; например, при растворении медного купороса имеем .
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом, а отрицательный — катодом (Имеется народная мудрость для запоминания знаков анода и катода: Андрей — парень положительный, Катька — девка отрицательная ;-)).
Рис. 5. Ионная проводимость электролита
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
Электролиз
Положительные и отрицательные ионы, будучи носителями свободных зарядов, в то же время являются частицами вещества. Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Явление переноса вещества при прохождении электрического тока через электролит называется электролизом. Законы электролиза были экспериментально изучены Фарадеем.
В процессе электролиза происходит разложение растворённого вещества на составные части и выделение этих частей на электродах. Так, в растворе медного купороса положительные ионы меди идут на катод, в результате чего катод покрывается медью. Кислотный остаток выделяется на аноде.
Естественным образом возникает вопрос о нахождении массы вещества, выделяющегося на электроде за определённое время . Эта масса, очевидно, совпадает с массой данного вещества, перенесённого током за время через электролит.
Пусть — масса одного иона этого вещества, — заряд иона ( — валентность вещества). Предположим, что за время через электролит прошёл заряд . Число ионов, пришедших на электрод, тогда равно . Масса выделившегося на электроде вещества равна суммарной массе пришедших ионов:
(1)
Величина является характеристикой вещества и называется его электрохимическим эквивалентом. Значения электрохимических эквивалентов различных веществ приводятся в таблицах.
При протекании через электролит постоянного тока за время проходит заряд . Подставляя это в формулу (1), получим первую формулу Фарадея:
(2)
Первый закон Фарадея. Масса выделяющегося на электроде вещества пропорциональна силе тока, протекающего через электролит, и времени прохождения тока.
Теперь преобразуем выражение для электрохимического эквивалента, введя молярную массу вещества:
Подставляя это выражение в (2), получим вторую формулу Фарадея:
(3)
Второй закон Фарадея. Масса выделяющегося на электроде вещества прямо пропорциональна молярной массе этого вещества и обратно пропорциональна его валентности.
В формуле (3) мы видим произведение двух констант и . Оно также является константой и называется постоянной Фарадея:
Кл/моль.
Формула (3) с постоянной Фарадея запишется так:
Как повысить плотность электролита в аккумуляторе?
Каждый год автолюбители сталкиваются с проблемой зарядки аккумулятора, сульфатации и десульфатации. Многие измеряют плотность электролита и пытаются ее восстановить. Но почему нельзя повысить плотность аккумулятора без добавления кислоты в электролит? Давайте ответим на этот вопрос.
Рассмотрим процессы, которые протекают при заряде и разряде аккумулятора — теория аккумулятора
Классическая формула:
⇐ заряд
Pb + PbO2 + 2H2SO4 ⇐ ⇒ 2PbSO4 + 2H2 O (1)
разряд ⇒Если внимательно разобрать формулу, то очевидно, что при разряде аккумулятора у нас образуется такое вещество, как сульфат свинца. Это вещество (соль) очень плохо растворимо в воде и при определенной концентрации выпадает в осадок, иногда образуя кристаллы. Из за образования данного вещества и уменьшения концентрации кислоты в электролите, соответственно пропадает плотность. Доведя аккумулятор до абсолютного разряда, плотность в электролите станет ровна единице. В растворе, будет отсутствовать кислота.
Если мы вернемся к вопросу: «Почему нельзя повысить плотность не добавляя кислоты в электролит?», а только лишь повышением напряжения, то ответ очевиден.
Предположим у нас при плотности 1,25 г/см3, которую залили на заводе, в аккумуляторе присутствует 100 молекул кислоты при полном заряде, мы начали разряжать аккумулятор, получаем 100 молекул сульфата. Если дальше заряжать аккумулятор мы опять получим те же 100 молекул кислоты и плотность 1,25 г/см3 (если не испарилась вода).
Вывод: если мы не добавляли кислоту в электролит, и у нас повысилась плотность – мы потеряли воду.
Теперь давайте разберемся с коварным веществом сульфатом свинца. Это вещество очень плохо растворимо в воде, а это значит, что насыщенный раствор данного вещества получается при очень небольшой его концентрации в электролите. Когда мы разряжаем аккумулятор, концентрация раствора сульфата свинца возрастает. Поэтому все производители аккумуляторов пишут придельное напряжение разряда аккумулятора (для 12В аккумулятора это 10,8В). Дальнейший разряд приводит к тому, что образуется перенасыщенный раствор сульфата свинца. С перенасыщенными растворами мы встречались в школе. Например, выращивая кристаллы из медного купороса. Когда в перенасыщенный раствор попадает нить, то на ней сразу начинает расти красивый синий камень. Такой же процесс происходит в аккумуляторе, начинают расти кристаллы сульфата свинца и самая большая проблема, они уже обратно не растворяются в воде. Именно этот процесс принято называть сульфатацией. Эти кристаллы не проводят электричество, поэтому вырастание их на пластинах приводит к умиранию аккумулятора. Свойства этого кристалла можно сравнить с кристаллом оксида алюминия. Например, алюминиевая ложка не растворяется в чае, хотя алюминий, в чистом виде, очень хорошо вступает в реакцию и с водой и с воздухом. Так вот, когда мы изготавливаем алюминиевую ложку, поверхностный слой практически сразу вступает в реакцию с воздухом и ложка покрывается тончайшим слоем оксида алюминия, который мы не видим, и именно этот слой защищает нашу ложку от растворения в чае (или в частности в воде).
Так же и с сульфатом свинца в аккумуляторе, он оседает на поверхности пластин и не дает нормальному протеканию процессов.
Обратим внимание на процессы ускоряющие сулифатацию. Как раз недостаток воды, которая испаряется, очень сильно влияет на ускорение процесса. Мы только что обсудили перенасыщенный раствор сульфата. Так вот перенасыщение его произойдет быстрее, если в аккумуляторе не хватает воды, следовательно и оседание сульфата на поверхностях пластины пройдет быстрее.
Возвращаясь к нашим 100 молекулам — в связанном состоянии теряем группу SO4, далее при заряде мы уже получаем , к примеру, 50 молекул кислоты. Емкость аккумулятора изменилась в меньшую сторону.
Теперь вернемся к процессам заряда аккумулятора зарядными устройствами. Есть две (не будем сильнее углубляться в тему) основные схемы заряда аккумулятора, постоянным током (часто пишут IU) и постоянным напряжением (UI). Например, зарядные устройства Optimate используют первую схему. Она более правильная. Смысл ее в том, что в аккумулятор подается постоянный ток. Происходит та реакция, о которой мы говорили выше, оставшиеся наши молекулы, а их осталось 50, становятся снова кислотой. И так как замещать больше нечего, напряжение на пластинах повышается до 14,4В. Optimate понимает, что замещать больше нечего и переходит в другой режим работы. Дальнейший заряд не приведет к увеличению емкости, а лишь усугубит положение путем выпаривания воды из электролита.
Если мы заряжаем постоянным напряжением, то устройство не понимает, произошла ли вся замена растворенных молекул сульфата свинца на молекулы кислоты. А это ведет к тому, что дальнейшая подача тока в аккумулятор будет замещать не сульфат свинца, а непосредственно восстанавливать воду до молекул водорода и кислорода, выпаривая ее дальше из электролита. Процесс кипения аккумулятора — это активное выделение на пластинах водорода и кислорода приводит к визуальному представлению, что аккумулятор кипит. К чему приводит потеря воды мы рассмотрели выше.
Лучшие инструменты
PL-C010P
Зарядное устройство Battery Service Expert, PL-C010P
14.4/14.7/16В, ток 2,5, 6, 10А, десульфатация — импульсы/16В, SLA, GEL, AGM, Ca/Ca
8 350 ₽
Технология залитого аккумулятора от VARTA®
VARTA® предлагает обширную линейку залитых свинцово-кислотных аккумуляторов для широкого диапазона автомобилей. Каждый аккумулятор создан, чтобы отвечать специфическим требованиям наших потребителей во всем мире — как производителей оборудования, так и покупателей на рынке компонентов.
Залитые свинцово-кислотные аккумуляторы являются наиболее распространенным типом аккумуляторов. Жидкий электролит, состоящий из серной кислоты и воды, покрывает все внутренние детали. Залитые аккумуляторы VARTA обладают герметичной конструкцией, поэтому они защищены от протеканий.
Залитые аккумуляторы для легковых автомобилей
Наши залитые 12-вольтовые аккумуляторы разработаны, чтобы удовлетворять потребности в электроэнергии современных автомобилей, и обеспечивают надежную пусковую мощность снова и снова в самых сложных климатических условиях. В них используется наша эксклюзивная технология решетки PowerFrame®.
Залитые аккумуляторы для водного транспорта
Мы предлагаем широкий диапазон пусковых аккумуляторов и аккумуляторов глубокого цикла для водного транспорта, которые позволяют нашим покупателям дольше быть на воде. Мы предлагаем аккумуляторы для водного транспорта на любой вкус: от высокомощных стартерных аккумуляторов до стандартных или улучшенных аккумуляторов глубокого разряда с жидким электролитом. В отличие от стандартных залитых аккумуляторов, аккумуляторы VARTA Professional Dual Purpose защищены от разлива и позволяют наклонять себя до 90° на короткое время.
Преимущества:
- Стартерные аккумуляторы обеспечивают короткий и мощный импульс для запуска двигателя.
- Аккумуляторы глубокого разряда запускают двигатели и питают приборы, если двигатели не запущены.
- Более прочная конструкция с улучшенными характеристиками работы в циклическом режиме продлевают время эксплуатации для применений с глубоким разрядом.
Залитые аккумуляторы для гольф-мобилей
Нужен ли вам аккумулятор для перемещения по полю для гольфа или надежный источник энергии для промышленного применения, типа ножничных подъемников или поломоечных машин, наши аккумуляторы для гольф-мобилей обеспечивают необходимую производительность в режиме глубокого разряда.
Преимущества:
- Активная масса высокой плотности и сплав решетки со специальной формулой позволяют аккумулятору выдерживать нагрузку множественных циклов разряда.
- Механически соединенные отверстия для удобного долива воды.
- Прочные пластины и плотная установка компонентов для виброустойчивости.
Залитые аккумуляторы для газонокосилок и садовой техники
Наши аккумуляторы для газонокосилок и садовой техники разработаны так, чтобы обеспечивать надежную пусковую мощность раз за разом. Характеристики продукта:
- Удобная конструкция, не требующая обслуживания.
- Конверты-сепараторы защищают пластины, обеспечивают необычайную пусковую мощность и предотвращают от внутреннего замыкания.
Залитые аккумуляторы для тяжелых грузовиков
Наши аккумуляторы высокой мощности для коммерческого применения обеспечивают высочайшую производительность и увеличенный срок службы в циклах для самых сложных условий. Технология решетки PowerFrame® обеспечивает более длительный срок службы, устойчивость к коррозии и до 70 % лучшее прохождение тока.
Кроме того:
- Усиленные полюсные мостики и горячий компаунд на ушках пластин увеличивают устойчивость к вибрации.
- Встроенные складные ручки обеспечивают простую переноску и установку.
- Устойчивый к ударам корпус с усиленными торцевыми стенками для большей прочности.
- Прочные сепараторы предотвращают короткие замыкания.
Формула супергидратирующего электролита — Кара Фицджеральд Н.Д. Натуропатический доктор
Это наш любимый рецепт электролита, адаптированный Всемирной организацией здравоохранения.
Гидратация особенно важна, если вы теряете много воды, например, в жаркую погоду, во время упражнений или если у вас диарея. Если вы хотите узнать больше о том, как распознать признаки обезвоживания, как избежать обезвоживания и когда обратиться за медицинской помощью, см. Наш сопутствующий блог здесь.
| Формула супергидратирующего электролита |
Формула супергидратирующего электролита
| Количество порций | Время приготовления |
| 4 чашки | 5 минут |
Ингредиенты
Порции: чашки
Единицы: метрические, США, имперские
Инструкция
- Смешайте все ингредиенты и перемешайте до полного растворения.Пейте не более 1 литра в день, если не указано иное.
- Если хотите аромат, выдавите лимон, лайм или апельсин. Или сделайте пюре из нескольких ягод или мяты (при желании можно добавить сельтерскую воду на часть 1 литра). Если вы предпочитаете сладость, можно добавить небольшое количество меда, кленового сиропа или стевии.
Примеры электролитов
Электролиты — это химические соединения, такие как жидкости или гели, которые содержат ионы и могут проводить электричество при расплавлении или растворении в растворе.Электролиты необходимы для работы аккумуляторов, а также для того, чтобы клетки регулировали свой электрический заряд и поток молекул воды через клеточные мембраны. Чрезмерное потоотделение, обезвоживание, рвота или диарея могут вызвать потерю электролитов и серьезно повлиять на здоровое функционирование организма.
Химические вещества, являющиеся электролитами
Здесь вы найдете несколько примеров электролитов.
- Хлорид натрия — также известный под формулой NaCl, хлорид натрия представляет собой соединение с равными частями натрия и хлорида.Она более известна как «соль» или «поваренная соль» и является основным ингредиентом пищевой соли, которой посыпают пищу для улучшения вкуса. Хлорид натрия присутствует в океане и является главным фактором, придающим морской воде такой соленый вкус.
- Азотная кислота — Эта сильная минеральная кислота, известная под формулой HNO 3 , представляет собой коррозионно-активную кислоту, используемую во многих областях, одна из самых распространенных из которых — ингредиент в удобрениях. Он также использовался в качестве одного из ингредиентов в некоторых типах жидкого ракетного топлива и представляет собой химическое вещество, используемое в деревообработке, чтобы дерево выглядело так, как будто оно состарилось.
- Хлорная кислота — HClO 3 — другое название этого электролита, который является очень опасным окислителем. Его можно получить в результате химической реакции.
- Хлористоводородная кислота — Эта сильная кислота широко используется в химической промышленности, но также входит в состав желатина, кожи и бытовых чистящих средств.
- Хлорид кальция — Хотя это тоже «соль» по определению, она отличается от описанной выше поваренной соли как хлорид натрия.Хлорид кальция представляет собой соединение, состоящее из кальция и хлорида, и является одним из типов соли, используемой для борьбы со льдом на тротуарах и дорогах. Компаунд часто производится из известняка.
- Нитрат калия — этот электролит, широко известный под формулой KNO 3 , используется в самых разных веществах. Его можно использовать в качестве пищевой добавки, но он также входит в состав различных видов ракетного топлива и фейерверков. Нитрат калия когда-то был известен как селитра и много лет входил в состав пороха.
- Гидроксид натрия — Гидроксид натрия, также известный как щелочь, широко использовался на протяжении всей истории человечества. Он является важным ингредиентом многих моющих средств, мыла и средств для очистки сточных вод. Это очень опасно из-за своей способности разлагать липиды и белки в коже, вызывая ожоги при неправильном обращении.
- Серная кислота — известная когда-то как купоросное масло, эта сильно коррозионная сильная кислота (известная под молекулярной формулой H 2 SO 4 ) может разъедать металлы, органические соединения, живые ткани и даже камень.Он используется в качестве электролита в некоторых типах автомобильных аккумуляторов для подачи электричества. Как и гидроксид натрия, он может вызвать очень серьезные химические ожоги при контакте с кожей, поэтому с ним очень важно обращаться с особой осторожностью.
- Ацетат натрия — еще один электролит, который включает натрий в качестве основного ингредиента, ацетат натрия часто используется для герметизации бетона, чтобы он был защищен от плохой погоды. Он также используется в качестве ингредиента в некоторых типах продуктов, таких как картофельные чипсы с солью и уксусом, из-за его соленого и острого вкуса при смешивании с другими приправами.
- Гидроксид магния — из-за своего молочного вида этот электролит долгое время был известен под названием «молоко магнезии». Он является основным компонентом многих слабительных и антацидов, а также дезодорантов и антиперспирантов для подмышек. Его также можно наносить на кожу головы как форму борьбы с себореей и перхотью.
Электролиты в организме
Электролиты также содержатся в жидкостях организма и способствуют перемещению жидкости между клетками. Общие электролиты, обнаруженные в организме, включают:
- Кальций
- Калий
- Хлор
- Магний
- Натрий
- Фосфат
Каждое из этих веществ является примерами электролитов, поскольку они обладают особым свойством проводить электричество, когда они находятся в расплавленной форме или когда они растворились в растворе.
Вкусный способ увлажнения
Чтобы гидратировался лучше и дольше оставался гидратированным, добавьте в свой рацион немного электролитов! Наша электролитическая вода — простой и вкусный способ сделать это. Это похоже на приготовление собственного спортивного напитка — без добавления сахара.
Электролиты — это минералы в крови, такие как натрий и калий, которые помогают вашему организму регулировать уровень жидкости. 1 Напитки с большим содержанием электролитов помогут вам дольше оставаться гидратированным, чем обычная вода.Цитрусовые, такие как лимоны и лаймы, содержат много электролитов. Как и кокосовая вода в нашем рецепте.
Ниже вы найдете один способ приготовления этого напитка, но вы можете изменить его любым способом по своему вкусу.
Если у вас заболевание почек или застойная сердечная недостаточность, посоветуйтесь с врачом, прежде чем делать этот напиток. Возможно, вам придется ограничить потребление жидкости.
Загрузите карту рецептов или пищевая ценность:
Настольный
Мобильный
Пищевая ценность
Электролит Вода
На две порции по 8 унций
Время подготовки: 10 минут
Время приготовления: 5 минут
Инструменты для приготовления: Средняя чаша для смешивания, 2 стакана
Состав
- 1/4 чайной ложки соли
- 1/4 стакана лимонного сока
- 1/4 стакана сока лайма
- 1 столовая ложка меда или нектара агавы
- 1 1/2 стакана кокосовой воды
- 2 стакана холодной воды
Инструкции
- 1.Смешайте соль, лимонный сок, сок лайма и нектар агавы или мед в большой мерной чашке или миске.
- 2. Добавьте кокосовую воду и холодную водопроводную воду.
- 3. Налейте в два стакана со льдом.
Сделай сам
Есть много способов внести свой вклад в электролитную воду:
- Используйте пищевую соду вместо соли, если у вас высокое кровяное давление или вы соблюдаете диету с низким содержанием натрия.
- Используйте апельсины или грейпфрут вместо лимонов и лаймов для другого вкуса.
- Добавьте свежую мяту или имбирь для аромата.
- Для улучшения вкуса используйте газированную воду вместо водопроводной.
- Добавьте порошок электролита для перорального применения, чтобы получить больше электролитов.
Источник
- 1. WebMD
Catalyte® — Восстанавливает электролиты, которые способствуют производительности, выносливости и восстановлению *
Catalyte® — Восстанавливает электролиты, которые способствуют производительности, выносливости и восстановлению * | Торн
{{banner.modal.message}}
Закрыть
Вы используете браузер, который мы больше не поддерживаем. Повысьте свой опыт с помощью Chrome, Edge, Safari или Firefox.
{{product.reviewSummary.reviewCount> 0? product.reviewSummary.reviewCount + ‘Reviews’: ‘Нет отзывов’}}
Метод сбора
{{collectionMethod}}
Что мы измеряем
{{biomarkerGroup}}
Вам следует пройти этот тест, если вы
Возможные симптомы
Информация о составе
Количество ингредиентов
Размер порции: {{product.serveSize}}
порций в упаковке: {{product.servingsPerContainer}}
| Имя | Сумма | |
|---|---|---|
| {{component.name}} | {{ингредиент.amount}} {{ингредиент.unit}} | – |
| Другие ингредиенты: {{otherIngredients}} |
Является {{product.name}} подходит именно вам?
Найдите причину своего самочувствия
Купить сейчас
{{relatedTest.shortDescription}}
{{product.name}} Подробности
Предупреждения
Отзывы
{{продукт.reviewSummary.ratingCounts [рейтинг-1]}}
Будьте первым напишите отзыв
Написать рецензию
{{review.authorName}}
Проверено
{{review.subject}}
{{review.body}}
Thorne Verified
Как использовать
Метод сбора
{{collectionMethod}}
Что мы измеряем
{{biomarkerGroup}}
Связанные
Статьи и видео
Сделайте свой собственный напиток с электролитом без сахара
Легко поддаться маркетингу спортивных напитков: если мы занимаемся спортом, нам нужно спортивных напитка, чтобы восполнить свои силы.Это заставляет задуматься, как много лет назад спортсмены и люди, занимающиеся физическими упражнениями, тренировались без них.
Однако есть много доказательств того, что электролиты действительно очень эффективны в регулировании баланса жидкости в вашем организме, особенно во время и после упражнений или болезней, а также если вы придерживаетесь строгого плана питания с низким содержанием углеводов. -углеводная диета и упражнения, или если вы придерживаетесь низкоуглеводной диеты и заболели, вам вдвойне нужны эти добавленные электролиты.
Зачем нужно больше электролитов
При низкоуглеводной диете уровень инсулина падает, и почки задерживают меньше натрия.По мере того, как вы выводите воду, важные минералы, в частности, кальций, натрий, магний, хлорид и калий, также выводятся из организма. Поэтому очень важно их восполнить, чтобы избежать таких негативных симптомов, как головокружение и обезвоживание, особенно если вы также тренируетесь или болеете.
Две столовые ложки лимонного сока почти точно содержат количество калия в 8 унциях обычного спортивного напитка. Щепотка соли обеспечивает 110 миллиграммов натрия, столько же в 8 унциях спортивного напитка.Итак, если вы хотите сделать свой собственный спортивный напиток с низким содержанием углеводов, это легко.
Однако, если вы когда-нибудь проходили по проходу со спортивными напитками в аптеке, вы знаете, что к этим продуктам добавлено много сахара и прочего мусора. Есть научная причина того, почему многие из этих напитков содержат сахар; Быстрая порция сахара обеспечивает полезную глюкозу для пополнения запасов энергии.
Большинству людей полезно употреблять небольшое количество углеводов во время тяжелых упражнений. Однако, если вы предпочитаете избегать сахара, вам может потребоваться напиток без сахара, который заменит жидкости и электролиты.
Рецепт спортивного напитка без сахара
Смешайте вместе:
- 1 стакан (8 унций) воды, негазированной
- 2 столовые ложки лимонного сока
- Маленькая щепотка соли (чайная ложка соли содержит 2300 миллиграммов натрия, поэтому вам понадобится 1/20 чайной ложки соли — немного)
- Ароматизатор и подсластитель по вкусу (по желанию). Попробуйте смесь Crystal Light Drink Mix, неподслащенный Kool Aid или сиропы без сахара. Если вы избегаете искусственных подсластителей, попробуйте стевию.
Ингредиенты для спортивных напитков
Вот что входит в состав большинства спортивных напитков и как адаптировать эти ингредиенты для низкоуглеводной диеты.
Вода
Конечно, основным ингредиентом спортивных напитков является вода. В конце концов, цель состоит в том, чтобы вас увлажнить.
Сахар
Спортивные напитки содержат довольно много сахара, но, что интересно, в них только половина сахара, чем в большинстве других коммерческих напитков. Одна бутылка Gatorade на 20 унций содержит около 34 граммов сахара, а газированная вода на 20 унций содержит около 69 граммов сахара.
В спортивных напитках содержится меньше сахара, чтобы предотвратить спазмы желудочно-кишечного тракта у спортсменов во время тренировок. Но хотя Gatorade содержит меньше сахара, чем газировка, в зависимости от ваших целей, он может быть не лучшим выбором для вас.
Вопрос о потребностях в питании людей, ограничивающих потребление углеводов, во время физических упражнений не изучался всесторонне. Мы знаем, что, когда люди сокращают потребление углеводов, их организм переходит от использования углеводов для получения энергии к использованию жира для получения энергии, хотя организму может потребоваться от двух до трех недель, чтобы сделать это изменение (это называется кетоадаптацией).
Мы знаем, что коренные народы, такие как инуиты, которые традиционно придерживались очень низкоуглеводной диеты, были и способны поддерживать интенсивные упражнения на выносливость в течение длительных периодов времени без видимого вредного воздействия. Таким образом, похоже, что со временем тела адаптируются к использование жира для получения энергии во время упражнений. Однако слишком резкое и быстрое сокращение углеводов может привести к неприятным симптомам («кето-грипп»).
В зависимости от типа упражнений, низкоуглеводная диета может быть полезной, а может и нет.
В большинстве случаев маловероятно, что вам понадобятся дополнительные углеводы во время умеренной тренировки. Однако для более длительных и энергичных тренировок (например, бега продолжительностью более часа) вам может потребоваться восполнение углеводов во время тренировки.
Кроме того, то, что вы едите до и после тренировки, также может повлиять на вашу работоспособность. Если вы хотите достичь определенных целей в фитнесе, вам будет полезно обратиться к зарегистрированному диетологу.
Электролиты
Электролиты — это молекулы определенных минералов, которые имеют электрический заряд.Наша нервная система работает на электричестве, генерируемом этими молекулами, называемыми ионами. Это означает, что каждая функция в организме, которая зависит от нашей нервной системы (движение мышц, дыхание, пищеварение, мышление и т. Д.), Требует электролитов, и организм отдает приоритет управлению ими.
Как упоминалось выше, тем, кто интенсивно тренируется в течение длительного времени, людям, соблюдающим низкоуглеводную диету, или больным может потребоваться дополнительная соль и калий. Спортивные напитки содержат небольшое количество натрия и калия.
В обычных условиях потеря минералов не проблема. Сбалансированная диета обеспечит ваше тело достаточным количеством минералов для удовлетворения ваших потребностей в электролитах, если вы занимаетесь умеренными физическими упражнениями.
Сделайте простой домашний напиток с электролитом
Купленные в магазине напитки с электролитом в бутылках производятся из химически обработанных рафинированных сахаров, они содержат пищевые красители, а также искусственные ароматизаторы и другие менее привлекательные ингредиенты, такие как бромированные растительные масла.Это все ингредиенты, которые я предпочитаю не использовать на кухне, так зачем мне подавать кому-либо напиток, содержащий все вышеперечисленное?
Это правда, что пить воду очень важно, особенно если вы много тренируетесь и потеете. Многие эксперты сходятся во мнении, что большинство людей будет в порядке, просто выпив воду и соблюдая сбалансированную диету. И есть большая разница между спортсменами, которые тренируются каждый день по несколько часов подряд, и теми, кто тренируется по 20 минут перед завтраком.
Кому нужны электролиты?
Кэтлин Финли / Getty Images
Электролиты включают кальций, натрий, магний, калий, хлорид и фосфат.По данным WebMD, это минералы, которые естественным образом встречаются в организме и могут влиять на pH-баланс жидкостей в вашем организме. В большинстве случаев ваше тело сохраняет все в равновесии, и простая вода — лучший ответ, но бывают моменты, когда домашний напиток может помочь.
Я слышал свидетельства других людей — одной из которых была беременная женщина, — которым в определенных ситуациях было трудно удержаться от обезвоживания одной водой. По совету врача моя беременная подруга начала делать домашний гидратационный напиток с натуральными электролитами, которые помогли им избежать обезвоживания.
Около пяти лет назад я серьезно заболел на неделю и обнаружил, что у меня ужасное обезвоживание. Куриный бульон с большим количеством нерафинированной соли вернул меня в страну живых — по крайней мере, я так себя чувствовал. Электролиты в соли и курином бульоне, вероятно, заставили меня чувствовать себя намного лучше, когда вода для меня ничего не делала. Я также обнаружил, что чайный гриб помогает мне чувствовать себя более увлажненным, когда я болею или в жаркий день.
WebMD говорит, что, хотя при симптомах простуды или гриппа покупать спортивные напитки — это нормально, они согласны с тем, что купленные в магазине электролитные напитки содержат слишком много сахара.Вот тут-то и пригодится рецепт, представленный ниже.
Хотя большинству из нас не нужно беспокоиться об электролитах, если мы не потеем и не тренируемся более часа, по словам специалиста по детской спортивной медицине, бывают случаи — когда вы больны, беременны, кормите грудью или выходите на улицу. много на солнце — когда напиток, содержащий натуральные электролиты, может увлажнять. Если вы хотите заменить спортивные напитки по завышенной цене, их просто приготовить дома.
Как приготовить простой электролитный напиток в домашних условиях
lucagavagna / Getty Images
Или вы можете сделать эту очень простую, легко адаптируемую версию, которая по вкусу напоминает апельсиновый лимонад с добавлением соли.Это вкусно и освежает. Я использовал местный сырой мед, который был нефильтрованным, поэтому он будет иметь слегка медовый вкус (даже с двумя столовыми ложками), но подойдет любой мед, который может быть у вас под рукой. Вы всегда можете заменить мед органическим небеленым сахаром, так как в некоторых рецептах он используется.
Супер простой напиток с электролитом
Состав:
- 1/2 стакана свежевыжатого апельсинового сока
- 1/4 стакана свежевыжатого лимонного сока
- 2 стакана фильтрованной воды
- 2-4 столовые ложки сырого меда по вкусу
- 1/8 чайной ложки нерафинированной соли (по вкусу)
В блендере смешайте все ингредиенты, пока мед или сахар не растворится.Попробуйте попробовать и при необходимости отрегулируйте. Наслаждаться.
Некоторые дополнительные естественные варианты включают простое употребление кокосовой воды. Баланс электролитов в кокосовой воде имитирует баланс электролитов в крови, а также освежает. Если хотите, можете добавить немного фруктового сока для придания аромата.
Вы также можете приготовить домашний сок в стиле «V8» с помощью соковыжималки, используя помидоры, сельдерей, морковь, немного петрушки, горсть зелени и даже лук, чеснок или красный перец. (Сельдерей содержит натуральный натрий и может сделать этот сок немного «солоноватым» на вкус, но некоторым людям нравится добавлять еще немного нерафинированной соли и молотого перца.) Другой вариант — простой овощной и фруктовый сок из 6 палочек сельдерея, 1 яблока и половины лимона.
Домашний электролитный напиток с 3 вариантами вкуса
Опубликовано: · Изменено: автор: Archana · Этот пост может содержать партнерские ссылки · Как партнер Amazon я зарабатываю на соответствующих покупках ·
Вы пробовали делать домашние напитки с электролитом? Эти средства для утоления жажды своими руками не только просты в изготовлении, но и недороги.Вы можете приготовить их с вашими любимыми вкусами и, самое главное,… зная, что именно вы вкладываете в свое тело!
Это спонсируемый пост. Я сотрудничаю с Shan Foods Global , чтобы делиться рецептами и идеями питания. Все высказанные мнения являются моими собственными.
В прошлом году я разговаривал со своим автором кулинарной книги и другом-блоггером, доктором Карен С. Ли, о стоимости покупки спортивных напитков и всех искусственных ингредиентах в них. Карен — мануальный терапевт на пенсии и знает все о важности солей и минералов, а.к.а. электролиты для гомеостаза нашего тела. Она объяснила мне, что наш организм нуждается в электролитах для правильного функционирования, поэтому очень важно восполнять минералы, потерянные во время упражнений или физической нагрузки, или если у вас была высокая температура, или даже после рвоты или диареи, чтобы предотвратить обезвоживание. И лучший и самый простой способ сделать это — выпить напитки с электролитом с розовой гималайской солью , богатой минералами, .
Мы договорились, что купленные в магазине «спортивные напитки» содержат добавленный сахар, искусственные ароматизаторы, красители и стоят очень дорого.Но что меня удивило, так это то, что она самостоятельно готовит электролитные напитки дома! А поскольку она использует ароматизаторы, которые нравятся ее семье за небольшую часть стоимости, она больше никогда не покупает «спортивные напитки» или напитки с электролитом!
Я понятия не имел, что вы можете делать свои собственные спортивные напитки! Она также повторила, насколько важно использовать качественную гималайскую соль, поскольку не все розовые соли одинаковы. Я полностью согласен! Мои мальчики после школы занимаются спортом, и мне нравится, что я могу делать для них более вкусные и полезные напитки, так как могу добавлять натуральные ароматизаторы и подсластители, которые им нравятся.Этот разговор изменил правила игры!
Спасибо, Карен, за эту удивительную идею приготовления спортивных напитков своими руками и все идеи о пользе для здоровья. После нашего разговора я больше не возвращался к покупным электролитным напиткам!
Как Карен упомянула выше, ключевым ингредиентом для создания лучшего домашнего электролита является использование высококачественной, богатой минералами розовой гимлайской соли. Вот почему я люблю использовать гималайскую соль премиум-класса Shan и натурально обогащенную гималайскую соль Virgin Pink ™ не только в этом рецепте, но и в яйцах на завтрак, морепродуктах и т. Д.для естественного усиления вкуса. Он не только ароматный, но и естественным образом обогащен 84 микроэлементами, которые необходимы для нашего здоровья.
Вот еще несколько фактов о розовой гималайской соли Shan:
- Это разновидность каменной соли из региона Пенджаб в Пакистане, недалеко от предгорья Гималаев. Соляная шахта Хевра — одна из старейших и крупнейших соляных шахт в мире.
- По химическому составу похожа на поваренную соль, содержащую до 98 процентов хлорида натрия.Остальная часть соли состоит из микроэлементов, таких как калий, магний и кальций. Они придают соли светло-розовый оттенок. Эти минералы также объясняют, почему гималайская соль отличается по вкусу от обычной поваренной соли.
- Отлично подходит для приготовления, приправы и консервирования продуктов.
- Поддерживает правильный баланс жидкости, предотвращает обезвоживание, а также помогает предотвратить низкое кровяное давление. домашний электролитный напиток просто начните с богатой минералами шанской розовой гималайской соли и добавьте любую из следующих комбинаций ингредиентов:
✔️ Liquid — фильтрованная или минеральная вода, газированная вода, кокосовая вода, зеленый чай и т. Д.
✔️ Natural Flavors — свежевыжатые фруктовые соки: лимон, лайм, апельсин, грейпфрут и т. Д.
✔️ Подсластитель — мед, чистый кленовый сироп и т. Д.
✔️ Дополнительные вкусовые добавки — мята, имбирь, куркума и т. Д.
Вот 3 моих любимых домашних электролита со вкусом электролита и простые шаги по их приготовлению:
Лимонно-имбирный электролит
- Натереть имбирь и выжать сок через сетчатое ситечко.У вас должно получиться около 1 столовой ложки имбирного сока. Примечание. Сохраните имбирь после отжима сока и используйте его для приготовления имбирного чая.
- Добавьте тертый имбирный сок, свежий лимонный сок, мед и розовую гималайскую соль в имбирный сок и взбейте, чтобы все перемешалось.
- Добавьте 2 стакана минеральной или газированной воды и хорошо перемешайте. Вылейте лед в чашки, чтобы сразу насладиться им, или поставьте в холодильник на 1-2 дня.
Электролит из мяты и извести
- Добавьте листья мяты и розовую гималайскую соль в миску или большую мерную чашку.Придавите листья с помощью мадлера, пока ваша кухня не наполнится ароматами. Вы также можете добавить ¼ дольки лайма в чашку и прижать ее вместе с листьями мяты. Это высвободит ароматизаторы и масла из лайма.
- Добавьте газированную или кокосовую воду и разлейте напиток по чашкам со льдом. Подавать немедленно.
Оранжевый электролит
- Взбейте свежевыжатый апельсиновый сок и розовую гималайскую соль.
- Добавьте натуральный подсластитель, например чистый кленовый сироп или мед, если делаете это для детей.Добавьте охлажденную минеральную или газированную воду, хорошо перемешайте и сразу подавайте.
Этот рецепт не только помог мне во время спортивного сезона, но и как натуральное лекарство помог мне вылечиться от лихорадки и гриппа . Вы можете укрепить свою иммунную систему, просто добавив мед, обладающий противовирусными свойствами, куркуму, обладающую антиоксидантными и противовоспалительными свойствами, и соки цитрусовых, содержащие витамин С, список можно продолжать и продолжать…
Вам нравятся домашние напитки? Вот некоторые из моих любимых горячих и холодных напитков, которые повторяются у меня дома:
★ Вы пробовали этот рецепт? Нам очень нравятся ваши отзывы. , Пожалуйста, нажмите на звездочки на карточке рецепта ниже, чтобы поставить оценку.
Пробовали рецепт? Нам очень важны ваши отзывы.Нажмите на звездочки в карточке рецепта ниже.
Домашний электролитный напиток с ароматизаторами
Электролиты для утоления жажды своими руками в 3-х ароматах со всеми натуральными ингредиентами
Время подготовки 10 минут
Общее время 10 минут
Курс: напитки
Кухня: американская
Порций: 2
калорий: 82 ккал
Состав
Электролит из мяты и лайма
Инструкции
Инструкции для электролита имбиря лимона:
Натереть имбирь и отжать сок с помощью сетчатого сита.У вас должно получиться около 1 столовой ложки имбирного сока. Добавьте в имбирный сок свежезаваренный лимонный сок, мед и розовую гималайскую соль и взбейте, чтобы все перемешалось.
Добавьте 2 стакана простой воды, минеральной воды или газированной воды и хорошо перемешайте. Вылейте лед в чашки, чтобы сразу насладиться им, или поставьте в холодильник на 1-2 дня.
Инструкции по электролиту мяты и извести
Добавьте листья мяты и соль в миску для смешивания или большую мерную чашку.Придавите листья с помощью мадлера, пока ваша кухня не наполнится ароматами. Вы также можете добавить ¼ дольки лайма в чашку и прижать ее вместе с листьями мяты. Это высвободит ароматизаторы и масла из лайма. Добавьте газированную воду и разлейте напиток по чашкам со льдом. Подавать немедленно.
Инструкции для апельсинового электролита
Взбейте апельсиновый сок и розовую гималайскую соль. Добавьте натуральный подсластитель, например чистый кленовый сироп или мед, если делаете это для детей.Добавьте охлажденную минеральную или газированную воду, хорошо перемешайте и сразу подавайте.
Питание
Калорий: 82 ккал | Углеводы: 22 г | Белок: 1 г | Жиры: 1 г | Насыщенные жиры: 1 г | Натрий: 972 мг | Калий: 216 мг | Клетчатка: 1 г | Сахар: 15 г | Витамин А: 336 МЕ | Витамин C: 48 мг | Кальций: 55 мг | Железо: 1 мг
♥ Подпишитесь на наш канал Youtube, чтобы смотреть вкусные и простые видео-рецепты.
