Содержание
Урок №51. Генетическая связь между основными классами неорганических соединений
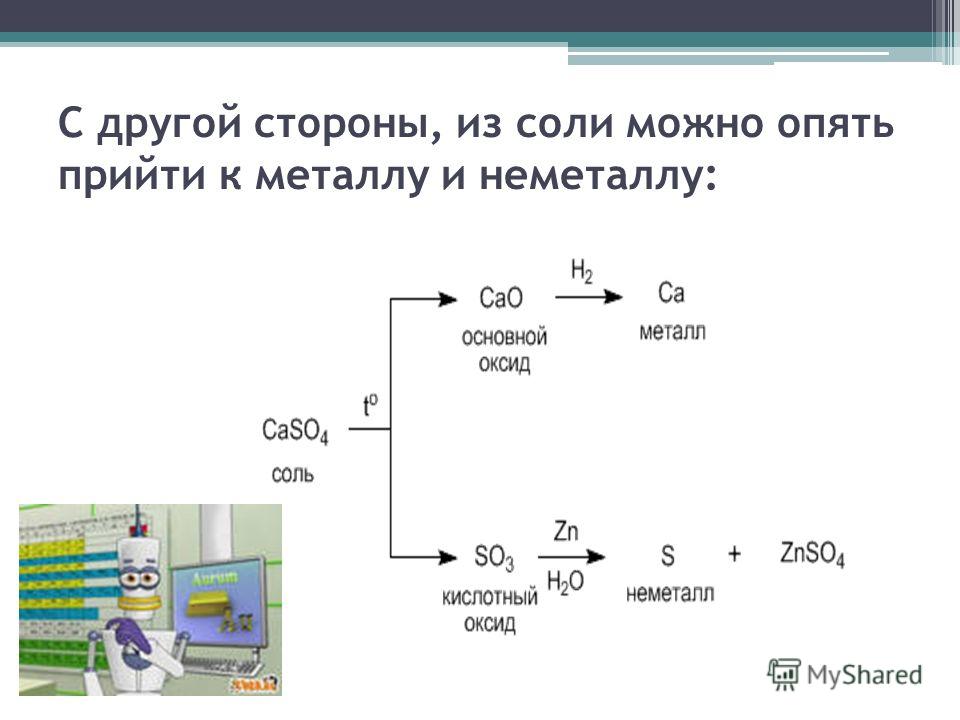
Генетические
связи — это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов
и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в
качестве основания выступает щёлочь. Этот ряд можно представить с помощью
следующих превращений:
металл→основный оксид→щёлочь→соль
Например,
K→K2O→KOH→KCl
2. Генетический ряд, где в качестве
основания выступает нерастворимое основание, тогда ряд можно представить
цепочкой превращений:
металл→основный оксид→соль→нерастворимое основание→
→основный оксид→металл
Например,
Cu→CuO→CuCl2→Cu(OH)2→CuO→Cu
Среди неметаллов также можно выделить две
разновидности рядов:
1. Генетический ряд неметаллов, где в
Генетический ряд неметаллов, где в
качестве звена ряда выступает растворимая кислота. Цепочку превращений можно
представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например,
P→P2O5→H3PO4→Na3PO4
2. Генетический ряд неметаллов, где в
качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота→
→кислотный оксид→неметалл
Например, Si→SiO2→Na2SiO3→H2SiO3→SiO2→Si
Закрепление:
Осуществите превращения по схеме, укажите типы реакций, назовите вещества
1.Al→Al2O3→AlCl3→Al(OH)3→Al2O3
2. P→P2O5→H3PO4→Na3PO4→Ca3(PO4)2
3. Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
4.Cu →CuO→CuCl2→Cu(OH)2→CuO→Cu
5.N2O5→HNO3→Fe(NO3)2→Fe(OH)2→FeS→FeSO4
Тренажёры:
Тренажёр №1.
«Классы неорганических соединений»
Тренажёр №2.
«Генетическая связь между классами неорганических веществ»
Презентация по теме «Генетическая связь неорганических веществ»
Генетическая связь между классами неорганических веществ.
ХИМИЯ – 8
Автор: Кунова Г.В. – учитель химии ЦДО, г. Липецк.
Цель урока
Повторить и обобщить изученный материал:
о классификации неорганических веществ;
свойствах кислот, оснований, оксидов и солей в свете ТЭД.
Сформировать понятие «генетический ряд», познакомить с генетическими рядами металлов и неметаллов и их видами.
Формировать умение составлять генетические ряды металлов и неметаллов и записывать соответствующие им уравнения химических реакций.
Задание 1
Заполните схему «Классификация неорганических веществ», выбрав из перечня необходимые слова.
ПРОСТЫЕ
СЛОЖНЫЕ
Металлы
Неметаллы
ОКСИДЫ
ОСНОВАНИЯ
КИСЛОТЫ
СОЛИ
ВЕЩЕСТВА
Приведите примеры для каждой группы веществ.
Задание 2
Посмотрим видео-опыты:
Горение фосфора в кислороде
2. Растворение оксида фосфора (V) в воде
Запишите уравнения химических реакций, показанных в опытах.
4Р + 5О2 = 2Р2О5
Р2О5 + 3Н2О = 2Н3РО4
Последовательность превращений в этих опытах можно выразить схемой:
Последовательность превращений в этих опытах можно выразить схемой:
Р → Р2О5 → Н3РО4
Что общего между веществами в этом ряду?
В состав всех веществ в этом ряду входит элемент фосфор.
Задание 3
Посмотрим видео-опыты:
Горение кальция
Взаимодействие
оксида кальция с водой
Запишите уравнения химических реакций, показанных в опытах.
2Са + О2 = 2СаО
СаО + Н2О = Са(ОН)2
Последовательность превращений в этих опытах можно выразить схемой:
Последовательность превращений в этих опытах можно выразить схемой:
Са → СаО → Са(ОН)2
Что общего между веществами в этом ряду?
В состав всех веществ в этом ряду входит элемент кальций.
Таким образом мы получили две цепочки превращений:
Таким образом мы получили две цепочки превращений:
Р → Р2О5 → Н3РО4
Са → СаО → Са(ОН)2
— А возможна ли реакция между Н3РО4 и Са(ОН)2?
Запишем уравнение реакции:
2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2↓ + 6Н2О
Са3(РО4)2
Выделим общие признаки в записанных нами рядах:
Выделим общие признаки в записанных нами рядах:
Все вещества одного ряда образованы одним химическим элементом.
Вещества, образованные одним и тем же элементом, принадлежат к различным классам неорганических веществ.
Вещества, образующие ряд одного элемента, связаны взаимопревращениями.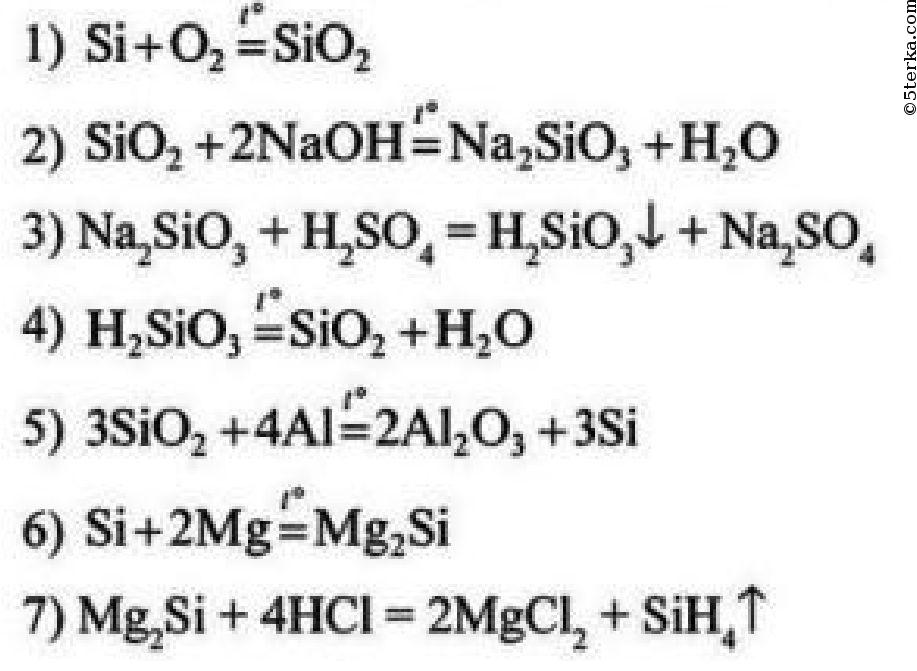
Такие ряды получили название «генетические».
Генетические ряды
Генетический ряд — это ряд веществ представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ.
Генетические ряды
металлов
неметаллов
Генетический ряд металлов отражает взаимосвязь веществ разных классов, образованных одним и тем же металлическим элементом.
Генетический ряд металлов отражает взаимосвязь веществ разных классов, образованных одним и тем же металлическим элементом.
Генетические ряды металлов
1 вид – металлу соответствует щелочь
2 вид – металлу соответствует нерастворимое основание
Генетические ряды металлов
1 вид – генетический ряд металлов, которым соответствует щелочь:
металл → основный оксид → щелочь → соль
Пример:
Ba → BaO → Ba(OH)2 → BaCl2
2Ba + O2 = 2BaO
BaO + h3O = Ba(OH)2
Ba(OH)2 + 2HCl = BaCl2 + 2h3O
Генетические ряды металлов
2 вид — генетический ряд металлов, которым соответствует нерастворимое основание:
металл → основной оксид → соль → основание (Н) → основной оксид → металл
Пример: генетический ряд цинка
Zn → ZnO → ZnCl2 → Zn(OH)2 → ZnO → Zn
Задание: напишите соответствующие уравнения реакций.
Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, образованных одним и тем же неметаллическим элементом.
Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, образованных одним и тем же неметаллическим элементом.
Генетические ряды неметаллов
1 вид – неметаллу соответствует растворимая кислота
2 вид – неметаллу соответствует нерастворимая кислота
Генетические ряды неметаллов
1 вид – генетический ряд неметаллов, которым соответствует растворимая кислота:
неметалл → кислотный оксид → кислота → соль.
Пример:
S → SO2 → h3SO3 → Na2SO3
S + O2 = SO2
SO2 + h3O = h3SO3
h3SO3 + 2NaOH = Na2SO3 + 2h3O
Генетические ряды неметаллов
2 вид — генетический ряд металлов, которым соответствует нерастворимая кислота:
неметалл → кислотный оксид → соль → кислота (Н) → кислотный оксид
Из изученных нами кислот нерастворимой является только кремниевая кислота, поэтому рассмотрим в качестве примера генетический ряд кремния:
Si → SiO2 → Na2SiO3 → h3SiO3 → SiO2
Задание: напишите соответствующие уравнения реакций.
Генетическая взаимосвязь веществ
Металл
Неметалл
Основный оксид
Основание
Кислотный оксид
Кислота
СОЛЬ
СОЛЬ
СОЛЬ
СОЛЬ
— Где можно применить?
Более сложные вещества могут быть получены из простых, минуя одну или две стадии в приведенных схемах, например, металл, взаимодействуя с кислотой, дает соль.
Возможно образование не только более сложных веществ из менее сложных, но и наоборот.
Различные способы получения оксидов, оснований, солей, кислот широко используют как в химических лабораториях, так и в химической промышленности.
Производство кислот (серной, соляной, азотной, фосфорной), солей (минеральных удобрений — аммиачной и калийной селитры, суперфосфата, аммофоса), оксидов (например, негашеной извести СаО) и многих других неорганических соединений имеет важное значение для деятельности человека.
Выбирая наиболее рациональные способы получения какого-либо вещества, обычно используют сырье, встречающееся в природе в достаточно большом количестве, или выпускаемое промышленностью.
Известняк
Экспериментальная задача
Прокалить медную проволоку, удерживая ее тигельными щипцами, в верхней части пламени спиртовки (1–2мин).
Удалить черный налет с проволоки и поместить его в пробирку. Прилить в пробирку 1-2 мл раствора соляной кислоты. Для ускорения реакции можно слегка нагреть ее содержимое. Что будет наблюдаться?
Осторожно погрузить в пробирку с раствором железный гвоздь. Через 2–3 мин извлечь гвоздь из раствора. Что будет наблюдаться?
Составьте генетический ряд по предложенному эксперименту и напишите соответствующие химические уравнения.
Домашнее задание:
§42.
Генетическая связь неорганических веществ
Цель:
- Сформировать понятие о генетической связи и генетическом ряде.
- Рассмотреть генетические ряды металлов и неметаллов.
- Выяснить генетическую связь между классами неорганических соединений.
- Продолжить формировать умения пользоваться таблицей растворимости и
периодической системой Д. И.Меделеева для прогнозирования возможных
И.Меделеева для прогнозирования возможных
химических реакций, а также применять полученные знания по темам свойства
классов веществ. - Повторить основные классы неорганических соединений и их классификацию.
- Развивать познавательный интерес к предмету, умение быстро и четко
отвечать на вопросы. - Продолжать формировать умения логически мыслить, работать с учебником,
работать с полученной информацией. - Закрепить и систематизировать знания по данной теме.
Оборудование: Периодическая система Д.И. Менделеева, кодоскоп, таблица
“Кислоты”, схема “Генетическая связь”, карточки для игры “Конвейер”, “Творческое
задание”.
Реактивы: В штативах 3 пробирки с растворами HCI, NaCI, NaOH,
универсальная индикаторная бумажка. На столе учителя: Na, H2O
кристаллизаторе, фенолфталеин, H2SO4.
Класс разбит на 4 микрогруппы: “Оксиды”, “Кислоты”, “Соли”, “Основания”.
Ход урока
I. Организационный момент.
1. Дисциплина.
2. Готовность класса к уроку.
3. Постановка цели урока, мотивация.
II. Основная часть.
1. Целевая установка урока
Другого ничего в природе нет
Ни здесь, ни там в космических глубинах.
Все – от песчинок малых – до планет
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгой,
Вокруг тебя творится мир живой,
Входи в него руками трогай.
Сегодня мы собрались здесь, чтобы подвергнуть испытанию лучших
восьмиклассников нашей школы и ответить на вопрос: “Достойны ли они, стать
гражданами великой химической страны?” Страна эта древняя и волшебная, хранящая
множество загадок. Отгадать многие из них еще не удавалось ни одному человеку.
Лишь самым, умным, смелым и настойчивым эта страна приоткрывает свои тайны.
Итак, начнем!
Итак, изучив тему “Важнейшие классы неорганических соединений” вы получили
представление о том, что неорганические соединения многообразны и взаимосвязаны.
На уроке мы с вами рассмотрим небольшие фрагменты взаимопревращений веществ,
вспомним классификацию неорганических веществ, поговорим о единстве и
многообразии химических веществ.
Задача нашего урока – обобщить сведения о веществах, об отдельных классах
неорганических соединений и их классификации в целом, закрепить знания о
генетических рядах, генетической связи, взаимодействии вещества разных классов,
научиться умению применять знания на практике.
Запишите в тетрадях тему нашего урока “Генетическая связь между
неорганическими соединениями”.
Но, сначала скажите о каких веществах идет речь (название, формула)?
- На суку сидит сова,
Выдыхает _____________________________ - Сапоги мои того,
Пропускают ___________________________ - Его все знают,
В магазине покупают,
Без него не сваришь ужин —
В малых дозах в блюдах нужен ___________ - Флакон с веществом, обычно имеется в каждой квартире,
С рожденья ребенок любой с ним знаком,
Едва лишь покинет он с мамой роддом,
Ею искупают в ванночке с _________ - Что за чудо посмотри,
По доске он проезжает,
За собой след оставляет. ____________________
____________________ - Если нет у вас для теста разрыхлителя
вы вместо него.
Положите в пироги. ________________________
Переведите с химического языка на
- Не все то аурум, что блестит.
_____________________________________________________________ - Куй феррум, пока горячо.
_____________________________________________________________ - Слово – аргентум, а молчание – аурум.
_____________________________________________________________ - 5.Купрумного гроша не стоит.
_____________________________________________________________ - Стойкий станумный солдатик.
_____________________________________________________________ - С тех пор много Н2О утекло.
_____________________________________________________________
Все эти вещества относятся, к какому то классу неорганических веществ.
Ответьте на вопрос:
– Как распределяются по классам на основе состава и свойств неорганические
вещества?
– Назовите известные вам классы неорганических соединений
По микрогруппам:
– Дайте определения.
Ученики дают определения веществам.
– Классификация данных классов веществ.
Ученики дают ответы.
На слайде:
Из предложенного перечня неорганических соединений выберите формулы:
1 группа – оксиды,
2 группа – кислоты,
3 группа – соли.
4 группа – основания.
Назовите эти вещества.
Ученики выполняют задание в тетрадях по микрогруппам.
Правильный ответ:
А теперь поиграем с вами в игру “крестики – нолики”.
Слайд 19.
Приложения 1.
Распределите вещества, формулы которых приведены в таблице по классам. Из
Из
букв, соответствующим правильным ответам, получите фамилию великого русского
ученого
| Формулы | Оксиды | Кислоты | Основания | Соли |
| K2O | М | А | Ш | А |
| H2CO3 | П | Е | Т | Р |
| P2O5 | Н | И | М | А |
| CuSO4 | П | О | С | Д |
| Ca(OH)2 | Л | И | Е | С |
| Fe(NO3)3 | А | Н | У | Л |
| SO2 | Е | Л | З | А |
| H3PO4 | Н | Е | Л | С |
| Na3PO4 | Ч | У | М | В |
Ответ: Менделеев.
Проблемное задание.
Могут ли разные классы неорганических соединений взаимодействовать друг с
другом?
Выделить признаки генетического ряда:
Ca
Ca(OH)2
CaCO3
CaO
CaSO4
CaCl2
Ca ?
Ответы:
- вещества разных классов;
- разные вещества образованы одним химическим элементом;
- разные вещества одного химического элемента связаны взаимопревращениями.
Между классами существует важная связь, которую называют генетической
(«генезиз» по-гречески обозначает «происхождение»). Эта связь
заключается в том, что из веществ одного класса можно получить вещества других
классов.
Генетическим называют ряд веществ – представителей разных классов
неорганических соединений, являющихся соединениями одного и того же химического
элемента, связанного взаимопревращениями и отражающего общность происхождения
этих веществ.
Генетический ряд отражает взаимосвязь веществ разных классов, в основу
которых положен один и тот же химический элемент.
Генетическая связь – связь между веществами разных классов, образованных
одним химическим элементом, связанных взаимопревращениями и отражающая единство
их происхождения.
Существует два основных пути генетических связей между веществами: один из
них начинается металлами, другой – неметаллами.
Среди металлов также можно выделить две разновидности рядов:
1
. Генетический ряд, в котором в качестве
основания выступает щелочь. Этот ряд можно представить с помощью следующих
превращений:
металл—основный оксид—щелочь–соль
Например: K—K2O—KOH—KCl.
2. Генетический ряд, где в качестве основания выступает
нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл—основный оксид—соль—нерастворимое основание—основный оксид—металл.
Например: Cu—CuO—CuCl2—Cu(OH)2—CuO—>Cu
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда
выступает растворимая кислота.
Цепочку превращений можно представить в следующем виде:
неметалл—кислотный оксид—растворимая кислота—соль.
Например:
P—P2O5—H3PO4—Na3PO4.
2. Генетический ряд неметаллов, где в качестве звена ряда
выступает нерастворимая кислота:
неметалл—кислотный оксид—соль—кислота—кислотный оксид–неметалл
Например: Si—SiO2—Na2SiO3—H2SiO3—SiO2—Si.
Осуществить превращения по микрогруппам.
Слайд 27.
Физкультминутка “Рыжий кот”.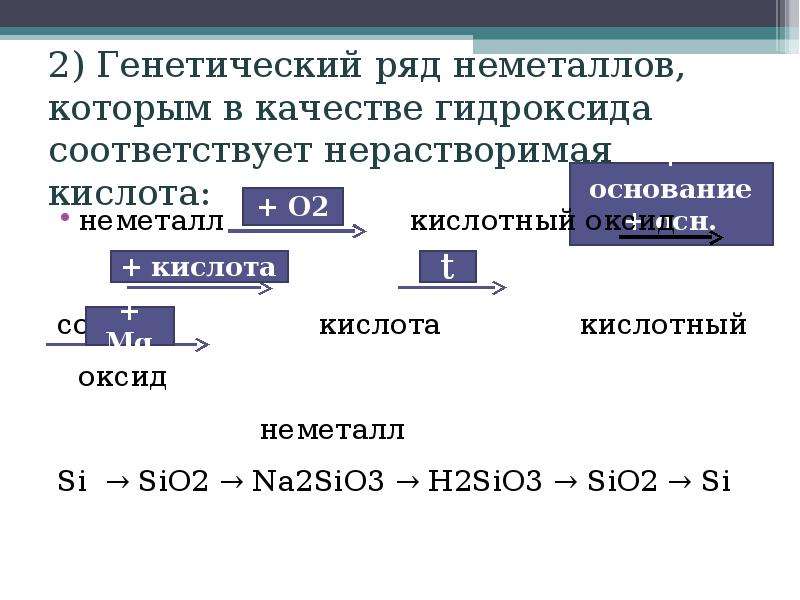
Решение задачи.
Слайд 29.
Задача.
Однажды Юх проводил эксперименты по измерению электропроводности растворов
разных солей. На его лабораторном столе стояли химические стаканы с растворами
KCl, BaCl2, K2CO3, Na2SO4
и AgNO3. На каждом стакане была аккуратно приклеена этикетка.
В лаборатории жил попугай, клетка которого запиралась не очень хорошо. Когда Юх,
поглощенный экспериментом, оглянулся на подозрительный шорох, он с ужасом
обнаружил, что попугай, грубо нарушая правила техники безопасности, пытается
пить из стакана с раствором BaCl2. Зная, что все растворимые соли
бария чрезвычайно ядовиты, Юх быстро схватил со стола стакан с другой этикеткой
и насильно влил раствор в клюв попугаю. Попугай был спасен. Стакан с каким
раствором был использован для спасения попугая?
Ответ:
BaCl2 + Na2SO4 = BaSO4 (осадок) +
2NaCl (сульфат бария настолько малорастворим, что не способен быть ядовитым, как
некоторые другие соли бария).
Демонстрационный эксперимент. Учитель показывает в пробирках
образцы:
1 – кусочек кальция, 2 – негашеная известь, 3 – гашеная известь, 4 – гипс
задает вопрос:
“Что общего между этими образцами?” и записывает цепочку из формул
представленных образцов.
Ca
CaO
Ca(OH)2
CaSO4
Хорошо, ребята! Подумайте, как с помощью химических реакций можно перейти от
простого вещества к сложному, от одного класса соединений к другим. Давайте
проведем эксперимент, доказывающий присутствие атомов меди в разных ее
соединениях. По ходу эксперимента запишите цепочку превращений. Назовите типы
химических реакций.
Работа выполняется по инструктивной карте.
Соблюдайте правила техники безопасности!
Инструктивная карта.
Лабораторная работа: “Практическое осуществление цепочки химических
превращений”.
Проверьте наличие оборудования и реактивов на рабочих местах.
Оборудование: штатив для пробирок, спиртовка, спички, зажим для пробирок,
тигельные щипцы.
Реактивы и материалы: раствор соляной кислоты (1:2), медная проволока,
железный гвоздь или скрепка, нитки.
Выполнение работы.
Проведите реакции, в которых осуществляются химические превращения.
Медная проволока
оксид меди(II)
хлорид меди(II)
медь
Прокаливайте медную проволоку, удерживая ее тигельными щипцами, в верхней
части пламени спиртовки (1–2мин). Что наблюдаете?
Аккуратно удалите черный налет с проволоки и поместите его в пробирку.
Отметьте цвет вещества.
Прилейте в пробирку в пробирку 1 мл раствора соляной кислоты (1:2). Для
ускорения реакции слегка нагрейте ее содержимое. Что наблюдаете?
Осторожно (почему?) погрузите в пробирку с раствором железный гвоздь
(скрепку).
Через 2–3 мин извлеките гвоздь из раствора и опишите произошедшие с ним
изменения.
Образованием какого вещества они вызваны?
Опишите и сравните цвет образовавшегося и исходного растворов.
Приведите рабочее место в порядок.
Внимание! Раствор с оксидом меди нагревать очень осторожно, держа
пробирку высоко над пламенем спиртовки.
III. Заключение.
Учитель. Понятия “оксид”, “кислота”, “основание”, “соль” образуют
систему, находящуюся в тесной взаимосвязи, она раскрывается при получении
веществ одного класса из веществ другого класса. Она проявляется в процессе
взаимодействия веществ и активно используется в практической деятельности
человека. Как вы думаете, ребята, достигли мы цели, которую ставили в начале
урока?
Сейчас мы это проверим.
IV. Закрепление знаний.
Назовите признаки, которые характеризуют генетический ряд.
Даны цепочки превращений:
a) Br2
HBr
NaBr
NaNO3
б) Fe
FeCl2
Fe(OH)2
FeO
Fe
в) CaCO3
CaO
CaC2
C2H2
г) Si
SiO2
Na2SiO3
H2SiO3
1-й уровень. Найдите и выпишите генетические ряды элементов. Запишите
Найдите и выпишите генетические ряды элементов. Запишите
уравнения химических реакций, иллюстрирующих переходы для одного генетического
ряда.
2-й уровень. Найдите и выпишите генетические ряды элементов. Запишите
уравнения химических реакций, иллюстрирующих переходы для одного генетического
ряда. Реакции ионного обмена запишите в молекулярной и ионной форме.
V. Домашнее задание.
Слайды 30, 31.
VI. Подведение итогов урока, оценивание, рефлексия.
Учитель. Ребята, пришло время подводить итоги. Чему вы сегодня
научились, что узнали нового, что вы делали на уроке?
Ученики дают ответы.
Составить генетический ряд лития и осуществить превращения. Генетическая связь между классами веществ. Тема: Обобщение пройденного материала
ПОМОГИТЕ ЗАВТРА НАДО) 8 КЛАСС ХИМИЯ, 1) Составьте генетический ряд серы, используя схему: неметалл—-> кислотный
оксид-> кислота →соль.
2) .
Составьте молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме:Na2O->NaOH->NaCl
Na2O->NaOH->Na2SO4
Укажите тип каждой реакции.
3)
Закончите фразу: «Водные растворы диссоциируют на…
помогите плиз хоть с чем-то
Вариант № 1
Часть А. Тестовые задания с выбором одного правильного ответа
1. (2балла). Ряд, в котором представлены формулы веществ каждого из четырех классов неорганических соединений:
А. CuO, CO2, h3SO4, FeS Б. HNO3, h3S, Al2O3, CuCl2 В. P2O5, NaOH, HCl, Na2CO3
2. (2балла). В генетическом ряду CuSO4→X→CuO
Веществом Х является вещество с формулой: А.CuOH Б. Cu(OH)2 В. CuCl2
3. (2балла). Формула гидроксида, соответствующего оксиду серы(VI):
А. h3S Б. h3SO3 В. h3SO4
4. (2балла). Генетическим рядом является ряд, схема которого:
А. Cu(OH)2→CuO→ Cu Б. FeSO4→Fe(OH)2→ h3O В. SO3→h3SO4→h3
5. (2балла). Гидроксид меди(II) можно получить при взаимодействии веществ, формулы которых: А. Cu и h3O Б. CuO и h3O В. CuCl2 и NaOH
Cu и h3O Б. CuO и h3O В. CuCl2 и NaOH
6. (2балла). Пара формул веществ, взаимодействующих друг с другом:
А. Ca(OH)2 и CuO Б. HCl и Hg В. h3SO4 и MgO
7. (2балла). Гидроксид калия вступает в реакцию:
А. с гидроксидом меди(II) Б. с оксидом углерода(IV) В. с оксидом кальция
8. (2балла). В схеме превращений CaO→X Ca(OH)2 →Y CaCl2
вещества Х и Y имеют формулы:
А. X – h3O, Y – HCl Б. X – h3, Y – HNO3 В.X – O2, Y — HCl
9. (2балла). В генетическом ряду Э→Э2О→ЭОН→Э2SО4 Элемент Э – это:
А. Литий Б. Кальций В. Сера
10. (2балла). Ряд формул соединений, в котором каждое из них взаимодействует с водой при обычных условиях:
А. CO2, SO2, SiO2 Б. BaO, P2O5, Li2O В. K2O, CaO, CuO
Часть Б. Задания со свободным ответом
11. (8 баллов). Составьте генетический ряд бария, используя необходимые для этого формулы веществ: Ba(OH)2, h3SO4, CO2, Ba, MgO, BaSO4, BaO
12. (8 баллов). Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме: P→P2O5→h4PO4→Na3PO4
13. (6 баллов) Допишите уравнения реакции:
(6 баллов) Допишите уравнения реакции:
? + 2HCl→? + ? +СО2
14. (4 балла). Запишите формулы веществ А и В, пропущенных в генетическом ряду: CuSO4→А→В→Cu
ЧАСТЬ А. Тестовые задания с выбором правильного ответа
1/ (2 балла) Ряд, в котором представлены формулы веществ каждого из четырёх классов неорганических соединений:
P2O5, h3SO4, h3SO3, NaOH
SO2, h3SiO3, MgSO4, CuO
CO2, h3S, K2SO3, KOH
2/ (2 балла) В генетическом ряду
Li Li2O X LiCl
веществом Х является вещество с формулой
A) Li B)LiOH C) HCl
3) (2 балла) Формула гидроксида, соответствующего оксиду фосфора (V):
A) HPO2 B) h4PO3 C) h4PO4
4) (2 балла) Генетическим рядом является ряд, схема которого
A) SO3 h3SO4 CaSO4
B) ZnCl2 Zn(OH)2 h3O
C) Al AlCl3 AgCl
5) (2 балла) Хлорид меди (II) можно получить при взаимодействии веществ, формулы которых:
A) Cu + HCl B) CuO + HCl C) CuOH + HCl
6) (2 балла) Пара формул веществ, взаимодействующих друг с другом:
A) Ag + HCl B) SO2 + NaOH C) CuO + NaOH
7) Cоляная кислота вступает в реакцию:
А) с магнием В) с оксидом серы (IV) С) с серебром
8) (2 балла) В схеме превращений:
P P2O5 h4PO4
вещества Х и У имеют формулы:
А) Х – h3O, Y – HCl B) X – O2, Y – h3 C) X – O2, Y – h3O
(2 балла) В генетическом ряду
Э Э2О5 Н3ЭО4 Na3ЭО4
элемент Э – это:
А) калий В) сера С) фосфор
10) (2 балла) Ряд формул соединений, в котором каждое из них взаимодействует с водой при обычных условиях:
A) CO2, Li2O, SO3 B) CuO, P2O5, CaO C) BaO, FeO, ZnO
Часть Б. задание со свободным ответом
задание со свободным ответом
(8 баллов) Составьте генетический ряд бария, используя необходимые для этого формулы веществ: h3O, SO2, Fe2O3, S, CaCO3, h3SO3, K2SO3
(8 баллов) Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме:
Ba BaO Ba(OH)2 BaSO4
Укажите типы реакций по числу и составу исходных веществ и продуктов реакции.
(6 баллов) Допишите уравнения реакций:
Fe(OH)3 + NaOH = ? +
(4 балла) Запишите формулы веществ А и В, пропущенных в генетическом ряду:
Li A B Li3PO4
(4 балла) Допишите уравнение реакций
N2 + ?= N2O3
Генетической связью между веществами называется такая связь, которая основывается на их взаимопревращениях, она отражает единство происхождения веществ, другими словами – генезис.
Обладая знаниями о классах простых веществ, можно выделить два генетических ряда:
1) Генетический ряд металлов
2) Генетический ряд неметаллов.
Генетический ряд металлов раскрывает взаимосвязанность веществ разных классов, в основу которой положен один и тот же металл.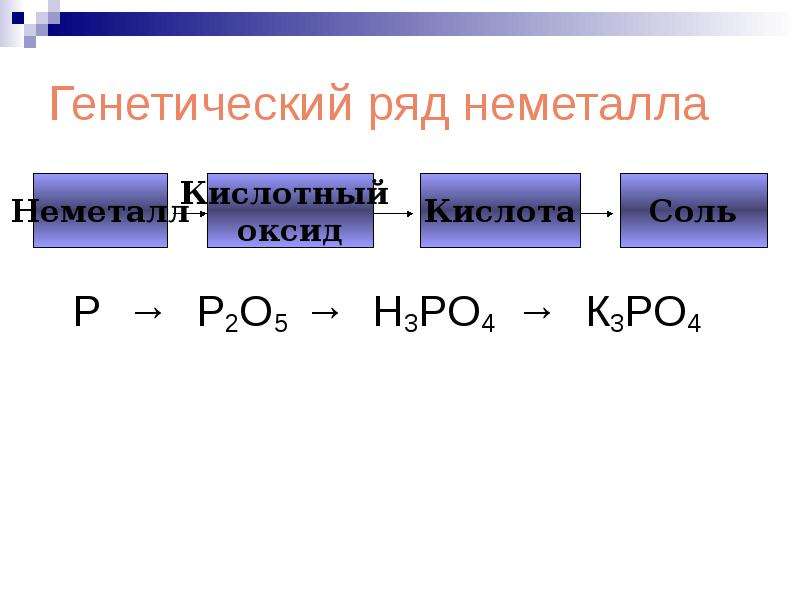
Генетический ряд металлов бывает двух видов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. Такой ряд может быть представлен подобной цепочкой превращений:
металл → основной оксид → основание (щелочь) → соль
Возьмем для примера генетический ряд кальция:
Ca → CaO → Ca(OH) 2 → Ca 3 (PO 4) 2 .
2. Генетический ряд металлов, которым соответствуют нерастворимые основания. В данном ряде больше генетических связей, т.к. он более полно отражает идею прямых и обратных превращений (взаимных). Такой ряд можно изобразить очередной цепочкой превращений:
металл → основной оксид → соль → основание → основной оксид → металл.
Возьмем для примера генетический ряд меди:
Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu.
Генетический ряд неметаллов раскрывает взаимосвязь веществ различных классов, в основе которых лежит один и тот же неметалл.
Давайте выделим еще две разновидности.
1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть изображен в виде следующей линии превращений:
неметалл → кислотный оксид → кислота → соль.
Возьмем для примера генетический ряд фосфора:
P → P 2 O 5 → H 3 PO 4 → Ca 3 (PO 4) 2 .
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть изображен очередной цепочкой трансформаций:
неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Поскольку из рассмотренных нами кислот нерастворимой является исключительно кремниевая кислота, давайте рассмотрим в качестве примера генетический ряд кремния:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si.
Итак, давайте подведем итоги и выделим самую основную информацию.
Целосность и разнообразие химических веществ наиболее выражено изображены в генетической связи веществ, которая раскрывается в генетических рядах. Рассмотрим самые важные признаки генетических рядов:
Генетические ряды – это группа органических соединений, у которых равное число атомов углерода в молекуле, различающихся функциональными группами.
Генетическая связь – более общее понятие, в отличие от генетического ряда, который пусть и является достаточно ярким, но в тоже время частным проявлением данной связи, которая может происходить при любых двусторонних превращениях веществ.
blog.сайт,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Каждый такой ряд состоит состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
2Сa + O 2 = 2СaO; 2Mg + O 2 = 2MgO;
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путём известной вам реакции гидратации, например:
СaO + H 2 O = Сa(OH) 2 .
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их – в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH) 2 используют последовательные реакции:
MgO + H 2 SO 4 = MgSO 4 + H 2 O; MgSO 4 + 2NaOH = Mg(OH) 2 ↓ + Na 2 SO 4 .
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щёлочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей. Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Так, растворимые основания (щёлочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей. Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Генетические ряды неметаллов и их соединений
.
Каждый такой ряд состоит состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей анионы этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
4P + 5O 2 = 2 P 2 O 5 ; Si + O 2 = SiO 2 ;
Переход от кислотных оксидов к кислотам в первых трёх рядах осуществляется путём известной вам реакции гидратации, например:
P 2 O 5 + 3H 2 O = 2 H 3 PO 4 .
Однако, вы знаете, что содержащийся в последнем ряду оксид SiO 2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O; K 2 SiO 3 + 2HСl = 2KCl + H 2 SiO 3 ↓.
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или с солями.
Следует запомнить:
· Вещества одного и того же генетического ряда друг с другом не реагируют.
· Вещества генетических рядов разных типов реагируют друг с другом. Продуктами таких реакций всегда являются соли (рис. 5):
Рис. 5. Схема взаимосвязи веществ разных генетических рядов.
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними.
Задание по теме:
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
2. P → P 2 O 5 → H 3 PO 4 → K 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4 ;
3. Ca → CaO → Ca(OH) 2 → CaCl 2 → CaCO 3 → CaO;
4. S → SO 2 → H 2 SO 3 → K 2 SO 3 → H 2 SO 3 → BaSO 3 ;
5. Zn → ZnO → ZnCl 2 → Zn(OH) 2 → ZnSO 4 → Zn(OH) 2 ;
6. C → CO 2 → H 2 CO 3 → K 2 CO 3 → H 2 CO 3 → CaCO 3 ;
C → CO 2 → H 2 CO 3 → K 2 CO 3 → H 2 CO 3 → CaCO 3 ;
7. Al → Al 2 (SO 4) 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 ;
8. Fe → FeCl 2 →FeSO 4 → Fe(OH) 2 → FeO → Fe 3 (PO 4) 2 ;
9. Si → SiO 2 → H 2 SiO 3 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 ;
10. Mg → MgCl 2 → Mg(OH) 2 → MgSO 4 → MgCO 3 → MgO;
11. K → KOH → K 2 CO 3 → KCl → K 2 SO 4 → KOH;
12. S → SO 2 → CaSO 3 → H 2 SO 3 → SO 2 → Na 2 SO 3 ;
13. S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3 ;
14. Cl 2 → HCl → AlCl 3 → KCl → HCl → H 2 CO 3 → CaCO 3 ;
15. FeO → Fe(OH) 2 → FeSO 4 → FeCl 2 → Fe(OH) 2 → FeO;
16. CO 2 → K 2 CO 3 → CaCO 3 → CO 2 → BaCO 3 → H 2 CO 3 ;
17. K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3 ;
18. P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → H 3 PO 4 → H 2 SO 3 ;
19. Al 2 O 3 → AlCl 3 → Al(OH) 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 ;
20. SO 3 → H 2 SO 4 → FeSO 4 → Na 2 SO 4 → NaCl → HCl;
21. KOH → KCl → K 2 SO 4 → KOH → Zn(OH) 2 → ZnO;
22. Fe(OH) 2 → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe(NO 3) 2 → Fe;
Fe(OH) 2 → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe(NO 3) 2 → Fe;
23. Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgSO 4 → Mg(OH) 2 → MgCl 2 ;
24. Al(OH) 3 → Al 2 O 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 → Al(OH) 3 ;
25. H 2 SO 4 → MgSO 4 → Na 2 SO 4 → NaOH → NaNO 3 → HNO 3 ;
26. HNO 3 → Ca(NO 3) 2 → CaCO 3 → CaCl 2 → HCl → AlCl 3 ;
27. CuСO 3 → Cu(NO 3) 2 → Cu(OH) 2 → CuO → CuSO 4 → Cu;
28. MgSO 4 → MgCl 2 → Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgCO 3 ;
29. K 2 S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3 ;
30. ZnSO 4 → Zn(OH) 2 → ZnCl 2 → HCl → AlCl 3 → Al(OH) 3 ;
31. Na 2 CO 3 → Na 2 SO 4 → NaOH → Cu(OH) 2 → H 2 O → HNO 3 ;
Данный урок посвящен обобщению и систематизации знаний по теме «Классы неорганических веществ». Учитель расскажет, как из веществ одного класса можно получить вещество другого класса. Полученные знания и умения пригодятся для составления уравнений реакций по цепочкам превращений.
В ходе химических реакций химический элемент не исчезает, атомы переходят из одного вещества в другое. Атомы химического элемента как бы передаются от простого вещества к более сложному, и наоборот. Таким образом, возникают так называемые генетические ряды, начинающиеся простым веществом — металлом или неметаллом — и заканчивающиеся солью.
Атомы химического элемента как бы передаются от простого вещества к более сложному, и наоборот. Таким образом, возникают так называемые генетические ряды, начинающиеся простым веществом — металлом или неметаллом — и заканчивающиеся солью.
Напомню вам, что в состав солей входят металлы и кислотные остатки. Итак, генетический ряд металла может выглядеть таким образом:
Из металла в результате реакции соединения с кислородом можно получить основный оксид, основный оксид при взаимодействии с водой дает основание (только, если это основание — щелочь), из основания в результате реакции обмена с кислотой, солью или кислотным оксидом можно получить соль.
Обратите внимание, такой генетический ряд подходит только для металлов, гидроксиды которых являются щелочами.
Запишем уравнения реакций, соответствующих превращениям лития в его генетическом ряду:
Li → Li 2 O → LiOH→ Li 2 SO 4
Как вы знаете, металлы при взаимодействии с кислородом, как правило, образуют оксиды. При окислении кислородом воздуха литий образует оксид лития:
При окислении кислородом воздуха литий образует оксид лития:
4Li + O 2 = 2Li 2 O
Оксид лития, взаимодействуя с водой, образует гидроксид лития — растворимое в воде основание (щелочь):
Li 2 O + H 2 O = 2LiOH
Сульфат лития можно получить из лития несколькими способами, например, в результате реакции нейтрализации с серной кислотой:
2. Химическая информационная сеть ().
Домашнее задание
1. с. 130-131 №№ 2,4
из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
2. с.204 №№ 2, 4
из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
6.5 Генетическая связь между важнейшими классами
6.5.
Генетическая связь между важнейшими классами неорганических
соединений
Генетические
связи — это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов
и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот
ряд можно представить с помощью следующих превращений:
металл→основный
оксид→щёлочь→соль
Например, K→K2O→KOH→KCl
2. Генетический ряд, где в качестве основания выступает нерастворимое
основание, тогда ряд можно представить цепочкой превращений:
металл→основный
оксид→соль→нерастворимое основание→
→основный
оксид→металл
Например, Cu→CuO→CuCl2→Cu(OH)2→CuO→Cu
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает
растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный
оксид→растворимая кислота→соль
Например, P→P2O5→H3PO4→Na3PO4
2. Генетический ряд неметаллов, где в качестве звена ряда выступает
Генетический ряд неметаллов, где в качестве звена ряда выступает
нерастворимая кислота:
неметалл→кислотный
оксид→соль→кислота→
→кислотный
оксид→неметалл
Например, Si→SiO2→Na2SiO3→H2SiO3→SiO2→Si
1. Напишите
молекулярные и ионные уравнения реакций, при помощи которых можно осуществить
следующие превращения:
________________________________________________________________
2. Распределите вещества, формулы которых приведены в таблице по классам.
Из букв, соответствующим правильным ответам, получите фамилию великого русского
ученого:
Ответ:
Менделеев.
________________________________________________________________
3. Из предложенного перечня неорганических
соединений выберите формулы:
1 группа – оксиды,
2 группа – кислоты,
3 группа – соли.
4 группа – основания.
Назовите эти вещества.
Правильный
ответ:
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Осуществите
превращения по схеме, укажите типы реакций, назовите вещества:
1.Al→Al2O3→AlCl3→Al(OH)3→Al2O3
2. P→P2O5→H3PO4→Na3PO4→Ca3(PO4)2
2.
Назовите признаки, которые характеризуют генетический ряд.
Даны цепочки превращений:
a) Br2 → HBr → NaBr → NaNO3
б) Fe → FeCl2 → Fe(OH)2 → FeO → Fe
в) CaCO3 → CaO → CaC2 → C2H2
г) Si → SiO2 → Na2SiO3 → H2SiO3
1-й
уровень. Найдите и выпишите
генетические ряды элементов. Запишите уравнения химических реакций,
иллюстрирующих переходы для одного генетического ряда.
2-й
уровень. Найдите и выпишите
Найдите и выпишите
генетические ряды элементов. Запишите уравнения химических реакций,
иллюстрирующих переходы для одного генетического ряда. Реакции ионного обмена
запишите в молекулярной и ионной форме.
3. Составьте молекулярные и ионные уравнения реакций, с
помощью которых можно осуществить превращения:
4. Составьте молекулярные и ионные уравнения реакций, с
помощью которых можно осуществить превращения:
5. Составьте молекулярные и ионные уравнения реакций, с
помощью которых можно осуществить превращения:
6. Составьте молекулярные и ионные уравнения реакций, с
помощью которых можно осуществить превращения:
7. Составьте молекулярные и ионные уравнения реакций, с
помощью которых можно осуществить превращения:
8. Даны известняк СаСО3 и соляная кислота. Не расходуя
никаких других веществ, получите не менее 11 новых веществ. В том числе 4
простых. Напишите уравнения соответствующих реакций и укажите условия их
протекания.
9. 1,563 г
смеси хлорида железа (III) и хлорида
алюминия растворили в воде и прибавили раствор гидроксида калия в избытке.
Выпавший осадок отфильтровали. Промыли и прокалили. Масса его оказалась равной
0,640 г. что представляет собой осадок после прокаливания? Вычислить состав
исходной смеси солей в массовых долях.
10. Соедините стрелками «лепестки ромашки», которые могут
взаимодействовать друг с другом. Напишите уравнения соответствующих реакций.
1. | |
2. | |
а) оксид висмута (V) | б) оксид фосфора (V) |
в) оксид азота (V) | г) оксид мышьяка (V) |
3. | |
а) последовательно нарастают | б) последовательно ослабевают |
в) не изменяются | г) изменяются немонотонно |
4. | |
б) не изменяется | |
г) самая сильная кислота – азотная, | |
5. | |
6. | |
7. | |
а) растворением оксида в воде | б) обработкой оксида соляной кислотой |
в) обработкой оксида щелочью | г) восстановлением оксида водородом и |
8. | |
а) уменьшаются | б) усиливаются |
в) не изменяются | г) сначала растут, затем уменьшаются |
9. | |
в) K2O, | г) K2O, |
10. | |
а) с увеличением | б) с возрастанием массы атомов при |
в) с уменьшением прочности связи | г) с увеличением прочности связи в |
Генетический ряд неметалла — это.
 .. Что такое Генетический ряд неметалла?
.. Что такое Генетический ряд неметалла?
- Генетический ряд неметалла
Генетический ряд неметалла
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях. Зная классы неорганических веществ можно составить генетические ряды металлов и неметаллов. Среди металлов существуют две разновидности генетических рядов:
- Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
- металл — основный оксид — щёлочь — соль. Ярким примером является генетический ряд калия: K—K2O—KOH—KCl.
- Генетический ряд, где в качестве основания выступает нерастворимое основание можно представить цепочкой превращений:
- металл — основный оксид — соль — нерастворимое основание — основный оксид — металл.
 Возьмем например генетический ряд меди: Cu—CuO—CuCl2—Cu(OH)2—CuO—Cu.
Возьмем например генетический ряд меди: Cu—CuO—CuCl2—Cu(OH)2—CuO—Cu.
- металл — основный оксид — соль — нерастворимое основание — основный оксид — металл.
Среди неметаллов также можно выделить две разновидности рядов:
- Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
- неметалл — кислотный оксид — растворимая кислота — соль. Возьмем к примеру фосфор:
P—P2O5—H3PO4—Na3PO4.
- Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
- неметалл — кислотный оксид — соль — кислота — кислотный оксид — неметалл, к примеру возьмем кремний:
Si—SiO2——H2SiO3—SiO2—Si.
Wikimedia Foundation.
2010.
- Генетика — продажная девка империализма
- Гэндзанский десант
«Генетическая связь между классами неорганических соединений»
Урок по теме «Генетическая связь между
классами неорганических соединений»
(8 класс)
Цель урока: систематизировать, обобщить и закрепить знания об основных классах неорганических соединений.
Задачи.
Обучающие:
обобщить и систематизировать знания об основных классах неорганических веществ;
рассмотреть генетическую взаимосвязь между классами неорганических соединений;
показать, что генетическая связь веществ – основа для осуществления взаимных превращений.
Воспитательные:
продолжить формировать умение работать в группах;
воспитывать культуру поведения, общения друг с другом в процессе учебной деятельности.
Развивающие:
продолжить формирование общеучебных умений и навыков: планирование своего ответа, сравнение фактов, обобщение основных понятий, самоконтроль, самоанализ деятельности.
Тип урока: комбинированный урок, урок закрепления знаний с применением тренировочных упражнений.
Оборудование и реактивы: мультимедийный проектор, карточки с заданиями, магниты,
Раздаточный материал:
таблички с названиями «оксиды», «кислоты», «основания», «соли»
карточки с недописанными формулами: оксидов S…, P…, Na…, Cu…, Ca…, Si…, оснований Na……, Ca(……) , K……., Cu(……) , Fe(……) , Fe(……) , кислот …S…, …S…, …P…., …Si…, …C…, …N…, солей Ca..(P…).., Cu(N…).., Na..S…, K..Si…., Fe..(S…)..
задания группам
Этапы урока:
I. Стадия «Вызов».
Приветствие учителя.
Ребята, вы изучили основные классы неорганических соединений. Давайте повторим состав данных веществ.
Класс разделен на 4 группы: 1 группа «Оксиды», 2 группа «Основания», 3 группа «Кислоты», 4 группа «Соли». (На столах у каждой группы табличка с названием)
Задание 1.
Группа 1. Дать определение классу оксиды и написать общую формулу.
Группа 2. Дать определение классу основания и написать общую формулу.
Группа 3. Дать определение классу кислоты и написать общую формулу.
Группа 4. Дать определение классу соли и написать общую формулу.
При написании общих формул использовать следующие обозначения: Н – водород, О – кислород, Ме – металл, Нм – неметалл. (слайд 1.)
Задание 2.
Группа 1. Даны элементы: S, P, Na, Cu, Ca, Si. Привести формулы оксидов данных элементов и назвать их.
Группа 2. Даны элементы: Na, Ca, K, Cu, Fe. Привести формулы гидроксидов, образованных данными элементами, и дать им названия.
Группа 3. Даны элементы: S, P, Si, C, N. Привести формулы кислот, образованных данными элементами, и дать им названия.
Группа 4. Впишите знаки химических элементов так, чтобы получились формулы солей и дайте им названия. Ca..(P…).., Cu(N…).., Na..S…, K..Si…., Fe..(S…)..
Впишите знаки химических элементов так, чтобы получились формулы солей и дайте им названия. Ca..(P…).., Cu(N…).., Na..S…, K..Si…., Fe..(S…)..
Создание проблемной ситуации.
Из каждой группы вызываются по одному ученику с карточками, содержащими соединения кальция. (1группа – СаO, 2 группа – Сa(OH)2, 3 группа – Сa3(РO4)2.)
Задание 3. Расположить данные соединения в ряд по мере усложнения состава.
Вопросы классу:
Что объединяет данные соединения? (наличие атома кальция)
Как в биологии называется носитель генетической информации? (ген)
Как вы думаете, какой элемент будет являться «геном» для данной цепи? (кальций)
Действительно, в данной цепи мы наблюдаем наличие родственной или генетической связи между соединениями.
Тема урока: Генетическая связь между классами неорганических соединений. (слайд 2.) Учащиеся записывают тему урока в тетрадь.
Формулирование целей и задач урока. Обучающимся предлагается из ключевых вопросов урока выбрать, те, что они уже знают и хотят узнать. И вписать в соответствующую колонку таблицы (приложение 1.)
Знаю | Хочу узнать | Узнал(а) |
Ключевые вопросы урока:
Генетический ряд металлов, в котором в качестве основания выступает щелочь.
Генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает растворимая кислота.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает нерастворимая кислота.
II. Стадия «Осмысление».
Генетические связи – это связь между разными классами, основанные на их взаимопревращениях.
Генетический ряд – ряд веществ – представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями.
Задание 4. Исходя из определения генетический ряд, выявите характерные признаки генетических рядов:
Все вещества должны быть образованы …. (одним и тем же химическим элементом).
В генетическом ряду химический элемент должен быть представлен разными формами соединений: …., …., …. и …. (простым веществом, оксидом, гидроксидом, солью).
Вещества, образующие генетический ряд одного элемента, должны быть связаны …. (взаимопревращениями).
Действительно, рассматриваемый генетический ряд: Са → СаО → Са(ОН)2 → Сa3(РO4)2 отражает реальные химические процессы.
Задание 5. Приведите уравнения реакций, соответствующие данной цепочке превращений.
А теперь из нашего частного случая давайте выстроим генетический ряд металлов.
Ме → МеО → МеОН → МеНмО
основный основание соль
оксид
Задание 6. На основе данного генетического ряда выстройте генетический ряд на примере соединений меди. Из каждой группы вызываются по одному ученику с примерами соединений меди. (1 группа – CuO, 2 группа — Cu(OH)2 , 3 группа — Cu(NO3)2)
Приведите уравнения реакций, соответствующие данной цепочке превращений. С какой проблемой мы с вами столкнулись? (невозможность реально провести процесс превращения CuO → Cu(OH)2)
Проблемный вопрос: Как будет выглядеть генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание?
В ходе совместного обсуждения учащиеся приходят к следующей цепочке:
Ме → МеО → МеНмО → МеОН
основный соль основание
оксид нерастворимое
Сu → СuО → Cu(NO3)2 → Сu(ОН)2
Задание 7. Приведите уравнения реакций, соответствующие данной цепочке превращений.
А теперь по аналогии генетических рядов металлов перейдем к рассмотрению генетических рядов неметаллов.
Задание 8.
Группа 1. Выстроить генетический ряд неметаллов, в котором в качестве гидроксида выступает растворимая кислота.
Группа 2. Составить цепочку превращений на примере соединений фосфора.
Группа 3. Выстроить генетический ряд неметаллов, в котором в качестве гидроксида выступает нерастворимая кислота.
Группа 4. Составить цепочку превращений на примере соединений кремния.
Задание 9. Приведите уравнения реакций, соответствующие данным цепочкам превращений:
Р → Р2О5 → Н3РО4 → Сa3(РO4)2
Si → SiO2 → Na2SiO3 → H2SiO3
Для закрепления и контроля степени освоения материала по данной теме группам учащихся предлагается выполнить упражнение.
Задание 10. Cоставьте цепочку превращений, запишите уравнения реакций:
Li → … → … → …
… → ZnO → … → …
… → … → H2SO3 → …
… → … → FeCl2 → …
III. Стадия «Размышление (рефлексия)».
Учащиеся возвращаются к таблице в стадии «Вызов» и заполняют графу «Узнал(а)».
Группа 1. «Оксиды»
Задания:
1. Дайте определение классу оксиды и напишите общую формулу. (При написании общих формул используйте следующие обозначения: Н – водород, О – кислород, Ме – металл, Нм – неметалл.)
2. Даны элементы: S, P, Na, Cu, Ca, Si. Приведите формулы оксидов данных элементов и назвовите их.
3. Из предложенных ключевых вопросов урока выберите те, которые вы уже знаете или хотите узнать и соотнесите в соответствующую колонку таблицы 1.
Ключевые вопросы урока:
Генетический ряд металлов, в котором в качестве основания выступает щелочь.
Генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает растворимая кислота.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает нерастворимая кислота.
Таблица 1.
Знаю | Хочу узнать | Узнал(а) |
4. Исходя из определения генетический ряд, выявите характерные признаки генетических рядов:
Все вещества должны быть образованы ________________________________.
В генетическом ряду химический элемент должен быть представлен разными формами соединений: ___________, ______________, __________ и ______________.
Вещества, образующие генетический ряд одного элемента, должны быть связаны _______________________.
5. Приведите уравнения реакций, соответствующие данной цепочке превращений:
Са → СаО → Са(ОН)2 → Сa3(РO4)2
____________________________________________
____________________________________________
____________________________________________
6. Выстройте генетический ряд металлов, в котором в качестве основания выступает щелочь.
___________________________________________________
Выстройте генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
___________________________________________________
7. Приведите уравнения реакций, соответствующие данной цепочке превращений:
Сu → СuО → Cu(NO3)2 → Сu(ОН)2
____________________________________________
____________________________________________
____________________________________________
8. Выстройте генетический ряд неметаллов, в котором в качестве гидроксида выступает растворимая кислота.
____________________________________________________
9. Cоставьте цепочку превращений, запишите уравнения реакций:
Li → ______ → _________ → _______
__________________________________
__________________________________
__________________________________
Группа 2. «Основания»
Задания:
1. Дайте определение классу основания и напишите общую формулу. (При написании общих формул используйте следующие обозначения: Н – водород, О – кислород, Ме – металл, Нм – неметалл.)
2. Даны элементы: Na, Ca, K, Cu, Fe. Приведите формулы гидроксидов, образованных данными элементами, и дайте им названия.
3. Из предложенных ключевых вопросов урока выберите те, которые вы уже знаете или хотите узнать и соотнесите в соответствующую колонку таблицы 1.
Ключевые вопросы урока:
Генетический ряд металлов, в котором в качестве основания выступает щелочь.
Генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает растворимая кислота.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает нерастворимая кислота.
Таблица 1.
Знаю | Хочу узнать | Узнал(а) |
4. Исходя из определения генетический ряд, выявите характерные признаки генетических рядов:
Все вещества должны быть образованы ________________________________.
В генетическом ряду химический элемент должен быть представлен разными формами соединений: ___________, ______________, __________ и ______________.
Вещества, образующие генетический ряд одного элемента, должны быть связаны _______________________.
5. Приведите уравнения реакций, соответствующие данной цепочке превращений:
Са → СаО → Са(ОН)2 → Сa3(РO4)2
____________________________________________
____________________________________________
____________________________________________
6. Выстройте генетический ряд металлов, в котором в качестве основания выступает щелочь.
___________________________________________________
Выстройте генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
___________________________________________________
7. Приведите уравнения реакций, соответствующие данной цепочке превращений:
Сu → СuО → Cu(NO3)2 → Сu(ОН)2
____________________________________________
____________________________________________
____________________________________________
8. Составьте цепочку превращений на примере соединений фосфора.
_____________________________________________________
9. Cоставьте цепочку превращений, запишите уравнения реакций:
______→ ZnO → _________ → _______
__________________________________
__________________________________
__________________________________
Группа 3. «Кислоты»
Задания:
1. Дайте определение классу кислоты и напишите общую формулу. (При написании общих формул используйте следующие обозначения: Н – водород, О – кислород, Ме – металл, Нм – неметалл.)
2. Даны элементы: S, P, Si, C, N. Приведите формулы кислот, образованных данными элементами, и дайте им названия.
3. Из предложенных ключевых вопросов урока выберите те, которые вы уже знаете или хотите узнать и соотнесите в соответствующую колонку таблицы 1.
Ключевые вопросы урока:
Генетический ряд металлов, в котором в качестве основания выступает щелочь.
Генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает растворимая кислота.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает нерастворимая кислота.
Таблица 1.
Знаю | Хочу узнать | Узнал(а) |
4. Исходя из определения генетический ряд, выявите характерные признаки генетических рядов:
Все вещества должны быть образованы ________________________________.
В генетическом ряду химический элемент должен быть представлен разными формами соединений: ___________, ______________, __________ и ______________.
Вещества, образующие генетический ряд одного элемента, должны быть связаны _______________________.
5. Приведите уравнения реакций, соответствующие данной цепочке превращений:
Са → СаО → Са(ОН)2 → Сa3(РO4)2
____________________________________________
____________________________________________
____________________________________________
6. Выстройте генетический ряд металлов, в котором в качестве основания выступает щелочь.
___________________________________________________
Выстройте генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
___________________________________________________
7. Приведите уравнения реакций, соответствующие данной цепочке превращений:
Сu → СuО → Cu(NO3)2 → Сu(ОН)2
____________________________________________
____________________________________________
____________________________________________
8. Выстройте генетический ряд неметаллов, в котором в качестве гидроксида выступает нерастворимая кислота.
____________________________________________________
9. Cоставьте цепочку превращений, запишите уравнения реакций:
______→ _________ → H2SO3 → _______
__________________________________
__________________________________
__________________________________
Группа 4. «Соли»
Задания:
1. Дайте определение классу соли и напишите общую формулу. (При написании общих формул используйте следующие обозначения: Н – водород, О – кислород, Ме – металл, Нм – неметалл.)
2. Впишите знаки химических элементов так, чтобы получились формулы солей и дайте им названия. Ca..(P…).., Cu(N…).., Na..S…, K..Si…., Fe..(S…)..
3. Из предложенных ключевых вопросов урока выберите те, которые вы уже знаете или хотите узнать и соотнесите в соответствующую колонку таблицы 1.
Ключевые вопросы урока:
Генетический ряд металлов, в котором в качестве основания выступает щелочь.
Генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает растворимая кислота.
Генетический ряд неметаллов, в котором в качестве гидроксида выступает нерастворимая кислота.
Таблица 1.
Знаю | Хочу узнать | Узнал(а) |
4. Исходя из определения генетический ряд, выявите характерные признаки генетических рядов:
Все вещества должны быть образованы ________________________________.
В генетическом ряду химический элемент должен быть представлен разными формами соединений: ___________, ______________, __________ и ______________.
Вещества, образующие генетический ряд одного элемента, должны быть связаны _______________________.
5. Приведите уравнения реакций, соответствующие данной цепочке превращений:
Са → СаО → Са(ОН)2 → Сa3(РO4)2
____________________________________________
____________________________________________
____________________________________________
6. Выстройте генетический ряд металлов, в котором в качестве основания выступает щелочь.
___________________________________________________
Выстройте генетический ряд металлов, в котором в качестве основания выступает нерастворимое основание.
___________________________________________________
7. Приведите уравнения реакций, соответствующие данной цепочке превращений:
Сu → СuО → Cu(NO3)2 → Сu(ОН)2
____________________________________________
____________________________________________
____________________________________________
8. Составьте цепочку превращений на примере соединений кремния.
__________________________________________________________
9. Cоставьте цепочку превращений, запишите уравнения реакций:
______→ _________ → FeCl2 → _______
__________________________________
__________________________________
__________________________________
Контроль морфологии и механических характеристик биокремнезема с помощью консервативного гена диатомовых водорослей Silicanin-1
Условия культивирования
T. pseudonana (клон CCMP 1335) выращивали при 18 ° C с циклом 16 часов света / 8 часов темноты при 5000 –10 000 люкс в среде с искусственной морской водой (NEPC) в соответствии с протоколом сбора культур северо-восточной части Тихого океана (http://www3.botany.ubc.ca/cccm/NEPCC/esaw.html), если не указано иное. Для экспериментов, проводимых в среде, содержащей NH 4 + , NEPC был приготовлен без NaNO 3 и автоклавирован.Стерильно отфильтрованный NH 4 Cl добавляли до конечной концентрации 550 мкМ.
Конструирование нокаутной плазмиды pSin1KO
Олигонуклеотидные праймеры, использованные для конструирования плазмиды, перечислены в таблице ниже. Плазмиду pTpNR-GFP / fcpNat (-KpnI) 29 использовали в качестве отправной точки для конструирования pSin1KO. Первый этап включал удаление сайта Bbs I в гене nat1 с помощью обратной ПЦР и самолигирования с использованием праймеров BbsI_removal_for и BbsI_removal_rev, в результате чего была получена плазмида pTpNR-GFP / fcpNat (-KpnI / -BbsI).Ген Cas9 амплифицировали из плазмиды pSpCas9 (BB) -2A-GFP 30 с праймером Cas_for и Cas9_rev и клонировали с помощью In-Fusion ® (Takara) в EcoR V и Kpn I, расщепленный pTpNR. GFP / fcpNat (-KpnI / BbsI), что привело к плазмиде pTpNR-Cas9-GFP / fcpNAT. Промотор T. pseudonana U6 амплифицировали из геномной ДНК с использованием праймеров U6_for и U6_rev. Каркас пРНК амплифицировали из плазмиды pSpCas9 (BB) -2A-GFP с использованием праймеров gRNA_for и tracrRNA_rev.Очищенные продукты ПЦР обеих реакций использовали в качестве матриц для ПЦР для гена SOEing с использованием праймера U6_for и traceRNA_rev. Конечный продукт ПЦР был клонирован с помощью In-Fusion ® (Takara) в Spe I и Xba I, расщепленный pTpNR-Cas9-GFP / fcpNAT, что привело к плазмиде pTpNR-Cas9-GFP / fcpNAT / U6-BbsI. .
Sin1 специфические гРНК вводили, как описано ниже. Раствор 1 мкл 100 нг мкл -1 плазмиды pTpNR-Cas9-GFP / fcpNAT / U6-BbsI смешивали с 0.5 мкл буфера Cutsmart (NEB), 0,5 мкл буфера T4-лигазы (NEB) и 2 единицы Bbs I (NEB) в общем объеме 9,0 мкл в течение 30 мин при 37 ° C. Отдельно праймеры Sin1_gRNA-1 / 2_for и Sin1_gRNA-1 / 2_rev смешивали в 100 мкл H 2 O до конечной концентрации 500 фмоль мкл -1 каждый. Смесь праймеров нагревали до 95 ° C, а затем температуру снижали до 40 ° C с шагом 5 ° C (после каждой капли температура поддерживалась в течение 10 с). Аликвоту 0,5 мкл отожженной смеси праймеров и 200 ед. ДНК-лигазы Т4 (NEB) добавляли к расщеплению плазмиды Bbs I и инкубировали дополнительно в течение 30 мин при 37 ° C.Аликвоту 2,5 мкл использовали для трансформации с получением плазмид pTpNR-Cas9-GFP / fcpNAT / U6-Sin1_gRNA-1 и -2 соответственно. Плазмиду pTpNR-Cas9-GFP / fcpNAT / U6-Sin1_gRNA-2 использовали в качестве матрицы для амплификации U6-Sin1_gRNA-2 с праймером 2nd_U6_for и tracrRNA_rev. Продукт ПЦР клонировали с помощью In-Fusion ® (Takara) в pTpNR-Cas9-GFP / fcpNAT / U6-Sin1_gRNA-1, расщепляли только Xba I, в результате чего получали плазмиду pSin1KO (дополнительный рисунок 1). Целостность плазмиды подтверждали тестовым расщеплением и секвенированием.В таблице 2 перечислены праймеры, которые использовали для ПЦР.
Таблица 2 Праймеры для ПЦР, которые использовали при конструировании нокаутной плазмиды pSin1KO
Биолистическая трансформация
Плазмида pSin1KO была введена в T. pseudonana (выращенных на среде NH 4 + , содержащей NEPC) с использованием биолистической среды. Система доставки частиц PDS-1000 / He (Bio-Rad) в соответствии с ранее опубликованным методом 21 . Вкратце, 3 мг вольфрамовых частиц M17 были покрыты 5 мг кольцевой плазмидной ДНК с использованием метода CaCl 2 -спермидина в соответствии с инструкциями производителя.Всего 10 8 клеток из нестационарной культуры T. pseudonana (~ 10 6 клеток на мл -1 ) высевали в центр (диаметром 5 см) чашки с агаром NEPC. После сушки на воздухе планшет помещали в биолистическую камеру на расстоянии 7 см от стопорного экрана. Затем клетки бомбардировали 600 нг покрытых ДНК вольфрамовых частиц с использованием разрывных дисков 1100 фунтов на квадратный дюйм. После бомбардировки клетки соскребали с планшетов, ресуспендировали в NH 4 + , содержащей жидкую среду NEPC (конечная плотность 10 6 клеток, мл -1 ), и инкубировали в течение 24 ч при постоянном освещении.Всего 5 × 10 6 клеток высевали на чашки с агаром NEPC (1,5% агар), содержащим 550 мкМ NH 4 Cl в качестве единственного источника азота и 1,5% агар с добавлением 150 мкг мл -1 норсеотрицина ( Jena Bioscience). Для повторного посева клонов 5000 клеток были перенесены в 300 мкл NEPC и разложены на чашку, содержащую NEPC в 1,5% агаре без антибиотика. Планшеты инкубировали при постоянном освещении.
ПЦР-амплификация гена
Sin1 и Sin2
Последовательности ДНК Sin1 и Sin2 присутствуют в базе данных Uniprot под thapsdraft_24710 и thapsdraft_6586 соответственно.Гены амплифицировали с помощью ПЦР колоний с использованием ДНК-полимеразы Phusion High-Fidelity (Thermo Fisher), используя соответствующий прямой и обратный праймер. Для амплификации готовили 20 мкл полного раствора ПЦР и добавляли 0,25 мкл культуры диатомовых клеток. Для начальной денатурации праймера и лизиса клеток раствор инкубировали при 98 ° C в течение 3 мин. Продукты ПЦР очищали в геле и секвенировали с использованием праймеров для секвенирования Sin1_seq, Sin2_seq_for и Sin2_seq_rev (см. Таблицу ниже). В таблице 3 перечислены праймеры, которые использовали для ПЦР-амплификации и секвенирования.
Таблица 3 Праймеры, которые использовались для ПЦР-амплификации и секвенирования генов Sin1 и Sin2
ПЦР-амплификация потенциальных сайтов вне мишени для gRNA_1
Предполагалось, что нецелевые 1 находятся на хромосоме 1 внутри гена thapsdraft_20571, нецелевой 2 на хромосоме 5 в гене thapsdraft_22527, не целевой 3 на хромосоме 10 в гене thapsdraft_29506 и нецелевой 4 на хромосоме 16b в гене thapsdraft_25190. Для каждого положения амплифицировали фрагмент размером ~ 1000 п.н., который покрывает потенциальную область вне мишени, и продукты ПЦР секвенировали с использованием соответствующих обратных праймеров (см. Таблицу ниже).В таблице 4 перечислены праймеры, которые использовали для ПЦР-амплификации и секвенирования.
Таблица 4 Праймеры, которые использовали для ПЦР-амплификации и секвенирования потенциальных сайтов вне мишени
Вестерн-блот
Для усиления экспрессии белка Sin1 культура клеток была синхронизирована методом кремниевого голодания-восполнения в соответствии с ранее опубликованными протокол 31 . Вкратце, культивирование клеток проводили в 100 мл среды ASW 32 . Когда плотность клеток достигла 5 × 10 5 клеток / мл -1 , культуру дважды промывали 40 мл ASW без Si и ресуспендировали в 100 мл ASW без Si в течение ~ 24 ч при аэрации в поликарбонатных колбах.Затем к культуре добавляли Na 2 SiO 3 до конечной концентрации 210 мкМ, и через 3 часа культивирования клетки центрифугировали (3220 г, , 10 мин и 18 ° C). Осадок ресуспендировали в 1 мл среды NEPC, добавляли 300 мкл стеклянных шариков и встряхивали в течение 3 × 30 с. К 1 мл клеточного лизата 250 мкл 5-кратного загрузочного буфера SDS (250 мМ Трис / HCl, pH 6,8, 10% (мас. / Об.) SDS, 30% (об. / Об.) Глицерина, 62,5 мМ EDTA, pH 8,0, 5 % (об. / об.) β-меркаптоэтанола и 0,05% (мас. / об.) бромфенолового синего) добавляли к образцу и инкубировали при 95 ° C в течение 10 мин.Соответствующий объем, содержащий 5 × 10 5 клеток, загружали на каждую дорожку 4-20% SDS-PAGE без пятен TGX (Bio-Rad). После электрофореза SDS-PAGE наносили на мини-мембрану из ПВДФ 0,2 мкм с использованием системы Trans-Blot Turbo Blotting System (Bio-Rad). Мембрану инкубировали с 1 × Roti ® -Block (Carl Roth) в течение 60 мин при комнатной температуре, а затем один раз промывали PBST (137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na 2 HPO 4 , 1,8 мМ KH 2 PO 4 и 0.05% (об. / Об.) Твин-20). Блот одновременно инкубировали с антисывороткой против rSin1 lum 18 (1: 1000 в PBST) и антителами против гистона-3 (Agrisera; 1:20 000 в PBST). После 60 мин инкубации при комнатной температуре мембрану трижды промывали по 10 мин PBST и затем инкубировали с конъюгатом пероксидазы козьего антитела против кроличьего IgG (Sigma-Aldrich; 1: 10 000 в PBST). После 60 мин инкубации при комнатной температуре мембрану дважды промывали по 10 мин в 20 мл PBST и дважды в 20 мл PBS.Мембрану переносили в мешок для утилизации перед инкубацией с 2 мл хемилюминесцентного субстрата SuperSignal West Pico (Thermo Scientific) в течение 5 минут при комнатной температуре. Хемилюминесценцию детектировали с помощью системы визуализации ChemiDoc MP (Bio-Rad) с временем экспозиции 1 с.
Определение скорости роста клеток, содержания диоксида кремния и размера
Клетки выращивали в 300 мл среды NEPC, и каждый штамм подвергали трем последовательным циклам роста (инокуляция на ~ 3000 клеток на мл -1 , рост до ~ 10 6 клеток мл -1 , а затем разведение до ~ 3000 клеток мл -1 ).Плотность клеток измеряли в четвертом цикле роста, проводя по крайней мере два измерения в каждый момент времени для каждого штамма с использованием автоматического счетчика клеток TC20 (Bio-Rad). Для расчета темпов роста временные точки от 7 до 16 дней были подобраны с помощью линейной регрессии.
Для определения общего содержания кремнезема центрифугировали 13 мл ~ 10 6 клеток / мл -1 (точное количество клеток определяли непосредственно из культуры) (3220 × г , 10 мин, 18 ° C).После тщательного удаления супернатанта осадок промывали один раз 13 мл H 2 O (3220 × г, , 10 мин и 18 ° C) и, наконец, ресуспендировали в 1 мл H 2 O. , Добавляли 500 мкл 6 М NaOH и инкубировали при 95 ° C в течение 30 мин. Аликвоту 50 мкл отбирали для определения содержания кремниевой кислоты в соответствии с ранее опубликованным методом 33 . Вкратце, к 50 мкл образца при перемешивании после каждого добавления добавляли следующие растворы: 150 мкл H 2 O, 100 мкл уксусной кислоты, 40 мкл сульфатного буфера (1.25 M NaHSO 4 , 0,75 M Na 2 SO 4 ) и 20 мкл раствора молибдата (80 мМ (NH 4 ) 6 Mo 7 O 2 4 ). На всех последующих этапах инкубации образец оставляли в темноте. После инкубации в течение 10 минут при 60 ° C раствор выдерживали в течение 5 минут при комнатной температуре, затем добавляли 100 мкл раствора цитрата (2,2 М лимонная кислота в 0,4 М HCl) и смесь инкубировали в течение 20 минут при комнатной температуре. Наконец, 10 мкл восстанавливающего раствора (100 мМ 4-амино-3-гидрокси-1-нафталинсульфоновой кислоты, 95 мМ Na 2 SO 3 и 63 мМ Na 2 S 2 O 5 ) были Добавляли смесь инкубировали в течение 20 мин при комнатной температуре и определяли поглощение раствора при λ = 800 нм.Пентагидрат метасиликата натрия использовали в качестве стандарта.
Для определения размера клеток были сделаны изображения световой микроскопии в светлом поле перед измерениями содержания кремнезема с использованием прибора Zeiss Axiovert 200 при увеличении × 500. Размеры клеток измеряли с помощью программного обеспечения Fiji.
Приготовление биокремнезема для электронной микроскопии
Для выделения биокремнезема было собрано 100 мл ~ 10 6 клеток -1 мл (3220 × г , 10 мин). Осадок ресуспендировали в 6 мл буфера для экстракции (2% SDS, 100 мМ EDTA, pH 8 и 1 мМ PMSF) и непрерывно встряхивали при 55 ° в течение 1 часа для растворения внутриклеточного материала.Биокремнезем осаждали (3220 × г, , 2 мин) и дважды промывали 2 мл 10 мМ EDTA, pH 8, и 1 мМ PMSF. Экстракцию и промывку повторяли до тех пор, пока биокремнезем не стал бесцветным. Бесцветный биокремнезем промывали 2 мл ацетона, четыре раза 5 мл H 2 O и, наконец, ресуспендировали в 1 мл H 2 O.
Для сканирующей электронной микроскопии интактный биокремнезем поэтапно заменяли на H 2 O. до 100% этанола промыванием (3220 г , 2 мин) с постепенным увеличением концентрации этанола (20%, 40%, 60%, 80% и 100%).Безводный биокремнезем сушили до критической точки с использованием прибора Leica CPD 300 (Leica Microsystems). Высушенный биокремнезем закрепляли на угольных подушках на алюминиевых штырях и напыляли платиной с использованием прибора Baltec SCD 050 и аргона в качестве технологического газа (40 мА, 40 с). Изображения вторичной электронной микроскопии получали с использованием автоэмиссионного сканирующего электронного микроскопа JSM 7500F (Jeol) при ускоряющем напряжении 5 кВ.
Чтобы отделить пояска от створок, изолированный биокремнезем ресуспендировали в 500 мкл H 2 O в 1.5-мл пробирку и обработали ультразвуком с помощью наконечника сонотрода MS72 (Bandelin), приложив в общей сложности 0,12 кДж в течение 5 с. Для просвечивающей электронной микроскопии (ТЕМ) 10 мкл обработанного ультразвуком биокремнезема переносили на покрытые золотом поисковые решетки Formvar (G200F2-Au от EMS), которые были укреплены испаренным углеродом. Большую часть жидкости удаляли промоканием куском фильтровальной бумаги, промывали четыре раза 50 мкл H 2 O и образцы сушили на воздухе в течение ночи перед визуализацией. Изображения ПЭМ были получены с использованием прибора Morgagni 268D (FEI) или прибора Jeol JEM-1400 TEM при ускоряющем напряжении 80 кВ.
Атомно-силовая микроскопия (АСМ)
Изолированный биокремнезем иммобилизовали на стеклянном держателе для образцов, покрытом поли-l-лизином, путем инкубации в течение 1 часа при комнатной температуре. Измерения АСМ проводились на Nanowizard IV (JPK Instruments) с использованием режима измерения QI TM с усилием срабатывания 200 пН. Biolever Mini (BL-AC40-TS, Olympus Micro) использовался в качестве кантилевера для измерений. Калибровка кантилеверов производилась бесконтактным методом согласно инструкции производителя.Коррекцию и выравнивание изображения выполняли в программе обработки данных JPK (JPK Instruments). Высота ребер рассчитывалась с помощью инструмента «Извлечь профиль» программы Gwyddion. Для этого на вершине берега и в долине рядом с этим побережьем была проведена линия длиной не менее 100 морских миль, чтобы рассчитать профиль их средней высоты. Чистая высота косты была рассчитана путем вычитания средней высоты долины из средней высоты соседних с ней берегов.
Nanoindentation
Biosilica, выделенный из T.pseudonana клетки были высушены до критической точки с использованием прибора Leica CPD 300 (Leica Microsystems) и перенесены на покрытые палладием стеклянные покровные стекла (диаметром 0,5 см), прикрепленные к алюминиевым штырям и закрепленные проводящим клеем. Заглушки устанавливали в системе пикоиндентирования in situ PI 85 (Bruker), снабженной алмазным наконечником с кубическим углом, установленным внутри электронного микроскопа Scios DualBeam (Thermo Fisher). Во время экспериментов были записаны кривые «нагрузка-смещение» и запись процесса вдавливания в реальном времени.
За счет обеспечения контакта между наконечником и центром клапанов эксперименты по вдавливанию проводились в двух режимах: с контролем нагрузки и с контролем смещения. В режиме управления нагрузкой использовалась функция нагрузки от 10 с до максимальной силы 10 мкН с последующим временем выдержки 2 с и временем разгрузки 10 с. В случае биокремнезема дикого типа первоначальный контакт 2 мкН между наконечником и клапанами был установлен перед проведением эксперимента. В случае мутантного нокаута-1 из-за высокой податливости биокремнезема начальный контакт только 0.Было установлено 5 мкН. Контактная жесткость конфигурации наконечник индентора-образец измерялась путем расчета наклона линейной части кривых нагрузка-смещение в интервале от 0 до 150 нм с использованием метода наименьших квадратов. Было выполнено не менее пяти экспериментов по вдавливанию на каждый тип клеточной стенки. В режиме с контролируемым перемещением наконечник опускался в стенку ячейки до тех пор, пока не было достигнуто проникновение в 1 микрон. Функция загрузки состояла из времени загрузки 10 с и времени разгрузки 10 с.
Статистика и воспроизводимость
Статистический анализ проводился с использованием программных пакетов Excel и OriginPro. Среднее и стандартное отклонение были рассчитаны для измерений содержания кремнезема, размера клеток, плотности клеток и скорости роста. Скорость роста рассчитывали в режиме линейного роста методом линейной аппроксимации методом наименьших квадратов с использованием точек данных в диапазоне плотности клеток от 5 × 10 5 клеток / мл -1 до 2 × 10 5 клеток / мл -1 .Плотность перекрестных соединений и высота costa z в клапанах были рассчитаны по медиане наборов данных в соответствии со статистической дисперсией точек данных. Никакие точки данных не были исключены из расчетов. Измерения содержания кремнезема и скорости роста проводили не менее трех раз, подсчет клеток — не менее двух раз, а размер клеток — один раз. Контактная жесткость конфигурации алмазного наконечника-образца для каждого эксперимента по вдавливанию рассчитывалась как наклон начальной части кривой нагрузка-смещение в интервале между 0–150 нм с использованием аппроксимации методом наименьших квадратов в OriginPro.Окончательное значение контактной жесткости выражается как среднее значение пяти экспериментов по наноиндентированию ± стандартное отклонение.
Сводка отчетов
Дополнительная информация о дизайне исследования доступна в Сводке отчетов по исследованиям природы, связанной с этой статьей.
Характеристика системы поглощения кремния и молекулярное картирование гена-переносчика кремния в рисе
Abstract
Рис ( Oryza sativa L. cv Oochikara) — типичное растение, накапливающее кремний, но механизм, ответственный за высокий уровень кремния поглощение корнями плохо изучено.Мы охарактеризовали систему поглощения кремния корнями риса с использованием мутанта риса с низким содержанием кремния ( lsi1 ) и риса дикого типа. Кинетическое исследование показало, что концентрация кремния в корневом симпластическом растворе увеличивается с увеличением концентрации кремния во внешнем растворе, но насыщается при более высокой концентрации в обеих линиях. Не было различий в концентрации кремния в симпластическом растворе между рисом дикого типа и мутантом. Форма растворимого кремния в корне, ксилеме и листе, идентифицированная с помощью 29 Si-ЯМР, также была одинаковой в двух линиях.Однако концентрация кремния в ксилемном соке у дикого типа была намного выше, чем у мутанта. Эти результаты показывают, что по крайней мере два транспортера участвуют в транспорте кремния из внешнего раствора в ксилему, и что мутант риса с низким содержанием кремния дефектен в загрузке кремния в ксилему, а не в поглощении кремния из внешнего раствора в корковые клетки. Чтобы картировать ответственный ген, мы выполнили групповой сегрегантный анализ с использованием как микросателлитных, так и экспрессируемых маркеров ПЦР на основе меток.В результате ген был картирован на хромосоме 2, фланкирован микросателлитным маркером RM5303 и экспрессируется маркером ПЦР на основе метки последовательности E60168.
Рис ( Oryza sativa L. cv Oochikara) требует высокого содержания кремния для здорового роста и стабильной и высокой продуктивности (Savant et al., 1997; Ma and Takahashi, 2002). Кремний в количестве до 10% от сухой массы накапливается в побегах, и более 90% кремния присутствует в виде силикагеля (Ma and Takahashi, 2002). Силикагель откладывается на клеточной стенке эпидермальных клеток листьев, стеблей и шелухи, образуя двойной слой кремнезема и кутикулы и двойной слой кремнезема и целлюлозы (Yoshida, 1965; Raven, 2003).Кремний также откладывается на булевидных клетках, гантелейных клетках, а также на длинных и коротких клетках на поверхности листьев и шелухи. Осаждение кремния увеличивает прочность и жесткость клеточных стенок и, таким образом, увеличивает устойчивость риса к болезням, вредителям и полеганию, улучшая форму светочувствительных растений в сообществе и уменьшая транспирацию (Epstein, 1994, 1999; Ma and Takahashi, 2002; Ма, 2003). Таким образом, кремний играет важную роль в повышении устойчивости риса к множественным стрессам, включая биотические и абиотические стрессы (Ma, 2004).Силикатные удобрения вносятся в рисовые почвы для повышения урожайности риса.
Высокое накопление кремния в рисе объясняется способностью корней поглощать кремний (Takahashi et al., 1990; Richmond and Sussman, 2003). Недавно из обработанных азидом натрия семян риса M 2 был выделен мутант риса с низкой концентрацией кремния в побегах (Ma et al., 2002). Этот мутант (рис с низким содержанием кремния 1, lsi1 , ранее GR1) имел тип растения, сходный с диким типом, за исключением того, что пластинка листа lsi1 оставалась обвисшей при добавлении кремния.Концентрация кремния в верхушках у мутанта была намного ниже, чем у дикого типа, в то время как концентрация кремния в корнях была аналогичной. Краткосрочный эксперимент с поглощением показал, что поглощение кремния мутантом было значительно ниже, чем потребление кремния диким типом, в то время как не было никакой разницы в поглощении других питательных веществ, таких как фосфор и калий. Кроме того, поглощение кремния рисом дикого типа ингибировалось метаболическими ингибиторами, включая NaCN и 2,4-динитрофенол, и низкой температурой, тогда как поглощение кремния lsi1 не ингибировалось этими агентами.Концентрация кремния в ксилемном соке риса дикого типа также была намного выше, чем у lsi1 . Эти результаты указывают на то, что у мутанта нарушена активная транспортная система для поглощения кремния (Ma et al., 2002).
Как правило, поглощение минерала корнями включает, по крайней мере, два процесса: радиальный перенос минерала из внешнего раствора в корковые клетки и высвобождение минерала из кортикальных клеток в ксилему (нагрузка ксилемы; Marschner, 1995).Однако эти процессы поглощения кремния корнями риса остаются плохо изученными. В этом исследовании мы охарактеризовали систему поглощения кремния корнями риса с использованием мутанта ( lsi1 ) по сравнению с рисом дикого типа. Ген, ответственный за низкое поглощение кремния, был картирован с использованием как ПЦР на основе экспрессируемой метки последовательности (EST), так и микросателлитных маркеров.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика системы поглощения кремния корнями риса
На протяжении десятилетий рис был известен как наиболее эффективный кремний-накапливающий вид, хотя механизмы, участвующие в высоком поглощении кремния, плохо изучены.Одна из причин заключается в том, что, в отличие от других минералов, генотипическая разница в концентрации кремния в рисе слишком мала, чтобы ее можно было использовать для сравнительного исследования поглощения кремния корнями риса. Альтернативный подход заключается в использовании мутанта риса ( lsi1 ) с низкой концентрацией кремния в побегах (Ma et al., 2002). Этот мутант представляет собой полезный инструмент для изучения механизма поглощения кремния и клонирования генов поглощения кремния. В этом исследовании система поглощения кремния была охарактеризована с точки зрения радиального транспорта кремния из внешнего раствора к кортикальным клеткам и загрузки кремния в ксилеме путем сравнения мутантного и дикого риса.Для изучения первого процесса мы получили симпластный раствор корней центрифугированием после удаления апопластического раствора и последующего замораживания-оттаивания. Временной эксперимент показал, что концентрация кремния в симпласте корневых клеток растений, культивируемых в 0,5 мм растворе кремния, увеличивалась со временем в обеих линиях и достигла плато через 8 часов (). Не было значительной разницы в концентрации кремния в симпласте между диким типом и мутантом. Концентрация кремния в апопластическом растворе была аналогична таковой во внешнем растворе (), но концентрация кремния в симпластическом растворе была в 3-7 раз выше, чем во внешнем растворе.Этот результат предполагает, что кремниевая кислота транспортируется против градиента концентрации от внешнего раствора к кортикальным клеткам. Это согласуется с предыдущими выводами о том, что поглощение кремния ингибируется метаболическими ингибиторами (Okuda and Takahashi, 1962) и низкой температурой (Ma et al., 2002), хотя в этих экспериментах измерялось полное поглощение.
Концентрации кремния в апопластических и симпластических растворах корней риса, подвергнутых воздействию раствора кремния в течение разного времени.Апопластные и симпластные растворы экстрагировали центрифугированием из кончиков корней дикого (WT) и мутантного ( lsi1 ) риса, культивированного в питательном растворе Kimura половинной концентрации, содержащем 0,5 мм кремния в качестве кремниевой кислоты. Значения представляют собой средние значения ± стандартное отклонение трех повторностей.
Кинетическое исследование показало, что концентрация кремния в симпласте корневых клеток увеличивается с увеличением концентрации кремния во внешнем растворе, но насыщается при более высокой концентрации кремния в обеих линиях ().И снова не было значительной разницы в концентрации кремния в симпластическом растворе между диким типом и мутантом. Эти результаты предполагают, что транспорт кремния из внешнего раствора к кортикальным клеткам корня опосредуется типом транспортера, и что транспортер мутанта идентичен транспортеру дикого типа. На основе кривой в K m значение было оценено как 0,15 мм кремния. Это значение K м для кремния намного выше, чем для других минералов, таких как фосфор (Kochian, 2000), но с учетом концентрации кремния в почвенном растворе, которая колеблется от 0.От 1 до 0,6 мм (Эпштейн, 1994), это значение кажется разумным.
Концентрация кремния в симпластическом растворе кончиков корней риса, подвергнутом воздействию раствора кремния с различной концентрацией кремния. Симпластический раствор экстрагировали из кончиков корней дикого типа (WT) и мутантного ( lsi1 ) риса, культивированного в питательном растворе Kimura половинной концентрации, содержащем различные концентрации кремния, в течение 8 часов. Значения представляют собой средние значения ± стандартное отклонение трех повторностей.
Затем было проведено кинетическое исследование загрузки ксилемы кремнием на рисе дикого типа и мутантном рисе.В отличие от концентрации кремния в симпласте кортикальных клеток корня, концентрация кремния в ксилемном соке была намного выше у дикого типа, чем у мутанта (). У мутанта концентрация кремния в ксилемном соке постепенно увеличивалась с увеличением концентрации кремния во внешнем растворе без насыщения. У риса дикого типа концентрация кремния в ксилемном соке также увеличивалась с увеличением концентрации кремния во внешнем растворе, но он был насыщенным при более высокой концентрации.Концентрация кремния в ксилемном соке дикого типа была выше 30 мм при подаче кремния 0,9 мм (). Эта концентрация была намного выше, чем в симпласте корневых клеток (), что позволяет предположить, что кремний транспортируется из корневых клеток в ксилему также против градиента концентрации. Кривая также предполагает, что высвобождение кремния в ксилему опосредуется переносчиком дикого типа. Поскольку не было способа определить концентрацию кремния в клетках паренхимы ксилемы, невозможно оценить значение K m для нагрузки ксилемы кремния.Однако, принимая во внимание значение K m (0,32 мм) для всего поглощения (Tamai and Ma, 2003), кажется, что переносчик для загрузки ксилемы отличается от переносчика для переноса из внешнего раствора в корень. ячейки ().
Концентрация кремния в ксилемном соке риса, выращенного в растворе кремния при различных концентрациях. Сеянцы (возрастом 26 дней) риса дикого типа (WT) и мутантного ( lsi1 ) культивировали в питательном растворе Kimura половинной концентрации, содержащем различные концентрации кремния.Стебель был отрезан через 8 ч, и ксилемный сок собирали в течение 30 мин. Значения представляют собой средние значения ± стандартное отклонение трех повторностей.
Кремниевая форма в ксилемном соке была недавно идентифицирована как монокремниевая кислота, в то время как существование монокремниевой кислоты в высокой концентрации в ксилеме было временным (J.F. Ma, неопубликованные данные). Кремниевую форму в корнях, ксилеме и листьях сравнивали с использованием метода 29 Si-ЯМР, чтобы проверить, есть ли какие-либо другие различия между диким типом и мутантом.Только один сигнал во всех образцах наблюдался при химическом сдвиге -72,5 м.д. (). Этот химический сдвиг согласуется с химическим сдвигом монокремниевой кислоты, предполагая, что растворимый кремний в корнях, ксилеме и листьях присутствует в форме монокремниевой кислоты и что нет разницы в форме кремния между диким типом и мутантом. Интенсивность пика в спектрах ЯМР сока корневых клеток была почти одинаковой между двумя линиями, но пиковая интенсивность ксилемного сока была выше у дикого типа, чем у мутанта (), подтверждая результаты, показанные на рис.
Спектры 29 Si-ЯМР сока листовых клеток, сока корневых клеток и ксилемного сока риса. После того, как проростки риса дикого типа (WT) и мутантного ( lsi1 ) культивировали в обогащенном Si 0,5 мм растворе кремния 29 в течение 4 часов, ксилемный сок собирали в течение 30 минут и соки листьев и корневых клеток были извлечены из замороженных-размороженных образцов. Спектры были измерены на частоте 99,4 МГц для резонансной частоты 29 Si.
Приведенные выше результаты предполагают, что по крайней мере два транспортера участвуют в поглощении кремния корнями риса ().Один расположен на плазматической мембране кортикальных клеток корня (SIT1, переносчик кремния 1), которые переносят кремний из внешнего раствора в корковые клетки корня. Другой расположен на плазматической мембране клеток паренхимы ксилемы (SIT2, переносчик кремния 2), который отвечает за высвобождение кремния в ксилему. Эти переносчики могут иметь разное сродство к кремниевой кислоте (и). Наши результаты также ясно показали, что мутант нарушает загрузку кремния ксилемой, а не транспорт кремния из внешнего раствора в клетку корня.
Схематическое изображение системы поглощения кремния корнями риса. SIT1, переносчик кремния из внешнего раствора в корковые клетки. SIT2, Транспортер кремния для загрузки ксилемы.
Молекулярное картирование гена для загрузки кремния ксилемой
Как обсуждалось выше, поглощение кремния корнями риса регулируется по крайней мере двумя разными транспортерами. Однако ни ген, кодирующий переносчик кремния, ни сам белок-переносчик не были выделены из риса и других высших растений.У морских диатомовых водорослей ( Cylindrotheca fusiformis ), которым кремний является важным элементом, было идентифицировано семейство генов, кодирующих переносчик кремния (Hildebrand et al., 1993, 1997). Более того, аналогичный переносчик кремниевой кислоты был обнаружен у всех исследованных диатомовых водорослей. Однако аналогичные гены не были обнаружены у риса при поиске гомологии последовательностей. Кроме того, когда ген переносчика кремния из диатомовых водорослей был перенесен в табак ( Nicotiana tabacum ), повышенное поглощение кремния не наблюдалось в трансгенном табаке (J.Ф. Ма, неопубликованные данные). Эти факты свидетельствуют о том, что система поглощения кремния у диатомовых и высших растений различается. В этом исследовании молекулярное картирование генов поглощения кремния корнями риса было проведено в качестве первого шага к клонированию генов-переносчиков кремния. Гибриды F 1 были получены путем скрещивания мутанта ( lsi1 ), охарактеризованного выше, и сорта риса Kasalath, а затем семена F 2 были получены из семян F 1 . Измерение поглощения кремния показало, что популяции F 2 были сегрегированы в поглощении кремния.Из 105 растений F 2 80 растений показали высокое поглощение кремния, аналогичное Kasalath (1,75 ± 0,25 мг кремния г -1 сырого веса корней 6 ч -1 ), а 25 растений показали низкое поглощение, аналогичное показателю мутант (0,14 ± 0,04 мг кремния г −1 свежей массы корней 6 ч −1 ;). Это соотношение сегрегации соответствовало соотношению 3: 1 ( × 2 = 3,41, 0,05 < P <0,10), подтверждая предыдущий вывод из популяции F 2 , полученной от скрещивания мутанта и его диких животных. сорт (Oochikara), в котором низкое поглощение кремния мутантом контролируется одним рецессивным геном (Ma et al., 2002).
Распределение частот поглощения кремния потомством, полученным в результате генетического скрещивания Kasalath с мутантом ( lsi1 ). Поглощение кремния каждым проростком в питательном растворе, содержащем 0,6 мм кремния, определяли в течение 6 ч.
Для картирования гена ( Lsi1 ), который связан с поглощением кремния, мы сначала выполнили объемный сегрегантный анализ путем объединения равных количеств ДНК из 10 растений с низким потреблением кремния F 2 растений или 10 растений с высоким поглощением кремния F 2 растений на основе результатов, представленных в.В общей сложности 128 маркеров ПЦР на основе EST, которые разбросаны по целым хромосомам, были отобраны для изучения полиморфизма между низким потреблением кремния и большим объемом поглощения кремния, мутантом и Kasalath. В результате маркеры ({«type»: «entrez-nucleotide-range», «attrs»: {«text»: «C53493-C63223», «start_term»: «C53493», «end_term»: «C63223», «start_term_id»: «23», «end_term_id»: «2421928»}} C53493-C63223) на хромосоме 2 были связаны с геном генов с низким потреблением кремния. Для дальнейшего картирования гена поглощения кремния мы выбрали дополнительные маркеры ПЦР на основе EST и микросателлитные маркеры вокруг указанных выше маркеров на хромосоме 2 и протестировали их на полиморфизм в растениях с низким потреблением кремния F 2 .Результаты показали, что фланкирующими маркерами были микросателлитные маркеры RM5303 и RM5631 и маркер на основе EST E60168. Дальнейшее исследование полиморфизма с использованием этих трех маркеров у 105 растений F 2 показало, что целевой ген ( Lsi1 ) и маркеры располагались между RM5303 и E60168 на хромосоме 2 (). Поскольку мутант нарушает загрузку кремния ксилемой, как описано выше, этот ген кодирует SIT2 ().
Связь между ПЦР на основе EST и микросателлитными маркерами и геном загрузки кремниевой ксилемы ( Lsi1 ) на хромосоме 2 риса.
Недавно ген, ответственный за загрузку бора в ксилему, был выделен у Arabidopsis (Takano et al., 2002). Как и кремний, бор также поглощается в виде недиссоциированной молекулы. Однако физиологические данные показали, что переносчики бора и кремния различаются, по крайней мере, в рисе (Tamai and Ma, 2003). В настоящее время в нашей лаборатории выполняется клонирование Lsi1 на основе карты.
МАТЕРИАЛЫ И МЕТОДЫ
Экстракция симпластического сока
Семена риса дикого типа ( Oryza sativa L.cv Oochikara) и мутант риса с низким содержанием кремния, lsi1 (ранее называвшийся GR1), вымачивали в воде на ночь при 25 ° C в темноте. Затем семена переносили в сетку, плавающую на 0,5 мм растворе CaCl 2 в пластиковом контейнере. На 6 день проростки переносили в 1,5-литровый пластиковый горшок, содержащий раствор Kimura B наполовину (pH 5,6) с кремниевой кислотой. О составе раствора Kimura B сообщалось ранее (Ma et al., 2001). Кремниевую кислоту получали пропусканием силиката калия через катионообменную смолу (Amberlite IR-120B, форма H + ; Organo, Tokyo; Ma et al., 2001). Апопластические и симпластические растворы экстрагировали центрифугированием с небольшими модификациями методов Yu et al. (1999). Для временного эксперимента кончики корней (0–1,5 см) вырезали в моменты времени, указанные в, после воздействия 0,5 мм раствора кремния при 25 ° C. Для каждого образца использовали 30 корней. Обрезанные концы быстро промывали дистиллированной водой и промокали насухо. Наконечники помещали в фильтрующий элемент 0,45 мкм м (ULTRAFREER-MC; Millipore, Bedford, MA) срезанными концами вниз и центрифугировали при 2000 г в течение 15 минут при 4 ° C для получения раствора апопласта.После центрифугирования сегменты корней замораживали при -80 ° C в течение 2 ч, а затем оттаивали при комнатной температуре. Симпластический раствор готовили из замороженных-оттаявших тканей центрифугированием при 2000 g в течение 15 мин при 4 ° C. Концентрацию кремния в апопластических и симпластических растворах сразу определяли, как описано ниже. В предварительном эксперименте мы подтвердили, что процесс замораживания-оттаивания не влияет на концентрацию кремния.
Для кинетического исследования проростки (возрастом 6 дней), приготовленные, как указано выше, культивировали в растворе Kimura B с половинной концентрацией (pH 5.6) с различной концентрацией кремния. После 8-часового культивирования растворы апопласта и симпласта экстрагировали, как описано выше. Все эксперименты проводились в трех повторностях.
Чтобы проверить чистоту апопластического раствора, мы определили активность яблочной дегидрогеназы в апопластическом и симпластическом растворе согласно Бергмейеру и Бернту (1974). Активность яблочной дегидрогеназы в апопластическом растворе была ниже одной двадцатой и примерно одной сороковой от симпластического раствора.
Кинетическое исследование загрузки кремниевой ксилемы
Сеянцы (возрастом 6 дней), приготовленные, как описано выше, переносили в 3-литровый пластиковый горшок, содержащий раствор Kimura B половинной концентрации (pH 5,6). Раствор обновляли каждые 2 дня. На 20-е сутки проростки пересаживали в пластиковую бутылку объемом 250 мл (4 сеянца на горшок), содержащую питательный раствор с различной концентрацией кремния. После культивирования в течение 8 часов стебель отделяли на 1 см выше корней и собирали ксилемный сок в течение 30 минут с помощью микропипетки.Концентрация кремния в ксилемном соке и внешнем растворе до и после 8-часового культивирования определялась немедленно. Также регистрировали массу корней и потерю воды.
Измерение
29 Si-ЯМР
Проростки (возраст 40 дней) культивировали в питательном растворе, содержащем 0,5 мм 29 Кремний, обогащенный кремнием, в виде кремниевой кислоты. 29 Si-обогащенный 29 SiO 2 (обогащение 98,7%) был приобретен в Shoko (Токио). Порция (0.1 г) 29 SiO 2 растворяли в 2 н. NaOH с помощью микроволн, затем разбавляли дистиллированной водой и пропускали через катионообменную смолу, как описано выше, перед использованием. После культивирования в течение 4 часов ксилемный сок собирали, как описано выше. Корни и листья замораживали при -80 ° C в течение 2 ч. Клеточный сок получали из корней и листьев путем выдавливания замороженного образца пластиковым шприцем до его полного размораживания при комнатной температуре. Собранные ксилемный сок, сок корневых клеток и сок клеток листьев немедленно подвергали измерению 29 Si-ЯМР с использованием 5-мм ЯМР-трубки.
Спектры Si-ЯМР 29 получали при 99,36 МГц (спектрометр DMX-500; Bruker BioSpin GMBH, Карлсруэ, Германия). Параметры наблюдения для Si-ЯМР 29 были следующими: диапазон частот 27,8 кГц; точка данных, 64 КБ; время сбора данных 1,18 с; задержка релаксации 3,2 с; количество сканирований, 512. Раствор дейтерированного хлороформа, содержащий 1% тетраметилсилана, использовали в качестве внешнего эталона для калибровки химического сдвига (0 ppm). Также был записан спектр 29 Si-ЯМР кремниевой кислоты, обогащенной 2 мм 29 Si.
Определение концентрации кремния
Концентрацию кремния в симпластических и апопластических растворах и в ксилемном соке определяли колориметрическим методом молибденового синего сразу после сбора. Краткое описание метода заключается в следующем. Раствор 0,01 мл образца добавляли к 1,15 мл воды, затем 0,6 мл 0,26 н. HCl, 0,08 мл 10% (NH 4 ) 6 Mo 7 O 24 , 0,08 мл 20% винной кислоты и 0.08 мл восстановителя. Восстановитель получали растворением 1 г Na 2 SO 3 , 0,5 г 1-амино-2-нафтол-4-сульфоновой кислоты и 30 г NaHSO 3 в 200 мл воды. Через 1 ч оптическую плотность измеряли на спектрофотометре (Jasco, Tokyo) при 600 нм.
Картирование сцепления
Lsi1
Сеянцы (возрастом 4 недели) популяций F 2 , полученные от мутанта ( lsi1 ) и Kasalath, использовали для определения поглощения кремния.Всего 105 проростков F 2 каждый в пластиковом флаконе объемом 50 мл культивировали в питательном растворе, содержащем 0,6 мм кремния, в течение 6 ч при 25 ° C. Концентрацию кремния в питательном растворе до и после культивирования определяли, как описано выше. Также регистрировали потерю воды и вес корней в свежем виде.
Для экстракции ДНК образцы листьев отбирали после эксперимента по поглощению и хранили при -80 ° C до использования. ДНК экстрагировали согласно Komatsuda et al. (1998). Вкратце, лист (приблизительно 50 мг) помещали в пробирку и гомогенизировали в буферном растворе (300 мМ, мкл, л), содержащем 100 мМ Трис-HCl, 50 мМ ЭДТА, 500 мМ NaCl и 10 мМ 2-меркаптоэтанола при pH 8. .0, с последующим добавлением 40 мкл л 10% SDS и нагреванием при 65 ° C в течение 15 минут с периодическим встряхиванием. Затем добавляли 100 мкл л 5 м раствора ацетата калия, кратковременно встряхивали и охлаждали на льду в течение 15-30 минут. После добавления 500 мкл л фенола / хлороформа и встряхивания пробирки центрифугировали при 12000 об / мин в течение 5 минут при 4 ° C. Супернатант (350, мкл, л) переносили в новую пробирку, смешивали с равным количеством изопропанола и хорошо перемешивали. Пробирки центрифугировали при 12000 об / мин в течение 30 с, супернатант отбрасывали.Осадок промывали 70% этанолом и снова центрифугировали. Наконец, осадок растворяли в 100 мкл л 0,1 × Трис-ЭДТА.
Чтобы идентифицировать молекулярные маркеры, связанные с Lsi1 , мы выполнили объемный сегрегантный анализ путем объединения равных количеств ДНК из 10 растений с низким потреблением кремния и 10 растений с высоким потреблением кремния из популяции F 2 , на основе результата эксперимент по поглощению кремния, описанный выше. В общей сложности 128 маркеров ПЦР на основе EST, разбросанных по целым хромосомам, были отобраны для изучения полиморфизма между массами с низким и высоким поглощением кремния, а также между Kasalath и мутантом.Подробная информация об этих маркерах для массового сегрегантного анализа доступна на http://rgp.dna.affrc.go.jp.
Хромосомное положение Lsi1 было подтверждено путем исследования отдельной линии с низким потреблением кремния с использованием фланкирующих маркеров ({«type»: «entrez-nucleotide-range», «attrs»: {«text»: «C53493-C63223) «,» start_term «:» C53493 «,» end_term «:» C63223 «,» start_term_id «:» 23 «,» end_term_id «:» 2421928 «}} C53493-C63223). Для дальнейшего картирования гена Lsi1 использовали маркеры ПЦР на основе EST и микросателлитные маркеры на хромосоме 2 (McCouch et al., 2002; Wu et al., 2002). Наконец, генотипы 105 растений F 2 были исследованы с использованием RM5303, RM5631 и E60168.
ПЦР-амплификации проводили в аликвотах 10- мкл л, каждая из которых содержала 10 нг мкл л -1 ДНК, 0,2 мк мкм обоих праймеров, 200 мкМ dNTPs, 1,5 мм MgCl 2 и 1 × Ampli Tag gold. Используемые программы термоциклирования включали предварительный этап: 2 мин при 94 ° C, 30 циклов по 30 с при 94 ° C, 1 мин при 60 ° C, 1 мин при 72 ° C, с заключительным этапом 5 мин при 72 ° C. для маркеров ПЦР на основе EST и предварительный этап 2 мин при 94 ° C, 35 циклов по 1 мин при 94 ° C, 1 мин при 55 ° C и 2 мин при 72 ° C с заключительным этапом 5 мин при 72 ° C для микросателлитных маркеров.Продукты ПЦР анализировали на 3% агарозных гелях, окрашенных бромидом этидия. Данные сегрегации поглощения кремния и полиморфизма использовали для анализа сцепления, выполненного MAPMARKER / EXP версии 3.0b (Lander et al., 1987).
Примечания
1 Эта работа была поддержана грантом на научные исследования Министерства образования, культуры, спорта, науки и технологий Японии (грант № 15380053 для JFM) и Министерством Сельское, лесное и рыбное хозяйство Японии (грант проекта «Геном риса» №IP-5003 в J.F.M.).
Информацию о статье, дате публикации и цитировании можно найти на сайте www.plantphysiol.org/cgi/doi/10.1104/pp.104.047365.
Токсикология наночастиц кремнезема: обновление
Цитотоксичность
Окислительный стресс (чрезмерное производство активных форм кислорода, т. Е. АФК), вызванный НЧ, может повредить клеточные компоненты и привести к гибели клеток через апоптоз (Fu et al. 2013) . Таким образом, в этом разделе были обобщены исследования, посвященные цитотоксичности и окислительному стрессу.
Цитотоксичность, связанная с окислительным стрессом
Duan et al. (2013a) показали, что S-SiNP (62 нм) индуцируют время (6, 12 и 24 часа) и дозозависимое (25–100 мкг / мл) снижение жизнеспособности клеток (оценивается по 3- (4,5- диметилтиазол-2-ил) -2,5-дифенилтетразолий бромид, т.е. МТТ), потеря целостности мембраны (высвобождение лактатдегидрогеназы (ЛДГ)) и апоптоз (окрашивание аннексином V / PI) в эндотелиальных клетках пупочной вены человека (HUVEC). Апоптоз также индуцировался в эпителиальных клетках легких (A549) и кожи (A431), обработанных Pr-SiNP (15 нм).Дозозависимое увеличение (25–200 мкг / мл в течение 72 часов) цитотоксичности (МТТ и ЛДГ), продукции ROS (оцениваемой с помощью анализа дихлоргидрофлуоресцеина, т.е. DCFH-DA), перекисного окисления липидов (измерение малонового диальдегида, то есть MDA) , и апоптоз (активность каспаз 3 и 9) наблюдался в обеих клеточных линиях. Клетки легких в целом показали немного более высокий токсический ответ по сравнению с клетками кожи (Ahamed 2013).
SiNP (20 и 80 нм) индуцировали P53-опосредованный апоптоз в фибробластах легких плода человека (HFL-1).При дозе 500 мкг / мл 20 нм SiNP вызывали трехкратное увеличение флуоресценции DCF по сравнению с 80 нм. Кроме того, повышенная экспрессия P53, активация цитохрома C (CytC) и каспазы 9 и подавление антиапоптотического белка B-клеточной лимфомы 2 (bcl2) наблюдались в клетках, обработанных 1000 мкг / мл в течение 48 часов (Xu et al. al.2012). Другое исследование фибробластов легких также показало, что SiNP (20 нм) могут снижать жизнеспособность клеток (MTT), вызывая апоптотическую гибель клеток (флуоресцентная микроскопия) дозозависимым образом (250–1000 мкг / мл в течение 48 часов) (Zhang et al. .2011). Athinarayanan et al. (2014) выделили SiNP (10–50 нм) из коммерческих пищевых продуктов, обработанных пищевой добавкой диоксид кремния (E551), и экспонировали фибробласты легких человека (линия клеток WI-38) с возрастающими дозами (25–400 мкг / мл). Через 24 часа они наблюдали цитотоксичность (МТТ) в зависимости от дозы и продукцию ROS (DCFH-DA) на уровне 50 мкг / мл.
Цитотоксичность, не связанная с окислительным стрессом
Py-SiNP (12 и 40 нм) индуцировали значительный размер и дозу (31,3, 93,8 и 156,3 мкг / см) 2 лунок для культивирования) цитотоксичность (LDH, анализ сульфородамина B) (SRB) и водорастворимый тетразолий-1 (WST-1)) в клеточной линии карциномы толстой кишки человека (HT29), в то время как индукция ROS (DCFH-DA) не наблюдалась (Gehrke et al.2013). В исследовании Napierska et al. (2012a), 50 мкг / мл (24 ч) 16 нм легированных железом S-SiNP и чистых S-SiNP индуцировали сильную цитотоксичность (MTT и LDH) в линии эндотелиальных клеток человека (EA.hy926), но значительное увеличение в маркерах окислительного стресса [истощение GSH, малоновый диальдегид (образование MDA), индукция гемоксигеназы-1, глутатионредуктазы и НАДФН-оксидазы-1] наблюдали только для SiNP, допированных железом.
Заключение: цитотоксичность
Цитотоксичность SiNP исследовали с использованием различных клеточных линий и времени инкубации, что затрудняет сравнение исследований.Однако из таблицы 3 ясно, что все типы SiNP индуцируют цитотоксичность. Значительные (по сравнению с необработанными клетками) цитотоксические эффекты наблюдались только при концентрации 25 мкг / мл или выше. Более того, можно ясно видеть, что SiNPs индуцируют окислительный стресс и опосредуют апоптоз, главным образом, через внутренний или митохондриальный путь (каспазозависимый путь) в зависимости от размера и дозы. Считается, что опосредованная АФК токсичность является важным механизмом токсичности НЧ, включая SiNP (Manke et al.2013). Тем не менее, Py- и S-SiNPs вызвали цитотоксичность без измеримых уровней продукции ROS. Было продемонстрировано, что нарушение целостности мембраны из-за прямого межклеточного взаимодействия может быть другим возможным механизмом цитотоксичности NP (Fröhlich et al. 2009; Thomassen et al. 2011). Однако ни одно из этих исследований не подтвердило эти наблюдения, и, следовательно, цитотоксические эффекты SiNP в отсутствие окислительного стресса остаются малоизученными.
Таблица 3 Сравнение токсических эффектов, вызванных различными типами SiNP (in vitro)
Более того, некоторые авторы использовали очень высокие концентрации, которые могут вызывать «перегрузку» клеток и изменять природу взаимодействий NP-клетки (Wittmaack 2011).В этих случаях трудно оценить, являются ли наблюдаемые эффекты физиологически значимыми. Несмотря на то, что это сложно, мы считаем дозу 384 мкг / см 2 или выше не имеющей отношения к ингаляционному воздействию аморфного кремнезема на человека, основываясь на оценке, которая может быть получена из уровней профессионального воздействия (OEL) (рис. 2) .
Рис. 2
Оценка дозы in vitro на основе переносимых для человека уровней (OEL)
Генотоксичность
В этом разделе мы представили исследования генотоксических эффектов SiNP, поскольку они используются в качестве еще одной важной конечной точки для характеристики опасности НМ.Прямое взаимодействие с ДНК, окислительное повреждение ДНК, истощение антиоксидантов, остановка клеточного цикла и аномальная экспрессия генов были идентифицированы как потенциальные механизмы NP-опосредованной (гено) токсичности (Donaldson et al. 2010).
Повреждение ДНК, связанное с окислительным стрессом
Воздействие SiNP (15, 30 и 100 нм) приводило к зависимому от размера и дозы (2,5–10 мкг / мл в течение 24 часов) увеличению 8-гидрокси-2 ′ -дезоксигуанозина (8-OH-dG), фосфорилирование гистона по серину-139 (ɣh3AX) и разрывы цепей ДНК (комета) в кератиноцитах человека (HaCaT) (Gong et al.2012). Набеши и др. (2011a) также продемонстрировали, что воздействие SiNP (70 нм; 10–90 мкг / мл в течение 24 ч) приводит к увеличению окислительного повреждения ДНК (уровни 8-OH-dG) в клетках HaCaT. SiNP поглощались посредством актин-опосредованного эндоцитоза. Частицы микронного размера, использованные в этих исследованиях, не показали никаких эффектов или показали их незначительные эффекты.
Жизнеспособность клеток кавказской аденокарциномы толстой кишки (Caco-2) упала до 40% при воздействии 15 нм C-SiNP (64 мкг / мл в течение 24 часов), и при этой же концентрации количество микроядер увеличилось почти в три раза. наблюдались пятикратное увеличение фосфорилирования гистонов (ɣh3AX) и значительное увеличение флуоресценции DCF.Частицы были локализованы в лизосомах и эндоцитарных компартментах, но не в ядре. 55 нм C-SiNP не вызывали ни одного из этих эффектов при той же концентрации (Tarantini et al. 2015b).
Незначительное увеличение% хвостовой ДНК (анализ комет) и отсутствие хромосомных аберраций были вызваны 17 нм SiNP в периферических лимфоцитах человека, обработанных 100 мкг / мл, в то время как дозозависимые (50–100 мкг / мл в течение 24 дней). h) Наблюдались продукция ROS (DCFH-DA) и истощение GSH (Rajiv et al.2015).
Остановка клеточного цикла, связанная с окислительным стрессом
S-SiNP (62 нм) индуцировала увеличение флуоресценции DCF и снижение супероксиддисмутазы (SOD) и глутатионпероксидазы (GSH-Px) в HUVECs дозозависимым образом (25– 100 мкг / мл в течение 24 ч). Окислительный стресс был связан с остановкой клеточного цикла в контрольной точке G2 / M (повышающая регуляция chk 1 и понижающая регуляция Cdc25c, Cyclin B1 и Cdc2) и увеличение апоптоза (Duan et al. 2013a). В исследовании Li et al. (2011), зависимое от размера (19, 43 и 68 нм) увеличение окислительного стресса (флуоресценция DCF) и остановка клеточного цикла в S и G2 / M наблюдались в клетках HepG2, подвергнутых воздействию 100 мкг / мл C-SiNP. .Остановка клеточного цикла в фазе G2 / M наряду с увеличением ROS была также замечена в линии клеток печени человека (LC-02), обработанной S-SiNP (50 нм) дозозависимым образом (50-200 мкг / мл для 24 ч) (Wang et al.2013).
Повреждение ДНК, не связанное с окислительным стрессом
Генотоксичность SiNP Py-SNP (20 и 25–70 нм), Pr-SNP (20 нм) и C-SNP (15 и 40–80 нм) изучалась на китайском языке. фибробласты легких хомяка. Py-SiNP (20 нм) вызывали значительное увеличение разрывов цепей ДНК при 66 мкг / мл (24 ч), в то время как C-SiNP (15 нм) демонстрировали аналогичный эффект только при 252 мкг / мл.Ни один из этих SiNP не индуцировал АФК. SiNP размером 25–80 нм не проявляли генотоксичности или проявляли небольшую генотоксичность (Guichard et al. 2016).
Сообщения о генотоксичности без оценки окислительного стресса
M-SiNP (100 нм) индуцировали значительное увеличение фосфорилированных-ɣh3AX-фокусов в клетках HT-29, обработанных дозой 10 мкг / мл в течение 24 часов (Sergent et al. 2012 г.). В линии клеток эмбриональной почки человека (HEK293) 579 генов были активированы, а 1263 гена были подавлены после 24 часов воздействия (100 мкг / мл) на 100 нм M-SiNP (Zhang et al.2015). В другом исследовании 15-нм C-SiNPs вызывали значительное увеличение разрывов цепей ДНК (анализ комет) в клетках китайского хомячка (V79) и клетках A549 при 100 мкг / мл (24 ч), но для 55 нм этот эффект наблюдали только в клетках A549 (Maser et al. 2015). Значительное увеличение длины хвоста ДНК (анализ комет) наблюдалось в клетках HaCaT, обработанных 30 мкг / мл (24 ч) 70 нм SiNP (Nabeshi et al. 2011b).
Воздействие C-SiNP (~ 7 нм) приводило к положительным генотоксическим эффектам (анализ лимфомы) в клетках лимфомы мыши, обработанных 100 и 150 мкг / мл в течение 4 часов (Демир и Кастранова, 2016).SiNP (12 нм) индуцировали разрывы цепи ДНК в RAW 264.7 при 200 и 400 мкг / мл, но индукция микроядер наблюдалась только при 400 мкг / мл. Частицы были интернализованы в везикулах и в ядре (Hashimoto and Imazato 2015).
При любых испытанных концентрациях (1–100 мкг / мл в течение 72 часов) SiNP (10–25, 5–30, 35, 15, 80 и 90 нм) не вызывали ни цитотоксичности, ни микроядер в иммортализованных фибробластах Balb / 3T3 ( Убольди и др. 2012). В другом исследовании Pr-SiNPs (NM-200 и NM-201) и Py-SiNPs (NM-202 и NM-203) с первичным размером от 14.5 и 16 нм не индуцировали никаких микроядер (анализ микронуклеусов цитокинеза) в периферических лимфоцитах человека, подвергшихся воздействию различных концентраций (200–1250 мкг / мл) в течение 24 часов (Tavares et al. 2014). Также стоит отметить, что в последнем исследовании использованный положительный контроль не отличался от контрольных условий.
Заключение: генотоксичность
C-SiNP и S-SiNP индуцировали генотоксичность в линиях опухолевых клеток человека (легкие, почки, кожа и желудочно-кишечный тракт), а амплитуда эффекта отрицательно коррелировала с размером NP.Разрывы цепей ДНК наблюдались при низких концентрациях (2,5–10 мкг / мл), особенно в линиях клеток кожного происхождения. Генотоксические эффекты C- и S-SiNP в основном связаны с индукцией окислительного стресса, тогда как такая информация очень ограничена для других типов (Py- и Pr-SiNP). Одно исследование показало, что Py-SiNPs вызывают повреждение ДНК без генерации ROS, предполагая, что могут быть задействованы другие механизмы, такие как прямое повреждение ДНК (Magdolenova et al. 2014). Однако очень трудно судить, является ли такой генотоксический эффект прямым или косвенным, поскольку о клеточном захвате и субклеточной локализации SiNP не часто сообщается.Кроме того, несколько факторов, таких как свойства SiNP, тип клеток и сценарии воздействия (такие как концентрации, анализы и конечные точки), могут влиять на результаты (Магдоленова и др., 2014), что затрудняет сравнение исследований и указывает на острую необходимость в стандартизация исследований генотоксичности.
Иммунотоксичность
НЧ, попадая в организм, скорее всего, будут взаимодействовать с иммунными клетками, поскольку они являются первой линией защиты в организме человека. В этом разделе мы представили иммунные ответы, индуцированные SiNP в различных клеточных линиях.
Иммунотоксичность, связанная с окислительным стрессом
Hara et al. (2014) подвергали макрофаги, полученные из THP-1, воздействию 100 мкг / мл SiNP (30 нм) в течение 6 часов и обнаружили значительное увеличение интерлейкина-1-бета (IL-1β), продукции ROS и поглощения SiNP посредством фагоцитоза. В исследовании Choi et al. (2010), SiNPs большего размера (150–200 нм) эффективно фагоцитировались первичными микроглиальными клетками крысы после 24 часов воздействия различных концентраций (0,0728–7,28 мкг / мл). Значительное увеличение ROS, активных форм азота (RNS) и IL-1β было обнаружено при всех концентрациях.
Иммунотоксичность, не связанная с окислительным стрессом
При 10 и 20 мкг / мл, Di Cristo et al. (2016) обнаружили, что Py-SiNP (~ 14 нм) индуцировали более сильное увеличение фактора некроза опухоли-альфа (TNF-α), интерлейкина (IL) -6 и IL-1β в макрофагах RAW.264.7 по сравнению с Pr -SiNPs; Примечательно, что SiNP не индуцировали АФК в макрофагах RAW.264.7.
Отчеты об иммунотоксичности без оценки окислительного стресса
Значительное увеличение TNF-α, IL-6 и IL-1α, митоген-активированных протеинкиназ (MAPK) и ядерного фактора (NF) -κB наблюдалось только для C. -SiNP (100 нм) в J774A.1 макрофаги подвергались воздействию 100 мкг / мл C-SiNP или M-SiNP того же размера (100 нм) (Lee et al. 2011).
Uemura et al. (2016) показали, что SiNP (10 и 50 нм) вызывают дозозависимое (6,25–100 мкг / мл) увеличение продукции TNF-α и снижение IL-6 в макрофагах RAW.264.7, в то время как их поверхность модифицирована амином. аналогов не было. Более того, частицы микронного размера 300 и 1000 нм (как без покрытия, так и модифицированные амином) также показали дозозависимое снижение IL-6. Примечательно, что эффекты были сильнее для 50 нм по сравнению с другими частицами.Эту же клеточную линию использовали Yu et al. (2011) для исследования фагоцитоза с помощью масс-спектроскопии с индуктивно связанной плазмой (ICP-MS), и они обнаружили, что S-SiNP (25 нм) фагоцитируются по крайней мере в десять раз чаще, чем M-SiNP того же размера и SiNP с высоким соотношением сторон (AR 2, 4 и 8). В исследовании Napierska et al. (2012b), клетки THP-1, которым вводили дозу 5 мкг / см 2 S-SiNP (2 нм), показали значительное увеличение IL-8, TNF-α и воспалительного белка макрофагов (MIP) -1α, в то время как только Незначительное увеличение экспрессии MIP-1α наблюдалось для S-SiNP размером 16 и 104 нм.
Заключение: иммунотоксичность
Основными клетками, используемыми для изучения иммунных ответов на SiNP, были «врожденные» клетки, такие как моноциты и макрофаги. Таким образом, выявленные исследования in vitro затрагивают только очень ограниченную часть иммунной системы, в основном провоспалительные реакции и потенциальный фагоцитоз. Кроме того, данные об иммунных ответах и окислительном стрессе очень ограничены, и поэтому нельзя сделать однозначных выводов. SiNP не только вызывают более сильные провоспалительные реакции по сравнению с частицами субмикронного и микронного размера, но также наблюдаются эффекты, зависящие от размера в нанодиапазоне в иммунных клетках.Помимо размера, формы и пористости, похоже, влияют на фагоцитоз SiNP.
Аутофагия
В последнее время появляется все больше данных о том, что аутофагия является механизмом клеточной защиты против токсичности NP, поскольку она играет ключевую роль в удалении неправильно свернутых белков и очищении поврежденных органелл (Glick et al. 2010). Поэтому мы представляем здесь исследования, которые показывают индукцию аутофагии при воздействии SiNP.
Аутофагия, связанная с окислительным стрессом
Одни и те же S-SiNP (62 нм) использовались в трех исследованиях для изучения индукции аутофагии.Наряду с дозозависимым (25–100 мкг / мл) увеличением продукции ROS было обнаружено увеличение аутофагии биомаркер-микротрубочки-ассоциированный белок 1A / 1B-легкая цепь 3 (LC3) и аутофагические вакуоли, меченные монодансилкадаверином (MDC). в клетках HepG2, обработанных 62 нм S-SiNP. Кроме того, изображения просвечивающей электронной микроскопии (ПЭМ) показали, что аутофагосомы и автолизосомы индуцируются в присутствии SiNPs (Yu et al. 2014). Те же S-SiNP (62 нм) индуцировали увеличение соотношения LC3-II / LC3-I и снижение p-mTOR / mTOR, p-P13 K / P13 K и p-Akt / Akt в клетках HUVEC в дозозависимой дозе. (25–100 мкг / мл) способом (Duan et al.2013б, 2014а, б). Результаты Guo et al. (2016) также предполагают, что 50 мкг / мл S-SiNP (58 нм) могут вызывать аутофагию посредством передачи сигналов MAPK / Bcl-2 и PI3K / Akt / mTOR в HUVEC.
После 4 часов воздействия 200 мкг / мл S-SiNP (50 нм) в клетках HaCaT наблюдали продукцию аутофагосом и АФК. ПЭМ-изображения показали, что SiNP находятся в цитоплазме и лизосомах, но не в ядре. (Лян и др., 2014).
SiNP (4–13 нм, 62,5 мкг / мл) индуцировали зависящее от времени (24, 48 и 72 ч) снижение жизнеспособности клеток и увеличение окислительного стресса (флуоресценция DCF и истощение GSH) в линии клеток фибробластов легких MRC-5.По сравнению с контролем, значительное увеличение количества аутофагических вакуолей и соотношения LC-3 II / LC3-I также наблюдалось в зависимости от времени (Voicu et al. 2015). Клетки A549 при воздействии 100 и 1000 мкг / мл 20-нм SiNP показали трехкратное и пятикратное увеличение флуоресценции MDC соответственно. Кроме того, гены аутофагии, такие как ATG-12 и BECN, были значительно активированы (в 30 и 50 раз, соответственно) вместе с увеличением продукции ROS в клетках с дозой 1000 мкг / мл (Nowak et al. 2014).
Заключение: аутофагия
SiNPs, особенно S-SiNPs, индуцируют аутофагию, главным образом, за счет опосредованной окислительным стрессом активации генов, связанных с аутофагией, и дифференциальной регуляции передачи сигналов Akt / mTOR. Подобно цитотоксичности, 25 мкг / мл оказались самой низкой концентрацией воздействия, при которой SiNP проявляли значительный эффект. Кроме того, индуцированная аутофагия коррелирует с цитотоксичностью, предполагая, что воздействие SiNP вызывает необратимое (серьезное) клеточное повреждение и приводит к гибели аутофагических клеток.Помимо индукции аутофагии, лизосомальная дисфункция и дисфункция аутофагии могут быть потенциальным механизмом токсичности НЧ (Stern et al. 2012), который, однако, не исследовался для SiNP.
Токсическое воздействие на клетки крови и эндотелиальная дисфункция
Некоторые исследования показывают, что НЧ при вдыхании или проглатывании могут перемещаться через барьеры (например, воздух – кровь) тела, попадать в кровоток и взаимодействовать с сердечно-сосудистой системой. В этом разделе мы обобщили исследования, в которых сообщается о влиянии SiNP на кровь и эндотелиальные клетки.
Токсическое действие на клетки крови
Nemmar et al. (2015) показали, что тромбоциты крови мыши могут агрегировать после 3 мин инкубации с 5 или 25 мкг / мл 50-нм C-SiNP, тогда как в исследовании Jose Corbalan et al. (2012) такая агрегация наблюдалась через 15 мин (10 мкг / мл 10 нм C-SiNP). Последнее исследование также показало четырехкратное снижение отношения оксида азота (NO) / пероксинитрита (ONOO —) по сравнению с необработанными тромбоцитами.
Maurer-jones et al. (2010) исследовали роль пористости SiNP на токсичность клеток крови.M-SiNP (25 нм) снижали жизнеспособность красных кровяных телец (RBC) до 50% при концентрации 270 мкг / мл, в то время как для непористых S-SiNP аналогичного размера для достижения этого уровня требовалось всего 20 мкг / мл. цитотоксичности. В другом исследовании 10% гемолиз (LC 10 ) эритроцитов наблюдался при 36 мкг / мл для S-SiNP (115 нм), в то время как M-SiNP требовалось 154 мкг / мл, чтобы вызвать те же эффекты. Для аналогов, покрытых амином, LC 10 составлял 97 и 30 мкг / мл для S- и M-SiNP соответственно (Yu et al. 2011).
Дисфункция эндотелия
Воздействие различных концентраций (12,5–100 мкг / мл) S-SiNP (58 нм) приводило к дозозависимому увеличению медиаторов воспаления, таких как IL-1β, IL-8 и TNFα, межклеточный молекула адгезии-1 (ICAM-1), молекула адгезии сосудистых клеток (VCAM-1) и хемоаттрактантный белок-1 моноцитов (MCP-1) в клетках HUVEC (Guo et al.2015). В исследовании Corbalan et al. (2011), 10 мкг / мл 10-нм C-SiNP индуцировали чрезвычайно низкое отношение NO / NOO — (~ 0.1) в клетках HUVEC. Кроме того, продукция свободных радикалов, провоспалительные цитокины (IL-6 и IL-8) и активность связывания NF-κB были значительно увеличены в обработанных клетках. В этих двух исследованиях увеличение ROS наблюдалось при всех испытанных концентрациях.
S-SiNPs (62 нм) вызвали дисбаланс фермента отношения NO / синтаза оксида азота (NOS) в клетках HUVEC, и такой дисбаланс привел к значительному усилению провоспалительного ответа (c-реактивный белок CRP, IL-1β , IL-6 и TNFα) в зависимости от дозы (50–100 мкг / мл) (Duan et al.2014b).
Заключение: токсическое воздействие на клетки крови и эндотелиальная дисфункция
Эндотелиальные клетки и тромбоциты вместе играют ключевую роль в поддержании сосудистого гомеостаза (Rajendran et al. 2013). C-SiNPs вызывали окислительный стресс и нарушали соотношение NO / NOO –, что приводило к агрегации тромбоцитов и эндотелиальной дисфункции. Эта информация недоступна для других типов SiNP. Кроме того, опосредованная C-SiNP дисфункция эндотелия приводит к провоспалительным сигналам через секрецию цитокинов и молекул адгезии.Вместе эти результаты указывают на потенциал SiNPs вызывать тромбоз сосудов и атеросклероз (Radomski et al. 2005). Кроме того, SiNPs вызывают гемолиз эритроцитов в зависимости от размера, заряда и пористости.
Нейротоксичность
НЧ очень малого размера способны перемещаться через гематоэнцефалический барьер (Hu and Gao 2010). Поэтому здесь представлены исследования, изучающие влияние на клетки, имеющие отношение к нейротоксичности.
Опухолевые клетки мозгового вещества крысы (линия клеток PC12), инкубированные с супернатантом микроглиальных клеток, обработанных 20 нм SiNP (250 мкг / мл и 500 мкг / мл в течение 24 ч), не показали каких-либо эффектов по сравнению с контролем.Ранее в этом исследовании секреция биомедиаторов не наблюдалась в обработанных SiNPs микроглиальных клетках (Xue et al. 2012). В отличие от этого исследования, клетки PC12, подвергшиеся непосредственному воздействию SiNP (25 нм; 25-200 мкг / мл в течение 24 часов), показали повышенное поглощение и дозозависимое увеличение индукции аутофагии (увеличение LC-II и Beclin 1). и ингибирование передачи сигналов PI3 K-Akt-mTOR (Xie and Wu 2016). Ян и др. (2014a) показали, что воздействие SiNP (15 нм; 10 мкг / мл в течение 24 часов) индуцировало патологические признаки болезни Альцгеймера, такие как измененная экспрессия белка-предшественника амилоида (APP) и неприлизина, усиленное фосфорилирование тау по Ser262 и Ser396 и активация киназы синтеза гликогена (GSK) -3β в клетках SK-N-SH человека и нейробластомы нейробластомы мыши.
Заключение: нейротоксичность
В исследованиях in vitro использовались клеточные линии клеток ЦНС, в основном нейроноподобные клетки. Хотя данные о нейротоксических эффектах SiNP очень ограничены, исследования, приведенные выше, предполагают, что SiNP могут вызывать побочные эффекты, включая маркеры болезни Альцгеймера, при прямом контакте с клетками нейробластомы.
Разные проблемы
Влияние клеточных линий на цитотоксичность SiNP
В клетках HepG2 в присутствии SiNP (7 и 20 нм) наблюдали дозозависимое (80–640 мкг / мл) снижение жизнеспособности и увеличение апоптоза , но значительное снижение наблюдалось в нормальных клетках печени человека (LC-02) только при нереалистичном уровне дозы 640 мкг / мл (Lu et al.2011). В другом исследовании SiNP (10-50 нм) вызывали дозозависимое (100-600 мкг / мл) увеличение высвобождения ЛДГ в клетках Caco-2, но значительное высвобождение ЛДГ наблюдалось только при нереалистичной дозе 600 мкг. / мл в эпителиальных клетках желудка человека (GES-1). Более того, воздействие этих SiNP (200 мкг / мл в течение 48 часов) также индуцировало остановку клеточного цикла в S-фазе для клеток GES и G2 / M в клетках Caco-2 (Yang et al. 2014b). В линии клеток почек свиньи (LLC PK1), подвергнутых воздействию SiNP с длиной волны 20 нм, наблюдалось дозозависимое (5-50 мкг / мл) увеличение флуоресценции DCF и образования MDA, тогда как клетки почек человека (HK-2) демонстрировали мало эффекты при 50 мкг / мл (Passagne et al.2012).
Заключение: прочие вопросы
По этим случаям нельзя сделать однозначных выводов; однако цитотоксичность SiNP, по-видимому, зависит от вида и линии клеток.
Физиологически релевантные культуры
Модели совместного культивирования легких
Совместные культуры клеток легких обычно получают с эпителиальными клетками на апикальной части и эндотелиальными клетками на базальном компартменте трансвеллентной мембраны с моноцитами на поверхности эпителия или без клетки.В совместном культивировании (A 549 на апикальной части и ISO-HAS-1 в базолатеральном компартменте), подвергнутом воздействию 100 мкг / мл 30-нм C-SiNP (покрытых сурфактантом или без него), почти пятикратное увеличение содержания IL-2……………………………………………………………………………………………………………………………………….. 8 высвобождение обеих форм SiNPs наблюдалось в обоих компартментах (Kasper et al. 2015). Когда использовали другие эпителиальные клетки — клетки h541 — в апикальном направлении вместе с клетками ISO-HAS-1 в базолатеральном компартменте, эти C-SiNPs, индуцированные IL-8, экспрессировались в обоих компартментах, тогда как SiCAM-1 (6-600 мкг / мл) и IL-6 (6 и 60 мкг / мл) наблюдались только в апикальной части (Kasper et al.2011). Та же самая модель совместного культивирования подвергалась воздействию 100 мкг / мл S-SiNP (15, 35 и 80 нм), и авторы заметили увеличение IL-8, TNF-α и белка сурфактанта (SP-A1 и SP -A2) по сравнению с контролем. Кроме того, меньшая экспрессия IL-8 и сурфактантного белка и больше TNF-α наблюдались в совместной культуре с добавлением THP-1, в частности, эффект был максимальным для 35 нм (Farcal et al. 2012).
Napierska et al. (2012b) протестировали SiNP с первичным размером 2, 16, 60 и 104 нм (дозировка 10 мкг / см 2 ) в совместном культивировании (A549 на апикальной части и EA.hy926 в базолатеральном компартменте) и наблюдали увеличение цитокинов, таких как IL-6, IL-8, TNF-α и MIP-1α, только для 60 и 2 нм (кроме IL-8). Когда THP-1 был добавлен к совместной культуре, значительное увеличение IL-8 и снижение TNF-α наблюдались только для 2 нм. Экспрессия цитокинов также по-разному регулировалась для 16 и 104 нм до и после добавления THP-1, но эффекты были сильнее для 60 и 2 нм, особенно для НЧ 60 нм.
Граница раздела воздух – жидкость
На границе раздела воздух – жидкость (ALI) аэрозольные и осажденные 12 нм Py-SiNP (52 мкг / см 2) и 50 нм S-SiNP (117 мкг / см 2 ) вызывали значительно меньшие биологические эффекты (утечка LDH, высвобождение IL-8, экспрессия COX-2 и фосфорилирование p38) в клетках A549 по сравнению с A549, подвергшимися воздействию 15.6 мкг / см 2 в условиях погружения (Панас и др., 2014).
Заключение: физиологически релевантные культуры
Утверждается, что субслитые (со) культуры и системы ALI (Lenz et al. 2013; Panas et al. 2014) более точно имитируют сценарии воздействия in vivo по сравнению с монокультурами. В этих системах токсичность и провоспалительные реакции в значительной степени модулируются SiNP, которые представляют сложность систем in vivo и необходимость создания физиологически релевантных культур in vitro.Однако в настоящий момент трудно сказать, повлияли ли на эти биологические реакции физико-химические свойства SiNP.
Хронические исследования in vitro
В недавнем исследовании изучалось хроническое воздействие Py-SiNP (12 нм) на линию кишечных эпителиальных клеток (C2BBe1) in vitro. Клетки подвергались воздействию SiNP 2 с концентрацией 10 мкг / см в течение 24 часов. Через 24 ч среду заменяли (без НЧ) и давали клеткам расти в течение 4–6 дней. В конце инкубации клетки пассировали, снова экспонировали в течение 24 часов и выращивали в течение 4–6 дней; этот цикл повторяли 29 пассажей (общая продолжительность жизни).Клетки и супернатанты собирали в конце каждого пассажа для анализа. Хотя частицы были интернализованы (только во фракции клеток), никакой значительной индукции некроза, апоптоза и высвобождения ЛДГ и снижения жизнеспособности клеток не наблюдалось ни в одном из этих состояний (McCracken et al. 2013).
Границы | Поглощение и локализация кремния в финиковой пальме (Phoenix dactylifera) — уникальная ассоциация со склеренхимой
Введение
Кремний (Si) не считается важным элементом для растений, но его концентрация в тканях может превышать концентрацию многих основных элементов у некоторых видов растений (Hodson et al., 2005; Белый и коричневый, 2010). Роль Si как полезного элемента для растений, защищающего их от различных абиотических стрессов и биотических проблем, давно обсуждается в литературе (Epstein, 1999; Coskun et al., 2018).
В большинстве случаев корни растений поглощают Si из почвенного раствора, а затем он транспортируется к надземным органам через ксилему (Casey et al., 2003; Mitani et al., 2005). Накопление Si сильно различается у разных видов растений и видов, принадлежащих к отряду комлинид однодольных Poales (e.g., злаки, травы, бромелии и осоки) и арековые (например, пальмы) обычно накапливают больше Si, чем другие растения (Hodson et al., 2005). Идентификация генов, кодирующих белки, ответственные за транспорт Si, показала, что накопление Si является результатом эффективного симпластического пути, опосредованного механизмами переноса притока и оттока Si в плазматическую мембрану клеток корня (Ma and Yamaji, 2015). Белки притока кремния, называемые Lsi1, являются членами группы NIP III (нодулин 26-подобный внутренний белок III) аквапорин-подобных белков, принадлежащих к большому суперсемейству MIP (главный внутренний белок), которое содержит различные классы интегральных мембранных белков, функционирующих как диффузионные. посредников воды и небольших незаряженных растворенных веществ (Wallace and Roberts, 2005; Ma and Yamaji, 2015; Pommerrenig et al., 2015; Дешмук и др., 2016). Аквапорины в группе NIP III содержат два отличительных домена: уникальный фильтр селективности (фильтр ar / R, также известный как фильтр GSGR), образованный глицином (G), серином (S), глицином (G) и аргинином (R), и два Мотивы NPA (также называемые блоками NPA), состоящие из аспарагина (N), пролина (P) и аланина (A), разделенных 108 аминокислотами (Deshmukh et al., 2015; Ma and Yamaji, 2015).
После поглощения корнями Si может откладываться в тканях растений в различных формах, чаще всего в кремниевых клетках или кремнеземных телах, распределенных внутри эпидермиса листа или в виде плотного слоя под кутикулой (Datnoff et al., 2001; Coskun et al., 2018). Другими частыми местами отложения Si являются специализированные клетки, называемые стегматами, которые образуют оболочку вокруг волокон склеренхимы, прикрепленных к сосудистым пучкам или отдельным пучкам волокон у таких видов, как ладони в отряде однодольных Комлинид Arecales и орхидеи в отряде однодольных некомлинид Asparagales (Møller and Rasmussen , 1984). Ткани корня также являются местами накопления Si у некоторых видов растений, причем энтодерма является доминирующим местом отложения, особенно у однодольных (Sangster and Hodson, 1992; Lux et al., 2003).
Отложение кремния на ладонях — хорошо известное, но малоизученное явление. Это исследование сфокусировано на подробном описании анатомии финиковой пальмы, поскольку она связана с уникальным распределением Si у этого вида, и представляет новые наблюдения о механизмах поглощения Si финиковыми пальмами и филогенетических отношениях между транспортными белками Si финиковой пальмы и другими Si- накапливающиеся виды.
Материалы и методы
Выращивание растений
В наших исследованиях мы сравнили три стадии развития финиковых пальм: молодые саженцы (возрастом около 1 месяца), выращенные на гидропонике, однолетние растения, выращенные на перлите, и 10-летние растения, выращенные в почве.Для экспериментов с ооцитами РНК экстрагировали из корней однонедельной финиковой пальмы и растений риса, выращенных в гидропонике.
Перед выращиванием в гидропонике и перлите семена финиковой пальмы стерилизовали поверхность в 2,5% растворе NaClO в течение 10 минут и несколько раз промывали dH 2 О. После такой обработки прорастание длилось около 2,5 недель. В гидропонике применялись две разные обработки: обработка Si-control раствором Хогланда (Hoagland and Arnon, 1950) и без добавления кремния, и обработка Si + раствором Хогланда и добавлением Si в виде силиката натрия [Na 2 O (SiO 2 ) х .xH 2 O, или также обозначается как Na 2 O 7 Si 3 от Sigma-Aldrich] до конечной концентрации 1 мМ (в тексте это соединение обозначается как Si) или 0,084 г / Л элементарного кремния. Эта концентрация Si была выбрана потому, что она аналогична концентрациям Si в почвенных растворах и рекомендуется для лабораторных исследований (Epstein, 1994; Liang et al., 2015). Растения выращивали в камере для выращивания при 12 ч света / 12 ч темноты, интенсивности света 200 мкмоль PAR m -2 с -1 , относительной влажности примерно 75% и дневных / ночных температур 28/24 °. С.В течение первых 5 дней проросшие растения акклиматизировали к гидропонике, выращивая их в растворе Хогланда половинной концентрации без добавления Si. Впоследствии были начаты две различные обработки (Si- и Si +), и пять растений культивировались в 3-литровых горшках в течение 21 дня. Раствор Хогланда обновляли каждые три дня, и pH доводили до значения 6,2.
Выращивание в горшках объемом 1 л, наполненных перлитом (68–73% SiO 2 , 7,5–15,0% Al 2 O 3 , 1,0–2.0% Fe 2 O 3 , 0,5–2,0% CaO, 0,2–1,0% MgO, 2,0–5,5% K 2 O, 2,5–5,0% Na 2 O, макс. 1,0% TiO 2 , макс. 0,2% P 2 O 5 , макс. 0,3% MnO) хватило примерно на 12 месяцев. Растения (по одному на горшок) поливали один раз в неделю раствором Хогланда половинной концентрации (200 мл). Растения выращивали в камере для выращивания в условиях, идентичных условиям, выращиваемым на гидропонике.
Кроме того, были изучены 10-летние растения, выращенные в почве в теплице на кафедре физиологии растений факультета естественных наук Университета Коменского в Братиславе.Растения регулярно поливали водопроводной водой, и каждые два года их переносили в более крупный горшок, содержащий свежую супесчаную почву с концентрацией биодоступного Si 113 ± 15 мг / кг -1 , как описано Bokor et al. (2017). Конечный объем горшка в конце выращивания составил 60 л.
Световая микроскопия
Срезы руки получали, как описано Lux et al. (2015). Поперечные и продольные срезы всех изученных органов, первичные, боковые и придаточные корни, стебель, верхушка побега, черешки листьев, влагалища и пластинки листьев были исследованы под микроскопом (Axioskop 2 plus, Carl Zeiss, Германия) и задокументированы с помощью цифровая камера DP72 (Olympus, Япония).
Для общей анатомии использовали как неокрашенные срезы, так и срезы, очищенные молочной кислотой и окрашенные в водном 0,05% (мас. / Об.) Растворе толуидинового синего. Реакция Виснера флороглюцин-HCl была использована для идентификации лигнификации клеточных стенок в отдельных тканях. Суберин визуализировали в очищенных и окрашенных срезах 0,01% (мас. / Об.) Раствором Fluorol Yellow 088 (FY088; Sigma-Aldrich) в молочной кислоте при 70 ° C в течение 1 ч (Lux et al., 2015) и исследовали под эпифлуоресцентный микроскоп (Axioskop 2 plus, Carl Zeiss, Германия; набор фильтров Carl Zeiss N.25: фильтр возбуждения ТВР 400 нм + 495 нм + 570 нм, хроматический светоделитель TFT 410 нм + 505 нм + 585 нм и эмиссионный фильтр ТВР 460 нм + 530 нм + 610 нм).
Последовательные поперечные и продольные срезы фиксированных, залитых в парафин и окрашенных срезов использовали для дополнительных исследований всех органов. Вкратце, образцы отдельных органов фиксировали в системе формалин – уксусная кислота – спирт (FAA), дегидратировали в градуированной серии этанола, переносили в ксилол и заливали парафином (Johansen, 1940).Срезы толщиной 15–20 мкм депарафинизировали в ксилоле, окрашивали альциановым синим / сафранином и помещали в канадский бальзам. Наблюдение и документирование выполнялись, как описано выше.
Сканирующая электронная микроскопия (СЭМ) в сочетании с рентгеновским микроанализом
Поперечно и продольно разрезанные и высушенные воздухом ткани корня, стебля и листа закрепляли на алюминиевых стержнях, покрытых углеродной наклейкой. Поверхностная проводимость была увеличена за счет углеродного покрытия, что, в свою очередь, также привело к образованию однородного углеродного слоя толщиной примерно 60 нм на поверхности ткани.Распределение Si анализировали с помощью сканирующего электронного микроскопа (SEM) Jeol JSM-IT300, оборудованного энергодисперсионным рентгеновским анализатором (EDX) (EDAX, Octane Plus, Ametek, США).
Фитолиты растений были исследованы в нескольких различных точках на каждой из трех исследованных тканей растения (корень, стебель и лист). Необработанные данные обрабатывались с помощью TEAM Enhanced ver. 4.3 (EDAX-Ametek, США), и все значения были выражены в весовых% от общего количества проанализированного Si-элемента.
Концентрации общего Si в тканях растений
В конце культивирования общую концентрацию Si измеряли в корнях и вторых полностью развитых листьях растений, культивируемых в перлите; и в корнях, на вершинах побегов, черешках и пластинках листьев растений, выращиваемых в почве. Концентрацию Si в сухой биомассе образцов растений определяли с помощью атомно-абсорбционной спектроскопии (ААС). Образцы растений сушили при комнатной температуре и измельчали на мелкие кусочки (<1 мм) с помощью ступки и пестика.Разложение образцов растений проводили в сосудах высокого давления из ПТФЭ ZA-1 (Чехия), покрытых нержавеющей сталью, в электрической печи при 160 ° C в течение 6 часов. Каждый сосуд содержал от 0,1 до 0,5 г образца высушенного растения, 5 мл концентрированной HNO 3 , 0,25 мл концентрированной HF и 2 мл 30% H 2 O 2 . После переваривания добавляли 2 мл насыщенного раствора H 3 BO 3 , и полученную смесь разбавляли до 25 мл бидистиллированной водой и хранили в полиэтиленовой бутылке объемом 100 мл.Концентрации кремния определяли методом атомно-абсорбционной спектрометрии в пламени (AAS Perkin Elmer Model 5000, длина волны 251,6 нм, пламя: ацетилен-N 2 O). Концентрацию биодоступного Si из перлита (70 ± 5 мг / кг -1 ) анализировали согласно Rodrigues et al. (2003) с соответствующими модификациями. После экстракции 0,5 М уксусной кислотой Si был измерен с помощью ICP-MS вместо колориметрического определения с использованием процедуры синей кремнемолибденовой кислоты, которая использовалась в исходной методике, а также был проанализирован сертифицированный эталонный материал для контроля качества на Si.Анализы проводились в сертифицированной лаборатории Института лабораторных исследований геоматериалов (факультет естественных наук Университета Коменского в Братиславе).
Выделение фитолитов кремнезема
Поперечные срезы руки из базальной части оболочки листа помещали на предметное стекло микроскопа и добавляли каплю 96% -ной серной кислоты. Через 5 мин добавили несколько капель дистиллированной воды, образец накрыли покровным стеклом и осторожно надавили, чтобы разрушить переваренные ткани.Затем выделенные образцы фитолитов использовали либо для темнопольной световой микроскопии, либо для анализа комбинационного рассеяния света.
Рамановская микроскопия
Для анализа комбинационного рассеяния были подготовлены срезы микротома толщиной 15 мкм с образцами, залитыми парафином, депарафинированные с использованием 100% ксилола в течение 30 минут (2 ×) и постепенно регидратированные с шагом 20 минут. Использовали постепенную серию смесей этанола и дистиллированной воды (1: 0; 1: 0; 0,7: 0,3; 0,5: 0,5; 0,3: 0,7; 0: 1; 0: 1). Срезы помещали на предметные стекла микроскопа, помещали в дистиллированную воду, закрывали покровными стеклами и закрывали лаком для ногтей, чтобы избежать испарения воды.Гидратированный силикагель получали в виде водной суспензии силикагеля для хроматографии. Спектры комбинационного рассеяния регистрировали с помощью микроскопа DXR Raman Microscope (Thermo Fisher Scientific, США), оснащенного лазером с длиной волны 532 нм, с использованием решетки 900 штр. Мм –1 . Спектры были записаны с использованием мощности лазера 9 мВт, времени фотообесцвечивания 12 с, времени сбора данных 10–30 с на коллекцию и восьми коллекций на измерение. Было собрано и проанализировано не менее пяти спектров на структуру. Для сбора спектров использовали программу Omnic Atlas (Thermo Fisher Scientific, США).Спектральную обработку выполняли с помощью Spectragryph 1.0.7 (F. Menges «Spectragryph — программное обеспечение для оптической спектроскопии», версия 1.0.7, 2017). Спектры были скорректированы по базовой линии, сглажены (Sawitzky-Golay, 9 точек, полиномиальный порядок 4) и нормализованы относительно пика при 2895 см -1 , если не указано иное. Спектры представлены как средние по всем спектрам, собранным от анализируемого объекта. Справочная таблица, используемая для присвоения пиков для этих спектров, показана в дополнительных таблицах S1, S2. Оценка отношения S / G-лигнин основывалась на соотношении интенсивностей пиков 1334/1273 см –1 (Lupoi and Smith, 2012).Оценка кристалличности целлюлозы была основана на соотношении интенсивностей пиков 380/1096 см -1 (Agarwal et al., 2010).
Экстракция РНК и синтез кДНК
На третий день гидропонного культивирования и в течение следующих 5 дней из тканей корня отбирали образцы растений, растущих как при обработке Si-, так и Si +, для оценки экспрессии генов. Перед экстракцией РНК образцы (до 150 мг) хранили при –80 ° C. Тотальную РНК экстрагировали и обрабатывали ДНКазой I с использованием набора Spectrum Plant Total RNA (Sigma-Aldrich, США) в соответствии с инструкциями производителя, за исключением продолжительности обработки ДНКазой I, которая была увеличена до 60 минут.Концентрацию РНК и чистоту образца измеряли с помощью спектрофотометра NanoDrop TM 1000 (Thermo Fisher Scientific, Германия), а целостность РНК проверяли электрофорезом в агарозном (1%) геле. Синтез первой цепи кДНК проводили с использованием системы обратной транскрипции ImProm-II (Promega, США) с использованием праймеров Oligo (dT) 15 в соответствии с инструкциями производителя. Для каждого образца проводили контроль без RT, чтобы определить, были ли какие-либо следы геномной ДНК.Образцы, содержащие только кДНК (разведенную в 10 раз), использовали для анализа количественной ПЦР.
Конструкции плазмид для гетерологической экспрессии в ооцитах Xenopus
кДНК, полученную из риса и финиковой пальмы, использовали для амплификации открытых рамок считывания (ORF) OsLsi1 и PdNIP2-1 . ORF, амплифицированные с использованием полимеразы Phusion Taq (New England Biolabs, Whitby, ON, Canada), сначала клонировали в плазмидном векторе pUC18 и секвенировали для подтверждения точности ORF.Для гетерологичной экспрессии в ооцитах Xenopus laevis ORF были дополнительно клонированы с использованием сайтов рестрикции Eco RI / Xba I в векторе Pol1 (PdNIP2-1EcoR1F: CCGAATTCATGGCTTCCTTATTCCGAGAC, 9bdNIPGAGis Вектор экспрессии ооцитов , полученный из pGEM и содержащий промотор Т7, нетранслируемые области глобина Xenopus и поли (A) тракт (Caron et al., 2000). Обе плазмидные конструкции OsLsi1-Pol1 и PdNIP2-1-Pol1 трансформировали в штамм Escherichia coli TOP10 и хранили при -80 ° C.Правильность конструкций проверяли секвенированием (T7P: TAATACGACTCACTATAGG, Xeno3UTR: GACTCCATTCGGGTGTTCTTG) перед трансляцией in vitro на .
Анализ транспорта
Si с использованием гетерологической экспрессии в
ооцитах Xenopus
Плазмиды
, содержащие ORF OsLsi1 или PdNIP2-1 , выделяли из свежей бактериальной культуры с использованием набора QIAprep Spin Miniprep (Qiagen). Пять микрограммов каждой плазмиды линеаризовали с использованием Nhe I (Roche).Расщепленные продукты очищали на колонке с использованием набора для очистки ПЦР (Qiagen), и 1 мкг плазмидной ДНК in vitro транскрибировали с использованием набора mMessage mMachine T7 Ultra (Ambion). Комплементарные РНК (кРНК) очищали с использованием метода осаждения хлоридом лития, как описано производителем, и суспендировали в сверхчистой воде.
Анализы ооцитов выполняли, как описано Deshmukh et al. (2013) с небольшими изменениями. Ооциты на стадии 5 или 6 инъецировали 25 нл 1 нг / нл кРНК или равным объемом H 2 O в качестве отрицательного контроля.Затем ооциты инкубировали в течение 1 дня при 18 ° C в среде Барта (MBS) [88 мМ NaCl, 1 мМ KCl, 2,4 мМ NaHCO 3 , 0,82 мМ MgSO 4 , 0,33 мМ Ca (NO 3 ) . 2 ⋅4H 2 0, 0,41 мМ CaCl 2 , 15 мМ HEPES, pH 7,6] с добавлением по 100 мкМ пенициллина и стрептомицина. Затем 10 наборов по 10 ооцитов для каждого условия подвергали воздействию раствора МБС, содержащего 1,7 мМ Si, в течение 30 или 60 минут. После воздействия ооциты промывали в растворе, содержащем 0.32 М сахарозы и 5,0 мМ HEPES (pH 7,4). Количественное определение Si проводили на атомном спектрометре Zeeman AA240Z (Varian, Пало-Альто, Калифорния, США), оборудованном распылителем с графитовой трубкой GTA120 Zeeman. Данные спектрометра анализировали с использованием JMP 9.0.2 (SAS Institute Inc.). Для этого анализа использовали три повтора.
Дизайн праймеров и RT-qPCR
В базе данных NCBI два транскрипта PdNIP2 (последовательности мРНК) со следующими номерами доступа XM_008804384.2 для PdNIP2-1 и XM_008785804.2 для PdNIP2-2 были доступны для финиковой пальмы. Праймеры для эталонного гена actin (XM_008778129.2) и генов NIP2 (дополнительная таблица S3) были сконструированы с использованием инструмента Primer3plus. Для определения температуры отжига праймеров была проведена градиентная ПЦР. После этого продукты ПЦР были проверены электрофорезом в агарозном (2%) геле и секвенированы методом Сенгера для проверки специфичности продукта на кафедре молекулярной биологии факультета естественных наук Университета Коменского в Братиславе.Перед анализом кПЦР оценивали стабильность референсного гена и эффективность амплификации гена (Livak and Schmittgen, 2001; Pfaffl et al., 2004). Контрольный ген, PdNIP2-1 и PdNIP2-2 гены были амплифицированы с помощью Maxima SYBR Green / ROX qPCR Master Mix (Thermo Fisher Scientific, Германия) в 96-луночных планшетах с использованием Light Cycler II 480 (Roche, Швейцария). ). Анализ кривой плавления продуктов амплификации включали в конце каждого цикла реакции qPCR.Основная цель анализа кривой плавления заключалась в проверке специфичности продукта ПЦР; то есть для подтверждения того, что образовывалась только специфическая амплификация и не образовывались неспецифические продукты ПЦР или димеры праймеров. Относительное изменение экспрессии генов оценивали по методу Pfaffl, включая эффективность амплификации выбранных генов (Pfaffl, 2001).
Биоинформатика и статистика
аминокислотных последовательностей было выровнено с использованием алгоритма MAFFT с сотней загрузочных повторов на GUIDANCE2Server (Sela et al., 2015). Уровень достоверности результирующего базового многопоследовательного выравнивания (MSA) оценивался путем сравнения деревьев начальной загрузки в качестве направляющих деревьев с алгоритмом выравнивания. Ненадежно выровненные столбцы были удалены из MSA при пороговом значении 0,93. Чтобы проанализировать влияние маскировки на выводы дерева, все филогенетические анализы проводились также на немаскированном MSA.
Филогенетических деревьев были построены с использованием как байесовского метода, так и метода максимального правдоподобия. Байесовский вывод был выполнен с использованием компьютерной программы MrBayes ver.3.2.6 (Ronquist et al., 2012) на портале CIPRES Portal ver. 3.1, с использованием модели замены аминокислот WAG, четырех независимых цепей, одного миллиона поколений и частоты выборки 100. Первые 25% отобранных деревьев были признаны выгорающими и отброшены. Был вычислен 50% консенсус по правилам большинства остальных деревьев и оценены апостериорные вероятности его схемы ветвления. Анализ максимального правдоподобия проводился с помощью компьютерной программы PhyML ver. 3.0 на биоинформатической платформе юга Франции (Guindon et al., 2010), с реорганизацией дерева SPR и 1000 непараметрических реплик начальной загрузки. Лучшая модель аминокислотной замены для анализа максимального правдоподобия была выбрана автоматически с использованием информационного критерия Акаике, реализованного в PhyML. Байесовские деревья и деревья максимального правдоподобия были вычислены как некорневые и имели корень a posteriori в FigTree ver. 1.2.3 (Эндрю Рамбаут) методом средней точки.
Трехмерная структура белков была построена с использованием сервера Phyre 2 (Kelley et al., 2015). Профилирование трансмембранных доменов выполняли с помощью инструмента TMHMM, а функциональную аннотацию NIP2-1-подобных белков выполняли с использованием базы данных консервативных доменов. Аминокислоты выравнивали в CLC Sequence Viewer (версия 7.7.1) для визуализации мотивов NPA и фильтров селективности ar / R в белках PdNIP2.
Для статистической оценки использовалось программное обеспечение Statgraphics Centurion (версия 15.2.05) и Microsoft Excel 365. Различия между средними значениями групп оценивали с помощью ANOVA (дисперсионный анализ), и LSD (наименьшее значимое различие) служило апостериорным тестом .Данные количественной ПЦР оценивали с помощью теста Стьюдента t (Microsoft Excel). Статистическая значимость оценивалась на уровне вероятности 0,05.
Результаты
Накопление кремния
Кремний накапливается во всех исследованных органах финиковой пальмы (рис. 1). Концентрация Si в тканях растений варьировалась в зависимости от стадии развития растений и метода выращивания. Наибольшая концентрация Si была обнаружена в листовых пластинах растений, выращиваемых в почве или перлите (рис. 1).Средняя концентрация Si в листовых пластинах 10-летних пальм достигала ок. 13 г кг -1 сухого веса (1,3% сухого веса). Вершины побегов, черешки листьев и придаточные корни 10-летних растений имели значительно более низкие концентрации Si, чем листовые пластинки (рис. 1). Концентрация Si в листовых пластинах однолетних растений, выращенных на перлите, была значительно меньше, чем в листовых пластинах 10-летних растений, выращенных в почве, тогда как концентрация Si в корнях однолетних растений, выращенных в перлит был значительно больше, чем у 10-летних растений, выращенных в почве (рис. 1).Концентрация Si в первичных корнях растений, выращенных на гидропонике, существенно не отличалась от концентрации Si в корнях растений, выращиваемых в перлите или почве.
Рис. 1. Концентрация кремния в вегетативных органах Phoenix dactylifera , выращенных на гидропонике, на перлите или в почве. Растения, выращенные на перлите, были однолетними по сравнению с хорошо развитыми 10-летними растениями, выращенными в почве. Разные буквы указывают на существенные различия между обработками при 0.05 уровень. Значения представляют собой средние значения ( n = 4) ± стандартное отклонение.
Анатомия вегетативных органов и отложения Si
Структурная организация финиковой пальмы с акцентом на осаждение Si представлена на рисунках 2, 3 и дополнительном рисунке S1. Отложения кремния присутствуют в виде агрегатов кремнезема, называемых фитолитами, в специализированных небольших ячейках, называемых стегматами. Стегматы в корнях прикрепляются исключительно к склерифицированным пучкам волокон коры.Эти пучки редко встречаются в первичных семенных корнях (Рисунок 2A), но могут быть многочисленными в боковых корнях (Рисунки 2B, C) и придаточных корнях (Рисунки 2D – J). В самых тонких латералях (диаметр ≤1 мм) развиваются только отдельные пучки, образованные 2–4 волокнами (рис. 2С). В более толстых латералях (≥1 мм) один круг пучков волокон образован ~ 10 волокнами (рис. 2В). В самых толстых придаточных корнях количество пучков волокон может превышать 100, и они разбросаны по всей средней кортикальной области (рисунки 2D, F).
Рисунок 2. Анатомия отдельных типов корней у P. dactylifera с перевязками волокон и стегматами — специализированными Si-аккумулирующими клетками. (A) Семенной корень. (B, C) Боковые корни. (D – J) Придаточные корни в поперечном (D – H) и продольных сечениях (I, J) . Залитые в парафин срезы, окрашенные альциановым синим / сафранином (A, B, D, E, H – J) или основным фуксином (F) , неокрашенные — автофлуоресценция (C) , и ручные срезы, окрашенные флуороловым желтым в УФ-свете (G) . (A) Семенной корень двухмесячного проростка, покрытый ризодермой (эпидермисом) (e) и составной гиподермой. В средней части коры обычно развивается обширная аэренхима (аэр). Сосудистый цилиндр полиарха (vc) с 11 чередующимися полюсами ксилемы и флоэмы, несколько сосудов поздней метаксилемы смещены центростремительно, а в центре расположена склерифицированная сердцевина. На этой стадии разработки нет волоконных лент. (B, C) Боковые корешки структурно напоминают семенной корень, за исключением волоконных полос (белые стрелки), регулярно разбросанных по коре.Клетки стегмат, прилегающие к волокнам, не видны при таком увеличении. Ризодерма (e) и составная гиподерма (hyp) образованы несколькими слоями клеток с различной толщиной клеточной стенки. Обширная аэренхима (аэр) занимает среднюю часть коры. Эндодерма (en) с толстыми U-образными внутренними тангенциальными стенками. Широкие сосуды поздней метаксилемы (lx) смещены центростремительно от полюсов ксилемы, образованных сосудами ранней метаксилемы (ex). (D – J) Придаточные корни взрослых растений характеризуются множеством волоконных полос (белые стрелки), разбросанных в средней части коры.Пропорционально возрасту / толщине придаточных корней количество волоконных лент составляет от десятков (F, G) до сотен (D, E, H) . Составная гиподерма (гиподерма) образована несколькими слоями экзодермы с пробуренными клеточными стенками (G, H) . Наружная кора расположена внутри гиподермы и состоит из нескольких слоев склеренхимы. Многие клетки периферических тканей содержат дубильные вещества (tc). Сосудистый цилиндр полиарха с несколькими десятками чередующихся полюсов ксилемы (ex) и флоэмы (ph) окружен толстостенной энтодермой (en).Дополнительный круг сосудов поздней метаксилемы (lx) присутствует центростремительно от полюсов ксилемы. У толстых корней сердцевина (p) может образовывать центральную полость. (E) Стегматы с кремнеземными фитолитами (красные наконечники стрелок) прикреплены к поверхности волоконных лент и хорошо видны на продольных срезах корней (I, J) .
Рисунок 3. Структура верхушки стебля (A) , молодой лист (B) , листовая пластинка (C – G) , черешок листа (H, I) и влагалище листа (J –L) .Стегматы в листьях связаны как с перевязками волокон, так и с сосудистой склеренхимой. (A) Стереомикроскопическое изображение верхушки побега, показывающее апикальную меристему побега (sam), зачатки листьев (lp), сосудистые пучки (vb) и полосы волокон (белые наконечники стрелок). (B) Неокрашенный парадермальный срез молодого листа проростка финиковой пальмы, показывающий эпидермальные клетки, стому (st) и субэпидермальные стегматы (красные наконечники стрелок), прикрепленные к поверхности волоконной ленты. (C – G) Листовка для взрослых от 10-летнего ребенка.Неокрашенные срезы (C, E) показывают эпидермальный и гиподермальный слои на поверхности листа, мезофилл с сосудистыми пучками (vb) и полосы волокон (белые стрелки), расположенные как адаксиально, так и абаксиально. В центральной части листочка средняя вена отсутствует (E) , а расширяющаяся ткань крупных клеток паренхимы присутствует адаксиально (exp). В противоположно-абаксиальной части развиты две большие волокнистые полосы. Стегматы, прилегающие к волокнистым связкам и оболочкам склеренхимы сосудистых пучков, можно увидеть при большом увеличении (D) и более четко на продольных срезах (F, G) .Образцы, окрашенные альциановым синим / сафранином (D, F, G) . (H, I) черешок листа и (J – L) влагалища листьев взрослого 10-летнего растения на неокрашенных поперечных срезах показаны либо в белом свете (H, J, L), , либо при УФ-облучении (Я). (J, K) Окрашивание флороглюцином-HCl, визуализирующее лигнификацию клеточной стенки. Черешок и влагалище листа покрыты однослойным эпидермисом и одревесневшей гиподермой (I, J) . Мезофилл состоит из хлоренхимы (H, I) и паренхиматозной основной ткани.Периферически присутствующие волокна (белые стрелки) и большие оболочки склеренхимы сосудистых пучков сопровождаются стегматами, как видно при большом увеличении (F, G, K, L) . Клетки измельченной ткани обычно содержат некоторое количество крахмальных зерен (sg).
Здесь мы изучили относительно молодые растения финиковой пальмы и сосредоточили внимание на наличии склерерирующих влагалищ сосудистых пучков и следов листьев, расположенных вблизи верхушки побега (рис. 3А). Эти оболочки уже сопровождаются стегматами, накапливающими Si.
Анатомия простых листьев молодых растений подобна листочкам сложных листьев взрослых растений (Рисунки 3B – E). Стегматы с фитолитами присутствуют в листьях в двух анатомически разных местах. Одно место — вокруг изолированных пучков волокон склеренхимы, расположенных непосредственно субэпидермально или глубоко в мезофилле, покрытых аксиально расположенными рядами стегмат (Рисунки 3F, G). Второе место — вокруг оболочки волокон склеренхимы, окружающих вены, с коллатеральным расположением сосудистых тканей.Стегматы, расположенные на черешках и листовых влагалищах, имеют тот же тип и распространение, что и на листьях и листочках (3 H – L).
SEM / EDX и Рамановский анализ фитолитов Si
Было проведено подробное исследование различных тканей финиковой пальмы для выявления картины распределения Si с использованием SEM в сочетании с рентгеновским анализом распределения элементов (EDX). В корнях клетки стегмат, содержащие агрегаты Si, располагались на внешней поверхности пучков склеренхимы (рис. 4A, B), организованных в ряды клеток со средним расстоянием между отдельными фитолитами около 10–12 мкм и средним размером Si фитолиты размером от 6 до 8 мкм (Рисунки 4C, D).Кремний также присутствует в верхушке побега, в основном в виде отдельных фитолитов Si, связанных со склеренхимой сосудистого пучка. В листьях рентгеноструктурный анализ показал, что Si локализуется в тканях листа на двух участках: в составе склеренхимы вокруг сосудистых пучков и в составе отдельных пучков склеренхимы в мезофилле листа. Кремний не был обнаружен ни в эпидермисе, ни в связи с кутикулой (Рисунки 4E, F). В чехлах листьев наблюдалась очень плотная сетка агрегатов Si.Размер фитолитов Si варьировал от 5 до 10 мкм, и они были связаны с поверхностными слоями клеток пучков склеренхимы (рисунки 4G, H).
Рис. 4. Изображения, полученные с помощью сканирующей электронной микроскопии, различных тканей P. dactylifera с соответствующими картами, показывающими распределение Si (фиолетовый цвет). (A, B) Поперечный разрез придаточного корня, показывающий деталь волоконной полосы (белая стрелка) с соседними клетками стегмат, содержащими фитолиты Si (красные наконечники стрелок).Множественные фитолиты не видны в (A) , хотя обнаруживаются с помощью EDX (B) . (C, D) Продольный разрез волоконной ленты (белая стрелка) в придаточном корне. Клеточные стенки нескольких клеток стегмат разрушены, обнажая фитолиты Si (красные наконечники стрелок). (E, F) Поперечный разрез листа, показывающий присутствие фитолитов Si в клетках стегамат, связанных с сосудистыми пучками (vb) и полосами волокон (белые стрелки). Деталь на стегме (красная стрелка), связанная со склеренхимой сосудистого пучка (scl). (G, H) Вид поверхности волоконной ленты (белая стрелка) с плотной сеткой смежных стегмат. Клеточные стенки множественных стегмат разрушаются, обнажая фитолиты Si (красные наконечники стрелок).
В целом стегматы были почти полностью заполнены фитолитами Si (Рисунки 5A – C). Рентгеновский анализ элементного состава поверхности фитолитов выявил два основных элемента, Si и кислород (рис. 5D). Присутствие углерода было связано с углеродным покрытием поверхности образцов перед анализом.Других элементов в фитолитах не обнаружено.
Рис. 5. EDX и Рамановский анализ фитолитов Si. (A) Сканирующая электронная микрофотография, показывающая три соседних стегматы с разрушенными клеточными стенками, обнажая фитолиты Si. (B) Деталь обнаженного фитолита, используемого в анализе EDX. (C) Микроскопическое изображение в темном поле изолированных фитолитов Si, используемых в рамановском анализе. (D) Типичный спектр EDX-анализа фитолита Si, демонстрирующий преобладание Si и O как его основных химических компонентов. (E) Сравнение спектров комбинационного рассеяния, полученных для изолированных фитолитов кремнезема [показано на панели (C) ], гидратированного силикагеля и опала.
Сравнивались типичные спектры комбинационного рассеяния изолированных фитолитов кремнезема и эталонные спектры гидратированного силикагеля и опала (рис. 5E). Во всех трех спектрах преобладала широкая полоса в области 400–490 см –1 , относящаяся к колебанию связи Si – O – Si, что подчеркивает аморфную природу кремнезема. В отличие от спектров от опала, спектры как от фитолитов, так и от силикагеля показали хорошо разрешенный пик около 482 см -1 .Широкая и асимметричная полоса около 800 см -1 , видимая во всех трех спектрах, была отнесена к симметричным валентным колебаниям Si – O – Si, возникающим из-за неоднородностей в геометрии субъединиц SiO 2 . Колебания Si – O немостикового кислорода в области 950–1000 см –1 отражают обилие групп Si – OH (985 см –1 ) и присутствие химических примесей. В то время как спектр опала показал относительно низкое содержание групп Si – OH, что свидетельствует о его компактной внутренней структуре, как фитолиты, так и силикагель демонстрируют относительно высокое содержание групп Si – OH, что указывает на большую площадь поверхности.Полоса, относящаяся к асимметричным валентным колебаниям Si – O – Si, находится между 1050 и 1200 см -1 . Здесь спектры фитолита показывают пик около 1053 см -1 , указывая на то, что могут присутствовать некоторые другие элементы или загрязнители.
Рамановский анализ состава клеточной стенки
Рамановская микроскопия
была использована для исследования состава клеточной стенки тканей корня и листа (дополнительный рисунок S2). В корнях относительно тонкие стенки гиподермальных клеток демонстрировали сигналы, указывающие на суберизацию и интенсивную лигнификацию, со сбалансированным соотношением S / G-лигнина, относительно высоким содержанием H-лигнина и феруловой / п-кумаровой кислотами.Внешний кортикальный слой демонстрирует состав клеточной стенки, аналогичный составу кортикальных волокон, характеризующийся высокой кристалличностью целлюлозы, относительно слабой лигнификацией клеточной стенки, но интенсивной лигнификацией в сложных средних ламеллах. Тонкостенные клеточные нити, разделяющие лакуны аэренхимы в средней коре головного мозга, показали высокое содержание как ароматических, так и алифатических сложных эфиров. Клеточные стенки внутренней коры демонстрируют низкое содержание фенольных соединений (1600–1660 см, –1 ), но на их сложное эфирное строение указывает широкая полоса между 1660 и 1750 см –1 (C = C и C = O растяжение).Эти клетки, вероятно, представляли собой раннюю стадию развития тонкостенных клеток средней коры. Энтодерма имеет толстую U-образную клеточную стенку с относительно высоким содержанием фенольных соединений (включая H-лигнин) по сравнению с тонкостенными клетками средней коры, а также со стенками волокон. Кроме того, множественные сигналы, связанные с липидными веществами, указывали на отложения суберина и относительно большое количество феруловой / пара-кумаровой кислоты.
Клеточные стенки сердцевинной склеренхимы имели качественно такой же состав, как и внешняя кора, но с несколько большей степенью лигнификации стенок.Ранние стенки метаксилемы были сильно одревесневшими с высоким соотношением S / G-лигнин. Спектры стенок поздних метаксилем имели очень похожий профиль, но с меньшим одревесневением стенок. Клеточные стенки флоэмы демонстрировали профиль, связанный с простыми первичными клеточными стенками, показывая относительно высокий сигнал пектина (817 см -1 ), очень низкий сигнал от фенольных соединений, низкую кристалличность целлюлозы и относительно высокое содержание гемицеллюлоз (область 470). –515 см –1 , 1462 см –1 ).
Филогенетическое размещение переносчиков Si из финиковой пальмы
Два предполагаемых транспортера Si, PdNIP2-1 (XP 008802606.1) и PdNIP2-1 (XP_008784026.1), на 87% имеют идентичность, основанную на выравнивании BLAST, и оба демонстрируют характерные особенности, необходимые для транспорта Si (рис. 6A). Трехмерная модель обоих белков показала структуру, подобную песочным часам (Фигуры 6B, C). Инструмент TMHMM для предсказания трансмембранных доменов показал шесть трансмембранных спиралей для обоих белков, идентичных известным переносчикам Si других видов растений (Рисунки 6D, E).С помощью этого инструмента оба белка были функционально классифицированы как мембранные каналы, которые являются членами суперсемейства MIP.
Рисунок 6. Выравнивание аминокислотных последовательностей переносчиков притока кремния (NIP2) у различных видов растений с выделенными мотивами NPA (красный цвет) и фильтром селективности G-S-G-R Ar / R (зеленый цвет) (A) . Предсказание трехмерной структуры белков PdNIP2-1 (B) и PdNIP2-2 (C) . Прогнозирование трансмембранных доменов белков PdNIP2-1 (D) и PdNIP2-2 (E) .
Филогенетический анализ показал, что переносчики PdNIP2-1 и PdNIP2-2 из финиковой пальмы принадлежат к четко определенной группе переносчиков притока Si, ранее идентифицированных у различных видов растений (рис. 7). Последовательности транспортеров из Arecaceae были сгруппированы вместе с сильной статистической поддержкой в байесовских деревьях и деревьях максимального правдоподобия. В обоих филогенетических анализах последовательности из семейства Poaceae были классифицированы в сестринском положении с последовательностями из Arecaceae, подтверждая общее филогенетическое происхождение переносчиков Si в однодольном кластере.Переносчики NIP2 из двудольных растений сформировали отдельную, статистически полностью поддерживаемую группу (Рисунок 7).
Рисунок 7. Филогения переносчиков притока кремния (NIP2) однодольных и двудольных растений. Апостериорные вероятности для байесовского вывода и значения бутстрапа для максимального правдоподобия были отображены на дереве консенсуса правила 50% -ного большинства. Масштабная линейка показывает две замены на десять сотен аминокислотных положений.
Кремниевая проницаемость PdNIP2-1
Для подтверждения работоспособности PdNIP2, X.laevis , экспрессирующие PdNIP2-1 , анализировали на их способность накапливать Si (фиг. 8A). Ооциты, экспрессирующие PdNIP2-1 или рис OsLsi1 , накапливали значительно больше Si, чем ооциты, инъецированные с водой, и такое же количество после 60-минутной инкубации, подтверждая функцию PdNIP2-1 в качестве переносчика Si, как было предсказано из . in silico (фиг. 8А).
Рис. 8. (A) Активность переноса кремния PdNIP2-1 из финиковой пальмы, оцениваемая в двух разных временных точках в анализах ооцитов Xenopus .Ооциты, инъецированные OsLsi1 из риса или воды, использовали в качестве положительного и отрицательного контролей соответственно. Значения представляют собой средние значения ± стандартное отклонение. Разные буквы указывают на значительные различия в один и тот же момент времени. Относительный уровень транскрипта генов PdNIP2-1 (B) и PdNIP2-2 (C) в корнях гидропонно выращенных проростков финиковой пальмы при обработке Si– (оранжевая линия) и обработке Si + (синий линия) с третьего по седьмой день выращивания.Экспрессия гена для контроля была установлена как 1,0. Статистически значимые различия между контрольными и обработанными растениями были проанализированы с помощью теста Стьюдента t и обозначены как * P <0,05. Значения представляют собой средние значения ± стандартное отклонение. Средние значения основаны на трех технических и трех биологических повторностях.
Экспрессия транспортеров PdNIP2 Si в корнях растений финиковой пальмы
Экспрессия генов PdNIP2 в корнях растений финиковой пальмы была постоянной.Относительное количество транскриптов PdNIP2-1 в корнях показало лишь незначительные суточные колебания (фиг. 8B), варьируя от 0,62–1,29 до 0,54–1,12 для мРНК при обработке Si- и Si +, соответственно. Второй транскрипт PdNIP2-2 показал общее увеличение экспрессии с увеличением продолжительности культивирования при обработке как Si-, так и Si + (фигура 8C). Однако кратность изменения этого транскрипта находилась в пределах от 1,0 до 2,35 при обработке Si- и от 1,0 до 1,92 при обработке Si +. Поскольку эта вариация обоих транскриптов довольно низкая, мы также использовали инструмент BestKeeper для определения стабильности экспрессии транскриптов в условиях Si- и Si + на основе коэффициента корреляции всех возможных пар возможных эталонных генов (Дополнительная таблица S4).Оба транскрипта показали низкое (<1) стандартное отклонение значений порогового цикла (SD C T ) и низкое SD (<2) кратного изменения экспрессии гена (x-кратное) с сильной корреляцией для всех стенограммы (дополнительная таблица S4).
Обсуждение
О роли Si в финиковой пальме известно мало, и данные ограничены (Fathi, 2014). Настоящее исследование может стимулировать исследования этого важного элемента как в экономическом (FAOSTAT, 2019), так и в медицинском (Zhang et al., 2017) важных видов. Это исследование предоставляет убедительные доказательства наличия и функциональности переносчиков притока Si в финиковой пальме и подчеркивает уникальную картину отложения Si в клетках стегмат. Стегматы, содержащие фитолиты Si, присутствуют во всех органах финиковой пальмы, прикреплены к поверхности пучков склеренхимы в корнях, листьях и стебле и к поверхности оболочек склеренхимы сосудистых пучков в стеблях и листьях (рис. 2–4).
Морфология фитолитов
Фитолиты Phoenix dactylifera классифицируются как сферические, с внешним видом от бородавчатых до эхинатных / колючих (рис.5) (Prychid et al., 2003; Томлинсон и др., 2011). Такая морфология признана типичной для видов пальм и обеспечивает надежный таксономический идентификатор (Piperno, 2006; Tomlinson et al., 2011). Шляпообразные / конические фитолиты — единственный другой морфотип, встречающийся в пальмах, и их можно найти, например, у Caryota, Sclerosperma и Reinhardtia (Tomlinson et al., 2011). Напротив, фитолиты трав, по-видимому, демонстрируют гораздо большую морфологическую изменчивость, что позволяет идентифицировать несколько морфотипов только в пределах эпидермиса листа (Kumar et al., 2017).
Зрелые стегматы обладают толстыми внутренними тангенциальными и радиальными клеточными стенками и тонкими первичными внешними тангенциальными стенками (рис. 2, 3). В большинстве случаев каждая стегма содержит единственный фитолит, занимающий почти весь объем клетки. Размер стегмат колеблется от 10 до 12 мкм, а размер фитолитов — от 6 до 8 мкм.
Структура фитолита
Рамановская микроскопия
подтвердила аморфную природу кремнеземного каркаса (широкая полоса в области 400–490 см –1 ), что является хорошо известным признаком кремнеземных фитолитов в целом (Currie and Perry, 2007).Хорошо разрешенный пик около 482 см -1 и относительно сильный сигнал около 985 см -1 дополнительно указали на большую площадь поверхности кремнезема и предположили, что фитолиты имеют микропористую структуру (Iqbal and Vepřek, 1982; Gailliez -Degremont et al., 1997). Это согласуется с исследованием Lins et al. (2002), выявив пористую структуру фитолитов пальмы Syagrus coronata . Большое количество поверхностных групп -ОН может способствовать адсорбции новых частиц кремнезема через водородные связи (Coradin and Lopez, 2003) и способствовать росту фитолита.Согласно Lins et al. (2002) фитолиты S. coronata состояли из гранул разного размера и морфологии. Эта особенность отражается в спектрах комбинационного рассеяния в виде широкой полосы около 1200 см –1 , что указывает на то, что в фитолитах финиковой пальмы присутствует несколько степеней полимеризации силикатных единиц (McMillan and Remmele, 1986). Это могло произойти из-за загрязнений, разрушающих кремнеземный каркас во время полимеризации (McMillan, 1984; Marsich et al., 2009).
Ассоциация фитолитов с клеточными стенками
Фитолиты финиковой пальмы, по-видимому, не содержат какой-либо органической основы (рис. 5), о чем также сообщалось для пальмы S. coronata (Lins et al., 2002). В отличие от пальм, фитолиты трав обычно связаны с клеточными стенками, в частности, в одревесневших тканях (Guerriero et al., 2016; Kumar et al., 2017). Рамановские сигналы от органических материалов, на которых они строятся, могут быть обнаружены даже при использовании жестких процедур для выделения фитолитов (Gallagher et al., 2015), что обычно указывает на присутствие фенольных соединений и гемицеллюлоз (Guerriero et al., 2016; Soukup et al., 2017). Недавние исследования показывают, что для начала отложения кремнезема может потребоваться лигнификация (Zhang et al., 2013; Soukup et al., 2017). Об ассоциации фитолитов с одревесневшими клеточными стенками также сообщалось у двудольных растений, несмотря на то, что они имеют низкие концентрации Si в тканях (Scurfield et al., 1974; Hodson et al., 2005). Предполагается, что в растениях может происходить компромисс между накоплением кремнезема и лигнина (Schoelynck et al., 2010; Ямамото и др., 2012; Klotzbücher et al., 2018). Такое явление часто считают полезным, поскольку стоимость окварцевания составляет всего 3,7% от стоимости одревеснения (Raven, 1983). Однако, хотя жесткость, обеспечиваемая этими двумя компонентами, может быть сопоставимой, они не полностью взаимозаменяемы из-за гораздо более низкой плотности лигнина и его водоотталкивающих свойств (Raven, 1983; Soukup et al., 2017). Однако, в отличие от трав, фитолиты Si в пальмах, вероятно, образуются внутриклеточно в вакуоли и, по-видимому, не имеют органического каркаса.Schmitt et al. (1995) выполнили детальное ТЕМ-исследование онтогенеза стегмат у ротанговых пальм Calamus axillaris . Они пришли к выводу, что «кремнеземное тело» растет внутри вакуоли. Рост «кремнеземного тела», вероятно, контролируется за счет накопления активного Si, постепенно перенасыщающего вакуоль, и за счет дополнительной модуляции ее физико-химического окружения.
Анатомические наблюдения финиковой пальмы показывают, что стегматы, которые почти полностью заполнены фитолитами Si, очень многочисленны рядом с одревесневшими тканями, в основном на внешней поверхности пучков (волокон) склеренхимы в корнях, стеблях и побегах финиковой пальмы (рис. 2, 3). ).Поэтому мы также выполнили анализ спектров комбинационного рассеяния клеточных стенок в одревесневших тканях. Несмотря на то, что спектры комбинационного рассеяния от клеточных стенок волокон указывают на относительно слабую лигнификацию, они показали хорошую чувствительность к реакции Визнера (флороглюцин-HCl). Это может быть связано с относительно высоким содержанием синапил / конифериловых альдегидов, которые являются ключевыми реагентами клеточной стенки в этой реакции. Кроме того, высокое содержание фенольных альдегидов в полимере лигнина указывает на раннюю стадию лигнификации (Pomar et al., 2002). В более старых тканях в спектрах появлялись дополнительные сигналы H-лигнина, и соотношение S / G-лигнин снижалось, предполагая, что на более поздних стадиях развития клеточной стенки откладывались преимущественно G- и H-лигнин. Относительно слабое лигнификация клеточной стенки, высокая кристалличность целлюлозы и сильная лигнификация сложных средних ламелей указывают на студенистый характер этих волокон (Mellerowicz, Gorshkova, 2012). По существу, эти волокна могут обеспечивать регулируемую механическую поддержку, которая постепенно стабилизируется отложением лигнина по мере созревания ткани и достижения органом своего оптимального положения в окружающей среде.Эта анатомическая черта могла заменить вторичный рост, позволяя ладоням достичь стабильного вертикального положения туловища с гораздо меньшими метаболическими затратами, вложенными в жесткие механические ткани.
Роль кремнеземных фитолитов
Фитолиты кремнезема традиционно воспринимаются как структуры, поддерживающие механические свойства тканей растений (Currie, Perry, 2007; Yamanaka et al., 2009). Абразивная природа кремнезема также отпугивает пасущихся животных и насекомых-фитофагов (Massey and Hartley, 2009).Более того, фитолиты листьев могут способствовать прохождению света к мезофиллу и повышать эффективность фотосинтеза (Sato et al., 2016). Несмотря на эти преимущества, требования, определяющие эволюцию образования фитолитов кремнезема, все еще остаются неясными (Strömberg et al., 2016). Противоположная эволюционная точка зрения рассматривает кремниевую кислоту как потенциально токсичное вещество, а контролируемое силицирование — как механизм его детоксикации (Exley, 2015). В концентрациях, превышающих 2 мМ, кремниевая кислота склонна к полимеризации и может привести к образованию отложений кремнезема на поверхности мембран или ферментов и ухудшить их функциональность.С другой стороны, он обеспечивает защиту от грибков и насекомых и может стабилизировать мембрану от вредных воздействий (Coskun et al., 2018). До сих пор роль фитолитов кремнезема в пальмах экспериментально не оценивалась. Помимо возможных профилактических функций, внутриклеточное образование фитолитов Si может указывать на их роль в использовании избыточного Si, накопленного растением. Это может иметь решающее значение для долговечности тканей ладони и / или медленного прогрессирования лигнификации волокон. Например, в рисовой соломе было зафиксировано на 20–30% меньше лигнина из-за компромисса кремнезема и лигнина (Klotzbücher et al., 2018), а в старых листьях бамбука эпидермальное окварцевание распространяется на хлоренхиму и снижает эффективность фотосинтеза листьев (Motomura et al., 2008). Любопытно, что отрицательная корреляция между долголетием листьев и содержанием кремния была обнаружена у различных групп растений (Cooke and Leishmann, 2011).
Молекулярные аспекты транспорта Si
Транспортер Lsi1, который обеспечивает поступление Si к корням, был впервые обнаружен у растений риса (Ma et al., 2006). С тех пор список переносчиков кремния растений был расширен за счет включения переносчиков кремния многих других видов (Yamaji et al., 2008; Чиба и др., 2009; Митани и др., 2009 г., Митани-Уэно и др., 2011 г .; Montpetit et al., 2012; Vivancos et al., 2016; Ouellette et al., 2017). Транспортеры NIP2, особенно хорошо охарактеризованный NIP2-1 (Lsi1), играют роль в поглощении Si из почвы в корневые клетки и, следовательно, непосредственно участвуют в накоплении Si цветущими растениями. Кроме того, более эффективный аквапорин NP3,1 был идентифицирован в хвоще ( Equisetum arvense ), который содержит поры STAR в отличие от поры GSGR в однодольных, включая финиковую пальму (Grégoire et al., 2012). Однако в нашем исследовании мы принимаем во внимание только белки NIP2. По этой причине мы сосредоточили молекулярное исследование на свойствах PdNIP2 в корнях финиковой пальмы. В нашем исследовании транскриптомные данные, биоинформатические анализы и анализы ооцитов показали наличие и функциональность транспортеров PdNIP2 у P. dactylifera , аналогичных известным для других растений. Эти белки имеют общие отличительные черты, такие как поры ar / R и последовательность из 108 аминокислот между петлями NPA, необходимыми для транспорта Si через плазматическую мембрану (Deshmukh et al., 2015). Проницаемость PdNIP2-1 для Si сравнима с проницаемостью Lsi1 риса с использованием биоанализа ооцитов Xenopus , гетерологичной системы экспрессии, которая оказалась надежной для тестирования функциональности переносчиков Si. Используя Si в качестве субстрата, а не германий, наши данные также устранили любые возможные осложнения, связанные с суррогатным субстратом (Garneau et al., 2018). Филогенетический анализ сгруппировал последовательности транспортеров NIP2 из Arecaceae отдельно, но в сестринском положении по отношению к Poaceae.
На экспрессию генов PdNIP2 в корнях гидропонно выращиваемых растений финиковой пальмы относительно не влияло присутствие или отсутствие Si в среде для выращивания (фиг. 8). Виды растений, по-видимому, различаются по влиянию снабжения ризосферы Si на экспрессию генов NIP2, и их экспрессия может быть повышена, подавлена или не затронута добавлением Si в среду для культивирования (подробный обзор см. В Ma and Yamaji, 2015 ). Анализ с использованием инструмента BestKeeper показывает, что и PdNIP2-1 , и PdNIP2-2 обладают транскрипционными атрибутами эталонного гена, хотя PdNIP2-1 является лучшим эталонным геном, чем PdNIP2-2 .Возможно, что конститутивно большое накопление Si в растениях P. dactylifera может быть следствием относительно высокой стабильной экспрессии генов PdNIP2 , которые, скорее всего, ответственны за поглощение Si. Напротив, растения, которые не накапливают Si, особенно двудольные, имеют конститутивно низкую экспрессию генов NIP2, которая даже подавляется присутствием Si в культуральной среде, как, например, NIP2-1 (XM_013836541) в Brassica napus (Haddad и другие., 2019), что может объяснить меньшее накопление Si двудольными, чем однодольными. Мы обнаружили гомологичные последовательности транскриптов OsLsi2 и OsLsi6 в последовательности P. dactylifera . Поэтому предполагается, что поглощение Si из почвы в эпидермальные клетки корня опосредуется PdNIP2. Затем кремний транспортируется из кортикальных клеток в ксилему с помощью Lsi2-подобного белка, а также перемещается и распределяется в листьях с помощью Lsi6-подобных белков.
Заключение
Таким образом, Si накапливается во всех тканях P.dactylifera , где агрегаты Si присутствуют в стегматах. В отличие от злаков, у которых Si обычно связан с эпидермальными тканями, стегматы ладоней обильны на внешней поверхности пучков (волокон) склеренхимы, присутствующих в корнях, верхушке побега, черешках и пластинках листьев с диаметром агрегатов Si / фитолиты размером от 6 до 8 мкм. Поверхность фитолитов состоит только из кремния и кислорода без каких-либо органических компонентов. Анализ клеточных стенок волокон предполагает, что они обладают гелеобразным характером и вместе с фитолитами кремния могут обеспечивать сильную механическую поддержку растения.Опять же, в отличие от злаков, у которых фитолиты Si в основном связаны с клеточными стенками, фитолиты P. dactylifera , по-видимому, образуются внутриклеточно. Поскольку P. dactylifera представляет собой аккумулятор Si, гомологичные последовательности генов Lsi , типичных для трав, которые также являются аккумуляторами Si, были предсказаны на основе его генома и оказались функциональными. Филогенетический анализ этих переносчиков в пределах Arecaceae показал, что они занимали сестринскую кладу по отношению к таковым у Poaceae, и оба отличались от клады двудольных.Вероятно, что по мере расхождения пальм и трав в каждой кладе установились разные закономерности накопления Si.
Доступность данных
Все наборы данных, созданные для этого исследования, включены в рукопись и / или дополнительные файлы.
Авторские взносы
BB, KŠ и SV провели исследование экспрессии генов, биоинформатический анализ и другие эксперименты по молекулярной биологии. ПВ провел филогенетический анализ. RB, RD и HS провели анализы ооцитов и функциональную аннотацию гена NIP2-1 .MS провела анализ клеточной стенки. AL, MV, MW и IL провели сканирующую электронную микроскопию в сочетании с рентгеновским микроанализом. AL провел анатомическое исследование, разработал исследование вместе с PW и HE-S и руководил проектом. Все авторы обсудили результаты и прокомментировали рукопись.
Финансирование
Эта работа явилась результатом реализации проекта: Университет Коменского в Братиславском научном парке при поддержке Оперативной программы исследований и разработок, финансируемой ЕФРР (грант No.ITMS 26240220086). Эта работа также была поддержана Словацким грантовым агентством VEGA грантом VEGA 1/0605/17; при частичной поддержке Словацкого агентства исследований и разработок по контракту № APVV-17-0164; и Программа стипендий выдающихся ученых Университета короля Сауда (PW и HE-S). Работа в Институте Джеймса Хаттона была поддержана Управлением исследований и анализа сельского хозяйства и окружающей среды Шотландии.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Техническая помощь госпожи Зузаны Шулавиковой была признательна. HS, RD и RB хотели бы поблагодарить Совет по естественным наукам и инженерным исследованиям Канады (NSERC), Fonds de recherche du Québec — Nature et technologies (FRQNT) и Канадскую программу научных кафедр.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fpls.2019.00988 / полный # дополнительный материал
Сноски
- http://www.effemm2.de/spectragryph/
- http://www.qiagen.com/
- http://www.roche.com
- http://www.invitrogen.com/site/us/en/home/brands/ambion.html
- http://primer3plus.com/web_3.0.0/primer3web_input.htm
- http://guidance.tau.ac.il/ver2/
- http://www.phylo.org
- http: // www.atgc-montpellier.fr/phyml/
- http://tree.bio.ed.ac.uk/software/figtree/
- http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index
- www.cbs.dtu.dk/services/TMHMM/
- www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml
Список литературы
Агарвал, У. П., Райнер, Р. С., и Ральф, С. А. (2010). Определение кристалличности целлюлозы I методом Фурье-рамановской спектроскопии: одномерные и многомерные методы. Целлюлоза F 17, 721–733. DOI: 10.1021 / jf304465k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bokor, B., Ondoš, S., Vaculík, M., Bokorová, S., Weidinger, M., Lichtscheidl, I., et al. (2017). Экспрессия генов поглощения, накопления Si и корреляции Si с другими элементами в иономе ядра кукурузы. Фронт. Plant Sci. 8: 1063. DOI: 10.3389 / fpls.2017.01063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карон, Л., Руссо, Ф., Ганьон, Э, и Изенринг, П. (2000). Клонирование и функциональная характеристика белка, взаимодействующего с катион-Cl-котранспортером. J. Biol. Chem. 275, 32027–32036. DOI: 10.1074 / jbc.m000108200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кейси, В. Х., Кинрейд, С. Д., Найт, К. Т. Г., Рейнс, Д. В., и Эпштейн, Э. (2003). Водные силикатные комплексы пшеницы, Triticum aestivum L. Среда растительных клеток. 27, 51–54.DOI: 10.1046 / j.0016-8025.2003.01124.x
CrossRef Полный текст | Google Scholar
Кук, Дж., И Лейшманн, М. Р. (2011). Концентрация кремния и долговечность листьев: играет ли кремний в спектре сухой массы листьев? Функц. Ecol. 25, 1181–1188. DOI: 10.1111 / j.1365-2435.2011.01880.x
CrossRef Полный текст | Google Scholar
Coskun, D., Deshmukh, R., Sonah, H., Menzies, J. G., Reynolds, O., Ma, J. F., et al. (2018). Споры о роли кремния в биологии растений. New Phytol. 221, 67–85. DOI: 10.1111 / Nph.15343
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Датнофф, Л. Э., Снайдер, Г. Х., и Корндорфер, Г. Х. (2001). Кремний в сельском хозяйстве. Исследования в области растениеводства , 8. Амстердам: Elsevier.
Google Scholar
Дешмук Р. К., Сона Х. и Беланже Р. Р. (2016). Аквапорины растений: полногеномная идентификация, транскриптомика, протеомика и передовые аналитические инструменты. Фронт. Plant Sci. 7: 1896. DOI: 10.3389 / fpls.2016.01896
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дешмук, Р. К., Виванкос, Дж., Герен, В., Сона, Х., Лаббе, К., Белзил, Ф. и др. (2013). Идентификация и функциональная характеристика переносчиков кремния в сое с использованием сравнительной геномики основных внутренних белков арабидопсиса и риса. Завод Мол. Биол. 83, 303–315. DOI: 10.1007 / s11103-013-0087-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дешмук, Р.К., Виванкос, Дж., Рамакришнан, Г., Герен, В., Карпентье, Г., Сона, Х. и др. (2015). Точное расстояние между доменами NPA аквапоринов важно для проницаемости кремния у растений. Завод J. 83, 489–500. DOI: 10.1111 / tpj.12904
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эпштейн, Э. (1999). Кремний. Annu. Rev. Plant Physiol. Завод Мол. Биол. 50, 641–664.
Google Scholar
Фатхи, Л. (2014). Структурные и механические свойства древесины кокосовых, масличных и финиковых пальм. Гамбург: Центр древесных наук, Гамбургский университет.
Google Scholar
Гайлье-Дегремонт, Э., Бакке, М., Лоринс, Дж., И Морселле, М. (1997). Полиамины, адсорбированные на силикагеле: анализ методом рамановского микрозонда. J. Appl. Polym. Sci. 65, 871–882. DOI: 10.1002 / (sici) 1097-4628 (19970801) 65: 5 <871 :: aid-app4> 3.0.co; 2-k
CrossRef Полный текст | Google Scholar
Галлахер, К.Л., Альфонсо-Гарсия, А., Санчес, Дж., Потма, Э. О., и Сантос, Г. М. (2015). Условия роста растений изменяют углерод фитолита. Фронт. Plant Sci. 6: 753. DOI: 10.3389 / fpls.2015.00753
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарно А. П., Марку А. А., Френет-Коттон Р., Беланже Р. и Изенринг П. (2018). Новый золотой стандарт для характеристики транспорта Si через клеточные мембраны у животных. J. Cell. Physiol. 233, 6369–6376.DOI: 10.1002 / jcp.26476
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грегуар К., Ремус-Борель В., Виванкос Дж., Лаббе К., Белзиль Ф. и Беланже Р. Р. (2012). Открытие мультигенного семейства аквапориновых переносчиков кремния у примитивного растения Equisetum arvense . Завод J. 72, 320–330. DOI: 10.1111 / j.1365-313X.2012.05082.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Guindon, S., Dufayard, J.Ф., Лефорт В., Анисимова М., Хордейк В., Гаскуэль О. (2010). Новые алгоритмы и методы для оценки филогении максимального правдоподобия: оценка производительности PhyML 3.0. Syst. Биол. 59, 307–321. DOI: 10.1093 / sysbio / syq010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Haddad, C., Trouverie, J., Arkoun, M., Yvin, J.-C., Caïus, J., Brunaud, V., et al. (2019). Поставка кремния влияет на транскриптом корня Brassica napus L. Planta 249, 1645–1651. DOI: 10.1007 / s00425-019-03120-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоугланд Д. Р. и Арнон Д. И. (1950). Водный метод выращивания растений без почвы. Circ. Univ. Калифорния, Сельское хозяйство. Exp. Станция 347: 32.
Google Scholar
Икбал, З., и Вепржек, С. (1982). Рамановское рассеяние на гидрированном микрокристаллическом и аморфном кремнии. J. Phys. C: Физика твердого тела. 15, 377–392.
Google Scholar
Йохансен, Д. Дж. (1940). Завод микротехники. Нью-Йорк, Нью-Йорк: McGraw-Hill Book Company, Inc.
Google Scholar
Келли, Л. А., Мезулис, С., Йейтс, К. М., Васс, М. Н., и Штернберг, М. Дж. (2015). Веб-портал Phyre2 для моделирования, прогнозирования и анализа белков. Нац. Protoc. 10, 845–858. DOI: 10.1038 / nprot.2015.053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клотцбюхер, Т., Klotzbücher, A., Kaiser, K., Vetterlein, D., Jahn, R., and Mikutta, R. (2018). Переменное накопление кремния в растениях влияет на круговорот углерода в земных тканях, контролируя синтез лигнина. Глоб. Сменить Биол. 24, e183 – e189. DOI: 10.1111 / gcb.13845
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лян Ю., Николич М., Беланже Р., Гонг Х. и Сонг А. (2015). Кремний в сельском хозяйстве: от теории к практике. Берлин: Спрингер.
Google Scholar
Линс, У., Баррос, К. Ф., да Кунья, М., и Коста Мигуэнс, Ф. (2002). Структура, морфология и состав кремниевых биокомпозитов пальмы Syagrus coronata (Mart.) Becc . Protoplasma 220, 89–96. DOI: 10.1007 / s00709-002-0036-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ливак К. Дж. И Шмитген Т. Д. (2001). Анализ данных относительной экспрессии генов с использованием количественной ПЦР в реальном времени и метода 2-ΔΔCT. Методы 25, 402–408.DOI: 10.1006 / meth.2001.1262
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лупой, Дж. С., и Смит, Э. А. (2012). Характеристика состава лигнина древесных и травянистых биомасс с помощью дисперсионной многоканальной рамановской спектроскопии с длиной волны 1064 нм. заявл. Spectrosc. 66, 903–910. DOI: 10.1366 / 12-06621
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Люкс, А., Люксова, М., Абэ, Дж., Танимото, Э., Хаттори, Т., и Инанага, С.(2003). Динамика отложения кремния в энтодерме корня сорго. New Phytol. 158, 437–441. DOI: 10.1046 / j.1469-8137.2003.00764.x
CrossRef Полный текст | Google Scholar
Lux, A., Vaculík, M., and Kováč, J. (2015). «Улучшенные методы очистки и окрашивания образцов растений», в Plant Microtechniques and Protocols , ред. Е. К. Т. Йунг, К. Стасола, М. Дж. Самнер и Б. К. Хуанг (Берлин: Springer), 167–178. DOI: 10.1007 / 978-3-319-19944-3_10
CrossRef Полный текст | Google Scholar
Ма, Дж.Ф., Тама, К., Ямаджи, Н., Митани, Н., Кониси, С., Кацухара, М., и др. (2006). Транспортер кремния в рисе. Природа 440, 688–691.
Google Scholar
Марсич, Л., Моймас, Л., Серго, В., и Шмид, К. (2009). Рамановское спектроскопическое исследование биоактивных стекол на основе диоксида кремния: роль соотношения щелочь / щелочноземельный металл в соотношении немостикового кислорода / мостикового кислорода (NBO / BO). Спектроскопия 23, 227–232. DOI: 10.1155 / 2009/418698
CrossRef Полный текст | Google Scholar
Мэсси, Ф.П., Хартли С. Э. (2009). Физическая защита изнуряет вас: прогрессирующее и необратимое воздействие кремнезема на насекомых-травоядных. J. Anim. Ecol. 78, 281–291. DOI: 10.1111 / j.1365-2656.2008.01472.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макмиллан П. (1984). Рамановское исследование стекол в системе CaO-MgO-SiO 2 . амер. Минеральная. 69, 645–659.
Google Scholar
Макмиллан, П. Ф.и Реммеле Р. Л. младший (1986). Гидроксильные центры в стекле SiO 2 : примечания к инфракрасным и рамановским спектрам. г. Минеральная. 71, 772–778.
Google Scholar
Меллерович Э. Дж., Горшкова Т. А. (2012). Генерация напряжения растяжения в желатиновых волокнах: обзор и возможный механизм, основанный на структуре и составе клеточной стенки. J. Exp. Бот. 63, 551–565. DOI: 10.1093 / jxb / err339
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Митани-Уэно, Н., Ямаджи, Н., и Ма, Дж. Ф. (2011). Транспортеры оттока кремния, выделенные из двух сортов тыквы, различающиеся по поглощению Si. Завод Сигнал. Behav. 6, 991–994. DOI: 10.4161 / psb.6.7.15462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Møller, J. D., and Rasmussen, H. (1984). Стегматы у Orchidales: распределение состояний характера и полярность. Бот. J. Linn. Soc. 89, 53–76. DOI: 10.1111 / j.1095-8339.1984.tb01000.x
CrossRef Полный текст | Google Scholar
Montpetit, J., Vivancos, J., Mitani-Ueno, N., Yamaji, N., Rémus-Borel, W., Belzile, F., et al. (2012). Клонирование, функциональная характеристика и гетерологичная экспрессия TaLsi1, гена переносчика кремния пшеницы. Завод Мол. Биол. 79, 35–46. DOI: 10.1007 / s11103-012-9892-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мотомура, Х., Хикосака, К., и Судзуки, М. (2008). Связь между фотосинтетической активностью и накоплением кремнезема с возрастом листа у Sasa veitchii (Poaceae, Bambusoideae ). Ann. Бот. 101, 463–468. DOI: 10.1093 / aob / mcm301
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ouellette, S., Goyette, M.-H., Labbé, C., Laur, J., Gaudreau, L., Gosselin, A., et al. (2017). Переносчики кремния и эффекты кремниевых добавок в клубнике в высоких туннельных и полевых условиях. Фронт. Plant Sci. 8: 949. DOI: 10.3389 / fpls.2017.00949
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пфаффл, М.В., Тихопад А., Пргомет К. и Невианс Т. П. (2004). Определение стабильных генов домашнего хозяйства, дифференциально регулируемых генов-мишеней и целостности выборки: инструмент на основе bestkeeper – excel с использованием парных корреляций. Biotechnol. Lett. 26, 509–515. DOI: 10.1023 / B: желчь.0000019559.84305.47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пиперно, Д. Р. (2006). Фитолиты: подробное руководство для археологов и палеоэкологов. Оксфорд: Altamira Press.
Google Scholar
Помар Ф., Мерино Ф. и Рос Барсело А. (2002). О-4-связанные кониферил и синапилальдегиды в лигнифицирующих клеточных стенках являются основными мишенями реакции Виснера (флороглюцин-HCl). Protoplasma 220, 17–28. DOI: 10.1007 / s00709-002-0030-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Поммеррениг Б., Дин Т. А. и Бинерт Г. П. (2015). Металлоидопорины: важность внутренних белков, подобных нодулину 26, в транспорте металлоидов. Plant Sci. 238, 212–227. DOI: 10.1016 / j.plantsci.2015.06.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Прихид, К. Дж., Рудалл, П. Дж., И Грегори, М. (2003). Систематика и биология кремнеземных тел однодольных. Бот. Ред. 69, 377–440. DOI: 10.1663 / 0006-8101 (2004) 069 [0377: SABOSB] 2.0.CO; 2
CrossRef Полный текст | Google Scholar
Рэйвен, Дж. А. (1983). Транспорт и функция кремния в растениях. Biol.Ред. 58, 179–207. DOI: 10.1111 / j.1469-185x.1983.tb00385.x
CrossRef Полный текст | Google Scholar
Родригес, Л. Л., Дауб, С. Х., Райс, Р. У. и Снайдер, Г. Х. (2003). Сравнение трех методов испытания почвы для оценки содержания кремния, доступного для растений. Commun. Почвоведение. Завод анальный. 34, 2059–2071. DOI: 10.1081 / css-120024048
CrossRef Полный текст | Google Scholar
Ронквист, Ф., Тесленко, М., ван дер Марк, П., Эйрес, Д. Л., Дарлинг, А., Höhna, S., et al. (2012). MrBayes 3.2: эффективный байесовский филогенетический вывод и выбор модели в большом модельном пространстве. Syst. Биол. 61, 539–542. DOI: 10.1093 / sysbio / sys029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сангстер А. Г. и Ходсон М. Дж. (1992). «Отложение кремнезема в подземных органах», в Phytolith Systematics: Emerging Issues , eds S. C. Mulholland и G. Rapp Jr. (Нью-Йорк, Нью-Йорк: Plenum Press), 239–251. DOI: 10.1007 / 978-1-4899-1155-1_12
CrossRef Полный текст | Google Scholar
Сато К., Ямаути А., Одзаки Н., Исигуре Т., Оаки Ю. и Имаи Х. (2016). Оптические свойства биокремнезема в растениях риса. RSC Adv. 6: 109168–109173. DOI: 10.1039 / c6ra24449a
CrossRef Полный текст | Google Scholar
Шмитт У., Вайнер Г. и Лизе У. (1995). — Тонкая структура стегмат Calamus axillaris во время созревания. IAWA J. 16, 61–68. DOI: 10.1163 / 22941932-
390
CrossRef Полный текст | Google Scholar
Шелинк, Дж., Бал, К., Бэкс, Х., Окрушко, Т., Мейре, П., и Струйф, Э. (2010). Поглощение кремния водными и водно-болотными макрофитами: стратегический выбор между кремнеземом, лигнином и целлюлозой? New Phytol. 186, 385–391. DOI: 10.1111 / j.1469-8137.2009.03176.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скарфилд, Г., Андерсон, К. А., Сегнит, Э.Р. (1974). Кремнезем в древесных стеблях. Aust. J. Bot. 22, 211–229.
Google Scholar
Села И., Ашкенази Х., Катох К. и Пупко Т. (2015). GUIDANCE2: точное обнаружение областей ненадежного выравнивания с учетом неопределенности нескольких параметров. Nucleic Acids Res. 43, W7 – W14. DOI: 10.1093 / nargkv318
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соукуп, М., Мартинка, М., Боснич, Д., Чапловичова, М., Эльбаум, Р., и Люкс, А. (2017). Формирование агрегатов кремнезема в энтодерме корня сорго предопределено архитектурой и развитием клеточной стенки. Ann. Бот. 120, 739–753. DOI: 10.1093 / aob / mcx060
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стрёмберг, К. А. Э., Ди Стилио, В. С., и Сонг, З. (2016). Функции фитолитов сосудистых растений: эволюционная перспектива. Функц. Ecol. 30, 1286–1297. DOI: 10.1111 / 1365-2435.12692
CrossRef Полный текст | Google Scholar
Томлинсон, П.Б., Хорн, Дж. У., и Фишер, Дж. Б. (2011). Анатомия пальм: Arecaceae — Palmae. Оксфорд: Издательство Оксфордского университета.
Google Scholar
Виванкос, Дж., Дешмук, Р., Грегуар, К., Ремус-Борель, В., Белзиль, Ф., и Беланже, Р. Р. (2016). Идентификация и характеристика переносчиков оттока кремния в хвоще ( Equisetum arvense ). J. Plant Physiol. 200, 82–89. DOI: 10.1016 / j.jplph.2016.06.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уоллес, И.С., Робертс Д. М. (2005). Различная транспортная селективность двух структурных подклассов нодулиноподобного внутреннего семейства белков акваглицеропориновых каналов растений. Биохимия 44, 16826–16834. DOI: 10.1021 / bi0511888
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямамото Т., Накамура А., Иваи Х., Исии Т., Ма, Дж. Ф., Йокояма Р. и др. (2012). Влияние дефицита кремния на синтез вторичной клеточной стенки в листьях риса. J. Plant Res. 125, 771–779. DOI: 10.1007 / s10265-012-0489-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яманака, С., Такеда, Х., Комацубара, С., Ито, Ф., Усами, Х., Тогава, Э. и др. (2009). Строение и физиологические функции кремнеземных тел в эпидермисе растений риса. заявл. Phys. Lett. 95: 123703. DOI: 10.1063 / 1.3232204
CrossRef Полный текст | Google Scholar
Чжан, К., Ван, Л., Чжан, В., и Чжан, Ф. (2013).Предшествуют ли лигнификация и силицификация клеточной стенки отложению кремния в клетках кремнезема эпидермиса листьев риса ( Oryza sativa L.)? Растительная почва 372, 137–149. DOI: 10.1007 / s11104-013-1723-z
CrossRef Полный текст | Google Scholar
Zhang, C.-R., Aldosari, S. A., Polana, S. P. V., Vidyasagarn, P. S. P. V., Shukla, P., Muraleedharan, G., et al. (2017). Польза для здоровья плодов фиников, произведенных в Саудовской Аравии, на основе тестов in vitro на антиоксидантные, противовоспалительные и ингибирующие пролиферацию опухолевых клеток человека. J. Saudi Soc. Agric. Sci. 16, 287–293. DOI: 10.1016 / j.jssas.2015.09.004
CrossRef Полный текст | Google Scholar
Мезопористые наночастицы диоксида кремния для доставки лекарств и генов
Abstract
Мезопористые наночастицы диоксида кремния (MSN) привлекают все больший интерес для потенциальных биомедицинских приложений. Благодаря специально подобранной мезопористой структуре, огромной площади поверхности и объему пор, селективной функциональности поверхности, а также контролю морфологии, MSN демонстрируют высокую нагрузочную способность для терапевтических агентов и свойства контролируемого высвобождения, если они модифицированы реагирующими на стимулы группами, полимерами или белками.В этой обзорной статье кратко излагается применение MSN в фармацевтике для улучшения биодоступности лекарств, снижения токсичности лекарств и доставки с возможностью нацеливания на клетки. В частности, подчеркивается впечатляющий прогресс в разработке эффективных систем доставки на основе MSN для плохо растворимых лекарств, противоопухолевых агентов и терапевтических генов.
Аббревиатуры
APTES
3-аминопропилтриэтоксисилан
APTMS
аминопропилтриметоксисилан
BCS
Система биофармацевтической классификации
Bio-TEM
биологическая трансмиссионная электронная микроскопия
CMC
СТАБИЛЬНАЯ КОНЦЕНТРАЦИЯ КРИТИЧЕСКИХ МИЦЕЛЛ
CTAB
Критическая концентрация мицелл
CTAB
Критическая концентрация мицелл
CTAB FDA
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов
LHRH
рилизинг-гормон лютеинизирующего гормона
MTT
3- [4,5-диметилтиазол-2-ил] -2,5-дифенилтетразолий бромид
MRP1
белок множественной лекарственной устойчивости 1
MSN-Dox- G2
Dox-загруженные и G2 PAMAM-модифицированные MSN
MSN
мезопористые наночастицы диоксида кремния
[email protected]
Полидофамин, модифицированный поли (этиленгликоль), функционализированный фолиевой кислотой
MSNs-HA
MSN, конъюгированные с гиалуроновой кислотой
MSN- RGD / TAT
MSN, модифицированные пептидом RGD / TAT
MSNs-TAT
MSN, модифицированные пептидом TAT
PDEAEMA 9 0004 поли (2- (диэтиламино) этилметакрилат)
PDMAEMA
поли (2- (диметиламино) этилметакрилат)
PEG400
полиэтиленгликоль 400
Q-MSN
инкапсулированный в кверцетин MSN
RGD
-аргинин-
активизирующий аргинин транскриптор
КЛЮЧЕВЫЕ СЛОВА
Мезопористые наночастицы кремнезема
Плохо растворимое лекарство
Лечение рака
Множественная лекарственная устойчивость
Доставка генов
Рекомендуемые статьи Цитирующие статьи (0)
© Китайская фармацевтическая ассоциация и Институт Материи Медика, 2018 г. медицинских наук.Производство и хостинг Elsevier B.V.
Рекомендуемые статьи
Ссылки на статьи
Кремний модулирует многослойную защиту арабидопсиса от мучнистой росы | Фитопатологические исследования
Bélanger RR, Benhamou N, Menzies JG. Цитологические доказательства активной роли кремния в устойчивости пшеницы к мучнистой росе ( Blumeria graminis f. Sp. tritici ). Фитопатология. 2003. 93: 402–12.
PubMed
Статья
PubMed Central
Google Scholar
Boursiac Y, Lee SM, Romanowsky S, Blank R, Sladek C, Chung WS и др.Нарушение вакуолярных кальций-АТФаз в Arabidopsis приводит к активации зависимого от салициловой кислоты пути запрограммированной гибели клеток. Plant Physiol. 2010; 154: 1158–71.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Бругьер Т., Эксли К. Отложение кремнезема, связанное с каллозой, у Arabidopsis. J Trace Elem Med Biol. 2017; 39: 86–90.
PubMed
Статья
CAS
PubMed Central
Google Scholar
Brunings AM, Datnoff LE, Ma JF, Mitani N, Nagamura Y, Rathinasabapathi B и др.Дифференциальная экспрессия генов риса в ответ на кремний и рисовый бластный гриб Magnaporthe oryzae . Ann Appl Biol. 2009; 155: 161–70.
CAS
Статья
Google Scholar
Карвер TLW, Роббинс М.П., Томас Б.Дж., Трот К., Рейстрик Н., Зейен Р.Дж. Депривация кремния усиливает локальные автофлуоресцентные ответы и активность фенилаланин-аммиак-лиазы у овса, пораженного Blumeria graminis . Physiol Mol Plant Pathol.1998. 52: 245–57.
CAS
Статья
Google Scholar
Цепь F, Коте-Болье C, Белзиль Ф, Мензис Дж. Г., Беланже Р. Р.. Комплексный транскриптомный анализ влияния кремния на растения пшеницы в условиях стресса и стресса от патогенов. Мол, взаимодействие растений и микробов. 2009; 22: 1323–30.
CAS
PubMed
Статья
Google Scholar
Chiba Y, Mitani N, Yamaji N, Ma JF.HvLsi1 является переносчиком притока кремния в ячмене. Плант Дж. 2009; 57: 810–8.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Coskun D, Deshmukh R, Sonah H, Menzies JG, Reynolds O, Ma JF, et al. Споры о роли кремния в биологии растений. Новый Фитол. 2019; 221: 67–85.
PubMed
Статья
Google Scholar
Эллингер Д., Науманн М., Фальтер С., Цвикович С., Джамроу Т., Маниссери С. и др.Повышенное раннее отложение каллозы приводит к полной устойчивости Arabidopsis к проникновению мучнистой росы. Plant Physiol. 2013; 161: 1433–44.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Эпштейн Э. Аномалия кремния в биологии растений. Proc Natl Acad Sci U S. A. 1994; 91: 11–7.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Фальк А., Фейс Б.Дж., Фрост Л.Н., Джонс Д.Дж., Дэниэлс М.Дж., Паркер Дж.Э. EDS1 , важный компонент R генной устойчивости к болезням Arabidopsis, имеет гомологию с эукариотическими липазами. Proc Natl Acad Sci U S. A. 1999; 96: 3292–7.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Fauteux F, Chain F, Belzile F, Menzies JG, Bélanger RR. Защитная роль кремния в патосистеме арабидопсиса и мучнистой росы. Proc Natl Acad Sci U S. A. 2006; 103: 17554–9.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Фейс Б.Дж., Мойсан Л.Дж., Ньюман М.А., Паркер Дж. Прямое взаимодействие между сигнальными белками устойчивости к болезни Arabidopsis, EDS1 и PAD4. EMBO J. 2001; 20: 5400–11.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Floková K, Tarkowská D, Miersch O, Strnad M, Wasternack C, Novák O.Целевое профилирование стресс-индуцированных фитогормонов на основе УВЭЖХ – МС / МС. Фитохимия. 2014; 105: 147–57.
PubMed
Статья
CAS
Google Scholar
Frantz JM, Locke JC, Datnoff L, Omer M, Widrig A, Sturtz D, et al. Обнаружение, распределение и количественное определение кремния в цветочных культурах с использованием трех различных аналитических методов. Коммунальные почвенные растения Анал. 2008; 39: 2734–51.
CAS
Статья
Google Scholar
Ghanmi D, McNally DJ, Benhamou N, Menzies JG, Bélanger RR.Мучнистая роса Arabidopsis thaliana : патосистема для изучения роли кремния во взаимодействиях между растениями и микробами. Physiol Mol Plant Pathol. 2004. 64: 189–99.
CAS
Статья
Google Scholar
Ghareeb H, Bozsó Z, Ott PG, Repenning C, Stahl F, Wydra K. Транскриптом индуцированной кремнием резистентности против Ralstonia solanacearum в томате, не аккумулирующем кремний, подразумевает эффект прайминга.Physiol Mol Plant Pathol. 2011; 75: 83–9.
CAS
Статья
Google Scholar
Guzman P, Ecker JR. Использование тройного ответа Arabidopsis для выявления мутантов, связанных с этиленом. Растительная клетка. 1990; 2: 513–23.
CAS
PubMed
PubMed Central
Google Scholar
Джираж Д., Тутл Т.Л., Ройбер Т.Л., Фрост Л.Н., Фейс Б.Дж., Паркер Дж.Э. и др. PAD4 Arabidopsis thaliana кодирует липазоподобный ген, который важен для передачи сигналов салициловой кислоты.Proc Natl Acad Sci U S. A. 1999; 96: 13583–8.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Kulich I, Vojtíková Z, Sabol P, Ortmannová J, Neděla V, Tihlaříková E, et al. Субъединица экзоцисты EXO70h5 играет специфическую роль в секреции каллозосинтазы и накоплении кремнезема. Plant Physiol. 2018; 176: 2040–51.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Lei J, Finlayson SA, Salzman RA, Shan L, Zhu-Salzman K.BOTRYTIS-INDUCED KINASE1 модулирует устойчивость Arabidopsis к зеленой персиковой тле через PHYTOALEXIN DEFICIENT4. Plant Physiol. 2014; 165: 1657–70.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Ливак К.Дж., Шмитген ТД. Анализ данных относительной экспрессии генов с использованием количественной ПЦР в реальном времени и метода 2 -ΔΔCT . Методы. 2001; 25: 402–8.
CAS
PubMed
Статья
Google Scholar
Луи Дж., Гоббато Э., Мондал Х.А., Фейс Б.Дж., Паркер Дж. Э., Шах Дж.Дискриминация активности Arabidopsis PAD4 в защите от зеленой персиковой тли и патогенов. Plant Physiol. 2012; 158: 1860–72.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Луи Дж., Леунг К., Пегадараджу В., Риз Дж, Шах Дж. PAD4 -зависимый антибиотик способствует придаваемой ssi2 гиперрезистентности зеленой персиковой тли. Мол, взаимодействие растений и микробов. 2010; 23: 618–27.
CAS
PubMed
Статья
Google Scholar
млн лет JF.Переносчики кремния у высших растений. В: Ян Т.П., Бинерт Г.П., редакторы. МИП и их роль в обмене металлоидами. Нью-Йорк: Спрингер; 2010. с. 99–109.
Google Scholar
Ма Дж. Ф., Тамай К., Ямаджи Н., Митани Н., Кониси С., Кацухара М. и др. Транспортер кремния в рисе. Природа. 2006; 440: 688.
CAS
PubMed
Статья
Google Scholar
Menzies J, Bowen P, Ehret D, Glass AD.Внекорневая подкормка силикатом калия снижает проявление мучнистой росы на огурцах, дынях и кабачках. J Am Soc Hortic Sci. 1992; 117: 902–5.
CAS
Статья
Google Scholar
Мейер Д., Пайонк С., Микали С., О’Коннелл Р., Шульце-Леферт П. Внеклеточный транспорт и интеграция секреторных белков растений в компартменты клеточной стенки, индуцированные патогенами. Плант Дж. 2009; 57: 986–99.
CAS
PubMed
Статья
Google Scholar
Mitani N, Yamaji N, Ago Y, Iwasaki K, Ma JF.Выделение и функциональная характеристика переносчика кремния притока у двух сортов тыквы, различающихся накоплением кремния. Плант Дж. 2011; 66: 231–40.
CAS
PubMed
Статья
Google Scholar
Мияке Ю., Такахаши Э. Влияние кремния на рост огурцов, выращиваемых в растворе. Почвоведение Растение Нутр. 1983; 29: 71–83.
CAS
Статья
Google Scholar
Montpetit J, Vivancos J, Mitani-Ueno N, Yamaji N, Rémus-Borel W., Belzile F, et al.Клонирование, функциональная характеристика и гетерологичная экспрессия TaLsi1 , гена-переносчика кремния пшеницы. Завод Мол Биол. 2012; 79: 35–46.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Nishimura MT, Stein M, Hou BH, Vogel JP, Edwards H, Somerville SC. Потеря каллозосинтазы приводит к устойчивости к болезням, зависящим от салициловой кислоты. Наука. 2003. 301: 969–72.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Пегадараджу В., Луис Дж., Сингх В., Риз Дж. К., Баутор Дж., Фейс Б. Дж. И др.Устойчивость к зеленой персиковой тле на основе флоэмы контролируется Arabidopsis PHYTOALEXIN DEFICIENT4 без его сигнального партнера ENHANCED DISEASE SUSCEPTIBILITY1 . Плант Дж. 2007; 52: 332–41.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Pieterse CMJ, Leon-Reyes A, Van der Ent S, Van Wees SC. Сетевое взаимодействие низкомолекулярных гормонов в иммунитете растений. Nat Chem Biol. 2009; 5: 308.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Рафи М.М., Эпштейн Э., Фальк Р.Х. Недостаток кремния вызывает физические нарушения у пшеницы ( Triticum aestivum L). J. Plant Physiol. 1997; 151: 497–501.
CAS
Статья
Google Scholar
Рашид М.Х., Хан А, Хоссейн М.Т., Чунг Ю.Р. Индукция системной устойчивости против тли эндофитной Bacillus velezensis YC7010 посредством экспрессии PHYTOALEXIN DEFICIENT4 в Arabidopsis.Фронтальный завод им. 2017; 8: 211.
PubMed
PubMed Central
Google Scholar
Reynolds OL, Keeping MG, Meyer JH. Кремний-усиленная устойчивость растений к травоядным насекомым: обзор. Ann Appl Biol. 2009; 155: 171–86.
CAS
Статья
Google Scholar
Shetty R, Fretté X, Jensen B, Shetty NP, Jensen JD, Jørgensen HJL, et al. Вызванные кремнием изменения противогрибковых фенольных кислот, флавоноидов и ключевых генов фенилпропаноидного пути при взаимодействии миниатюрных роз с биотрофным патогеном Podosphaera pannosa .Plant Physiol. 2011; 157: 2194–205.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Шетти Р., Дженсен Б., Шетти Н. П., Хансен М., Хансен К. В., Старки К. Р. и др. Кремний индуцировал устойчивость роз к мучнистой росе, вызываемой Podosphaera pannosa . Завод Патол. 2012; 61: 120–31.
CAS
Статья
Google Scholar
Такахаши Э., Ма Дж. Ф., Мияке Ю.Возможность кремния как необходимого элемента для высших растений. Комментарии Agric Food Chem. 1990; 2: 99–122.
CAS
Google Scholar
Thordal-Christensen H, Zhang Z, Wei Y, Collinge DB. Субклеточная локализация H 2 O 2 в растениях. H 2 O 2 накопление в сосочках и гиперчувствительный ответ при взаимодействии ячменя и мучнистой росы. Плант Дж. 1997; 11: 1187–94.
CAS
Статья
Google Scholar
Van Bockhaven J, De Vleesschauwer D, Höfte M.На пути к установлению устойчивости растений к болезням широкого спектра: кремний лидирует. J Exp Bot. 2012; 64: 1281–93.
PubMed
Статья
CAS
Google Scholar
Van Bockhaven J, Spíchal L, Novák O, Strnad M, Asano T, Kikuchi S, et al. Кремний индуцирует устойчивость к грибку с коричневыми пятнами Cochliobolus miyabeanus , предотвращая проникновение патогена в этиленовый путь риса. Новый Фитол. 2015; 206: 761–73.
PubMed
Статья
CAS
Google Scholar
Виванкос Дж., Лаббе С., Мензис Дж. Г., Беланже Р. Р.. Опосредованная кремнием устойчивость Arabidopsis к мучнистой росе включает механизмы, отличные от зависимого от салициловой кислоты (SA) пути защиты. Мол Растение Патол. 2015; 16: 572–82.
CAS
PubMed
Статья
Google Scholar
Wei Y, Zhang Z, Andersen CH, Schmelzer E, Gregersen PL, Collinge DB и др.Оксалатоксидазоподобный белок, специфичный для эпидермиса / сосочка, в защитной реакции ячменя, пораженного грибком мучнистой росы. Завод Мол Биол. 1998. 36: 101–12.
CAS
PubMed
Статья
Google Scholar
Вен И, Ван В., Фенг Дж., Ло М.К., Цуда К., Катагири Ф. и др. Идентификация и использование мучнистой росы осотника как плохо адаптированного патогена для анализа постинвазионных механизмов устойчивости арабидопсиса, не являющихся хозяевами.J Exp Bot. 2010; 62: 2117–29.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Визе Дж., Визе Х., Шварц Дж., Шуберт С. Осмотический стресс и кремний действуют аддитивно в повышении устойчивости ячменя к патогенам против мучнистой росы ячменя. J Plant Nutr Soil Sci. 2005; 168: 269–74.
CAS
Статья
Google Scholar
Сяо С., Браун С., Патрик Е., Брирли С., Тернер Дж.Повышенная транскрипция генов устойчивости к болезням Arabidopsis RPW8. 1 и RPW8. 2 через схему амплификации, зависимую от салициловой кислоты, требуется для гибели гиперчувствительных клеток. Растительная клетка. 2003; 15: 33–45.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Ян Л., Ли П, Ли Ф, Али С., Сан Х, Хоу М. Кремниевая поправка для растений риса способствует сокращению кормления насекомых, сосущих флоэму, за счет модуляции отложения каллозы.Ecol Evol. 2018; 8: 631–7.
PubMed
Статья
PubMed Central
Google Scholar
Ye M, Song Y, Long J, Wang R, Baerson SR, Pan Z, et al. Праймирование опосредованных жасмонатом защитных реакций против травоядных в рисе кремнием. Proc Natl Acad Sci U S. A. 2013; 110: 3631–9.
Артикул
Google Scholar
Йошида С. Химические аспекты роли кремния в физиологии рисовых растений.Bull Natl Inst Agric Sci Ser B. 1965; 15: 1–58.
Google Scholar
Zhan LP, Peng DL, Wang XL, Kong LA, Peng H, Liu SM и др. Прайминговое действие кремния, внесенного в корень, на повышение индуцированной устойчивости к узловатой нематоде Meloidogyne graminicola в рисе. BMC Plant Biol. 2018; 18:50.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Zhang Q, Berkey R, Blakeslee JJ, Lin J, Ma X, King H и др.Фосфолипазы Dα1 и Dδ арабидопсиса противоположно модулируют EDS1- и SA-независимую базальную устойчивость против адаптированной мучнистой росы. J Exp Bot. 2018; 69: 3675–88.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Важность кремния и механизмы образования биокремнезема в растениях
Кремний (Si) — один из наиболее распространенных макроэлементов, выполняющих важную функцию в оздоровлении растений в ответ на стрессы окружающей среды.Цель использования Si — вызвать устойчивость к различным стрессам, болезням и патогенам. Кроме того, Si может улучшить состояние почв, которые наряду с другими химическими элементами содержат токсичные уровни тяжелых металлов. Кремний сводит к минимуму токсичность Fe, Al и Mn, увеличивает доступность P и усиливает засуху наряду с солеустойчивостью растений за счет образования окремненных тканей у растений. Однако концентрация Si зависит от генотипа растений и организмов. Следовательно, применение Si может повлиять на физиологические механизмы и метаболическую активность растений.Пептиды, а также аминокислоты могут эффективно создавать поликремниевые соединения посредством взаимодействия с различными видами силикатов внутри раствора. Карбоновая кислота и спиртовые группы серина и аспарагина, как правило, не играют какой-либо существенной роли в образовании полисиликатов, но боковая цепь гидроксильной группы может участвовать в образовании водородной связи с Si (OH) 4 . Механизмы и тенденции абсорбции Si различны для разных видов растений. Кроме того, транспортировка Si требует энергетического механизма; таким образом, низкие температуры и метаболические репрессоры ингибируют транспорт Si.
1. Введение
Как правило, продовольственная безопасность и здоровье — это две важнейшие проблемы для жизни человека. В связи с ростом населения, особенно в развивающихся странах, и распространением инфекционных и неинфекционных заболеваний среди населения, наличие гибкой сельскохозяйственной системы как никогда необходимо. Сельскохозяйственные системы — это надежный способ увеличить количество пищи для людей за счет использования природных ресурсов. Для повышения качества и количества пищевых продуктов растениям следует использовать различные стратегии преодоления неблагоприятных воздействий на окружающую среду.Используя генные стратегии, растения могут повысить свою устойчивость к негативным воздействиям окружающей среды. Наряду с этим ученые приложили усилия для повышения устойчивости растений к болезнетворным микроорганизмам. Кремний (Si), как макроэлемент, играет жизненно важную роль в жизненных циклах растений. Этот элемент является восьмым по распространенности элементом в природе и вторым по распространенности элементом в почве после кислорода. Одна из основных функций Si — улучшение роста и урожайности растений, особенно в стрессовых условиях. Чтобы добиться устойчивости растений, Si способствует фотосинтезу растений, благоприятно подвергая листья воздействию света.С другой стороны, макроэлемент оказался в ответ на различные абиотические и биотические стрессы. То есть повышение устойчивости к болезням и патогенам, токсичности металлов, засолению и стрессу засухи являются одними из наиболее важных функций этого фактора. Действительно, защита растений от чрезвычайно высоких или низких температур, необходимых для конфигурации клубеньков, а также для положительного воздействия на минеральный состав и ферментативную активность растений, являются другими преимуществами макроэлемента [1].Рост растений зависит от нескольких элементов, существующих в почве. Эти элементы можно разделить на группы полезных, незаменимых и токсичных [2]. Токсичные элементы неконструктивно влияют на рост растений, в то время как важнейшие элементы играют решающую роль для всех растений в различных условиях роста. Полезные элементы жизненно важны для некоторых видов растений, растущих в определенных условиях роста. Благоприятное воздействие Si на различные виды растений хорошо задокументировано. Несмотря на вышеупомянутые преимущества этого фактора, некоторые ученые все еще верят в ненужную функцию Si в циклах растений.Напротив, отсутствие документальных доказательств заставило исследователей определить надлежащую роль этого элемента в растениях. Вторая группа считает, что Si — вездесущий и важный элемент растений и почвы. Кроме того, они заметили, что Si играет важную роль в повышении продуктивности и жизни сельскохозяйственных культур [3]. Например, результаты исследования функции Si в борьбе с мучнистой росой в огурцах показали, что этот макроэлемент способен продуцировать неактивные фитоалексины или гликозилированные [4], которые активируются при заражении обработанных Si растений грибами, что приводит к гибели клеток грибы [5].Сообщалось, что Si способен повышать стрессоустойчивость и уменьшать повреждение мембран у томатов ( Solanumly copersicum ) и шпината ( Spinacia oleracea ) [6]. С другой стороны, Si помогает пшенице ( Triticum spp.) Преодолевать окислительное повреждение горшков в условиях засухи и мучнистой росы [7, 8]. Кремний также приводит сорго ( Sorghum bicolor ) для повышения устойчивости к засухе [9], рис ( Oryza sativa ) для усиления бактериального ожога ( Rhizoctonia solani ) и устойчивости к бактериальным болезням [10–12], сахарный тростник ( Saccharum officinarum). ) для снижения восприимчивости к eldana saccharina ( Lepidoptera: Pyralidae ) [13], ячменю ( Hordeum vulgare L.) [14, 15] и огурца ( Cucumis sativus ) для повышения солеустойчивости [14–16] и кукурузы ( Zea mays subsp. mays ) для повышения устойчивости к кадмию, снижения токсичности алюминия и повышения эффективности с использованием воды [17–19]. Более того, основная важная роль Si в растениях заключается в воздействии абиотических и биотических стрессов. Макроэлемент способен подавлять эти стрессы в растениях, что приводит к повышению их продуктивности [20]. В поддержку этого удобрение рисовой почвы Si, которое началось в 1955 году в Японии, значительно увеличило производство риса [21].
Кроме того, согласно опубликованным результатам исследования, растения, обработанные Si, имеют прочную структуру [22]. Более того, эти растения по сравнению с контролем более устойчивы к биотическим и абиотическим стрессам, таким как токсичность патогенов и металлов, соответственно. Результаты исследования также убедительно подтвердили роль гена , богатого серином , в формировании биокремнезема у трансгенного Arabidopsis thaliana [23].
В общем, приведенное выше доказательство высвобождает необходимую функцию Si в циклах трусов [22].Большинство почв способны обеспечить растения достаточным количеством питательных веществ без каких-либо дополнительных удобрений. Однако на увеличение роста и продуктивности растений может повлиять искусственное изменение питательных веществ почвы посредством удобрений, поскольку растения могут получать необходимые питательные вещества из удобренной почвы. Добавление Si в качестве удобрения в почву может не обеспечивать одинаковую эффективность для всех растений и культур в разных географических районах и почвенных условиях. Следовательно, генетическая модификация растений с целью поглощения большего количества Si из почвы и накопления его в корнях и побегах дает более эффективные и устойчивые результаты.Катионный обмен, возникающий в результате перекачивания водорода (H + ) корневыми волосками растений, приводит к поглощению питательных веществ, поскольку ионы H + перемещают катионы (отрицательно заряженные частицы), которые прикреплены к частицам почвы, в корни растений. В этом обзоре мы проиллюстрируем несколько физиологических, биохимических и молекулярных факторов, которые влияют на механизмы поглощения Si и образования биокремнезема в растениях. Кроме того, этот обзор предоставляет полезную информацию относительно ранее открытого нового гена , богатого серином белка , который играет решающую роль в образовании биокремнезема у растений [24].
2. Важная роль кремния
2.1. Формы Si в почве
Каждый килограмм почвы обычно содержит от 50 до 400 граммов Si. Диоксид кремния (SiO 2 ) — обычная форма Si в почве. Вермикулит, смектит, каолин (богатые минералами в почвах), ортоклаз, полевые шпаты, плагиоклаз (силикаты в форме кристаллов), аморфный кремнезем и кварц являются основными компонентами кремния в большинстве структур почв [25]. Растворимость всех вышеперечисленных форм Si низкая и биогеохимически неподвижна.Основными растворимыми формами Si в почве являются поли- и монокремниевая кислоты [26]; однако монокремниевая кислота в основном находится в слабо адсорбируемом состоянии [27] и имеет низкую способность к миграции внутри почвы [28]. Увеличивая концентрацию монокремниевой кислоты в почвенном растворе, растения могут напрямую поглощать фосфаты (P). Количество монокремниевой кислоты увеличивается из-за химического сходства между фосфатными и силикатными анионами, вызывающими конкурентную реакцию в почве [29]. Нерастворимость монокремниевой кислоты несколько снижается из-за взаимодействия с тяжелыми металлами, железом, алюминием и марганцем [30].
Важнейшими компонентами почвы являются поликремниевая кислоты, которые обычно влияют на физические свойства почвы. Напротив, адсорбент на основе монокремниевой кислоты химически неподвижен и образует коллоидные частицы [31]. Таким образом, поликремниевые кислоты препятствуют формированию структуры почвы и ее водоудерживаемости [32]. В биохимических процессах, происходящих в почве, функция Si выделяется, потому что этот элемент обладает химическими свойствами, которые могут создавать молекулы с полезными биологическими функциями.Основным недостатком Si является неспособность этого элемента образовывать химические связи с различными типами атомов, которые необходимы для химической универсальности метаболизма. Эта неспособность вызвана размером и молекулярной массой атома Si, что приводит к ограничению взаимодействия с другими атомами и образованию монотонных молекул.
2.2. Кремний и растения
2.2.1. Изменчивость содержания Si у различных видов растений
Среди растений сахарный тростник ( Saccharum officinarum ), рис ( Oryza sativa ) и пшеница ( Triticum spp.) поглощают наибольшее количество Si: 300–700, 150–300 и 50–150 кг Si га –1 соответственно [33]. Как правило, поглощение Si злаковыми растениями намного выше, чем его поглощение другими видами растений. Например, рис является обычным собирателем Si, который поглощает Si в активном развитии [34], как и другие злаковые растения, включая пшеницу ( Triticum spp.) [35], ячмень ( Hordeum vulgare L.) [36] , райграс ( Lolium perenne ) [37], кукуруза ( Zea mays subsp. Mays ) [38], а также некоторые циперообразные растения. Большинство двудольных растений, таких как огурцы ( Cucumis sativus ), дыни, клубника и соя ( Glycine max L. Merr), инертно поглощают Si [39]. Тем не менее, некоторые растения, особенно двудольные, такие как томаты ( Solanum lycopersicum ), бобы и другие растения, не способны поглощать Si из почвы [39–42].
2.2.2. Формы поглощения Si растениями
Монокремниевая кислота или ортокремниевая кислота (H 4 SiO 4 ) — это формы Si, которые поглощаются корнями растений [43, 44].Следовательно, Si накапливается в тканях эпидермиса, и создается слой целлюлозной мембраны — Si, когда присутствуют ионы Ca и пектина [45], что обеспечивает защиту растений [19, 46, 47]. Увеличение содержания Si в соке растений приводит к полимеризации Si [48], идентифицированной как гель Si, гидратированный молекулами воды [49]. Процесс гидратации моно- и поликремниевых кислот выглядит следующим образом (рисунок 1).
Недавно Нурул Майзайтул Азва ( личное сообщение ) сообщил, что мангровые растения могут поглощать большие количества Si из почвенного раствора (Рисунок 2).Аморфный кремнезем является конечной формой 90% абсорбированного и преобразованного Si в Si-целлюлозных структурах [50]. Нанометровый уровень биогенного кремнезема образуется в виде межклеточных структур [51]. Концентрация Si значительно различается в побегах и корнях растений, и это обширное изменение в различных тканях растений связано с различиями в механизмах поглощения и транспортировки Si [52, 53]. Поглощение питательных веществ растениями зависит от водного потенциала и растворимости элементов в почве.Путь поглощения питательных веществ — из почвенного раствора с более высокой концентрацией растворенных веществ в ткани растений с более низкой концентрацией растворенных веществ. Хотя Si в большом количестве содержится как в силикатной, так и в оксидазной формах в почве, растворимость Si в почвенном растворе является препятствием для поглощения растениями, поскольку монокремниевая кислота является единственной формой Si, которую растения могут поглощать.
2.3. Кремний и абиотические стрессы
Широко сообщалось, что Si способен подавлять как физический стресс, такой как засуха, высокая температура, УФ, нагрузка и замерзание, так и химический стресс, включая засоление, дисбаланс питательных веществ и токсичность металлов [54 , 55].
2.3.1. Напряжение кремния и солености
Напряжение солености, основной фактор ограничения текучести в сухих и полусухих областях, может быть снижено путем увеличения Si [56]. Кремний косвенно снижает окислительное повреждение тканей огурца при солевом стрессе за счет активности пероксидазы гваякола, аскорбатпероксидазы, супероксиддисмутазы, дегидроаскорбатредуктазы и глутатионредуктазы [16]. Окислительное повреждение листьев томата уменьшается с увеличением Si [5], что приводит к увеличению активности ферментов каталазы и супероксиддисмутазы, увеличению содержания белка в листьях томатов, снижению фермента аскорбатпероксидазы, снижению концентрации малонового диальдегида и снижению H 2 O 2 уровней [57].Облегчающий эффект Si при стрессе засоления был продемонстрирован на пшенице ( Triticum spp.) [55, 58], рисе ( Oryza sativa ) [55, 59], ячмене ( Hordeum vulgare L.) [14 , 40, 55, 60], мескит [61], томат ( Solanum lycopersicum ) [57, 62], огурец ( Cucumis sativus ) [63] и кукуруза ( Zea mays subsp. mays ) [64, 65]. Корни и побеги обработанных Si растений риса в условиях солевого стресса заметно улучшились по сравнению с контрольными растениями [66].Сообщалось, что солеустойчивость мескита и пшеницы может быть значительно увеличена после подачи питательного раствора Si в небольших количествах [58]. Наряду с этим устойчивость риса, выращенного на гидропонике, к засолению может быть повышена путем добавления Si в питательный раствор [67]. Добавление Si уменьшало концентрацию Na в побегах ячменя [68] и риса [69].
Положительные физиологические эффекты кремния на улучшение растений связаны с эндогенными стрессовыми реакциями растений в различных условиях окружающей среды [70].Кремний способен увеличивать содержание растворимого белка в листьях растений, что помогает растениям преодолевать солевой стресс, заменяя потерянное содержание растворимого белка в условиях солевого стресса. Кремний также может увеличивать активность антиоксидантных ферментов супероксиддисмутазы (SOD), гваяколпероксидазы (GPX), аскорбатпероксидазы (APX), дегидроаскорбатредуктазы (DHAR) и глутатионредуктазы (GR) у растений в условиях солевого стресса [14, 16, 68]. Вызванное окислительное повреждение солью может быть уменьшено за счет снижения уровня процента утечки электролита (ELP), перекисного окисления липидов (LPO) и содержания H 2 O 2 [16].Этот механизм ферментативной защиты помогает растениям преодолевать повреждения, вызванные солевым стрессом [71–73]. Значительное усиление активности антиоксидантных ферментов в листьях огурцов, подвергшихся солевому стрессу, за счет дополнительной обработки Si свидетельствует о том, что Si может участвовать в физиологических или метаболических циклах растений [16]. Питание Si значительно увеличивало активность каталазы во всех частях растений и активность пероксидазы в клеточной стенке побегов растений [57, 74].
С физической точки зрения Si способен уменьшать проницаемость плазматической мембраны в клетках листьев растений, что приводит к снижению уровней перекисного окисления липидов.Внесение кремния в растения в стрессовых условиях приводит к снижению содержания лигнина в клеточных стенках побегов растений. Сообщалось, что применение Si в растениях канолы приводило к снижению содержания Si в частях побегов растений за счет форматирования комплексов Si-полифенола или замещения Si и лигнина [75]. Эти физические изменения в клеточной стенке растений могут способствовать процессу разрыхления и способствовать росту клеток, что приводит к росту растений в условиях солевого стресса [74, 76]. Si защищает растения от стресса окружающей среды, такого как засуха и жара, обеспечивая более стабильные липиды, участвующие в их клеточных мембранах [16, 77].
Считалось, что Si-индуцированная мотивация со стороны плазматической мембраны корней может увеличивать абсорбцию и транспортировку K и уменьшать захват и транспортировку Na от корней к побегам ячменя при засолении [60]. С другой стороны, концентрация ионов Na + в тканях канолы в условиях солевого стресса снижается при применении Si. Накопление Si в энтодерме и клеточных стенках растений может снижать накопление Na в корнях и побегах с за счет уменьшения на при апопластическом транспорте [74, 78–81].Растения в условиях солевого стресса сталкиваются с низким водным потенциалом извне из-за высокого содержания Na + и Cl — в почве и отложения солей в других клеточных областях растений [82]. Эти ионы перемещаются в надземные части растений посредством транспирации, и когда Na + и Cl — достигают порога токсичности, различные ткани растений могут быть серьезно повреждены. Гидрофильная природа Si может снизить уровень ядовитости ионов солевого раствора и снизить осмотический эффект солевого стресса на поглощение и хранение воды растениями.Кроме того, обработка Si в растениях приводит к увеличению клеток листьев за счет расширения клеточной стенки , что помогает растениям удерживать больше воды. Сообщается, что растения, обработанные Si, выращенные в условиях солевого стресса, имеют большее соотношение массы листьев и меньшую удельную площадь листьев, чем необработанные растения, которые имеют меньшую площадь поверхности листьев и потерю транспирации воды [58]. Показано, что при обработке засоленных растений Si количество воды в них увеличивалось до 40%. Более того, тургорный потенциал растений, обработанных как NaCl, так и Si, был на 42% выше, чем у растений, обработанных NaCl [62].Засоленные растения, обработанные кремнием, показали на 17% более высокую эффективность использования воды, чем необработанные растения [16]. Это говорит о том, что Si может смягчить вредное воздействие соленого стресса. Кремний может снижать перекисное окисление липидов в растениях, подвергшихся солевому стрессу, за счет усиления ферментативной и неферментативной активности антиоксидантов [16, 57]. Внесение кремния в растения при солевом стрессе ограничивает степень транспирации и увеличивает активность корней. Уменьшение транспирации приводит к снижению осмотического стресса в растительных клетках и улучшению деятельности корней.Вследствие деятельности корней растения могут увеличивать поглощение питательных веществ и снижать солевую токсичность. Поглощение кремния растениями приводит к увеличению активности PPase и ATPase в вакуолях, что снижает захват Na + и увеличивает захват K + клеточной мембраной. Разделение ионов соли в вакуоли и увеличение соотношения K + / Na + в клетках корней и листьев снижает токсичность Na + . Повышение антиоксидантной ферментативной активности прекращает потери электронов из липидов в клеточных мембранах, что снижает перекисное окисление липидов и повреждение клеток.Схема механизма взаимодействия обработки Si у растений в условиях солевого стресса показана на рисунке 3.
2.3.2. Кремний и тяжелые металлы
(1) Токсичность кремния и марганца . Роль Si в подавлении токсичности тяжелых металлов широко известна у высших растений. Облегчающая роль Si по отношению к марганцу в растворной культуре ячменя была впервые обнаружена в 1957 г. [83, 84]. Хотя Si не может влиять на весь Mn в листьях ячменя, он способен равномерно распределять Mn по всему листу и не позволяет Mn концентрироваться в отдельных некротических пятнах [85].Кроме того, функция Si в снижении токсичности Mn широко описана для риса [55], тыквы [20, 86], ячменя [87], сорго [88], кукурузы [89], фасоли [90], сои [91]). ], огурцы [75, 85, 92] и коровий горох [93, 94].
Катион-связывающую способность в клеточной стенке вигны можно регулировать с помощью Si [95]. Кремний способен подавлять токсичность Mn либо за счет снижения концентрации растворимого Mn в апопласте в клеточной стенке, либо за счет детоксикации Mn в апопласте [93, 94]. Результаты исследования Iwasaki et al.показывают, что высвобожденный Si может вызывать окисление Mn в осажденной форме через связь с фенольными веществами апопласта, что приводит к повышению устойчивости листьев к Mn [93, 94]. Кремний может снизить токсичность Mn, связывая большую часть Mn в клеточных стенках тканей листа, и только небольшое количество Mn обнаруживается в симпласте [96]. Кремний подавляет токсичность Mn в огурцах, уменьшая эффекты перекисного окисления липидов мембран и увеличивая ферментативную и неферментативную активность антиоксидантов [85].
(2) Токсичность кремния и кадмия . Кремний может снизить токсичность кадмия (Cd), создаваемую увеличением pH в процессе детоксикации. Сообщалось, что поглощение Cd растениями снижается за счет увеличения количества доступного Si и повышения pH [97]. О роли Si в качестве дополнительного фактора, который снижает токсичность кадмия, сообщалось в отношении огурцов [98], кукурузы [99–101], риса [102–104], Brassica chinensis [105] и арахиса [106]. ]. Кремний минимизирует поглощение ионов металлов и ограничивает трансформацию токсичных металлов между корнями и побегами проростков риса, выращенных в Cd [107].Отложение Si вокруг энтодермы дает возможность контролировать апопластный транспорт Cd, физически препятствуя обходному потоку апопласта в корне [107]. Обработка кукурузы Si при стрессе Cd значительно увеличила биомассу растения за счет снижения доступности Cd и увеличения pH почвы [17]. Смягчающая функция Si в отношении токсичности Cd не ограничивается иммобилизирующей ролью за счет повышения pH почвы, Si также способствует детоксикации Cd в кукурузе [17]. Кремний играет аналогичную роль в повышении устойчивости растений к токсичности Mn и Cd за счет иммобилизации металлов в клеточных стенках корня и ингибирования их транспорта в цитозоль [93, 94, 96].Эти исследования показали, что Si способен ковалентно связываться с тяжелыми металлами и образовывать нестабильную силикатную форму (рис. 4), которая впоследствии подавляет токсичность металлов и легко разлагается до диоксида кремния (SiO 2 ). Следовательно, можно понять, что Si играет решающую роль в межклеточных и внеклеточных частях клеток растений. Внеклеточная активность Si заключается в ограничении проникновения тяжелых металлов в цитоплазму в зависимости от его концентрации Si.Секвестрация тяжелых металлов в вакуолях — это межклеточная активность Si, происходящая в цитоплазме.
(3) Токсичность кремния и алюминия . Подавляющее действие обработки Si на токсичность алюминия (Al) в растениях и возможные механизмы этого подавления были тщательно исследованы. Роль Si в снижении токсичности Al различна для разных видов растений. В связи с этим Si может значительно снизить токсичность Al в Zea mays ( Teosinte L.ssp. Mexicana), ячмень ( Hordeum vulgare L.), соя ( Glycine max L. Merr) и сорго ( Sorghum bicolor ). Однако для других видов, таких как пшеница ( Triticum aestivum L.), рис ( Oryza sativa L.), горох ( Pisum sativum L.) и хлопок ( Gossypium hirsutum ), Si неэффективен. в снижении токсичности Al [108]. Кроме того, сообщалось об использовании Si в качестве альтернативного метода детоксикации при токсичности Al для сорго ( Sorghum bicolor L.) [109, 110], томат ( Lycopersicum esculentum L.) [111] и ячмень ( Hordeum vulgare L.) [112]. Было документально подтверждено, что сдерживание токсичности Al с помощью Si в соевых бобах нестабильно и зависит от pH [110]. Концентрация Al может увеличиваться во время обработки Si за счет образования гидроксил-алюмосиликатных комплексов в побегах растения. Вследствие увеличения концентрации увеличивается перенос алюминия между корнями и побегами [113]. Более того, Si способен повышать толерантность кукурузы к Al за счет метаболизма фенольных соединений, что приводит к увеличению содержания фенольных веществ в растении [114].Катехин, кверцетин и другие флавоноидные фенолы потенциально могут повысить устойчивость растений к тяжелым металлам.
2.3.3. Дисбаланс кремния и питательных веществ
(1) Кремний и фосфор . Кремний способен повышать урожайность в условиях стресса, связанного с дефицитом фосфора. Добавление Si в питательные растворы риса приводило к увеличению сухой массы рисовых ростков [115]. Хотя Si не влияет на доступность фосфора внутри почвы, на способность фиксации фосфора не влияет концентрация кремниевой кислоты в почве [116].Было показано, что на поглощение P растениями, культивируемыми как в растворе, так и в почве, обработка Si не влияет [115, 116]. В условиях дефицита фосфора внутренняя доступность фосфора контролируется другими металлами, такими как Mn и Fe. Следовательно, Si может косвенно увеличивать доступность P, уменьшая доступность Fe и Mn в растениях [55].
Кремний может влиять на стрессы как дефицита, так и передозировки P. Кремний также способен подавлять повреждающие эффекты избытка фосфора за счет уменьшения экстремального поглощения фосфора, поскольку отложение Si в эндодермальных клетках корня [117] может действовать как препятствие для апопласта для снижения фосфора. поглощение корнями.
(2) Кремний и азот . Накопление Si в листовых пластинах и стеблях риса снижает взаимное затенение и чувствительность растений к болезням, вызванным высокой доступностью азота. После обработки кремнием частота возникновения бактериальной болезни значительно снизилась на поле, особенно когда передозировка азота произошла в почве с густыми насаждениями [118].
2.3.4. Кремний и климатические условия
Кремний эффективно снижает ущерб, наносимый рису ( Oryza sativa ) в условиях стресса окружающей среды, включая недостаточный солнечный свет, низкие температуры и тайфуны [20].С другой стороны, высокое накопление Si в рисе приводит к увеличению толщины стенки стебля и размера сосудистых пучков, следовательно, к увеличению прочности стебля [119] и уменьшению полегания. Осаждение Si на корпусе останавливает потерю воды и позволяет установке выдерживать сильные ветры [120]. Более того, урожайность риса, обработанного Si, не зависит от недостаточного количества солнечного света и низких температур. На листьях растений, обработанных Si, утечка электролита в результате высокой температуры меньше, чем на листьях необработанных растений [77].
2.4. Кремний и биотические стрессы
2.4.1. Кремний и болезни растений
По имеющимся данным, Si способен снижать восприимчивость риса к болезням оболочки [11, 121, 122]. Полимеризация растительного опала или стекла и твердого покрытия SiO 2 в слое кутикулы растений является возможным механизмом снижения восприимчивости к болезням с помощью Si [12]. Физическое препятствие, создаваемое SiO 2 , увеличивает инкубационный период в оболочке листа риса и приводит к затруднению R.solani для уменьшения количества и расширения кожных ран. По сравнению с физическим препятствием для раннего проникновения, распространение поражения является более важным фактором с точки зрения устойчивости к бактериальному ожогу, особенно у восприимчивых сортов [123]. Кремний увеличивает сопротивляемость болезням оболочки за счет создания физического препятствия SiO 2 и снижает интенсивность заболевания. Было высказано предположение, что Si способен уменьшать эффект фитофтороза, мотивируя защитные механизмы сельскохозяйственных культур против патогенеза, увеличивая количество фенольных компонентов и повышая активность пероксидазы, хитиназ, полифенолоксидазы, β -1, 3-глюканазы и ферменты фенилаланинаммиаклиаза [12].
В нескольких исследованиях сообщалось о подавляющей роли Si в отношении возбудителя риса, вызываемого Magnaporthe grisea [121, 124, 125]. Кремний может снизить интенсивность болезни листа и метелки на разных стадиях роста. Уменьшение повреждений листьев риса после 96 часов инокуляции M. grisea между обработанными Si и необработанными растениями было исследовано Rodrigues et al. [124]. Результаты эксперимента показали, что на листьях необработанного растения наблюдались многочисленные сливающиеся и крупные поражения, регулярно окруженные хлоротичным ореолом.Однако отдельные и крошечные поражения, которые, казалось, были ограничены на стадии расширения, наблюдались в обработанном Si рисе. Более того, листья контрольных растений проявляли сильный хлороз по сравнению с растениями, обработанными Si.
Интенсивность поражения шейки и листьев как у чувствительных, так и у частично устойчивых сортов риса может быть уменьшена на посредством обработки Si в зависимости от нормы внесения Si и тяжести заболевания [126]. Повышенная степень тяжести врожденных болезней на определенных участках требует большого количества Si-удобрений, чтобы уменьшить поражение шейки и листопад так же эффективно, как и в случае устойчивых сортов риса.Si применялся для предотвращения возникновения мучнистой росы, одного из заболеваний растений, созданных Sphaerotheca fuliginea . Сообщается, что кремний является эффективным подавителем мучнистой росы ( Blumeria graminis ) [8, 127–129]. Увеличение содержания Si в побегах огурца приводит к снижению заболеваемости мучнистой росой [130]. Кроме того, сообщалось, что возникновение мучнистой росы уменьшилось после увеличения концентрации Si в культуральном растворе [131].Макроэлемент может снижать эффективность заражения, размер колоний и прорастание конидий у огурцов [132]. Сообщалось, что эффективное использование Si при внекорневой подкормке способствует росту листьев винограда, огурцов ( Cucumis sativus ) и дынь ( Cucumis melo ) [133, 134]. Тенденция роста, скорее всего, зависит от осаждения Si на поверхности листьев. Кремний также повышает толерантность корней огурца к грибковым заболеваниям P. aphanidermatum и Pythium ultimum [135].Кремний также оказывает запретительное действие на рисовых зеленых цикадок ( Eurymela independent ), листовых пауков, коричневых личинок растений [136], белых цикад и клещей ( Lorryia formosa ) [137]. Наряду со всем вышесказанным, устойчивость риса к личинке коричневого растения ( Nilaparvata lugens ) связана с содержанием Si в растении [136]. Кроме того, документально подтверждено, что Si способен повышать устойчивость сорго ( Sorghum bicolor ) к антракнозу [138].
3. Транспортировка и осаждение кремния
Интенсивность поглощения Si варьируется в зависимости от вида растений. Митани и Ма провели исследование переноса Si тремя разными видами растений, включая рис ( Oryza sativa ), томат ( Solanumly copersicum ) и огурцы ( Cucumis sativus ) с различной способностью абсорбции Si (высокая, средняя , и низкий) и указали, что транспорт Si между внешним раствором и кортикальным слоем клеток контролируется конкретным транспортером (значение 15% мМ) у всех трех видов [39].Однако эти три вида отличаются от высокого к низкому, что позволяет сделать вывод о том, что плотность переносчиков различается между видами. Было высказано предположение, что транспортировка Si требует энергии, а низкие температуры и метаболические репрессоры ингибируют транспортировку Si [39]. Транспорт кремния между кортикальными клетками и ксилемой является наиболее важным фактором, ответственным за высокий уровень отложения Si в побегах риса. Более низкое отложение Si у некоторых видов, таких как огурцы ( Cucumis sativus ) и томаты ( Solanumly copersicum ), связано с более низкой плотностью транспорта Si между внешним раствором и кортикальными клетками или несовершенным транспортером Si между кортикальными клетками. и ксилема.Абсорбция кремния при загрузке ксилемы в рисе связана только с одним типом переносчиков. Для сравнения, перевозка огурцов и помидоров осуществляется разными перевозчиками. После поглощения Si корнями и перемещения в ксилеме силикагель (SiO 2 · n H 2 O) образуется в результате полимеризации кремниевой кислоты высокой концентрации (> 2 мМ). Ксилемный сок риса и пшеницы включает дополнительную концентрацию Si, представленную в виде мономерной кремниевой кислоты [43].Транспирация воды и полимеризация Si являются двумя основными факторами образования высокой концентрации кремниевой кислоты в побегах растений. При увеличении концентрации кремниевой кислоты она сначала превращается в коллоидную кремниевую кислоту, а затем в силикагель [54].
Сообщалось, что абсорбция и транспортировка Si в рисе и кукурузе с аналогичным механизмом накопления Si, а также у других видов, таких как восковая тыква и подсолнечник в качестве промежуточных видов, зависят как от видов растений, так и от концентрации Si во внешней среде.В целом, влияние видов растений на поглощение и транспорт Si связано со способностью поглощать кремний в пассивной или активной форме [139].
Было продемонстрировано, что окварцевание происходит в части энтодермы корней злаковых во время созревания. Однако клеточные стенки других тканей, включая сосудистые, эпидермальные и кортикальные, могут быть окремнены в более старых корнях. Также окварцевание происходит в различных частях трав, таких как корни и побеги, включая листья и стебель, в основном в соцветиях [140].
Результаты исследования риса [141] показали, что слой нанесенного Si (2,5 мкм мкм) образуется мгновенно под кутикулой с двойным слоем Si-кутикулы в пластинках листа. Результаты также продемонстрировали, что силицификация клеток, включая клетки в форме колокольчика в сосудистых пучках, клетки кремнезема и тельца кремнезема на булевидных клетках, не ограничивается пластинками рисового листа, поскольку кремнеземистые клетки также можно найти в слое эпидермиса и сосудов ткань влагалища, стебля и оболочки листа [141].Результаты других исследований Equisetum sp. показали, что кремнеземистые структуры обнаруживаются на поверхности эпидермиса клеточной стенки в виде дискретных розеток и выступов, защищенных спикулами [142, 143]. Расположение поверхности кремнезема влияет на ее толщину, например, 3–7 мм в стебле и 0,2–1,0 в листьях растений.
Метод ядерного магнитного резонанса (ЯМР) и колориметрический метод были использованы для исследования поглощения Si пшеницей [144]. Метод ЯМР позволяет точно обнаружить любые молекулярные частицы, содержащие Si.Однако этот метод обнаружил только два вида кремниевой кислоты (мономерный и димерный) в самых ранних экссудатах и не смог измерить растворимый Si в более поздних экссудатах с помощью спектроскопии 29 Si-ЯМР.
Силицифицированные клетки, образующиеся в листовых пластинках, тканях сосудов и стеблей эпидермиса, а также в оболочке и листовой оболочке, играют защитную роль в растениях от различных стрессов и предоставляют функциональную археологическую и палеоэкологическую информацию [52]. Осаждение большого количества Si в рисе снижает способность корней поглощать Si [5].Поглощение кремния корнями риса намного выше, чем корнями кукурузы ( Zea mays subsp. mays ), пшеницы ( Triticum spp.), Ржи ( Secale cereale ), ячменя ( Hordeum vulgare ). L.) и сорго [53].
Первоначальное исследование гена-переносчика Si было проведено на морских диатомовых водорослях в 1997 г. [145]. Транспорт Si у голой Cylindrotheca fusiformis , морской диатомеи, кодируется семейством генов [146]. Результаты исследования переноса гена Si диатомовых водорослей в табак без наблюдаемого увеличения поглощения Si показали, что механизм поглощения Si различен у высших растений и диатомовых водорослей [147].Было высказано предположение, что высокое содержание Si, наблюдаемое в побегах риса, не связано с диффузией кремниевой кислоты через липид клеточной мембраны [148]. Однако в корнях риса должен быть активный переносчик Si, ведущий к высокому накоплению Si в побегах [148, 149]. Первый активный ген поглощения Si ( Lsi1 ) между высшими растениями был идентифицирован у риса [53, 147]. Три гена-транспортера Lsi1 , Lsi2 и Lsi6 , которые используются для поглощения и транспортировки Si, были идентифицированы у риса [49, 150].Lsi1 был выделен из риса и был клонирован, охарактеризован и функционально проанализирован в 2006 г. [151]. Мутант Lsi1 был использован для поиска и картирования генов, ответственных за загрузку ксилемы Si в рисе [147].
И Lsi1 , и Lsi2 расположены на клеточной плазматической мембране клеток корня энтодермы и экзодермы на дистальной стороне и проксимальной стороне соответственно [150, 151]. Комплементарная ДНК Lsi1 составляет 1409 п.н., а длина предполагаемого белка составляет 298 аминокислот.Экспрессия Lsi1 и Lsi2 постоянно наблюдалась в корнях риса [151]. Lsi6 аналогичен Lsi1 и Lsi2 и состоит из пяти экзонов и четырех интронов с открытой рамкой считывания (ORF) 894 п.н. Подобно Lsi1 , Lsi6 кодирует белок из 298 аминокислот. Lsi6 выражается в пластинках, оболочках листьев и корнях, тогда как Lsi1 и Lsi2 выражаются только в корнях.Предсказанный белок как Lsi1 , так и Lsi6 состоит из двух хорошо консервативных доменов NPA (Asn-Pro-Ala) и четырех трансмембранных доменов [34, 49]. В отличие от Lsi2 , который действует как переносчик оттока кремниевой кислоты [150], оба гена Lsi1 и Lsi6 являются переносчиками притока кремниевой кислоты [49, 151, 152]. Сообщалось, что Lsi1 и Lsi2 значительно увеличивают поглощение Si корнями [150], в то время как Lsi6 участвует в переносе Si в побегах [49]. ZmLsi1 и ZmLsi6 были идентифицированы в Zea mays и участвуют в абсорбции и транспортировке Si в различных частях корней [153]. ZmLsi1 сильно экспрессируется в боковых корнях и незначительно в корневых корнях. Напротив, ZmLsi6 более высоко экспрессируется на влагалищах и лопастях листа и корня кроны [153].
Было высказано предположение, что белков, богатых серином, белков, богатых пролином, и других полисахаридов участвуют в накоплении Si [154].Недавно из корней мангровых зарослей был выделен ген богатого серином белка ( Rhizophora apiculata ), который, возможно, отвечает за абсорбцию и накопление Si в растениях [24]. Вычислительный анализ кДНК, клонированной и выделенной из корней мангрового дерева, обработанных различными концентрациями Si в разные периоды времени посредством супрессивной субтрактивной гибридизации (SSH), показал, что ген богатого серином белка имеет кодирующую область размером 696 п.н. для белка 223 аминокислоты и, скорее всего, участвует в абсорбции и транспортировке Si в корнях растений.Результат другого исследования [23] показал, что ген , богатый серином , увеличивает количество абсорбции и накопления Si, особенно в листьях и корнях трансгенного Arabidopsis thaliana по сравнению с растениями дикого типа (Рисунок 5). В будущих исследованиях можно предложить установить некоторую связь между полимеризацией силиката аминокислот и белков, богатых серином .
4. Механизмы образования биокремнезема
Виды растений, диатомовые водоросли и губки способны накапливать, хранить и обрабатывать Si для создания сложной структуры биокремнезема.Продукция кремнезема организмами образуется при атмосферном давлении и температурах от 4 до 40 ° C в водной фазе насыщенного раствора кремнезема [155]. Механизм образования биокремнезема организмами до сих пор является предметом обширных исследований и дискуссий. Сообщалось, что органическая среда, содержащая широкий спектр углеводов, белков, липидов, фенольных соединений и ионов металлов, может играть главную роль в образовании биокремнезема [155, 156].
Конденсация диоксида кремния в природе зависит от многих факторов, включая концентрацию диоксида кремния, pH, температуру и присутствие других полимеров, небольших молекул и различных ионов.При полимеризации всех различных разновидностей кремнезема фундаментальную роль играют угол связи Si – O – Si и расстояния связи Si – O. Материал, участвующий в полимеризации диоксида кремния, содержащий группы ОН, и в реакциях окружающей среды может различаться у разных видов из-за растворимости, состава, твердости, вязкости и плотности [157].
Было проведено несколько исследований in vitro и in vivo , чтобы показать важность биомолекул в биосилификации. Функциональные группы всех аминокислотных остатков в структуре белка доступны для кремнезема и играют ключевую роль в определении физической структуры и природы веществ, которые образуются на стадиях созревания.Было высказано предположение, что роль аминокислот в биосилицификации может быть такой же, как их роль in vivo . В этом случае влияние аминокислот на биосилицификацию и их роль in vivo в расположении может быть ключевым фактором для контроля биосилицификации [158]. Пептиды и аминокислоты эффективны в создании поликремниевых соединений за счет взаимодействий с различными видами силикатов в растворе. Обе формы силиката, нейтральный Si (OH) 4 и отрицательно заряженный [SiO (OH) 3 ] —, участвуют в процедуре оксоляции (рис. 6).
Процесс оксоляции приводит к полимеризации Si за счет концентрации силанольных единиц и высвобождения молекул H 2 O. Процесс нуклеофильного замещения или оксоляции SN2 включает перенос внутреннего протона через переходное состояние, приводящий к образованию молекул H 2 O в уходящей форме. Нуклеофильное замещение SN2 может катализироваться основанием или кислотой, и pH является основным определяющим фактором скорости реакции оксоляции. Процесс окисления сильно зависит от pH.В случае диоксида кремния он начинается с pH 3, минимального нулевого заряда, и увеличивается с увеличением pH. Скорость полимеризации Si увеличивается при pH до 8-9. Водородные связи с силикатными частицами и электростатические связи между группами (Si – O — и), по прогнозам, возникнут во время оксоляции (Рисунки 4 и 6). Боковые цепи аминокислот определяют ионизацию в водном растворе и создают общий заряд.
Значения амино- и карбоксильных групп аминокислот составляют приблизительно от 9 до 10 и 2 соответственно.Следовательно, при нейтральном pH группа (COOH) аминокислот является (COO —) или отрицательно заряженной, тогда как аминогруппа или () аминокислот должна быть протонированной. В исследовании, проведенном для демонстрации эффектов четырех аминокислот (серина, пролина, лизина и аспарагиновой кислоты) на образование полисиликатов [159], нуклеофильная каталитическая сила протонированных аминогрупп не наблюдалась. Кроме того, количество групп уменьшалось при увеличении pH, тогда как оно увеличивалось при отрицательном заряде полисиликатов.Был сделан вывод, что между этими последствиями должен существовать некоторый стабильный баланс (рис. 7). На площадь поверхности силикатных компонентов могут влиять различные аминокислоты в зависимости от гидрофобности, изоэлектрической точки и среднего размера пор силиката [158].
Результаты другого эксперимента показали, что группы карбоновых кислот и спиртов аминокислот P-серина и P-аспарагина не играли значительной роли в образовании полисиликатов, скорее всего, из-за отрицательного заряда этих групп на с другой стороны, боковые группы –OH серина, по-видимому, участвуют в образовании водородной связи с Si (OH) 4 [159].Однако сообщалось, что поверхности с концевыми аминогруппами не выделяются при зародышеобразовании кремнезема; другие субстраты, такие как карбоксильный и гибридный NH 3 ( + ) / COO ( — ), в основном активны для накопления кремнезема. С другой стороны, препятствия свободной энергии для образования кластера кремнезема одинаковы для поверхностных форм с карбоксильными или аминными концевыми группами [160]. Среди всех аминокислот p-Asp и p-Ser являются впечатляющими катализаторами при pH 4,9, где основным силикатом является нейтральный Si (OH) 4 .Однако эти аминокислоты менее энергичны при pH 9,2, где преобладающая разновидность силиката имеет отрицательный заряд [SiO (OH) 3 ] — [159]. Было показано, что органические молекулы, содержащие гидроксильную группу, химически не участвуют в образовании кремнезема. Вместо этого они могут только способствовать обеспечению растворимости и стабильности поглощенных органических молекул, обнаруженных в диоксиде кремния. С другой точки зрения, можно предположить, что если гидроксильные группы органических молекул влияют на образование диоксида кремния, полимеризация кремниевой кислоты будет встречаться с дефицитом воды, чтобы увеличить функциональные эффекты гидроксильных групп белка в образовании диоксида кремния [161].Можно предсказать, что аминокислота серин подходит для процесса оксоляции, приводящего к образованию биокремнезема, поскольку эта аминокислота нейтральна с точки зрения растворимости в воде в различных диапазонах pH и имеет простую структуру по сравнению с другими аминокислотами. Как упоминается в литературе, единственная форма Si, которая усваивается растениями, — это монокремниевая кислота. Из-за разбавления силикатного раствора молекулы силанола не могут легко связываться с аминогруппами. Следовательно, боковые группы аминокислот и карбонильные группы, участвующие в полипептидной цепи, с большей вероятностью объединяют молекулы, и происходит образование биокремнезема.
Можно понять, что и аминокислота, и пептид могут взаимодействовать с растворами силикатов посредством электростатических взаимодействий и водородных связей. Однако пептиды, по-видимому, имеют более значительный эффект, чем аминокислоты, поскольку водородные связи или электростатические взаимодействия с одной молекулой (аминокислотой) недостаточно сильны для благоприятной реакции конденсации. Поскольку конденсация между молекулярными предшественниками происходит, когда частицы сближаются, можно сказать, что распределение водородной связи (образующей карбонильные группы) и заряженных боковых групп вдоль пептидной цепи сближает частицы в реакционноспособном состоянии.Кроме того, в силикатных растворах довольно мало спонтанных столкновений, связанных с броуновским движением [159].
5. Выводы
Основная цель этого обзора — дать исчерпывающее представление о роли Si в растениях и эффектах биомолекул, которые участвуют в механизме образования биокремнезема. Кремний играет важную роль, помогая растениям преодолевать различные типы абиотических и биотических стрессов. Макроэлемент также улучшает состояние почвы при токсичных уровнях тяжелых металлов и некоторых химических элементов.Помимо роли Si как физического препятствия, применение Si может влиять на физиологическую и метаболическую активность растений. Можно рекомендовать Si как полезный элемент, участвующий в клеточных процессах. Понимание роли Si для высших растений может улучшить их рост и урожайность, а также снизить их восприимчивость к широкому спектру заболеваний. Из-за 3 гидроксипропановых групп серин классифицируется как гидрофильная полярная аминокислота. Серин играет важную роль в анаболизме пиримидинов и пуринов.Структура серина помогает этой аминокислоте участвовать в других метаболитах, легко высвобождая один атом углерода в процессе биосинтеза. Следовательно, серин является важным компонентом в механизме образования биокремнезема и улучшении метаболизма растений. Большинство растений, особенно двудольные, не способны поглощать большое количество Si из почвы. Следовательно, генетические и биохимические манипуляции с корнями растений для увеличения их способности абсорбировать Si и последующий перенос Si к частям побегов могут помочь растениям преодолеть широкий спектр стрессов и улучшить их метаболизм.



