Содержание
Метан гомологи — Справочник химика 21
Растворенный в нефти газ тяжелый. По содержанию основных компонентов (метан, гомологи метана) он лишь незначительно отличается от среднего состава нефтяного газа. Содержание азота повышено. [c.193]
Метан, гомологи метана. …….. [c.364]
Растворенный в нефти газ тяжелый. Соотношение основных компонентов в нем (метан, гомологи метана, азот) близко к среднему. [c.204]
Растворенный в нефти газ пашийского горизонта жирный, тяжелый. Соотношение основных компонентов газа (метан, гомологи метана и азот) близко к среднему для нефтяных газов. [c.261]
Растворенный в нефти газ сухой, легкий. В его составе преобладает метан, гомологов метана относительно мало. Содержание азота несколько ниже, чем в среднем для нефтяных газов. [c.322]
Растворенный в нефти газ легкий. В его составе преобладает метан, гомологов метана относительно мало (17%). Содержание азота соответствует среднему содержанию его в нефтяных газах. -с- [c.339]
В его составе преобладает метан, гомологов метана относительно мало (17%). Содержание азота соответствует среднему содержанию его в нефтяных газах. -с- [c.339]
Процесс формирования углей Ю. М. Жемчужниковым разделяется на четыре стадии торфяную, буроугольную, каменноугольную и антрацитовую. На всех стадиях превращения исходного материала в уголь происходит образование газов. Газы торфяной стадии — болотные газы — состоят в основном из метана. Неуглеводородные компоненты здесь представлены азотом и аргоном, проникающим из атмосферы, и углекислым газом биохимического происхождения. На буроугольной стадии биохимические процессы затухают, однако газы (метан и углекислый газ) продолжают образовываться, но уже в меньшем количестве, как на этой стадии, так и в процессе дальнейшей углефикации. И, наконец, на антрацитовой стадии образуется только метан. Гомологи метана играют весьма подчиненную роль и содержатся далеко не во всех газах. [c.261]
Отходящие газы каталитической ароматизации состоят в основ-.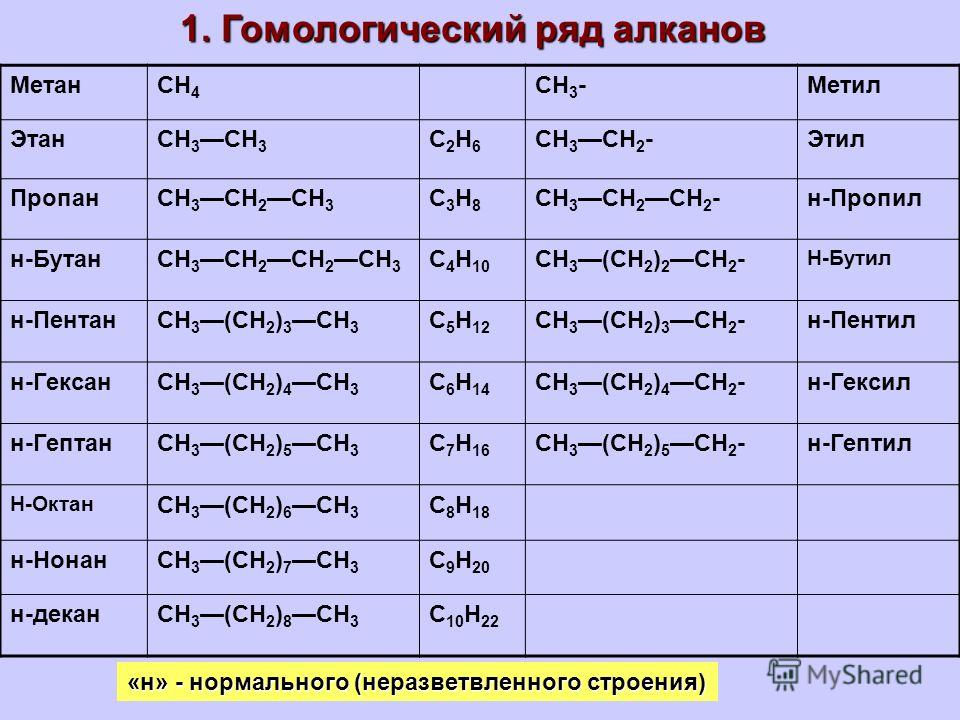 ном из водорода, метана и гомологов последнего. Основными компонентами метан-водородных фракций являются в большинстве случаев водород, метан, гомологи метана, низшие олефины и азот. Адсорбируемость на угле гомологов метана и олефинов значительно больше, чем метана и, тем более, водорода. Гомологи метана и олефины будут извлекаться из указанных газовых смесей легче других компонентов и при разделении смесей методом гиперсорбции будут представлять собой нижний продукт колонны. [c.276]
ном из водорода, метана и гомологов последнего. Основными компонентами метан-водородных фракций являются в большинстве случаев водород, метан, гомологи метана, низшие олефины и азот. Адсорбируемость на угле гомологов метана и олефинов значительно больше, чем метана и, тем более, водорода. Гомологи метана и олефины будут извлекаться из указанных газовых смесей легче других компонентов и при разделении смесей методом гиперсорбции будут представлять собой нижний продукт колонны. [c.276]
Состав газов, растворенных в водах газовых залежей, близок к составу свободных газов, они представлены почти исключительно метаном, гомологов метана — не более 0,4% (табл. 51). [c.330]
В переходной зоне (от 1000 до 1700 м) преобразование органического вещества происходит вследствие как биохимических процессов (затухают), так и термокатапитических (начальная стадия). В зтой зоне генерируются метан (5 С среднее — 6,0) и небольшое количество гомологов метана. С углеводородами зтой зоны связано формирование крупнейших газовых залежей (например, газовые залежи на севере Тюменской области). В термокаталитической зоне (глубже 1500- 1700 м) преобразование органического вещества происходит в результате термокаталитических процессов генерируются метан, гомологи метана и нефть. Углерод метана-зтой зоны наиболее обогащен тяжелым изотопом (5 С от —3,0 до -5,7). На глубинах более 4000 — 5000 м может происходить некоторое облегчение углерода метана, что, вероятно, обусловлено изотопно-кинетическим эффектом при разложении тяжелых углеводородов в условиях повышенных температур (B. . Лебедев, 1974 г.). Эта схема подразделения осадочной толщи на три зоны (биохимическую — диа1енез, переходную и термокаталитическую — катагенез) на первый взгляд, представляется превосходно обоснованной как глубинами залегания УВ, так и изотопным составом углерода СН и составом УВ. В действительности она оказывается несостоятельной по целому ряду причин. Во-первых, в очень молодых осадках встречаются УВ, содержащие большое количество ТУ (табл.
С углеводородами зтой зоны связано формирование крупнейших газовых залежей (например, газовые залежи на севере Тюменской области). В термокаталитической зоне (глубже 1500- 1700 м) преобразование органического вещества происходит в результате термокаталитических процессов генерируются метан, гомологи метана и нефть. Углерод метана-зтой зоны наиболее обогащен тяжелым изотопом (5 С от —3,0 до -5,7). На глубинах более 4000 — 5000 м может происходить некоторое облегчение углерода метана, что, вероятно, обусловлено изотопно-кинетическим эффектом при разложении тяжелых углеводородов в условиях повышенных температур (B. . Лебедев, 1974 г.). Эта схема подразделения осадочной толщи на три зоны (биохимическую — диа1енез, переходную и термокаталитическую — катагенез) на первый взгляд, представляется превосходно обоснованной как глубинами залегания УВ, так и изотопным составом углерода СН и составом УВ. В действительности она оказывается несостоятельной по целому ряду причин. Во-первых, в очень молодых осадках встречаются УВ, содержащие большое количество ТУ (табл.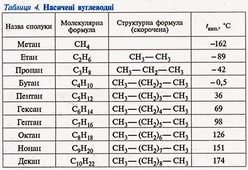 3), Во-вторых, изотопные составы углерода УВГ и СО нередко значительно варьируют (рис. 6,7). В-третьих, до значительных глубин наблю- [c.19]
3), Во-вторых, изотопные составы углерода УВГ и СО нередко значительно варьируют (рис. 6,7). В-третьих, до значительных глубин наблю- [c.19]
Растворенный в нефтях всех горизонтов Карамалы-Губеевского месторождения газ тяжелый. Содержание основных компонентов газа (метан, гомологи метана, азот) близко к среднему для нефтяных газов. Отметим лишь повышенное (3,8%) содержание сероводорода в газе, растворенном в нефти турнейского яруса. [c.208]
В тех случаях, когда скважина по истечении некоторого времени эксплуатации начинает фонтанировать газом с нефтью, постепенно наблюдается некоторое обогащение газа гомологами метана и углекислотой по сравнению с начальным, чисто газовым фонтаном. Объясняется это следующим образом. При вскрытии нефтяного пласта с богатым запасом газа в первую очередь выделяется метан гомологи же метана и углекислота, обладающие под давлением большей растворимостью в нефти, будут выделяться лишь в незначительном количестве. По мере выхода газа и спадания в пласте давления гомологи метана и углекислота начинают выделяться в большем количестве, что нередко совпадает с появлением нефти из буровой. В табл. 36 приведен пример того, как для одной из буровых Кара-Чухура (VI горизонт) на протяжении 10 месяцев изменялся состав газа. [c.128]
По мере выхода газа и спадания в пласте давления гомологи метана и углекислота начинают выделяться в большем количестве, что нередко совпадает с появлением нефти из буровой. В табл. 36 приведен пример того, как для одной из буровых Кара-Чухура (VI горизонт) на протяжении 10 месяцев изменялся состав газа. [c.128]
Основной компонент подземных вод нефтегазоносных бассейнов — метан Гомологи метана — этан СаНе, пропан СзНв и бутаны С4Н10 — встречаются в меньшем количестве Содержание метана варьирует в широких пределах — от нескольких кубических сантиметров в литре до 5000 см /л В последнее время установлена высокая насыщенность углеводородными газами вод зон АВПД — 20—40 тыс см /л [c.22]
Общая химия (1987) — [
c.304
,
c.305
]
Справочник азотчика Том 1 (1967) — [
c.71
,
c.84
,
c. 279
279
]
Геология и геохимия нефти и газа (1982) — [
c.267
]
Основы общей химии Том 2 (1967) — [
c.47
]
Справочник азотчика Т 1 (1967) — [
c.71
,
c.84
,
c.279
]
Производство технологического газа для синтеза аммиака и метанола из углеводородных газов (1971) — [
c.36
,
c.41
,
c.42
,
c.76
,
c.77
,
c.91
,
c.99
,
c.124
,
c.230
,
c.239
]
Газообразный гомолог — метан — Большая Энциклопедия Нефти и Газа, статья, страница 1
Газообразный гомолог — метан
Cтраница 1
Газообразные гомологи метана — тяжелые углеводороды — ТУВ ( этан С2Нб, пропан С3Н8, бутан С4Н10) имеют большую по сравнению с метаном сорбционную способность и низкий коэффициент диффузии, что позволяет им концентрироваться в газах закрытых пор.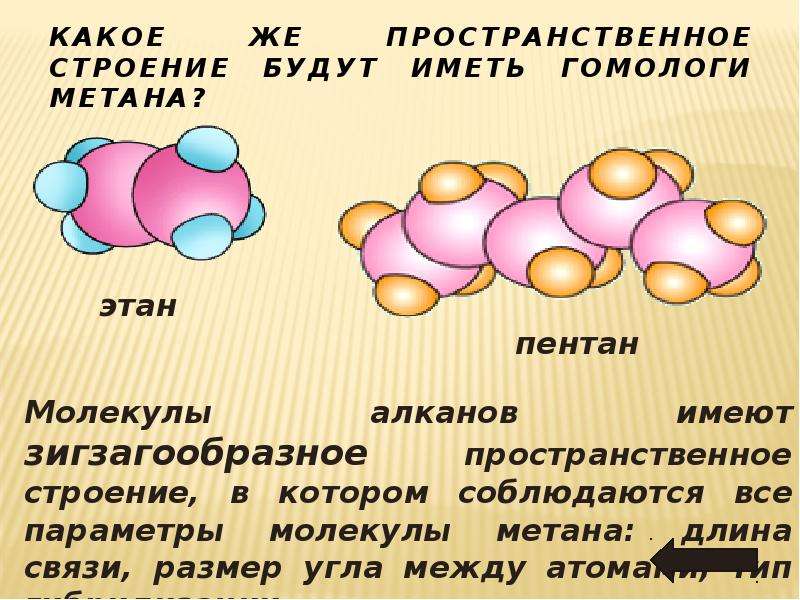 Смеси этих газов с воздухом так же взрывоопасны. Газообразные гомологи метана — ценное сырье нефтехимической промышленности; они используются в производстве синтетического каучука, полиэтилена, пластмасс. Промышленное значение имеют газы, содержащие не менее 2 — 3 % ТУВ.
Смеси этих газов с воздухом так же взрывоопасны. Газообразные гомологи метана — ценное сырье нефтехимической промышленности; они используются в производстве синтетического каучука, полиэтилена, пластмасс. Промышленное значение имеют газы, содержащие не менее 2 — 3 % ТУВ.
[1]
Газообразные гомологи метана вступают в эту реакцию-только в среде растворителей, например четыреххлористого углерода.
[2]
Газообразные гомологи метана, встречающиеся в природных газах; ближайший из гомологов — этан — иногда в сумму Т.у. не включается.
[3]
Конверсия газообразных гомологов метана по сравнению с конверсией метана изучена менее полно.
[4]
Напишите формулу газообразного гомолога метана, при сгорании которого получается углекислый газ по объему в 3 раза больший, чем объем исходного углеводорода.
[5]
При пиролизе всех газообразных гомологов метана уже при температурах 700 — 750 С обнаружены газообразные и жидкие олеф мы и ароматические углеводороды.
[6]
Анализ литературных данных по конверсии газообразных гомологов метана [1-11] свидетельствует об общности этого процесса с детально изученным взаимодействием метана с водяным паром. В то же время конверсию гомологов метана отличают более низкие температуры процесса, необходимые для полного проведения исходного углеводорода, и значительно большее количество водяного пара в исходной смеси.
[7]
В последнее время все больше появляется данных, указывающих на наличие в современных осадках газообразных гомологов метана до бутана включительно. В частности, Э. В. Чер-тикова, Л. М. Зорькин ( 1972 г.) в донных осадках Черного и Каспийского морей установили все предельные УВ от метана до гексана, их изомеры и соответствующие им непредельные УВ.
[9]
Состав попутных газов зависит от природы нефти и от принятой схемы отделения газа, которая позволяет в значительной степени освободиться от более тяжелых газообразных гомологов метана и получить попутный газ, близкий по составу к природному.
[10]
Основным компонентом нефтяного газа является обычно метан. Из углеводородных компонентов в нефтяных газах могут содержаться все газообразные гомологи метана — этан, пропан, н-бутан и изобутан. Из неуглеводородных компонентов часто в значительных количествах имеются азот и двуокись углерода и в небольших количествах могут присутствовать сероводород, аргон, гелий, водород.
[11]
Состав попутных газов зависит от природы нефти, в которой они находятся в естественных подземных резервуарах, а также от принятой схемы отделения газа от нефти при выходе их из скважины. Применение четырехступенчатой системы сепарации позволяет в значительной степени освободиться от более тяжелых газообразных гомологов метана и получить попутный газ, близкий по составу к природному.
[12]
Состав попутных газов зависит от природы нефти, в которой они заключены в естественных подземных резервуарах, а также от ( Принятой схемы отделения газа от нефти при выходе их из скважиньи. Применение четырехступенчатой системы сепарации позволяет в значительной степени освободиться от более тяжелых газообразных гомологов метана и получить попутный газ, близкий ло составу к природному.
[13]
Сырым называют конденсат, получаемый при давлении и температуре сепарации. Он представляет собой жидкость, содержащую, кроме жидких углеводородов, газообразные гомологи метана.
[14]
Газообразные гомологи метана — тяжелые углеводороды — ТУВ ( этан С2Нб, пропан С3Н8, бутан С4Н10) имеют большую по сравнению с метаном сорбционную способность и низкий коэффициент диффузии, что позволяет им концентрироваться в газах закрытых пор. Смеси этих газов с воздухом так же взрывоопасны. Газообразные гомологи метана — ценное сырье нефтехимической промышленности; они используются в производстве синтетического каучука, полиэтилена, пластмасс. Промышленное значение имеют газы, содержащие не менее 2 — 3 % ТУВ.
Смеси этих газов с воздухом так же взрывоопасны. Газообразные гомологи метана — ценное сырье нефтехимической промышленности; они используются в производстве синтетического каучука, полиэтилена, пластмасс. Промышленное значение имеют газы, содержащие не менее 2 — 3 % ТУВ.
[15]
Страницы:
1
2
Особенности состава газов залежей углеводородов арктического сектора Западной Сибири — Геологоразведка
Очевидно, что будущие открытия крупных и уникальных залежей углеводородов (УВ) на территории Западной Сибири следует связывать с ее арктическим сектором, включая шельф Карского моря. Согласно выполненной в ИНГГ СО РАН количественной оценке, Карское море является одной из наиболее перспективных акваторий шельфа Российской Арктики и на его долю приходится порядка 25% всех ресурсов углеводородов Северных морей [1]. Нефтегазопоисковые работы в арктическом секторе Западной Сибири ведутся с 30-х годов прошлого века. В годы Великой Отечественной Войны геологические изыскания в самом центре арктических районов Западной Сибири проводил В.Н. Сакс. В 1945 г. он рекомендовал низовья р. Надым в качестве одного из самых перспективных районов поисков месторождений углеводородов. С 60-х по 80-е годы XX столетия были открыты уникальные газовые месторождения: Заполярное (1965), Уренгойское (1966), Медвежье (1967), Ямбургское (1969) и другие. До Западной Сибири мир не знал подобных газовых гигантов [2].
В годы Великой Отечественной Войны геологические изыскания в самом центре арктических районов Западной Сибири проводил В.Н. Сакс. В 1945 г. он рекомендовал низовья р. Надым в качестве одного из самых перспективных районов поисков месторождений углеводородов. С 60-х по 80-е годы XX столетия были открыты уникальные газовые месторождения: Заполярное (1965), Уренгойское (1966), Медвежье (1967), Ямбургское (1969) и другие. До Западной Сибири мир не знал подобных газовых гигантов [2].
Созданная за годы освоения Западной Сибири газовая промышленность является одним из ключевых секторов экономики современной России. Основная масса добываемого газа расходуется промышленностью и идет на экспорт [3]. В настоящее время ПАО «ГАЗПРОМ» успешно осуществляет реализацию амбиционной «Программы комплексного освоения месторождений полуострова Ямал и прилегающих акваторий» и создает Бованенковскую, Тамбейскую и Южную промышленные зоны. Активное освоение ресурсов УВ осуществляют также дочерние структуры ПАО «НОВАТЭК», «РОСНЕФТЬ», «ЛУКОЙЛ» и других.
Промышленная газоносность арктических районов Западной Сибири установлена в широком стратиграфическом диапазоне: от газ-салинской пачки (турон-нижний коньяк) верхнего мела до верхней части палеозойского фундамента [4-5]. Уникальные запасы газа сосредоточены в отложениях апт-альб-сеноманского нефтегазоносного комплекса (НГК) (Бованенковское, Ямбургское, Уренгойское и другие), при этом львиная доля запасов связана с сеноманом. Основные запасы газа сконцентрированы на глубинах 1000-1500 м [6]. В настоящей работе впервые обобщены данные по составу газов более 5000 залежей УВ северных и арктических районов Западно-Сибирской нефтегазоносной провинции (рис. 1).
РИС. 1. Местоположение изученных месторождений
1 – область картопостроения рис. 5; 2 – граница распространения мезозойских отложений Западно-Сибирской плиты; 3-8 – месторождения: 3 – газовые, 4 – газоконденсатные, 5 – газонефтяные, 6 – нефтяные, 7 – нефтегазовые, 8 – нефтегазоконденсатные.
Фазовый состав залежей УВ
Термобарические условия залежей УВ исследуемого района характеризуются пластовыми температурами от 18 до 160 оС и давлениями от 5 до 37 МПа, общая тенденция которых хорошо видна на рисунке 2. Изучаемый регион характеризуется широким развитием аномально высоких пластовых давлений (АВПД) в резервуарах неокома и юры [7-9]. При статистической обработке данных использованы анализы газов по более 2200 залежам свободного газа, более 600 газовых шапок нефтяных залежей и более 2200 нефтяным залежам (попутным газам). Углеводородные газы и нефть генетически тесно связаны между собой. Гомологический ряд газообразных углеводородов: метан – этан – пропан – бутан – изобутан продолжается уже в нефти, содержащей пентан, гексан, гептан и другие нормальные УВ и их изомеры. При большом содержании УВ над нефтяной залежью образуется газовая шапка. Если содержание газообразных УВ невелико, то газовой шапки может и не быть. Весь этот газ в этом случае находится в нефти, составляя с ней единую смесь, начинающуюся с метана и до высокомолекулярных жидких и твердых растворенных в нефти УВ. При очень большом давлении, повышенной температуре и достаточном количестве газа образуется газовый раствор, содержащий жидкие нефтяные УВ. В этом случаем мы имеем дело с газоконденсатными месторождениями.
Весь этот газ в этом случае находится в нефти, составляя с ней единую смесь, начинающуюся с метана и до высокомолекулярных жидких и твердых растворенных в нефти УВ. При очень большом давлении, повышенной температуре и достаточном количестве газа образуется газовый раствор, содержащий жидкие нефтяные УВ. В этом случаем мы имеем дело с газоконденсатными месторождениями.
Выделяется следующий ряд значений содержания стабильного конденсата, характеризующих типы скоплений с газовой фазой УВ (г/м3): чисто газовые (< 1,0), низкоконденсатные (1 – 10), конденсатные с пониженным содержанием жидкой фазы (10 – 30), среднеконденсатные с пониженным (30 – 100) и повышенным (100 – 300) содержанием жидкой фазы, а также высококонденсатные (> 300) [10]. Так, среднее содержание стабильного конденсата в рассматриваемых месторождениях закономерно увеличивается с ростом пластовых температур и давлений от 45,9 г/м3
в залежах апт-альб-сеноманского комплекса до 209,7 г/м3 в залежах юрского возраста (рис. 2). Аномальными значениями (более 500 г/м3) характеризуются неокомские залежи Надымского и Умсейского месторождений, верхнеюрские залежи Тэрельского и среднеюрские Ютырмальского месторождений.
2). Аномальными значениями (более 500 г/м3) характеризуются неокомские залежи Надымского и Умсейского месторождений, верхнеюрские залежи Тэрельского и среднеюрские Ютырмальского месторождений.
РИС. 2. Содержание стабильного конденсата в зависимости от термобарических условий УВ залежей
Особенности геохимии газов залежей УВ
К настоящему времени в научной литературе предложено более 30 классификаций природных газов по химическому составу (В.И. Вернадский, И.М. Губкин, В.А. Соколов, Н.А. Еременко, К.П. Кофанов, В.Ф. Никонов, И.С. Старобинец, В.И. Ермаков, Л.М. Зорькин и другие). В анализе имеющихся данным мы использовали классификацию М.И. Субботы и А.Ф. Романюка [10]. Статистическая обработка имеющихся данных по составу углеводородных и неуглеводородных компонентов в свободных и растворенных газах позволило выявить характерные особенности их соотношения для газовых, газоконденсатных, нефтегазоконденсатных и нефтяных залежей.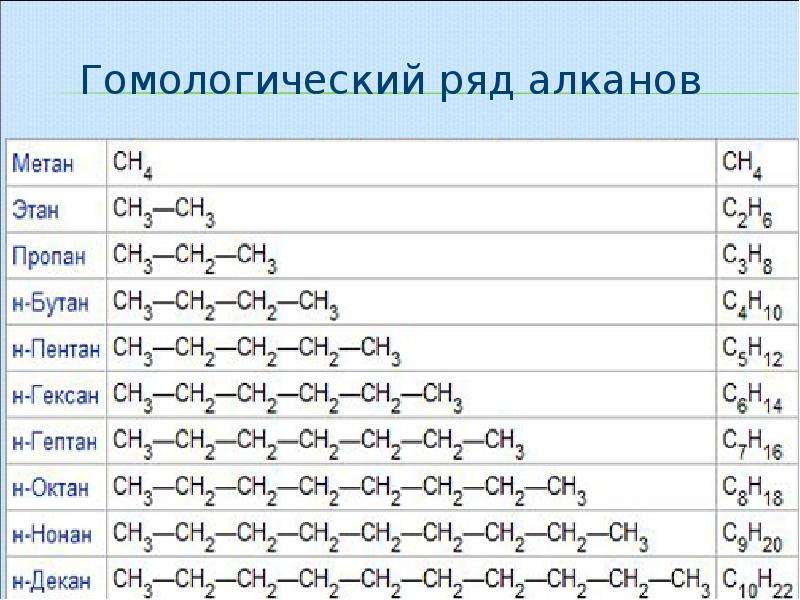 Газы практически всех изученных залежей характеризуются преобладанием в составе (до 90-99 об. %) углеводородов метанового ряда (рис. 3). Основным компонентом, генетически наиболее близким к метану, является этан. Пропан, бутан и более тяжелые гомологи характерны для газоконденсатных, нефтегазоконденсатных и нефтяных залежей. В газах отсутствует сероводород, в малых количествах содержатся азот (0,1-3,0 об.%), за исключением ряда залежей на Салмановском (Утреннем), Среднеямальском, Нейтинском, Хамбатейском и ряде других месторождений, где его концентрации достигают 7-15 об.%. Содержания углекислого газа не превышают 13 об.%, составляя в среднем 0,6 об.%. Количество гелия и аргона, в среднем, составляют 0,01 и 0,026 об.% соответственно. Иногда встречается водород (от долей до 1,7 об.%). Газы продуктивных горизонтов отличаются друг от друга главным образом по содержанию тяжелых углеводородов (C2H6+высшие) (табл. 1, рис. 4). Их повышенное содержание связано с газами газоконденсатных и нефтегазоконденсатных залежей и находится в прямой зависимости от выхода стабильного конденсата [6].
Газы практически всех изученных залежей характеризуются преобладанием в составе (до 90-99 об. %) углеводородов метанового ряда (рис. 3). Основным компонентом, генетически наиболее близким к метану, является этан. Пропан, бутан и более тяжелые гомологи характерны для газоконденсатных, нефтегазоконденсатных и нефтяных залежей. В газах отсутствует сероводород, в малых количествах содержатся азот (0,1-3,0 об.%), за исключением ряда залежей на Салмановском (Утреннем), Среднеямальском, Нейтинском, Хамбатейском и ряде других месторождений, где его концентрации достигают 7-15 об.%. Содержания углекислого газа не превышают 13 об.%, составляя в среднем 0,6 об.%. Количество гелия и аргона, в среднем, составляют 0,01 и 0,026 об.% соответственно. Иногда встречается водород (от долей до 1,7 об.%). Газы продуктивных горизонтов отличаются друг от друга главным образом по содержанию тяжелых углеводородов (C2H6+высшие) (табл. 1, рис. 4). Их повышенное содержание связано с газами газоконденсатных и нефтегазоконденсатных залежей и находится в прямой зависимости от выхода стабильного конденсата [6]. Рассмотрим подробнее особенности геохимии газов залежей в зависимости от их фазового типа.
Рассмотрим подробнее особенности геохимии газов залежей в зависимости от их фазового типа.
РИС. 3. Диаграммы общего состава газов и состава тяжелой углеводородной фракции свободных газов
залежей арктического сектора Западной Сибири.
Условные обозначения см на рис. 2.
РИС. 4. Средний состав газов залежей УВ арктического сектора Западной Сибири.
Таблица 1. Средний состав газов в зависимости от фазового типа УВ залежи и НГК.
|
НГК
|
N2
|
CO2
|
H2
|
He
|
Ar
|
CH4
|
C2H6
|
C3H8
|
iC4H10
|
nC4H10
|
iC5H12
|
nC5H12
|
iC6H14
|
nC6H14
|
Ʃ (ТУ)
|
рВ
|
|
Газовые залежи (Г)
| ||||||||||||||||
|
I
|
1,79
|
0,44
|
0,03
|
0,008
|
0,025
|
96,5
|
1,00
|
0,13
|
0,08
|
0,06
|
0,03
|
0,0189
|
0,007
|
0,002
|
1,12
|
0,56
|
|
II
|
1,82
|
0,52
|
0,11
|
0,016
|
0,032
|
94,6
|
2,02
|
0,33
|
0,14
|
0,11
|
0,05
|
0,0279
|
0,030
|
0,004
|
2,54
|
0,60
|
|
III
|
2,35
|
0,43
|
0,18
|
0,013
|
0,026
|
96,6
|
0,46
|
0,02
|
0,00
|
0,00
|
—
|
—
|
—
|
—
|
0,48
|
0,57
|
|
IV
|
2,24
|
0,73
|
0,13
|
0,017
|
0,034
|
95,5
|
1,33
|
0,19
|
0,04
|
0,01
|
0,00
|
0,0001
|
—
|
—
|
1,55
|
0,58
|
|
Газоконденсатные залежи (ГК)
| ||||||||||||||||
|
I
|
1,28
|
0,80
|
0,02
|
0,008
|
0,014
|
90,4
|
5,20
|
1,12
|
0,51
|
0,31
|
0,19
|
0,0951
|
0,090
|
0,017
|
7,48
|
0,63
|
|
II
|
1,38
|
0,48
|
0,04
|
0,007
|
0,029
|
89,0
|
5,53
|
2,17
|
0,53
|
0,54
|
0,19
|
0,1235
|
0,060
|
0,031
|
9,13
|
0,64
|
|
III
|
2,81
|
0,47
|
0,04
|
0,014
|
0,053
|
85,3
|
6,89
|
3,13
|
0,49
|
0,55
|
0,17
|
0,1302
|
0,036
|
0,008
|
11,41
|
0,67
|
|
IV
|
2,01
|
0,44
|
0,19
|
0,008
|
0,044
|
88,8
|
5,70
|
2,28
|
0,39
|
0,57
|
0,15
|
0,1041
|
0,017
|
0,010
|
8,78
|
0,66
|
|
Нефтегазоконденсатные залежи (НГК)
| ||||||||||||||||
|
I
|
0,31
|
1,03
|
0,00
|
0,006
|
0,004
|
75,9
|
13,53
|
4,54
|
2,13
|
1,10
|
0,85
|
0,4658
|
0,428
|
0,222
|
23,15
|
0,76
|
|
II
|
1,03
|
0,49
|
0,08
|
0,007
|
0,020
|
77,2
|
10,39
|
6,42
|
1,53
|
1,81
|
0,59
|
0,3964
|
0,153
|
0,063
|
21,33
|
0,78
|
|
III
|
1,39
|
0,59
|
0,11
|
0,011
|
0,025
|
75,4
|
11,11
|
7,67
|
1,27
|
1,67
|
0,44
|
0,3114
|
0,082
|
0,037
|
22,60
|
0,79
|
|
IV
|
2,73
|
0,42
|
0,18
|
0,007
|
0,023
|
72,8
|
13,00
|
7,11
|
1,05
|
1,78
|
0,45
|
0,3452
|
0,073
|
0,040
|
23,84
|
0,77
|
|
Нефтяные залежи (Н)
| ||||||||||||||||
|
I
|
3,49
|
0,62
|
—
|
—
|
—
|
39,3
|
25,77
|
8,24
|
16,70
|
3,93
|
2,13
|
0,5812
|
0,253
|
0,081
|
57,68
|
1,16
|
|
II
|
0,50
|
0,42
|
0,02
|
0,003
|
0,016
|
40,7
|
14,91
|
18,08
|
10,74
|
9,75
|
3,27
|
1,4730
|
0,500
|
0,187
|
58,89
|
1,25
|
|
III
|
0,37
|
0,60
|
0,02
|
0,003
|
0,027
|
50,4
|
16,86
|
18,93
|
4,20
|
6,01
|
1,39
|
0,9125
|
0,220
|
0,098
|
48,63
|
1,07
|
|
IV
|
5,40
|
0,22
|
0,54
|
0,008
|
0,046
|
60,1
|
14,84
|
12,07
|
1,87
|
3,46
|
0,70
|
0,7090
|
0,127
|
0,064
|
33,84
|
0,86
|
Газовые залежи имеют состав С1 > N2 > C2 > CO2 > C3 > H2 > i-C4 > n-C4 > Ar > i-C5 > He > n-C5 > i-C6 > n-C6 и характеризуются средними содержаниями углеводородных компонентов (об. %): метана 94,6-96,6; этана 0,46-2,02; пропана 0,02-0,33; изобутана от следовых до 0,14; бутана от следовых до 0,11; изопентана от следовых до 0,05; пентана от следовых до 0,03; изогексана от следовых до 0,03; гексана в следовых количествах. Неуглеводородные компоненты составляют (об.%): азот 1,79-2,35; углекислый газ 0,43-0,73; водород 0,03-0,18; гелий от следовых до 0,017 и аргон 0,025-0,034. Сумма гомологов метана (ƩТУ) варьирует от следовых до 5 об.%, отношение С2/С3
%): метана 94,6-96,6; этана 0,46-2,02; пропана 0,02-0,33; изобутана от следовых до 0,14; бутана от следовых до 0,11; изопентана от следовых до 0,05; пентана от следовых до 0,03; изогексана от следовых до 0,03; гексана в следовых количествах. Неуглеводородные компоненты составляют (об.%): азот 1,79-2,35; углекислый газ 0,43-0,73; водород 0,03-0,18; гелий от следовых до 0,017 и аргон 0,025-0,034. Сумма гомологов метана (ƩТУ) варьирует от следовых до 5 об.%, отношение С2/С3
составляет от 2 до 160, коэффициент этанизации Кэ = 100∙С2/(С3+ С4) изменяется от 200 до 3000 и более, а коэффициент жирности Кж
= С2+высшие/С1 от 0,1 до 5,5. Для примера, в газе залежи пласта БП61 Западно-Таркосалинского месторождения ƩТУ = 4,99 об.%, С2/С3 = 3,75, Кэ = 286,8 и Кж
= 5,5. Установлено, что в наибольшей степени обогащены гомологами метана газы неокомских залежей, и в меньшей степени – верхнеюрских.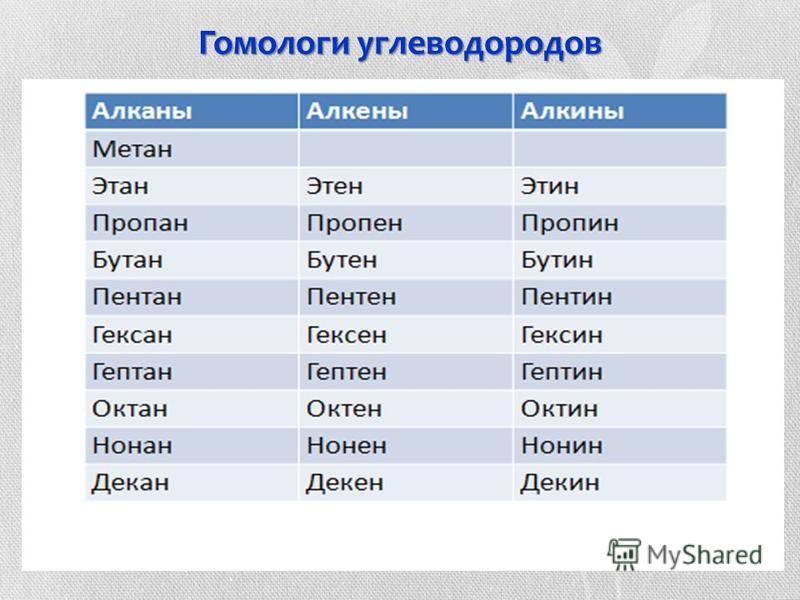
Газоконденсатные залежи имеют состав С1 > C2 > C3 > N2 > CO2 > n-C4 > i-C4 > i-C5 > n-C5 > H2 > i-C6 > Ar > n-C6 > He и отличаются более высокими средними содержаниями углеводородных компонентов (об.%): метана 85,3-90,4; этана 5,20-6,89; пропана 1,12-3,13; изобутана 0,39-0,53; бутана 0,31-0,57; изопентана 0,15-0,19; пентана 0,09-0,13; изогексана 0,02-0,09; гексана 0,01-0,03. Неуглеводородные компоненты составляют (об.%): азот 1,28-2,81; углекислый газ 0,44-0,80; водород 0,02-0,19; гелий от следовых до 0,01 и аргон 0,014-0,053. ƩТУ изменяется от 5 до 15 об.%, отношение С2/С3
составляет от 1 до 15, Кэ изменяется от 50 до 300, а Кж
от 5,4 до 18,2. Например, в газе залежи пласта БП8 Северо-Губкинского месторождения ƩТУ = 8,04-13,55 об. %; С2/С3 = 6,8-8,0; Кэ
%; С2/С3 = 6,8-8,0; Кэ
= 288,2-317,4 и Кж = 9,0-15,9. В целом, средние характеристики состава газоконденсатных залежей слабо изменяются по юрско-меловому разрезу.
Нефтегазоконденсатные залежи имеют состав С1 > C2 > C3 > n-C4 > i-C4 > N2 > CO2 > i-C5 > n-C5 > i-C6 > H2 > n-C6 > Ar > He и характеризуются еще более высокими средними содержаниями углеводородных компонентов (об.%): метана 72,8-77,2; этана 10,39-13,53; пропана 4,54-7,67; изобутана 1,05-2,13; бутана 1,10-1,81; изопентана 0,44-0,85; пентана 0,31-0,47; изогексана 0,07-0,43; гексана 0,04-0,22. Неуглеводородные компоненты представлены (об.%): азотом 0,31-2,73; углекислым газом 0,42-1,03; водородом от следовых до 0,18; гелием от следовых до 0,01 и аргоном от следовых до 0,025. В нефтегазоконденсатных залежах и залежах газовых шапок ƩТУ составляет 10-30 об.%, отношение С2/С3
составляет от 0,6 до 7, Кэ изменяется от 20 до 330, а Кж
от 15,0 до 45,9. К примеру, нефтегазоконденсатная залежь пласта БП11
Тарасовского месторождения характеризуется значениями ƩТУ = 20,78 об.%; С2/С3
= 1,18; Кэ = 79,0 и Кж = 26,6. На общем фоне залежи апт-альб-сеноманского нефтегазоносного комплекса имеют несколько более легкий состав гомологов метана.
Нефтяные залежи по составу растворенных газов представлены С1 > C2 > C3 > i-C4 > n-C4 > N2 > H2 > i-C5 > n-C5 > CO2 > i-C6 > n-C6 > Ar > He и отличаются наиболее высокими концентрациями гомологов метана и характеризуются средними содержаниями (об.%): метана 39,3-60,1; этана 14,84-25,77; пропана 8,24-18,93; изобутана 1,87-16,70; бутана 3,46-9,75; изопентана 0,70-3,27; пентана 0,58-1,47; изогексана 0,12-0,50; гексана 0,06-0,19. Неуглеводородные компоненты представлены (об.%): азотом 0,37-5,40; углекислым газом 0,22-0,62; водородом 0,02-0,54; гелием в следовых количествах и аргоном от 0,02 до 0,05. В нефтяных залежах ƩТУ составляет 30-95 об.%, отношение С2/С3 составляет от 0,1 до 5, Кэ изменяется от 5 до 120, а Кж от 43 до 600. Так, растворенные газы нефтяной залежи пласта БП16 Восточно-Таркосалинского месторождения характеризуются значениями ƩТУ = 31,97-42,84 об.%; С2/С3
= 1,01-2,25; Кэ = 67-96 и Кж = 47-75. Наиболее тяжелым составом растворенных газов характеризуют нефтяные залежи неокомского комплекса.
Зональность состава газовых залежей
Как видно из таблицы 1, при практически одинаковых концентрациях неуглеводородных компонентов и доминировании в составе газовых залежей основных НГК метана, наибольшие различия выявлены в распределении его гомологов. Максимальные их содержания установлены в газах неокомского, а наименьшие в залежах верхнеюрского НГК. Так, средние концентрации в газах апт-альб-сеноманского НГК ниже, чем в неокомском: по этану в 2,03 раза; пропану – 2,58; бутану (изомерной и нормальной форме) от 1,71 до 1,89, пентану (изомерной и нормальной форме) от 1,47 до 1,54 и гексану (изомерной и нормальной форме) от 2,09 до 4,34 раз. Газы апт-альб-сеноманских отложений отличаются также наиболее низкими концентрациями водорода, гелия и аргона по сравнению с ниже залегающими НГК.
Установленные выше особенности наиболее ярко проявляются на картах, отражающих особенности геохимии газовых залежей (рис. 5). Так, содержание стабильного конденсата достигает максимальных значений в газовых залежах юрских НГК, составляя до 400 г/м3
и более. Высококонденсатные газы распространены в южных районах изучаемого региона. При этом в апт-альб-сеноманском НГК газы с содержанием конденсата более 85 г/м3
ограничены группой Тамбейских месторождений на севере и Пякяхинским месторождением на юго-востоке (рис. 5а). Отмеченная ранее связь содержаний ТУ с конденсатностью газов хорошо видна на примере неокомских и юрских НГК (рис. 5б-в). Например, в неокомском НГК область с высоким (более 350 г/м3) содержанием стабильного конденсата трассируется изолинией ƩТУ = 15 об.%. Подобная аномалия выявлена и в пределах юрских НГК в юго-восточной области территории картопостроения. Закартированы области распространения газов с повышенным содержанием в составе доли неуглеводородных компонентов: азота свыше 2,5 об.% и углекислого газа более 1 об.%. Как правило, эти зоны взаимосвязаны.
РИС.
5. Карты средних содержаний стабильного конденсата, тяжелых углеводородов,
азота и углекислого газа в газовых залежах апт-альб-сеноманского (а),
неокомского (б) и юрских комплексов (в).
Содержание
газов: 1 – ƩТУ; 2 – азота; 3 – углекислого газа.
Резюмируя вышесказанное, можно сделать следующие выводы:
1) Промышленная газоносность арктического сектора Западной Сибири связана с широким стратиграфическим интервалом: от газ-салинской пачки (турон-нижний коньяк) верхнего мела до верхней части палеозойского фундамента. Основные запасы газа сконцентрированы на глубинах 1000-1500 м.
2) Термобарические условия залежей УВ исследуемого района характеризуются пластовыми температурами от 18 до 160 оС и давлениями от 5 до 37 МПа. Среднее содержание стабильного конденсата в рассматриваемых месторождениях закономерно увеличивается с ростом пластовых температур и давлений от 45,9 г/м3
в залежах апт-альб-сеноманского комплекса до 209,7 г/м3 в залежах юрского возраста. Аномальными значениями (более 500 г/м3) характеризуются отдельные неокомские и юрские залежи.
3) Газы практически всех изученных залежей УВ характеризуются преобладанием в составе (до 90-99 об. %) углеводородов метанового ряда. Основным компонентом, генетически наиболее близким к метану, является этан. Пропан, бутан и более тяжелые гомологи характерны для газоконденсатных, нефтегазоконденсатных и нефтяных залежей. Газовые залежи имеют состав С1 > N2 > C2 > CO2 > C3 > H2 > i-C4 > n-C4 > Ar > i-C5 > He > n-C5 > i-C6 > n-C6; газоконденсатные – С1 > C2 > C3 > N2 > CO2 > n-C4 > i-C4 > i-C5 > n-C5 > H2 > i-C6 > Ar > n-C6 > He; нефтегазоконденсатные – С1 > C2 > C3 > n-C4 > i-C4 > N2 > CO2 > i-C5 > n-C5 > i-C6 > H2 > n-C6 > Ar > He и нефтяные (растворенные газы) – С1 > C2 > C3 > i-C4 > n-C4 > N2 > H2 > i-C5 > n-C5 > CO2 > i-C6 > n-C6 > Ar > He.
Исследования проводились при финансовой поддержке проектов ФНИ № 0331-2019-0017, 0331-2019-0025; РФФИ в рамках научного проекта № 18-05-70074 «Ресурсы Арктики»; РФФИ и Правительства Ямало-Ненецкого автономного округа в рамках научного проекта № 19-45-890005.
Литература:
-
Конторович В.А., Конторович А.Э. Геологическое строение и перспективы нефтегазоносности шельфа Карского моря // Доклады РАН. 2019. Т. 489. № 3. С. 272-276. -
Конторович А.Э. Пути освоения ресурсов нефти и газа Российского сектора Арктики // Вестник РАН. 2015. Т. 85. № 5-6. С. 420-430. -
Эдер Л.В., Филимонова И.В., Комарова А.В., Немов В.Ю., Шумилова С.И. Экспорт газа из России: структура и динамика поставок // Газовая промышленность. 2019. № 1(779). С. 86-92. -
Конторович А.Э., Эпов М.И., Бурштейн Л.М., Каминский В.Д., Курчиков А.Р., Малышев Н.А., Прищепа О.М., Сафронов А.Ф., Ступакова А.В., Супруненко О.И. Геология, ресурсы углеводородов шельфов арктических морей России и перспективы их освоения // Геология и геофизика. 2010. Т. 51. № 1. С. 7-17. -
Брехунцов А.М., Монастырев Б.В., Нестеров (мл.) И.И. Закономерности размещения залежей нефти и газа Западной Сибири // Геология и геофизика. 2011. Т. 52. № 8. С. 1001-1012. -
Новиков Д.А., Дульцев Ф.Ф., Черных А.В., Фурсенко Е.А. Особенности состава газовых залежей северных и арктических районов Западной Сибири [Электронный ресурс]// Добыча, подготовка, транспорт нефти и газа: VIII Всероссийская научно-практическая конференция с международным участием, посвященная 50-летию основания ИХН СО РАН (г. Томск, 1-3 октября 2019 г.). 2019. С. 717. -
Новиков Д.А. Роль элизионного водообмена в формировании гидродинамического поля Ямало-Карской депрессии // Литология и полезные ископаемые. 2019. № 3. С. 248-261. -
Шварцев С.Л., Новиков Д.А. Природа вертикальной гидрогеохимической зональности нефтегазоносных отложений (на примере Надым-Тазовского междуречья, Западная Сибирь) // Геология и геофизика. 2004. Т. 45. № 8. С. 1008-1020. -
Novikov D.A. Hydrogeochemistry of the Arctic areas of Siberian petroleum basins // Petroleum Exploration and Development. 2017. V. 44. № 5. р. 780-788. -
Ермаков В.И., Зорькин Л.М., Скоробогатов В.А., Старосельский В.И. Геология и геохимия природных горючих газов. М.: Недра. 1990. 315 с.
Key words: gas geochemistry, phase composition, hydrocarbon pool, Western Siberia, Arctic
Марка | Производи- | Давление | Частота | Привод | Габариты | Масса | Область | ||
началь- | конеч- | тип | мощ-ть, | ||||||
4ГЦ2-184/13,5-76 УХЛ4 | 190 | 1,32 | 7,45 | 10363 | ЭД | 12000 | 2,25х1,41х1,63* | 14050 | Газопереработка |
4ГЦ2-124/14-79 ГТУ | 124 | 1,36 | 7,69 | 8059 | ГТУ (АИ-336-2-8) | 8000 | 21,80х20,40х33,00 | 240000 | Газопереработка |
4ГЦ2-130/6-65 | 130 | 0,56 | 6,48 | 8796 | ЭД | 6300 | 9,23х7,10х5,89 | 75450 | Газопереработка. Установка стабилизации жидких углеводородов |
4ГЦ2-70/17-62 ГТУ УХЛ1 | 70 | 1,7 | 6,17 | 8478 | ГТ (ГТУ-6ПГ) | 6000 | 29,00х21,00х20,00 | 220000 | Газопереработка. Утилизация ПНГ |
3ГЦ2-112/5-23-К.У1 | 112 | 0,5 | 2,3 | 13116 | ЭД | 3150 | 10,70х8,45х5,70 | 46700 | Тепловая энергетика. Сжатие и подача газа в камеры сгорания газотурбинной установки энергоблока |
3ГЦ2-123/4-25 УХЛ4 | 123 | 0,4 | 2,45 | 14674 | ЭД | 3150 | 7,70х7,80х4,50 | 39500 | Тепловая энергетика. Сжатие и подача газа в газотурбинную установку энергоблоков |
4ГЦ2-87/5-35-К.У1 | 87 | 0,5 | 3,5 | 10541 | ЭД | 3150 | 11,00х8,50х6,00 | 90000 | Тепловая энергетика. Сжатие и подача газа в газовую турбину, входящую в состав парогазового блока |
42ГЦ2-275/1,9-18 УХЛ4 | 275 | 0,18 | 1,79 | 9268/ | ЭД | 3150 | 9,75х2,86х4,06 | 41000 | Нефтепереработка. |
3ГЦ2-84/11-26-К.У1 | 84 | 1,0÷1,2 | 2,5 | 13006 | ЭД | 2500 | 9,50х7,50х4,50** | 75000 | Тепловая энергетика. Сжатие и подача газа в газовую турбину, входящую в состав парогазовой установки |
32ГЦ2-52/2-29 М3.1 | 52 | 0,2 | 2,84 | 14107 | ЭД | 2500 | 10,50х4,50х3,50 | 56000 | Морские нефтегазодобывающие платформы. Сжатие и подача газа в газовую турбину |
22ЦКО-42/8-38М1 | 42 | 0,8 | 3,8 | 16800 | ЭД | 2000 | 12,00х5,70х6,18 | 43000 | Химическая промышленность. Установки синтеза аммиака |
3ГЦ2-46/6-35 М3.1 | 46 | 0,6 | 3,43 | 13911 | ЭД | 2000 | 7,30х3,65х3,17 | 27000 | Морские нефтегазодобывающие платформы |
3ГЦ1-160/15 | 160 | 0,10 | 1,5 | 13054 | ЭД | 1600 | 6,50х5,20х3,50 | 21000 | Нефтехимия. Установки каталитического крекинга |
3ГЦ2-40/9,7-29-К.У1 | 40 | 0,95 | 2,9 | 12136 | ЭД | 1600 | 9,50х7,50х4,50** | 60000 | Тепловая энергетика. Сжатие и подача газа в газовую турбину, входящую в состав энергоблока |
3ГЦ2-38/9,5-28 К.У1 | 37 | 0,93 | 2,74 | 11544 | ЭД | 1600 | 12,00х9,00х4,50 | 6000 | Тепловая энергетика. Сжатие и подача газа в камеры сгорания газотурбинной установки |
5ГЦ2-310/0,66-5 М3.1 | 310 | 0,06 | 0,5 | 7415 | ЭД | 1600 | 10,50х3,50х4,00 | 41000 | Нефтепереработка. Морские нефтегазодобывающие платформы |
2ГЦ2-23/21-37 УХЛ4 | 23 | 2,06 | 3,63 | 13902 | ЭД | 1250 | 6,00х2,50х2,50 | 19000 | Нефтепереработка. Установки гидрокрекинга |
2ГЦ2-14/25-40 УХЛ4 | 14 | 2,32 | 3,92 | 13165 | ЭД | 800 | 5,23х2,41х2,00 | 20000 | Нефтехимия. Установки каталитического крекинга |
Декарбонизация: тем ли мы путем идем? — Энергетика и промышленность России — № 3-4 (407-408) февраль 2021 года — WWW.EPRUSSIA.RU
Газета «Энергетика и промышленность России» | № 3-4 (407-408) февраль 2021 года
Переход к водородной энергетике обосновывается необходимостью снижения выбросов в атмосферу углекислого газа. Этот процесс называется декарбонизацией.
Известно, что увеличение концентрации углекислого газа в атмосфере Земли приводит к повышению средней температуры воздуха, то есть «глобальному потеплению».
Для стимулирования процесса декарбонизации Европейский Союз планирует принять так называемый «углеродный налог» на все импортируемые товары.
В июле прошлого года аналитики компании KPMG подсчитали вероятные потери российских экспортеров в случае введения сбора. При худшем сценарии он появится уже в 2022 году и коснется как прямых, так и косвенных выбросов. Тогда поставщики заплатят 50,6 млрд евро до 2030 года. При базовом сценарии налог введут в 2025 году и распространят только на прямые выбросы, это обойдется российским экспортерам в 33,3 млрд евро. Самый позитивный сценарий предполагает появление налога в 2028 году, в таком случае производители заплатят 6 млрд долларов.
При развитии водородной энергетики будут снижаться выбросы в атмосферу углекислого газа и увеличиваться выбросы водяного пара, поскольку в процессе реакции водорода и кислорода выделяется энергия и водяной пар.
Считается, что водяной пар безвреден для человека и окружающей среды.
Есть ли связь между водяным паром и парниковым эффектом?
Чем выше температура воздуха, тем большее количество водяного пара может содержаться в воздухе.
Влияет ли водяной пар, растворенный в воздухе, на климат и если влияет, то можно ли сравнить его влияние с влиянием углекислого газа?
Сжигание природного газа
Природный газ состоит из смеси предельных углеводородов, таких, как метан (СН4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10), пентан (С5Н12) и гексан (С6Н14), а также незначительного количества инертных газов.
Характеристики природного газа, такие, как плотность и теплота сгорания, с большой точностью могут быть определены с помощью характеристик первых четырех гомологов. Общая формула реакции предельных углеводородов с кислородом имеет следующий вид:
СnH(2n+2) + 0,5 (3n+1)O2 → nCO2 + (n+1) h3O,
где n — число молекул углерода и порядковый номер гомолога углеводорода.
Рассмотрим уравнения реакции горения четырех первых гомологов углеводородов С1, С2, С3 и С4, которые в атмосферных условиях находятся в газообразном состоянии.
При n=1
Ch5 + 2O2 → CO2 + 2 h3O
(т. е. 1 моль метана, соединяясь с 2 молями кислорода, образует 1 моль углекислого газа и 2 моля водяного пара).
При сжигании одного килограмма метана (СН4) выделяется 50 МДж тепловой энергии, а также 2,75 кг углекислого газа (СО2) и 2,25 кг водяного пара (Н2О), то есть выбросы водяного пара в атмосферу немного ниже, чем выбросы углекислого газа.
При n=2
C2H6 + 3,5O2 → 2CO2 + 3 h3O.
При сжигании одного килограмма этана (С2Н6) выделяется 47,8 МДж тепловой энергии, а также 2,93 кг углекислого газа (СО2) и 1,8 кг водяного пара (Н2О), то есть массовая доля водяного пара в продуктах сгорания этана меньше, чем при сжигании метана.
При n=3
C3H8 + 5O2 → 3CO2 + 4 h3O.
При n=4
C4h20 + 6,5O2 → 4CO2 + 5 h3O.
Из данных выражений видно, что при увеличении номера гомолога углеводорода для его полного окисления требуется больший объем кислорода, при этом выделяется больший объем углекислого газа и водяного пара, чем при сжигании метана. Объем выделяющегося при сжигании углеводородов СО2 пропорционален порядковому номеру гомолога, а водяного пара — n+1. При сжигании метана выделяется в два раза больше водяного пара, чем углекислого газа, а при увеличении доли «тяжелых» углеводородов в сжигаемом газе эта пропорция уменьшается.
Сжигание водорода и метана
Сравним количество выбросов в атмосферу парниковых газов при сжигании водорода и метана, который является основным компонентом природного газа.
При соединении двух молекул водорода с одной молекулой кислорода возникают две молекулы воды. Реакция соединения водорода и кислорода сопровождается выделением энергии.
2*Н2 + О2 → 2*Н2О + энергия (1)
При сжигании одного килограмма водорода (Н2) выделяется 120 МДж тепловой энергии и 9 кг водяного пара (Н2О).
При соединении одной молекулы метана с двумя молекулами кислорода возникают две молекулы воды и одна молекула углекислого газа. Реакция соединения метана и кислорода сопровождается выделением тепловой энергии.
СН4 + 2*О2 → 2*Н2О + СО2 +
тепловая энергия (2)
При сжигании одного килограмма метана (СН4) выделяется 50 МДж тепловой энергии, а также 2,75 кг углекислого газа (СО2) и 2,25 кг водяного пара (Н2О), то есть 5 кг парниковых газов.
Для получения 120 МДж тепловой энергии потребуется сжечь 2,4 кг метана. При этом в атмосферу попадет 6,6 кг углекислого газа и 5,4 кг водяного пара, то есть 12 кг парниковых газов.
Данные приведенных выше расчетов приведены в таблице 1.
Примечание: Учитывается только низшая теплота сгорания водорода и метана.
Из данного расчета видно, что при получении одинакового количества энергии суммарные выбросы парниковых газов при сжигании метана на 30% выше, чем при сжигании водорода.
При этом выбросы водяного пара при сжигании природного газа на 40% ниже, чем при сжигании водорода.
Из публикации Lindzen (1996) видно, что влияние водяных паров на парниковый эффект в 2,3 раза выше, чем влияние углекислого газа.
Если учесть этот факт, то парниковый эффект от сжигания 1 кг водорода будет соизмерим со сжиганием 2,4 кг метана. То есть при выделении одинакового количества энергии влияние водорода и метана на парниковый эффект соизмеримо.
Вместе с тем, по публикациям зарубежных средств массовой информации (СМИ) можно сделать вывод, что на увеличение парникового эффекта оказывает влияние только углекислый газ!
В Rick Panpaleo (2014) сообщается, что исследования, проведенные учеными из University of Miami Rosenstiel School of Marine and Atmospheric Science, подтвердили, что водяные пары в тропосфере — слой атмосферы, расположенный между поверхностью Земли и простирающийся на высоту 5–20 км — будут играть возрастающую роль в изменении климата в будущем.
Исследователи из Флориды сообщили, что увеличивающееся количество водяного пара в атмосфере вызвано человеческой деятельностью.
Если это так, то наряду с уменьшением выбросов в атмосферу углекислого газа необходимо контролировать и выбросы водяного пара.
Источники выбросов водяного пара
Как уже отмечалось выше, при использовании углеводородных газов, таких, как метан, этан, пропан и бутан, наряду с выбросами углекислого газа образуются водяные пары.
В тепловой и атомной энергетике рабочим телом, участвующим в выработке электрической и тепловой энергии, является водяной пар, для конденсации которого применяются различного типа градирни, а также прямоточное охлаждение водой из рек, озер и водохранилищ.
В 2008 году при проектировании и строительстве новых электростанций в России прямоточное охлаждение было запрещено.
Так называемые «мокрые» градирни являются источниками выбросов водяного пара в атмосферу.
Сократить выбросы водяного пара в энергетике позволяют «сухие» градирни, а также воздушные конденсационные установки (ВКУ).
Водород — топливо будущего
Как отмечалось выше, замещение природного газа водородом в качестве топлива не приводит к уменьшению парникового эффекта в случае, если пар, образующийся в результате сжигания водородсодержащего газа, не конденсировать.
Это относится и к топливным элементам, в которых электрическая энергия вырабатывается электрохимическим способом, поскольку на выходе из топливного элемента наряду с электрической энергией образуется водяной пар.
То есть при переходе к водородной энергетике надо стимулировать не только технологии, снижающие выбросы в атмосферу углекислого газа, но и водяного пара. И нашим ответственным лицам стоит задуматься о возможности введения ответного налога на продукцию, поставляемую в РФ, которая произведена на водородном топливе с выбросами водяного пара в атмосферу.
Гомологи метана » storinka.click
Материал параграфа поможет вам:
выяснить, что такое гомологический ряд соединений и какие углеводороды являются гомологами метана;
называть гомологи метана и составлять их формулы;
узнать о физических свойствах метана и его гомологов.
Формулы соединений. В предыдущем параграфе речь шла о простейшем насыщенном углеводороде — метане СН4. Выведем формулы насыщенных углеводородов, в молекулах которых имеется два и три атома Карбона. Сначала соединим атомы Карбона черточками (простыми ковалентными связями):
Затем от каждого атома Карбона проведем столько дополнительных черточек, чтобы их у него было четыре (атом Карбона четырехвалентный):
После этого допишем к каждой черточке атом Гидрогена и получим формулы соответствующих углеводородов:
Так можно вывести структурные формулы молекул линейного строения других углеводородов с простыми ковалентными связями.
Составленные структурные формулы молекул часто записывают в сокращенном виде, с черточками только между атомами Карбона:
Углеводороды СН4, С2Н6, С3Н8 принадлежат к гомологическому ряду метана.
Гомологическим рядом называют ряд органических соединений, молекулы которых имеют подобное строение и различаются по составу на одну или несколько групп атомов СН2.
Название группы атомов СН2 — гомологическая разность. Соединения С2Н6, С3Н8 и многие другие являются гомологами метана.
Для того чтобы составить химическую формулу гомолога метана с четырьмя атомами Карбона в молекуле, достаточно добавить к формуле С3Н8 группу атомов СН2. Получаем: С3Н8СН2 => С4Н10. Эту формулу можно также вывести из формулы метана: СН4(СН2)3 => С4Н10.
Если углеводород гомологического ряда метана содержит п атомов Карбона в молекуле,
то его формула — CH4(CH2)n_i, или СЛН2п+2. Вторая формула является общей для углеводородов этого типа.
Воспользовавшись формулой СлН2л+2, составьте химические формулы гомологов метана, в молекулах которых содержится 5, 6 и 7 атомов Карбона.
Названия. Четыре простейших по составу углеводорода гомологического ряда метана имеют названия метан, этан, пропан, бутан. Названия остальных соединений этого типа происходят от иноязычных числительных (с. 21), соответствующих количеству атомов Карбона в молекулах углеводородов (табл. 2). В названиях метана и его гомологов имеется суффикс -ан.
Углеводороды гомологического ряда метана СцНгл+г
Таблица 2
Гомологи метана
Строение молекул. Вам известно, что молекула метана СН4 имеет форму тетраэдра. Выясним пространственное строение молекул других углеводородов гомологического ряда метана.
Молекула этана С2Н6 состоит из двух соединенных групп атомов СН3, каждая из которых является частью молекулы метана. Легко прийти к выводу, что все атомы в молекуле этана размещены не на плоскости, а в трехмерном пространстве (рис. 48).
В молекулах пропана, бутана (рис. 49) и других гомологов метана центры атомов Карбона находятся на ломаной, зигзагообразной, линии. Поэтому сокращенные структурные формулы молекул пропана и бутана следует изображать так:
Рис. 49.
Зигзагообразная форма карбоновой цепи в молекулах: а — пропана; б — бутана
В школьном курсе химии для упрощения используют не зигзагообразные, а линейные структурные формулы молекул углеводородов.
Физические свойства. Метан — газ, не имеющий запаха. Он легче воздуха. При охлаждении до температуры -162 ° С (при нормальном давлении) этот газ превращается в жидкость. Этан,
пропан и бутан в обычных условиях также являются газами, следующие двенадцать гомологов метана — жидкости (они имеют характерный «бензиновый» запах), а остальные — твердые вещества. Температуры плавления и кипения гомологов метана с увеличением числа атомов Карбона в молекулах возрастают.
Поскольку молекулы метана и его гомологов неполярны, эти соединения нерастворимы в воде (рис. 50), но хорошо растворяются (во многих случаях — неограниченно) в органических растворителях и друг в друге.
Физиологическое действие метана и его гомологов. Метан при длительном вдыхании вызывает отравление, которое может привести к летальному исходу. С целью обнаружения его утечки из плиты, негерметичного или поврежденного трубопровода в газовую магистраль добавляют небольшое количество веществ с очень неприятным запахом (их название — меркаптаны). Пользуясь газом в быту, необходимо чаще проветривать помещение.
Газообразные и жидкие гомологи метана негативно воздействуют на центральную нервную систему. Твердые насыщенные углеводороды нетоксичны (парафин1 используют в лечебных целях).
Это интересно
Формула
простейшего
меркаптана
1 Парафин — смесь насыщенных углеводородов с количеством атомов Карбона в молекулах от 18 до 35.
Выводы
Ряд органических соединений, молекулы которых имеют подобное строение и различаются по составу на одну или несколько групп атомов СН2, называют гомологическим рядом.
Общая формула метана и его гомологов — СпН2п+2. Названия большинства этих соединений происходят от иноязычных числительных; название каждого соединения содержит суффикс -ан.
Молекулы пропана и последующих гомологов метана имеют зигзагообразную карбоновую цепь.
Метан, этан, пропан и бутан — газы, остальные гомологи метана — жидкости или твердые вещества. Все эти соединения не растворяются в воде.
Метан, а также его газообразные и жидкие гомологи негативно влияют на организм.
152. Что такое гомологический ряд? Какие соединения называют гомологами?
153. Укажите среди приведенных формул те, которые принадлежат соединениям гомологического ряда метана: С3Н6, С5Н12, С6Н12, C7Hi6.
154. Установите последовательность углеводородов по уменьшению количества атомов Карбона в их молекулах:
а) гептан; г) пентан;
б) бутан; д) пропан.
в) гексан;
155. Изобразите электронную формулу молекулы: а) этана; б) пропана.
156. Укажите правильное окончание предложения «Отношение количества атомов Гидрогена к количеству атомов Карбона в молекулах гомологов метана с возрастанием молярной массы соединений…»:
а) уменьшается;
б) увеличивается;
в) изменяется хаотически.
157. Какова относительная молекулярная масса гомолога метана, в молекуле которого имеется 5 атомов Карбона? (Устно.)
158. В каком соединении массовая доля Карбона наибольшая — в этане, пропане или бутане? Попробуйте дать ответ, не проводя расчетов.
159. Определите количество вещества (устно):
а) в 15 г этана;
б) в 4,48 л бутана (н. у.).
160. Заполните таблицу:
161. Запишите формулу гомолога метана, в молекуле которого вдвое больше атомов Гидрогена, чем в молекуле бутана.
162. Какой углеводород имееттакую же плотность, что и углекислый газ?
г
ДЛЯ ЛЮБОЗНАТЕЛЬНЫХ
Два бутана, три пентана…
Для молекулы С4Н10 можно предложить не только «линейную» карбоновую цепь
но и разветвленную:
Соответствующие структурные формулы и их сокращенные варианты имеют такой вид:
Каждая формула отвечает определенной молекуле. Поэтому должны существовать два соединения с одинаковыми химическими формулами С4Н10, но с молекулами разного строения — нераз-ветвленного и разветвленного. Эти углеводороды известны и хорошо изучены.
Соединения, молекулы которых имеют одинаковый состав, но разное строение, называют изомерами.
С увеличением числа атомов Карбона в молекулах углеводородов количество изомеров резко возрастает. Одну и ту же формулу
С4Н10 имеют два углеводорода, С5Н12 — три, С6Н14 — пять, С7Н16 — девять и т. д.
Существование изомеров — одна из причин разнообразия и многочисленности органических соединений.
Если молекула углеводорода имеет неразветвленное («нормальное») строение, то перед его названием записывают букву н и дефис. Например, соединение с формулой СНз-СН2-СН2-СНз называют н-бутаном. Изомер с формулой
получил название «изобутан».
Это материал учебника Химия 9 класс Попель, Крикля
Откуда взялся природный газ. Две теории газа.
Многие ли в наше время могут сразу дать определение природному газу? Знают ли его историю и химический состав? Очевидно нет, ведь в Google найдется все.
Итак.
Природный газ — смесь углеводородов, представляющая собой нечто эфемерное, то, что нельзя потрогать, увидеть и без запаха. Основу природного газа составляет метан (Ch5) — простейший углеводород (органическое соединение, состоящее из атомов углерода и водорода). Обычно в его состав также входят более тяжелые углеводороды, гомологи метана: этан (C2H6), пропан (C3H8), бутан (C4h20) и некоторые неуглеводородные примеси.
В поисках истины.
Ученые до сих пор не могут прийти к единому мнению относительно происхождения природного газа, и своем споре разбились на два лагеря, пытаясь доказать возникновение газа, предложили две основные теории.
Минеральная теория
Согласно этой теории все химические элементы, из которых состоит природный газ и нефть изначально заложены в мантии Земли, представляя собой залежи полезных ископаемых. находясь глубоко в пластах горных пород являются частью процесса дегазации Земли. Из-за внутренних движений Земли углеводороды, находящиеся на больших глубинах поднимаются ближе к поверхности, туда, где образуется наименьшее давление, таким образом, в результате появляются нефтяные и газовые залежи.
Биогенная теория.
Приверженцы этой теории считают, что природный газ образовался из остатков растительных и животных организмов, вымерших в конце палеозойской эры, которые под действием бактерий, высокого давления и температуры превратились в смесь газообразных углеродов. Именно биохимические процессы и обеспечили химический коктейль природного газа: 80-98% метана, 2-3% его ближайших гомологов – этана, пропана, бутана, пентана, а также небольшое количество примесей – сероводорода, углекислого газа, азота.
Газ видишь? Нет. А он есть.
Большинство людей, далеких от газовой отрасли, представляют, что газ, находящийся под землей подобен ценным ископаемым, занимает собой некие пустоты в недрах земли, и легко полностью извлекается. Но это не совсем верно. Природный газ действительно находится глубоко под землей, внутри горных пород, имеющих пористую структуру, но поры на столько микроскопические, что их невооружённым глазом разглядеть почти нереально. Поэтому, взяв в руки извлеченный из недр земли небольшой кусок песчаника, сложно осознать, что внутри заключен природный газ.
Священный огонь.
Древний зороастрийский храм Атешгях
У многих народов огонь вызывал благоговейный трепет. Люди поклонялись огню, огонь любили, огонь ненавидели.
Человечество знает о существовании природного газа давно. И, хотя уже в IV веке до н. э. в Китае его научились использовать для отопления и освещения, долгое время яркое пламя, не оставляющее пепла, являлось предметом мистического и религиозного культа для некоторых народов. Например, на Апшеронском полуострове (современная территория Азербайджана) в VII веке был воздвигнут храм огнепоклонников Атешгях, почитаемый в разное время зороастрийцами, индуистами и сикхами. Храм возник на месте «вечных» неугасимых огней — горящих выходов естественного газа, благодаря чему храм и носит название «Атешгях», что означает «Дом огня». Служения в нем проходили вплоть до XIX века. Однако, сами зороастрийцы говорят, что они не поклоняются огню как таковому, а почитают Творца (Q’rt’), символом которого является огонь.
Добыть и использовать.
«Человечеству всего около 200 тыс. лет. А добыча газа началась только в прошлом веке»
Человек всегда и везде ищет выгоду. Вот и персидский царь в I веке н.э., увидев огонь, горевший и день и ночь, не требующий дополнительного топлива приказал построить дворцовую кухню на месте где газ выходил на поверхность. Природный газ впервые применили в 1821 году в городе Фредония, штат Нью-Йорк.
На заметку: Общая протяженность газопроводов в России в два раза больше, чем расстояние от Земли до Луны или в 20 раз больше, чем протяженность экватора.
file = cangas_8.ans
Таблица CANGAS_8081_PGS снова представляет собой комбинацию двух таблиц PGS. Этот
таблица содержит данные химического состава, а также стабильный углерод
изотопные данные для соединений метана и CO2 в верхней части
консервированных образцов (химический анализ консервированного газа).
Таблица CANGAS_8081_PGS Определения столбцов
Количество записей: 75
# Имя поля Тип данных Длина поля
1 Текст ВМО 20
2 RC_G080 Текст 7
3 LC_G080 Текст 4
4 DO_G080 Текст 6
5 Номер AIR (двойной) 8
6 МЕТАН Число (двойное) 8
7 Число CO2 (двойное) 8
8 ЭТАНОВЫЙ Число (Двойное) 8
9 h3S Число (Двойное) 8
10 ПРОПАН Число (двойное) 8
11 ИБУТАН Число (двойное) 8
12 НБУТАНОВОЕ число (двойное) 8
13 IPENTANE Число (двойное) 8
14 NPENTANE Число (двойное) 8
15 ГЕКСАНОВ Число (двойное) 8
16 RC_G081 Текст 7
17 LC_G081 Текст 4
18 DO_R081 Текст 6
19 13C_C1 Текст 8
20 13C_CO2 Текст 8
21 КОММЕНТАРИЙ Текст 40
Описание атрибутов:
1 ВМО Измененная форма номера API.2 RC_G080 Старый код записи PGS для этого анализа.
3 LC_G080 Код, обозначающий субподрядную лабораторию, в которой
образец был проанализирован.
4 DO_G080 Предполагается, что это дата завершения анализа или
дата, когда данные были закодированы в файл.
5 AIR Молярный процент воздуха и азота в образце
6 МЕТАН Молярное процентное содержание метана в образце
7 CO2 Молярный процент углекислого газа в образце
8 ЭТАН Молярное процентное содержание этана в образце
9 h3S мол. Процентное содержание сероводорода в образце
10 ПРОПАН Молярное процентное содержание пропана в образце
11 ИБУТАН Молярное процентное содержание изобутана в образце
12 НБУТАН Молярное процентное содержание нормального бутана в образце
13 IPENTANE Мол. Процентное содержание изопентана в образце
14 НПЕНТАН Молярное процентное содержание нормального пентана в образце
15 ГЕКСАНОВ Расчетное мольное процентное содержание гексанов + в образце
16 RC_G081 Старый код записи из PGS для этого анализа
17 LC_G081 Код, обозначающий субподрядную лабораторию, в которой
образец был проанализирован
18 DO_R081 Предполагается, что это дата завершения анализа или
дата, когда данные были закодированы в файл
19 13C_C1 Стабильный изотоп углерода (13) гомолога метана как
по сравнению с международным стандартом PDB
20 13C_CO2 Стабильный изотоп углерода (13) пика двуокиси углерода как
по сравнению с международным стандартом PDB
21 КОММЕНТАРИЙ Аналитические комментарии к образцу.ПРИМЕЧАНИЕ: это
поле комментария не то же самое, что поле комментария в
COMMENTS_PGS или MASTER_PGS таблицы.
Геномный взгляд на окисление метана аэробными бактериями и анаэробными археями | Genome Biology
Ward N, Larsen O, Sakwa J, Bruseth L, Khouri H, Durkin AS, Dimitrov G, Jiang L, Scanlan D, Kang KH, et al: Геномное понимание метанотрофии: полная последовательность генома Methylococcus capsulatus (Bath).PLoS Biol. 2004, 2: e303-
PubMed
PubMed Central
Статья
Google Scholar
Kao WC, Chen YR, Yi EC, Lee H, Tian Q, Wu KM, Tsai SF, Yu SS, Chen YJ, Aebersold R, Chan SI: Количественный протеомный анализ метаболической регуляции с помощью ионов меди в Methylococcus capsulatus (Bath). J Biol Chem. 2004, 279: 51554-51560. 10.1074 / jbc.M408013200.
PubMed
CAS
Статья
Google Scholar
Халлам С.Дж., Патнэм Н., Престон С.М., Деттер Дж.К., Рохсар Д., Ричардсон П.М., Делонг Е.Ф.: Обратный метаногенез: проверка гипотезы с помощью геномики окружающей среды. Наука. 2004, 305: 1457-1462. 10.1126 / science.1100025.
PubMed
CAS
Статья
Google Scholar
Krüger M, Meyerdierks A, Glöckner FO, Amann R, Widdel F, Kube M, Reinhardt R, Kahnt J, Böcher R, Thauer RK, Shima S: заметный белок никеля в микробных матах, которые анаэробно окисляют метан. .Природа. 2003, 426: 878-881. 10.1038 / природа02207.
PubMed
Статья
Google Scholar
Lidstrom ME: Аэробные метилотрофные прокариоты. Прокариоты. Отредактировано: Stackebrandt E. 2001, Нью-Йорк: Springer-Verlag, 3
Google Scholar
Yu SS, Chen KH, Tseng MY, Wang YS, Tseng CF, Chen YJ, Huang DS, Chan SI: Производство высококачественной монооксигеназы в виде твердых частиц с высоким выходом из Methylococcus capsulatus (Ванна) с биореактор с половолоконной мембраной.J Bacteriol. 2003, 185: 5915-5924. 10.1128 / JB.185.20.5915-5924.2003.
PubMed
CAS
PubMed Central
Статья
Google Scholar
Столяр С., Костелло А.М., Пиплс Т.Л., Лидстрем М.Э .: Роль множественных копий генов в активности макрочастиц метанмонооксигеназы в метанокисляющей бактерии Methylococcus capsulatus Bath. Микробиология. 1999, 145: 1235-1244.
PubMed
CAS
Статья
Google Scholar
Столяр С., Франке М., Лидстрем М. Е.: Экспрессия отдельных копий генов метанмонооксигеназы в виде частиц Methylococcus capsulatus (Bath). J Bacteriol. 2001, 183: 1810-1812. 10.1128 / JB.183.5.1810-1812.2001.
PubMed
CAS
PubMed Central
Статья
Google Scholar
Csaki R, Bodrossy L, Klem J, Murrell JC, Kovacs KL: Гены, участвующие в медьзависимой регуляции растворимой метанмонооксигеназы Methylococcus capsulatus (Bath): клонирование, секвенирование и мутационный анализ.Микробиология. 2003, 149: 1785-1795. 10.1099 / mic.0.26061-0.
PubMed
CAS
Статья
Google Scholar
Муррелл Дж. К., Гилберт Б., Макдональд И.Р .: Молекулярная биология и регуляция метанмонооксигеназы. Arch Microbiol. 2000, 173: 325-332. 10.1007 / s002030000158.
PubMed
CAS
Статья
Google Scholar
Lipscomb JD: Биохимия растворимой метанмонооксигеназы.Annu Rev Microbiol. 1994, 48: 371-399. 10.1146 / annurev.mi.48.100194.002103.
PubMed
CAS
Статья
Google Scholar
Чан С.И., Чен К.Х., Ю С.С., Чен К.Л., Куо С.С.: К описанию структуры и функции макрочастиц метанмонооксигеназы метанотрофных бактерий. Биохимия. 2004, 43: 4421-4430. 10.1021 / bi0497603.
PubMed
CAS
Статья
Google Scholar
Валентин DL: Биогеохимия и микробная экология окисления метана в бескислородных средах: обзор. Антони Ван Левенгук. 2002, 81: 271-282. 10.1023 / А: 1020587206351.
PubMed
CAS
Статья
Google Scholar
Strous M, Jetten MSM: анаэробное окисление метана и аммония. Annu Rev Microbiol. 2004, 58: 99-117. 10.1146 / annurev.micro.58.030603.123605.
PubMed
CAS
Статья
Google Scholar
Тауер РК: Биохимия метаногенеза: дань уважения Майори Стивенсону. Микробиология. 1998, 144: 2377-2406.
PubMed
CAS
Статья
Google Scholar
Деппенмайер У: мембраносвязанная система транспорта электронов видов Methanosarcina . J Bioenerg Biomembr. 2004, 36: 55-64. 10.1023 / B: JOBB.0000019598.64642.97.
PubMed
CAS
Статья
Google Scholar
Hallam SJ, Girguis PR, Preston CM, Richardson PM, DeLong EF: Идентификация генов метил-кофермента М-редуктазы A ( mcrA ), связанных с окисляющими метан археями. Appl Environ Microbiol. 2003, 69: 5483-5491. 10.1128 / AEM.69.9.5483-5491.2003.
PubMed
CAS
PubMed Central
Статья
Google Scholar
Чистосердова Л., Чен С.В., Лапидус А., Лидстром М.Е.: Метилотрофия у Methylobacterium extorquens AM1 с геномной точки зрения.J Bacteriol. 2003, 185: 2980-2987. 10.1128 / JB.185.10.2980-2987.2003.
PubMed
CAS
PubMed Central
Статья
Google Scholar
Methylobacillus flagellatus проект генома. [http://genome.jgi-psf.org/draft_microbes/metfl/metfl.home.html]
Энтони К. Биохимия метилотрофов. 1982, Academic Press, Лондон
Google Scholar
Бакстер, штат Нью-Джерси, Хирт Р.П., Бодросси Л., Ковач К.Л., Эмбли Т.М., Проссер Д.И., Муррелл Дж.С.: Кластер гена рибулозо-1,5-бисфосфаткарбоксилазы / оксигеназы Methylococcus capsulatus (Бат). Arch Microbiol. 2002, 177: 279-289. 10.1007 / s00203-001-0387-х.
PubMed
CAS
Статья
Google Scholar
Ворхольт Ю.А., Чистосердова Л., Столяр С.М., Тауэр Р.К., Лидстром М.Е.: Распределение тетрагидрометаноптерин-зависимых ферментов у метилотрофных бактерий и филогения циклогидролаз метенилтетрагидрометаноптерина.J Bacteriol. 1999, 181: 5750-5757.
PubMed
CAS
PubMed Central
Google Scholar
Короткова Н., Чистосердова Л., Кукса В., Лидстром М.Е.: Путь регенерации глиоксилата у метилотрофа Methylobacterium extorquens AM1. J Bacteriol. 2002, 184: 1750-1758. 10.1128 / JB.184.6.1750-1758.2002.
PubMed
CAS
PubMed Central
Статья
Google Scholar
Hagemeier CH, Chistoserdova L, Lidstrom ME, Thauer RK, Vorholt JA: Характеристика второй метилентетрагидрометаноптериндегидрогеназы из Methylobacterium extorquens AM1. Eur J Biochem. 2000, 267: 3762-3769. 10.1046 / j.1432-1327.2000.01413.x.
PubMed
CAS
Статья
Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
морских сверхмалых прокариот, вероятно, влияют на круговорот углерода, метана, азота и серы | Геном, биология и эволюция
Аннотация
Недавно мы обнаружили генетические компоненты шести автотрофных путей фиксации углерода в очищенных фракциях ультрамалого размера из морских образцов (<0.22 мкм), собранных по всему миру экспедицией Tara Oceans Expedition. Это первое открытие предполагает, что прокариотические наноорганизмы, филогенетически отдаленно связанные с известными группами CPR и DPANN, могут коллективно влиять на круговорот углерода и фиксацию углерода в мировом океане. Чтобы расширить нашу добычу функциональной и таксономической микробной темной материи из фракции сверхмалого размера из экспедиции Tara Oceans Expedition, мы исследовали распределение 28 метаболических путей, связанных с круговоротом углерода, метана, азота и серы.Для всех этих путей мы сообщаем о существовании не только новых метаболических гомологов в ультрамалой фракции океанического микробиома, связанных с наноорганизмами, принадлежащими к линиям CPR и DPANN, но также и метаболических гомологов, обнаруживаемых исключительно в таксонах морских хозяев, принадлежащих к другие (еще не назначенные) микробные линии. Таким образом, мы делаем вывод, что морские наноорганизмы вносят вклад в большее разнообразие ключевых биогеохимических циклов, чем это считается в настоящее время. В частности, мы предполагаем, что океанические наноорганизмы могут участвовать в метаболической петле вокруг ацетил-КоА, обладать недооцененным генетическим потенциалом разложения метана, способствовать поддержанию окислительно-восстановительных реакций путем производства коэнзима F420 и влиять на круговорот серы, особенно поскольку они несут полный набор гомологов ферментов системы SOX.
Значение
Вклад морских микроорганизмов в биогеохимические циклы, включающие серу, азот, метан и углерод, и особенно сверхмалых океанических прокариот, привлекает все большее внимание с недавним открытием ультрамалых прокариотических таксонов, которые кодируют метаболические гены, например участвует в фиксации углерода в мировом океане. Однако масштабы этого потенциального вклада, вероятно, остаются недооцененными. Мы сообщаем о новых, массивных доказательствах того, что, помимо известных ультрамелких бактерий и архей, некультивируемые прокариоты, процветающие в океанах, принадлежащие к микробной темной материи, кодируют богатое филогенетическое разнообразие гомологов метаболических генов из путей, связанных с азотом, серой, углеродом, и метаболизм метана.Следовательно, некультивируемые океанические ультрамалые прокариоты, вероятно, участвуют в круговороте элементов гораздо больше, чем предполагалось ранее.
Круговорот стихий имеет решающее значение для поддержания жизни на Земле и подвержен влиянию микробов (Anantharaman et al., 2016; Escalas et al., 2019; Tanentzap et al., 2019; Logares et al., 2020). Соответственно, гены, участвующие в биогеохимических циклах серы, азота, углерода и метана, вызывают все больший интерес, и десятки связанных метаболических путей были задокументированы в базе данных KEGG.Поскольку гены, связанные с этими путями KEGG, в основном происходят от культивируемых организмов, разнообразие и географическое распределение таксонов, способствующих этому метаболизму в природе, вероятно, недооценивается. В частности, метаболический потенциал некультивируемых микробов, называемых микробной темной материей, все еще в значительной степени недостаточно изучен (Rinke et al. 2013; Brown et al. 2015; Castelle et al. 2015; Parks et al. 2017), особенно в фракция сверхмалого размера (менее 200 нм). Действительно, долгое время считалось, что фракция такого размера не включает какие-либо микробные клетки, а только вирусы.Недавнее открытие ультрамалых бактерий (группа CPR) и ультрамалых архей (в группе DPANN) поставило под сомнение эту точку зрения и выявило новых экологических и эволюционных игроков. Например, недавно было предложено, чтобы линии CPR и DPANN способствовали фиксации углерода (Wieder et al. 2015; Dyksma et al. 2016; Guidi et al. 2016; La Cono et al. 2018; Jaffe et al. 2019). Более того, Anantharaman et al. обнаружили присутствие ключевых ферментов, участвующих в циклах углерода, азота, серы и водорода в CPR из водоносных горизонтов (Колорадо, США), где также были обнаружены гены Rubisco типа II / III (Wrighton et al.2016). Совсем недавно наше широкомасштабное исследование содержания генов в образцах фракций ультрамалого размера морских животных подтвердило этот вывод и предположило, что филогенетически разнообразные морские ультрамалые прокариоты, в дальнейшем называемые наноорганизмами, могут играть важную роль в фиксации углерода (Lannes et al., 2019; McGrath). 2019). Здесь мы расширили наш предыдущий анализ, используя ту же методологию, что и у Lannes et al. (2019), чтобы получить предполагаемые дополнительные метаболические гомологи биогеохимических циклов серы, азота, углерода и метана.Мы использовали ферменты путей KEGG (по состоянию на октябрь 2019 г.), связанные с серой, азотом, углеродом и метаном, в качестве семян для обнаружения гомологов в наноорганизмах из 65 участков отбора проб из наборов данных метагенома TARA Oceans (Sunagawa et al.2015). Мы также проанализировали их географическое распределение и филогенетическое разнообразие, выявив метаболические гомологи, исключительные для морской среды и принадлежащие к линиям, отличным от известных клонов CPR / DPANN и отличающимся от любого из полных геномов, присутствующих в NCBI, вероятно, закодированных в геномах ультрамалой фракции. микробной темной материи.
Для этого мы использовали сортировку и дезактивацию (то есть удаление последовательностей из известных вирусов и прокариот обычного размера), реализованные Lannes et al. (2019) для общедоступных предсказанных ORF из фракции сверхмалого размера (<0,22 мкм) метагеномной базы данных TARA Oceans . Вкратце, последовательности, обнаруженные во фракции сверхмалого размера, но не исключительно во фракции этого размера, определяют «потенциально сверхмалый» (PU) набор данных, содержащий 6 119 497 последовательностей.Затем мы отфильтровали эти последовательности в два вложенных набора данных: набор данных UO (для «Только сверхмалые», 4300 092 последовательности) включает последовательности, встречающиеся исключительно в фракциях сверхмалого размера, и более строгий набор данных WUO («Широко распространенный только сверхмалый размер»). , ”1,128,306 последовательностей) содержит последовательности, обнаруженные исключительно во фракции сверхмалого размера в более чем одной точке отбора проб по всему миру. Мы также воспользовались тем фактом, что Lannes et al. дополнительно отнесли эти микробные последовательности к двум уровням микробной темной материи на основе их процента идентичности (% ID) с их лучшими совпадениями в nr (база данных NCBI), а также на основе исчерпывающей базы данных CPR / DPANN, используя DIAMOND (Buchfink et al. .2015). Мы классифицировали как «светлую темную материю» последовательности, которые показали взаимное покрытие> 80% и% ID <90% с их лучшим совпадением по nr, то есть последовательности, которые были <90% похожи на потенциальные гомологи в известных таксонах. . Сильно расходящиеся последовательности, то есть с> 80% взаимного покрытия, но <70%% ID с их лучшим попаданием в nr, были классифицированы как «темная материя». Такое различие позволило сопоставить два порога% ID, а также уравновесить риск сосредоточения внимания только на очень расходящихся последовательностях.Мы распределили как «темную материю», так и «светлую темную материю» последовательности, которые были таксономически отнесены к DPANN, CPR, неклассифицированным бактериям, неклассифицированным архее, кандидату или «корню: неназначенный», потому что эти таксоны, вероятно, соответствуют истинным ультрамалым, но тем не менее некультивируемые прокариоты.
Список терминов KEGG Orthology (KO), соответствующих 28 метаболическим путям, связанным с круговоротом метана, серы, углерода и азота (12, 3, 6, 7 путей, соответственно), был составлен с использованием базы данных KEGG (Ogata et al. .1999) (дополнительная таблица 1, дополнительные материалы онлайн). Как и у Lannes et al., Все белки, участвующие в этих путях, были извлечены с помощью инструмента картирования Uniprot (http://www.uniprot.org/mapping/) или службы KEGG API (март 2017 г.). Затем гомологи каждого из этих белков KEGG были идентифицированы в наборах данных PU, UO и WUO с использованием NCBI BLAST (версия 2.6.0) (Camacho et al. 2009) с использованием следующих критериев, которые учитывают потенциально далекие гомологи:% ID> 25%, значение E <1 e -5 и охват взаимного выравнивания> 80%.Пути KEGG состоят из ферментов, мы оценили полноту данного пути как процент необходимых ферментов, гомологи которых были обнаружены в наших наборах данных (Lannes et al.2019).
Полнота каждого метаболического пути была представлена с использованием тепловых карт для наборов данных UO (рис. 1) и WUO (рис. 2), которые содержат последовательности, связанные исключительно с фракцией ультрамалого размера океанического микробиома. Более того, мы классифицировали гомологи эталонных метаболических генов по ступеням, чтобы улучшить описание океанической генетической микробной темной материи (т.е., ген, который можно отнести к известным семействам, хотя они явно расходились с известными представителями). Идентификация гомологов в «светлой темной материи» намекает на варианты окружающей среды метаболических генов, которые в некотором смысле ближе к известным генам, что волнует, но менее удивительно, чем варианты гомологов, связанные с «темной» материей. Сопоставление этих результатов показывает изменчивость этих семейств генов в океанах. Каждая тепловая карта показывает глобальное географическое и стратиграфическое распределение 28 протестированных метаболических путей, отсортированных по их вкладу в метаболизм серы, азота, метана и углерода.Этот широкий взгляд на метаболизм, кодируемый генетическим материалом из ультрамалого океанического микробиома, показывает неоднородное распределение этих метаболизмов по участкам отбора проб как для наборов данных UO, так и для наборов данных WUO. Примечательно, что многие сайты содержат почти полные метаболические пути (полнота более 80%), которые кодируются фракцией ультрамалых микробов, тогда как другие сайты не обладают таким метаболическим потенциалом. Таким образом, в этих метаболически компетентных участках вклад наноорганизмов, по-видимому, заслуживает дальнейшего исследования для количественной оценки их фактического вклада в круговорот элементов.Кроме того, клетки в рамке и черные точки на наших тепловых картах (рис. 1 и 2) указывают на участки, в которых полнота пути у ультрамалых микробов была выше в океаническом наборе данных, чем сообщается в известных геномах CPR и DPANN. Следовательно, такие океанические участки предполагают новый, недооцененный метаболический вклад ультрамелких прокариот из окружающей среды в отношении метаболического потенциала известных линий CPR и DPANN в круговорот азота, серы, углерода и метана. Например, путь транспортной системы нитратов / нитритов и путь M00378 (биосинтез F420) представляют собой яркие примеры возможной роли генов ультрамелкой микробной темной материи, поскольку расходящиеся гомологи всех составляющих их ферментов были обнаружены в нескольких отдельных местах отбора проб.Интересно, что все участки с ≥5 путями с более полными путями в ультрамалых океанических микробах, чем в известных CPR и DPANN, находятся либо с поверхности, либо из слоя максимума глубокого хлорофилла (DCM). В частности, станция Тара 025_DCM (Черноморская провинция, слой DCM) является самой богатой по метаболическим путям, кодируемым ультрамалыми морскими прокариотами, и, таким образом, является главным кандидатом для дальнейшего геномного исследования их влияния на биогеохимический цикл.
Рис.1
Тепловая карта, показывающая общее распределение 28 метаболических путей в Мировом океане для набора данных UO. Верхние строки соответствуют объединенным наборам данных известных сверхмалых таксонов прокариот и исследуемому набору данных TARA OCEANS. Кластеризованные строки (с использованием scipy.cluster.hierarchy.linkage [метод «ward»], дендрограмма, показанная слева от тепловой карты) соответствуют участкам отбора проб в формате: Идентификатор участка отбора проб TARA (три цифры) _ глубина. Глубины: SRF (поверхность), DCM (максимум глубокого хлорофилла), MES (мезопелагический) и MIX (смешанный).Цвета меток строк представляют океанические регионы: коричневый для северной части Тихого океана, зеленый для южной части Тихого океана, фиолетовый для Южного океана, оранжевый для южной части Атлантического океана, темно-синий для Индийского океана, красный для Красного моря, розовый для Средиземного моря. Столбцы соответствуют путям KEGG, сгруппированным по биогеохимическому циклу, в который они вносят вклад (S для серы, N для азота, CH 4 для метана и C для углерода). Цвета ячеек отражают% полноты пути на каждом участке, как показано цветной полосой справа.Черные квадраты обозначают образцы морской среды, в которых полнота пути больше, чем в известном наборе данных CPR + DPANN. Синие квадраты указывают образцы, для которых путь обнаружен исключительно в океанических образцах, а не в CPR / DPANN. Черные и синие стрелки подчеркивают столбец с ячейками в рамке, а черные точки указывают соответствующие образцы. Слева направо: полнота пути в наборе данных UO для всех последовательностей, для последовательностей, отнесенных к светлой темной материи, и для последовательностей, отнесенных к темной материи.
Рис. 1
Тепловая карта, показывающая общее распределение 28 метаболических путей в Мировом океане для набора данных UO. Верхние строки соответствуют объединенным наборам данных известных сверхмалых таксонов прокариот и исследуемому набору данных TARA OCEANS. Кластеризованные строки (с использованием scipy.cluster.hierarchy.linkage [метод «ward»], дендрограмма, показанная слева от тепловой карты) соответствуют участкам отбора проб в формате: Идентификатор участка отбора проб TARA (три цифры) _ глубина. Глубины: SRF (поверхность), DCM (максимум глубокого хлорофилла), MES (мезопелагический) и MIX (смешанный).Цвета меток строк представляют океанические регионы: коричневый для северной части Тихого океана, зеленый для южной части Тихого океана, фиолетовый для Южного океана, оранжевый для южной части Атлантического океана, темно-синий для Индийского океана, красный для Красного моря, розовый для Средиземного моря. Столбцы соответствуют путям KEGG, сгруппированным по биогеохимическому циклу, в который они вносят вклад (S для серы, N для азота, CH 4 для метана и C для углерода). Цвета ячеек отражают% полноты пути на каждом участке, как показано цветной полосой справа.Черные квадраты обозначают образцы морской среды, в которых полнота пути больше, чем в известном наборе данных CPR + DPANN. Синие квадраты указывают образцы, для которых путь обнаружен исключительно в океанических образцах, а не в CPR / DPANN. Черные и синие стрелки подчеркивают столбец с ячейками в рамке, а черные точки указывают соответствующие образцы. Слева направо: полнота пути в наборе данных UO для всех последовательностей, для последовательностей, отнесенных к светлой темной материи, и для последовательностей, отнесенных к темной материи.
Рис. 2
Тепловая карта, показывающая общее распределение 28 метаболических путей в Мировом океане для набора данных WUO. Легенда такая же, как и выше. Слева направо: полнота пути в наборе данных WUO для всех последовательностей, для последовательностей, отнесенных к светлой темной материи, и для последовательностей, отнесенных к темной материи.
Рис. 2
Тепловая карта, показывающая общее распределение 28 метаболических путей в Мировом океане для набора данных WUO.Легенда такая же, как и выше. Слева направо: полнота пути в наборе данных WUO для всех последовательностей, для последовательностей, отнесенных к светлой темной материи, и для последовательностей, отнесенных к темной материи.
В целом для наборов данных UO и WUO семь метаболических путей (M00529 [денитрификация, нитрат => азот], M00595 [окисление тиосульфата комплексом SOX, тиосульфат => сульфат], M00376 [двухцикл 3-гидроксипропионата] , M00378 [биосинтез F420], M00438 [система переноса нитратов / нитритов], M00174 [окисление метана, метанотроф, метан => формальдегид], M00175 [фиксация азота, азот => аммиак]) чаще встречаются у ультрамалых океанических микробов, чем у всем известный CPR / DPANN.Интересно, что они включают три пути (M00595, M00438, M00174), которые обнаруживаются только в океанических образцах для набора данных WUO (а также в дополнительном исключительно морском пути, M00175, из набора данных UO). Таким образом, наши результаты подчеркивают новый и недооцененный метаболический потенциал организмов, захваченных в ультрамалых фракциях из мирового океана. В совокупности океанические наноорганизмы в наборах данных UO и WUO кодируют гены всех ферментов, связанных с 16 путями. Следовательно, предполагается, что океанические наноорганизмы, в том числе связанные с двумя уровнями темной материи, будут взаимодействовать с циклами S, N, CH , 4, и C.
В частности, мы восстановили гомологи для большинства известных ферментов, участвующих в фиксации углерода во фракциях сверхмалого размера и в нескольких местах (рис. 3 и 4). Это более подробное представление подтверждает вероятное участие наноорганизмов в фиксации углерода и расширяет анализ Lannes et al. (2019) к более широкому набору линий передачи CPR / DPANN. Что касается их сравнительного распределения среди наноорганизмов, гены, кодирующие шесть ферментов, участвующих в фиксации углерода в эталонных таксонах, встречаются исключительно в известных CPR / DPANN, тогда как восемь ферментов (6.4.1.1, 1.2.1.75, 1.1.1.298, 6.2.1.36, 4.2.1.116, 1.3.1.84, 4.2.1.148, 4.2.1.153) встречаются только в морских образцах. Все эти семь последних ферментов участвуют в превращении производного продукта ацетил-КоА, малонил-КоА в пропионил-КоА и в функционально связанном превращении производного пропионил-КоА, B-метилмалил-КоА, в ацетил -CoA. Такое преобладание исключительно морских ферментов, связанных с фракцией сверхмалого размера, предполагает возможную роль морских наноорганизмов в метаболической петле вокруг ацетил-КоА в океанах.
Рис. 3
Метаболизм метана и фиксация углерода Карты KEGG, описывающие распределение гомологов метаболических ферментов по образцам. Название рассматриваемых метаболизмов указано в верхнем поле. Ферменты имеют цветовую маркировку в зависимости от их распределения. Красный: присутствует в наборе данных WUO и в CPR / DPANN; голубой: отсутствует в CPR / DPANN, но присутствует в наборе данных PU; синий: отсутствует в CPR / DPANN, но присутствует в наборе данных UO; темно-синий: синий: отсутствует в CPR / DPANN, но присутствует в наборе данных WUO; Зеленый: присутствует исключительно в CPR / DPANN.
Рис. 3
Метаболизм метана и фиксация углерода Карты KEGG, описывающие распределение гомологов метаболических ферментов по образцам. Название рассматриваемых метаболизмов указано в верхнем поле. Ферменты имеют цветовую маркировку в зависимости от их распределения. Красный: присутствует в наборе данных WUO и в CPR / DPANN; голубой: отсутствует в CPR / DPANN, но присутствует в наборе данных PU; синий: отсутствует в CPR / DPANN, но присутствует в наборе данных UO; темно-синий: синий: отсутствует в CPR / DPANN, но присутствует в наборе данных WUO; Зеленый: присутствует исключительно в CPR / DPANN.
Рис. 4
Метаболизм азота и серы Карты KEGG, описывающие распределение гомологов метаболических ферментов по образцам.
Рис. 4
Метаболизм азота и серы Карты KEGG, описывающие распределение гомологов метаболических ферментов по образцам.
Наши анализы также выявили гомологи для большинства известных ферментов, связанных с метаболизмом метана. В частности, гены, кодирующие два фермента (1.14.1325, 1.14.183), катализирующие переход от метана к метанолу, были обнаружены исключительно во фракции ультрамалых морских организмов в наборах данных PU и UO соответственно.Более того, два из трех ферментов (1.1.2.7, 1.1.3.13), участвующих в переходе от метанола к формальдегиду, также были обнаружены в наборе данных WUO. В совокупности эти результаты предполагают, что морские наноорганизмы обладают недооцененным генетическим потенциалом по разложению метана. Два фермента, обнаруженные исключительно в наборах данных UO (2.7.8.28, 2.7.7.68), также участвовали в биосинтезе коэнзима F420-0, а третий фермент, также обнаруженный в наборе данных UO (1.5.98.2), катализировал переход от 5,10-Метилен THMPT в 5-Метил THM (S) PT, опосредованный коферментом F420-h3, который также высвобождает кофермент F420.Эти результаты предполагают, что морские наноорганизмы способствуют поддержанию этой формы кофермента и, следовательно, окислительно-восстановительным реакциям в океане. Следует отметить, что мы также обнаружили гомологи шести ферментов в известных CPR / DPANN, которые, по прогнозам, вносят вклад в синтез коферментов B и M. В целом, эти анализы подтверждают расширенную роль наноорганизмов в круговороте метана.
Точно так же мы сообщаем, что наноорганизмы кодируют множество ферментов, участвующих в круговороте азота. Например, гомологи ферментов, участвующих в диссимиляционном восстановлении нитратов (NarGh2, NirBD), в нитрификации (NxrAB) и денитрификации (NarGh2, NirK, NorBC), являются общими как для CPR / DPANN, так и для морских наноорганизмов.Кроме того, другие гомологи, участвующие в диссимиляции (NapAB, NrfAH) и ассимиляции (NasAB), восстановлении нитратов, денитрификации (NapAB, NirS, NosZ) и интеграции внеклеточного нитрата (NrtABCD), связаны исключительно с фракциями ультрамелких микробов в океане, и находятся на нескольких сайтах. Океанические наноорганизмы также могут влиять на метаболизм серы. Гены, кодирующие гомологи ферментов, общих для известных CPR / DPANN и морских наноорганизмов-кандидатов, были обнаружены для восстановления ассимиляционного сульфата и диссимиляционного восстановления и окисления сульфата.Кроме того, мы идентифицировали замечательно полный набор гомологов ферментов системы SOX (SoxA, SoxB, SoxC, SoxD, SoxX, SoxY, SoxZ) (Friedrich et al. 2005), обнаруженных исключительно у морских наноорганизмов в нашем наборе данных, и на нескольких сайтах.
Филогенетическое положение всех метаболических гомологов было выведено с помощью анализа максимального правдоподобия (с использованием IQ-Tree [Trifinopoulos et al. 2016], модели LG + G и 1000 сверхбыстрых бутстреп-реплик [Minh et al. 2013]) для урезанного выравнивания. (с использованием MAFFT [Katoh et al.2002] и тримАл [Capella-Gutierrez et al. 2009] с параметрами по умолчанию) этих метаболических гомологов, которые также включают эталонные последовательности из полных прокариотических геномов и из всех опубликованных геномов CPR и DPANN. Филогенетический анализ этих метаболических генов дополнительно подтвердил богатое филогенетическое разнообразие хозяев метаболических гомологов в ультрамалой фракции, помимо известных CPR / DPANN (доступно на https://itol.embl.de/shared/TeamAire, в каталоге Lannes_Cavaud_etal, последний доступ 23 декабря 2020 г.), что согласуется с нашим предыдущим исследованием (Lannes et al.2019), что можно увидеть, например, на деревьях K05884 (N), K13039 (CH 4 ) и K08691 (CH 4 ) (дополнительный рисунок 1, дополнительный материал онлайн). Более того, некоторые из экологических последовательностей, которые квалифицируются как «светлая темная материя» и как «темная материя», образовали клады в этих филогении, увеличивая описанное филогенетическое разнообразие этих метаболических ферментов и намекая на неописанные сверхмалые клоны внутри известных основных групп прокариот, которые могут принимают участие в метаболизмах N, S, C и CH 4 .
В целом, обнаружение генов, связанных с метаболизмом N, S, C и CH 4 , за исключением фракции сверхмалого размера, полученной в рамках проекта TARA Oceans , стимулирует будущие анализы генома одиночных клеток и метатранскриптомные исследования для далее охарактеризовать точные механизмы, с помощью которых эти ранее необнаруженные последовательности от наноорганизмов вносят вклад в круговорот элементов.
Дополнительные материалы
Дополнительные данные доступны на сайте Genome Biology and Evolution онлайн.
Благодарности
Мы благодарим Дж. Бернарда и К. Боулера за критические комментарии. Эта работа получила доступ к ресурсам высокопроизводительных вычислений Института вычислений и данных (ISCD) Университета Пьера и Марии Кюри. R.L., E.B. и L.C. были поддержаны грантовым соглашением FP7 / 2007-2013 № 615274.
Доступность данных
Данные, лежащие в основе этой статьи, будут переданы по разумному запросу соответствующему автору.
Цитированная литература
Анантараман
К
, и другие.
2016
.
Тысячи микробных геномов проливают свет на взаимосвязанные биогеохимические процессы в системе водоносного горизонта
.
Нац Коммуна
.
7
(
1
):
13219
.
Коричневый
CT
, и другие.
2015
.
Необычная биология в группе, включающей более 15% домена Бактерии
.
Природа
523
(
7559
):
208
—
211
.
Buchfink
B
,
Се
С
,
Huson
DH.
2015
.
Быстрое и чувствительное выравнивание белков с помощью DIAMOND
.
Нат методы
.
12
(
1
):
59
—
60
.
Камачо
C
, и другие.
2009
.
BLAST +: архитектура и приложения
.
BMC Bioinformatics
10
(
1
):
421
.
Капелла-Гутьеррес
S
,
Силла-Мартинес
JM
,
Габалдон
т.
2009
.
trimAl: инструмент для автоматической обрезки совмещения в крупномасштабных филогенетических анализах
.
Биоинформатика
25
(
15
):
1972
—
1973
.
Castelle
CJ
, и другие.
2015
.
Расширение генома домена архей подчеркивает роль организмов из новых типов в анаэробном круговороте углерода
.
Курр Биол
.
25
(
6
):
690
—
701
.
Диксма
S
, и другие.
2016
.
Вездесущие гаммапротеобактерии доминируют в фиксации темного углерода в прибрежных отложениях
.
ISME J
.
10
(
8
):
1939
—
1953
.
Escalas
A
, и другие.
2019
.
Функциональное разнообразие микробов: от концепций до приложений
.
Ecol Evol
.
9
(
20
):
12000
—
12016
.
Фридрих
CG
,
Бардыщевский
Ф
,
Ротер
D
,
Quentmeier
A
,
Fischer
J.
2005
.
Прокариотическое окисление серы
.
Curr Opin Microbiol
.
8
(
3
):
253
—
259
.
Guidi
L
, и другие.
2016
.
Планктонные сети, стимулирующие экспорт углерода в олиготрофный океан
.
Природа
532
(
7600
):
465
—
470
.
Jaffe
AL
,
Castelle
CJ
,
Dupont
CL
,
Banfield
JF.
2019
.
Боковой перенос генов формирует распределение RuBisCO среди радиационных бактерий-кандидатов филы и архей DPANN
.
Мол Биол Эвол
.
36
(
3
):
435
—
446
.
Като
К
,
Мисава
К
,
Кума
К
,
Мията
т.
2002
.
MAFFT: новый метод быстрого совмещения множественных последовательностей на основе быстрого преобразования Фурье
.
Nucleic Acids Res
.
30
(
14
):
3059
—
3066
.
Ла Коно
В
, и другие.
2018
.
Вклад ассимиляции бикарбонатов в динамику пула углерода в глубоких водах Средиземного моря и культивирование активно нитрифицирующих и фиксирующих CO 2 -фиксирующих батипелагических прокариотических консорциумов
.
Передний микробиол
.
9
:
3
.
Lannes
R
,
Olsson-Francis
K
,
Лопес
P
,
Батесте
E.
2019
.
Фиксация углерода ультрамалыми морскими прокариотами
.
Genome Biol Evol
.
11
(
4
):
1166
—
1177
.
Логарес
R
, и другие.
2020
.
Распутывание механизмов формирования микробиоты поверхности океана
.
Микробиом
8
(
1
):
55
.
МакГрат
К.
2019
.
Основные моменты: вклад сверхмалых микробов в глобальный углеродный цикл
.
Genome Biol Evol
.
11
(
5
):
1431
—
1431
.
Минь
BQ
,
Нгуен
MA
,
von Haeseler
A.
2013
.
Сверхбыстрое приближение для филогенетического бутстрапа
.
Мол Биол Эвол
.
30
(
5
):
1188
—
1195
.
Огата
H
, и другие.
1999
.
KEGG: киотская энциклопедия генов и геномов
.
Nucleic Acids Res
.
27
(
1
):
29
—
34
.
Парки
DH
, и другие.
2017
.
Восстановление почти 8000 геномов, собранных из метагеномов, существенно расширяет древо жизни
.
Нат Микробиол
.
2
(
11
):
1533
—
1542
.
Ринке
C
, и другие.
2013
.
Понимание филогении и кодирующего потенциала микробной темной материи
.
Природа
499
(
7459
):
431
—
437
.
Sunagawa
S
, и другие.
2015
.
Планктон океана. Структура и функции микробиома глобального океана
.
Наука
348
(
6237
):
1261359
—
1261359
.
Танентзап
AJ
, и другие.
2019
.
Ковариация химического и микробного разнообразия в пресной воде влияет на функционирование экосистемы
.
Proc Natl Acad Sci USA
.
116
(
49
):
24689
—
24695
.
Трифинопулос
Дж
,
Нгуен
LT
,
von Haeseler
A
,
Minh
BQ.
2016
.
W-IQ-TREE: быстрый онлайн-филогенетический инструмент для анализа максимального правдоподобия
.
Nucleic Acids Res
.
44
(
W1
):
W232
—
235
.
Видер
WR
,
Кливленд
CC
,
Лоуренс
DM
,
Bonan
ГБ.
2015
.
Влияние структурной неопределенности модели на прогнозы углеродного цикла: биологическая фиксация азота в качестве примера
.
Энвирон Рес Летт
.
10
(
4
):
044016
.
Райтон
KC
, и другие.
2016
.
RubisCO нуклеозидного пути, известного из архей, обнаружен в различных некультивируемых типах бактерий
.
ISME J
.
10
(
11
):
2702
—
2714
.
Заметки автора
© Автор (ы) 2020. Опубликовано Oxford University Press от имени Общества молекулярной биологии и эволюции.
Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/4.0/), которая разрешает некоммерческое повторное использование, распространение, и воспроизведение на любом носителе при условии правильного цитирования оригинала. По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].
Широко распространенная почвенная бактерия, окисляющая атмосферный метан
Через 2 года обогащения была получена чистая культура MOB из посевного материала почвы полигона.Полная последовательность генома штамма MG08 была определена из 94 080 длинных считываний (Pacific Biosciences), которые собраны в единую кольцевую хромосому с 3 326 440 п.н. и содержанием GC 58,94% ( SI Приложение , Таблица S2). Все считывания, нанесенные на карту генома, подтверждают отсутствие в культуре контаминирующих организмов. Геном кодировал 46 генов тРНК, единственный оперон гена 16S, 23S и 5S рРНК, единственный оперон pmoCAB и один сиротский ген pmoC .
Филогения и глобальное распространение.
Предполагаемая последовательность PmoA вновь культивированного MOB, сгруппированная в ранее описанном USCα Jasper Ridge 1 / кластер 5 (32) (рис. 1 A ), и имела до 87,7% аминокислотной идентичности с последовательностями, извлеченными из окружающей среды (FR720169) внутри этого кластера. Соответственно, филогенетический анализ на основе гена 16S рРНК показал, что этот MOB кластер с последовательностью гена 16S рРНК (идентичность 97,8%) некультивируемого USCα Candidatus Methyloaffinis lahnbergensis (25) ( SI Приложение , рис.S1). Два дополнительных генома USCα, которые были недавно собраны из метагеномов субарктических болот, не содержали генов 16S рРНК (31). Средняя аминокислотная идентичность (AAI) между нашим изолятом и ранее опубликованными геномами, собранными из метагенома (MAG) USCα, колеблется от 70% до 72% (рис. 2 A ), подтверждая, что наш изолят и существующие MAG USCα, вероятно, принадлежат к одному и тому же род. Интересно, что AAI между нашим изолятом и охарактеризованными видами Methylocapsa колеблется от 67% до 69%.Это сопоставимо с AAI, общим для достоверно опубликованных видов Methylocapsa (67–72%), что позволяет предположить, что наш изолят и, соответственно, другие МАГ USCα являются членами рода Methylocapsa . Геномная средняя нуклеотидная идентичность (gANI), общая для нашего изолята и других представителей рода Methylocapsa , включая USCα MAG, колеблется от 74% до 79%, демонстрируя, что изолят представляет собой вид в пределах рода Methylocapsa (рис.2 A ), которую мы назвали M. gorgona MG08; gor.go’na. L. fem. п. gorgona (от греч. Fem. N. gorgonè ) злобное чудовище женского пола из греческой мифологии с острыми клыками и волосами живых ядовитых змей в отношении волосоподобных структур, образованных этим типом штамма (рис. В ).
Рис. 1.
Филогенетическая взаимосвязь PmoA и электронные микрофотографии M. gorgona MG08. ( A ) Некорневое дерево максимального правдоподобия на основе положений 155-аа было вычислено с использованием модели аминокислотного замещения на основе матрицы Джонса Тейлора Торнтона.Env. Seq., Последовательность из окружающей среды (клон или последовательность DGGE). PmoA M. gorgona, MG08 кластеры с другими некультивируемыми MOB в пределах USCα JR1 / кластера 5 (виды Methylocella, не несут гены, кодирующие pMMO, и поэтому не представлены на дереве). Значения начальной загрузки представлены в точках ветвления (1000 повторений данных). Штанга, замен 0,05-аа на сайт. ( B ) Сканирующая электронная микрофотография клеток M. gorgona MG08, выращенных при 21 ° C в жидкой культуре с 20% CH 4 без встряхивания.( C ) Просвечивающая электронная микрофотография клеток, выращенных в тех же условиях, показывающая внутрицитоплазматические мембраны типа III и включения, напоминающие гранулы ПОБ.
Рис. 2.
Средняя идентичность нуклеотидов и аминокислот, филогенетическое родство и сравнение центрального метаболизма между M. gorgona MG08 и его родственниками, секвенированными по геному. ( A ) Симметричная матрица попарных gANI и AAI между всеми штаммами и MAG, упорядоченная, как в B .ANI представлен в нижнем левом треугольнике и указаны значения ≥74. AAI представлен в виде треугольника , правого верхнего угла и предоставлены значения ≥60. M. gorgona MG08 и Ca. M. lahnbergensis (AAI, 71,3; ANI, 78,1), MAG USC1 (AAI, 70,1; ANI, 78,0), MAG USC2 (AAI, 70,0; ANI, 77,3), M. aurea KYG T (AAI, 69,3; ANI, 72,5), M. acidiphila B2 (AAI, 67,4; ANI, 74,75), M. palsarum NE2 (AAI, 66,1; ANI, 67,9) и M.silvestris BL2 (AAI, 62,5; ANI, 69,9) ниже видового порога 96,6 ANI (3) и 95 AAI (4). ( B ) Филогеномное дерево было рассчитано с 10 независимыми цепочками из 11000 поколений в рамках модели LG с четырьмя категориями скорости, используя входное выравнивание 34 сцепленных маркерных генов ( Материалы и методы ). В общей сложности 6000 поколений каждой цепочки были отброшены как выгорание, остальные были взяты подвыборки через каждые пять деревьев (bpcomp -x 6000 5 11000) и объединены вместе для расчета сообщенного 50% согласованного дерева и двухчастичных апостериорных вероятностей (maxdiff = 0 .814, meandiff = 0,010076). Модель и количество категорий оценок были определены с помощью ModelFinder ( Материалы и методы, ). ( C ) Распределение функциональных комплексов, представленное на рис. 4 и SI Приложение , таблица S1, было определено с помощью взрыва (5), OrthoFinder (6) и ручного исследования деревьев. Наличие полного комплекса обозначается сплошным квадратом. Неполные комплексы отмечены вкрапленным ромбом. Сокращения для функциональных комплексов: ака, карбоангидраза; соотв, ацетил-КоА карбоксилаза; атр, АТФ-синтаза; cox, дегидрогеназа монооксида углерода; cyd, терминальная цитохромоксидаза; ено, енолаза; феи, фермент, активирующий формальдегид; fdh, формиатдегидрогеназа; fdx, ферредоксин, 2Fe-2S; fhc, комплекс формилтрансфераза / гидролаза; fhs, формиат-тетрагидрофолателигаза; ФНР, ферредоксин-НАДФ + оксидоредуктаза; фол, бифункциональная 5,10-метилентетрагидрофолатдегидрогеназа и 5,10-метилентетрагидрофолатциклогидролаза; gck, 2-глицераткиназа; gcv, комплекс расщепления глицина; гли, серингидроксиметилтрансфераза; hhy, [NiFe] гидрогеназа; hpr, гидроксипируватредуктаза; mch, метенилтетрагидрометаноптеринциклогидролаза; mcl, малил-КоА-лиаза; mdh, малатдегидрогеназа; mtd, NAD (P) -зависимая метилентетрагидрометаноптериндегидрогеназа; mtk, малаттиокиназа; mxa, метанолдегидрогеназа; ниф, нитрогеназа; nuo, НАДН-хинон оксидоредуктаза; пэт, убихинол-цитохром c редуктаза; pmo, метанмонооксигеназа в виде частиц; ppc, фосфоенолпируваткарбоксилаза; и sga, серин-глиоксилатаминотрансфераза.
Идентификация M. gorgona как члена группы USCα была подтверждена филогенетическим анализом на основе конкатенированного выравнивания 34 консервативных таксономических маркерных генов (рис. 2 B ). Однако мы не получили убедительной поддержки монофилетической клады Methylocapsa , независимо от того, считали ли мы USCα частью этого рода или нет. Это отсутствие разрешения было связано с включением двух штаммов Methylocella silvestris в нашу филогенетическую реконструкцию.Эти штаммы имеют 64–65% AAI с признанными видами Methylocapsa , что ниже, чем 67–72% AAI, общих для признанного Methylocapsa , но схоже с AAI 63–69%, общих между признанными видами Methylocapsa и Геномы USCα (рис.2 A ). Вместе Methylocapsa , USCα и Methylocella вместе образуют единую сильно поддерживаемую кладу. Хотя ценности AAI и филогенетические аргументы, взятые вместе, подтверждают присвоение M.gorgona MG08 и другие USCα как члены Methyolcapsa , наши данные не разрешают взаимосвязь между Methylocella и линиями Methylocapsa . Мы надеемся, что выделение и секвенирование генома дополнительных штаммов Methylocapsa в будущем поможет разрешить порядок ветвления и отношения внутри этой клады.
Скрининг всех общедоступных наборов данных ампликонов гена 16S рРНК окружающей среды выявил 194764 последовательности в 1537 наборах данных (0.8% всех проверенных наборов данных), которые были идентичны или очень похожи (идентичность> 97%) с геном 16S рРНК M. gorgona MG08. Эти наборы данных происходят почти исключительно из наземных сред (в основном из почвы), охватывающих шесть континентов, с широтами от высокого арктического Шпицбергена над тропиками до южной Австралии и Новой Зеландии (рис. 3), демонстрируя, что микробы идентичны или тесно связаны с нашими изолировать глобально распространены в наземных экосистемах.
Рис. 3.
Глобальное распространение линии M. gorgona . На карте указаны места выборки общедоступных наборов данных SRA, содержащих элементы M . gorgona lineage ( Материалы и методы ). Модель M . gorgona Линия была идентифицирована в 1537 наборах данных SRA, из которых показаны 1240. Широта и долгота были недоступны для остальных 297 наборов данных.
Сравнительная геномика и протеомика.
Геном M.gorgona MG08 кодирует и экспрессирует несколько путей, которые обычно обнаруживаются в альфа-протеобактериальных MOB, но, что интересно, также содержит уникальные метаболические особенности (Фиг.2 C и 4 и SI Приложение , Таблица S1). Как и другие MOB, он использует твердую монооксигеназу метана (pMMO) для окисления CH 4 до метанола. pMMO требует меди, но оперон метанобактина (медьсвязывающий пептид), обнаруженный у различных видов Methylocystis (33), отсутствует в геноме M.горгона MG08. Однако мы обнаружили гомолог одного члена этого оперона, кассетного белка биосинтеза метанобактина MbnB / DUF692 (PF05114.12). У M. gorgona MG08 и других видов Methylocapsa этот ген является частью консервативного генного кластера из четырех генов, гомологичных оперону GIG в Legionella pneumophila , который реагирует на изменение концентрации меди (34). Эти гены кодируют предполагаемый интегральный мембранный сигнальный белок (DUF2282 – PF10048.8, экспрессия подтверждена в протеоме в присутствии 1 мкМ Cu), предполагаемый ДНК-связывающий белок (DUF2063 – PF09836.8) и белок внутренней мембраны (домен DoxX, содержащий PF07681). Мы наблюдали PQQ-связанную метанолдегидрогеназу (MxaFJGI), которая использует кальций в качестве каталитического кофактора для преобразования метанола в формальдегид, который отсутствует в тесно связанных USCα MAG (наборы данных S1 и S2). Кроме того, лантаноид-зависимая метанолдегидрогеназа из семейства xoxF 5 с аминокислотной идентичностью 75% с Methylobacterium nodulans ORS 2060 и 72% с Methylobacterium extorquens CM4 (35), для которых лантаноид-зависимая регуляция метилотрофия тщательно изучена (36), кодируется в геноме.В жидкой культуре с 20% CH 4 (объем / объем) в свободном пространстве и без добавления лантаноидов экспрессия mxaF в M. gorgona MG08 была примерно в 10 раз выше, чем экспрессия xoxF ( SI Приложение , Таблица S1). M. gorgona MG08 кодирует полный путь опосредованного тетрагидрометаноптерином (H 4 MPT) окисления формальдегида до формиата, необратимую формиатдегидрогеназу для окисления формиата, генерирующего NADH, до CO 2 и путь включения C 1 в сериновом цикле через перенос C 1 , опосредованный тетрагидрофолатом (H 4 F) (рис.4). Также существует предполагаемый путь окисления формальдегида с образованием формиата через H 4 F. Этот путь требует спонтанного превращения формальдегида в 5,10-метилен H 4 F для его работы (37). Однако, основываясь на предыдущих экспериментах с M. extorquens , где присутствуют оба пути, но только путь H 4 MPT отвечает за окисление формальдегида (38), мы считаем маловероятным, что путь H 4 F ответственен за для окисления формальдегида в М.горгона MG08. Мы также идентифицировали наборы генов для полного цикла окислительной трикарбоновой кислоты (TCA), пути Энтнера-Дудорова, пентозофосфатного пути и глиоксилатного цикла, а также полную дыхательную цепь с пятью версиями терминальных респираторных оксидаз, что указывает на то, что это имеет способность расти при различных концентрациях кислорода (Рис. 4 и SI Приложение , Таблица S1). Однако геном не кодирует полный путь этиломалонил-КоА. М.gorgona MG08 имеет неполный цикл Кальвина-Бенсона-Бассама (CBB) и поэтому контрастирует в этом отношении с другими членами Methylocapsa , Methylocella и некоторыми гаммапротеобактериальными и веррукомикробными MOB (39–44). Его единственный гомолог гена RuBisCO кодирует тип IV RuBisCO, который не допускает фиксации CO 2 ( SI Приложение , рис. S2 A ), но вместо этого может участвовать в метаболизме метионина, реакции на окислительный стресс или окислении серы (45 ).Это говорит о том, что M. gorgona MG08 потеряли ген канонического RuBisCO. Это не общая особенность USC, поскольку USC1 и USC2 MAG (31) кодируют как канонический RuBisCO, так и RuBisCO типа IV, в то время как гены канонического RuBisCO и его гомолога типа IV не были обнаружены в неполном геноме Ca . M. lahnbergensis (25). Дальнейшее понимание распределения канонического RuBisCO должно дождаться полной последовательности генома Ca. M. lahnbergensis и другие штаммы USC. M. gorgona MG08 действительно имеет полный восстановительный глициновый путь для фиксации CO 2 (46), который включает комплекс формиатдегидрогеназы, гомологичный кислородно-толерантному комплексу в Rhodobacter capsulatus , который, как было экспериментально подтверждено, катализирует CO 2 редукция ( SI Приложение , рис. S2 B ) (47). Этот путь перекрывается с H 4 F-опосредованным переносом C 1 для одновременной ассимиляции CO 2 и аммиака (NH 3 ).Гены этого пути последовательно обнаруживались во всех геномах родов Methylocapsa , Methylocella и трех USCα MAG, но из трех MAG только Ca. M. lahnbergensis содержала все необходимые гены для полного пути (набор данных S1). Кроме того, M. gorgona MG08 обладает полным опероном nifHDKENX , который кодирует структурные компоненты нитрогеназы, который, за исключением единственного гена nifH в USC1, отсутствует в проекте MAG Ca. M. lahnbergensis USC1 и USC2 (рис.2 C и набор данных S1). Филогении NifH и NifD показали, что гены nif из M. gorgona MG08 имеют другое эволюционное происхождение, чем гены других близкородственных культур ( SI Приложение , Рис. S3). Гены, кодирующие гидроксиламиноксидоредуктазу ( hao ) и цитохром c 554 , отсутствовали в геноме, что подтверждает, что M. gorgona MG08 не имеет потенциала для получения энергии от окисления аммиака (48).Интересно, что M. gorgona MG08 содержит гены, которые кодируют O 2 -толерантную / нечувствительную [NiFe] группу 1h респираторную гидрогеназу с высоким сродством ( hhyL и hhyS ) и респираторный монооксид углерода I класса [MoCu]. дегидрогеназа (Рис. 2 C и SI Приложение , Рис. S4). Поскольку эти ферменты принадлежат к тем же линиям, что и те, которые кодируются неметанотрофными сообществами в почвах антарктических пустынь (49) и почвенной actinobacterium Mycobacterium smegmatis (50), которые способны использовать атмосферные концентрации H 2 и CO, M.gorgona MG08 может также сохранять энергию от аэробного дыхания этих газовых примесей при атмосферных концентрациях. Эта особенность, очевидно, более широко распространена среди членов USCα, так как черновые геномы Ca. M. lahnbergensis, USC1 и USC2 также кодируют близкородственные CO дегидрогеназы (рис. 2 C и SI, приложение , рис. S4 B ), а также USC1 и USC2 (неполный геном Ca. M. lahnbergensis не имеет высокоаффинной гидрогеназы) содержат гены гидрогеназы, которые очень похожи на гены, обнаруженные у M.gorgona MG08 (Рис.2 C и SI Приложение , Рис. S4 A ).
Рис. 4.
Центральный углеродный и энергетический метаболизм M. gorgona MG08, как было предсказано на основе его генома и подтверждено протеомикой. H 4 MPT, тетрагидрометаноптерин. Пунктирные черные стрелки указывают на пассивную диффузию через клеточную мембрану. Цифры этапов метаболизма на рисунке относятся к следующим названиям ферментов: (1) метанмонооксигеназа в виде частиц, (2) метанолдегидрогеназа и соответствующий цитохром c , (3) фермент, активирующий формальдегид, (4) НАД (Ф) -зависимый метилентетрагидрометаноптериндегидрогеназа, (5) метенилтетрагидрометаноптеринциклогидролаза, (6) формилтрансфераза / гидролаза, (7A) НАД-зависимая формиатдегидрогеназа, (7B) обратимая молибдоптерин-связывающая формиат-дегидрогеназа / CO 2 редуктодегидрогеназа / CO 2 (9) бифункциональная 5,10-метилентетрагидрофолатдегидрогеназа и 5,10-метилентетрагидрофолатциклогидролаза, (10) система расщепления глицина, (11) серингидроксиметилтрансфераза, (12) серин-глиоксилатаминотрансфераза, (13) гидроксипируват редуктаза 14) 2-глицераткиназа, (15) енолаза, (16) фосфоенолпируваткарбоксилаза, (17) малатдегидрогеназа, (18) малаттиокиназа, (19) малил-КоА-лиаза, (20) карбоангидраза, (21) ацетил-Со Карбоксилаза, (22) [MuCo] класс I дегидрогеназа монооксида углерода, (23) цитохром c редуктаза и соответствующий цитохром c , (24) цитохром c / d / o концевые оксидазы (цитохром d оксидаза — cydAB , цитохром-убихинолоксидаза — cyoABCD , гем-цитохром меди c оксидаза типа A1 — ctaAEGBC , гем-медный цитохром типа C cbb 3 оксидаза — ccoNOme-оксид меди и гем-медь-цитохром и гем-медь-цитохром тип А1 — coxCAB ).(25) [NiFe] группа 1h гидрогеназа, (26) НАДН-дегидрогеназа, (27) АТФ-синтаза, (28) нитрогеназа, (29) ферредоксин, 2Fe-2S и (30) ферредоксин-НАДФ + оксидоредуктаза. Все ферменты и белки-переносчики электронов также были обнаружены в протеоме, за исключением нитрогеназы и оксидазы cbb 3 . Полный список белков, соответствующих генов и записей генома можно найти в Приложении SI , Таблица S1.
Протеомный анализ M. gorgona MG08, выращенного в жидкой культуре в атмосфере, содержащей 20% CH 4 (но при комнатной концентрации CO и H 2 ) в присутствии 10 мМ нитрата, подтвердил, что все белки показаны на рис.4, за исключением нитрогеназы и цитохрома c оксидазы типа cbb3 ( SI Приложение , Таблица S1). Среди обнаруженных белков были белки восстановительного глицинового пути, включая его редуктазу CO 2 , высокоаффинную гидрогеназу и дегидрогеназу монооксида углерода.
Физиология и морфология.
M. gorgona MG08 филогенетически принадлежит к кладе предполагаемых высокоаффинных альфа-протеобактерий USCα MOB. Поэтому мы провели эксперименты, чтобы проверить, может ли этот изолят расти в окружающем воздухе, содержащем атмосферную концентрацию CH 4 , используя технику культивирования микроколоний с фильтрами, плавающими на жидкой нитратной минеральной солевой среде без какой-либо дополнительной энергии или источника углерода.Эти эксперименты однозначно продемонстрировали, что M. gorgona MG08 растет в окружающем воздухе (∼1,86 ppmv CH 4 , ∼0.2 ppmv CO и ∼0.5 ppmv H 2 ) и выше (20 и 1000 ppmv об.) CH 4 концентрации (рис. 5). Спустя до 3 недель инкубации самые большие колонии наблюдались при скорости менее 1000 ppmv. CH 4 , в то время как более мелкие колонии образовывались при 20 ppmv, аналогично колониям в неизмененном атмосферном воздухе, подтверждая, что повышенные концентрации CH 4 стимулировали рост.Продолжающийся рост M. gorgona MG08 в неизмененном воздухе был подтвержден через 5 и 12 месяцев (рис. 5), достигая более чем в 10 раз размера первоначальной популяции через 5 месяцев и продолжая расти и образовывать сферические колонии, наблюдаемые через 12 месяцев (рис. Рис.5). Для сравнения, голодающие Sinorhizobium meliloti смогли утроить свой первоначальный размер популяции, используя внутриклеточный полигидроксибутират (ПОБ) в качестве источника углерода и энергии, и сохранить свою популяцию в течение 5 месяцев, прежде чем она снизилась до уровня ниже первоначального (51).Вид, более близкий к M. gorgona MG08, MOB Methylocystis parvus OBBP, вообще не реплицировался с использованием хранимого PHB и зависел от доступа к CH 4 для совместного окисления двух субстратов для роста ( 52). Учитывая это, мы считаем маловероятным, что рост M. gorgona MG08 полностью зависел бы от ПОБ для своего роста в течение 12 месяцев, но возможно, что любые существующие хранилища ПОБ были задействованы во время инкубационного периода и использовались в качестве углерода и энергетическая добавка к своему основному рациону.
Рис. 5.
Микроколонии M. gorgona MG08, культивируемые при различных концентрациях CH 4 . Микроколонии выращивали на поликарбонатных фильтрах, плавающих на жидкой нитратной минеральной солевой среде в течение количества дней, указанных на каждом рисунке, либо в закрытых сосудах с воздухом, дополненным различными концентрациями CH 4 , либо на открытом воздухе. Для фиксации фильтры переносили в свежеприготовленный 2% параформальдегид в 1 × PBS в холодильнике на ночь.Для окрашивания фильтры переносили (стороной с бактериями вверх) поверх 200 мкл капель 1000 × SYBRgreen и инкубировали в течение 10 мин, промывали и сушили на воздухе.
M. gorgona MG08 кодирует только одну копию твердой метанмонооксигеназы, которая также была обнаружена в ее протеоме. Это показывает, что один и тот же фермент ответственен за катализ окисления CH 4 как при высоких, так и при низких концентрациях CH 4 . Чтобы подтвердить, что M. gorgona MG08 способен окислять атмосферные концентрации CH 4 , мы провели эксперимент по окислению CH 4 и росту микроколоний с клетками на плавающих фильтрах в атмосфере атмосферного воздуха (1.86 часов в час. СН 4 ). Результаты ясно показывают, что CH 4 окислился в течение 120 дней инкубации в атмосферном воздухе (фиг. 6 A ). Проверка фильтров подтвердила рост клеток (фиг. 6 B ). M. gorgona MG08 также несет единичные копии высокоаффинной респираторной гидрогеназы и дегидрогеназы монооксида углерода, и обе экспрессируются при 20% концентрации CH 4 в свободном пространстве, без добавления CO или H 2 . Таким образом, кажется вероятным, что эти белки конститутивно экспрессируются при различных концентрациях CH 4 и, таким образом, вносят вклад в сбор энергии из воздуха.Однако невозможно сделать вывод по этому поводу, пока мы не определим протеом M. gorgona MG08, выращенный на воздухе, что еще не было достигнуто из-за ограничений биомассы. Кроме того, из-за сложности подготовки атмосфер и сред, свободных от следовых количеств альтернативного углерода и источников энергии, таких как CO (0,2 ppmv в воздухе) и H 2 (0,5 ppmv в воздухе) и EDTA (53) (1,1 мкМ в используемой среде с разбавленной нитратной минеральной солью 1/10), соответственно, мы еще не можем сделать вывод, возможен ли рост только на атмосферном CH 4 .Однако рост действительно происходил на неорганических фильтрах Anodisc с матрицей из оксида алюминия высокой чистоты, плавающих на нитратной минеральной солевой среде в атмосфере атмосферного воздуха ( SI Приложение , рис. S5). Это подтверждает, что клетки, по крайней мере, не зависели от бисфенила A (BPA), просачивающегося из поликарбонатных фильтров (54, 55) в качестве дополнительного источника углерода и энергии.
Рис. 6.
CH 4 окисление микроколониями M. gorgona MG08, инкубированные на плавающих фильтрах в атмосферном воздухе ( A ).Образование микроколоний в атмосфере атмосферного воздуха ( B ). ( A ) Пять бутылочек объемом 170 мл с плавающими поликарбонатными фильтрами инкубировали на 35 мл разбавленной 1/10 нитратной минеральной соли среды ( Материалы и методы ) в атмосфере атмосферного воздуха (135 мл 1 атм свободного пространства, закрытого резиновой пробкой) для 120 дн. Дополнительный набор из пяти бутылок инкубировали без фильтров в качестве отрицательного контроля для окисления CH 4 . Тест с двумя образцами t , предполагающий равные отклонения, подтвердил, что концентрации CH 4 в свободном пространстве значительно различались во флаконах с фильтрами, содержащими клетки (значение P <0.001) по сравнению с без ячеек. ( B ) Фильтры из A проверяли вручную для выявления образования колоний. ( Top ) Показаны отдельные клетки до инкубации. ( Нижний ) Колонии образовались после 120-дневной инкубации в одной из бутылей из A . Для окрашивания в B фильтры переносили (стороной с бактериями вверх) поверх 200 мкл капель 1000 × SYBRgreen и инкубировали в течение 10 минут, промывали и сушили на воздухе.
Дополнительный эксперимент по окислению CH 4 с использованием клеток в жидкой культуре в диапазоне концентраций CH 4 был проведен для оценки константы половинного насыщения [K m (прибл.) ] для M.gorgona MG08 ( SI Приложение , рис. S6). Мы показываем, что он имеет K m (приблизительно) , равный 4,905 мкМ, аналогичный тому, который наблюдается для Methylocapsa acidiphila B2, M. parvus , Methylocystis sp. SC2 и многие другие штаммы MOB (23). В отличие от M. gorgona MG08, ни один из этих штаммов ранее не обнаруживал рост при атмосферных концентрациях CH 4 . Удельная аффинность [a 0 s = V max (app) / K m (app) ] была предложена как лучший показатель олиготрофии (6) как Methylocystis sp.LR1 проявлял высокоаффинную активность (K m ~ 100 нМ) при низких концентрациях CH 4 (<275 ppmv) и низкоаффинную активность (K m ~ 1 мкМ), когда концентрации CH 4 были выше, в то время как его удельное сродство оставалось постоянным (56). При V max (приложение) 9,54 × 10 −10 мкмоль53клет −1 ⋅h −1 , удельное сродство M. gorgona MG08 составляет ∼195 (× 10 −12 L⋅cell −1 ⋅h −1 ), что примерно в 17 раз превышает соответствующее значение M.acidiphila B2 (12 × 10 −12 L⋅cell −1 ⋅h −1 ), что примерно в 10 раз выше, чем у Methylocystis sp. LR1 (20 × 10 −12 L⋅cell −1 ⋅h −1 ), что в ∼6 раз выше, чем у Methylocystis sp. SC2 (34 × 10 −12 L⋅cell −1 ⋅h −1 ), ранее MOB с самым высоким известным a 0 s (23). Таким образом, высокоаффинный MOB, вероятно, лучше определить как высокоспецифичный MOB, как это было предложено Dunfield (6) более 10 лет назад, но для подтверждения этого необходимо дождаться стандартизованных сравнений между USCα и другими штаммами MOB.
Несмотря на более низкую удельную аффинность (a 0 s ), чем у M. gorgona MG08, мы решили проверить, способны ли другие виды Methylocapsa расти при атмосферных концентрациях CH 4 . Неожиданно оказалось, что и M. acidiphila , и Methylocapsa aurea также могли расти на плавающих фильтрах, инкубированных в атмосферном воздухе ( SI Приложение , рис. S7). Это говорит о том, что способность MOB расти на фильтрах, плавающих на нитратной минеральной солевой среде в неизмененном воздухе, не является уникальной способностью видов в USCα и не зависит от высокого a 0 s для CH 4 .Однако очевидный успех USCα на многих высокогорных почвах все еще может быть результатом его самого высокого значения a 0 s .
В соответствии с физиологическими и геномными прогнозами, эксперименты NanoSIMS, проведенные на микроколониях на поликарбонатных фильтрах, качественно показали, что M. gorgona MG08 включает 13 C-меченный углерод в свою биомассу при выращивании в закрытом сосуде, содержащем 20 p.pmv. 13 CH 4 и немаркированный CO 2 (рис.7 А ). Включение 13 C также наблюдалось в присутствии 13 CO 2 при 20 час. и немеченый CH 4 (фиг. 7 B ), как и ожидалось из включения CO 2 / HCO 3 — через реакцию карбоксилирования серинового цикла (фермент № 16, фиг. 4). Также существует вероятность того, что CO 2 может быть ассимилирован посредством восстановительного глицинового пути, но с текущими данными невозможно различить различные возможные точки входа углерода, ассимилированного из CO 2 .Накопление 13 CO 2 в свободном пространстве культур во время инкубации с 20 част. и 1000 часов в час. 13 CH 4 подтвердили, что организм способен полностью окислять CH 4 до CO 2 и впоследствии высвобождать CO 2 из клетки ( SI Приложение , рис. S8).
Рис. 7.
Фиксация углерода в M. gorgona MG08. NanoSIMS визуализация включения изотопной метки 13 C в M.gorgona MG08 клетки, выращенные на поликарбонатных фильтрах в атмосфере, содержащей 20 частей на миллион по объему. CH 4 и 1,000 p.pmv. СО 2 . Сравниваются две инкубации: 13 CH 4 в комбинации с 12 CO 2 ( A ) и 12 CH 4 в комбинации с 13 CO 2 ( B ) . Значения доли изотопа 13 C / ( 12 C + 13 C), выраженные в ат.%, Отображаются на шкале ложных цветов в диапазоне от 0.От 9 ат.% (Темно-синий) до 2,5 ат.% (Красный). Клетки, выращенные в немеченом изотопом метане и диоксиде углерода, показали содержание 13 C 1,09 ± 0,01 ат.% (SD, n = 60).
Дополнительные физиологические характеристики M. gorgona MG08 проводили в жидких культурах, выращенных при высокой концентрации CH 4 . Эффективный рост наблюдался, когда N 2 предлагался в качестве единственного источника азота в полностью аэробных условиях ( SI Приложение , рис.S9). M. gorgona MG08 разделяет эту способность с близкородственным M. acidiphila B2 T и неметанотрофными представителями рода Beijerinckia , в то время как Methylocystis и Methylosinus требуют некоторого пониженного напряжения кислорода. Methylococcus capsulatus (Bath) очень чувствителен к кислороду (39, 57, 58). Почти все испытанные азотсодержащие соединения, включая N 2 , NO 3 — и NH 4 + , действовали как хорошие источники азота для M.gorgona MG08 ( SI Приложение , рис. S9), в то время как гистидин и глицин ингибировали рост, как показано ранее для M. capsulatus (только гистидин) (59), Thiobacillus neapolitanus (только гистидин) (60) и метилотрофные бактерии (только глицин) (61).
Не наблюдалось роста в контрольных жидких периодических культурах, снабженных ацетатом, этанолом, формиатом, галактозой, глюкозой, метанолом, оксалатом, пируватом, сахарозой, сукцинатом или мочевиной без добавления CH 4 ( SI Приложение , рис.S10 A ). Чтобы оценить потенциальные эффекты концентрации метанола, мы попытались выращивать 5%, 0,5%, 0,01%, 0,005% и 0,001% CH 3 OH, но наблюдали только минимальное увеличение оптической плотности культур ( SI Приложение ). , Рис. S10 B ). Учитывая, что M. gorgona MG08 несет и экспрессирует гены окисления метанола, его неспособность расти на метаноле была неожиданной, но это согласуется с наблюдениями, что M. aurea , M.acidiphila и Methylocapsa palsarum плохо растут на метаноле (39, 62, 63). Интересно, что мы наблюдали зависимое от концентрации ингибирование роста M. gorgona MG08 в присутствии концентраций метанола ≥0,01% при выращивании на CH 4 (20% CH 4 в свободном пространстве). Таким образом, одна токсичность не может объяснить его неспособность использовать метанол. Возможно, метанолдегидрогеназа, которой для приема электронов необходим окисленный цитохром c , таким образом, зависит от одновременного окисления CH 4 (рис.4) из-за сильно связанных реакций окисления CH 4 и метанола, протекающих в суперкомплексе. Если это так, окислительно-восстановительные взаимодействия будут отличаться от внутрицитоплазматических мембранных ансамблей pMMO и метанолдегидрогеназы (MDH) в метаноле и CH 4 с использованием M. capsulatus (Bath) (64).
Неспособность M. gorgona MG08 расти на ацетате также была неожиданной, учитывая, что он несет все гены, необходимые для аэробного метаболизма ацетата, т.е.е., ацетат-коА-лигаза, ацетаткиназа, фосфотрансацетилаза и полный цикл TCA. Аналогично, M. acidiphila B2 T также обладает полным набором ферментов метаболизма ацетата (65), но не может расти на ацетате в качестве единственного источника углерода (39). Дедыш и др. (66) сообщили об аналогичных результатах для облигатного метанотрофа Methyloferula stellata AR4 T и предположили, что отсутствие способности утилизировать ацетат может быть связано с отсутствием специфического гена переносчика ацетата / гликолата, actP , а не количество генов мембранных транспортеров (67, 68).В подтверждение этой гипотезы, ген actP , кодирующий ацетатпермеазу, отсутствует как в штамме M. gorgona MG08, так и в штамме M. acidiphila B2 T .
Клетки M. gorgona MG08 представляют собой грамотрицательные неподвижные коккоиды или толстые палочки, встречающиеся по отдельности или в виде конгломератов. Клетки имеют ширину 0,6–0,8 мкм и длину 0,8–1,5 мкм и показывают многочисленные волосковидные структуры (рис. 1 B ). Рост на поверхности происходит путем образования микроколоний круглой формы.Размножается нормальным делением клеток и не образует розеток. Клетки содержат хорошо развитую внутрицитоплазматическую мембранную систему расположения типа III, которая выглядит как стопки мембранных везикул, упакованных параллельно только на одной стороне клеточной мембраны (Рис. 1 C ). Было показано, что такое расположение характерно для представителей рода Methylocapsa (39, 62, 63). Включения, похожие на гранулы ПОБ, присутствовали (рис. 1 C ), но не демонстрировали биполярного расположения преломляющих гранул ПОБ, характерного для M.aurea KYG T и представители рода Methylocella . Оптимальный рост наблюдался между 15 ° C и 27 ° C, в то время как некоторый рост все еще наблюдался при испытанных крайних значениях, 7 ° C и 37 ° C ( SI Приложение , рис. S11 A ). Оптимальный диапазон температур роста был аналогичен, но шире, чем у M. aurea (25–30 ° C), но шире, чем у M. acidiphila (20 ° C) и M. palsarum (18–30 ° C), но выше / шире. 25 ° С) (39, 62, 63). M. gorgona MG08 до сих пор является единственным штаммом Methylocapsa , способным к росту при 37 ° C.Оптимальный pH для роста M. gorgona MG08 был в диапазоне от 6,5 до 7 ( SI Приложение , рис. S11 B ), что значительно выше, чем для M. acidiphila (5,0–5,5), M. aurea (6.0–6.2) и M. palsarum (5.2–6.5), но это соответствует частому обнаружению USCα в нейтральных и слабокислых почвах (8, 16). Было показано, что NaCl подавляет рост при 0,5% (вес / объем) и выше ( SI Приложение , рис. S11 C ), как и три других штамма Methylocapsa (39, 62, 63).
Активный атмосферный сток метана в криозолях минералов высокой Арктики (Журнальная статья)
Лау, Мэгги CY, Стакхаус, Б., Лейтон, Элис К., Чаухан, Арчана, Вишнивецкая, Т.А., Чоури, Каруна, Микитчук, NCS, Беннетт, Фил К., Ламарш-Ганьон, Г., Бертон, Н., Ренхольм, Дж., Хеттич, Р.Л., Поллард, У.Х., Омелон, К.Р., Медвиги, Дэвид М., Пффифнер, Сьюзан М., Уайт, Л.Г., и Онстотт, Т.К.Активный атмосферный сток метана в криозолях высоких арктических минералов. США: Н. П., 2015.
Интернет. DOI: 10.1038 / ismej.2015.13.
Лау, Мэгги CY, Стакхаус, Б., Лейтон, Элис К., Чаухан, Арчана, Вишнивецкая, Т.А., Чоури, Каруна, Микитчук, NCS, Беннетт, Фил К., Ламарш-Ганьон, Г., Бертон, Н., Ренхольм, Дж., Хеттич, Р.Л., Поллард, У.Х., Омелон, К.Р., Медвиги, Дэвид М., Пффифнер, Сьюзан М., Уайт, Л. Г., и Онстотт, Т. С. Активный атмосферный сток метана в криозолях с высоким содержанием арктических минералов. Соединенные Штаты. DOI: https: //doi.org/10.1038/ismej.2015.13
Лау, Мэгги С.Ю., Стакхаус, Б., Лейтон, Элис С., Чаухан, Арчана, Вишнивецкая, Т.А., Чоури, Каруна, Микитчук, Н.С.С., Беннетт, Фил К., Ламарш-Ганьон, Г., Бертон, Н., Renholm, J., Hettich, R.L., Pollard, W.H., Omelon, C.R., Medvigy, David M., Pffifner, Susan M., Whyte, L.G. и Onstott, T.C. Thu.
«Активный атмосферный сток метана в криозолях высоких арктических минералов». Соединенные Штаты. DOI: https: //doi.org/10.1038/ismej.2015.13. https://www.osti.gov/servlets/purl/1213309.
@article {osti_1213309,
title = {Активный атмосферный сток метана в криопочвах высоких минералов Арктики},
author = {Лау, Мэгги К.Ю. и Стакхаус, Б. и Лейтон, Элис К. и Чаухан, Арчана и Вишнивецкая, Т. А. и Чоури, Каруна и Микитчук, NCS и Беннет, Фил К. и Ламарш-Ганьон, Г., Бертон, Н. и Ренхолм, Дж. И Хеттич, Р.Л. и Поллард, У.Х. и Омелон, С.Р. и Медвиги, Дэвид М. и Пффифнер, Сьюзан М. и Уайт, Л.Г. и Онстотт, ТС},
abstractNote = {Переход арктических криозолей, богатых углеродом, в водно-болотные угодья, излучающие метан (CH₄), из-за глобального потепления вызывает растущую озабоченность.Однако пространственно преобладающие минеральные криозоли и их потенциал эмиссии CH2 изучены плохо. Потоки, измеренные на месте и оцененные в лабораторных условиях в сочетании с анализом -omics, показывают: (1) криозоли минералов в высокогорных районах Канады содержат атмосферные CH2-окисляющие бактерии; (2) атмосферный поток поглощения CH⁺ увеличивается с ростом температуры земли; и, как следствие, (3) сила поглощения атмосферного CH₄ увеличится в 5-30 раз по мере потепления Арктики на 5-15 ° C в течение столетия.Мы продемонстрировали, что криозоли с кислыми минералами обладают ранее нераспознанным потенциалом отрицательной обратной связи по CH₄.},
doi = {10.1038 / ismej.2015.13},
journal = {Журнал ISME},
число = 8,
объем = 9,
place = {United States},
год = {2015},
месяц = {1}
}
Ферменты, участвующие в анаэробном окислении н-алканов: от метана до длинноцепочечных парафинов | Интернет-исследования в области здравоохранения и окружающей среды (HERO)
Заголовок
Ферменты, участвующие в анаэробном окислении н-алканов: от метана до длинноцепочечных парафинов
Журнал
Границы микробиологии
ISSN: 1664-302X
Абстрактный
Анаэробные микроорганизмы играют ключевую роль в биогеохимическом круговороте метана и неметановых алканов.На сегодняшний день существует по крайней мере три предложенных механизма анаэробного окисления метана (АОМ). Первый путь опосредуется консорциумом архей анаэробных окислителей метана и сульфатредуцирующих бактерий (SRB) посредством «обратного метаногенеза» и катализируется гомологом метил-кофермент М-редуктазы. Второй путь также опосредуется анаэробными окислителями метана и SRB, где члены архей катализируют как окисление метана, так и восстановление сульфата, а нульвалентная сера является ключевым промежуточным продуктом.Третий механизм АОМ представляет собой нитрит-зависимый «интрааэробный» путь, описанный для денитрифицирующей бактерии Candidatus Methylomirabilis oxyfera. Предполагается, что АОМ происходит путем восстановления нитрита до оксида азота с последующим превращением двух молекул оксида азота в диазот и молекулярный кислород. Последний может быть использован для функционализации метана через метанмонооксигеназу в виде твердых частиц. Что касается неметановых алканов, также, по-видимому, существуют новые механизмы активации.Наиболее хорошо описанным путем является добавление неметановых алканов через двойную связь фумарата с образованием алкилзамещенных сукцинатов с помощью предполагаемого фермента радикального глицила, алкилсукцинатсинтазы (также известной как метилалкилсукцинатсинтаза).
