Содержание
Как определять степень окисления | Решаем химию: вопросы и ответы
Степень окисления и валентность – понятия в чём-то близкие и взаимозаменяемые в ряде ситуаций. Но если валентность всегда положительна (поскольку по определение – способность атомов образовывать то или иное число химических связей. А число связей, очевидно, отрицательным быть не может), то степень окисления может иметь как положительные, так и отрицательные значения. А всё потому, что степень окисления – показывает, каким бы был заряд атома, если бы все электроны, образующие химическую связь сместились к нему (или полностью от него оторвались, сместившись к другому атому).
Фото: pixabay.com
Фото: pixabay.com
В бинарных соединениях степень окисления найти просто. Нужно помнить два момента:
1. Молекула всегда нейтральна, у неё нет заряда (или же он равен 0), поэтому число отрицательных зарядов равно числу зарядов положительных.
2. Произведения степени окисления атома и индекса, стоящего у атома в молекуле, у обоих составляющих молекулу атомов равны по модулю.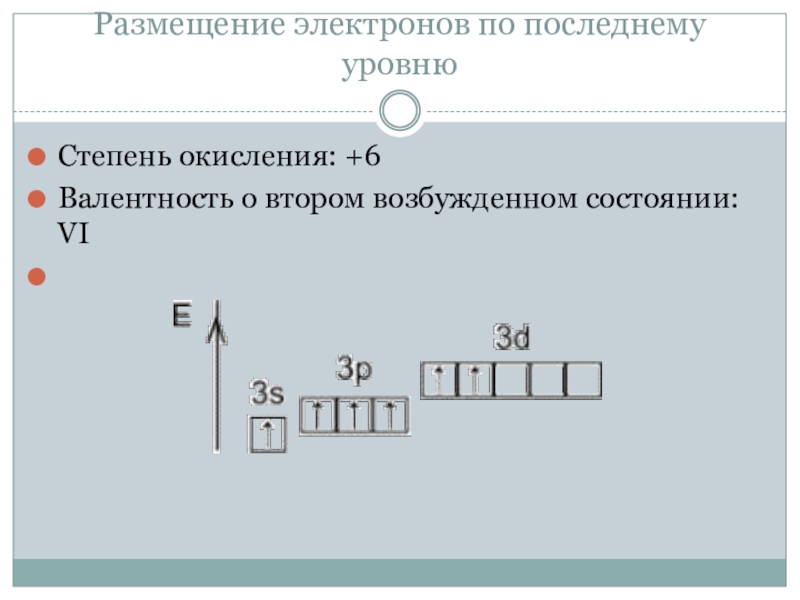
Также стоит запомнить, что
у многих элементов степени окисления почти всегда постоянны. Так, кислород имеет степень окисления -2, водород (очень часто, но не всегда!) и щелочные металлы +1, металлы второй группы +2 и т.д.
Но есть и элементы, которые могут иметь разную степень кисления, например, у серы она может быть -2, +4 или +6.
Для примера определим степени окисления меди в двух оксидах: Cu2O и CuO.
Известно, что у кислорода степень окисления -2. Напомню, что степень окисления указывается справа вверху от элемента. Таким образом, запишем для первого оксида:
Для кислорода произведение степени окисления и индекса -2*1=-2 или по модулю 2. Для меди произведение степени окисления и индекса тоже должно равняться 2. С учётом того, что у меди стоит индекс 2 получаем степень окисления 1. Очевидно, что это +1: поскольку в молекуле уже есть отрицательно заряженная составляющая, другая составляющая должна быть заряжена положительно. Таким образом, в оксиде меди Cu2O степень окисления меди +1.
С оксидом CuО дело обстоит ещё проще. Когда в молекуле атомы соединены 1 к 1, то степени окисления у них равны по модулю. Поскольку у кислорода степень окисления -2, то у меди здесь степень окисления +2.
Теперь разберём примеры посложнее и рассмотрим молекулы, состоящие из атомов трёх видов.
Пример 1.
Определите степень окисления серы в серной кислоте.
Серная кислота имеет формулу h3SO4. Чтобы понять, какая степень окисления у серы в этом соединении, нужно помнить, что заряд молекулы всегда равен 0, то есть число отрицательных зарядов всегда равно числу положительных. Теперь посмотрим на формулу и вспомним, что кислород имеет степень окисления -2, водород +1, то есть:
Что отсюда видно? Что пока у нас имеется два положительных заряда, это вклад водорода (+2 мы получаем, умножив степень окисления водорода на индекс: +1*2=+2) и восемь отрицательных, это вклад кислорода (-8 мы получаем, умножив степень окисления кислорода на индекс: -2*4=-8). Но нам нужно, чтобы число положительных зарядов было равно числу отрицательных, только при этом условии заряд молекулы будет 0. Следовательно, недостаёт 6 положительных зарядов. Это и есть степень окисления серы в серной кислоте: +6. То есть можно записать так:
Следовательно, недостаёт 6 положительных зарядов. Это и есть степень окисления серы в серной кислоте: +6. То есть можно записать так:
Пример 2.
Найдём степень окисления азота в азотистой кислоте HNO2.
Рассуждать будет аналогично, исходя из известных степеней окисления (-2 у кислорода и +1 и водорода):
Перемножив степени окисления с индексами, получим, что у нас 1 положительный заряд (от водорода: +1*1=+1) и четыре отрицательных (от кислорода: -2*2=-4). Для общего нулевого заряда молекулы недостаёт трёх положительных зарядов, которые и даст азот. То есть в азотистой кислоте степень окисления азота +3:
Для тренировки попробуйте самостоятельно определить степень окисления хрома в бихромате калия K2CrO4.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
А4. Валентность. Степени окисления — ХИМИЧИМ!!!
Немного теории.
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число ковалентных химических связей с атомами других элементов.
В образовании ковалентной связи по обменному механизму принимают участие валентные неспаренные электроны атомов. Поэтому валентность, как правило совпадает с числом валентных неспаренных электронов в атоме.
В(Н)=I В(Cl)=I В(C)=IV В(Н)=I В(N)=III В(N)=III
В(O)=II В(O)=II В(O)=II В(Н)=I
Если элемент может образовывать разное количество ковалентных связей, то валентности таких элементов традиционно записываются римскими цифрами после названия
Оксид серы (VI) Оксид серы (IV)
Сте́пень окисле́ния — численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху.
Отрицательное значение степени окисления могут иметь только атомы неметаллов (т.к. они могут принимать электроны для приобретения устойчивого восьми электронного состояния внешнего энергетического уровня). Отрицательная степень окисления (низшая степень окисления) элемента определяется по формуле: 8 — № группы.
Положительное значение степени окисления имеют те атомы, которые могут отдавать свои валентные электроны другим атомам (все, кроме фтора). Атомы металлов всегда имеют положительную степень окисления в соединениях. У металлов I-III групп главных подгрупп значение положительной степени окисления всегда равно номеру группы.
Максимальная положительная степень окисления элемента называется высшей степенью окисления. Высшая степень окисления элемента совпадает с номером группы (кроме элементов фтора и кислорода).
Степень окисления указывается сверху над символом элемента.
Значение заряда иона и значение степени окисления совпадают! Но в отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:
— степень окисления,
— заряды.
Степень окисления атома в простом веществе равна нулю, например:
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
Значение валентности и степени окисления совпадают в веществах с ковалентной полярной связями, например: оксид серы (VI): СО(S)=+6; СО(О)=-2
Значение валентности и степени окисления не совпадают для веществ и ковалентной неполярной связью и ковалентной полярной связью, образованной по донорно-акцепторному механизму.
Тренажер «Составление названий бинарных соединений»
Тренажер «Степень окисления»
В химических соединениях степень окисления и валентность. Чем валентность отличается от степени окисления.
 Как рассчитать степень окисления элемента в соединении
Как рассчитать степень окисления элемента в соединении
Видеоурок 2:
Степень окисления химических элементов
Видеоурок 3:
Валентность. Определение валентности
Лекция:
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность
Электроотрицательность
– это способность атомов притягивать к себе электроны других атомов для соединения с ними.
Судить об электроотрицательности того или иного химического элемента легко по таблице. Вспомните, на одном из наших уроков было сказано о том, что она возрастает при движении слева направо по периодам в таблице Менделеева и с перемещением снизу вверх по группам.
К примеру,
дано задание определить какой элемент из предложенного ряда наиболее электроотрицателен: C (углерод), N (азот), O (кислород), S (сера)? Смотрим по таблице и находим, что это О, потому что он правее и выше остальных.
Какие же факторы оказывают влияние на электроотрицательность? Это:
- Радиус атома, чем он меньше, тем электроотрицательность выше.

- Заполненность валентной оболочки электронами, чем их больше, тем выше электроотрицательность.
Из всех химических элементов фтор является наиболее электроотрицательным, потому как у него малый атомный радиус и на валентной оболочке 7 электронов.
К элементам, имеющим низкую электроотрицательность, относятся щелочные и щелочноземельные металлы. У них большие радиусы и очень мало электронов на внешней оболочке.
Значения электроотрицательности атома не могут быть постоянными, т.к. она зависит от многих факторов в числе которых перечисленные выше, а также степень окисления, которая может быть различной у одного и того же элемента. Поэтому принято говорить об относительности значений электроотрицательности. Вы можете пользоваться следующими шкалами:
Значения электроотрицательности вам понадобятся при записи формул бинарных соединений, состоящих из двух элементов. К примеру, формула оксида меди Cu 2 O — первым элементом следует записывать тот, чья электроотрицательность ниже.
В момент образования химической связи если разница электроотрицательности между элементами больше 2,0 образуется ковалентная полярная связь, если меньше, ионная.
Степень окисления
Степень окисления
(СО)
– это условный или реальный заряд атома в соединении: условный – если связь ковалентная полярная, реальный –
если связь ионная.
Атом приобретает положительный заряд при отдаче электронов, а отрицательный заряд – при принятии электронов.
Степени окисления записываются над символами со знаком «+»/«-»
. Есть и промежуточные СО. Максимальная СО элемента положительная и равна № группы, а минимальная отрицательная для металлов равна нулю, для неметаллов = (№ группы – 8)
. Элементы с максимальной СО только принимают электроны, а с минимальной, только отдают. Элементы же, имеющие промежуточные СО могут и отдавать и принимать электроны.
Рассмотрим некоторые правила, которыми стоит руководствоваться для определения СО:
СО всех простых веществ равна нулю.
Равна нулю и сумма всех СО атомов в молекуле, так как любая молекула электронейтральна.
В соединениях с ковалентной неполярной связью СО равна нулю (О 2 0), а с ионной связью равна зарядам ионов (Na + Cl — СО натрия +1, хлора -1). СО элементов соединений с ковалентной полярной связью рассматриваются как с ионной связью (H:Cl = H + Cl — , значит H +1 Cl -1).
Элементы в соединении, имеющие наибольшую электроотрицательность, имеют отрицательные степени окисления, если наименьшую положительные. Исходя из этого можно сделать вывод, что металлы имеют только «+» степень окисления.
Постоянные степени окисления
:
Водород +1. Исключение:
гидриды активных металлов NaH, CaH 2 и др., где степень окисления водорода равна –1.Кислород –2. Исключение:
F 2 -1 O +2 и пероксиды, которые содержат группу –О–О–, в которой степень окисления кислорода равна –1.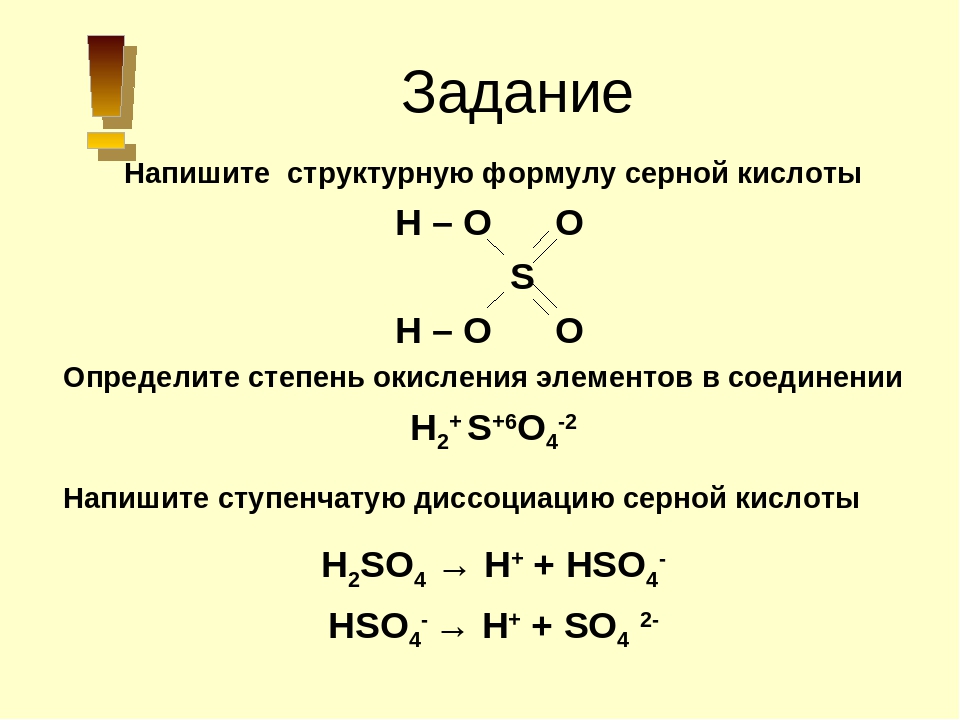
Щелочные металлы +1.
Все металлы второй группы +2. Исключение:
Hg +1, +2.
Алюминий +3.
Когда образуется ионная связь, происходит определенный переход электрона, от менее электроотрицательного атома к атому большей электроотрицательности. Так же, в данном процессе, атомы всегда теряют электронейтральность и впоследствии превращаются в ионы. Так же образуются целочисленные заряды. При образовании ковалентной полярной связи, электрон переходит только частично, поэтому возникают частичные заряды.
Валентность
Валентность
– это способность атомов образовать n — число химических связей с атомами других элементов.
А еще валентность – это способность атома удержать другие атомы возле себя. Как вам известно из школьного курса химии, разные атомы связываются друг с другом электронами внешнего энергетического уровня. Неспаренный электрон ищет для себя пару у другого атома. Эти электроны внешнего уровня называются валентными. Значит валентность можно определить и как число электронных пар, связывающих атомы друг с другом. Посмотрите структурную формулу воды: Н – О – Н. Каждая черточка – это электронная пара, значит показывает валентность, т.е. кислород здесь имеет две черточки, значит он двухвалентен, от молекул водорода исходят по одной черточке, значит водород одновалентен. При записи валентность обозначается римскими цифрами: О (II), Н (I). Может указываться и над элементом.
Каждая черточка – это электронная пара, значит показывает валентность, т.е. кислород здесь имеет две черточки, значит он двухвалентен, от молекул водорода исходят по одной черточке, значит водород одновалентен. При записи валентность обозначается римскими цифрами: О (II), Н (I). Может указываться и над элементом.
Валентность бывает постоянной либо переменной. К примеру, у щелочей металлов она постоянна и равняется I. А вот хлор в различных соединениях проявляет валентности I, III, V, VII.
Как определить валентность элемента?
Вновь обратимся к Периодической таблице. Постоянная валентность у металлов главных подгрупп, так металлы первой группы имеют валентность I, второй II. А у металлов побочных подгрупп валентность переменная. Также она переменная и у неметаллов. Высшая валентность атома равна № группы, низшая равна = № группы — 8. Знакомая формулировка. Не означает ли это то, что валентность совпадает со степенью окисления. Помните, валентность может совпадать со степенью окисления, но данные показатели не тождественны друг другу. Валентность не может иметь знака =/-, а также не может быть нулевой.
Валентность не может иметь знака =/-, а также не может быть нулевой.
Второй способ определения валентности по химической формуле, если известна постоянная валентность одного из элементов. Например, возьмем формулу оксида меди: CuО. Валентность кислорода II. Видим, что на один атом кислорода в данной формуле приходится один атом меди, значит и валентность меди равна II. А теперь возьмем формулу посложнее: Fe 2 O 3 . Валентность атома кислорода равна II. Таких атомов здесь три, умножаем 2*3 =6. Получили, что на два атома железа приходится 6 валентностей. Узнаем валентность одного атома железа: 6:2=3. Значит валентность железа равна III.
Кроме того, когда необходимо оценить «максимальную валентность», всегда следует исходить из электронной конфигурации, которая имеется в «возбужденном» состоянии.
Валентность и степень окисления – понятия, часто применяемые в неорганической химии. Во многих химических соединениях значение валентности и степень окисления элемента совпадают, именно по этой причине у школьников и студентов часто возникает путаница. У этих понятий действительно есть кое-что общее, но отличия более существенны. Чтобы понять, чем же отличаются эти два понятия, стоит узнать о них больше.
У этих понятий действительно есть кое-что общее, но отличия более существенны. Чтобы понять, чем же отличаются эти два понятия, стоит узнать о них больше.
Сведения о степени окисления
Степень окисления – вспомогательная величина, приписываемая атому химического элемента или группе атомов, которая показывает, каким образом распределены общие пары электронов между взаимодействующими элементами.
Это вспомогательная величина, не имеющая физического смысла как такового. Ее суть достаточно просто объяснить с помощью примеров:
Молекула пищевой соли NaCl
состоит из двух атомов – атома хлора и атома натрия. Связь между этими атомами ионная. У натрия на валентном уровне 1 электрон, значит у него с атомом хлора одна общая электронная пара. Из этих двух элементов хлор более электроотрицателен (обладает свойством смешать к себе электронные пары), то единственная общая пара электронов сместится к нему. В соединении элемент с более высокой электротрицательностью имеет отрицательную степень окисления, менее электроотрицательный, соответственно, положительную, а ее значение равно количеству общих пар электронов. Для рассматриваемой молекулы NaCl степени окисления натрия и хлора будут выглядеть так:
Для рассматриваемой молекулы NaCl степени окисления натрия и хлора будут выглядеть так:
Хлор, со смещенной к нему электронной парой, теперь рассматривают как анион, то есть атом, присоединивший к себе дополнительный электрон, а натрий – как катион, то есть атом, отдавший электрон. Но при записи степени окисления на первом месте идет знак, а на втором числовое значение, а при записи ионного заряда – наоборот.
Степень окисления можно определить как число электронов, которых положительному иону не хватает до электронейтрального атома, или которые нужно забрать у отрицательного иона, чтобы окислить до атома. На данном примере очевидно, что положительному иону натрия за счет смещения электронной пары не хватает электрона, а у иона хлора один электрон лишний.
Степень окисления простого (чистого) вещества, не зависимо от его физических и химических свойств, равна нулю. Молекула О 2 , например, состоит из двух атомов кислорода. У них одинаковые значения электроотрицательности, потому общие электроны не смещаются ни к одному из них. Значит, электронная пара находится строго между атомами, потому степень окисления будет нулевой.
Значит, электронная пара находится строго между атомами, потому степень окисления будет нулевой.
Для некоторых молекул бывает сложно определить, куда смещаются электроны, особенно если элементов в ней три или больше. Чтобы высчитать степени окисления в таких молекулах, нужно воспользоваться несколькими простыми правилами:
- Атом водорода почти всегда имеет постоянную степень окисления +1..
- Для кислорода этот показатель равен -2. Исключение из этого правила составляют только оксиды фтора
ОF 2 и О 2 F 2 ,
Так как фтор – элемент с наивысшей электроотрицательностью, потому он всегда смещает к себе взаимодействующие электроны. Согласно международным правилам, элемент с меньшим значением электроотрицаельности записывается первым, потому в этих оксидах кислород на первом месте.
- Если суммировать все степени окисления в молекуле, получится ноль.
- Для атомов металлов характерна положительная степень окисления.
При вычислении степеней окисления нужно помнить, что наибольшая степень окисления элемента равна номеру его группы, а минимальная — номер группы минус 8. Для хлора максимальное возможное значение степени окисления +7, потому что он в 7-ой группе, а минимальная 7-8=-1.
Для хлора максимальное возможное значение степени окисления +7, потому что он в 7-ой группе, а минимальная 7-8=-1.
Общие сведения о валентности
Валентность – число ковалентных связей, которые может образовывать элемент в разных соединениях.
В отличии от степени окисления, понятие валентности есть реальный физический смысл.
Самый высокий показатель валентности равен номеру группы в таблице Менделеева. Сера S расположена в 6-ой группе, то есть ее максимальная валентность 6. Но она может быть также 2 (H 2 S) или 4 (SO 2).
Почти для всех элементов характерна переменная валентность. Однако есть атомы, для которых эта величина постоянная. К ним относятся щелочные металлы, серебро, водород (их валентность всегда равна 1), цинк (валентность всегда 2), лантан (валентность равна 3).
Что же общего у валентности и степени окисления
- Для обозначения и той, и другой величины используют положительные целые числа, которые пишутся над латинским обозначением элемента.

- Наивысшая валентность, как и наибольшая степень окисления, совпадает с номером группы элемента.
- Степень окисления какого-либо элемента в сложном соединении совпадает с числовым значением одного из показателей валентности. Например, хлор, находясь в 7-ой группе, может иметь валентность 1, 3, 4, 5, 6, или 7, значит возможные степени окисления ±1, +3,+4,+5,+6,+7.
Основные отличия между этими понятиями
- У понятия «валентность» есть физический смысл, а степень окисления – вспомогательный термин, не имеющий реального физического смысла.
- Степень окисления может быть нулевой, больше или меньше нуля. Валентность же строго больше нуля.
- Валентность отображает число ковалентных связей, а степень окисления – распределение электронов в соединении.
Электроотрицательность (ЭО)
— это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s 2 2p 5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
Разность электроотрицательностей элементов в соединении (ΔX
) позволит судить о типе химической связи. Если величина Δ X
= 0 – связь ковалентная неполярная
.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной
, например: связь H-F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными
. Например: связь Na-Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
Степень окисления (СО)
— это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
такие условные заряды и называют степенью окисления.
На этом рисунке изображены степени окисления, характерные для первых 20 элементов.
Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева. У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО. Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Валентность
Вале́нтность
(от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей
. Если в атоме имеется n
неспаренных электронов и m
неподелённых электронных пар, то этот атом может образовывать n + m
ковалентных связей с другими атомами, т.е. его валентность будет равна n + m
. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния.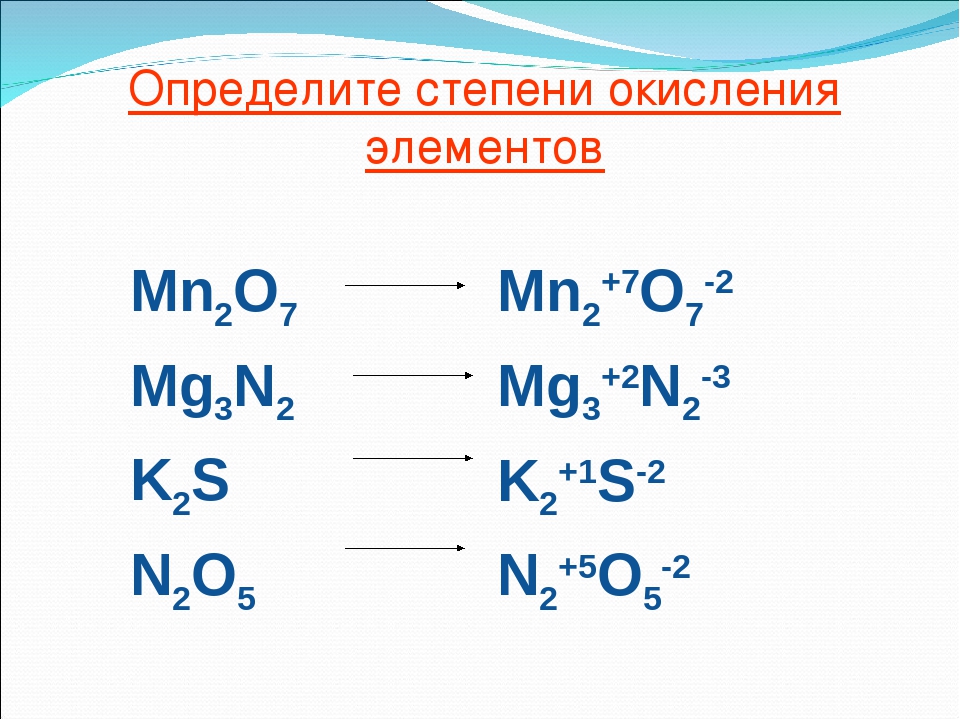 Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 — и NH 4 +), фосфора — 5 (PCl 5), серы — 6 (H 2 SO 4), хлора — 7 (Cl 2 O 7).
Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 — и NH 4 +), фосфора — 5 (PCl 5), серы — 6 (H 2 SO 4), хлора — 7 (Cl 2 O 7).
В ряде случаев, валентность может численно совпадать со степенью окисления, но ни коим образом они не тождественны друг другу. Например, в молекулах N 2 и CO реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления азота равна 0, углерода +2, кислорода −2.
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
Учимся определять валентность и степень окисления. Практика показывает, что многие обучающиеся испытывают затруднения при определении валентности и степени окисления. формирование умения давать количественные оценки и проводить расчеты валентности и степени окисления по химическим формулам в неорганических и органических соединениях, а также способствует подготовке студентов для сдачи ЕГЭ. Пособие направлено на формирование навыков самостоятельной работы с учебным материалом, осуществления поиска и использования информации, формирование и развитие творческого потенциала, повышение интереса к дисциплине. Валентность и степень окисления. Правила определения степеней окисления элементов I Валентность – это способность атомов присоединять к себе определенное число других атомов. Правила определения валентности 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. II Степень окисления Рассмотрим строение атомов фтора и натрия: — Что можно сказать о завершённости внешнего уровня атомов фтора и натрия? — Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня? Оба атома имеют незавершённый внешний уровень? Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня. F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион — анион Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион — катион Как определить степень окисления атома в ПСХЭ? Правила определения 1. 2. Кислород 3. Металлы 4. Фтор 5. Для элементов главных подгрупп Высшая Низшая Правила определения степени окисления атома в соединении: I. Степень окисления свободных атомов II. В сложном веществе Например, H [ Задание 1 1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х» (+1)*1+(х)*1+(-2)*4=0 Х=6 или (+6), следовательно, у серы CО +6, т. е. S+6 Задание 2 1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (+1)*3+(х)*1+(-2)*4=0 Х=5 или (+5), следовательно, у фосфора CО +5, т. е. P+5 Задание 3 1. Проставим известную степень окисления у водорода, а СО азота примем за «х» 2. Составим и решим уравнение, согласно правилу (II): (х)*1+(+1)*4=+1 Х=-3, следовательно, у азота CО -3, т. е. N-3 Алгоритм составления формулы по степени окисления Составление названий бинарных соединений Сравним понятия «валентность» и «степень окисления»: |
Запомни!
Валентность —
— это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: h3, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления
– это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор
высшая степень окисления ноль в простом веществе F20
кислород
высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы
(по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила
определения степени окисления
(далее обозначим: ст. ок.)
Общее правило:
Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю
(Молекула электронейтральна.), в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю:
Са
0
, O2
0
, Cl2
0
II.
ст. ок. в бинарных
c
оединениях:
Менее электроотрицательный элемент
ставится на первое место. (Исключения: С-4Н4+ метан и N-3h4+аммиак)
Нужно помнить, что
Ст. ок. металла всегда положительна
Ст. ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст. ок. вычисляется по общему правилу.
Более электроотрицательный элемент
ставится на второе место, его ст. ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1,Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, — S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III.
Степень окисления в основаниях Ме
+
n
(ОН)
n
равна количеству гидроксогрупп.
1. в гидроксогруппе ст. ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст. ок. металла равна количеству гидроксогрупп
IV. Степень окисления
в кислотах:
1. ст. ок. водорода +1, кислорода -2
2. ст. ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить,
что у кислот с высшей степени окисления центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3 угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления
в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст. ок. элемента в кислоте.
VI.
Степень окисления элемента в сложном ионе равна заряду иона.
Например, Nh5+Cl- : записываем ион NхН4+1
х + 4∙(+1) = +1
ст. ок. азота -3
Например, определить ст. ок. элементов в гексацианоферрате(III) калия К3
У калия +1: К3+1, отсюда заряд иона 3-
У железа +3 (указано в названии) 3-, отсюда (CN)66-
У одной группы (CN)-
Более электроотрицательный азот: у него -3, отсюда (CхN-3)-
ст. ок. углерода +2
VII.
Степень
окисления
углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст. ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
ст. ок. углерода -2 (при этом валентность углерода равна IV)
Задание.
Определить степень окисления и валентность фосфора в фосфорноватистой кислоте h4PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1)
∙ 3 + х + (-2)
∙ 2 = 0, отсюда х = +1.
Определим валентность фосфора в этой кислоте.
Известно, что это — одноосновная кислота, поэтому только один атом водорода связан с атомом кислорода. Учитывая, что водород в соединениях одновалентен, а кислород — двухвалентен, получаем структурную формулу, из которой видно, что фосфор в этом соединении имеет валентность пять.
Графический метод определения степени окисления
в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом
, при этом получается усредненное значение степени окисления
. Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления).
Рассмотрим такой случай:
Пример 1
. Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + h3SO4 ® CO2 + h3O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = — 2/5
В электронном балансе учитываем все 5 атомов углерода:
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = № группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF 2). Расставим известные степени окисления:
Обозначим степень окисления серы как x
:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH 4 + (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH 4 + , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2- .
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x
и y
соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x
и y
:
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать .
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s,
т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных () орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH 3), азотистой кислоты (HNO 2), треххлористого азота (NCl 3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор() предоставляет ее другому атому с вакантной () орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d
-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO 3 или оксида азота N 2 O 5 ? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная
π
-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O 3 , бензола C 6 H 6 и т.д.
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d
-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s
-орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d
-подуровня, распаривание электронов s
и p-
орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H 2 S.
Как мы видим, у атома серы на внешнем уровне появляется d
-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p
-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO 2 , SF 4 , SOCl 2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s
-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO 3 , H 2 SO 4 , SO 2 Cl 2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Презентация по химии на тему «Степень окисления. Определение степени окисления» (8 класс)
Опорная схема урока по теме:
«Степень окисления. Определение степени окисления»
Класc: Ф.И. ученика:
I. Степень окисления — это условный заряд атома в молекуле или кристалле при условии, что все связи имеют ионный характер.
Виды степеней окисления:
Положительная – равна числу отданных электронов данным атомом (проявляют металлы и неметаллы, кроме F, He и Ne)
Отрицательная – равна числу принятых электронов данным атомом (проявляют только неметаллы)
Нулевого значения (у элементов, входящих в состав простых веществ)
Правила определения степени окисления атома:
1. В простом веществе степень окисления атома равна нулю
Н20, СI20, F20, S0, AI0
2. Водород в большинстве соединений имеет степень окисления «+1», кроме соединений с активными металлами, где степень окисления «-1»: Na+1H-1
H+1F-1 , H+1Cl-1 , H+1Br-1 , h3+10-2 , N-3h4+1
3. Кислород в большинстве случаев имеет степень окисления «-2» (исключением являются: h3+1O2-1, O+2F2-1)
h3+1O-2 , S+4O2-2 , K2+1O-2 , P2+5O5-2
4. Сумма степеней окисления всех элементов в молекуле с учетом индексов равна нулю
Cl2O7
2x=+14
Cl2xO7-2
x= +7
2x + 7×(-2)=0;
Cl2+7O7-2
5. Степень окисления F во всех соединениях равна «-1»: Na+1 F-1, H+1 F-1
6. Степень окисления металлов главных подгрупп I, II, III групп во всех соединениях равна «+1», «+2», «+3» соответственно
I II III
Na+1H-1 Ca+2h3-1 Al+3h4-1
Na2+1O-2 Ca+2O-2 Al2+3O3-2
I. Определение степени окисления элементов в соединениях
Алгоритм определения степени окисления:
1. Сначала расставляют известные степени окисления (правила 1,2,3,5,6)
2. Затем по правилу 4 определяют неизвестную степень окисления атома
H+1NxO3-2
1+x+3*(-2)=0
x= +5
II. Закрепление материала
Задание 1. Определите степени окисления атомов в соединениях:
А) NaF h3O CaBr2 h3 P2O5 Fe
Б) h3CO3 Ph4 Nh4 Ch5 P4 Cl2 Cu HNO3
Задание 2. Среди списка веществ выпишите отдельно те, в которых атом азота проявляет степень окисления +3 и те, где азот проявляет степень +5.
N2O3 KNO2 N2O5 HNO3 Nh4 NO NO2
Ca(NO2)2 NaNO3 Ba(NO3)2 HNO2 N2O
III. Контроль усвоения знаний, полученных на уроке.
IV. Домашнее задание:
1. Задание 1 (Б)
2. Учебник:_п.54, №_1, 4, 5, 6, 12__(Химия 8 класс, Еремин В.В., Кузьменко Н.Е. и др.)
3. Выучить правила определения степени окисления
F2, HCL, SO3, h3CO3, h3S, химия
5-9 класс
Krussia51
18 марта 2015 г., 19:36:51 (6 лет назад)
Раиска1702
18 марта 2015 г., 22:19:29 (6 лет назад)
F2 валентность,окисление 0 1)H валентность 1,CL валентность 1,окисление CL -1,Н+1 ) S валентность 3,О3 валентность 2,окисление над О3 ставим -2,а над S +6) h3-валентность 1,СО3 валентность 2, H+1,С+4,О-2)h3S валентность 2,степень окисления над H +1 а над S -2)
Olga2000egorova
19 марта 2015 г., 1:05:21 (6 лет назад)
Хотя бы первые три
Ответить
Другие вопросы из категории
Seasafge / 16 марта 2015 г., 16:06:17
какие из этих веществ с ионной связью!?
NaBr,Al(OH)3,BaO,MnO2,Ba(OH)2,AgNO3,O3,NO2,CaO,h4PO4,CaC2,F2,HBr.
Читайте также
Mechanik / 21 марта 2015 г., 4:05:50
Укажите валентность и степень окисления атомов в молекуле азота (N2).
Укажите валентность и степень окисления атомов в молекуле водорода (h3).
Укажите валентность и степень окисления атома кислорода в молекуле воды (h3O).
Укажите валентность и степень окисления атома хлора в молекуле хлороводорода (HCl).
P.S. Если не трудно, изобразите пожалуйста структурную (графическую) формулу этих молекул.
1998vk / 26 дек. 2013 г., 16:26:17
1) допишите уравнения реакций,укажите степени окисления элементов и расставьте коэффициенты методом электронного баланса: Са+О2 ->, N2+h3 ->. 2)
определите степень окисления каждого элемента,расставьте коэффициенты методом электронного баланса: KCIO3+S -> KCI+SO2. 3) определите пожалуйста степень окисления серы в следующих соединениях: h3SO4, SO2, h3S, SO2, h3SO3. 4 в сторону атомов какого химического элемента смещаются общие электронные пары в молекулах следующих соединений: h3O, HI, PCI3, h4N, h3S, CO2? дайте пожалуйста обоснованный ответ! 5) скажите, изменяются ли степени окисления атомов при образовании воды из водорода и кислорода? 6) напишите уравнения электролитической диссоциации: нитрата меди, соляной кислоты, сульфата алюминия, гидроксида бария, сульфата цинка. 7) пожалуйста напишите молекулярные и ионные уравнения реакций между растворами: гидроксида лития и азотной кислоты, нитрата меди и гидроксида натрия, карбоната калия и фосфорной кислоты. 8) при взаимодействии растворов каких веществ одним из продуктов реакции является вода? K2CO3 и HCI: Ca(OH)2 и HNO3: NaOH и h3SO4: NaNO3 и h3SO4? напишите пожалуйста уравнения реакций в молекулярной и ионной формулах. 9) какие из перечисленных солей подвергаются гидролизу при растворении в воде: хлорид алюминия, сульфид калия, хлорид натрия? Напишите уравнения, отвечающие гидролизу.
Вы находитесь на странице вопроса «2) определить валентность и степень окисления элементов в следующих соеденениях: F2, HCL, SO3, h3CO3, h3S«, категории «химия«. Данный вопрос относится к разделу «5-9» классов. Здесь вы сможете получить ответ, а также обсудить вопрос с посетителями сайта. Автоматический умный поиск поможет найти похожие вопросы в категории «химия«. Если ваш вопрос отличается или ответы не подходят, вы можете задать новый вопрос, воспользовавшись кнопкой в верхней части сайта.
Найдите степень окисления серы в h3SO4 A + 6, класс 11, химия CBSE
Совет : Степень окисления также иногда называют степенью окисления, и это общее количество электронов, которые атом приобретает или теряет для образования химической связи с другим атомом.
Полное пошаговое решение :
Есть определенные правила, которые нужно учитывать при вычислении степеней окисления в молекуле.
и. Любой свободный элемент имеет степень окисления, равную нулю.
ii. Для одноатомных ионов степень окисления всегда равна суммарному заряду, соответствующему иону.
iii. Атом водорода имеет степень окисления $ + 1 $. Однако, когда он связан с элементом с меньшей электроотрицательностью, он показывает степень окисления $ — 1 $.
iv. Кислород в большинстве своих соединений имеет степень окисления $ — 2 $. Однако, когда он связан в пероксидах, степень окисления, соответствующая кислороду, составляет $ — 1 $.
v. Все щелочные металлы или элементы группы $ 1 $ в своих соединениях имеют степень окисления $ + 1 $.
vi. Все щелочноземельные металлы или элементы группы 2 показывают степень окисления $ + 2 $ в своих соединениях.
vii. В соединениях, состоящих из двух элементов, галоген имеет присвоенную ему степень окисления $ — 1 $.
viii. В случае нейтральных соединений сумма всех степеней окисления составляющих атомов равна нулю.
Когда рассматриваются многоатомные ионы, сумма всех степеней окисления атомов, составляющих их, равна чистому заряду многоатомного иона.
Теперь пусть степень окисления атома серы в $ {H_2} S {O_4} $ равна «X».
Применяя вышеуказанные правила для молекулы $ {H_2} S {O_4} $, уравнение принимает следующий вид:
$ 2 \ times (1) + X + 4 \ times (- 2) = 0 $
Где $ 1 $ — степень окисления водорода и $ — 2 $ — степень окисления кислорода, умноженная на количество составляющих атомов.
Далее, решая для «X», получаем
$
2 + X — 8 = 0 \\
X — 6 = 0 \\
X = + 6 \\
$
Следовательно, степень окисления серы в $ {H_2} S {O_4} $ оказывается равным $ + 6 $ (вариант A).
Примечание : Учащийся должен позаботиться о том, чтобы они умножали степень окисления на составляющее количество атомов, присутствующих в данной молекуле, а также правильно наблюдали электроотрицательность.
Степени окисления (степени окисления)
Использование степеней окисления для определения того, что было окислено, а что восстановлено
Это наиболее распространенное использование степеней окисления.
Помните:
Окисление связано с увеличением степени окисления
Восстановление включает снижение степени окисления
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный потенциал, и если да, то что было окислено, а что восстановлено.
Пример 1:
Это реакция между магнием и соляной кислотой или газообразным хлороводородом:
Изменилась ли степень окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и как несоединенные элементы с другой.Чтобы быть уверенным, проверьте все степени окисления :.
Степень окисления магния увеличилась — он окислился. Степень окисления водорода упала — она уменьшилась. Хлор находится в одной и той же степени окисления по обе стороны уравнения — он не был окислен или восстановлен.
Пример 2:
Реакция между гидроксидом натрия и соляной кислотой:
Проверка всех степеней окисления:
Ничего не изменилось.Это не окислительно-восстановительная реакция.
Пример 3:
Это подлый! Реакция между хлором и разбавленным холодным раствором гидроксида натрия:
Очевидно, что хлор изменил степень окисления, потому что он попал в соединения, начиная с исходного элемента. Проверка всех степеней окисления показывает:
Хлор только вещь, чтобы изменить степень окисления. Он был окислен или восстановлен? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала.Другой был окислен.
Это хороший пример реакции диспропорционирования . Реакция диспропорционирования — это реакция, в которой одно вещество одновременно окисляется и восстанавливается.
Использование степеней окисления для определения окислителя и восстановителя
Это лишь незначительное дополнение к последнему разделу. Если вы знаете, что было окислено, а что восстановлено, вы можете легко определить, что такое окислитель и восстановитель.
Пример 1
Это реакция между ионами хрома (III) и металлическим цинком:
Степень окисления хрома изменилась с +3 до +2, и поэтому он был восстановлен. Цинк перешел от нулевой степени окисления в элементе до +2. Он был окислен.
Так что же происходит с уменьшением? Это цинк — цинк отдает электроны ионам хрома (III). Итак, цинк — это восстановитель.
Точно так же вы можете вычислить, что окислителем должны быть ионы хрома (III), потому что они отбирают электроны у цинка.
Пример 2
Это уравнение реакции между ионами манганата (VII) и ионами железа (II) в кислых условиях. Это прорабатывается далее на странице.
Если взглянуть быстро, становится очевидно, что ионы железа (II) окислены до ионов железа (III). Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3.
Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились.Если определить степень окисления марганца, то она упала с +7 до +2 — снижение.
Итак, ионы железа (II) окислены, а ионы манганата (VII) восстановлены.
Что восстановило ионы манганата (VII) — ясно, что это ионы железа (II). Железо — единственное, что имеет измененную степень окисления. Итак, ионы железа (II) являются восстановителем.
Точно так же ионы манганата (VII) должны быть окислителем.
Использование степеней окисления для определения реакционных соотношений
Это иногда полезно, когда вам нужно выработать реакционные пропорции для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения.
Помните, что каждый раз, когда степень окисления изменяется на одну единицу, переносится один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона.
Что-то еще в реакции должно терять эти электроны. Любое понижение степени окисления одного вещества должно сопровождаться увеличением степени окисления другого вещества на такую же степень окисления.
Этот пример основан на информации из старого вопроса AQA уровня A.
Ионы, содержащие церий в степени окисления +4, являются окислителями. (Они более сложные, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2-). При этом церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы реагирующие пропорции?
Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна снизиться на 4 для компенсации.
Но степень окисления церия в каждом из его ионов падает только с +4 до +3, то есть на 1. Таким образом, очевидно, что для каждого иона молибдена должно быть задействовано 4 иона церия.
Реакционные пропорции: 4 церийсодержащих иона на 1 ион молибдена.
Или возьмем более общий пример, включающий ионы железа (II) и ионы манганата (VII). . .
Раствор манганата калия (VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа (II) до ионов железа (III).При этом ионы манганата (VII) восстанавливаются до ионов марганца (II). Используйте степени окисления, чтобы составить уравнение реакции.
Степень окисления марганца в ионе манганата (VII) +7. Название говорит вам об этом, но попробуйте еще раз просто для практики!
При переходе к ионам марганца (II) степень окисления марганца снизилась на 5. Каждый ион железа (II), который вступает в реакцию, увеличивает степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата (VII).
Следовательно, левая часть уравнения будет иметь вид: MnO 4 — + 5Fe 2+ +?
Правая часть будет: Mn 2+ + 5Fe 3+ +?
После этого вам придется гадать, как уравновесить оставшиеся атомы и заряды. В этом случае, например, весьма вероятно, что кислород попадет в воду. Это означает, что вам откуда-то нужен водород.
Это не проблема, потому что реакция протекает в растворе кислоты, поэтому водород вполне может происходить из ионов водорода.
В конечном итоге вы получите это:
Лично я предпочел бы выводить эти уравнения из электронных полууравнений!
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
ГЛАВА II
ГЛАВА II
A. Атомы
Периодическая таблица элементов перечисляет атомные номера
и атомные веса для каждого элемента. Атомные номера,
число протонов в каждом атоме, обычно не используется в
экологический анализ.Однако атомные веса довольно
полезный. Они представляют собой общий вес каждого атома в
атомные единицы массы (AMU) или Дальтон. Для многих элементов
приведенные в таблице атомные веса представляют собой среднее значение атомных весов.
веса каждого из встречающихся в природе изотопов, взвешенные
по их численности в биосфере. Таблица 2.1 является
алфавитный список стабильных элементов с их атомарными
числа и веса.
B. Молекулы и химические связи
1.Виды облигаций
а. Ионные связи — перенос электрона для завершения
октет.
атомов в ионы
Na + Cl ———> NaCl или Na + + Cl- (2.1)
(2.2)
г. Ковалентные связи — совместное использование одного или нескольких электронов
пар
Одинарная связь
2 Н + О ————> Н-О-Н (2.3)
(2,4)
Двойная связь
2 O —————> O = O (2,5)
(2,6)
2.Валентность.
Валентность атома — это количество химических связей, которые он
образует с другими атомами, в том числе ионными и ковалентными. Многие
элементы имеют более одной валентности, как указано в таблице 2.1.
Элементы в первом столбце периодической таблицы (т. Е.
щелочных металлов; натрий, калий и т. д.) имеют валентность
1. Поэтому их называют одновалентными металлами. Те, кто в
вторая колонка (т.е. щелочноземельные элементы; магний, кальций,
и т. д.) имеют валентность 2 и называются двухвалентными.
С.Состояние окисления
Степень окисления характеризуется степенью окисления
который является зарядом, который можно было бы ожидать от атома, если бы он был
диссоциировать от окружающей молекулы или иона. Это может быть
положительное или отрицательное число, обычно целое число
между -VII и + VII (римские цифры обычно используются для
представляют степень окисления). Эта концепция полезна в
балансирование химических уравнений и выполнение определенных
расчеты. Правила расчета степени окисления:
следующим образом:
а.Степень окисления атомов или ионов просто равна
заряд вида. Например, степень окисления
ионов натрия, Na + или хлорида, Cl-, равно + I и -I
соответственно.
г. Степень окисления атомов в элементе
молекула или гомоядерная ковалентная молекула (например, кислород, O = O)
равно нулю.
г. Степень окисления атомов в ковалентной
неэлементная молекула определяется поэтапно.
Гетероядерные ковалентные связи (т. Е. Где разные атомы
соединены ковалентной связью), как правило, полярны, что
есть, электроны не распределяются равномерно между двумя
атомы.Число окисления определяется путем представления заряда
которые существовали бы, если бы эти полярные связи стали
полностью ионный. Другими словами, степень окисления — это
заряд на каждом атоме после того, как все электроны связи были
назначен более электроотрицательному из двух атомов, соединенных
каждой связью. В общем, чем менее металлический атом (
ближе к верхнему правому углу периодической
таблица), тем она более электроотрицательна. Однако когда
сомневаюсь, следует обратиться к сравнительному
электроотрицательности (см. таблицу 2.1). Где два атома
идентичны, ковалентная связь неполярная и связь
электроны делятся поровну.
В большинстве случаев можно отнести все водороды к окислительным.
состояние + I (исключение: гидриды [-I]), кислород и
степень окисления -II (исключение: пероксиды [-I]). Затем
молекула расщепляется по связям между похожими атомами (например,
Связи C-C и C = C). Сумма всех валентностей в каждом
фрагмент молекулы должен равняться общему заряду
та часть молекулы (обычно нулевая).Из этого
ограничение, степень окисления остальных атомов
(обычно углерод, азот и сера) могут быть определены.
Таблица 2.1
Свойства стабильных элементов
Сноска 1
Элемент | Символ | Атомный # | Атомный вес. | Валентность | Электроотрицательность |
|---|---|---|---|---|---|
Алюминий | Аl | 13 | 26.98 | 3 | 1,47 |
Сурьма | Сб | 51 | 121,75 | 3,5 | 1,82 |
Аргон | Ар | 18 | 39.95 | 0 | |
Мышьяк | Как | 33 | 74.92 | 3,5 | 2,20 |
Барий | Ba | 56 | 137,34 | 2 | 0,97 |
Бериллий | Be | 4 | 9.01 | 2 | 1,47 |
висмут | Bi | 83 | 208.98 | 3,5 | 1,67 |
Бор | Б | 5 | 10,81 | 3 | 2,01 |
Бром | Br | 35 | 79.91 | 1,3,5,7 | 2,74 |
Кадмий | КД | 48 | 112.40 | 2 | 1,46 |
Кальций | Ca | 20 | 40,08 | 2 | 1.04 |
Углерод | С | 6 | 12.01 | 2,4 | 2,50 |
Церий | CE | 58 | 140.12 | 3,4 | 1.06 |
Цезий | CS | 55 | 132,91 | 1 | 0,86 |
Хлор | Класс | 17 | 35,45 | 1,3,5,7 | 2.83 |
Хром | Кр | 24 | 52,00 | 2,3,6 | 1,56 |
Кобальт | Co | 27 | 58.93 | 2,3 | 1,70 |
Медь | Cu | 29 | 63.54 | 1,2 | 1,75 |
Диспрозий | Cy | 66 | 162,50 | 3 | 1,10 |
Эрбий | Er | 68 | 167,26 | 3 | 1,11 |
Европий | Eu | 63 | 151.96 | 2,3 | 1.01 |
Фтор | Ф | 9 | 19,00 | 1 | 4,10 |
Гадолиний | Gd | 64 | 157,25 | 3 | 1,11 |
Галлий | Ga | 31 | 69.72 | 2,3 | 1,82 |
Германий | Ge | 32 | 72,59 | 4 | 2,02 |
Золото | Au | 79 | 196.97 | 1,3 | 1,42 |
Гафний | Hf | 72 | 178.49 | 4 | 1,23 |
Гелий | He | 2 | 4,00 | 0 | |
Холмиуум | Ho | 67 | 164,93 | 3 | 1,10 |
Водород | H | 1 | 1.01 | 1 | 2,20 |
Индий | В | 49 | 114,82 | 3 | 1,49 |
Йод | I | 53 | 126,90 | 1,3,5,7 | 2,21 |
Утюг | Fe | 26 | 55.85 | 2,3 | 1,64 |
Криптон | Кр | 36 | 83,80 | 0 | |
Лантан | La | 57 | 138,91 | 3 | 1.08 |
Свинец | Пб | 82 | 207.19 | 2,4 | 1,55 |
Литий | Ли | 3 | 6.94 | 1 | 0,97 |
Лютеций | Лю | 71 | 174,97 | 3 | 1,14 |
Магний | мг | 12 | 24.31 | 2 | 1,23 |
Марганец | Мн | 25 | 54.94 | 2,3,4,6,7 | 1,60 |
Таблица 2.1, продолжение
Свойства стабильных элементов
Элемент | Символ | Атомный # | Атомный вес. | Валентность | Электроотрицательность |
|---|---|---|---|---|---|
Меркурий | Hg | 80 | 200,59 | 1,2 | 1,44 |
молибден | Пн | 42 | 95.94 | 3,4,6 | 1.30 |
Неодим | Nd | 60 | 144,24 | 3 | 1,30 |
Неон | Ne | 10 | 20,18 | 0 | 1.07 |
Никель | Ni | 28 | 58.71 | 2,3 | 1,75 |
Ниобий | Nb | 41 | 92.91 | 3,5 | 1,23 |
Азот | № | 7 | 14.01 | 3,5 | 3,07 |
Осмий | Ос | 76 | 190.2 | 2,3,4,8 | 1,52 |
Кислород | О | 8 | 16,00 | 2 | 3,50 |
Палладий | Pd | 46 | 106,4 | 2,4,6 | 1.39 |
фосфор | п. | 15 | 30,97 | 3,5 | 2,06 |
Платина | Pt | 78 | 195.09 | 2,4 | 1,44 |
Калий | К | 19 | 39.10 | 1 | 0,91 |
празеодим | Пр | 59 | 140.91 | 3 | 1.07 |
Рений | Re | 75 | 186,2 | 1,46 | |
Родий | Rh | 45 | 102.91 | 3 | 1,45 |
Рубидий | руб. | 37 | 85,47 | 1 | 0,89 |
Рутений | Ру | 44 | 101,07 | 3,4,6,8 | 1.42 |
Самарий | См | 62 | 150,35 | 2,3 | 1.07 |
Скандий | SC | 21 | 44.96 | 3 | 1,20 |
Селен | SE | 34 | 78.96 | 2,4,6 | 2,48 |
Кремний | Si | 14 | 28.09 | 4 | 1,74 |
Серебро | Ag | 47 | 107,87 | 1 | 1,42 |
Натрий | Na | 11 | 22.99 | 1 | 1.01 |
Стронций | Sr | 38 | 87,62 | 2 | 0,99 |
Сера | S | 16 | 32,06 | 2,4,6 | 2,44 |
Тантал | Ta | 73 | 180.95 | 5 | 1,33 |
Теллур | Te | 52 | 127,60 | 2,4,6 | 2,01 |
Тербий | ТБ | 65 | 158.92 | 3 | 1.10 |
Таллий | Тл | 81 | 204,37 | 1,3 | 1,44 |
торий | Чт | 90 | 232,04 | 4 | 1,11 |
Тулий | ТМ | 69 | 168.93 | 3 | 1,11 |
Олово | Sn | 50 | 118,69 | 2,4 | 1,72 |
Титан | Ti | 22 | 47,90 | 3,4 | 1,32 |
Вольфрам | Вт | 74 | 183.85 | 6 | 1,40 |
Уран | U | 92 | 238,03 | 4,6 | 1,22 |
Ванадий | В | 23 | 50.94 | 3,5 | 1,45 |
Ксенон | Xe | 54 | 131.30 | 0 | |
Иттербий | Y | 39 | 88.91 | 2,3 | 1.06 |
цинк | Zn | 30 | 65,37 | 2 | 1,66 |
цирконий | Zr | 40 | 91.22 | 4 | 1,22 |
Таблица 2.2
Общие группы атомов
Имя | Формула | Заряд | Специальная номенклатура |
|---|---|---|---|
Аммоний | Nh5 | +1 | |
Гидроксид | OH | -1 | |
Бикарбонат | HCO3 | -1 | h3CO3-угольная кислота |
Нитрат | NO3 | -1 | HNO3-азотная кислота |
Нитрит | НО2 | -1 | HNO2-азотистая кислота |
Перманганат | MnO4 | -1 | |
Гипохлорит | OCl | -1 | HOCl-гипохлористый |
Йодат | IO3 | -1 | |
Хлорат | ClO3 | -1 | |
Бромат | BrO3 | -1 | |
Хлорит | ClO2 | -1 | |
Хлорат | ClO3 | -1 | |
Перхлорат | ClO4 | -1 | HClO4-хлорная |
Метафосфат | PO3 | -1 | HPO3-метафосфорный |
Карбонат | CO3 | -2 | |
Сульфат | SO4 | -2 | h3SO4-серная кислота |
Сульфит | SO3 | -2 | |
Дихромат | Cr2O7 | -2 | |
Фосфат (ортофосфат) | PO4 | -3 | h4PO4-фосфорный |
Пример 2.1: Какова степень окисления атомов в
уксусная кислота?
Сначала мы знаем, что водород, вероятно, окисляется.
состояние + I, а кислород -II. Тогда мы можем разбить атом
на связи углерод-углерод, и каждая половина должна иметь
степень окисления нулевая. Таким образом, углерод на
левая сторона должна иметь степень окисления -III, а
один с правой стороны, + III. Это пример
переменная степень окисления углерода, которая колеблется от -4 до
метан, до +4 для углекислого газа.Углерод может даже присутствовать
в разных степенях окисления в одной и той же молекуле, так как
проиллюстрировано этим примером.
D. Меры концентрации
Количественная аналитическая химия основана на умении
измерить концентрацию и выразить ее недвусмысленно
способ. В науках об окружающей среде концентрации могут быть
выражается на основе массы, молярности или эквивалента
основание.
1. Массовая основа.
Это просто выражение массы аналита на
объем образца (например,г. на литр для водной пробы).
Поскольку большинство вод и сточных вод имеют плотность почти равную
в чистую воду, один литр этих образцов может быть явно
приравнивается к одному килограмму. Так, например, 1 мг / л
концентрация может быть выражена как 1 мг / кг. Это
безразмерное число, равное 1/1000000 или 1 часть на
миллион. По этой причине концентрации мг / л и ppm являются
часто используются как взаимозаменяемые. В таблице 2.3 перечислены масса / объем.
концентрации, обычно используемые в области окружающей среды с
эквивалентные единицы массы / массы для водных образцов.
Таблица 2.3
Единицы измерения массовой концентрации
Единицы массы / объема | Масса / Масса | Типичные области применения |
|---|---|---|
г / л (граммы / литр) | (частей на тысячу) | Базовые растворы |
мг / л (миллиграммы / литр) 10-3 г / л | частей на миллион | Обычные загрязнители (DO, нитрат, хлорид) |
мкг / л 10-6 г / л | ppb (частей на миллиард) | Тригалометаны, фенолы. |
нг / л (нанограммы / литр) 10-9 г / л | ppt (частей на триллион) | ПП, диоксины |
пг / л (пикограммы / литр) 10-12 г / л | Феромоны |
Для высококонцентрированных исходных растворов, особенно
кислоты и основания, концентрации иногда выражаются как
отношение коммерческого соединения к воде.Например, 1 + 3
HCl готовится путем добавления одного объема соляной кислоты.
(конц.) на три части дистиллированной воды. Таким образом, это 25% от
концентрация технической концентрированной соляной
кислота.
Концентрация может также относиться к определенной части
молекула. Например, раствор сульфита калия будет
содержат определенную концентрацию K2SO3. Однако можно
хотите знать только концентрацию сульфита, или, возможно,
любой из элементарных компонентов: калий, сера или
кислород.
2. Молярные концентрации.
Молярные концентрации выражаются числом молей.
вещества, присутствующего в объеме одного литра. Родинка — это грамм
молекулярная масса (GMW) или, в более общем смысле, формула в граммах
вес (GFW) вещества. Это соответствует количеству
вещества в граммах, что равно атомному весу
вещество, будь то атом, молекула или ион.
Полезность этих единиц заключается в том, что один моль содержит одинаковые
количество атомов, молекул или ионов (Число Авогадро,
6.02×1023) независимо от принадлежности вещества. А
раствор 1 моль вещества, растворенного в литре
вода (т. е. 1 моль / л) называется одномолярным раствором и является
говорят, что молярность равна единице.
(2.7a)
или более широко:
(2.7b)
Пример 2.2: Какова концентрация в граммах / литр
a 1 молярный раствор сульфата аммония, (Nh5) 2SO4?
2 x MW (N) = 2 x 14 = 28
8 x MW (H) = 8 x 1 = 8
1 x MW (S) = 1 x 32 = 32
4 x MW (O) = 4 x 16 = 64
GMW = 132
Ответ: 132 г / л.
3. Эквивалентные концентрации.
Обычно используется эквивалентная концентрация или нормальность
с реакциями кислоты / основания или окисления / восстановления. это
рассчитано таким образом, что один эквивалент вещества будет реагировать
ровно с одним эквивалентом другого вещества. A 1 Нормальный
раствор содержит 1 грамм эквивалентного веса (GEW)
вещества на литр объема.
(2,8)
Грамм эквивалентный вес — это масса вещества.
который содержит один грамм атома «доступного»
водород или его эквивалент.
(2,9)
, где Z — некоторое положительное целое число (обычно 1,2 или 3)
что представляет собой количество эквивалентов на моль. А
раствор, содержащий один эквивалент на литр, называется 1
Нормальный (или 1 Н). Решения дробной нормальности часто
выражается в виде дроби; например, 0,25 Нормальный может быть
сокращенно N / 4.
Из уравнений 2.7, 2.8 и 2.9 следующие
связь между молярностью и нормальностью может быть получена.
Обратите внимание: поскольку Z обычно больше или равно
единицы нормальность решения будет равна или
больше, чем его молярность.
Нормальность = Молярность * Z (2,10)
Для кислот Z — это просто количество протонов, которые будут
пожертвовано.
Z = 1, для монопротонных кислот (например, соляной кислоты или
уксусная кислота)
HCl ———> H + + Cl- (2,11)
Ch4COOH ——> Ch4COO- + H + (2,12)
Z = 2, для дипротонных кислот (например, серной кислоты)
ч3SO4 ———> 2H + + SO42 (2,13)
Z = 3, для трипротонных кислот (например, фосфорной кислоты)
h4PO4 ———> 3H + + PO43 (2.14)
Для оснований Z — количество выделившихся гидроксид-ионов,
потому что один гидроксид нейтрализует один протон с образованием
вода.
Z = 1, для моногидроксидов (например, гидроксида натрия)
NaOH ————> Na + + OH- (2,15)
Z = 2, для дигидроксидов (например, гидроксида кальция)
Ca (OH) 2 ———-> Ca + + 2OH- (2,16)
Для видов, подвергающихся окислению или восстановлению (редокс)
реакций, Z — количество электронов, перенесенных за
молекула.
Z = 1, для одноэлектронных передач, таких как
окисление двухвалентного железа до трехвалентного железа.
Fe + 2 ————-> Fe + 3 + e- (2.17)
Z = 6, для шести электронных переносов, таких как восстановление
дихромата калия в трехвалентный хром.
K2Cr2O7 + 7H + + 6e- ———-> 2K + + 2Cr + 3 + 7OH-
(2,18)
Для других реакций, таких как осаждение или
комплексообразования Z будет зависеть от конкретной стехиометрии.
Однако в большинстве случаев значение Z будет равно
значение степени окисления атома (или группы), которое будет
будет реагировать, умноженное на количество этих атомов (или групп), которые
связаны в реагирующей молекуле.Например, есть два
атомы Al (+ III) в одной молекуле квасцов (Al2 (SO4) 3 18h3O).
Следовательно, значение Z для квасцов равно шести.
Пример 2.3: Рассмотрим раствор аммония.
Сульфат получают растворением 66 г безводного соединения.
в воде и разводя до 1 л. Какая концентрация
этого решения в:
а) г / л?
б) моль / л?
в) эквивалентов / л?
г) г / л в виде сульфата?
e) г / л как N?
Ответ:
а) 66 г / л
б) В примере 2.1, грамм молекулярной массы аммония
сульфата было определено 132 г / моль. Итак, используя уравнение
2.7, на ГП:
Молярность = 132 г / моль = 0,5 моль / л или 0,5 М.
c) Без какой-либо конкретной информации об использовании
этого решения, можно было бы просто предположить, что либо
сульфатная группа или группа аммония будут реагировать
разновидность. В любом случае Z должно быть равно двум (произведение
степень окисления, умноженная на количество групп). С использованием
уравнение 2.10, вычисляется:
Нормальность = 0.5 моль / л * 2 эквивалента / моль
= 1 эквивалент / л или 1,0 Н или Н / 1.
d) GFW для сульфата:
GFW = 32 + 4 * 16 = 96.
Молярность сульфата:
Молярность = 0,5 моль- (Nh5) 2SO4 / л * 1
моль-SO4 / моль- (Nh5) 2SO4
= 0,5 моль-SO4 / л
Затем, переставляя уравнение 2.7b, получаем:
масса / л = молярность * GFW = 0,5 моль-SO4 / л * 96
г-SO4 / моль-SO4
= 48 г-SO4 / л
e) GFW для азота просто 14:
Молярность азота:
Молярность = 0.5 моль- (Nh5) 2SO4 / л * 2
моль-N / моль- (Nh5) 2SO4
= 1 моль-Н / л
Опять же, переставляя уравнение 2.7b, получаем:
масса / л = молярность * GFW = 1 моль-Н / л * 14
г-N / моль-N
= 14 г-н / л или 14 г Nh4-н / л
E. pC
пКл определяется как отрицательное значение логарифма
молярная концентрация любого химического вещества, «C»
(уравнение 2.19). Это обозначение чаще всего используется в
в сочетании с концентрацией ионов водорода (т.е.д, pH).
Поскольку ионы водорода вступают в реакцию со многими видами, обнаруженными в
воды, их концентрация имеет решающее значение для понимания
кинетика и термодинамика водных химических процессов. Это
часто проще всего основывать химические модели таких систем на
pH, и в результате pH упоминается как
«основная переменная» (см. Штум и Морган, 1981,
Глава 3)
пКл = -log [С] (2,19)
F. Уравновешивание химических уравнений
Сбалансированные химические уравнения соответствуют законам
сохранение массы и сохранение заряда.Закон
сохранение массы диктует, что общее количество атомов
каждого типа на одной стороне уравнения должны равняться
номер с другой. Для сохранения заряда необходимо, чтобы
чистый заряд всех реагентов равен чистому заряду всех
продукты. Чтобы получить сбалансированное уравнение, необходимо
начать с точного знания личности всех
реактивы и все продукты. Тогда законы сохранения
масса и заряд могут быть удовлетворены путем регулировки
коэффициенты, связанные с любым из реагентов или
продукты.Часто этого бывает недостаточно. Можно также иметь
добавить переменное количество молекул воды (h3O) или ее
составляющие (H + или OH-) с обеих сторон. Это
приемлемая практика, потому что очень сложно
определить, производятся или потребляются эти виды
реакцию проводят в разбавленном водном растворе. Однако это
хорошо известно, что они являются обычными участниками
водно-фазные реакции.
ПРОБЛЕМЫ
2.1 Рассчитайте молекулярную массу в граммах: (a) NaNO3,
(б) Mg (OH) 2, (в) Al2 (SO4) 3, (г) KMnO4.
2.2 Сколько дихромата калия необходимо добавить в
литр воды для приготовления 0,05 молярного раствора?
2.3 Каков эквивалентный вес в граммах: (a) HClO4, (b)
BaSO4?
2,4 Уравновесить следующие уравнения:
а) CaCl2 + Na2CO3 ———-> CaCO3 + NaCl
б) MnO2 + NaCl + h3SO4 ———> MnSO4 + h3O + Cl2 +
Na2SO4
в) C6h5 (COOH) 2 + O2 ———-> CO2
Сноска1
от; Товарищ по химикам: практическое руководство
Данные, методы и ссылки.А.Дж. Гордон и Р.А. Форд,
J. Wiley & Sons Publ., Нью-Йорк, 1972 г.
ГЛАВА 22, Раздел 6
ГЛАВА 22, Раздел 6
Помимо кислорода, другими элементами группы 6А являются сера, селен, теллур и полоний. В этом разделе мы рассмотрим свойства группы в целом, а затем рассмотрим химический состав серы, селена и теллура. Мы не будем много говорить о полонии, который образуется при радиоактивном распаде радия. У этого элемента нет стабильных изотопов, и он содержится в радийсодержащих минералах только в незначительных количествах.
Общие характеристики элементов группы 6А
Элементы группы 6A имеют общую внешнюю электронную конфигурацию ns 2 np 4 , где n имеет значения в диапазоне от 2 до 6. Таким образом, эти элементы могут получить электронную конфигурацию благородного газа с помощью добавление двух электронов, что приводит к степени окисления -2. Поскольку элементы группы 6A являются неметаллами, это обычная степень окисления. Однако, за исключением кислорода, элементы группы 6A также обычно находятся в положительных степенях окисления до +6, и они могут иметь расширенные валентные оболочки.Таким образом, встречаются такие соединения, как SF 6 , SeF 6 и TeF 6 , в которых центральный атом находится в степени окисления +6 с более чем октетом валентных электронов.
Таблица 22.5 суммирует некоторые из наиболее важных свойств атомов элементов группы 6A. Стандартный потенциал восстановления, указанный в последней строке таблицы, относится к восстановлению элемента в его стандартном состоянии с образованием H 2 X ( водн. ) в кислом растворе.В большинстве свойств, перечисленных в таблице 22.5, мы видим регулярные изменения в зависимости от атомного номера. Например, атомные и ионные радиусы увеличиваются, а энергии ионизации уменьшаются, как и ожидалось, по мере продвижения по семейству.
Обратите внимание, что легкость уменьшения свободного элемента до формы H 2 X сильно варьируется в зависимости от серии. В то время как кислород очень легко восстанавливается до степени окисления -2, потенциал восстановления теллура сильно отрицателен. Эти наблюдения указывают на все более металлический характер элементов группы 6А по мере увеличения атомного номера.Физические свойства элементов также соответствуют возрастающему металлическому характеру. На вершине семейства находятся кислород, двухатомная молекула, и сера, непроводящее твердое вещество, плавящееся при 113 ° C. Внизу находится теллур, стабильная форма которого имеет яркий блеск, низкую электропроводность и температуру плавления 452 ° C.
Появление и получение серы, селена и теллура
Крупные подземные месторождения являются основным источником элементарной серы.Процесс Frasch , показанный на рисунке 22.24, используется для получения элемента из этих отложений. Метод основан на низкой температуре плавления и низкой плотности серы. Перегретая вода нагнетается в залежь, где плавит серу. Затем сжатый воздух выталкивает расплавленную серу по трубе на поверхность выше, где сера охлаждается и затвердевает.
РИСУНОК 22.24. Добыча серы по процессу Фраша. Процесс назван в честь Германа Фраша, который изобрел его в начале 1890-х годов.Этот процесс особенно полезен для извлечения серы из отложений, расположенных под зыбучими песками или водой.
Сера также широко встречается в виде сульфидных и сульфатных минералов. Его присутствие в качестве второстепенного компонента угля и нефти представляет собой серьезную проблему. Сжигание этих «нечистых» видов топлива приводит к серьезному загрязнению оксидами серы. (Для получения дополнительной информации см. Раздел 18.4) Операции, в которых сульфидные минералы используются в качестве источников металлов, также выделяют оксиды серы. Много усилий было направлено на удаление этой серы, и эти усилия увеличили доступность серы.Продажа этой серы помогает частично компенсировать затраты на процессы и оборудование для обессеривания. Около половины серы, используемой в США каждый год, производится не по технологии Фраша.
Селен и теллур встречаются в редких минералах, таких как Cu 2 Se, PbSe, Ag 2 Se, Cu 2 Te, PbTe, Ag 2 Te и Au 2 Te. Они также встречаются в качестве второстепенных компонентов в сульфидных рудах меди, железа, никеля и свинца.
Свойства и использование серы, селена и теллура
Обычно сера желтого цвета, без вкуса и почти без запаха.Он нерастворим в воде и существует в нескольких аллотропных формах. Термодинамически стабильной формой при комнатной температуре является ромбическая сера, которая состоит из гофрированных колец S 8 , как показано на рисунке 22.25. При нагревании выше температуры плавления (113 ° C) сера претерпевает множество изменений. Расплавленная сера сначала содержит молекулы S 8 и является жидкой, поскольку кольца легко скользят друг по другу. Дальнейшее нагревание этой жидкости соломенного цвета приводит к разрыву колец; затем фрагменты соединяются, образуя очень длинные молекулы, которые могут запутаться.В результате сера становится очень вязкой. Это изменение отмечено изменением цвета на темно-красновато-коричневый (рис. 22.26). Дальнейшее нагревание разрывает цепи, и вязкость снова снижается.
Большая часть из 1,3 × 10 10 кг (14 миллионов тонн) серы, производимой в США каждый год, используется в производстве серной кислоты. Сера также используется при вулканизации резины — процессе, который делает резину более жесткой за счет образования поперечных связей между полимерными цепями. (Для получения дополнительной информации см. Раздел 12.2)
Наиболее стабильные аллотропы селена и теллура — это кристаллические вещества, содержащие спиральные цепочки атомов, как показано на рис. 22.27. Каждый атом цепи находится рядом с атомами в соседних цепочках, и похоже, что происходит некоторое совместное использование электронных пар между этими атомами, как показано пунктирными линиями на рис. 22.27.
РИСУНОК 22.27. Часть структуры кристаллического селена. Пунктирные линии представляют слабые связывающие взаимодействия между атомами в соседних цепочках.Теллур имеет такую же структуру.
Электропроводность селена очень низкая в темноте, но значительно увеличивается при воздействии света. Это свойство элемента используется в фотоэлементах и люксметрах. Фотокопировальные машины также зависят от фотопроводимости селена. Копировальные машины содержат ленту или барабан, покрытые пленкой селена. Этот барабан заряжается электростатически, а затем подвергается воздействию света, отраженного от копируемого изображения. Электрический заряд стекает с селена, где селен становится проводящим под воздействием света.Черный порошок («тонер») прилипает только к тем участкам, которые остаются заряженными. Фотокопия делается, когда тонер переносится на лист обычной бумаги, который нагревается для сплавления тонера с бумагой.
Оксиды, оксикислоты и оксианионы серы
Диоксид серы был впервые открыт Джозефом Пристли в 1774 году, когда он нагрел ртуть концентрированной серной кислотой:
[22,49]
В лаборатории SO 2 получают действием водной кислоты на сульфитную соль:
[22.50]
Диоксид серы образуется при сжигании серы на воздухе; он имеет удушающий запах и ядовит. Этот газ особенно токсичен для низших организмов, таких как грибы, и поэтому используется для стерилизации сушеных фруктов. При давлении 1 атм и комнатной температуре SO 2 растворяется в воде до 45 объемов газа на объем воды с образованием раствора с концентрацией около 1,6 M . Раствор SO 2 ( водн. ) является кислым, и мы описываем его как сернистую кислоту, H 2 SO 3 ( водн. ).Сернистая кислота — это дипротонная кислота:
[22,51]
[22,52
Соли SO 3 2 — (сульфиты) и HSO 3 — (гидросульфиты или бисульфиты) хорошо известны. Небольшие количества Na 2 SO 3 или NaHSO 3 используются в качестве пищевых добавок для предотвращения бактериальной порчи. Поскольку у некоторых людей сильная аллергия на сульфиты, теперь все пищевые продукты с сульфитами должны иметь предупреждение, указывающее на их присутствие.
Как мы видели, при сжигании серы на воздухе образуется в основном SO 2 , но также образуются небольшие количества SO 3 . В результате реакции образуется в основном SO 2 , поскольку барьер энергии активации для дальнейшего окисления до SO 3 очень высок, если реакция не катализируется. Триоксид серы имеет большое коммерческое значение, поскольку он представляет собой ангидрид серной кислоты. При производстве серной кислоты SO 2 сначала получают путем сжигания серы.Затем SO 2 окисляют до SO 3 с использованием катализатора, такого как V 2 O 5 или платины. SO 3 растворяется в H 2 SO 4 , потому что он не растворяется быстро в воде (уравнение 22.53). Образующийся в этой реакции H 2 S 2 O 7 , называемый пиросерной кислотой, затем добавляют к воде с образованием H 2 SO 4 , как показано в уравнении 22.54:
[22,53]
[22.54]
Техническая серная кислота обычно содержит 98 процентов H 2 SO 4 . Это густая бесцветная маслянистая жидкость, температура кипения которой составляет 340 ° C. Серная кислота обладает многими полезными свойствами: это сильная кислота, хороший дегидратирующий агент и умеренно хороший окислитель. Его обезвоживающая способность показана на рисунке 22.28.
Год за годом производство серной кислоты является крупнейшим из всех химических веществ, производимых в Соединенных Штатах. В 1995 году в этой стране было произведено около 4,3 × 10 10 кг (48 миллионов тонн).Серная кислота так или иначе используется почти во всех производственных процессах. Следовательно, его потребление считается стандартным показателем производственной деятельности.
Серная кислота относится к сильным кислотам. Однако в водном растворе полностью ионизируется только первый водород в серной кислоте. Второй водород ионизируется лишь частично:
Следовательно, серная кислота образует два ряда соединений: сульфаты и бисульфаты (или гидросульфаты). Бисульфатные соли являются обычными компонентами «сухих кислот», используемых для регулирования pH в плавательных бассейнах и гидромассажных ваннах; они также входят в состав многих чистящих средств для унитазов.
К сульфат-иону относится тиосульфат-ион S 2 O 3 2 —, образованный при кипячении щелочного раствора SO 3 2 — с элементарной серой:
[22,55]
Термин тио указывает на замещение кислорода серой. Структуры сульфат- и тиосульфат-ионов сравниваются на рисунке 22.29. При подкислении тиосульфат-ион разлагается с образованием серы и H 2 SO 3 .
РИСУНОК 22.29. Сравнение структур ( a ) сульфата, SO 4 2-, и ( b ) тиосульфата, S 2 O 3 2- , ионов.
Пентагидратированная соль тиосульфата натрия Na 2 S 2 O 3 • 5H 2 O, известная как «гипо», используется в фотографии. Фотопленка состоит из суспензии микрокристаллов AgBr в желатине. Под воздействием света часть AgBr разлагается, образуя очень мелкие зерна серебра.Когда пленка обрабатывается мягким восстанавливающим агентом («проявитель»), ионы Ag + в AgBr рядом с зернами серебра восстанавливаются, образуя изображение черного металлического серебра. Затем пленку обрабатывают раствором тиосульфата натрия для удаления неэкспонированного AgBr. Ион тиосульфата реагирует с AgBr с образованием растворимого комплекса тиосульфата серебра:
[22,56]
Этот этап процесса называется «исправление». Ион тиосульфата также используется в количественном анализе в качестве восстановителя йода:
[22.57]
Оксиды, оксикислоты и оксианионы Se и Te
Селен и теллур образуют кислые диоксиды и триоксиды. Диоксид селена, SeO 2 , реагирует с водой с образованием селенистой кислоты H 2 SeO 3 , слабой дипротоновой кислоты. Диоксид теллура, TeO 2 , нерастворим в воде, но соли, такие как NaHTeO 3 и Na 2 TeO 3 , образуются, когда TeO 2 растворяется в водной основе.
Окисление H 2 SeO 3 перекисью водорода дает селеновую кислоту, H 2 SeO 4 , сильную дипротонную кислоту, напоминающую серную кислоту:
[22.58]
Теллуровая кислота (также называемая ортотеллуровой кислотой) образуется при обработке TeO 2 различными водными окислителями. Можно ожидать, что формула этой кислоты будет H 2 TeO 4 по аналогии с соответствующими кислотами серы и селена. Однако ортотеллуриновая кислота — это H 6 TeO 6 , что можно рассматривать как результат добавления двух молекул H 2 O к H 2 TeO 4 . [Формулу можно также записать Te (OH) 6 .] Как и в H 5 IO 6 (рисунок 22.17), центральный атом в H 6 TeO 6 окружен шестью атомами O. Большие размеры Te и I позволяют им связываться с шестью окружающими атомами O. Ортотеллуровая кислота — слабая кислота, способная диссоциировать два протона в водном растворе (при 25 ° C, K a 1 = 2,4 × 10 — 8 , K a 2 = 1,0 × 10 — 11 ).
Сульфиды, селениды и теллуриды
Сера образует соединения путем прямого соединения со многими элементами.Когда элемент менее электроотрицателен, чем сера, образуются сульфиды , содержащие S 2 —. Например, сульфид железа (II), FeS, образуется в результате прямого соединения железа и серы. Многие металлические элементы находятся в форме сульфидных руд, например, PbS (галенит) и HgS (киноварь). Ряд родственных руд, содержащих дисульфид-ион, S 2 2 — (аналог пероксидного иона), известен как пирит . Железный пирит, FeS 2 , встречается в виде золотисто-желтых кубических кристаллов (Рисунок 22.30). Поскольку шахтеры иногда ошибочно принимают его за золото, его часто называют «золотом дураков».
Одним из наиболее важных сульфидов является сероводород H 2 S. Это вещество обычно не образуется путем прямого объединения элементов, поскольку оно нестабильно при повышенной температуре и разлагается на элементы. Обычно его получают действием разбавленной кислоты на сульфид железа (II):
[22,59]
Сероводород часто используется в лаборатории для качественного анализа ионов определенных металлов.(Для получения дополнительной информации см. Раздел 17.7)
Одно из наиболее узнаваемых свойств сероводорода — его запах; H 2 S в значительной степени отвечает за неприятный запах тухлых яиц. Сероводород на самом деле довольно токсичен. К счастью, наш нос способен обнаруживать H 2 S в чрезвычайно низких, нетоксичных концентрациях. Серосодержащие органические молекулы, обладающие аналогичным запахом, добавляют в природный газ для придания ему заметного запаха.
Летучие гидриды H 2 Se и H 2 Te во многом аналогичны H 2 S.Оба соединения обладают очень неприятным стойким запахом и токсичны. В водных растворах сила кислоты увеличивается в порядке H 2 S
Селен | химический элемент | Британника
Селен (Se) , химический элемент кислородной группы (группа 16 [VIa] периодической таблицы), тесно связанный по химическим и физическим свойствам с элементами серы и теллура. Селен встречается редко и составляет примерно 90 частей на миллиард земной коры.Иногда он встречается в несмешанном виде вместе с самородной серой, но чаще встречается в сочетании с тяжелыми металлами (медью, ртутью, свинцом или серебром) в некоторых минералах. Основным коммерческим источником селена является побочный продукт рафинирования меди; его основное применение — производство электронного оборудования, пигментов и стекла. Селен — это металлоид (элемент, промежуточный по свойствам между металлами и неметаллами). Серая металлическая форма элемента наиболее устойчива в обычных условиях; эта форма обладает необычным свойством значительного увеличения электропроводности при воздействии света.Соединения селена токсичны для животных; растения, выращенные на селеносных почвах, могут концентрировать элемент и становиться ядовитыми.
Британская энциклопедия, Inc.
Британская викторина
118 Названия и символы Периодической таблицы викторины
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 34 | |
|---|---|---|
| атомная масса | 78.96 | |
| массы стабильных изотопов | 74, 76, 77, 78, 80, 82 | |
| аморфный | 50 ° C (122 ° F) | |
| серый | 217 ° C (423 ° F) | |
| точка кипения | 685 ° C (1,265 ° F) | 9 |
| 9 90 плотность | ||
| аморфный | 4.28 г / см 3 | |
| серый | 4,79 г / см 3 | |
| степени окисления | −2, +4, +6 | |
| электронная конфигурация | 1 1 1 2 2 с 2 2 с 6 3 с 2 3 с 6 3 с 10 4 с 2 35 43594 2 35 4 |
История
В 1817 году шведский химик Йенс Якоб Берцелиус заметил красное вещество, образовавшееся из сульфидных руд рудников Фалуна, Швеция.Когда в следующем году исследовали этот красный материал, он оказался элементом и был назван в честь Луны или богини Луны Селены. Руда с необычно высоким содержанием селена была обнаружена Берцелиусом всего за несколько дней до того, как он сделал доклад о селене для научных обществ мира. Его чувство юмора очевидно в названии, которое он дал руде, эвкарит , что означает «как раз вовремя».
Возникновение и использование
Доля селена в земной коре составляет от 10 −5 до 10 −6 процентов.Его получают в основном из анодных шламов (отложений и остаточных материалов на аноде) при электролитическом рафинировании меди и никеля. Другими источниками являются дымовая пыль при производстве меди и свинца и газы, образующиеся при обжиге пирита. Селен сопровождает медь при рафинировании этого металла: около 40 процентов селена, присутствующего в исходной руде, может концентрироваться в меди, отложенной в электролитических процессах. Из одной тонны выплавленной меди можно получить около 1,5 килограмма селена.
При добавлении в стекло в небольших количествах селен обесцвечивает; в больших количествах он придает стеклу чистый красный цвет, который используется в сигнальных огнях. Этот элемент также используется для изготовления красных эмалей для керамики и стальных изделий, а также для вулканизации резины для повышения устойчивости к истиранию.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Наибольшие усилия по переработке селена прилагаются в Германии, Японии, Бельгии и России.
Аллотропия селена не такая обширная, как у серы, и аллотропы не изучены так тщательно. Только две кристаллические разновидности селена состоят из циклических молекул Se 8 : обозначенные α и β, обе существуют в виде красных моноклинных кристаллов. Серый аллотроп с металлическими свойствами образуется при выдерживании любой из других форм при температуре 200–220 ° C и является наиболее стабильным в обычных условиях.
Аморфная (некристаллическая) красная порошкообразная форма селена образуется при обработке раствора селенистой кислоты или одной из ее солей диоксидом серы.Если растворы очень разбавлены, очень мелкие частицы этого сорта образуют прозрачную красную коллоидную суспензию. Прозрачное красное стекло получается в результате аналогичного процесса, который происходит при обработке расплавленного стекла, содержащего селениты, углеродом. Стекловидная, почти черная разновидность селена образуется при быстром охлаждении других модификаций от температур выше 200 ° C. Превращение этой стекловидной формы в красные кристаллические аллотропы происходит при ее нагревании выше 90 ° C или при поддержании контакта с органическими растворителями, такими как хлороформ, этанол или бензол.
Препарат
Чистый селен получают из шламов и шламов, образующихся при производстве серной кислоты. Неочищенный красный селен растворяется в серной кислоте в присутствии окислителя, такого как нитрат калия или некоторые соединения марганца. Образуются как селеновая кислота, H 2 SeO 3 , так и селеновая кислота, H 2 SeO 4 , и их можно выщелачивать из остаточного нерастворимого материала. В других методах используется окисление воздухом (обжиг) и нагревание с карбонатом натрия с получением растворимого селенита натрия Na 2 SeO 3 · 5H 2 O и селената натрия Na 2 SeO 4 .Также можно использовать хлор: его действие на селениды металлов дает летучие соединения, включая дихлорид селена, SeCl 2 ; тетрахлорид селена, SeCl 4 ; дихлорид диселена, Se 2 Cl 2 ; и оксихлорид селена, SeOCl 2 . В одном процессе эти соединения селена превращаются водой в селенистую кислоту. Наконец, селен регенерируют путем обработки селенистой кислоты диоксидом серы.
Селен — обычный компонент руд, который ценится за содержание серебра или меди; он концентрируется в шламах, осаждаемых при электролитической очистке металлов.Были разработаны методы отделения селена от этих шламов, которые также содержат некоторое количество серебра и меди. При плавлении шлама образуется селенид серебра Ag 2 Se и селенид меди (I) Cu 2 Se. Обработка этих селенидов хлорноватистой кислотой HOCl дает растворимые селениты и селенаты, которые можно восстановить диоксидом серы. Окончательная очистка селена осуществляется повторной перегонкой.
Физико-электрические свойства
Самым выдающимся физическим свойством кристаллического селена является его фотопроводимость: при освещении электрическая проводимость увеличивается более чем в 1000 раз.Это явление возникает в результате продвижения или возбуждения относительно слабо удерживаемых электронов светом в более высокие энергетические состояния (называемые уровнями проводимости), что позволяет электронам мигрировать и, таким образом, обеспечивать электрическую проводимость. Напротив, в типичных металлах электроны уже находятся на уровнях или зонах проводимости, способных течь под действием электродвижущей силы.
Удельное электрическое сопротивление селена варьируется в огромном диапазоне в зависимости от таких переменных, как природа аллотропа, примеси, метод очистки, температура и давление.Большинство металлов нерастворимы в селене, а неметаллические примеси увеличивают удельное сопротивление.
Освещение кристаллического селена в течение 0,001 секунды увеличивает его проводимость в 10-15 раз. Красный свет более эффективен, чем свет с более короткой длиной волны.
Эти фотоэлектрические и светочувствительные свойства селена используются при создании различных устройств, которые могут преобразовывать изменения интенсивности света в электрический ток и, следовательно, в визуальные, магнитные или механические эффекты.Устройства сигнализации, механические устройства открытия и закрытия, системы безопасности, телевидение, звуковые пленки и ксерография зависят от полупроводниковых свойств и светочувствительности селена. Выпрямление переменного электрического тока (преобразование в постоянный) в течение многих лет осуществлялось с помощью устройств, контролируемых селеном. Многие фотоэлементы, использующие селен, были заменены другими устройствами, использующими материалы, более чувствительные, более доступные и более легкие в изготовлении, чем селен.
Соединения
В своих соединениях селен существует в степенях окисления -2, +4 и +6. Он проявляет отчетливую тенденцию к образованию кислот в более высоких степенях окисления. Хотя сам элемент не ядовит, многие его соединения чрезвычайно токсичны.
Селен непосредственно соединяется с водородом, в результате чего образуется селенид водорода H 2 Se, бесцветный газ с неприятным запахом, который является совокупным ядом. Он также образует селениды с большинством металлов (например, селенид алюминия, селенид кадмия и селенид натрия).
В сочетании с кислородом он встречается в виде диоксида селена, SeO 2 , белого твердого цепочечного полимерного вещества, которое является важным реагентом в органической химии. Реакция этого оксида с водой дает селенистую кислоту H 2 SeO 3 .
Селен образует множество соединений, в которых атом селена связан как с кислородом, так и с атомом галогена. Ярким примером является оксихлорид селена, SeO 2 Cl 2 (с селеном в степени окисления +6), чрезвычайно мощный растворитель.Самая важная кислота селена — селеновая кислота, H 2 SeO 4 , которая так же сильна, как серная кислота, и легче восстанавливается.
Роберт С. Брастед
Узнайте больше в этих связанных статьях Britannica:
элемент кислородной группы: естественное происхождение и использование
Элемент селен (символ Se) встречается гораздо реже, чем кислород или сера, и составляет примерно 90 частей на миллиард земной коры.Иногда он встречается в несмешанном виде вместе с самородной серой, но чаще встречается в сочетании с тяжелыми металлами (такими как медь, ртуть, свинец или…
телевизор: Механические системы
… Джозеф Мэй понял, что селеновая проволока различается по своей электропроводности.Дальнейшее расследование показало, что изменение произошло, когда луч солнечного света упал на проволоку, которая случайно оказалась на столе у окна. Хотя в то время его важность не осознавалась,…
Технология фотографии: Экспонометрические системы
Ячейки селена , которые все еще используются в некоторых камерах, также генерируют ток, но они больше и менее чувствительны.…
«Валентность и молекулярная структура», лекция 3. Видеоклип: Валентность и молекулярная структура: лекция 3, часть 1. (7:26)
Линус Полинг: Во время предыдущих двух лекций мы обсуждали электронную структуру
атомы и молекулы и некоторые аспекты валентности; ионная валентность с переносом
электронов от одного атома к другому, ковалентность, разделение пары электронов
между двумя атомами, нормальная ковалентность, если атомы являются атомами одного и того же элемента…Ковалентность,
с некоторым ионным характером, если атомы являются атомами разных элементов с разными
электроотрицательности. Эта идея, эта идея, идея ковалентных связей с частичными
ионный характер, является одной из иллюстраций прогресса в химии, который был достигнут
из-за развития теории резонанса.
Теперь мы хотим коснуться некоторых других аспектов общей темы валентности и молекулярной
структура, такие аспекты, как лигантность или координационное число.Металлическая валентность,
природа сил, которые удерживают атомы меди вместе в металлической меди. Окисление
числа, часть, идея в области теории валентности, которая полезна для уравновешивания
окислительно-восстановительные уравнения. Водородная связь, ну, это вводит нас в
вопрос о слабых силах, которые действуют, относительно слабых силах, которые действуют
между молекулами.
Теперь позвольте мне упомянуть два или три аспекта ковалентности. У меня есть модель серы,
молекула серы, S 8 , как она появляется в обычной ромбической сере. Он очень хорошо сочетается с общим
теория валентности, которую мы обсуждали. Я не могу нарисовать все кольцо, у нас есть каждое
атом серы, образующий две связи и имеющий две электронные пары. Это четыре орбитали
которые соответствуют оболочке аргона.Сера завершила свою аргоновую структуру в формировании
молекула такого рода.
Хлористый водород — это упомянутая мною молекула HCl, в которой имеется ковалентный
связь с примерно двадцатипроцентным частичным ионным характером. Хочу отметить, что мы
не следует путать частичный ионный характер в молекуле газообразного хлористого водорода с
ионизация хлороводорода, соляной кислоты в водном растворе.Эти
это две разные вещи. В водном растворе хлористый водород, соляная кислота,
это сильный электролит, полностью ионизированный. Он образует ионы водорода или, возможно, мы
следует сказать, ионы гидроксония, к которым присоединен водород, дополнительный ион водорода
присоединен к молекуле воды, кислород завершил свой октет, как и в воде
сама, но в данном случае имеет неоновую структуру, как и сама вода, в этом
если у него есть три неразделенных пары — три общие пары и одна неразделенная пара в неоне
валентной оболочки.
С этим связан вопрос об использовании орбиталей, не участвующих в
валентная оболочка ближайшего благородного газа, благородный газ с несколько более крупными атомными
номер. Позвольте мне использовать кремниевую кислоту и родственные ей кислоты, фосфорную кислоту, серную
кислота, например хлорная кислота. Кремниевая кислота — это SiOH 4 , и мы можем нарисовать для нее структуру таким образом, как G.Первым это сделал Н. Льюис, в котором
каждый из атомов кислорода достиг гелия, структуры неона. В то же самое
способ для фосфорной кислоты, мы можем показать P, O, O, OH, OH. Для серной кислоты S, O, O,
H, H, O и хлорная кислота, Cl, OH, O, O, O. В каждой из этих структур центральная
атом показан как достигший аргоновой конфигурации электронов. Но межатомный
расстояния, наблюдаемые для этих кислот, таковы, что указывают на то, что существует значительный
количество двойной связи в связях кремний-кислород, фосфор-кислород
связи, связи сера-кислород и связи хлор-кислород.Этот символ двойной связи
может быть достигнуто за счет использования орбиталей, которые находятся в следующей оболочке за пределами
оболочка аргона.
Я могу упомянуть кислотную силу этих кислот. Есть простое соображение
это приводит к пониманию наблюдаемой силы кислоты. Кремниевая кислота, H 4 SiO 4 , является очень слабой кислотой, только немного более сильной, чем сама вода.Теперь здесь
у нас есть ОН. Если ион водорода ионизируется, у этого иона остается отрицательный
заряда, и именно притяжение этого кислорода к иону водорода заставляет
кислота очень слабая кислота. Если, однако, ион водорода ионизируется вдали от фосфорной
кислоты, мы видим, что осталось два атома кислорода, которые эквивалентны друг другу, поэтому
что мы можем сказать, что есть заряд минус половина, общий заряд минус
один из H 2 PO 4 делится между этими двумя атомами кислорода.Ни один из них не притягивает протон, так как
он приближается настолько сильно, насколько этот кислород с зарядом минус один притягивает протон
в кремниевой кислоте, и на самом деле фосфорная кислота намного сильнее кремниевой кислоты —
это все еще классифицируется как слабая кислота.
Когда серная кислота ионизируется, мы можем сказать, что есть заряд минус одной трети на
каждый из этих трех атомов кислорода иона HSO 4 , иона HSO 4 —, и поэтому притяжение протона по мере его приближения все еще слабее, поскольку
его привлекают все три, ни один из них не тянется так сильно, как в ионе H 2 PO 4 — .

 Пособие направлено на овладение основополагающими химическими понятиями валентность и степень окисления,
Пособие направлено на овладение основополагающими химическими понятиями валентность и степень окисления,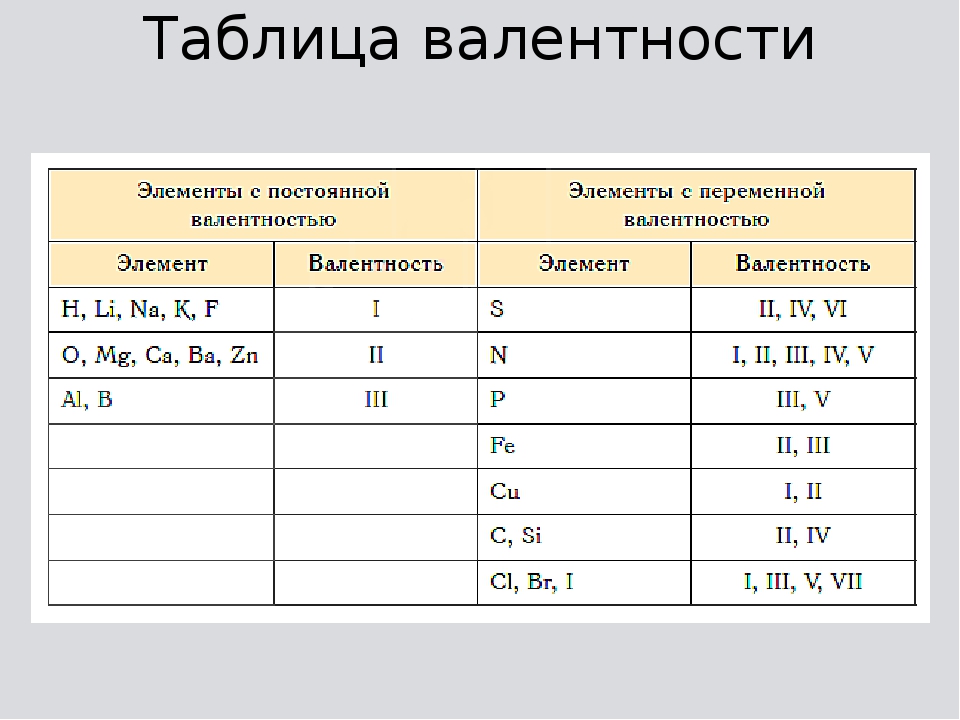
 Водород
Водород