Содержание
Неорганические вещества. Характерные химические свойства.
Задание №1
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) S Б) SO3 В) Zn(OH)2 Г) ZnBr2 (р-р) | 1) AgNO3, Na3PO4, Cl2 2) BaO, H2O, KOH 3) H2, Cl2, O2 4) HBr, LiOH, CH3COOH 5) H3PO4, BaCl2, CuO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3241
Пояснение:
А) При пропускании газообразного водорода через расплав серы образуется сероводород H2S:
H2 + S =to=> H2S
При пропускании хлора над измельченной серой при комнатной температуре образуется дихлорид серы:
S + Cl2 = SCl2
Для сдачи ЕГЭ знать точно, как реагирует сера с хлором и соответственно уметь записывать это уравнение не нужно. Главное — на принципиальном уровне помнить, что сера с хлором реагирует. Хлор – сильный окислитель, сера часто проявляет двойственную функцию — как окислительную, так и восстановительную. То есть, если на серу подействовать сильным окислителем, коим и является молекулярный хлор Cl2, она окислится.
Главное — на принципиальном уровне помнить, что сера с хлором реагирует. Хлор – сильный окислитель, сера часто проявляет двойственную функцию — как окислительную, так и восстановительную. То есть, если на серу подействовать сильным окислителем, коим и является молекулярный хлор Cl2, она окислится.
Сера горит синим пламенем в кислороде с образованием газа с резким запахом – диоксида серы SO2:
S + O2 = SO2
Б) SO3— оксид серы (VI) обладает ярко выраженными кислотными свойствами. Для таких оксидов наиболее характерными являются реакции взаимодействия с водой, а также с основными и амфотерными оксидами и гидроксидами. В списке под номером 2 мы как раз видим и воду, и основные оксид BaO, и гидроксид KOH.
При взаимодействии кислотного оксида с основным оксидом образуется соль соответствующей кислоты и металла, входящего в состав основного оксида. Какому-либо кислотному оксиду соответствует та кислота, в которой кислотообразующий элемент имеет ту же степень окисления, что и в оксиде. Оксиду SO3 соответствует серная кислота H2SO4 (и там, и там степень окисления серы равна +6). Таким образом, при взаимодействии SO3 с оксидами металлов будут получаться соли серной кислоты — сульфаты, содержащие сульфат-ион SO42-:
Оксиду SO3 соответствует серная кислота H2SO4 (и там, и там степень окисления серы равна +6). Таким образом, при взаимодействии SO3 с оксидами металлов будут получаться соли серной кислоты — сульфаты, содержащие сульфат-ион SO42-:
SO3 + BaO = BaSO4
При взаимодействии с водой кислотный оксид превращается в соответствующую кислоту:
SO3 + H2O = H2SO4
А при взаимодействии кислотных оксидов с гидроксидами металлов образуется соль соответствующей кислоты и вода:
SO3 + 2KOH = K2SO4 + H2O
В) Гидроксид цинка Zn(OH)2 обладает типичными амфотерными свойствами, то есть реагирует как кислотными оксидами и кислотами, так и с основными оксидами и щелочами. В списке 4 мы видим как кислоты – бромоводородную HBr и уксусную, так и щелочь – LiOH. Напомним, что щелочами называют растворимые в воде гидроксиды металлов:
Zn(OH)2 + 2HBr = ZnBr2 + 2H2O
Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
Zn(OH)2 + 2LiOH = Li2[Zn(OH)4]
Г) Бромид цинка ZnBr2 является солью, растворим в воде.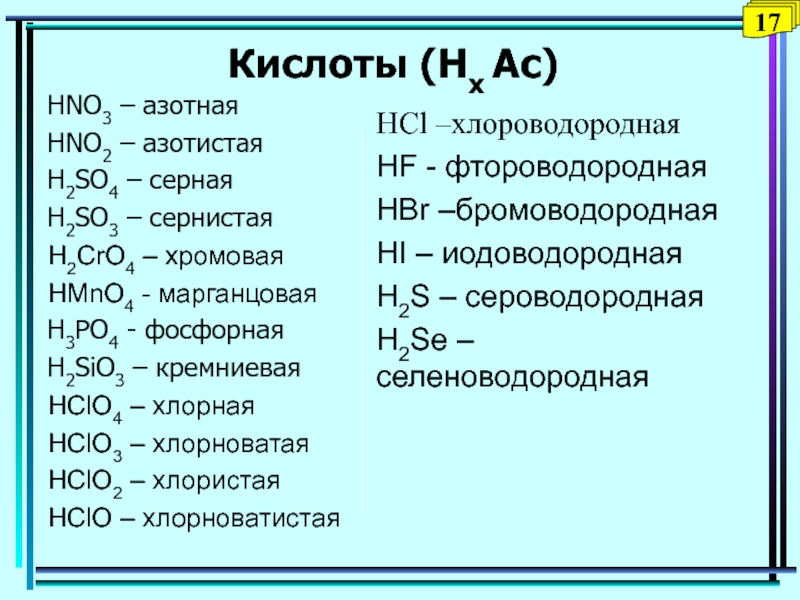 Для растворимых солей наиболее распространены реакции ионного обмена. Соль может реагировать с другой солью при условии что обе исходные соли растворимы и образуется осадок. Также ZnBr2 содержит бромид ион Br-. Для галогенидов металлов характерно то, что они способны вступать в реакцию с галогенами Hal2, находящимися выше в таблице Менделеева. Таким образом? описанные типы реакций протекают со всеми веществами списка 1:
Для растворимых солей наиболее распространены реакции ионного обмена. Соль может реагировать с другой солью при условии что обе исходные соли растворимы и образуется осадок. Также ZnBr2 содержит бромид ион Br-. Для галогенидов металлов характерно то, что они способны вступать в реакцию с галогенами Hal2, находящимися выше в таблице Менделеева. Таким образом? описанные типы реакций протекают со всеми веществами списка 1:
ZnBr2 + 2AgNO3 = 2AgBr + Zn(NO3)2
3ZnBr2 + 2Na3PO4 = Zn3(PO4)2 + 6NaBr
ZnBr2 + Cl2 = ZnCl2 + Br2
Задание №2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Fe Б) KI В) HCl Г) CO2 | 1) NaOH, C, Mg 2) Br2, CuCl2, AgNO3 3) AgNO3, KOH, MnO2 4) H2, CuSO4, HCl 5) N2, Na2O, Ba(OH)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение Ответ: 2231 Пояснение: Будем двигаться по-порядку, признавая ответ неподходящим, как только столкнемся с реагентом, с которым указанное вещество не реагирует:
А) Fe — железо. Проверяем вариант ответа 1:
Fe + NaOH ≠ — реакция не протекает, так как с щелочами реагируют всего три металла — Be, Zn Al («безнал»).
проверяем вариант ответа 2:
Fe + Br2 . Бром — очень сильный окислитель, из металлов реагирует практически со всеми (аналогично Cl2, O2). Железо — металл средней активности, реагирует даже с мягкими окислителями, такими как, например, неокисляющими кислотами, солями менее активных металлов. Отсюда вывод — реакция возможна. Поскольку бром, как уже было сказано — сильный окислитель, то он окисляет железо до степени окисления +3, а не +2.
2Fe + 3Br2 =to=> 2FeBr3
Fe + CuCl2. Металлы реагируют с солями в том случае, если исходный свободный металл (в нашем случае железо) является более активным, чем тот, что входит в состав соли (в нашем случае медь). Железо является более активным, поскольку в ряду активности находится левее меди:
Металлы реагируют с солями в том случае, если исходный свободный металл (в нашем случае железо) является более активным, чем тот, что входит в состав соли (в нашем случае медь). Железо является более активным, поскольку в ряду активности находится левее меди:
Fe + CuCl2 = FeCl2 + Cu
Fe + AgNO3 — взаимодействие аналогичное рассмотренному выше:
Fe + AgNO3 = Fe(NO3)2 + Ag
Таким образом для A подходит вариант ответа 2.
Б) KI — иодид калия. Проверяем вариант ответа 1:
KI + NaOH ≠ реакция не протекает, т.к. для протекания реакции между гидроксидом металла и средней солью необходимо выполнение одновременно двух требований
1) растворимость исходных соли и гидроксида
2) в предполагаемых продуктах есть нерастворимое вещество или газ.
В данном случае первое требование выполняется, а второе нет.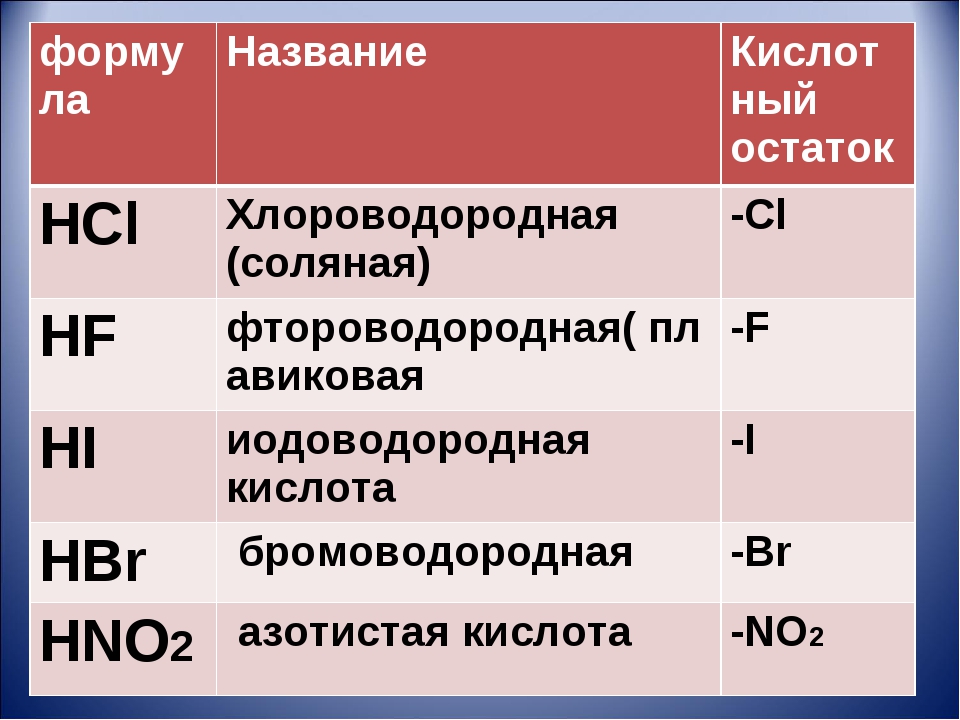 Значит реакция не идет.
Значит реакция не идет.
Проверяем вариант ответа 2:
KI + Br2 — реакция между галогенидом металла и свободным галогеном протекает в том случае, если свободный галоген более активен (расположен ниже в таблице Менделеева), чем входящий в состав соли. Т.е. данная реакция протекает:
2KI + Br2 = 2KBr + I2
KI + CuCl2 — реакция протекает т.к. иодид-ионы окисляются двухвалентной медью до свободного йода. Медь при этом понижает свою степень окисления с +2 до +1:
2KI + 2CuCl2 = 2CuCl + I2 + 2KCl
KI + AgNO3 — для протекания реакции между солями необходимо выполнение одновременно двух требований:
1) растворимость исходных солей
2) в предполагаемых продуктах есть нерастворимое вещество или газ.
В данном случае выполняются оба требования. Значит реакция идет:
KI + AgNO3 = AgI↓ + KNO3
Таким образом для Б подходит вариант ответа 2.
В) HCl — кислота. Проверяем вариант ответа 1:
Кислоты реагирует с основными оксидами/гидроксидами. Т.е. реакция с NaOH протекает. Поскольку соляная кислота относится к кислотам со слабыми окисляющими свойствами (окисляет водородом), то из металлов она способна реагировать только с теми, что находятся до водорода. Окислить металлы, а также неметаллы она не способна. Т.е. реакция с Mg протекает, а с С — нет.
Проверяем вариант ответа 2:
HCl + Br2 — реакция не протекает т.к. для протекания реакции требуется, чтобы свободный галоген должен быть выше в таблице Менделеева, чем входящий в состав галогеноводородной кислоты или ее соли.
Проверяем вариант ответа 3:
HCl + AgNO3 = AgCl↓ + HNO3 — данная реакция обмена протекает, т.к. образуется осадок — хлорид серебра.
HCl + KOH = KCl + H2O — данная реакция обмена протекает, т. к. образуется малодиссоциирующее вещество — вода.
к. образуется малодиссоциирующее вещество — вода.
HCl + MnO2 — взаимодействие концентрированной соляной кислоты с такими окислителями как MnO2, KMnO4, K2Cr2O7 и KClO3 является распространенным способом получения газообразного хлора в лабораторных условиях. В нашем случае уравнение имеет вид:
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
Таким образом для В подходит вариант ответа 3.
Г) CO2 — кислотный оксид. Реагирует с щелочами:
CO2 + NaOH = NaHCO3 или CO2 + 2NaOH = Na2CO3+ H2O
CO2 + C =to=> 2CO — реакция сопропорционирования
CO2 + 2Mg =to=> 2MgO + C, предварительно подожженный магний сгорает в углекислом газе
Задание №3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.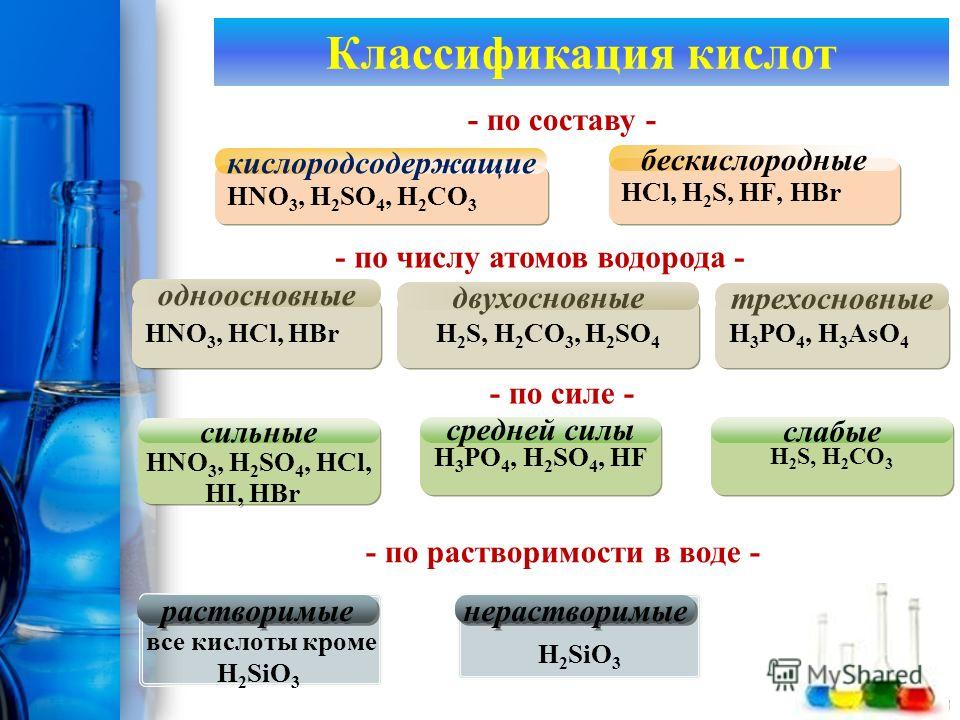
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Br2 Б) SiO2 В) K2CO3 Г) Fe2(SO4)3 | 1) HF, NaOH, CaCO3 2) HCl, Al2O3, CaCl2 3) LiOH, KI, BaCl2 4) H2SO4, O2, CO2 5) Mg, H2S, H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5123
Пояснение:
А) 5
Br2 — сильный окислитель, способен реагировать практически со всеми металлами кроме серебра, платины и золота:
Br2 + Mg = MgBr2
Br2 способен вытеснить менее активные галогены (те что ниже в таблице Менделеева) из их галогенидов и галогеноводородных кислот. Аналогично реагирует также с сульфидами и сероводородом — вытесняет серу как элемент с существенно более низкой электроотрицательностью:
Аналогично реагирует также с сульфидами и сероводородом — вытесняет серу как элемент с существенно более низкой электроотрицательностью:
Br2 + H2S= S↓ + 2HBr
Br2 входит в список простых веществ, способных реагировать с водородом. К ним относятся щелочные и щелочноземельные металлы, углерод, азот, кислород, все галогены:
Br2 + H2 = 2HBr
Б) 1
SiO2 — кислотный оксид, имеющий атомное строение и, как следствие, очень химически инертен. Например, в отличие от любого другого кислотного оксида он не реагирует с водой.
Ввиду того, что SiO2 относится к кислотным оксидам, многие разумно предполагают, что с веществами кислотной природы (кислотными оксидами и кислотами) не реагирует. Практически всегда это действительно так. Однако, существует небольшое количество реакций, являющихся исключением из этого правила, и взаимодействие диоксида кремния с плавиковой кислотой (HF) относится как раз к таким реакциям:
SiO2 + 4HF = SiF4 + 2H2O или при избытке HF:
SiO2 + 6HF = H2[SiF6] + 2H2O
SiO2, как уже было сказано, является весьма инертным веществом и способен реагировать лишь с немногими другими сложными веществами, а именно с щелочами , с карбонатами и сульфитами (при сплавлении), а также с плавиковой кислотой.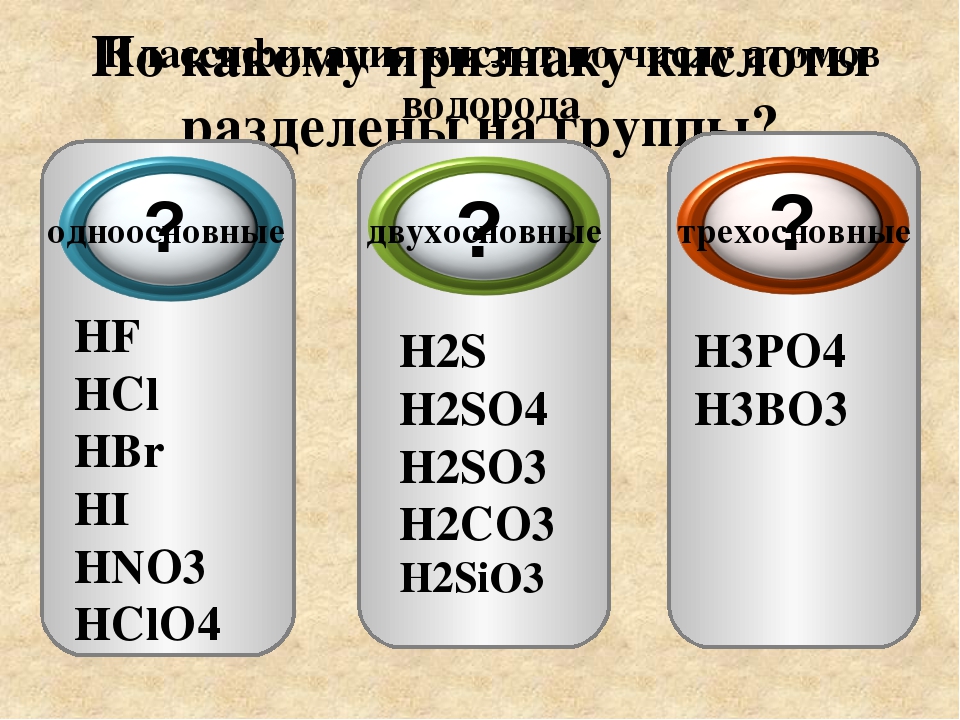 Взаимодействие с щелочью возможно либо при кипячении SiO2 в ее концентрированном растворе или же сплавлении с чистой твердой щелочью. В обоих случаях уравнение реакции имеет вид:
Взаимодействие с щелочью возможно либо при кипячении SiO2 в ее концентрированном растворе или же сплавлении с чистой твердой щелочью. В обоих случаях уравнение реакции имеет вид:
2NaOH + SiO2 t° > Na2SiO3 + H2O
Как уже было сказано выше, диоксид кремния реагирует с карбонатами и сульфитами при их сплавлении друг с другом (с растворами карбонатов и сульфитов такая реакция не протекает):
SiO2 + CaCO3 t° > CaSiO3 + CO2↑
В) 2
Карбонаты реагируют со всеми растворимыми кислотами:
K2CO3 + 2HCl = H2O + CO2↑ + 2KCl
Аналогично диоксиду кремния, амфотерные оксиды способны вытеснять намного более летучие CO2 и SO2 из твердых карбонатов и сульфитов при сплавлении:
K2CO3 + Al2O3 t° > 2KAlO2 + CO2↑
Взаимодействие с CaCl2
для протекания реакции между солями необходимо выполнение одновременно двух требований:
1) растворимость исходных солей
2) в предполагаемых продуктах есть нерастворимое вещество или газ.
В нашем случае выполняются оба требования — K2CO3 и CaCl2 — растворимы, а в продуктах есть нерастворимое вещество — CaCO3:
K2CO3 + CaCl2 = CaCO3↓ + 2KCl
Г) 3
Взаимодействие Fe2(SO4)3 с LiOH
Для протекания реакции между гидроксидом металла и солью необходимо выполнение одновременно двух требований
1) растворимость исходных соли и гидроксида
2) в предполагаемых продуктах есть осадок, газ или малодиссоциирующее вещество.
В данном случае оба требования выполняются Fe2(SO4)3 с LiOH — растворимы в воде, а в продуктах есть нерастворимое вещество Fe(OH)3, следовательно, реакция протекает:
Fe2(SO4)3 + 6LiOH = 2Fe(OH)3↓ + 3Li2SO4
Взаимодействие Fe2(SO4)3 с KI
Если мы посмотрим в таблицу растворимости на предполагаемые продукты реакции обмена между Fe2(SO4)3 и KI, т. е. на сульфат калия и иодид железа (III), мы увидим, что сульфат калия растворим, а в ячейке характеризующей FeI3 стоит знак «?», говорящий о том, что данное вещество не существует. Какой вывод можно сделать из этого? Реакция протекает или нет? Следует усвоить тот факт, что если в предполагаемых продуктах обмена вы видите вещество, которому в таблице Менделеева соответствует символ » — » или «?», то это значит, что реакция точно протекает, но протекает необычными образом. В частности, в данном случае, ионы Fe3+ не могут сосуществовать в одном растворе с иодид-ионами, поскольку окисляют их до свободного йода, сами при этом восстанавливаясь до ионов Fe2+:
е. на сульфат калия и иодид железа (III), мы увидим, что сульфат калия растворим, а в ячейке характеризующей FeI3 стоит знак «?», говорящий о том, что данное вещество не существует. Какой вывод можно сделать из этого? Реакция протекает или нет? Следует усвоить тот факт, что если в предполагаемых продуктах обмена вы видите вещество, которому в таблице Менделеева соответствует символ » — » или «?», то это значит, что реакция точно протекает, но протекает необычными образом. В частности, в данном случае, ионы Fe3+ не могут сосуществовать в одном растворе с иодид-ионами, поскольку окисляют их до свободного йода, сами при этом восстанавливаясь до ионов Fe2+:
Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4
Или в ионном виде:
2Fe3+ + 2I— = 2Fe2+ + I2
Взаимодействие Fe2(SO4)3 с BaCl2 :
Исходные соли растворимы, а в предполагаемых продуктах ионного обмена есть нерастворимое вещество — BaSO4, следовательно, реакция протекает:
Fe2(SO4)3 + BaCl2 = 3BaSO4↓ + 2FeCl3
Задание №4
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ |
А) оксид кремния Б) оксид азота (IV) В) оксид бария Г) оксид меди (II) | 1) Al, HNO3, CO 2) FeO, CO2, H2O 3) C, KOH, CaCO3 4) NaOH, H2O, CaO 5) H2O, SO3, H3PO4 6) H2O, HNO3, Ca(OH)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №5
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Ca Б) ZnO В) CuSO4 Г) Na2SO3 | 1) HCl, BaCl2, HNO3 2) Al, NaOH, Na2S 3) Cu, HCl, BaCl2 4) H2, HCl, NaOH 5) P, HCl, O2 6) AlCl3, HNO3, K2CO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №6
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Zn Б) P2O3 В) Ca(OH)2 Г) MgSO4 | 1) HCl, Na2CO3, HNO3 2) BaCl2, NaOH, Na3PO4 3) H2O, HCl, CO2 4) HBr, NaOH, CuSO4 5) O2, Ba(OH)2, CaO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №7
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Al Б) O2 В) CO Г) H2SO4 | 1) CaO, H2S, LiOH 2) NaOH, HCl, CH4 3) O2, Zn, KOH(р-р) 4) C, P2O3, SO2 5) Fe2O3, O2, CuO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №8
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) CaO Б) S В) Zn(OH)2 Г) KHCO3 | 1) K, Br2, CaSO4 2) O2, KOH, HNO3 3) NaOH, HNO3, CH3COOH 4) HBr, SO3, N2 5) CO2, H2O, HCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №9
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Sr Б) Na2O В) HNO3 Г) (NH4)2SO4 | 1) Pb, S, C 2) O2, S, Cl2 3) HCl, CO2, P2O5 4) CaO, Br2, K2SO4 5) Ba(NO3)2, KOH, Ca(OH)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №10
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) S Б) P2O3 В) Fe2O3 Г) Cu(OH)2 | 1) H2O, NaOH, HCl 2) Fe, HCl, NaOH 3) HCl, HCHO, H2SO4 4) O2, NaOH, HNO3 5) H2O, CO2, HCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №11
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) P2O5 Б) Fe(OH)2 В) NH4Br Г) Cu(NO3)2 | 1) Ca(OH)2, AgNO3, Cl2 2) Fe, Na3PO4, KOH 3) H2O2, H2SO4, HCl 4) H2O, CaO, LiOH 5) CO, H2O, PbS |
Запишите в таблицу выбранные цифры под соответствующими буквами.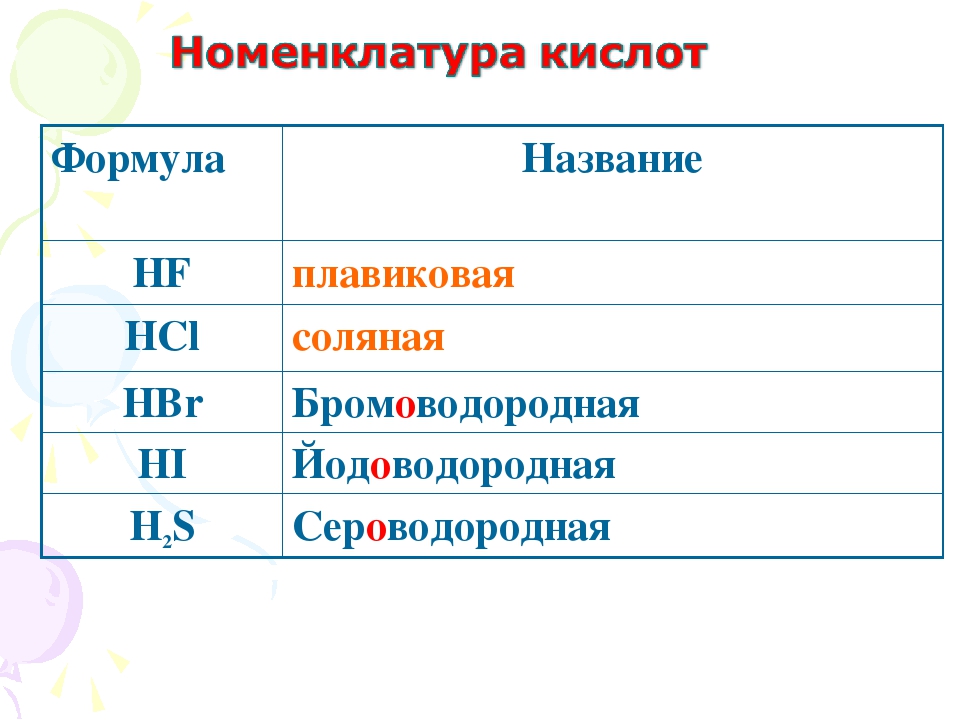
Решение
Задание №12
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Na Б) SO2 В) Al(OH)3 Г) MgBr2 | 1) CaO, O2, KOH 2) Cl2, K3PO4, KOH 3) K2SO4, P2O5, HNO3 4) Ba(OH)2, H2SO4, HCl 5) H2SO4, S, C2H5OH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №13
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) H2O Б) O2 В) Si Г) CuSO4 | 1) P2O5, Na, Al2S3 2) H2S, FeO, NH3 3) Cl2, KOH, Ca 4) CO2, HF, CH4 5) H2S, NaOH, KI |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №14
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Cl2 Б) Al2O3 В) Ca(OH)2 Г) NaHSO3 | 1) NaOH, NaCl, HF 2) H2SO4, NaOH, HBr 3) NaHSO4, Br2, SO2 4) NaBr, Ba(OH)2, Fe 5) C6H6, HCl, NaOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №15
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Cr(OH)3 Б) H2SO4(разб.) В) H2S Г) Ba | 1) LiOH, HNO3, HCl 2) NaOH, K2O, CuSO4 3) H2O, S, HNO3 4) Zn, BaCl2, NaHS 5) NaNO3, CuO, SiO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №16
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) P Б) P2O3 В) MgBr2 Г) Zn(OH)2 | 1) HCl, NaOH, CaO 2) NaOH, Na3PO4, Cl2 3) HNO3, HCl, Cl2 4) O2, NaOH, HNO3 5) S, HCl, O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №17
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) O2 Б) H2O В) NaOH Г) NaHCO3 | 1) Mg, CuO, CuSO4 2) CO, P2O3, Cu 3) HCl(р-р), KOH(р-р), H2SO4 4) NH4Cl(р-р), HCl(р-р), CuSO4(р-р) 5) P2O5, CaC2, Na2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №18
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) N2 Б) CuO В) HNO3 Г) CuSO4 | 1) H2, O2, Li 2) H2, CO, Al 3) Fe2O3, O2, CO2 4) S, Na2CO3, FeS 5) NaOH, BaCl2, KI |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №19
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Na Б) SiO2 В) H2SO4 Г) CuSO4 | 1) CaCO3, Zn, N2 2) H3PO4, Cl2, H2O 3) LiOH, Ba(NO3)2, (NH4)2S 4) HF, Na2CO3, KOH 5) CO2, Li3PO4, BaO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №20
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) P Б) CO2 В) Al(OH)3 Г) CuCl2 | 1) K2SO4, CO2, (NH4)3PO4 2) (NH4)2S, Fe, AgNO3 3) CaO, NaOH, H2O 4) HI, Ba(OH)2, HCl 5) Na, HNO3, Br2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №21
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Li Б) CO2 В) Ba(OH)2 Г) Ca(HCO3)2 | 1) HCl, Ca(OH)2, Na2SiO3 2) H2, KOH, Na2SO4 3) CuCl2, Na2СO3, Fe(NO3)2 4) C, Mg, NaOH 5) H2O, N2, Cl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №22
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) N2 Б) Fe2(SO4)3 В) SO3 Г) HCl | 1) H2O, MgO, KOH 2) AgNO3, Ba(OH)2, CuO 3) Ba(NO3)2, Mg, Zn 4) KNO3, Cu(OH)2, NaCl 5) Ca, O2, H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №23
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) HI Б) Cl2 (г.) В) Al2O3 Г) Na3PO4 | 1) Cu, P, Na 2) Al(OH)3, K2CO3, Mg 3) K2CO3, KOH, H2SO4 (p-p) 4) CuCl2, Ca(NO3)2, Al2(SO4)3 5) HNO3, N2, NH4Cl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №24
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Zn Б) CuO В) Ca(OH)2 (p-p) Г) Na2CO3 | 1) O2, HNO3, FeCl3 2) H2, HCl, NH3, 3) Cu(OH)2, O2, MgCl2 4) HNO3, BaCO3, Na3PO4, 5) H2SO4, HCl, ZnCl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №25
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Na3PO4 (р-р) Б) HBr В) Fe Г) K2O | 1) Ba, KNO3, S 2) Zn, CuO, ZnO 3) H2SO4 (р-р), Fe2O3, S 4) H2O, CO2, HNO2 5) AgNO3, Ba(OH)2, Sr(NO3)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №26
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) K2CO3 Б) H2SO4 (p-p) В) Cu Г) ZnO | 1) HBr, NaOH, H2SO4 (конц.) 2) Fe, Al, Fe(OH)2 3) HNO3 (p-p), O2, AgNO3 4) CaCl2, HNO3, Ba(OH)2 5) Al(OH)3, Cl2, LiNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №27
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
А) Cu Б) Al(OH)3 В) ZnCl2 Г) Cu(NO3)2 | 1) O2, Br2, HNO3 2) CH3COOH, KOH, FeS 3) NaOH, Mg, Ba(OH)2 4) BaCl2, Pb(NO3)2, S 5) HCl, LiOH, H2SO4 (р-р) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа № 12
Предмет: ХИМИЯ
Дата: 10.02.2016г
Пользуясь образцом выполнения варианта №1 таблицы 20 на стр.144 (приложение 1), выполнить вариант №2
Приложение 1.
|
Вариант 1
|
а)
|
б)
|
в)
|
г)
|
д)
|
|
Формула вещества
|
Принадлежит к классу
|
Название
вещества
|
Валентность кислотного остатка
(в кислоте, соли)
|
Растворимость (по таблице растворимости на форзаце 2 учебника)
|
Физические свойства знакомых (агрегатное состояние, цвет, запах, растворимость в воде)
|
|
CaO
|
Оксид основный
|
Оксид кальция
|
|
|
твёрд., белый, растворим.
|
|
H2S
|
Кислота
|
Сероводородная кислота
|
II
|
Р(растворимое вещество)
|
|
|
NaCl
|
Соль
|
Хлорид натрия (повареная соль)
|
I
|
Р
|
твёрд., белый, растворим.
|
|
Ca3(PO4)2
|
Соль
|
Фосфат кальция
|
III
|
Н (нерастворимое вещество)
|
|
|
N2O5
|
Оксид кислотный
|
Оксид азота (V)
|
|
|
|
|
AgNO3
|
Соль
|
Нитрат серебра
|
I
|
Р
|
|
|
Mg
|
Металл
|
Магний
|
|
|
твёрд., серебристого цвета
|
|
FeSO4
|
Соль
|
Сульфат железа (II)
|
II
|
Р
|
|
|
HNO3
|
Кислота
|
Азотная кислота
|
I
|
Р
|
|
Если тетрадь в школе, выполняете все задания в новой тетради!
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр.144
Предмет: ХИМИЯ
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр.144
Предмет: ХИМИЯ
Дата: 03.02.2016г
Выучить наизусть формулы и название кислот, кислотных остатков, оксидов, соответствующих кислотам по таблице №1:
Таблица №1
|
Формула
кислоты
|
Название кислоты
|
Формула
кислотного остатка
|
Валентность кислотного
остатка
|
Название
кислотного
остатка
|
Оксид,
соответствующий кислоте
|
|
HCl
|
Хлороводородная
(соляная)
|
Cl
|
I
|
Хлорид
|
—
|
|
HF
|
Фтороводородная
(плавиковая)
|
F
|
I
|
Фторид
|
—
|
|
HBr
|
Бромоводородная
|
Br
|
I
|
Бромид
|
—
|
|
HI
|
Иодоводородная
|
I
|
I
|
Иодид
|
—
|
|
H2S
|
Сероводородная
|
S
|
II
|
Сульфид
|
—
|
|
H2SO3
|
Сернистая
|
SO3
|
II
|
Сульфит
|
SO2
|
|
H2SO4
|
Серная
|
SO4
|
II
|
Сульфат
|
SO3
|
|
HNO2
|
Азотистая
|
NO2
|
I
|
Нитрит
|
N2O3
|
|
HNO3
|
Азотная
|
NO3
|
I
|
Нитрат
|
N2O5
|
|
H2CO3
|
Угольная
|
CO3
|
II
|
Карбонат
|
CO2
|
|
H2SiO3
|
Кремниевая
|
SiO3
|
II
|
Силикат
|
SiO2
|
|
H3PO4
|
Фосфорная
(Ортофосфорная)
|
PO4
|
III
|
Фосфат
(Ортофосфат)
|
P2O5
|
Выполните следующее задание в тетради:
Начертите таблицу и заполните свободные клеточки (впишите формулу или название) в таблице №2 (по памяти, не пользуясь таблицей №1)
Таблица №2
|
Формула
кислоты
|
Название кислоты
|
Формула
кислотного остатка
|
Валентность кислотного
остатка
|
Название
кислотного
остатка
|
Оксид,
соответствующий кислоте
|
|
HNO3
|
|
|
|
Нитрат
|
N2O5
|
|
|
Иодоводородная
|
|
|
|
—
|
|
H3PO4
|
|
|
|
|
|
|
|
Сернистая
|
SO3
|
|
|
|
|
H2CO3
|
|
|
|
|
|
|
HCl
|
|
|
|
Хлорид
|
—
|
|
|
Кремниевая
|
|
|
|
|
|
HF
|
|
|
|
|
—
|
|
|
|
|
|
Сульфид
|
—
|
|
|
|
|
|
Бромид
|
—
|
|
|
Серная
|
|
|
|
|
|
HNO2
|
Азотистая
|
NO2
|
I
|
Нитрит
|
N2O3
|
Все работы, выполненные в дни карантина, будут проверены и оценены. Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Предмет: ХИМИЯ
Дата: 28.01.2016г
Изучить §32, записать в тетради основные понятия:
Кислотами называются сложные вещества ………..
Валентность кислотного остатка находят ………..
К бескислородным кислотам относят: ….., ……, ……, …..
К кислородсодержащим кислотам относят: …, …,…..,….,….,….,…..
Выучить наизусть формулы и название кислот (таблица 19 на стр.141)
Выполните в тетради задания:
№1. Распределите химические формулы кислот из перечня формул веществ в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
|
Кислоты
| ||||||
|
Бес-кисло-
родные
|
Кислород- содержащие
|
растворимые
|
нераст-воримые
|
одно-
основные
|
двух-основные
|
трёх-основные
|
Выполните задания №1, №2, №3 на стр.142
При изучении нового материала можно воспользоваться дополнительным материалом:
Урок по теме: Кислоты: классификация, номенклатура, физические и химические свойства
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода,
способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
По числу атомов водорода:число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих
кислотных оксидов:
|
Кислота (НnА)
|
Кислотный остаток (А)
|
Соответствующий кислотный оксид
|
|
HClO4 хлорная
|
ClO4 (I) перхлорат
|
Cl2O7 оксид хлора (VII )
|
|
H2SO4 серная
|
SO4 (II) сульфат
|
SO3 оксид серы (VI ), серный ангидрид
|
|
HNO3 азотная
|
NO3 (I) нитрат
|
N2O5 оксид азота ( V )
|
|
HMnO4 марганцевая
|
MnO4 (I) перманганат
|
Mn2O7 оксид марганца (VII )
|
|
H2SO3 сернистая
|
SO3 (II) сульфит
|
SO2 оксид серы (IV )
|
|
H3PO4 ортофосфорная
|
PO4 (III) ортофосфат
|
P2O5 оксид фосфора (V )
|
|
HNO2 азотистая
|
NO2 (I) нитрит
|
N2O3 оксид азота (III )
|
|
H2CO3 угольная
|
CO3 (II) карбонат
|
CO2 оксид углерода ( IV), углекислый газ
|
|
H2SiO3 кремниевая
|
SiO3 (II) силикат
|
SiO2 оксид кремния (IV)
|
б) Таблица бескислородных кислот
|
Кислота (НnА)
|
Кислотный остаток (А)
|
|
HCl соляная, хлороводородная
|
Cl (I) хлорид
|
|
H2S сероводородная
|
S(II) сульфид
|
|
HBr бромоводородная
|
Br (I) бромид
|
|
HI йодоводородная
|
I(I) йодид
|
|
HF фтороводородная,плавиковая
|
F(I) фторид
|
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны
также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все
кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
|
бескислородные
|
кислородсодержащие
|
|
HCl, HBr, HI, HF, H2S
|
HNO3, H2SO4 и другие
|
|
ПОЛУЧЕНИЕ
| |
|
1. Прямое взаимодействие неметаллов
H2 + Cl2 = 2 HCl
|
1. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
|
|
2. Реакция обмена между солью и менее летучей кислотой
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl
| |
Предмет: ХИМИЯ
Дата: 27.01.2016г
Изучить §31, записать в тетради основные понятия:
Основаниями называются …………
По характеру свойств различают ………
К щелочам относят …………….
Исторически сложившиеся названия щелочей:
KOH – едкое кали
NaOH – …..
Ca(OH)2 – ……..
Ba(OH)2– ……..
Ca(OH)2– ……..
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Распределите химические формулы в таблицу :
LiOH , NO , Al 2 O 3, Zn(OH)2, CaO , SiO 2, CrO , NaOH , Mn 2 O 7, Fe(OH)2, Cr 2 O 3
|
Основный оксид
|
Кислотный оксид
|
Амфотерный оксид
|
Безразличный оксид
|
Щёлочь
|
Нерастворимое основание
|
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
При изучении нового материала можно использовать дополнительный материал:
Урок по теме: Основания: классификация, номенклатура, получение
|
ОСНОВАНИЯ
Основания — это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула:
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Классификация оснований
Щёлочи – это основания растворимые в воде. К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые.
Классификация оснований по числу групп ОН:
n=1 однокислотное
n=2 двухкислотное
n=3 трехкислотное
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
ЩЁЛОЧЕЙ
1. Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba,Ra)
2. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
Na2O + H2O = 2 NaOH
Здесь, ОКСИД МЕТАЛЛА (основный оксид, растворимый в воде) – щелочного металла (Li,Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
|
Неделя литовской культуры-2015
Дни литовской культуры проходят в гимназии с 2003 года, и это стало доброй традицией. За это время реализован не один образовательный проект, гимназия принимала видных деятелей культуры, искусства и литературы Литвы.
Гостями церемонии открытия Недели стали заместитель председателя ассоциации учителей литовского языка в Калининградской области Альгирдас Кормилавичус, фольклорный коллектив «Рутяле» (г. Гурьевск) под руководством Ирены Тирюбы, фольклорный коллектив (художественный руководитель Ирма Куркова) из пос. Переславское «Куполите». Ирена Тирюба рассказала о народных литовских инструментах и особенностях национального костюма.
В рамках реализации гимназического проекта «Неделя литовской культуры» состоялась открытая лекция Б.Н. Адамова для учащихся гимназии. Борис Николаевич Адамов — член правления и один из организаторов Калининградского клуба краеведов, автор книги «Кристионас Донелайтис. Время. Люди. Память». В лекции об известных литовцах Кёнигсберга он особое внимание уделил Людвигу Резе – литовскому поэту, критику, переводчику, профессору и ректору Кёнигсбергского университета.
Тренер баскетбольной команды БФУ им.И. Канта Гедиминас Мелунас провел мастер-класс для баскетбольной команды 5«А» класса. Ребятам были показаны новые техники и приемы игры в баскетбол, которые многому их научили. Время пролетело очень быстро, но тренер обещал встретиться еще раз.
Учащиеся 10-х классов, слушатели Школы юного дипломата, совершили визит в Генеральное консульство Республики Литва. Это событие стало частью программы Дней литовской культуры в гимназии № 40. Учащихся встречали Генеральный консул господин Витаутас Умбрасас и атташе по культуре господин Романас Сенапедис, которые очень тепло и радушно отнеслись к гостям. На встрече обсуждались такие вопросы, как путь дипломата в профессию. Другой интересующей всех участников темой был вопрос молодежного международного сотрудничества. Учащиеся поделились своим впечатлениями от проектов с литовскими школами и гимназиями. Другим вопросом обсуждения стала деятельность консульства в сфере обмена культур на территории Калининградской области.
10-я юбилейная Неделя Литовской культуры в гимназии № 40 завершилась 20 февраля 2015 г. Почетными гостями церемонии стали руководитель представительства МИД России в Калининграде Павел Анатольевич Мамонтов, Витаутас УМБРАСАС, министр-советник, исполняющий обязанности генерального консула Литовской Республики, заместитель председателя ассоциации учителей литовского языка в Калининградской области Альгирдас Кормилавичус, руководитель общественной кафедры «Образование и дипломатия» гимназии №40, главный специалист-эксперт Представительства МИД России в Калининграде Юлия Изидоровна Матюшина. Были подведены итоги Недели, награждены участники и победители различных конкурсов. В конкурсе чтецов «По следам литовских поэтов» среди учащихся 5-11 классов победителями стали Булаев Дмитрий, ученик 6«С» класса, Балесная Мария, ученица 7«Б» класса, Даудова Деши, читавшая стихотворения на литовском языке. В фотоконкурсе «Путешествие по Литве» победителем конкурса стала творческая группа 8«О» класса (Волошина Тамара, Громазина Арина, Рубцова Лариса Владимировна). Дипломы победителям вручали руководитель представительства МИД России в Калининграде Павел Анатольевич Мамонтов и Витаутас Умбрасас, министр-советник, исполняющий обязанности генерального консула Литовской Республики. Ярким украшением Церемонии закрытия стало выступление народного коллектива лицея № 35 «Жюгелис (žiogelis)» (руководитель Альгирдас Кормилавичус) и музыкального коллектива гимназии № 40 «Канцона» (руководитель Н.В. Литвинова).
Список альбомов пуст.
HBR — Энциклопедический словарь
Скорость любой химической реакции зависит от условий, в которых она протекает: от концентрации реагентов (или их давления, если это газы), температуры, наличия катализатора или излучения и т.д. Одни реакции протекают практически мгновенно (например, нейтрализация кислоты основанием), другие при обычных условиях идут настолько медленно, что заметные изменения концентраций реагентов наблюдаются лишь через несколько лет (например, взаимодействие водорода с кислородом с образованием воды в отсутствие катализатора). При этом существует множество реакций, протекающих с вполне измеримыми скоростями в обычных условиях. Химическая кинетика занимается определением скоростей химических реакций и изучением их механизма. Это относительно молодая наука, и в ней имеется много нерешенных проблем. Во всех кинетических исследованиях фигурируют время и промежуточные продукты (вещества, образующиеся на промежуточных стадиях реакции). Этим они отличаются от исследований систем в условиях химического равновесия, когда рассматриваются только начальное и конечное состояния реагентов.
См. также ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА.
ХИМИЧЕСКАЯ КИНЕТИКА
В одном кинетическом эксперименте нередко участвуют одновременно две или несколько реакций, при этом их скорости могут зависеть от наличия загрязнений и следов катализаторов. В результате получаемые данные бывают плохо воспроизводимыми, что затрудняет их интерпретацию. Если с термодинамической точки зрения из одних и тех же исходных веществ возможно образование разных продуктов, следует подбором концентрации реагентов, температуры и специфического катализатора добиться, чтобы протекала именно та реакция, которая интересует исследователя. Скорость реакций обычно определяют при постоянной температуре, лучше при двух и более ее значениях, используя один или несколько высокоточных термостатов.
Измерение скоростей реакций. Скорости реакций измеряют разными способами. Можно отбирать пробы из термостатируемого реактора через строго определенные интервалы времени либо замедлять или полностью останавливать реакцию (быстрым охлаждением реактора или каким-либо иным способом) и анализировать пробы титрованием или другими аналитическими методами. Иногда одновременно запускают несколько идентичных реакций, а затем последовательно останавливают их быстрым охлаждением и анализируют продукты. Если один из реагентов или продуктов реакции обладает оптической активностью, то следят за его концентрацией с помощью поляриметра. Аналогично, если изменение концентрации реагента или продукта реакции либо их обоих сопровождается изменением электропроводности, для кинетических измерений используют электрические методы. Иногда концентрацию одного из реагирующих веществ определяют, измеряя оптическую плотность раствора при определенной длине волны и используя закон Ламберта — Бера.
См. также ХИМИЯ АНАЛИТИЧЕСКАЯ. Скорость реакции можно рассчитать исходя из данных об изменении давления или объема в газофазной системе либо объема газа, выделяющегося в ходе реакции. В случае газофазных реакций, протекающих в потоке, в реактор иногда вводят катализатор или повышают температуру, чтобы ускорить процесс. Входные и выходные трубки в таких системах делают достаточно малыми, чтобы газы поступали в реактор и выходили из него как можно быстрее и в области с неконтролируемым градиентом температуры находились непродолжительное время. Время нахождения газов в реакторе (время протекания реакции) определяют исходя из объема газов, проходящих через реактор в 1 с, отнесенного к объему реактора. Если общее число молекул в ходе реакции изменяется, то оценить время становится довольно трудно. В проточных системах используются большие количества реагентов и получаются большие количества продуктов, что облегчает моделирование соответствующих химических процессов в промышленных масштабах. Скорость реакции можно определить по уменьшению концентрации исходных веществ или по увеличению концентрации продуктов. Скорость уменьшения концентрации исходного вещества равна -dC/dt, а скорость увеличения концентрации продукта равна dC/dt, где С — концентрация, t — время. Концентрацию обычно измеряют в единицах молярности (моль/л), время — в секундах.
Порядок реакции. Порядок реакции — это эмпирическая величина, равная сумме показателей степеней, с которыми концентрации реагентов входят в выражение для скорости реакции. Так, для реакции aA + bB -> mM + nN скорость уменьшения концентрации С реагента А можно представить в виде
где СА и СВ — концентрации исходных веществ А и В соответственно. Порядок реакции в этом случае равен а + b. Коэффициент пропорциональности k, входящий в уравнение, называется константой скорости. Он равен скорости реакции при единичной концентрации реагентов.
Реакции первого порядка. Если скорость реакции зависит от концентрации только одного реагента в первой степени, то выражение для скорости принимает вид
О такой реакции говорят, что она является реакцией первого порядка. Чтобы найти зависимость концентрации от времени, нужно проинтегрировать уравнение (1). Разделив переменные и проинтегрировав, получим -ln C = kt + const
где ln — натуральный логарифм. Или, перейдя к десятичным логарифмам:
График зависимости lg C от t является прямой с тангенсом угла наклона -s, равным -k/2,303. Отсюда k = 2,303*s
Зная k и концентрацию С при данном t, можно найти константу интегрирования (const) и рассчитать концентрацию для любого момента времени. Константу интегрирования можно также определить из координат точки пересечения прямой с осью lg C при t = 0 (рис. 1).
Рис. 1. ГРАФИК ЗАВИСИМОСТИ логарифма концентрации от времени.
Уравнение (1) можно проинтегрировать в пределах от С1 до С2, равных концентрациям реагента в моменты времени t1 и t2:
Отсюда
Размерность k равна размерности t -1. Если в начальный момент времени (t1 = 0) C1 = C0, то концентрация C в любой момент времени t в соответствии с уравнением (2) будет равна
Уравнение (1) можно записать в другом виде, приняв, что а — это начальное количество реагента, x — его количество, прореагировавшее за время t. Тогда (а — x) равно количеству реагента, оставшемуся через время t, и уравнение реакции примет вид
Разделив переменные и проинтегрировав, получим -ln(a — x) = kt + const
отсюда при t = 0, x = 0 и const = -ln a
Часто представляет интерес характеристическая величина t1/2 — время полупревращения реакции, т.е. время, за которое концентрация исходного вещества уменьшается вдвое. При x = (1/2)a и t = t1/2 из уравнения (3) получим
Это соотношение иллюстрирует важную особенность реакций первого порядка: время, за которое количество вещества уменьшается вдвое, не зависит от его количества в момент начала реакции и в любой данный момент реакции. Если известна константа скорости k, можно рассчитать количество вещества, прореагировавшего к данному моменту времени, или определить, за какое время прореагирует данное количество вещества. Уравнению первого порядка следуют многие химические реакции. Например, пентаоксид азота, растворенный в тетрахлориде углерода, разлагается при температуре 45° С в строгом соответствии с уравнением реакции первого порядка:
Реакции второго порядка. Когда скорость реакции пропорциональна квадрату концентрации отдельного реагента или концентрациям каждого из двух реагирующих веществ в первой степени, мы имеем дело с реакцией второго порядка. В дифференциальной форме выражения для скорости такой реакции имеют вид
и
Пусть a — начальная молярная концентрация реагента А, x — число его молей в 1 л, прореагировавшее за время t; тогда скорость реакции будет равна dx/dt = k(a — x)2
или dx/(a — x)2 = kdt
Проинтегрировав, получим 1/(a — x) = kt + C
Поскольку x = 0 при t = 0, константа С = 1/а. Отсюда
и
Если а и b — начальные молярные концентрации реагентов А и В соответственно и если за время t прореагировало x молей этих реагентов в 1 л, то, проинтегрировав соответствующее уравнение для скорости реакции, можно найти выражение для константы скорости:
Размерность k — л/(моль*с). Численное значение k можно найти, подставив концентрации и время в уравнение (4) либо построив графики зависимости
или
от времени. Умножение наклона полученной таким образом прямой на 2,303/(a — b) дает k.
Реакции третьего порядка. Скорость реакции третьего порядка может зависеть от концентрации одного реагента в третьей степени, либо концентрации одного реагента во второй степени и второго реагента в первой степени, либо от концентрации каждого из трех реагентов в первой степени. Так,
или dx/dt = k(a — x)3
Разделение переменных и интегрирование дают
или
Здесь размерность k — л2/(моль2*с). Реакции нулевого порядка. Скорость реакций нулевого порядка не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях). Уравнение для скорости такой реакции в дифференциальной форме имеет вид -dC/dt = k
или, выраженное через концентрацию x продукта, dx/dt = k
Проинтегрировав, получим x = kt + C
Значению x = 0 соответствует t = 0, откуда константа С = 0 и x = kt
В величину k могут входить различные константы, например интенсивность света, концентрация насыщенного раствора или пара. Размерность k — моль/(лЧс).
Реакции п-го порядка. В общем случае для реакции порядка п при п > 1 связь между концентрацией и временем для конечного времени наблюдения описывается уравнением
где С — концентрация реагента в момент времени t, C0 — начальная концентрация. График зависимости 1/(Сn — 1) от t представляет собой прямую с наклоном (n-1) k. Размерность k — (моль/л)1 — n/c. Реакции не всегда имеют целочисленный порядок. Показатели степени при концентрациях в выражении для скорости часто являются дробными. Однако и в этом случае порядок реакции равен сумме показателей степеней. Например, для реакции, скорость которой равна
порядок п = 0,7 + 1,8 = 2,5. Часто порядок реакции, определяемый экспериментально, не соответствует порядку, который следует из стехиометрического уравнения. Большинство химических реакций включает две или несколько стадий, протекающих одновременно, что приводит к более сложным выражениям для скорости.
Определение порядка реакции. Подстановка в формулы. Если k остается постоянной при подстановке значений концентрации и времени в уравнение скорости реакции, значит, порядок реакции, задаваемый уравнением, верен. Если же расчеты не согласуются с экспериментальными данными, то реакция сложнее, чем предполагалось, и, вероятно, протекает в две или несколько стадий.
Графический метод. Для определения порядка реакции можно прибегнуть к графическому представлению функций, описывающих зависимость концентрации от времени. Если при построении зависимости С от t получается прямая, это означает, что реакция — нулевого порядка. Если линейна зависимость lg C от t, имеет место реакция первого порядка. При условии что начальная концентрация всех реагентов одинакова, реакция имеет второй порядок, если линейным является график зависимости 1/С от t, и третий — в случае линейности зависимости 1/С 2 от t.
Определение времени полупревращения. Для реакции первого порядка время, за которое прореагирует определенная часть реагента (например, половина), не зависит от начальной концентрации (см. выше),
Для реакции второго порядка при равенстве начальных концентраций обоих реагентов, а = b, время, за которое прореагирует половина вещества, обратно пропорционально начальной концентрации. Из приведенного выше выражения для константы скорости реакции второго порядка получаем
или
t1/2 = 1/ka
Изменение соотношения между реагентами. Если выражение для скорости представить как
где СА, СВ, СС … — концентрации участвующих в реакции веществ А, В и С …, а а, b, с … — соответствующие показатели степени в уравнении для скорости, то порядок реакции п можно определить, увеличив вдвое значение СА без изменения СВ и СС и экспериментально определив величину Dx/Dt для СА и 2СА. Так, если
скорость при концентрации 2СА, а
— скорость при концентрации СА, то, взяв отношение этих двух величин, получим
Предположим, что наблюдаемое отношение
равно 4; тогда а = 2 и реакция является реакцией второго порядка относительно реагента А. Если это отношение равно 2, то а = 1 и имеет место реакция первого порядка относительно того же реагента. Аналогичным образом определяют b, с и т.д.
Добавление избытка реагентов. Добавив в реакционную смесь в большом избытке все реагирующие вещества, кроме одного, можно определить порядок реакции по этому реагенту, т.е. показатель степени, с которым концентрация данного реагента входит в уравнение скорости. Таким же образом определяют порядок реакции по каждому реагенту. Показатель степени для концентрации реагента А, не находящегося в избытке, устанавливают по графику зависимости dCA/dt от ln CA согласно уравнению
Наклон полученной прямой равен а. Константа kў является произведением константы скорости на концентрации реагентов, находящихся в избытке, взятые в соответствующих степенях. Молекулярность реакции определяется числом молекул, участвующих в самой медленной, лимитирующей стадии. Реакции бывают моно-, би-, три- и т.д. молекулярными. Порядок реакции и ее молекулярность не всегда можно предсказать исходя из стехиометрии реакции; для этого нужно провести кинетические измерения. В некоторых случаях порядок и молекулярность реакции, определенные исходя из ее стехиометрии, совпадают. Мономолекулярной называется такая реакция, в которой лимитирующей стадией является превращение одной молекулы, например распад ее на составляющие (диссоциация молекул иода I2 -> 2I) или превращение в другую молекулу в результате внутримолекулярной перестройки:
Бимолекулярная реакция — это взаимодействие двух молекул (например, молекулярного водорода с молекулярным иодом, h3 + I2 (r) 2HI). Реакция, протекающая одновременно с участием трех молекул, называется тримолекулярной. Поскольку вероятность столкновения сразу трех молекул, да еще в правильной взаимной ориентации, очень мала, такие реакции происходят редко.
Механизм химических реакций. При изучении механизма любой химической реакции рассматривают столкновение между отдельными реагирующими частицами (классическая теория столкновений) и другие элементарные акты с участием этих частиц. Учитывается также взаимная пространственная ориентация (стереохимия) реагирующих молекул. Считается, что реакция проходит через образование промежуточного комплекса, и для установления ее механизма необходимо знать состав и геометрию этого комплекса — межатомные расстояния и валентные углы. Реакции, называемые цепными, протекают через последовательность стадий. Продолжение цепи инициируют высокоэнергетические атомы или свободные радикалы. Рассмотрим фотохимическую реакцию образования хлороводорода. Под действием света молекула хлора распадается с образованием атомарного хлора. Атомы хлора реагируют с молекулой водорода с образованием HCl и атомарного водорода. Последний реагирует с молекулой хлора, вновь образуя HCl и высвобождая атом хлора:
(точкой в верхнем индексе обозначается неспаренный электрон в валентной оболочке атомов; этим подчеркивается, что атомы и являются высокоактивными свободными радикалами). Иногда эта цепь взаимодействий продолжается до тех пор, пока не прореагируют более миллиона молекул на каждый образовавшийся при фотодиссоциации атом хлора. Если два атома, ответственные за рост цепи (и ),прореагируют друг с другом с образованием НCl или если один из них потеряет энергию в результате столкновений со стенками реактора либо с посторонними частицами, цепь прервется. Важным параметром, определяющим скорость газофазных реакций, является число столкновений между молекулами в единицу времени, которые имеют подходящую ориентацию и обладают достаточной для вступления в реакцию энергией. Частота и энергия соударений зависят от размера частиц и их средней скорости. В качестве иллюстрации того, как с помощью кинетических данных можно получить информацию о механизме химических реакций, рассмотрим образование HI и HBr: h3 + I2 = 2HI и h3 + Br2 = 2HBr
Стехиометрические уравнения этих реакций идентичны. Однако кинетические измерения скоростей реакций показывают, что их механизмы совершенно различны. Для первой реакции, в которой происходит столкновение молекул водорода и иода, увеличение концентрации HI во времени определяется уравнением d[[HI]]/dt = k[[h3]][[I2]] где [[h3]] и [[I2]] — молярные концентрации водорода и иода, k — константа скорости реакции. В то же время, как показывают кинетические измерения, увеличение во времени концентрации HBr следует уравнению
где [[h3]], [[Br2]] и [[HBr]] — молярные концентрации водорода, брома и бромоводорода, k и k’ — константы. Реакция идет по цепному механизму, аналогичному тому, в соответствии с которым реагируют между собой хлор и водород с образованием хлороводорода: Br2 = 2Br, Br + h3 = HBr + H, H + Br2 = HBr + Br и т.д.
Выражение для скорости полной реакции можно получить, используя уравнения скоростей каждой из ее стадий. Температурные коэффициенты скоростей реакций. В диапазоне температур, близких к комнатной, скорость многих реакций удваивается или утраивается при повышении температуры на каждые 10°. С.Аррениус предложил следующее уравнение, описывающее зависимость константы скорости реакции от температуры: k = s exp(-DHa/RT)
Предэкспоненциальный множитель s называется аррениусовским частотным фактором и в бимолекулярной реакции определяется частотой столкновений молекул, которые имеют подходящую ориентацию для того, чтобы вступить в химическое взаимодействие, DНа — теплота (или энтальпия) активации, R — универсальная газовая постоянная [[1,987 кал/(град*моль), если DНа выражается в кал/моль]]. DНа равна кинетической энергии, которой должны обладать сталкивающиеся частицы, чтобы преодолеть их взаимное отталкивание и образовать продукты. Уравнение Аррениуса можно записать в дифференциальной форме:
Интегрирование в предположении, что DНа не зависит от Т, дает
откуда
Интегрирование в предположении независимости DНа от Т дает
или
Из уравнения (5) следует, что график зависимости ln k от 1/Т является прямой с наклоном -DНа/R, откуда DНа можно определить как -RЧs (где s — тангенс наклона прямой). Используя данное значение DНа и значение k при одной температуре, можно найти частотный фактор и затем рассчитать k при любой другой температуре из температурного диапазона, в котором сохраняется постоянной величина DНа. Член ln s в уравнении Аррениуса можно также определить графически, экстраполяцией графика зависимости ln k от 1/T к 1/Т = 0. В этой точке ln k = ln s (рис. 2).
Рис. 2. ГРАФИК ЗАВИСИМОСТИ логарифма k от 1/Т.
Экспоненциальный член exp(-DНа/RT) в уравнении (6) равен доле молекул с энтальпией , т.е. молекул, обладающих достаточной энергией, чтобы вступить в реакцию. Для бимолекулярных реакций аррениусовский частотный фактор можно представить как число столкновений в единицу времени в единице объема между молекулами, имеющими нужную ориентацию. Таким образом, k определяется числом столкновений химически активных и ориентированных нужным образом молекул. В рамках теории абсолютных скоростей реакций (или термодинамической теории) частотный фактор можно представить как
где x — трансмиссионный коэффициент, представляющий собой долю молекул, энергия которых превышает энергетический барьер на пути перехода от реагентов к продуктам, k — константа Больцмана, h — постоянная Планка, DSа — энтропия активации на моль реагента. DSа является мерой относительного числа степеней свободы молекул в активированном и исходном состояниях (т.е. числа независимых типов колебаний и вращений). Для некоторых мономолекулярных газофазных реакций распада активированный комплекс настолько близок по своей структуре к исходным реагентам, что изменение энтропии очень мало, т.е. DSа можно принять равным нулю. В этих случаях
,
и если x = 1, то константа скорости реакции определяется выражением
При 27° С (300 К)
(N — число Авогадро). Отсюда получаем приближенное уравнение для мономолекулярных реакций:
и менее точное уравнение для бимолекулярных реакций:
где 10 10 в первом приближении равно числу столкновений молекул при комнатной температуре, если концентрации выражены в моль/л.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Обратимость и равновесие. Обратимая химическая реакция — это реакция, в ходе которой происходят превращения как в прямом, так и в обратном направлениях. Первым, кто четко сформулировал представление об обратимости химических реакций, был К.Бертолле (1799). Участвуя в Египетской экспедиции Бонапарта, он обратил внимание на образование карбоната натрия в соляных озерах и пришел к заключению, что карбонат натрия образуется в результате взаимодействия между насыщенным раствором хлорида натрия и растворенным карбонатом кальция. Этот процесс обратен проводимой в лаборатории реакции между карбонатом натрия и растворенным хлоридом кальция с образованием карбоната кальция. В 1864 К.Гульдберг и П.Вааге открыли закон действующих масс, согласно которому скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Положение равновесия можно определить, зная скорости прямой и обратной реакций. Уравнение обратимой реакции имеет вид
Если СА, СВ, СL и СМ — молярные концентрации веществ А, В, L и М; а, b, l и m — соответствующие стехиометрические коэффициенты, k1 и k2 — константы скорости прямой и обратной реакций, то
В равновесии скорости прямой и обратной реакций равны:
и
где С — равновесная концентрация соответствующего вещества, KС — константа химического равновесия, выраженная через концентрации. Более строгий подход к выводу выражения для константы равновесия основан на принципах термодинамики. Можно показать, что в условиях равновесия (при равновесных концентрациях реагентов и продуктов) стандартное изменение свободной энергии системы определяется уравнением
Поскольку DF0 при постоянной температуре является константой, то и KС тоже константа, равная
Для газофазных реакций константу равновесия можно выразить через парциальные давления реагентов:
Представленная таким образом константа равновесия отличается от KС, выраженной через молярные концентрации, соответственно различаются и DF0 для этих двух случаев. Поясним, что такое изменение свободной энергии DF0 в ходе химической реакции. При постоянных температуре и давлении уменьшение свободной энергии является максимальной работой, которую можно совершить в ходе процесса, причем эта работа не связана с изменением объема или давления в системе. Стандартное изменение свободной энергии DF0 равно разности свободных энергий реагентов и продуктов в стандартных состояниях. Такое состояние для идеального газа — давление 1 атм, а для твердых веществ или жидкостей — их наиболее стабильная форма при давлении 1 атм и определенной температуре. Для идеального растворенного вещества стандартным является состояние при концентрации 1 моль на 1000 г растворителя (моляльная концентрация). Для газофазных реакций KС можно связать с Kр, используя уравнение состояния идеального газа: C = 1/V = p/RT
где V — объем, занимаемый одним молем газа, R — газовая постоянная, Т — абсолютная температура,
где Dn = (l + m) — (a + b) разность между суммой молей продуктов реакции и суммой молей исходных реагентов; эта разность определяется коэффициентами стехиометрического уравнения реакции. Следует иметь в виду, что DF0 — это разность свободных энергий реагентов и продуктов в их стандартных состояниях, а именно при концентрации растворенных веществ 1 М и давлении газов 1 атм, а рассчитывается эта разность свободных энергий по данным для равновесных концентрации и давления.
Равновесие в газофазных системах. Рассмотрим диссоциацию N2O4 (тетраоксид диазота) на две молекулы диоксида азота (NО2). Мол. масса N2O4 равна 92; это бурый газ с т. кип. 21,3° С. При нагревании цвет газа меняется до черного. При температуре 140° С происходит полная диссоциация N2O4 на NO2 с мол. массой 46 в соответствии с уравнением
Пусть a — мольная доля газа, подвергшегося диссоциации, а из каждого моля получается n молей газообразных продуктов; тогда общее число молей газа будет равно 1 — a + na = 1 + (n — 1)a
Плотность данной массы газа при постоянном давлении обратно пропорциональна числу молей. Обозначим через d1 плотность недиссоциированного газа, а через d2 — плотность смеси исходного и диссоциированного газа при том же давлении. Тогда
и
Заменив плотности на мол. массы, получим
где М1 — мол. масса недиссоциированного газа, М2 — средняя мол. масса смеси исходного и диссоциированного газа. Поскольку для данной реакции n = 2 и общее число молей газа в смеси равно 1 — a + 2a = 1 + a, парциальные давления N2O4 и NO2 равны соответственно
и
где Р — суммарное давление. Теперь
Если доля диссоциированного газа при 75° С равна 0,741 и суммарное давление 1 атм, то
Отметим, что при повышении суммарного давления степень диссоциации будет уменьшаться в соответствии с уравнением (7) и принципом Ле Шателье, согласно которому система стремится сохранить состояние, в котором она находится, в противовес любым внешним воздействиям. Приведем в качестве примера несколько изученных газофазных реакций: N2 + 3h3 2Nh4 h3 + I2 2HI N2 + O2 2NO CO2 + h3 CO + h3O В последних трех случаях изменение давления в системе не повлияет на ход реакции, поскольку число молекул исходных соединений и продуктов одинаково. Однако в первом случае при повышении давления будет наблюдаться ускорение процесса — образование большего количества продукта.
Равновесие в гомогенной жидкой системе. Одним из типичных примеров обратимой реакции в гомогенной жидкой системе является реакция между уксусной кислотой и этиловым спиртом с образованием этилацетата и воды:
Константа равновесия KС этой реакции равна
Если а молей кислоты и b молей спирта в смеси с l молями этилацетата и m молями воды образуют раствор объемом v и если x молей кислоты и x молей спирта дают x молей этилацетата и x молей воды, то можно записать уравнение (8) в следующем виде:
Разные электролиты диссоциируют в полярных растворителях в разной степени (см. ЭЛЕКТРОЛИТЫ). Для определения степени диссоциации электролитов чаще всего применяют достаточно простой и точный метод, основанный на измерении их электропроводности. Согласно Аррениусу, степень диссоциации электролита равна
где A — эквивалентная электропроводность (т.е. проводимость, соответствующая одному «молю» заряда) электролита, концентрацию которого хотят определить, L0 — эквивалентная электропроводность электролита при бесконечном разбавлении, когда он полностью диссоциирован. Зная концентрацию и степень диссоциации, можно определить константу ионизации (для кислот — константу протолиза) слабого электролита. Обычно ионизация или диссоциация подавляется при добавлении в среду избытка продукта диссоциации. Кислота, образующаяся при захвате протона данным основанием, называется кислотой, сопряженной с этим основанием; соответственно основание, образующееся при отдаче протона данной кислотой, называется основанием, сопряженным с этой кислотой. Представим протолиз (или ионизацию кислоты в воде) как взаимные превращения сопряженных кислот и оснований: HA + h3O h4O+ + A-где НА и А- сопряженные кисло
Название веществ CaO NaCl KOH HBr
Здесь работает принцип Ле Шателье — Брауна
а при увеличении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов. В данном случае равновесие сместится в сторону прямой реакции.
б При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. Тоесть в данном случае равновесие сместится в сотрону обратной реакции
А принцип формулируется так:
Приинцип Ле Шателье — Брауна — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные в сторону противодействия изменениям.
KCLO₃ — хлорат калия. В соединение входят:
1 атом калия K;
1 атом хлора Cl;
3 атома кислорода О;
H₃PO₄- ортофосфорная кислота. В соединение входят:
3 атома водорода Н;
1 атом фосфора Р;
4 атома кислорода О;
Al₂O₃ — оксид алюминия. В соединение входят:
2 атома алюминия Al;
3 атома кислорода О₃;
CuSO₄ — сульфат меди. В соединение входят:
1 атом меди Cu;
1 атом серы S;
4 атома кислорода О;
Fe(OH)3 — Гидроксид железа. В соединение входят:
1 атом железа Fe;
3 атома кислорода О;
3 атома водорода Н;
C14/6(бета-распад)=N14/7+e+v(e)(выделяется энергия=156,46 кэВ).Образуется стабильный нуклид N14/7.
Это происходит под воздействием температуры. То есть, для перехода из одного состояния в другое расходуется в определенном количестве тепло
(испарение, таяние снега и льда) или оно выделяется(конденсация, замерзание воды)
Бромистоводородная кислота — опасный, но важный химический реактив
Бромистоводородная кислота — сильная неорганическая кислота, ее формула HBr. Может называться также бромоводород, бромистый водород.
В промышленных масштабах вещество получают химической реакцией водорода и брома в процессе нагревания, а так же как побочный продукт органического синтеза бромосодержащих соединений.
Свойства
Бромоводород в нормальных условиях представляет собой газ тяжелее воздуха, без цвета, с кислым вкусом, очень гигроскопичный. Газ сильно «дымит» на воздухе, активно поглощая влагу и образуя туман — капельки водной кислоты. Запах резкий, неприятный, напоминает запах соляной кислоты. При температуре около -67 °С сгущается в жидкость, а при t -87 °С кристаллизируется. Может образовывать кристаллогидраты.
Кислота хорошо растворяется в воде, спиртовой раствор образует электролит. Термически устойчива, даже при нагревании до 1000 °С на водород и бром разлагается не более полпроцента молекул вещества.
Водный раствор HBr — прозрачная бесцветная или слегка желтоватая жидкость. Желтый цвет раствору придают молекулы Br, образующиеся в процессе реакции вещества с кислородом воздуха. Реактив тяжелее воды, с резким запахом. С точки зрения химии — это одноосновная кислота с восстановительными свойствами. Считается одной из самых сильных кислот, по своей активности сопоставима с соляной кислотой. Реагирует с металлами, оксидами и щелочами с образованием бромидов. В реакции с металлами выделяет водород, который может воспламениться. Бромистоводородная кислота разрушает большинство металлов. Ее смесь с азотной кислотой способна растворять золото и платину.
Меры безопасности
Химреактив ядовит, класс опасности 3, ПДК паров в помещении, где проводятся работы, составляет 2 мг/м3. Кислота и ее пары при попадании внутрь и вдыхании вызывают кашель, состояние удушья, нарушение функций нервной системы и терморегуляции. Раздражают кожу, слизистые, глаза. Пострадавшему следует промыть глаза водой или раствором соды, кожу — мыльным раствором или водой и срочно доставить к врачу.
Гост 2062-77 требует, чтобы работы с бромоводородом велись с использованием средств защиты лица, глаз, тела, органов дыхания, в вытяжном шкафу, с учетом правил противопожарной безопасности. Для нейтрализации пролитого реактива используют 10% раствор щелочи или большое количество воды. Для осаждения паров разлитой кислоты разбрызгивают воду. Газ тяжелее воздуха, поэтому при аварийных выбросах скапливается в нижней части помещения, в подвалах, в низинах.
HBr допускается перевозить любым транспортом с соответствующей маркировкой тары знаком опасности по ГОСТ 19433. Газообразная кислота транспортируется в баллонах под давлением 24 атм. Наиболее подходящая тара для хранения водной кислоты — пластиковые канистры.
Применение
— Бромистоводородная кислота, ее газообразная форма и водные растворы разной концентрации, применяются для получения бромидов металлов, органических производных брома. Особенно важно производство бромида серебра, применяющегося в изготовлении кино- и фотоматериалов.
— Реактив используется как катализатор в реакциях алкилирования в органическом синтезе.
— Бромоводород востребован в аналитической химии и микробиологии, в нефтяной и химической индустрии.
В интернет-магазине реактивов и химического оборудования «ПраймКемикалс Групп» можно купить как бромистоводородную кислоту, так и пластиковую и стеклянную тару для нее, а также средства защиты для работы с агрессивными веществами.
Общая характеристика кислот — урок. Химия, 8–9 класс.
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
Название кислоты | Формула кислоты | Формула кислотного остатка | Название соли этой кислоты |
| Фтороводородная (плавиковая) | HF | −F | Фторид |
| Хлороводородная (соляная) | HCl | −Cl | Хлорид |
| Бромоводородная | HBr | −Br | Бромид |
| Угольная | h3CO3 | =CO3 | Карбонат |
| Кремниевая | =SiO3 | Силикат | |
| Азотная | HNO3 | −NO3 | Нитрат |
Ортофосфорная (фосфорная) | h4PO4 | ≡PO4 | Ортофосфат (фосфат) |
| Серная | h3SO4 | =SO4 | Сульфат |
| Сернистая | h3SO3 | Сульфит | |
| Сероводородная | h3S | =S | Сульфид |
Представителем органических кислот является уксусная кислота Ch4COOH. Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Источники:
Оржековский П. А. и др. Химия: 8-й класс. — Москва: АСТ: Астрель, 2013.
Габриелян О. С. Химия: 8-й класс. — Москва: Дрофа, 2002.
Бромистоводородная кислота — обзор
2.1 Неорганические кислоты и основания
Неорганическая кислота (также называемая минеральной кислотой) — это кислота, полученная из одного или нескольких неорганических соединений. Все неорганические кислоты образуют ионы водорода и сопряженные основные ионы при растворении в воде. Обычно используемые неорганические кислоты — это серная кислота (H 2 SO 4 ), соляная кислота (HCl) и азотная кислота (HNO 3 ). Неорганические кислоты варьируются от суперкислот (таких как хлорная кислота, HClO 4 ) до очень слабых кислот (таких как борная кислота, H 3 BO 3 ).Неорганические кислоты обычно хорошо растворяются в воде и не растворяются в органических растворителях.
Неорганические кислоты используются во многих секторах химической промышленности в качестве сырья для синтеза других химических веществ, как органических, так и неорганических. Большие количества этих кислот, особенно серной, азотной и соляной кислоты, производятся для коммерческого использования на крупных заводах. Неорганические кислоты также используются напрямую из-за их коррозионных свойств. Например, разбавленный раствор соляной кислоты используется для удаления отложений внутри котлов с соблюдением мер предосторожности для предотвращения коррозии котла под действием кислоты.Этот процесс называется очисткой от накипи.
Хотя HF можно назвать фтористым водородом, ему дали другое название, чтобы подчеркнуть, что это кислота — вещество, которое диссоциирует на ионы водорода (H + ) и анионы в воде. Быстрый способ идентифицировать кислоты — увидеть, есть ли перед молекулярной формулой соединения буквой H (обозначающей водород). Чтобы назвать кислоты, префикс hydro- помещается перед неметаллом и модифицируется, чтобы закончить на -ic . Состояние кислот — водное ( водн. ), потому что кислоты содержатся в воде.Некоторые распространенные бинарные кислоты включают:
HF ( г ) (фтористый водород) → HF ( водн. ) (плавиковая кислота)
HBr ( г ) (бромоводород) → HBr ( водн. ) (бромистоводородный кислота)
HCl ( г ) (хлористый водород) → HCl ( водн. ) (соляная кислота)
H 2 S ( г ) (сероводород) → H 2 S ( водн. ) (сероводородная кислота)
Термин неорганическое основание представляет большой класс неорганических соединений, способных реагировать с кислотами, то есть нейтрализовать кислоты с образованием солей.Неорганическое основание заставляет индикатор приобретать характерные цвета и обычно относится к водорастворимым гидроксидам, таким как гидроксид натрия (NaOH), гидроксид калия (KOH) или гидроксид аммония (NH 4 OH). Термин также включает слабые основания, такие как водорастворимые производные карбоната () или производные бикарбоната ().
Некоторые химические вещества могут действовать как кислота и как основание — примером является вода, которая может либо отдавать ион водорода (с образованием гидроксильного иона, OH — ), либо принимать ион водорода с образованием иона гидроксония (H 3 O + ), также называемый ионом гидроксония.Это свойство делает воду амфотерным растворителем. Вкратце, амфотерное соединение — это молекула или ион, которые могут действовать как кислота, так и как основание, и это свойство может влиять на поведение химических веществ в окружающей среде.
Оксиды металлов, которые реагируют как с кислотами, так и с основаниями с образованием соли и воды, являются амфотерными оксидами и включают оксид свинца (PbO) и оксид цинка (ZnO), среди многих других, таких как оксиды алюминия (Al 2 O 3 ) и медь (CuO).Другими примерами амфотерных соединений являются оксиды и гидроксиды элементов, которые лежат на границе между металлическими и неметаллическими элементами в периодической таблице (рис. 3.2). Например, гидроксид алюминия [Al (OH) 3 ] нерастворим при нейтральном pH (pH = 7,0), но может принимать протоны в кислотном растворе с образованием [Al (H 2 O) 6 ] 3+ или принять ион гидроксида (OH — ) в щелочном растворе для получения ионов [Al (OH) 4+ ] — .Следовательно, оксид алюминия растворим в кислоте и в основании, но не в нейтральной воде. Другими примерами амфотерных оксидов являются оксид бериллия (BeO), оксид галлия (Ga 2 O 3 ) и оксид сурьмы (Sb 2 O 3 ). Повышение степени окисления металла увеличивает кислотность его оксида за счет снижения электронной плотности у атомов кислорода. Например, пятиокись сурьмы (Sb 2 O 5 ) является кислой, а триоксид сурьмы (Sb 2 O 3 ) — амфотерным.
Рисунок 3.2. Периодическая таблица элементов, показывающая группы и периоды, включая элементы лантанидов и элементы актинидов.
Еще одно явление, которое заслуживает рассмотрения, — это явление, известное как выравнивание растворителя , которое возникает, когда сильная кислота помещается в растворитель, такой как (но не ограничиваясь этим) вода. Поскольку сильные кислоты отдают свои протоны растворителю, самой сильной кислотой, которая может существовать, является сопряженная кислота растворителя.В водном растворе это ион гидроксония (H 3 O + ). Это означает, что сила кислот, таких как соляная кислота (HCl) и бромистоводородная кислота (HBr), не может быть дифференцирована в воде, поскольку обе они диссоциированы на 100% до иона гидроксония.
БРОМИД ВОДОРОДА БЕЗВОДНЫЙ | CAMEO Chemicals
Химический лист данных
Химические идентификаторы |
Опасности |
Рекомендации по ответу |
Физические свойства |
Нормативная информация |
Альтернативные химические названия
Химические идентификаторы
В
Поля химического идентификатора
включать общие идентификационные номера,
NFPA алмаз
U.S. Знаки опасности Министерства транспорта и общие
описание химического вещества. Информация в CAMEO Chemicals поступает
из множества
источники данных.
NFPA 704
данные недоступны
Общее описание
Бесцветный газ с резким раздражающим запахом. Едкий. Тяжелее воздуха. Продолжительное воздействие огня или сильной жары может привести к сильному разрыву и взрыву контейнера. Длительное воздействие низких концентраций или кратковременное воздействие высоких концентраций может привести к неблагоприятным последствиям для здоровья от вдыхания.Используется для производства других химикатов и в качестве катализатора при производстве химикатов.
Скорость появления: Немедленно
Стойкость: От минут до часов
Порог запаха: 2 ppm
Источник / использование / другая опасность: Химическая промышленность; очень едкий.
Опасности
Оповещения о реактивности
Реакции воздуха и воды
Едкий запах, пары во влажном воздухе образуют облака, содержащие бромистоводородную кислоту. Теплота растворения большая, [Merck, 11-е изд., 1989].
Пожарная опасность
Поведение при пожаре: Контейнер под давлением может взорваться с выделением токсичного, раздражающего пара. (USCG, 1999)
Опасность для здоровья
Вдыхание вызывает сильное раздражение носа и верхних дыхательных путей, повреждение легких. Проглатывание вызывает ожоги рта и желудка. Попадание в глаза вызывает сильное раздражение и ожоги. Попадание на кожу вызывает раздражение и ожоги. (USCG, 1999)
Профиль реактивности
БРОМИД ВОДОРОДА — безводная (не содержащая воды) сильная кислота.Реагирует быстро и экзотермически с основаниями всех типов (включая амины и амиды). Реагирует экзотермически с карбонатами (включая известняк и строительные материалы, содержащие известняк) и гидрокарбонатами с образованием диоксида углерода. Реагирует с сульфидами, карбидами, боридами и фосфидами с образованием токсичных или легковоспламеняющихся газов. Реагирует со многими металлами (включая алюминий, цинк, кальций, магний, железо, олово и все щелочные металлы) с образованием легковоспламеняющегося газообразного водорода. Интенсивно Реагирует с уксусным ангидридом, 2-аминоэтанолом, гидроксидом аммония, фосфидом кальция, хлорсульфоновой кислотой, 1,1-дифторэтиленом, этилендиамином, этиленимином, олеумом, хлорной кислотой, b-пропиолактоном, оксидом пропилена, смесью перхлорат серебра и четыреххлористого углерода, гидроксид натрия. , фосфид урана (IV), винилацетат, карбид кальция, карбид рубидия, ацетилид цезия, ацетилид рубидия, борид магния, сульфат ртути (II), фосфид кальция, карбид кальция.
Принадлежит к следующей реактивной группе (ам)
Потенциально несовместимые абсорбенты
Информация отсутствует.
Ответные рекомендации
В
Поля рекомендаций ответа
включать расстояния изоляции и эвакуации, а также рекомендации по
пожаротушение, противопожарное реагирование, защитная одежда и первая помощь. В
информация в CAMEO Chemicals поступает из различных
источники данных.
Изоляция и эвакуация
Выдержка из руководства ERG 125 [Газы — Коррозионные]:
В качестве немедленной меры предосторожности изолировать место разлива или утечки на расстоянии не менее 100 метров (330 футов) во всех направлениях.
РАЗЛИВ: См. Таблицу 1 ERG — Начальные расстояния изоляции и защитных действий в спецификации UN / NA 1048.
ПОЖАР: Если цистерна, железнодорожный вагон или автоцистерна вовлечены в пожар, ИЗОЛИРУЙТЕ на 1600 метров (1 милю) во всех направлениях; также рассмотрите возможность начальной эвакуации на 1600 метров (1 милю) во всех направлениях. (ERG, 2016)
Пожарная
Выдержка из руководства ERG 125 [Газы — Коррозионные]:
МАЛЫЙ ПОЖАР: Сухой химикат или CO2.
БОЛЬШОЙ ПОЖАР: водяная струя, туман или обычная пена.Уберите контейнеры из зоны пожара, если это можно сделать без риска. Не допускайте попадания воды внутрь контейнеров. С поврежденными цилиндрами должны обращаться только специалисты.
ПОЖАРНЫЕ ТАНКИ: тушите пожар с максимального расстояния или используйте необслуживаемые держатели шлангов или контрольные сопла. После того, как огонь не погаснет, охладите емкости затопленным количеством воды. Не направляйте воду на источник утечки или предохранительные устройства; может возникнуть обледенение. Немедленно удалите воду в случае появления шума из вентиляционных устройств безопасности или обесцвечивания бака.ВСЕГДА держитесь подальше от танков, охваченных огнем. (ERG, 2016)
Non-Fire Response
Выдержка из руководства ERG 125 [Газы — Коррозионные]:
Полностью герметизирующую пароизоляционную одежду следует носить в случае разливов и утечек без возгорания. Не прикасайтесь к пролитому материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Если возможно, поверните протекающие емкости так, чтобы выходил газ, а не жидкость. Не допускайте попадания в водные пути, канализацию, подвалы или закрытые пространства. Не направляйте воду на пролитую или источник утечки.Используйте водное распыление, чтобы уменьшить испарения или отвести облако пара. Избегайте попадания сточных вод на разлитый материал. Изолируйте область, пока газ не рассеется. (ERG, 2016)
Защитная одежда
Кожа: Если химическое вещество находится в растворе, наденьте соответствующую личную защитную одежду для предотвращения контакта с кожей и предотвращения замерзания кожи от контакта с жидкостью или от контакта с сосудами, содержащими жидкость.
Глаза: Если химическое вещество находится в растворе, используйте соответствующие средства защиты глаз, чтобы предотвратить попадание жидкости в глаза, что может привести к ожогам или повреждению тканей в результате обморожения.
Вымыть кожу: Если химическое вещество находится в растворе, рабочий должен немедленно промыть кожу, если она загрязнится.
Удаление: Если химическое вещество находится в растворе, необходимо снять и заменить рабочую одежду, которая стала влажной или значительно загрязненной.
Изменение: Нет рекомендаций относительно необходимости для работника менять одежду после рабочей смены.
Предоставить: Фонтаны для промывки глаз должны быть предоставлены (когда химическое вещество находится в жидкой форме) в местах, где есть вероятность того, что рабочие могут подвергнуться воздействию вещества; это независимо от рекомендаций, связанных с ношением средств защиты глаз.В непосредственной рабочей зоне должны быть предусмотрены средства для быстрого обмачивания тела (когда химическое вещество находится в растворе) для экстренного использования, где есть вероятность воздействия. [Примечание: предполагается, что эти устройства обеспечивают достаточное количество или поток воды для быстрого удаления вещества из любых участков тела, которые могут подвергнуться воздействию. Фактическое определение того, что представляет собой адекватное устройство для быстрого слива, зависит от конкретных обстоятельств. В некоторых случаях должен быть легко доступен дренчерный душ, тогда как в других наличие воды из раковины или шланга можно считать достаточным.] В непосредственной близости от рабочей зоны должны быть предусмотрены приспособления для быстрого смачивания и / или фонтаны для промывания глаз для аварийного использования, где есть любая возможность воздействия очень холодных или быстро испаряющихся жидкостей. (NIOSH, 2016)
Ткани для костюмов DuPont Tychem®
Легенда ткани Tychem®
| QS = Tychem 2000 SFR |
| QC = Tychem 2000 |
| SL = Тихем 4000 |
| C3 = Тихем 5000 |
| TF = Тихем 6000 |
| TP = Tychem 6000 FR |
| BR = Тихем 9000 |
| RC = Tychem RESPONDER® CSM |
| TK = Тихем 10000 |
| RF = Тихем 10000 FR |
Детали тестирования
Данные о проницаемости ткани были получены для DuPont независимыми
испытательные лаборатории с использованием ASTM F739, EN369, EN 374-3, EN ISO 6529
(методы A и B) или методы испытаний ASTM D6978.Нормализованное время прорыва
(время, при котором скорость проникновения равна 0,1 мкг / см2 / мин)
сообщается в минутах.
Все жидкие химикаты были протестированы при температуре примерно от 20 ° C до
27 ° C, если не указано иное.
Другая температура может существенно повлиять на
время прорыва; скорость проникновения обычно увеличивается с
температура.
Все химические вещества имеют
были протестированы при концентрации более 95%, если не указано иное
заявил.Если не указано иное, проницаемость измерялась для отдельных химикатов.
Характеристики проницаемости смесей могут значительно отличаться.
от проницаемости отдельных химических веществ.
Боевые отравляющие вещества (люизит, зарин, зоман, сера
Горчица, табун и нервно-паралитический агент VX) были протестированы при 22 ° C и 50%
относительная влажность в соответствии с военным стандартом MIL-STD-282.
| Химическая промышленность | Номер CAS | Государство | QS | QC | SL | C3 | TF | TP | BR | RC | ТК | РФ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Бромистоводородная кислота (48-49%) | 10035-10-6 | Жидкость | > 480 | |||||||||
| Бромистый водород (> 95%, газ) | 10035-10-6 | Пар | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 |
Особые предупреждения от DuPont
- Зубчатые и переплетенные швы повреждены какой-либо опасной жидкостью
химические вещества, такие как сильные кислоты, и их не следует носить при
эти химические вещества присутствуют. - ВНИМАНИЕ: эта информация основана на технических данных, которые
DuPont считает себя надежным. Подлежит пересмотру как
приобретаются дополнительные знания и опыт. DuPont не делает
гарантия результатов и не берет на себя никаких обязательств или ответственности …… в связи с этой информацией. Ответственность за
определить уровень токсичности и надлежащие средства индивидуальной защиты
необходимое оборудование.Информация, изложенная здесь, отражает лабораторные
эксплуатационные качества тканей, а не комплектных предметов одежды, в контролируемых условиях.
Он предназначен для информационного использования лицами, имеющими технические навыки для
оценка в соответствии с их конкретными условиями конечного использования, по их собственному усмотрению
и риск. Любой, кто намеревается использовать эту информацию, должен сначала проверить
что выбранная одежда подходит для предполагаемого использования. Во многих случаях,
швы и закрытия имеют более короткое время прорыва и более высокую проницаемость
ставки, чем ткань.Пожалуйста, свяжитесь с DuPont для получения конкретных данных. Если ткань
рвется, истирается или прокалывается, или если швы или затворы выходят из строя, или если
прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен прекратить использование
одежды, чтобы избежать потенциального воздействия химикатов. Поскольку условия использования
находятся вне нашего контроля, мы не даем никаких гарантий, явных или подразумеваемых,
включая, помимо прочего, отсутствие гарантий товарной пригодности или пригодности
для конкретного использования и не несем ответственности в связи с любым использованием
эта информация.Эта информация не предназначена для использования в качестве лицензии на работу.
под или рекомендацией нарушить какой-либо патент или техническую информацию
компании DuPont или других лиц, охватывающих любой материал или его использование.
(DuPont, 2018)
Первая помощь
Глаза: Если это химическое вещество в растворе попадет в глаза, немедленно промойте глаза большим количеством воды, иногда приподнимая нижнее и верхнее веко. Немедленно обратитесь за медицинской помощью. Контактные линзы нельзя носить при работе с этим химическим веществом.Если ткань глаза замерзла, немедленно обратитесь за медицинской помощью. Если ткань не замерзла, немедленно и тщательно промойте глаза большим количеством воды в течение не менее 15 минут, иногда приподнимая нижнее и верхнее веко. Если раздражение, боль, отек, слезотечение или светобоязнь не проходят, как можно скорее обратитесь за медицинской помощью.
Кожа: Если это химическое вещество в растворе попало на кожу и не произошло обморожения, немедленно промойте загрязненную кожу водой. Если это химическое вещество проникает в одежду, немедленно снимите одежду и промойте кожу водой.Немедленно обратитесь за медицинской помощью. Если произошло обморожение, немедленно обратитесь за медицинской помощью; НЕ трите пораженные участки и не смывайте водой. Чтобы предотвратить дальнейшее повреждение тканей, НЕ пытайтесь снимать замерзшую одежду с обмороженных участков.
Дыхание: Если человек вдыхает большое количество этого химического вещества, немедленно выведите пострадавшего на свежий воздух. Если дыхание остановилось, выполните реанимацию «рот в рот». Держите пострадавшего в тепле и покое. Как можно скорее обратитесь за медицинской помощью.
Проглатывание: Если это химическое вещество в растворе было проглочено, немедленно обратитесь за медицинской помощью. (NIOSH, 2016)
Физические свойства
Точка воспламенения: данные недоступны
Нижний предел взрываемости (НПВ): данные недоступны
Верхний предел взрываемости (ВПВ): данные недоступны
Температура самовоспламенения: данные недоступны
Температура плавления:
-124 ° F
(NIOSH, 2016)
Давление газа:
20 атм
(NIOSH, 2016)
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес:
2.14
при -88,6 ° F
(USCG, 1999)
Точка кипения:
-88,2 ° F
при 760 мм рт.
(USCG, 1999)
Молекулярный вес:
80,92
(USCG, 1999)
Растворимость воды:
49%
(NIOSH, 2016)
Потенциал ионизации:
11,62 эВ
(NIOSH, 2016)
IDLH:
30 частей на миллион
Как HBr
(NIOSH, 2016)
AEGL (рекомендуемые уровни острого воздействия)
| Срок действия | AEGL-1 | AEGL-2 | AEGL-3 |
|---|---|---|---|
| 10 минут | 1 частей на миллион | 250 частей на миллион | 740 частей на миллион |
| 30 минут | 1 частей на миллион | 83 страниц в минуту | 250 частей на миллион |
| 60 минут | 1 частей на миллион | 40 страниц в минуту | 120 страниц в минуту |
| 4 часа | 1 частей на миллион | 10 частей на миллион | 31 частей на миллион |
| 8 часов | 1 частей на миллион | 5 страниц в минуту | 15 страниц в минуту |
(NAC / NRC, 2017)
ERPG (Руководство по планированию действий в чрезвычайных ситуациях)
Нет доступной информации по ERPG.
PAC (Критерии защитного действия)
| Химическая промышленность | PAC-1 | PAC-2 | PAC-3 |
|---|---|---|---|
| бромистый водород; (Бромоводородная кислота) (10035-10-6) | 1 частей на миллион | 40 страниц в минуту | 120 страниц в минуту |
(DOE, 2016)
Нормативная информация
В
Поля нормативной информации
включать информацию из
U.S. Сводный список раздела III Агентства по охране окружающей среды.
Списки,
химический объект Министерства внутренней безопасности США
Стандарты борьбы с терроризмом,
и Администрации США по охране труда
Стандартный список управления производственной безопасностью особо опасных химических веществ
(подробнее об этих
источники данных).
Сводный список списков EPA
Нет нормативной информации.
Стандарты по борьбе с терроризмом химического предприятия DHS (CFATS)
| ВЫПУСК | КРАЖА | САБОТАЖ | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Представляющее интерес химическое вещество | Номер CAS | Мин. Концентрация | STQ | Безопасность Выпуск | Мин. Концентрация | STQ | Безопасность Выпуск | Мин. Концентрация | STQ | Безопасность Выпуск |
| Бромистый водород (безводный) | 10035-10-6 | 95.33% | 500 фунтов | WME | ||||||
(DHS, 2007)
Список стандартов управления безопасностью процессов (PSM) OSHA
| Химическое название | Номер CAS | Пороговое количество (TQ) |
|---|---|---|
| Бромистый водород | 10035-10-6 | 5000 фунтов |
(OSHA, 2011)
Альтернативные химические названия
В этом разделе представлен список альтернативных названий этого химического вещества,
включая торговые наименования и синонимы.
- БЕЗВОДНАЯ ВОДОРОДНАЯ КИСЛОТА
- БЕЗВОДНЫЙ БРОМИД ВОДОРОДА
- ВОДНЫЙ БРОМИД ВОДОРОДА (Т.Е., ВОДОРОДНАЯ КИСЛОТА)
- КИСЛОТА ВОДОРОДНАЯ БЕЗВОДНАЯ
- БРОМИД ВОДОРОДА
- БРОМИД ВОДОРОДА (h3BR2)
- БРОМИД ВОДОРОДА (HBR)
- БРОМИД ВОДОРОДА (ВОДОРОДНАЯ КИСЛОТА)
- БРОМИД ВОДОРОДА БЕЗВОДНЫЙ
- МОНОБРОМИД ВОДОРОДА
бинарных кислот | Введение в химию
Цель обучения
- Объясните периодические тенденции, влияющие на силу бинарных кислот.
Ключевые моменты
- Сила бинарной кислоты зависит от прочности связи H-X; чем слабее связь, тем сильнее кислота.
- Названия бинарных кислот начинаются с «гидро-», за которым следует имя другого элемента, измененное так, чтобы заканчиваться на «-ic».
- Бинарные кислоты относятся к одному из двух классов кислот; вторые — это оксикислоты (или оксикислоты), которые состоят из водорода, кислорода и другого элемента.
Условия
- бинарные кислотымолекулярные соединения, в которых водород объединен со вторым неметаллическим элементом
- pKaa — количественная мера силы кислоты в растворе; слабая кислота имеет значение pKa в приблизительном диапазоне от -2 до 12 в воде, а сильная кислота имеет значение pKa менее примерно -2.
Кислотная прочность и прочность связи
Бинарные кислоты — это определенные молекулярные соединения, в которых водород соединен со вторым неметаллическим элементом; эти кислоты включают HF, HCl, HBr и HI.
HCl, HBr и HI — все сильные кислоты, а HF — слабая кислота. Сила кислоты увеличивается по мере уменьшения экспериментальных значений pKa в следующем порядке:
HF (pKa = 3,1) Почему HF — слабая кислота, а остальные галогеноводородные кислоты — сильные? Можно было бы правильно предположить, что фтор очень электроотрицателен, поэтому связь H-F очень полярна, и мы можем ожидать, что HF легко диссоциирует в растворе; это рассуждение не является неправильным, но аргумент об электроотрицательности опровергается соображениями ионного размера.Вспомните периодическую тенденцию увеличения размера ионов по мере продвижения вниз по таблице Менделеева. Поскольку фтор находится в верхней части галогенов, ион F — является самым мелким галогенидом; следовательно, его электроны сосредоточены вокруг его ядра, и в результате связь H-F относительно коротка. Более короткие связи более стабильны, и поэтому связь H-F сложнее разорвать. Однако, как только мы перейдем к хлору, тенденция изменится. Хлор больше и имеет больше электронов, поэтому связь H-Cl длиннее и слабее.В присутствии воды электростатическое притяжение между частично отрицательным кислородом воды и частично положительным водородом на H-Cl достаточно сильно, чтобы разорвать связь H-Cl, и ионы диссоциируют в растворе. Те же рассуждения применимы как для HBr, так и для HI. Эти кислоты даже сильнее, чем HCl, потому что ионы Br — и I — даже больше. По существу, связи H-Br и H-I еще слабее, и эти соединения также легко диссоциируют в растворе. Имена бинарных кислот начинаются с «гидро-», за которым следует имя другого элемента, модифицированное так, чтобы заканчиваться на «-ic».Например, HCl называется соляной кислотой. Бинарные кислоты — это один из двух классов кислот, второй — это оксикислоты (или оксикислоты), которые состоят из водорода, кислорода и третьего элемента, который часто является неметаллом. Соляная кислота Соляная кислота представляет собой прозрачный бесцветный раствор хлористого водорода (HCl) в воде. Это очень коррозионная, сильная минеральная кислота, которая используется во многих промышленных целях. Соляная кислота естественным образом содержится в желудочном соке. Он входит в состав бинарных кислот. Показать источники Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники: Пользовательский поиск Именование ковалентных соединений Именование бинарных ионных соединений Многоатомные ионы Именование многоатомных ионов Именование римскими цифрами Написание формул Именование кислот Кислоты — Для простоты названия кислот, которые мы будем рассматривать на самом деле это просто особый класс ионных соединений, где катион всегда H + .Итак, если в формуле первым записан водород, то это обычно означает, что водород является катионом H + , а соединение — кислотой. При растворении в воде кислоты производят ионы H + (также называемые протонами, поскольку удаление одного электрона из нейтрального атома водорода оставляет один протон). Правила наименования кислот, не содержащих кислород в анионе: HCl, который содержит хлорид аниона, называется гидро хлор ic кислота . HCN, который содержит цианид аниона, называется hydro cyan ic acid . Правила наименования оксикислот (анион содержит элемент кислород): HNO 3 , который содержит многоатомный ион нитр ат, , называется нитром ic кислоты. HNO 2 , который содержит многоатомный ион нитр и , называется нитром или кислоты. Выделите, чтобы раскрыть название аниона и название кислоты фторид фтористая кислота — 26 — 3 9228 25 — 3 9228 нитрат кислота сульфат серная кислота HClO 2 хлорсодержащая кислота йодная кислота 2 — это Составление 9126 Ионные соединения. Обозначение многоатомных ионов с помощью многоатомных ионов. Обозначение с помощью римских цифр. Формула для обозначения кислот. . Демонстрационные видеоролики. Год основания 2010 Юридический статус Фирмы Физическое лицо — Собственник Характер BusinessExporter Количество сотрудников от 11 до 25 человек Годовой оборот R.1-2 крор Участник IndiaMART с января 2017 г. GST33BVZPK8301D1ZH RasChem Trading — ведущее предприятие по импорту, экспорту, торговле и снабжению, базирующееся в Ченнаи, Индия. Созданная и продвигаемая высококвалифицированными бизнес-профессионалами, а также укомплектованная опытными технологами и разнородным персоналом, компания имеет огромные стандарты в области инноваций, ориентации на клиентов и эффективности обслуживания.Наш разнообразный ассортимент продукции включает промышленные химикаты для энергетики / нефти и газа, промежуточные продукты, специальные продукты, смолы, добавки, соли, растворители, мономеры и специальные химические вещества для оптимизации процессов и настройки. В настоящее время компания занимает лидирующие позиции во многих промышленных секторах и быстро выходит на другие географические рынки, помимо Индии и стран Персидского залива. Для поддержки нашей деятельности у нас есть эксклюзивные маркетинговые и экспортные соглашения с крупными индийскими производителями на поставку конкретных продуктов на согласованные географические рынки с поддержкой зарубежных партнеров и торговых партнеров.Мы также сравниваем наши экспортные услуги со сторонними сертификатами и международными агентствами, когда это когда-либо требуется, чтобы гарантировать стандарты качества наших взыскательных зарубежных клиентов. Наше внимание уделяется брому и бромным химикатам, включая бромистоводородную кислоту, жидкий бром, н-пропилбромид и бромированные антипирены. Наши нефтепромысловые химикаты включают бромид натрия (NaBr), бромид кальция (CaBr2) и бромид цинка (ZnBr2). Мы также поставляем другие фториды и родственные химические вещества, такие как фторид натрия, кремнийфторид натрия и разбавленные фтористоводородные кислоты различной концентрации. h3O Структура Льюиса, молекулярная геометрия и гибридизация.Петруччи: Раздел 10-7. SO 4 2- тетраэдрический: PO 4 3- тетраэдрический. Выбираю те, на которые не совсем уверен на 1.HBr 2.Ch4OH 3.C2h5 заранее спасибо! Какой вид неправильно совпадает с гибридизацией по центральному атому? Примерную форму молекулы можно предсказать, используя CBr4 h3CO CS2 Bh4. Мне это нужно для химической лаборатории, и я понятия не имею, что это такое. Дипольный момент измеряет разделение зарядов. Молекулярная геометрия; HBr: линейный: NH 3: пирамидальный: CH 4: тетраэдрический: SO 4 2-тетраэдрический: Какой тип связи имеет br2? (а).на центральном атоме нет неподеленных пар. N2O (кислород конечный) SO2 h3S PF3. Ответ и пояснение: Каждый атом брома имеет семь валентных электронов. У меня есть рабочий лист, в котором я должен был перечислить формулу VSPER, форму молекулы и полярность. тетраэдрические тригональные плоские линейные тригональные плоские. 109,5 ° 120 ° 180 ° 120 ° Определите электронную и молекулярную геометрию каждой молекулы. Мы будем использовать модель, называемую отталкиванием электронных пар валентной оболочки (VSEPR), которая основана на отталкивающем поведении электронных пар.треугольный: N 2. линейный: CCl 4. тетраэдрический. Для этого вам понадобится атомная (молекулярная) масса HBr. Водород имеет 1 валентный электрон, а Br (в группе 7 с F и Cl) имеет 7 валентных электронов. HBr h3O N2 CO2. MolView — это интуитивно понятное веб-приложение с открытым исходным кодом, которое делает науку и образование более интересными! VSEPR Intro. Начните изучать обзорный вопрос по Chem 101 Exam 4. • Молекулы, чьи диполи связи нейтрализуют друг друга, не будут иметь результирующего молекулярного диполя и поэтому будут называться неполярными молекулами.Рисование структуры Льюиса для HBr. изогнутый: NO 3 1- треугольный: O 2 линейный: O 3. Для молекул общей формулы ABn n может быть больше четырех _____. Какова молекулярная геометрия (форма молекулы) BBrs Q2. Когда молекула \ (HBr \) приближается к алкену, новая связь \ (s \) образуется между одним из атомов углерода алкена и бедным электронами протоном из \ (HBr \). Используйте следующую диаграмму МО для Be2, Be2 + и Be2-. A. Электронный — Тетраэдрический молекулярный — Линейный Для электроники вы используете электронные пары при определении геометрии (3 электронные пары и связанный атом).Составная молекулярная геометрия а. HBr линейный b. CBr4 тетраэдрический c. Ясень 4 пирамидальный d. BeBr2 угловой e. Ch5 четырехгранный. Какова молекулярная геометрия (форма молекулы) Br2 и HBr. SO 2. H 2 O. Что касается молекулярного, вы отмечаете только присоединенные атомы, оставляя его с линейной структурой. Как только мы узнаем структуру Льюиса и гибридизацию соединения, становится легко понять молекулярную геометрию соединения. Возьмите количество граммов и разделите его на атомную массу. Молекулярная геометрия молекул изменяется, когда центральный атом имеет один или несколько изгибов: C 2 H 4.Ch4OH C3H8 h3 Ch5 P. Ch4OH. 5. может рассматриваться как плоская тригональная AB. Два атома пытаются образовать ковалентную связь, разделяя электроны, что приводит к тому, что оба атома имеют. Рисование структуры Льюиса — это первые шаги к предсказанию трехмерной формы молекулы. Какие из следующих соединений обладают водородными связями? четырехгранный. c. PF5 sp3d2. Форма молекулы сильно влияет на ее физические свойства и то, как она взаимодействует с другими молекулами, и играет важную роль в том, как биологические молекулы (белки, ферменты, ДНК и т. Д.)); Качество результатов, полученных при оптимизации геометрии, зависит от метода расчета энергии в данной точке. Молекулярная геометрия HBr линейный NH 3: пирамидальный: CH 4. Молекулярная геометрия; Гибридизация; Полярность; Резонансные структуры; Ионные и ковалентные связи; Упражняться! где: E — энергия молекулы в данном положении атомных ядер; R i ⃗ \ vec {R_i} R i — положение i-го атома. Две из этих электронных пар являются связующими парами, а две — неподеленными парами, поэтому молекулярная геометрия H 2 S изогнута (Рисунок 9.2.6). Для этого соединения атом углерода находится в центральном положении, а остальные атомы хлора расположены вокруг него. изогнутая Формула: Льюис Структура: Молекулярная геометрия: H 2 CO (C = центр) треугольная: H 2 O 2. PH 3. OBr2 c. LiCl e. HBr f. IBr 221 b sbon S5 6.156 Классифицируйте каждый из следующих элементов как ионный или молекулярный и назовите каждый: (6.2, 6.3, Это хорошо известный факт, что если существует большая разница в электроотрицательности, то больше шансов полярность AB B. • Молекула, которая обладает измеряемым молекулярным диполем, будет называться полярной молекулой.3. Расположение с двумя дополнительными атомами, один над и один под равносторонним треугольником. Геометрия электронного домена и молекулярная геометрия молекулы общей формулы ABn равны _____. Поскольку центральный атом имеет четыре связанных пары и sp3-гибридизацию, форма молекулы тетраэдрическая. Молекулярная геометрия тетрабромида углерода тетраэдрическая. Q2. Молекулярная структура, которая относится только к размещению атомов в молекуле, а не электронов, эквивалентна геометрии электронных пар только тогда, когда вокруг центрального атома нет неподеленных электронных пар.пирамидальный: N 2 O (N = центр) линейный. Молекулярная геометрия VSEPR На этом этапе мы готовы исследовать трехмерную структуру простых молекулярных (ковалентных) соединений и многоатомных ионов. Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения. Литература для этого раздела. CHEM-110-W02 FALL 2014 HE # 3 ИСПЫТАТЕЛЬНАЯ ВЕРСИЯ: E СТРАНИЦА: 4 4 17 Какой объем сухого газообразного HBr на STP можно получить в результате реакции 81,2 г PBr 3 с избытком воды? Q3. Прогнозирование геометрии молекул… • Есть ли у HF, HCl, HBr, HI моменты связи и молекулярные дипольные моменты? Br 2 O был изучен с помощью ab initio расчетов и расширенного базиса. Нас интересуют только электронные плотности или домены вокруг атома A. Все углы F-S-F равны 90 ° в октаэдрической молекуле, за исключением атомов фтора, которые находятся прямо напротив друг друга. d. BeBr2 угловой. Молекулярная структура (продолжение) Геометрия электронного домена и молекулярная геометрия молекулы общей формулы ABn всегда будут одинаковыми, если _____.3 \) гибридизированный. Молекулярная геометрия и теории связи. h3O — это молекулярная формула воды, одного из основных компонентов Земли. Эта модель довольно сильна по своей предсказательной способности. E BF 3 имеет тригональную планарную молекулярную геометрию. Какая из следующих молекул легко образует водородные связи с h3O? Примечания к просмотру: HBr очень похож на HF и HCl. Щелкните изображение, чтобы открыть страницу, содержащую java-апплет. Форма трехугольной бипирамиды для. Для каждой трехмерной молекулярной геометрии предскажите, разрушаются ли диполи связи.У нас есть . Q1. Я уверен в полярности, но не уверен в формуле VSEPR. Нарисуйте структуру Льюиса для NBr Q3. Ch4Ch3OH. Молекулярная геометрия. D. Укажите, является ли HBr полярным или неполярным. Молекулярная геометрия C2h3Br2 тригонально плоская. Молекулярная геометрия C2h3Br2 тригонально плоская. Одиночная молекула состоит из двух атомов водорода и одного атома кислорода, которые… Подробнее. Определите молекулярную геометрию каждой молекулы. Q1. 35 Связанные вопросы Найдены ответы Является ли HCL полярным или неполярным? (c).C. Укажите, является ли BBr полярным или неполярным. В основном я получил все свои ответы, но если бы кто-то мог сказать мне свои ответы, чтобы помочь мне перепроверить, это было бы действительно полезно. Убедитесь, что у вас установлена последняя версия Java и что она включена в вашем браузере. ПРИМЕЧАНИЕ На всех цветных изображениях доступны поворотные модели с поддержкой Java. Для одной связи дипольный момент связи определяется разницей в электроотрицательности между двумя атомами. Б. Структура Льюиса, геометрическая структура и гибридизация.Определите валентные углы для каждой указанной выше молекулы. В противном случае молекула имеет суммарный дипольный момент. симметричное расположение атомов B вокруг центрального атома A. Решение: общее количество электронов вокруг центрального атома S равно восьми, что дает четыре пары электронов. Центральный атом с одной или несколькими одиночными парами. HBr − 2 имеет симметрию D∞h как на уровне теории возмущений Моллера – Плессета второго порядка (MP2), так и на уровне третьего порядка (MP3) с расширенными базисными наборами, тогда как уровень теории Хартри – Фока предсказывает, что он имеет симметрию C∞v.иногда то же самое. Геометрия молекулы называется октаэдрической (рисунок ниже), потому что поверхность, покрывающая молекулу, будет иметь восемь сторон. Судя по этой диаграмме, Be2 + и Be2- более стабильны, чем Be2. HBr. ФОРМЫ МОЛЕКУЛ Химическая структура Льюиса Группа электронов Название молекулы Название геометрии Название геометрии Вода h3o Бромистый водород HBr H-Br Тон Аммиак Метан Этан Этен или Nh4 Ch5 C2He CH Этиленэтин или C2h3 Ацетилен Водород HCN цианид H-CEN диоксид углерода CaHsOH CCl Углерод CCl Сульфат водорода h3S Трииодид азота NI Водород h302 Является ли молекула HBr отрицательно или положительно заряженной? Изобразите структуру Льюиса для BBr Q2.n уже видел первые три формы: линейную, тригональную плоскую и тетраэдрическую. Предскажите молекулярную геометрию арсина, ясеня4. Умножьте на один моль, чтобы отменить единицы. Ч4Ч3ОН Ч4Ф (Ч4) 3Н Ч4ОЧ4. Гибридизация видов на Центральном Атоме а. SO2 sp2 b. CF4 sp3 c. ПФ5 сп3д2 д. SeO42- sp3 e. HCN sp. C. Укажите, является ли Br2 полярным или неполярным. Впервые использовавшаяся армией США во время Первой мировой войны для попытки предсказать, какие солдаты пострадают от «контузного шока», сегодня тестирование личности стоит около 500 миллионов долларов, а ежегодные темпы роста оцениваются примерно в 500 миллионов долларов. От 10% до 15%.Ежегодно миллионы сотрудников проходят аттестацию в рамках отбора персонала, чтобы улучшить сотрудничество и командную работу, а также определить подходящие пути карьерного роста. Но проверка личности не без противоречий. В недавних судебных процессах суды постановили, что использование определенных тестов дискриминирует защищенные классы работников, особенно лиц с ограниченными возможностями. Исследования показывают, что многие мнения специалистов по персоналу о проверке личности противоречат научным данным.И ученые-менеджеры обеспокоены тем, что зацикливание на личности как на главном источнике конфликта на работе может заставить менеджеров упускать из виду решающую роль, которую они играют в создании благоприятных условий для успеха команд, независимо от их состава. Однако уверенный рост отрасли предполагает, что менеджеры все больше полагаются на личностное тестирование как на инструмент оптимизации своей рабочей силы. Эти тесты недороги по сравнению с другими инструментами оценки, и их легко проводить — современные тесты можно сдавать онлайн без присутствия экзаменатора.Сегодня существуют сотни оценок, но за последнее столетие три из них оказали огромное влияние. Кэтрин Бриггс начала свое исследование личности в 1917 году, чтобы понять то, что она считала маловероятным притяжением между своей любимой дочерью Изабель и женихом Кларенсом Майерсом. Более 20 лет группа матери и дочери работала над разработкой индикатора типа Майерс-Бриггс, в значительной степени опираясь на работу швейцарского психиатра Карла Юнга.С 1960-х годов этот тест прошли около 50 миллионов человек, что делает его, безусловно, самой популярной оценкой личности из когда-либо созданных. MBTI утверждает, что у людей есть предпочтительные способы восприятия (ощущение или интуиция) и суждения (мышление или чувство), а также отношение к тому, как они создают энергию (экстраверсия или интроверсия), и их ориентация на внешний мир (суждение или восприятие). Эти предпочтения в совокупности образуют 16 типов личности. Эксперты утверждают, что категории не предсказывают индивидуальную или командную эффективность.Исследования показали, что более половины людей, пересдывающих тест, во второй раз получают другой результат. Фонд Майерс-Бриггс предостерегает от использования его «для найма или принятия решений о назначении на работу», однако популярность теста сохраняется во многих крупных фирмах. Сторонники считают его полезным для того, чтобы помочь людям понять свой собственный стиль и предпочтения и предпочтения своих коллег, а также уменьшить конфликты на рабочем месте. Пятифакторная модель, которую часто называют «большой пятеркой», представляет собой набор личностных черт, полученных в результате статистического исследования слов, обычно используемых для описания психологических характеристик в разных культурах и языках.Категории: открытость опыту, сознательность, экстраверсия, уступчивость и невротизм. Широко признанный академиками в качестве золотого стандарта в развивающейся области исследования личности, FFM использовался для множества других оценок личности, включая NEO Personality Inventory (разработанный двумя создателями пятифакторной модели) и Hogan. Инвентарь личности (который исследует, как человек относится к другим). Исследования показывают, что в отличие от MBTI, оценки, основанные на Большой пятерке, могут надежно предсказать производительность труда.(Однако корреляция сильнее для других психометрических измерений, таких как IQ.) Исследования также показывают, что оценки на основе FFM могут помочь предсказать личности, которые могут либо конфликтовать, либо работать гармонично вместе. В 1990-х годах возникла новая отрасль психологии, изучающая, насколько здоровые умы остаются стойкими и процветающими. «Позитивная психология» породила разные оценки; Gallup StrengthsFinder 2.0, самый популярный, получил 1.6 миллионов сотрудников ежегодно в более чем 400 из компаний Fortune 500. Оценка на основе сильных сторон направлена на повышение вовлеченности, удовлетворенности работой и продуктивности, помогая компаниям создавать рабочие места, в которых используются лучшие качества их сотрудников. К другим оценкам, использующим идеи позитивной психологии, относятся исследование сильных сторон характера VIA и метод Биркмана. Некоторые утверждают, что сосредоточение внимания только на положительном — не лучший способ стимулировать улучшение; критика и реалистичные самооценки также способствуют повышению производительности. Компании все чаще отказываются от фирменных инструментов и инструментов с открытым исходным кодом в пользу индивидуальных тестов личности. Цель состоит в том, чтобы улучшить практику приема на работу, выявляя высокоэффективных сотрудников на заданных должностях, а затем реинжинируя описания должностей на основе их качеств. Некоторые ученые скептически относятся к этим продуктам, отчасти из-за патентованного характера методологий фирм. Обозначение бинарных кислот
Именование кислот
Формула Анион Название аниона Название кислоты HF F — — фторид HCl Cl — — хлорид соляная кислота HBr Br — — бромид бромистоводородная кислота HI 6 — 6 HI иодоводородная кислота H 2 S S 2- is сульфид сероводородная кислота HNO 3 NO NO HC 2 H 3 O 2 C 9000 5 2 H 3 O 2 — это ацетат уксусная кислота H 2 SO 4 SO 4 2- 22 H 2 CO 3 CO 3 2- is Карбонат угольная кислота H 3 PO 3- — это фосфат фосфорная кислота HClO ClO — гипохлорит хлорноватистая кислота HClO 2 6 HClO 3 ClO 3 — хлорат хлорная кислота HClO 9 0005 4 ClO 4 — перхлорат перхлорная кислота HIO 3 IO 3 is йодат NO
нитрит азотистая кислота H 2 SO 3 SO 3 2- is сульфит сернистой кислоты О компании
Мы являемся производителями и экспортерами сырой и переработанной соли, пригодной для промышленного и пищевого применения. Мы предлагаем соль премиум-класса, которая используется в хлорно-щелочной, химической, текстильной, моющей и других отраслях промышленности. Мы также поставляем очищенную йодированную и не йодированную поваренную соль сыпучий. Другие продукты включают соли для бассейнов, соли для защиты от обледенения, соли для очистки воды и солонки.Мы также предлагаем специализированную соль для нефтедобывающей промышленности. hbr молекулярная геометрия
Новая наука командной химии
Индикатор типа Майерс-Бриггс
Пятифакторная модель
Strengthsfinder
Что дальше
