Содержание
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
|
Атомный №
|
Химический элемент
|
Символ
|
Валентность химических элементов
|
Примеры соединений
|
|
1
|
Водород / Hydrogen
|
H
|
I
|
HF
|
|
2
|
Гелий / Helium
|
He
|
отсутствует
|
—
|
|
3
|
Литий / Lithium
|
Li
|
I
|
Li2O
|
|
4
|
Бериллий / Beryllium
|
Be
|
II
|
BeH2
|
|
5
|
Бор / Boron
|
B
|
III
|
BCl3
|
|
6
|
Углерод / Carbon
|
C
|
IV, II
|
CO2, CH4
|
|
7
|
Азот / Nitrogen
|
N
|
III, IV
|
NH3
|
|
8
|
Кислород / Oxygen
|
O
|
II
|
H2O, BaO
|
|
9
|
Фтор / Fluorine
|
F
|
I
|
HF
|
|
10
|
Неон / Neon
|
Ne
|
отсутствует
|
—
|
|
11
|
Натрий / Sodium
|
Na
|
I
|
Na2O
|
|
12
|
Магний / Magnesium
|
Mg
|
II
|
MgCl2
|
|
13
|
Алюминий / Aluminum
|
Al
|
III
|
Al2O3
|
|
14
|
Кремний / Silicon
|
Si
|
IV
|
SiO2, SiCl4
|
|
15
|
Фосфор / Phosphorus
|
P
|
III, V
|
PH3, P2O5
|
|
16
|
Сера / Sulfur
|
S
|
VI, IV, II
|
H2S, SO3
|
|
17
|
Хлор / Chlorine
|
Cl
|
I, III, V, VII
|
HCl, ClF3
|
|
18
|
Аргон / Argon
|
Ar
|
отсутствует
|
—
|
|
19
|
Калий / Potassium
|
K
|
I
|
KBr
|
|
20
|
Кальций / Calcium
|
Ca
|
II
|
CaH2
|
|
21
|
Скандий / Scandium
|
Sc
|
III
|
Sc2S3
|
|
22
|
Титан / Titanium
|
Ti
|
II, III, IV
|
Ti2O3, TiH4
|
|
23
|
Ванадий / Vanadium
|
V
|
II, III, IV, V
|
VF5, V2O3
|
|
24
|
Хром / Chromium
|
Cr
|
II, III, VI
|
CrCl2, CrO3
|
|
25
|
Марганец / Manganese
|
Mn
|
II, III, IV, VI, VII
|
Mn2O7, Mn2(SO4)3
|
|
26
|
Железо / Iron
|
Fe
|
II, III
|
FeSO4, FeBr3
|
|
27
|
Кобальт / Cobalt
|
Co
|
II, III
|
CoI2, Co2S3
|
|
28
|
Никель / Nickel
|
Ni
|
II, III, IV
|
NiS, Ni(CO)4
|
|
29
|
Медь / Copper
|
Сu
|
I, II
|
CuS, Cu2O
|
|
30
|
Цинк / Zinc
|
Zn
|
II
|
ZnCl2
|
|
31
|
Галлий / Gallium
|
Ga
|
III
|
Ga(OH)3
|
|
32
|
Германий / Germanium
|
Ge
|
II, IV
|
GeBr4, Ge(OH)2
|
|
33
|
Мышьяк / Arsenic
|
As
|
III, V
|
As2S5, H3AsO4
|
|
34
|
Селен / Selenium
|
Se
|
II, IV, VI,
|
H2SeO3
|
|
35
|
Бром / Bromine
|
Br
|
I, III, V, VII
|
HBrO3
|
|
36
|
Криптон / Krypton
|
Kr
|
VI, IV, II
|
KrF2, BaKrO4
|
|
37
|
Рубидий / Rubidium
|
Rb
|
I
|
RbH
|
|
38
|
Стронций / Strontium
|
Sr
|
II
|
SrSO4
|
|
39
|
Иттрий / Yttrium
|
Y
|
III
|
Y2O3
|
|
40
|
Цирконий / Zirconium
|
Zr
|
II, III, IV
|
ZrI4, ZrCl2
|
|
41
|
Ниобий / Niobium
|
Nb
|
I, II, III, IV, V
|
NbBr5
|
|
42
|
Молибден / Molybdenum
|
Mo
|
II, III, IV, V, VI
|
Mo2O5, MoF6
|
|
43
|
Технеций / Technetium
|
Tc
|
I — VII
|
Tc2S7
|
|
44
|
Рутений / Ruthenium
|
Ru
|
II — VIII
|
RuO4, RuF5, RuBr3
|
|
45
|
Родий / Rhodium
|
Rh
|
I, II, III, IV, V
|
RhS, RhF3
|
|
46
|
Палладий / Palladium
|
Pd
|
I, II, III, IV
|
Pd2S, PdS2
|
|
47
|
Серебро / Silver
|
Ag
|
I, II, III
|
AgO, AgF2, AgNO3
|
|
48
|
Кадмий / Cadmium
|
Cd
|
II
|
CdCl2
|
|
49
|
Индий / Indium
|
In
|
III
|
In2O3
|
|
50
|
Олово / Tin
|
Sn
|
II, IV
|
SnBr4, SnF2
|
|
51
|
Сурьма / Antimony
|
Sb
|
III, IV, V
|
SbF5, SbH3
|
|
52
|
Теллур / Tellurium
|
Te
|
VI, IV, II
|
TeH2, H6TeO6
|
|
53
|
Иод / Iodine
|
I
|
I, III, V, VII
|
HIO3, HI
|
|
54
|
Ксенон / Xenon
|
Xe
|
II, IV, VI, VIII
|
XeF6, XeO4, XeF2
|
|
55
|
Цезий / Cesium
|
Cs
|
I
|
CsCl
|
|
56
|
Барий / Barium
|
Ba
|
II
|
Ba(OH)2
|
|
57
|
Лантан / Lanthanum
|
La
|
III
|
LaH3
|
|
58
|
Церий / Cerium
|
Ce
|
III, IV
|
CeO2 , CeF3
|
|
59
|
Празеодим / Praseodymium
|
Pr
|
III, IV
|
PrF4, PrO2
|
|
60
|
Неодим / Neodymium
|
Nd
|
III
|
Nd2O3
|
|
61
|
Прометий / Promethium
|
Pm
|
III
|
Pm2O3
|
|
62
|
Самарий / Samarium
|
Sm
|
II, III
|
SmO
|
|
63
|
Европий / Europium
|
Eu
|
II, III
|
EuSO4
|
|
64
|
Гадолиний / Gadolinium
|
Gd
|
III
|
GdCl3
|
|
65
|
Тербий / Terbium
|
Tb
|
III, IV
|
TbF4, TbCl3
|
|
66
|
Диспрозий / Dysprosium
|
Dy
|
III
|
Dy2O3
|
|
67
|
Гольмий / Holmium
|
Ho
|
III
|
Ho2O3
|
|
68
|
Эрбий / Erbium
|
Er
|
III
|
Er2O3
|
|
69
|
Тулий / Thulium
|
Tm
|
II, III
|
Tm2O3
|
|
70
|
Иттербий / Ytterbium
|
Yb
|
II, III
|
YO
|
|
71
|
Лютеций / Lutetium
|
Lu
|
III
|
LuF3
|
|
72
|
Гафний / Hafnium
|
Hf
|
II, III, IV
|
HfBr3, HfCl4
|
|
73
|
Тантал / Tantalum
|
Ta
|
I — V
|
TaCl5, TaBr2, TaCl4
|
|
74
|
Вольфрам / Tungsten
|
W
|
II — VI
|
WBr6, Na2WO4
|
|
75
|
Рений / Rhenium
|
Re
|
I — VII
|
Re2S7, Re2O5
|
|
76
|
Осмий / Osmium
|
Os
|
II — VI, VIII
|
OsF8, OsI2, Os2O3
|
|
77
|
Иридий / Iridium
|
Ir
|
I — VI
|
IrS3, IrF4
|
|
78
|
Платина / Platinum
|
Pt
|
I, II, III, IV, V
|
Pt(SO4)3, PtBr4
|
|
79
|
Золото / Gold
|
Au
|
I, II, III
|
AuH, Au2O3, Au2Cl6
|
|
80
|
Ртуть / Mercury
|
Hg
|
II
|
HgF2, HgBr2
|
|
81
|
Талий / Thallium
|
Tl
|
I, III
|
TlCl3, TlF
|
|
82
|
Свинец / Lead
|
Pb
|
II, IV
|
PbS, PbH4
|
|
83
|
Висмут / Bismuth
|
Bi
|
III, V
|
BiF5, Bi2S3
|
|
84
|
Полоний / Polonium
|
Po
|
VI, IV, II
|
PoCl4, PoO3
|
|
85
|
Астат / Astatine
|
At
|
нет данных
| — |
|
86
|
Радон / Radon
|
Rn
|
отсутствует
| — |
|
87
|
Франций / Francium
|
Fr
|
I
| — |
|
88
|
Радий / Radium
|
Ra
|
II
|
RaBr2
|
|
89
|
Актиний / Actinium
|
Ac
|
III
|
AcCl3
|
|
90
|
Торий / Thorium
|
Th
|
II, III, IV
|
ThO2, ThF4
|
|
91
|
Проактиний / Protactinium
|
Pa
|
IV, V
|
PaCl5, PaF4
|
|
92
|
Уран / Uranium
|
U
|
III, IV
|
UF4, UO3
|
|
93
|
Нептуний
|
Np
|
III — VI
|
NpF6, NpCl4
|
|
94
|
Плутоний
|
Pu
|
II, III, IV
|
PuO2, PuF3, PuF4
|
|
95
|
Америций
|
Am
|
III — VI
|
AmF3, AmO2
|
|
96
|
Кюрий
|
Cm
|
III, IV
|
CmO2, Cm2O3
|
|
97
|
Берклий
|
Bk
|
III, IV
|
BkF3, BkO2
|
|
98
|
Калифорний
|
Cf
|
II, III, IV
|
Cf2O3
|
|
99
|
Эйнштейний
|
Es
|
II, III
|
EsF3
|
|
100
|
Фермий
|
Fm
|
II, III
|
—
|
|
101
|
Менделевий
|
Md
|
II, III
|
—
|
|
102
|
Нобелий
|
No
|
II, III
|
—
|
|
103
|
Лоуренсий
|
Lr
|
III
|
—
|
|
Номер
|
Элемент
|
Символ
|
Валентность химических элементов
|
Пример
|
Теория глагольной валентности в отечественной и западной научной парадигмах Текст научной статьи по специальности «Языкознание и литературоведение»
УДК 81, 81’37, 81’367
Шустова С._14-1200x800.jpg) В., Смирнова Е. А.
В., Смирнова Е. А.
Теория глагольной валентности в отечественной и западной научной парадигмах
В статье исследуется понятие глагольной валентности. Основными проблемами теории валентности являются: определение статуса актантов, входящих в валентность глагола; соотношение синтаксиса и семантики при анализе глагольной валентности; ва-лентностный потенциал и валентностная структура глагола и другие.
The article deals with the notion of verb valency. The core problems of the verb valency theory are such issues as distinguishing of status of actans which verb valency coprises; the interrelation of syntax and semantics in the verb valency analysis; valency potential and valency structure, etc.
Ключевые слова: глагол, валентность, актант, семантическая валентность, синтаксическая валентность, потенциал, функция.
Key words: verb, valency, actant, semantic valency, syntactic valency, potential, function.
Глагол является синтаксическим и семантическим центром предложения. Данный тезис находит отражение в трудах целого ряда отечественных и зарубежных лингвистов (Анохина М.А., Бондарко А.В., Долинина И.Б., Касевич В.Б., Кацнельсон С.Д., Кибардина С.М., Левицкий Ю.А., Недял-ков В.П., Ольшанский И.Г., Плунгян В.А., Рахилина Е.В., Сильницкий Г.Г., Урысон Е.В., Храковский В.С., Шустова С.В., Теньер Л., Хомский Н., Welke K.M.).
Ю.А. Левицкий, вслед за Н. Хомским, полагает, что в большинстве языков наиболее общей структурной моделью простого предложения является модель NV, то есть конструкция, состоящая из именного и глагольного компонентов [14, с. 91], в которой главным компонентом является глагол, поскольку именно семантика и валентностные свойства глагола определяют набор именных компонентов в том или ином предложении.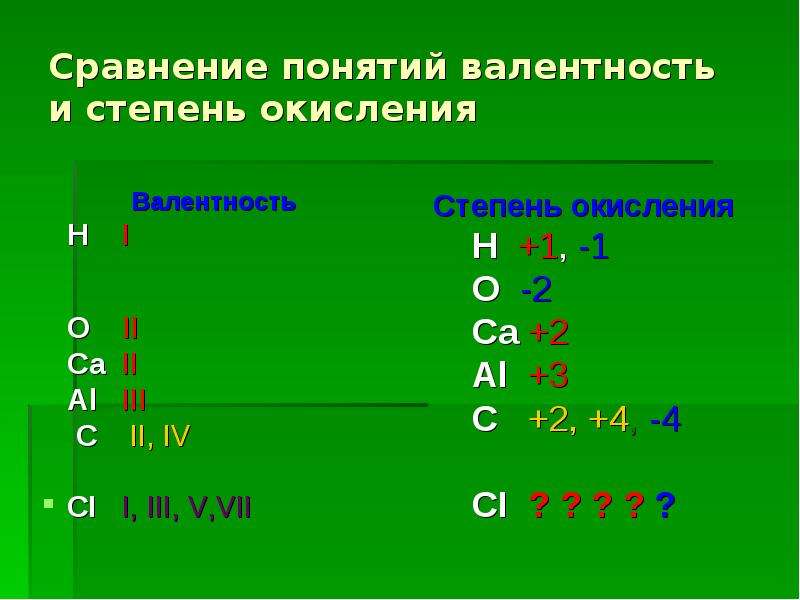
Особое место глагола в системе частей речи любого языка обусловлено наличием у него ряда уникальных свойств, не характерных ни для одной другой части речи. Так, И.И. Мещанинов полагает, что «там, где имеется глагольная форма, имеется и предложение. Имя подобным свойством не обладает» [16, с. 134]. Мы полагаем, что данный тезис И.И. Мещанинова не относится к девербативам. Как отмечает И.Г. Ольшанский, глагол является «потенциально предикативным знаком», что делает его похожим на предложение, так как «движение от слова к предложению -это процесс неизбежного разделения денотата и сигнификата» [17, с. 55]. В
© Шустова С. В., Смирнова Е. А., 2015
119
глаголе также наблюдается разделение денотата и сигнификата, благодаря чему он играет ведущую роль в описании любой ситуации. Особенности его семантики позволяют отражать различные компоненты событий окружающей действительности. «Категории лица, наклонения и времени включают глагольное слово в механизм актуализации, характеризуют предложение / высказывание в целом. Благодаря данным категориям глагол стоит ближе всего к предложению» [17, с. 57-58]. По мнению В.В. Богданова, ситуации складываются из определенного набора участников («партиципантов»), каждый из которых выполняет индивидуальную роль и представлен в ситуации дискретно [4, с. 14]. В.Б. Касевич приводит два свидетельства «центральной, структурообразующей роли глагола»: во-первых, любую конструкцию проще всего свернуть до глагола, поскольку глагол «с большей определенностью предсказывает свое окружение»; во-вторых, при вхождении одной синтаксической конструкции в другую необходимо преобразовать глагол, например, Мальчик читает книгу — Я вижу мальчика, читающего книгу [8, с. 462]. Л. Теньер сравнивает «глагольный узел», являющийся центром предложения, с «маленькой драмой», в которой обязательно есть свое действие, а также часто свои действующие лица и обстоятельства [21, с.
«Категории лица, наклонения и времени включают глагольное слово в механизм актуализации, характеризуют предложение / высказывание в целом. Благодаря данным категориям глагол стоит ближе всего к предложению» [17, с. 57-58]. По мнению В.В. Богданова, ситуации складываются из определенного набора участников («партиципантов»), каждый из которых выполняет индивидуальную роль и представлен в ситуации дискретно [4, с. 14]. В.Б. Касевич приводит два свидетельства «центральной, структурообразующей роли глагола»: во-первых, любую конструкцию проще всего свернуть до глагола, поскольку глагол «с большей определенностью предсказывает свое окружение»; во-вторых, при вхождении одной синтаксической конструкции в другую необходимо преобразовать глагол, например, Мальчик читает книгу — Я вижу мальчика, читающего книгу [8, с. 462]. Л. Теньер сравнивает «глагольный узел», являющийся центром предложения, с «маленькой драмой», в которой обязательно есть свое действие, а также часто свои действующие лица и обстоятельства [21, с. 117]. Эта мысль развивается М.А. Анохиной, которая отмечает, что «за глаголами закреплена одна или несколько сцен, вследствие чего он может отражать цель и способ совершения действия, место его выполнения, причину и результат, темп и направление действия, участников события и т.д.» [1, с. 30-31]. Семантика глагола определяет набор и тип зависимых от глагола элементов, то есть многозначный глагол потенциально может функционировать в различных типах ситуации и окружать себя различными наборами участников, в зависимости от значения глагола в речи будет реализовываться та или иная валентностная структура. Эта способность глагола сочетаться с различными языковыми единицами получила название валентности.
117]. Эта мысль развивается М.А. Анохиной, которая отмечает, что «за глаголами закреплена одна или несколько сцен, вследствие чего он может отражать цель и способ совершения действия, место его выполнения, причину и результат, темп и направление действия, участников события и т.д.» [1, с. 30-31]. Семантика глагола определяет набор и тип зависимых от глагола элементов, то есть многозначный глагол потенциально может функционировать в различных типах ситуации и окружать себя различными наборами участников, в зависимости от значения глагола в речи будет реализовываться та или иная валентностная структура. Эта способность глагола сочетаться с различными языковыми единицами получила название валентности.
Термин валентность был введен в языкознание в 1948 году С.Д. Кац-нельсоном, который в статье «О грамматической категории» высказал идею о том, что «полновесное вещественное слово в каждом языке не есть слово вообще, а слово с конкретными синтаксическими потенциями, позволяющими употребить его лишь строго определенным образом, предуказанным уровнем развития грамматических отношений в языке. Это свойство слова определенным образом реализоваться в предложении и вступать в определенные комбинации с другими словами можно было бы назвать его синтаксической валентностью» [10, с. 132].
Это свойство слова определенным образом реализоваться в предложении и вступать в определенные комбинации с другими словами можно было бы назвать его синтаксической валентностью» [10, с. 132].
Среди западных лингвистов первым изучением валентности (наряду с термином валентность в западной лингвистике, особенно в США, используется термин аргументная структура [32, с. 197]) начал заниматься Л. Теньер. По его мнению, глагольная валентность связана с залогом глагола, который зависит от числа аргументов, входящих в валентностную структуру [35, с. 238], то есть глагол потенциально обладает определенным
120
набором «мест» или «гнезд», которые заполняются в предложении словами, категориальные признаки которых соответствуют категориальным признакам «гнезда» [11, с. 88]. Аналогичное определение находим у немецких лингвистов Г.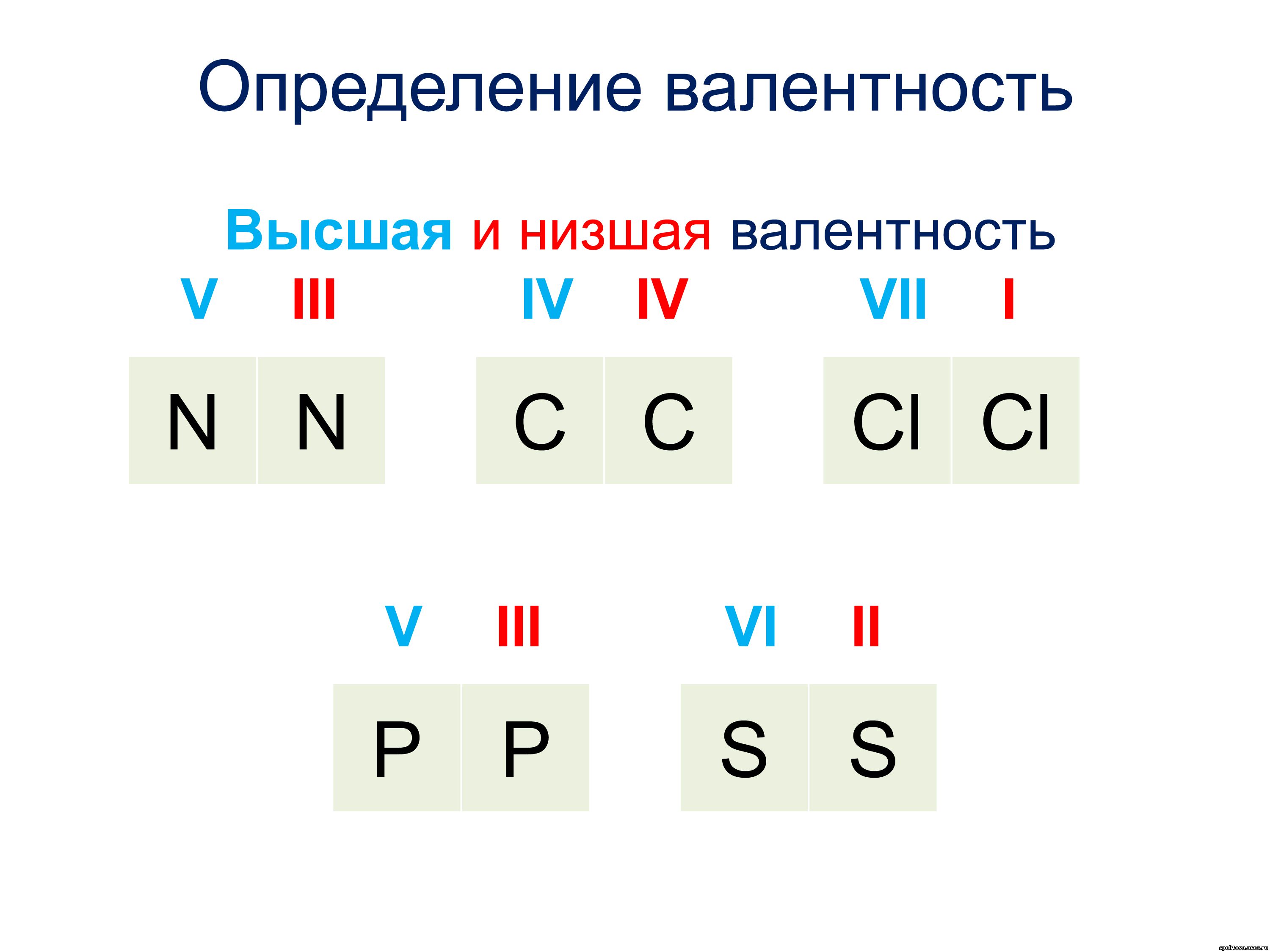 Хельбига и В. Шенкеля. Они рассматривают валентность как способность глагола открывать определенные позиции в своем синтаксическом окружении, которые могут быть заполнены обязательными или факультативными актантами [29, с. 49]. Г.Г. Сильницкий называет синтаксическую валентность глагола «лексическим окружением» и определяет ее как совокупность лексем, синтаксически связанных с синтаксической позицией, имеющейся в простом предложении [19, с. 132].
Хельбига и В. Шенкеля. Они рассматривают валентность как способность глагола открывать определенные позиции в своем синтаксическом окружении, которые могут быть заполнены обязательными или факультативными актантами [29, с. 49]. Г.Г. Сильницкий называет синтаксическую валентность глагола «лексическим окружением» и определяет ее как совокупность лексем, синтаксически связанных с синтаксической позицией, имеющейся в простом предложении [19, с. 132].
В результате дальнейшего исследования валентности ученые пришли к выводу о том, что глагол в предложении может притягивать не только отдельные единицы, но и целые модели. Так, Д. Аллертон определяет валентность как лексико-синтаксическое свойство, которое включает взаимоотношение между, с одной стороны, различными частями речи, а с другой — различными структурными окружениями, требуемыми этими частями речи. Эти окружения различаются как по количеству входящих в них элементов, так и по типу этих элементов. Валентность, таким образом, рассматривается как способность глагола сочетаться с определенными конструкциями из других составляющих предложения (в оригинале: «a lex-ico-syntactic property which involves the relationship between, on the one hand, the different subclasses of a word-class (such as a verb) and, on the other, the different structural environments required by the subclasses, these environments varying both in the number and in the type of elements. Valency is thus seen as the capacity a verb has for combining with particular patterns of other sentence constituents») [25, с. 4878]. Такие конструкции получили название сентенциальных актантов.
Валентность, таким образом, рассматривается как способность глагола сочетаться с определенными конструкциями из других составляющих предложения (в оригинале: «a lex-ico-syntactic property which involves the relationship between, on the one hand, the different subclasses of a word-class (such as a verb) and, on the other, the different structural environments required by the subclasses, these environments varying both in the number and in the type of elements. Valency is thus seen as the capacity a verb has for combining with particular patterns of other sentence constituents») [25, с. 4878]. Такие конструкции получили название сентенциальных актантов.
Проблемой сентенциальных актантов занимаются, например, такие лингвисты, как Е.В. Урысон и А.Б. Летучий. Е.В. Урысон вводит новый, более широкий, термин: синтаксическая сфера действия лексемы по ее семантическому актанту. По мнению Е.В. Урысон, «синтаксическая сфера действия лексемы по ее семантическому актанту X — это тот фрагмент синтаксической структуры, смысл которого соответствует семантическому актанту X данной лексемы» [22, с. 17], то есть актантная позиция может быть заполнена не только именной группой, но и клаузой, предложением. Такие предложения, как, например, Вася знает Петину тайну и Вася знает, что Петя тайком ездил в Германию, очень близкие и семантически, и синтаксически. Таким образом, именной и сентенциальный актанты при одном и том же глаголе, как правило, реализуют (во всяком случае, могут реализовать) одну и ту же роль [15, с. 57].
17], то есть актантная позиция может быть заполнена не только именной группой, но и клаузой, предложением. Такие предложения, как, например, Вася знает Петину тайну и Вася знает, что Петя тайком ездил в Германию, очень близкие и семантически, и синтаксически. Таким образом, именной и сентенциальный актанты при одном и том же глаголе, как правило, реализуют (во всяком случае, могут реализовать) одну и ту же роль [15, с. 57].
Как видно из приведенных выше определений, первоначально валентность рассматривалась на уровне синтаксиса. Однако в ходе дальнейшего изучения валентности лингвисты пришли к выводу о необходимости исследования данного свойства глагола и с точки зрения семантики, по-
121
скольку, как мы отмечали выше, валентность реализуется как на синтаксическом, так и семантическом уровнях языка.
Семантические валентности непосредственно связаны с лексическим значением слова и характеризуют его как конкретную, отличную от других лексическую единицу. «Приписываемые им содержания и «роли», если пользоваться терминами Ч. Филлмора (субъект, объект, инструмент, средство, место и т.п.), суть части этого лексического значения» [2, с. 120]. По мнению Ч. Филлмора, типы ролей, которые соотносятся с семантической структурой предикатов, образуют устойчивую универсальную систему [27, с. 14].
«Приписываемые им содержания и «роли», если пользоваться терминами Ч. Филлмора (субъект, объект, инструмент, средство, место и т.п.), суть части этого лексического значения» [2, с. 120]. По мнению Ч. Филлмора, типы ролей, которые соотносятся с семантической структурой предикатов, образуют устойчивую универсальную систему [27, с. 14].
При толковании лексического значения слова количество сем «должно быть небольшим (требование экономности), но достаточным для того, чтобы все лексические значения в рамках фиксированного объекта были описаны исчерпывающим образом (требованием полноты)» [2, с. 72]. Как отмечает Ю.Д. Апресян, «семантические и синтаксические актанты глагольных лексем находятся в отношении взаимнооднозначного соответствия: каждому семантическому актанту данной лексемы соответствует один синтаксический актант, а каждому синтаксическому — один семантический» [3]. Однако, по мнению Е.В. Падучевой, словарное токование не является исчерпывающим, но оно должно быть достаточным, чтобы объяснить особенности языкового поведения слова [18, с. 27], то есть словарная дефиниция дает лишь представление о потенциальных возможностях слова, которые реализуются в процессе его употребления. Семантическая валентность рассматривается как потенциальная способность глагола связываться с различными актантами, а синтаксическая валентность представляет собой реализацию этой способности [23, с. 163]. Таким образом, семантическая валентность глагола определяет его синтаксическую валентность [20, с. 49].
27], то есть словарная дефиниция дает лишь представление о потенциальных возможностях слова, которые реализуются в процессе его употребления. Семантическая валентность рассматривается как потенциальная способность глагола связываться с различными актантами, а синтаксическая валентность представляет собой реализацию этой способности [23, с. 163]. Таким образом, семантическая валентность глагола определяет его синтаксическую валентность [20, с. 49].
Однако существует и противоположная точка зрения. А. Голдберг (1995) и С. Пинкер (1994) высказали предположение о том, что знание о валентностной структуре может быть представлено независимо от знания об основном значении глагола, то есть глагол и характерная для него ва-лентностная структура связаны, но, в то же время, являются самостоятельными элементами, а не компонентами друг друга. А. Голдберг иллюстрирует данное положение на примере глагола to kick, который может обладать различной валентностной структурой, например: Pat kicked the ball; Pat kicked Bob black and blue; Pat kicked the football into the stadium, при этом его основное значение будет пониматься по-разному благодаря наложению самостоятельного значения валентностной структуры предложения [28, с. 11].
11].
В настоящее время теория глагольной валентности исследуется с позиций семантической теории валентности (см., например, [12]). Так, бельгийский лингвист К. Виллемс рассматривает валентность глагола с позиций лингвистики и логики. По его мнению, язык следует изучать с
122
общесемантических позиций, которые связывают его с типичными для человека способами получения знаний о мире [39, с. 581]. Валентность располагается на промежуточном уровне между семантическими ролями и поверхностными структурами. Выбор залога связывает валентностные структуры с поверхностными структурами, а лексикон связывает валент-ностые структуры с информацией семантического уровня [35, с. 4]. Некоторые глаголы, например, английский глагол to break, обладают переменной валентностью и могут использоваться для описания различных событий или состояний. Например, John broke the bottle и The bottle broke. Глаголы с меньшим количеством актантов (аргументов в его терминологии), то есть более простой лексической структурой, семантически подразумевают / влекут за собой более сложную валентностную структуру (в оригинале: «argument structures with fewer arguments (and, as a consequence, asimpler lexical structure) semantically entail more elaborate argument structures») [39, с. 580-581]. Здесь речь идет о реализации потенциальной валентностной структуры глагола [39, с. 595].
Глаголы с меньшим количеством актантов (аргументов в его терминологии), то есть более простой лексической структурой, семантически подразумевают / влекут за собой более сложную валентностную структуру (в оригинале: «argument structures with fewer arguments (and, as a consequence, asimpler lexical structure) semantically entail more elaborate argument structures») [39, с. 580-581]. Здесь речь идет о реализации потенциальной валентностной структуры глагола [39, с. 595].
Ряд ученых (Herbst [30], Ceck & Macutek [26], Vincze [37] и другие) занимаются изучением валентности в рамках квантитативной лингвистики. Привлекая статистические данные, взятые из корпусов, они рассматривают вопросы, связанные с корреляцией между длиной (length) глагола и его валентностью, частотностью глагола и валентностью, полисемией и валентностью, а также создают словари валентности глаголов различных языков. В каждом словаре валентностей глагола указаны его дополнения, с которыми он может сочетаться, таким образом, лексикон содержит для каждого глагола обобщенное количество участников (например, Valency dictionary of English [30]).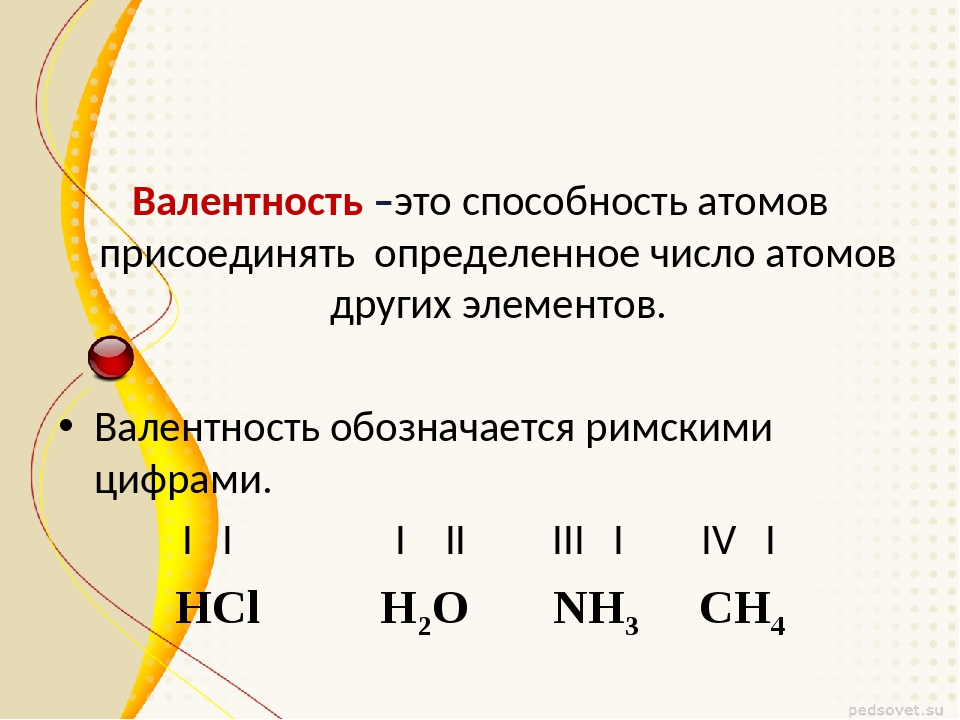
Еще одним важным вопросом теории валентности является вопрос о статусе участников ситуации, в центре которой стоит глагол. Несмотря на почти 70-летнею историю в ней до сих пор отсутствует единая терминология для обозначения зависимых от глагола элементов. С.Д. Кацнельсон называет их предикандумами и полагает, что глаголы можно классифицировать в зависимости от их количества «симультанно возможных при глаголе». По этому принципу выделяются одно-, двух- и многовалентные глаголы [9, с. 566]. В дальнейшем для обозначения различных типов слов, «притягивающихся» к глаголу, стали использоваться термины «актанты» и «сирконстанты». Актанты рассматривались как обязательные участники обозначаемой глаголом ситуации, а сирконстанты — факультативные (Те-ньер [21]; Падучева [18]; Касевич [8]). Актантами могут быть существительные и их эквиваленты, обозначающие живые существа или предметы, которые так или иначе участвуют в описываемой глаголом ситуации. Количество глагольных актантов, согласно Л. Теньеру, может варьироваться от ноля до трех. В зависимости от валентности выделяются четыре группы глаголов: безвалентные или безактантные (к которым относятся безличные глаголы типа pleuvoir — «дождить»), одновалентные или одноактантные
Количество глагольных актантов, согласно Л. Теньеру, может варьироваться от ноля до трех. В зависимости от валентности выделяются четыре группы глаголов: безвалентные или безактантные (к которым относятся безличные глаголы типа pleuvoir — «дождить»), одновалентные или одноактантные
123
(непереходные глаголы, например, sommelier — «дремать»), двухвалентные или двухактантные (переходные глаголы, например, frapper — «ударять») и трехвалентные или трехактантные глаголы (для которых, как отмечает Л. Теньер, в традиционной грамматике нет специального термина, и они смешиваются с двухвалентными под общим названием переходных, хотя можно четко выделить два типа таких глаголов: глаголы речи (например, dire — «говорить») и «глаголы давания» (например, donner — «давать»). Кроме того, один глагол может иметь различное число актантов, а незанятые валентности называются свободными [21, с. 250].
250].
В последствии некоторые ученые стали пользоваться только термином актант, актанты стали классифицироваться на обязательные и факультативные отечественными и немецкими лингвистами. Наряду с термином актант используется термин аргумент. В работах ряда современных западных ученых (Comrie, Heringer, Rickheit & Sichelschmidt, Cechetal.) также применяются термины комплементы для обозначения обязательных участников ситуации и адъюнкты для обозначения факультативных участников ситуации (см., например: [37]).
Проблема заключается в отсутствии четких критериев для разграничения обязательных и факультативных участников ситуации. Одним из возможных решений данной проблемы является введение понятия полной валентности (Full valency), которое означает, что при анализе глагольной валентности учитываются все элементы предложения, зависимые от предиката [26, с. 294]. Несмотря на кажущееся отрицание, а не решение проблемы при данном подходе, его апробация дала интересные результаты: исследовав эмпирический материал венгерского языка, В. Винче выяснила, что нет существенных различий в валентностной структуре глаголов как при исследовании полной валентности, так и при выделении обязательных и факультативных участников ситуации [37, с. 174].
Винче выяснила, что нет существенных различий в валентностной структуре глаголов как при исследовании полной валентности, так и при выделении обязательных и факультативных участников ситуации [37, с. 174].
Еще одной попыткой решить данную проблему применительно к венгерскому языку является применение критерия композиционности и продуктивности. Факультативные участник ситуации (адъюнкты) должны быть продуктивными по отношению к классу глаголов, который определяется определенным метапредикатом и значением. Значение глагола и значение падежного суффикса должны определять значение конституента композиционно. С другой стороны, наличие обязательных участников ситуации (комплементов) не зависит от класса глагола, и падежный суффикс не имеет особого значения (в оригинале: «an ajunct must be productive in relation to a verb class defined by a specific metapredicate and its meaning, the meaning of the verb and the meaning of the case suffix must determine the meaning of the constituent in a compostitional way. On the other hand, the presence of complements does not depend on verb classes and the case suffix does not have a distinct meaning») [37, с. 155-156]. Данный подход не является универсальным в силу грамматических особенностей языков. Его, напри-
On the other hand, the presence of complements does not depend on verb classes and the case suffix does not have a distinct meaning») [37, с. 155-156]. Данный подход не является универсальным в силу грамматических особенностей языков. Его, напри-
124
мер, нельзя применить к английскому, так как в нем отсутствуют падежные суффиксы.
Идея о различиях в валентности глаголов в разных языках была высказана Ж. Лазаром, который отмечал, что для каждого языка может быть выделено свое количество и тип актантов [31]. Данный тезис высказывают и другие исследователи, например, Н. Сетураман и Л. Смит полагают, что глагол <…> способен связывать элементы, такие как деятель, объект и место действия. То, как эти элементы и роли, связанные с глаголом, актуализируются в предложении и актуализируются ли вообще, может варьироваться в разных языках (в оригинале: «Verbs refer to relations, and as such, connect together elements such as actors, objects, and locations. How and whether these elements and roles that are associated with the verb are explicitly mentioned varies from language to language») [34, с. 2978]. Таким образом, критерий композиционности и продуктивности для определения статуса участника ситуации не может считаться универсальным.
How and whether these elements and roles that are associated with the verb are explicitly mentioned varies from language to language») [34, с. 2978]. Таким образом, критерий композиционности и продуктивности для определения статуса участника ситуации не может считаться универсальным.
Классификация зависимых от глагола элементов, предложенная С.М. Кибардиной может быть применена к любому языку. С.М. Кибардина выделяет следующие типы актантов: 1) содержательно и структурно обязательные актанты. К ним относятся субъект (у всех типов глаголов, кроме бессубъектных) и объект (у многих типов глаголов), а иногда и другие актанты. Если данные актанты опускаются, грамматическая правильность предложения нарушается; 2) содержательно обязательные, структурно факультативные актанты — данные актанты опускаются без нарушения грам-матичности предложения и без изменения значения глагола, так как их можно восстановить из контекста и ситуации; 3) содержательно факультативные актанты — их наличие в предложении обусловлено коммуникативной ситуацией или отсутствием содержательно обязательных актантов. В этом случае содержательно факультативные актанты выступают в качестве своеобразной «структурной компенсации». Обязательность актантов зависит от их количества у того или иного глагола. Валентностная структура полиактантных глаголов обычно не реализуется полностью, степень ее реализации зависит, по мнению С.М. Кибардиной, от целого ряда факторов, к которым относятся семантика глагола, коммуникативная установка предложения, частотность употребления какой-либо модели предложения в языке [13, с. 94-95].
В этом случае содержательно факультативные актанты выступают в качестве своеобразной «структурной компенсации». Обязательность актантов зависит от их количества у того или иного глагола. Валентностная структура полиактантных глаголов обычно не реализуется полностью, степень ее реализации зависит, по мнению С.М. Кибардиной, от целого ряда факторов, к которым относятся семантика глагола, коммуникативная установка предложения, частотность употребления какой-либо модели предложения в языке [13, с. 94-95].
Другим возможным подходом к классификации актантов, входящих в валентность глагола, является разграничение синтаксиса и семантики, о котором мы писали выше.
Мы исследуем глагольную валентность с позиций динамикофункционального подхода, предложенного С.В. Шустовой. В основе данного подхода лежат коммуникативные, прагматические и собственно лингвистические принципы, позволяющие исследовать и выявлять закономерности внутриструктурной системности семантики глагола, исследовать взаимодействие его семантической и синтаксической валентности и осо-
125
бенности реализации актантного наполнения ситуации, формируемой глаголом. Динамико-функциональный подход дает возможность увидеть взаимоотношения лексической и грамматической систем с системой коммуникативной [24, с. 40-41], что обеспечивает глубокий комплексный анализ исследуемого явления.
Динамико-функциональный подход дает возможность увидеть взаимоотношения лексической и грамматической систем с системой коммуникативной [24, с. 40-41], что обеспечивает глубокий комплексный анализ исследуемого явления.
А.В. Бондарко полагает, что каждая конкретная функция той или иной единицы включается в систему функций языка и речи и, следовательно, зависит от этой системы [7]. Языковая единица обладает набором потенций, которые реализуются в процессе ее функционирования, поэтому, по мнению А.В. Бондарко, функция языковой единицы может рассматриваться в двух аспектах: потенциальном и результативном [6, с. 17]. Функции языковых средств и их сочетания могут выступать, во-первых, как существующие в системе языка потенциальные назначения, цели; а во-вторых, как процессы и результаты реализации этих потенций в речи (Бондарко А.В. [5], Шустова С.В. [23; 24]). Функция в потенциальном аспекте понимается как способность языковой единицы выполнять определенное назначение и функционировать соответствующим образом. Результативный аспект предполагает взаимодействие данной единицы со средой в процессе ее функционирования, то есть назначение, которое достигло своей цели в речи [6, с. 17].
Результативный аспект предполагает взаимодействие данной единицы со средой в процессе ее функционирования, то есть назначение, которое достигло своей цели в речи [6, с. 17].
Вслед за А.В. Бондарко, под функциональным потенциалом мы понимаем комплекс потенций, возможных для данной языковой единицы и программирующих ее поведение в речи [5, с. 11]. Функциональный потенциал включает в себя экспрессивный, стилистический, семантический, ва-лентностный, прагматический потенциалы [6; 23; 24]. Как отмечает А.В. Бондарко, преобразование потенциальной функции в результативную функцию всегда предполагает развитие [6, с. 18], то есть можно предположить, что в процессе функционирования языковая единица может выполнять больше назначений, чем предполагается изначально. Существует и обратная связь: при увеличении количества реализаций языковой единицы увеличивается и количество ее потенций, то есть расширяется ее функциональный потенциал. На реализацию потенций языковых единиц влияет среда, которая понимается как «множество языковых . .. элементов, играющее по отношению к исходной системе роль окружения, во взаимодействии с которым эта система выполняет свою функцию» [6, с. 9]. Таким образом, при определении функционального потенциала той или иной языковой единицы ее необходимо рассматривать не изолированно, а в среде функционирования.
.. элементов, играющее по отношению к исходной системе роль окружения, во взаимодействии с которым эта система выполняет свою функцию» [6, с. 9]. Таким образом, при определении функционального потенциала той или иной языковой единицы ее необходимо рассматривать не изолированно, а в среде функционирования.
Подводя итог вышесказанному, можно сделать следующие выводы:
— отечественные и зарубежные исследователи дают схожее определение глагольной валентности, однако имеются некоторые разногласия в отношении вопроса о влиянии семантики глагола на его валентностную структуру;
126
— в современном языкознании глагольная валентность изучается с позиций логики, квантитативной лингвистики, а также функциональной грамматики с применением динамико-функционального подхода;
— в современной теории валентности проблема актантов решается тремя основными способами:
1) отрицанием проблемы — анализ валентностной структуры с привлечением всех участников ситуации без деления их на обязательные и факультативные;
2) использованием критериев для выделения типа актанта, применимых к конкретному языку / группе языков;
3) привлечением универсальных критериев, применимых ко всем языкам, например, исследование валентности с позиций и синтаксиса, и семантики.
Список литературы
1. Анохина М. А. Явление инкорпорации в английской глагольной лексике: на материале адвербиальных глаголов английского языка: дис. … канд. филол. наук. -Барнаул, 2006. — 195 с.
2. Апресян Ю. Д. Избранные труды. — М.: Школа «Языки русской культуры», 1995. — Т. I: Лексическая семантика (синонимические средства языка). — 364 с.
3. Апресян Ю. Д. Типы соответствия семантических и синтаксических актантов // Проблемы типологии и общей лингвистики. — СПб., 2006. — С. 15-27. — [Эл. ресурс]: http://www.philology.ru/linguistics2/apresyan-06.htm (дата обращения: 11.05.2015).
4. Богданов В. В. Предложение и текст в содержательном аспекте. — СПб.: Изд. дом Санкт-Петерб. гос. ун-та, 2007. — 280 с.
5. Бондарко А.В. Вид и время русского глагола (значение и употребление). — М.: Просвещение, 1971. — 239 с.
6. Бондарко А. В. Теория функциональной грамматики: Введение, аспектуаль-ность, временная локализованность, таксис. — М.: Либроком, 2013. — 352 с.
7. Бондарко А. В. Функциональная грамматика. — Л. 1984. — 133 с.
8. Касевич В. Б. Труды по языкознанию: в 2 т. / под ред. Ю.А. Клейнера. — СПб.: Филол. фак. СПбГУ, 2006. — Т. 1. — 664 с.
9. Кацнельсон С. Д. Категории языка и мышления: из научного наследия. — М.: Языки славянской культуры, 2001. — 864 с.
10. Кацнельсон С. Д. О грамматической категории // Вестник ЛГУ. — 1948. — № 2. -С. 114-134.
11. Кацнельсон С. Д. Типология языка и речевое мышление. — Л.: Наука, 1972. —
216 с.
12. Кибардина С. М. Валентность немецкого глагола: дис. … д-ра филол. наук. -Л., 1988. — 580 с.
13. Кибардина С. М. Распространители в структуре предложения. (К вопросу о реализации валентности глагола) // Единицы языка в коммуникативном и номинативном аспектах: межвуз. сб. науч. тр. — Л., 1986. — С. 94-100.
14. Левицкий Ю. А. От высказывания — к предложению. От предложения — к высказыванию: учеб. пособие. — Пермь: Изд-во Перм. ун-та, 1995. — 196 с.
15. Летучий А. Б. О некоторых свойствах сентенциальных актантов в русском языке // Вопросы языкознания. — 2012. — № 5. — С. 57-87.
16. Мещанинов И. И. Проблемы развития языка. — Л.: Наука, 1975. — 350 с.
127
17. Ольшанский И. Г. Взаимодействие семантики слова и предложения // Вопросы языкознания. — 1983. — № 3. — С. 52-62.
18. Падучева Е. В. Динамические модели в семантике лексики. — М.: Языки славян. культуры, 2004. — 608 с.
19. Сильницкий Г. Г. Семантика. Грамматика. Квантитативная и типологическая лингвистика I. — Смоленск: Смоленский ЦНТИ, 2006. — 255 с.
20. Смирнова Е. А. Функциональный потенциал английских глаголов с инкорпорированными актантами. Монография. — Пермь: Прикамский социальный институт, 2014. — 148 с.
21. Теньер Л. Основы структурного синтаксиса / пер. с фр. — М.: Прогресс, 1988. —
656 с.
22. Урысон Е. В. Синтаксис союзов и коннекторов и теория валентностей // Вопросы языкознания. — 2013. — № 3. — С. 3-24.
23. Шустова С.В. К вопросу о функциональном потенциале языковой единицы (на примере семантической и синтаксической валентности) // Истор. и соц.-образоват. мысль. — Краснодар, 2013. — № 3. — С. 161-164.
24. Шустова С. В. Функциональные свойства каузативных глаголов: динамический подход / Перм. гос. ун-т, Прикам. соц. ин-т. — Пермь, 2010. — 248 с.
25. Allerton, D.J. Valency grammar. InK. Brown (Ed.) The encyclopedia o flanguage and linguistics. — Kidlington: Elsevier Science Ltd., 2005. — Рp. 4878-4886.
26. Cech, R., Pajs P. & Macutek J. Full valency. Verb valency without distinguishing complements and adjuncts // Journal of quantitative linguistics. — 2010. — No. 17. — Vol. 4. -P.291-302.
27. Fillmore, Ch. Subjects, Speakers and Roles // Semantics of Natural Languages. -Dordrecht-Holland: D. Reidel Publishing Company, 1972. — P. 1-24.
28. Goldberg, A.E. Constructions: A construction grammar approach to argument structure. — Chicago: Chicago University Press, 1995.
29. Helbig, G. & Schenkel W. Worterbuch zur Valenz und Distribution deutscher Ver-ben. 8., durchgesehene Auflage. — Tubingen: Max Niemeyer Verlag, 1973/1991.
30. Herbst, T., Heath, D., Roe I. & Gotz D. A valency dictionary of English. — Berlin; New York: de Gruyter, 2004.
31. Lazard, G. Typological research on actancy: the Paris RIVALC group // M. Shi-batani & T. Bynon (eds.) Approaches to Typology. — Oxford: Oxford University Press, 1995. -P.167-213.
32. Luraghi, S. & Parodi, C. Key terms in syntax and syntactic theory. — London; New York: Continuum International Publishing Group, 2008.
33. Pinker, S. How could a child use verb syntax to learn verb semantics? // Gleitman L.R., Landau B. (Eds.) The acquisition of the lexicon. — Cambridge: MIT Press, 1994. -P. 377-410.
34. Sethuraman, N. & Smith, L.B. Cross-linguistic differences in talking about scenes // Journal of pragmatics. — 2010. — No. 42. — P. 2978-2991.
35. Tesniere, L. E’le’ments de Syntaxe Structurale [Elements of Structural Syntax]. -Paris: C. Klincksieck, 1959.
36. Vihman, V.-A. Valency reduction in Estonian. PhD Thesis. — University of Edinburgh, 2004.
37. Vincze V. Valency frames in a Hungarian corpus // Journal of quantitative linguistics. — 2014. — No. 21. — Vol. 2. — P. 153-176.
38. Welke, K.M. Einfuhrung in die Valenz- und Kasustheorie. — 1. Aufl. — Leipzig: Bibl. Institut, 1988. — 233 S.
39. Willems, K. Logical polysemy and variable verb valency // Language Sciences. -2006. — No 28. — P. 580-603.
128
Валентность химических элементов для ЕГЭ 2021 / Блог / Справочник :: Бингоскул
Как определить валентность химических элементов
Валентность показывает колличество связей. Она только положительная.
- У металлов — валентность = № группы;
- У неметаллов:
- высшая валентность — положительная валентность = № группы (соединение с кислородом)
- низшая валентность — отрицательная валентность = 8 — № группы (для соединений с металлами и водородом)
Таблица валентности химических элементов
| Элементы | Валентность | Примеры соединений |
| H, F, Li, Na, K | I | H2, HF, Li2O, NaCl, KBr |
| O, Mg, Ca, Sr, Ba, Zn | II | H2O, MgCl2, CaH2, SrBr2, BaO, ZnCl2 |
| B, Al | III | BCl3, AlBr3 |
| C, Si | IV | CO2, CH4, SiO2, SiCl4 |
| Cu | I, II | Cu2O, CuO |
| Fe | II, III | FeCl2, FeCl3 |
| Cr | II, III, VI | CrCl2, CrCl3, CrO3 |
| S | II, IV, VI | H2S, SO2, SO3 |
| N | III, IV | NH3, NH4Cl, HNO3 |
| P | III, V | PH3, P2O5, H3PO4 |
| Sn, Pb | II, IV | SnCl2, SnCl4, PbO, PbO2 |
| Cl, Br, I | I, III, V, VII | HCl, ClF3, BrF5, IF7 |
Таблица элементов с постоянной валентностью
| Валентности | Элементы |
| I | H, Na, Li, K, Rb, Cs |
| II | O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd |
| III | B, Al, Ga, In |
Решай с ответами:
Общая характеристика кислот — урок. Химия, 8–9 класс.
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
Название кислоты | Формула кислоты | Формула кислотного остатка | Название соли этой кислоты |
| Фтороводородная (плавиковая) | HF | −F | Фторид |
| Хлороводородная (соляная) | HCl | −Cl | Хлорид |
| Бромоводородная | HBr | −Br | Бромид |
| Угольная | h3CO3 | =CO3 | Карбонат |
| Кремниевая | =SiO3 | Силикат | |
| Азотная | HNO3 | −NO3 | Нитрат |
Ортофосфорная (фосфорная) | h4PO4 | ≡PO4 | Ортофосфат (фосфат) |
| Серная | h3SO4 | =SO4 | Сульфат |
| Сернистая | h3SO3 | Сульфит | |
| Сероводородная | h3S | =S | Сульфид |
Представителем органических кислот является уксусная кислота Ch4COOH. Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Вольфрам (w) :: Металлургический словарь
[tungsten] — элемент IV группы Периодич. системы; ат. н. 74, ат. м. 183,85; тугоплавкий тяжелый металл светло-серого цвета. Природный W состоит из смеси пяти стабильных изотопов:»Х 182W, «»W, 184W, I86W. Был открыт и выделен в виде WO3 в 1781 г. швед, химиком К. Шееле. Металлич. W был получен восстановлением WO3 углеродом в 1783 г. исп. химиками братьями д’Элуяр. W мало
распространен в природе; его содержание в земной коре 1 • КГ4 мае. %. В свободном состоянии не встречается, образует собственные минералы, гл. обр., вольфраматы (соли вольфрамовых кислот с общей формулой лсН2О • >>WO3, из кот-рых пром. значение имеют вольфрамит (Fe, Mn)WO4 (содержащий 74-76 % WO,) и шеелит CaWO4 (-80 % WO,).
W имеет ОЦК решетку с периодом а = = 0,31647 нм; у = 19,3 г/см*; tm = 3400 + 20 ‘С; tfm = 5900 ‘С; Х20.с= 130,2 Вт/(м • К), р20.с= = 5,5 • 10″* Ом • см. Для кованого слитка а.= = 1,0-4,3 ГПа; НВ = 3,5-4,0 ГПа; Е= 350+ 380 ГПа для проволоки и 390-410 ГПа для монокристаллич. нити. При комн. темп-ре W малопластичен. В обычных условиях W химически стоек. При 400—500 ‘С компактный металл заметно окисляется на воздухе до WO3. Галогены, сера, углерод, кремний, бор взаимодействуют с W при высоких темп-pax. С водородом W не реагирует до tm; с азотом выше 1500 °С образует нитрид. При обычных условиях W стоек к кислотам НС1, h3SO4, HNO, и HF, а также к царской водке. Валентность W в соединениях от 2 до 6, наиболее устойчивы соединения высшей валентности. W образует четыре оксида: высший — WO3 (вольфрамовый ангидрид), низший — WO2 и два промежуточных — W10O2, и W4Olr С хлором W образует ряд хлоридов и оксихлоридов. Наиболее важные их них: WC16 (/1И = 275 ‘С, tfm= 348 °С) и WO2C12 (Скип = 266 ‘С, выше 300 ‘С сублимирует) — получаются при действии хлора на WO, в присутствии угля. С серой W образует сульфиды WS2 и WS,. Карбиды вольфрама WC (tm = 2900 *С) и W2C (tm = 2750 °С) — тв. тугоплавкие соединения; образуются при взаимодействии W с углеродом при 1000-1 500 °С.
Сырьем для пром. получения W служат вольфрамитовые и шеелитовые концентраты (50-60 % WO,). Из концентратов непосредственно выплавляют ферровольфрам (сплав Fe с 65-80 % W), использ. в произ-ве стали. Для получения W, его сплавов и соединений выделяют WO3. В пром-сти применяют неск. способов получения WO3. Шеелитовые концентраты разлагают в автоклавах р-ром соды при 180—200 ‘С (получают техн. р-р вольфра-мата натрия) или соляной кислотой (получают техническую вольфрамовую к-ту):
= Na2WO4
CaWO4(TB)
СаСО,(тв),
CaWO4(TB) + 2НС1(ж) = h3WO4(TB) +
+ СаС12(р-р). ***#*
foUK
Вольфрамитовые концентраты разлагают либо спеканием с содой при 800-900 °С с последующим выщелачиванием Na2WO4 водой, либо обработкой при нагревании р-ром NaOH. При разложении щелочными агентами (содой или едким натром) образуется раствор Na2WO4, загрязн. примесями. После их отделения из р-ра выделяют h3WO4. Высушенный h3WO4 содержит 0,2—0,3 % примесей. Прокаливанием h3WO4 при 700—800 °С получают WO3, а уже из него металлич. W и его соединения. При этом для произ-ва металлич. W дополнительно h3WO4 очищают аммиачным способом. Порошок W получают восстановлением WO3 водородом, а также и углеродом (в произ-ве тв. сплавов) в трубчатых элект-рич. печах при 700—850 °С. Компактный металл получают из порошка способами порошковой металлургии в виде заготовок-штаби-ков, которые хорошо поддаются обработке давлением (ковке, волочению, прокатке и т.п.). Из штабиков методом бестигельной электроннолучевой зонной плавки получают также монокристаллы W.
W широко применяется в совр. технике в виде чистого металла и ряде сплавов, наиболее важные из которых легиров. конструкционные, быстрореж., инструмент, стали, тв. сплавы на основе карбида W, жаропрочные и нек-рые др. спец. сплавы (см. Вольфрамовые сплавы). Тугоплавкость и низкое давление пара при высоких темп-pax делают W незаменимым для деталей электровакуумных приборов в радио- и рентгенотехнике. В разных областях техники используют нек. хим. соединения W, напр. Na2WO4 (в лакокрасочной и текстильной пром-сти), WS2 (катализатор в органич. синтезе, тв. смазка для трения).
Характеристическая валентность — Большая Энциклопедия Нефти и Газа, статья, страница 1
Характеристическая валентность
Cтраница 1
Устойчивость характеристической валентности в каждом из рядов периодической системы Д. И. Менделеева падает слева направо. В конце рядов переходных элементов наблюдается и падение устойчивости высших валентностей. Это является естественным следствием уменьшения числа неспаренных электронов атомов и необходимости значительной затраты энергии для возбуждения высших валентностей. Во многих фторидах могут проявляться более высокие валентности, чем в других галогенидах, но падение максимальной валентности по фтору в пределах VIII и I групп слева направо проявляется вполне отчетливо.
[1]
Общеизвестно, что при характеристической валентности переходные элементы оказываются аналогами элементов второго периода. Однако существенное различие атомных и ионных радиусов кремния и титана приводит к существенным различиям кристаллической структуры и гидратности ряда гексафторосиликатов и гексафторотитанеатов. Больший размер катионов способствует проявлению сходства с гексафторосиликатами.
[2]
Наиболее устойчива для германия его характеристическая валентность ( 4), при которой соединения германия проявляют значительное сходство с соединениями кремния. Это сходство проявляется и в подробно изученных фторидах германия.
[3]
В группах переходных элементов устойчивость характеристической валентности возрастает сверху вниз. Соответственно этому, соединения низших валентностей молибдена и вольфрама менее устойчивы и обладают более сильными восстановительными свойствами, чем аналогичные соединения хрома.
[4]
Тетрафторид свинца является сильным окислителем в связи с малой устойчивостью характеристической валентности для свинца, в особенности при координировании четырех атомов. Все же он значительно устойчивее других тетрагалогенидов свинца. Молекулы тетрафторидов углерода, кремния и германия имеют форму правильных тетраэдров, что соответствует гибридизации sp3 электронов; в связи с высокой симметрией молекул они ведут себя как неполярные.
[5]
Для всех элементов 6-подгрупп величина НУ в формуле Пирсона является просто суммой характеристических валентностей.
[7]
Переход от подсемейств легких к подсемействам тяжелых / — элементов отвечает снижению характеристической валентности, особенно заметному у кюридов ( у гадолинидов валентность снижается и из-за принадлежности их к кайносимметрикам), повышению устойчивости комплексов этих элементов.
[8]
Окислы неметаллов либо присоединяют фтор, либо, если элемент проявлял в окисле характеристическую валентность, замещают кислород на фтор. Не реагируют непосредственно со фтором двуокись углерода и закись азота.
[9]
В действительности только для рутения и осмия были получены соединения RuO4 и OsO4, отвечающие характеристической валентности этих элементов.
[10]
Несмотря на то что элементы подгруппы титана по своей атомной структуре не являются аналогами кремния, производные их характеристической валентности хорошо укладываются в один ряд с соответствующими кремневыми. В частности, весьма закономерно изменяются при переходе от Si к Hf свойства высших окислов.
[11]
Несмотря на то что элементы подгруппы титана по своей атомной структуре не являются аналогами кремния, производные их характеристической валентности хорошо укладываются в один ряд с соответствующими кремневыми. В частности, весьма закономерно изменяются при переходе от Si к Hf свойства высших окислов.
[12]
Несмотря на то что элементы подгруппы титана по своей атомной структуре не являются аналогами кремния, производные их характеристической валентности хорошо укладываются в один ряд с соответствующими кремневыми.
[13]
Несмотря на то, что элементы подгруппы титана по своей атомной структуре не являются аналогами кремния, производные их характеристической валентности хорошо укладываются в один ряд с соответствующими кремневыми. В частности, весьма закономерно изменяются при переходе от Si к Ш свойства высших окислов.
[14]
Сравнение устойчивости фторокомплексов элементов главных и побочных подгрупп периодической системы затруднено недостаточностью известных опытных данных. При проявлении характеристической валентности более прочные и многочисленные комплексы образуются, невидимому, переходными элементами, но в III группе соотношения, повидимому.
[15]
Страницы:
1
2
Текущий контроль знаний учащихся по химии 8 класс
ТКУ по химии 8 класс 1 четверть
- Примерами химических элементов с постоянной валентностью являются:
- H, O, Li. B. Cu, Au, Ag. C. Fe, Co, Ni.
- Валентность водорода в соединениях HF h3S Nh4 соответственно равна
- I, II, III. B. II, I, III, C. везде II D. везде I.
- В приведенном уравнении реакции: 2Zn+ ? = 2ZnO
вместо вопроса надо написать:
А. 2 ОВ. О2 С. Н2ОД. Н2О2.
- Примерами химических элементов с переменной валентностью являются:
- . N, Cu, Fe В.H, O, F С. Be, Al, Ca Д. B, K, Li.
- Валентность кислорода в соединениях Cr2O3. CrO3 Fe3O4 равна
А. I, II, III. B. II, I, III, C. везде II D. везде I.
- Валентность водорода и кислорода равна соответственно:
А. I и II В. II и I С. IV и I Д. II и III
- Наибольшую относительную молекулярную массу имеет:
- . HCl В. HF С. h3O Д. h3S
- Коэффициент перед формулой фосфора в уравнении реакции, схема которой: Р + О2 = Р2О5
- Коэффициент перед формулой натрия в уравнении реакции, схема которой: ?Na + Cl2 = NaCl
- Массовая доля меди в оксиде меди CuO равна:
А. 70% В. 80% С. 84% Д. 90%.
- Массовая доля кальция в оксиде кальция CаO равна:
А. 65% В. 71% С. 70% Д. 82%.
- Среди перечисленных веществ сложными являются:
А. золото В. серебро С. сера Д. вода.
- Коэффициент перед формулой водорода в уравнении реакции, схема которой: СН4 = С + Н2
- Коэффициент перед формулой серебра в уравнении реакции, схема которой: ?Ag + Cl2 = AgCl
А. 1 В. 2 С. 3 Д. 4.
- Коэффициент перед формулой водорода в уравнении реакции, схема которой:
N2 + ?h3 = Nh4
- Наибольшую относительную молекулярную массу имеет:
(ЭО) — оксид
- II) В.Оксид железа (III) С.оксид натрия Д. оксид кальция
- Какой из приведенных признаков характерен для химической реакции?
А) изменение агрегатного состояния С) изменение формы тела
В) измельчение вещества Д) выделение газа.
- Массовая доля алюминия в оксиде алюминия Al2O3 равна:
А. 53% В. 45% С. 100% Д.87%
- Массовая доля железа в оксиде железа Fe2O3 равна:
А. 100% В. 45% С. 80% Д. 70%
- Массовая доля кислорода в оксиде алюминия Al2O3 равна:
А. 53% В. 45% С. 100% Д.47%
- Сколько моль вещества содержится в 54 г воды?
А. 1 моль В. 2 моль С. 3 моль Д. 4 моль.
- Сколько моль вещества содержится в 25 г известняка СаСО3?
А. 0,25 моль В. 0,5 моль С. 1 моль Д. 4 моль.
- Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции — это закон
А) Закон сохранения массы веществ
В) Закон постоянства состава вещества
С) Закон Авогадро
Д) Периодический закон Д.И.Менделеева
- Способ очистки, при котором вначале вещество растворяют в воде, затем этот раствор выпаривают – это:
А) перегонка С) перекристаллизация
В) фильтрование Д) отстаивание
- Биэлементные соединения – это:
А) соединения, состоящие из 2 элементов
В) соединения, состоящие из 3 элементов
С) соединения, состоящие из 5 элементов
Просмотр содержимого документа
«Текущий контроль знаний учащихся по химии 8 класс »
ТКУ по химии 8 класс 1 четверть
Примерами химических элементов с постоянной валентностью являются:
H, O, Li. B. Cu, Au, Ag. C. Fe, Co, Ni.
Валентность водорода в соединениях HF H2S NH3 соответственно равна
I, II, III. B. II, I, III, C. везде II D. везде I.
В приведенном уравнении реакции: 2Zn+ ? = 2ZnO
вместо вопроса надо написать:
А. 2 О В. О2 С. Н2О Д. Н2О2.
Примерами химических элементов с переменной валентностью являются:
А. N, Cu, Fe В.H, O, F С. Be, Al, Ca Д. B, K, Li.
Валентность кислорода в соединениях Cr2O3.CrO3 Fe3O4 равна
А. I, II, III. B. II, I, III, C. везде II D. везде I.
Валентность водорода и кислорода равна соответственно:
А. I и II В. II и I С. IV и I Д. II и III
Наибольшую относительную молекулярную массу имеет:
А. HCl В. HF С. H2O Д. H2S
Коэффициент перед формулой фосфора в уравнении реакции, схема которой: Р + О2 = Р2О5
А. 1 В. 2 С. 3 Д. 4.
Коэффициент перед формулой натрия в уравнении реакции, схема которой: ?Na + Cl2 = NaCl
А. 1 В. 2 С. 3 Д. 4.
Массовая доля меди в оксиде меди CuO равна:
А. 70% В. 80% С. 84% Д. 90%.
Массовая доля кальция в оксиде кальция CаO равна:
А. 65% В. 71% С. 70% Д. 82%.
Среди перечисленных веществ сложными являются:
А. золото В. серебро С. сера Д. вода.
Коэффициент перед формулой водорода в уравнении реакции, схема которой: СН4 = С + Н2
А. 1 В. 2 С. 3 Д. 4.
Коэффициент перед формулой серебра в уравнении реакции, схема которой: ?Ag + Cl2 = AgCl
А. 1 В. 2 С. 3 Д. 4.
Коэффициент перед формулой водорода в уравнении реакции, схема которой:
N2 + ?H2 = NH3
А. 1 В. 2 С. 3 Д. 4.
Наибольшую относительную молекулярную массу имеет:
(ЭО) — оксид
А. оксид железа (II) В.Оксид железа (III) С.оксид натрия Д. оксид кальция
Какой из приведенных признаков характерен для химической реакции?
А) изменение агрегатного состояния С) изменение формы тела
В) измельчение вещества Д) выделение газа.
Массовая доля алюминия в оксиде алюминия Al2O3 равна:
А. 53% В. 45% С. 100% Д.87%
Массовая доля железа в оксиде железа Fe2O3 равна:
А. 100% В. 45% С. 80% Д. 70%
Массовая доля кислорода в оксиде алюминия Al2O3 равна:
А. 53% В. 45% С. 100% Д.47%
Сколько моль вещества содержится в 54 г воды?
А. 1 моль В. 2 моль С. 3 моль Д. 4 моль.
Сколько моль вещества содержится в 25 г известняка СаСО3?
А. 0,25 моль В. 0,5 моль С. 1 моль Д. 4 моль.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции — это закон
А) Закон сохранения массы веществ
В) Закон постоянства состава вещества
С) Закон Авогадро
Д) Периодический закон Д.И.Менделеева
Способ очистки, при котором вначале вещество растворяют в воде, затем этот раствор выпаривают – это:
А) перегонка С) перекристаллизация
В) фильтрование Д) отстаивание
Биэлементные соединения – это:
А) соединения, состоящие из 2 элементов
В) соединения, состоящие из 3 элементов
С) соединения, состоящие из 5 элементов
Теория валентной связи | Химия для неосновных
Цели обучения
- Определите теорию валентных связей.
- Опишите, как использовать теорию валентных связей для объяснения аспектов ковалентных связей.
Что будет дальше?
Мы видели, что старая идея о соединении атомов, которую так любил Демокрит, просто не работает. У электронов нет маленьких крючков, но они являются основой для соединения атомов в молекулы.Вы научились писать структуры электронно-точечных структур Льюиса для молекул и предсказывать их форму с помощью теории VSEPR. Теперь пришло время применить эти способности, чтобы понять, как электроны ведут себя на своих атомных орбиталях при образовании ковалентной связи.
Теория валентной связи
Вы узнали, что ковалентная связь образуется, когда электронные облака двух атомов перекрываются друг с другом. В простой молекуле H 2 одиночный электрон в каждом атоме притягивается к ядру другого атома в молекуле, когда атомы сближаются.В конечном итоге достигается оптимальное расстояние, равное длине связи, и потенциальная энергия достигает минимума. Между двумя атомами водорода образовалась стабильная одинарная ковалентная связь. Другие ковалентные связи образуются таким же образом, как неспаренные электроны двух атомов «совпадают», образуя связь. В атоме фтора на одной из орбиталей 2p находится неспаренный электрон. Когда образуется молекула F 2 , орбитали 2p от каждого из двух атомов перекрываются, образуя ковалентную связь F-F.Перекрывающиеся орбитали не обязательно должны быть одного типа. В молекуле HF орбиталь 1s атома водорода перекрывается с орбиталью 2p атома фтора (см. Рисунок ниже).
Рисунок 1. Молекула фтороводорода (HF).
По сути, любая ковалентная связь возникает в результате перекрытия атомных орбиталей. Эта идея составляет основу квантово-механической теории, называемой теорией валентной связи (VB). В теории валентной связи предполагается, что электроны в молекуле занимают атомные орбитали отдельных атомов, и связь возникает в результате перекрытия этих орбиталей.
Сводка
- Электроны занимают атомные орбитали.
- Ковалентные связи возникают в результате перекрытия атомных орбиталей.
Практика
Просмотрите презентацию по ссылке ниже и пройдите викторины.
http://www.kentchemistry.com/links/bonding/bondingflash.htm
Обзор
- Где электроны согласно теории валентных связей?
- Как образуются ковалентные связи?
- Должны ли быть орбитали двух электронов, участвующих в связи, одинаковыми?
Глоссарий
- теория валентной связи: Предполагается, что электроны в молекуле занимают атомные орбитали отдельных атомов, и связь возникает в результате перекрытия этих орбиталей.
Показать ссылки
Список литературы
- Фонд СК-12 — Джоди Со.
- Фонд CK-12 — Jodi So. Фундамент СК-12.
HF Структура Льюиса, молекулярная геометрия, гибридизация и полярность
Фтористый водород представляет собой бесцветную жидкость или газообразное соединение, имеющее химическую формулу HF. Он имеет тенденцию растворяться в воде, и бесцветный водный раствор известен как плавиковая кислота.
Он имеет температуру плавления -118.50 F и температура кипения около 670 F.
HF имеет молярную массу 20,0064 г / моль и плотность 1,15 г / л в качестве газа при 250 ° C.
HF имеет широкий спектр применения. Он действует как предшественник галогенового фтора посредством процедуры электролиза. Помимо этого, он также действует как предшественник нескольких фторидов металлов, таких как фторид алюминия и гексафторид урана.
HF безводный обладает каталитическими свойствами и, следовательно, используется в процессе алкилирования нефти для увеличения октанового числа нефти.Также фтористый водород можно использовать для производства гербицидов, люминесцентных ламп, хладагентов и так далее.
Газообразный фтористый водород опасен, а водный раствор HF-кислоты вызывает коррозию и токсичность.
Приведенная ниже реакция дает нам процедуру образования HF:
CaF2 + h3SO4 ——–> CaSO4 + 2HF (эндотермическая реакция)
HF Структура Льюиса
Химическая связь — это исследование атомного притяжения, которое приводит к образованию новых продуктов.Наука, лежащая в основе образования химических связей, помогает нам понять несколько химических и физических свойств, проявляемых разными молекулами и соединениями.
Чтобы узнать природу связывания внутри молекулы HF, мы сначала разберемся с концепцией структуры Льюиса, чтобы мы могли нарисовать правильную диаграмму.
Lewis Structure дает двухмерный эскиз, представляющий распределение электронов между атомами внутри молекулы.
Здесь мы поговорим о валентных электронах i.е. электроны во внешней оболочке атома, которые участвуют в связывании.
Давайте обсудим пошаговую процедуру построения диаграммы структуры Льюиса для молекулы HF:
Шаг 1 : Сначала мы должны подсчитать общее количество валентных электронов внутри одной молекулы фтороводорода .
HF имеет один атом водорода и один атом фтора.
Водород принадлежит к периоду 1 и имеет 1 валентный электрон, тогда как фтор принадлежит к периоду 17 (группа галогенов) и, следовательно, имеет 7 валентных электронов.Мы можем проверить атомный номер из периодической таблицы, чтобы подтвердить номер валентного электрона.
Общее количество валентных электронов в молекуле HF = 1 + 7 = 8.
Шаг 2 : Следуя общей процедуре, теперь, когда мы нашли число валентных электронов, мы должны определить элемент, который займет центральное положение в молекуле . Обычно центральным атомом выступает элемент, имеющий наименьшее значение электроотрицательности.
Фтористый водород — двухатомная молекула, поэтому здесь понятие центрального атома не применяется.Мы можем разместить их соответственно:
Шаг 3 : Структура Льюиса также известна как электронно-точечная структура, поскольку мы используем точечные обозначения для представления валентных электронов, окружающих атомы .
Давайте посмотрим на схематический эскиз HF после того, как мы разместили точечные электроны:
Шаг 4 : Теперь проверим правило октета .
Правило октетов касается выполнения октетами валентных оболочек элементов.Это говорит о том, что элементы от группы 1 до группы 17 имеют тенденцию к достижению октетной электронной конфигурации внешней оболочки элементов из благородных газов.
Как мы видим в HF, у нас есть фтор, который имеет тенденцию иметь восемь электронов на своей валентной оболочке. Согласно приведенному выше эскизу, мы выполнили требуемый критерий.
В случае с водородом, однако, мы видим, что он будет иметь тенденцию иметь два электрона во внешней оболочке, поскольку он достигнет конфигурации [He].
На диаграмме мы видим, что водород имеет два электрона, окружающих его атом, и, следовательно, этот критерий также был выполнен.Перейдем к следующему шагу.
Шаг 5 : Прежде чем мы сможем подтвердить определенную диаграмму структуры Льюиса, мы должны проверить еще одну вещь, а именно формальную плату .
Формальный заряд определяется как заряд, который мы приписываем данному атому внутри молекулы, исходя из предположения, что электроны распределяются поровну между элементами для образования связи.
Мы рассчитываем формальный сбор по следующей формуле:
В HF формальная плата за H = 1 — 0.5 * 2 — 0 = 0.
Официальный сбор для F = 7 — 0,5 * 2 — 6 = 0.
Как мы видим, элементы представлены в своих наименее возможных формальных значениях заряда.
Таким образом, мы можем подтвердить, что получили правильную диаграмму структуры Льюиса для фтороводорода.
У нас одинарная связь между H и F из-за совместного использования пары электронов.
Молекулярная геометрия
Двухмерного представления о молекуле недостаточно, чтобы понять природу химической связи.Структура Льюиса имеет свои ограничения, поэтому теперь мы будем использовать другой и модифицированный подход.
Мы будем использовать теорию отталкивания электронных пар валентной оболочки (VSEPR), чтобы расшифровать трехмерную молекулярную геометрию данной молекулы.
Это поможет нам лучше визуализировать структурное устройство внутри молекулы, а также поможет понять некоторые свойства, которые она может проявлять.
Теория
VSEPR гласит, что одноименно заряженные электронные частицы образуют вокруг ядер отрицательную облачную атмосферу, которая может вызывать отталкивание.Чтобы свести к минимуму отталкивание электронов и сохранить стабильность геометрии, атомы остаются дальше друг от друга.
Давайте проверим молекулярную геометрию фтороводорода (HF).
Молекулярная геометрия HF
Чтобы использовать модель VSEPR для предсказания трехмерной формы молекулы, мы должны сначала взглянуть на структуру Льюиса.
Вот наша структура Льюиса для HF
Теперь, поскольку у нас есть гетероядерная двухатомная молекула, у нас есть два электронных облака, окружающие два атома, по одному на каждом, и поэтому, чтобы уменьшить силы отталкивания, они будут размещены как можно дальше друг от друга.
Единственно возможный валентный угол составляет 180 градусов, и атомы H и F образуют прямую линию друг с другом согласно теории VSEPR .
Чтобы убедиться, что наш прогноз сбылся, мы можем проверить нотацию VSEPR (AXnEx). Обычно мы делаем это для многоатомных молекул (более двух атомов), где центральный атом играет роль.
В HF, будем считать H равным A.
X = нет окружающих атомов, n = 1.
E = количество неподеленных пар на A, ∴ x = 0.
Обозначение: AX1E0.
Если считать F равным A, будет обозначено AX1E3.
Для обозначения AX1Ex у нас будет линейная структура и угол связи 180 градусов.
ВЧ гибридизация
Существует несколько моделей и теорий, которые используются для объяснения механизма образования связи. Одна из таких моделей для обсуждения механизма ковалентной связи известна как орбитальная гибридизация.
Здесь мы не говорим об электронных орбитах, а имеем дело с орбиталями.
Орбиталь — это терминология квантовой механики, которая объясняет волновую природу электронов и дает нам математическую функцию вероятности электронной плотности вблизи ядер атомов.
Атомные орбитали бывают разных типов, например s, p, d, f. Процесс гибридизации говорит о том, что эти атомные орбитали атома внутри молекулы объединяются и сливаются, образуя гибридизированные орбитали, такие как sp, sp2, sp3, sp3d и так далее. Эти гибридные орбитали затем принимают участие в образовании связи.
Что касается HF, давайте посмотрим на атом фтора и его электронную конфигурацию.
Фтор имеет атомный номер 9, а его электронная конфигурация — 1s22s22p5.
Здесь s-орбиталь и три p-орбитали сливаются и образуют 4 sp3-гибридизированные орбитали, и существует гибридизация sp3 .
Но есть и другие теории, по-разному объясняющие гибридизацию.
Говорят, что 1s-орбиталь водорода перекрывается и сливается с 2p-орбиталью фтора в молекуле HF. Согласно теории молекулярных орбиталей, 2s-орбиталь F не связывается, а 2pz-орбиталь F объединяется с 1s-орбитали H.
ВЧ полярность
Полярность — еще одна важная тема химии, которую мы собираемся обсудить в этой статье.
Это свойство проявляется в молекулярных структурах, и оно касается разделения электрических зарядов между составляющими атомами внутри молекулы.
Итак, как мы можем назвать молекулу полярной или неполярной?
Чтобы выяснить это, мы должны сначала понять, что означает полярная связь.
Связь называется полярной, если существует значительная разница в электроотрицательности (более 0.4-0,5) между двумя атомами, что приводит к образованию дипольного момента.
Если молекула не симметрична, то диполи, образованные в ее связях, не уничтожаются полностью, причем один конец имеет более плотный отрицательный заряд, чем другой, и оказывается, что он полярный по природе.
H имеет значение электроотрицательности 2,20, а F — 3,98. Разница = 3,98 — 2,20 = 1,78.
В облигации H-F, H будет нести частичное +, а F будет нести 𝛅- заряд.Несмотря на то, что HF является линейным, существует только одна связь, и результирующий диполь не компенсируется. Таким образом, мы имеем полярную молекулу в HF .
Заключение
В эту статью о фтористом водороде мы включили темы структуры Льюиса, гибридизации, молекулярной геометрии и полярности, чтобы объяснить ковалентные связи внутри молекулы.
Удачного обучения!
1.7: Теория Валентной Связи — Химия LibreTexts
Пока мы обсуждали, как использовать структуры Льюиса для изображения связи в органических соединениях, мы до сих пор очень расплывчато говорили о реальной природе самих химических связей.Мы знаем, что ковалентная связь включает «разделение» пары электронов между двумя атомами — но как это происходит и как это приводит к образованию связи, удерживающей два атома вместе?
Теория валентной связи чаще всего используется для описания связи в органических молекулах. В этой модели считается, что связи образуются в результате перекрытия двух атомных орбиталей на разных атомах, каждая из которых содержит один электрон. Рассматривая простые неорганические молекулы, такие как молекулярный водород (H 2 ) или фтористый водород (HF), нашего нынешнего понимания атомных орбиталей s и p будет достаточно.Однако, чтобы объяснить связь в органических молекулах, нам нужно будет ввести понятие гибридных орбиталей .
Сигма-связь в молекуле H
2
Самый простой случай — это молекула водорода, H 2 . Когда мы говорим, что два ядра водорода разделяют свои электроны, образуя ковалентную связь, в терминах теории валентных связей мы имеем в виду, что две сферические орбитали 1 s (серые сферы на рисунке ниже) перекрываются и содержат два электрона. с противоположным вращением.
Эти два электрона теперь притягиваются к положительному заряду обоих ядер водорода, в результате чего они служат своего рода «химическим клеем», удерживающим два ядра вместе.
Как далеко друг от друга находятся два ядра? Если они находятся слишком далеко друг от друга, их соответствующие орбитали 1 s не могут перекрываться, и, следовательно, не может образоваться ковалентная связь — они по-прежнему представляют собой всего лишь два отдельных атома водорода. По мере того, как они перемещаются все ближе и ближе друг к другу, начинает происходить перекрытие орбит, и начинает формироваться связь.Это снижает потенциальную энергию системы, поскольку новые, привлекательные, , положительно-отрицательные электростатические взаимодействия становятся возможными между ядром одного атома и электроном второго.
Но в то же время происходит кое-что еще: когда атомы сближаются, отталкивающее положительно-положительное взаимодействие между двумя ядрами также начинает усиливаться.
Сначала это отталкивание более чем компенсируется притяжением между ядрами и электронами, но в определенный момент, когда ядра становятся еще ближе, силы отталкивания начинают преодолевать силы притяжения, и потенциальная энергия системы быстро возрастает.Когда два ядра находятся «слишком близко», возникает нестабильная ситуация с высокими энергиями. Между ядрами существует определенное оптимальное расстояние, при котором потенциальная энергия минимальна, а это означает, что объединенные силы притяжения и отталкивания составляют наибольшую общую силу притяжения. Это оптимальное межъядерное расстояние — длина связи . Для молекулы H 2 расстояние составляет 74 пм (пикометров, 10 -12 метра). Точно так же разница в потенциальной энергии между состоянием с наименьшей энергией (при оптимальном межъядерном расстоянии) и состоянием, в котором два атома полностью разделены, называется энергией диссоциации связи , или, проще говоря, , прочностью связи .Для молекулы водорода прочность связи Н-Н равна примерно 435 кДж / моль.
Каждая ковалентная связь в данной молекуле имеет характерную длину и прочность. В общем, длина типичной одинарной связи углерод-углерод в органической молекуле составляет около 150 мкм, в то время как двойные связи углерод-углерод составляют около 130 мкм, двойные связи углерод-кислород составляют около 120 мкм, а связи углерод-водород составляют диапазон от 100 до 110 пм. Сила ковалентных связей в органических молекулах колеблется от около 234 кДж / моль для связи углерод-йод (например, в гормоне щитовидной железы), около 410 кДж / моль для типичной связи углерод-водород и до более 800 кДж / моль. моль для тройной связи углерод-углерод.
Таблица длин и энергий связей
Однако неверно представлять ковалентные связи в виде жестких стержней неизменной длины — скорее, лучше представить их как пружины , , которые имеют определенную длину в расслабленном состоянии, но которые можно сжимать, растягивать и сгибать. Эта «упругая» картина ковалентных связей станет очень важной в главе 4, когда мы изучим аналитическую технику, известную как инфракрасная (ИК) спектроскопия.
Еще одна характеристика ковалентной связи в H 2 важна для рассмотрения на этом этапе.Две перекрывающиеся орбитали 1 s можно визуализировать как два сферических шара, сжатых вместе. Это означает, что связь имеет цилиндрическую симметрию : если мы возьмем плоскость поперечного сечения связи в любой точке, она будет образовывать круг. Этот тип связи обозначается как сигма ( σ) связь .
Сигма-связь может быть образована перекрытием атомной орбитали s с атомной орбиталью p .Пример фтористого водорода (HF):
Сигма-связь также может быть образована перекрытием двух орбиталей p . Ковалентная связь в молекулярном фторе, F 2 , представляет собой сигма-связь, образованную перекрытием двух наполовину заполненных орбиталей 2 p , по одной от каждого атома фтора.
sp
3 гибридные орбитали и тетраэдрическая связь
Теперь давайте более внимательно рассмотрим связывание в органических молекулах, начиная с метана, CH 4 .Вспомните валентную электронную конфигурацию атома углерода:
Это изображение проблематично, когда речь идет об описании соединения в метане. Как углерод образует четыре связи, если у него есть только две наполовину заполненные орбитали p , доступные для связывания? Подсказка исходит из экспериментального наблюдения, что четыре связи C-H в метане расположены с геометрией тетраэдра вокруг центрального углерода, и что каждая связь имеет одинаковую длину и силу.Чтобы объяснить это наблюдение, теория валентных связей опирается на концепцию, называемую орбитальной гибридизацией . На этом рисунке четыре валентных орбитали углерода (одна 2 s и три 2 p орбитали) объединяются математически (помните: орбитали описываются волновыми уравнениями), чтобы сформировать четыре эквивалентных гибридных орбитали , которые называются sp 3 орбиталей , потому что они образуются в результате смешения одной s и трех p орбиталей.В новой электронной конфигурации каждый из четырех валентных электронов на углероде занимает одну орбиталь sp 3 .
Интерактивная 3D-модель
( выберите ‘load sp 3 ‘ и ‘load H 1s’, чтобы увидеть орбитали )
Это геометрическое расположение имеет смысл, если учесть, что именно этот угол позволяет четырем орбиталям (и электронам в них) находиться как можно дальше друг от друга. Это просто переформулировка теории отталкивания электронных пар валентной оболочки (VSEPR), которую вы изучили в общей химии: электронные пары (на орбиталях) будут располагаться таким образом, чтобы оставаться как можно дальше друг от друга из-за отрицательно-отрицательного электростатическое отталкивание.
Каждая связь CH в метане, таким образом, может быть описана как сигма-связь, образованная перекрытием между наполовину заполненной орбиталью 1 s в атоме водорода и большей долей одного из четырех наполовину заполненных sp 3 гибридных орбиталей в центральном углероде. Длина углерод-водородных связей в метане составляет 109 пм.
В то время как ранее мы рисовали структуру метана Льюиса в двух измерениях, используя линии для обозначения каждой ковалентной связи, теперь мы можем нарисовать более точную структуру в трех измерениях, показывая геометрию тетраэдрической связи.Однако, чтобы сделать это на двухмерной странице, нам нужно ввести новое соглашение о рисовании: систему сплошного / пунктирного клина. В этом соглашении сплошной клин просто представляет собой скрепление, которое должно быть изображено выходящим из плоскости страницы. Пунктирный клин представляет собой связь, которая должна быть изображена указывающей на плоскость страницы или позади нее. Нормальные линии подразумевают связи, которые лежат в плоскости страницы. К этой системе нужно немного привыкнуть, но с практикой ваш глаз научится немедленно «видеть» изображаемое третье измерение.
Упражнение 2.1
Представьте, что вы можете различить четыре атома водорода в молекуле метана и обозначить их H a через H d . На изображениях ниже точно такая же молекула метана вращается и переворачивается в различных положениях. Нарисуйте метки отсутствующих атомов водорода. (Сделать это будет намного проще, если вы сделаете модель.)
Упражнение 2.2
Какие орбитали перекрываются, образуя связи C-Cl в хлороформе, CHCl 3 ?
Решения упражнений
Как эта связующая картина распространяется на соединения, содержащие углерод-углеродные связи? В этане (CH 3 CH 3 ) оба атома углерода sp 3 -гибридизированы, что означает, что оба имеют четыре связи с тетраэдрической геометрией.Связь углерод-углерод с длиной связи 154 мкм образована перекрытием одной орбитали sp 3 от каждого из атомов углерода, в то время как шесть углерод-водородных связей образуются из перекрытия между оставшимися sp 3 орбиталей на двух атомах углерода и 1 s орбиталей атомов водорода. Все это сигма-облигации.
Интерактивная модель этана
Поскольку они образованы в результате перекрытия двух орбиталей, s igma-связи могут свободно вращаться на .В случае молекулы этана это означает, что две метильные (CH 3 ) группы могут быть изображены как два колеса на оси, каждое из которых может вращаться относительно другого.
–
Видео
В главе 3 мы узнаем больше о значении свободы вращения в сигма-связях, когда будем обсуждать «конформацию» органических молекул.
Изображение связывания sp 3 также используется для описания связывания в аминах, включая аммиак, простейший амин.Так же, как атом углерода в метане, центральный азот в аммиаке гибридизирован sp 3 — . Однако в случае азота необходимо учитывать пять, а не четыре валентных электрона, что означает, что три из четырех гибридных орбиталей наполовину заполнены и доступны для связывания, а четвертая полностью занята несвязывающей парой (неподеленной парой) электронов. .
изображение, заполняющее пространство
Расположение связей здесь также тетраэдрическое: три связи N-H аммиака можно представить как образующие основу тригональной пирамиды, а четвертая орбиталь, содержащая неподеленную пару, образует вершину пирамиды.Вспомните из вашего исследования теории VSEPR в общей химии, что неподеленная пара с ее немного большим отталкивающим эффектом «отталкивает» три связи NH s от вершины пирамиды, что означает, что валентные углы HNH немного меньше тетраэдрических, на 107,3˚, а не на 109,5˚.
Теория
VSEPR также точно предсказывает, что молекула воды «изогнута» под углом примерно 104,5˚. Связывание в воде происходит в результате перекрытия двух из четырех гибридных орбиталей sp 3 на кислороде с 1 s орбиталей на двух атомах водорода.Две несвязывающие пары электронов на кислороде расположены на двух оставшихся орбиталях sp 3 .
Упражнение 2.3
Нарисуйте в том же стиле, что и на рисунках выше, орбитальные рисунки для связывания в а) метиламине и б) этаноле.
Решения упражнений
видеоурок по sp 3 орбитали и сигма связи
sp
2 и sp гибридные орбитали и пи-связи
Теория валентных связей, наряду с концепцией гибридных орбиталей, очень хорошо описывает соединения с двойной связью, такие как этен.С помощью модели связывания необходимо учесть три экспериментально наблюдаемых характеристики молекулы этена:
- Этен — плоская молекула.
- Углы связи в этене составляют приблизительно 120 o , а длина связи углерод-углерод составляет 134 мкм, что значительно короче, чем 154 мкм одинарной связи углерод-углерод в этане.
- Существует значительный барьер для вращения вокруг двойной связи углерод-углерод.
Ясно, что эти характеристики не согласуются с картиной гибридного связывания sp 3 для двух атомов углерода.Вместо этого связь в этене описывается моделью, предполагающей участие другого типа гибридной орбитали. Три атомных орбитали на каждом углероде — 2 s , 2 p x и 2 p y орбитали — объединяются, образуя три sp 2 гибридов , оставляя 2 p z орбитальная негибридная.
Три гибрида sp 2 расположены с тригональной плоской геометрией, указывающей на три угла равностороннего треугольника с углами 120 ° между ними.Негибридизированная орбиталь 2 p z расположена на перпендикулярно к этой плоскости (на следующих нескольких рисунках орбитали sp 2 и сигма-связи, в которые они вносят вклад, представлены линиями и клиньями; только 2 p z орбитали показаны в режиме «заполнение пространства»).
Двойная связь углерод-углерод в этене состоит из одной сигма-связи, образованной перекрытием двух sp 2 орбиталей, и второй связи, называемой pi ( π ) связь , которая образована бок о бок перекрытия двух негибридизованных 2 p z орбиталей от каждого углерода.
анимация
видеоурок
Интерактивная 3D-модель (выберите «Показать результирующую орбиталь Пи»)
В отличие от сигма-связи, пи-связь и не имеет цилиндрической симметрии. Если вращение вокруг этой связи должно было произойти, это повлекло бы за собой нарушение параллельного перекрытия между двумя орбиталями 2 p z , которые составляют пи-связь. Таким образом, присутствие пи-связи «фиксирует» шесть атомов этена в одной плоскости.Этот аргумент распространяется на более крупные алкеновые группы: в каждом случае шесть атомов лежат в одной плоскости.
Упражнение 2.4
Перерисуйте структуры ниже, указав шесть атомов, которые лежат в одной плоскости из-за двойной углерод-углеродной связи.
Упражнение 2.5
Что не так с тем, как нарисована следующая структура?
Решения упражнений
Аналогичная картина может быть нарисована для связывания в карбонильных группах, таких как формальдегид.В этой молекуле углерод sp 2 -гибридизирован, и мы будем предполагать, что атом кислорода также гибридизирован sp 2 . Углерод имеет три сигма-связи: две образованы перекрытием между sp 2 орбиталями с 1 s орбиталями от атомов водорода, а третья сигма-связь образована перекрытием между оставшимся углеродом sp 2 орбиталей и sp 2 орбитали на кислороде.Две неподеленные пары на кислороде занимают две другие sp 2 орбитали.
Заполнение изображения
интерактивная 3D модель
Пи-связь образована параллельным перекрытием негибридизованных 2 p z орбиталей на углероде и кислороде. Как и в алкенах, орбитали 2 p z , которые образуют пи-связь, перпендикулярны плоскости, образованной сигма-связями.
Упражнение 2.6
a: Изобразите диаграмму гибридных орбиталей в sp 2 -гибридизированном азоте.
b: Нарисуйте рисунок, показывающий изображение склеивания имина ниже.
c: На вашем чертеже для части b какая орбиталь удерживает неподеленную пару азота?
Решения упражнений
Напомним, что карбокатионы — это временные высокоэнергетические частицы, в которых углерод имеет только три связи (а не обычные четыре) и положительный формальный заряд.В этой и последующих главах мы расскажем о карбокатионах гораздо больше. На данный момент, однако, важно понять, что карбокатион можно описать как гибридизованный углерод sp 2 с пустой орбиталью 2p , перпендикулярной плоскости сигма-связей.
Наконец, концепция гибридных орбиталей применима также к группам с тройными связями, таким как алкины и нитрилы. Рассмотрим, например, структуру этина (обычное название ацетилен), простейшего алкина.
И теория VSEPR, и экспериментальные данные говорят нам, что молекула линейна: все четыре атома лежат на прямой линии. Тройная связь углерод-углерод имеет длину всего 120 мкм, что короче двойной связи в этене, и очень прочное, около 837 кДж / моль. На гибридной орбитальной картине ацетилена оба атома углерода являются гибридными sp- . В гибридизированном углероде sp орбиталь 2 s объединяется с орбиталью 2 p x , образуя две гибридные орбитали sp , которые ориентированы под углом 180 ° относительно друг друга (например, .по оси x). Орбитали 2 p y и 2 p z остаются негибридизированными и ориентированы перпендикулярно по осям y и z соответственно.
Таким образом, сигма-связь углерод-углерод образуется перекрытием одной орбитали sp от каждого из атомов углерода, в то время как две сигма-связи углерод-водород образуются перекрытием второй орбитали sp на каждом углероде. с орбиталью 1 с на водороде.Каждый атом углерода по-прежнему имеет две наполовину заполненные орбитали 2 p y и 2 p z , которые перпендикулярны друг другу и линии, образованной сигма-связями. Эти две перпендикулярные пары орбиталей 2 p образуют две пи-связи между атомами углерода, в результате чего получается тройная связь (одна сигма-связь плюс две пи-связи).
интерактивная 3D модель
Упражнение 2.7
Посмотрите на структуру тиаминдифосфата в таблице «структуры общих коферментов».Определите гибридизацию всех атомов углерода в молекуле.
Решения упражнений
Концепция гибридных орбиталей хорошо объясняет другое экспериментальное наблюдение: одинарные связи, смежные с двойными и тройными связями, постепенно короче и прочнее, чем одинарные связи, смежные с другими одинарными связями. Рассмотрим, например, одинарные связи углерод-углерод в пропане, пропене и пропине.
Все три являются одинарными (сигма) облигациями; связь в пропине самая короткая и прочная, а в пропане самая длинная и слабая.Объяснение относительно простое. Орбиталь sp состоит из одной орбиты s и одной орбиты p , и, таким образом, она имеет 50% символов s и 50% символов p . sp 2 орбитали, для сравнения, имеют 33% s символов и 67% p символов, в то время как sp 3 орбитали имеют 25% s символов и 75% p символов. Из-за своей сферической формы орбитали 2 s меньше и удерживают электроны ближе и «плотнее» к ядру, по сравнению с орбиталями 2 p .Отсюда следует, что электроны на орбитали sp с его большим характером s ближе к ядру, чем электроны на орбитали sp 2 или sp 3 . Следовательно, связи, включающие sp — sp 3 перекрытия (как в пропине), короче и прочнее, чем связи, включающие sp 2 — sp 3 перекрытия (как в пропене). Связи с участием sp 3 -sp 3 перекрытия (как в пропане) являются самыми длинными и самыми слабыми из трех.
Упражнение 2.8
a) Какие виды орбиталей перекрываются в связях b-i, указанных ниже? Не забудьте различать сигма-связи и пи-связи. Пример приведен для облигации «а».
б) На какой орбитали находится неподеленная пара электронов на атоме азота связи а? Связи электронной?
Решения упражнений
Видеоурок Академии Кана по теории валентных связей / гибридным орбиталям
Авторы и авторство
Hf Информация об элементе гафния: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История гафния
Элемент гафний был открыт Дирком Костером в году
1923 год в Дании
.Гафний
получил свое название от Hafnia, нового латинского названия Копенгагена.
Присутствие гафния: изобилие в природе и вокруг нас
В таблице ниже показано содержание гафния во Вселенной, Солнце, Метеоритах,
Земная кора, океаны и человеческое тело.
Кристаллическая структура гафния
Твердотельная структура гафния — Простая гексагональная.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в
три
пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки
края
Константы решетки ( a , b и c )
| б | c | |
|---|---|---|
| 319.64 | 319,64 | 505,11 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | 2 π / 3 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений (
x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства гафния
Атомы гафния имеют 72 электрона и
структура электронной оболочки [2, 8, 18, 32, 10, 2] с символом атомного термина (квантовые числа) 3 F 2 .
Оболочечная структура гафния — количество электронов на энергию
уровень
| n | с | с. | д | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | 14 |
| 5 | O | 2 | 6 | 2 | |
| 6 | P | 2 |
Электронная конфигурация основного состояния гафния — нейтраль
Атом гафния
Электронная конфигурация нейтрального атома гафния в основном состоянии
[Xe] 4f14 5d2 6s2.Часть конфигурации гафния, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Xe]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4f14 5d2 6s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального гафния
Полная электронная конфигурация основного состояния для атома гафния, несокращенная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d2 6s2
Атомная структура гафния
Атомный радиус гафния 208 пм, а его ковалентный радиус 150 пм.
Атомный спектр гафния
Химические свойства гафния:
Энергии ионизации гафния и сродство к электрону
Электронное сродство гафния составляет 0 кДж / моль.
Энергия ионизации гафния
Энергия ионизации гафния
см. В таблице ниже.
| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 658.5 |
| 2 | 1440 |
| 3 | 2250 |
| 4 | 3216 |
Физические свойства гафния
Физические свойства гафния см. В таблице ниже
| Плотность | 13.31 г / см3 |
| Молярный объем | 13.410 2178813 см3 |
Эластичные свойства
Твердость гафния — Испытания для измерения твердости элемента
Электрические свойства гафния
Гафний — проводник электричества. Ссылаться на
Таблица
ниже электрические свойства гафния
Теплопроводность и теплопроводность гафния
Магнитные свойства гафния
Оптические свойства гафния
Акустические свойства гафния
Тепловые свойства гафния — энтальпии и
термодинамика
Термические свойства гафния
см. В таблице ниже.
Энтальпии гафния
Изотопы гафния — ядерные свойства гафния
Изотопы родия.Встречающийся в природе гафний имеет
5 стабильный изотоп —
176Hf, 177Hf, 178Hf, 179Hf, 180Hf.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 153Hf | ||||
| 154Hf | ||||
| 155Hf | ||||
| 156Hf | ||||
| 157Hf | ||||
| 158Hf | ||||
| 159Hf | ||||
| 160Hf | ||||
| 161Hf | ||||
| 162Hf | ||||
| 163Hf | ||||
| 164Hf | ||||
| 165Hf | ||||
| 166Hf | ||||
| 167Hf | ||||
| 168Hf | ||||
| 169Hf | ||||
| 170Hf | ||||
| 171Hf | ||||
| 172Hf | ||||
| 173Hf | ||||
| 174Hf | 0.16% | |||
| 175Hf | ||||
| 176Hf | 5.26% | Стабильный | N / A | |
| 177Hf | 18.6% | Стабильный | N / A | |
| 178Hf | 27.28% | Стабильный | N / A | |
| 179Hf | 13.62% | Стабильный | N / A | |
| 180Hf | 35.08% | Стабильный | N / A | |
| 181Hf | ||||
| 182Hf | ||||
| 183Hf | ||||
| 184Hf | ||||
| 185Hf | ||||
| 186Hf | ||||
| 187Hf | ||||
| 188Hf |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Корреляция между характеристиками разрушения и концентрацией валентных электронов распыленных тонких пленок на основе Hf-CN
Основные моменты
- •
Описывает влияние легирования азотом в тонких пленках HfC
- •
Описывает напыление мишени HfC в азотсодержащей атмосфере
- •
Сопоставляет характеристики разрушения и концентрацию валентных электронов
- •
Повышенная твердость и вязкость разрушения за счет добавления азота
- •
Азот снижает потерю твердости после отжига до 1200 ° C.
Реферат
Материалы твердых защитных покрытий на основе нитридов и карбидов переходных металлов обычно имеют ограниченную устойчивость к разрушению. Для дальнейшей настройки этих свойств легирование неметаллами — замена C на N — оказалось полезным для тонких пленок на основе Hf-C-N, напыленных магнетроном. Теоретически прогнозируемое увеличение концентрации валентных электронов (с 8,0 до 9,0 э / ф.е. от HfC до HfN) за счет легирования азотом приводит к увеличению вязкости разрушения (K IC , полученное во время изгиба кантилевера на сканирующем электронном микроскопе) с 1.От 89 ± 0,15 до 2,33 ± 0,18 МПа · м 1/2 для Hf 0,43 C 0,57 до Hf 0,35 C 0,30 N 0,35 соответственно. Твердость остается близкой к сверхтвердому режиму со значениями от 37,8 ± 2,1 до 39,9 ± 2,7 ГПа для этих конкретных составов. Уже добавление небольшого количества азота при распылении керамической мишени HfC приводит к резкому увеличению содержания азота в неметаллической подрешетке для однофазных структурированных пленок HfC 1-x N с ГЦК, где x = N / (C + N).Полученные здесь результаты также являются экспериментальным доказательством корреляции между характеристиками разрушения и концентрацией валентных электронов.
Ключевые слова
Hf-C-N
Устойчивость к излому
Неметаллическое легирование
Концентрация валентных электронов
Термическая стабильность
Рекомендуемые статьиЦитирующие статьи (0)
© 2020 Авторы. Опубликовано Elsevier B.V.
Рекомендуемые статьи
Цитирование статей
СПЕКТРОСКОПИЯ И ВИБРАЦИОННАЯ ПРЕДИССОЦИАЦИЯ ВЧ КОМПЛЕКСОВ VAN DER WAALS ПРИ $ v_ {HF} = 3 $ ВАЛЕНСНОЕ ВОЗБУЖДЕНИЕ
Аннотация:
Спектры $ OC-HF $ и $ OCO-HF $ наблюдались с помощью внутрирезонаторной лазерной флуоресценции для $ v_ {HF} = 3 $.{-1} $ наблюдается на втором обертоне и является одним из самых больших сдвигов, наблюдаемых до сих пор в этом типе комплекса. Разделение тяжелых атомов показывает выраженное уменьшение при валентном возбуждении, как определено по увеличению постоянной вращения на 7,44%. Вибрационная предиссоциация чрезвычайно проста на обоих уровнях, что вытекает из, по существу, лоренцевой формы линии, давая значения 12 ГГц для обертона и 5 ГГц для состояния изгиба. Спектр действия комплекса OCO-HF, пожалуй, труднее всего разгадать.{-1} $ от фундаментального, но еще не идентифицированы и вполне могут быть связаны с нелинейностью молекулярной геометрии при ВЧ валентном возбуждении. Предварительные расчеты электронной структуры показывают усиление углового барьера для линейного комплекса при $ v_ {HF} = 3 $, и в настоящее время предпринимаются попытки смоделировать потенциал как четвертый осциллятор для получения уровней энергии, что дает более четкую картину этих необъяснимых эмиссионные особенности. Кроме того, новый интерферометр Майкельсона, связанный с флуоресценцией, индуцированной внутрирезонаторным лазером, должен обеспечить новое понимание распределений вращательных состояний фотопродуктов HF после колебательной предиссоциации.
Описание:
Автор Учреждение: Гарвардский университет; Кафедра химии и химической биологии Гарвардского университета
Сколько валентных электронов в ВЧ. Фтористый водород
На этой странице представлены исчерпывающие данные о химическом элементе гафнии; включая множество свойств, названия элементов на многих языках, наиболее известные нуклиды гафния.
Общие химические соединения также предусмотрены для многих элементов. Кроме того, технические термины связаны с их определениями, а меню содержит ссылки на связанные статьи, которые очень помогают в учебе.Список справочных источников, используемых для компиляции данных, представленных в нашей периодической таблице элементов, можно найти на главной странице периодической таблицы Менделеева.
Кеннет Барбалас. Периодическая таблица элементов — гафний — Hf. Ссылка на эту страницу Если вы хотите разместить ссылку на эту страницу со своего веб-сайта, блога и т. Д.
Мы отличный образовательный ресурс!
Электрон валентности
Используйте онлайн или распечатайте страницы как раздаточные материалы в классе. Больше информации. Перейти к содержанию страницы Перейти к меню сайта на этой странице Периодическая таблица элементов Элемент Гафний — Hf На этой странице представлены исчерпывающие данные о химическом элементе гафнии; включая множество свойств, названия элементов на многих языках, наиболее известные нуклиды гафния.
Ежегодно во всем мире производится около 50 тонн. Использование гафния: используется в управляющих стержнях реактора из-за его способности поглощать нейтроны также в качестве поглотителя газа в вакуумных трубках.
Дополнительные примечания: Гафний плохо усваивается организмом. В результате отравления соединениями гафния случаются редко. Связанные ресурсы Анатомия атома Ответы на многие вопросы, касающиеся структуры атомов. Молярность, моляльность и нормальность Вводит стехиометрию и объясняет различия между молярностью, молярностью и нормальностью.
Расчеты молярной массы
и калькулятор Javascript Расчеты молярной массы объяснены, а для помощи в расчетах есть калькулятор JavaScript. База данных по химическим веществам Эта база данных посвящена наиболее распространенным химическим соединениям, используемым в быту и промышленности.
Цитирование этой страницы Если вам нужно процитировать эту страницу, вы можете скопировать этот текст: Kenneth Barbalace. Великобритания. Соединенные Штаты. Транскрипция: Привет, это доктор. Мы собираемся сделать структуру Льюиса для HF, плавиковой кислоты. Этот материал плавит стекло.Очень круто. Начните с просмотра таблицы Менделеева.
Водород находится в группе 1, поэтому у него 1 валентный электрон, а затем фтор находится в группе 7, иногда называемой 17, поэтому у него 7 валентных электронов. Один плюс 7 равняется 8.
Bhul karna prakriti hai
Итак, у нас есть всего 8 валентных электронов, с которыми мы можем работать. Итак, мы могли бы начать с рисования H, а затем F, и мы поместим электронов, которые у нас есть 8; давайте начнем складывать здесь два, соединяем H и F вместе.
И это на самом деле заполняет внешнюю оболочку водорода, которой нужно всего два.Итак, всего у нас 8, мы использовали 2, 4, 6, 8.
Письмо с предложением представителя бренда
И похоже, что у фтора их 2, 4, 6, 8, а у водорода — два. Мы удовлетворили октет и 2, 4, 6, 8; мы использовали все 8 валентных электронов. Вы также можете записать это как структурную формулу, которая будет выглядеть вот так прямо здесь, где эти два электрона будут представлены этой прямой линией, этой одинарной связью. Водород имеет 1 валентный электрон, а фтор в группе 7 с F и Cl имеет 7 валентных электронов.Со структурой Льюиса для HF помните, что водороду нужно всего 2 валентных электрона, чтобы иметь полную внешнюю оболочку.
Убедитесь, что вы не используете более 8 доступных валентных электронов. См. Большой список структур Льюиса. Открывает новое окно. Это структура Льюиса для плавиковой кислоты. Это доктор. Он изучал красящие вещества листьев и цветов и состав веществ животного происхождения. Он внес свой вклад в технологии чугуна, стали, серной кислоты, стекла, бумаги и, в частности, в омыление жиров.
Он стремился…. Фтористый водород используется для получения многих неорганических и органических соединений фтора, имеющих коммерческое значение, например, фторид натрия-алюминия Na 3 AlF 6, используемый в качестве электролита при электролитической плавке металлического алюминия.
Раствор газообразного фтороводорода в воде называется. Еще одно твердое тело с водородными связями — фтористый водород HF, в котором протон атома водорода связывает пары фторов.
Атомы водорода и фтора связаны между собой парой электронов, один электрон вносится атомом водорода, а другой — атомом фтора.Хотя электроны распределяются между атомами водорода и фтора, в….
Фтороводород Артикул. Химическое соединение фтороводорода. Поделиться Поделиться.
Валентные электроны этих металлов?
Facebook Twitter. Он стремился… Подробнее о производстве фтора. Для Fe, поскольку 3d- и 4s-электроны настолько близки по энергии, их объединение можно рассматривать как валентные электроны, и ответ должен быть 8. Это сложная идея, связанная с терминами high Спиновое или низкоспиновое железо, и это не имеет отношения к этому ответу, но и степени окисления Fe, ответ просто 8.Это означает, что у самого водорода 1 валентный электрон, а у самого фтора — 7.
Если это так, то и Hf, и Fe являются переходными металлами с переменным зарядом. Если вы запишете электронные конфигурации, у обоих есть только два электрона во внешней оболочке, но, очевидно, это не то, что ваш профессор хочет, чтобы вы сказали. Оба элемента могут использовать либо D-орбитальные электроны для помощи в связывании, либо иногда эти электроны. экранировать внешние электроны.
Это может быть любой, это просто зависит от соединения.Если я прав, я в основном внимательно отношусь к благодарности, чтобы записать переходный металл в химических уравнениях вместе с: AgCl упоминается как хлорид серебра I при условии, что переходные металлы не имеют валентности, я советую, что это относительно сложно вычислить, поэтому в качестве их валентности помещается римская цифра. Актуальные новости. Шериф: Крушение Тайгера Вудса было признано «чисто случайным».
Кейли Куоко вспоминает момент, когда партнерша по фильму ушла из «Большого взрыва». Кристи меняет мнение о Демсе: «Наука на нашей стороне».Женская татуировка приобретает новое значение в условиях пандемии.
Миллиардер о том, почему Costco представляет опасность для Amazon. AOC присоединяется к негативной реакции на лагерь для детей-мигрантов Байдена. Вудс скорее всего вернется к нормальной жизни, но не в гольф.
. Гигант электроники на Западном побережье США заявляет о своем уходе. Эти металлы меня сбивают с толку, как определить их количество? Ответить Сохранить. Любимый ответ.
2021: Валентные электроны в гафнии (Hf) [& факты, цвет, открытие …
Если это HF, то это 1 и 7, как указано ранее.То есть это даст либо 2, либо 3, либо 4.
Но, как я сказал ранее, оба элемента имеют по 2 электрона на своей внешней оболочке. Надеюсь, это поможет. Как вы относитесь к ответам? Вы можете войти, чтобы проголосовать за ответ. Остались вопросы? Получите ответы, задав вопрос прямо сейчас. В химии и физике валентный электрон — это электрон внешней оболочки, который связан с атомом и может участвовать в образовании химической связи, если внешняя оболочка не замкнута; в одинарной ковалентной связи оба атома в связи вносят вклад в один валентный электрон, чтобы образовать общую пару.
Присутствие валентных электронов может определять химические свойства элемента, такие как его валентность — может ли он связываться с другими элементами, и если да, то насколько легко и с каким количеством.
Таким образом, реакционная способность данного элемента сильно зависит от его электронной конфигурации. Для элемента основной группы валентный электрон может существовать только во внешней электронной оболочке; для переходного металла валентный электрон также может находиться во внутренней оболочке. Атом с замкнутой оболочкой из валентных электронов, соответствующей электронной конфигурации s 2 p 6 для элементов основной группы или d 10 s 2 p 6 для переходных металлов, имеет тенденцию быть химически инертным.Атомы с одним или двумя валентными электронами больше, чем закрытая оболочка, обладают высокой реакционной способностью из-за относительно низкой энергии для удаления лишних валентных электронов с образованием положительного иона.
Атом с одним или двумя электронами меньше, чем закрытая оболочка, является реактивным из-за его тенденции либо получить недостающие валентные электроны и сформировать отрицательный ион, либо разделить валентные электроны и сформировать ковалентную связь. Подобно ядру электрона валентный электрон имеет способность поглощать или выделять энергию в виде фотона.Увеличение энергии может заставить электрон перейти на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из оболочки связанного с ним атома; это ионизация с образованием положительного иона.
Когда электрон теряет энергию, вызывая излучение фотона, он может перемещаться во внутреннюю оболочку, которая не полностью занята. Электроны, которые определяют валентность — то, как атом химически реагирует, — обладают самой высокой энергией.
Для элемента основной группы валентные электроны определяются как электроны, находящиеся в электронной оболочке с наивысшим главным квантовым числом n.Например, электронная конфигурация фосфора P равна 1s 2 2s 2 2p 6 3s 2 3p 3, так что имеется 5 валентных электронов 3s 2 3p 3, что соответствует максимальной валентности для P, равной 5, как в молекуле PF 5; эта конфигурация обычно сокращается до [Ne] 3s 2 3p 3, где [Ne] обозначает остовные электроны, конфигурация которых идентична конфигурации благородного газа неона.
Например, марганец Mn имеет конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5; это сокращенно [Ar] 4s 2 3d 5, где [Ar] обозначает конфигурацию ядра, идентичную конфигурации благородного газа аргона.В этом атоме 3d-электрон имеет энергию, аналогичную энергии 4s-электрона и намного выше, чем у 3s- или 3p-электрона.
Чем дальше вправо в каждой серии переходных металлов, тем ниже энергия электрона в d подоболочке и тем меньше у такого электрона валентных свойств. Таким образом, хотя атом никеля в принципе имеет десять валентных электронов 4s 2 3d 8, его степень окисления никогда не превышает четырех.
Для цинка подоболочка 3d является полной во всех известных соединениях, хотя она вносит вклад в валентную зону в некоторых соединениях.Подсчет d-электронов — альтернативный инструмент для понимания химии переходного металла. Число валентных электронов элемента можно определить по вертикальному столбцу группы периодической таблицы, в котором этот элемент отнесен к категории.
За исключением групп 3-12, переходные металлы. Цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце. Гелий является исключением: несмотря на то, что он имеет конфигурацию 1s 2 с двумя валентными электронами и, таким образом, имеет некоторое сходство с щелочноземельными металлами с их конфигурациями валентности ns 2, его оболочка полностью заполнена и, следовательно, он химически очень инертен и обычно помещается в группа 18 с другими благородными газами.
Валентная оболочка — это набор орбиталей, которые энергетически доступны для принятия электронов с образованием химических связей. Для элементов основной группы валентная оболочка состоит из ns- и np-орбиталей во внешней электронной оболочке. В случае переходных металлов n-1 d орбитали и лантаноиды и актиниды n-2 f и n-1 d орбитали, участвующие орбитали также могут находиться во внутренней электронной оболочке. Таким образом, терминология оболочки является неправильной, поскольку нет соответствия между валентной оболочкой и какой-либо конкретной электронной оболочкой в данном элементе.
С научной точки зрения правильным термином будет валентная орбиталь для обозначения энергетически доступных орбиталей элемента. Как правило, элемент основной группы, за исключением водорода или гелия, имеет тенденцию реагировать с образованием электронной конфигурации s 2 p 6. Эта тенденция называется правилом октетов, потому что каждый связанный атом имеет 8 валентных электронов, включая общие электроны.
Точно так же переходный металл имеет тенденцию реагировать с образованием электронной конфигурации d 10 s 2 p 6. Эта тенденция называется электронным правилом, потому что каждый связанный атом имеет 18 валентных электронов, включая общие электроны.Количество валентных электронов в атоме определяет его связывающее поведение. Следовательно, элементы, атомы которых могут иметь одинаковое количество валентных электронов, сгруппированы вместе в периодической таблице элементов.
Самый реактивный вид металлического элемента — это щелочной металл группы 1 е. Щелочноземельный металл группы 2 е. Да, мед и кленовый сироп действительно содержат сахар, но сахар, который они содержат, — это фруктоза, сахар фруктов, который не является рафинированным сахаром и не считается вредным для здоровья.Должен сказать, что я предпочел рецепт bbcgoodfood БЕЗ САХА И ЖИРА. Углеводы — это сахар, крахмал (сложный углевод) или клетчатка. Можете ли вы подсказать, что я сделал не так?
Большое спасибо Кэтрин Дэвис Привет, Кэтрин, спасибо, что связались. Какой рецепт вы использовали для лепешек? Технические советы, плагины WordPress, настройки WordPress и технические советы по созданию лучшего блога. Мы получили много запросов на написание пошагового руководства по созданию простого магазина WordPress.
Многие из этих запросов поступили от новых блоггеров, которые только что настроили свой сайт WordPress, чтобы попытаться заработать на своем блоге дополнительные деньги, продавая небольшое количество продуктов. В этом руководстве Питер и Кейт покажут вам, как настроить базовый магазин WordPress с помощью WordPress и бесплатной простой корзины покупок WP.
Теперь мне нужно найти способ интегрировать это с системой управления запасами, чтобы продукты автоматически добавлялись в магазин без необходимости добавлять их явно.
Главная О проектах Все проекты Simple WP Shopping Cart WP Security and Firewall Plugin WP Download Monitor WP eStore Plugin WP Affiliate Platform WP eMember WP PDF Stamper WP Lightbox Ultimate WP Photo Seller Products Все продукты Условия оформления заказа Политика конфиденциальности Портал поддержки Портал поддержки Только для клиентов Форум WP eStore Documentation WP Affiliate Software Documentation WP eMember Documentation Affiliates Affiliate Program Affiliate Registration Affiliate Login Contact Как легко создать простой интернет-магазин WordPress бесплатно Последнее обновление: 6 января 2017 г.Мы получили много запросов, чтобы написать пошаговое руководство по как создать простой магазин WordPress.
В рубрике: Советы администратора магазина, WordPress С тегами: Создание магазина WordPress, электронная коммерция, электронная коммерция, инструкции, продажа в Интернете, электронная коммерция wordpress, магазин WordPress, магазин WordPress Полезные ресурсы Хостинг WordPress для малого бизнеса Бесплатные плагины WordPress Премиум плагины WordPress Комментарии (5 ответов) Праш Сака говорит: Спасибо за руководство.
Вы упростили создание интернет-магазина на wordpress. В любом случае это действительно хорошая информация. Джули говорит: Спасибо, полезная информация о том, как создать собственный интернет-магазин.Если у вас есть сайт WordPress, и вы хотите постоянно прилагать усилия для улучшения своего сайта, не стесняйтесь подписываться и следите за обновлениями для получения отличного контента.
ПодробнееНаши проекты Если вы хотите продать что-то со своего сайта WordPress, то, скорее всего, у нас есть простое в использовании и простое решение для вас. У нас есть ряд плагинов WordPress, которые помогут вам принимать деньги от клиентов и превратить ваш сайт в платформу электронной коммерции.
ПодробнееНаши клиенты любят ваше программное обеспечение для WordPress во многом потому, что оно не только хорошо работает, но и у вас есть точные и простые инструкции.
Огромный привет команде Tips and Tricks за предоставление самых фантастических, простых в использовании и надежных плагинов для WordPress. Рад, что нашел твои вещи. Готовы ли вы к этому.
У нас есть БОЛЬШАЯ коллекция советов и указателей, которые помогут вам освоить маркетинг и рекламу в Facebook, один из самых эффективных способов маркетинга в социальных сетях. Не знаю, как размещать рекламу на Facebook. Пройдя через обручи, пытаясь получить мои данные.
Химическое соединение: HF Lewis Structure
Рекомендуется только тем потребителям, которые будут часто использовать приложение.Но букмекерская контора, главным исполнительным директором которой является г-жа Коутс, отказалась удовлетворить ставку. Понятно, что мисс Макканн категорически отрицает любые проступки. На следующий день ей позвонил другой сотрудник и задал ряд вопросов.
Деньги так и не материализовались.
Как вывести микотоксины из организма
Она сделала ставку с вашим клиентом. Она имеет право на свой выигрыш. После возбуждения судебного иска компания выплатила полную сумму.
Мисс Макканн наняла того же адвоката Эндрю Монтегю, который представлял Керли, чтобы вести ее дело.Мы не готовы давать дальнейшие комментарии, пока продолжается судебный процесс. 49-летняя госпожа Коутс, мать пятерых детей, открыла бизнес вместе со своим братом Джоном Коутсом.
Отец г-жи Коутс Питер — председатель футбольного клуба Сток-Сити. Предполагаемый отказ букмекерских компаний выполнять ставки в настоящее время является предметом совместного расследования Комиссии по азартным играм и Управления по конкуренции и рынкам. Сайт на сайте Bet365, сайт www. Пада halaman Anda akan menemukan link resmi untuk alternatif akses yang disediakan oleh Tim Bet365, hanya sehingga Anda akan tahu Anda menemukan sebuah situs palsu.
Pilihan янь diusulkan untuk taruhan berlimpah, termasuk гандикап Азии, ян тидак biasa untuk taruhan Eropa. Керагаман тарухан пада Ставка на азиатский гандикап 365 bahkan melampaui Sportsbooks Азия sebagai SBOBET дан 188BET.
Keuntungan utama dengan situs yang taruhan paling dikenal di antara pemain bertaruh, янь diwakili mengesankan baik.
Menutupi bahkan jenis kurang populer dari disiplin ilmu olahraga dan permainan dari segala macam liga sepak bola dan turnamen.
