Содержание
Формулы химические простейшие — Справочник химика 21
Формульная единица Группа атомов или ионов, представленных химической формулой вещества. Простейшая единица ионного соединения [c.548]
Вывод простейшей (эмпирической) формулы химического соединения [c.16]
Формулы химических соедине пгй подразделяют на простейшие, или эмпирические, и истинные, или молекулярные. Для вывода простейшей формулы достаточно определить экспериментально качественный и количественный состав вещества и знать атомные массы входящих в него элементов. Для вывода истинной формулы кроме состава вещества необходимо знать и его молекулярную массу. [c.23]
В учении о составе химических соединений основное понятие — формула химического соединения. Какие атомы составляют молекулу соединения, показывает простейшая формула. Ее можно получить из данных химического анали- [c. 7]
7]
Химические формулы расположены в порядке латинского алфавита. Рядом с формулами указаны порядковые номера рубрик. Приведены формулы веществ, простых и комплексных анионов. Формулы распространенных анионов Вг , С -, СО , СГ, Г, Н, Г, N , N05. О , 0 , ОН, PO . S , SO не представлены из-за многочисленности их соединений.) [c.467]
Химическая формула выражает качественный и количественный состав вещества и показывает соотношение между атомами этого вещества. Для определения формулы необходимо проанализировать соединение, установить, какие элементы и в каком количестве входят в его состав. Зная атомные массы этих элементов, можно найти соотношение атомов в молекуле и определить формулу. Такую формулу называют простейшей, или эмпирической, а соответствующую ей молекулярную массу — формульной. Она не отражает истинного состава молекулы. [c.51]
Установите простейшую формулу химического соединения, зная массовые доли составляющих его элементов 8 — 40%, О — 60%. [c.13]
[c.13]
Простые вещества. Химические формулы простых веществ записываются символом соответствующего химического элемента с указанием числа атомов с помощью подстрочных индексов (индекс 1 в формулах одноатомных простых веществ не ставится). Систематические названия простых веществ строятся из названий химических элементов с указанием числа их атомов с помощью латинских приставок (приставка моно- иногда опускается), например [c.188]
В учении о с о с т а в е. химических соединений основное понятие формула химического соединения. Какие атомы составляют молекулу соединения, показывает простейшая формула. Ее можно получить из данных химического Анализа. Истинная формула отражает численное соотношение этих атомов и следует из данных о молекулярной массе соединения. [c.7]
Установление простейших и истинных формул химических соединений [c.14]
ФОРМУЛА ХИМИЧЕСКАЯ — условная запись буквами латинского алфавита и числовыми индексами состава химического соединения или простого вещества. Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]
Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]
Формулы. Химическая формула сложного вещества включает в себя катион (условно электроположительную составляющую) и анион (условно электроотрицательную составляющую). Катион всегда ставится в формуле на первое место (слева), ашон — на второе. Катионы и анионы могут быть простыми и сложными и содержать металлические и неметаллические элементы. [c.7]
Формула химического соединения показывает его состав и количественное соотношение между атомами. Формулы, в которых соотношения между количествами атомов выражаются наименьшими целыми числами, называются простейшими формулами. Атомные массы элементов и молекулярные массы химического соединения выражаются в углеродных единицах (у. е.). Углеродной единицей условно названа V12 массы атома изотопа углерода С. [c.9]
Несмотря иа то что у атома кремния строеипе внешней электронной оболочки такое же, как у атома углерода, в химии этих двух элементов мало сходства. Действительно, хотя структура элементного кремния такая же, как одной из модификаций углерода— алмаза, а также соблюдается соответствие формул некоторых простейших соединений кремния и углерода, однако в химических и физических свойствах соединений этих элементов редко наблюдается большое сходство. Поскольку кремний бо-. (ее электроположителен, чем углерод, со многими металлами он образует соединения, которые имеют строение, типичное длл сплавов (разд. 23.4), и некоторые из них имеют ту же структуру, что и соответствующие бориды. Фактически кремний во-многом больше напоминает бор, чем углерод, хотя формулы соединений кремния и бора обычно совершенно различны. Некоторые из таких параллелей в химии кремния и бора рассмотрены в начале следующей главы. Силициды ио своему строению мало ио.хожи па карбиды, по весьма сходны с боридами например, -)то проявляется в образовании каркасов из атомов 51 (В), хотя немногие силициды н бориды действительно пзоструктурны. [c.88]
Действительно, хотя структура элементного кремния такая же, как одной из модификаций углерода— алмаза, а также соблюдается соответствие формул некоторых простейших соединений кремния и углерода, однако в химических и физических свойствах соединений этих элементов редко наблюдается большое сходство. Поскольку кремний бо-. (ее электроположителен, чем углерод, со многими металлами он образует соединения, которые имеют строение, типичное длл сплавов (разд. 23.4), и некоторые из них имеют ту же структуру, что и соответствующие бориды. Фактически кремний во-многом больше напоминает бор, чем углерод, хотя формулы соединений кремния и бора обычно совершенно различны. Некоторые из таких параллелей в химии кремния и бора рассмотрены в начале следующей главы. Силициды ио своему строению мало ио.хожи па карбиды, по весьма сходны с боридами например, -)то проявляется в образовании каркасов из атомов 51 (В), хотя немногие силициды н бориды действительно пзоструктурны. [c.88]
Структурная формула, которой мы пользуемся, определяет расположение и характер химических схзязей. Допустим, функция отображает расположение и характер химических связей и определяет структурную формулу но просто суммировать, складывать квадраты ф-функций мы пе можем, так же х ак не можем производить арифметические действия (например, сложение) со структурными формулами. Чтобы второе равенство было справедливым, нужно добавить к нему третий член, который пе соответствует никакой структурной формуле. [c.130]
Допустим, функция отображает расположение и характер химических связей и определяет структурную формулу но просто суммировать, складывать квадраты ф-функций мы пе можем, так же х ак не можем производить арифметические действия (например, сложение) со структурными формулами. Чтобы второе равенство было справедливым, нужно добавить к нему третий член, который пе соответствует никакой структурной формуле. [c.130]
Таким образом, метод полностью параметризован все входящие в расчет величины (а, р, и др.) суть параметры, определяемые по экспериментальным данным. Интегралы перекрывания базисных орбиталей либо считаются одними и теми же для соответствующих эквивалентных пар атомов, например 5 для всех пар соседних атомов углерода, либо просто полагаются равными нулю. Подобная параметризация автоматически учитывает симметрию задачи (для эквивалентных по симметрии атомов и пар атомов, очевидно, вводятся одинаковые матричные элементы) и учитывает последовательность расположения атомов сопряженного фрагмента, поскольку понятие соседние атомы либо целиком опирается на классическую формулу химического строения молекулы, либо использует структурные данные о равновесной геометрической конфигурации молекулы. [c.368]
[c.368]
По определению грамм-эквивалентом называется весовое количество вещества, химически эквивалентное 1 г Н , 8 г кислорода, 35,45 г хлора или просто одному молю (6,023 10 ) электронов в зависимости от того, в реакции какого типа участвует данное вещество. Нам придется сталкиваться с двумя понятиями, одним из которых является грамм-эквивалент, а другим число эквивалентов. Это совершенно аналогично тому, как пользуются понятиями молекулярный вес и число молей. Однако с молекулярными весами путаницы не возникает, поскольку налицо имеется формула химического вещества. В отличие от этого грамм-эквиваленты определяются по конкретной химической формуле, но зависят и от того, в реакции какого типа участвует данное вещество. [c.205]
Во-первых, применение рациональной номенклатуры позволяет не приводить в таблицах формул химического строения углеводородов. При использовании названий углеводородов, ие связанных простыми однозначными правилами с их строением (так называемых произвольных или тривиальных названий), пришлось бы наряду с названием приводить формулу химического строения, что потребовало бы значительного дополнительного объели. [c.6]
[c.6]
Химические формулы. Химическими формулами пользуются для обозначения состава простых и сложных веществ. Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы. Например, формула N2 показывает, что молекула азота состоит из двух атомов азота aS04 — в молекуле сульфата кальция содержится один атом кальция, один атом серы и четыре атома кислорода. [c.27]
Обычно в любой программе при изложении содержания тем подробно перечисляются законы, понятия и т. д., но при этом отсутствует упоминание о деятельности, которую должны осуществлять ученики. Выше уже говорилось, что в содержание должен входить опыт деятельности. Например, в программе написано Химические формулы , но не сказано, что нужно делать, чтобы химические формулы были усвоены учащимися. Предполагается, что об этом писать не надо, учитель сам поймет, что с ними надо делать. Но, действительно, что Просто выучить определение химической формулы и изложить его учителю, или научиться узнавать химическую формулу, писать формулы, или просто принять к сведению, что они существуют Программа должна определять и уровень усвоения понятия. Это крайне важно еще и потому, что только в деятельности осуществляется воспитание и развитие детей. Если бы было написано еще Составление химических формул веществ, состоящих из двух элементов, на основе их валентности , то тогда было бы понятно, чего добиваться от учащихся. Этот недостаток некоторые составители программ стараются устранить, введя особый раздел в конце каждого год обучения Требования к результатам обучения , но этот раздел мы находим далеко не во всех программах. Его отсутствие в последнее время объясняется еще и тем, что проводилась работа по разработке Государственного Стандарта образования, где нашли отражение эти результаты, но в настоящее время работа над Стандартом временно приостановлена. [c.39]
Это крайне важно еще и потому, что только в деятельности осуществляется воспитание и развитие детей. Если бы было написано еще Составление химических формул веществ, состоящих из двух элементов, на основе их валентности , то тогда было бы понятно, чего добиваться от учащихся. Этот недостаток некоторые составители программ стараются устранить, введя особый раздел в конце каждого год обучения Требования к результатам обучения , но этот раздел мы находим далеко не во всех программах. Его отсутствие в последнее время объясняется еще и тем, что проводилась работа по разработке Государственного Стандарта образования, где нашли отражение эти результаты, но в настоящее время работа над Стандартом временно приостановлена. [c.39]
Химическая формула сложного вещества отражает, помимо его элементного состава, количественные соотношения между числом атомов различных элементов в молекуле, например вода — Н2О, оксид фосфора (V) — Р2О5, сахароза — С,2Н220,, и т. д. Для твердых веществ, представляющих собой молекулярные ассоциаты или агрегаты, в химических формулах учитывается простейшее сочетание их атомов, например ЫаС1. [c.11]
[c.11]
В первой главе были выведены основные формулы для простых рециркуляционных процессов, когда в одной среде (в одном реакторе) проводится одна нли несколько параллельно или последовательно протекающих химических реакций. Сопряженно работающие системы, в которых одновременно в разных реакторах проводятся различные взаимосвязанные процессы, как, например, в комбинированных системах, ранее не рассматривались. [c.35]
При сопоставлении таких картин с классическими представлениями о химических связях между определенными парами атомов в частице возникает следующая альтернатива. Либо, оставляя содержание представления о химической связи таким по смыслу, каким оно было в классической теории, отображающим только парные взаимодействия атомов,— рассматривать его как ограниченное, пригодное для описания только тех частиц, где картина распределения электронной плотности имеет максимальные значения, расположенные приблизительно на отрезках прямых, соединяющих некоторые пары ядер , и непригодное для отображения строения других частиц (или других состояний частиц), где такой простой картины нет. Либо необходимо обобщить представление классической теории о химической связи, не связывать его с попарными взаимодействиями атомов, ввести представление о возможности химической связи сразу между группой атомов (трех, четырех и т. д.), причем такой химической связи , которая не может быть представлена как совокупность попарных взаимодействий. В этом последнем случае пришлось бы выработать новые способы изображения химического строения таких частиц с помощью формул строения, так как язык классических формул химического строения позволяет отображать только попарные взаимодействия атомов (с помощью черточек между символами соответствующей пары атомов). [c.124]
Либо необходимо обобщить представление классической теории о химической связи, не связывать его с попарными взаимодействиями атомов, ввести представление о возможности химической связи сразу между группой атомов (трех, четырех и т. д.), причем такой химической связи , которая не может быть представлена как совокупность попарных взаимодействий. В этом последнем случае пришлось бы выработать новые способы изображения химического строения таких частиц с помощью формул строения, так как язык классических формул химического строения позволяет отображать только попарные взаимодействия атомов (с помощью черточек между символами соответствующей пары атомов). [c.124]
В ряде случаев химические формулы указывают лишь соотношение между числом атомов различных элементов, входящих в молекулу, а не абсолютное число их. Такие формулы называются простейшими или эмпирическими. [c.53]
Формулы молекул простых веществ образованы одинаковыми химическими знаками, так как они состоят из атомов одного я того же элемента Нг (молекула водорода), N2 (молекула азота) СЬ (молекула хлора), О2 (молекула кислорода) и т.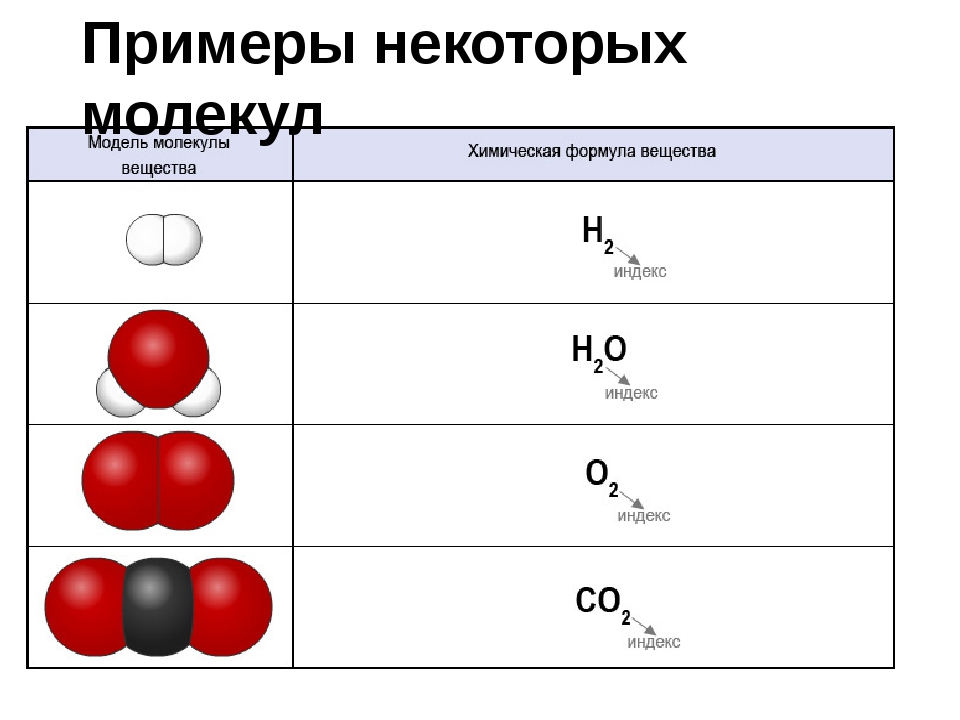 д. [c.43]
д. [c.43]
Относительной молекулярной массой, или просто молекулярной массой, вещества называется масса его молекулы, выраженная в атомных единицах массы, и обозначается М . Зная формулу химического вещества, его относительную молекулярную массу можно определить как сумму относительных атомных масс элементов, входящих в состав молекулы данного вещества. Например A1ai,(soj, = = 2, 27 + 3 32 + 12 16 = 342. [c.16]
Такие вещества получили название структурных изомеров. Простейшими структурными изомерами являются, например, углеводородын-бутан и 2-метилпропан. Порядок химической связи в этих углеводородах отображается следующими формулами химического строения [c.29]
Прежде чем перейти к номенклатуре неорганических веществ, напомним, что состав вещества отображается с помощью химической формулы. Химическая формула отображает атомы каких видов и в каких количественных соотношениях составляют вещество. Соотношение количеств атомов каждого вида обозначается индексом (вообще, химическая формула — это более общее понятие, включающее брутто-формулу, струетурную, графическую и т. д., но об этом будет сказано позже, в разделе, посвященном химической связи). Так, химическая формула Н 80з отображает, что вещество содержит атомы трех химических элементов — водорода Н, серы 8, кислорода О. На один аггом серы приходится 2 атома водорода и 3 атома кислорода. Если вещество имеет молекулярное строение, то формула должна отображать количество атомов каждого вида в молекуле. Например, химическая формула показывает, что молекула кислорода состоит из двух атомов. По составу все вещества делятся на простые и сложные. [c.9]
д., но об этом будет сказано позже, в разделе, посвященном химической связи). Так, химическая формула Н 80з отображает, что вещество содержит атомы трех химических элементов — водорода Н, серы 8, кислорода О. На один аггом серы приходится 2 атома водорода и 3 атома кислорода. Если вещество имеет молекулярное строение, то формула должна отображать количество атомов каждого вида в молекуле. Например, химическая формула показывает, что молекула кислорода состоит из двух атомов. По составу все вещества делятся на простые и сложные. [c.9]
К сложным относят удобрения, содержащие несколько элементов питания,, в максимальной степени освобожденные от посторонних примесей н составляющие единый заводской продукт. Часто такое удобрение можно выразить химической формулой. Примером простейшего сложного удобрения является калийная селитра KNO3— соль, содержащая два элемента питания растений азот и калий. [c.476]
Количество химически связанной воды в гидратах может быть весьма различным и приведенные формулы соответствуют простейшим из возможных соединений. Следует имегь в виду, что процесс гидратации совершенно безводных окислов протекает весьма медленно. У кварца, т. е. кристаллической модификации двуокиси кремния, этот процесс настолько длителен, что им вообще можно пренебречь. Гидраты окислов кремния и германия представляют собой типичные амфотерные соединения, которые незначительно, диссоциируют как по кислотному, так и по основному типу, по кислотному типу [c.93]
Следует имегь в виду, что процесс гидратации совершенно безводных окислов протекает весьма медленно. У кварца, т. е. кристаллической модификации двуокиси кремния, этот процесс настолько длителен, что им вообще можно пренебречь. Гидраты окислов кремния и германия представляют собой типичные амфотерные соединения, которые незначительно, диссоциируют как по кислотному, так и по основному типу, по кислотному типу [c.93]
Химические формулы расположены в порядке латниского алфавита. Рядом с формулами указаны порядковые номе м рубртс. Приведены формулы веществ, простых и комплексных анионов. Формулы распространенных анионов ВГ, с «, СО , СГ, р-, Н . Г. N . N03, О «, О . ОН», P0 , 8 . 80 не представлены из-за многочисленности их соединений.) [c.467]
Замещение катионов с образованием заряженных слоев. Еслн в электрически нейтральном слое Mg l2 часть Mg + замешена па Ка+, слой становится отрицательно заряженным. Напротив, при частичном замещении M. g + в слое Mg(0H)2 на АГ+ слон заряжается положительно. Слои таких двух типов совместно могут образовать структуру, в которой чередуются отрицательно и положительно заряженные слои (см. ниже схему а). Слои распространяются по всему кристаллу, химическая формула которого просто соответствует составу повторяющихся слоев. Другая возможность — чередование заряженных слоев с противоположно заряженными дискретными ионами (а также н молекулами воды, если необходимо заполнить остаточное свободное пространство), как это изображено на схемах б и в [c.313]
g + в слое Mg(0H)2 на АГ+ слон заряжается положительно. Слои таких двух типов совместно могут образовать структуру, в которой чередуются отрицательно и положительно заряженные слои (см. ниже схему а). Слои распространяются по всему кристаллу, химическая формула которого просто соответствует составу повторяющихся слоев. Другая возможность — чередование заряженных слоев с противоположно заряженными дискретными ионами (а также н молекулами воды, если необходимо заполнить остаточное свободное пространство), как это изображено на схемах б и в [c.313]
В первой главе нами были выведены основные формулы для простых рециркуляцигнных процессов, когда в одной среде (в одном реакторе) проводится одна или несколько параллельно или последовательно протекающих химических реакций. Сопряженно работающие системы характеризуются тем, что в ряде реакторов одновременно проводятся различные процессы, связанные между собой либо источником сырья, либо последующим использованием отходящих продуктов и представляют онг собой комплексные процессы. В этих системах вопросы рецир-кул>щии принимают более сложный характер. [c.29]
В этих системах вопросы рецир-кул>щии принимают более сложный характер. [c.29]
Фактически пренебрежения, которые нужно сделать в операторе Н, чтобы представить его как сумму операторов //(/) (без чего рассматриваемое приближение не проходит), диктуются ни какими-либо квантово-механическими соображениями, а просто постулируются, исходя из классической формулы химического строения и произвольного постулата о том, что на ординарную химическую связь приходится два локализованных влектрона. [c.81]
Неудовлетворительность методов определения атомных весов, приводившая химиков к различным результатам, породила сомнение в достоверности определений атомных весов и даже в возможности подобных определений [11, с. 173]. Это привело к предложению вместо атомных весов в формулах химических соединений применять эквивалентные веса (или просто эквиваленты, пропорциональные числа, паи и т. п.), выражающие лишь равные по химическому значению (например, до способности соединяться с одной весовой частью водорода) весовые количества элементов.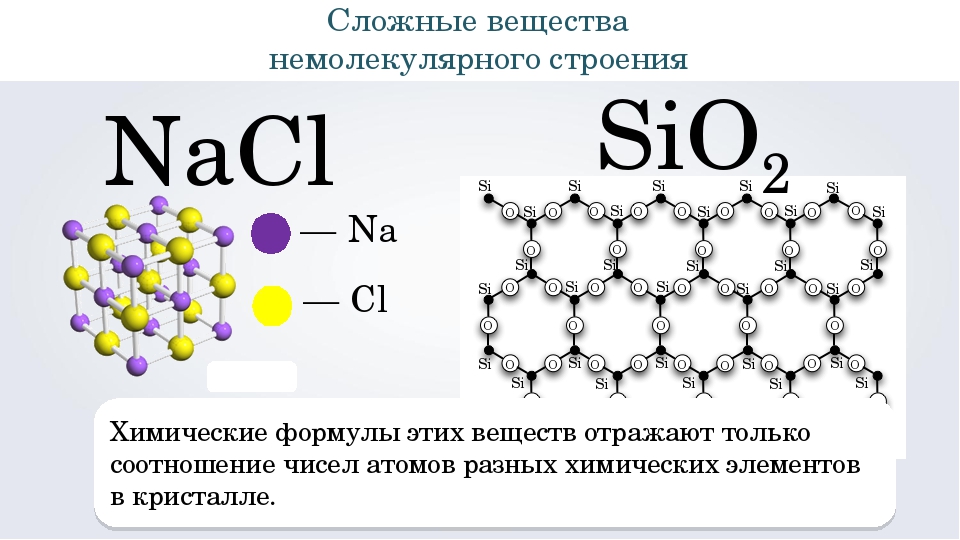 Но и здесь не обошлось без известной неноследовательности, потому что если эквивалент кислорода принимается равным 8, то эквивалент [c.19]
Но и здесь не обошлось без известной неноследовательности, потому что если эквивалент кислорода принимается равным 8, то эквивалент [c.19]
Двухатомные молекулы. Типы связей, преобладающие в органических соединениях, присутствуют также в некоторых простейших природных соединениях, химически активных газообразных элементах водороде, кислороде, фторе, хлоре и азоте. В противоположность инертным газам, у которых наименьшими устойчивыми частицами являются атомы, эти реактивные элементы существуют в виде крошечных частиц, состоящих из двух ядер и такого количества электронов, которое необходимо, чтобы сделать частицу нейтральной. Формулы химических соединений, в виде которых они существуют, таковы Н , О , Р , С12 и Эти незаряженные неионные частицы, образующие наименьшие стабильные единицы упо.мянутых элементов, называются молекилами. Так как они состоят из двух ядер, их иногда называют двухатомными молекулами. [c.51]
Химические формулы веществ — Основы химии на Ида Тен
Содержание статьи
Что такое химическая формула?
В любой науке есть своя система обозначений. Химия в этом плане не исключение. Вам уже известно, что для обозначения химических элементов используются символы, образованные от латинских названий элементов. Химические элементы способны образовывать как простые, так и сложные вещества, состав которых можно выразить химической формулой.
Химия в этом плане не исключение. Вам уже известно, что для обозначения химических элементов используются символы, образованные от латинских названий элементов. Химические элементы способны образовывать как простые, так и сложные вещества, состав которых можно выразить химической формулой.
Чтобы написать химическую формулу простого вещества необходимо записать символ химического элемента, который образует простое вещество, и справа внизу записать цифру, показывающую количество его атомов. Данная цифра называется индексом.
Например, химическая формула кислорода – О2. Цифра 2 после символа кислорода – это индекс, указывающий, что молекула кислорода состоит из двух атомов элемента кислорода.
Индекс – число, показывающее в химической формуле количество атомов определенного типа Чтобы написать химическую формулу сложного вещества, необходимо знать, из атомов каких элементов оно состоит (качественный состав), и число атомов каждого элемента (количественный состав).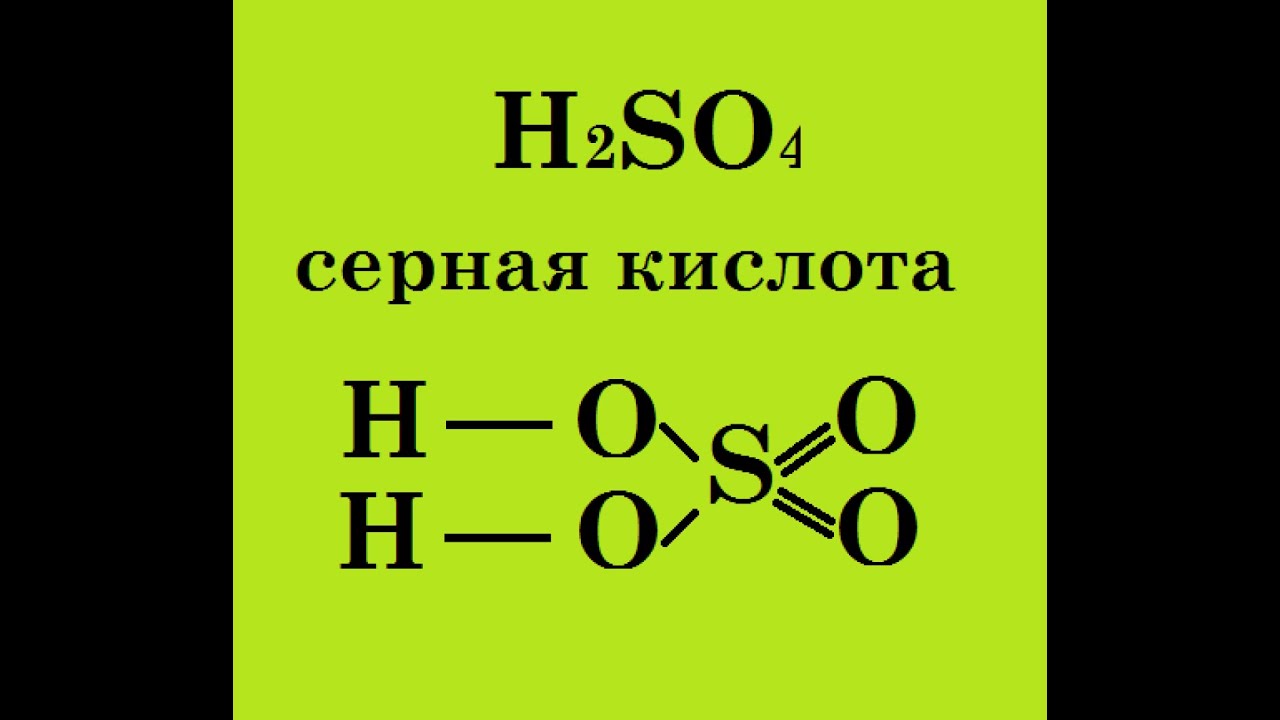
Например, химическая формула пищевой соды – NaHCO3. В состав этого вещества входят атомы натрия, водорода, углерода, кислорода – это его качественный состав. Атомов натрия, водорода, углерода по одному, а атомов кислорода – три. Это количественный состав соды
- Качественный состав вещества показывает, атомы каких элементов входят в его состав
- Количественный состав вещества показывает количество атомов, которые входят в его состав
Химическая формула – условная запись состава вещества при помощи химических символов и индексов
Обратите внимание на то, что если в химической формуле присутствует только один атом одного вида, индекс 1 не ставится. Например, формулу углекислого газа записывают так – CO2, а не С1О2.
Как правильно понимать химические формулы?
При записи химических формул нередко встречаются цифры, которые записывают перед химической формулой.
Например, 2Na, или 5О2. Что обозначают эти цифры и для чего они нужны? Цифры, записанные перед химической формулой, называют коэффициентами.
Коэффициенты показывают общее количество частиц вещества: атомов, молекул, ионов.
Коэффициент – число, которое показывает общее количество частиц.
Коэффициент записывается перед химической формулой вещества молекул кислорода. Обратите внимание, что молекулы не могут состоять из одного атома, минимальное количество атомов в молекуле – два.
- Таким образом, записи: 2Н, 4P обозначают два атома водорода и четыре атома фосфора соответственно.
- Запись 2Н2 обозначает две молекулы водорода, содержащие по два атома элемента водорода.
- Запись 4S8 – обозначает четыре молекулы серы, каждая из которых содержит восемь атомов элемента серы.
- Подобная система обозначений количества частиц используется и для ионов.
 Запись 5K+ обозначает пять ионов калия.
Запись 5K+ обозначает пять ионов калия.
Стоит отметить, что ионы могут быть образованы не только атомом одного элемента.
- Ионы, образованные атомами одного химического элемента, называют простыми: Li+, N3−.
- Ионы, образованные несколькими химическими элементами, называют сложными: OH⎺, SO4 2−. Обратите внимание, что заряд иона обозначают верхним индексом.
А что будет обозначать запись 2NaCl?
Если на этот вопрос ответить – две молекулы поваренной соли, то ответ не правильный. Поваренная соль, или хлорид натрия, имеет ионную кристаллическую решетку, то есть это ионное соединение и состоит из ионов Na+ и Сl⎺. Пару этих ионов называют формульной единицей вещества. Таким образом, запись 2NaCl обозначает две формульных единицы хлорида натрия. Термин формульная единица используют так же и для веществ атомного строения.
Формульная единица – наименьшая частица вещества немолекулярного строения Ионные соединения так же электронейтральны, как и молекулярные. Значит, положительный заряд катионов полностью уравновешен отрицательным зарядом анионов. Например, какова формульная единица вещества, состоящего из ионов Ag+ и PO4 3−? Очевидно, что для компенсации отрицательного заряда иона (заряд –3), необходимо иметь заряд +3. С учетом того, что катион серебра имеет заряд +1, то таких катионов понадобиться три. Значит формульная единица (формула) данного вещества – Ag3PO4.
Таким образом, при помощи символов химических элементов, индексов и коэффициентов, можно четко составить химическую формулу вещества, которая даст информацию, как о качественном, так и о количественном составе вещества.
В завершение рассмотрим, как правильно произносить химические формулы. Например, запись 3Ca2+ произносится: «три иона кальций два плюс» или «три иона кальция с зарядом два плюс». Запись 4НСl, произносится «четыре молекулы аш хлор». Запись 2NaCl, произносится как «две формульных единицы хлорида натрия».
Запись 4НСl, произносится «четыре молекулы аш хлор». Запись 2NaCl, произносится как «две формульных единицы хлорида натрия».
Закон постоянства состава вещества
Одно и то же химическое соединение можно получить различными способами. Так, например, углекислый газ, CO2, образуется при сжигании топлива: угля, природного газа. Во фруктах содержится много глюкозы. При длительном хранении фрукты начинают портиться, начинается процесс, называемый брожением глюкозы, в результате которого выделяется углекислый газ.
Углекислый газ образуется и при нагревании таких горных пород, как мел, мрамор, известняк. Химические реакции совершенно разные, но вещество, образовавшееся в результате их протекания, имеет одинаковый качественный и количественный состав – CO2.
Эта закономерность касается, в основном, веществ молекулярного строения. В случае веществ немолекулярного строения, возможны случаи, когда состав вещества зависит от методов его получения.
Закон постоянства состава веществ молекулярного строения: состав сложного вещества всегда одинаков и не зависит от способа его получения
Итог статьи по теме Химические формулы веществ:
- Индекс – число, показывающее в химической формуле количество атомов определенного типа
- Качественный состав вещества показывает, атомы каких элементов входят в его состав
- Количественный состав вещества показывает количество атомов, которые входят в его состав
- Химическая формула – условная запись состава вещества при помощи химических символов и индексов (если нужно)
- Коэффициент – число, которое показывает общее количество частиц. Коэффициент записывается перед химической формулой вещества
- Формульная единица – наименьшая частица вещества атомного или ионного строения
Урок 5. Химическая формула – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Химические формулы.
Как составлять формулы химических соединений? Предлалагаем посмотреть следующий видеоролик.
Формула простого вещества (элемента) или соединения, существующих в форме молекул, состоит из символов одного или нескольких элементов, входящих в молекулу, и указывает число атомов каждого элемента в одной молекуле. Такая разновидность химической формулы называется молекулярной формулой. Например, одна молекула кислорода содержит два атома кислорода. Она имеет формулу O2. Одна молекула аммиака содержит один атом азота и три атома водорода и имеет формулу Nh4.
Такая разновидность химической формулы называется молекулярной формулой. Например, одна молекула кислорода содержит два атома кислорода. Она имеет формулу O2. Одна молекула аммиака содержит один атом азота и три атома водорода и имеет формулу Nh4.
Формула металлического ионного или координационного ковалентного кристалла указывает простейшее соотношение между числом атомов или ионов каждого вида в его кристаллической решетке. Формула многоатомного (комплексного) иона указывает соотношение между числом атомов каждого элемента, входящего в данный ион. Например, в кристаллической решетке флюорита (фторида кальция) на каждый ион кальция приходится два фторид-иона. Поэтому флюорит имеет формулу CaF2.
Структурная формула ковалентного простого вещества или соединения показывает, как связаны между собой атомы в каждой его молекуле (табл. 4.3). Если в такой формуле полностью указаны все связи, она называется развернутой структурной формулой.
Эмпирическая формула соединения указывает простейшее соотношение между числом различных атомов или ионов в данном веществе. Для кристаллов координационного типа можно указать только эмпирическую формулу. Однако для ковалентных веществ, состоящих из простых молекул, молекулярная формула обычно представляет собой целочисленное кратное их эмпирической формулы (табл. 4.3).
Для кристаллов координационного типа можно указать только эмпирическую формулу. Однако для ковалентных веществ, состоящих из простых молекул, молекулярная формула обычно представляет собой целочисленное кратное их эмпирической формулы (табл. 4.3).
Таблица 4.3. Молекулярная формула
Существуют две наиболее распространенные системы химической номенклатуры. Одна из них разработана Международным союзом теоретической и прикладной химии (ИЮПАК), а другая-Ассоциацией научного образования (ASE). Обе эти системы имеют много общего. Однако система ИЮПАК в большей мере основана на использовании тривиальных названий. Многие вещества имеют тривиальные названия. Эти названия часто являются традиционными и хорошо установленными, но не согласуются ни с какой систематической номенклатурой. Однако еще важнее то, что они не дают сведений о химическом составе вещества; например, вода (h3O) и озон (O3).
Система ASE в большей мере основана на использовании систематических . названий. Эти названия образуются по вполне определенным правилам. В данной книге используется номенклатура ASE, хотя во многих случаях она совпадает с номенклатурой ИЮПАК.
названий. Эти названия образуются по вполне определенным правилам. В данной книге используется номенклатура ASE, хотя во многих случаях она совпадает с номенклатурой ИЮПАК.
Важнейшим правилом номенклатуры является требование, чтобы название вещества имело однозначный смысл. Например, оксид магния-однозначное название, поскольку магний образует только один оксид, MgO. Однако оксид углерода — неоднозначное название, поскольку углерод образует два оксида, СО и CO2. Поэтому СО называется моноксид углерода, a CO2-диоксид углерода.
Систематические названия, особенно по номенклатуре ИЮПАК, в значительной мере основаны на использовании численных приставок, указывающих количество одинаковых атомов или групп в формуле вещества (табл. 4.4). Приставку моно- часто опускают. Например, моноксид азота (NO) называют также оксидом азота.
Таблица 4.4. Численные приставки
Названия «медный купорос», «сернокислая медь», «сульфат меди», «гидрат сульфата меди» и «пентагидрат сульфата меди(II)» означают одно и то же соединение с формулой CuSO4 *5h3O.
Оглавление:
Составление химических формул простым и доступным языком
Одной из самых главных задач в химии является правильное составление химических формул. Химическая формула — это письменное представление состава химического вещества с помощью латинского обозначения элемента и индексов. Для правильного составления формулы нам обязательно понадобится таблица Менделеева и знание простых правил. Они достаточно простые и запомнить их смогут даже дети.
Как составлять химические формулы
Основным понятием при составлении химических формул является «валентность«. Валентность — это свойство одного элемента удерживать определенное число атомов в соединении. Валентность химического элемента можно посмотреть в таблице Менделеева, а также нужно помнить и уметь применять простые общие правила.
- Валентность металла всегда равна номеру группы, при условии, что он находится в главной подгруппе. Например, калий имеет валентность 1, а кальций — 2.
- С неметаллами немного сложнее. Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2.
- В соединении двух неметаллов низшую валентность имеет тот химический элемент, который находится в таблице Менделеева правее и выше. Однако, фтор всегда имеет валентность 1.
- И еще одно важное правило при расстановке коэффициентов! Общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
Закрепим полученные знания на примере соединения лития и азота. Металл литий имеет валентность, равную 1. Неметалл азот располагается в 5 группе и имеет высшую валентность 5 и низшую — 3. Как мы уже знаем, в соединениях с металлами неметаллы всегда имеют низшую валентность, поэтому азот в данном случае будет иметь валентность равную трем. Расставляем коэффициенты и получаем искомую формулу: Li3N.
Расставляем коэффициенты и получаем искомую формулу: Li3N.
Вот так, достаточно просто, мы научились составлять химические формулы! А для лучшего запоминания алгоритма составления формул мы подготовили его графическое представление.
Составление химических формул: алгоритм
Алгоритм составления химических формул
Понравилась статья? Поделиться с друзьями:
Химические формулы. Относительные атомная и молекулярная массы
Модель Дж. Дальтона и Й.Я. Берцелиуса
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода.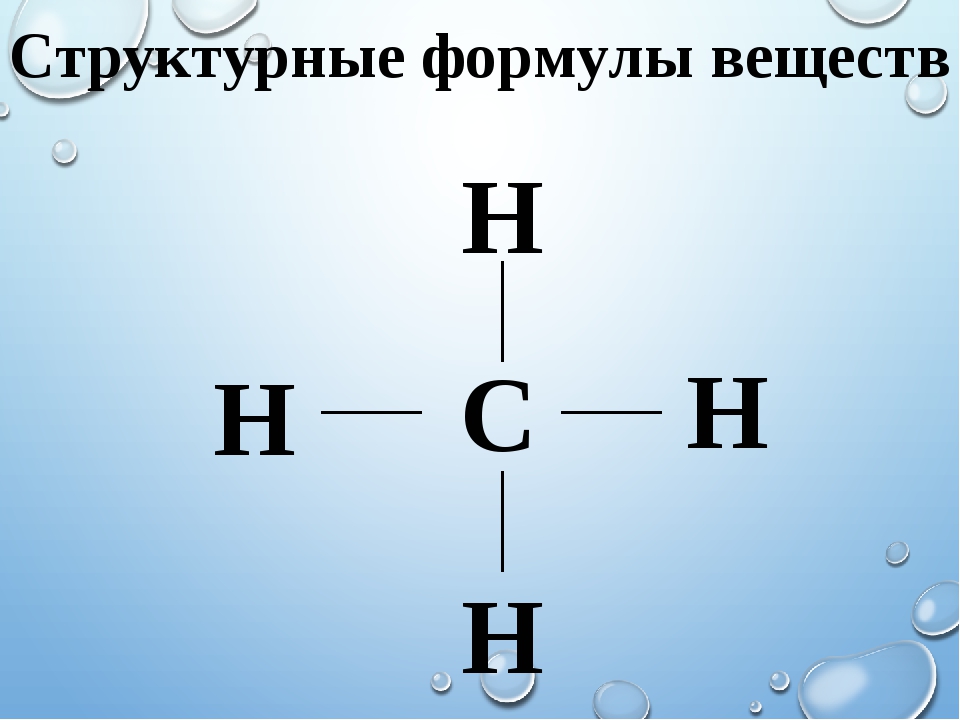 В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Ученый заметил, что масса атома водорода самая маленькая, т.к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Массы атомов очень малы.
Абсолютные массы некоторых атомов:
m(C) =1,99268 ∙ 10-23 г
m(H) =1,67375 ∙ 10-24 г
m(O) =2,656812 ∙ 10-23 г
В настоящее время в физике и химии принята единая система измерения.
Введена атомная единица массы (а.е.м.)
m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10-24 г.
· Ar(H) = m(атома) / m (а.е.м.) = 1,67375 ∙ 10-24 г/1,66057 ∙ 10-24 г = 1,0079 а.е.м.
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина.
Относительная атомная масса — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная атомная масса безразмерная величина
Например, относительная атомная масса атома кислорода равна 15,994 (используем значение из периодической системы химических элементов Д. И. Менделеева).
Записать это следует так, Ar(O) = 16. Всегда используем округлённое значение, исключение представляет относительная атомная масса атома хлора:
Ar(Cl) = 35,5
Связь между абсолютной и относительной массами атома представлена формулой: m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг
III. Относительная молекулярная масса
Относительная молекулярная масса
В химии не используют значения абсолютных масс молекул, а пользуются величиной относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr.
Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Вычислим относительную молекулярную массу воды.
Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Посмотрите презентацию: “Вычисление относительной молекулярной массы серной кислоты”:
Химические формулы. Относительная молекулярная масса
Цель урока:
Личностные:
- Развитие ответственного отношения к учению, способности
обучающихся к саморазвитию и самообразованию на
основе мотивации к обучению и познанию.
- Формирование целостного мировоззрения.
Метапредметные:
- Развитие умений определять способы действий в
рамках предложенных условий и требований. - Развитие умение осуществлять контроль своей
деятельности в процессе достижения результата. - Развитие компетентности в области
использования информационно-коммуникационных
технологий.
Предметные:
- Формирование первоначальных представлений о
веществах: понятия “химическая формула”,
“индекс”, “коэффициент”, “относительные
атомная и молекулярная массы”. - Овладение основами химической грамотности:
умение писать и читать формулы веществ. - Формирование навыков расчёта относительной
молекулярной массы вещества.
Тип урока: урок введения нового
материала с использованием
электронно-образовательных ресурсов и
самостоятельной исследовательской деятельности
учащихся.
Формы работы учащихся: фронтальная,
индивидуальная, мини-группы (в парах).
Оборудование: Таблица Д.И.Менделеева,
ПК, экран, опорные схемы (приложение
1), карточка для организации игры
“Химическое лото”, комплект шаростержневых
моделей, лоток для моделей молекул, комплект
цветных магнитов, магнитная доска.
ЭТАПЫ УРОКА
1. Актуализация знаний. Повторение символов
химических элементов и их названий.
Учитель:
Начнём урок со строк Степана Щипачёва:
“В природе ничего другого нет,
Ни здесь, ни там, в космических глубинах.
Все от песчинок малых до планет
Из элементов состоит единых”
Все вещества окружающих нас тел живой и неживой
природы состоят из химических элементов. Чтобы
изучить свойства веществ и превращения одних
веществ в другие, необходимо знать химический
язык. Знаки химических элементов — это “буквы”
Знаки химических элементов — это “буквы”
химического языка. Проверим знания химических
элементов.
За работу на уроке вы получаете “аурики” –
показатель вашей активности. Название “Аурики”
образовано от латинского названия химического
элемента – драгоценного металла – Аурум
(Золото). После урока вы вернёте их, в обмен на
оценку.
Игра. “Химическое лото”. Работа по
индивидуальным карточкам (приложение
2).
Зачеркните знак химического элемента, о
котором идёт речь в строках стихотворения. (При
чтении стихотворных строк ученик, выполнивший
задание, держит руку на локте вместе с ручкой –
сигнал выполнения работы).
Взаимопроверка (по слайду презентации),
оценивание, подведение итогов игры.
Критерии оценивания:
- 16 – “5”
- 12 — 15 – “4”
- 9 – 11 – “3”
Карточки трёх учащихся (по желанию) -
индивидуальная проверка учителем после урока.
Приложение 2
| Na | H | K | Mg |
| О | Cu | Ag | P |
| N | Fe | Au | Сl |
| Hg | Ca | C | S |
| Унылая пора! Очей очарованье! Приятна мне твоя прощальная краса — Люблю я пышное природы увяданье, В багрец и в золото одетые леса.  | А. С. Пушкин |
| В их стройно зыблемом строю Лоскутья сих знамен победных, Сиянье шапок этих медных, Насквозь простреленных в бою. | А. С. Пушкин |
| И квакуши, как шарики ртути, Голосами сцепляются в шар. | О. Мандельштам |
| И вспышками магния, кроя с балконов Смертельною известью лица, В агонии красных огней и вагонов В лице изменялась столица. | В. Катаев |
| О, если бы вы знали, Какой за ним уход! Он принимает калий, Ему дают азот. | Вера Инбер |
| Воды минеральные бьют из-под земли, Кальцием и натрием насыщены они.  | Г. Колпакова |
| О, мощный властелин судьбы! Не так ли ты над самой бездной На высоте, уздой железной Россию поднял на дыбы? | А. С. Пушкин |
| Тогда услышал я (о диво!) запах скверный; Как будто тухлое разбилось яйцо. Иль карантинный страж курил жаровней серной. | А.С. Пушкин |
Учитель: Назовите не закрашенные
элементы (за правильный ответ — дополнительный
балл).
Физ.минутка. Предлагаю немного
отдохнуть и устроить “Стрельбу глазами” [ 1 ]
Задание:
- В периодической системе найдите самый сильный
элемент – неметалл – окислитель -7 группа,
главная подгруппа, 2 период. (F) - Переведите свой взгляд влево, на элемент,
стоящий в том же периоде в 3 группе. (B)
(B) - Переведите взгляд вниз, на самый сильный металл
– 7 период. (Fr) - Переведите взгляд вверх и вправо, на элемент 6
группы, главной подгруппы, 2 период, образующий
вещество, которое поддерживает горение. (O) - Переведите взгляд вниз и влево, на элемент,
атомы которого образуют металл, содержащийся в
градусниках. (Hg) - Переведите взгляд вверх и вправо, на элемент с
относительной атомной массой 35,5. (Cl) - Переведите взгляд вниз и влево, на элемент, 2
группы, главной подгруппы, с порядковым номером
56. (Вa) - Переведите взгляд на элемент, который
возглавляет группу инертных газов в
периодической системе Менделеева. (Не) - Переведите свой взгляд вниз и влево, на элемент,
атомы которого образуют драгоценный металл
желтого цвета. (Au)
2. Введение новых знаний. Создание и решение
Создание и решение
проблемной ситуации. Исследовательское
моделирование.
Учитель: Что означают знаки (символы)
химических элементов?
Учащиеся: Символы химических
элементов используют для обозначения атомов
определённого вида; удобное международное
сокращение греческих или латинских названий
элементов.
Учитель: Знаки химических элементов -
это знаковые модели. Давайте попробуем создать
предметные модели частиц, из которых состоят
вещества. Начнем с атомов. Чем отличаются друг от
друга атомы разных видов, т.е. разных химических
элементов?
Учащиеся: Атомы разных видов
отличаются массой, размерами, строением.
Учитель: Вам выданы шаростержневые
модели. Для того, чтобы показать отличие атомов
друг от друга, шарики разного цвета. Это – цвет
моделей, шариков, но не атомов. Атомы не окрашены.
Рассмотрите их. Модели атомов кислорода красного
(оранжевого) цвета. Модели атомов азота – синего
цвета. Шарики чёрного цвета – обозначают атомы
углерода.
Характеристика моделей атомов (инструкция на
комплекте шаростержневых моделей).
водород
белый
углерод
чёрный
кислород
красный (оранжевый)
азот
синий
сера
жёлтый
галогены
зелёный
алюминий
тёмно-серый
(На доске — магнитные модели, записи. Учащиеся,
Учащиеся,
одновременно с учителем, делают рисунки и записи
в опорном конспекте – выделенное поле для
работы).
Учитель: Положите на лоток три шарика,
обозначающие атомы элемента водорода. Какой
символ можно использовать для обозначения?
Учащиеся: Н (аш)
Учитель: Как учесть их количество?
Учащиеся: Записать цифру три перед
знаком элемента водорода.
Учитель: Вы за партой работаете в
парах. Сколько атомов водорода в ваших моделях
приходится на двоих? Как это обозначим в записи?
Учащиеся: Записать цифру шесть перед
знаком элемента водорода.
Учитель: Выложите в лотке модели двух
атомов кислорода.
Делаем рисунок и соответствующую запись (2О).
Сколько атомов кислорода в ваших моделях
приходится на двоих? Как это обозначим в записи?
Учащиеся: Записать цифру четыре перед
химическим знаком элемента кислорода.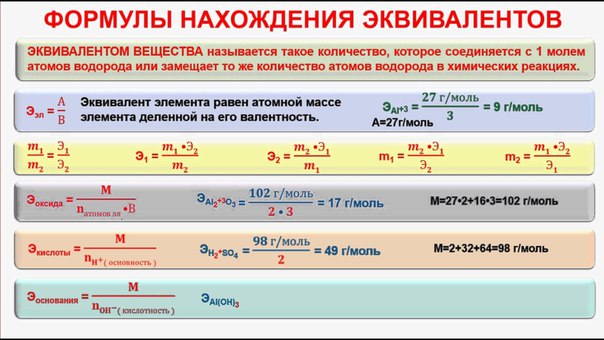
Учитель: Но во многих веществах атомы
объединяются друг с другом.
Например, самый лёгкий газ водород, состоит из
молекул. Каждая состоит из двух атомов элемента
водорода. Создайте модель молекулы газа
водорода, используя металлический стержень для
соединения атомов.
1 молекула газа водорода, состоит из двух атомов
(Н2).
Выложите на лоток две молекулы газа водорода.
Две молекулы газа водорода, каждая состоит из
двух атомов.
Как это записать, используя знаки? (2 Н2)
- индекс
- коэффициент
Учитель: Давайте сосчитаем все
молекулы газа водорода, созданные сегодня с
помощью моделей? (Запись 12 Н2 )
Цифры в данной записи называются: индекс,
коэффициент. Попробуйте объяснить, что означает
индекс? Коэффициент? Где записывается индекс?
Коэффициент?
Работа по заполнению таблицы в опорной схеме.
Учащиеся: Индекс указывает на число
атомов в молекуле, коэффициент – на число
отдельных частиц.
Учитель: Молекула воды состоит из
одного атома кислорода и двух атомов водорода,
расположенных под углом. Соберите модель на
столах (на доске – магнитная модель, рисунок в
тетради, запись) (Н2О)
Сколько молекул воды в ваших моделях
приходится на двоих? Как это обозначим в записи?
Учащиеся: Поставим коэффициент два
перед записью.
Учитель: Как вы думаете, чем модели
молекул похожи? Чем модели отличаются друг от
друга?
Учащиеся: В одной группе – молекула
состоят из одинаковых атомов, в другой – из
разных.
Учитель: Вещества, которые состоят из
одинаковых атомов одного химического элемента,
называют простыми. Работа по заполнению таблицы.
Работа по заполнению таблицы.
Учитель: Дайте определение сложным
веществам.
Учащиеся: Сложные вещества состоят из
атомов разного вида.
Учитель: Итак, состав веществ
записывается знаковыми моделями, т.е.
химическими формулами.
О чем говорит нам химическая формула?
Учащиеся: О том, из каких атомов
состоит вещество, в каком количестве атомы
входят в состав вещества.
Учитель: Качественный состав вещества
показывает, из атомов каких химических элементов
оно состоит.
Количественный состав показывает число атомов
каждого химического элемента в составе вещества.
Следовательно, химическая формула описывает
КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ вещества.
3. Первичное закрепление знаний, умений,
навыков (с использованием слайдов №3 — №13
презентации, при необходимости осуществляется
проверка в виде голосового сопровождения к
презентации при нажатии на значок).
Порядок действий:
- Прочитать химическую формулу.
- Дать характеристику состава сложного вещества
(качественный и количественный состав).
Чтение химических формул, определение
качественного и количественного состава сложных
веществ. ДЛЯ СЛОЖНЫХ ВЕЩЕСТВ (За правильный ответ
— “аурик”).
H2O, AgNO3, Al, HCl, Cu, C, NaCl, Mg, O2, CO, CaCO3
4. Игра. Будь внимателен!
Учитель: На какие группы можно разделить
предложенные формулы веществ? (Слайд №14
презентации).
Учащиеся: Можно разделить на простые и сложные
вещества.
Учитель: Определим, где простые, а где сложные
вещества в этом перечне. Если показываемое
вещество простое, 1 хлопок в ладоши (поднять одну
руку), если сложное – 2 хлопка (поднять две руки,
работает весь класс). Слайд №15 презентации к
уроку.
H2O, AgNO3, Al, HCl, Cu, C, NaCl, Mg, O2, CO, CaCO3
Встречаемся ли мы с предложенными веществами в
повседневной жизни?
Рассказ учащегося о применении предложенных
веществ (учебный проект). Слайд №16 презентации к
уроку.
Физ.минутка. Гимнастика для глаз с
использованием кружков, расположенных на окне.
Посмотреть на круг, приклеенный на стекло, на
счет 1–4, потом перевести взгляд вдаль на счет 1–6.
Повторить 4–5 раз.
Крепко зажмурить глаза (считать до 3), открыть
глаза и посмотреть вдаль (считать до 5). Повторить
4–5 раз.
Закрыть глаза и посидеть спокойно, медленно
считая до 5.
Открыть глаза, потянуться, на счёт 1-4 медленно
поднимаем руки вверх, на счёт 1-4 опускаем руки,
кладём на парту. Повторить 3-4 раза.
5. Введение новых знаний. Вычисление
относительной молекулярной массы.
Учитель: Одной из основных характеристик
вещества является его относительная
молекулярная масса Mr. Слайд №17 презентации к
уроку (или работа с ЭОР в сети интернет).
http://fcior.edu.ru/card/13775/otnositelnaya-molekulyarnaya-massa-veshestva.html»>http://fcior.edu.ru/card/13775/otnositelnaya-molekulyarnaya-massa-veshestva.html»
Видеомодуль коллекции ЭОР http://fcior.edu.ru. 1,2 слайды.
Рисунок 1
Учитель: Молекулы также как и атомы,
имеют массу, которая также очень мала, поэтому в
расчётах используют относительную молекулярную
массу.
Как вы считаете, как можно найти массу молекулы,
зная массу атомов? Конечно, сложить атомные массы
между собой, но при этом не надо забывать, что
атомов в молекуле может быть не один и это тоже
нужно учитывать.
Относительная молекулярная масса вещества (Mr)
– это число, показывающее во сколько раз масса
молекулы данного вещества больше 1/12 массы атома
углерода.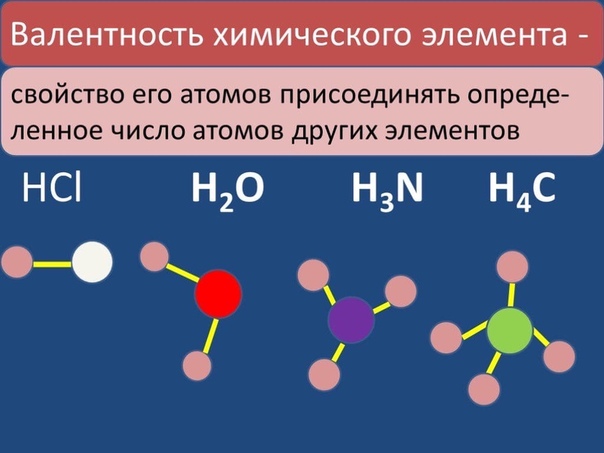 Это безразмерная величина
Это безразмерная величина
Мы умеем определять относительную атомную
массу ХЭ. Где можно найти и проверить цифровое
значение относительной атомной массы?
Учащиеся: Можно найти в периодической
системе химических элементов Д.И.Менделеева.
Учитель: А как можно определить
относительную массу молекулы?
Учащиеся: Относительная молекулярная
масса вещества равна сумме относительных
атомных масс атомов, входящих в состав молекулы с
учетом их индексов.
AxByCz где A, B, C — знаки Эl x, y, z – количество атомов
этих Эl
Mr = Ar(A)*X + Ar(B)*Y + Ar(C)*Z
6. Первичное закрепление изученного
материала (работа с опорной схемой).
Последовательность действий при определении
относительной молекулярной массы.
Алгоритм. Вычисление относительной
молекулярной массы по химической формуле.
1. Найти значения относительных атомных масс
элементов в периодической системе.
2. Умножить число атомов на значение
относительной атомной массы для каждого
элемента.
3. Сложить полученные значения.
Работа с тренажёром “Вычисление
относительной молекулярной массы”
(http://fcior.edu.ru/card/12971/trenazher-vychislenie-otnositelnoy-molekulyarnoy-massy-veshestv.html)
Слайд №18 презентации к уроку (или работа с ЭОР в
сети интернет).
Рисунок 2
Определение относительной молекулярной массы
веществ по предложенным формулам (работа с
опорной схемой).
| молекула | значение Мr |
| Н2О | Мr(Н2О)= 2Ar (Н) +1Ar(О)= 2·1 +1·16 = 18 |
| H2SO4 | Мr(H2SO4) = Ar( ) + Ar ( ) + Ar ( ) = |
| HNO3 | Мr(HNO3) = Ar( ) + Ar( ) + Ar( ) = |
| Fe2O3 | Мr(Fe2O3) = Ar + Ar = |
| SO3 | Мr( ) = |
| NaOH | Мr( ) = |
| H3PO4 | Мr ( ) = |
| N2 | Мr ( ) = |
| H2O2 | Мr ( ) = |
7. Закрепление знаний, умений, навыков.
Закрепление знаний, умений, навыков.
Cамостоятельная работа.
Сравнение относительных молекулярных масс.
Вставьте знак, больше, меньше, равно, выполнив
вычисления. Слайд №19 презентации к уроку.
| Mr (Н2SO4) | Mr (Н3РO4) | |
| Mr (SO3) | Mr (MgO) | |
| 5 Mr (CH4) | 2 Mr (NaOH) | |
| Mr (NH3) | Mr (PH3) |
8. Итог. Рефлексия.
Учитель: С какими понятиями мы
познакомились сегодня на уроке.
| Я узнал много нового. | ||
| 2. | На уроке было над чем подумать. | |
| 3. | Мне это пригодиться в жизни. | |
| 4. | На все возникшие вопросы я получил(а)
ответы. | |
| 5. | На уроке я поработал добросовестно. |
9. Домашнее задание. П.12
Индивидуальное задание (по вариантам, приложение 3).
Сайт “Мир ХИМИИ” Раздел
“Учащимся. 8 класс” Урок №14.
ДОПОЛНИТЕЛЬНЫЕ ЗАДАНИЯ (если на уроке
остаётся несколько свободных минут):
1. Найдите и запишите значения относительных
Найдите и запишите значения относительных
молекулярных масс:
1) хлорида меди (II), состоящей из одного атома
меди и двух атомов хлора;
2) оксида фосфора(V), состоящего из двух атомов
фосфора и пяти атомов кислорода;
3) двухатомной молекулы хлора.
| молекула | значение Мr |
| Мr( ) = | |
| Мr( ) = | |
| Мr( ) = |
Приложение 4
Приложение 5
Приложение 6
Источники информации.
- Е. П. Пак. Типы химических реакций.
Игра-путешествие. 8 класс. “Первое сентября.
Химия” N19 (761), 1-15.11.2008 - Баженов А.
 А. Тренажер к уроку химии. 8 класс.
А. Тренажер к уроку химии. 8 класс.
“Чтение химических формул”
Химические символы и формулы — Введение в химические реакции — OCR Gateway — GCSE Chemistry (Single Science) Revision — OCR Gateway
Химические символы
Каждый элемент представлен своим собственным химическим символом. В периодической таблице показаны названия и символы элементов. Химический символ:
- состоит из одной или двух букв.
- всегда начинается с заглавной буквы, а любая другая буква в нижнем регистре.
Например, элемент ртуть отображается как Hg.Вы не должны показывать это как HG, hg или hG.
0.0.0.1:0.1.0.$0.$1.$4″> Формулы элементов
Химическая формула представляет собой элемент или соединение в сбалансированных уравнениях. Формулы для большинства элементов — это всего лишь их символ.
Некоторые неметаллические элементы существуют в виде простых молекул с двумя соединенными вместе атомами. Мы говорим, что эти элементы двухатомные. Чтобы показать это, их формулы содержат нижний индекс 2. Например:
- водород, H 2
- азот, N 2
- кислород, O 0.$0.$1.$7.$2.$1″> 2
- фтор, F 2
- бром, Br 2
- хлор, Cl 2
- йод, I 2
Элементы, обозначенные цифрой 2 в их формуле, — это водород, азот и кислород, а также элементы из группы 7 (группа IUPAC 17 ).
Формулы простых ковалентных соединений
Соединение содержит два или более элемента, соединенных химическими связями. Простые ковалентные соединения содержат атомы неметаллов, соединенные ковалентными связями. Их молекулярные формулы показывают:
Их молекулярные формулы показывают:
- символы для каждого элемента в молекуле
- количество атомов каждого элемента в молекуле
Вот несколько примеров и их значения:
| Название соединения | Формула | Атомы в каждой молекуле |
|---|---|---|
| Аммиак | NH 3 | 1 азот, 3 водорода |
| Диоксид углерода | CO 2 | 1 углерод, 2 кислорода |
| Метан | CH 4 | 1 углерод, 4 водорода |
| Диоксид серы | SO 2 | 1 сера, 2 кислорода |
| Вода | H 2 O | 2 водород, 1 кислород |
Химическая формула — определение, типы и примеры
Определение химической формулы
Химическая формула — это обозначение, используемое учеными для обозначения количества и типа атомов, присутствующих в молекуле, с использованием атомных символов и числовых индексов.Химическая формула — это простое письменное представление существующей трехмерной молекулы. Химическая формула описывает вещество с точностью до атомов, из которых оно состоит. Существует три основных типа химических формул: эмпирическая формула , молекулярная формула и структурная формула .
Каждая из этих химических формул дает немного разную информацию о составе вещества и подсказывает его трехмерную форму и то, как оно будет взаимодействовать с другими молекулами, атомами и ионами.В химической формуле буквы представляют собой атомный символ каждого атома. Нижний индекс (нижний) представляет номер каждого атома, а верхний индекс (верхний) представляет заряд данного атома. Коэффициент перед химической формулой представляет это количество единиц молекулы. Каждый из различных типов химических формул читается немного по-своему.
Типы химических формул
Эмпирическая формула
Эмпирическая химическая формула представляет относительное количество атомов каждого элемента в соединении.Некоторые соединения, такие как вода, имеют одинаковую эмпирическую и молекулярную формулу, потому что они маленькие и имеют одинаковое соотношение атомов в молекулах и количество атомов в молекуле. Эмпирическая и молекулярная формула воды выглядит так:
H 2 O
Эмпирическая формула определяется весом каждого атома в молекуле. Следовательно, для более крупной молекулы, такой как перекись водорода, эмпирическая формула показывает только соотношение атомов.В этом случае:
HO:
Однако эта эмпирическая химическая формула показывает только основную основу молекулы. На самом деле две молекулы HO: объединяются и образуют молекулу перекиси водорода.
Молекулярная формула
Молекулярная формула показывает фактическое количество атомов в каждой молекуле. Таким образом, для перекиси водорода молекулярная формула:
H 2 O 2
Как видите, это несколько сбивает с толку реальную структуру перекиси водорода.Хотя эмпирическая химическая формула дает ключ к разгадке того, что в молекуле два атома кислорода связаны между собой посередине, молекулярная формула не делает этого ясным. Однако молекулярная формула часто используется для описания молекул просто потому, что это удобно, и большинство молекул можно найти после определения их формулы.
Структурная формула
Структурная формула молекулы — это химическая формула с более художественной интерпретацией. В этой химической формуле показаны фактические связи между молекулами.Это помогает читателю понять, как связаны разные атомы и как молекула функционирует в пространстве. Необходимо учитывать множество различных структурных химических формул.
Самый простой метод, метод электронных точек , использует двоеточия и точки для обозначения связей между атомами. Каждое двоеточие представляет собой пару электронов, разделенных между атомами по обе стороны от толстой кишки. Эта формула более точно представляет фактическое расположение атомов в молекуле. В случае воды формула электронной точки будет выглядеть так:
Н: О: В
Другая химическая формула, формула линии связи , также показывает связи между атомами.Вместо того, чтобы показывать каждый электрон, который является общим, используется линия для обозначения электронной пары , общей для атомов. Вода в формуле бонда выглядит так:
H-O-H
Ученые разработали гораздо более продвинутые формулы и представления молекул, включая трехмерные модели с шариком и палкой , модели , заполняющие пространство, и даже модели, которые учитывают электронную плотность моделируемых атомов. Эти продвинутые модели учитывают не только присутствующие атомы и их количество, но и углы, размеры и расстояния между атомами внутри молекулы.Модель воды с мячом и палкой ниже даже показывает полярность молекулы, поскольку большой атом кислорода имеет тенденцию притягивать наибольшее количество электронов.
Молекулярная масса по химической формуле
Один из важных навыков, основанных на химической формуле, — это вычисление молекулярной массы . Молекулярная масса молекулы — это сумма всех различных атомов внутри. Каждое вещество имеет определенную молекулярную массу, определяемую его особым составом.
Чтобы определить молекулярную массу вещества, рассмотрите химическую формулу. Формула легко отображает каждый присутствующий атом. Обязательно умножьте на количество атомов каждой молекулы. Нижние индексы на каждом атоме указывают их количество. Некоторые большие молекулы с несколькими похожими группами будут отображать группы примерно как в примере ниже:
С (ОН) 4
В этом случае имеется четыре группы (OH), а не 4 атома водорода. Убедитесь, что вы приняли это во внимание при расчете молекулярной массы.Молекулярная масса может использоваться для идентификации веществ, правильного взвешивания веществ для экспериментов и выполнения ряда расчетов с участием энергии, участвующей в химических реакциях. Ученые часто используют химические формулы как хранилище большей части этой информации, не объясняя основы химии в каждой статье.
Викторина
Список литературы
- Мур, Дж. Т. (2010). Основы химии для чайников .Индианаполис: Wiley Publishing, Inc.
- Нельсон Д. Л. и Кокс М. М. (2008). Принципы биохимии. Нью-Йорк: W.H. Фримен и компания.
- Зильберберг, М. С. (2009). Химия: молекулярная природа материи и изменений (5-е изд.). Бостон: Высшее образование Макгроу-Хилла.
Химическая формула и уравнения
Химическая формула и уравнения — индексы
Химическая формула или уравнение показывает символы элементов в соединении и соотношение элементов друг к другу.Если вещество содержит более одного атома определенного элемента, это количество указывается в химических формулах или уравнениях с помощью нижнего индекса , числа после символа элемента. Номер нижнего индекса относится только к элементу, за которым он непосредственно следует. Например, химическая формула воды — H 2 O, что означает, что 2 атома водорода соединяются с 1 атомом кислорода.
Как написать химическую формулу или уравнение с использованием индексов
Чтобы ввести или написать индекс химической формулы или уравнения, просто следуйте этим простым инструкциям:
- Введите формулу или уравнение, например, h3O
- Выделите число
- Щелкните Формат.
- Выберите шрифт… Уменьшите размер шрифта числа
- Под заголовком Эффекты отметьте поле Подстрочный
- В формуле теперь будет отображаться уравнение с числом в нижнем индексе — H 2 O
Химическая формула и уравнения
Формула и уравнения — примеры и значения индексов
Например, химическая формула воды — h3O, которая указывает, что 2 атома водорода соединяются с 1 атомом кислорода. Химическая формула хлорида натрия (соли) — NaCl, что указывает на то, что один атом натрия соединяется с одним атомом хлора в соотношении один к одному.Индексы добавляются после символа элемента, чтобы указать, что количество атомов этого элемента в соединении, если оно больше единицы. Например, формула бромида магния MgBr2, которая указывает, что один атом магния соединяется с двумя атомами брома.
Значения и примеры химических формул и уравнений
Следующие ниже примеры химических формул и уравнений объясняют их значение.
Пример химической формулы соли (хлорида натрия) — NaCl
NaCl
Символ Na указывает на элемент Натрий
Символ Cl указывает на элемент Хлор
Нет нижних индексов означает только 1 атом для каждого элемента
Пример химической формулы для воды — H 2 O
H 2 O
S символ H обозначает элемент Водород
Символ O обозначает элемент кислород
Нижний индекс обозначает 2 атома водорода
Химическая формула и уравнения — Список общих химических формул
В следующем списке химических формул и уравнений показаны некоторые из наиболее распространенных химических формул.
Список общих химических формул | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Na | Натрий | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
H 2 O | Вода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вода | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O 6 | Глюкоза | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C 2 H 6 O | Спирт | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сульфатная группа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
H 9152 2 Водород | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
NaCl | Соль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O 2 | Кислород | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
C 2 H 6 O | 2 | H 4 O 2 | Уксус | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
NH 3 | Аммиак | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Mg | Магний | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
C 2 H 4 O 2 | Уксусная кислота | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
H 4 Бутан | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NO 3 — | Нитрат | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cu | Медь | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
N 2 | Азот | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
H 2 SO 4 | Серная кислота | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CH 4 | 6
| 6 Метан 12 H 22 O 11 | Сахароза | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
C 3 H 8 | Пропан | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
NaHCO 3 | Пищевая сода 96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
F 2 | Фторид | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
H 2 O 2 | Пероксид | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Кофеин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
NaCl | Хлорид натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
C C | Аспирин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
HCl | соляная кислота | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zn (NO 3 ) 2 | цинк | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CO | CO | окись углерода 9007 900 | Гидроксид натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
NaCN | Цианид натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ca (CN) 2 | Цианид кальция 073 9078I Йод Sn Олово | C 6 H 6 H 6 26 026 0Сероводород CH 90 152 3 COCH 3 Ацетон H 3 PO 4 Фосфорная кислота H 5 2 2 Пентан CH 3 OH Метанол HBr Бромистоводородная кислота 3 H Углеродная кислота | Ti Титан NaClO Гипохлорит натрия C2H6 C2H6 2 SO 4 | Сульфат аммония C 8 H 18 Октан CuSO 4 Сульфат меди 9023 | C Холестерин C 7 H 6 O 2 Бензойная кислота H 2 SO 378 C 6 H 12 O 6 Галактоза C 6 H 8 O 6 id | 000 Ascorbic Сухой лед NaNO 3 90 296 Нитрат натрия | CaO Оксид кальция HIO 3 Йодная кислота 73 9038 3 Молочная кислота MgBr 2 Молочная кислота H 2 O Оксид | C Углерод | H Водород | C n H 2n O n n | Сахар | N 2 O Азот | 902 96 C 6 H 8 O 7 | Лимонная кислота | C 8 H 18 Октан | C 10 H 16000 Камфора AgI | Оксид серебра | Триоксид мышьяка Au 2 O 3 Золото
Золото 2 S Сульфид золота Br 2 | Бром | Al 2 O 3 Алюминиевая фольга Обычная 32 Список | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Химическая формула и уравнения
Приведенный выше список Chemica l «Формула и уравнения» содержит подробную информацию об общих химических формулах.
5.3: Химические формулы — как представлять соединения
Цели обучения
- Определите количество различных атомов в формуле.
- Определите химическую формулу, молекулярную формулу и эмпирическую формулу.
A химическая формула — это выражение, которое показывает элементы в соединении и относительные пропорции этих элементов. Вода состоит из водорода и кислорода в соотношении 2: 1. Химическая формула воды \ (\ ce {H_2O} \).Серная кислота является одним из наиболее широко производимых химических веществ в Соединенных Штатах и состоит из элементов водорода, серы и кислорода. Химическая формула серной кислоты \ (\ ce {H_2SO_4} \).
Определенные группы атомов связаны вместе, образуя так называемый многоатомный ион, который действует как единое целое. Более подробно многоатомные ионы обсуждаются в разделе 5.5. Многоатомные ионы заключаются в скобки с нижним индексом, если в химической формуле существует более одного иона одного и того же типа.Формула \ (\ ce {Ca3 (PO4) 2} \) представляет собой соединение со следующим:
3 атома Ca + 2 PO 4 3- ионов
Чтобы подсчитать общее количество атомов в формулах с многоатомными ионами, заключенными в скобки, используйте нижний индекс в качестве множителя для каждого атома или количества атомов.
Ca 3 (PO 4 ) 2
3 Ca + 2 x1 P + 2 x 4 O = 3 атома Ca + 2 атома P + 8 атомов O
Молекулярная формула
A Молекулярная формула — это химическая формула молекулярного соединения, которая показывает виды и количество атомов, присутствующих в молекуле соединения.Аммиак представляет собой соединение азота и водорода, как показано ниже:
Рисунок \ (\ PageIndex {1} \): Молекулярная формула аммиака.
Обратите внимание на пример, что существуют некоторые стандартные правила, которым нужно следовать при написании молекулярных формул. Расположение элементов зависит от конкретной конструкции, которая на данном этапе не имеет значения. Количество атомов каждого типа указывается нижним индексом после атома. Если имеется только один атом, число не записывается. Если имеется более одного атома определенного типа, номер записывается в виде нижнего индекса после атома.Мы не будем писать \ (\ ce {N_3H} \) для аммиака, потому что это будет означать, что в молекуле есть три атома азота и один атом водорода, что неверно.
Эмпирическая формула
Эмпирическая формула — это формула, которая показывает элементы в соединении в их наименьшем целочисленном соотношении. Глюкоза — это важный простой сахар, который клетки используют в качестве основного источника энергии. Его молекулярная формула \ (\ ce {C_6H_ {12} O_6} \). Поскольку каждый из нижних индексов делится на 6, эмпирическая формула для глюкозы равна \ (\ ce {CH_2O} \).Когда химики анализируют неизвестное соединение, часто первым шагом является определение его эмпирической формулы.
- молекулярная формула: \ (\ ce {C_6H_ {12} O_6} \)
- эмпирическая формула: \ (\ ce {CH_2O} \)
Существует очень много соединений, молекулярные и эмпирические формулы которых совпадают. Если молекулярная формула не может быть упрощена до меньшего целочисленного отношения, как в случае \ (\ ce {H_2O} \) или \ (\ ce {P_2O_5} \), то эмпирическая формула также является молекулярной формулой.
Сводка
- Химическая формула — это выражение, которое показывает элементы в соединении и относительные пропорции этих элементов.
- Если присутствует только один атом определенного типа, нижний индекс не используется.
- Для атомов, в которых присутствуют два или более атомов определенного типа, после символа этого атома пишется нижний индекс.
- Многоатомные ионы в химических формулах заключаются в скобки с нижним индексом, если существует более одного многоатомного иона одного и того же типа.
- Молекулярные формулы не указывают на расположение атомов в молекуле.
- Эмпирическая формула показывает наименьшее целочисленное соотношение элементов в соединении. Эмпирическая формула не показывает действительное количество атомов.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Easy Way to Learn Chemistry Formulas
Химические формулы — это сокращенные способы представления количества и типа атомов в соединении или молекуле, например H 2 O для воды или NaCl для хлорида натрия или соли.При написании химических формул следует соблюдать несколько правил, поэтому процесс может быть довольно сложным. Чем больше вы познакомитесь с периодической таблицей и названиями распространенных соединений, тем легче будет научиться писать химические формулы.
Используйте периодическую таблицу
Чтобы написать химические формулы, познакомьтесь с химическими символами, которые легче всего найти в периодической таблице элементов. Периодическая таблица представляет собой таблицу всех известных элементов, и она часто включает как полное название каждого элемента, так и его символ, например H для водорода или Cl для хлора.Некоторые из этих символов очевидны, например, O для кислорода, в то время как другие не так интуитивно понятны с их английским названием; Например, Na означает натрий, но этот символ происходит от латинского слова natrium, обозначающего натрий. Вы можете использовать периодическую таблицу, чтобы сослаться на символы, которые вы не можете запомнить.
Определение химических символов
Прежде чем вы сможете написать свою химическую формулу, вам нужно записать символ каждого атома, присутствующего в вашей молекуле или соединении. Вам могут дать название соединения, например, хлорид натрия, и вы должны определить, какие атомы присутствуют.Напишите Na для натрия и Cl для хлорида, формы элемента хлора, которые вместе создают формулу NaCl для хлорида натрия или соли. Ковалентные соединения, образованные из двух неметаллов, легко записать по их имени. Могут присутствовать префиксы для обозначения более чем одного атома. Например, формула диоксида углерода — CO 2 , потому что di определяет два атома кислорода.
Определение валентности
Ионные соединения, образованные из металла и неметалла, являются более сложными, чем ковалентные соединения, поскольку они содержат заряженные атомы.Вы могли заметить, что в некоторых таблицах Менделеева указаны валентности, положительный или отрицательный заряд. Катионы или положительные ионы находятся в группе 1 с зарядом +1; группа 2, с зарядом +2; и переходные элементы, находящиеся в группах с 3 по 12. Группы 13, 14 и 18 имеют переменные заряды, а группы с 15 по 17 являются анионами, что означает, что они имеют отрицательные заряды.
Уравновешивание зарядов
Определение валентности каждого элемента важно при написании, потому что вам нужно сбалансировать свою химическую формулу, чтобы она не имела заряда.Например, напишите символы оксида магния вместе с соответствующими зарядами. Магний или Mg имеет заряд +2, а оксид, который относится к кислороду, имеет заряд -2. Так как сумма +2 и -2 равна O, вы получаете только по одному атому магния и кислорода. Соедините символы, чтобы получить MgO, формулу оксида магния.
Написание химической формулы
В химических формулах нижние индексы используются для обозначения количества каждого атома в молекуле или соединении. В предыдущем примере вы написали MgO, потому что каждый элемент содержит только один атом; обратите внимание, вы не используете индекс 1 только для одного атома.С другой стороны, чтобы сбалансировать хлорид магния, записанный MgCl 2 , вам нужно два атома хлора на один атом магния; цифра 2 написана как нижний индекс рядом с Cl, чтобы указать два атома хлора.
Дополнительные советы
Практикуясь в написании химических формул, вы познакомитесь с химической номенклатурой или терминами, используемыми для описания соединений. Например, элементы, оканчивающиеся на -ide, можно найти в группах с 15 по 17 периодической таблицы. Римские цифры в скобках, как видно из железа (II), обозначают заряды, в данном случае a +2.Когда многоатомные ионы или группы атомов, такие как гидроксид, обозначаемые как OH, объединяются в соединение, они заключаются в скобки в химических формулах, как показано в Al (OH) 3 , формуле гидроксида алюминия.
Химическая формула | Britannica
Химическая формула , любое из нескольких видов выражений состава или структуры химических соединений. Обычно встречаются эмпирические, молекулярные, структурные и проекционные формулы.
Британская викторина
По химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Эмпирическая формула состоит из символов, представляющих элементы в соединении, таких как Na для натрия и Cl для хлора, и нижних индексов, указывающих относительное количество атомов каждого составляющего элемента. (Нижний индекс не используется, однако, если число не больше единицы.) Таким образом, бензол представлен эмпирической формулой CH, которая указывает, что типичный образец соединения содержит один атом углерода (C) на один атом углерода водород (H). Вода представлена эмпирической формулой H 2 O, означающей, что вещество содержит два атома водорода (H 2 ) на каждый атом кислорода (O).
Общая формула — это тип эмпирической формулы, которая представляет состав любого члена целого класса соединений. Каждый член класса парафиновых углеводородов состоит, например, из водорода и углерода, причем число атомов водорода всегда на два или более чем в два раза превышает число атомов углерода. Учитывая, что n означает «любое число», общая формула этого класса, следовательно, будет C n H 2 n + 2 .
Эмпирические формулы обычно используются для представления веществ с неопределенной молекулярной структурой или веществ, не состоящих из нормальных молекулярных единиц — , например, хлорид натрия (поваренная соль), который состоит из ионов. Чтобы выразить химический состав отдельных молекул вещества — молекула является самой маленькой частицей, в которой вещество сохраняет свои химические свойства, — используется молекулярная формула. Например, молекулярные формулы C 2 H 4 и C 3 H 6 для этилена и пропилена соответственно указывают количество и вид каждого атома, присутствующего в молекуле каждого вещества.Напротив, и этилен, и пропилен имеют одну и ту же эмпирическую формулу, CH 2 , потому что они оба состоят из атомов углерода и водорода в соотношении от 1 до 2. В некоторых случаях, таких как вода, эмпирические и молекулярные формулы вещество может быть идентичным.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Структурные формулы определяют расположение химических связей между атомами молекулы. Структурная формула состоит из символов атомов, соединенных короткими линиями, которые представляют химические связи — одна, две или три линии, обозначающие одинарные, двойные или тройные связи соответственно.Например, структурная формула этана
означает, что соединение состоит из двух атомов углерода, каждый из которых связан друг с другом и с тремя атомами водорода одинарными связями. Структурные формулы особенно полезны для демонстрации различий соединений с одинаковым типом и числом атомов.
Формула проекции — это двумерное представление того, что на самом деле является трехмерной молекулой. Такая формула напоминает структурный тип тем, что состоит из символов, представляющих атомы составляющих элементов, соединенных между собой штрихами или кривыми, обозначающими химические связи.Таким образом, молекула метана, характеризующаяся тетраэдрическим расположением четырех химических связей вокруг атома углерода, удобно представлена формулой проекции
Формулы проекции широко используются при изучении стереоизомеров — соединений, которые имеют такой же состав, но которые различаются пространственным расположением атомов, составляющих их молекулы. Были приняты определенные соглашения для составления формул проекции, чтобы стереоизомеры можно было отличить друг от друга посредством соответствующих различий в их формулах.
Что такое химическая формула? — Определение, типы и примеры — Видео и стенограмма урока
Молекулярная формула
Молекулярная формула , иногда известная как истинная формула , сообщает нам фактическое количество различных элементов в одной молекуле соединения. В молекулярной формуле каждый элемент записан как их символы в периодической таблице, а количество атомов для каждого элемента показано нижним индексом (маленькое число в правом нижнем углу элемента).Вот несколько примеров молекулярных формул:
Если мы посмотрим на бутан, мы увидим, что он имеет 4 атома углерода (C) и 10 атомов водорода (H).
Эмпирическая формула
Слово эмпирический определяется как то, что подтверждается наблюдением. В химии мы проверяем факты, проводя эксперименты. Итак, эмпирическая формула определяется как простейшее соотношение целых чисел элементов, составляющих соединение, и этот тип формулы выводится из экспериментальных данных.
Так же, как мы упрощаем дроби в классе математики, в химии мы можем также упрощать формулы. В этом случае давайте посмотрим на молекулярную формулу глюкозы:
В то время как молекулярная формула дает нам фактическое количество атомов каждого элемента в молекуле, эмпирическая формула дает нам простейшее соотношение, а не фактическое количество атомов элемента. Вот несколько примеров эмпирических формул, полученных из молекулярных формул:
Иногда есть молекулярные формулы, которые уже находятся в их простейшем соотношении, что означает, что они не могут быть далее сокращены.В этих случаях молекулярная формула совпадает с эмпирической формулой, которую можно увидеть на этих примерах.
В сахарозе индексы 12, 22 и 11 не имеют наибольшего общего множителя, поэтому их нельзя уменьшить. То же самое и с этанолом.
Структурная формула
Когда мы просто записываем молекулярную формулу, мы не знаем, как атомы расположены или какие атомы связаны друг с другом.Структурная формула показывает как фактическое количество атомов элементов в соединении, так и то, как атомы расположены, и какие атомы связаны друг с другом.
Вот структурные формулы этана, пропана и этанола. Молекулярные формулы каждого из них отражены под структурными формулами.
Давайте посмотрим на этан. Это показывает, что атом углерода (C) слева связан с тремя атомами водорода (H) и другим атомом углерода.Углерод справа также связан с тремя атомами водорода и углеродом слева.
Иногда встречаются соединения, которые имеют одинаковую молекулярную формулу, но разную химическую структуру. Например, соединения этанол и диметиловый эфир имеют одинаковую молекулярную формулу C2H6O, но разные структуры:
Краткая структурная формула
Структурные формулы может быть утомительно писать и рисовать, и они занимают много места.Однако есть другой способ написать структурные формулы, и это делается путем написания сжатой структурной формулы. Сводная структурная формула показывает положение атомов по отношению друг к другу без указания их связей.
Для более сложных структур сжатая структурная формула показывает ограниченную информацию. Однако для более простых химических веществ этого типа формулы достаточно. Вот несколько примеров сокращенных структурных формул:
Сводная структурная формула также является хорошим способом записать формулы длинных цепочек или повторяющихся групп, как показано здесь:
Краткое содержание урока
Химические формулы очень важны при поиске информации о химическом соединении, потому что они показывают, какие элементы присутствуют, а также пропорции атомов элементов, обнаруженных в химическом веществе или соединении.Различные типы химических формул показывают присутствующие элементы, а также соотношение элементов, присутствующих в химическом соединении. Каждый тип химической формулы предоставляет различную информацию о химическом соединении.
Эмпирическая формула дает нам простейшее соотношение атомов элементов в соединении. Молекулярная формула сообщает нам фактическое количество атомов для каждого элемента, присутствующего в соединении. Структурная формула показывает фактическое количество атомов элементов, а также дает нам пространственное расположение атомов и то, какие атомы связаны друг с другом.Концентрированная структурная формула похожа на сокращенный или сокращенный способ записи структурной формулы, которая по-прежнему дает пространственное расположение атомов различных элементов, не занимая столько места, сколько структурная формула.
Типы химических формул
| Молекулярный | Эмпирический | структурный | Конденсированные структурные |
|---|---|---|---|
| Показывает количество атомов для каждого элемента в соединении. |
