Содержание
11. Химические свойства оснований. Химические свойства кислот.
Кислоты — это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
Общая формула кислот НnА, где А — кислотный остаток.
1. Диссоциация
HCl = H+ + Cl–
Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H2SO4 = H+ + НSO4– (1 ступень)
HSO4– = H+ + SO42– (2 ступень)
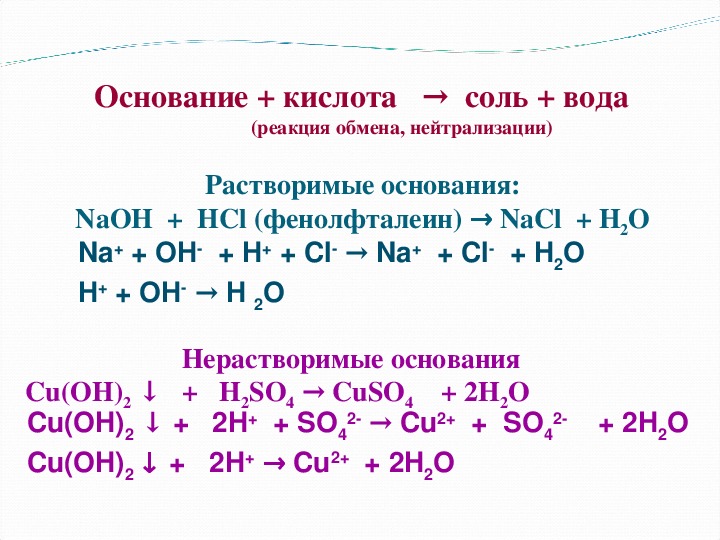
2. Взаимодействие с основаниями и амфотерными гидроксидами
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O
3. Взаимодействие с основными и амфотерными оксидами
H2SO4 + CaO = CaSO4 + H2O
H2SO4 + ZnO = ZnSO4 + H2O
4. Взаимодействие с металлами
Взаимодействие с металлами
а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, h3SO4, h4PO4 и др.).
В реакцию вступают металлы, расположенные в ряду активности до водорода:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
2HCl + Fe = FeCl2 + H2
б) кислоты-окислители по аниону (концентрированная серная, азотная любой концентрации):
2Fe + 6H2SO4 (конц.) = Fe2(SO4)3 + 3SO2 + 6H2O
5. Взаимодействие с солями
Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок:
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
СaCl2 + H2SO4 = CaSO4 + 2HCl
6. Разложение.
При разложении кислородсодержащих кислот получаются кислотный оксид и вода.
H2SiO3 = SiO2 + H2O
Кислоты-окислители разлагаются сложнее:
4НNO3 = 4NO2 + 2H2O + O2
Интернет-источники
ЕГЭ. Химические свойства оснований
Химические свойства оснований
1. Щелочи (растворимые основания) из металлов реагируют только с Zn, Be и Al:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Cr + NaOH → реакция не идет
Fe + NaOH → реакция не идет
2. Щелочи из неметаллов реагируют только с S, P, Si и галогенами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
3. Основания взаимодействуют с кислотами с образованием средних, кислых или основных солей. Тип соли зависит от соотношения реагентов: например, в избытке кислоты образуются кислые соли.
Условие: один из реагентов должен быть растворимым.
H2SO4 + 2KOH → K2SO4 + 2H2O (соотношение реагентов 1:2)
H2SO4 + KOH → KHSO4 + H2O (соотношение реагентов 1:1)
HCl + Cu(OH)2 → CuOHCl + H2O или
2HCl + Cu(OH)2 → CuCl2 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет, так как и H2SiO3 и Cu(OH)2 нерастворимые.
4. Основания взаимодействуют с солями
Основания взаимодействуют с солями
Условие: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2 + 2NaCl
NaOH + NH4NO3 → NH3 + NaNO3 + H2O
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
5. Основания реагируют с кислотными оксидами. Если оксид в избытке образуется кислая соль:
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
6. Щелочи реагируют с амфотерными оксидами:
1) реакции в растворе:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
2) реакции при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (метаалюминат натрия)
7. Щелочи реагируют с амфотерными гидроксидами:
Щелочи реагируют с амфотерными гидроксидами:
1) реакции в растворе:
Zn(OH)2 + NaOH → Na2[Zn(OH)4]
Be(OH)2 + NaOH → Na2[Be(OH)4]
Al(OH)3 + NaOH → Na[Al(OH)4]
2) реакции при сплавлении:
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O (кислота: H2ZnO2)
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O (кислота: H2BeO2)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (кислота: HAlO2)
8. Нерастворимые основания (а также Ca(OH)2 и LiOH) разлагаются при нагревании:
Ca(OH)2 → CaO + H2O
2LiOH → Li2O + H2O
Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O.
Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.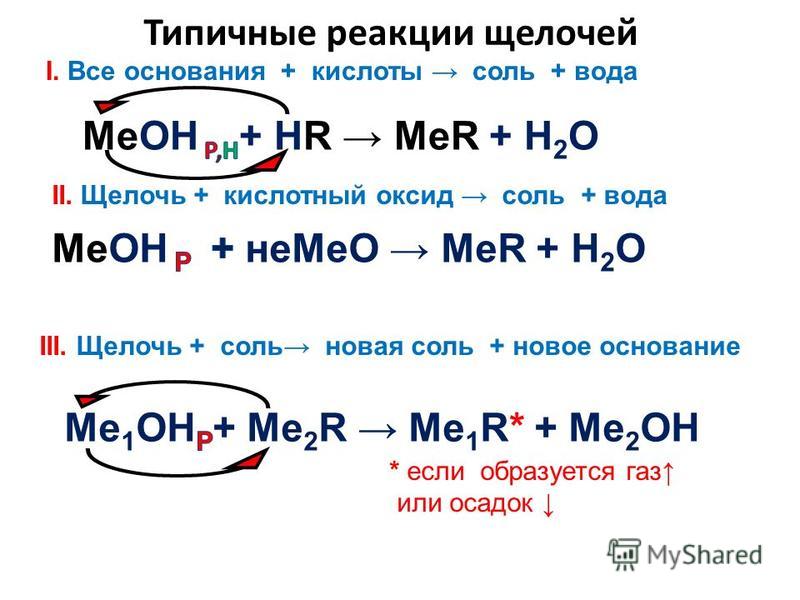
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
<. p>
p>
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.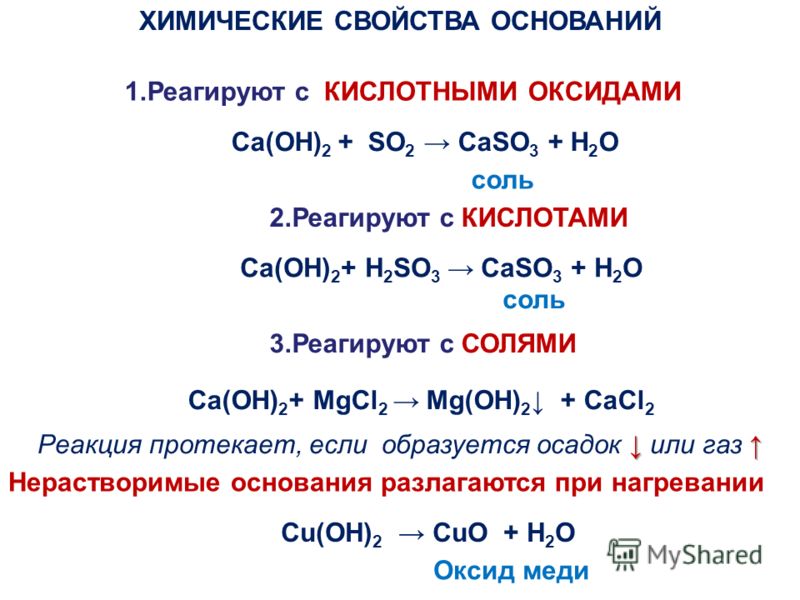
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т. е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
ЗАДАНИЯ ПО ХИМИИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ПО ТЕМЕ «ОСНОВАНИЯ»
ЗАДАНИЯ ПО ХИМИИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ПО ТЕМЕ «ОСНОВАНИЯ»
- Срок
Нет даты выполнения
- Баллы
Нет
|
1.
| |
|
ИСХОДНЫЕ ВЕЩЕСТВА
|
ПРОДУКТЫ РЕАКЦИИ
|
|
Cd(OH)2 + HCl =
|
|
|
KOH + H2SO4 =
|
|
|
NaOH + SO2 =
|
|
|
KOH + Al2O3 =
|
|
|
Fe(OH)3 =t =
|
|
|
Mg(OH)2+ N2O5 =
|
|
|
NaOH + ZnCl2 =
|
|
|
Ca(OH)2 + Cl2O7 =
|
|
|
Mg(OH)2+ HClO4 =
|
|
|
2.
| |
|
3. С какими из перечисленных веществ: серной кислотой, гидроксидом калия, оксидом бария, железом, нитратом железа (II) — будет взаимодействовать гидроксид бария? Напишите уравнения возможных реакций.
| |
|
4. С какими из перечисленных веществ будет взаимодействовать гидроксид железа (III): медь, азотная кислота, вода, гидроксид стронция, оксид железа(II), соляная кислота — будет взаимодействовать оксид кальция? Напишите уравнения возможных реакций. Напишите уравнение реакции, протекающей при нагревании гидроксида железа (III).
| |
|
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Zn → ZnCl2 → Zn(OH)2 → Zn(NO3)2
| |
0
Критерий оценки
Невозможно изменить критерий оценки после того, как вы начали использовать его.
Заголовок
Вы уже оценили студентов с помощью этого критерия оценки. Серьезные изменения могут повлиять на результаты оценки.
Для создания записей видео и звука на компьютере должна быть включена веб-камера. Если на компьютере отсутствует веб-камера, можно записывать звуковые сообщения, установив подключаемый модуль Google Video Chat.
Физические и химические свойства оснований
Все неорганические основания классифицируют на растворимые в воде (щелочи) – NaOH, KOH и нерастворимые в воде (Ba(OH)2, Ca(OH)2). В зависимости от проявляемых химических свойств среди оснований выделяют амфотерные гидроксиды.
Химические свойства оснований
При действии индикаторов на растворы неорганических оснований происходит изменение их окраски, так, при попадании в раствор основания лакмус приобретает синюю окраску, метилоранж – жёлтую, а фенолфталеин – малиновую.
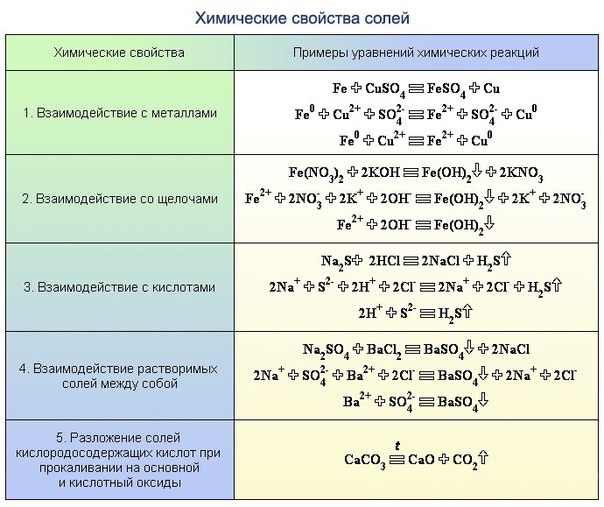
Неорганические основания способны реагировать с кислотами с образованием соли и воды, причем, нерастворимые в воде основания взаимодействуют только с растворимыми в воде кислотами:
Cu(OH)2↓ + H2SO4 = CuSO4 +2H2O;
NaOH + HCl = NaCl + H2O.
Нерастворимые в воде основания термически неустойчивы, т.е. при нагревании они подвергаются разложению с образованием оксидов:
2Fe(OH)3 = Fe2O3 + 3 H2O;
Mg(OH)2 = MgO + H2O.
Щелочи (растворимые в воде основания) взаимодействуют с кислотными оксидами с образованием солей:
NaOH + CO2 = NaHCO3.
Щелочей также способны вступать в реакции взаимодействия (ОВР) с некоторыми неметаллами:
2NaOH + Si + H2O → Na2SiO3 +H2↑.
Некоторые основания вступают в реакции обмена с солями:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓.
Амфотерные гидроксиды (основания) проявляют также свойства слабых кислот и реагируют с щелочами:
Al(OH)3 + NaOH = Na[Al(OH)4].
К амфотерным основаниям относятся гидроксиды алюминия, цинка. хрома (III) и др.
Физические свойства оснований
Большинство оснований – твердые вещества, которые характеризуются различной растворимостью в воде. Щелочи – растворимые в воде основания – чаще всего твердые вещества белого цвета. Нерастворимые в воде основания могут иметь различную окраску, например, гидроксид железа (III)- твердое вещество бурого цвета, гидроксид алюминия – твердое вещество белого цвета, а гидроксид меди (II) – твердое вещество голубого цвета.
Получение оснований
Основания получают разными способами, например, по реакции:
— обмена
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4;
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓;
— взаимодействия активных металлов или их оксидов с водой
2Li + 2H2O→ 2LiOH +H2↑;
BaO + H2O→ Ba(OH)2↓;
— электролиза водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2↑.
Примеры решения задач
Тест по химии для 8 класса «Основания и их химические свойства»
Всероссийский дистанционный конкурс для педагогов на лучшую методическую разработку «Тест по химии»
Тест по химии 8 класс «Основания и их химические свойства»
Тест по химии предназначен для текущей проверки знаний учащихся 8 класса по теме «Основания и их химические свойства». Тесты включают в себя 20 заданий, на выполнение которых отводится 45 минут. Тест представлен в формате ОГЭ, где к каждому заданию даны варианты ответов, из которых нужно выбрать правильный.
Тест способствует развитию умений анализировать, исследовать. При ответе на вопросы учащиеся развивают аналитическое мышление, совершенствуют умения обобщать и делать выводы.
Данный материал Вы можете использовать не только на уроке, но и при подготовке учащихся к ОГЭ
Инструкция по выполнению работы
Тестовая работа состоит из двух частей, включающих в себя 20 вопросов.
Часть первая 18 заданий, вторая 2 задания на соответствие.
18 вопросов с выбором одного ответа-оцениваются в 1 балл, 2 вопроса на соответствие -оцениваются в 2 балла. Ответы к заданиям 1-18 записываются одной цифрой, 19-20 последовательностью цифр и соответствующих им букв.
Ответы к заданиям 19-20 записываются в виде последовательности цифр, которые переносятся в поле ответа в тексте работы.
При выполнении работы можно пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжённости металлов и непрограммируемым калькулятором.
Баллы, полученные за правильные ответы, суммируются. В случае ошибочного ответа аккуратно зачеркните и напишите рядом правильный ответ.
Контрольно — измерительные материалы
Инструкция по выполнению работы
Тестовая работа состоит из двух частей, включающих в себя 20 вопросов.
Часть первая 18 заданий, вторая 2 задания на соответствие.
18 вопросов с выбором одного ответа-оцениваются в 1 балл, 2 вопроса на соответствие оцениваются в 2 балла. Ответы к заданиям 1-18 записываются одной цифрой, 19-20 последовательностью цифр и соответствующих им букв
Ответы к заданиям 19-20 записываются в виде последовательности цифр, которые переносятся в поле ответа в тексте работы.
При выполнении работы можно пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжённости металлов и непрограммируемым калькулятором.
Баллы, полученные за правильные ответы, суммируются. В случае ошибочного ответа аккуратно зачеркните и напишите рядом правильный ответ.
Часть 1
Ответом к заданиям 1-18 является одна цифра, соответствующая номеру правильного ответа. Запишите ее в бланк ответов.
Запишите ее в бланк ответов.
Соединение состава Сu(OH)2 называется:
А) гидроксид меди (I)
Б) гидрид меди (II)
В) гидроксид меди (II)
Г) медный купорос
2. В щелочной среде малиновую окраску приобретает индикатор:
А) метиловый оранжевый
Б) лакмус
В) фенолфталеин
3. Какое из приведенных ниже веществ является основанием:
А) СuCl2
Б) Fe(OH)2
B) Na2SO4
Г) СаО
4. При нагревании разлагается:
А) гидроксид натрия
Б) гидроксид меди (II)
В) гидроксид аммония
Г) гидроксид лития
5. Щелочь не взаимодействует с:
А) основным оксидом
Б) кислотой
В) солью
Г) кислотным оксидом
6. Формулы только оснований записаны в ряду:
Формулы только оснований записаны в ряду:
А) К2О, КОН, Fe(OH)2
Б) Li2O, Na2O, Cu(OH)2
В) NaOH, KOH, Al(OH)3
Г) Fe(OH)2, Mg(OH)2, Zn(OH)2
7. В щелочах окраска лакмуса меняется на:
А) красную
Б) малиновую
В) желтую
Г) синюю
8.С какими веществами реагирует раствор NaOH:
А) СО2, Сu, Cu(OH)2
Б) h3SO4, SO2, K2SO4
В) HCl, CO2, AlCl3
Г) S, SO2, Na2S
9. Что образуется при взаимодействии NaOH с СО2
А) основание и оксид
Б) соль и вода
В) соль и кислота
Г) соль и водород
10. Основание диссоциирует на:
А) катионы металла и гидроксид анионы
Б) катионы водорода и анионы кислотного остатка
В) катионы металла и анионы кислотного остатка
Г) не подвергаются диссоциации
11. Формулы только щелочей записаны в ряду:
Формулы только щелочей записаны в ряду:
А) NaОH, КОН, Fe(OH)2
Б) Cu(OH)2, Al(OH)3, Zn(OH)2
В) NaOH, KOH, Ba(OH)2
Г) FeO, CuO, SO3
12. Гидроксиду натрия соответствует формула:
А) ZnO
Б) Zn(OH)2
В) ZnOH
Г) Zn2O
13. Малорастворимым основанием является:
А) Cu(OH)2
Б) Са(OH)2
В) Ba(OH)2
Г) Pb(OH)2
14. Какой гидроксид применяется в строительстве, для побелки деревьев, получения хлорной извести:
А) KOH
Б) Са(OH)2
В) Nh5OH
Г) Fe(OH)3
15. Верны ли следующие суждения об основаниях:
1. Основания взаимодействуют с основными и кислотными оксидами
Основания взаимодействуют с основными и кислотными оксидами
2. Реакции щелочей с основаниями называется реакций нейтрализации
А) верно только 1
Б) верно только 2
В) верны оба суждения
Г) оба суждения не верны
16. Какое уравнение соответствует реакции нейтрализации?
А) НСl + Zn = ZnCl2 + h3
Б) h3 + S = h3S
В) НСl + KOH =KCl + h3O
Г) НСl + AgNO3 = AgCl + HNO3
17. Какой гидроксид соответствует оксиду серы (VI):
А) Н2SO3
Б) Н2SO4
В) Н2S
Г) SO3
18. С какими из нижеперечисленных веществ взаимодействует гидроксид натрия:
А) СО2 и К2SO4
Б) Н2SO4 и СО2
В) HNO3 и Al(OH)3
Г) ZnO и СuCl2
Часть 2
19. Установите соответствие между названием оксида и его формулой:
Название основания | Формула основания |
Гидроксид алюминия | А. Ba(OH)2 |
Гидроксид железа (III) | Б. Fe(OH)3 |
Гидроксид натрия | В. Al(OH)3 |
Гидроксид бария | Г. Al2O3 |
Д. NaOH | |
Е. Fe(OH)2 |
20. Установите соответствие между формулой гидроксида и продуктами его взаимодействия с избытком соляной кислоты:
Название основания | Формула основания |
Гидроксид аммония | А. LiCl + h3O |
Гидроксид железа (III) | Б. Nh5Cl + h3O |
Гидроксид натрия | В. FeCl3 +h3O |
Гидроксид лития | Г. NaCl + h3 |
Д. NaCl + h3O | |
Е. FeCl2 + h3O |
Ответы:
1. в
2. в
3. б
4. б
5. а
6. в
7. г
8. в
9. б
10. а
11. в
12. б
13. б
14.б
15. б
16. в
17. б
18. б
19. 1-в 2-б 3-д 4-а
20. 1-б 2-в 3-д 4-а
Кислоты и основания — Электронный учебник K-tree
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое
pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота — это всё что с H, а основание — c OH. НО! Не всегда. Что бы отличать кислоту от основания
необходимо… запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с
Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот
и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу — это класс веществ, которые
в реакции с водой диссоциируют (распадаются), образовывая катион водорода H+. Основания Аррениуса в водном растворе образуют
анионы OH—. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать
протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила
справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад
HCl на H+ и Cl—.
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион,
в водном растворе выделяют анион OH—.
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется
газ.
Часто используемые кислоты:
H2O, H3O+, CH3CO2H, H2SO4,
HSO4−, HCl, CH3OH, NH3
Часто используемые основания:
OH−, H2O, CH3CO2−,
HSO4−, SO42−, Cl−
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы.
Пример сильной кислоты — соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl—(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO3 — азотная кислота
- HClO4 — хлорная кислота
- H2SO4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + h3O(ж) → h4O+(р-р) + F—(р-р) —
в такой реакции более 90% кислоты не диссоциирует:
[H3O+]=[F—] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов,
чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
- H2SiO3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены,
щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH—:
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH—(р-р)
Большинство слабых оснований — это анионы:
F—(р-р) + H2O ↔ HF(р-р) + OH—(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и
основания, результирующий раствор будет нейтральным.
Пример:
H3O+ + OH— ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH—(р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства
основания:
HX(р-р) + OH—(р-р) ↔ H2O + X—(р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H+ ↔ NH4
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от
равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH—(р-р)
Kc = [H3O+][OH—]/[H2O]2
Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее
равенство: [H3O+][OH—] = 10-14, что называется константой
диссоциации воды. Для чистой воды [H3O+] = [OH—] = 10-7,
откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество
имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический
сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора,
используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-.
В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют
в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH:
не отдают ионы ни H+, ни OH— в воде. Например, Cl—, NO—3,
SO2-4, Li+, Na+, K+.
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F—, CH3COO—,
CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного
основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание
с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв
на pH раствора - Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Реакции кислот, оснований и нейтрализации
4.12: Кислоты, основания и реакции нейтрализации
Кислотно-основная реакция — это реакция, в которой ион водорода H + передается от одного химического соединения к другому. Такие реакции имеют центральное значение для многочисленных природных и технологических процессов, начиная от химических превращений в клетках, озерах и океанах до промышленного производства удобрений, фармацевтических препаратов и других веществ, необходимых для общества.
Есть несколько способов определения кислоты. В контексте водных растворов кислота — это вещество, которое растворяется с образованием ионов водорода.
Это определение кислоты по Аррениусу, названное в честь шведского химика Сванте Аррениуса (1859–1927). Ион водорода, обозначенный символом H + , называется протоном. В растворе протоны химически соединяются с молекулами воды через неподеленные пары кислорода, образуя ионы гидроксония, H 3 O + .
Химическое уравнение ионизации кислоты записывается как
Кислоты, которые полностью реагируют с водой таким образом, называются сильными кислотами. HCl, HNO 3 и HBr — несколько примеров.
Большинство кислот, встречающихся в повседневной жизни, — это слабые кислоты. Лимонная кислота во фруктах, уксусная кислота в уксусе и молочная кислота в молоке — вот несколько примеров. Знакомый пример слабой кислоты — уксусная кислота, главный ингредиент пищевого уксуса.При растворении в воде в обычных условиях только около 1% молекул уксусной кислоты находится в ионизированной форме, CH 3 CO 2 —.
Использование двойной стрелки в приведенном выше уравнении обозначает аспект частичной реакции этого процесса.
Основание — это вещество, которое растворяется в воде с образованием гидроксид-ионов, OH —. Наиболее распространенными основаниями являются ионные соединения, состоящие из катионов щелочных или щелочноземельных металлов (группы 1 и 2) в сочетании с гидроксид-ионом, например, NaOH и Ca (OH) 2 .В отличие от кислотных соединений, обсуждавшихся ранее, эти соединения не вступают в химическую реакцию с водой; вместо этого они растворяются и диссоциируют, высвобождая ионы гидроксида непосредственно в раствор. Например, KOH и Ba (OH) 2 растворяются в воде и полностью диссоциируют с образованием катионов (K + и Ba 2+ соответственно) и гидроксид-ионов, OH —. Эти основания, наряду с другими гидроксидами, которые полностью диссоциируют в воде, считаются сильными основаниями.
Рассмотрим для примера растворение гидроксида натрия в воде:
Это уравнение подтверждает, что гидроксид натрия является основанием.При растворении в воде NaOH диссоциирует с образованием ионов Na + и OH —. Это также верно для любого другого ионного соединения, содержащего ионы гидроксида. Поскольку процесс диссоциации по существу завершается, когда ионные соединения растворяются в воде в типичных условиях, NaOH и другие ионные гидроксиды классифицируются как сильные основания.
В отличие от ионных гидроксидов, некоторые соединения образуют ионы гидроксида при растворении в результате химической реакции с молекулами воды. Во всех случаях эти соединения реагируют только частично и поэтому классифицируются как слабые основания.Эти типы соединений также широко распространены в природе и являются важным сырьем в различных технологиях. Например, глобальное производство слабого основного аммиака обычно превышает 100 метрических тонн в год, потому что он широко используется в качестве сельскохозяйственных удобрений, сырья для химического синтеза других соединений и активного ингредиента в бытовых чистящих средствах. При растворении в воде аммиак частично реагирует с образованием гидроксид-ионов, как показано здесь:
Это, по определению, кислотно-основная реакция, включающая перенос ионов H + от молекул воды к молекулам аммиака.В типичных условиях только около 1% растворенного аммиака присутствует в виде ионов NH 4 + .
Реакция нейтрализации — это особый тип кислотно-основной реакции, в которой реагентами являются кислота и основание (но не вода), а продуктами часто являются соль и вода:
Чтобы проиллюстрировать реакцию нейтрализации, рассмотрим, что происходит, когда обычный антацид, такой как молоко магнезии (водная суспензия твердого Mg (OH) 2 ), проглатывается для облегчения симптомов, связанных с избытком желудочной кислоты (HCl):
Обратите внимание, что помимо воды в этой реакции образуется соль хлорид магния.H + ( водн. ) из кислоты (сильной или слабой) соединяется с OH — ( водн. ) из основания (или полученным реакцией слабого основания с водой) с образованием H 2 O ( л ). Например, реакция между водными растворами HCl (сильная кислота) и NaOH (сильное основание) записывается следующим образом:
И HCl, и NaOH подвергаются 100% ионизации. Таким образом, полное ионное уравнение можно записать как:
Cl — и Na + называются ионами-наблюдателями, которые компенсируются, давая чистое ионное уравнение как:
Этот текст адаптирован из OpenStax Chemistry 2e, раздел: 4.2: Классификация химических реакций.
Кислотно-основные реакции | Типы реакций
13.2 Кислотно-основные реакции (ESBQY)
Реакция между кислотой и основанием известна как реакция нейтрализации . Часто при взаимодействии кислоты и основания образуются соль и вода. Мы рассмотрим несколько примеров кислотно-основных реакций.
В химии слово соль не означает белое вещество, которым вы посыпаете пищу (это белое вещество является солью, но не единственной солью).{-} \) ионы. Соль все еще образуется как единственный продукт, но вода не образуется.
Важно понимать, насколько полезны эти реакции нейтрализации. Ниже приведены несколько примеров:
Бытовое использование
Оксид кальция (\ (\ text {CaO} \)) — это основа (все оксиды металлов являются основаниями), которую наносят на слишком кислую почву. Порошковый известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие намного медленнее и менее эффективно.Эти вещества также могут использоваться в больших количествах в сельском хозяйстве и в реках.
Известняк (белый камень или карбонат кальция) используется в выгребных ямах (или длинных отстойниках). Известняк — это основа, которая помогает нейтрализовать кислотные отходы.
Биологическое использование
Кислоты в желудке (например, соляная кислота) играют важную роль в переваривании пищи. Однако, когда у человека язва желудка или когда в желудке слишком много кислоты, эти кислоты могут вызвать сильную боль. Антациды используются для нейтрализации кислот, чтобы они не горели так сильно. Антациды — это основания, нейтрализующие кислоту. Примерами антацидов являются гидроксид алюминия, гидроксид магния («молоко магнезии») и бикарбонат натрия («бикарбонат соды»). Антациды также можно использовать для снятия изжоги.
Промышленное использование
Основной гидроксид кальция (известковая вода) может использоваться для поглощения вредного кислого \ (\ text {SO} _ {2} \) газа, который выделяется на электростанциях и при сжигании ископаемого топлива.
Укусы пчел являются кислыми и имеют pH от \ (\ text {5} \) до \ (\ text {5,5} \). Их можно успокоить, используя такие вещества, как бикарбонат соды и молоко магнезии. Обе основы помогают нейтрализовать кислотный укус пчелы и немного уменьшить зуд!
Кислотно-основные реакции
Цель
Для исследования кислотно-основных реакций.
Аппаратура и материалы
- Мерная колба
- Колбы конические
- раствор гидроксида натрия
- раствор соляной кислоты
- пипетка
- индикатор
Метод
Используйте пипетку, чтобы добавить \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в мерную колбу.Долить до отметки водой и хорошо взболтать.
Отмерьте \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в коническую колбу. Добавьте несколько капель индикатора.
Медленно добавьте \ (\ text {10} \) \ (\ text {ml} \) соляной кислоты. Если есть изменение цвета, остановитесь. Если нет, добавьте еще \ (\ text {5} \) \ (\ text {ml} \). Продолжайте добавлять \ (\ text {5} \) \ (\ text {ml} \) приращения, пока не заметите изменение цвета.
Наблюдения
Раствор меняет цвет после добавления заданного количества соляной кислоты.
В приведенном выше эксперименте вы использовали индикатор, чтобы увидеть, когда кислота нейтрализует основание. Индикаторы — это химические соединения, которые меняют цвет в зависимости от того, находятся они в кислоте или в основе.
Включен рекомендуемый эксперимент для неформальной оценки по обнаружению природных индикаторов. Учащиеся могут протестировать множество разноцветных растений, чтобы увидеть, что происходит с каждым растением при смешивании с кислотой или основанием.Основная идея состоит в том, чтобы учащиеся извлекли цвет из растения путем кипячения растительного вещества, а затем сливают жидкость. Для таких веществ, как порошок карри, учащиеся могут растворить его в воде, а для чая они могут заварить чашку чая, а затем вынуть пакетик перед тестом. Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полоски бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе.
Важно, чтобы учащиеся не помещали лицо или нос прямо над стаканом или в него, когда нюхали лук и ванильную эссенцию. Они должны держать стакан в одной руке, а другой рукой доносить (т. Е. Махать рукой взад и вперед) запах в сторону своего лица.
Кислоты и щелочи едкие и могут вызвать серьезные ожоги, поэтому с ними нужно обращаться осторожно.
Показатели
Цель
Чтобы определить, какие растения и продукты питания могут выступать в качестве индикаторов.
Аппаратура и материалы
- Возможные индикаторы: краснокочанная капуста, свекла, ягоды (например, шелковица), порошок карри, красный виноград, лук, чай (ройбуш или обычный), разрыхлитель, ванильная эссенция
- кислоты (например, уксус, соляная кислота), основания (напр.грамм. аммиак (во многих бытовых чистящих средствах)) для испытания
- Стаканы
Метод
Возьмите небольшое количество первого возможного индикатора (не используйте лук, ванильную эссенцию и разрыхлитель). Варить вещество до тех пор, пока вода не изменит цвет.
Отфильтруйте полученный раствор в стакан, стараясь не попасть в стакан. (Также можно вылить воду через дуршлаг или сито.)
Половину полученного окрашенного раствора налейте во второй стакан.
Поместите один стакан на лист бумаги формата А4 с надписью «кислоты». Поместите другой стакан на лист бумаги с надписью «основы».
Повторите со всеми другими возможными индикаторами (кроме лука, ванильной эссенции и разрыхлителя).
Во все мензурки на листе с кислотой осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты.Запишите свои наблюдения.
Во все мензурки на листе основы осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) основы. Запишите свои наблюдения.
Если у вас более одной кислоты или основания, вам нужно будет повторить вышеуказанные шаги, чтобы получить свежие индикаторные образцы для вашей второй кислоты или основания. Или вы можете использовать меньше полученного окрашенного раствора для каждой кислоты и основания, которые вы хотите проверить.
Обратите внимание на запах лука и ванильной эссенции.Положите в стакан небольшой кусочек лука. Это для тестирования с кислотой. Налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты. Помашите рукой над стаканом, чтобы выдувать воздух к носу. Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Поместите небольшой кусочек лука в стакан. Это для тестирования с базой. Залейте \ (\ text {5} \) \ (\ text {ml} \) основы. Помашите рукой над стаканом, чтобы выдувать воздух к носу.Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Наконец, поместите в стакан чайную ложку разрыхлителя. Осторожно налейте в стакан \ (\ text {5} \) \ (\ text {ml} \) кислоты. Запишите свои наблюдения. Повторите, используя базу.
Наблюдения
Вещество | Цвет | Результаты с кислотой | Капуста 3 | ||||||||||||||||||||||||||||||||||||||||||||||
Свекла | |||||||||||||||||||||||||||||||||||||||||||||||||
Ягоды | |||||||||||||||||||||||||||||||||||||||||||||||||
Карри в порошке | |||||||||||||||||||||||||||||||||||||||||||||||||
Лук | |||||||||||||||||||||||||||||||||||||||||||||||||
Ванильная эссенция | |||||||||||||||||||||||||||||||||||||||||||||||||
Разрыхлитель |
| База | Я (-) | Класс (-) | H 2 O | CH 3 CO 2 (-) | RS (-) | CN (-) | РО (-) | NH 2 (-) | CH 3 (-) |
|---|---|---|---|---|---|---|---|---|---|
| Conj.Кислота | HI | HCl | H 3 O (+) | CH 3 CO 2 H | RSH | HCN | ROH | NH 3 | CH 4 |
| pK a | -9 | -7 | -1,7 | 4,8 | 8 | 9.1 | 16 | 33 | 48 |
Нуклеофильность — более сложное свойство. Обычно это относится к скорости реакции замещения в
галогенсодержащий атом углерода эталонного галогенида алкила, такого как CH 3 -Br.
Таким образом, нуклеофильность реагента Nu: (-) в следующей реакции замещения изменяется, как показано на диаграмме ниже. Диапазон реактивности, охватываемый этими реагентами, превышает 5000 раз, причем тиолат является наиболее реактивным.Ясно, что есть существенные различия между этими нуклеофильностями и основностями, обсужденными выше.
Нуклеофильность: CH 3 CO 2 (-) |
| Были задокументированы некоторые полезные тенденции: (i) Для данного элемента отрицательно заряженные частицы являются более нуклеофильными (и основными), чем эквивалентные нейтральные частицы. (ii) Для данного периода периодической таблицы нуклеофильность (и основность) уменьшается при движении слева направо. (iii) Для данной группы таблицы Менделеева нуклеофильность увеличивается сверху вниз ( , т.е. с увеличением размера), , хотя существует зависимость от растворителя из-за водородных связей. Основность различается противоположным образом. |
Для двух или более молекул, содержащих нуклеофильные атомы одного вида и заряда, более сильное основание обычно является более сильным нуклеофилом.Таким образом, 2,2,2-трифторэтоксид (pK a 12) является более слабым основанием и нуклеофилом, чем этоксид (pK a 16). Заметное исключение из этого правила возникает, когда вицинальный (соседний) атом несет несвязывающую электронную пару. Двумя распространенными примерами этого исключения, называемого альфа-эффект , являются гидроксид-ион (pK a 15,7) по сравнению с ионом гидропероксида (pK a 11,6) и аммиак (pK a 9,3) по сравнению с гидразином (pK a 8,0). В каждой из этих пар более слабое основание — более сильный нуклеофил.
Сольватация нуклеофильных анионов заметно влияет на их реакционную способность. Указанные выше нуклеофильности были получены в результате реакций в растворе метанола. Полярные протонные растворители, такие как вода и спирты, сольватируют анионы за счет взаимодействия водородных связей, как показано на диаграмме справа. Эти сольватированные частицы более стабильны и менее реакционны, чем несольватированные «голые» анионы. Полярные апротонные растворители, такие как ДМСО (диметилсульфоксид), ДМФ (диметилформамид) и ацетонитрил, не сольватируют анионы почти так же хорошо, как метанол, но обеспечивают хорошую сольватацию сопутствующих катионов.Следовательно, большинство обсуждаемых здесь нуклеофилов быстрее реагируют в растворах, приготовленных из этих растворителей. Такие эффекты растворителя более выражены для небольших основных анионов, чем для крупных слабоосновных анионов. Таким образом, для реакции в растворе ДМСО наблюдается следующий порядок реактивности:
| Нуклеофильность: I (-) (-) <Класс (-) ~ N 3 (-) |
В отличие от порядка в метаноле (показанном выше), этот порядок примерно соответствует порядку увеличения основности.Нейтральные основания, такие как аммиак и простые первичные и вторичные амины, имеют сходную основность (pKa = от 9 до 11) и также являются хорошими нуклеофилами. В реакциях с бромистым метилом в метаноле их нуклеофильность больше, чем Cl (-) , и меньше, чем N 3 (-) . В слабоосновных апротонных растворителях они реагируют с умеренными электрофилами, такими как алкилгалогениды (Cl, Br и I) и карбонильные группы (альдегиды, кетоны, сложные эфиры и ангидриды), давая четвертичные соли из первых и имины, енамины и амиды из последних. .Третичные амины и объемные вторичные амины являются более бедными нуклеофилами и ведут себя исключительно как основания.
Эффекты растворителя
Кислоты
Ионизация группы кислот в данном растворителе может использоваться как мера силы кислоты, и в таких случаях растворитель служит общим эталонным основанием. Определение значений K a и pK a для любой системы растворителей может быть выполнено таким же образом, как и в воде; однако кислотности, полученные для группы кислот, измеренные в различных растворителях, обычно будут разными, как по числовому значению для каждого, так и иногда в относительном порядке.
| A – H кислота | + | Sol: растворитель | A: (-) сопряженное основание | + | Sol – H (+) конъюгированная кислота |
Есть несколько факторов, которые влияют на измерения кислотности, сделанные в воде и других растворителях. Эти:
1. Ионизация кислоты дает ионы. Растворители с большими диэлектрическими постоянными способствуют образованию и разделению заряда.
2. Конъюгированная кислота из растворителя представляет собой катион, который стабилизируется за счет ассоциации с другими молекулами растворителя, явление, называемое сольватацией.
3. Основание, сопряженное с кислотой, представляет собой анион, который в большинстве случаев также стабилизируется сольватацией.
В качестве примеров рассмотрим следующие данные, полученные для шести сильных кислот в трех распространенных растворителях.
| ||||||||||||||||||||||||||||
| * Хлорная кислота и трифторметансульфоновая кислота полностью ионизированы в воде и ДМСО. Значение pK a , равное –10, является приблизительным и предназначено для отражения высокой степени диссоциации. |
Все три растворителя имеют довольно высокие диэлектрические постоянные, но вода (ε = 80) значительно больше, чем ДМСО (ε = 46,7) или ацетонитрил (ε = 37,5). Более высокая кислотность (более низкий pK a ) последних четырех соединений в воде может быть отнесена на счет диэлектрической разницы; тем не менее, лучшая сольватация анионов, обеспечиваемая водой, считается основным фактором.И ДМСО, и ацетонитрил являются плохими растворителями для анионной сольватации, следовательно, показанное выше ионизационное равновесие будет смещено влево.
Полезно сначала сосредоточить внимание на различиях pK a между водой и ДМСО. Мы делаем это, потому что вода и ДМСО имеют схожую основность, поэтому стабилизация видов кислоты, сопряженной с растворителем, не должна существенно отличаться. HBr и HCl отображают pK a s в ДМСО, которые примерно на 9-10 раз больше, чем в воде, а более слабая кислота HF второго периода показывает еще большее изменение (pK a = 3.17 в воде и 15 в ДМСО). Все сопряженные основания этих кислот представляют собой одноатомные анионы. Поскольку отрицательный заряд локализован, стабилизация анионов путем сольватации, вероятно, является наиболее важным фактором в установлении положения этих равновесий. Напротив, сопряженные основания из серной кислоты и трифторуксусной кислоты внутренне стабилизированы делокализацией заряда по двум или трем атомам кислорода. Следовательно, важность сольватации менее важна, и изменение кислотности в ДМСО снижается до 4-х кратных десяти.
Когда ацетонитрил является растворителем, измеренное значение pK a s этих кислот показывает дальнейшее увеличение, и даже самые сильные кислоты не диссоциируют полностью. Это изменение может быть в значительной степени связано с уменьшением сольватации растворителя, сопряженного с кислотой, которая является основной разновидностью катионов в разбавленных растворах. Поскольку как катионные, так и анионные частицы от кислотной ионизации плохо стабилизируются сольватацией, равновесие диссоциации находится далеко влево (небольшая ионизация).
| Соединение | H 2 O | ДМСО | CH 3 CN |
|---|---|---|---|
| C 2 H 5 OH | 17 | 29 | 42 |
| CF 3 CH 2 OH | 12,4 | 23,5 | 33,5 |
| C 6 H 5 C≡CH | 19 | 29 | 40.6 |
| C 4 H 9 SH | 10,5 | 17 | 28,6 |
| CH 3 CO 2 H | 4,8 | 12,8 | 22,3 |
| C 6 H 5 CO 2 H | 4,2 | 11,1 | 20,7 |
| C 6 H 5 OH | 10 | 18 | 26,6 |
| C 6 H 5 SH | 6.6 | 10,3 | 20,6 |
Большинство органических соединений являются гораздо более слабыми кислотами, чем сильные кислоты, рассмотренные выше. Поэтому представляет интерес определить изменения кислотности, которые имеют место, когда такие соединения исследуются в тех же трех растворителях. Первые четыре соединения в этой таблице (заштрихованные светло-зеленым) представляют собой слабые кислоты с сопряженными основаниями, в которых заряд локализован на одном атоме (O, C и S). Замена воды в растворителе на ДМСО снижает кислотность на 10–12 десятичных степеней для атомов второго периода (C и O) и на 6.5 для третьего периода сульфгидриловой кислоты. Так же, как и в более кислых случаях, рассмотренных выше, сольватация сопряженных основных анионов является важным стабилизирующим фактором в воде, хотя более низкая плотность заряда серы снижает ее значимость. Дальнейшее увеличение pK a , которое происходит в растворах ацетонитрила, относительно ДМСО, довольно равномерно (от 10 до 12 единиц) и немного больше, чем сдвиг, обнаруженный для сильных кислот.
Последние четыре соединения (заштрихованы синим) имеют конъюгированные основания, стабилизированные делокализацией заряда.Здесь снижение кислотности при переходе от воды к ДМСО снижается до 7-8 десятичных степеней для кислорода и менее 4 для серы. Как отмечалось ранее, делокализация заряда внутри аниона снижает важность стабилизации сольватации. Увеличение pK a , обнаруженное для растворов ацетонитрила, остается примерно таким же и может быть связано с плохой сольватацией в этом растворителе.
За исключением производного ацетилена, все предыдущие соединения являются гетероатомными кислотами.Подобные измерения для группы активированных угольных кислот показывают согласие с предыдущим анализом и иллюстрируют способ, которым делокализация анионного заряда снижает pK — разницу между измерениями воды и ДМСО. Обратите внимание на близкую идентичность второго и третьего примеров в следующей таблице. Как и ожидалось, увеличение pK на при переходе в ацетонитрил из ДМСО остается примерно постоянным (около 11).
| Соединение | H 2 O | ДМСО | CH 3 CN |
|---|---|---|---|
| (CH 3 CO) 2 CH 2 | 9 | 13.3 | 24,4 |
| (NC) 2 CH 2 | 11,2 | 11,2 | 22,2 |
| (C 6 H 5 SO 2 ) 2 CH 2 | 11,6 | 12,2 | 23,2 |
| (C 2 H 5 OCO) 2 CH 2 | 13,5 | 16,4 | 27,8 |
| C 4 H 4 CH 2 циклопентадиен | 15.0 | 18,0 | 31,2 |
Основания
Наиболее распространенное обозначение для отчета об относительной силе оснований нейтрального основания (B 🙂 выражается в pK a соответствующих конъюгированных кислот (эти конъюгированные кислоты часто называют «ониевыми» катионами) . Следующее уравнение показывает равновесие, участвующее в этой взаимосвязи. Обратите внимание, что сильные основания будут иметь слабокислые сопряженные кислоты, поэтому pK a пропорционален основной силе нейтрального основания.
| B – H (+) конъюгированная кислота | + | Sol: растворитель | B: основание | + | Sol – H (+) конъюгированная кислота |
Ранее определенные факторы, влияющие на кислотность, теперь могут быть повторно исследованы для этого нового равновесия.
1. Ионы присутствуют в обеих частях уравнения. Следовательно, различия в диэлектрической проницаемости растворителей должны быть относительно несущественным фактором.
2. Катионы кислоты, сопряженной с основанием, и сопряженной с растворителем кислоты, стабилизируются путем сольватации. Это будет решающим фактором, связанным с основностью растворителя.
3. В приведенном выше уравнении нет анионов; однако для нейтрализации заряда требуется противоанион. Поскольку один и тот же анион будет присутствовать в обеих частях уравнения, его влияние на это равновесие будет отменено.
В следующей таблице приведены значения pK и для некоторых важных азотистых оснований, некоторые структуры которых показаны справа.В примерах триэтиламина и DABCO в верхней части таблицы катионный заряд относительно локализован на одном атоме азота. Заряд в лутидине может быть делокализован на кольцевых атомах углерода за счет ароматической стабилизации. Последние три примера — это соединения, в которых заряд делокализован за счет резонанса (протонирование происходит у голубого азота) или внутренней водородной связи (протонная губка).
В отличие от более ранних примеров кислоты pK a s, значения для этих катионов аммония почти идентичны в воде и растворителях ДМСО.Действительно, тот факт, что большинство DMSO pK a s немного ниже, чем их водные аналоги, предполагает, что DMSO является немного более щелочным, чем вода. В ацетонитриле все значения pK и примерно на 10 единиц выше, чем значения для ДМСО.
|
Влияние растворителя на кислотность и основность, указанное выше, может вызвать неожиданные изменения в простых кислотно-основных равновесиях. Если уксусная кислота и триэтиламин смешиваются вместе в воде, происходит быстрый перенос протона с почти количественным образованием ацетата триэтиламмония. Конъюгированные кислоты различаются по силе на 10 6 , и самая слабая из них находится в равновесии.Когда те же два соединения объединяются в растворе ДМСО, перенос протонов незначителен, поскольку уксусная кислота теперь более чем в 10 3 раз слабее кислоты, чем катион триэтиламмония.
Функция кислотности Хаммета
Измерения ионизации водных растворов кислот (и оснований) обычно ограничиваются диапазоном pH от 1,5 до 13. Относительные значения более сильных кислот (и оснований) требуют использования других растворителей, а из-за различий в диэлектрической проницаемости сольватация, и прочие отклонения от идеала, устойчивые отношения не достигаются.Выход из этой ситуации был предложен Луи Хэмметом (Колумбийский университет). Хэмметт предложил использовать серию слабых индикаторных оснований, в которых соотношение [B] / [BH + ] можно было определить колориметрически из-за отчетливо окрашенного конъюгата кислоты. Когда отношение [B] к [BH + ] становится особенно малым и экспериментально невозможно точно измерить, другой, менее щелочной индикатор, перекрывающий первый, может служить для расширения диапазона кислотности. Дополнительные более слабые индикаторные основания позволили бы тогда перепрыгнуть через шкалу кислотности, увеличив ее примерно в 10 10 раз.Для этого определяли функцию кислотности H o , как показано с помощью следующего уравнения.
В идеале H o обеспечивает количественную меру силы кислоты для неводных и концентрированных водных кислот Бренстеда. Функция кислотности — это мера кислотности среды или системы растворителей, обычно выражаемая в терминах ее способности отдавать протоны основанию с известной основностью. Преобладающая разновидность кислоты в разбавленных водных растворах — H 3 O + , поэтому шкала pH является наиболее часто используемой функцией кислотности в таких системах.В концентрированной серной кислоте преобладающим видом кислоты является H 3 SO 4 + , гораздо более сильная кислота, таким образом, H o является расширением шкалы pKa для очень сильных кислот.
Ключевым фактором для измерения значимого H o является выбор подходящего растворителя. Идеально. желателен слабоосновный протонный растворитель, имеющий большую диэлектрическую проницаемость, значительную степень автопротолиза и хорошую сольватацию ионов. Нетрадиционным выбором Хамметта была безводная серная кислота .Несмотря на очевидные опасения по поводу коррозионной активности, гигроскопичности и вязкости, этот выбор оказался вдохновляющим, о чем свидетельствуют следующие характеристики. Поскольку следы воды нежелательны, необходимо титрование SO 3 (дымящая серная кислота) до максимальной температуры плавления.
| автопротолиз 2 H 2 SO 4 H 3 SO 4 (+) + HSO 4 (-) |
|
В следующих таблицах перечислены некоторые индикаторные основания Hammett и H o некоторых очень сильных кислот или «суперкислот». Значение pKa индикаторных оснований определяли в водных растворах сильных кислот H 2 SO 4 и HClO 4 . Значения Ho были определены в безводной серной кислоте, и значения выше -16 являются оценочными.
|
|
|---|
Крепкие базы
Химикам-органикам нужны основы разной силы в качестве реагентов, адаптированных к требованиям конкретных реакций.Нейтральные соединения азота могут охватывать диапазон основности примерно 10 10 , как показано в следующей таблице. Пиридин обычно используется в качестве акцептора кислоты в реакциях с образованием побочных продуктов минеральных кислот. Его основность и нуклеофильность могут быть изменены стерическими препятствиями, как в случае лутидина (pK a = 6,3), или резонансной стабилизацией, как в случае 4-диметиламинопиридина (pK a = 9,2). Основание Хюнига относительно ненуклеофильно (из-за стерических затруднений), и, как DBU, часто используется в качестве основания в реакциях элиминирования E2, проводимых в неполярных растворителях.Основание Бартона представляет собой сильное, слабонуклеофильное нейтральное основание, которое используется в случаях, когда электрофильное замещение DBU или других аминовых оснований является проблемой.
Самыми сильными основаниями, доступными химикам-органикам, являются соли алкоксидов щелочных металлов, такие как трет-бутоксид калия (pK a = от 16 до 19), алкилы щелочных металлов, такие как реактивы Гриньяра, н-бутиллитий и димсил натрия (pK a ). = От 28 до 40 лет) и амидные соли щелочных металлов, такие как LDA (pK a = от 30 до 40) и гидрид натрия (pK a ~ 42).Все эти мощные основания являются потенциальными нуклеофилами (некоторые в большей степени, чем другие) и имеют частично ионные связи с металлами. Основания в этих диапазонах pKa используются для превращения слабых кислот C-H в пригодные для использования карбанионные металлические реагенты.
———————————- | Некоторые примеры получения алкилметаллов вместе с аналогичными металлическими основаниями амидов показаны в следующих уравнениях.Во всех случаях используются инертные растворители, такие как бензол, циклогексан, тетрагидрофуран и простой эфир. Поскольку эти реакции продолжаются до завершения, стрелки равновесия не нарисованы. Иодид метилмагния: CH 3 I + Mg — > CH 3 MgI (эфирный раствор) |
——————————— |
Неионные сверхоснования
Недавно был получен и изучен новый класс неметаллических слабонуклеофильных нейтральных оснований. Некоторые примеры показаны на следующей диаграмме.
Основным сайтом в основании Веркаде является атом фосфора, сопряженная кислота стабилизируется трансаннулярным связыванием с азотом.Сила этих оснований может быть изменена заместителями во фланкирующих атомах азота. Фосфазеновые основания Швезингера увеличивают свою силу, поскольку дополнительные фосфазеновые звенья добавляются вместе с основным сайтом (светло-голубым атомом азота). Все значения pK и для этих оснований измерены в ацетонитриле.
Кинетическая кислотность
Наиболее распространенная кислотно-основная терминология, pK a , отражает равновесную кислотность, экстраполированную или нормированную на воду.В следующем уравнении основание B: (-) M (+) отрывает протон от кислоты HA с образованием конъюгированной пары кислота-основание (A: (-) M (+ ) и BH). Скорость прямого отрыва протона составляет k f , а скорость обратного переноса протона составляет k r . Этот вид равновесия обычно характеризуется константой равновесия K eq , которая представляет собой отношение констант скорости (k f / k r ).Если H-A является более слабой кислотой, чем H-B, равновесие будет находиться слева, и K экв. будет меньше 1.
| H-A + B: (-) M (+) | A: (-) M (+) + B-H | |
| (кислота 1 ) (основание 1 ) | (основание 2 ) (кислота 2 ) |
В случаях, когда H-A намного слабее, чем H-B, K eq может быть слишком маленьким для измерения, но при определенных обстоятельствах можно определить скорость прямого отрыва протона.Если меченый изотопом конъюгат кислоты основания используется в качестве растворителя для реакции (B-D в следующих уравнениях), то любое происходящее отщепление протона будет отмечено преобразованием H-A в D-A. Уравнение, закрашенное зеленым верхом, показывает начальную потерю протона, а второе уравнение описывает быстрое дейтерирование промежуточного сопряженного основания, A: (-) . По мере протекания этих реакций реагент H-A будет все чаще обозначаться как D-A, а скорость изотопного обмена будет указывать на кинетическую кислотность H-A .Предполагается, что кинетическая кислотность примерно пропорциональна равновесной (термодинамической) кислотности, но это не всегда верно.
| растворитель = B-D | ||
| H-A + B: (-) M (+) | A: (-) M (+) + B-H | |
| D-A + B: (-) M (+) | A: (-) M (+) + B-D |
Следующая диаграмма представляет собой поучительный пример этих принципов.Первое уравнение, выделенное желтым цветом, дает важную информацию о тяжелой воде (оксид дейтерия), которая будет использоваться в качестве растворителя в нашем эксперименте. Тяжелая вода во многих отношениях похожа на воду, но она на 10% плотнее и в десять раз слабее кислоты. 1 молярная концентрация дейтероксида натрия будет служить основанием, а эквимолярное количество 3,3-диметил-1-бутина будет служить слабой кислотой. Самый кислый водород в этом углеводороде (окрашен в красный цвет) находится в C-1. На практике нам необходимо использовать сорастворитель для полного растворения углеводорода в тяжелой воде, но это было опущено, чтобы упростить обсуждение.
Второе уравнение описывает существенные изменения, ожидаемые при объединении этих реагентов в тяжелом водном растворителе. Поскольку концевой алкин является гораздо более слабой кислотой, чем тяжелая вода, кислотно-основное равновесие не благоприятствует его сопряженному основанию. Тем не менее, если образуется ацетилид-анион даже в низкой концентрации, он должен быстро отреагировать, отрывая дейтерий от соседней молекулы оксида дейтерия. Результатом будет наблюдаемый обмен дейтерия на водород, свидетельствующий о том, что произошла кислотно-основная реакция.
Поле с зеленым затенением содержит уравнения, которые помогают нам интерпретировать экспериментальные результаты. Чтобы оценить равновесную кислотность субстрата, нам необходимо измерить константу равновесия K eq для начального кислотно-щелочного равновесия, показанного в верхней части заштрихованной рамки. Поскольку нам известны K a 3,3-диметил-1-бутина и тяжелой воды, мы можем оценить K eq , разделив первое (10 -25 ) на второе (10 -17 ).Этот расчет показывает K eq , который было бы трудно измерить напрямую из-за его небольшой величины (10 -8 ). В самом деле, равновесная концентрация ацетилид-аниона оценивается всего в 2 * 10 -10 M.
. Если мы рассмотрим этот эксперимент с точки зрения кинетики, можно получить легко наблюдаемые доказательства терминальной алкиновой кислотности. Последние три строки уравнений в зеленой заштрихованной рамке проясняют это. Поскольку K eq представляет собой отношение констант прямой и обратной скорости, можно сделать выводы о скорости отрыва концевых протонов от алкина.Это приводит к выводу, что будет происходить достаточно быстрый обмен водород-дейтерий, даже если анион ацетилида никогда не присутствует в концентрациях, превышающих 10 -9 M.
Этот пример также демонстрирует пределы подхода изотопного обмена. Подложка 3,3-диметил-1-бутина также имеет девять других атомов водорода (окрашенных в оранжевый цвет), которые не обмениваются с дейтерием в этих условиях. Мы знаем, что эти водороды гораздо менее кислые (K a ок.10 -48 ), и интересно рассмотреть их возможное участие в кислотно-основных реакциях с помощью предыдущего анализа. Расчетное значение K eq для такого образования карбаниона составляет примерно 10 -30 с учетом девятикратного увеличения концентрации. Это означает концентрацию одного карбаниона на каждые 10 9 литров раствора. Кинетический анализ также обескураживает. Константа форвардного курса оценивается в 10 -20 Ms -1 .Следовательно, время, необходимое для обмена половины этих атомов водорода на дейтерий, составит около 100 веков!
Для изучения кинетической кислотности чрезвычайно слабых кислот (pK a s = от 30 до 50) необходимо использовать более сильные основания, которые, конечно, имеют гораздо более слабые сопряженные кислоты. Для этой цели были использованы амидные анионы (pK a s = от 26 до 36).
Путем сравнения скоростей водородного обмена для различных соединений в идентичных условиях можно составить таблицы относительных кинетических кислотностей.Об интересном примере такого исследования сообщалось для группы нитроалканов, имеющих кислые α-атомы водорода. Удаление α-водорода основанием приводит к образованию конъюгированного основания, называемого аци-анионом , как показано здесь.
По сравнению с рассмотренным выше концевым алкином такие нитроалканы представляют собой относительно сильные C-H кислоты.Поскольку они являются более сильными кислотами, чем вода, эксперименты по кинетическому обмену должны проводиться в более мягких условиях, чем те, которые используются для терминального алкина. Это достигается за счет использования меньших концентраций основания и снижения температуры реакции обмена. Точные значения pK и для 2-нитропропана, нитроэтана и нитрометана могут быть измерены непосредственно в водном растворе. Эти кинетическая и равновесная кислотности перечислены в таблице справа. Обратите внимание, что для этих трех соединений кинетическая кислотность изменяется противоположно равновесной кислотности.Кинетический порядок, кажется, отражает стерические препятствия и карбанионную стабильность; тогда как равновесие способствует усиленному замещению двойной связи аци-аниона. |
|
Исследования изотопного обмена, катализируемого основаниями, в соединениях, включающих более одного набора кислых водородов, дают дополнительную информацию о создании и использовании нуклеофильных конъюгированных оснований. Кетоны предоставляют множество примеров образования региоизомерного енолятного основания, и на следующей диаграмме показаны два таких случая. Как отмечалось в исследовании нитроалканов, атомы водорода на α-метильной группе обмениваются быстрее, чем на более замещенных α-атомах углерода.Уравнения на диаграмме показывают только исходный продукт от единственного обмена. Эти продукты содержат дополнительные α-водороды, которые также обмениваются в последующих реакциях такого рода, так что полная замена всех α-водородов дейтерием происходит за короткое время.
Относительная стабильность полученных енолятов увеличивается при замещении енолятной двойной связи. Уравнения, показывающие равновесные концентрации этих изомерных енолятов, будут отображены при нажатии кнопки Toggle Equations .Для определения енолят-анионного равновесия для этих кетонов использовали объемный сильный щелочной бис (триметилсилил) амид натрия (pK a = 26).
Если нажать кнопку Toggle Equations второй раз, выше отобразятся относительные скорости обмена α-водорода для некоторых замещенных циклогексанонов. И снова менее замещенные α-углеродные атомы обмениваются быстрее, но обнаружено, что более высокозамещенные еноляты преобладают в условиях равновесия.Третье нажатие кнопки Toggle Equations отобразит энергетический профиль для случая 2-метилциклогексанона, который должен прояснить различие между кинетической и равновесной кислотностью. Также показаны два других примера. Эти дисплеи можно периодически переключать.
Большинство углеродных кислот образуют сопряженные основания, которые стабилизируются делокализацией заряда на соседних гетероатомах. Эта резонансная стабилизация требует значительной структурной реорганизации исходного соединения, которая, в свою очередь, создает энергетический барьер, замедляющий скорость отрыва протонов.Например, альфа-углерод кетона или сложного эфира должен подвергаться повторной гибридизации при образовании енолят-аниона. Стереоэлектронные требования этого изменения были описаны выше, и неудивительно, что образование енолят-аниона происходит намного медленнее, чем перенос эквивалентных протонов между спиртами и другими гидроксильными соединениями. Скорости депротонирования фенола и нитрометана, соединений с почти идентичными pK a (10,0), являются поучительным примером этого фактора структурной реорганизации.Кислый протон в феноле связан с кислородом, поэтому депротонирование требует небольшого изменения структуры и происходит очень быстро. Нитрометан — это угольная кислота. Депротонирование до аци-аниона включает значительные структурные изменения и в миллион раз медленнее, чем образование фенолята. Эти структурные изменения показаны на следующей диаграмме.
Обратите внимание, что электронная пара O-H в феноле остается в основном на кислороде в соответствующем сопряженном основании, тогда как электронная пара C-H в нитрометане преимущественно смещена на кислород в его сопряженном основании (окрашен в синий цвет).Обозначенные здесь тенденции немного упрощены, поскольку не учитывались влияния растворителей и катионов.
Эта страница является собственностью Уильяма Ройша. Комментарии, вопросы и ошибки следует присылать по адресу:
[email protected].
Микроскопическое описание кислотно-щелочного равновесия
Значение
Кислотно-основные реакции относятся к наиболее важным химическим процессам. Однако у нас нет простого способа описать этот класс реакций как функцию координат атомов.Фактически, будучи растворенными в воде, H + и сопряженный с ним анион OH- имеют сильно текучую структуру, которую трудно определить. Здесь мы решаем эту проблему, принимая точку зрения описания кислотно-основных реакций как равновесия между растворенным веществом и всем растворителем. Это позволяет идентифицировать общеприменимые дескрипторы. Как следствие, теперь стало возможным выполнять количественное моделирование с улучшенным отбором проб кислотно-щелочной реакции в воде и в других средах, таких как полости цеолита или на поверхности.
Abstract
Кислотно-основные реакции имеют повсеместную природу. Понимание их механизмов имеет решающее значение во многих областях, от биохимии до промышленного катализа. К сожалению, эксперименты дают лишь ограниченную информацию без глубокого понимания молекулярного поведения. Атомистическое моделирование могло бы дополнить эксперименты и пролить драгоценный свет на микроскопические механизмы. Однако большие барьеры свободной энергии, связанные с диссоциацией протонов, делают обязательным использование расширенных методов отбора проб.Здесь мы выполняем ab initio моделирование молекулярной динамики (МД) и улучшаем выборку с помощью метадинамики. Это стало возможным благодаря введению дескрипторов или коллективных переменных (CV), которые основаны на концептуально другом взгляде на кислотно-щелочное равновесие. Мы успешно тестируем наш подход на трех различных водных растворах уксусной кислоты, аммиака и бикарбоната. Они представляют кислотное, основное и амфотерное поведение.
Кислотно-основные реакции играют ключевую роль во многих областях химии.Реакции неорганического комплексообразования, сворачивание белка, ферментативные процессы, полимеризация, каталитические реакции и многие другие превращения в различных областях чувствительны к изменениям pH. Понимание роли pH в этих реакциях предполагает контроль их реакционной способности и кинетики.
Решающее значение pH стимулировало сбор большого количества данных о кислотно-щелочном равновесии. Обычно они измеряются в газовой и конденсированной фазах с использованием спектроскопических и потенциометрических методов.Однако существуют практические ограничения точности этих методов, особенно в конденсированных фазах (1). Кроме того, очень трудно извлечь из экспериментальных данных микроскопическую картину происходящих процессов. Поэтому неудивительно, что кислотно-щелочное равновесие было предметом интенсивной теоретической активности (1⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓ – 12).
Кислотность химического вещества в воде может быть выражена через pKa, отрицательный логарифм константы диссоциации кислоты. Есть два способа вычисления этих значений: статический и динамический.
Наиболее стандартным подходом является статический подход, в котором свободные энергии фазы раствора и, следовательно, pKas, получаются путем замыкания цикла Борна – Габера, состоящего из газовой фазы и энергий, свободных от сольватации (1, 3–7). Хотя статический подход во многих случаях чрезвычайно успешен, он имеет некоторые ограничения. Необходимо выбрать сольватационную модель, а модели континуального растворителя имеют ограниченную точность. Это особенно верно для таких систем, как цеолиты или белки, характеризующиеся нерегулярными полостями, в которых неявное описание растворителя затруднительно.Очевидно, что при таком подходе нельзя получить динамическую информацию. Более того, могут быть конкурентные реакции, которые нельзя учесть, если они явно не включены в модель.
В принципе, эти ограничения могут быть сняты с помощью более динамичного подхода, основанного на моделировании молекулярной динамики (МД), в котором молекулы растворителя рассматриваются явно. Если бы у кого-то было неограниченное компьютерное время, такое моделирование исследовало бы все возможные пути и присваивало бы относительный статистический вес различным состояниям.К сожалению, наличие кинетических узких мест сводит на нет эту возможность, удерживая систему в метастабильных состояниях, поскольку различные состояния протонирования разделены большими барьерами. Кроме того, в кислотно-основных реакциях разрываются и образуются химические связи. Это требует использования ab initio MD, в котором межатомные силы вычисляются на лету из теорий электронной структуры. Это делает вычисления более дорогостоящими и еще больше сокращает время, которое можно исследовать.
Чтобы преодолеть эту трудность, становится обязательным использование расширенных методов выборки (13), которые ускоряют исследование конфигурационного пространства.Очень популярный класс расширенных методов выборки основан на определении степеней свободы, которые участвуют в медленной реакции, представляющей интерес. Эти степени свободы обычно называют коллективными переменными (CV) и выражаются как явные функции атомных координат R. Затем выборка усиливается путем добавления смещения, которое является функцией выбранных CV (14⇓ – 16). Кроме того, создание правильного набора хороших резюме также имеет более глубокое значение. Успешные CV в сжатом виде фиксируют физику проблемы, определяют ее медленные степени свободы и приводят к полезному модельному описанию процесса.
В стандартных химических реакциях это относительно просто, поскольку реагентам и продуктам можно приписать четко определенные структуры (17⇓ – 19). Это не относится к кислотно-основным реакциям, в которых протон добавляется или вычитается из растворенного вещества. Как только этот процесс происходит, ионы воды (H + или / и OH-) сольватируются, и их структура становится неуловимой. Фактически, ионы воды могут быстро диффундировать в среде по механизму Гроттуса (20). Они стали очень подвижными, и идентичность атомов, участвующих в их структуре, постоянно меняется.Природу этих видов, таким образом, трудно уловить в явной аналитической функции R. Однако, учитывая актуальность кислотно-основных реакций, было сделано много попыток определить эти сущности (8-12). К сожалению, эти резюме носят временный характер и, будучи успешными в том или ином случае, не могут применяться в целом.
Для создания общих и полезных резюме мы делаем два концептуальных шага. Один из них — рассматривать кислотно-основной процесс как реакцию, в которой участвуют только несколько фрагментов, а именно весь растворитель и реагирующие остатки в сольватированной молекуле.Например, когда существует только один тип диссоциирующего остатка, мы думаем о кислотно-основном равновесии как о реакции типа A + h3NON⇌Bq0 + h3N + q1ONq1, [1] где N — количество молекул воды, A и B — обычная кислотно-основная молекула в растворе и сопряженные с ней разновидности, соответственно, q0 и q1 — целые числа, которые могут принимать значения +1 и -1 в соответствии с кислотно-основным поведением разновидностей, и q1 + q0 = 0.
Это означает, что мы не рассматриваем растворитель как набор молекул, которые конкурируют за взаимодействие с кислотно-основными частицами.Скорее мы рассматриваем растворитель в целом как один из двух аддуктов. Эта точка зрения особенно важна для полярных растворителей, таких как вода, для которых характерны высокоструктурированные сети. В этом случае наличие избытка или недостатка протонов локально изменяет структуру сети, и это искажение распространяется по всей сети.
С самых первых дней работы Вике и Эйгена (21) и Цунделя и Мецгера (22) исследователи боролись с тем, сколько молекул следует включить в определение возмущения (23–25).Учитывая отсутствие физических параметров, способных дать четкий и однозначный ответ на этот вопрос, идея рассмотрения растворителя в целом позволяет обойти эту проблему. Таким образом, растворитель — это не просто среда с пассивной ролью, он рассматривается как ансамбль молекул, которые в совокупности вносят вклад в образование пары сопряженных кислот и оснований. Эта точка зрения намного ближе к исходной, предложенной Бренстедом и Лоури, в которой реакция может рассматриваться как простой обмен водородным катионом между парой кислота-основание.
Чтобы реакция произошла, центр возмущения должен отойти от растворенного вещества. Таким образом, вторым важным шагом является отслеживание центра возмущения. Из-за механизмов, подобных Grotthuss, возмущение перемещается по сети. Это может привести к различным определениям центра дефекта. Однако, если мы замощим все пространство, используя многогранники Вороного с центром на атомах кислорода воды, мы можем однозначно отнести каждый атом водорода к одному и только одному из этих многогранников.Узел, многогранник Вороного которого содержит аномальное число протонов, принимается за центр возмущения (рис. 1).
Рис. 1.
Два примера разбиения пространства. ( Left ) Мы показываем конвективный подход, в котором расстояние от атома кислорода используется для определения его окружения. Видны явно искусственные суперпозиции. ( Right ) Месселяция Вороного не страдает этими недостатками.
Эта точка зрения придает методу очень общий характер, что делает его применимым к любой кислотно-основной системе без необходимости предварительной фиксации реагирующих пар.Таким образом, можно исследовать все соответствующие состояния протонирования даже в системах, состоящих из более чем одной пары кислота-основание.
Этот общий подход позволяет определять CV без необходимости навязывания конкретных структур или выбора идентичности задействованных атомов. Мы тестируем наш метод, выполняя моделирование метадинамики в случае слабой кислоты (уксусная кислота), в слабом основании (аммиак) и в амфотерном веществе (бикарбонат), выбранных в качестве эталонов из-за их сопоставимой силы, но различного кислотно-основного поведения.
Методы
Как обсуждалось выше, мы вводим две CV, одну, связанную с состоянием протонирования, а другую, которая определяет местонахождение дефектов заряда и измеряет их относительное расстояние. Оба этих CV нуждаются в четком определении для отнесения атомов водорода к соответствующему кислотно-основному участку. Для достижения этого результата мы разбиваем все пространство на многогранники Вороного с центрами на кислотно-основных узлах i, расположенных в Ri. Сайты включают все атомы, способные разорвать и образовать связи с протоном кислоты.Стандартное разбиение пространства Вороного описывается набором индексных функций wi (r) с центром на различных Ris, таких что wi (r) = 1, если i-й атом ближайший к r, и w i ( r ) = 0 в противном случае. Для их использования в расширенных методах выборки CV должны быть дифференцируемыми. Для этого мы вводим гладкую версию индексных функций wis (r). Они определяются с помощью функций softmax wis (r) = e − λ | Ri − r | ∑me − λ | Rm − r |, [2] где i и m пробегают все кислотно-основные центры, а λ контролирует крутизну, с которой кривые убывают до 0, то есть селективности функции.При соответствующем выборе λ это определение приводит к желаемому результату, как показано на рис. 2. Таким образом, атом водорода в позиции Rj присваивается многограннику с центром в позиции i с весом wi (Rj). Тогда общее количество атомов водорода, отнесенных к i-му кислотно-основному участку, равно Wi = ∑j∈Hwis (Rj), [3] где суммирование по j проводится по всем атомам водорода.
Рис. 2.
Гладкая мозаика двумерного пространства с ячейками, центрированными на трех атомах кислорода молекулы воды. Плоские синие области представляют собой часть пространства, в которой функция принимает значение 1, а желтые области представляют собой границы между ячейками.Эта поверхность была получена со значением λ = 4.
Каждому кислотно-основному участку можно присвоить эталонное значение Wi0, которое подсчитывает количество связанных атомов водорода в нейтральном состоянии. Разница между мгновенным значением атомов водорода и эталонным составляет δi = Wi-Wi0. [4] Когда оно отличается от нуля, δi будет сигнализировать, получил ли i-й сайт протон или потерял его. В случае атомов кислорода воды ион гидроксония имеет δi = + 1, а ион гидроксида имеет δi = -1.
Затем мы группируем кислотно-основные центры по видам.Например, в случае простейшей аминокислоты глицина в водном растворе количество разновидностей Ns будет равно 3. Все атомы кислорода воды принадлежат одной разновидности; затем в другой разновидности считают два карбоксильных атома кислорода и, наконец, третьей разновидностью считают атом азота аминогруппы.
В духе этой работы мы подсчитываем общий избыток или дефект протонов, связанных с каждым видом: qk = ∑i∈kδi. [5] Это означает, что нас интересует не конкретная идентичность прореагировавшего сайта, а то, или нет, k-й вид в целом увеличился (qk = + 1), уменьшился (qk = −1) или не изменил свое количество протонов.Если мы рассматриваем растворенное вещество только с одним реактивным фрагментом, то каждое возможное состояние системы может быть описано одним из трех двумерных векторов (0,0), (-1,1) или (1, -1).
В общем случае каждое состояние протонирования можно описать вектором q → = (q0, q1,… qNs − 1) с размерностью, равной количеству неэквивалентных реактивных центров, Ns. Более исчерпывающее объяснение дается в Приложении SI .
Для использования в расширенной выборке эти векторы должны быть выражены как скалярная функция f = f (q →) так, чтобы для каждого физически значимого q → f достигала значений, позволяющих различать различные общие состояния протонирования.Есть бесконечно много способов построить скаляр из вектора. Возможно, самый простой выбор — написать f (q →) = X → ⋅q → и, чтобы различать различные состояния протонирования, выбрать X → = (20,21,22,… 2Ns − 1).
Это приводит к следующему определению CV, которое используется для описания состояния протонирования системы, sp = ∑k = 0Ns − 12k⋅qk, [6] где k — индексы, используемые для маркировки соответствующих групп реактивных сайтов. . В приложении СИ Приложение подробно проработан пример. Конечно, CV делается непрерывным за счет использования Wi в вычислении δi, необходимого для оценки qk в уравнении. 5 .
Второй CV представляет собой сумму расстояний между всеми кислотно-основными сайтами, умноженных на их частичный заряд δi, sd = ∑i, m> i − rim⋅δi⋅δm, [7] где индексы i и m проходят по всем кислотно-основные центры принадлежат разным k-группам, а rim — расстояние между двумя атомами. Таким образом, только пара кислота-основание, обменявшая протон, дает вклад, отличный от нуля. Уравнение Код 7 действителен только в том случае, если присутствует одна пара кислотно-основного конъюгата с одним конъюгатом. Однако из-за действия смещения иногда может образоваться несколько кислотно-основных пар.Чтобы избежать выборки этих очень маловероятных событий, мы ограничиваем количество пар. Более подробная информация представлена в приложении SI .
Результаты
Мы применили наш метод к трем водным растворам уксусной кислоты, аммиака и бикарбоната, представляющим слабую кислоту, слабое основание и амфотерное соединение соответственно. Установки всех трех моделей идентичны, за исключением идентичности сольватированных молекул. Это гарантирует, что результат отражает различный химический состав этих трех систем и что нет смещения из-за начального состояния.
Каждое моделирование систем выполнялось с помощью МД-моделирования Борна – Оппенгеймера в сочетании с хорошо темперированной метадинамикой (14, 26) с использованием пакета CP2K (27), исправленного PLUMED 2 (28) и строго ограниченного и соответствующим образом нормированного функционала (29). для xc energy, Exc. Подробнее см. SI Приложение .
На рис. 3 изображены поверхности свободной энергии (FES) как функции sp и sd. Эти FES ярко воспроизводят ожидаемое поведение. Все они имеют минимум при sp = 0, что соответствует состоянию, при котором в растворителе отсутствуют заряды.В FES уксусной кислоты (рис. 3 A ) второй минимум, близкий к sp = -1, отражает его кислотное поведение. Напротив, FES аммиака (рис. 3 B ) показывает второй минимум, близкий к sp = 1. Формы ПЭС аммиака и уксусной кислоты приблизительно связаны зеркальной симметрией, отражающей их контрастное поведение. Точно так же симметричный бикарбонатный FES (рис. 3 C ) отражает его амфотерный характер.
Рис. 3.
( A – C ) Поверхности свободной энергии вдоль sp и sd уксусной кислоты ( A ), аммиака ( B ) и бикарбоната ( C ) в водном растворе.Цветные полосы показывают свободную энергию, выраженную в единицах кДж⋅моль -1 . CV sd выражается в ангстремах.
По мере образования сопряженной пары sd начинает принимать положительные значения, соответствующие разделению и диффузии сопряженной пары. По сравнению с недиссоциированным состоянием, в котором разрешено только sd = 0, состояния, в которых присутствует сопряженная пара, показывают вытянутую форму бассейнов вдоль этой переменной. Это вызвано диффузионным поведением ионов гидроксония и гидроксида в растворе, что делает доступным непрерывный диапазон расстояний.Более того, вдоль этого CV мы можем наблюдать барьер около 1,5, соответствующий разрыву ковалентной связи между атомом водорода и кислотно-основным участком.
Выводы
Общая применимость этого метода к системам с разной природой является важным шагом в их понимании и описании. Схема может быть расширена за счет включения квантовых ядерных эффектов с использованием интегральной молекулярной динамики по траекториям (30). Это имело бы количественное значение, поскольку, например, на значения pKa влияет дейтерирование.Более того, отсутствие предположений или наложений относительно реактивных кандидатов или путей реакции позволяет распространить этот метод на системы возрастающей сложности, которые не могут быть решены с помощью традиционных методов. Примерами вопросов, на которые теперь можно ответить, являются таутомерные равновесия в биохимических процессах и кислотное поведение в цеолитах и на поверхности оксидов, подверженных воздействию воды.
Благодарности
Расчеты проводились на кластере ETH Euler и кластере Mönch в Швейцарском национальном суперкомпьютерном центре.Исследование было поддержано грантом Европейского Союза ERC-2014-AdG-670227 / VARMET.
Сноски
Вклад авторов: E.G., G.P., and M.P. спланированное исследование; НАПРИМЕР. и Г. проведенное исследование; Э.Г., Г.П. и М.П. проанализированные данные; и E.G., G.P., и M.P. написал газету.
Рецензенты: C.D., Венский университет; и D.E.M. Оксфордского университета.
Авторы заявляют об отсутствии конфликта интересов.
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1819771116/-/DCSupplemental.
Как определить положение равновесия для кислотно-щелочной реакции
В предыдущем посте мы узнали о p K a и суммировали факторы, которые влияют на кислотность и значение p K a. Значения p K a в основном используются для прогнозирования положения равновесия кислотно-основной реакции, а также для выбора кислоты или основания для протонирования или депротонирования определенных частиц.
Например. Реакция между уксусной кислотой и гидроксидом натрия — это простая кислотно-основная реакция, которую вы, вероятно, использовали в своем курсе общей химии для эксперимента по кислотно-щелочному титрованию:
Итак, мы знаем, что эта реакция работает, но как мы объясним это в терминах значений p K a?
Вот как это работает. Во-первых, вам необходимо понять и запомнить эту важную концепцию:
Любая кислотно-основная реакция способствует образованию более слабой кислоты и более слабого основания.
Причина этого в том, что, как и любая химическая реакция или процесс, кислотно-основные реакции переходят в более низкое энергетическое состояние. Сильная кислота или основание означает, что они обладают большой энергией и очень реактивны, тогда как более слабые кислоты и основания имеют меньшую энергию.
Следовательно, чтобы предсказать положение равновесия, выполните следующие действия:
1) Определите кислоту и сопряженную кислоту основания:
В данном случае это уксусная кислота и вода соответственно.Помните, что кислота является донором протонов (CH 3 COOH), основание является акцептором протонов ( — OH), а сопряженная кислота является протонированной формой основания (H 2 O).
2) Найдите p K a значения кислоты и конъюгированной кислоты:
p K a (CH 3 COOH) = 4,75, p K a (H 2 O) = 15,7
3) Напишите уравнение реакции, указав положение равновесия более длинной стрелкой:
Вода — это кислота в 10 11 раз более слабая.Следовательно, равновесие смещено вправо. При таких больших различиях в кислотности реакция даже не считается равновесной, и очень часто кислотно-основные реакции показаны одной стрелкой.
Другой пример: На какой стороне, по вашему мнению, находится положение равновесия для следующей реакции?
Давайте выполним шаги, которые мы только что обсудили.
1) Определите кислоту и сопряженную кислоту.Кислота представляет собой алкин, а сопряженная кислота — аммиак (NH 3 ).
2) Найдите их значения p K a:
p K a (CH 3 CCH) = 25, p K a (NH 3 ) = 38
3) Укажите положение равновесия стрелкой большего размера:
Положение равновесия указывает на то, что обратная реакция не происходит в значительной степени, и если бы мы использовали продукты в качестве исходного материала, стрелку противоположного направления потребуется:
Вы также можете предсказать кислотно-щелочную реакцию, не имея значений p K a.Помните, в начале мы говорили, что положение равновесия всегда на стороне более слабой кислоты и более слабого основания. Следовательно, вы можете сравнить основание и конъюгат основания вместо сравнения кислоты и конъюгированной кислоты.
Если основание более стабильно (проверьте факторы, влияющие на стабильность конъюгированного основания), чем конъюгатное основание, реакция благоприятствует реагентам :
Если, с другой стороны, конъюгатное основание является более стабильной, то равновесие благоприятствует продуктам :
Во всех этих примерах у нас была реакция, для которой нам нужно было определить, является ли она возможной кислотно-основной реакцией или нет.
Однако иногда вам могут дать один компонент и попросить выбрать подходящую кислоту или основание для его протонирования или депротонирования. Это также делается на основе значений p K a. Подробное освещение в следующем посте.
1.
Используя значения p K a в таблице, определите положение равновесия для каждой из следующих кислотно-основных реакций: достаточно ли сильна кислота, чтобы протонировать основание, или, что то же самое, достаточно сильное основание, чтобы дептротонировать кислоту в каждой реакции? Или же можно сформулировать вопрос — будет ли каждая из следующих реакций протекать в значительной степени?
Проверьте свои ответы
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединяясь к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению проблем, викторин с несколькими вариантами ответов, головоломок, и мощному набору of Краткое руководство по органической химии 1 и 2 .
Кислотно-основная реакция — Энциклопедия Нового Света
Кислотно-основная реакция — это химическая реакция, которая происходит между кислотой и основанием.Существует несколько концепций, которые обеспечивают альтернативные определения задействованных механизмов реакции и их применение при решении связанных проблем. Несмотря на некоторое сходство в определениях, их важность становится очевидной из-за различных методов анализа, когда они применяются к кислотно-основным реакциям для газообразных или жидких веществ, или когда кислотный или основной характер может быть несколько менее очевидным.
Общие кислотно-основные теории
Определение Лавуазье
Исторически первая научная концепция кислот и оснований была представлена французским химиком Антуаном Лавуазье примерно в 1776 году. [1] Знания Лавуазье о сильных кислотах в основном ограничивались оксикислотами, которые, как правило, содержат центральные атомы в высоких степенях окисления в окружении кислорода, такие как HNO 3 и H 2 SO 4 , и он не был осведомлены об истинном составе галогеноводородных кислот, HCl, HBr и HI. Исходя из своих ограниченных знаний, он определил кислоты с точки зрения содержания в них кислорода, и назвал кислород от греческих слов, означающих «кислотообразующий» (от греческого οξυς (oxys) , что означает «кислота» или «острый» и γεινομαι (гейномай) или «порождающий»).
Определение Лавуазье считалось абсолютной истиной на протяжении более 30 лет, до статьи 1810 года и последующих лекций сэра Хэмфри Дэви, в которых Дэви доказал недостаток кислорода в сероводороде (H 2 S), теллуриде водорода (H 2 Te) и галогеноводородные кислоты.
Определение Либиха
Примерно в 1838 г., [2] Юстус фон Либих предложил новое определение кислот, основанное на его обширных работах по химическому составу органических кислот.На этом завершился доктринальный переход от кислот на основе кислорода к кислотам на основе водорода, начатый Дэви. Согласно Либиху, кислота — это водородсодержащее вещество, в котором водород может быть заменен металлом. [3] Определение Либиха, будучи полностью эмпирическим, использовалось почти 50 лет до принятия определения Аррениуса. [4]
Определение Аррениуса
Разработанная после теории замещения металлов Юстуса фон Либиха и, несмотря на некоторые модификации более поздних теорий, концепция Аррениуса (на фото) остается простым научным определением характера кислотно-основной реакции. [5]
Определение кислотно-основных реакций по Аррениусу представляет собой более упрощенную концепцию кислотно-основных реакций, разработанную Сванте Аррениусом, которая использовалась для обеспечения современного определения оснований, вытекающего из его работы с Фридрихом Вильгельмом Оствальдом при установлении присутствия ионов в водном растворе в 1884 году, и привело к тому, что Аррениус получил Нобелевскую премию по химии в 1903 году за «признание выдающихся заслуг … оказанных продвижению химии его электролитической теорией диссоциации». [5]
Как было определено во время открытия, кислотно-основные реакции характеризуются кислотами Аррениуса, которые диссоциируют в водном растворе с образованием водорода или ионов оксония (H 3 O + ), которые позднее называются оксониевыми (H 3 O + ), [5] и основания Аррениуса, которые образуют ионы гидроксида (OH — ). В более поздних рекомендациях IUPAC предлагается использовать новый термин «гидроксоний» [6] в пользу более старого принятого термина «оксоний» [7] для иллюстрации механизмов реакции, таких как те, что определены в системе Бренстеда-Лоури и системе растворителей. определения более четкие, с определением Аррениуса, служащим простой общей схемой кислотно-основного характера [5] Более кратко, определение Аррениуса можно предположить следующим образом: «Аррениусовские кислоты образуют ионы водорода в водном растворе, а основания Аррениуса образуют гидроксид-ионы. .»
Универсальное водное кислотно-основное определение . концепции Аррениуса описывается как образование воды из ионов водорода и гидроксида или ионов гидроксония и гидроксид-ионов, образующихся в результате диссоциации кислоты и основания в водном растворе (2 H 2 O → OH — + H 3 O + ) [8] , что приводит к определению, что в кислотно-основных реакциях Аррениуса соль и вода образуются в результате реакции между кислотой и основание — [5] в более простых научных определениях эта форма реакции называется реакцией нейтрализации.
- кислота + + основание — → соль + вода
Положительный ион основания может образовывать соль с отрицательным ионом кислоты. Например, два моля основного гидроксида натрия (NaOH) могут соединяться с одним моль серной кислоты (H 2 SO 4 ) с образованием двух молей воды и одного моля сульфата натрия.
- 2NaOH + H 2 SO 4 → 2 H 2 O + Na 2 SO 4
Определение Brønsted-Lowry
Определение Brønsted-Lowry, сформулированное независимо двумя его сторонниками Йоханнес Николаус Бренстед и Мартин Лоури в 1923 году основали идею протонирования оснований за счет депротонирования кислот, что обычно называется способностью кислот «отдавать» ионы водорода (H + ) или протоны основаниям. , которые их «принимают». [9] В отличие от определения Аррениуса, определение Бренстеда-Лоури относится к продуктам кислотно-основной реакции как к конъюгированным кислотам и основаниям, чтобы указать на связь одного протона и указать, что произошла реакция между двумя величинами, а не «образование» из соли и воды, как объясняется в определении Аррениуса. [5] [9]
Он определяет, что в реакциях происходит передача и прием протона, что по существу относится к удалению иона водорода, связанного внутри соединения, и его реакции с другим соединением, [10] , а не удаление протона из ядра атома, которое потребовало бы чрезмерных количеств энергии, недостижимых путем простой диссоциации кислот.В отличие от определения Аррениуса, определение Бренстеда-Лоури постулирует, что для каждой кислоты существует конъюгированная кислота и основание или «конъюгированная пара кислота-основание », которая образуется в результате полной реакции, которая также включает воду, амфотерный: [10] [5] [9]
|
Определение Льюиса
- Дополнительная информация: кислота Льюиса и основание Льюиса
Определение Льюиса кислотно-основных реакций, разработанное Гилбертом Н.Льюис в 1923 г. [11] — это всеобъемлющая теория для определений Бренстеда-Лоури и системы растворителей [12] в отношении предпосылки механизма пожертвования, [12] , который, наоборот, приписывает пожертвование электронных пар от оснований и принятия кислотами, а не протонами или другими связанными веществами [12] и охватывает как водные, так и неводные реакции. [12]
- Ag + + 2: NH 3 → [H 3 N: Ag: NH 3 ] +
- Катион серебра реагирует как кислота с аммиаком, который действует как донор электронных пар, образуя аддукт аммиака и серебра
В реакциях между кислотами Льюиса и основаниями происходит образование аддукта [12] , когда самая высокая занятая молекулярная орбиталь (ВЗМО) молекулы , такой как NH 3 с доступной неподеленной электронной парой (парами) отдает неподеленные пары электронов на нижнюю незанятую молекулярную орбиталь (НСМО) электронно-дефицитной молекулы через координационную ковалентную связь; в такой реакции молекула, взаимодействующая с HOMO, действует как основание, а молекула, взаимодействующая с LUMO, действует как кислота. [12] В высокополярных молекулах, таких как трифторид бора (BF 3 ), [12] наиболее электроотрицательный элемент притягивает электроны к своим собственным орбиталям, обеспечивая более положительный заряд на менее электроотрицательном элементе и различие в его электронной структуре из-за аксиального или экваториального положения орбиты его электронов, вызывающее отталкивающие эффекты от неподеленной пары, связывающей пару (Lp-Bp) взаимодействий между связанными атомами сверх тех, которые уже обеспечиваются парным связыванием парных взаимодействий (Bp-Bp). [12] Аддукты с участием ионов металлов называют координационными соединениями. [12]
Определение системы растворителей
Это определение основано на обобщении более раннего определения Аррениуса на все самодиссоциирующие растворители.
Во всех таких растворителях имеется определенная концентрация положительных частиц, сольвониевых катионов и отрицательных частиц, сольватных анионов , в равновесии с нейтральными молекулами растворителя. Например:
- 2H 2 O ⇌ H 3 O + (гидроний) + OH — (гидроксид)
- 2NH 3 ⇌ NH 4 + (аммоний) + NH 2 — (амид)
или даже некоторые апротонные системы
- N 2 O 4 ⇌ NO + (нитрозоний) + NO 3 — (нитрат)
- 2SbCl 3 ⇌ SbCl 2 + (дихлорантимоний) + SbCl 4 — (тетрахлорантимонат)
Растворенное вещество, вызывающее увеличение концентрации сольвониевых ионов и уменьшение сольват-ионов, составляет кислота и одна, вызывающая обратное, — основание .Таким образом, в жидком аммиаке KNH 2 (обеспечивающий NH 2 —) является сильным основанием, а NH 4 NO 3 (обеспечивающий NH 4 + ) сильной кислотой. В жидком диоксиде серы (SO 2 ) тионильные соединения (обеспечивающие SO 2+ ) ведут себя как кислоты, а сульфиты (обеспечивающие SO 3 2-) как основания.
Вот некоторые неводные кислотно-основные реакции в жидком аммиаке
- 2NaNH 2 (основание) + Zn (NH 2 ) 2 (амфифильный амид) → Na 2 [Zn (NH 2 ) 4 ]
- 2NH 4 I (кислота) + Zn (NH 2 ) 2 (амфифильный амид) → [Zn (NH 3 ) 4 )] I 2
Азотная кислота может быть основанием в жидкой серной кислоте:
- HNO 3 (основание) + 2H 2 SO 4 → NO 2 + + H 3 O + + 2HSO 4 —
И все становится еще более странным в апротическом мире, например, в жидком N 2 O 4 :
- AgNO 3 (основание) + NOCl (кислота) → N 2 O 4 + AgCl
Поскольку определение системы растворителей зависит от растворителя, а также от самого соединения , одно и то же соединение может менять свою роль в зависимости от выбора растворителя.Таким образом, HClO 4 представляет собой сильную кислоту в воде, слабую кислоту в уксусной кислоте и слабое основание в фторсульфоновой кислоте.
Другие кислотно-основные теории
Определение Усановича
Наиболее общее определение дано российским химиком Михаилом Усановичем, и его можно кратко охарактеризовать как определение кислоты как «всего, что принимает отрицательные частицы или дает положительные», и база как обратная. Это имеет тенденцию частично совпадать с концепцией окислительно-восстановительного потенциала (окисление-восстановление), и поэтому химики не очень одобряют его.Это связано с тем, что окислительно-восстановительные реакции больше фокусируются на физических процессах переноса электронов, а не на процессах образования / разрыва связей, хотя различие между этими двумя процессами несколько неоднозначно.
Определение Lux-Flood
Это определение, предложенное немецким химиком Германом Люксом [13] [14] в 1939 году, усовершенствованное Хоконом Потопом около 1947 года. [15] и теперь широко используемое в современной геохимии и геохимии. Электрохимия расплавленных солей описывает кислоту в качестве акцептора оксидных ионов и основание в качестве донора оксидных ионов.Например:
- MgO (основание) + CO 2 (кислота) → MgCO 3
- CaO (основание) + SiO 2 (кислота) → CaSiO 3
- NO 3 — (основание) + S 2 O 7 2- (кислота) → NO 2 + + 2SO 4 2- [16]
Определение Пирсона
In 1963, [17] Ральф Пирсон предложил усовершенствованную качественную концепцию, известную как принцип твердой и мягкой кислотной основы, которая позже стала количественной с помощью Роберта Парра в 1984 году.«Жесткий» относится к видам, которые малы, имеют высокий заряд и слабо поляризуемы. «Мягкий» относится к видам, которые являются крупными, имеют низкие зарядовые состояния и сильно поляризуемы. Кислоты и основания взаимодействуют между собой, и наиболее стабильные взаимодействия — твердо-твердые и мягкие-мягкие. Эта теория нашла применение как в органической, так и в неорганической химии.
См. Также
Примечания
- ↑ L.M. Miessler and D.A. Tarr (1991), 166 — Таблица открытий приписывает Антуану Лавуазье первому постулату научной теории относительно оксикислот.
- ↑ Miessler and Tarr (1991), 166 — Таблица открытий относит публикацию Юстуса фон Либиха к 1838 году.
- ↑ Richard L. Meyers, The Basics of Chemistry (Westport, CT: Greenwood Press, 2003), 156.
- ↑ HL Finston and AC Rychtman, A New View of Current Acid-Base Theories (New York: John Wiley & Sons, 1982), 140-146.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5.6 Miessler and Tarr (1991), 165.
- ↑ K.K. Мюррей и др. 2006. Стандартные определения терминов ИЮПАК, относящиеся к конференции по масс-спектрометрии: Международная конференция по масс-спектрометрии, в Праге, Чешская Республика, том 17. Получено 27 июля 2018 г. (Обратите внимание, что в этом документе нет ссылки на осуждение «оксония», который все еще принят, поскольку он остается в книге IUPAC Gold, , но скорее показывает предпочтение термина «гидроксоний».)
- ↑ Международный союз чистой и прикладной химии, оксониевые илиды. Золотая книга ИЮПАК , 2006. Проверено 27 июля 2018 года.
- ↑ Использование H + является сокращением для H 3 O; 2 H 2 O → H 3 O + + OH — = H 2 O → H + + OH —
- ↑ 9,0 9,1 9,2 Miessler и Tarr (1991), 167-169 — Согласно этой странице, первоначальное определение заключалось в том, что «кислоты имеют тенденцию терять протон».
- ↑ 10.0 10,1 J. Clayden et al. Organic Chemistry (Oxford: Oxford University Press, 2000), 182-184.
- ↑ Miessler and Tarr (1991), 166 — В таблице открытий датой публикации / выпуска теории Льюиса является 1923 год.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 12,7 12,8 Мисслер и Тарр (1991), 170-172.
- ↑ Х. Франц, Растворимость водяного пара в щелочно-боратных расплавах. J. Am. Ceram. Soc. 49 (9) (1966): 473–477.
- ↑ Hermann Lux, «Säuren» und «Basen» im Schmelzfluss: die Bestimmung. der Sauerstoffionen-Konzentration. Ztschr. Elektrochem 45 (4): 303–309. В переводе: Герман Люкс, «Кислоты и основания» в плавленой соляной ванне: определение содержания ионов кислорода. Журнал электрохимии 45 (4) (1939): 303–309.
- ↑ Х. Флад и Т. Форланд, Кислотные и основные свойства оксидов. Acta Chem. Сканд. 1 (1947): 592.
- ↑ Рассел С. Драго и Кеннет В. Уиттен, Синтез оксигалогенидов с использованием сред с плавленой солью. Inorg. Chem. 5 (4) (1966): 677–682.
- ↑ Ральф Г. Пирсон, Жесткие и мягкие кислоты и основания. J. Am. Chem. Soc. 85 (22) (1963): 3533–3539.
Список литературы
- Браун, младший, Теодор Л., Х. Юджин Лемей, Брюс Эдвард Бурстен и Джулия Р. Бердж. Химия: Центральная наука, 9 изд. Река Аппер Сэдл, Нью-Джерси: Prentice Hall, 2002.ISBN 0130669970.
- Чанг, Раймонд. Химия, 9-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill Science / Engineering / Math, 2006. ISBN 0073221031.
- Clayden, Jonathan, et al. Органическая химия. Oxford: Oxford University Press, 2000. ISBN 0198503474.
- Коттон, Ф. Альберт и Джеффри Уилкинсон. Продвинутая неорганическая химия, 4-е изд. Нью-Йорк, Нью-Йорк: Wiley, 1980. ISBN 0471027758.
- Драго, Рассел С. и Кеннет В. Уиттен. Синтез оксигалогенидов с использованием плавленосолевых сред. Inorg. Chem. 5 (4) (1966): 677–682.
- Флад, Х. и Т. Форланд. Кислотные и основные свойства оксидов. Acta Chem. Сканд. 1 (1947): 592.
- Франц, Х. Растворимость водяного пара в щелочно-боратных расплавах. J. Am. Ceram. Soc. 49 (9) (1966): 473–477.
- Мисслер, Гэри Л. и Дональд А. Тарр. Неорганическая химия. Энглвуд Клиффс, Нью-Джерси: Прентис-Холл, 1991. ISBN 0134656598.
- Майерс, Ричард Л. Основы химии. Основы точных наук. Вестпорт, Коннектикут: Greenwood Press, 2003. ISBN 0313316643.
- Пирсон, Ральф Г. Твердые и мягкие кислоты и основания. J. Am. Chem. Soc. 85 (22) (1963): 3533–3539.
Внешние ссылки
Все ссылки получены 13 апреля 2021 г.
Кредиты
Энциклопедия Нового Света писатели и редакторы переписали и дополнили статью Википедия
в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа.

 Напишите уравнения следующих реакций с участием оснований:
Напишите уравнения следующих реакций с участием оснований: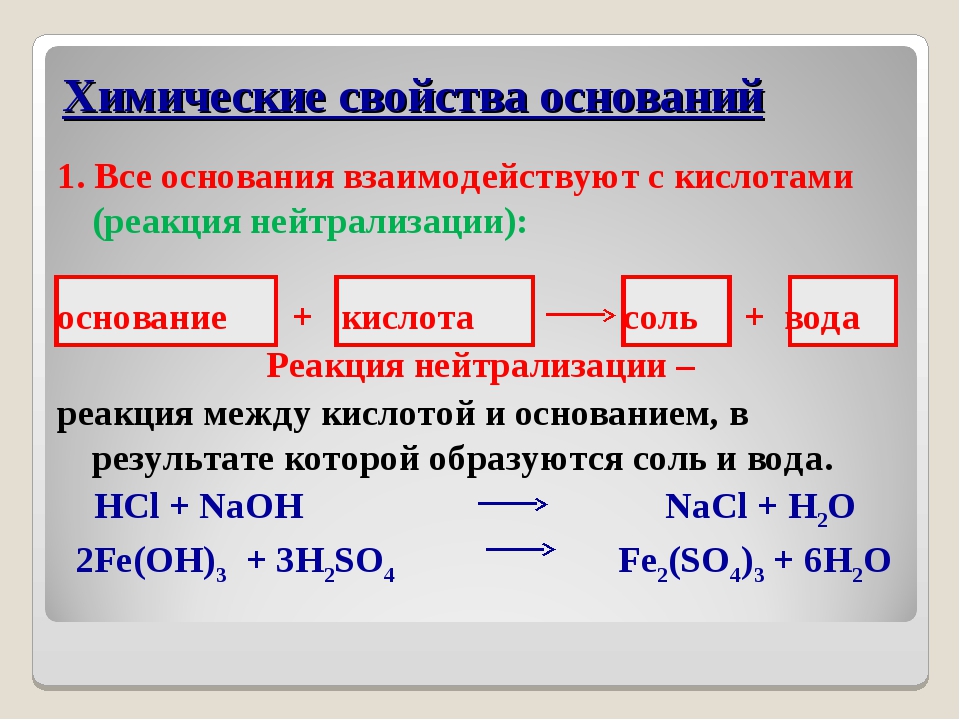 Какие из оснований: RbOH, KOH, Cu(OH)2, Fe(OH)3, Ni(OH)2, SO3, LiOH, Mg(OH)2 – являются растворимыми в воде? Напишите уравнения реакций, которые протекают при действии на эти основания раствором нитрата меди (II).
Какие из оснований: RbOH, KOH, Cu(OH)2, Fe(OH)3, Ni(OH)2, SO3, LiOH, Mg(OH)2 – являются растворимыми в воде? Напишите уравнения реакций, которые протекают при действии на эти основания раствором нитрата меди (II).