Содержание
Реакции обратимые — Справочник химика 21
Возможность изменения направления реакций окисления — восстановления на прямо противоположное является, очевидно, следствием обратимости этих реакций. Обратимые реакции, как известно, приводят к установлению химического равновесия. Константу равновесия нетрудно рассчитать, зная. стандартные потенциалы обеих окислительно-восстановительных пар. [c.357]
Смещение равновесия при обратимых реакциях. Обратимую реакцию можно доводить почти до конца, если один из продуктов постоянно отводится из системы. Примером может служить реакция этерификации, проводимая между труднолетучими реагентами, во время которой отгоняется вода [c.371]
Кинетические выражения, подобные тем, с которыми мы имели дело до сих пор, хорошо обоснованы теоретически для случая гомогенных реакций. Часто они с успехом используются и для корреляции экспериментальных данных по кинетике гетерогенно-каталитических реакций. Возникает, однако, опасность, что кинетическое выражение, имеющее слабое теоретическое обоснование, будет хорошо описывать имеющиеся неполные кинетические данные, тогда как его экстраполяция приведет к неправильным выводам. Так, для процесса, рассмотренного в упражнении IV. 15, опыты, проведенные нри A i // 2 могли бы подтвердить кинетическую зависимость г = кЬа, к = k- k ajk — Отсюда можно сделать вывод, что скорость реакции неограниченно возрастает с увеличением концентрации 6 на самом же деле она достигает предельного значения k a d, когда к- Ык становится велико по сравнению с единицей. Другой пример — обратимая реакция из упражнения IV.17. Если опыты проводятся вдали от равновесия, их результаты будут хорошо описываться выражением из упражнения IV.16, так как отношение к е/к будет мало. Поскольку реакция обратима, исследователь [c.80]
Возникает, однако, опасность, что кинетическое выражение, имеющее слабое теоретическое обоснование, будет хорошо описывать имеющиеся неполные кинетические данные, тогда как его экстраполяция приведет к неправильным выводам. Так, для процесса, рассмотренного в упражнении IV. 15, опыты, проведенные нри A i // 2 могли бы подтвердить кинетическую зависимость г = кЬа, к = k- k ajk — Отсюда можно сделать вывод, что скорость реакции неограниченно возрастает с увеличением концентрации 6 на самом же деле она достигает предельного значения k a d, когда к- Ык становится велико по сравнению с единицей. Другой пример — обратимая реакция из упражнения IV.17. Если опыты проводятся вдали от равновесия, их результаты будут хорошо описываться выражением из упражнения IV.16, так как отношение к е/к будет мало. Поскольку реакция обратима, исследователь [c.80]
При хлорсульфировании первая стадия реакции — сульфирование проходит до конца, так как образующийся хлористый водород удаляется в виде газа, вторая же стадия — реакция обратимая. Уравнения этой реакции представляются следующим образом [c.519]
Уравнения этой реакции представляются следующим образом [c.519]
Большинство химических реакций обратимо, т. е. протекают они одновременно в противоположных направлениях. Рассмотрим обратимую реакцию [c.176]
Если реакции обратимы, наблюдается примерно та же картина, но решить уравнения несколько труднее. В этом случае имеем [c.99]
Э. д. с. всякого работающего или способного к работе элемента является величиной существенно положительной. Однако в теории гальванических элементов возникает необходимость рассматривать реакции, лежащие в основе работы элемента, как реакции обратимые, т. е. способные совершаться в прямом и в обратном направлениях. В связи с этим вводится условие о знаках э. д. с. гальванических цепей. [c.419]
Эти реакции обратимы над тем же катализатором и при такой же температуре из пропилена и бензола могут получаться моно- и диизопропилбензол [272]. [c.335]
Условия проведения иодометрических определений. 1. Потенциал пары Ь/2Г невелик, и потому многие иодометрические реакции обратимы и до конца не доходят только при создании надлежащих условий они протекают практически до конца. [c.399]
1. Потенциал пары Ь/2Г невелик, и потому многие иодометрические реакции обратимы и до конца не доходят только при создании надлежащих условий они протекают практически до конца. [c.399]
При обработке режимов медленной и быстрой реакции, обратимость химической реакции учитывалась рассмотрением равновесной концентрации с, которую принимали постоянной по всему объему жидкой фазы. Из этого следует, что концентрации как жидкого реагента, так и продукта реакции намного больше, чем концентрация абсорбированного газа. [c.118]
Эта реакция обратима, ее протекание вправо определяет энтропийный фактор, протекание влево — энтальпийный фактор. Равновесие этой реакции ниже 400°С практически смещено Б сторону образования СО 2, выше 1000°С— в сторону образования СО (рис. 171). Скорость реакции при низкой температуре незначительна, поэтому в обычных условиях оксид углерода (И) не диспропорционирует, т.е. вполне устойчив. [c.406]
Здесь будут рассмотрены два случая обратимых реакций — обратимые реакции второго порядка и смешанного. порядка. [c.34]
порядка. [c.34]
Необходимо подчеркнуть правильный с нашей точки зрения вывод об общей природе пятичленного переходного состояния двух реакций Сз-дегидроциклизации алканов и гидрогенолиза циклопентанов. Эти реакции обратимы и идут в сходных условиях на поверхности одних и тех же Pt-катализаторов. [c.202]
А И А — алканы О и О — алкены М и К — соответственно металлические и кислотные участки катализатора) были исследованы превращения изомерных бутанов, в том числе н-бутанов, меченных в метильной и метиленовой группах, пентанов, гексанов. Опыты проводили в атмосфере водорода над (1—2% Р1)/(5Ю2—АЬОз) при 300 °С. Исследование кинетики взаимных превращений различных изомерных алканов состава С4—Се позволило определить эффективные константы скорости взаимопревращений каждой пары (скорость превращения н-гексана в 2-метилпентан принята за стандарт, при этом соответствующая константа скорости равна 10). Поскольку все реакции обратимы, то равновесие в каждой стадии [c. 205]
205]
Катализатор является веществом, которое влияет на скорость реакции. В течение процесса сам катализатор может изменяться или оставаться неизменным. Если катализатор действительно изменяется, его рассматривают как катализатор только в том случае, когда не существует никакого целочисленного стехио-метрического соотношения между его количеством и количеством прореагировавшего вещества. Часто весьма эффективны очень незначительные количества (следы) катализатора. Число молекул прореагировавшего вещества на одну молекулу катализатора, или выход по катализатору, может составлять миллионы. Если реакция обратима, то скорость обратной реакции увеличивается в такой же степени, что и скорость прямой. Когда необратимая реакция протекает по различным схемам, катализатор может ускорять реакцию преимущественно в одном из направлений, и таким образом, приводить к иному распределению продуктов, чем в некатализируемой реакции. [c.79]
Введением в анализ химической концепции является установление с помощью стехиометрических расчетов количеств основных и вспомогательных веществ, которые теоретически необходимы для получения определенного количества продукта. Расчеты основаны на законах сохранения массы, постоянства состава и кратных отношений, а также на законе действия масс, если реакция обратима и известно значение константы равновесия. [c.102]
Расчеты основаны на законах сохранения массы, постоянства состава и кратных отношений, а также на законе действия масс, если реакция обратима и известно значение константы равновесия. [c.102]
Специальное планирование программы экспериментов часто позволяет упростить расчет констант скорости. Так, например, если одна из реакций в рассматриваемой системе протекает по второму, порядку, ее можно заставить протекать по псевдопервому порядку, применяя большой избыток одного из реагентов. Еще пример если одна из реакций обратима, могут быть использованы только начальные данные, когда реакция настолько далека от равновесия, что скоростью обратной реакции можно пренебречь. В отдельных случаях могут применяться иные приемы. Несколько систем сложный реакций приведены в табл. И. Другие примеры рассмотрены Фростом и Пирсоном . [c.75]
Эта реакция обратима и быстро достигает состояния равновесия. Константа равновесия К имеет величину порядка 10 . Значительно более медленным актом, определяющим скорость взаимодействия изобутилена с формальдегидом, является электрофиль-ная атака ненасыщенной углеводородной связи [c. 698]
698]
Аналогичное явление наблюдается и при других химических реакциях. Таким образом, химические реакции—обратимы наряду с химическим взаимодействием между исходными веществами прямая реакция) протекает химическое взаимодействие между продуктами реакции обратная реакция), в результате которого снова образуются исходные вещества. По мере протекания процесса скорость прямой реакции (количество молекул продуктов реакции, образующихся в секунду) уменьшается, а скорость обратной реакции (количество молекул этих продуктов, прореагировавших в секунду) увеличивается. Когда обе скорости сравняются, наступает состояние химического равновесия—число молекул веществ, составляющих химическую систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях. Таким образом, химическое равновесие является динамичным и подвижным—с изменением внешних условий равновесие сдвигается в одну или в другую сторону и возвращается к исходному состоянию, если внешние условия [c. 261]
261]
При протекании химической реакции концентрации исходных веществ уменьшаются в соответствии с законом действия масс это приводит к уменьшению скорости реакции. Если реакция обратима, т. е. может протекать как в прямом, так и в обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия и дальнейшего изменения концентраций участвующих в реакции веществ не происходит. [c.94]
Поскольку реакция обратима, наблюдаемая константа скорости реакции, рассчитываемая ио уравнению реакции первого порядка, является суммой констант скорости прямой и обратной реакции, т. е. [c.360]
Как уже говорилось, в растворах с pH > 10 основной реакцией в прямом направлении является реакция между СОг и ОН». Эта реакция обратима [c.241]
Если рассматриваемая реакция — обратимая, то во внешнедиффузионном режиме приповерхностные концентрации всех реагентов близки к равновесным. Их можно определить, используя термодинамическое соотношение между равновесными концентрациями [c.115]
Их можно определить, используя термодинамическое соотношение между равновесными концентрациями [c.115]
Адиабатические реакторы. В адиабатическом процессе отсутствует теплообмен с внешней средой (д = 0). В случае, когда имеется только одна реакция (обратимая или необратимая), расчетные уравнения принимают вид [c.284]
Хотя теоретически необратимый процесс можно представить протекающим в определенных условиях обратимо, т. е. в принципе можно считать все реакции обратимыми, однако химику нередко приходится встречаться с процессами, в которых преобладает реакция, идущая в одном направлении. Это бывает в тех случаях, когда продукты взаимодействия удаляются из сферы реакции (выпадение осадка, выделение газа, образование — в случае ионных реакций — практически недиссоциированных продуктов), или же, когда за счет огромного избытка исходных веществ противоположный процесс практически подавляется. Таким образом, естественное или искусственное исключение возможности обратной реакции позволяет довести процесс практически до конца. [c.31]
[c.31]
Полученные н-бутилен и 2-метилбутен-2 могут далее превращаться соответственно в бутадиен и изопрен. Эти реакции обратимы и почти не имеют теплового эффекта. Вследствие этого равновесная степень конверсии мало зависит от температуры, составляя для диспропорционирования пропилена 50—55%. [c.58]
Более детальный механизм превращения исходных веществ в конечные продукты дается теорией переходного состояния. Согласно этой теории реагенты взаимодействуют с образованием неустойчивых переходных состояний, называемых активированными комплексами, которые самопроизвольно диссоциируют на конечные продукты. Кроме того, предполагается, что все время существует равновесие между исходными реагентами и активированными комплексами и что скорость распада комплекса одна и та же для всех реакций и равна кТ/Ь, где к — постоянная Больцмана, а Ь = 6,62-10 эрг-сек — постоянная Планка. Таким образом, для прямой элементарной реакции обратимого процесса [c. 43]
43]
Рассмотрим два различных пути протекания простой обратимой реакции. Если одно из этих направлений предпочтительно для прямой реакции, то оно должно быть предпочтительным и для обратной реакции (так называемый принцип детального равно в е сия). В качестве примера приведем прямую реакцию обратимого процесса [c.49]
Кинетическими опытами в реакторе периодического действия установлено, что при работе с исходным раствором, свободным от продукта Я в течение 1140 сек при 25° С достигается степень превращения 79,3% и за 480 сек при 35° С степень превращения 69,1%. Предположить, что реакция обратима и описывается кинетическим уравнением первого порядка. [c.214]
Х-8. Реагент А в периодически действующем реакторе за 360 сек претерпел превращение на 57%. Реакция обратима и протекает по уравнению первого порядка [c.322]
Пример реакции обратимого дегидрирования — получение ацетилена при высоких температурах. При понижении температуры в присутствии водорода ацетилен превращается в олефин или алкая. Избежать этой нежелательной реакции удается или очень быстрым охлаждением за счет впрыскивания воды в реактор (см. рис. 4), или очень быстрым охлаждением в сочетании с дезактивацией или пассивацией стенок реактора. Способы пассивации стенок реактора приведены выще. Быстрое охлаждение за счет впрыскивания воды или добавления пара обычно позволяет снизить температуру до значений, при которых гидрирование не идет или идет очень медленно. [c.139]
При понижении температуры в присутствии водорода ацетилен превращается в олефин или алкая. Избежать этой нежелательной реакции удается или очень быстрым охлаждением за счет впрыскивания воды в реактор (см. рис. 4), или очень быстрым охлаждением в сочетании с дезактивацией или пассивацией стенок реактора. Способы пассивации стенок реактора приведены выще. Быстрое охлаждение за счет впрыскивания воды или добавления пара обычно позволяет снизить температуру до значений, при которых гидрирование не идет или идет очень медленно. [c.139]
Гидрирование, н-гексена на металлических участках приводит к получению н-гексана. Приведенная выше реакция обратима и может привести к образованию метилциклопентана из гексана. [c.27]
Реакции без изменения состояния окисления элементов чаще всего протекают в газовых и жидких растворах с участием ионов. Как известно, ионные реакции обратимы, и теоретически каждой системе ионов при данных условиях отвечает определенное состояние равновесия. Смещение химического равновесия (иногда практически нацело) происходит при уменьшении концентрации каких-либо ионов за счет образования относительно мало ионизирующихся молекул или комплексных ионов малорастворимых или летучих соединений правило Бертолле). Так, в реакции нейтрализации ионное равновесие смещается в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе [c.207]
Смещение химического равновесия (иногда практически нацело) происходит при уменьшении концентрации каких-либо ионов за счет образования относительно мало ионизирующихся молекул или комплексных ионов малорастворимых или летучих соединений правило Бертолле). Так, в реакции нейтрализации ионное равновесие смещается в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе [c.207]
Оставляя в стороне предположения о п-ненасыщен-ной природе этого переходного комплекса, необходимо подчеркнуть весьма интересный и правильный, с нашей точки зрения, вывод об общей природе пятичленного переходного состояния реакций Сз-дегидроциклизации алканов и гидрогенолиза циклопентанов. Эти реакции обратимы и идут в сходных условиях на поверхности одного и того же Pt-кaтaлизaтopa. Независимо от указанных авторов и в более детализированной форме к такому же выводу пришел один из авторов данной книги [c.135]
Пример У111-12. В трубчатом реакторе непрерывного действия проводится димеризация бутадиена при температуре 910 К и давлении 1 ат. Диаметр аппарата О = 0,1 м. Смесь, подводимая к реактору, состоит из бутадиена и водяных паров в мольном соотношении 2 1. В этих условиях реакция обратима и протекает согласно кинетическому уравнению [c.319]
Диаметр аппарата О = 0,1 м. Смесь, подводимая к реактору, состоит из бутадиена и водяных паров в мольном соотношении 2 1. В этих условиях реакция обратима и протекает согласно кинетическому уравнению [c.319]
Обычно В относится к такому типу, в котором карбонильная группа присоединена непосредственно к одному из олефиновых или ацетиленовых углеродных атомов (а, /З-ненасыщенные карбонильные соединения). Характерными диенофилами этого типа являются кислоты или их ангидриды, эфиры или галоидпроизводные, альдегиды, кетоны или хиноны. Карбонильные группы необязательны, и они могут быть заменены аце-Т0КСИ-, нитро-, сульфснил-, циано- или винильными группами или даже водородом и др. Однако реакция протекает значительно легче при наличии у Н карбонильнсй группы. Эта реакция обратима и иногда вновь можно получить исходные продукты пиролизом аддукта. Алкильные заместители у диена или энина могут принимать участие в образовании части цикла. [c.466]
Простейшие олефины так же действуют, как диенофилы, по требуют сравнительно более высоких температур. Например этилен и бутадиен при 200° дают циклогексен с выходом 18% [31]. С другими диенами были получены лучшие выходы, например с 2,3-диметилбутадиеном (50%) и циклопентадиеном (74%) [31]. При более высокой температуре такие реакции обратимы и пиролиз циклогексена является одним иа хороших лабораторных методов получения бутадиена. Винилацетат, хлористый винил, другие хлорзамещенные этилены и различные аллильные производные такн е вступают в реакцию конденсации с реакционноспособными диенами при 100—200°, однако известно, что все эти реакции должны проводиться при сравнительно высоких давлениях [27]. Стирол и другие фенилзамещенные этилены, по-видимому, в некоторых случаях вступают в реакцию, и, как будет показано ниже, молекулы диенов могут конденсироваться одна с другой, например, при димеризации бутадиена в ви-нилциклогексен [35]. Эта специфическая реакция весьма услон няет работу с бутадиеном. Конденсации такого рода в качестве побочной реакции возможны при любой из реакций Дильса-Альдера [c.
Например этилен и бутадиен при 200° дают циклогексен с выходом 18% [31]. С другими диенами были получены лучшие выходы, например с 2,3-диметилбутадиеном (50%) и циклопентадиеном (74%) [31]. При более высокой температуре такие реакции обратимы и пиролиз циклогексена является одним иа хороших лабораторных методов получения бутадиена. Винилацетат, хлористый винил, другие хлорзамещенные этилены и различные аллильные производные такн е вступают в реакцию конденсации с реакционноспособными диенами при 100—200°, однако известно, что все эти реакции должны проводиться при сравнительно высоких давлениях [27]. Стирол и другие фенилзамещенные этилены, по-видимому, в некоторых случаях вступают в реакцию, и, как будет показано ниже, молекулы диенов могут конденсироваться одна с другой, например, при димеризации бутадиена в ви-нилциклогексен [35]. Эта специфическая реакция весьма услон няет работу с бутадиеном. Конденсации такого рода в качестве побочной реакции возможны при любой из реакций Дильса-Альдера [c. 177]
177]
При —78,51° хлористый алюминий не растворяется заметно в толуоле, не имеется также каких-либо данных о взаимодействии между обоими компонентами в условиях, исключающих наличие влаги. В присутствии же хлористого водорода хлористый алюминий переходит в раствор с образованием прозрачного зеленого раствора. Прп большом избытке хлористого водорода количество хлористого алюминия, переходящее в раствор, и количество хлористого водорода, используемое для образования комплекса, соответствуют соотношению (АгН)п НС1 А1С1з. Реакция обратима. Удаление хлористого водорода при низких давлениях вызывает выпадение осадка хлористого алюминия и освобождение толуола. [c.399]
Реакция обратима. Это значит, что при растворении дихромата в воде всегда образуется некоторое, хотя и незначительное, количество ионов Н и СгОГ поэтому раствор дихромата имеет кислую реакцию. Если к раствору дихромата прибавлять щелочь, то гидроксид-ионы будут связывать находящиеся в растворе ионы водорода, равновесие смещается влево и в результате дихромат превращается в хромат. Таким образом, в присутствии избытка гидроксид-ионов в растворе практически существуют только ионы СгО , т. е. хромат, а при избытке ионов водорода -— иоиы СгаО . т. е. дихромат. [c.656]
Таким образом, в присутствии избытка гидроксид-ионов в растворе практически существуют только ионы СгО , т. е. хромат, а при избытке ионов водорода -— иоиы СгаО . т. е. дихромат. [c.656]
Дегидрогенизация начинается при 170° и достигает максимума при 300°. При 8Т0Й температуре она протекает полностью, так что в продуктах дегидрогенизации не находят ни ди- ни тетра-гидропропзводных, а лишь одни ароматические углеводороды. Реакция обратима в атмосфере водороДа при низкой температуре (100—110°). Палладий является специфическим катализатором дегидрогенизации лишь для циклогексана и его гомологов. Ни гексан, например, ни метил-цикло-нентан не дегидрогенизуются палладием в тех же условиях. [c.336]
Заметим, что это выражение пригодно не только для плоского зерна, но и для зерна произвольной формы, поскольку во впутри-диффузионном режиме реакция проходит практически до конца в тонком слое, кривизна которого несущественна. Если реакция обратима, то состав смеси в центре пластины близок к равновесному. В этом случае величину С[ можно определить с помощью равновесного соотношения (III.46) между концентрациями реагентов и температурой п линейных соотношений (IIL66), (III.81) между этими переменными. [c.128]
В этом случае величину С[ можно определить с помощью равновесного соотношения (III.46) между концентрациями реагентов и температурой п линейных соотношений (IIL66), (III.81) между этими переменными. [c.128]
Физическая химия (1980) — [
c.244
]
Химия (1986) — [
c.116
,
c.162
]
Физическая и коллоидная химия (1988) — [
c.121
]
Химия для поступающих в вузы 1985 (1985) — [
c.20
,
c.97
]
Химия для поступающих в вузы 1993 (1993) — [
c.109
]
Учебник общей химии (1981) — [
c.101
,
c.104
,
c.105
]
Химия (1979) — [
c. 120
120
,
c.165
]
Химические реакторы как объекты математического моделирования (1967) — [
c.13
,
c.27
,
c.28
]
Методы оптимизации в химической технологии издание 2 (1975) — [
c.303
]
Химия (1978) — [
c.287
]
Химический энциклопедический словарь (1983) — [
c.499
]
Теория горения (1971) — [
c.487
]
Физическая химия (1978) — [
c.292
]
Химический анализ в металлургии Изд.2 (1988) — [
c.10
]
Органическая химия (1990) — [
c.65
]
Принципы органического синтеза (1962) — [
c. 120
120
]
Химические реакторы как объект математического моделирования (1967) — [
c.13
,
c.27
,
c.28
]
Большой энциклопедический словарь Химия изд.2 (1998) — [
c.499
]
Справочник Химия изд.2 (2000) — [
c.69
,
c.235
,
c.253
]
Равновесие и кинетика реакций в растворах (1975) — [
c.90
,
c.94
,
c.128
,
c.138
,
c.142
,
c.144
,
c.412
]
Курс химии Часть 1 (1972) — [
c. 168
168
]
Общая химия и неорганическая химия издание 5 (1952) — [
c.122
,
c.123
,
c.164
,
c.167
]
Неорганическая химия (1974) — [
c.176
]
Неорганическая химия Издание 2 (1976) — [
c.219
]
Физика макромолекул Том 2 (1979) — [
c.53
]
Аналитическая химия (1975) — [
c.41
,
c.43
]
Неорганическая химия (1950) — [
c.97
]
Химия (1975) — [
c.136
,
c.152
]
Общая химия Издание 4 (1965) — [
c. 94
94
]
Основы химической термодинамики и кинетики химических реакций (1981) — [
c.112
,
c.168
,
c.175
]
Неорганическая химия (1969) — [
c.183
]
Общая и неорганическая химия (1981) — [
c.176
]
Физическая биохимия (1949) — [
c.69
]
Курс физической химии Том 2 Издание 2 (1973) — [
c.15
]
Методы кибернетики в химии и химической технологии Издание 3 1976 (1976) — [
c.276
,
c.357
]
Физическая и коллоидная химия (1954) — [
c.67
]
Неорганическая химия (1994) — [
c. 124
124
,
c.142
]
Неорганическая химия Изд2 (2004) — [
c.30
]
Общая химия Изд2 (2000) — [
c.173
]
Основы химической кинетики (1964) — [
c.32
,
c.35
]
Качественный химический полумикроанализ (1949) — [
c.61
]
Курс физической химии Издание 3 (1975) — [
c.641
]
Краткая химическая энциклопедия Том 2 (1963) — [
c.0
]
Основы аналитической химии Издание 2 (1965) — [
c.22
,
c.23
]
Общая химия (1968) — [
c.167
]
Практикум по общей химии Издание 3 (1957) — [
c. 68
68
]
Практикум по общей химии Издание 4 (1960) — [
c.68
]
Практикум по общей химии Издание 5 (1964) — [
c.73
]
Окислительно-восстановительные полимеры (1967) — [
c.71
]
Курс общей химии (0) — [
c.123
]
Курс общей химии (0) — [
c.123
]
Предмет химии (0) — [
c.123
]
Справочник инженера-химика Том 1 (1937) — [
c.63
]
Обратимые и необратимые химические реакции. Химическое равновесие
Гданская А.В. учитель химии высшей квалификационной категории МБОУ СОШ УИОП г.Зерноград Ростовской обл.
Методическая разработка урока по теме: «Обратимые и необратимые химические реакции. Химическое равновесие» 11 кл. (профильный уровень)
Химическое равновесие» 11 кл. (профильный уровень)
Тип урока: практическая работа
Дидактические цели:
▪ сформировать понятия об обратимых и необратимых реакциях, химическом равновесии, условиях необратимого протекания реакции, условиях смещения равновесия.
▪ продолжить формирование таких логических приёмов, как наблюдение, анализ, сравнение, обобщение, исследовательских навыков у учащихся;
▪ формирование научной картины мира путем интеграции с физикой, математикой;
▪ показать прикладной аспект изучаемых вопросов;
▪ привитие аккуратности, внимательности при выполнении опытов;
▪ способствовать обучению специфическим умениям коллективной деятельности.
Оборудование:
▪ на столах учащихся: карточки-задания для самостоятельной работы, лотки с набором реактивов, карандаши, линейки.
Девиз урока: «Опыт – единственно верный путь спрашивать природу и слышать её ответ в лаборатории» Д.И. Менделеев
Ход урока
Организационный момент
II. Проверка домашнего задания. Опрос:
Какие реакции называются гомогенными, гетерогенными?
Что называется скоростью гомогенной реакции?
Что называют скоростью гетерогенной реакции?
От каких факторов зависит скорость любой химической реакции? Какие дополнительные факторы влияют на скорость гетерогенных реакций?
Как формулируется закон действующих масс?
Как формулируется правило Вант-Гоффа?
Что такое катализатор? Что называется катализом?
Что такое ферменты?
III. Объяснение нового материала.
Объяснение нового материала.
1.Обратимые и необратимые реакции.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в продукты называются необратимыми (демонстрационные опыты, с записью опорного конспекта)
выпадают в виде осадка:
BaCl2 + H2SO4 → BaSO4 ↓ +2HCl
выделяются в виде газа:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
2
Образуется малодиссоциированное соединение, например вода
2NaOH + H2SO4 → Na2SO4 + 2H2O
(подкрашенный
фенолфталеином)
3
Реакция сопровождается большим выделением энергии, например горение магния:
2Mg + O2 → 2MgO + 602.
 5 кДж/моль
5 кДж/моль
Многие реакции обратимы – они протекают одновременно в противоположенных направлениях не до конца, при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Состояние обратимой реакции, при котором скорость прямого процесса равна скорости обратного, а концентрации реагирующих веществ сохраняют определенные постоянные значения, называется химическим равновесием. Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884г)
● Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Внешними факторами, которые могут приводить к смещению химического равновесия, являются:
а) концентрация исходных веществ и продуктов;
б) температура;
в) давление.
При производстве важнейших химических продуктов принцип Ле-Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химического процесса, которые обеспечивают максимальный выход желаемого вещества. Принцип Ле-Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др.
Подтвердим опытным путем смещение химического равновесия при изменении внешних условий.
Опыт 1. Смещение химического равновесия при изменении концентрации реагирующих веществ.
Оборудование и реактивы: штатив с 4-мя проборками, растворы хлорида железа (III), роданида калия, кристаллы хлорида калия
Смещение химического равновесия при изменении концентрации реагирующих веществ рассмотрим на примере следующей обратимой химической реакции:
FeCl3 + 3KCNS ↔ Fe(CNS)3 + 3KCl
Растворы веществ в этой системе имеют различную окраску: роданида калия и хлорида калия – бесцветны, хлорида железа ((III) желто-коричневую, а роданида железа (III) – красную.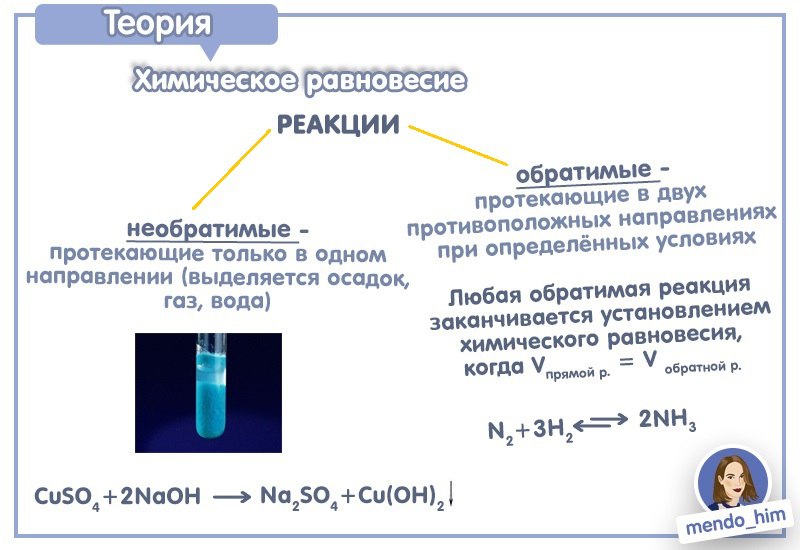 По изменению интенсивности красной окраски системы можно судить об изменении концентрации Fe(CNS)3, т.е. о смещении равновесия в сторону прямого или обратного процессов.
По изменению интенсивности красной окраски системы можно судить об изменении концентрации Fe(CNS)3, т.е. о смещении равновесия в сторону прямого или обратного процессов.
Налить в пробирку по 5 мл разбавленных растворов хлорида железа (III) и роданида калия. Полученный раствор перемешать и разлить поровну в 4 пробирки. Одну из пробирок оставить в качестве контрольной для сравнения результатов опыта. Во 2-ю пробирку добавить 1-2 капли концентрированного раствора роданида калия, в 3-ю – 1-2 капли концентрированного раствора хлорида железа (III), а в 4-ю – немного кристаллического хлорида калия. Встряхнуть содержимое пробирок и сравнить окраску растворов в трёх последних пробирках с окраской контрольного раствора в первой пробирке. По изменению интенсивности красной окраски раствора, т.е. по изменению концентрации Fe(CNS)3, сделать вывод о направлении смещения равновесия. Результаты опыта записать в таблицу.
2
3
4
——
FeCl3
KCNS
KCl
На основании опыта сделать вывод о неизменности химического равновесия при постоянных внешних условиях (пробирка 1) и смещении равновесия при изменении концентрации реагирующих веществ (пробирки 2,3,4)
Как сместить химическое равновесие в сторону продуктов реакции? В сторону исходных веществ?
Как можно обратимую реакции довести практически до конца?
Опыт 2. Смещение химического равновесия при изменении температуры.
Смещение химического равновесия при изменении температуры.
Оборудование и реактивы: штатив с пробирками, спички, спиртовка, держатель для пробирок, растворы крахмала и иода.
При взаимодействии иода с крахмалом протекает обратимая химическая реакция и образуется синее вещество сложного состава (иодкрахмал) Прямой процесс является экзотермическим, а обратный – эндотермическим. Описанную обратимую реакцию можно представить в общем виде следующей схемой:
ИОД + КРАХМАЛ ↔ ИОДКРАХМАЛ + Q
(коричневый) (серовато-белый) (синий)
Налейте в пробирку 2 мл раствора крахмала и добавьте 1-2 капли разбавленного раствора иода до появления синей окраски. Осторожно нагрейте пробирку. Как изменилась окраска раствора и почему? В каком направлении сместилось химическое равновесие? Затем охладите пробирку с исследуемым раствором до появления синего окрашивания. В каком направлении сместится химическое равновесие в этом случае?
Сделайте вывод о влиянии изменения температуры на состояние химического равновесия, ответив на вопросы:
В сторону какого процесса (экзотермического или эндотермического) смещается равновесие при: а) понижении температуры? б) повышении температуры?
Влияние давления на сдвиг химического равновесия (опорный конспект)
3H2(газ) + N2 (газ) ↔ 2NH3(газ)
n = 3 моль n = 1 моль n = 2 моль
вступило в реакцию 4 моля веществ образовалось – 2 моля
При повышении давления равновесие смещается в сторону, где образуется меньшее количество молей газообразных веществ, т. е. вправо, при понижении давления – в сторону с большим числом молей газообразных веществ, т.е. влево.
е. вправо, при понижении давления – в сторону с большим числом молей газообразных веществ, т.е. влево.
Если число молекул в обеих частях уравнения реакции, в которой участвуют газы одинаково, то изменение давления не вызывает смещения химического равновесия. Например,
N2(газ) + O2(газ) ↔ 2NO (газ)
n = 1 моль n = 1 моль n = 2 моль
вступило в реакцию 2 моля образовалось – 2 моля
Катализатор на смещение равновесия влияния не оказывает.
IV. Закрепление
Работа с карточками-заданиями для самостоятельной работы (например)
а) перечислите факторы смещения равновесия вправо в реакциях:
CaCO3 ↔ CaO + CO2 — Q
2SO2 (газ) + O2 (газ) ↔ 2SO3( газ) + Q
б) куда сместиться равновесие в реакции H2 (газ) + Cl2 (газ) ↔ 2HCl (газ) при:
─ понижении давления;
─ повышении концентрации хлора.
В конце урока собираю тетради и выставляю 2 оценки за практическую работу и за самостоятельную.
Д/з – опорный конспект.
Литература
О.С. Габриелян, Г.Г. Лысова Химия 11 кл. Дрофа, 2018
А.С. Егоров Химия Пособие для поступающих в вузы Ростов-на-Дону «Феникс», 2014 с.180
Условия необратимой химической реакции. Обратимые и необратимые химические реакции
Одной из важнейших характеристик химической реакции является глубина (степень) превращения, показывающая, насколько исходные вещества превращаются в продукты реакции. Чем она больше, тем экономичнее можно проводить процесс. Глубина превращения, помимо других факторов, зависит от обратимости реакции.
Обратимые
реакции,
в отличие от необратимых
, протекают не до конца: ни одно из реагирующих веществ не расходуется полностью. Одновременно идет взаимодействие продуктов реакции с образованием исходных веществ.
Рассмотрим примеры:
1) в замкнутый сосуд при определенной температуре введены равные объемы газообразного йода и водорода. Если столкновения молекул этих веществ происходят с нужной ориентацией и достаточной энергией, то химические связи могут перестроиться с образованием промежуточного соединения (активированный комплекс, см. п.1.3.1). Дальнейшая перестройка связей может привести к распаду промежуточного соединения на две молекулы йодистого водорода. Уравнение реакции:
H 2 + I 2 ® 2HI
Но молекулы йодистого водорода также будут беспорядочно сталкиваться с молекулами водорода, йода и между собой. При столкновении молекул HI ничто не помешает образоваться промежуточному соединению, которое затем может разложиться на йод и водород. Этот процесс выражается уравнением:
2HI ® H 2 + I 2
Таким образом, в этой системе одновременно будут протекать две реакции — образование йодистого водорода и его разложение. Их можно выразить одним общим уравнением
H 2 + I 2 « 2HI
Обратимость процесса показывает знак «.
Реакция, направленная в данном случае в сторону образования йодистого водорода, называется прямой, а противоположная — обратной.
2) если смешать два моль диоксида серы с одним моль кислорода, создать в системе условия, благоприятствующие протеканию реакции, и по истечении времени провести анализ газовой смеси, то результаты покажут, что в системе будут присутствовать как SO 3 – продукт реакции, так и исходные вещества – SO 2 и O 2 . Если в те же условия в качестве исходного вещества поместить оксид серы (+6), то можно будет обнаружить, что часть его разложится на кислород и оксид серы (+4), причем конечное соотношение между количествами всех трех веществ будет такое же, как и в том случае, когда исходили из смеси диоксида серы и кислорода.
Таким образом, взаимодействие диоксида серы с кислородом также является одним из примеров обратимой химической реакции и выражается уравнением
2SO 2 + O 2 « 2SO 3
3) взаимодействие железа с соляной кислотой протекает согласно уравнению:
Fe + 2HCL ® FeCL 2 + H 2
При достаточном количестве соляной кислоты реакция закончится, когда
все железо израсходуется. Кроме того, если попытаться провести эту реакцию в обратном направлении – пропускать водород через раствор хлорида железа, то металлического железа и соляной кислоты не получится – эта реакция не может идти в обратном направлении. Таким образом, взаимодействие железа с соляной кислотой – необратимая реакция.
Кроме того, если попытаться провести эту реакцию в обратном направлении – пропускать водород через раствор хлорида железа, то металлического железа и соляной кислоты не получится – эта реакция не может идти в обратном направлении. Таким образом, взаимодействие железа с соляной кислотой – необратимая реакция.
Однако, следует иметь ввиду, что теоретически любой необратимый процесс можно представить протекающим в определенных условиях обратимо, т.е. в принципе все реакции можно считать обратимыми. Но очень часто одна из реакций явно преобладает. Это бывает в тех случаях, когда продукты взаимодействия удаляются из сферы реакции: выпадает осадок, выделяется газ, при ионообменных реакциях образуются практически недиссоциирующие продукты; или же когда за счет явного избытка исходных веществ противоположный процесс практически подавляется. Таким образом, естественное или искусственное исключение возможности протекания обратной реакции позволяет довести процесс практически до конца.
Примерами таких реакций могут служить взаимодействие хлорида натрия с нитратом серебра в растворе
NaCL + AgNO 3 ® AgCl¯ + NaNO 3 ,
бромида меди с аммиаком
CuBr 2 + 4NH 3 ® Br 2 ,
нейтрализация хлороводородной кислоты раствором едкого натра
HCl + NaOH ® NaCl + H 2 O.
Это все примеры лишь практически
необратимых процессов, так как и хлорид серебра несколько растворим, и комплексный катион 2+ не абсолютно устойчив, и вода диссоциирует, хотя и в крайне незначительной степени.
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
Химическое равновесие
Химические реакции, протекающие в одном направлении, называют необратимыми
.
Большинство химических процессов являются обратимыми
. Это значит, что при одних и тех же условиях протекают и прямая, и обратная реакции (особенно если речь идет о замкнутых системах).
Например:
а) реакция
$CaCO_3{→}↖{t}CaO+CO_2$
в открытой системе необратима;
б) эта же реакция
$CaCO_3⇄CaO+CO_2$
в замкнутой системе обратима.
Рассмотрим более подробно процессы, протекающие при обратимых реакциях, например, для условной реакции:
На основании закона действующих масс скорость прямой реакции
${υ}↖{→}=k_{1}·C_{A}^{α}·C_{B}^{β}$
Так как со временем концентрации веществ $А$ и $В$ уменьшаются, то и скорость прямой реакции тоже уменьшается. 3}$
3}$
Влияние изменения концентрации веществ
При добавлении в реакционную смесь азота $N_2$ и водорода $Н_2$ увеличивается концентрация этих газов, а значит, увеличивается скорость прямой реакции. Равновесие смещается вправо, в сторону продукта реакции, т.е. в сторону аммиака $NH_3$.
Этот же вывод можно сделать, анализируя выражение для константы равновесия. При увеличении концентрации азота и водорода знаменатель увеличивается, а так как $K_{равн.}$ — величина постоянная, должен увеличиваться числитель. Таким образом, в реакционной смеси увеличится количество продукта реакции $NH_3$.
Увеличение же концентрации продукта реакции аммиака $NH_3$ приведет к смещению равновесия влево, в сторону образования исходных веществ. Этот вывод можно сделать на основании аналогичных рассуждений.
Влияние изменения давления
Изменение давления оказывает влияние только на те системы, где хотя бы одно из веществ находится в газообразном состоянии. При увеличении давления уменьшается объем газов, а значит, увеличивается их концентрация.
Предположим, что давление в замкнутой системе повысили, например, в $2$ раза. Это значит, что концентрации всех газообразных веществ ($N_2, H_2, NH_3$) в рассматриваемой нами реакции возрастут в $2$ раза. В этом случае числитель в выражении для $K_{равн.}$ увеличится в 4 раза, а знаменатель — в $16$ раз, т.е. равновесие нарушится. Для его восстановления должна увеличиться концентрация аммиака и должны уменьшиться концентрации азота и водорода. Равновесие сместится вправо. Изменение давления практически не сказывается на объеме жидких и твердых тел, т.е. не изменяет их концентрацию. Следовательно, состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления.
Влияние изменения температуры
При повышении температуры, как вы знаете, скорости всех реакций (экзо- и эндотермических) увеличиваются. Причем повышение температуры больше сказывается на скорости тех реакций, которые имеют большую энергию активации, а значит, эндотермических.
Таким образом, скорость обратной реакции (в нашем примере эндотермической) увеличивается сильнее, чем скорость прямой. Равновесие сместится в сторону процесса, сопровождающегося поглощением энергии.
Направление смещения равновесия можно предсказать, пользуясь принципом Ле Шателье (1884 г.):
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Сделаем выводы:
- при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
- при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
- при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
- при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
- при понижении температуры — в сторону экзотермического процесса.
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химических процессов, которые обеспечивают максимальный выход желаемого вещества.
На уроке будет рассмотрена тема «Обратимые и необратимые химические реакции. Химическое равновесие», будут рассматриваться факторы, влияющие на смещение химического равновесия. Вы познакомитесь с принципом Ле Шателье. Вводится понятие обратимых и необратимых реакций.
Тема: Классификация реакций, термохимия, скорость
Урок: Обратимые и необратимые химические реакции. Химическое равновесие и способы его смещения
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
А+В→АВ, Прямая реакция.
Но многие химические реакции могут идти в обратную сторону.
АВ
А+В; Обратная реакция.
Для краткости такую реакцию записывают, используя две стрелки, одну — вперед, другую — назад.
А+В
АВ
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н 2 +
I
2
(1)
Скорость химической реакции увеличивается с увеличением концентрации исходных веществ и соответственно уменьшается с уменьшением концентрации исходных веществ. Получается, что, по мере прохождения реакций, скорость прямой реакции будет уменьшаться, т. к. исходные вещества будут расходоваться. А скорость обратной реакции будет возрастать, потому что концентрация вещества АВ исходного для обратной реакции будет постепенно увеличиваться. До каких пор скорость прямой реакции будет уменьшаться, а обратной увеличиваться? Это будет до того момента, когда скорости прямой и обратной реакции станут равными. Наступит химическое равновесие. Рис. 1.
Рис. 1
Химическое равновесие — это состояние реакционной системы, в котором скорости прямой и обратной реакции равны.
Равновесная концентрация веществ
— это концентрации веществ в реакционной смеси, находящихся в состоянии химического равновесия. Равновесная концентрация обозначается химической формулой вещества, заключенной в квадратные скобки.
Например, следующая запись обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.
Рис. 2
Химическое равновесие
(Рис. 2) отличается от привычного для нас понятия «равновесие». Химическое равновесие — динамическое. В системе, находящейся в состоянии химического равновесия, происходят и прямая, и обратная реакции, но их скорости равны, и поэтому концентрации участвующих веществ не меняются. Химическое равновесие характеризуется константой равновесия, равной отношению констант скоростей прямой и обратной
реакций.
Константы скорости прямой и обратной реакции — это скорости данной реакции при концентрациях исходных для каждой из них веществ в равных единицах. Также константа равновесия равна отношению равновесных концентраций продуктов прямой реакции в степенях стехиометрических коэффициентов к произведению равновесных концентраций реагентов.
Если , то в системе больше исходных веществ. Если , то в системе больше продуктов реакции.
Если константа равновесия значительно больше 1, такую реакцию называют необратимой.
Необратимыми называются химические реакции, которые происходят только в одном направлении до полного расходования одного из реагентов.
Например, это реакция:
4Р+5О 2 =2Р 2 О 5
(2)
Обратимыми называются химические реакции, которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях.
Если изменить внешние условия, то состояние химического равновесия нарушится. Смещение равновесия в зависимости от изменения внешних условий в общем виде определяется
· Принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении.
Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. Какие факторы можно изменять, чтобы сместить равновесие? Это
· Температура
· Давление
· Концентрации веществ
· Добавление катализатора
· Изменение площади реакционной поверхности гетерогенных реакций
Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций
не оказывают влияние на смещение химического равновесия.
Остальные факторы рассматриваем более детально.
Температура
Реакция синтеза аммиака (Рис. 3)
относится к экзотермическим
реакциям. При прохождении прямой реакции теплота выделяется, а при прохождении обратной — поглощается. Если увеличить температуру, то, согласно правилу Ле Шателье, равновесие сместится в таком направлении, чтобы уменьшить это воздействие. В данном случае влево,
так как теплота поглощается. Реакция синтеза аммиака проводится при температуре около 500
Если реакция эндотермическая,
то повышение температуры приведет к смещению равновесия вправо.
Изменение концентрации веществ
При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ — в сторону реакции его образования. Например, при увеличении концентрации азота в реакции синтеза аммиака, равновесие сместится вправо, т. е. в сторону расходования азота. Если же в этой реакции удалять из реакционной смеси аммиак, то равновесие сместится в сторону его образования. Сделать это можно, например, при растворении аммиака в воде.
Изменение давления
Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака.
Если число моль газа одинаково и слева и справа, например, в реакции получения оксида азота (II),
N
2
+
O
2
(3)
то изменение давления не будет оказывать влияние на положение химического равновесия в таких реакциях. Изучение химического равновесия имеет большое значение, как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Окончательный выбор условий требует учета влияния их и на скорость процесса.
Подведение итога урока
На уроке была изучена тема «Химическое равновесие», рассмотрены условия смещения равновесия в случае обратимых реакций.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. — 14-е изд. — М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. — К.: ИЦ «Академия», 2008. — 240 с.: ил.
3. Габриелян О.С.
Химия. 11 класс. Базовый уровень. 2-е изд., стер. — М.: Дрофа, 2007. — 220 с.
1. Электроотрицательность. Различие между полярной ковалентной и ионной связями ().
3. Электроотрицательность атомов по полингу ().
Домашнее задание
1. №№7-9 (с. 63) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. — 14-е изд. — М.: Просвещение, 2012.
2. Какие факторы не влияют на смещение химического равновесия?
3. Назовите условия наступления химического равновесия.
>> Химия: Обратимые и необратимые реакции
СО2+ h3O = h3CO3
Оставим полученный раствор кислоты стоять в штативе. Через некоторое время мы увидим, что раствор снова стал фиолетовым, так как кислота разложилась на исходные вещества.
Это процесс можно провести гораздо быстрее, если подо треть раствор угольной кислоты. Следовательно, реакция получения угольной кислоты протекает как в прямом, так н в обратном направлении, то есть является обратимой. Обратимость реакции обозначается двумя противоположно направленными стрелками:
Среди обратимых реакций, лежащих в основе получения важнейших химических продуктов, в качестве примера назо вем реакцию синтеза (соединения) оксида серы (VI) из оксида серы (IV) и кислорода.
1. Обратимые и необратимые реакции.
2. Правило Бертолле.
Запишите уравнения реакций горения, о которых говорилось в тексте параграфа, зияя, что в результате этих реакций образованы оксиды тех элементов, из которых построены исходные вещества.
Дайте характеристику трех последних реакций, проведенных а конце параграфа, по плану: а) характер и число реагентов и продуктов; б) агрегатное состояние; в) направление: г) наличие катализатора; д) выделение или поглощение теплоты
Какая неточность допущена в предложенной в тексте параграфа записи уравнения реакции обжига известняка?
Насколько справедливо утверждение, что реакции соединения будут, как правило, зкзотермическими реакциями? Обоснуйте свою точку зрения, пользуясь приведенными в тексте учебника фактами.
Содержание урока
конспект урока
опорный каркас
презентация урока
акселеративные методы
интерактивные технологии
Практика
задачи и упражнения
самопроверка
практикумы, тренинги, кейсы, квесты
домашние задания
дискуссионные вопросы
риторические вопросы от учеников
Иллюстрации
аудио-, видеоклипы и мультимедиа
фотографии, картинки
графики, таблицы, схемы
юмор, анекдоты, приколы, комиксы
притчи, поговорки, кроссворды, цитаты
Дополнения
рефераты
статьи
фишки для любознательных
шпаргалки
учебники основные и дополнительные
словарь терминов
прочие
Совершенствование учебников и уроков
исправление ошибок в учебнике
обновление фрагмента в учебнике
элементы новаторства на уроке
замена устаревших знаний новыми
Только для учителей
идеальные уроки
календарный план на год
методические рекомендации
программы
обсуждения
Интегрированные уроки
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца — до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях.
Рассмотрим два примера.
Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению:
При достаточном количестве азотной кислоты реакция закончатся только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении — пропускать диоксид азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится — данная реакция не может протекать в обратном направлении. Таким образом, взаимодействие цинка с азотной кислотой — необратимая реакция.
Пример 2. Синтез аммиака протекает согласно уравнению:
Если смешать один моль азота с тремя молями водорода, осуществить в системе условия, благоприятствующие протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород). Если теперь в те же условия в качестве исходного вещества поместить не азото-водородную смесь, а аммиак, то можно будет обнаружить, что часть аммиака разложится на азот и водород, причем конечное соотношение между количествами всех трех веществ будет такое же, как в том случае, когда исходили из смеси азота с водородом. Таким образом, синтез аммиака — обратимая реакция.
В уравнениях обратимых реакций вместо знака равенства можно ставить стрелки; они символизируют протекание реакции как в прямом, так и обратном направлениях.
На рис. 68 показано изменение скоростей прямой и обратной реакций с течением времени. Вначале, при смешении исходных веществ, скорость прямой реакции велика, а скорость обратной ракцни равна нулю, По мере протекания реакции исходные вещества расходуются и их концентрации падают.
Рис. 63. Изменение скорости прямой и обратной реакции с течением времени .
В результате этого уменьшается скорость прямой реакции. Одновременно появляются продукты реакции, и их концентрация возрастает. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. Так, в последнем примере устанавливается равновесие между азотом, водородом и аммиаком.
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодо-водорода:
Согласно закону действия масс, скорости прямой и обратной реакций выражаются уравнениями:
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К):
Отсюда окончательно
В левой части этого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии- равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину.
Можно показать, что в общем случае обратимой реакции
константа равновесия выразится уравнением:
Здесь большие буквы обозначают формулы веществ, а маленькие — коэффициенты в уравнении реакции.
Таким образом, при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собою. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Численное значение константы равновесия в первом приближении характеризует выход данной реакции. Например, при выход реакции велик, потому что при этом
т. е. при равновесии концентрации продуктов реакции много больше концентраций исходных веществ, а это и означает, что выход реакции велик. При (по аналогичной причине) выход реакции мал.
В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс (см. § 58), входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
константа равновесия имеет вид:
Величина константы равновесия зависит от природы реагирующих веществ и от температуры. От присутствия катализаторов она не зависит. Как уже сказано, константа равновесия равна отношению констант скорости прямой и обратной реакции. Поскольку катализатор изменяет энергию активации и прямой, и обратной реакций на одну и ту же величину (см. § 60), то на отношение констант их скорости он не оказывает влияния.
Поэтому катализатор не влияет на величину константы равновесия и, следовательно, не может ни увеличить, ни снизить выход реакции. Он может лишь ускорить или замедлить наступление равновесия.
Камарзин Александр Алексеевич
(1934 – 2000 гг.)
- 1958 – окончание Московского химико-технологического института им. Менделеева — старший лаборант ИНХ СО РАН
- 1959 – младший научный сотрудник ИНХ СО РАН
- 1968 – защита кандидатской диссертации
- 1969 – заведующий лабораторией ИНХ СО АН СССР
Романтик-реалист. Воспоминания В. Бакакина
Камарзин — для ИНХа фигура знаковая, прежде всего из-за общественно-активной жизненной позиции Александра Алексеевича. Для меня эта фамилия была на слуху с первых новосибирских лет. Признаюсь, сначала она привлекала внимание необычной аллитерацией с фамилией классика, и нужно было к ней привыкать. (Между прочим, и сейчас в телефонной базе Новосибирска — наряду с тремя «классическими» Карамзиными — Сашина фамилия единственная!)
К сожалению, за сорок с лишним лет совместной работы в ИНХе мне не пришлось тесно сотрудничать с А.А. по научной тематике. И в этих строках я коснусь лишь трёх моментов «воспоминательного» толка.
1) Для новогоднего номера «Неорганика» за 1985 год в цикле моих дружеских шаржей на «офицерский корпус» ИНХа возник и такой рифмованный экспромт-зарисовка:
Из отчёта А.А. Камарзина на Учёном совете»
Товарищи!
Везде — в Сибири, в тропиках
В моторах ли, в сортирах ли — керамика.
Практична, как для женщин аэробика,
Экономична, как трусцодинамика.
С сульфидной же керамикой — непросто.
О ней скажу в ответах на вопросы.
Помню, я сразу показал опус А.А., всё-таки тогда было строгое отношение к любым печатным словам. Судя по его первой реакции, он был несколько озадачен, но, видимо, природная сдержанность не позволила ему комментировать текст. Словом, проверку на чувство юмора он выдержал.
2) Осенью 89-го года профком института получил «талон» на распределение жигулёвской «восьмёрки». Главным критерием для очередников был стаж работы в ИНХе. Мне сообщили, что моя кандидатура, — как сотрудника с октября 1958 г.- первая. Семья уже срочно изыскивала недостающие деньги. И вдруг кто-то сказал, что у Камарзина стаж работы недели на две больше, и он, если захочет, будет первым претендентом. Конечно, я с определённым волнением разыскивал его. И он в своей спокойной манере сказал, что пока не собирается приобретать машину. Этот эпизод предметно показал мне, во-первых, как давно А.А. работает в ИНХе, а во-вторых, — его порядочность и бескорыстие. Время было нелёгкое, как вскоре оказалось — на излёте советской власти. И народ уже начинал привыкать к «лёгким» махинациям с собственностью, находились и в нашем институте подобные «автолюбители».
Небольшое комментарий-отступление, косвенно связанное с описанным эпизодом. К Новому 1990 г. — опять же для «Неорганика», была сочинена «Молитва года белой овцы», где, в частности, хотелось-желалось:
«…Чтоб порядок в доме. Чтоб покой в душе. Пиво в гастрономе. Курица в лапше. Чтобы без талона — просто за рубли: хочешь — макароны, хочешь — «Жигули».»
Эти мечтательные строки, казалось, верно отражали время с его дефицитно-распределительной системой. Всего через несколько лет стала очевидна их наивность. Как сказал в финале Остап Бендер, «сбылась мечта идиота». И что? Всего завались, но сосчитайте на калькуляторе, через сколько лет «бюджетник» осилит даже отечественное авто? (Кстати, та — потенциально камарзинская «восьмёрка» и сейчас успешно бегает у нас в семье.
3) Александр Алексеевич очень много и ответственно работал в инховских общественных организациях, неоднократно возглавлял и профком, и партбюро. Но что кардинально отличало его от многих других «общественников»? Я думаю, искренность в своих убеждениях, верность жизненной позиции. Когда развалили СССР и настали тяжёлые времена для КПСС, парторганизация ИНХ уменьшилась сразу на порядок(!). Большинство тихо аннигилировали, кто-то перешёл в сочувствующие, кое-кто «слинял» не без удовольствия, слава Богу, не оказалось откровенных «марков Захаровых». А Камарзин остался коммунистом, сохранил членство в КПРФ до конца, хотя в последний период по состоянию здоровья вынужденно ограничивался уплатой членских взносов.
Когда-то мне запомнилась газетная фраза: коммунисты подразделяются на \фанатиков, карьеристов и романтиков. Саша Камарзин не был ни фанатиком, ни в малейшей степени карьеристом. Думаю, его можно назвать романтиком-реалистом.
ЕСТЕСТВОИСПЫТАТЕЛЬ АЛЕКСАНДР АЛЕКСЕЕВИЧ КАМАРЗИН. Воспоминания В. Баковца
Александр Алексеевич Камарзин — один из немногих химиков Института, чей исследовательский интерес распространялся на такие далекие, относительно химии, сферы науки, как оптика, радиоэлектроника и т. д. Характерной чертой его стиля работы была, прежде всего, постановка задачи исследования какого-либо явления или синтеза задуманного химического соединения. Это уже определяло все дальнейшие действия, и ничто не могло остановить этот процесс. Если необходимо было собрать установку, изготовить устройство — они собирались из любого подручного материала. Однако это не означало, что установка может не соответствовать стандартам физического или химического эксперимента. По ходу работу создавались методики тарировки, стандартизации, определения приборных ошибок и т. д. и т. п. Это как раз тот случай, когда, если человек хочет, он ищет пути осуществления задуманного. Думаю, не ошибусь, если буду утверждать, что в Институте Александр Алексеевич является первым, и до сей поры единственным, кто проводил синтезы при температуре 2500 С. Одним словом, он был экспериментатором от бога.
Вспоминаю, как, уже проработав с Александром Алексеевичем значительное время, вдруг узнаю, что он играет в футбол. В этой части он также все делал с полной отдачей, но, фактически, избыточное курение не давало простора дыханию, и он, в то время, был способен на кратковременные спортивные подвиги. Много раз мы вдвоем уезжали на велосипедах в район бердского залива собирать грибы в соснячке. После продолжительного сбора урожая было «приятно посидеть на еловой подстилке. При этом мы всегда начинали обсуждение последних достижений науки и техники, за чем Александр Алексеевич внимательно следил и всегда восторгался, как ребенок. Признаюсь, такая дружба и сотрудничество меня всегда вдохновляли.
К сожалению, Александр Алексеевич не занимался достаточно много студентами и аспирантами, а жаль. Такой огромный опыт работы при высоких температурах в агрессивных средах, вероятно, не имеет никто в Институте. У меня создалось впечатление, что и руки Александра Алексеевича — это манипуляторы, имевшие четкость движения, но не имевшие физиологической чувствительности. Однажды, занимаясь пайкой какой-то схемы при мне, он взялся руками за голый провод, находящийся под напряжением более 100 вольт. Честно сказать, я аж обомлел, и уже вспомнил правило техники безопасности — ударом сбить его руки с токоведущих концов, но он, как говорят, даже «не поморщился». Когда я удивленно спросил его о такой оплошности, он сказал, что это свойство его пальцев. Вот такой уникальный человек работал вместе с нами.
Воспоминания И. Васильевой
В лабораторию синтеза и роста монокристаллов соединений Р.З.Э. я перешла в 1977г. Пришлось водную химию менять на высокотемпературную. Александр Алексеевич возглавлял в то время группу, занимающуюся химией сульфидов Р.З.Э. Поражало то, как глубоко прорабатывались задачи, которые нужно было решать. Мы, работающие рядом с ним, были с головой вовлечены в процесс решения этих задач. Выслушивались наши мнения, пути решения проблемы. Такие деловые беседы, обычно проходившие в начале рабочего дня, задавали положительный тон на весь день. Следует отметить, что Александр Алексеевич всегда был полон идей, он жил работой, решал проблемы оригинально, привлекая к этому не только теоретический потенциал, но и практическую направленность данной задачи. Это помогло лаборатории выстоять в тяжелейший период, когда страна была ввергнута в эпоху глобальных перемен. По предложению Александра Алексеевича мы начали готовить и реализовывать эмульсии, помогающие поддерживать нормальное артериальное давление. Это было первоначальным накоплением капитала нашей лаборатории, что в дальнейшем помогало сотрудникам в трудных ситуациях. Однако основным заделом явились разработки лаборатории по сульфидам Р.З.Э., проводимые под руководством Александра Алексеевича. По публикациям на нашу лабораторию вышли французские ученые из крупнейшей в мире фирмы «Ронк Пуленк», и мы на несколько лет получили контракт, что было очень престижно, а также давало нам материальную поддержку.
Александр Алексеевич всегда был в курсе проблем, решить которые нужно было именно в данное время. Такой проблемой, в частности, было получение высокочистого кремния. Идея получать кремний высокой чистоты (так называемый «солнечный кремний»), используя гидрид-литиевую технологию, принадлежит Александру Алексеевичу. Задача решалась при финансовой поддержке НЗХК. До конца своих дней Александр Алексеевич был в курсе всех этапов проводимой работы. И только прекращение финансирования уже после его ухода не позволило довести ее до конца.
А.А.Камарзин. Две встречи. Воспоминания В. Дёмина
Хотя с А.А. в одном отделе мы были вместе почти тридцать лет, в памяти особенно запечатлелись две. В 1970 году, будучи студентом старшекурсником НГУ мы выбирали лабораторию для выполнения дипломной работы. Так оказалось, что лаб. А.А.Камарзина оказалось первой, какую мы посетили в ИНХе и Ал.А. был первый ученый-экспериментатор из Института, который рассказывал о своей работе. Он говорил строго, коротко и очень просто и доходчиво даже для нас двух друзей- третьекурсников. Не агитировал в свою лабораторию. Просто показал установки высокотемпературного синтеза соединений р.з.м., тут же заметил, что синтез многочасовой и иногда приходиться дежурить и ночью. Нам он показался слишком суровым, а мы ему слишком легкомысленными, наверное. В результате мы оказались в других лабораториях: мой друг Николай Д. в лаб. С.В.Земскова, а я в лаб.Ф.А.Кузнецова.
Запомнилась еще одна встреча, когда он уже был болен. Он был один из инициаторов развития силановой технологии, всячески агитировал за этот путь производства кремния для Красноярска и во многом, благодаря его авторитету среди производственников, НЗКХ стал заниматься работами в этой области.
Зная, что я вместе с сотрудниками лаб. д.ф.-м.н. А.Н.Тимошевского (ИТПМ) занимаюсь разработкой плазменных технологий получения кремния, пригласил меня домой для обсуждения возможности применения мощных плазмотронов для пиролиза силана. Мы беседовали более часа. Он сразу отметил большие экспериментальные трудности, которые могут возникать при работе с силаном в условиях его больших расходов в дуговых плазмотронах, понял перспективность этих работ. Мы говорили только о работе, он держался как всегда строго и официально, но когда я, уходя, заметил, что А.Н.Тимошевский сейчас не смог подойти, так как приболел и возможно ляжет в больницу, он долго распрашивал, дал ряду советов по лечению. При этом он ни разу не обмолвился о своих проблемах со здоровьем ни в этот раз, ни в последующие несколько встреч у него на квартире.
С ним было легко разговаривать о работе. Потому что он всегда искренне интересовался вашей работой, любил и знал экспериментальную химию высокотемпературного синтеза веществ, всегда находил в нашей работе много интересного и нового. Под его, на первый взгляд, строгой внешностью, скрывался добрый и отзывчивый, может немногословный, человек, который всегда вам готов помочь бескорыстно.
Александр Алексеевич Камарзин… Воспоминания Е. Золотовой
Сколько приятных и теплых воспоминаний. Как легко с ним было работать! Александр Алексеевич был человеком и исследователем, который всегда знал какой конкретно нужно получить результат и что для этого нужно сделать. Он всегда был спокоен и доброжелателен ко всем. Александр Алексеевич заложил много хороших традиций, и лаборатория продолжает им следовать. Уже ~ 5 лет, как его нет с нами, но не проходит и дня, чтобы по какому-либо поводу не вспомнили Камарзина «тихим добрым словом». Можно сказать, что все без исключения, мы его любили и всегда будем помнить.
Камарзин – химик. Воспоминания Ю. Зеленина
Впервые с Александром Алексеевичем я познакомился в 1969 году. Тогда я числился сотрудником лаборатории 2а, но я был взят туда только для того чтобы отбыть за лабораторию трудовую повинность в Тальменском совхозе. М.П. Григоренко — начальник ОК сказал мне, чтобы я не писал заявление об уходе, а пока не появится вакансия, буду получать зарплату. В то время мои бывшие однокурсники делали дипломы и мне было куда придти посидеть, поговорить. И вот однажды, зайдя к своему дипломнику А.А. Камарзин увидел меня. Узнав ситуацию сказал, что у И. И. Яковлева освободилась ставка инженера и посоветовал обратиться к нему. Таким образом Александр Алексеевич стал моим крестным отцом работы в ИНХе. Следующая встреча состоялась года через три. Необходимо было подать заявку на авторское свидетельство по поводу нового способа получения солей четвертичных аммониевых оснований (ЧАО). Лучшим консультантом Ю.А. Дядин посчитал А.А. Камарзина и мы пошли к нему за помощью. Помню отказа не было, было сказано как это делается и пожелание сначала пропустить внутри института как рацпредложение, короче, получили исчерпывающую информацию.
Следующий контакт состоялся уже в лаборатории К.Е. Миронова, где я оказался в группе А.А. Камарзина. Вот тут я в полной мере ощутил все стороны его характера. У него был нестерпимый зуд конструктора. Он никогда не давал передышки. Не успев сделать одно устройство, приходилось приступать к его модернизации, под неопровержимом аргументом: по-настоящему надо делать по другому. Если желаемое не получилось, делался новый прибор с той же аргументацией: по-настоящему… И так далее до бесконечности. Не все приборы вступали в эксплуатацию, но если какой-то начинали использовать, то он получал статус установки какого-либо назначения, но проведя на ней запланированный цикл работ ее отправляли либо на демонтаж либо на модернизацию. Редкие установки сохранились в первозданном виде. Короче говоря, был А.А. Камарзин, на мой взгляд, мощным инженер — конструктор – технологом и с ним было интересно работать.
На его похоронах когда ритуальная команда засыпала могилу, встали мы в кружок разлили горькую, пригласили Федора Андреевича помянуть усопшего. Он поинтересовался: — Традиция ли это? А как же? Конечно. Выпили. Помолчали. И тут я изложил то, что написано в предыдущем абзаце. Федор Андреевич возразил, — «Нет, он был хорошим химиком». Дискутировать не хотелось, согласился. А по истечении некоторого времени, когда притупилась боль утраты и пора было продолжать начатое им дело, я стал перебирать, что же значимое по части фундаментальных исследований совершил А. Камарзин. Оказалось не так уж мало. Перечислить могу только то, что свершалось на моих глазах: пигменты, скандий, моносилан.
Скандий. Технологию пересказывать нет смысла, но догадаться получать металл через его гидрид, отмывая этот гидрид разбавленной кислотой от всех примесей, которые загрязнили бы конечный продукт, мог только Камарзин.
Моносилан. В свое время была так называемая Президентская программа по организации в России производства солнечного кремния. Были спущены огромные деньги. Надо было вписываться в проект. Александр Алексеевич на совещании НЗХК предложил использовать монопольное владение гидрида лития для налаживания производства конверсии четыреххлористого кремния в моносилан. Подготовил бизнес-план и подарил его друзьям из НЗХК. Ребята получили некоторую сумму. Сколько это было неизвестно, но он заключив с ними договор, дал лаборатории стимул для работы не только по кремниевой программе, но и по разработке технологии пигментов, методики получения особочистых редкоземельных металлов. И многое другое.
Особо хочется рассказать о последней реализованной идеей Камарзина, где, на мой взгляд, он выступил как алхимик. Мы часто с ним обсуждали планы работ, направление приложения усилий, текущие события и т.д. и т.п. И вот однажды он мне показывает на листочке запись реакции:
SiO2 + 4LiH = 2Li2O + SiH4
и категорически рекомендует сделать приспособление и провести эту реакцию. Моему недоумению не было предела. Это же металлотермия, в лучшем случае получится элементарный кремний. Эту реакцию надо вести при высокой температуре, а моносилан вообще термодинамически не устойчив выше температуры 100 К. В ответ услышал: — «По-настоящему реакция пойдет как написано, иди делай». Нормальный юмор, подумал я, и с отличным настроением, спасая идею сделал устройство с быстрым выводом газообразных продуктов реакции из зоны нагрева. Первый анализ на газовом масс-спектрометре показал наличие значительного количества моносилана. По разности веса определили выход, было что-то около 12%. Маловато, но он есть, а что бы было больше, надо брать тонкоизмельченные исходные вещества. Таков был вывод. И еще был очередной договор. И лаборатория продолжала жить по-человечески и работать по-стахановски.
Нет с нами А. А. Камарзина, но его дело продолжается, если, как говорится, пройдет, то лабораторные разработки перейдут на новый уровень. Начнутся работы по реализации их на промышленной основе. Но где же химия, где фундаментальная наука? А ее не на что делать, Одно утешает, заработанные деньги позволят провести кое-какие алхимические реакции. Например:
I + Sn = In + S, P + Nb = Pb +1/2N2, Ar + Cu = Cr + Au.
Следует заметить реакции обратимые, а вот материальный баланс не сходится. По-видимому, кроме катализатора требуется наличие философского камня, который обеспечит нужное направление реакции и материальный баланс. Отсюда уже видно, что философский камень будет типов: отрицательный и положительный. Что же при наличии финансирования займемся их поисками.
С днем химика, коллеги!
Пусть всё!
Воспоминания Анны Зубаревой
Если говорить о таких человеческих качествах как принципиальность, порядочность и честность, то в полной мере это относится к Александру Алексеевичу. Эти качества проявлялись как в общественной, так и в научной деятельности. Александр Алексеевич был коммунистом в лучшем смысле этого слова. В тяжёлые годы для партии он им оставался и этого не стеснялся, так как своих убеждений не менял и их не предавал, тем самым вызывая большое уважение коллег и соратников. Коллектив неоднократно избирал его парторгом, председателем профсоюзного комитета. Человек с острым умом, четкими представлениями обо всём, Александр Алексеевич не растерялся и в годы «перестройки». Понимая ситуацию, он находит выход из сложившегося тяжёлого материального положения для сотрудников своей лаборатории, за что они бесконечно благодарны ему.
Волей судеб я оказалась в его лаборатории. Попросилась сама. Не из-за материальных благ (от них я отказалась, что называется, на пороге, считая что никакого отношения не имею к разработкам лаборатории). Принимая меня на работу, Александр Алексеевич был честен и прям со мной, нарисовал перспективы и трудности, которые меня ждут.
Работать с ним было удовольствием. В любой ситуации сдержан, рассудителен, задачу всегда ставил чётко и на перспективу. Первым моим заданием было отработать методику анализа на кремний: экспрессную (чтобы можно было быстро определять кремний) и более точную. С этим я справилась. Далее были другие задачи. Я была удивлена: целый год об анализе на кремний никто не вспоминал. Зачем же я это делала? Мне всё стало ясно, когда начались работы по кремнию. Это только эпизод.
Писать об этом человеке можно много. Воспоминания о нём светлы и приятны. К сожалению, Александр Алексеевич рано покинул нас, но светлая память о нём в наших сердцах и делах.
Воспоминания Л. Трушниковой
Александр Алексеевич был не только настоящим ученым, но и прекрасным семьянином, обожал жену и детей, которым отдавал свое доброе сердце. И они платили ему тем же.
Он был талантливым человеком, причем его талант проявлялся во всем: будь то изобретательство (Александр Алексеевич автор большого числа патентов и изобретений) или выращивание урожая в саду: он очень гордился огромными томатами, прекрасными яблоками и грушами.
Такие люди составляют цвет нации, ее гордость. О нем можно сказать, что
Шел он всегда к победе,
Как верный, доблестный солдат.
Однако мы, скорей, солдаты,
А он — идейный генерал,
Давал не только нам зарплаты,
Но мыслей — полный арсенал.
Вся жизнь его была достойной,
Как много дел он совершил!
И жизнью честной, благородной
Он наши души окрылил.
Обратимая реакция | Химия для неосновных
Цели обучения
- Определите обратимую реакцию.
- Приведите примеры обратимых реакций.
Как изменить цвет раствора?
Раствор хлорида кобальта в воде имеет розовый цвет из-за присутствия сольватированного иона Co 2+ . Если добавлено достаточное количество HCl, раствор становится синим, поскольку образуется ион CoCl 4 2-.Реакция может вернуться к розовой форме, если к раствору добавить больше воды.
Обратимые реакции
До этого момента мы писали уравнения химических реакций таким образом, который, казалось бы, указывает на то, что все реакции протекают полностью, пока все реагенты не будут превращены в продукты. В действительности очень многие химические реакции не проходят полностью. Обратимая реакция — это реакция, в которой превращение реагентов в продукты и превращение продуктов в реагенты происходят одновременно.Одним из примеров обратимой реакции является реакция газообразного водорода и паров йода с образованием иодистого водорода. Прямые и обратные реакции можно записать следующим образом.
В прямой реакции водород и йод объединяются с образованием иодистого водорода. В обратной реакции иодистый водород снова разлагается на водород и йод. Две реакции можно объединить в одно уравнение с помощью двойной стрелки.
Двойная стрелка указывает на то, что реакция обратимая.
Когда газообразные водород и йод смешиваются в герметичном контейнере, они начинают реагировать с образованием йодистого водорода. Сначала происходит только прямая реакция, потому что HI отсутствует. По мере протекания прямой реакции она начинает замедляться по мере уменьшения концентраций H 2 и I 2 . Как только образовалось некоторое количество HI, оно начинает распадаться обратно на H 2 и I 2 . Скорость обратной реакции начинается медленно из-за низкой концентрации HI.Постепенно скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается. В конце концов, скорость объединения H 2 и I 2 с образованием HI становится равной скорости разложения HI на H 2 и I 2 . Когда скорости прямой и обратной реакций сравнялись, реакция достигла состояния равновесия.
Сводка
- Определена обратимая реакция.
Практика
Прочтите материалы на XtremePapers.com и ответьте на следующие вопросы:
- Какого цвета гидратированный сульфат меди?
- Если прямая реакция экзотермическая, как бы вы увеличили выход продукта?
- Как мы можем увеличить образование аммиака в процессе Габера?
Обзор
- Все ли химические реакции завершаются?
- Почему приведенная выше реакция считается обратимой?
- Как обозначить обратимую реакцию?
Глоссарий
- обратимая реакция: Реакция, в которой превращение реагентов в продукты и превращение продуктов в реагенты происходят одновременно.
Обратимые и необратимые реакции — Химия LibreTexts
Обратимые и необратимые реакции широко распространены в природе и ответственны за такие реакции, как разложение аммиака.
Введение
Считалось, что все химические реакции являются необратимыми до 1803 года, когда французский химик Клод Луи Бертолле представил концепцию обратимых реакций. Сначала он заметил, что карбонат натрия и хлорид кальция реагируют с образованием карбоната кальция и хлорида натрия; однако, наблюдая за образованием карбоната натрия по краям соляных озер, он понял, что большое количество солей в испаряющейся воде реагирует с карбонатом кальция с образованием карбоната натрия, что указывает на то, что происходит обратная реакция.
Химические реакции представлены химическими уравнениями. Эти уравнения обычно имеют однонаправленную стрелку (\ (\ rightarrow \)) для обозначения необратимых реакций. Другие химические уравнения могут иметь двунаправленные гарпуны (\ (\ rightleftharpoons \)), которые представляют обратимые реакции (не путать с двойными стрелками \ (\ leftrightarrow \), используемыми для обозначения резонансных структур). Чтобы ознакомиться с основами химических реакций, щелкните здесь: Химические реакции
Необратимые реакции
Фундаментальная концепция химии состоит в том, что химические реакции происходят, когда реагенты взаимодействуют друг с другом с образованием продуктов.Эти однонаправленные реакции известны как необратимые реакции, реакции, в которых реагенты превращаются в продукты, а продукты не могут превращаться обратно в реагенты. Эти реакции по сути похожи на выпечку. Ингредиенты, действующие как реагенты, смешиваются и выпекаются вместе, образуя лепешку, которая действует как продукт. Этот осадок нельзя превратить обратно в реагенты (яйца, муку и т. Д.), Так же как продукты необратимой реакции не могут снова превратиться в реагенты.
Пример необратимой реакции — горение. Сжигание включает сжигание органического соединения, такого как углеводород, и кислорода с образованием диоксида углерода и воды. Поскольку вода и диоксид углерода стабильны, они не вступают в реакцию друг с другом с образованием реагентов. Реакции горения имеют следующий вид:
\ [C_xH_y + O_2 \ rightarrow CO_2 + H_2O \]
Обратимые реакции
В обратимых реакциях реагенты и продукты никогда не расходуются полностью; каждый из них постоянно реагирует и производится.Обратимая реакция может иметь следующий обобщенный вид:
\ [A + B \ underset {k _ {- 1}} {\ overset {k_1} {\ rightleftharpoons}} C + D \]
Эту обратимую реакцию можно разделить на две реакции.
Реакция 1: \ [A + B \ xrightarrow {k_1} C + D \]
Реакция 2: \ [C + D \ xrightarrow {k _ {- 1}} A + B \]
Эти две реакции происходят одновременно , что означает, что реагенты реагируют с образованием продуктов, так как продукты реагируют с образованием реагентов.Столкновения реагирующих молекул вызывают химические реакции в замкнутой системе. После образования продуктов связи между этими продуктами разрываются, когда молекулы сталкиваются друг с другом, производя достаточную энергию, необходимую для разрыва связей продукта и молекул реагента.
Ниже приведен пример обобщенной формы обратимой реакции и разрыва обратимой реакции N 2 O 4 ↔ 2NO 2
Реакция 1 и Реакция 2 происходят одновременно, потому что они находятся в закрытой системе.
Синий: Азот Красный: Кислород
Реакция 1 Реакция 2
Представьте себе бальный зал. Пусть реагентом A будет 10 девочек, а реагентом B — 10 мальчиков. Когда каждая девочка и мальчик выходят на танцпол, они объединяются в пары, чтобы стать продуктом. Когда пять девочек и пять мальчиков выходят на танцпол, одна из пяти пар распадается и уходит в сторону, снова становясь реагентами.Когда эта пара покидает танцпол, другой мальчик и девочка в сторонке объединяются, чтобы снова сформировать продукт. Этот процесс продолжается снова и снова, представляя обратимую реакцию.
В отличие от необратимых реакций, обратимые реакции приводят к равновесию: в обратимых реакциях реакция протекает в обоих направлениях, тогда как в необратимых реакциях реакция протекает только в одном направлении. Чтобы узнать больше об этом явлении, щелкните здесь: Химическое равновесие
Если реагенты образуются с той же скоростью, что и продукты, существует динамическое равновесие.Например, если резервуар для воды наполняется водой с такой же скоростью, как вода выходит из резервуара (через гипотетическое отверстие), количество воды, остающейся в резервуаре, остается постоянным.
Связь с биологией
Белок гемоглобина имеет четыре сайта связывания. Молекулы гемоглобина могут связываться с углекислым газом или кислородом. Когда кровь проходит через альвеолы легких, молекулы гемоглобина улавливают богатые кислородом молекулы и связываются с кислородом. Когда гемоглобин проходит через остальную часть тела, он отдает кислород в капиллярах, чтобы система органов могла использовать кислород.Удалив кислород, он улавливает углекислый газ. Поскольку этот процесс постоянно происходит в организме, всегда есть молекулы гемоглобина, улавливающие или вытесняющие кислород, и другие молекулы гемоглобина, которые улавливают или вытесняют углекислый газ. Следовательно, молекулы гемоглобина, кислород и углекислый газ являются реагентами, а молекулы гемоглобина со связанным с ними кислородом или углекислым газом являются продуктами. В этой замкнутой системе некоторые реагенты превращаются в продукты, так как некоторые продукты превращаются в реагенты, что делает эту реакцию похожей на обратимую реакцию.
Авторы и авторство
- Хизер Йи (UCD), Мандип Сохал (UCD)
Обратимые реакции, равновесие и принцип Ле Шателье — Сложный процент
Нажмите для увеличения
Когда вы думаете о химических реакциях, вы можете думать о них как о необратимых, постоянно преобразующих одно вещество в другое. Хотя в некоторых случаях это верно, некоторые химические реакции обратимы, и мы можем взять продукты реакции и превратить их обратно в реагенты.Эти обратимые реакции могут при определенных условиях достигать того, что мы называем «равновесием». Понятие равновесия может быть непростым для понимания, но этот рисунок пытается прояснить его.
Во-первых, давайте выясним, что такое равновесие. Когда у нас есть обратимая реакция, протекающая в замкнутой системе, то есть в системе, в которой никакие вещества не добавляются и не теряются, в начале реакции у нас будут только реагенты. Как только реакция начнется, количества реагентов начнут уменьшаться, а количества продуктов начнут увеличиваться.В необратимой реакции это было бы почти все, но когда реакция обратима, продукты также могут реагировать с образованием реагентов.
Через некоторое время обратимая реакция в замкнутой системе может достичь того, что мы называем «динамическим равновесием». Здесь прямая реакция (реагенты реагируют с образованием продуктов) и обратная реакция (продукты, реагирующие с преобразованием реагентов) протекают с одинаковой скоростью. Это означает, что количества реагентов и продуктов остаются постоянными, несмотря на то, что обе реакции все еще продолжаются.
В качестве аналогии для этого полезно подумать о двух мужчинах, один из которых выкапывает землю из ямы, а другой стоит за пределами ямы и сгребает грязь обратно. Если оба работают с одинаковой скоростью, то размер ямы и размер кучи грязи за пределами ямы останется неизменным, несмотря на то, что они оба все еще сгребают грязь туда-сюда. Динамическое равновесие во многом то же самое.
Хотя количества реагентов и продуктов могут быть изначально такими же, как только мы достигаем динамического равновесия, мы можем внести коррективы в условия равновесия, чтобы изменить пропорции реагентов и продуктов в равновесной смеси.Результаты вносимых нами изменений можно определить с помощью так называемого «принципа Ле Шателье».
Принцип Ле Шателье гласит, что когда мы вносим изменения в реакцию при равновесии, равновесие будет реагировать на изменение, которое мы делаем, чтобы попытаться отменить это изменение. Например, если мы увеличим температуру реакции, она отреагирует так, что температура снизится. Если мы увеличим концентрацию реагента, он отреагирует таким образом, что концентрация этого реагента снизится.На первый взгляд это кажется довольно простым. Однако его применение может быть немного сложнее, чем кажется на первый взгляд.
Концентрация
Давайте начнем с обсуждения концентрации. Концентрация — это просто мера того, сколько вещества находится в определенном объеме. Если мы увеличиваем концентрацию определенного вещества в реакции, согласно принципу Ле Шателье, реакция равновесия будет заключаться в попытке уменьшить концентрацию этого вещества.
Допустим, мы увеличиваем концентрацию одного из реагентов; равновесие может снизить его концентрацию, благоприятствуя прямой реакции и производя больше продуктов. Мы иногда называем это равновесием «движение вправо». Конечным результатом увеличения концентрации реагентов будет производство большего количества продуктов в равновесии.
Температура
Изменение температуры также может повлиять на положение равновесия.Если мы увеличим температуру, согласно принципу Ле Шателье, равновесие снизит температуру. Как он это делает и благоприятствует ли он реагентам или продуктам, будет зависеть от реакции.
Химические реакции могут быть экзотермическими (выделение тепла) или эндотермическими (выделение тепла). Если энергия, необходимая для разрыва связей, меньше энергии, выделяющейся при образовании новых связей, реакция будет экзотермической. Если энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при образовании новых связей, реакция является эндотермической.Для обратимых реакций прямая или обратная реакция будет экзотермической, а другая — эндотермической.
Когда мы повышаем температуру, реакция будет благоприятствовать той, которая является эндотермической, с выделением тепла и понижением температуры. С другой стороны, если мы снизим температуру, экзотермическая реакция будет благоприятной, так как это приведет к выделению тепла и повышению температуры.
Давление
Изменение давления реакции с участием газов также может повлиять на положение равновесия.Давление вызывается столкновениями частиц газа со стенками емкости. Отсюда следует, что чем больше количество частиц газа, тем выше будет давление — и это дает нам представление о влиянии изменения давления на положение равновесия.
Если мы увеличим давление, принцип Ле Шателье гласит, что равновесие изменится, чтобы уменьшить давление. Это можно сделать, отдав предпочтение стороне реакции с меньшим количеством молекул газа; на чьей это стороне, конечно, будет зависеть рассматриваемая реакция.И наоборот, если мы уменьшим давление, равновесие будет реагировать на повышение давления и, следовательно, будет благоприятствовать стороне реакции с большим количеством молекул газа.
В качестве предостережения: существует множество реакций, в которых фактически имеется такое же количество газообразных молекул, как показано в сбалансированном уравнении. В этом случае изменение давления не будет иметь никакого эффекта, так как это не повлияет на обе стороны реакции.
Катализаторы
Катализаторы часто используются химиками для увеличения скорости химических реакций.Однако его использование никоим образом не влияет на положение равновесия. Это потому, что он в равной степени ускоряет как прямую, так и обратную реакцию, поэтому в целом ни одна из сторон реакции не пользуется одной из них.
Почему все это имеет значение?
Вас можно простить за то, что вы задаетесь вопросом, почему химики так заинтересованы в том, как изменение условий равновесия повлияет на него, и почему это действительно важно для всех, кто не химик. На самом деле для нехимиков это важнее, чем вы думаете.Процесс Габера, реакция, в которой водород и азот соединяются с образованием аммиака, является примером реакции, в которой используются некоторые химические элементы, которые мы здесь обсуждали. Часть аммиака, производимого в результате этого процесса, используется для производства удобрений, и, по оценкам, это помогает прокормить около 40% населения мира.
Проблема с реакцией в том, что она обратима; поэтому требуется некоторая настройка, чтобы произвести как можно больше аммиака. Во-первых, во время процесса любой азот и водород, которые не вступают в реакцию, рециркулируют до тех пор, пока не вступят в реакцию.Образующийся аммиак также удаляется из реактора, так что равновесие смещается, чтобы произвести больше аммиака. Железный катализатор часто используется для ускорения реакции.
С точки зрения температуры прямая реакция (азот и водород в аммиак) является экзотермической. Это означает, что рекомендуется использовать низкую температуру. Однако в промышленных масштабах процесс Габера обычно проводят при 400-450 ° C. Это ни в коем случае не низкая температура, так зачем ее использовать? Ну, температура также влияет на скорость реакции, как подробно описано на предыдущем графике здесь — если температура слишком низкая, реакция будет происходить слишком медленно! Поэтому используется так называемая «компромиссная температура», обеспечивающая баланс между достаточно быстрой реакцией и условиями, которые способствуют образованию желаемых продуктов.
Наконец, сбалансированное уравнение реакции показывает, что в левой части уравнения (4) больше молекул газа, чем в правой части (2).
Следовательно, реакции способствует высокое давление, так как это смещает равновесие в сторону с меньшим количеством молекул газа, производя больше аммиака. По этой причине процесс Габера обычно проводится при давлении около 200 атмосфер. Опять же, здесь есть определенный компромисс; более высокое давление приведет к образованию еще большего количества аммиака, но потребует более дорогостоящего оборудования и более дорогостоящего обслуживания.
В заключение стоит отметить, что есть и другие способы рассмотрения того, как изменения влияют на равновесие, путем использования более математических подходов вместо принципа Ле Шателье. Они лучше помогают делать прогнозы, поскольку позволяют избежать некоторой путаницы, к которой иногда приводит Принцип. Однако, если вы студент в Великобритании, эти методы появляются только после GCSE, поэтому принцип Ле Шателье является Нравится вам это или нет, но до тех пор ваш единственный инструмент для предсказания равновесия!
Понравились эта публикация и изображение? Подумайте о поддержке сложного процента на Patreon и получайте предварительные просмотры предстоящих публикаций и многое другое!
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 Международная лицензия. См. Рекомендации по использованию содержания сайта.
Ссылки и дополнительная литература
13.1 Химическое равновесие — Химия
Цели обучения
К концу этого раздела вы сможете:
- Опишите природу равновесных систем
- Объясните динамическую природу химического равновесия
Химическая реакция обычно описывается способом, предполагающим, что она протекает в одном направлении, в том направлении, в котором мы читаем, но все химические реакции обратимы, и как прямая, так и обратная реакция протекают в той или иной степени в зависимости от условий.В химическом равновесии прямые и обратные реакции протекают с равными скоростями, а концентрации продуктов и реагентов остаются постоянными. Если мы запускаем реакцию в замкнутой системе, чтобы продукты не могли улетучиться, мы часто обнаруживаем, что реакция не дает 100% выхода продуктов. Вместо этого некоторые реагенты остаются после того, как концентрации перестают изменяться. В этот момент, когда нет дальнейшего изменения концентраций реагентов и продуктов, мы говорим, что реакция находится в равновесии.Смесь реагентов и продуктов находится в состоянии равновесия.
Например, когда мы помещаем образец тетроксида диазота (N 2 O 4 , бесцветный газ) в стеклянную трубку, он образует диоксид азота (NO 2 , коричневый газ) в результате реакции
[латекс] \ text {N} _2 \ text {O} _4 (g) \; {\ rightleftharpoons} \; 2 \ text {NO} _2 (g) [/ latex]
Цвет становится темнее, поскольку N 2 O 4 преобразуется в NO 2 . Когда система достигает равновесия, присутствуют как N 2 O 4 , так и NO 2 (Рисунок 1).
Рисунок 1. Смесь NO 2 и N 2 O 4 движется к равновесию. Бесцветный N 2 O 4 реагирует с образованием коричневого цвета NO 2 . По мере того, как реакция идет к равновесию, цвет смеси темнеет из-за увеличения концентрации NO 2 .
Образование NO 2 из N 2 O 4 является обратимой реакцией , которая обозначена стрелкой равновесия (⇌).Все реакции обратимы, но многие реакции для всех практических целей протекают в одном направлении до тех пор, пока реагенты не будут исчерпаны, и обратятся вспять только при определенных условиях. Такие реакции часто изображаются односторонней стрелкой от реагентов к продуктам. Многие другие реакции, такие как образование NO 2 из N 2 O 4 , являются обратимыми в более легко достижимых условиях и, следовательно, названы так. В обратимой реакции реагенты могут объединяться с образованием продуктов, а продукты могут реагировать с образованием реагентов.Таким образом, не только N 2 O 4 может разлагаться с образованием NO 2 , но и образовавшийся NO 2 может реагировать с образованием N 2 O 4 . Как только прямая реакция дает какой-либо NO 2 , начинается обратная реакция, и NO 2 начинает реагировать с образованием N 2 O 4 . В состоянии равновесия концентрации N 2 O 4 и NO 2 больше не изменяются, поскольку скорость образования NO 2 в точности равна скорости потребления NO 2 , а скорость образования образование N 2 O 4 в точности равно норме расхода N 2 O 4 . Химическое равновесие — это динамический процесс. : Как и в случае с пловцами и загорающими, количество каждого из них остается постоянным, но между ними существует постоянный поток (рис. 2).
Рис. 2. Эти жонглеры демонстрируют динамическое равновесие. Каждый бросает булавы друг другу с той же скоростью, с которой он получает дубинки от этого человека. Поскольку булавы бросаются непрерывно в обоих направлениях, количество булав, движущихся в каждом направлении, постоянно, а количество булав, которые каждый жонглер имеет в данный момент времени, остается (примерно) постоянным.
В химическом равновесии прямая и обратная реакции не прекращаются, скорее они продолжают протекать с той же скоростью, что приводит к постоянным концентрациям реагентов и продуктов. Графики, показывающие, как скорости реакции и концентрации меняются во времени, показаны на рисунке 1.
Мы можем обнаружить состояние равновесия, потому что концентрации реагентов и продуктов не меняются. Однако важно убедиться, что отсутствие изменений связано с равновесием, а не со скоростью реакции, которая настолько медленная, что изменения концентрации трудно обнаружить.
Мы используем двойную стрелку при написании уравнения обратимой реакции. Такая реакция может быть равновесной, а может и не быть. Например, на рисунке 1 показана реакция:
[латекс] \ text {N} _2 \ text {O} _4 (g) \; {\ rightleftharpoons} \; 2 \ text {NO} _2 (g) [/ latex]
Когда мы хотим поговорить об одном конкретном компоненте обратимой реакции, мы используем единственную стрелку. Например, в равновесии, показанном на рисунке 1, скорость прямой реакции
[латекс] 2 \ text {NO} _2 (g) \; {\ longrightarrow} \; \ text {N} _2 \ text {O} _4 (g) [/ latex]
равна скорости обратной реакции
[латекс] \ text {N} _2 \ text {O} _4 (g) \; {\ longrightarrow} \; 2 \ text {NO} _2 (g) [/ latex]
Равновесие и безалкогольные напитки
Связь между химией и газированными безалкогольными напитками восходит к 1767 году, когда Джозеф Пристли (1733–1804; в основном известный сегодня своей ролью в открытии и идентификации кислорода) открыл метод смешивания воды с углекислым газом для получения газированной воды.В 1772 году Пристли опубликовал статью под названием «Пропитка воды фиксированным воздухом». В статье описывается капание купоросного масла (сегодня мы называем это серной кислотой, но какой отличный способ описать серную кислоту: «купоросное масло» буквально означает «жидкая мерзость») на мел (карбонат кальция). Образовавшийся CO 2 попадает в емкость с водой под сосудом, в котором происходит начальная реакция; перемешивание помогает газообразному CO 2 смешаться с жидкой водой.
[латекс] \ text {H} _2 \ text {SO} _4 (l) \; + \; \ text {CaCO} _3 (s) \; {\ longrightarrow} \; \ text {CO} _2 (g) \; + \; \ text {H} _2 \ text {O} (l) \; + \; \ text {CaSO} _4 (aq) [/ latex]
Двуокись углерода плохо растворяется в воде.{+} (водн.) [/ латекс]
Сегодня CO 2 может находиться под давлением в безалкогольных напитках, устанавливая равновесие, показанное выше. Однако, как только вы открываете контейнер с напитком, происходит каскад сдвигов равновесия. Во-первых, газ CO 2 в воздушном пространстве наверху бутылки улетучивается, вызывая смещение равновесия между газовой фазой CO 2 и растворенным или водным CO 2 , снижая концентрацию CO 2 в безалкогольный напиток. Уменьшение количества растворенного в жидкости CO 2 приводит к разложению угольной кислоты на растворенный CO 2 и H 2 O.Пониженная концентрация угольной кислоты вызывает сдвиг окончательного равновесия. Пока безалкогольный напиток находится в открытом контейнере, CO 2 пузырится из напитка, выпуская газ в воздух (Рисунок 3). При снятой крышке бутылки реакции CO 2 больше не находятся в равновесии и будут продолжаться до тех пор, пока не перестанут оставаться реагенты. В результате получается безалкогольный напиток с гораздо более низкой концентрацией CO 2 , который часто называют «безалкогольным».
Рисунок 3. При открытии безалкогольного напитка происходит несколько сдвигов равновесия. (кредит: модификация работы «D Coetzee» / Flickr)
Давайте рассмотрим испарение брома как второй пример системы в состоянии равновесия.
[латекс] \ text {Br} _2 (l) \; {\ rightleftharpoons} \; \ text {Br} _2 (g) [/ latex]
Равновесие может быть установлено для физических изменений, таких как переход жидкости в газ, а также для химической реакции. На рис. 4 показан образец жидкого брома в состоянии равновесия с парами брома в закрытом контейнере.Когда мы наливаем жидкий бром в пустую бутылку, в которой нет паров брома, часть жидкости испаряется, количество жидкости уменьшается, а количество пара увеличивается. Если мы закроем бутылку так, чтобы пар не выходил, количество жидкости и пара в конечном итоге перестанет меняться и установится равновесие между жидкостью и паром. Если бутылка не закрыта крышкой, пары брома улетучатся и равновесие не будет достигнуто.
Рис. 4. Изображено равновесие между жидким бромом, Br 2 ( l ), темной жидкостью, и парами брома, Br 2 ( г ), оранжевым газом.Поскольку контейнер герметичен, пары брома не могут улетучиваться и равновесие сохраняется. (кредит: http://images-of-elements.com/bromine.php)
Реакция находится в равновесии, когда количества реагентов или продуктов больше не меняются. Химическое равновесие — это динамический процесс, означающий, что скорость образования продуктов прямой реакции равна скорости, с которой продукты реформируют реагенты обратной реакцией.
Химия: упражнения в конце главы
- Что значит назвать реакцию «обратимой»?
- Чем отличается обратимая реакция при написании уравнения от необратимой реакции?
- Если реакция обратима, когда можно сказать, что она достигла равновесия?
- Находится ли система в равновесии, если константы скорости прямой и обратной реакций равны?
- Если концентрации продуктов и реагентов равны, находится ли система в равновесии?
Глоссарий
- равновесие
- в химических реакциях — состояние, при котором превращение реагентов в продукты и превращение продуктов обратно в реагенты происходят одновременно с одинаковой скоростью; состояние баланса
- обратимая реакция
- химическая реакция, которая может протекать как в прямом, так и в обратном направлении при заданных условиях
Решения
Ответы на упражнения в конце главы по химии
1.Реакция может идти как в прямом, так и в обратном направлении.
3. Когда система достигла равновесия, никаких дальнейших изменений в концентрациях реагентов и продуктов не происходит; реакции продолжают происходить, но с одинаковой скоростью.
5. Концепция равновесия не предполагает равных концентраций, хотя это возможно.
физическая химия — Можем ли мы заставить обратимую реакцию в равновесии достичь 100% завершения?
Эти два вопроса как бы связаны, поэтому я отвечу в меру своих возможностей.
Реакция в динамическом равновесии может приближаться к завершению в зависимости от ее константы равновесия, которая представляет собой соотношение между продуктами и реагентами при определенной температуре. Нет, константа равновесия не изменится, если вы добавите больше реагентов в попытке довести реакцию до завершения. Мы ссылаемся на принцип Ле Шателье, который гласит, что если добавить еще один параметр, скажем, реагент, реакция будет действовать для стабилизации приложенного к нему напряжения.
Возьмите эту реакцию $ \ ce {PCl3 + Cl2 <=> PCl5} $.Если бы я добавил еще $ \ ce {PCl3} $, то изменение, которое мы стали бы свидетелями, было бы сдвигом в равновесии, то есть система будет реагировать, потребляя больше реагентов и производя больше продуктов. По сути, мы видим реакцию системы на стабилизацию внесенных нами изменений.
Однако этот принцип не ограничивается только добавлением реагентов или продуктов. Мы видим, что система пытается стабилизировать изменения давления, температуры и объема. Если мы увеличим давление, как система будет действовать, чтобы стабилизировать его? Давление возникает в результате ударов частиц газа о стенки контейнера.Таким образом, мы бы увидели, что система уменьшила количество частиц газа, чтобы снова достичь равновесия. По сути, он сместится в сторону с наименьшим количеством частиц газа. Объем и давление, очевидно, связаны в этом принципе. Увеличение объема — это уменьшение давления, а уменьшение объема — увеличение давления.
Возьмем, например, эту реакцию $ \ ce {CaCO3 (s) <=> CaO (s) + CO2 (g)} $. Если мы увеличим объем (уменьшим давление), мы увидим, что система сместится вправо, потому что в ней больше всего молей газа, и нам нужно больше частиц газа, чтобы заполнить объем и стабилизировать давление.
Наконец, при изменении тепла мы рассматриваем его как продукт или реагент для экзотермических и эндотермических реакций соответственно. В экзотермической реакции тепло записывается как продукт $ \ ce {A <=> B} + \ text {heat} $, а в эндотермической реакции тепло записывается как реагент. Таким образом, когда мы меняем теплоту эндотермической или экзотермической реакции, мы меняем ее реагенты или продукты и относимся к ней так же, как и к изменению концентрации.
Дело в том, что константа равновесия остается постоянной, иначе ее назвали бы переменной равновесия.Однако мы видим изменение положения равновесия.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Обратимые реакции
Простая модель обратимой реакции немного похожа на приведенную выше симуляцию «двух ящиков» с той разницей, что вероятность движения частицы слева направо отличается от вероятности движения частицы справа налево. Это приводит к тому, что в одном ящике появляется больше счетчиков, чем в другом, когда система переходит в устойчивое состояние. Еще раз обратите внимание, что даже когда было достигнуто устойчивое состояние («равновесие»), между двумя ячейками все еще есть движение счетчиков.Однако количество частиц, движущихся L R за данный момент времени, точно такое же, как количество движущихся R L. Моделирование позволяет исследовать влияние изменения двух скоростей на положение равновесия.
| Примечание. Здесь важно различать общую скорость частиц, перемещающихся из коробки в коробку, и внутреннюю скорость , которая связана с вероятностью перемещения отдельной частицы из одной коробки в другую.Последняя аналогична константе скорости химической реакции, а первая аналогична наблюдаемой скорости. Общая скорость — это внутренняя скорость, умноженная на количество частиц в соответствующем поле. |
Реальные обратимые реакции
Реальные реакции более сложны.
Как и в приведенном выше моделировании, положение равновесия определяется собственными скоростями (константами скорости) прямых и обратных реакций.Поскольку обычно существует более одного реагента и продукта, их пропорции могут варьироваться. Температура также влияет на положение равновесия. Моделирование равновесных смесей позволяет исследовать влияние изменения начальных концентраций реагентов и продуктов, а также температуры на некоторые важные обратимые реакции.
∆G и равновесие
Мы измеряем положение равновесия в обратимой реакции с помощью константы равновесия . Это соотношение общего вида [продукты] / [реагенты].Таким образом, чем больше значение, тем дальше равновесие смещается вправо (продукты).
Более формально, мы находим, что для реакции
aA + bB + cC xX + yY + zZ
выражение
| [X] экв. x [Y] экв. y [Z] экв. z |
| _______________________ |
| [A] экв. a [B] экв. b [C] экв. c |
является константой при определенной температуре и называется K c , индекс «c» означает, что она выражается в единицах концентрации.
| т.е. K c = | [X] экв. x [Y] экв. y [Z] экв. z | |
| _______________________ | ||
| [A] экв. a [B] экв. b [C] экв. c |
| Для газовых реакций мы часто используем парциальное давление как меру концентрации, но это мелочь. |
Возможно, неудивительно, что мы обнаруживаем, что константа равновесия связана с ∆ G . Чем отрицательнее ∆ G , тем больше продуктов преобладает и тем больше константа равновесия.
Математическое выражение:
∆ G = — RT ln K или ∆ G = –2,3 RT log 10 K (Коэффициент 2,3 преобразует использование натурального бревна, ln, и бревна в основание 10, журнал 10 , иногда просто пишется «журнал».) R — газовая постоянная. Он имеет значение 8,3 Дж. К -1 моль -1 .
Отрицательный знак означает, что по мере того, как ∆ G становится более отрицательным, K c становится больше и реакция приближается к завершению, то есть с большей долей продуктов в реакционной смеси.
Используя вышеприведенное выражение, значение ∆ G , равное –57 кДж моль -1 соответствует константе равновесия 1 x 10 10 (единицы зависят от реакции), т.е. реакция эффективна. полный.A ∆ G +57 кДж / моль -1 соответствует константе равновесия 1 x 10 -10 , , т.е. , реакция фактически не происходит. Это основа упомянутого выше эмпирического правила ± 60 кДж моль -1 .
∆
G и температура
∆ G зависит от температуры и, следовательно, от константы равновесия.
Мы видели реакцию
CaO (т.) + CO 2 (г) CaCO 3 (т)
, что мы можем определить температуру, когда ∆ G = 0 — переломный момент между реакцией, идущей вправо или влево.Это может быть полезно изобразить на графике зависимости ∆ G от температуры.
Обратите внимание, что он наклоняется вверх слева направо, , т.е. , по мере увеличения температуры реакция становится менее возможной. Это потому, что график на самом деле является графиком выражения.
∆ G = ∆ H — T ∆ S
Таким образом, наклон или градиент графика составляет –∆ S . Как мы видели, ∆ S для этой реакции отрицательное, поэтому наклон положительный.Наклон остается прежним, так как ∆ S не меняется с температурой.
Температура, когда ∆ G равна нулю, составляет примерно 1100 K, что мы и выяснили ранее. Мы можем построить тот же график для других реакций, таких как равновесные реакции, рассмотренные ранее.
Диаграммы Эллингема
Важной промышленной проблемой является извлечение металлов из руд. Руды обычно представляют собой оксиды металлов или соединения, такие как сульфиды и карбонаты, которые можно легко превратить в оксиды, нагревая их на воздухе (обжиг).Проблема состоит в том, чтобы найти подходящий восстановитель, который превратит оксид в металл. В идеале восстановитель должен быть дешевым и проводить восстановление при как можно более низкой температуре, чтобы снизить затраты на топливную энергию. Кокс (нечистая форма углерода) — дешевый и распространенный восстановитель, поскольку он удаляет кислород из оксидов металлов в виде моноксида углерода (или диоксида углерода).
Мы можем предсказать, какие восстановители, какие оксиды и при каких температурах могут восстанавливать, используя графическое изображение для построения графика ∆ G против T для множества соответствующих реакций.Все реакции написаны так, что в них участвует 1 моль молекул кислорода. Такая диаграмма называется диаграммой Эллингема, но график точно такой же, как и раньше, ∆ G в зависимости от температуры.
Например, можно ли использовать углерод для восстановления оксида цинка до цинка при а) 1000 К б) 1500 К?
Требуемая реакция:
2C + 2ZnO 2CO + 2Zn
График показывает, что при 1000 K мы имеем следующие приблизительные значения ∆ G :
1.2C + O 2 2CO ∆ G = –400 кДж моль -1
2. 2Zn + O 2 2ZnO ∆ G = –550 кДж моль -1
Так обратная реакция 2:
3. 2ZnO 2Zn + O 2 ∆ G = +550 кДж моль -1
Подсказка Обращение реакции меняет знак ∆ G
Складывая 1. и 3. получаем:
2C + O 2 + 2ZnO 2CO + 2ZnO + O 2
∆ G = –400 + 550 = +150 кДж моль -1
, поэтому при 1000 К реакция невозможна.
При 1500 K имеем следующие значения ∆ G :
4. 2C + O 2 2CO ∆G = –500 кДж моль -1
5. 2Zn + O 2 2ZnO ∆G = –250 кДж моль -1
так:
6. 2ZnO 2Zn + O 2 ∆G = +250 кДж моль -1
Сложив 4 и 6 и исключив кислород, как указано выше, мы получим
2ZnO + 2C 2CO + 2Zn ∆ G = –250 кДж моль -1
При 1500 K реакция является возможной .
В точке на графике, где пересекаются две линии, ∆ G = 0. Таким образом, указанная выше реакция возможна при температурах выше 1200 К.
Вышеупомянутую процедуру можно замкнуть накоротко. Постройте только линии для двух рассматриваемых процессов. При любой температуре реакция, представленная нижней линией , будет иметь более отрицательное значение ∆ G , чем реакция, представленная верхней линией. Таким образом, реакция, представленная нижней линией, пойдет на вперед на и приведет к реакции, представленной верхней линией в направлении , обратном , давая отрицательное значение ∆ G для всей реакции.Таким образом, углерод, переходящий в оксид углерода, будет восстанавливать оксид магния, например, только при температурах выше 2000 К.
Углерод в форме кокса используется в качестве восстановителя в ряде промышленных процессов, особенно в производстве железа, где оксиды железа (в основном оксид железа (III), Fe 2 O 3 ) восстанавливаются до железа в доменной печи.
Примечание. Потому что
∆ G = ∆ H — T ∆ S система
график зависимости ∆ G от T имеет наклон системы –∆ S . Изменения наклона указывают на то, что значение ∆ S система. изменился. Это происходит при температурах, когда один из реагентов или продуктов меняет состояние (плавится или кипит) и, следовательно, изменяется значение его энтропии.
.
