Содержание
Химические свойства солей для ЕГЭ 2021 / Блог / Справочник :: Бингоскул
Химические свойства солей
Соли следует рассматривать в виде продукта взаимодействия кислоты и основания. В итоге могут образовываться:
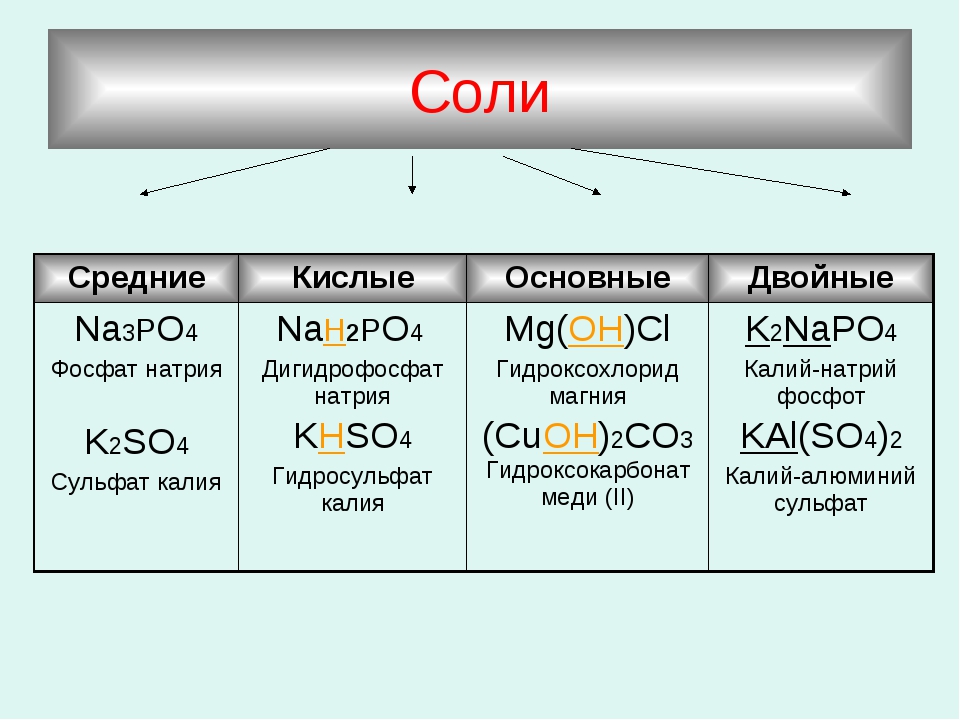
- нормальные (средние) — образуются при достаточном для полного взаимодействия количестве кислоты и основания. Названия нормальных солей состоят из двух частей. В начале называется анион (кислотный остаток), затем катион.
- кислые — образуются при избытке кислоты и недостаточном количестве щелочи, потому как при этом катионов металла становится недостаточно для замещения всех катионов водорода, имеющихся в молекуле кислоты. В составе кислотных остатков данного вида солей вы всегда увидите водород. Кислые соли образуются только многоосновными кислотами и проявляют свойства как солей, так и кислот. В названиях кислых солей ставится приставка гидро- к аниону.
- основные соли — образуются при избытке основания и недостаточном количестве кислоты, потому как в данном случае анионов кислотных остатков недостаточно для полного замещения гидроксогрупп, имеющихся в основании.
 основные соли в составе катионов содержат гидроксогруппы. Основные соли возможны для многокислотных оснований, а для однокислотных нет. Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. Название основных солей строится следующим образом: к аниону добавляется приставка гидроксо-.
основные соли в составе катионов содержат гидроксогруппы. Основные соли возможны для многокислотных оснований, а для однокислотных нет. Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. Название основных солей строится следующим образом: к аниону добавляется приставка гидроксо-.
| Типичные реакции нормальных солей |
|---|
|
| Типичные реакции кислых солей |
|---|
|
| Типичные реакции основных солей |
|---|
|
Комплексные соли — соединение, в узлах кристаллической решетки которого содержатся комплексные ионы.
Изучай химические свойства:
Решай с ответами:
Подготовка к ЦТ и ЕГЭ по химии
Солями называются сложные вещества, состоящие из кислотных остатков и атомов металлов или других атомных группировок. При диссоциации солей образуются катионы металлов (а также катион аммония NH4 +) и анионы кислотных остатков.
При полном замещении атомов водорода в молекуле кислоты образуются средние (или нормальные) соли, при неполном – кислые соли. Существуют несколько групп солей.
При частичном замещении групп OH— в молекуле многокислотного гидроксида кислотными остатками образуются средние соли, например, KNO3, Na2CO3.
Кислые соли образуются многоосновными кислотами в случае их неполной нейтрализации гидроксидом, например, NaHCO3, Ca(HCO3)2. Кислые соли могут образовывать только многоосновные кислоты, одноосновные кислоты кислых солей образовать не могут.
Если атомы водорода в многоосновной кислоте замещены атомами не одного, а двух различных металлов, образуются двойные соли, например, KAl(SO4)2, NaKCO3.
При частичном замещении групп OH— в молекуле многокислотного основания кислотными остатками образуются основные соли: Zn(OH)Cl, Al(OH)SO4.
Также существует группа комплексных солей, состав которых нельзя объяснить, используя обычные представления о валентности.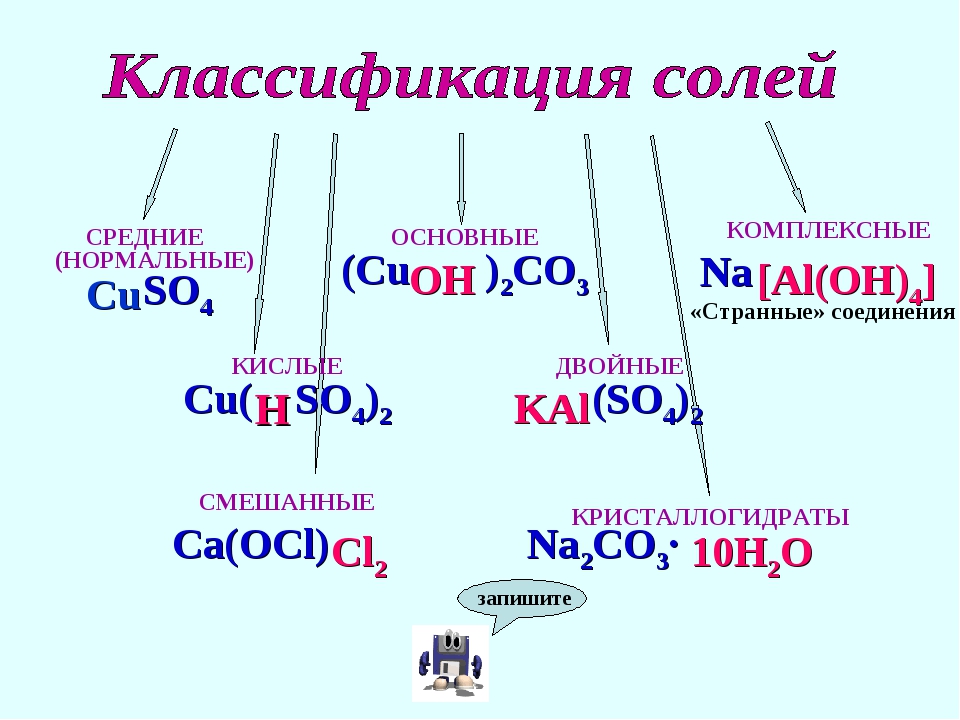 Строение и свойства этих соединений изучаются в высшей школе.
Строение и свойства этих соединений изучаются в высшей школе.
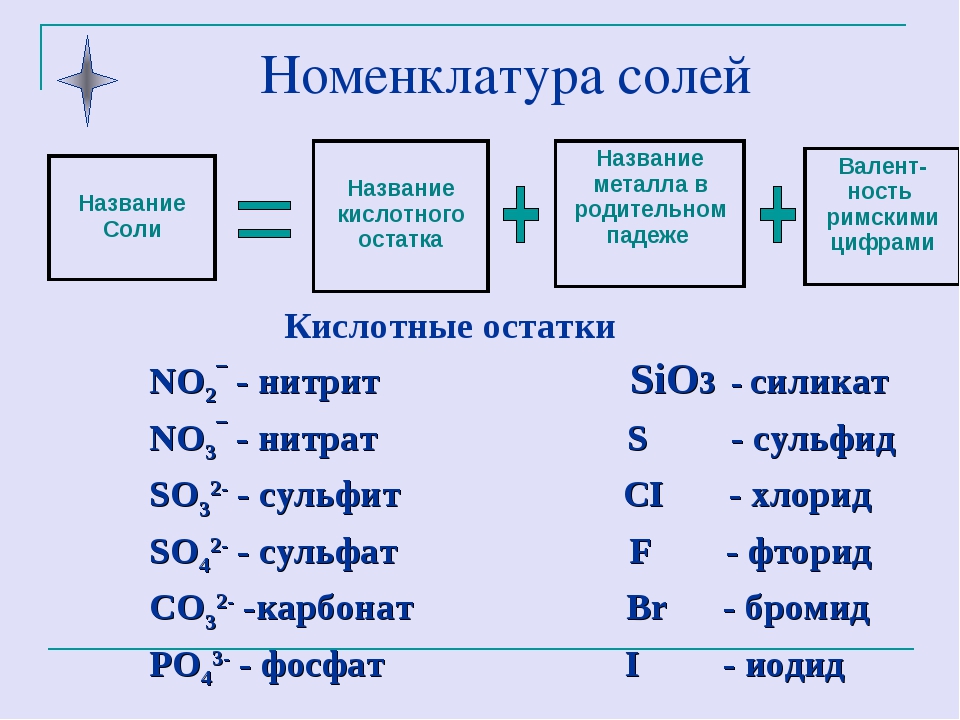
Название соли каждой кислоты происходит от латинского названия кислотного остатка. Например, соли азотистой кислоты называются нитритами: нитрит калия KNO2, нитрит магния Mg(NO2) 2. Названия солей бескислородных кислот оканчиваются на “ид”, например, сульфид калия K2S. В случае, когда соль образована металлом, имеющим разную валентность, то она указывается после названия металла римской цифрой в скобках. Например, FeCl2 – хлорид железа (II), Fe2(SO4)3 – сульфат железа (III). Если в кислой соли в кислотный остаток входит один атом водорода, то к названию соли добавляются частицы “би” или “гидро”, а если два атома, то “дигидро”: Mg(HCO3)2 – бикарбонат, или гидрокарбонат магния, Na2HPO4 – гидрофосфат натрия, NaH2PO4 – дигидрофосфат натрия.
Соли являются твердыми веществами с самой различной растворимостью в воде.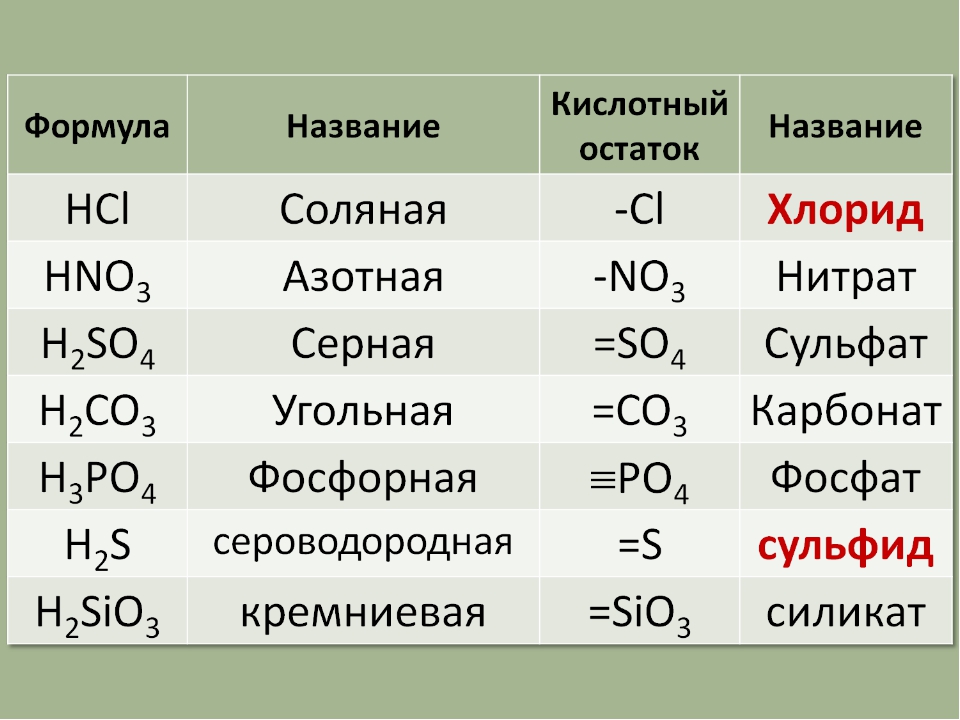 По этому критерию их условно делят на растворимые, малорастворимые и практически нерастворимые.
По этому критерию их условно делят на растворимые, малорастворимые и практически нерастворимые.
Как электролиты средние соли в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков:
MgSO4 = Mg2+ + SO42-
Кислые и основные соли диссоциируют ступенчато. У кислых солей вначале происходит диссоциация на катион металла и анион кислотного остатка, после чего в значительно меньшей степени, диссоциирует анион с образованием катионов водорода. У основных солей вначале отщепляются кислотные остатки, а затем, также в значительно меньшей степени, ионы OH—.
Химические свойства солей во многом зависят от их химической природы.
Если соль образована летучими или слабыми кислотами наподобие HCl, H2S, H2СO3, то она взаимодействует с нелетучими кислотами, например. H2SO4, с выделением летучей или слабой кислоты и образованием новой соли:
2NaCl + H2SO4 = Na2SO4 + 2HCl (соль твёрдая, кислота концентрированная, реакция протекает при нагревании)
Ca3(PO4) 2 + 3H2SO4 = 3CaSO4 + 2H3PO4
В водных растворах соли могут вступать в реакцию с гидроксидами, образуя новую соль и гидроксид при условии, если один из продуктов реакции будет выпадать в осадок:
CuCl2 +2NaOH = Cu(OH)2 + 2NaCl
Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH
При подобных условиях в водных растворах соли могут вступать в реакцию друг с другом, образуя новые соли:
KCl + AgNO3 = AgCl + KNO3
Соли также реагируют в водных растворах с металлами, стоящими в ряду активности до металла, входящего в состав соли:
Zn + CuSO4 = ZnSO4 + Cu
К наиболее общим способам получения солей относятся химические взаимодействия: металлов с неметаллами 2Na + Cl2 = 2NaCl
металлов с кислотами: Mg + H2SO4 = MgSO4 + H2
основных оксидов с кислотными CaO + CO2 = CaCO3.
кислот с солями H2SO4 + BaCl2 = BaSO4 + 2HCl.
оснований с солями 2NaOH + CuSO4 = Na2SO4 + Cu (ОН)2
кислот с основаниями NaOH + HCl = NaCl + H2O
основных оксидов с кислотами H2SO4 + CaO = CaSO4 + H2O
кислотных оксидов с основаниями Ca(OH)2 + CO2 = CaCO3 + H2O
двух солей между собой K2SO4 + BaCl2 = BaSO4 + 2KCl
металлов с солями Fe+ CuSO4 = FeSO4 + Cu
Кислые соли получают при неполной нейтрализации кислоты основанием, при этом гидроксид берут в количестве, недостаточном для полной нейтрализации кислоты: NaOH + H2S = NaHS + H2O
Основные соли получают частичной нейтрализацией основания кислотой:
Zn(ОН) 2 + HCl = Zn(ОН)Cl + H2O
|
Соли шестой подгруппы преимущественно бесцветные кристаллы или белые порошки. Многие из них очень гигроскопичны и расплываются на воздухе. Окислы этих металлов обладают амфотерными свойствами, поэтому большинство их солей легко подвергается гидролизу, переходя в основные соли, мало или вовсе нерастворимые в воде; известны также соли, где эти металлы входят в состав анионов (например, ниобаты и танталаты).
Соли химических веществ | Химия | Химические вещества. Соли. Солью называются сложные вещества, образующиеся в результате замещения одного или нескольких атомов водорода в кислоте на металл (или группу NHJ) и диссоциирующие в водных растворах на положительно заряженные ионы металла (или Nh5+) и отрицательно заряженные ионы — кислотные остатки. Различают соли средние, кислые, основные, двойные, смешанные и комплексные. |
|
ЕГЭ. Химические свойства солей
Химические свойства солей
1. Взаимодействие растворов солей с металлами
Более активные металлы вытесняют из солей менее активные металлы:
Fe + CuSO4 → Cu + FeSO4
Железо является более активным металлом, чем медь, так как стоит левее в ряду активностей металлов, следовательно вытесняет медь из ее соли. Такие реакции протекают в растворах, следовательно, соли должны быть растворимыми.
Ag + CuSO4 → реакция не идет, так как серебро стоит правее меди в ряду активностей металлов и, следовательно, является более слабым металлом.
2. Соли вступают в реакции ионного обмена с щелочами:
Условия: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2 + 2NaCl
NaOH + NH4NO3 → NH3 + NaNO3 + H2O
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
3. Соли вступают в реакции ионного обмена с кислотами:
Условие: должен выделяться газ, выпадать осадок или образовываться более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
4. Некоторые соли могут вступать в окислительно-восстановительные реакции.
1) Соли, проявляющие окислительные свойства: соли кислородсодержащих кислот галогенов (KClO3, KClO4 и др.), KMnO4, K2CrO7, нитраты (KNO3 и др) и некоторые другие.
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
3KBrO4 + 8NH3 → 3KBr + 4N2 + 12H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
2FeCl3 + Fe → 3FeCl2
2) Соли, прявляющие восстановительные свойства: соли Fe+2, Cr+2, Cr+3, Sn+2, Cu+, K2S и сульфиды, K2SO3 и сульфиты и некоторые другие.
2CrCl2 + 4H2SO4(к) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
Cr2O3 + NaClO3 + 2K2CO3 → 2K2CrO4 + NaCl + 2CO2
Cu2S + 14HNO3(к) → H2SO4 + 2Cu(NO3)2 + 10NO2 + 6H2O
3Na2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
5. Химические свойства кислых солей
1) Реагируют с металлами:
2KНSO4 + Ca → CaSO4 + K2SO4 + H2
2NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
2) Реагируют с оксидами и гидроксидами металлов:
2KHSO4 + MgO → MgSO4 + K2SO4 + H2O
2KHSO4 + 2NaOH → K2SO4 + Na2SO4 + 2H2O
2KHSO4 + Cu(OH)2 → K2SO4 + CuSO4 + 2H2O
3) Реагирую с солями, если выделяется газ или образуется осадок:
2KHSO4 + CaCO3 → K2SO4 + CaSO4 + CO2 + H2O
2KHSO4 + CaCl2 → CaSO4 + K2SO4 + 2HCl
KHS + Cu(NO3)2 → CuS + KNO3 + HNO3
AgH2PO4 + NH4Br → AgBr + NH4H2PO4
3NaHCO3 + AlCl3  → Al(OH)3 + 3NaCl + 3CO2
4) Реагируют с основаниями с образованием средних солей:
KНСO3 + KОН → K2СO3 + H2O
NaHCO3 + KOH → KNaCO3 + H2O
2KHCO3 + Ba(OH)2 → BaCO3 + K2CO3 + 2H2O
KHCO3 + Ba(OH)2(изб.)  → BaCO3 + KOH + H2O
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 + 4H2O
3Mg(H2PO4)2 + 12KOH → Mg3(PO4)2 + 4K3PO4 + 12H2O
2NH4H2PO4 + 3Ba(OH)2 → Ba3(PO4)2 + 2NH3 + 6H2O
5) Реагируют с кислотами с образованием средних солей, если выделяется газ или образуется осадок:
NaHCO3 + HCl → NaCl + H2O + CO2
2KHS + H2SO4 → K2SO4 + 2H2S
6) Разлагаются при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O (t)
Mg(HCO3)2 → MgCO3 + CO2 + H2O (t)
2NaHCO3 → Na2CO3 + CO2 + H2O (t)
NH4HCO3 → NH3 + CO2+ H2O (t)
6. Химические свойства комплексных солей
1) Реагируют с CO2 и SO2 с образованием амфотерных гидроксидов (могут образовываться как средние, так и ксилые соли):
Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3 или
2Na[Al(OH)4] + CO2 → Na2CO3 + 2Al(OH)3 + H2O
K3[Cr(OH)6]+ 3SO2 → 3KHSO3 + Cr(OH)3
2) Реагируют с кислотами (могут образовываться как средние, так и ксилые соли)
Na[Al(OH)4] + HCl → NaCl + Al(OH)3 + H2O
K3[Cr(OH)6] + 3HNO3 → 3KNO3 + Cr(OH)3 + 3H2O
K[Al(OH)4] + H2S(изб.) → KHS + Al(OH)3 + H2O
Но:
K2[Zn(OH)4] + 3H2S → 2KHS + ZnS + 4H2O
3) Разлагаются при нагревании:
Na[Al(OH)4] → NaAlO2 + 2H2O (t)
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
7. Разложение средних солей при нагревании
1) Нерастворимые карбонаты разлагаются при нагревании:
CaCO3 → CaO + CO2 (t)
FeCO3 → FeO + CO2 (t)
MgCO3 → MgO + CO2 (t)
2) Нитраты разлагаются при нагревании. Продукты зависят от положения металла в ряду активности металлов:
| MNO3 → MNO2 + O2 | M – металл, находящийся в ряду активности металлов левее Mg, исключая Li. |
| MNO3 → MO + NO2 + O2 | M – металл, находящийся в ряду активности металлов от Mg до Cu (Mg и Cu включительно), а также Li. |
| MNO3 → M + NO2 + O2 | M – металл, находящийся в ряду активности металлов правее Cu. |
3) Соли аммония разлагаются при нагревании:
NH4Cl → NH3 + HCl (t)
(NH4)3PO4 → 3NH3 + H3PO4(t)
(NH4)2CO3 → 2NH3 + CO2+ H2O (t)
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O (t)
NH4NO2 → N2 + H2O (t)
4) Термическое разложение кислородсодержащих солей хлора:
2KClO3 → 2KCl + 3O2 (t, kt = MnO2)
Почему в клинике все без соли? -Питание
Почему в клинике все без соли?
Мы с малых лет привыкаем солить еду во время ее приготовления, а иногда еще и в тарелке. А в сущности соль состоит из хлористого натрия, который сам по себе не приносит пользы организму. В составе соли нет органических веществ, она не содержит витаминов и, при этом, она входит в список трудноперевариваемых продуктов, поэтому это неорганическое вещество в виде пищевых добавок не только не оказывает питательного эффекта, но к тому же еще и может принести немалый вред. Поваренная соль наносит вред человеческому организму одновременно по двум системам пищеварительной и кровеносной.
Пищеварительная система страдает от разъедающих способностей соли. Легко сделать вывод, что первый удар выпадает на желудок, в который хлорид натрия направляется прямо из пищевода, а затем страдают и почки. Здоровый желудок с перевариванием соли обычно справляется достаточно хорошо, растворяя ее желудочным соком. А вот при различного рода заболеваниях этого внутреннего органа употребление данного продукта необходимо прекратить. Одним из примеров является гастрит. Эта болезнь вызывает острое воспаление слизистой оболочки желудка. У человека начинается отрыжка, рвота, сильная боль. И если к этому вдобавок происходит попадание в воспаленный орган большого количества поваренной соли, то рискнем предположить, что подобный процесс вряд ли окажет на организм целебное воздействие. Скорее, как раз произойдет наоборот – соль послужит катализатором для дальнейшего обострения.
Почкам поваренная соль причиняет вреда гораздо больше, так как это фильтр тела с очень нежной структурой и чутким восприятием, поэтому неорганический химический элемент – соль, почки переносят тяжело. Если человек употребляет пищевой соли больше, чем могут переработать почки, то «белая смерть» частично остается в организме, становясь причиной различных видов опухолей. Влияние поваренной соли на почки ведет к различным почечным заболеваниям, например нефриту (поражение почечных клубочков и как следствие воспалительный процесс), нефрозу ( повреждение почечных канальцев).
Проникая в организм человека через кровеносную систему, соль становится участником разрушительного процесса, где поражает систему кровоснабжения и наносит вред водно-солевому обмену организма. Между кровяной и тканевой жидкостями происходит регулярный обмен, тем самым происходит постоянный выход влаги из кровяных сосудов в ткани организма (процесс транссудации). В случаях, когда количество выделяемой жидкости кровеносными сосудами больше, обратно ими всасываемой, образуется скопление воды в тканях, и получается отек. Внешние признаки отека это набухание кожных покровов, наиболее ярко выражены, как правило на лице, руках и ногах. Очень часто отеки возникают в качестве спутников ряда болезней.
Скопление соли в кровеносных сосудах благоприятствует возникновению тромбов (сгустков крови, образующие наросты на стенках сосудов, состоящие из соединительной ткани, замедляющие кровообращение). Сейчас уже каждый может легко себе представить разрушительные возможности подобных образований. Следствием тромбов становятся многие заболевания, некоторые из которых могут иметь смертельный исход: тромбоз, тромбофлебит, коронарная недостаточность, ишемия миокарда, стенокардия, инфаркт миокарда, гангрена.
Повышенное содержание в крови хлорида натрия способствует развитию атеросклероза – еще одного вида заболеваний кровеносных сосудов. При его действии стенки сосудов набухают, становятся неровными. Внутри артерий разрастается соединительная ткань, появляются атеросклеротические бляшки. В итоге сосуды забиваются, сужается просвет, и происходит недостаточное питание сердца кровью. Употребление большого количества поваренной соли во время атеросклероза – путь, целенаправленно ведущий на уничтожение собственного здоровья. Этот продукт необходимо исключить из своего рациона. Следствием атеросклероза мозговых сосудов может явиться инсульт.
Конечно не следует приписывать мощную разрушительную силу только соли, иначе она бы была ядом и на нее наложили бы запрет использования еще в древности первые алхимики. Однако поваренная соль в совокупности с другими факторами способна нанести немалый вред здоровью. А к уже имеющимся болезням хлорид натрия может добавить серьезные осложнения. «Белая смерть» служит хорошим помощником алкоголизму, курению, наркомании, нервным перегрузкам в деле разрушения нормальной работы человеческого организма.
Вред, наносимый человеку поваренной солью, приводит к убеждению о необходимости удаления этого продукта из ежедневного рациона не только заболевшего человека, но и здоровому такая мера так же не будет вредна. А ведь есть целые народы которые не используют часто поваренную соль, например народы Севера: чукчи, скажем, едят морскую мороженую рыбу, не добавляя туда ни грамма соли и на вкус такое блюдо, между прочим, очень даже неплохое.
Следует учитывать и то, что природа мудра, и во всех «живых» продуктах она распределила те пропорции компонентов, которые были им необходимы. То же касается и соли. Она содержится и в моркови, и в капусте, и в мясе. Причем объемы этого элемента отвечают тем требованиям, которые диктует нам наше здоровье. Следовательно, добавлять соль нет никакой надобности – она и так есть везде.
Таким образом, практически всем пациентам нашей клиники необходима бессолевая диета и гипертоникам (людям, страдающим нарушением кровообращения), и беременным (у которых из-за отеков увеличивается и без того немалая нагрузка на ноги), и с проблемами почек, и курящим (этот процесс заставляет вены сужаться, заметно повышая давление), и даже если Вы молоды и восстанавливаетесь после операции на аппендицит.
Если необходимость бессолевой диеты сомнения у вас не вызывает, то это не значит, что следует забыть о блюдах, ставших давно привычными.
Есть множество возможностей подсолить, например, бессолевой борщ, НО ЕСЛИ В ВАШЕМ КОНКРЕТНОМ СЛУЧАЕ ЭТО НЕ ЗАПРЕЩЕНО ВРАЧОМ.
Придать супу соленый вкус можно, если добавить лимонный сок или петрушку. Солоновато-горький вкус любистка так же поможет выйти из положения. Имеют слегка горьковатый вкус и, тем самым, прекрасно заменяют соль: тмин, кумин, розмарин, семена сельдерея. Одновременно с этим, в травах содержится множество нужных нам витаминов и минералов. Тем самым, замена соли травами или соком лимона позволяет не только снизить риск ряда болезней, например, сердечно-сосудистых заболеваний или болезней почек, но и улучшить свой иммунитет, повысить жизненный тонус.
Химики объяснили появление «невозможных» солей
Кристаллическая структура NaCl3
Иллюстрация: Artem Oganov
Химики Габриеле Салех и Артем Оганов из Московского физико-технического института объяснили, как образуются химические соединения натрия и хлора, невозможные с точки зрения «школьной» химии. Речь идет о необычных солях, вроде Na3Cl, NaCl3 или NaCl7, которые в 2013 году были получены в условиях высокого давления в сотни тысяч атмосфер. Результаты исследования были опубликованы в журнале Physical Chemistry Chemical Physics.
Чтобы выяснить, каким образом происходило формирование «невозможных» солей, ученые воспользовались алгоритмом прогнозирования кристаллической структуры USPEX в сочетании с квантово-механическими вычислениями. Они смогли сформулировать основные принципы сохранения стабильности необычных соединений, а также построить диаграмму различных форм солей, переходящих друг в друга при изменении давления.
Ученые смоделировали структуру нескольких «невозможных» солей, образующихся при высоком давлении, в том числе Na3Cl и Na4Cl3. Например, Na3Cl был образован чередующимися слоями NaCl и Na. В нем натриевый слой образован ионами, которые соединены друг с другом в единую сеть и одновременно электростатически взаимодействуют с ионами Cl. Дальнейшее увеличение давления приводило к перестройке и формированию дополнительных связей между слоями Na и NaCl. Это, в свою очередь, вело к появлению новых структур. Кристалл соли по мере роста давления проходил через ряд фаз, в процессе чего происходило разрушение связей между атомами Na и появление дополнительных связей между Na и Cl.
Выделив важные факторы, обусловливающие стабильность «невозможных» солей, ученые разработали модель, которая способна спрогнозировать кристаллические свойства других соединений, образованных атомами лития, натрия и калия, а также фтором, хлором и бором при давлении в диапазоне до 350 гигапаскаль. Исследователи проверили, какие формы солей могли образоваться, а также какова их структурная эволюция при увеличении давления.
Лишь соли калия показали несоответствие модели, что объясняется тем, что у атома калия d-орбитали, слабо заполненные у лития и натрия, вносят большой вклад в формирование валентных связей.
Факторы стабильности, уверены ученые, не являются специфичными для исследованных соединений, а должны оказывать влияние на широкий диапазон других веществ. Однако, как было показано на примере с калием, для некоторых соединений могут играть роль другие факторы.
В 2013 году исследовательская группа под руководством Артема Оганова экспериментально доказала возможность существования при высоком давлении солей NaCl3 и Na3Cl, которые разрушаются при обычных условиях. Ученые разработали алгоритм USPEX, с помощью которого можно было предсказать структуры подобных соединений. В 2015 году исследователи смогли предсказать существование фаграфена — нового двумерного углеродного материала, — а также устойчивой структуры борофена, аналога графена, где атомы углерода заменены атомами бора.
Александр Еникеев
Удаление потемнения серебра
Серебро темнеет на воздухе и образуют черный налет сульфида серебра, который имеет формулу Ag2S. Серебро тускнеет после реакции с сероводородом (h3S) химическое уравнение которой выглядит следующим образом:
2 Ag(т) + H2S(г) → Ag2S(т) + H2(г)
Есть предположение, что, на сегодняшний день, потускнения серебра происходит быстрее из-за возросшего количества сероводорода который выделяется в атмосферу при сгорании ископаемого топлива и тому подобное. Сульфид серебра который и дает потускнение может быть довольно легко удален с помощью полиролей, содержащих абразивные вещества, чтобы стереть с серебра его сульфид, но недостатком этого процесса является то что удаляется и небольшое количеств серебра. Однако, химия предоставляет метод, который обходит эту проблему.
Как удалить потемнения серебра
В этом простом методе используется алюминиевая фольга, кипяток, питьевая сода (натрия гидрокарбонат) и поваренная соль (натрия хлорид). В миску с фольгой, добавить чайную ложку соды и немного соли, затем просто добавьте кипяток. Потускневшую серебряную вещь помещают в воду, убедившись, что нет контакта между ней и алюминиевой фольгой. Потемнения серебра тускнеют и быстро исчезают.
Химия реакции при удалении потемнения серебра
Алюминий имеет более сильное сродство к сере, чем серебро, поэтому в этой реакции алюминий просто вытесняет серебро из его сульфидного соединения, высвобождая чистое металлическое серебро и образуя сульфидное соединение алюминия:
3 Ag2S(т) + 2 Al(т) → 6 Ag(т) + Al2S3(т)
Реакция сама по себе является собственно электрохимической реакцией – по сути, крошечный электрический ток протекает между серебряной вещью и алюминиевой фольгой когда они находятся в контакте, и количество серебра в сульфиде серебра снижается (прирост электронов) в виде металлического серебра, а алюминий окисляется (теряет электроны) замещая Аl3+ на ионы:
3 Ag+ + 3 e– → 3 Ag
Al → Al3+ + 3e
Объединив эти две половины уравнений получаем полное уравнение окислительно-восстановительной реакции:
Al + 3 Ag+ → Al3+ + 3 Ag
Необходимость соды и соли при удалении потемнения серебра
Это реакция замечательная, но не объясняет необходимость соды или соли во время реакции, а ведь оба вещества являются важными компонентами в этой реакции. Натрия бикарбонат необходим, чтобы удалить тонкий слой гидроксида алюминия, который образуется на алюминиевой фольге; без этого, реакция будет не в состоянии начать образование ионов алюминия, и как таковая не начнется. Реакция между содой и алюминивой фольгой также производит водород, который не играет никакой роли в удалении потускнения серебра и просто улетучивается в виде газа. Соль, между тем, выступает в качестве “солевого моста” – это помогает в передаче электронов по мере протекания реакции, предотвращая дисбаланс и позволяет окислительно-восстановительной реакции продолжаться до конца.
Можно также заметить слабый запах яиц при проведении этой процедуры – это связано с дальнейшей реакции, которая может возникнуть. Сульфид алюминия дальше вступает в реакцию с водой следующим образом:
Al2S3(s) + 6 H2O(l) → 2 Al(OH)3(aq) + 3 H2S(g)
Сероводород, Н2S – тот же газ, что образуется при гниении яиц – отсюда и узнаваемый неприятный запах.
Статья написана по материалам сайта Compound Interest.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Salt Formation — обзор
Другой, наиболее распространенный подход, исследуемый для повышения растворимости лекарства в воде, — это солеобразование (солеобразование). ИЮПАК определяет соль как «химическое соединение, состоящее из совокупности катионов и анионов». В основном для баланса заряда фармацевтические соли часто имеют определенную стехиометрию ионизируемых лекарств (анионных, катионных и цвиттерионных), которые через стабильные ионные связи с протонами переходят от кислоты к основанию с образованием солей (Serajuddin, 2007; Bond, 2011; Vioglio и другие., 2017). Предполагается, что для стабильной ионной связи желательна разница> 3 между pKa кислоты и основания (Childs et al., 2007). Это лучше всего объясняется молярной свободной энергией раствора Δ G soln (уравнение 15.9), встречающейся при растворении соли в воде;
(15.9) ΔGsoln = ΔGanions + ΔGcations − ΔGcrystallattice
где Δ G soln , Δ G анионы , и Δ G мольные энергии свободных катионов гидратация соли, ее положительно заряженной и отрицательно заряженной частей соответственно, и Δ G кристаллическая решетка — энергия кристаллической решетки.Теоретически из-за внутримолекулярных ионных взаимодействий образование солей связано с более высокой энергией решетки, которая обычно может препятствовать общему процессу солюбилизации (David et al., 2012; Jain et al., 2015).
Помимо этого, на растворимость влияют противоионы в соли, которые присутствуют либо на молекулярном уровне (например, мезилат, ацетат и т. Д.), Либо в атомарном отношении (например, бромид, натрий и т. Д.) (Vioglio et al., 2017). Было показано, что присутствие противоионов изменяет pH микросреды, тем самым повышая скорость растворения солей по сравнению с соответствующими свободными формами (Kawabata et al., 2011). Guerrieri et al. (2010) заявили, что в зависимости от противоиона молярная растворимость в воде различных солей может отличаться более чем на два порядка. Banerjee et al. (2005) продемонстрировали повышение растворимости сахаринатов в воде различных лекарств, а именно хинина, миртазапина, галоперидола, псевдоэфедрина, рисперидона, ламивудина, венлафаксина, сертралина, золпидема и амлодипина, по сравнению со свободным основанием. Точно так же гиппурат ципрофлоксацина продемонстрировал 22-кратное увеличение растворимости в воде и более высокую скорость растворения по сравнению с исходной формой лекарственного средства (Chadha et al., 2016). Хотя противоионы полезны для повышения растворимости, они страдают недостатком, а именно эффектом обычных ионов. В большинстве случаев эффект обычных ионов ответственен за снижение растворимости лекарства (уравнение 15.10) (Elder et al., 2013):
(15.10) (BH + X-) s↔ [BH +] D (aq) + [X−]
, где (BH + X — ) s обозначает нерастворенную соль, которая находится в равновесии с растворенной солью, [BH + ] D (водн.) — растворимость соли , а [ X — ] — концентрация противоиона. Эти эффекты более выражены для солей, которые имеют меньшую растворимость в воде.
Именование солей — Получение солей — GCSE Chemistry (Single Science) Revision — Other
Соль — это любое соединение, образованное нейтрализацией кислоты основанием.
Название соли состоит из двух частей. Первая часть происходит из металла, оксида металла или карбоната металла. Вторая часть поступает из кислоты.
Вы всегда можете определить название соли, посмотрев на реагенты:
- азотная кислота всегда образует соли, оканчивающиеся на нитрат и содержащие нитрат ион , NO 3-
- соляная кислота всегда дает соли которые заканчиваются хлоридом и содержат ион хлорида , , Cl —
- , серная кислота всегда дает соли, оканчивающиеся на сульфат и содержащие сульфат-ион, SO 4 2-
Например, если Оксид калия вступает в реакцию с серной кислотой, продуктами будут сульфат калия и вода.
В таблице приведены еще несколько примеров:
| Металл | Кислота | Соль | ||
|---|---|---|---|---|
| Натрий гидроксид | вступает в реакцию с | с хлорноватистой кислотой | Хлорид натрия | |
| Оксид меди | вступает в реакцию с | Hydro хлорноватой кислотой | с образованием | Хлорид меди |
| 901 9018 Гидроокись натрия | с образованием | Сульфат натрия | ||
| Оксид цинка | вступает в реакцию с | Сульфом мочевой кислотой | с образованием | 902 902 9014 сульфат цинка соли аммония при его реакции с кислотами.Например, аммиак реагирует с соляной кислотой с образованием хлорида аммония .Ученые говорят: соль | Новости науки для студентоватом Основная единица химического элемента. Атомы состоят из плотного ядра, которое содержит положительно заряженные протоны и незаряженные нейтроны. Ядро вращается вокруг облака отрицательно заряженных электронов. основание (в химии) Химическое вещество, которое производит ионы гидроксида (ОН-) в растворе.Основные растворы также называют щелочными. (в генетике) Укороченная версия термина азотистое основание. Эти основания являются строительными блоками молекул ДНК и РНК. химия Область науки, изучающая состав, структуру и свойства веществ и способы их взаимодействия. Ученые используют эти знания для изучения незнакомых веществ, для воспроизведения больших количеств полезных веществ или для конструирования и создания новых и полезных веществ. (о соединениях) Химия также используется как термин для обозначения рецепта соединения, способа его получения или некоторых его свойств.Люди, работающие в этой области, известны как химики. соединение (часто используется как синоним химического) Соединение — это вещество, образующееся, когда два или более химических элемента объединяются (связываются) в фиксированных пропорциях. Например, вода — это соединение, состоящее из двух атомов водорода, связанных с одним атомом кислорода. Его химический символ — H 2 O. медь Металлический химический элемент из того же семейства, что и серебро и золото. Поскольку это хороший проводник электричества, он широко используется в электронных устройствах. кристалл (прил. Кристаллический) Твердое тело, состоящее из симметричного, упорядоченного, трехмерного расположения атомов или молекул. Это организованная структура, присущая большинству минералов. Например, апатит образует шестигранные кристаллы. Минеральные кристаллы, из которых состоят горные породы, обычно слишком малы, чтобы их можно было увидеть невооруженным глазом. алмаз Одно из самых твердых веществ и самых редких драгоценных камней на Земле. Алмазы образуются глубоко внутри планеты, когда углерод сжимается под невероятно сильным давлением. лазер Устройство, генерирующее интенсивный пучок когерентного света одного цвета. Лазеры используются при сверлении и резке, юстировке и наведении, хранении данных и хирургии. свинец Ядовитый тяжелый металл (сокращенно Pb), который в организме перемещается туда, где требуется кальций (например, в кости и зубы). Металл особенно токсичен для мозга. В развивающемся мозгу ребенка это может необратимо ухудшить IQ даже на относительно низком уровне. нитрат Ион, образованный комбинацией атома азота, связанного с тремя атомами кислорода. Этот термин также используется как общее название для любого из различных родственных соединений, образованных комбинацией таких атомов. азот Неактивный газообразный элемент без цвета, запаха и запаха, который составляет около 78 процентов атмосферы Земли. Его научный символ — N. Азот выделяется в виде оксидов азота при горении ископаемого топлива. кислород Газ, составляющий около 21 процента атмосферы Земли.Все животные и многие микроорганизмы нуждаются в кислороде для своего роста (и обмена веществ). соль Соединение, полученное путем объединения кислоты с основанием (в реакции, которая также создает воду). Океан содержит много разных солей, которые вместе называются «морской солью». Поваренная поваренная соль состоит из натрия и хлора. натрий Мягкий серебристый металлический элемент, который при добавлении в воду взрывоопасен. Это также основной строительный блок поваренной соли (молекула которой состоит из одного атома натрия и одного атома хлора: NaCl).Он также содержится в морской соли. сульфат Семейство химических соединений, связанных с серной кислотой (H 2 SO 4). Сульфаты естественным образом содержатся в питьевой воде. сера Химический элемент с атомным номером шестнадцать. Сера, один из самых распространенных элементов во Вселенной, является важным элементом для жизни. Поскольку сера и ее соединения могут накапливать много энергии, она присутствует в удобрениях и многих промышленных химикатах. сорняк (в ботанике) Растение, растущее в диком виде, вокруг — а иногда и подавляющее чрезмерно ценные растения, такие как сельскохозяйственные культуры или ландшафтные виды (включая газонные травы, цветы и кустарники).Часто растение становится таким ботаническим хулиганом, когда попадает в новую среду, где нет естественных хищников или контролирующих условий, таких как сильные морозы. (в биологии, в общем) Любой организм можно назвать «сорняком», если он попадает в окружающую среду и начинает подавлять местную экосистему. Соли — Концепция — Химия Видео от BrightstormИтак, в этом сегменте давайте поговорим о солях. В общем, это может возникнуть, когда вы думаете о кислотно-основных реакциях.Так что помните, что основная мысль о кислотно-основной реакции заключается в том, что движущей силой вперед является производство воды. Итак, здесь я очень просто написал, что когда у вас есть кислота и основание, вы получаете соль и воду. Итак, соль означает ионный вид, что-то похожее на поваренную соль, с которой вы очень хорошо знакомы, это хлорид натрия, который, когда вы помещаете в раствор, в водный раствор, вы получаете ионы натрия и ионы хлора. Итак, когда кислота и основание образуют соль и воду, это то, что называется реакцией нейтрализации. Таким образом, в зависимости от растворимости соли она может оставаться в ионной форме. так что плюс или катионы, или минус, или анионы, или осадок выходят из раствора. Таким образом, у вас также может быть обратная реакция, когда соль и вода уходят в обратном направлении, чтобы снова образовать кислоту и основание. Мы называем это реакцией гидролиза. Hydro означает воду. Итак, давайте рассмотрим четыре различных сценария тех реакций, с которыми вы обычно сталкиваетесь. Итак, первый, отчасти самый простой, — это реакция сильной кислоты и сильного основания.Так что помните, что сильные кислоты и сильные основания являются сильными электролитами, и когда что-то является электролитом, это означает, что когда вы помещаете его в водный раствор, он полностью ионизируется с образованием своих катионных и анионных состояний. Итак, у вас не осталось ни кислоты, ни основания. Они оба полностью разобщены. Таким образом, здесь сильнокислый водный раствор HCl, гидроксид натрия, наш сильный щелочной водный раствор, будет образовывать соль хлорида натрия и воды. Итак, по сути, два, о чем нужно думать, как о том, чтобы вспомнить, когда вы узнали что-то о других химических реакциях.Это своего рода реакция замещения кислотного основания. Итак, поскольку у вас сильная кислота и сильное основание, оно будет полностью нейтральным. так что у него будет ph семь. И снова ваши продукты будут солью и водой. Итак, давайте рассмотрим другой сценарий, в котором у вас может быть сильная кислота и слабое основание. Итак, здесь сильная кислота, я снова буду использовать одну из самых распространенных, соляную кислоту, HCl и обычный слабый щелочной аммиак. Итак, я поместил неспаренные электроны здесь поверх аммиака, потому что это просто напоминает вам, что он действует как слабое основание, что означает, что он может удалять протоны из HCl, чтобы получить аммоний, в основном, хлорид аммония.Итак, Nh5Cl. Здесь я написал его в ионной форме, чтобы пробудить наши воспоминания. Кh5 — плюс, а Cl — минус. Хорошо? Таким образом, вы также можете пойти дальше, потому что помните, что сильная кислота будет полностью диссоциировать, но слабое основание означает, что у нас будет часть этого аммиака, лежащая вокруг Nh4, и часть этого Nh5Cl, лежащая вокруг. Итак, этот ион аммония может реагировать с водой, чтобы затем воссоздать слабый щелочной аммиак. Итак, поскольку здесь сильная кислота, она будет преобладать. Значит, ваш ph будет меньше семи.Так что, поскольку у вас сильная кислота, ваш раствор все равно будет довольно кислым, хорошо? Итак, давайте рассмотрим слабую кислоту и сильное основание. Так что в основном противоположный предыдущему сценарию. Итак, здесь у нас есть соляная кислота в качестве слабой кислоты и гидроксид натрия в качестве сильного основания для образования гипохлорита натрия и воды. Так что вспомните, что снова образуется вода, потому что это кислотно-основная реакция. Хорошо. Итак, поскольку у нас здесь сильная база, это означает, что наш ph будет больше семи.Больше семи. Значит, старше 14, не так ли? Поскольку это базовый уровень, и поскольку у нас есть сильная база, это означает, что наш ph будет оставаться выше. И здесь, как и в предыдущей ситуации, когда у вас есть сильное основание, это означает, что сильное основание будет полностью диссоциировать на свои ионные частицы. Но со слабой кислотой некоторые из кислых веществ все равно будут валяться. Это означает, что здесь ваш гипохлорид натрия может реагировать с водой, чтобы преобразовать вашу слабую кислоту, вашу соляную кислоту. Хорошо. И последний сценарий — когда у вас слабая кислота и слабое основание. Итак, в этом случае у меня снова хлорноватистая кислота плюс аммиак, я засунул сюда одиночные неспаренные электроны, чтобы напомнить нам, что они действуют как слабое основание и, таким образом, оно может удалить протон из соляной кислоты с образованием продукта хлорида аммония, и я не Не пишите его в его ионных формах, но это будет Nh5 плюс 1 и ClO минус 1. Итак, здесь ситуация с ph будет немного другой. Итак, поскольку у вас есть и слабая кислота, и слабое основание, pH вашего общего раствора будет зависеть от относительной силы ваших реагентов, хорошо. Итак, это вводит в понятие нечто, называемое ka, которое является константой диссоциации кислоты. Таким образом, чем выше ka, тем больше вероятность, что один из этих парней отдаст свой протон. Таким образом, для этого конкретного сценария он окажется основным, потому что ka аммиака выше, чем ka соляной α-хлорноватистой кислоты. Хорошо, поэтому вам нужно иметь представление о том, каковы были ka для каждого из ваших реагентов, чтобы знать, каким будет общий pH этой ситуации.И это в двух словах о соли. Химия соли на кухнеСоль кажется достаточно распространенной, но у нее есть поразительные свойства. Предоставлено: Shutterstock. Когда мы говорим «соль», мы обычно имеем в виду то, что мы посыпаем чипсами, а именно хлорид натрия (NaCl). Но, технически говоря, это всего лишь один из примеров соли. В химии соль — это ионное соединение, которое образуется в результате реакции нейтрализации кислоты и основания.Позвольте мне объяснить это вам. Молекулы, обладающие электрическим зарядом, называются ионами. Те, у кого положительный заряд — это катионы, а те, у кого отрицательный заряд — анионы. Они похожи на противоположные концы магнита, поэтому анионы притягивают катионы. Кислоты — это вещества, которые выделяют положительно заряженные ионы водорода (H +) в воде, а основания выделяют отрицательно заряженные ионы гидроксида (OH-) в воде. При смешивании они нейтрализуют друг друга и образуют соль. Итак, соли состоят только из положительно заряженных катионов, связанных с отрицательно заряженными анионами.Хлорид натрия — это положительный ион натрия (Na +), связанный с отрицательным ионом хлорида (Cl-). Свойства солей различаются в зависимости от того, какие ионы сочетаются. Соленый Не все соли безопасны для употребления, и не все они соленые на вкус. Катион определяет, имеет ли соль соленый вкус, а анион определяет интенсивность этого аромата. Чтобы взаимодействовать с нашими вкусовыми рецепторами, соли сначала должны расщепиться — или диссоциировать — на свои ионы. Для этого нужен раствор, например, слюна или вода.Так что, если вы высунете язык, пока он не высохнет, и посолите его, вы не почувствуете солености.
Хотя добавление солей в воду — довольно безопасная химическая реакция, в элементарном состоянии каждый компонент может быть очень реактивным. И натрий, и хлор бурно реагируют с водой, но стабильны, когда их ионы находятся вместе в соли. Люди добавляли соль в пищу на протяжении тысячелетий по двум простым причинам: это дешевый и естественный консервант; и это улучшает вкус еды. Добавление соли продлевает срок хранения пищи за счет снижения «водной активности» продуктов. Соль по существу впитывает воду, создавая «сухую» среду, в которой затрудняется рост бактерий, портящих пищу. Соль также вытягивает воду из влажных внутренностей бактерий в более сухую среду, убивая их. При правильном уровне соль приятна на вкус. Вполне вероятно, что соленый превратился в приятный вкус, побуждающий нас потреблять необходимое количество.Соли важны во многих биологических процессах, таких как передача нервных сигналов, поэтому нам нужно немного соли в нашем рационе. Соль также усиливает вкус. Добавьте немного соли, и почти все станет вкуснее. Например, добавление соли в куриный суп не только делает его более соленым, но и делает его вкус более густым, сбалансированным и более «куриным». Соль делает это разными способами.
Соль подавляет неприятный привкус пищи, позволяя преобладать более приятным.Когда исследователи смешали горький и сладкий растворы во вкусовом тесте, добавление соли сделало вкус смеси более сладким. Но в сладком растворе добавление соли не так сильно улучшило вкус. Многие витамины и антиоксиданты горькие на вкус. Добавление соли в продукты, которые содержат или обогащены этими горькими соединениями, улучшает их вкус. Вот почему мы часто добавляем соль в наши зеленые овощи. Соль также снижает количество несвязанной воды, известное как «активность воды».Это приводит к относительному увеличению концентрации других ароматических компонентов, улучшая аромат, вкус и «густоту» пищевых продуктов. Это может улучшить вкус продуктов с низким содержанием жира или сахара. Так что проверьте свои пищевые панели; вы можете обменивать лишние килоджоули на избыток соли, которая не обязательно полезнее для здоровья. Когда образуется, соль образует кристаллы. Предоставлено: Тим Симпсон / Flickr, CC BY. Защитное питание Привычное употребление слишком большого количества соли связано с такими заболеваниями, как сердечно-сосудистые и почечные заболевания.Избыток соли в разовой дозе тоже не годится. При отсутствии достаточного количества воды избыток соли нарушает процессы, зависящие от конкретной концентрации соли. Избыток соли также стимулирует рецепторы горького и кислого вкуса, как часть «защитного приема пищи». Вот почему добавление соли в пищу улучшает вкус, а слишком много соли портит ее. Уровень соли, приятный или неприятный на вкус, варьируется у разных людей. Отчасти это связано с нашими генами, но акклиматизация также происходит в зависимости от наших обычных диетических привычек. Люди, которые обычно питаются с высоким содержанием соли, предпочитают больше соли. Те, кто придерживается низкосолевой диеты в молодом возрасте, едят меньше соли и имеют более низкое кровяное давление в более позднем возрасте. Однако мы можем использовать эту акклиматизацию в обратном порядке как стратегию для уменьшения потребления соли. Это может быть постепенное добавление меньшего количества в вашу собственную пищу, а также то, что производители продуктов питания постепенно снижают уровни в своих продуктах, позволяя потребителям адаптироваться. Хлорид калия — еще одна соль, которую иногда используют для замены хлорида натрия.Однако, поскольку он также имеет горький вкус, он может действовать только в качестве частичной замены. Используя еще более сложные смеси солей, мы можем улучшить солевой вкус и, следовательно, использовать меньше. Другой подход — заставить соль растворяться более эффективно, чтобы вкус ощущался быстрее. Если вы добавляете соль на поверхность продуктов, а не смешиваете ее, соль быстрее впадает в слюну. Уменьшение размера частиц соли, что увеличивает площадь поверхности, также позволяет соли быстрее растворяться в слюне, увеличивая «соленость». Другое интересное решение было недавно предложено группой японских исследователей: вилка, которая слегка поражает ваш язык электрическим током во время еды. Электрический импульс имитирует соленый вкус и снижает потребность в добавлении соли в пищу. Большая часть соли, которую мы едим, скрыта в пище, которую многие люди даже не назовут «соленой». А австралийцы едят больше, чем рекомендовано. Итак, теперь, когда вы знакомы с наукой, вы можете использовать ее, чтобы делать осознанный выбор соленой пищи. Жир и соль вместе — токсичная смесь для нашего здоровья и талии. Эта история любезно опубликована The Conversation (по лицензии Creative Commons-Attribution / Без производных). Ссылка : Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие Нейтрализация и гидролиз в солевых образованияхКогда кислоты и основания реагируют друг с другом, они могут образовывать соль и (обычно) воду.Это называется реакцией нейтрализации и принимает следующую форму: HA + BOH → BA + H 2 O В зависимости от растворимости соли она может оставаться в растворе в ионизированной форме или может выпадать в осадок из раствора. Реакции нейтрализации обычно проходят до завершения. Обратная реакция нейтрализации называется гидролизом. В реакции гидролиза соль реагирует с водой с образованием кислоты или основания: BA + H 2 O → HA + BOH Сильные и слабые кислоты и основанияВ частности, существует четыре комбинации сильных и слабых кислот и оснований: сильная кислота + сильное основание, e.г., HCl + NaOH → NaCl + H 2 O Когда вступают в реакцию сильные кислоты и сильные основания, образуются соль и вода. Кислота и основание нейтрализуют друг друга, поэтому раствор будет нейтральным (pH = 7), а образующиеся ионы не будут реагировать с водой. сильная кислота + слабое основание, например, HCl + NH 3 → NH 4 Cl Реакция между сильной кислотой и слабым основанием также дает соль, но вода обычно не образуется, потому что слабые основания, как правило, не являются гидроксидами.В этом случае водный растворитель будет реагировать с катионом соли с преобразованием слабого основания. Например: HCl (водн.) + NH 3 (водн.) ↔ NH 4 + (вод.) + Cl — , а слабая кислота + сильное основание, например, HClO + NaOH → NaClO + H 2 O Когда слабая кислота вступает в реакцию с сильным основанием, полученный раствор будет основным.Соль будет гидролизоваться с образованием кислоты вместе с образованием гидроксид-иона из молекул гидролизованной воды. слабая кислота + слабое основание, например, HClO + NH 3 ↔ NH 4 ClO PH раствора, образованного реакцией слабой кислоты со слабым основанием, зависит от относительной силы реагентов. Например, если кислотный HClO имеет K a 3,4 x 10 -8 , а у основания NH 3 K b = 1.6 x 10 -5 , то водный раствор HClO и NH 3 будет основным, потому что K a HClO меньше, чем K a NH 3 . . |

 основные соли в составе катионов содержат гидроксогруппы. Основные соли возможны для многокислотных оснований, а для однокислотных нет. Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. Название основных солей строится следующим образом: к аниону добавляется приставка гидроксо-.
основные соли в составе катионов содержат гидроксогруппы. Основные соли возможны для многокислотных оснований, а для однокислотных нет. Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. Название основных солей строится следующим образом: к аниону добавляется приставка гидроксо-.
 С кислотами реагируют, если в составе основной соли и кислоты имеется один и тот же кислотный остаток, то в результате образуется нормальная соль.
С кислотами реагируют, если в составе основной соли и кислоты имеется один и тот же кислотный остаток, то в результате образуется нормальная соль. Различают соли средние, кислые, основные, двойные, смешанные и комплексные.
Различают соли средние, кислые, основные, двойные, смешанные и комплексные.
 Это доказывается, например, тем, что в водном растворе алюмокалиевых квасцов можно обнаружить ионы К+, Аl3+
Это доказывается, например, тем, что в водном растворе алюмокалиевых квасцов можно обнаружить ионы К+, Аl3+ С учетом химических свойств, местонахождения солеобразующих элементов в периодической системе элементов Д. И. Менделеева и по некоторым другим признакам неорганические соли подразделяют на девять подгрупп.
С учетом химических свойств, местонахождения солеобразующих элементов в периодической системе элементов Д. И. Менделеева и по некоторым другим признакам неорганические соли подразделяют на девять подгрупп. Некоторые соли калия и натрия используют в качестве окислителей, плавней, комплексообразователей и т. п.; соли аммония — для колориметрических определений и как без-зольные реактивы в гравиметрическом анализе; калий кислый сурьмянокислый — для открытия и определения натрия.
Некоторые соли калия и натрия используют в качестве окислителей, плавней, комплексообразователей и т. п.; соли аммония — для колориметрических определений и как без-зольные реактивы в гравиметрическом анализе; калий кислый сурьмянокислый — для открытия и определения натрия.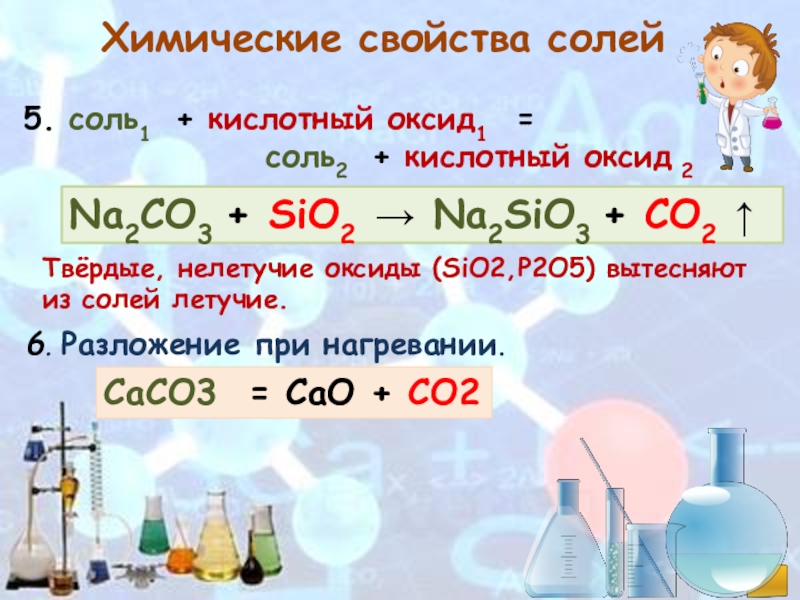 В отличие от солей щелочных металлов многие соли этой подгруппы очень мало или практически нерастворимы в воде, например, все углекислые и фосфорнокислые соли (кроме бериллия), сернокислые и фтористые соли кальция, стронция и магния. Соли магния имеют горький вкус, а соли бериллия—сладкий. Галогениды кальция и магния гигроскопичны и расплываются на воздухе.
В отличие от солей щелочных металлов многие соли этой подгруппы очень мало или практически нерастворимы в воде, например, все углекислые и фосфорнокислые соли (кроме бериллия), сернокислые и фтористые соли кальция, стронция и магния. Соли магния имеют горький вкус, а соли бериллия—сладкий. Галогениды кальция и магния гигроскопичны и расплываются на воздухе.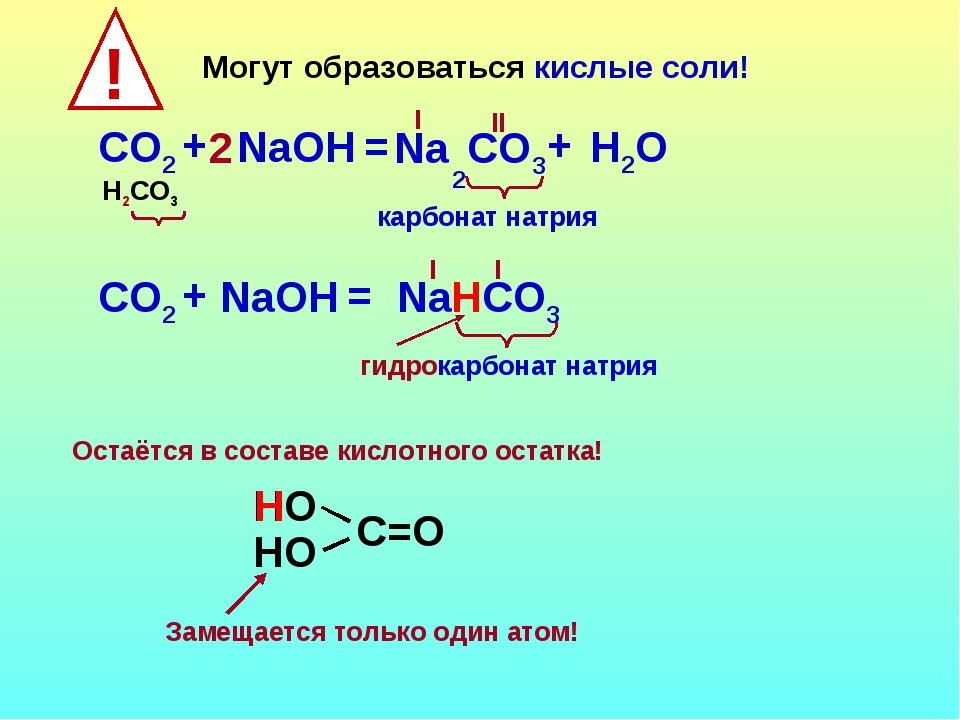 д.
д.


 Йодистые и большинство хлористых и бромистых солей очень гигроскопичны и расплываются на воздухе.
Йодистые и большинство хлористых и бромистых солей очень гигроскопичны и расплываются на воздухе.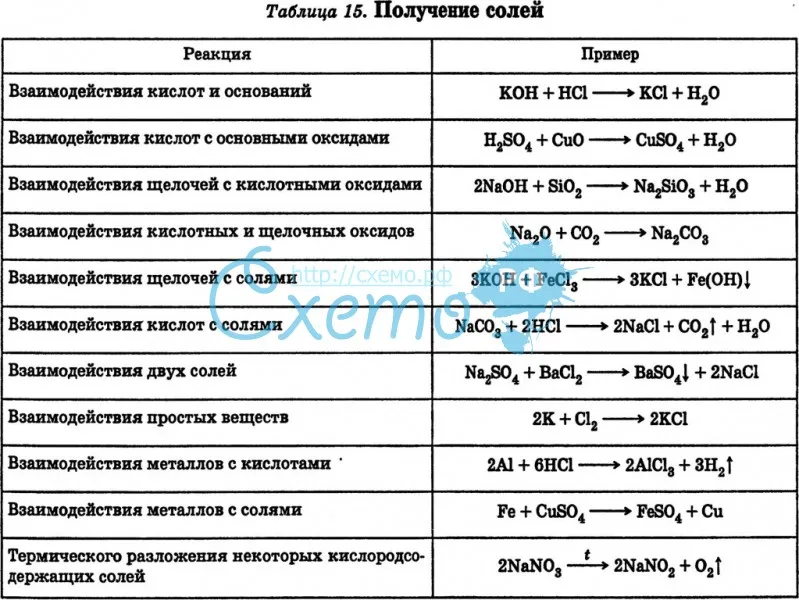
 Окислы высших валентностей этих элементов образуют кислоты: мышьяковистую, мышьяковую, орто-, мета- и пиросурьмяные, оловянную и др. Некоторые из этих кислот в свободном состоянии не получены, но соли их хорошо известны.
Окислы высших валентностей этих элементов образуют кислоты: мышьяковистую, мышьяковую, орто-, мета- и пиросурьмяные, оловянную и др. Некоторые из этих кислот в свободном состоянии не получены, но соли их хорошо известны. Многие соли этой подгруппы находят применение в технике и научных исследованиях. Соли мышьяковистой кислоты используют как энергичные восстановители, а калий мышьяковистокислый — в медицине; соли висмута — в медицине и как катализаторы в органическом синтезе; соли германия — при изготовлении светящихся экранов и в специальной оптике; четыреххлористый кремний — для синтеза кремнийорганических соединений и др.
Многие соли этой подгруппы находят применение в технике и научных исследованиях. Соли мышьяковистой кислоты используют как энергичные восстановители, а калий мышьяковистокислый — в медицине; соли висмута — в медицине и как катализаторы в органическом синтезе; соли германия — при изготовлении светящихся экранов и в специальной оптике; четыреххлористый кремний — для синтеза кремнийорганических соединений и др.