Содержание
Химические свойства оксидов — урок. Химия, 8–9 класс.
1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи.
Основный оксид + вода → основание.
Например, при взаимодействии оксида кальция с водой образуется гидроксид кальция:
CaO+h3O→Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
Основный оксид + кислота → соль + вода.
Например, при взаимодействии оксида меди с серной кислотой образуются сульфат меди и вода:
CuO+h3SO4→CuSO4+h3O.
3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли.
Основный оксид + кислотный оксид → соль.
Например, при взаимодействии оксида магния с углекислым газом образуется карбонат магния:
MgO+CO2→MgCO3.
Химические свойства кислотных оксидов
1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты.
Кислотный оксид + вода → кислота.
Например, при взаимодействии оксида серы(\(VI\)) с водой образуется серная кислота:
SO3+h3O→h3SO4.
Обрати внимание!
Оксид кремния SiO2 с водой не реагирует.
2. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду.
Кислотный оксид + основание → соль + вода.
Например, при взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуются сульфит натрия и вода:
SO2+2NaOH→Na2SO3+h3O.
3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли.
Кислотный оксид + основный оксид → соль.
Например, при взаимодействии оксида углерода(\(IV\)) с оксидом кальция образуется карбонат кальция:
CO2+CaO→CaCO3.
Химические свойства амфотерных оксидов
1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Например, при взаимодействии оксида цинка с соляной кислотой образуется хлорид цинка и вода:
ZnO+2HCl→ZnCl2+h3O.
2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла проявляют кислотные свойства. При сплавлении их со щелочами протекает химическая реакция, в результате которой образуются соль и вода.
Например, при сплавлении оксида цинка с гидроксидом калия образуется цинкат калия и вода:
ZnO+2KOH→K2ZnO2+h3O.
Если же с гидроксидом калия сплавить оксид алюминия, кроме воды образуется алюминат калия: Al2O3+2KOH→2KAlO2+h3O.
Химические свойства основных оксидов | CHEMEGE.RU
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CaO + H2O → Ca(OH)2
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи. При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
K2O + Al2O3 → 2KAlO2
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2—. Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:
Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe2+ можно окислить до иона Fe3+).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
Реакция протекает только при нагревании.
FeO + C = Fe + CO
Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe2O3 + CO = Al2O3 + CO2
CuO + CO = Cu + CO2
4.2. Восстановление водородом.
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O
4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например, оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.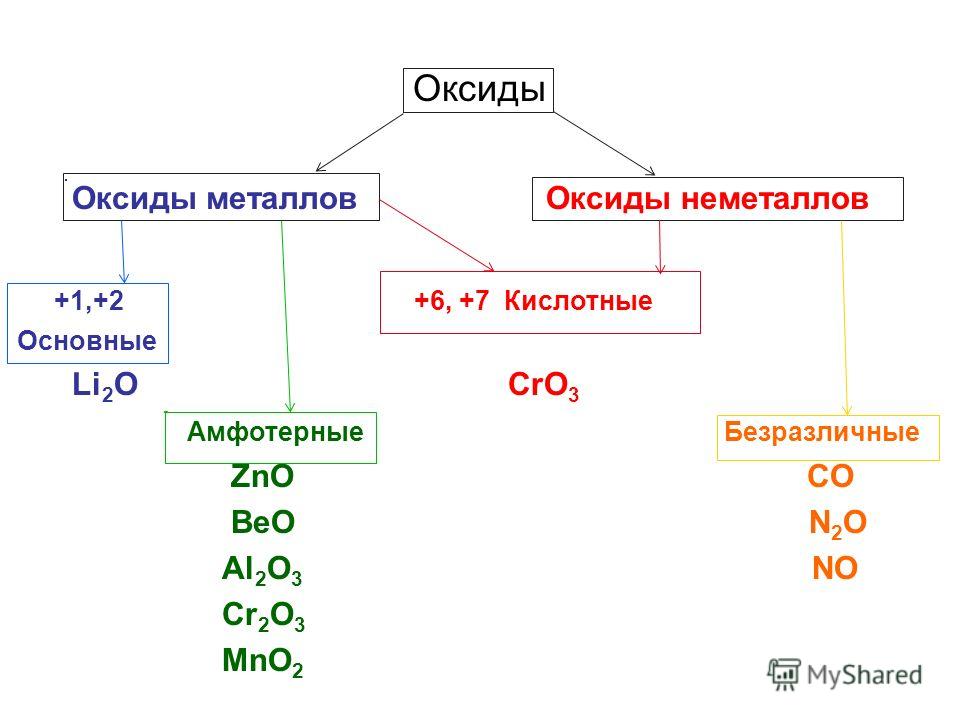
Например, аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe2+, Cr2+, Mn2+ и др.) могут выступать в качестве восстановителей.
Например, оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O2 = 2Fe2O3
Свойства оксидов, основные оксиды, кислотные оксиды. Получение оксидов. Оксиды азота
Свойства оксидов
Оксиды — это сложные химические вещества, представляющие собой химические соединения простых элементов с кислородом.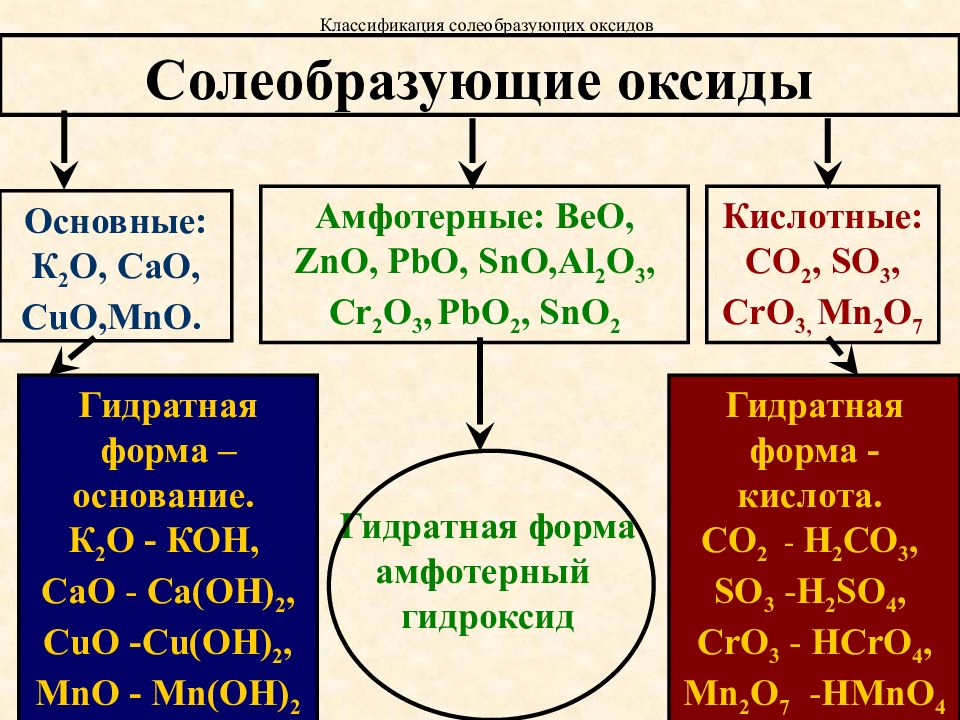 Они бывают солеобразующими и не образующие соли.
Они бывают солеобразующими и не образующие соли.
При этом солеобразующие бывают 3-х типов: основными (от слова «основание»), кислотными и амфотерными.
Примером окислов, не образующих соли, могут быть: NO (окись азота) — представляет собой бесцветный газ, без запаха. Он образуется во время грозы в атмосфере. CO (окись углерода) — газ без запаха, образуется при сгорании угля. Его обычно называют угарным газом. Существуют и другие окислы, не образующие соли.
Теперь разберём подробнее каждый вид солеобразующих окислов.
Основные оксиды
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие:
K2O (окись калия), CaO (окись кальция), FeO (окись железа 2-валентного).
Рассмотрим химические свойства оксидов на примерах
1. Взаимодействие с водой:
— взаимодействие с водой с образованием основания (или щёлочи)
CaO+H2O→ Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:
— взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H2SO4→ CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны всем под названием «гипс»).
3. Взаимодействие с кислотными оксидами: образование соли
CaO+CO2→ CaCO3 (Это вещество известно всем — обычный мел!)
Кислотные оксиды
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.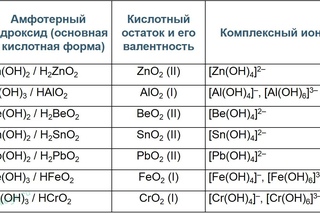
Примерами кислотных окислов могут быть:
CO2 (всем известный углекислый газ), P2O5 — оксид фосфора (образуется при сгорании на воздухе белого фосфора), SO3 — триокись серы — это вещество используют для получения серной кислоты.
— химическая реакция с водой
CO2+H2O→ H2CO3 — это вещество — угольная кислота — одна из слабых кислот, её добавляют в газированную воду для «пузырьков» газа. С повышением температуры растворимость газа в воде уменьшается, а его излишек выходит в виде пузырьков.
— реакция с щелочами (основаниями):
CO2+2NaOH→ Na2CO3+H2O- образовавшееся вещество (соль) широко используется в хозяйстве. Её название — кальцинированная сода или стиральная сода, — отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую!
Голыми руками работать не рекомендую!
— реакция с основными оксидами:
CO2+MgO→ MgCO3 — получившая соль — карбонат магния — ещё называется «горькая соль».
Амфотерные оксиды
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами). Наиболее частое применение слово «амфотерный» в нашем случае относится к оксидам металлов.
Примером амфотерных оксидов могут быть:
ZnO — окись цинка (белый порошок, часто применяемый в медицине для изготовления масок и кремов), Al2O3 — окись алюминия (называют еще «глинозёмом»).
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
Например:
— реакция с кислотным оксидом:
ZnO+H2CO3→ ZnCO3 + H2O — Образовавшееся вещество — раствор соли «карбоната цинка» в воде.
— реакция с основаниями:
ZnO+2NaOH→ Na2ZnO2+H2O — полученное вещество — двойная соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическим и химическим способами. Самым простым способом является химическое взаимодействие простых элементов с кислородом. Например, результатом процесса горения или одним из продуктов этой химической реакции являются оксиды.
Например, если раскалённое железный прутик, да и не только железный (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, — вообщем то, что имеется под рукой) поместить в колбу с кислородом, то произойдёт химическая реакция окисления железа, которая сопровождается яркой вспышкой и искрами. Продуктом реакции будет чёрный порошок оксида железа FeO:
Продуктом реакции будет чёрный порошок оксида железа FeO:
2Fe+O2→ 2FeO
Полностью аналогичны химические реакции с другими металлами и неметаллами.
Цинк сгорает в кислороде с образованием окисла цинка
2Zn+O2→ 2ZnO
Горение угля сопровождается образованием сразу двух окислов: угарного газа и углекислого газа
2C+O2→ 2CO — образование угарного газа.
C+O2→ CO2 — образование углекислого газа. Этот газ образуется если кислорода имеется в более, чем достаточном количестве, то есть в любом случае сначала протекает реакция с образованием угарного газа, а потом угарный газ окисляется, превращаясь в углекислый газ.
Получение оксидов можно осуществить другим способом — путём химической реакции разложения.
Например, для получения окисла железа или окисла алюминия необходимо прокалить на огне соответствующие основания этих металлов:
Fe(OH)2→ FeO+H2O
Твёрдый оксид алюминия — минерал корундОксид железа (III). Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в грунте оксида железа (III).Твёрдый оксид алюминия — корундРастворы оксидов
Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в грунте оксида железа (III).Твёрдый оксид алюминия — корундРастворы оксидов
2Al(OH)3→ Al2O3+3H2O,
а также при разложении отдельных кислот:
H2CO3→ H2O+CO2 — разложение угольной кислоты
H2SO3→ H2O+SO2 — разложение сернистой кислоты
Получение оксидов можно осуществить из солей металлов при сильном нагревании:
CaCO3→ CaO+CO2 — прокаливанием мела получают окись кальция (или негашенную известь) и углекислый газ.
2Cu(NO3)2→ 2CuO + 4NO2 + O2 — в этой реакции разложения получается сразу два окисла: меди CuO (чёрного цвета) и азота NO2 (его ещё называют бурым газом из-за его действительно бурого цвета).
Ещё одним способом, которым можно осуществить получение окислов — это окислительно-восстановительные реакции
Cu + 4HNO3(конц. )→ Cu(NO3)2 + 2NO2 + 2H2O
)→ Cu(NO3)2 + 2NO2 + 2H2O
S + 2H2SO4(конц.)→ 3SO2 + 2H2O
Оксиды хлора
Молекула ClO2Молекула Cl2O7Закись азота N2OАзотистый ангидрид N2O3Азотный ангидрид N2O5Бурый газ NO2
Известны следующие оксиды хлора: Cl2O, ClO2, Cl2O6, Cl2O7.
Все они, за исключением Cl2O7, имеют желтую или оранжевую окраску и не устойчивы, особенно ClO2, Cl2O6. Все оксиды хлора взрывоопасны и являются очень сильными окислителями.
Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорсодержащие кислоты:
Так, Cl2O — кислотный оксид хлора хлорноватистой кислоты.
Cl2O + H2O→ 2HClO — Хлорноватистая кислота
ClO2 — кислотный оксид хлора хлорноватистой и хлорноватой кислоты, так как при химической реакции с водой образует сразу две этих кислоты:
ClO2 + H2O→ HClO2 + HClO3
Cl2O6 — тоже кислотный оксид хлора хлорноватой и хлорной кислот:
Cl2O6 + H2O→ HClO3 + HClO4
И, наконец, Cl2O7 — бесцветная жидкость — кислотный оксид хлора хлорной кислоты:
Cl2O7 + H2O→ 2HClO4
Оксиды азота
Азот — газ, который образует 5 различных соединений с кислородом — 5 оксидов азота. А именно:
А именно:
— N2O — гемиоксид азота. Другое его название известно в медицине под названием веселящий газ или закись азота — это бесцветный сладковатый и приятный на вкус на газ.
— NO — моноксид азота — бесцветный, не имеющий ни запаха ни вкуса газ.
— N2O3 — азотистый ангидрид — бесцветное кристаллическое вещество
— NO2 — диоксид азота. Другое его название — бурый газ — газ действительно имеет буро-коричневый цвет
— N2O5 — азотный ангидрид — синяя жидкость, кипящая при температуре 3,5 0C
Из всех этих перечисленных соединений азота наибольший интерес в промышленности представляют NO — моноксид азота и NO2 — диоксид азота. Моноксид азота (NO) и закись азота N2O не реагируют ни с водой, ни с щелочами. Азотистый ангидрид (N2O3) при реакции с водой образует слабую и неустойчивую азотистую кислоту HNO2, которая на воздухе постепенно переходит в более стойкое химическое вещество азотную кислоту
Рассмотрим некоторые химические свойства оксидов азота:
Реакция с водой:
2NO2 + H2O→ HNO3 + HNO2 — образуется сразу 2 кислоты: азотная кислота HNO3 и азотистая кислота.
Реакция с щелочью:
2NO2 + 2NaOH→ NaNO3 + NaNO2 + H2O — образуются две соли: нитрат натрия NaNO3 (или натриевая селитра) и нитрит натрия (соль азотистой кислоты).
Реакция с солями:
2NO2 + Na2CO3→ NaNO3 + NaNO2 + CO2 — образуются образуются две соли: нитрат натрия и нитрит натрия, и выделяется углекислый газ.
Получают диоксид азота (NO2) из моноксида азота (NO) с помощью химической реакции соединения c кислородом:
2NO + O2→ 2NO2
Оксиды железа
Железо образует два оксида: FeO — оксид железа (2-валентный) — порошок чёрного цвета, который получают восстановлением оксида железа (3-валентного) угарным газом по следующей химической реакции:
Fe2O3+CO→ 2FeO+CO2
Этот основной оксид, легко вступающий в реакции с кислотами. Он обладает восстановительными свойствами и быстро окисляется в оксид железа (3-валентный).
4FeO +O2→ 2Fe2O3
Оксид железа (3-валентный) — красно-бурый порошок (гематит), обладающий амфотерными свойствами (может взаимодействовать и с кислотами и со щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что наиболее часто он его используют, как основной оксид .
Есть ещё так называемы смешанный оксид железа Fe3O4. Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным железняком или магнетитом).
Если железо сгорает, то в результате реакции горения образуется окалина, состоящая сразу из двух оксидов: оксида железа (III) и (II) валентные.
Оксид серы
Сернистый газ SO2
Оксид серы SO2 — или сернистый газ относится к кислотным оксидам, но кислоту не образует, хотя отлично растворяется в воде — 40л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называют сернистой кислотой).
При нормальных обстоятельствах — это бесцветный газ с резким и удушливым запахом горелой серы. При температуре всего -10 0C его можно перевести в жидкое состояние.
В присутствии катализатора -оксида ванадия (V2O5) оксид серы присоединяет кислород и превращается в триоксид серы
2SO2 +O2→ 2SO3
Растворённый в воде сернистый газ — оксид серы SO2 — очень медленно окисляется, в результате чего сам раствор превращается в серную кислоту
Если сернистый газ пропускать через раствор щелочи, например, гидроксида натрия, то образуется сульфит натрия (или гидросульфит — смотря сколько взять щёлочи и сернистого газа)
NaOH + SO2→ NaHSO3 — сернистый газ взят в избытке
2NaOH + SO2→ Na2SO3 + H2O
Если сернистый газ не реагирует с водой, то почему его водный раствор даёт кислую реакцию?! Да, не реагирует, но он сам окисляется в воде, присоединяя к себе кислород. И получается, что в воде накапливаются свободные атомы водорода, которые и дают кислую реакцию (можете проверить каким-нибудь индикатором!)
Элементы кислотно амфотерные — Справочник химика 21
Периодичность изменения химических свойств элементов на примере их бинарных соединений с водородо.м и оксидов. Кислотные, основные и амфотерные свойства. [c.302]
Характер оксида элементов главных подгрупп можно определить по положению элемента в таблице Д.И. Менделеева. Линия Ве—А1—Ge—Sn—РЬ соединяет элементы, все оксиды которых амфотерны. Левее этой линии амфотерные оксиды имеют галлий и индий. Амфотерным оксидом элемента, расположенного правее этой линии, является ЗЬгОз. Левее элементов с амфотерными оксидами в главных подгруппах расположены элементы, имеющие основные оксиды, а правее — элементы, имеющие кислотные оксиды . - [c.10]
Как видно из приведенных примеров, химическая природа однотипных оксидов и сульфидов, гидроксидов и гидросульфидов закономерно изменяется в пределах периода. Сульфиды, как и оксиды, бывают основными, кислотными и амфотерными. Основные свойства проявляют сульфиды наиболее типичных металлических элементов, кислотные — сульфиды неметаллических элементов. Различие химической природы сульфидов проявляется в реакциях сольволиза и при взаимодействии сульфидов разной химической природы между собой. Так, [c.351]
Цинк принадлежит к группе элементов, образующих амфотерные гидроокиси вместе с бериллием, алюминием и хромом (4-я группа по кислотно-щелочному методу). Поэтому цинк отделяется от кадмия и ртути, которые реагируют с гидроокисью аммония, образуя комплексные аммиакаты. Кобальт, никель, медь, кадмий, ртуть образуют группу элементов, гидроокиси которых растворяются в гидроокиси аммония (6-я группа по кислотно-щелочному методу). [c.191]
В соответствии с природой элемента в положительной степени окисления характер оксидов в периодах и группах периодической системы закономерно изменяется. В периодах уменьшается отрицательный эффективный заряд на атомах кислорода и осуществляется постепенный переход от основных через амфотерные оксиды к кислотным, например [c.313]
Деление оксидов на оснбвные и кислотные базируется на их собственном отношении к кислотам и щелочам, а также на свойствах соответствующих им гидроксидов. Большая группа оксидов по этим признакам относится к амфотер-ным. Элементы, образующие амфотерные оксиды, характеризуются средними значениями ОЭО в пределах 1,4 — 1,8 и степенями окисления (+2) — (+4). Если при степени окисления +2, +3 электроотрицательность менее 1,4, то оксиды (й отвечающие им гидроксиды) обладают оснбвными свойствами. Так, ОЭО [Са(+2)] составляет 1,0, ОЭО лантаноидов [Ьп (+3)] равна 1,2 — 1,3. Если при степени окисления +4 электроотрицательность элемента больше 1,8, оксид обладает кислотными свойствами. Например, ОЭО С(+4), 81(+4), Се(+4) равны соответственно 2,6, 1,9 и 2,0. Если электроотрицательность элемента находится в пределах 1,4 — 1,8 или даже несколько превышает этот интервал, а степень окисления + 1, оксид принадлежит к оснбвным (у Ag ОЭО 1,9). Когда же степени окисления элементов превышают +4 и значения ОЭО высоки, соответствующие оксиды кислотные. [c.267]
Окислы это соединения элементов с кислородом. По химическим свойствам они подразделяются на солеобразующие и несолеобразующие или безразличные. Солеобразующие окислы в свою очередь подразделяются на основные, кислотные амфотерные. Основным окислам отвечают основания, кислотным — кислоты. Амфо-терным окислам отвечают гидраты, проявляющие и кислотные, и основные свойства. Явление амфотерности рассматривается в 87. Безразличные окислы не образуют ни кислот, ни оснований. [c.36]
Подобно оксидам, фториды иногда подразделяют на основные, кислотные и амфотерные. К кислотным фторидам относятся фториды элементов подфупп 1УА- 11А периодической системы. Они реагируют с основными фторидами с образованием комплексных соединений, в которых катион — элемент основного фторида, а элемент кислотного фторида входит в состав комплексного аниона РРб]»- [c.459]
На примере гидридов и оксидов типических элементов хорошо иллюстрируется корреляция между валентностью и номером группы элемента. Элементы, расположенные в левом нижнем углу периодической системы, представляют собой металлы. Они образуют ионные гидриды и оксиды, водные растворы которых обладают основными свойствами. Элементы, расположенные в верхнем правом углу периодической системы, являются неметаллами. Их соединения с водородом и оксиды представляют собой небольщие молекулы с ковалентными связями при нормальных условиях они существуют в форме жидкостей или газов и проявляют кйслотные свойства. В промежуточной части периодической таблицы между ее верхним правым и нижним левым углами находятся элементы, которые обнаруживают постепенно изменяющиеся свойства. По мере перехода от неметаллических элементов к семиметаллическим и далее к металлам их соединения с водородом становятся вместо кислотных инертными или нейтральными и далее основными (хотя эта общая закономерность осложняется многими отклонениями), а оксиды переходят более закономерным образом от кислотных к амфотерным и далее к основным. [c.323]
Свойства гидроксидов (оксид-гидрокспдов) определяются характером электроположительного элемента. Гидроксиды активных металлов являются основаниями, т. е. акцепторами протонов. По мере уменьшения активности металлов, а особенно при переходе к неметаллическим элементам свойства их гидроксидов (оксид-гидроксидов) непрерывно изменяются происходит переход от типичных оснований к амфотерным соединениям и к кислотам, т. е. донорам протонов. В основных гидроксидах электроположительный элемент с кислородом связан ионной связью, а водород с кислородом — ковалентной. В кислотных гидроксидах, наоборот, связь кислорода с электроположительным элементом ковалентная, а с водородом — нонная или, во всяком случае, сильно полярная. Амфотерные гидроксиды обладают промежуточными свойствами. Изменение состава и характера гидроксидов (и оксид-гидроксидов) элементов можно видеть на примере соединений элементов третьего периода системы Д. И. Менделеева [c.127]
Оксиды — соединения элементов с кислородом (кроме соединений фтора) не образуют соединений с кислородом только Не, Ые и Аг. Степень окисления кислорода в оксидах равна — II. По составу и химическим свойствам делятся на основные, кислотные, амфотерные, двойные и несолеобразующие оксиды. [c.84]
Приведенный обзор показывает, что по сравнению с бором у алюминия признаки металлического элемента заметно усиливаются, В частности, в отличие от кислотных соединений бора однотипные соединения алюминия (П1) проявляют амфотерные свойства. Ослабление кислотных признаков однотипных производных алюминия (III) по сравнению с бором (III), а также у алюминия (III) по сравнению с кремнием (IV) можно проиллюстрировать на следующих примерах [c.461]
Как и для других d-элементов, для Сг, Мо и W при низких степенях окисления более характерны катионные комплексы, а при высокие — анионные комплексы= . Так, для Сг (III) возможны и катионные и анионные комплексы, тогда как для Сг (VI), Мо (VI) и W (VI) типичны анионные комплексы. В соответствии с этим, в част-ностр, СгО —основной оксид, СгаОз — амфотерный, а СгОз — кислотный. [c.549]
Граница между металлами и неметаллами в периодической таблице проходит в диагональном направлении, смещаясь направо и вниз приблизительно от Ве и В к Ро и Ас. Оксиды элементов, расположенных на этой границе или вплотную к ней, часто проявляют амфотерные свойства (кислотные в одних условиях и основные в других), к числу оксидов с амфо- [c.456]
Если оксиды элемента побочной подгруппы расположить в ряд по мере возрастания степени окисления центрального атома, то амфотерный оксид разделит все оксиды на две группы. Оксиды, содержащие центральный атом в степени окисления, низшей, чем в амфотер-ном оксиде, будут основными, а в высшей — кислотными. Амфотерные оксиды элементов побочных подгрупп — СГ2О3, МпОг, СиО, ZnO — следует запомнить. [c.11]
Э — элемент, образующий кислотный или амфотерный оксид. [c.80]
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на оснбвные, кислотные и амфотерные. Оснбвные оксиды образуют соли при взаимодействии с кислотами или кисл/отными оксидами. Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами. [c.26]
Элементы, обладающие постоянной валентностыв, образуют оксиды только одной из перечисленных групп (основные, кислотные, амфотерные). Элементы, проявляющие переменную валентность, могут образовывать различные оксиды. Например, марганец образует пять оксидов МпО, МпгОз, МпОг, МпОз и МП2О7. Два первых из них — основные, третий — ам-фотерный, а два последних — кислотные оксиды. [c.28]
Некоторые элементы в сильнокислых средах образуют комплексные ионы, например [ l l4] . Некоторые элементы (Сг, А1, 2п, РЬ) в щелочных растворах присутствуют в виде гидроксокомп-лексов. Эти элементы обладают амфотерными свойствами, т. е. в зависимости от кислотности среды проявляют свойства либо кислоты, либо основания. В кислой среде они ведут себя как основания, образуя при растворении соответствующие катионы, например 8п(ОН)2+2Н+ 8п2+- -2Н20 [c.41]
Для металлов р-элементов характерны амфотерные оксиды. Металлоиды образуют кислотные оксиды. Некоторые их производные—кислородсодержащие анионы (ЗЮз , ВОз -, РО4 , 804 , ОеОз ) образуют полиоксоанионы. Наибольшее разнообразие таких анионов (благодаря прочным —81—О—81—связям) у кремниевой кислоты (81207 -, 81з09 , 814012 -, 81б01б и др.). [c.406]
Оксиды -элементов в низких степенях окисления +2, -f-3 обладают основными свойствами. По мере повышения степени окисления элемента кислотный характер этих соединений усилнваетси. Амфотерными являются все оксиды элементов середин больших периодов в степени окисления +4. [c.500]
Напншите формулы возможных гидроксидов для всех р-элементов IVA группы. Укажите характер гидроксидов каждого элемента кислотный, основной, амфотерный. [c.169]
Деление оксидов на основные н кислотные базируется на их собственном отношении к кислотам и щелочам, а также на свойствах соответствующих им гидроксидов. Большая группа оксидов по этим признакам относится к амфотерным. Элементы, образующие амфотерные оксиды, характеризуются средними значениями ОЭО в пределах 1,4—1,8 и степенями окисления +2ч-+4. Если при степенях окисления +2, -ЬЗ электроотрицательность менее 1,4, то оксиды (и отвечающие им гидроксиды) обладают основными свойствами. Так, ОЭО 0Э0са(+2) составляет 1,0, ОЭО лантаноидов [Ln (+3)1 равна 1,2—1,3. Если при степени окисления +4 электроотрицательность элемента больше 1,8, оксид обладает кислотными свойствами. Например, ОЭО С (+4), Si(+4), Ge (+4) равны, соответ- [c.62]
Здесь наблюдается постепенный переход ог типично основных оксидов натрия и магния к амфотерным, или промежуточным (алюминия), и к кислотным оксидам фосфора, серы и хлора. Этот пе-ре.ход сопровождается понышепием окислительного числа эле.мен-тов, образующих оксиды. То же наблюдается у оксидов одного и того же элемента в разных степенях окисления. Так, например, в ряду [c.126]
Классификация анионов, как и катионов, связана с положением соответствующих элементов в периодической системе Д. И. Менделеева. Наиболее типичные и часто встречающиеся анноны образуются элементами II, III, IV и V периодов. В таблице на форзаце отмечены элементы, образующие амфотерные, кислотно-амфотерные, щелочноам-фотерные соединения в IV и V периодах — элементы, образующие анионы, находятся в 4-м и б-м рядах, а также составляющие семейства элементов переходных, побочных подгрупп. [c.42]
Теллур в анодном сплаве находится в виде механической примеси теллурида серебра Ag2Te в чистом серебре. Теллур, как элемент с амфотерными свойствами, в зависимости от рН среды может переходить в раствор как в виде анионов, так и в виде катионов. В кислой среде теллур находится в виде катионов Те +, в щелочной — в виде теллурат- и теллурит-ионов ТеО и ТеО [1, 2]. Для того чтобы полностью исключить попадание теллура в катодное пространство при наличии катионитовой мембраны, в анолите необходимо поддерживать щелочную среду (осуществить же это невозможно, так как в этом случае серебро будет выпадать в виде окиси серебра) или по возможности низкую кислотность, достаточную для того, чтобы серебро переходило в раствор в виде AgNOз. Очевидно, на характер перехода в раствор теллура в той или иной форме будет влиять и плотность тока. Как показала практика, до 80% теллура переходит в шлам в виде металлического теллура и Ag2Te, а также в виде теллу-ритов и теллуратов серебра. При использовании фильтрующей тканевой диафрагмы в катодный осадок теллур может попадать также из мелко взмученного шлама при применении ионообменной мембраны это полностью исключается. [c.262]
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений, в частности их основно-кислотная активность. Так. в случае оксидов в ряду — ВеО — В2О3 — СО2 — N,05 по мере уменьшения степени полярности связи (уменьшения отрицательного эффективного заряда атома кислорода б) ослабляются основные и нарастают кислотные свойства Ы О — сильно основный оксид, ВеО — амфотерный, а В2О3, СО и ЫзОй — кислотные. [c.250]
С увеличением порядкового номера металлические свойства рассматриваемых элементов, как и в других главных подгруппах, заметно усиливаются. Так, окснд бора нмеет кислотный характер, оксиды алюминия, галлия и нндия — амфотерны, а оксид тал-лия(1П) имеет основной характер. [c.630]
Подобно оксидам фториды иногда подразделяют на основные, кислотные и амфотерные. Кислотными являются фториды элементов подгрупп IVA—VIIA периодической системы. [c.471]
Для каждого элемента с ростом степени окисления ш усиливается, кислотная активность оксидов. Так, ТГО — основной оксид (растворяется в разбавленных кислотах), ТГОг — амфотерный оксид, с небол эшнм преобладанием кислотных свойств [c.506]
Эти элементы проявляют все степени окисления от О до+5. Рост ш отвечает усилению кислотных свойств и усилению тенденции к образованию комплексных соединений. Так, УО — основной оксид, растворяющийся в разбавленных кислотах (ему соответствует ос-1ювание У(0Н)2], а УаОз амфотерный оксид, малорастворимый в кислотах, у УОз основные свойства еще преобладают над кислотными [У(0Н)4 очень слабое основание], у УгОз, наоборот, преобладают кислотные свойства, это ангидрид слабой кислоты НУОз. [c.516]
Для элементов, проявляющих переменную валентность, влияние величины заряда выражается в следующей закономерности в низшей валентности элемент характеризуется основными свойствами, а в высшей — кислотными. Например, r дает типичное основание Сг ОН)г Сг(ОН)з обладает амфотерными свойствами, а Сг + образует кислоту Н2СГО4. [c.21]
Оксиды. — Химия — Подготовка к ЕГЭ
ОКСИДЫ
Оксидами называются сложные вещества, в состав которых входят атомы кислорода и какого-нибудь другого элемента. Иначе говоря, оксид – это соединение элемента с кислородом.
Оксиды можно получить как при непосредственном взаимо-действии кислорода с другим элементом, так и косвенным путем (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твердом (кремний-оксид(II), халцедон, аметист, горный хрусталь), жидком (вода), газообразном (угарный газ, углекислый газ) состояниях.
По химическим свойствам все оксиды подразделяют на солеобразующие и несолеобразующие или безразличные.
Несолеобразующими оксидами называют такие оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей. Несолеобразующих оксидов немного. К ним относятся: СО, NO, N2О,SiО.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами, основаниями и образуют при этом соль и воду, например: оксид калия – K2O, оксид натрия – Na2O.
Среди солеобразующих оксидов различают оксиды основные, кислотные и амфотерные.
А) Основные оксиды
Основными оксидами называются такие, которые при взаимодействии с кислотами образуют соль и воду. Соединения этих оксидов с водой относятся к классу оснований (гидроксидов).
Примерами основных оксидов могут служить Na2O, CaO, BaO, FeO, CuO, которым соответствуют основания (гидроксиды) NaOH, Ca(OH)2 , Ba(OH)2 и т. д. К основным оксидам относятся оксиды металлов с небольшими степенями окисления(+1 и +2),то есть оксиды металлов I и II группы периодической системы. Все основные оксиды представляют собой твердые вещества.
2
Химические свойства основных оксидов.
1. Основный оксид + кислота → соль + вода (реакция обмена).
CuO + 2HNO3 = Cu (NO3)2 + H2O
Основный оксид + кислотный оксид → соль (реакция соединения).
CaO + N2O5 = Ca (NO3)2
Основный оксид + вода → щелочь (реакция соединения).
K2O + H2O = 2KOH
Эта реакция протекает только в том случае, если образуется растворимое основание, поэтому
CuO + H2O ≠ т.к. Cu(OH)2 – нерастворимое основание.
Основной оксид + амфотерный оксид = соль (реакция соединения).
Оксиды ртути, серебра и благородных металлов распадаются при нагревании.
2HgO = 2Hg + O2
Основные оксиды могут вступать в окислительно- восстановительные реакции.
Fe2O3 + 2Al = 2Fe + Al2O3
2PbO + C = 2Pb + CO2
MnO + CO = Mn + CO2
CuO + H2 = Cu + H2O
Б) Кислотные оксиды.
Кислотными оксидами называются такие, которые при взаимодействии с основаниями образуют соль и воду. Соединения этих оксидов с водой относятся к классу кислот. Например, SO3, P2O5, CrO3 являются кислотными оксидами, которым соответ-ствуют кислоты H2SO4, H3PO4 и H2CrO4. Кислотные оксиды иначе называют ангидридами кислот.
К кислотным оксидам относятся оксиды неметаллов, а также оксиды металлов с большим значением степеней окисления, например:
CrO3 – H2CrO4
Mn2O7 – HMnO4
Химические свойства кислотных оксидов.
1. Кислотный оксид + щелочь → соль + вода (реакция обмена).
SO2 + 2NaOH = Na2SO4 + H2O
Кислотный оксид + основный оксид → соль (реакция соединения).
FeO + SO2 = FeSO3
3. Кислотный оксид + вода → кислота (реакция соединения).
SO3 + H2O = H2SO4
Эта реакция возможна только в том случае, если кислотный оксид растворим в воде, поэтому
SiO2 + H2O ≠ т.к. SiO2 – нерастворимый оксид.
4. Вступают в окислительно – восстановительные реакции
CO2 + C = 2CO2
CO2 + 2Mg = C + 2MgO
SO2 + 2H2S = 3S + 2H2O
5. Вступают в реакцию замещения с солями, если менее летучий оксид вытесняет более летучий.
CaCO3 + SiO2 = CaSiO2 + CO2 (при нагревании).
6. Несолеобразующий оксид СО кислотно-основных свойств не проявляет, однако взаимодействует с расплавом щёлочи при нагревании и давлении, образуя формиаты. При этом СО проявляет псевдокислотные свойства CO + NaOH = HCOONa.
В) Амфотерные оксиды
К амфотерным оксидам относятся такие, которые взаимодействуют с кислотами и основаниями с образованием соли и воды. Соединения этих оксидов с водой могут иметь как кислотные, так и основные свойства. Примеры указанных оксидов — Al2O3, Cr2O3, ZnO, (Fe2O3 – амфотерный, но слабо выражены кислотные свойства).
Химические свойства амфотерных оксидов.
1. Амфотерный оксид + кислота → соль + вода
4
Al2O3 + 6HBr = 2AlBr3 + 3H2O
2. Амфотерный оксид + кислотный оксид → соль
ZnO + SO3 = ZnSO4
3. Амфотерный оксид + щелочь → соль + вода
Al2O3 + 2NaOH( твёрдый ) =t 2NaAlO2 + H2O и
Al2O3 + 2NaOH( раствор ) + 3H2O = 2Na[Al(OH)4]
4.Амфотерный оксид + основный оксид → соль
ZnO + K2O = 2K2ZnO2
5. Амфотерные оксиды не реагируют с водой.
Получение оксидов.
Простое вещество + кислород
2C + O2 = 2CO
Разложение некоторых кислот (устойчивы к нагреванию сероводородная и фосфорная кислоты)
H2SiO3 → H2O + SiO2
Разложение при нагревании нерастворимых оснований
Cu(OH)2 → CuO + H2O
Разложение при нагревании некоторых солей
CaCO3 → CaO + CO2
Окисление (горение) сложных веществ
C6H12O6 + 6O2 = 6CO2 + H2O
Окисление сложных веществ
2NO + O2 = 2NO2
7. Реакция замещения, в ходе которых химически более активный металл вытесняет менее активный из его оксида.
Al + Fe2O3 = Al2O3 + Fe,
8. Обработка металлической стружки сильной кислотой
Cu + 4HNO3 (конц.) = Cu (NO3)2 + 2NO2+ 2H2O,
Химия — 8
1. Основные оксиды
2. Кислотные оксиды
3. Смешанные оксиды
a) SO3 b) Fe3O4
c) CuO d) AI2O3 e) CO2
1. Международное название оксида
2. Историческое, тривиальное название
а) оксид железа(III) b) угарный газ
с) оксид натрия d) веселящий газ
е) оксид цинка
1. В международном названии указывается валентность элемента, образующего оксид.
2. В международном названии валентность элемента, образующего оксид, не указывается.
a) CuO b) Al2O3 c) FeO d) MgO e) MnO
1. Амфотерный оксид
2. Основной оксид
3. Кислотный оксид
a) CuO b) ZnO c) NO2
d) Fe2O3 e) CaO f) BeO
1) монооксид азота 2) оксид железа(II) 3) монооксид углерода
4) оксид калия 5) оксид меди (II) 6) монооксид диазота
Оксиды
1. CU2O
2. Cr2O3
3. P2O5
Вид оксида
a) основной оксид b) амфотерный оксид
c) кислотный оксид d) смешанный оксид
| Формула оксида | Международное название оксида | Тип оксида |
|---|---|---|
| NO | ||
| Оксид алюминия | ||
| Cr2O3 | ||
| Оксид меди (II) |
| Оксиды | Агрегатное состояние в нормальных условиях | Тип оксида |
|---|---|---|
| XO2 | газ | кислотный оксид |
| YO | в твердом состоянии | амфотерный оксид |
| Z2O | в твердом состоянии | основной оксид |
1) C 2) Na 3) Zn
4) S 5) K 6) Be
| Оксиды | ω (X) в оксиде |
|---|---|
| XO | 80% |
a) 12C b) 64Cu c) 56Fe
d) 40Ca e) 65Zn
Оксиды: классификация и химические свойства
Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
Оксиды могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Они бывают солеобразующими и несолеобразующие.
Солеобразующие оксиды – это такие оксиды, которые в результате химических реакций образуют соли. Это оксиды металлов и неметаллов, которые при взаимодействии с водой образуют соответствующие кислоты, а при взаимодействии с основаниями – соответствующие кислые и нормальные соли. Например, оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl2 + H2O.
В результате химических реакций можно получать и другие соли:
CuO + SO3 → CuSO4.
Несолеобразующими оксидами называются такие оксиды, которые не образуют солей. Примером могут служить СО, N2O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова «основание»), кислотными и амфотерными.
Основными оксидами называются такие оксиды металлов, которым соответствуют гидроксиды, относящиеся к классу оснований. К основным оксидам относятся, например, Na2O, K2O, MgO, CaO и т.д.
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na2O + H2O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na2O + SO3 → Na2SO4.
3. Реагируют с кислотами, образуя соль и воду:
CuO + H2SO4 → CuSO4 + H2O.
4. Реагируют с амфотерными оксидами:
Li2O + Al2O3 → 2LiAlO2.
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO2, SO3, P2O5, N2O3, Cl2O5, Mn2O7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO3 + H2O → H2SO4.
Но не все кислотные оксиды непосредственно реагируют с водой (SiO2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO2 + CaO → CaCO3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO2 + Ba(OH)2 → BaCO3 + H2O.
В состав амфотерного оксида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH)2 и H2ZnO2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl2 + H2O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na2 ZnO2 + H2O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + H2O => Na2[Zn(OH)4].
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле. Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Остались вопросы? Хотите знать больше об оксидах?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Неорганическая химия — Почему Cr2O3 амфотерный, а CrO — нет?
Основной оксид — это оксид, который растворяется в воде с образованием растворимого гидроксида. По этой причине основные оксиды хорошо растворимы. Кислотные оксиды — это оксиды, которые растворяются в воде с образованием сильных кислот. Обычно ковалентные оксиды образуют кислые оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. По мере увеличения заряда электроотрицательность увеличивается, и, таким образом, оксид становится кислым. Это также относится к элементам, имеющим несколько оксидов.Поскольку окисления нет. увеличивается, увеличивается заряд и, таким образом, оксиды становятся кислыми. Эта ссылка содержит полезную информацию по этой теме:
Поскольку кислотность катиона быстро растет с ростом заряда, d-блок
элементы с широким диапазоном степеней окисления могут иметь
один или несколько оксидов, которые проявляют только основные свойства, и один или несколько
оксиды, проявляющие только кислотные свойства. Чем выше окисление
число более кислый соответствующий оксид. Хром является примером
такого элемента.{-}}) $.
Итак, эмпирическое правило заключается в том, что по мере увеличения степени окисления заряд металла увеличивается, кислотный характер увеличивается. Также основной оксид растворим в воде, кислотный оксид не растворяется в воде. Это можно использовать для различения кислотного и основного оксида.
Кислотно-основные свойства оксидов | Химия [Магистр]
Основные и амфотерные гидроксиды
Некоторые гидроксиды металлов являются амфотерными или способны действовать как кислота или основание.
Цели обучения
Укажите условия, при которых амфотерные гидроксиды действуют как кислоты.
Основные выводы
Ключевые моменты
- Амфотерные молекулы могут действовать как кислоты или основания.
- Гидроксиды с сильно заряженными катионами металлов часто бывают амфотерными.
- Амфотерные гидроксиды действуют как основания Бренстеда-Лоури (принимающие протоны) или кислоты Льюиса (принимающие электронную пару), в зависимости от условий реакции.
Ключевые термины
- основание : акцептор протона или донор электронной пары
- Кислота Льюиса : акцептор электронной пары
До сих пор в нашем обсуждении кислот и оснований гидроксиды всегда были синонимами оснований.Теперь мы рассмотрим амфотерные гидроксиды, то есть соли гидроксидов, которые могут действовать как кислота или основание, в зависимости от условий реакции. Мы начнем с известного случая, когда гидроксид действует как основание.
Реакция амфотерных гидроксидов в кислом растворе
Одним из наиболее распространенных и известных примеров амфотерного гидроксида является гидроксид алюминия, Al (OH) 3 . Из наших правил растворимости мы знаем, что Al (OH) 3 в значительной степени нерастворим в нейтральной воде; однако в сильнокислом растворе ситуация меняется.Например, рассмотрим реакцию Al (OH) 3 с HCl:
[латекс] \ text {HCl} (\ text {aq}) + \ text {Al} (\ text {OH}) _ 3 (\ text {aq}) \ rightarrow \ text {AlCl} _3 (\ text {aq }) + 3 \ text {H} _2 \ text {O} (\ text {l}) [/ latex]
Это классическая реакция кислотно-щелочной нейтрализации: HCl полностью протонирует все три гидроксида на моль Al (OH) 3 , давая чистую воду и соль AlCl 3 . Исходя из того, что мы знаем об основных свойствах гидроксидов до сих пор, это именно то, что мы ожидали — так как же гидроксид может действовать как кислота?
Гидроксид алюминия : Гидроксид алюминия может действовать как основание Бренстеда-Лоури, принимая протоны из кислого раствора, или как кислота Льюиса, принимая электронную пару от гидроксид-ионов в основном растворе.- (\ text {aq}) [/ latex]
Здесь гидроксид алюминия захватывает ион гидроксида из раствора, тем самым действуя как кислота Льюиса. Как это возможно? Рассмотрим структуру Льюиса для Al (OH) 3.
Центральный атом алюминия электронодефицитный — он образует только три связи, и правило октета не выполняется; таким образом, Al 3+ вполне счастлив принять пару электронов и образовать еще одну связь при правильных условиях. В щелочном растворе он образует связь с ионом OH —, вытягивая его из раствора и понижая pH раствора.
Заключение
Гидроксиды металлов с сильно заряженным центральным атомом металла могут быть амфотерными. Помимо алюминия, такие металлы, как цинк, олово, свинец и бериллий, также могут образовывать амфотерные оксиды или гидроксиды. Ведут себя такие гидроксиды как кислоты или основания, зависит от pH окружающего раствора.
Классификация оксидов — Введение, классификация, примеры и реакции
Что такое оксиды?
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент.Дианион кислорода также называют оксидом, который представлен O-2. Все оксидные соединения содержат хотя бы один дианион кислорода. Оксиды обычно представляют собой бинарные соединения, состоящие из кислорода и другого элемента.
Примеры оксидов — Al2O3 — оксид алюминия, CO2 — диоксид углерода, SO2 — диоксид серы, CaO — оксид кальция, MgO — оксид магния, Na2O — оксид натрия и т. Д.
Классификация оксидов
(изображение будет обновлено в ближайшее время )
Оксиды можно разделить на следующие типы в зависимости от валентности другого элемента в оксидах —
Простые оксиды — Простые оксиды состоят из одного металла или полуметалла и кислорода.Эти оксиды несут только то количество атомов кислорода, которое допускается нормальной валентностью элемента или металла.
Примеры простых оксидов — h3O, MgO, CaO, SiO2 и т. Д.
Смешанные оксиды — Смешанные оксиды образуются при объединении простых оксидов. Эти два простых оксида могут быть из одного металла (элемента) или из разных.
Примеры смешанных оксидов — Красный свинец (Pb3O) представляет собой смешанный оксид диоксида свинца (PbO2) и монооксида свинца (PbO). Другой пример — оксид железа и железа (Fe3O4), который представляет собой смешанный оксид двух простых оксидов — оксида железа (Fe2O3) и оксида железа (FeO).
Оксиды можно разделить на следующие типы в зависимости от металлического характера другого элемента в оксидах —
Основной оксид
Амфотерный оксид
Кислотный оксид
Нейтральный оксид
Основной оксид
Амфотерный оксид
Кислый оксид
Нейтральный оксид
Тенденция идет от сильно основных оксидов в левой части к сильнокислотным в правой, через амфотерный оксид (оксид алюминия) в середине.Амфотерный оксид — это оксид, который проявляет как кислотные, так и основные свойства.
Куда бы вы сейчас хотели отправиться?
900
(изображение будет скоро загружено)
Оксиды металлов — Оксиды металлов состоят из металла и кислорода. Обычно они встречаются в природе в виде минералов. Они образуются при окислении металлов.
Примеры оксидов металлов — CaO, MgO, Fe3O4, BaO, ZnO и т. Д.
Их можно разделить на следующие два типа —
Основной оксид — Если оксид реагирует с водой и образует основание, называемое основным оксидом. Таким образом, основной оксид при реакции с водой дает основание. Это означает, что если мы приготовим раствор основного оксида и воды и окунем в него красную лакмусовую бумажку, он станет синим.
Примеры основных оксидов — MgO, CaO, BaO и т. Д.
Горение магниевой ленты — Когда мы сжигаем магниевую ленту, она вступает в реакцию с кислородом воздуха и образует соединение серого цвета, которое представляет собой оксид магния. Теперь, когда мы растворяем это серое соединение в воде и окунаем в него лакмусовую бумагу красного цвета, она превращает красную лакмусовую бумажку в синюю, поскольку при реакции с водой образует гидроксид магния. Ниже приведены соответствующие реакции:
2Mg + O2 🡪 2MgO
MgO + h3O 🡪 Mg (OH) 2
Амфотерный оксид — Амфотерный оксид — это оксид металла, который проявляет двойное поведение.Он ведет себя как кислый оксид, так и как основной оксид. Он также реагирует как с основаниями, так и с кислотами.
Примеры амфотерных оксидов — оксид цинка (ZnO)
Когда оксид цинка реагирует с конц. Гидроксид натрия действует как кислый оксид, а когда он реагирует с HCl, он действует как основной оксид. Реакции приведены ниже —
ZnO + 2h3O + 2NaOH 🡪 Na3Zn [OH] 4 + h3
Кислый оксид цинка
ZnO + 2HCl 🡪 ZnCl2 + h3O
Основной оксид цинка
Другой пример амфотерного оксида алюминия — Al2O3. окись.Когда он реагирует с серной кислотой, он действует как основание, а когда он реагирует с гидроксидом натрия, он действует как кислота. Реакции приведены ниже —
Al2O3 + 3h3SO4 🡪 Al2 (SO4) 3 + 3h3O
Основной
Al2O3 + 2NaOH 🡪 2NaAlO2 + h3O
Кислый алюминат натрия
Другими примерами амфотерных оксидов
, BeO3 и т. Д. Являются. Неметаллические оксиды. Неметаллические оксиды образуются неметаллами и кислородом.Обычно они встречаются в природе в виде таких газов, как диоксид углерода. Они образуются при окислении неметаллов.
Примеры оксидов металлов — CO2, SO2, P2O5, CO и т. Д.
Их можно разделить на следующие два типа —
Кислотные оксиды — Если оксид вступает в реакцию с водой и образует кислоту, называемую кислым оксидом. Таким образом, кислый оксид при реакции с водой дает основание. Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной.В основном кислые оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокой степенью окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. Д., Также являются кислыми оксидами.
Примеры кислых оксидов — SO2, CO2, SO3 и т. Д.
Когда триоксид серы реагирует с водой, он образует серную кислоту. Реакция приведена ниже —
SO3 + h3O 🡪 h3SO4
Нейтральный оксид — Нейтральные оксиды — это оксиды, которые не проявляют ни кислотных свойств, ни основных свойств.Они не образуют соли, когда реагируют с кислотой или основанием.
Примеры нейтральных оксидов — N2O, NO, CO и т. Д.
Это все о классификации оксидов. Если вы ищете решения проблем NCERT на основе оксидов, войдите на сайт Vedantu или загрузите приложение Vedantu Learning App. Таким образом вы сможете получить доступ к бесплатным PDF-файлам решений NCERT, а также к заметкам о редакции, пробным тестам и многому другому.
КИСЛОТО-ОСНОВНОЕ ПОВЕДЕНИЕ ОКСИДОВ ПЕРИОДА 3 На этой странице рассматриваются реакции оксидов элементов периода 3 (натрия в хлор) с водой, а также с кислотами или основаниями, где это необходимо.Очевидно, что аргон не используется, потому что он не образует оксид. Краткое описание тенденции Оксиды Мы будем рассматривать следующие оксиды:
| |||||||||||||||
Примечание: Если вы еще не были там, возможно, вам будет интересно просмотреть страницу о структурах и физических свойствах оксидов Периода 3 в качестве полезного введения, прежде чем идти дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже, если вы решите перейти по этой ссылке. | |||||||||||||||
Тенденция кислотно-щелочного поведения Тенденция кислотно-основного поведения показана в различных реакциях, но в виде простого обобщения: Для этой простой тенденции вы должны смотреть только на самые высокие оксиды отдельных элементов. Это те, которые находятся в верхнем ряду выше, и там, где элемент находится в максимально возможной степени окисления. Картина не так проста, если вы включите и другие оксиды. Для оксидов неметаллов их кислотность обычно рассматривается в терминах кислотных растворов, образующихся при их реакции с водой — например, триоксид серы реагирует с образованием серной кислоты.Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия. Все эти реакции подробно рассматриваются на оставшейся части этой страницы. | |||||||||||||||
Предупреждение: Остальная часть этой страницы содержит довольно много деталей о различных оксидах. Не упускайте из виду общую тенденцию этого периода в отношении самых высоких оксидов, когда вы смотрите на все эти детали. Важно знать, что ваша программа говорит по этой теме, а также изучать прошлые работы и схемы отметок — иначе вы в конечном итоге увязнете в массе деталей, о которых вам действительно не нужно знать.Если вы готовитесь к экзамену в Великобритании (уровень A или его эквивалент) и у вас нет ничего из этого, перейдите по этой ссылке, прежде чем идти дальше, чтобы узнать, как их получить. | |||||||||||||||
Химия индивидуальных оксидов Оксид натрия Оксид натрия — простой сильноосновной оксид. Он является основным, поскольку содержит ион оксида, O 2-, который является очень сильным основанием с высокой тенденцией к объединению с ионами водорода. Реакция с водой Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. В зависимости от концентрации он будет иметь pH около 14. Реакция с кислотами Оксид натрия, как сильное основание, также вступает в реакцию с кислотами. Например, он будет реагировать с разбавленной соляной кислотой с образованием раствора хлорида натрия. Оксид магния Оксид магния также является простым основным оксидом, поскольку он также содержит ионы оксида.Однако он не так сильно щелочной, как оксид натрия, потому что ионы оксида не так свободны. В случае оксида натрия твердое тело удерживается вместе за счет притяжения между ионами 1+ и 2-. В случае оксида магния притяжение составляет от 2+ до 2-. Чтобы их сломать, требуется больше энергии. Даже с учетом других факторов (таких как энергия, выделяемая, когда положительные ионы притягиваются к воде в образовавшемся растворе), общий эффект этого заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции оксида натрия. Реакция с водой Если встряхнуть немного белого порошка оксида магния с водой, ничего не произойдет — похоже, он не вступит в реакцию. Однако, если вы проверите pH жидкости, вы обнаружите, что он находится где-то около 9, что свидетельствует о слабощелочной активности. Должна быть какая-то небольшая реакция с водой с образованием гидроксид-ионов в растворе. В реакции образуется некоторое количество гидроксида магния, но он почти нерастворим, поэтому в раствор фактически попадает не так много гидроксид-ионов. Реакция с кислотами Оксид магния реагирует с кислотами так же, как и любой простой оксид металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния. Оксид алюминия Описание свойств оксида алюминия может сбивать с толку, поскольку он существует в нескольких различных формах. Одна из этих форм очень инертна.Химически он известен как альфа-Al 2 O 3 и производится при высоких температурах. Далее мы предполагаем одну из наиболее реактивных форм. Оксид алюминия амфотерный . Он вступает в реакцию как с основанием, так и с кислотой. Реакция с водой Оксид алюминия не реагирует с водой простым образом в том смысле, в котором это происходит с оксидом натрия и оксидом магния, и не растворяется в ней.Хотя он все еще содержит ионы оксида, они слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой. | |||||||||||||||
Примечание: Однако некоторые формы оксида алюминия действительно очень эффективно поглощают воду. Я не смог установить, связано ли это поглощение только с такими вещами, как водородные связи, или происходит настоящая химическая реакция с образованием какого-то гидроксида. Если у вас есть надежная информация по этому поводу, не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте. | |||||||||||||||
Реакция с кислотами Оксид алюминия содержит ионы оксида и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Это означает, например, что оксид алюминия будет реагировать с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия. В этой (и подобных реакциях с другими кислотами) оксид алюминия показывает основную сторону своей амфотерной природы. Реакция с основаниями Оксид алюминия также имеет кислую природу, и это проявляется в реакции с основаниями, такими как раствор гидроксида натрия. Образуются различные алюминаты — соединения, в которых алюминий находится в отрицательном ионе. Это возможно, потому что алюминий обладает способностью образовывать ковалентные связи с кислородом. В случае натрия между натрием и кислородом существует слишком большая разница в электроотрицательности для образования чего-либо, кроме ионной связи.Но электроотрицательность увеличивается по мере прохождения периода, а разница электроотрицательностей между алюминием и кислородом меньше. Это позволяет образовывать ковалентные связи между ними. | |||||||||||||||
Примечание: Если вас не устраивает электроотрицательность, вы найдете объяснение, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | |||||||||||||||
С горячим концентрированным раствором гидроксида натрия оксид алюминия реагирует с образованием бесцветного раствора тетрагидроксоалюмината натрия. | |||||||||||||||
Примечание: Вы можете найти множество других формул, приведенных для продукта этой реакции. Они варьируются от NaAlO 2 (который представляет собой дегидратированную форму той, что указан в уравнении) до Na 3 Al (OH) 6 (который представляет собой совершенно другой продукт). То, что вы действительно получите, будет зависеть от таких вещей, как температура и концентрация раствора гидроксида натрия. В любом случае, правда почти наверняка намного сложнее, чем что-либо из вышеперечисленного.Это тот случай, когда было бы неплохо узнать, что ваши экзаменаторы цитируют в своих вспомогательных материалах или схемах выставления оценок, и придерживаться этого. При необходимости получите такую информацию от экзаменаторов (если вы изучаете курс в Великобритании), перейдя по ссылкам на странице учебных программ. | |||||||||||||||
Диоксид кремния (оксид кремния (IV)) К тому времени, когда вы дойдете до кремния в течение периода, электроотрицательность увеличится настолько, что уже не будет достаточной разницы в электроотрицательности между кремнием и кислородом для образования ионных связей. Диоксид кремния не имеет основных свойств — не содержит оксидных ионов и не вступает в реакцию с кислотами. Вместо этого он очень слабокислый, реагируя с сильными основаниями. Реакция с водой Диоксид кремния не реагирует с водой из-за сложности разрушения гигантской ковалентной структуры. Реакция с основаниями Диоксид кремния реагирует с раствором гидроксида натрия, но только если он горячий и концентрированный.Образуется бесцветный раствор силиката натрия. Вы также можете быть знакомы с одной из реакций, происходящих при извлечении железа в доменной печи — в которой оксид кальция (из известняка, который является одним из сырьевых материалов) реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция. Это также пример реакции кислого диоксида кремния с основанием. Важно! Что касается остальных оксидов, мы в основном будем рассматривать результаты их реакции с водой с образованием растворов различных кислот. Когда мы говорим о кислотности оксидов, возрастающей по мере перехода, скажем, от оксида фосфора (V) к триоксиду серы к оксиду хлора (VII), мы обычно говорим о возрастающей силе кислот, образующихся при их реакции. с водой. Оксиды фосфора Мы собираемся рассмотреть два оксида фосфора, оксид фосфора (III), P 4 O 6 , и оксид фосфора (V), P 4 O 10 . Оксид фосфора (III) Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабой кислоты, H 3 PO 3 , известной как фосфористая кислота, ортофосфорная кислота или фосфоновая кислота. Его реакция с горячей водой намного сложнее. | |||||||||||||||
Примечание: Обратите внимание на окончание «-ous» в первых двух именах. Это не орфографическая ошибка — это правда! Его используют, чтобы отличить его от фосфорной кислоты, которая совершенно иная (см. Ниже). Названия фосфорсодержащих кислот просто кошмар! (На самом деле, насколько я понимаю, фосфорные кислоты в целом всегда были и продолжают быть полным кошмаром!) Не беспокойтесь об этих названиях на этом уровне. Просто убедитесь, что вы можете написать формулы, если вам это нужно — и будьте благодарны за то, что вам больше не нужно о них знать! | |||||||||||||||
Чистая неионизированная кислота имеет структуру: Водороды не выделяются в виде ионов, пока вы не добавите в кислоту воду, и даже в этом случае их не так много, потому что фосфористая кислота является лишь слабой кислотой. Фосфорная кислота имеет pK a , равное 2,00, что делает ее более сильной, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76). | |||||||||||||||
Примечание: Если вы знаете о pK a , но не очень уверены, вы можете перейти по этой ссылке, но это, вероятно, займет у вас много времени. Все, что вам действительно нужно знать по этой теме, это то, что чем ниже значение pK и , тем сильнее кислота. | |||||||||||||||
Маловероятно, что вы когда-нибудь прореагируете напрямую оксидом фосфора (III) с основанием, но вам может потребоваться знать, что произойдет, если вы прореагируете образовавшуюся фосфористую кислоту с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислыми, а другой — нет. Это означает, что вы можете получить две возможные реакции, например, с раствором гидроксида натрия в зависимости от используемых пропорций. В первом случае только один из кислых атомов водорода прореагировал с гидроксид-ионами основания. Во втором случае (с использованием вдвое большего количества гидроксида натрия) прореагировали оба. Если бы вы реагировали непосредственно оксид фосфора (III) с раствором гидроксида натрия, а не сначала производили кислоту, вы бы получили те же возможные соли. | |||||||||||||||
Примечание: Проверьте свой учебный план, прошлые работы и схемы отметок, прежде чем вы слишком увязнете в этом! Перейдите по этой ссылке, чтобы узнать, как получить их, если у вас их еще нет (только для учебных программ в Великобритании). | |||||||||||||||
Оксид фосфора (V) Оксид фосфора (V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которой зависит от условий.Обычно мы просто рассматриваем одну из них, фосфорную (V) кислоту, H 3 PO 4 , также известную как фосфорная кислота или ортофосфорная кислота. На этот раз чистая неионизированная кислота имеет структуру: Фосфорная (V) кислота также является слабой кислотой с pK a , равным 2,15. Это делает его на слабее фосфористой кислоты. Растворы обеих этих кислот с концентрацией около 1 моль дм -3 будут иметь pH около 1. Еще раз, вы вряд ли когда-нибудь прореагируете этот оксид с основанием, но вполне можно ожидать, что вы узнаете, как фосфорная (V) кислота реагирует с чем-то вроде раствора гидроксида натрия. Если вы посмотрите на структуру, вы увидите, что она имеет три группы -OH, и каждая из них имеет кислый атом водорода. Вы можете провести реакцию с гидроксидом натрия в три стадии, причем один за другим эти атомы водорода вступают в реакцию с ионами гидроксида. Опять же, если бы вы реагировали непосредственно оксидом фосфора (V) с раствором гидроксида натрия, а не сначала производили кислоту, вы бы получили те же возможные соли. Это становится смешным, поэтому я приведу только один пример из возможных уравнений: | |||||||||||||||
Примечание: Если на экзамене вам задают вопрос, в котором вам просто нужно написать уравнение реакции гидроксида натрия с фосфорной (V) кислотой, какое уравнение вам следует написать? Это не имеет особого значения — все они совершенно верны. В каждом случае это просто зависит от пропорций двух используемых вами реагентов. Если вы действительно хотите быть уверенным, проверьте прошлые документы и отметьте схемы. Я нашел один вопрос о реакции между оксидом натрия и фосфорной (V) кислотой, где схема маркировки принимала любое из возможных уравнений — чего я и ожидал. (Я знаю, что не давал вам этот конкретный набор уравнений, но их несложно решить, если вы понимаете принцип, и я не могу привести каждое отдельное кислотно-основное уравнение. Это уже давно страница будет длиться вечно, и все в отчаянии сдадутся задолго до конца! Вот почему вы пытаетесь понять химию, а не изучать ее как попугай.) Пожалуйста, не тратьте время на изучение уравнений — или, по крайней мере, до тех пор, пока вы не узнаете и не поймете всю остальную химию, которую вам нужно знать и понимать! У любого уравнения очень мало шансов пройти экзамен, даже если оно входит в вашу конкретную программу. Жизнь слишком коротка, чтобы тратить время на изучение уравнений. Знайте, как их решить, если вам нужно. | |||||||||||||||
Оксиды серы Мы собираемся рассмотреть диоксид серы, SO 2 , и триоксид серы, SO 3 . Диоксид серы Диоксид серы хорошо растворяется в воде, реагируя с ней с образованием раствора, известного как сернистая кислота, который традиционно имеет формулу H 2 SO 3 . Однако основным веществом в растворе является просто гидратированный диоксид серы — SO 2 , xH 2 O. Спорный вопрос, существует ли вообще в растворе какой-либо H 2 SO 3 как таковой. Сернистая кислота также является слабой кислотой с pK a около 1.8 — немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты снова будет иметь pH около 1. . | |||||||||||||||
Примечание: Значения pK и , указанные для серной кислоты в различных источниках, варьируются от 1,77 до 1,92. У меня нет возможности узнать, что из этого правильно. Ионизация «серной кислоты» включает ионизацию гидратированного комплекса, и вам не нужно беспокоиться об этом на этом уровне. | |||||||||||||||
Диоксид серы также будет напрямую реагировать с основаниями, такими как раствор гидроксида натрия. Если диоксид серы барботируют через раствор гидроксида натрия, сначала образуется раствор сульфита натрия, а затем раствор гидросульфита натрия, когда диоксид серы оказывается в избытке. | |||||||||||||||
Примечание: Сульфит натрия также называют сульфатом натрия (IV).Гидросульфит натрия также является гидросульфатом натрия (IV) или бисульфитом натрия. Обратите внимание, что уравнения для этих реакций отличаются от примеров фосфора. В этом случае мы реагируем непосредственно оксид с гидроксидом натрия, потому что мы, скорее всего, будем это делать именно так. | |||||||||||||||
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (сульфата кальция (IV)).Это лежит в основе одного из методов удаления диоксида серы из дымовых газов на электростанциях. Трехокись серы Триоксид серы бурно реагирует с водой с образованием тумана из концентрированных капель серной кислоты. | |||||||||||||||
Примечание: Если вы знаете о контактном процессе производства серной кислоты, вы знаете, что триоксид серы всегда преобразуется в серную кислоту циклическим способом, чтобы избежать проблемы сернокислотного тумана. Если вам интересно, вы можете найти подробную информацию о процессе обращения в другом месте на этом сайте, но это не относится к текущей теме. | |||||||||||||||
Чистая неионизированная серная кислота имеет структуру: Серная кислота — сильная кислота, и растворы обычно имеют pH около 0. Кислота реагирует с водой, давая ион гидроксония (ион водорода в растворе, если хотите) и ион сероводорода.Эта реакция проходит практически на 100%. Второй водород удалить труднее. На самом деле ион гидросульфата является относительно слабой кислотой, по силе сходной с кислотами, которые мы уже обсуждали на этой странице. На этот раз вы получите равновесие: Серная кислота, конечно, имеет все реакции сильной кислоты, с которыми вы знакомы из вводных курсов химии. Например, нормальная реакция с раствором гидроксида натрия заключается в образовании раствора сульфата натрия, в котором оба кислых водорода реагируют с ионами гидроксида. В принципе, вы также можете получить раствор гидросульфата натрия, используя вдвое меньше гидроксида натрия и просто реагируя с одним из двух кислых водородов в кислоте. На практике лично я никогда этого не делал — на данный момент не вижу особого смысла! Сам по себе триоксид серы также вступает в непосредственную реакцию с основаниями с образованием сульфатов. Например, он будет реагировать с оксидом кальция с образованием сульфата кальция. Это похоже на реакцию с диоксидом серы, описанную выше. Оксиды хлора Хлор образует несколько оксидов, но единственными двумя, упомянутыми в любой из учебных программ уровня A Великобритании, являются оксид хлора (VII), Cl 2 O 7 , и оксид хлора (I), Cl 2 O. Хлор ( VII) оксид также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора. Оксид хлора (VII) Оксид хлора (VII) — это высший оксид хлора — хлор находится в максимальной степени окисления +7.Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой с образованием очень сильной кислоты, хлорноватой (VII) кислоты, также известной как хлорная кислота. PH типичных растворов, как и серной кислоты, будет около 0, . Неионизированная хлорная (VII) кислота имеет структуру: Вероятно, вам это не понадобится для целей UK A level (или его эквивалентов), но это полезно, если вы понимаете причину, по которой хлорная (VII) кислота является более сильной кислотой, чем хлорная (I) кислота (см. Ниже) .Вы можете применить те же рассуждения к другим кислотам на этой странице. Когда ион хлората (VII) (перхлорат-ион) образуется в результате потери иона водорода (например, когда он реагирует с водой), заряд может быть делокализован по каждому атому кислорода в ионе. Это делает его очень стабильным и означает, что хлорная (VII) кислота очень сильна. | |||||||||||||||
Примечание: Это похоже на делокализацию, которая происходит в этаноат-ионе, образующемся, когда этановая кислота ведет себя как слабая кислота.Вы найдете это более подробно на странице, посвященной органическим кислотам. Используйте кнопку НАЗАД в браузере, если вы решите перейти по этой ссылке. | |||||||||||||||
Хлорная (VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (VII). Сам оксид хлора (VII) также реагирует с раствором гидроксида натрия с образованием того же продукта. Оксид хлора (I) Оксид хлора (I) намного менее кислый, чем оксид хлора (VII).Он до некоторой степени реагирует с водой с образованием хлорноватистой (I) кислоты HOCl, также известной как хлорноватистая кислота. | |||||||||||||||
Примечание: Вы также можете найти хлорную (I) кислоту, записанную как HClO. Форма, которую я использовал, более точно отражает способ соединения атомов. | |||||||||||||||
Структура хлорноватой (I) кислоты в точности такая, как показано ее формулой HOCl. У него нет атомов кислорода с двойными связями и нет способа делокализации заряда по отрицательному иону, образовавшемуся в результате потери водорода. Это означает, что образовавшийся отрицательный ион не очень стабилен и легко восстанавливает свой водород, чтобы превратиться в кислоту. Хлорная (I) кислота очень слабая (pK a = 7,43). Хлорная (I) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия). Оксид хлора (I) также напрямую реагирует с гидроксидом натрия с образованием того же продукта. В меню «Период 3».. . В меню «Неорганическая химия». . . В главное меню. . . © Джим Кларк, 2005 г. (последнее изменение — ноябрь 2015 г.) | |||||||||||||||
Trends in Oxides Chemistry Tutorial
Сноски
1 Мы будем рассматривать только «нормальные» оксиды. Помимо нормального оксида Na 2 O, натрий также образует ионный пероксид Na 2 O 2 .
Однако следует отметить, что при сгорании натрия Na 2 O также будет реагировать с O 2 с образованием Na 2 O 2 , поэтому основным продуктом сгорания натрия является Na 2 О 2 .
2 Ограничение подачи кислорода во время горения дает низший оксид, P 4 O 6 вместо P 5 O 10
3 При сгорании фосфора в избытке кислорода образуется оксид фосфора P 4 O 10 .
4 При сгорании серы образуется диоксид серы SO 2 (г) .
Окисление SO 2 до SO 3 кислородом происходит самопроизвольно, но очень медленно:
SO 2 (г) + ½O 2 (г) → SO 3 (л)
5 Некоторые оксиды хлора склонны к взрыву: ClO 2 , Cl 2 O, Cl 2 O 3 и Cl 2 O 7 .
Похоже, они более чувствительны к удару, чем термически.
Тем не менее, ClO 2 и Cl 2 O используются в коммерческих целях в качестве отбеливающих агентов, в частности, для отбеливания бумаги и муки.
В промышленных масштабах ClO 2 получают экзотермической реакцией хлората натрия примерно в 4 моль л. -1 H 2 SO 4 , содержащего 0,05-0,25 моль л. -1 хлорид-иона с диоксидом серы:
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4
Cl 2 O можно получить обработкой свежеприготовленного желтого оксида ртути газообразным хлором или раствор хлора в четыреххлористом углероде:
2Cl 2 + 2HgO → HgCl 2 .HgO + Cl 2 O
6 Существует только одна формула оксида алюминия, Al 2 O 3 , известного как оксид алюминия, однако существует ряд полиморфов и гидратированных разновидностей.
Существует 2 формы безводного Al 2 O 3 , известные как α -Al 2 O 3 и γ -Al 2 O 3 .
α -Al 2 O 3 очень твердый и устойчивый к гидратации и воздействию кислот.
γ -Al 2 O 3 более мягкий, легко впитывает воду и растворяется в кислотах.
Существует несколько гидратированных форм оксида алюминия, включая AlO.OH и Al (OH). 3 , но их получают в щелочных растворах, а не путем взаимодействия оксида алюминия с водой.
7 Реакция протекает в холодной воде. Если используется горячая вода, образуется ряд продуктов, таких как PH 3 , фосфорная кислота и элемент P.
8 Эта реакция протекает легко, что делает P 4 O 10 хорошим осушающим агентом, но при этом образуется смесь кислот, в зависимости от количества воды и других условий.
9 Нет сомнений в том, что газообразный SO 2 растворяется в воде, но кислота H 2 SO 3 не выделяется. Тем не менее, это уравнение обычно используется для описания реакции.
10 Двуокись углерода, CO 2 , является кислым оксидом, но монооксид углерода, CO, является нейтральным оксидом.
11 Диоксид азота, NO 2 , является кислым оксидом, но оксид азота, NO, и закись азота, N 2 O, являются нейтральными оксидами.
Разница между кислотными и основными оксидами
Автор: Мадху
Ключевое различие — кислотные и основные оксиды
Оксиды — это соединения, в которых по крайней мере один атом кислорода присоединен к другому элементу. Оксиды образуются, когда определенный элемент реагирует с кислородом. Поскольку кислород обладает высокой реакционной способностью по своей природе, он реагирует с металлическими и неметаллическими элементами и образует оксиды этих элементов. Кислород поступает из воздуха или воды.Из-за высокой электроотрицательности кислород может реагировать практически со всеми элементами, кроме благородных газов. Основные типы оксидов включают кислотные оксиды, основные оксиды, амфотерные оксиды и нейтральные оксиды. Эта классификация проводится в соответствии с природой и свойствами этих оксидов. Ключевое различие между кислотными и основными оксидами состоит в том, что кислотных оксидов образуют кислоты при растворении в воде , тогда как основных оксидов образуют основания при растворении в воде.
СОДЕРЖАНИЕ
1.Обзор и основные различия
2. Что такое кислые оксиды
3. Что такое основные оксиды
4. Сравнение бок о бок — кислотные и основные оксиды
5. Резюме
Что такое кислотные оксиды?
Кислые оксиды образуются при реакции неметалла с кислородом. Кислые оксиды реагируют с водой с образованием водных кислот. Эти кислотные соединения состоят из атомов кислорода, водорода и атомов этого конкретного неметалла, связанных ковалентными связями. Эти кислотные соединения называются ангидридами кислот, поскольку они производят кислотное соединение этого оксида при растворении в воде.Например, диоксид серы называется сернистым ангидридом, а триоксид серы — серным ангидридом. Кислые оксиды могут реагировать с основанием с образованием его соли. Обычно кислотные оксиды имеют низкие температуры плавления и низкие температуры кипения, за исключением оксидов, таких как диоксид кремния, которые имеют тенденцию образовывать гигантские молекулы. Эти оксиды растворяются в основаниях и образуют соль и воду. Когда кислый оксид растворяется в воде, это снижает pH пробы воды из-за образования ионов H + .Некоторые общие примеры кислых оксидов: CO 2 , P 2 O 5 , NO 2 , SO 3 и т.д .. Следующая реакция представляет собой пример растворения кислотного оксида в воде.
SO 3 (с) + H 2 O (л) → H 2 SO 4 (водн.)
Рисунок 01: Диоксид азота при разных температурах
Что такое основные оксиды?
Основные оксиды образуются в результате реакции кислорода с металлами.Из-за разницы в электроотрицательности кислорода и металлов большинство основных оксидов имеют ионную природу. Таким образом, они имеют ионные связи между атомами. Эти оксиды активно реагируют с водой с образованием основных соединений. Эти оксиды также реагируют с кислотами и образуют соль и воду. Когда в воду добавляют основной оксид, pH воды увеличивается из-за образования гидроксильных ионов (OH — ). Некоторые примеры обычных основных оксидов: Na 2 O, CaO, MgO и т. Д. Следующий пример показывает растворение основного оксида в воде.
Na 2 O (с) + H 2 O (л) → NaOH (водн.)
Рисунок 02: Оксид магния (пример основного оксида)
В чем разница между кислотными и основными оксидами?
Кислотные и основные оксиды | |
| Кислые оксиды образуются, когда кислород реагирует с неметаллами. | Основные оксиды образуются при взаимодействии кислорода с металлами. |
| Реакция с водой | |
| Кислые оксиды реагируют с водой с образованием кислотных соединений. | Основные оксиды реагируют с водой с образованием основных соединений. |
| Реакция с кислотой | |
| Кислотные оксиды не реагируют с кислотами. | Основные оксиды реагируют с кислотами с образованием соли. |
| Реакция с основанием | |
| Кислые оксиды реагируют с основаниями с образованием соли. | Основные оксиды не реагируют с основаниями. |
| Облигации | |
| Кислые оксиды имеют ковалентные связи. | Основные оксиды имеют ионные связи. |
| Влияние на pH | |
| Когда кислые оксиды растворяются в воде, это снижает pH. | Растворение основных оксидов вызывает повышение pH. |
| Другие наименования | |
| Кислотные оксиды также известны как ангидриды кислот. | Основные оксиды также называются основными ангидридами. |
Резюме — Кислотные и основные оксиды
Оксиды — это соединения, в которых по крайней мере один атом кислорода связан с другим элементом. Этот элемент может быть металлическим или неметаллическим. В зависимости от свойств оксиды могут быть кислотными или основными. Если конкретный оксид может реагировать с кислотой, но не с основанием, он называется основным оксидом. Если оксид реагирует с основанием, но не с кислотами, это кислотный оксид. Ключевое различие между кислотными оксидами и основными оксидами заключается в том, что кислотные оксиды образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде.
Литература:
1. Дунк В., 2013. Показ слайдов. [Онлайн]
Доступно по адресу: https://www.slideshare.net/bsvab/acidic-and-basic-oxides-16541388 [дата обращения: 26 мая 2017 г.].
2. Чанг Р., 2010. химия. 10-е изд. Нью-Йорк: Макгроу-Хилл.
3. Hesthra, B., 2016. libretexts. [Онлайн] Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Descriptive_Chemistry/Main_Group_Reactions/Compounds/Oxides [доступ 26 мая 2017 г.].
Изображение предоставлено:
1. «Двуокись азота при разных температурах» Эфрамгольдберг — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
2. «Оксид магния» Валкерма. Собственная работа (на основании заявлений об авторском праве) (общественное достояние) через Commons Wikimedia
Оксид щелочного металла — обзор
26,6 Соединения металлов I и II группы
a. Оксиды и гидроксиды. За исключением оксида бериллия, ВеО, который является амфотерным, все оксиды металлов групп I и II являются сильноосновными. Все оксиды щелочных металлов активно взаимодействуют с водой с образованием гидроксидов.
M2O (s) + h3O (l) → 2MOH (водн.) (M = Li, Na, K, Rb, Cs)
Оксид бериллия практически не реагирует с водой. Оксид магния реагирует медленно и не очень энергично, но оксиды кальция, стронция и бария соединяются с водой со все большей энергией.
MO (s) + h3O (l) → M (OH) 2 (s) (M = Mg, Ca, Sr, Ba)
Гидроксиды щелочных металлов представляют собой белые водорастворимые твердые вещества. Все, кроме гидроксида лития, термически стабильны и могут плавиться и испаряться без разложения.При нагревании гидроксид лития разлагается до достижения точки кипения с образованием оксида лития и воды. Гидроксиды щелочных металлов являются гидроксидами самых основных металлов. Их водные растворы поглощают углекислый газ из воздуха с образованием карбонатов.
2MOH (водн.) + CO2 (г) → M2 (CO3) + h3O (l) (M = Li, Na, K, Rb, Cs)
Гидроксиды элементов группы II гораздо менее растворимы, чем гидроксиды щелочных металлов. металлов, растворимость увеличивается от Be (OH) 2 до Ba (OH) 2 , в соответствии с уменьшением притяжения между катионом и гидроксид-ионом в кристалле.Щелочность растворов этих гидроксидов ограничена их растворимостью.
Многие соединения щелочных и щелочноземельных металлов важны из-за их коммерческого применения. В таблице 26.7 перечислены некоторые из этих соединений. Гидроксид натрия, NaOH, занимает шестое место в списке промышленных химикатов, производимых в наибольших количествах. Его готовят промышленным способом двумя способами. В одном процессе эквивалентные количества карбоната натрия и гидроксида кальция смешиваются в виде суспензии.
ТАБЛИЦА 26.7. Некоторые коммерчески важные соединения щелочных и щелочноземельных металлов и их использование
| Общие названия даны в скобках. | |||
|---|---|---|---|
| NaOH a (щелок, каустическая сода) | Промышленное химическое производство Вискоза Целлюлозно-бумажная промышленность | ||
| Извлечение Al из руд | |||
| Удаление S из нефти | Мыло и моющие средства | ||
| Na 2 CO 3 a (кальцинированная сода) | Стекло | ||
| Промышленные химикаты | |||
| Моющие и умягчающие средства | |||
| NaHCO 3 (пищевая сода) | Пищевая промышленность | ||
| Бытовое применение | |||
| Промышленное химическое вещество | |||
| Огнетушители | |||
| Строительный раствор, гипс и цемент t | |||
| Удобрение | |||
| Щелочь промышленная | |||
| Целлюлозно-бумажная промышленность | |||
| Отбеливающий порошок | |||
| KOH | |||
| Жидкое мыло | |||
| Удобрение | |||
| Пирофосфаты тетракалия (моющие добавки) | |||
| K 2 CO 2 58 9025 3 CO 28 9025 9025 9025 CO 2 8 9025 9025 | Порох | ||
| KCl (хлористый калий) | Заменитель соли удобрения | ||
| MgO (магнезия) | Производство огнеупорной изоляционной бумаги | ||
| MgSO 4 O | Дубление кожи | ||
| Морилка | |||
| Лекарство | |||
| Удобрение |
Na2CO3 (водн.) + Ca (OH) 2 (водн.) → 2NaOH (водн.) + CaCOa (s)
После удаления осадка карбоната кальция фильтрацией, щелок упаривают, получая твердый гидроксид натрия.Во втором, более широко используемом методе электролизуют концентрированный водный раствор хлорида натрия (рассол), продукты которого представляют собой гидроксид натрия, хлор и водород (раздел 24.8).
Гидроксид калия, КОН, можно получить способами, аналогичными тем, которые описаны для соединения натрия. Например, реакция между растворами гидроксида бария и сульфата калия дает сульфат бария в виде осадка и гидроксид калия в растворе.
Ba (OH) 2 (водн.) + K2SO4 (водн.) → 2KOH (водн.) + BaSO4 (S)
Пероксид натрия, Na 2 O 2 , в частности, и супероксид калия, KO 2 , в меньшей степени — это соединения промышленного значения.Они являются мощными окислителями и отбеливателями и образуют перекись водорода при контакте с холодными растворами кислот или избытком холодной воды.
Na2O2 (т.) + 2h3O (л) → h3O2 (водн.) + 2NaOH (водн.) 2KO2 (т.) + 2h3O (л) → h3O2 (водн.) + O2 (г) + 2KOH (водн.)
Супероксид калия используется в «дыхательных» масках как быстрый источник кислорода. Такие маски используются при спасательных работах на шахтах и в других местах, где воздух настолько беден кислородом, что необходимо создавать искусственную атмосферу. Влага дыхания вступает в реакцию с оксидом, высвобождая кислород, и в то же время образующийся гидроксид калия удаляет углекислый газ при выдохе, позволяя постоянно восстанавливать атмосферу в маске.
С промышленной точки зрения, наиболее важным из оксидов металлов I и II групп является оксид кальция CaO, который широко известен как известь или негашеная известь. Это самый дешевый источник гидроксид-иона, и среди промышленных химикатов он уступает только серной кислоте по производимому количеству. Известь получают путем нагревания известняка для удаления CO 2 .
CaCO3 (s) известняк → ΔCaO (s) известь + CO2 (г)
Некоторые товарные сорта извести представляют собой смеси оксида кальция и оксида магния.Такие смеси получают путем нагревания доломитового известняка, содержащего карбонат магния, вместе с карбонатом кальция.
Гидроксид кальция, Ca (OH) 2 , продукт реакции воды с оксидом кальция, известен как гашеная известь , а насыщенный раствор гидроксида кальция (который малорастворимый) называется известковой водой . Оксид и гидроксид используются, иногда взаимозаменяемо, во многих отношениях (таблица 26.7).
Раствор представляет собой смесь Ca (OH) 2 , песка и воды.Он устанавливается, потому что Ca (OH) 2 поглощает CO 2 из воздуха.
Ca (OH) 2 (водн.) + CO2 (г) → CaCO3 (s) + h3O (г)
Образующиеся кристаллы CaCO 3 имеют тенденцию сцепляться и связывать массу вместе. Песок добавляется для придания объема и предотвращения чрезмерной усадки.
б. Карбонаты и гидрокарбонаты. Карбонаты щелочных металлов, за исключением карбоната лития, хорошо растворимы в воде, тогда как карбонаты элементов II группы (и большинство других карбонатов) практически не растворимы в воде.Водные растворы растворимых карбонатов щелочные из-за гидролиза карбонат-иона,
CO32-карбонат-ион + h3O (l) ⇌HCO3- гидрокарбонат-ион + OH-
Карбонаты металлов реагируют с сильнокислотными растворами с образованием диоксида углерода, т.е. Например,
MgCO3 (s) + 2H + → Mg2 ++ CO2 (г) + h3O (l)
Нерастворимые карбонаты переводятся в раствор водой, содержащей растворенный диоксид углерода, по следующей реакции, которая является обратной по отношению к термическому разложению. твердых гидрокарбонатов металлов:
MCO3 (s) + h3O (l) + CO2 (g) ⇄M2 ++ 2HCO3−
Подземные воды всегда содержат углекислый газ, и в такой воде растворяются известняк и доломит,
CaCO3⋅MgCO3 (s) доломит + 2h3O (l) + 2CO2 (водн.) ⇄Ca2 ++ Mg2 ++ 4HCO3−
Кальций и магний, растворенные таким образом, делают воду «жесткой» (Раздел 13.13).
Растворение карбонатных минералов в грунтовых водах имеет еще один интересный эффект — если минерал находится ниже поверхности Земли и покрыт камнями, которые не растворяются, может образоваться пещера. Подземные воды могут просочиться в пещеру через трещины в стенах или крыше. Вода содержит бикарбонаты кальция и магния, растворенные где-то в другом месте, и когда она входит в пещеру, давление на нее значительно снижается, и углекислый газ выходит из нее в обратном направлении реакции, показанной выше.Таким образом, образуются нерастворимые карбонаты кальция и магния, которые откладываются вокруг отверстия, через которое вода просачивалась в пещеру, образуя подобный сосульке отложение, называемое сталактитом . Часть бикарбоната остается в растворе, пока капли воды не упадут с кончика сталактита. Бикарбонат разлагается, когда капли падают, и образует отложение на полу пещеры, образуя еще одну «сосульку», называемую сталагмитом . Спустя много веков кончики сталактита и сталагмита встречаются, и две «сосульки» вырастают в колонну, которая, как можно было подумать, была оставлена там, чтобы поддерживать крышу пещеры.
Среди карбонатов и гидрокарбонатов групп I и II наиболее широко используются карбонат натрия и гидрокарбонат натрия. В 1938 году в Вайоминге были обнаружены очень большие месторождения относительно редкого минерала трона , Na 2 CO 3 ⋅ NaHCO 3 ⋅ 2H 2 O, и сейчас большая часть карбоната натрия производится из этого минерала. . Трону либо очищают сначала путем кристаллизации, а затем нагревают для превращения гидрокарбоната натрия в нормальный карбонат, либо сначала проводят нагревание, а затем очищают нечистый карбонат натрия.
Гидрокарбонат натрия, также известный как бикарбонат натрия или бикарбонат натрия, производится из чистого карбоната натрия
Na2CO3 (водн.) + H3O (л) + CO2 (г) → 2NaHCO3 (s)
Известен безводный карбонат натрия в торговле как кальцинированная сода (таблица 26.7). Карбонат также существует в форме ряда гидратов, наиболее распространенным из которых является декагидрат Na 2 CO 3 ⋅ 10H 2 O ( сода для стирки ). Растворы соли являются эффективными чистящими средствами из-за щелочности, возникающей в результате гидролиза карбонат-иона.Ион гидроксида отвечает за очищающее действие.
Бикарбонат натрия используется в разрыхлителях в качестве разрыхлителя, вещества, которое образует пузырьки газа в тесте. Отсюда и его общее название — пищевая сода . Кислотное вещество должно присутствовать в тесте для выделения углекислого газа в результате следующей реакции
HCO3- + H + → CO2 (г) + h3O (l)
При выделении газа тесто поднимается и продукт приобретает соответствующие свойства. легкость и фактура.Простокваша часто является источником кислоты. Некоторые рецепты требуют использования разрыхлителя. Эти порошки представляют собой смеси гидрокарбоната натрия и кислого вещества, например, квасцов натрия (сульфат натрия и алюминия), NaAl (SO 4 ) 2 ⋅ 12H 2 O; дигидрофосфат кальция, Ca (H 2 PO 4 ) 2 ; или гидротартрат калия, K (HC 4 H 4 O 6 ). Разрыхлитель «двойного действия» стал возможным благодаря покрытым кристаллам Ca (H 2 PO 4 ) 2 ; они высвобождают около половины своего иона H + во время смешивания и половину во время выпечки.
