Содержание
Способы получения кислых солей
Кислая
соль –
продукт
неполного замещения ионов водорода в
молекуле многоосновной кислоты ионами
металла: NaHS
–
гидросульфид
натрия, Ca(HCO3)2
–
гидрокарбонат
кальция.
Кислые
соли получают:
H2CO3
+ NaOH = NaHCO3
+ H2O
недостаток
СO2
+ NaOH = NaHCO3
Na2CO3
+ H2CO3
= 2 NaHCO3;
Na2CO3
+ HCl = NaHCO3
+ NaCl.
Для
перевода кислой соли в среднюю нужно
добавить раствор щелочи, чтобы связать
ион водорода, присутствующий в составе
кислой соли, гидроксогруппой в молекулу
воды:
NaHCO3
+ NaOH
= Na2CO3
+ H2O
Способы получения основных солей
Основная
соль –
продукт
неполного замещения гидроксогрупп в
молекуле многокислотного основания
кислотными остатками: MgOHCl
–
гидроксохлорид
магния, (CuOH)2SO4
–
гидроксосульфат
меди (II).
Основные
соли получают:
2Cu(OH)2
+ Задание
1= (CuOH)2SO4
Cu(OH)2
+ CuSO4
= (CuOH)2SO4
Для
перевода основной соли в среднюю нужно
подействовать раствором кислоты, для
того чтобы связать гидроксогруппу
основной соли ионами водорода кислоты
в молекулу воды:
MgOHCl
+ HCl
= MgCl2
+ H2O
Упражнения
1.
Напишите ступенчатую диссоциацию солей:
а) гидроксохлорида алюминия, б)
дигирофосфата калия, в) гидроксонитрата
висмута, г) гидроксохлорида магния, в)
гидросульфида бария.
2.
С каким из перечисленных веществ будет
реагировать сульфат меди (II):
а) серой, б) оловом, в) серебром, г)
гидроксидом бария, д) оксидом железа
(III),
е) хлоридом бария?
3.
Напишите уравнения реакций, с помощью
которых можно получить хлорид магния
исходя из следующих веществ: а) магния,
б) оксида магния, в) гидроксида магния,
г) карбоната магния, д) сульфата магния.
4.
Допишите схемы реакций получения солей
и составьте уравнения:
MgO
+ H3PO4
→
Cr2O3
+ HNO3
→
CO2
+ NaOH →
H2SO4
+ … →KHSO4
+ …
Fe2(SO4)3
+ KOH →
Cu(NO3)2
+ Mg →
Fe2(SO4)3
+ Ba(NO3)2
→
ЛАБОРАТОРНАЯ
РАБОТА
Свойства средних, кислых и основных солей
Приборы
и реактивы: 2н растворы соды, серной и
соляной кислот, гидроксидов натрия и
калия, сульфата меди, хлорида аммонии,
хлорида бария, хлорида висмута (III),
пробирки, спиртовка, индикаторная
бумага.
Опыт
1. Получение летучей кислоты из соли.
К
1 мл раствора карбоната натрия прибавить
по каплям раствор соляной или серной
кислоты. Что наблюдается? Какая кислота
Что наблюдается? Какая кислота
образуется? Написать уравнение реакции
в молекулярной и ионной формах.
Опыт
2. Получение основания из соли.
К
1 мл раствора сульфата меди прилить по
каплям раствор гидроксида натрия или
калия. Что наблюдается? Написать уравнение
реакции в молекулярной и ионной формах.
Опыт
3. Получение летучего основания из соли.
К
1 мл раствора хлорида аммония прилить
0,5 мл раствора гидроксида натрия и
содержимое пробирки нагреть. Над
пробиркой держать полоску индикаторной
бумаги, смоченной дистиллированной
водой. Что наблюдается? Написать уравнение
реакции в молекулярной и ионной формах.
Опыт
4. Взаимодействие солей.
К
1 мл раствора хлорида бария прилить 1 мл
раствора сульфата натрия. Что наблюдается?
Написать уравнение реакции в молекулярной
и ионной формах.
Опыт
5. Получение основной соли висмута (III).
К
1 мл раствора хлорида висмута добавить
3 – 4 мл воды. Образуется белый осадок
основной соли висмута (гидроксохлорида
висмута). К образовавшемуся осадку
прилить несколько капель соляной
кислоты. Что наблюдается? Написать
уравнения реакций в молекулярной и
ионной формах.
Гидроксиды, оксиды, соли | Задачи 165
Задача 165.
Какие из указанных гидроксидов могут образовать основные соли: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
Решение:
а) Гидроксид меди (II) Cu(OH)2 – двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксомеди (II) или хлорид гидроксомеди (II), например:
б) Гидроксид кальция Ca(OH)2 — двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксокальция или хлорид гидроксокальция, например:
в) Гидроксид лития LiOH — однокислотный гидроксид, поэтому не может образовывать основные соли.
г) Гидроксид алюминия Al(OH)3 – трёхкислотный гидроксид, поэтому может образовывыть одноосновные и двухосновные соли, например:
д) Гидроксид калия KOH — однокислотный гидроксид, поэтому основные соли не образует.
Ответ: а), б), г).2
Задача 166.
Ангидридом какой кислоты является Р2О5: а) фосфористой; б) двуфосфорной; в) ортофосфорной?
Решение:
Оксид фосфора Р2О5 является ангидридом ортофосфорной кислоты Н3РО4 и двуфосфорной кислоты Н4Р2О7. При взаимодействии с водой оксид фосфора (V) образует ортофосфорную и полифосфоные кислоты (в кристаллическом состоянии выделена только простейшая двуфосфорная кислота):
Р2О5 + 3H2O = 2H3PO4;
Р2О5 + 2H2O = 2Н4Р2О7.
Структурная формула ортофосфорной кислоты H3PO4:
Структурная формула двуфосфорной кислоты Н4Р2О7:
Таким образом, двуфосфорная кислота представляет собой продукт соединения двух тетраэдров РО4-.
Ангидридом фосфористой кислоты H3PO3 является оксид фосфора (III) Р2О3, который под действием холодной воды медленно взаимодействует с ней, образуя кислоту:
Р2О3 + 3H2O = 2H3PO3
Ответ: а; б.
Задача 167.
Ангидридом какой кислоты можно считать С12О7: а) хлорной; б) хлорноватой; в) хлорноватистой?
Решение:
а) Оксид хлора (VII) С12О7 можно считать ангидридом хлорной кислоты HClO4, потому что если нагреть хлорную кислоту в присутствии Р2О5, отнимающим воду, то образуется оксид хлора (VII):
2HClO4 + P2O5 + 2H2O = 2H3PO4 + Cl2O7
Оксид хлора (VII) С12О7 c водой не смешивается, их взаимодействие происходит на границе раздела фаз, при этом образуется хлорная кислота:
С12О7 + H2O = 2HClO4
В соединениях С12О7 и HClO4 атом хлора находится в своей степени окисления +7.
б) Ангидрид хлорноватой кислоты HClO3 не известен. При действии концентрированной серной кислоты на соль хлорноватой кислоты KClO3 вместо него выделяется жёлто-бурый газ с характерным запахом – оксид хлора (IV) ClO2.
в) Ангидридом хлорноватистой кислоты HOCl можно считать оксид хлора (I) Cl2O, потому что в водных растворах кислоты устанавливается два равновесия:
HOCl ⇔ H+ + OCl—;
2HOCl ⇔ Cl2O + H2O
Ответ: а).
Задача 168.
Какие из приведенных соединений относятся к пероксидам а) NO2; б) K2O2; в) BaO2; г) MnO2?
Решение:
Пероксидами или перекисями называются соли перекиси водорода Н2О2. Пероксиды состоят из положительно заряжённых ионов металла и отрицательно заряжённых ионов. Степень окисления кислорода в пероксидах равна -1.
Степень окисления кислорода в пероксидах равна -1.
а) NO2 – оксид азота (IV). Степень окисления кислорода в данном соединении равна -1, а азота – равна +4. Значит, NO2 – не пероксид.
б) К2О2 – пероксид калия. Степень окисления калия всегда равна +1, значит, степень окисления кислорода в этом соединении будет равна -1. Таким образом, К2О2 – пероксид.
в) ВаО2 – пероксид бария. Степень окисления бария в соединениях всегда равна +2, значит, степень окисления кислорода в данном соединении равна -1. Таким образом, ВаО2 – пероксид.
г) MnO2 – оксид марганца (IV). Степень окисления атома марганца равна +4, а степень окисления кислорода в данном соединении равна -2, значит, MnO2 – оксид.
Ответ: б), в).
Задача 169.
В реакции нейтрализации гидроксида калия ортомышьяковой кислотой эквивалентная масса последней оказалась равной 142 г/моль. Какая соль при этом образовалась: а) ортоарсенат калия; б) гидроортоарсенат калия; в) дигидроортоарсенат калия?
Какая соль при этом образовалась: а) ортоарсенат калия; б) гидроортоарсенат калия; в) дигидроортоарсенат калия?
Решение:
Мольная масса ортомышьяковой кислоты равнв 142г/моль.
Уравнения реакций образования :
В реакции а) три иона H+ замещаются на K+ , т.е, N(H+) = 3. Следовательно, согласно формуле fэкв(кислоты) = 1/N(H+) фактор эквивалентности ортомышьяковой кислоты в реакции а) будет равен fэкв(H3AsO4) = 1/N(H+) = 1/3. В реакции б) два иона H+ замещаются на K+, т.е, N(H+) =2 и fэкв(H3AsO4) = 1/N(H+) = 1/2. В реакции в) один ион H+ замещаются на ион К+, т.е, N(H+) = 1 и fэкв(H3AsO4) = 1/N(H+) = 1/1. Теперь рассчитаем молярную массу эквивалента H3AsO4 (в г/моль) — произведение фактора эквивалентности на молярную массу этого вещества по формуле:
M(fэквВ) = fэкв(В) . М(В)
М(В)
Или для H3AsO4:
M(fэквH3AsO4) = fэкв(H3AsO4) . М(H3AsO4)
Тогда
Так как по условию задачи эквивалентная масса кислоты равна 142г/моль, что соответствует реакции в), то образовалась соль – дигидроортоарсенат калия.
Ответ: в).
Задача 170.
Какая формула соответствует марганцовистой кислоте а) НМnО4; б) H4MnO4; в) Н2MnO4?
Решение:
Марганцовистая кислота Н2MnO4 — гидроксид марганца (VI) – гидроксид марганца(VI) – неустойчивое соединение, которое уже в водном растворе диссоциирует до марганцовой кислоты НМnО4 и оксида марганца (IV) MnO2, который при растворении в воде образует гидроксид марганца (IV) h5MnO4 или Mn(OH)4:
Марганцовистой кислоте соответствует ангидрид MnO3, который в свободном виде не получен. Соли марганцовистой кислоты называются манганатами, например K2MnO4. Манганаты в водных растворах имеют зеленную окраску, которую им придают манганат-ионы MnO42-. Степень окисления атома марганца в Н2MnO4 равна +6.
Соли марганцовистой кислоты называются манганатами, например K2MnO4. Манганаты в водных растворах имеют зеленную окраску, которую им придают манганат-ионы MnO42-. Степень окисления атома марганца в Н2MnO4 равна +6.
Ответ: в).
Задача 171.
Какая из формул соответствует хлорату бария: а) ВаСI2; б)Ba(OCl)2; в) Ва(ClO3)2; г) Ва(СIО2)2?
Решение:
Хлораты – соли хлорноватой кислоты HCO3. Ион ClO3— называется хлорат-ион.
а) ВаСI2 – хлорид бария – соль соляной кислоты HCl, её соли называются хлоридами.
б) Ba(OCl)2 – гипохлорит бария — соль хлорноватистой кислоты HlO, её соли называются гиипохлоритами.
в) Ва(ClO3)2 – хлорат бария – соль хлорноватой кислоты HClO3.
г) Ва(СIО2)2 – хлорит бария – соль хлористой кислоты HClO2, её соли называются хлоритами.
Ответ: в).
Задача 172.
Какое название соответствует соли (CuOH)2CO3: а) гидрокарбонат меди; б) карбонат гидроксомеди (II) в) карбонат дигидроксомеди (II)?
Решение:
а) Гидрокарбонат меди Cu(HCO3)2 – кислая соль угольной кислоты H2CO3, в которорй один атом водорода замещён на ион меди Cu2+ . Ион HCO3— называется гидрокарбонат-ион, поэтому соли угольной кислоты, в которой один атом водорода замещён на атом металла, называют гидрокарбонаты.
б) Основная соль образуются при неполном замещении гидроксогрупп основания на кислотный остаток. Основная соль может быть образована металлом, валентность которого равна двум или больше в тех случаях, когда для реакции взято в избытке основание, например:
2Cu(OH)2 + Na2CO3 = (CuOH)2CO3 + 2NaOH
Следовательно, (CuOH)2CO3 — основная соль гидроксида меди (II) Cu(OH)2, в молекуле которого одна гидроксильная группа замещена на кислотный остаток угольной кислоты карбонат-ион CO32-.
в) Гидроксид меди (II) Cu(OH)2 — двухкислотное основание, поэтому может образовывать только один вид основных солей, в молекулах которых одна гидроксогруппа замещена на кислотный остаток, например CuOHCl или (CuOH)2CO3. Следовательно, соль карбонат дигидроксомеди (II) не существует.
Ответ: б).
Задача 173.
Какая соль образуется при взаимодействии 1 моля гидроксида цинка и 2 молей ортофосфорной кислоты: а) ортофосфат цинка; б) дигидроортофосфат цинка; в) ортофосфат гидроксоцинка; г) гидроортофосфат цинка?
Решение:
а) Уравнение реакции получения ортофосфата цинка:
3Zn(OH)2 + 2H3PO4 = Zn3(PO4)2 + 6H2O
б) Уравнение реакции получения дигидроортофосфата цинка:
Zn(OH)2 + 2H3PO4 = Zn3(PO4)2 + 2H2O
в) Уравнение реакции получения ортофосфата гидроксоцинка:
3Zn(OH)2 + H3PO4 = (ZnOH)3PO4 + 3H2O
г) Уравнение реакции получения гидроортофосфата цинка:
Zn(OH)2 + 2H3PO4 = ZnHPO4 + 2H2O
Таким образом, из 1 моля гидроксида цинка и 2 молей орптофосфорной кислоты образуется 1 моль дигидроортофосфата цинка.
Ответ: б).
Задача 174.
Какое взаимодействие приведет к получению нормальной соли из хлорида гидроксомагния: a) MgOHCl + NaOH; б) MgOHClO3 + NaOH; в) MgOHClO3 + HCl; г) MgOHCl + HCl?
Решение:
а) В водных растворах MgOHCl и NaOH как сильные электролиты распадаются на ионы:
MgOHCl ⇔ Mg2+ + OH— + Cl—
NaOH ⇔ Na+ + OH—
Ионы Mg2+, OH—, Cl— и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
б) В водных растворах MgOHClO3 и NaOH как сильные электролиты распадаются на ионы:
MgOHClO3 ⇔ Mg2+ + OH— + ClO3—
NaOH⇔( Na+ + OH—
Ионы Mg2+, OH-, ClO3- и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
в) В водных растворах MgOHCjO3 и HCl как сильные электролиты распадаются на ионы:
MgOHClO3 ⇔ Mg2+ + OH— + ClO3—
HCl ⇔ H+ + Cl—
Из находящихся в растворе ионов Mg2+, OH—, ClO3—, Cl—, H+ ионы OH— и ионы H+ связываются друг с другом с образованием слабого электролита воды HOH, поэтому реакция протекает, и при этом образуются две соли: хлорид магния MgCl2 и хлорат магния Mg(ClO3)2:
2MgOHClO3 + 2HCl ⇔ Mg(ClO3)2 + MgCl2 + 2H2O
г) В водных растворах MgOHCl и HCl как сильные электролиты распадаются на ионы:
MgOHCl ⇔ Mg2+ + OH— + Cl—
HCl ⇔ H+ + Cl—
Из находящихся в растворе ионов Mg2+, OH—, Cl—, H+ ионы H+ и ионы OH— связываются друг с другом с образованием слабого электролита воды HOH, поэтому реакции протекает, и при этом образуется соль хлорид магния:
MgOHCl + HCl ⇔ MgCl2 + H2O
Ответ: в), г).
Основные соли, Средние соли гидролиз
Сероводородная кислота может реагировать с основаниями, основными окислами или солями, образуя два ряда солей средние — сульфиды, кислые — бисуль фиды (или гидросульфиды). Большинство сульфидов (за исключением сульфидов щелочных и щелочноземельных металлов, а также сульфида аммония) плохо растворимо в воде. Сульфиды, как соли очень слабой кислоты подвергаются гидролизу. Например, сульфид натрия очень сильно гидролизуется, давая щелочной раствор (см. 6, гл. VH). [c.294]
Основные соли обычно не образуются при частичной нейтрализации малорастворимых оснований (вместо этого происходит частичное растворение основания с образованием средней соли). Образование основных солей нехарактерно для сильных оснований. Обе указанные реакции, ведущие к образованию основных солей, связаны со смещением равновесия процессов гидролиза. [c. 256]
256]
Напомним, что основными солями называются соединения, содержащие, кроме ионов металла и кислотного остатка (характерны.ч для средних солей), также гидроксильные группы, характеризующие основания. Обычно основные соли образуются при гидролизе средних солей, например МеС1,- Н,0 ii MgOH l+H l. Подробнее см. 43. [c.94]
Кислые и основные соли могут образоваться также при гидролизе средних солей. [c.47]
Рассмотрим сначала гидролиз средней соли — фосфата натрия. Первая (основная) ступень гидролиза выражается следующими уравнениями [c.403]
Ржавление черных металлов, находящихся в контакте со смазочными маслами, может вызываться какими-либо компонентами, присутствующими в масле или образованными в нем в процессе работы, или же некоторыми загрязняющими примесями, чаще всего во Ьй. Иллюстрацией к первому случаю служит образование соляной кислоты в результате гидролиза хлорированного соединения. Что же касается воды, то она попадает в картер редуктора чаще всего в результате конденсации на холодных стенках корпуса влажного воздуха. Ржавление металла можно предотвратить независимо от причин, его вызывающих, вводя в редукторные масла специальные присадки, так называемые ингибиторы ржавления. Характерными ингибиторами ржавления являются полярные поверхностноактивные соединения, действие которых основано на обволакивании поверхностей черных металлов защитными водоотталкивающими пленками. Подобным эффектом обладают часто применяемые сульфонаты бария, кальция или натрия в концентрации 0,1—2,0%. Эти соединения можно получать как из нефтяных, так и из синтетических сульфоновых кислот молекулярного веса 300—500. Сульфонаты металлов могут быть получены в виде основных или средних солей. Первые наиболее желательны в тех случаях, когда кислые продукты образуются в масле в процессе эксплуатации. Сульфонаты металлов обладают высокой вязкостью и поэтому их в большинстве случаев удобнее поставлять в виде 50%-ного раствора в очищенном светлом масле. В некоторых маслах сульфонаты выполняют двойную функцию, т. е. действуют в качестве диспергирующего агента и ингибитора ржавления.
Ржавление металла можно предотвратить независимо от причин, его вызывающих, вводя в редукторные масла специальные присадки, так называемые ингибиторы ржавления. Характерными ингибиторами ржавления являются полярные поверхностноактивные соединения, действие которых основано на обволакивании поверхностей черных металлов защитными водоотталкивающими пленками. Подобным эффектом обладают часто применяемые сульфонаты бария, кальция или натрия в концентрации 0,1—2,0%. Эти соединения можно получать как из нефтяных, так и из синтетических сульфоновых кислот молекулярного веса 300—500. Сульфонаты металлов могут быть получены в виде основных или средних солей. Первые наиболее желательны в тех случаях, когда кислые продукты образуются в масле в процессе эксплуатации. Сульфонаты металлов обладают высокой вязкостью и поэтому их в большинстве случаев удобнее поставлять в виде 50%-ного раствора в очищенном светлом масле. В некоторых маслах сульфонаты выполняют двойную функцию, т. е. действуют в качестве диспергирующего агента и ингибитора ржавления. [c.98]
[c.98]
Получение мыл щелочных и щелочноземельных металлов не представляет больших трудностей, получаются при этом средние соли. В случае поливалентных металлов (алюминий, свинец и др.) получаются преимущественно смеси средних и основных мыл. Для предотвращения гидролиза реакцию омыления целесообразно проводить в неводных средах. С целью получения натриевых и литиевых мыл (стеаратов металла) исходную кислоту нейтрализуют снир- вода товым (водньсм) раствором щелочи в лабо-раторном приборе (рис. 91). Теоретически необходимое количество щелочи рассчитывают по уравнению [c.257]
Определение, согласно которому кислые и основные соли отличаются от средних тем, что в их растворах наряду с катионами металла (или анионами кислоты) имеются также ионы водорода (гидроксильные ионы), не учитывает процессов гидролиза многих средних солей. [c.246]
Поскольку основные соли обычно менее растворимы, чем средние соли сильных кислот, равновесие гидролиза и осаждения будет смещаться, приводя к получению средних солей. [c.257]
Водный раствор средней соли, образованной слабым основанием и сильной кислотой, имеет кислую реакцию. Если основание одноатомно, то при гидролизе соли образуется именно оно, а если многоатомно — то продуктом гидролиза будет основная соль. В первом случае направляющая реакция идет в сторону образования слабого электролита — основания, а во втором — основного иона. [c.188]
Азотнокислый основной висмут можно получить путем гидролиза средней соли [c.81]
Раствор основной соли сульфата алюминия можно также приготовить обработкой раствора соли среднего сульфата аммиаком. В работе [в] изучена кинетика гидролиза А1(Ш) в растворах при добавлении аммиака до pH н-7 при температуре 30-70°С. Установлено, что взаимодействие А1(Ш) с ОН -ионами протекает в три стадии [c.3]
Степень окисления иона оказывает существенное влияние на его химические свойства. Чем выше степень окисления, тем сильнее проявляются кислотные и ослабляются основные свойства элемента и тем больше степень гидролиза его солей. Например, pH растворов солей Fe составляет 5—6, а солей Fe + — около двух. Гидроксид сурьмы (III) обладает амфотерными свойствами, а сурьмы(V)—кислотными гидроксид хрома (III) имеет амфотерные свойства, а ион СгО , где хром имеет степень окисления -4-6, является анионом кислоты средней силы и т. д. [c.17]
Например, pH растворов солей Fe составляет 5—6, а солей Fe + — около двух. Гидроксид сурьмы (III) обладает амфотерными свойствами, а сурьмы(V)—кислотными гидроксид хрома (III) имеет амфотерные свойства, а ион СгО , где хром имеет степень окисления -4-6, является анионом кислоты средней силы и т. д. [c.17]
Прямое титрование бериллия щелочью [375] производят в горячем растворе с фенолфталеином в качестве индикатора. Метод дает заниженные результаты. Так, Блейер и Морман [375] при определении 18—120 мг бериллия получали в среднем на 1,1% бериллия меньше теоретического. Кроме того, при определении бериллия в растворах сульфатов в результате гидролиза образуются основные соли переменного состава, которые практически не удается перевести в гидроокись. Поэто.му Бриттон [376] рекомендует переводить сульфат в хлорид, вводя в раствор избыток хлорида бария. Раствор хлорида затем нагревают до кипения, и выделяющуюся кислоту оттитровывают щелочью. Метод применим до содержания Ве 2 мг в 100 мл раствора. Определению мешают все катионы, кроме щелочных и щелоч ю-земельных. Мешают также ионы аммония при титровании [c.59]
Определению мешают все катионы, кроме щелочных и щелоч ю-земельных. Мешают также ионы аммония при титровании [c.59]
Карбонат-ион является анионом угольной кислоты, которая принадлежит к числу слабых кислот Ki = = 4,5-10 , /(2=4,8-10- ). Карбонаты щелочных металлов в водных растворах, подвергаясь сильному гидролизу, имеют высокое значение pH (8,5—12,0). Из средних солей растворимы в воде только соли калия, натрия и аммония. Остальные катионы образуют с СО3- нерастворимые средние и основные соли. Катионы в степени окисления — -3 и выше, как правило, с карбонатами щелочных металлов образуют гидроксиды А1(0Н)з, Ре(ОН)з и др. [c.268]
Чтобы избежать мути, к раствору соли добавляют свободную кислоту, тогда реакция гидролиза ослабляется, так как кислота реагирует с основной солью, образуя среднюю соль. Например [c.356]
Соли «слабых кислот осаждают ряд катионов третьей группы не в виде нормальных (средних) солей, а в виде основных солей или даже гидратов окисей. Например, нормальные карбонаты катионов третьей группы, за исключением Мп++ и N1+ +, в растворах не образуются, так как все они в той или иной степени подвергаются гидролизу. При действии Ма СОз или К СОд на растворы солей кобальта или цинка, в зависимости от условий (концентрация соли и температура раствора), получаются основные соли, имеющие переменный состав. [c.187]
Например, нормальные карбонаты катионов третьей группы, за исключением Мп++ и N1+ +, в растворах не образуются, так как все они в той или иной степени подвергаются гидролизу. При действии Ма СОз или К СОд на растворы солей кобальта или цинка, в зависимости от условий (концентрация соли и температура раствора), получаются основные соли, имеющие переменный состав. [c.187]
Объясните, почему первая и вторая соль не подвергаются гидролизу При составлении уравнений гидролиза следует учесть, что А1С1з переходит в основную соль, а ЫзаСОз — в кислую. Ответьте, какие средние соли при гидролизе образуют основные соли и какие — кислые Почему в уравнениях гидролиза двух последних солей следует ставить вместо знака равенства знак обратимости [c.91]
Напомним, что основными солями называются соли, содержащие кроме металла и кислотного остатка, характерных для средних солей, также гидроксильные группы, характеризующие основания. Обычно основные соли обра-ауются в результате гидролиза средних солей, например [c. 62]
62]
Для второй точки эквивалентности, т. е. для средней соли двуосновной кислоты (или двукислотного основания), вычисления ведут по первой ступени гидролиза, пренебрегая следующими (например, для N32003 гидролиз происходит в основном по первой ступени до иона [c.110]
В инженерной практике следует помнить, что растворы средних солей далеко не всегда имеют нейтральную реакцию и pH может быть больше или меньше 7 а это определяет агрессивность среды при коррозионных процессах. Кроме того, для создания оптически прозрачных растворов некоторых солей, например uSO , следует подавлять обратимую реакцию гидролиза добавлением кислоты, так как основные соли, а тем более гидроксиды металлов трудно растворимы и будут создавать рассеяние света. [c.215]
В некоторых случаях степень гидролиза многозарядных катионов в разбавленных растворах оказывается настолько высокой, что образуются малорастворимые гидроксосоединения. Например, при разбавлении концентрированных растворов солей Bi начинают выпадать в осадок продукты гидролиза — смесь основных солей, содержащих группы BiOH + или Bi(0H>2, и гидратированного оксида BijOj ХН2О. В случае многоосновных кислот из-за гидролиза часто осаждаются не средние, а кислые соли, например [c.196]
В случае многоосновных кислот из-за гидролиза часто осаждаются не средние, а кислые соли, например [c.196]
Иногда ионы AP и Fe удаляют из раствора действием ацетата натрия Na Ha OO. При этом в осадок выпадают не средние, а основные соли, также образующиеся в результате гидролиза [c.54]
Твердый основной хлорид алюминия получают периодическим нагреванием и охлаждением водного раствора А1С1з (пат. 49—43478 Япония). При охлаждении горячего раствора до 70 °С отделяют избыток средней соли. При О °С образуются затравочные кристаллы, на которых при 30—40 °С кристаллизуется продукт состава А1з(0Н)5С14-пН20 п = = 9- 11). Кипячением растворов хлорида алюминия в течение 2—4 ч в сосуде с обратным холодильником и последующей сушкой распылением получают основные хлориды алюминия, растворимые в спиртах. Содержание воды в продукте составляет 18—20 %, отношение А1/С1 изменяется в пределах от 1/2 до 2/1 (пат. 3904741 США). Процесс получения основных хлоридов алюминия можно представить как направленный гидролиз по реакциям [c. 93]
93]
В кислых растворах с избытком алюминия наиболее устойчивой твердой фазой является основной фосфат алюминия. Если значение pH больше, чем pH, соответствующее минимуму растворимости фосфата (pH = 6), то основная соль гидролизуется до гидроксида алюминия, на поверхности которого сорбируется фосфат. При большой концентрации фосфата выделяется в осадок таранакит, который переходит в среднюю соль, если pH системы возрастает. [c.63]
Гидролиз всегда сопровождается изменением активности ионов Н . По этой причине растворы многих средних солей имеют кислую или щелочную реакцию. Например, раствор хлористого аммония в воде имеет явно кислую реакцию, а раствор соды КагСОз— щелочную. Изменение активности ионов Н» при растворении соли в воде может быть обнаружено проще всего с помощью кислотно-основных индикаторов. [c.121]
Вторую порцию дестиллята нейтрализуют 20% раствором соды, избегая ее избытка (проба на лак.мус), и прибавляют немного раствора хлорного железа. Образуется хорошо растворимая средняя соль уксуснокислого железа. Раствор нагревают до кипения. Вследствие гидролиза выпадает коричнево-красный осадок основной соли уксуснокислого железа. [c.62]
Образуется хорошо растворимая средняя соль уксуснокислого железа. Раствор нагревают до кипения. Вследствие гидролиза выпадает коричнево-красный осадок основной соли уксуснокислого железа. [c.62]
Напомним, что основными солями называются соединения, содержащие кроме ионов металла и кислотного остатка гидроксильные группы. Обычно основные соли образуются при гидролизе средних солей, например Mg U -Ь Н2О з ч MgOH l + НС1 (подробнее см. в 47). [c.122]
Как было показано выше, гидролиз средних солей многоосновных кислот приводит к образованию анионов кислых солей. Подобно этому, при гидролизе средних солей многокислотных оснований образуются катионы основных солей, в состав которых входят ионы металла и гидроксила. Например, в анализе катионов I аналитической группы при выпаривании раствора Mg b один из С1 -ионов этой соли замещается ОН -ионом воды и образуется основная соль MgOH l [c.232]
Повидимому, все средние гидратные соли окиси железа бесцветны, а тот бурый цвет, который свойствен их растворам, надо думать, принадлежит основным солям окиси, которые могут (вместе со свободною кислотою) происходить из средней соли при действии воды (гидролиз) например, Fe-X -f-+ №0 = Fe OX + 2НХ.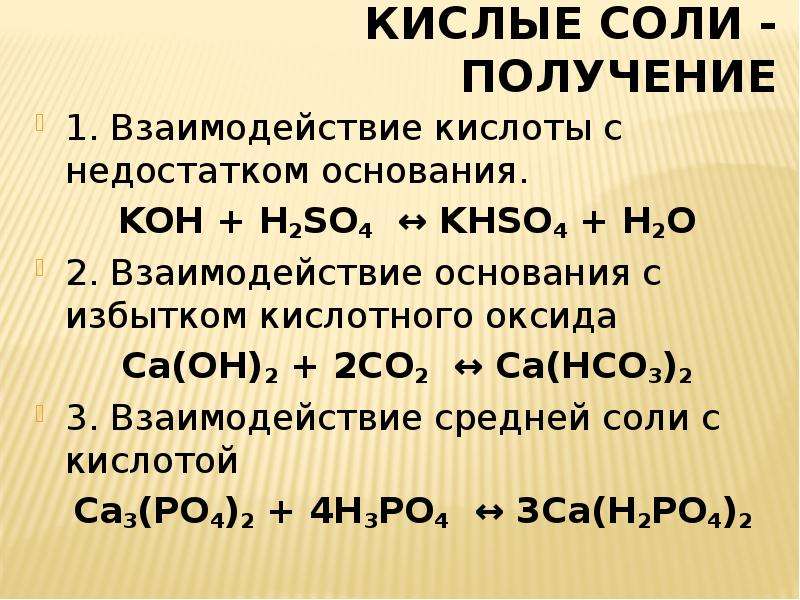 Замечательный пример изменения цвета солей представляют щавеАев[окисл]ые соли закиси и окиси железа. Первая из них в сухом виде желтого цвета, хотя обыкновенно соли закиси зеленого цвета, а соль окиси бесцветна или слабо-зеленовата. Когда средняя соль окиси растворяется в воде, то она, как многие соли, вероятно, разлагается водою на кислоту и основную соль, и эта последняя дает раствор бурого цвета. Железные квасцы почти бесцветны, водою легко разлагаются и служат лучшим доказательством указанного предположения. Параллельное изучение явлений, свойственных растворам солей Fe O и r-0 могло бы, по моему мнению, быть весьма полезным приобретением для истории водных рас- [c.596]
Замечательный пример изменения цвета солей представляют щавеАев[окисл]ые соли закиси и окиси железа. Первая из них в сухом виде желтого цвета, хотя обыкновенно соли закиси зеленого цвета, а соль окиси бесцветна или слабо-зеленовата. Когда средняя соль окиси растворяется в воде, то она, как многие соли, вероятно, разлагается водою на кислоту и основную соль, и эта последняя дает раствор бурого цвета. Железные квасцы почти бесцветны, водою легко разлагаются и служат лучшим доказательством указанного предположения. Параллельное изучение явлений, свойственных растворам солей Fe O и r-0 могло бы, по моему мнению, быть весьма полезным приобретением для истории водных рас- [c.596]
Для второй точки эквивалентности, т. е. для средней соли двуосновной кислоты (или двукислотного основания), вычисления ведут по первой ступени гидролиза, пренебрегая следующими (например, для ЫагСОз гидролиз происходит в основном по первой ступени до иона H O ), и pH вычисляется по второй константе диссоциации.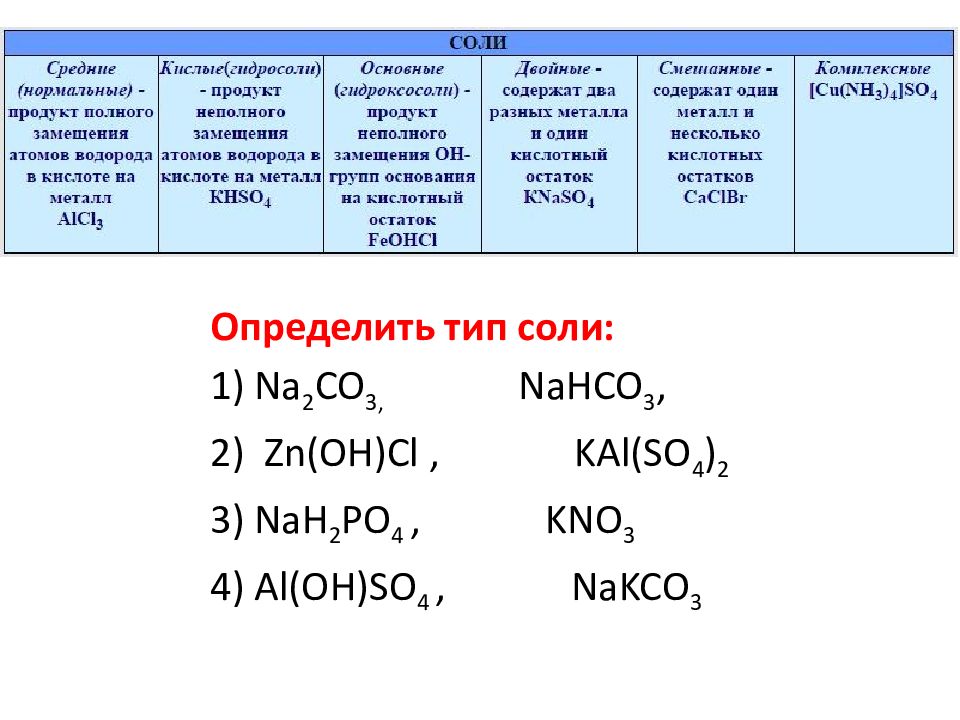 [c.97]
[c.97]
Если средние соли сильных кислот и трехвалентных оснований вследствие сильного гидролиза превращаются в основные, то они также нерастворимы в воде и их, подобно двух- и вышевалентным основаниям, приходится растворять в кислоте. Таковы, например, хлорокиси сурьмы и висмута. [c.213]
Y лоду среднюю уксуснокислую соль Ее(С2Нз02)д, что сказывает- ся в изменении окраски раствора в красно-бурую. Если раствор разбавить водой и прокипятить, то гидролиз Ре(С2Нз02)з усиливается и выпадает бурый осадок основной соли [c.136]
Основная коричнокислая соль бериллия и средние соли редкоземельных элементов и иттрия имеют постоянный состав, практически не подвержены гидролизу при пр01мьгвании, не меняют своего состава при высушивании при 110—120° С и могут служить удобной весовой формой для онределения этих элементов [30, 36]. [c.11]
ОСНОВНАЯ СОЛЬ — это… Что такое ОСНОВНАЯ СОЛЬ?
- ОСНОВНАЯ СОЛЬ
ОСНОВНАЯ СОЛЬ, соль основания, у которого один или несколько ионов оксида либо гидроксида (но не все) замещены другими отрицательными ионами.
 Основной солью, например, является гидроксинитрат свинца Pb(OH)NO3.
Основной солью, например, является гидроксинитрат свинца Pb(OH)NO3.
Научно-технический энциклопедический словарь.
- ОСНОВНАЯ ЕДИНИЦА ИЗМЕРЕНИЯ
- ОСНОВНОЕ СОСТОЯНИЕ
Смотреть что такое «ОСНОВНАЯ СОЛЬ» в других словарях:
Соль — получить на Академике действующий промокод Косметика Проф или выгодно соль купить со скидкой на распродаже в Косметика Проф
основная соль — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN basic salt … Справочник технического переводчика
основная соль — bazinė druska statusas T sritis chemija apibrėžtis Druska, turinti OH⁻ jonų. atitikmenys: angl. alkaline salt; basic salt rus. основная соль … Chemijos terminų aiškinamasis žodynas
СОЛЬ — 1.
 СОЛЬ1, соли, мн. соли, солей, жен. 1. Химическое соединение, вещество, представляющее собою продукт полного или частичного замещения водорода кислоты металлом (хим.). Основные соли. Двойные соли. Отложение солей в суставах (при подагре).… … Толковый словарь Ушакова
СОЛЬ1, соли, мн. соли, солей, жен. 1. Химическое соединение, вещество, представляющее собою продукт полного или частичного замещения водорода кислоты металлом (хим.). Основные соли. Двойные соли. Отложение солей в суставах (при подагре).… … Толковый словарь УшаковаСОЛЬ — 1. СОЛЬ1, соли, мн. соли, солей, жен. 1. Химическое соединение, вещество, представляющее собою продукт полного или частичного замещения водорода кислоты металлом (хим.). Основные соли. Двойные соли. Отложение солей в суставах (при подагре).… … Толковый словарь Ушакова
СОЛЬ — 1. СОЛЬ1, соли, мн. соли, солей, жен. 1. Химическое соединение, вещество, представляющее собою продукт полного или частичного замещения водорода кислоты металлом (хим.). Основные соли. Двойные соли. Отложение солей в суставах (при подагре).… … Толковый словарь Ушакова
Соль де Америка — (Асунсьон) Прозвища el Danzarín Основан 1909 Стадион Луис Альфонсо Джаньи, Вилья Элиса … Википедия
СОЛЬ — (ит.
 ). См. Sol. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. СОЛЬ Перуанская золотая монета и основная монетная единица = 5 франкам. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
). См. Sol. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. СОЛЬ Перуанская золотая монета и основная монетная единица = 5 франкам. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языкаСоль (криптография) — У этого термина существуют и другие значения, см. Соль (значения). В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Соль (хим.) — С. называется огромное количество химических соединений, имеющих определенную химическую функцию, отличающую их от других классов соединений, напр. кислот, оснований, спиртов и пр. С. в настоящее время определяется как кислота (см.), в которой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Соль (хим.) — С. называется огромное количество химических соединений, имеющих определенную химическую функцию, отличающую их от других классов соединений, напр.
 кислот, оснований, спиртов и пр. С. в настоящее время определяется как кислота (см.), в которой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
кислот, оснований, спиртов и пр. С. в настоящее время определяется как кислота (см.), в которой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Реакции ионного обмена — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Реакции ионного обмена – наиболее знакомая для большинства людей тема из курса химии. H2O, H2SO4, C2H5OH и то, что реакция идет, если выделяется газ, осадок или вода – вот «багаж знаний», которым обладает среднестатистический выпускник.
На самом деле все, конечно, несколько сложнее. Рассмотрим вопрос подробнее.
Реакции обмена – это процессы вида AB + CD → AD + CB, в которых участвуют оксиды и гидроксиды, обладающие кислотными или основными свойствами (амфотерные соединения могут выступать как в роли кислоты, так и в роди основания), а так же соли.
1) Взаимодействие основного или амфотерного (оксида или гидроксида) с кислотным называется реакцией нейтрализации. Но не каждая пара кислота + основание вступают в реакцию друг с другом.
Но не каждая пара кислота + основание вступают в реакцию друг с другом.
а) Растворимые гидроксиды – щелочи и гидроксид аммония – взаимодействуют с любой кислотой и кислотным оксидом. Для нерастворимой кремниевой кислоты реакция возможна только при нагревании.
NaOH + HCl → NaCl + H2O
LiOH + CH3COOH → CH3COOLi + H2O
Ba(OH)2 + CO2 → BaCO3↓ + H2O .
Также щелочи взаимодействуют с амфотерными оксидами и гидрокидами с образованием комплексных солей (в растворе) и смешанных оксидов, которые можно отнести и к классу солей (при сплавлении):
б) Нерастворимые основания и амфотерные гидроксиды не взаимодействуют со слабыми кислотами. Правило, действующее в большинстве случаев: реакция протекает, если предполагаемый продукт растворим. Исключение – взаимодействие с фосфорной кислотой, с ней реагируют даже оксиды и гидроксиды металлов, образующих нерастворимые ортофосфаты.
Mg(OH)2 + 2HCL → MgCl2 + 2H2O
Ag2 O+2CH3COOH → 2CH3COOAg+H2O
CuO + H2S реакция не идет, так как H2S – слабая кислота и сульфид меди нерастворим.
2) Обменные процессы с участием солей:
а) Растворимые соли взаимодействуют с другими растворимыми солями и гидроксидами, если в результате образуется газ или осадок:
2Na3PO4+3CuSO4 → 3Na2SO4+Cu3(PO4)2↓
FeCl3+3NaOH → 3NaCl+Fe(OH)3↓
BaSO4 + K2CO3 реакция не идет, так как реагент сульфат бария нерастворим
MnSO4 + KNO3 реакция не идет, так как не образуется ни газа, ни осадка, ни малодиссоциирующего вещества.
б) Соли взаимодействуют с кислотами, если в результате сильная кислота может вытеснить из соли слабую или нелетучая ‑ летучую:
CH3COONa + HCl → NaCl+CH3COOH
CaCO3 + H2SO4 → CaSO4 + H2O + CO2↑
CaSO4 + HCl реакция не идет, так как серная кислота – сильная и вытеснить ее из соли другой кислотой нельзя.
в) Соли многоосновных кислот взаимодейсвуют с той же кислотой с образованием кислых солей:
CaCO3 + H2O + CO2 → Ca(HCO3 )2
г) Растворимые кислые соли нейтрализуются щелочами:
KHCO3 + KOH → K2CO3 + H2O
Итого:
если вещество растворимо, оно легко вступает в реакцию обмена.
Если же нерастворимо, то оно вступает в обменный процесс только в агрессивной среде: сильная кислота или щелочь (только для амфотерных соединений).
Потренируйтесь:
Закончить уравнения реакций ионного обмена (внимание, идут не все реакции!)
Гидролиз
Гидролиз- обменная реакция соли с водой (сольволиз водой).При этом исходное вещество разрушается водой, с образованием новых веществ.
Так как гидролиз является реакцией ионного обмена, то его движущей силой является образование слабого электролита (выпадение осадка или(и)выделение газа). Важно помнить, что реакция гидролиза является реакцией обратимой(в большинстве случаев), но также существует необратимый гидролиз(протекает до конца, исходного вещества в растворе не будет). Гидролиз- процесс эндотермический (при повышении температуры возрастает и скорость гидролиза, и выход продуктов гидролиза).
Важно помнить, что реакция гидролиза является реакцией обратимой(в большинстве случаев), но также существует необратимый гидролиз(протекает до конца, исходного вещества в растворе не будет). Гидролиз- процесс эндотермический (при повышении температуры возрастает и скорость гидролиза, и выход продуктов гидролиза).
Как видно из определения, что гидролиз обменная реакция, то можно предположить, что к металлу идет OH—группа (+ возможный кислотный остаток, если образуется основная соль (при гидролизе соли, образованной сильной кислотой и слабым многокислотным основанием)), а к кислотному остатку идет протон водорода H+ (+ возможный ион металла и ион водорода, с образованием кислой соли, если гидролизуется соль, образованная слабой многоосновной кислотой)).
Существует 4 типа гидролиза:
1. Соль, образованная сильным основанием и сильной кислотой. Так как уже было указанно выше гидролиз- реакция ионного обмена, и она протекает лишь в случае образования слабого электролита. Как описанной выше, к металлу идёт OH— группа, а к кислотному остатку идет протон водорода H+, но ни сильное основание, ни сильная кислота не являются слабыми электролитами, следовательно гидролиз в данном случае не идёт:
Как описанной выше, к металлу идёт OH— группа, а к кислотному остатку идет протон водорода H+, но ни сильное основание, ни сильная кислота не являются слабыми электролитами, следовательно гидролиз в данном случае не идёт:
NaCl+HOH≠NaOH+HCl
Реакция среды близка к нейтральной: pH≈7
2. Соль образованна слабым основанием и сильной кислотой. Как указанно выше:к металлу идёт OH— группа, а к кислотному остатку идет протон водорода H+. Например:
NH4Cl+HOH↔NH4OH+HCl
NH4++Cl—+HOH↔NH4OH+H++Cl—
NH4++HOH↔NH4OH+H+
Как видно из примера-гидролиз идёт по катиону, реакция среды –кислая pH< 7.При написании уравнений гидролиза для солей, образованных сильной кислотой и слабым многокислотным основанием, то в правой части следует писать основную соль, так как гидролиз идёт только по первой ступени:
FeCl2+HOH↔FeOHCl+HCl
Fe2++2Cl—+HOH↔FeO++H++2Cl—
Fe2++HOH↔FeOH++H+
3. Соль образованна слабой кислотой и сильным основанием.Как указанно выше: к металлу идёт OH— группа, а к кислотному остатку идет протон водорода H+Например:
Соль образованна слабой кислотой и сильным основанием.Как указанно выше: к металлу идёт OH— группа, а к кислотному остатку идет протон водорода H+Например:
CH3COONa+HOH↔NaOH+CH3COOH
СH3COO—+Na++HOH↔Na++CH3COOH+OH—
СH3COO—+HOH↔+CH3COOH+OH—
Гидролиз идёт по аниону, реакция среды- щелочная, pH>7.При написании уравнений гидролиза соли, образованной слабой многоосновной кислотой и сильным основанием, в правой части следует писать образование кислой соли, гидролиз идёт по 1 ступени. Например:
Na2CO3+HOH↔NaOH+NaHCO3
2Na++CO32-+HOH↔HCO3—+2Na++OH—
CO32-+HOH↔HCO3—+OH—
4. Соль образованна слабым основанием и слабой кислотой. Это единственный случай, когда гидролиз идёт до конца, является необратимым(до полного расходования исходной соли).Например:
Соль образованна слабым основанием и слабой кислотой. Это единственный случай, когда гидролиз идёт до конца, является необратимым(до полного расходования исходной соли).Например:
СH3COONH4+HOH↔NH4OH+CH3COOH
Это единственный случай, когда гидролиз идёт до конца. Гидролиз идёт и по аниону, и по катиону, реакцию среды предугадать сложно, но она близка к нейтральной: pH≈7.
Также существует константа гидролиза, рассмотрим ее на примере ацетатного иона, обозначив его Ac—. Как видно из примеров выше уксусная(этановая) кислота является слабой кислотой, а, следовательно, ее соли гидролизуются по схеме:
Ac—+HOH↔HAc+OH—
Найдём константу равновесия для этой системы:
Зная ионное произведение воды , мы можем через него выразить концентрацию [OH]—,
Подставляя это выражение в уравнение для константы гидролиза, мы получаем:
Подставляя константу ионизации воды в уравнение, мы получаем:
Но константа диссоциации кислоты(на примере хлороводородной кислоты) равна:
Где [H3O+] представляет собой гидратированный протон водорода: [H+]. Аналогично и для уксусной кислоты, как в примере. Подставляя значение для константы диссоциации кислоты в уравнение константы гидролиза, мы получаем:
Аналогично и для уксусной кислоты, как в примере. Подставляя значение для константы диссоциации кислоты в уравнение константы гидролиза, мы получаем:
Как следует из примера, если соль образованна слабым основанием, то в знаменателе будет стоять константа диссоциации основания, вычисляемая по тому же признаку что и константа диссоциации кислоты. Если соль образованна слабым основанием и слабой кислотой, то в знаменателе будет стоять произведение констант диссоциаций кислоты и основания.
Степень гидролиза.
Так же есть еще одна величина, характеризующая гидролиз- степень гидролиза-α.Которая равна отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли Степень гидролиза зависит от концентрации соли, температуры раствора. Она увеличивается при разбавлении раствора соли и при увеличении температуры раствора. Напомним, что больше разбавлен раствор, тем меньше молярная концентрация исходной соли; а степень гидролиза возрастает при повышении температуры, так как гидролиз- процесс эндотермический, как было указанно выше.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие. Как следует из уравнения степени гидролиза и типов гидролиза: при необратимом гидролизе α≈1.
Степень гидролиза и константа гидролиза взаимосвязаны через уравнение Оствальда (Вильгельм Фридрих Оствальд-закон разбавления Оствальда,выведен в 1888 году).Закон разбавления показывает, что степень диссоциации электролита зависит от его концентрации и константы диссоциации. Примем начальную концентрацию вещества за C0, а продиссоциировавшую часть вещества- за γ, напомним, схему диссоциации вещества в растворе:
AB↔A++B—
Тогда закон Оствальда можно выразить следующим образом:
Напомним, что в уравнение стоят концентрации в момент равновесия. Но если вещество малодиссоциировавшее, то (1-γ)→1, что приводит уравнение Оствальда в вид: Kд=γ2C0.
Аналогично связанна степень гидролиза с его константой:
В подавляющем большинстве случаев используется именно эта формула. Но при необходимости, можно выразить степень гидролиза через такую формулу:
Особые случаи гидролиза:
1) Гидролиз гидридов (соединений водорода с элементами (тут мы рассмотрим только металлы 1 и 2 групп и метам), где водород проявляетстепень окисления -1):
NaH+HOH→NaOH+H2↑
CaH2+2HOH→ Ca(OH)2+2H2↑
CH4+HOH→CO+3H2↑
Реакция с метаном- один из промышленных способов получения водорода.
2) Гидролиз пероксидов. Пероксиды щелочных и щелочноземельных металлов разлагаются водой, с образованием соответствующего гидроксида и пероксида водорода (или кислорода):
Na2O2+2H2O→2NaOH+H2O2
Na2 O2+2H2O→2NaOH+O2↑
3) Гидролиз нитридов.
Ca3N2+6HOH→3Ca(OH)2+2NH3↑
4) Гидролиз фосфидов.
K3P+3HOH→3KOH+PH3↑
Выделяющийся газ PH3-фосфин, очень ядовит, поражает нервную систему. Так же способен к самовозгоранию при контакте с кислородом. Гуляли когда-нибудь ночью по болоту или ходили мимо кладбищ? Видели редкие всплески огней- «блуждающие огни», появляются, так как горит фосфин.
5) Гидролиз карбидов. Здесь будут приведены две реакции имеющие практическое применение, так как с их помощью получаются 1 члены гомологического ряда алканов (реакция 1) и алкинов (реакция 2):
Al4C3+12HOH→4Al(OH)3+3CH4↑(реакция 1)
СaC2+2HOH→Ca(OH)2+2C2H2↑(реакция 2, продукт – ацителен, по UPAС этин)
6) Гидролиз силицидов. В результате этой реакции образуется 1 представитель гомологического ряда силанов (всего их 8) SiH4 — мономерный ковалентный гидрид.
В результате этой реакции образуется 1 представитель гомологического ряда силанов (всего их 8) SiH4 — мономерный ковалентный гидрид.
Mg2
Si+4HOH→2Mg(OH)2+SiH4
7) Гидролиз галогенидов фосфора. Здесь будут рассмотрены хлориды фосфора 3 и 5, являющиеся хлорангидридами фосфористой и фосфорной кислот соответственно:
PCl3+3H2O=H3PO3+3HCl
PCl5+4H2O=H3PO4+5HCl
8) Гидролиз органических веществ.Жиры гидролизуются, с образованием глицерина (C3H5(OH)3) и карбоновой кислоты(пример предельной карбоновой кислоты) (CnH(2n+1)COOH)
Сложные эфиры:
СH3COOCH3+H2O↔CH3COOH+CH3OH
Алкоголята:
C2H5ONa+H2O↔C2H5OH+NaOH
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например, в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды — на моносахариды (например, на глюкозу).
Например, в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды — на моносахариды (например, на глюкозу).
При гидролизе жиров в присутствии щелочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицина и жирных кислот.
Задачи
1) Степень диссоциации а уксусной кислоты в 0,1 М растворе при 18 °С равна 1,4·10–2. Рассчитайте константу диссоциации кислоты Кд.(подсказка- используйте уравнение Оствальда.)
2) Какую массу гидрида кальция нужно растворить в воде, чтобы выделившемся газом восстановить до железа 6,96г оксида железа(II,III)?
3) Напишите уравнение реакции Fe2(SO4)3 + Na2CO3 + H2O
4) Рассчитайте степень, константу гидролиза соли Na2SO3 для концентрации См = 0,03 М, учитывая только 1-ю ступень гидролиза. (Константу диссоциации сернистой кислоты принять равной 6,3∙10-8)
Решения:
a) Подставим данные задачи в закон разбавления Оствальда:
b) Kд = [a2/(1 – a)]·[C] = (1,4·10–2)·0,1/(1 – 0,014) = 1,99·10–5
Ответ. Кд = 1,99·10–5.
c) Fe3O4+4H2→4H2O+3Fe
CaH2+HOH→Ca(OH)2+2H2↑
Находим количество молей оксида железа(II,III), оно равно отношению массы данного вещества к его молярной массе, получаем 0,03(моль).По УХР находим, что моли гидрида кальция равны 0,06(моль).Значит масса гидрида кальция равна 2,52(грамма).
Ответ: 2,52(грамма).
d) Fe2(SO4 )3
+3Na2CO3 +3H2 O→3СO2↑+2Fe(OH)3↓+3Na2
SO4
e) Сульфит натрия подвергается гидролизу по аниону, реакция среды раствора соли щелочная (рН > 7):
SO32- + H2O <—> OH— + HSO3—
Константа гидролиза (уравнение смотрите выше )равна : 10-14 / 6,3*10-8 = 1,58*10-7
Степень гидролиза рассчитывается по формуле α2/(1 — α) = Кh/С0.
Итак, α = (Кh/С0)1/2 = (1,58*10-7 / 0,03)1/2 = 2,3*10-3
Ответ: Kh=1,58*10-7 ;α =2,3*10-3
Автор статьи: Каштанов Артём Денисович
Редактор: Харламова Галина Николаевна
Определение основной соли в химии.
Примеры основной соли по следующим темам:
Соли, из которых производятся базовые растворы
- При растворении в воде основной соли образуется раствор с pH более 7,0.
- Существует несколько разновидностей солей , и в этом разделе мы рассмотрим основных солей .
- Что делает basic salt basic ?
- Примером основной соли является бикарбонат натрия, NaHCO3.
- Поскольку он способен депротонировать воду и давать основной раствор , бикарбонат натрия является основной солью .
Обзор кислотно-основных свойств соли
- Как мы уже обсуждали, соли могут образовывать кислые или основные растворы , если их катионы и / или анионы гидролизуются (способны реагировать в воде).
- Основные соли образуются в результате нейтрализации сильного основания и слабой кислоты; например, реакция гидроксида натрия (сильное основание) с уксусной кислотой (слабая кислота) даст воду и ацетат натрия.
- Ацетат натрия — это основная соль ; Ион ацетата способен депротонировать воду, тем самым повышая pH раствора.
- Кислотные соли являются противоположностью основных солей ; они образуются в реакции нейтрализации между сильной кислотой и слабым основанием.
- В этом видео рассматривается гидролиз кислоты соли , основной соли и соли , в которых гидролизуются оба иона.
Соли, образующие кислотные растворы
- Соли с кислотными протонами в катионе чаще всего представляют собой соли аммония или органические соединения, содержащие протонированную аминогруппу.
- Соли кислоты также могут содержать кислотный протон в анионе.
- Из предыдущей концепции мы знаем, что соли , содержащие ион бикарбоната (HCO3-), являются основными , тогда как соли , содержащие бисульфат-ион (HSO4-), являются кислотными.
- Мы определяем, является ли гидролизуемый ион кислотным или основным , сравнивая значения Ka и Kb для иона; если Ka> Kb, ион будет кислым, тогда как если Kb> Ka, ион будет основным .
- Хлорид анилиния является примером соли кислоты .
Синтез аминокислот
- Распространенным методом разделения рацематов является образование диастереомерной соли с чистой хиральной кислотой или основанием.
- На начальном изображении функция карбоновой кислоты способствует образованию диастереомерной соли .
- Рацемическая аминокислота сначала превращается в производное бензамида, чтобы удалить основной характер аминогруппы.
- Затем образуется соль аммония путем объединения карбоновой кислоты с оптически чистым амином, таким как бруцин (родственник стрихнина).
- Поскольку аминокислоты являются амфотерными, разделение также может быть достигнуто за счет использования основного признака аминовой функции.
Основные и амфотерные гидроксиды
- Теперь мы рассмотрим амфотерные гидроксиды, то есть гидроксид , соли , которые могут действовать как кислота или основание, в зависимости от условий реакции.
- Это классическая реакция кислотно-щелочной нейтрализации: HCl полностью протонирует все три гидроксида на моль Al (OH) 3, давая чистую воду и соль AlCl3.
- Исходя из того, что мы знаем об основных свойствах гидроксидов , это именно то, что мы ожидали — так как же гидроксид может действовать как кислота?
- Теперь рассмотрим реакцию гидроксида алюминия в сильно щелочном растворе :
- В растворе basic он образует связь с ионом OH-, вытягивая его из раствора и понижая pH раствора.
Реакции замещения и удаления аминов
- Реакции элиминирования солей 4º-аммония называются элиминированием Гофмана.
- Поскольку противоанион в большинстве 4º-аммониевых солей является галогенидом, его часто заменяют более основным гидроксид-ионом в результате реакции с гидроксидом серебра (или оксидом серебра).
- Полученная в результате гидроокись соль затем должна быть нагрета (100-200 ºC) для осуществления E2-подобного отщепления 3º-амина.
- Во-первых, он генерирует 4º-галогенид аммония соль способом, отличным от исчерпывающего метилирования.
- Во-вторых, эта соль не превращается в свой гидроксидный аналог до удаления.
Оксиды и карбонаты углерода
- Самыми основными оксоуглеродами являются монооксид углерода и диоксид углерода.
- Соль угольной кислоты называется карбонатом и характеризуется карбонатным ионом CO32-.
- В сильно основных условиях преобладает карбонатный ион, тогда как в слабоосновных условиях преобладает бикарбонатный ион.
- Карбонат натрия — это основной при растворении в воде (что означает, что при растворении образуется раствор основного ), а бикарбонат натрия — слабоосновный .
- Хотя карбонатные соли большинства металлов нерастворимы в воде, это не относится к бикарбонатным солям .
Нуклеофильность соединений серы
- Хотя основность простых эфиров примерно в сто раз больше, чем у эквивалентных сульфидов, нуклеофильность серы намного выше, чем у кислорода, что приводит к ряду интересных и полезных электрофильных замещений серы, которые обычно не наблюдаются. для кислорода.
- , например, реагируют с алкилгалогенидами с образованием солей тройного сульфония (уравнение № 1) таким же образом, как 3º-амины алкилируются до солей четвертичного аммония .
- Хотя эквивалентные оксониевые соли простых эфиров и известны, они получают только в экстремальных условиях и обладают исключительно реакционной способностью.
- Примечательно, что сульфоксиды (уравнение № 2), сульфинатные соли , (№ 3) и сульфитный анион (№ 4) также алкилируют серу, несмотря на частичный отрицательный формальный заряд кислорода и частичный положительный заряд серы.
Сульфиды
Основные реагенты
- Большинство основных реагентов представляют собой соли алкоксидов , амины или соли амидов .
- Поскольку спирты являются намного более сильными кислотами, чем амины, их сопряженные основания слабее, чем амидные основания, и заполняют пробел в силе оснований между аминами и солями амидов .
- Его основность и нуклеофильность могут быть изменены стерическими препятствиями, как в случае 2,6-диметилпиридина (pKa = 6,7), или резонансной стабилизацией, как в случае 4-диметиламинопиридина (pKa = 9,7).
- Была получена интересная группа нейтральных, высокоосновных соединений азота и фосфора, которые называются супероснованиями.
Чрезвычайно галофильные археи
- Одним из примеров является Chromohalobacter beijerinckii, обнаруженный в соленых бобах , консервированных в рассоле, и в соленых бобах .
- Tetragenococcus halophilus содержится в соленых анчоусах и соевом соусе.
- Чрезвычайно галофильные галоархеи требуют концентрации не менее 2 M соли и обычно встречаются в насыщенных растворах (около 36% мас. / Об. солей ).
- Галофилы адаптированы к условиям экстремальной концентрации соли , например, в Большом озере Salt в Юте.
- Соль накапливается вдоль Мертвого моря.
нейтрализующих кислот и оснований | Глава 6: Химические изменения
Проведите демонстрацию, чтобы показать студентам, что кислый раствор становится менее кислым при добавлении капель основания.
Материалы для демонстрации
- 4 прозрачных пластиковых стакана
- Цилиндр градуированный
- Универсальный индикатор
- Вода
- Карбонат натрия
- Лимонная кислота
- Плоские зубочистки
- 2 капельницы
- Малярная лента и ручка или перманентный маркер
Подготовка учителей
- Сделать индикаторное решение для студенческих групп
- Приготовьте разбавленный универсальный индикаторный раствор для этой демонстрации и для каждой студенческой группы, смешав 125 мл воды с 5 мл универсального индикаторного раствора.
- Налейте около 15 мл этого разбавленного раствора универсального индикатора в чистую чашку для каждой группы учащихся.
Примечание. Водопроводная вода из вашего местного водопровода, скорее всего, подойдет для демонстрации и занятий в этом уроке. Если приготовленный вами индикаторный раствор не зеленого цвета, это означает, что ваша вода либо кислая, либо щелочная. В этом случае используйте дистиллированную воду, которая продается в супермаркетах и аптеках.
Примечание. В рамках заданий «Вовлекать и расширять» учащиеся заполняют 6 лунок универсальным индикаторным раствором.Убедитесь, что достаточно 15 мл раствора. Для демонстрации вам потребуется около 25 мл индикаторного раствора. Если 125 мл раствора недостаточно, приготовьте еще в тех же пропорциях.
Подготовка к демонстрации
- Разделите оставшийся индикаторный раствор на две прозрачные пластиковые чашки, чтобы использовать их в демонстрации.
- Используйте клейкую ленту и ручку, чтобы промаркировать две пустые чашки с лимонной кислотой и карбонатом натрия.
- С помощью градуированного цилиндра добавьте 5 мл воды в каждую чашку с этикеткой.
- Используйте плоскую зубочистку, чтобы собрать как можно больше лимонной кислоты на конце зубочистки, как показано. Добавьте эту лимонную кислоту в воду в чашке с лимонной кислотой. Осторожно перемешайте, пока лимонная кислота не растворится.
- Используйте плоскую зубочистку, чтобы собрать как можно больше карбоната натрия на конце зубочистки. Добавьте этот карбонат натрия в воду в чашке для карбоната натрия.Осторожно взбалтывайте, пока карбонат натрия не растворится.
Процедура
- Поднимите две чашки с универсальным индикаторным раствором, обе зеленые.
- Также покажите студентам, что у вас есть раствор лимонной кислоты и раствор карбоната натрия.
Спросите студентов:
- Какого цвета станет зеленый индикаторный раствор, если я добавлю несколько капель раствора лимонной кислоты?
- Индикаторный раствор изменит цвет в сторону красного.
Процедура
- Добавьте 3-5 капель раствора лимонной кислоты в одну из чашек.
Ожидаемые результаты
Цвет раствора должен измениться с зеленого на красноватый.
Спросите студентов:
- Что, по вашему мнению, можно добавить к красноватому индикатору, чтобы сделать его менее кислым и вернуться к зеленому?
- Учащиеся должны предложить добавить карбонат натрия (основание) в кислый (красный) раствор.
Процедура
- Держа чашку с красноватым индикаторным раствором, добавьте 1 каплю раствора карбоната натрия, перемешайте и сравните цвет раствора с цветом контроля.
Добавьте еще одну каплю, если необходимо, чтобы приблизиться к зеленому цвету элемента управления. Продолжайте добавлять капли, пока цвет не станет близким к зеленому. Если вы добавляете каплю, и цвет переходит от зеленого к синему, спросите учащихся, что синий цвет говорит вам о решении.Синий цвет указывает на то, что раствор из кислого превратился в щелочной.
Объясните: кислоты и основания подобны химическим противоположностям. Скажите студентам, что они будут экспериментировать, чтобы выяснить, сколько капель основного раствора нужно, чтобы кислотный раствор переместился в середину шкалы pH. Это называется нейтрализацией кислоты.
Раздайте каждому учащемуся рабочий лист.
Учащиеся запишут свои наблюдения и ответят на вопросы о задании в листе действий.«Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально, в зависимости от ваших инструкций. Чтобы найти ответы на листе занятий, перейдите в область загрузок в онлайн-версии этого урока.
Попросите учащихся подготовить решения для упражнения.
Подготовка учителей
Студентам потребуется небольшое количество карбоната натрия и лимонной кислоты для выполнения задания.
- Пометьте две небольшие пластиковые стаканчики с раствором лимонной кислоты и раствором карбоната натрия для каждой группы.
- Налейте примерно ¼ чайной ложки лимонной кислоты и карбоната натрия в чашки с этикетками.
- Раздайте чашки с универсальным индикаторным раствором каждой группе учащихся.
Материалы для каждой группы
- Карбонат натрия в стакане
- Лимонная кислота в стакане
- Универсальный индикатор в чашке
- Вода
- 3 прозрачных пластиковых стакана
- Цилиндр градуированный
- Плоские зубочистки
- 2 капельницы
- Точечная пластина
- Малярная лента и ручка или перманентный маркер
Процедура
Обозначьте свое оборудование
Используйте малярную ленту и ручку, чтобы промаркировать одну чашку раствора лимонной кислоты и другую чашку раствора карбоната натрия.
- Используйте небольшой кусок малярной ленты и ручку, чтобы промаркировать одну пипетку с раствором лимонной кислоты, а другую — с раствором карбоната натрия.
Приготовьте раствор лимонной кислоты
- С помощью мерного цилиндра добавьте 5 мл воды в чашку с этикеткой лимонной кислоты.
Используйте плоскую зубочистку, чтобы собрать как можно больше лимонной кислоты на конце зубочистки, как показано.
- Добавьте эту лимонную кислоту в воду в чашке для лимонной кислоты. Осторожно перемешайте, пока лимонная кислота не растворится.
Приготовьте раствор карбоната натрия
С помощью мерного цилиндра добавьте 5 мл воды в чашку с надписью «карбонат натрия».
Используйте плоскую зубочистку, чтобы собрать как можно больше карбоната натрия на конце зубочистки.
Добавьте этот карбонат натрия в воду в чашке для карбоната натрия. Осторожно взбалтывайте, пока карбонат натрия не растворится.
Попросите учащихся нейтрализовать кислотный раствор.
Вопрос для расследования
Сколько капель раствора карбоната натрия потребуется, чтобы нейтрализовать раствор лимонной кислоты?
материалов для каждой группы
- Универсальное индикаторное решение
- Раствор лимонной кислоты
- Раствор карбоната натрия
- Не менее 6 плоских зубочисток
- Точечная пластина
- 3 капельницы
Процедура
- Воспользуйтесь пипеткой, чтобы почти заполнить две небольшие лунки планшета для точечных проб универсальным индикаторным раствором.В первую лунку больше ничего не добавляйте. Это будет ваш контроль.
- Добавьте 3 капли раствора лимонной кислоты к индикатору в одной из лунок. Используйте чистую зубочистку, чтобы перемешать раствор. Если он не красноватый, добавьте еще капель, но обязательно подсчитайте общее количество добавленных капель.
Спросите студентов:
- Что вы могли бы добавить, чтобы индикаторный раствор был менее кислым?
- Добавление основания, например раствора карбоната натрия, сделает раствор менее кислым.
- Следует добавлять по одной капле раствора карбоната натрия за раз или сразу по несколько капель?
- Вам следует добавлять по одной капле за раз, чтобы лучше контролировать, сколько еще капель раствора карбоната натрия следует добавить.
- Как узнать, что раствор нейтрализован?
- Цвет раствора будет аналогичен цвету элемента управления. Скажите студентам, что если раствор станет синим, значит, он превратился из кислотного в нейтральный и теперь является щелочным.В этом случае попробуйте добавить одну или несколько капель лимонной кислоты, пока цвет не станет близким к нейтральному. Обязательно следите за общим количеством добавленных вами капель кислоты и основания.
Добавьте отдельные капли карбоната натрия в ту же лунку, в которую вы добавляли кислоту. Обязательно считайте количество используемых капель и перемешивайте зубочисткой после добавления каждой капли.
Ожидаемые результаты
С каждой каплей карбоната натрия раствор лимонной кислоты будет приближаться к нейтральному, постепенно становясь зеленым.
Примечание: раствор может приближаться к зеленому цвету элемента управления, но, вероятно, не будет точным. Это связано с тем, что растворы лимонной кислоты и карбоната натрия не совсем равны по действию кислоты и основания. Кроме того, чтобы быть очень точным, ученики должны уметь использовать полукропы или даже четверть капли, что невозможно с капельницами, которые используют ученики. Пока ученики видят тенденцию к использованию зеленого контрольного цвета, этого достаточно.
| Кислый раствор | Количество капель раствора лимонной кислоты, добавленных в индикатор | Количество капель раствора карбоната натрия, необходимое для нейтрализации раствора лимонной кислоты |
|---|---|---|
| Первый раствор лимонной кислоты | 3 капли | |
| Второй раствор лимонной кислоты |
Обсудите наблюдения студентов.
- Сколько капель карбоната натрия потребовалось, чтобы вернуть цвет к цвету контроля?
- Результаты могут отличаться, но для нейтрализации раствора необходимо меньше капель карбоната натрия, чем капель лимонной кислоты.
- Становится ли раствор более или менее кислым по мере добавления в индикатор каждой капли карбоната натрия?
- Раствор становится менее кислым.
- Как использовать цвет контрольного элемента, чтобы нейтрализовать кислоту?
- Когда цвет универсального индикаторного раствора становится почти зеленым, кислотный раствор нейтрализован.
Объясните, как добавление основания в кислый раствор влияет на концентрацию ионов H
3 O + .
Спроектируйте анимацию «Нейтрализация кислотного раствора».
Объясните студентам, что добавление капель лимонной кислоты в индикаторный раствор увеличивает концентрацию ионов H 3 O + . Когда вы добавляете основание в этот кислотный раствор, оно принимает протоны от молекул воды, создавая ионы OH — .Ионы H 3 O + и молекула индикатора переносят протоны на ионы OH —. Когда добавляется достаточно основания, так что концентрация ионов H 3, , O + и OH — становится равной, раствор нейтрализуется.
Попросите учащихся сравнить, сколько еще капель основы нужно для нейтрализации более концентрированного кислотного раствора.
Вопрос для расследования
Сколько еще капель раствора карбоната натрия нужно, чтобы нейтрализовать более концентрированный раствор лимонной кислоты?
материалов для каждой группы
- Лимонная кислота
- Раствор лимонной кислоты
- Раствор карбоната натрия
- Универсальное индикаторное решение
- 2 плоские зубочистки
- 3 капельницы
- Точечная пластина
Нейтрализовать раствор лимонной кислоты
Используйте плоскую зубочистку, чтобы добавить две ложки лимонной кислоты в раствор лимонной кислоты, чтобы сделать его еще более кислым.Осторожно перемешайте, пока лимонная кислота не растворится.
- Добавьте универсальный индикаторный раствор в чистую лунку планшета.
- Добавьте к индикатору 3 капли более концентрированного раствора лимонной кислоты и перемешайте чистой зубочисткой.
Спросите студентов:
- Как вы думаете, потребуется больше, меньше или такое же количество раствора карбоната натрия, чтобы нейтрализовать этот более концентрированный раствор лимонной кислоты?
- Для нейтрализации более концентрированного раствора лимонной кислоты потребуется больше капель основы.
- Если задуматься над анимацией, зачем вам еще капель раствора карбоната натрия?
- Поскольку раствор более кислый, в нем больше ионов H 3 O + . Таким образом, требуется больше молекул основания, чтобы принять дополнительные протоны и двигаться в сторону нейтрального.
Нейтрализовать более концентрированный раствор лимонной кислоты
Добавьте отдельные капли раствора карбоната натрия в ту же лунку, в которую вы добавили кислоту.Обязательно считайте количество используемых капель и перемешивайте зубочисткой после добавления каждой капли. Запишите это число в таблицу.
Попросите учащихся нейтрализовать два основных решения, чтобы определить, какое из них наиболее концентрированное.
Материалы для каждой группы
- Универсальное индикаторное решение
- Раствор лимонной кислоты
- Решение A
- Раствор B
- Не менее 6 зубочисток
- Точечная пластина
- 3 капельницы
Подготовка учителей
Приготовьте два загадочных раствора, используя разное количество карбоната натрия.
- Пометьте две чашки с раствором A и раствором B для каждой группы.
- Сделайте классный набор решений A и B.
- Раствор A: 50 мл воды и 5 зубочисток карбоната натрия
- Раствор B: 50 мл воды и 10 зубочисток карбоната натрия
- Налейте около 5 мл каждого раствора в чашки с этикетками.
Спросите студентов:
- Растворы A и B являются основными растворами, приготовленными из карбоната натрия и воды.Один из этих растворов содержит больше карбоната натрия, чем другой. Как узнать, какой раствор более концентрированный?
- Студенты должны описать процедуру, очень похожую на ту, которую они использовали для нейтрализации двух растворов лимонной кислоты. Они должны предложить нейтрализовать каждый раствор карбоната натрия каплями лимонной кислоты и подсчитать, сколько капель требуется для нейтрализации каждого раствора. Когда цвет раствора приближается к цвету контроля, раствор нейтрализуют.
- Как узнать, какой раствор наиболее концентрированный?
- Раствор, для которого требуется наибольшее количество капель лимонной кислоты, чтобы стать нейтральным, является самым щелочным.
Обсудите, чем будут заниматься студенты:
- Для достижения наилучших результатов попросите учащихся поместить 2 капли раствора A в одну лунку, заполненную индикаторным раствором, и 2 капли раствора B в другую лунку, заполненную индикаторным раствором.
- Затем следует добавить отдельные капли раствора лимонной кислоты, перемешать и сравнить цвет с цветом контроля.
- Студенты должны отслеживать количество капель лимонной кислоты, необходимое для нейтрализации каждого раствора.
Процедура
- Добавьте универсальный индикаторный раствор в три лунки в чистом планшете.
Оставьте первый колодец в покое, чтобы его можно было использовать в качестве контроля. Добавьте 2 капли раствора А во вторую лунку.
- Добавьте 2 капли раствора B в третью лунку.
- Нейтрализованный раствор A. Запишите количество использованных капель в таблице.
- Нейтрализовать раствор B. Запишите количество использованных капель в таблице.
| Решение | Количество капель раствора, добавленных к индикатору | Количество капель раствора лимонной кислоты, необходимое для нейтрализации раствора карбоната натрия |
|---|---|---|
| Решение A | 2 капли | |
| Раствор B | 2 капли |
Спросите студентов:
- Какой раствор наиболее концентрированный? Откуда вы знаете?
- Студенты должны обнаружить, что для нейтрализации раствора Б. требуется больше капель лимонной кислоты.Следовательно, раствор B должен быть более концентрированным, чем раствор A.
- Антациды — это лекарства, которые люди принимают, когда желудочная кислота вызывает дискомфорт. В одной рекламе говорится, что это лекарство помогает при кислотном расстройстве желудка и желудке. Как вы думаете, какое химическое вещество используется в медицине?
- Основания нейтрализуют кислоты, поэтому химическое вещество, вероятно, является основанием.
Поместите таблетку Alka-Seltzer® в индикаторный раствор и попросите учащихся интерпретировать, что изменение цвета говорит о pH раствора.
Объясните, что Alka-Seltzer® содержит порошкообразные кислоты и основание. Кислоты — лимонная кислота, имеющая кисловатый вкус, и ацетилсалициловая кислота — аспирин. Основа — пищевая сода, известная также под химическим названием бикарбонат натрия.
Сообщите учащимся, что они будут наблюдать таблетку Алка-Зельцера в растворе универсального индикатора. Затем они будут использовать свои знания об универсальном индикаторе и изменении его цвета, чтобы описать, является ли раствор кислотным или основным, поскольку вещества в таблетке вступают в реакцию.
Вопрос для расследования
Как изменяется pH раствора во время химической реакции между ингредиентами таблетки Alka-Seltzer в воде?
материалов для каждой группы
- Универсальный индикаторный раствор в стакане
- Вода
- Алка-Зельцер таблетка
- Цилиндр градуированный
- Пластиковый пакет размером с застежку-молнию
Процедура
- Добавьте 20 мл универсального индикаторного раствора в небольшой пластиковый пакет, закрывающийся на молнии.
- Закройте пакет.
Примечание. Чтобы учащиеся не брали в руки «Алка-Зельцер», который является лекарством, вы должны положить таблетку «Алка-Зельцер» в сумку каждой группы.
Порядок действий учителя
Добавьте таблетку Alka-Seltzer в сумку каждой группы, открыв угол пакета ровно настолько, чтобы планшет мог пройти внутрь.
- Удалите как можно больше воздуха и уроните таблетку Алка-Зельцер через небольшое отверстие.
- Закройте пакет и передайте его одному из студентов. Попросите этого ученика встряхнуть сумку и передать ее так, чтобы каждый член группы имел возможность держать сумку.
Ожидаемые результаты
Как только таблетка Alka-Seltzer помещается в пакет, цвет индикаторного раствора меняется на красный. В растворе появляются пузырьки, и мешок надувается. Раствор тоже остывает. Со временем раствор становится оранжевым, желтым и, наконец, становится зеленым.
Обсудите наблюдения студентов.
Поскольку цвета меняются, а мешки надуваются, спросите учащихся:
- Что изменение цвета говорит вам о pH раствора в начале, середине и конце химической реакции?
- Начало: Раствор кислый.
- В центре: раствор становится менее кислым.
- Конец: раствор нейтрализован.
Учащиеся должны сделать вывод, что кислотные и основные ингредиенты в таблетке нейтрализуют друг друга.
коллоидов
коллоидов
Константы равновесия для кислот и оснований: K a
Проблемы с кислотой / основанием можно разделить на 4 категории: сильная кислота / основание, слабая кислота / основание, буферы и гидролиз.
Помните: сила кислоты определяется тем, насколько далеко находится равновесие вправо.Качественно об этом можно судить по К а кислоты. Большой K a указывает на сильную кислоту; маленький K a указывает на слабую кислоту.
Слабые кислоты и основания
Слабые кислоты и слабые основания не диссоциируют полностью. Равновесие существует между слабой кислотой, водой, H 3 O + , и анионом слабой кислоты. Равновесие находится в левой части уравнения, что указывает на то, что образуется не так много H 3 O + .Тот факт, что образуется очень мало H 3 O + , является определением слабой кислоты. K a для слабой кислоты мало, обычно число меньше 1.
Диссоциация слабой кислоты
В задачах этого типа вас попросят определить концентрацию иона гидроксония и / или pH слабой кислоты, начальная концентрация которой известна.Типичная проблема может быть:
Каковы концентрация иона гидроксония и pH 0,010 М раствора хлорноватистой кислоты, K a = 3,5 x 10 -8 ?
1 st запишите уравнение диссоциации :
HClO (водн.) + H 2 O (л) — H 3 O + (водн.) + ClO ¯ (водн.)
2 и запишите выражение равновесия: Примечание: H 2 O не входит в уравнение.Почему нет?
3 rd настроить стол ICE:
HClO (водн.) — H 3 O + (водн.) + ClO ¯ (водн.)
Начальный 0,010M 0 0
Изменить -x + x + x
Равновесие 0.010-х х х
4 th поместите значение в выражение равновесия и решите относительно x:
Решение для x упрощается, поскольку x, указанным в знаменателе, можно пренебречь. Этим x можно пренебречь, потому что он будет пренебрежимо малым по сравнению с концентрацией, 0,10 М. Чтобы определить, является ли x незначительным, сравните величину последнего десятичного знака концентрации кислоты с величиной константы равновесия.Если разница в величине больше 100, x можно пренебречь. В этом случае концентрация известна для позиции 10 -3 , а константа равновесия имеет величину 10 -8 . Разница в величине составляет 10 5 , поэтому x можно легко пренебречь.
5 th вычислить x: x 2 = (0,010) (3,5×10 -8 ) = 3,5 x 10 -10 ; х = 1,87 х 10 -5 M
6 th Рассчитайте pH, используя вновь найденное значение H 3 O + : [H 3 O + ] = 1.87 x 10 -5 M
pH = -log (0,87 x 10 -5 M) = 4,73
Тот же процесс, показанный выше, работает и для диссоциации основания, вам просто нужно вычислить [OH — ], вычислить pOH и затем преобразовать в pH.
Проблемы:
- Что такое концентрация гидроксид-иона и pH 0.10 М раствор NH 3 , K b = 1,8 x 10 -5 ?
NH 3 + H 2 O ó NH 4 + + OH —
Начальный 0,10 0 0
Изменить -x + x + x
Равновесие 0.10 — х х х
Предположим, что x мало по сравнению с концентрацией (Ka составляет ~ 10 -5 , концентрация составляет 10 -1 , разница составляет 10 000).
1,8 x 10 -5 = x 2 /0,10 x = 1,34 x 10 -3 , поэтому [OH] = 1,34 x 10 -3 M
pOH = -log (1.34 x 10 -3 M) = 2,9 SO pH = 14-2,9 = 11,1
- Предположим, у вас есть 1,0 л раствор, который изначально содержит 0,20 M в уксусной кислоте (HAc) и 0,10 M в ацетате натрия (NaAc). Каким будет pH этого раствора? Каким будет pH, если вы добавите в систему 2 мл 1,0 М HCl? K a = 1,8 x 10 -5
Исходная реакция: HAc + H 2 O — H 3 O + + Ac —
Начальный 0.20 0 0,10
Изменить -x + x + x
Равновесие 0,20 — x x 0,10 + x
Снова предположим, что x мало по сравнению с концентрацией кислоты и основания, упростим и вычислим x:
K a = 0,10x / 0.20 = 1,8 x 10 -5 x = 3,6 x 10 -5 [H 3 O] = 3,6 x 10 -5 M
, поэтому pH = –log (3,6 x 10 -5 M) = 4,44
Добавление сильной кислоты добавляет H + : 0,002 л x 1,0 моль / л = добавлено 0,002 моля. Таким образом, равновесие смещается влево, обратно в сторону слабой кислоты. К кислоте прибавляем концентрацию кислоты и вычитаем ее из основания:
После добавления кислоты новые концентрации равны: [Hac] = ~ 0.202М; [Ac — ] = ~ 0,098 М. Это наши новые начальные концентрации. Знак ~ присутствует, потому что концентрации включают 2 мл объема кислоты.
Реакция: HAc + H 2 O — H 3 O + + Ac —
Начальный ~ 0,202 0 ~ 0,098
Изменить -x + x + x
Равновесие 0.202 –x x 0,098 + x
Предположим, что x мало, тогда 1,8 x 10 -5 = 0,098x / 0,202 x = 3,64 x 10 -5 M
Новый pH = 4,43
По сути, это буферная система, поэтому изменения должны быть небольшими!
Гидролиз соли —
Когда сильная кислота и сильное основание нейтрализуются в реакции:
H + + OH — — H 2 O
Обычно образуется нейтральная соль.
Соль, образованная между сильной кислотой и слабым основанием, представляет собой кислотную соль . Аммиак — слабое основание, и его соль с любой сильной кислотой дает раствор с pH ниже 7.
Для примера рассмотрим реакцию:
HCl + NH 4 OH ó NH 4 + + Cl — + H 2 O
В растворе ион NH 4 + реагирует с водой (так называемый гидролиз) в соответствии с уравнением:
NH 4 + + H 2 O ó NH 3 + H 3 O + .
Основная соль образуется между слабой кислотой и сильным основанием. Основность обусловлена гидролизом сопряженного основания (слабой) кислоты, используемой в реакции нейтрализации. Например, ацетат натрия, образованный между слабой уксусной кислотой и сильным основанием NaOH, является основной солью. Когда соль растворяется, происходит ионизация:
NaCH 3 COO = Na + + CH 3 COO —
В присутствии воды гидролизуется CH 3 COO —:
H 2 O + CH 3 COO — = CH 3 COOH + OH —
Соли слабых кислот и слабых оснований
Соль, образованная между слабой кислотой и слабым основанием, может быть нейтральной, кислой или основной в зависимости от относительной силы кислоты и основания.
Если K a (катион)> K b (анион), раствор соли кислый.
Если K a (катион) = K b (анион), раствор соли нейтрален.
Если K a (катион) < K b (анион), раствор соли является основным.
Как получить K b , если вам дали только K a или наоборот?
K a * K b = K w = 1 x 10 -14 или pK a + pK b = pK w
Проблем:
- Является ли раствор ацетата натрия кислым, нейтральным или основным? Основной 2) Являются ли растворы хлорида аммония кислотными, основными или нейтральными? Кислый 3) Рассчитайте pH 0.100 M раствор KCN.
K a (HCN) = 6,2E-10, K b (CN-) = 1,6E-5.
CN — + H 2 O ó HCN + OH —
I 0,1 0 0
С -x + x + x
E 0,1-х х х
1.6 x 10 -5 = x 2 / 0,1 при условии, что x маленький x = 0,0013 = [OH — ] pOH = 2,9, поэтому pH = 11,1
HA + MOH à H 2 O + MA, где MA — соль. Это реакция нейтрализации. Стехиометрия реакции определяет количество кислоты или основания, остающегося непрореагировавшим в растворе, и, следовательно, pH раствора. (Помните лимитирующие и избыточные реагенты?)
Проблема: каков pH раствора, содержащего 10 мл 1.0 M HCl и 20 мл 1,0 M NaOH? После реакции остается 10 мл основания. Итак, 0,01 моль основания = pOH 2, поэтому pH будет 14-2 = 12.
Сильная кислота и слабое основание:
Когда вы складываете сильную кислоту со слабым основанием, вы все равно получаете соль:
HCl (водн.) + NH 3 (водн.) À NH 4 + Cl (водн.)
Но, как и большинство солей, он диссоциирует в воде.NH 4 + , как вы знаете, является кислотой, поэтому в дальнейшем он вступает в реакцию с водой в растворе как:
NH 4 + + H 2 O ó NH 3 + H 3 O +
pH раствора будет определяться K a NH 4 + . (K a = 5,6 x 10 -10 )
Проблема: Каким будет pH раствора, содержащего 20 мл 1M HCl и 20 мл 1M NH 3 ? HCl (водн.) + NH 3 (водн.) À NH 4 + Cl (водн.); 0.02 моль NH 4 + Cl (водн.), Полученный в реакции, поэтому начнем с:
NH 4 + + H 2 O ó NH 3 + H 3 O +
I 0,02 0 0
С -x + x + x
E 0,02 — х х х
5.6 x 10 -10 = x 2 / 0,02 при малом x. x = 3,35 x 10 -6 = [H 3 O + ] pH = 5,5
сильное основание и слабая кислота:
Когда вы складываете сильное основание со слабой кислотой, вы все равно получаете соль:
CH 3 COOH (водн.) + NaOH (водн.) Ó NaCH 3 COO ¯ (водн.) + H 2 O (л)
Но, как и большинство солей, он диссоциирует в воде.CH 3 COO ¯ , как вы знаете, является сопряженным основанием слабой кислоты, поэтому он далее реагирует с водой в растворе как:
CH 3 COO ¯ (водн.) + H 2 O (l) ó CH 3 COOH (водн.) + OH — (водн.)
Таким образом, pH раствора зависит от K b аниона соли. K b = 5,6×10 -10
Проблема: Каким будет pH раствора, содержащего 20 мл 1M CH 3 COOH и 20 мл 1M NaOH? CH 3 COOH (водн.) + NaOH (водн.) — NaCH 3 COO ¯ (водн.) + H 2 O (l); 0.02 моль NaCH 3 COO ¯ получают так, начиная с:
CH 3 COO ¯ (водн.) + H 2 O (l) ó CH 3 COOH (водн.) + OH — (водн.)
I 0,02 0 0
С -x + x + x
E 0.02-х х х
5,6 x 10 -10 = x 2 / 0,02 при малом x. x = 3,35 x 10 -6 = [OH — ] pOH = 5,5, поэтому pH = 8,5
Слабое основание и слабая кислота: K Rxn = K w / K a K b ; [H 3 O] = (K w K a / K b ) 1/2
При этом образуется соль, состоящая из сопряженной кислоты и основания.PH зависит от K a и K b этих видов.
Как рассчитать pH основного солевого раствора, смешанного с сильным основанием?
В точном решении Есть два уравнения и две неизвестные. Решение уравнений привело к точному решению. С компьютером это не проблема, но беспорядок даже для хорошего калькулятора. Итак, попробуем упростить задачу.
Начальный стол ICE
Давай:
$ x = $ образуются моли $ \ ce {Zn (OH) 2} $.{2+}]} & \ ce {[Ch4COO-]} & \ ce {[Ch4COOH]} & \ ce {[OH-]} & \ ce {Zn (OH) 2 (s)} \\\ hline
\ text {I} & \ pu {0,050000 M} & \ pu {0,100000 M} & \ pu {0,000000 M} & \ pu {0,025000 M} & \ pu {0 моль} \\
\ text {C} & -x & -y & y & \ pu {- 2x + y M} & \ pu {x moles} \\
\ text {E} & \ pu {0.{2 +}} $ явно больше. Предположим, что $ \ ce {[NaOH] _ {init}} $ количественно осаждается в виде $ \ ce {Zn (OH) 2} $.Таким образом, понятие упрощенной таблицы ICE состоит в том, что к 1 л декарбонизированной дистиллированной воды добавлено 0,037500 молей $ \ ce {Zn (Ch4COO) 2} $ и 0,025000 молей $ \ ce {Na (Ch4COO)} $.
Это игнорирует тот факт, что в растворе также должен быть осадок $ \ ce {Zn (OH) 2} $.
Пронация ацетат-аниона и растворение $ \ ce {Zn (OH) 2} $ делают раствор более щелочным.{2 +}} $ или $ \ ce {OH -} $. (Это можно было бы точно решить с помощью квадратного уравнения, если бы это действительно было необходимо.)
Используйте «?» для начальной концентрации $ \ ce {OH -} $, но она будет около $ \ pu {1e-7} $.
Осаждение $ \ ce {Zn (OH) 2} $ пытается сделать раствор кислым. Пронация ацетат-аниона пытается сделать раствор основным. Учитывая, что $ \ ce {Zn (OH) 2} $ очень нерастворим, а анион ацетата является слабым основанием, при равновесии раствор должен быть слегка кислым.2+] ‘} & \ ce {[Ch4COO-]’} & \ ce {[Ch4COOH] ‘} & \ ce {[OH-]’} & \ ce {Zn (OH) ‘_ 2 (s)} \\ \ hline
\ text {I} & \ pu {0,037500 M} & \ pu {0,100000 M} & \ pu {0,000000 M} & \ pu {?} \ приблизительно \ pu {1.000e-7} & \ pu {0 моль} \ \
\ text {C} & \ pu {-x ‘} & \ pu {-y’} & \ pu {y ‘} & \ pu {y’ -2x ‘} & x’ \ pu {moles} \\
\ text {E} & \ pu {0,037500 — x ‘M} & \ pu {0,100000 — y’M} & \ pu {y’} & \ pu {? + y ‘-2x’} & x ‘\ \ pu {moles} \\
\ end {array}Пренебрегая проблемой с начальной концентрацией $ \ ce {OH -} $ на данный момент, в равновесии есть четыре вида: $ \ ce {[Zn ^ {2+}], [Ch4COOH], [Ch4COO-]} $ и $ \ ce {[OH -]} $ на рассмотрение.Прямое решение потребует уравнения четвертой степени.
Давайте еще больше упростим это, предположив, что каждый ацетат-анион, который превращается в уксусную кислоту, создает анион гидроксида, который осаждается цинком. Таким образом, $ x ‘= \ frac {1} {2} y’ $. Это сводит проблему к кубическому уравнению, которое все еще сложно решить вручную. Итак, давайте воспользуемся итеративным решением.
Теперь мы предполагаем, что $ \ frac {y ‘} {2} $ мало, и можем принять 0,0375 для $ \ ce {[Zn] _ {equil}} $ в формуле $ \ ce {K_ {sp}} $ для вычисления $ \ ce {[OH -]} $.{+2}]} угадать & \ ce {[OH]} & \ ce {[Ch4COOH]} & \ ce {CF} & \% Err \\ \ hline
0,0365377 и 2,865431E-08 и 0,001
0 & & \\
\\
0,0375000 и 2,828427E-08 и 0,001949278 и 0,974668 и 0,026337 \\
0,0365501 и 2,864947E-08 и 0,0019 и 0,999667 и 0,000338 \\
0,0365379 и 2,865425E-08 и 0,001
4 и 0,999996 и 0,000005 \\
0,0365377 и 2,865431E-08 и 0,001
0 и 1,000000 и 0,000000 \\
\\
0.0500000 и 2.449490E-08 и 0.{-8}долларов США
$ \ pu {pOH} = 7,5428 $
$ \ pu {pH} = 14,0000 — \ pu {pOH} = 14,0000 — 7,5428 = 6,4572 \ ce {-> [Округлить до 2 SF]} 6,46 $
Сравнение Решение Wolfram Mathword
Решение Wolffram Mathword для исходной задачи:
- $ x = 0,0134623 $
- $ y = 0,001
$
По сравнению с начальной задачей $ x ‘= x — 0,0125 $ и $ y’ = y $, поэтому упрощенная задача получает:
- $ х = х ‘+ 0.0125 = 0,000962 + 0,0125 = 0,01346229 $
- $ y = y ‘= 0,001
0 $
Химия: кислоты и основания
ДОМ
Главы курса
Основы калькулятора
Математика Обзор
Основные понятия
Расширенные концепции
Раздел Тесты
Предварительный тест
Пост-тест
Полезные материалы
Глоссарий
Онлайн-калькуляторы
Калькулятор окислительно-восстановительного потенциала
Калькулятор кинетики Аррениуса
Калькулятор термодинамики
Калькулятор ядерного распада
Регрессия методом наименьших квадратов
Решатель уравнений метода Ньютона
Калькулятор сжимаемости
Калькулятор перевода единиц
Калькулятор номенклатуры
Ссылки по теме
Калькуляторы Texas Instruments
Калькуляторы Casio
Калькуляторы Sharp
Калькуляторы Hewlett Packard
Кредиты
Связаться с веб-мастером
Вода
Обычно мы говорим о кислотно-основных реакциях в водной фазе, то есть в присутствии воды.Самая фундаментальная кислотно-основная реакция — диссоциация воды:
В этой реакции вода распадается с образованием иона водорода (H + ) и гидроксильного иона (OH — ). В чистой воде мы можем определить специальную константу равновесия (K w ) следующим образом:
Где K w — константа равновесия для воды (безразмерная)
[H + ] — молярная концентрация водорода
[OH — — молярная концентрация гидроксидаКонстанта равновесия меньше единицы (1) предполагает, что реакция предпочитает оставаться на стороне реагентов — в этом случае вода предпочитает оставаться в виде воды.Поскольку вода почти не ионизируется, она очень плохо проводит электричество.
pH
Однако что представляет интерес в этом чтении, так это кислотно-основная природа вещества.
как вода. Вода на самом деле ведет себя как кислота и щелочь. Кислотность или
основность вещества чаще всего определяется
значение pH,
определяется как ниже:В состоянии равновесия концентрация H + составляет 10 -7 , поэтому мы можем рассчитать pH воды в состоянии равновесия как:
pH = -log [H + ] = -log [10 -7 ] = 7
Растворы с pH, равным семи (7), считаются нейтральными, тогда как растворы со значениями pH ниже семи (7) определяются как кислые, а растворы с pH выше семи (7) как основные.
pOH дает нам еще один способ измерения кислотности раствора. Это полная противоположность pH. Высокое значение pOH означает, что раствор является кислым, а низкий уровень pOH означает, что раствор является основным.
pOH = -log [OH — ]
pH + pOH = 14,00
Определения кислот и оснований
- Аррениуса
кислота : образует [H + ] в растворе
основание : образует [OH — ] в растворе
нормальное уравнение Аррениуса: кислота + основная соль + вода
пример: HCl + NaOH NaCl + H 2 O - Бренстед-Лоури:
кислота : все, что передает [H + ] (донор протонов)
основание : все, что принимает [H + ] (акцептор протона)
нормальное уравнение Бренстеда-Лоури: кислота + основная кислота + основание
пример: HNO 2 + H 2 O NO 2 — + H 3 O +
Каждая кислота имеет сопряженное основание и каждое основание содержит сопряженную кислоту.Эти сопряженные пары отличаются только протоном. В этом примере: HNO 2 — кислота, H 2 O — основание, NO 2 — — конъюнктура. основание, а H 3 O + — конъюнктура. кислота. - Льюис:
кислота : принимает электронную пару
основание : передает электронную пару
Преимущество этой теории состоит в том, что многие другие реакции могут считаться кислотно-основными реакциями, потому что они не должны происходить в решение.
Соли
Соль образуется при смешивании кислоты и основания и
кислота высвобождает ионы H + , а основание высвобождает ионы OH —. Этот процесс называется
гидролиз. PH соли зависит от крепости.
исходных кислот и оснований:Кислота Основа Соль pH сильный сильный pH = 7 слабый сильный pH> 7 905 905 905 905 905 905 905 слабый pH <7 слабый слабый зависит от того, какой из них сильнее Это связано с тем, что сопряженное основание сильной кислоты очень слабое и не может подвергаться гидролизу.Точно так же сопряженная кислота сильного основания очень слабая и также не подвергается гидролизу.
Кислотно-щелочной характер
Чтобы молекула со связью H-X была кислотой, водород должен иметь положительный
степень окисления, поэтому он может ионизироваться с образованием
положительный +1 ион. Например, в гидриде натрия (NaH)
водород имеет заряд -1, так что это не кислота, а на самом деле основание. Молекулы вроде
CH 4 с неполярными связями также не могут быть кислотами, потому что H не ионизируется.Молекулы с
сильные связи (большая электроотрицательность
различия), менее вероятно, будут сильными кислотами, потому что они не очень хорошо ионизируются. Для
молекула со связью X-O-H (также называемая
оксикислоты), чтобы быть кислотой, водород должен снова ионизироваться с образованием H + . Чтобы быть базой,
O-H должен отщепиться с образованием гидроксид-иона (OH — ). И то, и другое случается при работе
с оксикислотами.Сильные кислоты: Эти кислоты полностью ионизируются в растворе, поэтому они всегда
представлены в химических уравнениях в их ионизированной форме.Всего семь (7) сильных кислот:HCl, HBr, HI, H 2 SO 4 , HNO 3 , HClO 3 , HClO 4
Чтобы рассчитать значение pH, проще всего следовать стандартному процессу «Запуск, изменение, равновесие».
Пример задачи: определить pH 0,25 М раствора HBr.
Слабые кислоты: Это наиболее распространенный тип кислот. Они следуют уравнению:
HA (водн.) H + (водн.) + A — (водн.)
Константа равновесия диссоциации кислоты известна как K a .Чем больше значение K a , тем сильнее кислота.
Пример задачи: Определите pH 0,30 М уксусной кислоты (HC 2 H 3 O 2 ) с Ka 1,8×10 -5 .
Сильные основания: Как сильные кислоты, эти основания полностью ионизируются в растворе и всегда представлены в их ионизированной форме в химических уравнениях. Всего семь (7) сильных оснований:
LiOH, NaOH, KOH, RbOH, Ca (OH) 2 , Sr (OH) 2 , Ba (OH) 2
Пример проблемы: Определите pH 0.010 М раствор Ba (OH) 2 .
Слабые основания: Они подчиняются уравнению:
Слабое основание + H 2 O конъюгированная кислота + OH —
Например: NH 3 + H 2 O NH 4 + + OH +
Kb — константа диссоциации оснований:
K a x K b = K w = 1,00×10 -14
Чтобы рассчитать pH слабого основания, мы должны следовать очень похожему процессу «Начало, изменение, равновесие», как и для слабой кислоты, однако мы должны добавить несколько шагов.
Пример задачи: Определите pH 0,15 М аммиака (NH 3 ) с Kb = 1,8×10 -5 .
Имея дело со слабыми кислотами и слабыми основаниями, вам также, возможно, придется иметь дело с «общим ионным эффектом». Это когда вы добавляете соль к слабой кислоте или основанию, которые содержат один из ионов, присутствующих в кислоте или основании. Чтобы иметь возможность использовать тот же процесс для
когда это происходит, решите проблему pH, все, что вам нужно изменить, — это ваши «стартовые» числа. Сложите молярность иона, который образуется из соли, а затем решите уравнение K a или K b , как вы делали ранее.Пример задачи: найти pH раствора, образованного растворением 0,100 моль
HC 2 H 3 O 2 с Ка
1,8х10 -8 и 0,200 моль NaC 2 3 O 2 в общем объеме 1,00 лКислотно-основное титрование
Кислотно-основное титрование — это когда вы добавляете основание к кислоте до тех пор, пока не будет достигнута точка эквивалентности, когда количество молей кислоты равняется молям основания. Для титрования сильного основания
и сильной кислоты, эта точка эквивалентности достигается, когда pH раствора равен семи (7), как видно на следующей кривой титрования:Для титрования сильного основания слабой кислотой точка эквивалентности
достигается, когда pH больше семи (7).Половина эквивалентности
точка — это когда половина от общего количества базы, необходимой для нейтрализации
кислота была добавлена. Именно в этот момент pH = pK a
слабая кислота.При кислотно-основном титровании основание будет реагировать со слабой кислотой и образовывать раствор, содержащий слабую кислоту и сопряженное с ней основание, до тех пор, пока кислота полностью не уйдет. Для решения этих проблем мы будем использовать значение K для слабой кислоты и значение .
и молярности таким же образом, как и раньше.Перед
демонстрируя этот способ, давайте сначала рассмотрим сокращенный путь, названный
Уравнение Хендерсона-Хассельбаха . Это можно использовать, только если у вас есть
немного кислоты и сопряженного основания в вашем растворе. Если у вас есть только кислота, вы должны выполнить задачу с чистым K a , а если у вас есть только основание (например, после завершения титрования), вы должны выполнить задачу K b .Где:
pH — логарифм молярной концентрации водорода
pKa — константа равновесной диссоциации кислоты
[основание] — молярная концентрация основного раствора
[кислота] — молярная концентрация кислотного раствораПример проблемы: 25.0 мл 0,400 М КОН добавляют к 100 мл 0,150 М бензойной кислоты, HC 7 H 5 O 2 (Ka = 6,3×10 -5 ). Определите pH раствора.
Это уравнение часто используется при поиске pH буферных растворов. Буферный раствор — это раствор, который сопротивляется изменению pH при добавлении небольших количеств кислоты или основания. Они состоят из пары сопряженных кислот и оснований, таких как
HC 2 H 3 O 2 / C 2 H 3 O 2 — или NH 4 + / NH 3 .Они работают, потому что кислые частицы нейтрализуют ионы OH — , в то время как основные частицы нейтрализуют ионы H +. Буферная емкость — это количество кислоты или основания, которое буфер может нейтрализовать до того, как pH начнет изменяться до соответствующей степени. Это зависит от количества кислоты или основания в буфере. Высокая буферная емкость достигается благодаря решениямс высокими концентрациями кислоты и основания, и где эти концентрации близки по величине.
Практика проблемы слабой кислоты :
C 6 H 5 COONa представляет собой соль слабой кислоты C 6 H 5 COOH.Раствор .10 M C 6 H 5 COONa имеет pH 8,60.
- вычислить [OH — ] C 6 H 5 COONa
- рассчитать K для: C 6 H 5 COO — + H 2 OC 6 H 5 COOH + OH —
- рассчитать K a для C 6 H 5 COOH
См. Слабый кислотный раствор.
Задача практического титрования :
20.00 мл
0,160 M HC 2 H 3 O 2 (K a = 1,8×10 -5 ) титруют 0,200 M NaOH.- Каков pH раствора перед началом титрования?
- Каков pH после добавления 8,00 мл NaOH?
- Каков pH в точке эквивалентности?
- Каков pH после добавления 20,00 мл NaOH?
См. Раствор для титрования.
[Базовый индекс]
[Атомная структура]
[Стехиометрия]
[Химия кислотных оснований]
[Номенклатура]Кислоты и основания — соли, кислоты и основания
Соли, кислоты и основания
Передайте соль, кислоту и основание, пожалуйста,
В этом разделе мы поговорим о маленьком грязном секрете, что некоторые молекулы замаскированные под безвредные соли, могут иметь кислотные или щелочные свойства.Здесь соль будет относиться к молекуле, которая полностью диссоциирует при добавлении в водный раствор, которым в нашем случае будет вода.
Большинство людей знакомы с хорошей оле ‘поваренной солью или, как говорят химики, с NaCl. (На самом деле поваренная соль имеет более тонкие нюансы и, откровенно говоря, более восхитительна, чем простой старый NaCl — на ваш взгляд, химики.) NaCl — пример соли, которая не имеет кислотных или основных свойств при растворении в растворе.
Причина, по которой NaCl не изменяет pH раствора, заключается в том, что катион (Na + ) и анион (Cl — ), которые образуются при растворении NaCl, являются действительно слабыми кислотами и основаниями.Мы знаем это, потому что их сопряженные кислоты и основания действительно сильные кислоты и основания. Основание конъюгата Na + представляет собой NaOH, а сопряженная кислота Cl — — HCl.
Посмотрите, какие крошечные эти константы диссоциации. Эти константы диссоциации говорят нам, что реакция будет лежать очень лево. Если мы дадим этим уравнениям поворот на 180 °, это может иметь больше смысла, потому что NaOH и HCl являются сильным основанием и сильной кислотой соответственно. В растворе они почти полностью диссоциируют.Между прочим, объединение HCl и NaOH в равных пропорциях приводит к нейтральному раствору Na + и Cl — . Комбинирование любой сильной кислоты и сильного основания приводит к нейтральному раствору.
Для справки, вот некоторые катионы и анионы, которые не реагируют с водой с образованием кислотных или основных растворов:
- Катионы:
- Щелочные металлы из группы 1A: Li + , Na + , и K +
- Щелочноземельные металлы из группы 2A: Ca 2+ , Sr 2+ и Ba 2+
- Анионы:
- Cl — , Br — , I — , NO 3 — и ClO 4 —
Ситуация становится рискованной, когда определенный катион или анион из соли значительно реагирует с водой.Одним из примеров соли, которая дает кислотный раствор, является соль NH 4 Cl (хлорид аммония). Когда NH 4 Cl растворяется в воде, молекула распадается на анионы NH 4 + и Cl —. Выше мы показали, что Cl — не будет существенно взаимодействовать с водой, поскольку его партнер по конъюгату является сильной кислотой, но NH 4 + будет реагировать с водой в некоторой небольшой степени, действуя как кислота и передавая протон:
Если бы мы хотели, мы могли бы вычислить все виды, присутствующие в растворе NH 4 Cl, рассматривая NH 4 + , высвобождаемый солью, как слабый кислотный раствор.Не волнуйся. У вас будет возможность сделать это позже в примерах задач.
Оказывается, соли также могут обладать основными свойствами, когда они выделяют ионы, которые реагируют с водой с образованием OH — . Например, соль NaCN выделяет как катион Na + , который не реагирует, с водой, потому что его сопряженное основание действительно сильное, так и анион CN —, который действительно реагирует с водой, поскольку его конъюгат кислота слабая. Чего-чего?
Взгляните на химическое уравнение для CN — , действующего как основание:
Обратите внимание, что конъюгированная кислота, HCN, является слабой кислотой, которая не любит полностью диссоциировать.Некоторые из CN — будут реагировать с образованием HCN. Опять же, чтобы рассчитать равновесные концентрации и значения pH, вы можете использовать ту же процедуру, которую мы использовали ранее.
Наконец, возможно, что растворение соли в воде может привести к образованию анионов и катионов, которые реагируют с водой с образованием H 3 O + и OH —. Пусть начнется битва за протоны.
Если катион (обычно действующий как кислота) сильнее, чем анион (обычно действующий как основание), то катион победит, и раствор будет кислым.Если анион побеждает и действует как основание, то раствор будет основным. Вот пример соли NH 4 F, реагирующей с водой при растворении в растворе:
Сравнение констант диссоциации выше показывает, что NH 4 + является более сильным из двух ионов. Поскольку это кислота, она вытесняет анион F — , и раствор будет кислым.
Вот правила определения pH любого солевого раствора:
- Если K a > K b , раствор будет иметь больше H 3 O + и pH будет меньше 7.
- Если K a < K b раствор будет иметь больше OH — , а pH будет больше 7.
- Если K a ≈ K b раствор будет содержать примерно равные количества H 3 O + и OH —, а pH будет приблизительно 7. Если значения константы диссоциации приблизительно равны или меньше константы диссоциации для воды (1 × 10 -14 ), тогда раствор будет иметь значение pH примерно 7.
pH водных растворов солей Учебное пособие по химии
Примеры рабочих растворов
Вопрос 1. Является ли водный раствор хлорида натрия, NaCl (водн.) , кислотным, основным или нейтральным?
- Используйте формулу соли, чтобы решить, какая кислота и какая основание будут использоваться для получения соли.
NaCl: Na + и Cl —
Отрицательный ион (анион), Cl — , происходит из кислоты.Кислота H + + Cl — = HCl, соляная кислота.
Положительный ион (катион), Na + , происходит от основания. Основание — Na + + OH — = NaOH, гидроксид натрия. - Определите относительную концентрацию используемой кислоты и основания.
Соляная кислота, HCl (водн.) , является сильной кислотой.
Гидроксид натрия, NaOH (водн.) , является сильным основанием. - Определите кислотность (щелочность) солевого раствора:
сильная кислота + сильное основание → нейтральная соль
NaCl (водн.) — нейтральный раствор.
Вопрос 2. При 25 ° C pH водного раствора ацетата калия (этаноата калия), CH 3 COOK (вод.) , равен 7, меньше 7 или больше 7?
- Используйте формулу соли, чтобы решить, какая кислота и какая основание будут использоваться для получения соли.
CH 3 ПРИГОТОВЛЕНИЕ: K + и CH 3 COO —
Отрицательный ион (анион), CH 3 COO —, происходит из кислоты.Кислота — H + + CH 3 COO — = CH 3 COOH, уксусная кислота (этановая кислота).
Положительный ион (катион), K + , происходит от основания. Основание: K + + OH — = KOH, гидроксид калия. - Определите относительную концентрацию используемой кислоты и основания.
Уксусная кислота (этановая кислота), CH 3 COOH, является слабой кислотой.
Гидроксид калия, KOH (водн.) , является сильным основанием. - Определите кислотность (щелочность) солевого раствора:
Слабая кислота + сильное основание → основная соль
основание сильнее кислоты, при 25 ° C, pH> 7
CH 3 COOK (водн.) будет иметь pH больше 7 при 25 ° C
Вопрос 3. Является ли водный раствор сульфата аммония (NH 4 ) 2 SO 4 (водн.) кислотным, основным или нейтральным?
- Используйте формулу соли, чтобы решить, какая кислота и какая основание будут использоваться для получения соли.
(NH 4 ) 2 SO 4 : NH 4 + и SO 4 2-
Отрицательный ион (анион), SO 4 2- , происходит из кислота. Кислота — это 2H + + SO 4 2- = H 2 SO 4 , серная кислота.
Положительный ион (катион), NH 4 + , происходит от основания. Основание — NH 4 + + OH — = NH 4 OH, гидроксид аммония. - Определите относительную концентрацию используемой кислоты и основания.
Серная кислота, H 2 SO 4 (водн.) , является сильной кислотой.
Гидроксид аммония, NH 4 OH (водн.) , является слабым основанием. - Определите кислотность (щелочность) солевого раствора:
Сильная кислота + слабое основание → кислая соль
(NH 4 ) 2 SO 4 (водн.) будет кислым раствором.
1. Фактическая кислотность или щелочность солевого раствора слабой кислоты и слабого основания зависит от того, какой из них относительно более сильный.
2. Если температура не указана в экзаменационном вопросе, предположим, что температура составляет 25 ° C.
