Содержание
Периодический закон и система Д.И. Менделеева
1. Слева направо по периоду (см. Таблица Менделеева):
-
- металлические свойства простых веществ ослабевают (уменьшаются)
- неметаллические свойства усиливаются (увеличиваются)
- радиус атома уменьшается (атомное сжатие из-за увеличения заряда ядра)
- электроотрицательность элементов возрастает (самый ЭО элемент — фтор)
- восстановительные свойства уменьшаются
- окислительные свойства увеличиваются
- основные свойства оксидов и гидроксидов уменьшаются
- Кислотные свойства оксидов и гидроксидовусиливаются
- идет увеличение числа электронов на внешнем уровне
- увеличивается максимальная валентность элементов
2. Сверху вниз по группе (см. Таблица Менделеева) (для главной подгруппы):
-
- металлические свойства простых веществ усиливаются
- неметаллические свойства ослабевают
- радиус атома увеличивается
- электроотрицательность элементов уменьшается
- основные свойства оксидов и гидроксидов усиливаются
- кислотные свойства оксидов и гидроксидов убывают
- Число электронов на внешнем уровне не меняется
3. К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
4. К кислотным оксидам относятся оксиды неметаллов и оксиды металлов со степенью окисления +5, +6, +7
5. К амфотерным оксидам относятся Al2O3, BeO, ZnO, Cr2O3
Давайте порассуждаем вместе
1. Как изменяется радиус атома в ряду Be — Mg — Ca ?
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала уменьшается, потом увеличивается
Ответ: все элементы находятся в одной группе, сверху вниз, значит радиус атома увеличивается
2. Как изменяются металлические свойства в ряду Li — Be — B?
1) не изменяются
2) сначала усиливаются, потом уменьшаются
3) ослабевают
4) усиливаются
Ответ: все элементы находятся в одном периоде слева направо, значит металлические свойства ослабевают
3. Как изменяется электроотрицательность в ряду F — O — N?
Как изменяется электроотрицательность в ряду F — O — N?
1) сначала усиливается, потом ослабевает
2) уменьшается
3) не изменяется
4) усиливается
Ответ: все элементы находятся в одном периоде справа налево, значит электроотрицательность уменьшается.
4. Как изменяются неметаллические свойства в ряду As — P — N?
1) уменьшаются
2) не изменяются
3) сначала усиливаются, потом уменьшаются
4) усиливаются
Ответ: все элементы находятся в одной группе снизу вверх, значит неметаллические свойства усиливаются
5. Как изменяется число валентных электронов в ряду Li — Na — K?
1) не изменяется
2) увеличивается
3) уменьшается
4) сначала уменьшается, затем увеличивается
Ответ: все элементы находятся в одной группе сверху вниз, значит число валентных электронов не изменяется
6. Как изменяются окислительные свойства в ряду O — S — Se?
Как изменяются окислительные свойства в ряду O — S — Se?
1) увеличиваются
2) сначала уменьшаются, затем увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одной группе сверху вниз, значит окислительные свойства уменьшаются
7. Как изменяются восстановительные свойства в ряду Si — Al — Mg?
1) сначала уменьшаются, затем усиливаются
2) увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одном периоде справа налево, значит восстановительные свойства усиливаются
8. Как изменяются свойства оксидов в ряду MgO -> Al2O3 —> SiO2
1) от основных к кислотным
2) от кислотных к основным
3) от кислотных к амфотерным
4) от основных к амфотерным
Ответ: все элементы находятся в одном периоде слева направо, значит свойства оксидов изменяются от основных к кислотным
Задания повышенной сложности
1.
В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит:
1) усиление неметаллических свойств
2) усиление металлических свойств
3) высшая валентность элементов остается постоянной
4) изменяется валентность в водородных соединениях
5) уменьшается радиус атомов
Ответ: 2, 3
2. В главных подгруппах периодической системы восстановительная способность атомов увеличивается по мере
1) уменьшения радиуса атома
2) увеличения числа электронных слоев в атомах
3) уменьшения заряда ядра атомов
4) увеличения числа валентных электронов
5) увеличения порядкового номера элемента
Ответ: 2, 5
3.
В ряду химических элементов Be, Mg, Ca, Sr
1) усиливается способность атомов отдавать электроны
2) уменьшается заряд ядра атомов
3) усиливается восстановительная способность
4) уменьшаются металлические свойства
5) усиливается способность атомов принимать электроны
Ответ: 1, 3
4. В ряду химических элементов I, Br, Cl, F восстановительная способность атомов уменьшается, потому что
1) увеличивается радиус атома
2) увеличивается заряд ядра атомов
3) увеличивается число электронных слоев в атомах
4) уменьшается число электронных слоев в атомах
5) уменьшается способность атомов отдавать электроны
Ответ: 4, 5
5.
В ряду химических элементов As, P, N
1) увеличивается радиус атома
2) увеличивается электроотрицательность
3) усиливаются кислотные свойства их высших оксидов
4) возрастает значение высшей степени окисления
5) увеличивается число электронов во внешнем электронном слое атомов
Ответ: 2, 3
6. В ряду химических элементов P, N, O
1) уменьшается число электронов во внешнем электронном слое
2) увеличивается электроотрицательность
3) возрастает значение высшей валентности
4) ослабевают неметаллические свойства
5) усиливается способность атомов принимать электроны
Ответ: 2, 5
7.
В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3
1) увеличивается термическая стойкость
2) ослабевают основные свойства
3) увеличивается способность к электролитической диссоциации
4) ослабевают окислительные свойства
5) уменьшается растворимость в воде
Ответ: 2,5
Периодическая система химических элементов
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Закономерности изменения свойств химических элементов и их соединений по периодам и группам. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов: меди, цинка, хрома, железа — по их положению в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1. В ряду Na —>Mg —>Al —>Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
2. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов азот — кислород — фтор возрастает
1) валентность по водороду
2) число энергетических уровней
3) число внешних электронов
4) число неспаренных электронов
4. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
5. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 —> P2O5 —> As2O5 —> Sb2O5
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
7. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B
2) Cl,S,P,Si
3) C,Si,Ge,Sn
4) B,C,O,F
8. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1
2) O,S,Se,Te
3) At,I,Br,Cl
4) Mg,Al,Si, P
10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH2?
Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH2?
1) бор 2) калий 3) сера 4) хром
11. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
13. В ряду оксидов SiO2 — Р2О5 — SO2 — Cl2O7 кислотные свойства
1) возрастают
2) убывают
3) не изменяются
4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca, Ва
2) Na, Mg, A1
3) K,Ca,Fe
4) Sc, Ca, Mg
15. По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
16. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N, О 2) Si.Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
17. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2
2) 2, 8, 18, 1
3) 2, 8, 8, 1
4) 2,8, 18,2
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Rb,K,Na,Li
2) Na,Mg,Al, S
3) F, Cl, Br, I
4) C,N, О, F
20. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий
2) алюминий
3) фосфор
4) сера
21. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается
1) число валентных электронов в атомах
2) атомный радиус элементов
3) электроотрицательность элементов
4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует
Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
26. Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
1) Sn 2) А1 3) С 4) S
27. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
1) | увеличивается |
2) | уменьшается |
3) | не изменяется |
4) | изменяется периодически
|
29. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) | хлор |
2) | германий |
3) | мышьяк |
4) | селен |
30. Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
31. Газообразные водородные соединения состава ЭН3 образуют
1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. В ряду элементов
В ряду элементов
Cl ® S ® P ® Si
1) уменьшается число электронных слоев в атомах
2) увеличивается число внешних электронов в а томах
3) возрастают радиусы атомов
4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4) углерода
35. В ряду химических элементов
Li —>Be —> B —> C
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37. Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) | 1s22s22p1 |
2) | 1s22s22p63s1 |
3) | 1s22s2 |
4) | 1s22s22p63s23p1 |
39. В порядке увеличения восстановительной способности металлы расположены в ряду:
В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
40. В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
41. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
42. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
43. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
44. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
45. Сила оснований возрастает в ряду:
Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
46. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
47. Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
48. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
49. Основные свойства веществ ослабевают в ряду:
1) NaОН —> КОН —>RbOH
2) А1(ОН)3 —>Mg(OH)2 —> NaOH
3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2
4) В(ОН)3 —>Ве(ОН)2 —> LiOH
50. Верны ли следующие суждения?
Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
51. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
52. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
53. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
54. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
55. Верны ли следующие суждения об оксидах железа?
Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
56. В ряду оксидов
CrO — Сr2О3 — СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
57. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
58. Оцените справедливость суждений о металлах:
Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
59. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
60. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах.
Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
61. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
62. Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
63. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3
64 Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
65. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>О
3) N —>O —>F
4) O —>N —>F
66. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
67. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
68. В ряду: Si —>Р —> S —> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
69. В ряду элементов мышьяк —>селен —> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
70. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
71. Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
72. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3) хлором 4) кислородом
73. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4) HClO4
74. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) — 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
75. Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
76. Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
77. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
78. Верны ли следующие суждения о соединениях натрия и бериллия?
А. Оксид натрия проявляет основные свойства
Б. Гидроксид бериллия проявляет амфотерные свойства
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответы 1-4, 2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1, 16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1, 29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2, 39-4, 40-4, 41-2, 42-1, 43-4, 44-3, 45-1, 46-3, 47-2, 48-4, 49-3, 50-3, 51-1, 52-2, 53-2, 54-4, 55-1, 56-4, 57-2, 58-1, 59-4, 60-1, 61-2, 62-2, 63-1,64-1, 65-3, 66-2, 67-4, 68-1, 69-4, 70-1, 71-4, 72-1, 73-4, 74-1, 74-3, 76-2, 77-4, 78-3
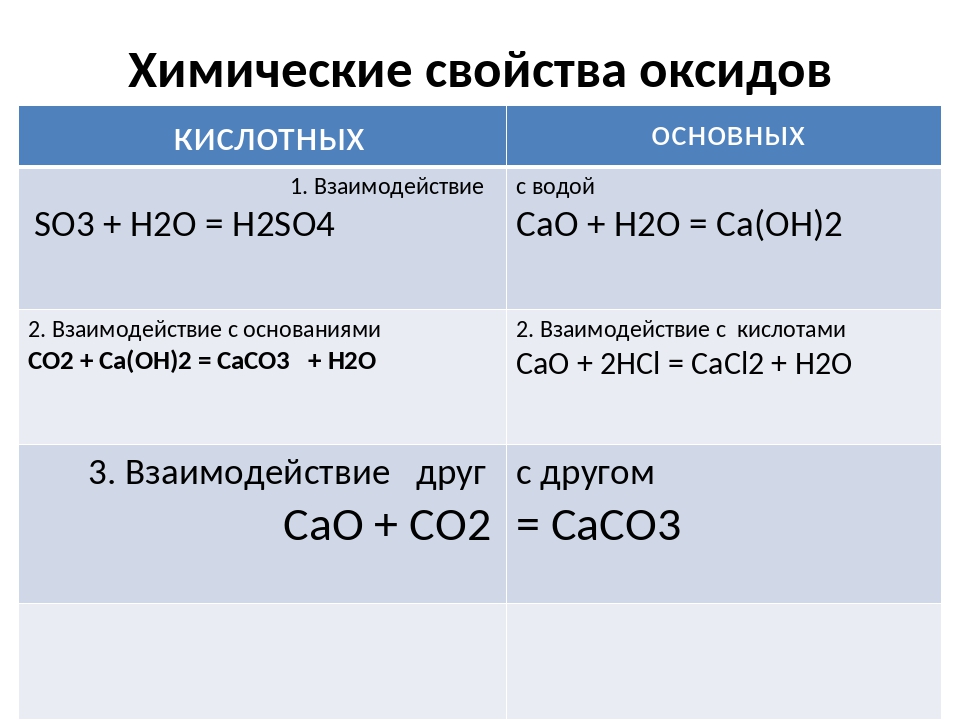
1.3. Закономерности и изменения свойств оксидов
Увеличение степени
окисления элемента и уменьшение радиуса
его иона (при этом происходит уменьшение
эффективного отрицательного заряда на
этоме кислорода) делают оксид более
кислотным. Это и объясняет закономерное
изменение свойств оксидов от основных
к амфотерным и далее к кислотным.
1) В одном периоде
при увеличении порядкового номера
происходит усиление кислотных свойств
оксидов и увеличение силы соответствующих
им кислот.
2)
В главных подгруппах периодической
системы при переходе от одного элемента
к другому сверху вниз наблюдается
усиление новых свойств оксидов:
3)
При повышении степени окисления элемента
усиливаются кислотные свойства оксида
и ослабевают основные
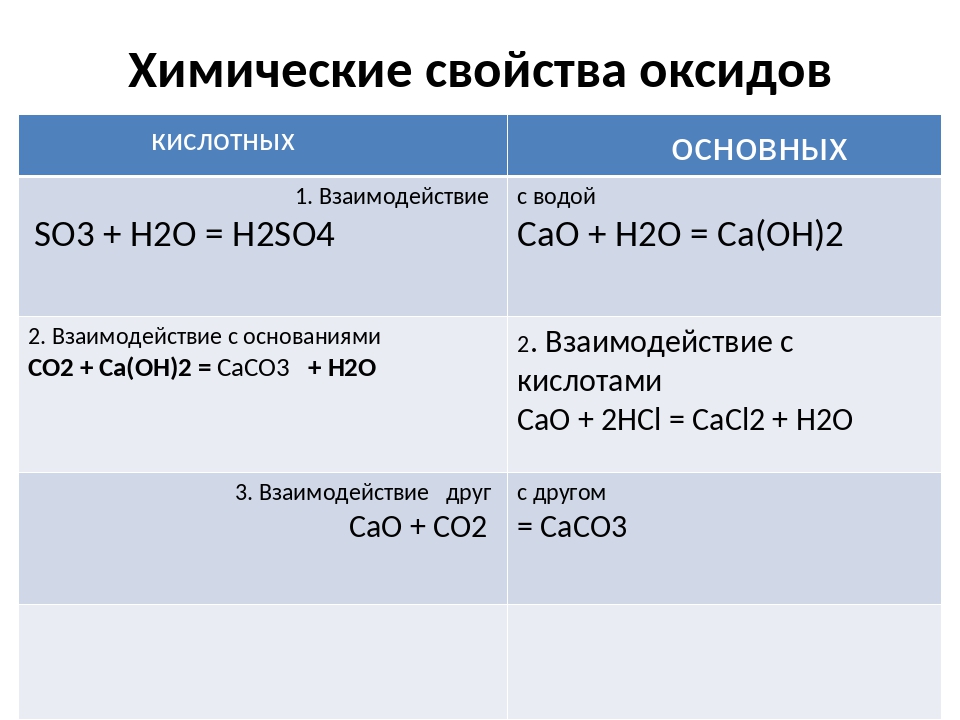
2. Химические свойства оксидов
2.1. Основные оксиды
К основным оксидам
относятся:
— оксиды всех
металлов главной подгруппы первой
группы (щелочные металлы Li — Fr)
— главной подгруппы
второй группы, начиная с магния (Mg — Ra)
— оксиды переходных
металлов в низших степенях окисления,
например, MnO, FeO.
Большинство
основных оксидов представляет собой
твердые кристаллические вещества
ионного характера, в узлах кристаллической
решетки расположены ионы металлов,
достаточно прочно связанные с оксид-ионами
О2-, поэтому оксиды типичных металлов
обладают высокими температурами
плавления и кипения.
Отметим одну
характерную для оксидов особенность.
Близость ионных радиусов многих ионов
металлов приводит к тому, что в
кристаллической решетке оксидов часть
ионов одного металла может быть заменена
на ионы другого металла. Это приводит
к тому, что для оксидов часто не выполняется
закон постоянства состава и могут
существовать смешанные оксиды переменного
состава.
Большинство
основных оксидов не распадается при
нагревании, исключение составляют
оксиды ртути и благородных металлов:
to
2HgO = 2Hg
+ O2
to
2Ag2O
= 4Ag
+ O2
Основные оксиды
при нагревании могут вступать в реакции
кислотными и амфотерными оксидами, с
кислотами:
ВаО + SiO2
= ВаSiO3,
МgО + Аl2О3
= Мg(AlO2)2,
ZnО + Н2SО4
= ZnSО4
+ Н2О.
Оксиды щелочных
и щелочноземельных металлов непосредственно
реагируют с водой:
Как и другие типы
оксидов, основные оксиды могут вступать
в окислительно-восстановительные
реакции:
to
Fe2O3+2Al
= Al 2O3
+ 2Fe
to
3CuO+2NH3
= 3Cu + N2+3H2O
to
4FeO+O2
= 2Fe2
+ O3
Основные оксиды
наиболее активных металлов (щелочных
и щелочноземельных, начиная с оксида
кальция) при взаимодействии с водой
(реакция гидратации) образуют
соответствующие им гидроксиды (основания).
Например, при растворении оксида кальция
(негашёной извести) в воде образуется
гидроксид кальция – сильное основание:
СаO + H2O
→ Са(OH)2
Основные оксиды
взаимодействуют с кислотами, образуя
соответствующие соли:
CaO + 2HCl → CaCl2
+ H2O
К образованию
солей также приводит реакция основных
оксидов с кислотными оксидами:
Na2O
+ CO2
→ Na2CO3
И с амфотерными
оксидами:
Li2O+Al2O3
→ 2LiAlO2
Основное свойство — оксид — Большая Энциклопедия Нефти и Газа, статья, страница 1
Основное свойство — оксид
Cтраница 1
Основные свойства оксидов от В3О3 к Т1203 и Т12О усиливаются.
[1]
Основные свойства оксидов и гидроксидов в подгруппе усиливаются сверху вниз, а кислотные свойства — ослабляются.
[2]
Основные свойства оксида алюминия выражены сильнее, чем кислотные.
[3]
Усиливаются основные свойства оксидов и гидроксидов. Следует помнить, что кислотно-основные свойства оксида или гндроксида зависят еще и от степени окисления элемента. Поэтому сравнивать следует соединения с одинаковыми степенями окисления элементов-а на логов.
[4]
Ослабевают основные свойства оксидов и гидроксидов элементов и одновременно усиливаются их кислотные свойства.
[5]
Усиливаются основные свойства оксидов и гидроксидов. Следует помнить, что кислотно-основные свойства оксида или гндроксида зависят еще и от степени окисления элемента. Поэтому сравнивать следует соединения с одинаковыми степенями окисления элементов-а на логов.
[6]
Ослабевают основные свойства оксидов и гидроксидов элементов и одновременно усиливаются их кислотные свойства.
[7]
Как изменяются основные свойства оксидов и гидроксидов s — элементов по мере увеличения порядкового номера элемента.
[8]
Как изменяются основные свойства оксидов элементов II-A группы.
[9]
Как изменяются кислотно — основные свойства оксидов хрома с повышением его степени окисления.
[10]
В той же последовательности увеличиваются основные свойства оксидов и гидроксидов, причем, как обычно, соединения с низкой степенью окисления элемента менее кислотны.
[11]
С повышением степени окисления металла основные свойства оксидов ослабевают, а кислотные усиливаются. Например: МпО — основной оксид, Мп02 проявляет кислотно-основную двойственность, Мп2О7 — кислотный оксид.
[12]
В той же последовательности увеличива ются основные свойства оксидов и гидроксидов, причем, как обычно, соединения с низкой степенью окисления элемента менее кислотны.
[13]
При переходе от Ti к Hf основные свойства оксидов усиливаются.
[14]
С увеличением степени окисления марганца ослабляются основные свойства оксидов и соответствующих им гидроксидов и усиливаются кислотные. Так, МпО и Мп2О3 обладают только основными свойствами, МпО2 — амфотерным, МпОз и Мп2О7 — кислотными.
[15]
Страницы:
1
2
3
1. В ряду химических элементов О → S → Sе: 1) уменьшается радиус атомов 2) уменьшается электроотрицательность 3) усиливаются неметаллические свойства 4) увеличиваются заряды ядер атомов 5) уменьшается число заполненных электронных слоев в атомах
2. В ряду химических элементов Na → Al → P происходит увеличение (усиление): 1) числа нейронов в ядрах атомов 2) восстановительных свойств 3) степени окисления в высших оксидах 4) радиуса атома 5) металлических свойств
3. В ряду химических элементов Cl → Si → Al: 1) уменьшаются заряды ядер атомов 2) возрастают кислотные свойства летучих водородных соединений 3) высшая степень окисления уменьшается 4) уменьшается радиус атомов 5) усиливаются металлические свойства
4. 4.В ряду химических элементов Sе → S → О: 1) уменьшается валентность в высших оксидах 2) возрастают радиусы атомов хим. элементов 3) усиливаются неметаллические свойства 4) увеличивается электроотрицательность 5) увеличивается число электронных слоев в атомах
5. 5.В ряду химических элементов Si → Р → S: 1) уменьшается число протонов в ядре 2) уменьшается электроотрицательность 3) увеличивается радиус атомов 4) увеличивается число электронов во внешнем электронном слое 5) усиливаются неметаллические свойства
6. 6.В ряду химических элементов Ве → Мg → Са: 1) уменьшается радиус атомов 2) возрастает способность атомов отдавать электроны 3) увеличиваются заряды ядер атомов 4) уменьшается относительная атомная масса 5) увеличивается степень окисления в высших гидроксидах
7. 7.В ряду химических элементов N → Р → Аs: 1) уменьшается электроотрицательность 2) уменьшаются радиусы атомов 3) ослабевают неметаллические свойства 4) увеличивается валентность в высших оксидах 5) уменьшается число заполненных электронных слоев в атомах
8. 8.В порядке ослабевания металлических свойств расположены элементы в рядах: 1) 1, Be → Mg → Ca 4, B → Be → Li 2) 2, Na → Mg → Al 5, Mg → Ca → Sr 3) 3, Rb → K → Na
9. Способность отдавать электроны возрастает у элементов следующих рядов: 1) Na → Al → P 2) Sr → Ca → Mg 3) C → N → O 4) Si → Al → Mg 5) B → Be → Li
10. В ряду химических элементов Al → Mg →Na: 1) усиливается электроотрицательность 2) усиливаются металлические свойства 3) усиливается основный характер их высших оксидов 4) уменьшается радиус атомов 5) усиливается кислотный характер их высших оксидов
| 11. В ряду химических элементов N → С → В: 1) увеличивается число протонов в ядре 2) увеличивается электроотрицательность 3) уменьшается радиус атомов 4) уменьшается число электронов во внешнем электронном слое 5) ослабевают неметаллические свойства
12. В порядке уменьшения числа электронов во внешнем слое расположены элементы следующих рядов: 1) N → O → F 2) С → Si → Ge 3) P → Si → Al 4) C → N → O 5) Br → Se → As
13. В ряду химических элементов Si → Ge → Sn: 1) увеличивается радиус атома 2) ослабевают металлические свойства соответствующих им простых веществ 3) ослабевает основный характер их высших оксидов 4) возрастает значение валентности в их высших оксидах 5) увеличивается число электронных слоёв в их атомах
14. В ряду химических элементов Cl → S → P → Si: 1) увеличиваются неметаллические свойства 2) уменьшается радиус атома 3) увеличивается число электронов во внешнем электронном слое 4) уменьшается низшая степень окисления 5) ослабевают неметаллические свойства
15. В ряду химических элементов Si → Аl → Мg: 1) уменьшается электроотрицательность 2) увеличиваются заряды ядер атомов 3) ослабевают неметаллические свойства 4) уменьшаются радиусы атомов 5) увеличивается число заполненных электронных слоев атомов
16. В ряду химических элементов Cl → P → Si: 1) уменьшаются заряды ядер атомов 2) уменьшается число электронных слоев 3) увеличивается атомный радиус 4) уменьшается низшая степень окисления 5) усиливаются неметаллические свойства
17. В ряду химических элементов I → Вr → Сl: 1) увеличивается степень окисления в высших оксидах 2) уменьшается число валентных электронов в атомах 3) увеличиваются заряды ядер атомов 4) усиливаются неметаллические свойства 5) уменьшается радиус атомов
18. В ряду химических элементов F → О → N: 1) увеличивается число электронных слоев в атомах 2) уменьшаются заряды ядер атомов 3) усиливаются неметаллические свойства 4) уменьшается радиус атомов 5) уменьшается число электронов во внешнем электронном слое
19. В ряду химических элементов Аl → Р → Сl: 1) увеличивается электроотрицательность 2) уменьшаются заряды ядер атомов 3) возрастают металлические свойства 4) уменьшаются радиусы атомов 5) уменьшается число электронов во внешнем электронном слое
20. В ряду химических элементов Li → Ве → В: 1) увеличивается электроотрицательность 2) уменьшаются металлические свойства 3) уменьшаются заряды ядер атомов 4) уменьшается число электронов во внешнем электронном слое 5) увеличивается число заполненных электронных слоев
|
Оксиды и гидроксиды металлов | Химическая энциклопедия
С усилением металлических свойств соответствующих химических элементов усиливаются и основные свойства их оксидов и гидроксидов.
Для s- и р-элементов по периоду слева направо они изменяются от ярко выраженных основных свойств у соединений щелочных и щелочноземельных металлов до амфотерных у металлов, стоящих ближе к линии, разделяющей металлы и неметаллы (у алюминия, германия, сурьмы, свинца). Так, например, свежеосажденный гидроксид алюминия легко растворяется в растворах как кислот, так и щелочей:
Аl(ОН)3 + 3HCl = AlCl3 + 3H2O;
Аl(ОН) 3 + 3КОН = К3 [Аl(ОН) 6].
Амфотерные оксиды и гидроксиды вступают в реакции не только с растворами щелочей, но и с твердыми основаниями при повышенной температуре (при сплавлении). Для проведения такой реакции смесь исходных твердых веществ нагревают до определенной температуры. При этом образуются иные, чем при реакции в водном растворе, продукты реакции. Например, при сплавлении гидроксида хрома(III) с гидроксидом, оксидом или карбонатом калия получается соль метахромовой кислоты НСЮ2 — метахромит калия:
Сr(ОН)3 + КОН =t KСrO2 + 2Н2О↑;
2Cr(ОН)3 + К2O =t 2КСrO2 + 3H2O↑;
2Сr(ОН)3 + 2СO3 =t 2КСrO2 + 3H2O↑ + CO2↑.
Оксиды щелочных и щелочноземельных металлов активно реагируют с водой с образованием растворимых гидроксидов:
К2O + Н2O = 2КОН;
ВаО + Н2O = Ва(ОН)2.
По группе сверху вниз металлические свойства s- и р-элементов усиливаются, и, соответственно, нарастают основные свойства их оксидов и гидроксидов. Так, например, в группе IIA оксид и гидроксид бериллия проявляют амфотерные свойства — легко растворяются в растворах кислот и щелочей:
ВеО + 2HCI = ВеС12 + Н2O;
ВеО + Н2O + 2NaOH = Na2[Be(OH) 4].
Соответствующие соединения бария и радия имеют ярко выраженные основные свойства:
ВаО + Н2O = Ва(ОН)2;
Ва(ОН)2 + 2HNO3 = Ba(NO3)2 + 2Н2O.
Существенное влияние на кислотно-основные свойства оксидов и гидроксидов d-элементов оказывает степень окисления атома металла: с увеличением степени окисления атома металла кислотные свойства соответствующего оксида и гидроксида усиливаются. Например, хром образует оксиды и гидроксиды, в которых атомы хрома проявляют степени окисления +2, +3 и +6:
Кислотно-основные свойства этих оксидов изменяются от основных (у СrО и Сr(ОН)2) через амфотерные (у Сr2O3 и Сr(ОН) 3) до кислотных (у СrO3 и Н2СrO4). Аналогичная зависимость наблюдается и для других d-металлов.
[table “” not found /]
Вам необходимо включить JavaScript, чтобы проголосовать
Оксиды и гидроксиды металлов
Для
всех металлов известны их оксиды и гидроксиды, а у d-элементов
различные степени окисления, поэтому они образуют множество оксидов и
гидроксидов. Свойства этих оксидов и гидроксидов зависят от положения
металла в периодической системе, от его активности и степени окисления металла.
Таким образом, все металлы образуют солеобразующие оксиды.
Известно,
что чем ярче выражены металлические свойства, тем сильнее основные свойства
оксидов и гидроксидов.
Для
s- и p-элементов слева направо
по периоду уменьшаются металлические свойства, а значит и основные свойства оксидов
и гидроксидов металлов. В IA группе
сверху вниз увеличиваются радиусы атомов, при отдаче электронов с внешнего
уровня образуются катионы. Естественно, что степень окисления у этих элементов
не изменяется, а основный характер оксидов усиливается.
Если
рассмотреть изменение свойств оксидов элементов по периоду на примере элементов
3 периода, то следует отметить, что в атомах этих элементов количество
энергетических уровней одинаковое, но степень окисления изменяется, то есть она
возрастает, а радиус иона уменьшается, поэтому характер оксидов изменяется от
основного через амфотерные к кислотному.
Например,
оксиды и гидроксиды щелочных и щелочноземельных металлов проявляют ярко
выраженные основные свойства, а уже оксид алюминия проявляют амфотерные свойства.
Так,
оксид натрия – это основный оксид, поэтому он будет реагировать с кислотными и
амфотерными оксидами, с кислотами. Например, в реакции оксида натрия с оксидом
углерода (IV) образуется соль – карбонат натрия, в
реакции оксида натрия с соляной кислотой образуется соль – хлорид натрия и
вода.
По
группе сверху вниз металлические свойства s- и p-элементов усиливаются, поэтому усиливаются и основные
свойства их оксидов.
Например,
в группе II A оксид бериллия проявляет амфотерные свойства, поэтому он
легко растворяется в растворах кислот и щелочей. Например, в реакции оксида
бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции
оксида бериллия с раствором гидроксида натрия образуется комплексная соль –
тетрагидроксобериллат натрия.
Соединения
бария и радия имеют уже ярко выраженные основные свойства, поэтому они будут
реагировать с кислотными и амфотерными оксидами, а также с кислотами. Так, в
реакции оксида бария с азотной кислотой образуется соль – нитрат бария и вода.
Характер
гидроксида зависит также от степени окисления и радиуса иона. Чем больше
степень окисления, тем меньше радиус иона.
Поэтому
в ряду от гидроксида натрия до гидроксида алюминия идёт ослабление основных
свойств и усиление кислотных, так как возрастает степень окисления и
уменьшается радиус иона.
Например,
в I A группе сверху вниз увеличивается радиус иона, степень
окисления не изменяется, поэтому усиливаются основные свойства. В ряду от
гидроксида лития до гидроксида цезия основные свойства будут усиливаться.
Переходные
элементы, расположенные в малых периодах – это Be, Al образуют оксиды и гидроксиды, проявляющие амфотерные
свойства.
Получим
гидроксид алюминия и исследуем его свойства. Сначала в растворимую соль
алюминия добавим щелочь, в результате у нас образуется осадок – это гидроксид
алюминия.
Затем
разделим этот осадок на две части: к первой части добавим соляную кислоту, осадок
растворяется из-за образования растворимой соли – хлорида алюминия. Ко второй
части осадка добавим гидроксид калия – осадок также растворяется, потому что
образуется растворимая соль – тетрагидроксоалюминат калия.
Al(OH)3
+ 3HCl = AlCl3 + 3H2O
Al(OH)3
+ KOH = K[Al(OH)4]
Амфотерные
оксиды и гидроксиды вступают в реакции не только с растворами щелочей, но и с
твёрдыми основаниями при сплавлении.
Например,
при сплавлении гидроксида хрома (III) с гидроксидом
калия образуется соль – метахромит калия и вода, при сплавлении гидроксида
хрома (III) с оксидом калия образуется метахромит калия
и вода, при сплавлении гидроксида хрома (III) с
карбонатом калия также образуется соль метахромит калия, вода и углекислый газ.
Аналогично
оксид и гидроксид алюминия ведёт себя: при сплавлении оксида алюминия и
гидроксида калия образуется соль – металюминат калия и вода, при сплавлении
гидроксида алюминия и гидроксида калия образуется соль – метаалюминат калия и
вода.
Оксид
и гидроксид бериллия также проявляет амфотерные свойства, потому что они реагирует
с кислотами, щелочами. Так, в реакции оксида бериллия с соляной кислотой
образуется соль – хлорид бериллия и вода, в реакции гидроксида бериллия и
серной кислоты образуется соль – сульфат бериллия и вода.
Большое
влияние на кислотно-основные свойства оксидов и гидроксидов d-элементов
оказывает степень окисления металла, поэтому с увеличением степени окисления
металла кислотные свойства соответствующего оксида и гидроксида усиливаются.
Например, хром образует оксиды и гидроксиды, в которых атомы хрома проявляют
степени окисления +2, +3 и +6.
В
оксиде CrO и гидроксиде Cr(OH)2 степень окисления
хрома +2, поэтому этот оксид и гидроксид будут проявлять основные свойства.
В оксиде Cr2O3
и гидроксиде Cr(OH)3
окисления хрома +3, поэтому оксид и гидроксид в этой степени окисления будут
проявлять амфотерные свойства, в оксиде CrO3
и гидроксиде H2CrO4
степень окисления хрома +6 – это высшая степень окисления для атома хрома,
поэтому этот оксид и гидроксид проявляют кислотные свойства.
Тоже
самое наблюдается и в соединениях марганца. Например, в оксиде MnO и в гидроксиде Mn(OH)2 степень окисления марганца +2 – это низшая
степень оксиления, поэтому эти соединения проявляют основные свойства, в
оксиде MnO2 и гидроксиде Mn(OH)4 марганец имеет степень окисления равную +4 –
это промежуточная степень окисления, поэтому эти соединения будут проявлять амфотерные
свойства. Если у марганца будет степень окисления +6 или +7, то его оксиды
и гидроксиды будут проявлять кислотные свойства. Это такие оксиды, как MnO3 и Mn2O7, а также их гидроксиды H2MnO4 и HMnO4.
Таким
образом, с увеличением степени окисления металла происходит уменьшение
радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от
основных через амфотерные к кислотным.
Кислотность Льюиса как объяснение окислительного промотирования металлов: последствия ее важности и ограничения для каталитических реакций
S.J. Таустер, акк. Chem. Res. 20 (1987) 389.
Google Scholar
A.T. Белл, в: Catalyst Design — Progress and Perspectives , ed. Л.Л. Хегедус (Wiley, Нью-Йорк, 1987).
Google Scholar
р.Burch, in: Hydrogen Effects in Catalysis , eds. З. Паал, П.Г. Менон (Деккер, Нью-Йорк, 1988).
Google Scholar
Г.Л. Халлер и Д.Э. Resasco, Adv. Катал. 36 (1989) 173.
Google Scholar
M.A. Vannice, Catal. Сегодня 12 (1992) 255.
Google Scholar
I.Mochida, I. Nonugide, H. Ishibashi и H. Fujitsu, J. Catal. 110 (1988) 159.
Google Scholar
T. Koerts, W.J.J. Велтерс и Р.А. ван Сантен, Дж. Катал. 134 (1992) 1.
Google Scholar
W.M.H. Sachtler, M.J. Ichikawa, J. Phys. Chem. 90 (1986) 4752.
Google Scholar
Т.Iizuka, Y. Tanaka и K. Tanabe, J. Catal. 76 (1982) 1.
Google Scholar
T. Iizuka, Y. Tanaka и K. Tanabe, J. Mol. Катал. 17 (1982) 381.
Google Scholar
А. Троварелли, К. Мустацца, Г. Дольчетти, Дж. Каспар и М. Грациани, Appl. Катал. 65 (1990).
П. Джонстон, Р. В. Джойнер, П. Д. А. Падни, Э. Шапиро и Б.П. Уильямс, Faraday Discussions Chem. Soc. 89 (1990) 91.
Google Scholar
Дж. П. Хиндерманн, А. Киннеманн и С. Тазкритт, в: Структура и реакционная способность поверхностей , ред. К. Мортерра, А. Зеккина и Г. Коста (Эльзевир, Амстердам, 1989).
Google Scholar
N.T. Панде и А. Белл, Дж. Катал. 98 (1986) 577.
Google Scholar
р.Берч и А. Flambard, J. Catal. 86 (1982) 384.
Google Scholar
W.M.H. Захтлер, Д.Ф. Шрайвер, У. Холленберг, А.Ф. Ланг, J. Catal. 92 (1985) 429.
Google Scholar
М.Е. Левин, М. Салмерон, A.T. Белл и Г.А. Somorjai, J. Catal. 106 (1987) 401.
Google Scholar
М.Э. Левин, М. Салмерон, А. Белл и Г.А. Somorjai, Faraday Trans. 183 (1987) 2061.
Google Scholar
М.Е. Левин, М. Салмерон, A.T. Белл и Г.А. Соморжай, Прибой. Sci. 195 (1988) 429.
Google Scholar
A.B. Боффа, А. Белл и Г.А. Somorjai, J. Catal. 139 (1993) 602.
Google Scholar
А.Б. Боффа, А. Белл и Г.А. Somorjai, J. Catal., В печати.
K.J. Уильямс, А. Боффа, М. Салмерон, А. Белл и Г.А. Соморжай, Катал. Lett. 5 (1990) 385.
Google Scholar
K.J. Уильямс, А. Боффа, М. Салмерон, А. Белл и Г.А. Соморжай, Катал. Lett. 9 (1991) 41.
Google Scholar
K.J. Уильямс, А. Боффа, М.Салмерон, А. Белл и Г.А. Соморжай, Катал. Lett. 11 (1991) 77.
Google Scholar
K.J. Уильямс, М. Салмерон, А. Белл и Г.А. Соморжай, Катал. Lett. 1 (1988) 331.
Google Scholar
H.C. Ван, Д.Ф. Оглетри и М. Салмерон, J. Vac. Sci. Tech. В 9 (1992) 853.
Google Scholar
К.Дж. Уильямс, М. Салмерон, A.T. Белл и Г.А. Соморжай, Прибой. Sci. 204 (1988) L745.
Google Scholar
K.J. Уильямс, докторская диссертация, факультет химической инженерии, Калифорнийский университет в Беркли, США (1990).
Google Scholar
A.B. Боффа, докторская диссертация, факультет химии, Калифорнийский университет в Беркли, США (1994).
Google Scholar
К.I. Tanaka и A. Ozaki, J. Catal. 8 (1967) 1.
Google Scholar
R.T. Sanderson, , Химическая периодичность (Рейнхольд, Нью-Йорк, 1960).
Google Scholar
C.P. Хорвиц и Д.Ф. Дрожь, Adv. Органомет. Chem. 23 (1984) 219.
Google Scholar
Изменение кислотности катализатора на основе оксида марганца ацетилацетонами для окисления аминов с регулируемой селективностью
Корма, А. и Серна, П. Хемоселективное гидрирование нитросоединений с нанесенными золотыми катализаторами. Наука 313 , 332–334 (2006).
ADS
CAS
Статья
Google Scholar
Маршалл, С. Т. и др. Контролируемая селективность палладиевых катализаторов с использованием самоорганизующихся монослоев. Nat. Матер. 9 , 853–858 (2010).
ADS
CAS
Статья
Google Scholar
Chen, G. et al. Межфазные электронные эффекты контролируют селективность реакции платиновых катализаторов. Nat. Матер. 15 , 564–569 (2016).
ADS
CAS
Статья
Google Scholar
Matsubu, J. C. et al. Опосредованные адсорбатом сильные взаимодействия металл-носитель в Rh-катализаторах на оксидных носителях. Nat. Chem. 9 , 120–127 (2017).
CAS
Статья
Google Scholar
Tan, Y. et al. Нанокластеры Au 25 на основе ZnAl-гидроталькита в качестве предкатализаторов для хемоселективного гидрирования 3-нитростирола. Angew. Chem. Int. Эд. 56 , 2709–2713 (2017).
CAS
Статья
Google Scholar
Xu, B. et al. Простые медные катализаторы аэробного окисления аминов: контроль селективности с помощью противоиона. Angew. Chem. Int. Эд. 55 , 15802–15806 (2016).
CAS
Статья
Google Scholar
Li, S., Zhu, S., Zhang, C., Song, S. & Zhou, Q. Катализируемое иридием энантиоселективное гидрирование α, β-ненасыщенных карбоновых кислот. J. Am. Chem. Soc. 130 , 8584–8585 (2008).
CAS
Статья
Google Scholar
Шенбаум, К. А., Шварц, Д. К. и Медлин, Дж. У. Управление поверхностной средой гетерогенных катализаторов с помощью самоорганизующихся монослоев. В соотв. Chem. Res. 47 , 1438–1445 (2014).
CAS
Статья
Google Scholar
Tian, S. et al. Регулируемая по температуре селективность гидрирования и гидродеоксигенации в превращении молекулы биомассы катализатором Ru 1 / mpg-C 3 N 4 . J. Am. Chem. Soc. 140 , 11161–11164 (2018).
CAS
Статья
Google Scholar
Li, S. et al. Настройка селективности каталитического гидрирования диоксида углерода по сравнению с катализаторами из иридия / оксида церия с сильным взаимодействием металла с носителем. Angew. Chem. Int. Эд. 56 , 10761–10765 (2017).
CAS
Статья
Google Scholar
Шюмперли М. Т., Хаммонд К. и Херманс И. Развитие аэробного окисления аминов. ACS Catal. 2 , 1108–1117 (2012).
Артикул
Google Scholar
Wang, L. et al. Контролируемое цианирование углерод-водородных связей кристаллами цеолита над катализатором из оксида марганца. Nat. Commun. 8 , 15240 (2017).
ADS
Статья
Google Scholar
Чжан, Дж., Ван, Б., Николла, Э. и Медлин, Дж. У. Направление путей реакции посредством контролируемого связывания реагентов на границах раздела Pd-TiO 2 . Angew. Chem. Int. Эд. 56 , 6594–6598 (2017).
CAS
Статья
Google Scholar
Zhang, J. et al. Цеолитный катализатор Pd @ для гидрирования нитроарена с высокой селективностью по продукту за счет стерически контролируемой адсорбции в микропорах цеолита. Angew. Chem. Int. Эд. 56 , 9747–9751 (2017).
CAS
Статья
Google Scholar
Лю П., Цинь Р., Фу Г. и Чжэн Н. Координационная химия поверхности металлических наноматериалов. J. Am. Chem. Soc. 139 , 2122–2131 (2017).
CAS
Статья
Google Scholar
Шредер И., Варнеке Дж., Бакенкёлер Дж. И Кунц С. Функционализация наночастиц платины L-пролином: одновременное повышение каталитической активности и селективности. J. Am. Chem. Soc. 137 , 905–912 (2015).
CAS
Статья
Google Scholar
Wu, B., Huang, H., Yang, J., Zheng, N. & Fu, G. Селективное гидрирование альфа, бета-ненасыщенных альдегидов, катализируемое нанокристаллами платины-кобальта с аминовыми группами. Angew. Chem. Int. Эд. 51 , 3440–3443 (2012).
CAS
Статья
Google Scholar
Панг, С. Х., Шенбаум, К.А., Шварц, Д. К. и Медлин, Дж. У. Направление путей реакции путем выбора активного центра катализатора с использованием самоорганизующихся монослоев. Nat. Commun. 4 , 2448 (2013).
ADS
Статья
Google Scholar
Кахсар, К. Р., Шварц, Д. К. и Медлин, Дж. У. Контроль селективности металлического катализатора посредством определенных нековалентных молекулярных взаимодействий. J. Am. Chem. Soc. 136 , 520–526 (2014).
CAS
Статья
Google Scholar
Эрнст, Дж. Б., Мурацугу, С., Ван, Ф., Тада, М. и Глориус, Ф. Настраиваемый гетерогенный катализ: N-гетероциклические карбены в качестве лигандов для гетерогенного Ru / K-Al на носителе 2 O 3 катализаторы для настройки реакционной способности и селективности. J. Am. Chem. Soc. 138 , 10718–10721 (2016).
CAS
Статья
Google Scholar
Zhang, J. et al. Контроль межфазного кислотно-металлического катализа с использованием органических монослоев. Nat. Катал. 1 , 148–155 (2018).
Артикул
Google Scholar
Эллис, Л. Д., Тротье, Р. М., Масгрейв, К. Б., Шварц, Д. К. и Медлин, Дж. У. Управление реакционной способностью поверхности диоксида титана посредством электронной настройки самоорганизующихся монослоев. ACS Catal. 7 , 8351–8357 (2017).
CAS
Статья
Google Scholar
Jia, X. et al. Металлооксидный катализатор, модифицированный карбоновой кислотой, для аэробного аммоксидирования с регулируемой селективностью. Nat. Commun. 9 , 933 (2018).
ADS
Статья
Google Scholar
Тамура М. и Томишиге К. Редокс-свойства CeO 2 при низкой температуре: прямой синтез иминов из спирта и амина. Angew. Chem. Int. Эд. 54 , 864–867 (2015).
CAS
Статья
Google Scholar
Tamura, M. et al. Образование нового сильноосновного аниона азота путем модификации оксида металла. J. Am. Chem. Soc. 139 , 11857–11867 (2017).
CAS
Статья
Google Scholar
Ямагути, К., Кобаяси, Х., Oishi, T. & Mizuno, N. Гетерогенно катализируемый синтез первичных амидов непосредственно из первичных спиртов и водного раствора аммиака. Angew. Chem. Int. Эд. 51 , 544–547 (2012).
CAS
Статья
Google Scholar
Wang, Y. et al. Гетерогенный катализатор на основе церия с водостойкими кислотными центрами Льюиса для однореакторного синтеза 1,3-диолов посредством реакций конденсации и гидролиза Принса. Дж.Являюсь. Chem. Soc. 135 , 1506–1515 (2013).
CAS
Статья
Google Scholar
Аль-Хмуд, Л. и Джонс, С. В. Пути реакции на катализаторах на основе оксида меди и церия для прямого синтеза иминов из аминов в аэробных условиях. J. Catal. 301 , 116–124 (2013).
CAS
Статья
Google Scholar
Wang, Y., Kobayashi, H., Yamaguchi, K. & Mizuno, N. Катализируемое оксидом марганца превращение первичных аминов в первичные амиды через последовательность окислительного дегидрирования и последовательной гидратации. Chem. Commun. 48 , 2642–2644 (2012).
CAS
Статья
Google Scholar
Ямагути, К., Ван, Ю. и Мизуно, Н. Катализируемый оксидом марганца аэробный окислительный синтез первичных амидов из первичных аминов без применения добавок и растворителей. Chem. Lett. 41 , 633–635 (2012).
CAS
Статья
Google Scholar
Biswas, S. et al. Аэробное окисление аминов до иминов мезопористым оксидом марганца, промотированным цезием. ACS Catal. 5 , 4394–4403 (2015).
CAS
Статья
Google Scholar
Сударсанам, П., Хиллари, Б., Амин, М. Х., Хамид, С. Б. и Бхаргава, С. К. Взаимосвязи между структурой и активностью наноразмерных гетероструктурных катализаторов MnO x / CeO 2 для селективного окисления аминов в экологически чистых условиях. Заявл. Катал. B Environ. 185 , 213–224 (2016).
CAS
Статья
Google Scholar
McNamara, W. R. et al. Якоря из ацетилацетоната для надежной функционализации наночастиц TiO 2 комплексами Mn (II) -терпиридин. J. Am. Chem. Soc. 130 , 14329–14338 (2008).
CAS
Статья
Google Scholar
Сяо, Д., Мартини, Л. А., Снебергер, Р. К. 3-й, Крэбтри, Р. Х. и Батиста, В. С. Обратный дизайн и синтез акак-кумариновых якорей для надежной сенсибилизации TiO 2 . J. Am. Chem. Soc. 133 , 9014–9022 (2011).
CAS
Статья
Google Scholar
Le Bahers, T., Pauporte, T., Labat, F., Lefevre, G. & Ciofini, I. Ацетилацетон, интересная группа по закреплению органических-неорганических гибридных материалов на основе ZnO: комбинированное экспериментальное и теоретическое исследование. Langmuir 27 , 3442–3450 (2011).
Артикул
Google Scholar
Бёрдетт, Дж. Л. и Роджерс, М. Т. Кето-енольная таутомерия в β-дикарбонилах, исследованная с помощью спектроскопии ядерного магнитного резонанса.I. Протонные химические сдвиги и константы равновесия чистых соединений. J. Am. Chem. Soc. 86 , 2105–2109 (1964).
CAS
Статья
Google Scholar
Caminati, W. & Grabow, J. U. Структура C 2v енольного ацетилацетона. J. Am. Chem. Soc. 128 , 854–857 (2006).
CAS
Статья
Google Scholar
Макканн, Б. У., МакФарланд, С. и Асеведо, О. Сравнительный анализ моделей континуального растворителя для таутомеризации кето-енолов. J. Phys. Chem. А 119 , 8724–8733 (2015).
CAS
Статья
Google Scholar
Роган, Дж. Б. и Эллис, Д. Дж. Конформации 3,3-диметил-2,4-пентандиона. J. Org. Chem. 26 , 5232–5233 (1961).
CAS
Статья
Google Scholar
Trivella, A. et al. УФ- и ИК-фотоизомеризация ацетилацетона, захваченного азотной матрицей. J. Phys. Chem. А 111 , 3074–3081 (2007).
CAS
Статья
Google Scholar
Пинхас, С., Сильвер, Б. Л. и Лаулихт, I. Инфракрасные спектры поглощения ацетилацетонатов Cr (III) и Mn (III), меченных 18 O. J. Chem. Phys. 46 , 1506–1510 (1967).
ADS
CAS
Статья
Google Scholar
Saberi, D., Mahdudi, S., Cheraghi, S. & Heydari, A. Комплекс Cu (II) -ацетилацетон, ковалентно закрепленный на магнитных наночастицах: синтез, характеристика и каталитическая оценка образования амидной связи с помощью окислительного сочетание карбоновых кислот с N, N-диалкилформамидами. J. Organomet. Chem. 772–773 , 222–228 (2014).
Артикул
Google Scholar
Ли, Дж., Ван, Р. и Хао, Дж. Роль решеточного кислорода и кислоты Льюиса в окислении этанола на катализаторе OMS-2. J. Phys. Chem. С 114 , 10544–10550 (2010).
CAS
Статья
Google Scholar
Фурукава, С., Суга, А. и Комацу, Т. Механическое исследование аэробного окисления амина над интерметаллическим Pd 3 Pb: согласованные промотирующие эффекты Pb и поддержка основности. ACS Catal. 5 , 1214–1222 (2015).
CAS
Статья
Google Scholar
Yamaguchi, K. et al. Зеленый окислительный синтез первичных амидов из первичных спиртов или альдегидов, катализируемый октаэдрическим молекулярным ситом на основе оксида марганца криптомеланового типа, OMS-2. Catal. Sci. Technol. 3 , 318–327 (2013).
CAS
Статья
Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Факты и информация о кислотном дожде
Кислотный дождь описывает любую форму осадков, которая содержит большое количество азотной и серной кислот.Это также может происходить в виде снега, тумана и крошечных кусочков сухого материала, которые оседают на Земле. Обычный дождь имеет слабокислый характер с pH 5,6, тогда как кислотный дождь обычно имеет pH от 4,2 до 4,4.
Причины кислотных дождей
Гниющая растительность и извергающиеся вулканы выделяют некоторые химические вещества, которые могут вызывать кислотные дожди, но большая часть кислотных дождей является результатом деятельности человека. Самыми крупными источниками являются угольные электростанции, фабрики и автомобили.
Когда люди сжигают ископаемое топливо, в атмосферу выбрасываются диоксид серы (SO 2 ) и оксиды азота (NO x ).Эти загрязнители воздуха реагируют с водой, кислородом и другими веществами с образованием переносимых по воздуху серной и азотной кислоты. Ветры могут распространять эти кислотные соединения в атмосфере на сотни миль. Когда кислотный дождь достигает Земли, он течет по поверхности со сточными водами, попадает в водные системы и опускается в почву.
На виртуальном кладбище деревьев европейской ели в Польше остались следы кислотных дождей. Вызывается, когда капли дождя поглощают загрязнения воздуха, такие как оксиды серы и азота, кислотный дождь ослабляет деревья, растворяя питательные вещества в почве до того, как растения смогут их использовать.
Фотография Дэвида Вудфолла / Getty Images
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Воздействие кислотных дождей
Диоксид серы и оксиды азота не являются основными парниковыми газами, которые способствуют глобальному потеплению, одному из основных последствий изменения климата; фактически, диоксид серы оказывает охлаждающее действие на атмосферу. Но оксиды азота способствуют образованию приземного озона, основного загрязнителя, который может быть вредным для людей.Оба газа вызывают проблемы с окружающей средой и здоровьем, потому что они могут легко распространяться через загрязнение воздуха и кислотные дожди.
Кислотные дожди имеют множество экологических последствий, особенно для озер, ручьев, водно-болотных угодий и других водных сред. Кислотные дожди делают такую воду более кислой, что приводит к большему поглощению алюминия почвой, который переносится в озера и ручьи. Эта комбинация делает воду токсичной для раков, моллюсков, рыб и других водных животных. (Узнайте больше о последствиях загрязнения воды.)
Некоторые виды переносят кислую воду лучше, чем другие. Однако во взаимосвязанной экосистеме то, что влияет на некоторые виды, в конечном итоге влияет на гораздо большее количество во всей пищевой цепочке, включая неводные виды, такие как птицы.
Кислотные дожди и туман также наносят ущерб лесам, особенно на возвышенностях. Кислотные отложения лишают почву необходимых питательных веществ, таких как кальций, и вызывают выброс алюминия в почву, что затрудняет поглощение воды деревьями. Кислоты также повреждают листья и иголки деревьев.
Воздействие кислотных дождей в сочетании с другими факторами экологического стресса делает деревья и растения менее здоровыми, более уязвимыми для холода, насекомых и болезней. Загрязняющие вещества также могут препятствовать воспроизводству деревьев. Некоторые почвы лучше нейтрализуют кислоты, чем другие. Но в районах, где «буферная способность» почвы низкая, например, в некоторых частях северо-востока США, вредное воздействие кислотных дождей намного сильнее.
Что такое загрязнение воздуха? Узнайте, как парниковые газы, смог и токсичные загрязнители влияют на изменение климата, а также на здоровье человека.
Кислотные отложения повреждают физические конструкции, такие как известняковые здания и автомобили. А когда он принимает форму вдыхаемого тумана, кислотные осадки могут вызвать проблемы со здоровьем, включая раздражение глаз и астму.
Что можно сделать?
Единственный способ бороться с кислотными дождями — это ограничить выбросы загрязняющих веществ, которые его вызывают. Это означает сжигание меньшего количества ископаемого топлива и установление стандартов качества воздуха.
В США Закон о чистом воздухе 1990 года нацелился на кислотные дожди, установив ограничения на загрязнение, которые помогли сократить выбросы диоксида серы на 88 процентов в период с 1990 по 2017 год.Стандарты качества воздуха также снизили выбросы диоксида азота в США на 50 процентов за тот же период. Эти тенденции помогли еловым лесам в Новой Англии и некоторым популяциям рыб, например, оправиться от повреждений, нанесенных кислотными дождями. Но восстановление требует времени, и почвы на северо-востоке США и востоке Канады только недавно показали признаки стабилизации питательных веществ.
Проблемы с кислотными дождями будут существовать до тех пор, пока будет использоваться ископаемое топливо, и такие страны, как Китай, которые в значительной степени полагались на уголь для производства электроэнергии и стали, борются с этими последствиями.Одно исследование показало, что кислотные дожди в Китае, возможно, даже способствовали смертельному оползню 2009 года. Китай вводит ограничения на выбросы диоксида серы, которые с 2007 года снизились на 75 процентов, а в Индии они увеличились вдвое.
Реакционная способность карбоновых кислот
Карбоновые кислоты
Карбоксильная функциональная группа, которая характеризует карбоновые кислоты, необычна тем, что состоит из двух функциональных групп, описанных ранее в этом тексте.Как видно из формулы справа, карбоксильная группа состоит из гидроксильной группы, связанной с карбонильной группой. Его часто записывают в сжатом виде как –CO 2 H или –COOH. Другие комбинации функциональных групп были описаны ранее, и были описаны значительные изменения в химическом поведении в результате групповых взаимодействий (например, фенол и анилин). В этом случае изменение химических и физических свойств в результате взаимодействия гидроксильной и карбонильной группы настолько велико, что комбинацию обычно рассматривают как отдельную и отличающуюся функциональную группу.
1. Номенклатура карбоновых кислот
Как и в случае с альдегидами, карбоксильная группа должна располагаться на конце углеродной цепи. В системе номенклатуры IUPAC углерод карбоксильной группы обозначен № 1, и другие заместители расположены и названы соответственно. Характерный суффикс ИЮПАК для карбоксильной группы — « oic acid », и следует проявлять осторожность, чтобы не путать эту систематическую номенклатуру с аналогичной общей системой. Эти две номенклатуры показаны в следующей таблице вместе с их температурами плавления и кипения.
Формула | Общее название | Источник | Название IUPAC | Точка плавления | Точка кипения | метановая кислота | 8,4 ºC | 101 ºC |
|---|---|---|---|---|---|
| CH 3 CO 2 H | уксусная кислота | уксус (L.ацетум) | этановая кислота | 16,6 ºC | 118 ºC |
| CH 3 CH 2 CO 2 H | пропионовая кислота | молочная кислота (Gk10 propanoic acid) | 0 protus -20,8 ºC | 141 ºC | |
| CH 3 (CH 2 ) 2 CO 2 H | масляная кислота | сливочное масло (L. butyrum) | бутановая кислота | 164 ºC | |
| CH 3 (CH 2 ) 3 CO 2 H | валериановая кислота | корень валерианы | пентановая кислота | -34.5 ºC | 186 ºC |
| CH 3 (CH 2 ) 4 CO 2 H | капроновая кислота | козы (L. caper) | гексановая кислота | 205 ºC | |
| CH 3 (CH 2 ) 5 CO 2 H | энантовая кислота | лозы (Gk. Oenanthe) | гептановая кислота | ||
| CH 3 (CH 2 ) 6 CO 2 H | каприловая кислота | козы (L.каперса) | октановая кислота | 16,3 ºC | 239 ºC |
| CH 3 (CH 2 ) 7 CO 2 H | пеларгоновая кислота | пеларгоновая кислота | 12,0 ºC | 253 ºC | |
| CH 3 (CH 2 ) 8 CO 2 H | каприновая кислота | козы (L. caper10 | 219 ºC |
Замещенные карбоновые кислоты названы либо системой IUPAC, либо общими названиями. Если вы не уверены в правилах номенклатуры ИЮПАК, вам следует ознакомиться с ними сейчас. Некоторые общепринятые названия, например, аминокислота треонин, не имеют никакого систематического происхождения, и их нужно просто запомнить. В других случаях в общих названиях используется обозначение греческой буквы для атомов углерода рядом с карбоксильной группой. Ниже приведены некоторые примеры обеих номенклатур.
Простые дикарбоновые кислоты общей формулы HO 2 C– (CH 2 ) n –CO 2 H
(где n = от 0 до 5) известны под общими названиями: оксалиновая (n = 0), малоновая (n = 1), янтарная (n = 2), глутаровая (n = 3), адипиновая (n = 4) и Пимелиновая (n = 5) кислоты. Общие названия, такие как эти, может быть трудно запомнить, поэтому были придуманы мнемонические средства, которые принимают форму запоминающейся фразы. Для этой группы соединений одна такая фраза: « O h M y
S uch G ood A pple P ie «.
2. Натуральные продукты на основе карбоновых кислот
Карбоновые кислоты широко распространены в природе, часто в сочетании с другими функциональными группами. Простые алкилкарбоновые кислоты, состоящие из четырех-десяти атомов углерода, представляют собой жидкости или легкоплавкие твердые вещества с очень неприятным запахом. жирные кислоты являются важными компонентами биомолекул, известных как липидов , особенно жиров и масел. Как показано в следующей таблице, эти длинноцепочечные карбоновые кислоты обычно называют их общими названиями, которые в большинстве случаев отражают их источники.Мнемоническая фраза для натуральных жирных кислот C 10 — C 20 каприновой, лауриновой, миристиновой, пальмитиновой, стеариновой и арахидиновой: « C urly,
L arry & M oe P erform S illy A ntics «(обратите внимание, что имена трех марионеток расположены в алфавитном порядке).
Интересно, что молекулы большинства природных жирных кислот имеют четное число атомов углерода . Аналогичные соединения, состоящие из нечетного числа атомов углерода, совершенно стабильны и были получены синтетическим путем.Поскольку природа создает эти длинноцепочечные кислоты, связывая вместе ацетатные звенья, неудивительно, что количество атомов углерода, составляющих природные продукты, кратно двум. Все двойные связи в ненасыщенных соединениях, перечисленных справа, являются цис (или Z).
ЖИРНЫЕ КИСЛОТЫ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Физические свойства и кислотность |
|---|
Свойства карбоновых кислот
1. Физические свойства карбоновых кислот
В таблице в начале этой страницы указаны точки плавления и кипения для гомологической группы карбоновых кислот, содержащих от одного до десяти атомов углерода.Точки кипения регулярно увеличивались с размером, а точки плавления — нет. Неразветвленные кислоты, состоящие из четного числа атомов углерода, имеют температуры плавления выше, чем гомологи с нечетными номерами, имеющие на один больше или на один атом углерода. Это отражает различия в силах межмолекулярного притяжения в кристаллическом состоянии. В таблице жирных кислот мы видим, что наличие цис-двойной связи значительно снижает температуру плавления соединения. Таким образом, пальмитолеиновая кислота плавится на 60º ниже, чем пальмитиновая кислота, и аналогичное уменьшение происходит для соединений C 18 и C 20 .Опять же, виноваты изменения в кристаллической упаковке и межмолекулярных силах.
Факторы, влияющие на относительные температуры кипения и растворимость в воде различных типов соединений, обсуждались ранее. Как правило, диполярные силы притяжения между молекулами повышают температуру кипения данного соединения, например, водородные связи. Водородная связь также является важным фактором водорастворимости ковалентных соединений. Чтобы освежить ваше понимание этих принципов, щелкните здесь.В следующей таблице приведены несколько примеров этих свойств для некоторых полярных соединений аналогичного размера (неполярный углеводородный гексан предоставлен для сравнения).
Формула | Название IUPAC | Молекулярный вес | Точка кипения | Растворимость в воде | ||||
|---|---|---|---|---|---|---|---|---|
| бутановая кислота | 88 | 164 ºC | очень растворимый | |||||
| CH 3 (CH 2 ) 4 OH | 1-пентанол | слаборастворимый | 88807 | |||||
| CH 3 (CH 2 ) 3 CHO | пентанал | 86 | 103 ºC | слаборастворимый | ||||
| CH 3 9024 2 CO 5 | этилэтаноат | 88 | 77 ºC | умеренно растворимый | ||||
| CH 3 CH 2 CO 2 CH 3 | метилпропаноат | 88 | 80 ºC | слаборастворимый | ||||
| CH 3 (CH 2 ) 2 CONH 2 | растворимый | |||||||
| CH 3 CON (CH 3 ) 2 | N, N-диметилэтанамид | 87 | 165 ºC | очень растворимый | 1-аминобутан | 87 | 103 ºC | очень растворимый |
CH 3 (CH 2 ) 310 CN 310 90itri7 п.| 140 ºC | слаборастворимый | | ||||||
| CH 3 (CH 2 ) 4 CH 3 | гексан | 86 | 69 ºC | inso растворимый |
Все первые пять позиций содержат кислородные функциональные группы, и относительно высокие температуры кипения первых двух явно обусловлены водородными связями.Карбоновые кислоты имеют исключительно высокие температуры кипения, в значительной степени из-за димерных ассоциаций, включающих две водородные связи. Структурная формула димера уксусной кислоты показана здесь. Когда указатель мыши проходит над рисунком, появляется диаграмма электронного облака. Высокие температуры кипения амидов и нитрилов в значительной степени обусловлены сильным дипольным притяжением, дополненным в некоторых случаях водородными связями.
2. Кислотность карбоновых кислот
Некоторые типичные карбоновые кислоты pK a перечислены в следующей таблице.Когда мы сравниваем эти значения со значениями сопоставимых спиртов, таких как этанол (pK a = 16) и 2-метил-2-пропанол (pK a = 19), становится ясно, что карбоновые кислоты являются более сильными кислотами на более чем десять степеней десяти! Кроме того, электроотрицательные заместители рядом с карбоксильной группой увеличивают кислотность.
Соединение | pK a | Соединение | pK a | |||||
|---|---|---|---|---|---|---|---|---|
| HCO 2 H | 3.75 | CH 3 CH 2 CH 2 CO 2 H | 4,82 | |||||
| CH 3 CO 2 H | 41 | 41 | 4,53 | |||||
| FCH 2 CO 2 H | 2,65 | CH 3 CH 2243 9024 H 2 24 CO 4,05 | ||||||
| ClCH 2 CO 2 H | 2.85 | CH 3 CH 2 CHClCO 2 H | 2,89 | |||||
| BrCH 2 CO 2 H | 2,90 | C 9024 902 902 902 2 H | 4,20 | |||||
| ICH 2 CO 2 H | 3,10 | pO 2 NC 6 H 4 63 CO 2 3,4 Класс 3 CCO 2 H | 0.77 | p-CH 3 OC 6 H 4 CO 2 H | 4,45 | |
Почему присутствие карбонильной группы, смежной с гидроксильной, должно иметь такое сильное влияние на кислотность гидроксильного протона? Чтобы ответить на этот вопрос, мы должны вернуться к природе кислотно-основного равновесия и определению pK a , проиллюстрированному общими уравнениями, приведенными ниже. Эти отношения были описаны в предыдущем разделе этого текста.
Мы знаем, что равновесие благоприятствует термодинамически более стабильной стороне, и что величина константы равновесия отражает разницу энергий между компонентами каждой стороны. В кислотно-основном равновесии равновесие всегда благоприятствует более слабой кислоте и основанию (это более стабильные компоненты). Вода является стандартной базой, используемой для измерений pK и ; следовательно, все, что стабилизирует сопряженное основание (A: (-) ) кислоты, обязательно сделает эту кислоту (H – A) сильнее и сместит равновесие вправо.Как карбоксильная группа, так и карбоксилат-анион стабилизируются за счет резонанса, но стабилизация аниона намного больше, чем стабилизация нейтральной функции, как показано на следующей диаграмме. В карбоксилат-анионе две участвующие структуры имеют равный вес в гибриде, а связи C – O имеют одинаковую длину (между двойной и одинарной связью). Эта стабилизация приводит к заметно повышенной кислотности, как показано на энергетической диаграмме, отображаемой при нажатии кнопки « Toggle Display ».
Виниловые кислоты |
Описанный здесь резонансный эффект, несомненно, является основным фактором исключительной кислотности карбоновых кислот. Однако индукционные эффекты также играют роль. Например, спирты имеют pK a , равное 16 или больше, но их кислотность увеличивается за счет электроноакцепторных заместителей в алкильной группе.Следующая диаграмма иллюстрирует этот фактор для нескольких простых неорганических и органических соединений (строка №1) и показывает, как индуктивное удаление электронов может также увеличить кислотность карбоновых кислот (строки №2 и 3). Кислый водород во всех примерах окрашен в красный цвет.
Вода менее кислая, чем перекись водорода, потому что водород менее электроотрицателен, чем кислород, и ковалентная связь, соединяющая эти атомы, поляризована, как показано. Спирты немного менее кислые, чем вода, из-за плохой электроотрицательности углерода, но хлоралгидрат, Cl 3 CCH (OH) 2 и 2,2,2, -трифторэтанол значительно более кислые, чем вода, из-за индуктивный отвод электронов электроотрицательными галогенами (и вторым кислородом в хлоралгидрате).В случае карбоновых кислот, если электрофильный характер карбонильного углерода снижается, кислотность карбоновой кислоты также будет уменьшаться. Точно так же увеличение его электрофильности увеличит кислотность кислоты. Уксусная кислота в десять раз слабее кислоты, чем муравьиная кислота (первые две позиции во втором ряду), подтверждая электронодонорный характер алкильной группы по отношению к водороду, как отмечалось ранее при обсуждении стабильности карбокатиона. Электроотрицательные заместители увеличивают кислотность за счет индуктивного отвода электронов.Как и ожидалось, чем выше электроотрицательность заместителя, тем больше увеличивается кислотность (F> Cl> Br> I), и чем ближе заместитель находится к карбоксильной группе, тем сильнее его влияние (изомеры в 3-м ряду). Заместители также влияют на кислотность производных бензойной кислоты, но резонансные эффекты конкурируют с индуктивными эффектами. Метоксигруппа является электронодонорной, а нитрогруппа — электроноакцепторной (последние три записи в таблице значений pK и ).
Для получения дополнительной информации о влиянии заместителей на кислотность карбоновых кислот щелкните здесь |
Получение карбоновых кислот |
|---|
Получение карбоновых кислот
Атом углерода карбоксильной группы имеет высокую степень окисления. Поэтому неудивительно, что многие химические реакции, используемые для их получения, являются окислениями.Такие реакции обсуждались в предыдущих разделах этого текста, и на следующей диаграмме суммировано большинство из них. Чтобы просмотреть предыдущее обсуждение любого из этих классов реакции, просто щелкните номер (от 1 до 4 ) или описательный заголовок группы.
Две другие полезные методики получения карбоновых кислот включают гидролиз нитрилов и карбоксилирование металлоорганических промежуточных соединений. Как показано на следующей диаграмме, оба метода начинаются с органического галогенового соединения, а карбоксильная группа в конечном итоге заменяет галоген.Оба метода требуют двух стадий, но они дополняют друг друга в том, что промежуточный нитрил в первой процедуре образуется в результате реакции S N 2, в которой цианид-анион является нуклеофильным предшественником карбоксильной группы. Гидролиз может быть катализируемым кислотой или основанием, но последние дают карбоксилатную соль в качестве исходного продукта.
Во второй процедуре электрофильный галогенид сначала превращается в сильно нуклеофильное производное металла, которое присоединяется к диоксиду углерода (электрофилу).Исходный продукт представляет собой соль карбоновой кислоты, которую затем необходимо высвободить обработкой сильной водной кислотой.
Существующая карбоновая кислота может быть удлинена одной метиленовой группой с использованием процедуры гомологации, называемой реакцией Арндта-Эйстерта. . |
Реакции карбоновых кислот
1. Солевое образование
Из-за своей повышенной кислотности карбоновые кислоты реагируют с основаниями с образованием ионных солей, как показано в следующих уравнениях.В случае гидроксидов щелочных металлов и простых аминов (или аммиака) образующиеся соли имеют ярко выраженный ионный характер и обычно растворимы в воде. Тяжелые металлы, такие как серебро, ртуть и свинец, образуют соли, имеющие более ковалентный характер (3-й пример), и растворимость в воде снижается, особенно для кислот, состоящих из четырех или более атомов углерода.
| RCO 2 H | + | NaHCO 3 | RCO 2 (-) Na (+) + CO 2 + H 2 O | |
| RCO 2 H | + | 3 №: | RCO 2 (-) (CH 3 ) 3 NH (+) | |
| RCO 2 H | + | AgOH | RCO 2 δ (-) Ag δ (+) + H 2 O |
Карбоновые кислоты и соли с алкильными цепями длиной более шести атомов углерода демонстрируют необычное поведение в воде из-за присутствия как гидрофильных (CO 2 ), так и гидрофобных (алкильных) участков в одной и той же молекуле.Такие молекулы называются амфифильными (греч. Amphi = обе) или амфифильными . В зависимости от природы гидрофильной части эти соединения могут образовывать монослои на поверхности воды или сферические кластеры, называемые мицеллами, в растворе.
2. Замещение гидроксильного водорода
Этот класс реакции можно назвать электрофильным замещением по кислороду и определяется следующим образом (E — электрофил). Некоторые примеры этой замены представлены в уравнениях (1) — (4).
| RCO 2 –H + E (+) | RCO 2 –E + H (+) |
Если E является сильным электрофилом, как в первом уравнении, он будет атаковать нуклеофильный кислород карбоновой кислоты напрямую, давая положительно заряженный промежуточный продукт. который затем теряет протон. Если E представляет собой слабый электрофил, такой как алкилгалогенид, необходимо преобразовать карбоновую кислоту в более нуклеофильный карбоксилат-анион, чтобы облегчить замещение.Это процедура, используемая в реакциях 2 и 3. Уравнение 4 иллюстрирует использование реагента диазометана (CH 2 N 2 ) для получения сложных метиловых эфиров. Этот токсичный и взрывоопасный газ всегда используется в виде эфирного раствора (ярко-желтого цвета). За реакцией легко следует выделение газообразного азота и исчезновение окраски реагента. Считается, что эта реакция протекает за счет быстрого связывания сильного электрофила с карбоксилат-анионом.
Природа реакций S N 2, как в уравнениях 2 и 3, описана в другом месте.Механизмы реакций 1 и 4 будут отображены при нажатии кнопки « Toggle Mechanism » под диаграммой.
Алкины могут также служить электрофилами в реакциях замещения такого типа, как показано на примере синтеза винилацетата из ацетилена. При добавлении внутримолекулярных карбоксильных групп к алкенам образуются циклические сложные эфиры, известные как лактоны . Чаще всего образуются пятичленные (гамма) и шестичленные (дельта) лактоны.Электрофильные частицы, такие как кислоты или галогены, являются необходимыми инициаторами лактонизации. Даже слабый электрофильный йод инициирует иодолактонизацию γ, δ- и δ, ε-ненасыщенных кислот. Примеры этих реакций будут отображены при нажатии кнопки « Другие примеры ».
3. Замещение гидроксильной группы
Реакции, в которых гидроксильная группа карбоновой кислоты заменяется другой нуклеофильной группой, важны для получения функциональных производных карбоновых кислот.Спирты представляют собой полезный эталонный химический состав, по которому можно оценивать этот класс превращений. В общем, гидроксильная группа оказалась плохой уходящей группой, и практически все спиртовые реакции, в которых она была потеряна, включали предшествующее превращение -ОН в лучшую уходящую группу. Это подтвердилось и в отношении карбоновых кислот.
Четыре примера этих реакций замещения гидроксила представлены следующими уравнениями. В каждом примере новая связь с карбонильной группой окрашена в пурпурный цвет, а нуклеофильный атом, который заменил гидроксильный кислород, окрашен в зеленый цвет.Гидроксильный фрагмент часто теряется в виде воды, но в реакции № 1 водород теряется в виде HCl, а кислород — в виде SO 2 . Эта реакция параллельна аналогичному превращению спиртов в алкилхлориды, хотя ее механизм отличается. Другими реагентами, которые производят аналогичное превращение в ацилгалогениды, являются PCl 5 и SOBr 2 .
Образования амида и ангидрида, показанные в уравнениях № 2 и 3, требуют сильного нагревания, и более мягкие процедуры, обеспечивающие эти превращения, будут описаны в следующей главе.
Реакция № 4 называется этерификацией , поскольку ее обычно используют для превращения карбоновых кислот в их сложноэфирные производные. Сложные эфиры могут быть получены разными способами; действительно, уравнения №1 и №4 на предыдущей диаграмме иллюстрируют образование трет-бутилового и метилового эфиров соответственно. Катализируемое кислотой образование этилацетата из уксусной кислоты и этанола, показанное здесь, является обратимым, с константой равновесия около 2. Реакцию можно принудительно завершить, удалив воду по мере ее образования.Этот тип этерификации часто называют этерификацией Фишера . Как и ожидалось, обратная реакция, катализируемый кислотой гидролиз сложного эфира , может быть проведена путем добавления избытка воды.
Вдумчивое изучение этой реакции (№4) заставляет задуматься, почему она классифицируется как гидроксильное замещение, а не как замещение водорода. Следующие уравнения, в которых гидроксильный атом кислорода карбоновой кислоты окрашен в красный цвет, а атом спирта — в синий, иллюстрируют это различие (обратите внимание, что исходные соединения находятся в центре).
| H 2 O + CH 3 CO-OCH 2 CH 3 | H-замещение |
| HO-замена | CH 3 CO-OCH 2 CH 3 + H 2 O |
Чтобы правильно классифицировать эту реакцию и установить правдоподобный механизм, атом кислорода спирта был изотопно помечен как 18 O (окрашен в синий цвет в нашем уравнении).Поскольку этот кислород содержится в сложноэфирном продукте, а не в воде, гидроксильная группа кислоты должна быть заменена при замещении. Механизм этой общей реакции этерификации будет отображен при нажатии кнопки « Esterification Mechanism »; Кроме того, после отображения схемы механизма координаты реакции для нее можно увидеть, щелкнув по головке зеленой стрелки « энергетическая диаграмма ». Механизмы присоединения-элиминирования такого типа протекают через тетраэдрические промежуточные соединения (такие как A и B на схеме механизмов) и являются обычными в реакциях ацильного замещения.Кислотный катализ необходим для повышения электрофильности карбоксильного атома углерода, чтобы он быстрее связывался с нуклеофильным кислородом спирта. Основной катализ бесполезен, потому что основание превращает кислоту в основание, сопряженное с карбоксилат-анионом, разновидность, у которой снижается электрофильный характер углерода.
Поскольку тетраэдрический промежуточный продукт занимает больше места, чем планарная карбонильная группа, можно ожидать, что скорость этой реакции будет замедляться при использовании объемных реагентов.Чтобы проверить это предсказание, этерификацию уксусной кислоты сравнивали с этерификацией 2,2-диметилпропановой кислоты, (CH 3 ) 3 CO 2 H. Здесь относительно небольшая метильная группа уксусной кислоты заменена более крупной. трет-бутильная группа, и более объемная кислота реагирует в пятьдесят раз медленнее, чем уксусная кислота. Увеличение количества спиртового реагента приводит к аналогичному снижению скорости.
Реакции восстановления и окисления |
|---|
Восстановление и окисление карбоновых кислот
1.Редукция
Атом углерода карбоксильной группы находится в относительно высокой степени окисления. Восстановление до 1º-спирта происходит быстро при обработке мощным металлогидридным реагентом, алюмогидридом лития, как показано следующим уравнением. Одна треть гидрида теряется в виде газообразного водорода, а исходный продукт состоит из солей металлов, которые необходимо гидролизовать для образования спирта. Это восстановление происходит за счет добавления гидрида к карбонильному углероду таким же образом, как указано ранее для альдегидов и кетонов.Полученная соль карбонилгидрата затем распадается на альдегид, который подвергается дальнейшему восстановлению.
| 4 RCO 2 H + 3 LiAlH 4 | эфир | 4 H 2 + 4 RCH 2 ОМ + оксиды металлов | H 2 O | 4 RCH 2 OH + гидроксиды металлов |
Диборан, B 2 H 6 , восстанавливает карбоксильную группу аналогичным образом.Боргидрид натрия, NaBH 4 , не восстанавливает карбоновые кислоты; однако выделяется газообразный водород и образуются соли кислоты. Непосредственное частичное восстановление карбоновых кислот до альдегидов невозможно, но такие превращения достигаются в две стадии с помощью определенных карбоксильных производных. Это будет описано позже.
2. Окисление
Поскольку он уже находится в высокой степени окисления, дальнейшее окисление удаляет углерод карбоксильной группы в виде диоксида углерода.В зависимости от условий реакции степень окисления оставшейся органической структуры может быть выше, ниже или неизменной. Следующие ниже реакции являются примерами декарбоксилирования (потеря CO 2 ). В первом случае карбоксильная группа замещается бромом, поэтому как атом углерода карбоксильной группы, так и оставшаяся органическая часть окисляются. Соли серебра также использовались, чтобы инициировать это преобразование, известное как реакция Хунсдикера . Вторая реакция представляет собой интересное бис-декарбоксилирование, при котором атомы органического остатка сохраняют свои первоначальные степени окисления.Тетраацетат свинца также окисляет монокарбоновые кислоты аналогично реакции №1. Наконец, третий пример иллюстрирует общее декарбоксилирование β-кетокислот, которое оставляет органический остаток в восстановленном состоянии (обратите внимание, что углерод СО 2 повысил степень окисления).
Три дополнительных примера реакции Хунсдикера и предлагаемый механизм превращения будут показаны выше при нажатии на диаграмму.Обратите внимание, что метадигалогенбензол, образующийся в реакции 4, не может быть получен прямыми реакциями галогенирования, поскольку хлор и бром являются орто / пара-направляющими заместителями. Кроме того, различные производные йодида могут быть получены непосредственно из соответствующих карбоновых кислот. Карбоксилатная соль тяжелого металла превращается в ацилгипогалогенид под действием галогена. Слабая связь кислород-галоген в этом промежуточном продукте гомолитически расщепляется при нагревании или на свету, и образующийся карбоксильный радикал декарбоксилатируется до алкильного или арильного радикала.Затем цепная реакция повторяет эти события. Поскольку ацилгипогалогениты являются источником электрофильного галогена, эта реакция протекает иначе, когда присутствуют двойные связи и реакционноспособные производные бензола. В этом отношении помните о добавлении гипогалогенных реагентов к двойным связям и легком бромировании анизола.
Для обзора основных реакций карбоновых кислот щелкните здесь
Улучшенные процессы удаления нафтеновых кислот (Технический отчет)
Чжан, Айхуа, Ма, Цишэн, Ван, Канши, Тан, Юнчунь и Годдард, Уильям А. Улучшенные процессы удаления нафтеновых кислот . США: Н. П., 2005.
Интернет. DOI: 10,2172 / 881034.
Чжан, Айхуа, Ма, Цишэн, Ван, Канши, Тан, Юнчун и Годдард, Уильям А. Улучшенные процессы удаления нафтеновых кислот . Соединенные Штаты. https://doi.org/10.2172/881034
Чжан, Айхуа, Ма, Цишэн, Ван, Канши, Тан, Юнчунь и Годдард, Уильям А.Пт.
«Улучшенные процессы удаления нафтеновых кислот». Соединенные Штаты. https://doi.org/10.2172/881034. https://www.osti.gov/servlets/purl/881034.
@article {osti_881034,
title = {Улучшенные процессы удаления нафтеновых кислот},
author = {Чжан, Айхуа и Ма, Цишэн и Ван, Канши и Тан, Юнчунь и Годдард, Уильям А},
abstractNote = {В течение последних трех лет мы следовали плану работы, предложенному в предложении, и прилагали все усилия для достижения целей проекта.Благодаря нашему большому объему творческой и продуктивной работы, включая как экспериментальные, так и теоретические аспекты, мы достигли важного технического прорыва в процессе удаления нафтеновой кислоты и получили глубокое понимание химии каталитического декарбоксилирования. В деталях, мы разработали комплексную методологию, которая будет служить для всех экспериментальных и теоретических работ. В результате наших экспериментальных исследований обнаружены четыре типа эффективных катализаторов реакции декарбоксилирования модельных соединений карбоновых кислот.Эксперимент по адсорбции выявил эффективность некоторых твердых материалов для адсорбции нафтеновой кислоты и снижения кислотности сырой нефти, которая может быть как природными минералами, так и синтезированными материалами. Испытания с сырой нефтью также дали многообещающие результаты, которые потенциально могут быть использованы на практике в нефтяной промышленности. Теоретическая работа предсказала несколько возможных механизмов каталитического декарбоксилирования, которые будут управлять путями декарбоксилирования в зависимости от типа используемых катализаторов.Расчет энергии активации реакции хорошо согласуется с нашими экспериментальными измерениями.},
doi = {10.2172 / 881034},
url = {https://www.osti.gov/biblio/881034},
journal = {},
number =,
объем =,
place = {United States},
год = {2005},
месяц = {12}
}
Окисление океана | Смитсоновский океан
Подкисление океана иногда называют «одинаково злым двойником изменения климата», и не зря: это серьезное и вредное последствие избытка углекислого газа в атмосфере, которого мы не видим и не чувствуем, потому что его последствия происходят под водой.По крайней мере, четверть углекислого газа (CO 2 ), выделяемого при сжигании угля, нефти и газа, не остается в воздухе, а вместо этого растворяется в океане. С начала индустриальной эры океан поглотил из атмосферы около 525 миллиардов тонн CO 2 , что в настоящее время составляет около 22 миллионов тонн в день.
Сначала ученые думали, что это может быть хорошо, потому что в воздухе остается меньше углекислого газа, который нагревает планету. Но в последнее десятилетие они осознали, что это замедленное потепление произошло за счет изменения химического состава океана.Когда углекислый газ растворяется в морской воде, вода становится более кислой, а pH океана (показатель кислотности или щелочности океана) падает. Несмотря на то, что океан огромен, достаточное количество углекислого газа может оказать серьезное воздействие. Только за последние 200 лет вода в океане стала на 30 процентов более кислой — быстрее, чем любое известное изменение химического состава океана за последние 50 миллионов лет.
Ученые раньше не беспокоились об этом процессе, потому что они всегда предполагали, что реки переносят из горных пород в океан достаточно растворенных химических веществ, чтобы поддерживать стабильный pH океана.(Ученые называют этот стабилизирующий эффект «буферизацией».) Но такое количество углекислого газа растворяется в океане так быстро, что эта естественная буферность не успевает за ним, что приводит к относительно быстрому падению pH в поверхностных водах. Поскольку эти поверхностные слои постепенно смешиваются с глубокой водой, это затрагивает весь океан.
Такое относительно быстрое изменение химического состава океана не дает морской жизни, которая эволюционировала в течение миллионов лет в океане с в целом стабильным pH, много времени для адаптации.Фактически, панцири некоторых животных уже растворяются в более кислой морской воде, и это только один из способов, которым подкисление может повлиять на жизнь океана. В целом ожидается, что это окажет драматическое и в основном негативное воздействие на экосистемы океана, хотя некоторые виды (особенно те, которые живут в устьях рек) находят способы адаптироваться к меняющимся условиям.
Однако, хотя химический состав можно предсказать, детали биологических воздействий — нет. Хотя ученые отслеживают pH океана более 30 лет, биологические исследования на самом деле начались только в 2003 году, когда стремительный сдвиг привлек их внимание и впервые был придуман термин «закисление океана».Что мы действительно знаем, так это то, что все будет выглядеть иначе, и мы не можем предсказать в деталях, как они будут выглядеть. Некоторые организмы выживут или даже будут процветать в более кислых условиях, в то время как другие будут бороться за адаптацию и даже могут исчезнуть. Помимо утраты биоразнообразия, подкисление затронет рыболовство и аквакультуру, угрожая продовольственной безопасности миллионов людей, а также туризму и другим странам, связанным с морем.
.
