Содержание
Соляная кислота | Chemwatch
Соляная кислота представляет собой жидкую форму своего газового аналога (гидрохлорид или HCl) и является результатом добавления воды к гидрохлориду. Он от слегка желтого до бесцветного, негорючий, но вызывает сильную коррозию.
Для чего используется соляная кислота?
Соляная кислота имеет множество применений в различных отраслях промышленности. Он обычно используется в качестве компонента при производстве батарей и фейерверков, а также для регулирования уровня pH в бассейнах. Его можно использовать для удаления ржавчины и окалины со стали.
Соляная кислота также используется в производстве питьевой воды (для дезинфекции воды), других напитков и пищевых продуктов (для улучшения вкуса и уменьшения порчи), а также в фармацевтических препаратах.
Соляная кислота защищает бассейны от водорослей
Опасности, связанные с соляной кислотой
Основные пути воздействия соляной кислоты — через рот и попадание на кожу или в глаза, при этом также возможен вдыхание.
Отравление соляной кислотой повлияет на покровы человека (волосы, кожа и ногти) и дыхательную систему (дыхательные пути и легкие).
Серьезность ваших симптомов будет зависеть от уровня и типа воздействия химического вещества.
Они могут включать;
- Прием внутрь:
- Тошнота и рвота
- Расстройство желудка
- Разъедание носа, горла, дыхательных путей, желудка и пищевода
- Контакт с кожей:
- рубцевание
- образование язвы
- Сильные ожоги
- Вдыхание:
- Охриплость
- Кашляющий
- Грудная боль
- Изъязвление и воспаление дыхательных путей
- Отек легких (избыток жидкости в легких)
Длительное воздействие соляной кислоты может вызвать дерматит, воспаление кожи, хронический бронхит и гастрит. Продолжительное воздействие низких концентраций кислоты, например, содержащихся в обычных продуктах питания и напитках, может привести к кариесу и обесцвечиванию зубов.
Безопасность соляной кислоты
Если вы проглотили соляную кислоту, немедленно обратитесь за медицинской помощью и не вызывайте рвоту, если не рекомендовано или не более чем в 15 минутах от больницы (вызывайте рвоту только у человека, который находится в сознании).
В случае контакта с кожей; снимите всю загрязненную одежду, обувь и аксессуары и немедленно промойте пораженный участок большим количеством воды с мылом. Перед повторным ношением загрязненную одежду необходимо выстирать. Если симптомы не исчезнут, обратитесь к врачу.
При попадании в глаза промойте глаза водой не менее 15 минут (не забудьте под веками). Снять контактные линзы должен только опытный профессионал.
Если человек вдохнул химическое вещество, отнесите его из зараженной зоны к ближайшему источнику свежего воздуха и следите за его дыханием. Если они не дышат, вы можете выполнить СЛР (при наличии соответствующей квалификации) с помощью одностороннего клапана или защитной маски, чтобы обезопасить себя от остаточных химических веществ, которые могут присутствовать в дыхательных путях пациента.
Безопасное обращение с соляной кислотой
Кислоты особенно вредны для глаз, поэтому необходимо надевать защитные очки.
Безопасный душ и фонтанчики для аварийной промывки глаз должны быть доступны в непосредственной близости от потенциального воздействия химического вещества, и всегда должна быть соответствующая вентиляция.
СИЗ, такие как защитные очки с боковыми щитками, пыленепроницаемая одежда, перчатки, фартуки и маски / респираторы, необходимы при работе с химическими веществами. Также следует избегать ношения контактных линз.
Ингибированная соляная кислота НАПОР-HCl
ПродукцияИнгибированная соляная кислота НАПОР-HCl
Ингибированная соляная кислота НАПОР-HCl по составу представляет смесь соляной кислоты с массовой долей хлористого водорода 20-24% (синтетической, технической или являющейся полупродуктом химических производств) и ингибитора кислотной коррозии НАПОР КБ. Предназначена для кислотной обработки и подавления сульфатвосстанавливающих бактерий призабойной зоны нефтяных скважин, для травления черных металлов и изделий из них, а также для химической очистки котлов и аппаратов.
Ингибированная соляная кислота
Ингибированная соляная кислота – это едкая, негорючая жидкость, растворяющая большинство металлов и оксидов. Однако, к ней устойчив фарфор, керамика, стекло, гранит. Кислота хорошо смешивается с водой, эфиром и бензолом.
Ингибированная соляная кислота способна разлагать любые отложения, в частности и карбонатные, при этом, не оказывая существенных негативных воздействий на металл. Данное свойство возможно благодаря растворенному в кислоте ингибитору.
Способность ингибированной соляной кислоты растворять карбонатные отложения нашла широкое применение в нефтяной промышленности. Ее широко применяют для воздействия на пласты при нефтеразработках. Данная кислота предназначена для кислотной обработки скважин, а также, применяется для подавления сульфатвосстанавливающих бактерий.
Так как пласты, богатые нефтью, зачастую далеки от идеального для начала добычи нефти состояния, одним из важнейших этапов нефтеразработки является подготовительный. От того, насколько качественно он будет завершен, зависит качество нефти и нефтерподуктов, а так же их цена. Слишком грязная нефть, в которой присутствует много примесей, требует качественной очистки, дорогостоящих реагентов. Поэтому, при добыче важно учесть все возможные вложения, связанные с улучшением качеств нефтяных пластов. Одной из распространенных проблем являются коррозии различного типа, которые действуют как на нефтепромысловое оборудование, так и на сам продукт. Для улучшения состояния пород, сложенных из известняка, пород-доломитов, а также, загрязненных карбонатными отложениями, применяют ингибированную соляную кислоту. Она улучшает сообщаемость скважин с пластом, расширяет и очищает трещины и поры в породе от отложений, микроорганизмов.
От того, насколько качественно он будет завершен, зависит качество нефти и нефтерподуктов, а так же их цена. Слишком грязная нефть, в которой присутствует много примесей, требует качественной очистки, дорогостоящих реагентов. Поэтому, при добыче важно учесть все возможные вложения, связанные с улучшением качеств нефтяных пластов. Одной из распространенных проблем являются коррозии различного типа, которые действуют как на нефтепромысловое оборудование, так и на сам продукт. Для улучшения состояния пород, сложенных из известняка, пород-доломитов, а также, загрязненных карбонатными отложениями, применяют ингибированную соляную кислоту. Она улучшает сообщаемость скважин с пластом, расширяет и очищает трещины и поры в породе от отложений, микроорганизмов.
Кислотная обработка скважин — эффективный метод очистки продуктивного пласта от продуктов загрязнения, попавших или образовавшихся в призабойной зоне в процессе вскрытия бурением, цементажа обсадной колонны или при эксплуатации скважины.
Дебит скважины во многом зависит от проницаемости продуктивного пласта (главным образом его призабойной зоны – ПЗП), которая всегда меняется в процессе заканчивания и эксплуатации скважины. Коллекторские свойства неизбежно ухудшаются вследствие набухания глин, выпадения солей из пластовых вод, образования стойких эмульсий, отложения смол, парафинов и продуктов коррозии в фильтровой части ствола, гидратации пород, размножения сульфатвосстанавливающих бактерий.
Кроме применения в нефтедобывающей отрасли, ингибированная соляная кислота используется для травления и очистки окисленных слоев черных и цветных металлов, а также, для химической очистки от неорганических отложений, накипи котлов или аппаратов.
Преимуществом соляной кислоты ингибированной является то, что она сохраняет антикоррозийную стабильность в течение всего срока хранения. При этом на покрытие цистерн она не действует отрицательно, а также, не влияет на качество нефти и на процесс нефтепереработки.
АО «НАПОР» предлагает соляную ингибированную кислоту НАПОР-HCl для кислотной обработки и подавления сульфатвосстанавливающих бактерий (СВБ) призабойной зоны нефтяных скважин, с целью улучшения сообщаемости пластов и скважин между собой, а также, очистки и расширения пор и трещин. Также, применяют соляную ингибированную кислоту НАПОР-HCl для того, чтобы снять фильтрационное сопротивление коллекторов, которые сложены из карбонатных пород (доломитов и известняков) или загрязненных карбонатными отложениями.
Также, применяют соляную ингибированную кислоту НАПОР-HCl для того, чтобы снять фильтрационное сопротивление коллекторов, которые сложены из карбонатных пород (доломитов и известняков) или загрязненных карбонатными отложениями.
Классификация и характерные химические свойства кислот.
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.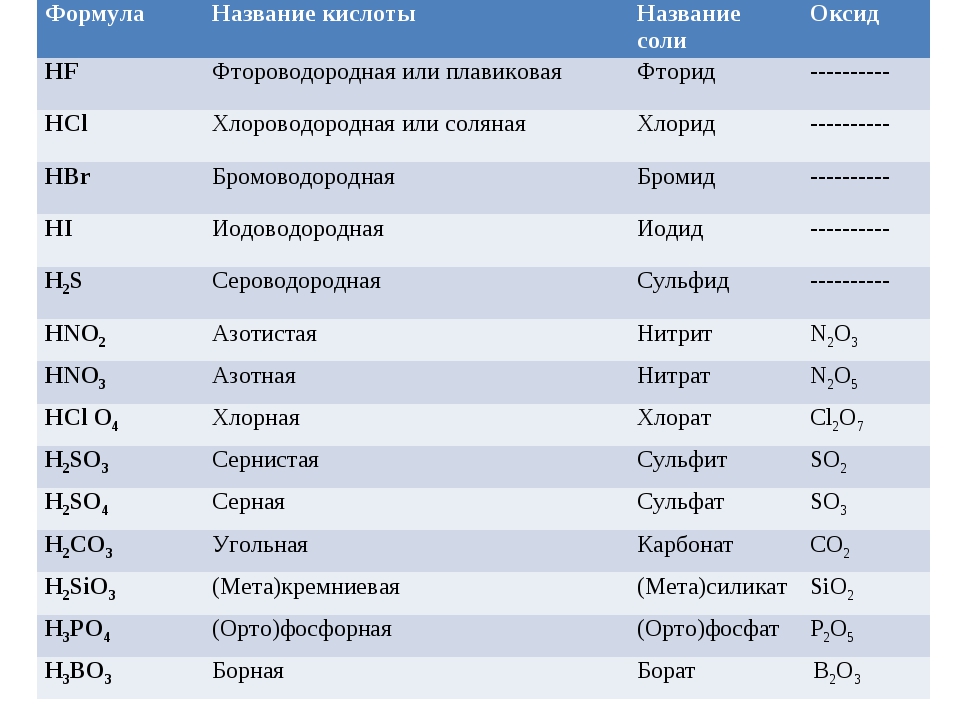
| Летучие | Нелетучие |
H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
практически все кислоты кроме HNO3 и H2SO4 (конц. | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4.
 Взаимодействие кислот с основаниями и амфотерными гидроксидами
Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
Кислоты
3.
КИСЛОТЫ
Кислотами
называются
сложные
вещества,
состоящие из
атомов
водорода и
кислотных
остатков.
С
точки зрения
теории
электролитической
диссоциации
кислоты это
электролиты, диссоциирующие
в водных
растворах
на катионы
только водорода
Н+ и анионы
кислотных
остатков.
Если
кислота
одноосновная,
то она диссоциирует
в одну
ступень:
HCI
H+
+ CI
HNO3 H+ + NO3
Если
кислота
многоосновная,
то она диссоциирует
ступенчато:
H3PO4 H+ + H2PO4
(первая
ступень),
H2PO4 H+ + HPO42
(вторая ступень),
HPO42 H+ + PO43
(третья
ступень).
Ступенчатой
диссоциацией
многоосновных
кислот
объясняется
образование
кислых солей.
Номенклатура
кислот.
1. Бескислородные
кислоты
В бескислородных
кислотах
называется
кислотообразующий
элемент и
добавляется
окончание
водородная:
HCl хлороводородная
кислота
H2S
сероводородная
кислота
2.
Кислородосодержащие
кислоты.
Составление
названий
кислородосодержащих
кислот
рассмотрим
на следующих
примерах:
H2SO4
серная
кислота,
H3AsO4
мышьяковая
кислота.
Называется
кислотообразующий
элемент с суффиксом
н или ов (если
степень
окисления
элементов
максимальная).
Если
степень
окисления
элемента
промежуточная,
то в
названии
используется
еще и суффикс
ист:
H2SO3
сернистая
кислота,
H3AsO3
мышьяковистая
кислота.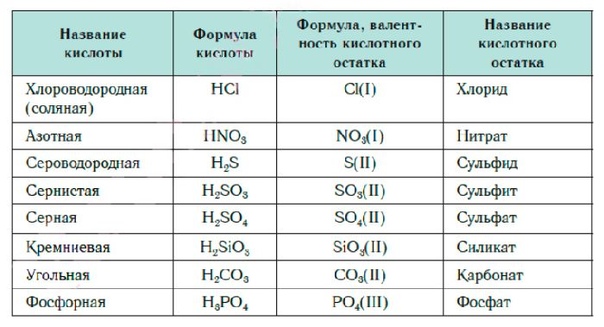
Когда
элемент
образует
много
кислородсодержащих
кислот
(например,
хлор), то, по
мере убывания
степени
окисления
кислотообразующего
элемента, они
имеют
следующие
названия:
HO4
хлорная
кислота;
HO3
хлорноватая
кислота;
HO2
хлористая кислота;
HO
хлорноватистая
кислота.
Иногда
в молекулах
кислородосодержащих
кислот
элемент
имеет
одинаковую
степень окисления,
тогда в
названии
используются
приставки,
которые
указывают на
различное
содержание
воды в
кислоте:
мета
— мало воды,
орто —
много воды.
Например:
P2O5 + H2O →
2HO3
метафосфорная
кислота,
P2O5 + 3H2O →
2H3O4
ортофосфорная
кислота.
При
составлении
формул
придерживаются
следующих
правил:
1. Бескислородные
кислоты.
Зная
название
кислоты,
записываем
сначала
водород, а затем
кислотообразующий
элемент.
Степень окисления
водорода в
кислотах
всегда +1. Степень
окисления
элемента
отрицательная.
Она равна
номеру
группы ПСЭ (в
которой
находится
элемент)
минус восемь.
Например:
сероводородная
кислота
элемент сера,
расположен в
шестой
группе ПСЭ. 6 — 8 = -2.
Степень
окисления серы
2. Записываем
символы
водорода и
серы Н+S-2, т.к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
2.
Кислородсодержащие
кислоты.
По
суффиксам в
названии
кислоты
определяем
степень
окисления кислотообразующего
элемента. Эта
степень
окисления
сохраняется
в кислотном
оксиде. По
приставке в
названии
определяем
количество
воды в
кислоте.
Например:
метафосфорная
кислота
кислотообразующий
элемент
фосфор.
Суффикс н
показывает,
что он имеет
максимальную
степень
окисления,
фосфор в
пятой группе
ПСЭ,
следовательно,
максимальная
степень
окисления +5,
она
сохраняется
и в оксиде
фосфора Р2+5О5-2.
Приставка
мета
говорит о
том, что воды
в кислоте
минимальное
количество.
В
формулах
кислородосодержащих
кислот
сначала
записывается
водород, затем
кислотообразующий
элемент и
кислород. Индексами
выравнивают
число
положительных
и
отрицательных
зарядов. Если
они четные,
то их
сокращают и
ставят перед
формулой соответствующий
коэффициент.
+5 -2
P2O5 + H2O →
H2P2O6 →
2HPO3
метафосфорная
кислота,
+5 -2
P2O5 + 2H2O →
H4P2O7
пирофосфорная
кислота,
+5 -2
P2O5 + 3H2O →
H6P2O8 →
2H3PO4
ортофосфорная
кислота.
Классификация
кислот по
следующим
признакам:
По
содержанию
кислорода:
1. Кислородосодержащие
2. Бескислородные
Бескислородные
HNO3, H2SO4, H3PO4
HCl, HJ, H2S
По основности
(по числу
атомов
водорода в
молекуле
кислоты)
1. Одноосновные
2. Многоосновные
HCl, HNO3, HBr
H2SO4, H3PO4, H2S
По силе (по
степени
диссоциации)
1. Сильные (α =100 %)
2. Слабые (α < 100 %)
HCl, HNO3, H2SO4
H2S, HNO2, H2CO3
По
растворимости
1. Растворимые
Растворимые
2. Нерастворимые
HCl, HNO3
H2SiO3, H2MoO4
Получение
1. Бескислородные
кислоты
получают
синтезом из
простых веществ
летучих
соединений с
последующим
растворением
их в воде.
Например:
H2 + Cl2 →
2HCl хлороводород,
газ.
Растворяем
его в воде,
получаем HCl хлороводородную
кислоту
жидкость.
2.
Растворение
соответствующего
оксида в воде:
P2O5 + 3H2O →
2H3PO4.
3.
Электролиз
растворов
солей:
Na2SO4 + 4H2O H2SO4
+2H2+O2+2NaОН.
4.
Взаимодействие
растворимой
соли с сильной
кислотой
(получают
нерастворимые,
легколетучие,
слабые
кислоты):
Na2SiO3 + 2HCl → 2NaCI
+ H2SiO3
H2O
Na2CO3
+ 2HCl → 2NaCI + H2 CO3
CO2
Физические
свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Химические
свойства
1.
Изменение
цвета
индикаторов:
фенолфталеин
бесцветный,
лакмус
розовый,
метилоранж
красный.
2.
Взаимодействие
с
основаниями
с образованием
соли и воды
(реакция
нейтрализации):
H2SO4 + 2NaOH →
Na2SO4 + 2H2O.
3.
Взаимодействие
с основными
оксидами:
H2SO4 + Na2O →
Na2SO4 + 2H2O.
4.
Взаимодействие
с солями:
а)
менее
летучие
кислоты
вытесняют
более летучие
из их солей:
H2SO4 + NaCI
→ NaHSO4 + HCI
конц. тверд.
б)
более
сильные
кислоты
вытесняют
менее сильные
из растворов
их солей:
3HCI + Na3PO4 →
3NaCI + H3PO4.
5.
Взаимодействие
с металлами
различных
кислот
протекает
согласно
положению
металлов в
ряду
напряжений,
который
характеризует
окислительно-восстановительную
способность
электрохимической
системы
металл — ион
металла.
Li К Ca Мg Al Ti Cr Zn
Fe Ni Sn Pb H Cu Ag Au
Исходя
из этого, все
металлы
удобно
разделить на
три условные
группы:
Активные | Средней активности | Малоактивные |
Li К Ca Мg Al | Ti Cr Zn Fe | Cu Ag Au |
Взаимодействие
металлов с хлороводородной
кислотой
.
Активные | Средней | Малоактивные |
Реагируют | Реагируют (пассивируется | Не |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные
и
щелочноземельные
металлы с растворами
кислот
взаимодействуют
в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O →
2NaОН + H2
2). NaОН
+ HCI→ NaCI + H2O.
Малоактивные
металлы,
расположенные
в ряду
напряжений
правее
водорода, из
разбавленного
раствора
кислоты его
не вытесняют:
Cu + HCl
Взаимодействие
металлов с
разбавленной
серной
кислотой
Активные | Средней | Малоактивные |
Реагируют | Реагируют (пассивируется | Не |
Например:
Zn + H2SO4 → ZnSO4
+ H2
Малоактивные
металлы,
расположенные
в ряду
напряжений
правее
водорода, из
разбавленного
раствора
кислоты его
не вытесняют:
Cu + H2SO4
Взаимодействие
металлов с
концентрированной
серной
кислотой
Активные | Средней | Малоактивные |
Реагируют | Реагируют (пассивируются | Реагируют не Au, Pt |
В
результате
взаимодействия
образуются сульфат
металла,
вода и один
из продуктов
окисления
серной
кислоты:
S , H2S, SO2 | S , H2S, SO2 | |
Например: Zn +
2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S +
4H2O,
3Zn
+ 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.
Холодная
концентрированная
серная кислота
пассивирует
Al, Fe; при
нагревании пассивирующие
пленки
растворяются,
и
взаимодействие
с кислотой
протекает
интенсивно.
Взаимодействие
металлов с
разбавленной
азотной
кислотой
Активные | Средней | Малоактивные |
Реагируют | Реагируют (пассивируется | Реагируют не Au, Pt |
В
результате
взаимодействия
образуются нитрат
металла,
вода
и один из
продуктов
окисления
азотной кислоты:
NH3, | | |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2
+ NH4NO3 + 3H2O.
Взаимодействие
металлов с
концентрированной
азотной
кислотой
Активные | Средней | Малоактивные |
Реагируют | Реагируют (пассивируются | Реагируют не Au, Pt |
В
результате
взаимодействия
образуются нитрат
металла, вода
и NO2
(газ бурого
цвета). При
взаимодействии
с кислотой
активных
металлов
возможно
выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При
взаимодействии
азотной
кислоты любой
концентрации
и
концентрированной
серной с
металлами водород
никогда не
выделяется.
Холодная
концентрированная
азотная
кислота пассивирует
следующие
металлы Fe, Cr, Al, Ti, но при
нагревании
взаимодействие
этих металлов
с кислотой
протекает
энергично.
6.
Взаимодействие
с
неметаллами
азотной и концентрированной
серной
кислот:
3P + 5HNO3 + 2H2O → 3H3PO4
+ 5NO,
C + 2H2SO4(к)
→ CO2 + 2SO2 + 2H2O.
7.
При
нагревании
некоторые
кислоты
разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт
№ 1. Взаимодействие
Взаимодействие
кислотного
оксида
с
водой
Стеклянной
палочкой
взять
кусочек
оксида
фосфора (V) и
смешать его с
небольшим
количеством
воды. В
полученный
раствор
добавить 23
капли лакмуса.
Написать
уравнение
реакции.
Опыт
№ 2. Взаимодействие
соли с
кислотой
Положить
в пробирку
немного
сухого ацетата
натрия
CH3COONa
или другой
соли
уксусной
кислоты и
добавить
небольшое
количество
разбавленной
серной
кислоты.
Образовавшаяся
кислота
может быть
обнаружена
по запаху. При
выяснении
запаха нельзя
нюхать
вещество
прямо из
пробирки, так
как вдыхание
газов и паров
может вызвать
сильное
раздражение
дыхательных
путей. Необходимо
ладонью руки
сделать
легкие движения
от пробирки к
носу. В этом
случае в нос
будет
попадать
смесь газа с
воздухом и
сильного
раздражения
не
произойдет.
В
пробирку
внести 56
капель
концентрированного
раствора
силиката
натрия Na2SiO3
и постепенно
добавить 56
капель
соляной кислоты,
непрерывно
встряхивая
пробирку. Образуется
Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Опыт
№ 3. Взаимодействие
основного
оксида с
кислотой
К
небольшому
количеству
оксида
магния в пробирке
прилить
небольшое
количество
соляной
кислоты.
Отметить
растворение
осадка.
Написать уравнения
реакции.
Какая соль
образовалась?
Опыт
№ 4. Взаимодействие
основания с
кислотой
(реакция
нейтрализации)
Налить в
фарфоровую
чашку 10 см3 2
моль/дм3
раствора гидроксида
натрия.
Добавить 12
капли
фенолфталеина,
чтобы
окраска
стала
малиновой,
что подтверждает
наличие
щелочи в
растворе. Затем
в пробирку по
каплям
добавлять
раствор
соляной
кислоты, до
обесцвечивания
раствора.
Выпарить
содержимое
чашки и
убедиться,
что
образовалась
соль.
Написать
уравнение реакции.
Соляная кислота
СПЕЦПРЕДЛОЖЕНИЯ
Принимаем заявки на поставку Гипохлорита натрия марки А по ГОСТ 11086-76 в автоцистернах по 23 тонны.
Соляная кислота (хлороводородная, хлористоводородная, хлористый водород) — сильная одноосновная кислота, представляющая собой бесцветную едкую жидкость, «дымящую»на воздухе. Хорошо растворима в воде.
Область применения:
1. в цветной и черной металлургии для снятия оксидных плёнок с поверхности металлов
2. для получения хлоридов металлов
3. для химической очистки воды, не используемой в питьевом водоснабжении
4. в пищевой промышленности в качестве регулятора кислотности рН
Качественные показатели на Соляную кислоту ХЧ ГОСТ 3118-77 представлены в таблице:
НАИМЕНОВАНИЕ ПОКАЗАТЕЛЕЙ | НОРМА по ГОСТ 3118-77 «ХЧ»
|
1. | выд. испытание |
2. Массовая доля соляной кислоты (HCl), % | 35 — 38 |
3. Массовая доля остатка после прокалывания ( в виде сульфатов), %, не более
| 0,0005 |
4. Массовая доля сульфитов (SO3), %, не более
| 0,0002 |
5. Массовая доля сульфатов (SO4), %, не более
| 0,0002 |
6. Массовая доля свободного хлора (Cl), %, не более
| 0,00005 |
7. Массовая доля аммонийных солей (NH4), %, не более
| 0,0003 |
8. Массовая доля тяжелых металлов (Pb), %, не более
| 0,00005 |
9. Массовая доля железа (Fe), %, не более
| 0,00005 |
10.
| 0,000005 |
Соляная кислота ХЧ ГОСТ 3118-77 в канистрах по 37 кг и мелкой таре по 1,2 кг всегда в наличии на складе в г. Саратове. По вопросам приобретения Соляной кислоты ХЧ необходимо связаться по телефонам (8452) 33-85-11, 33-85-17, 25-24-51.
Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Рабочие среды / / Хлороводород HCl, он же — Cоляная кислота. Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: | |||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||
| Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||
Наименование | Норма |
Внешний | Испытания |
Массовая | 35 |
Массовая | 0,0005 |
Массовая | 0,00005 |
Массовая | 0,0002 |
Массовая | 0,0002 |
Массовая | 0,0003 |
Массовая | 0,00005 |
Массовая | 0,000005 |
Массовая | 0,00005 |
Гарантийный | |
Наименование | Норма |
Массовая | 35-38 |
Остаток | 5*10-4 |
Алюминий, | 4*10-6 |
Бор, | 1*10-6 |
Висмут, | 1*10-6 |
Железо, | 4*10-6 |
Кадмий, | 5*10-6 |
Калий, | не |
Кальций, | не |
Кобальт, | 1*10-6 |
Кремневая | 1*10-4 |
Магний, | 5*10-6 |
Марганец, | 1*10-6 |
Медь, | 5*10-7 |
Мышьяк, | 1*10-6 |
Натрий, | не |
Никель, | 1*10-6 |
Олово, | 3*10-6 |
Свинец, | 1*10-6 |
Сера | 3*10-4 |
Серебро, | 5*10-7 |
Сурьма, | 1*10-5 |
Титан, | 1*10-6 |
Фосфор, | 1*10-6 |
Цинк, | 5*10-6 |
Свободный | 1*10-4 |
Массовая | 35-38 |
Остаток | 5*10-4 |
Алюминий, | 4*10-6 |
Бор, | 1*10-6 |
Гарантийный | |
Наименование | Норма |
Внешний | Прозрачная |
Массовая | 35 |
Массовая | 0,001 |
Массовая | 0,010 |
Массовая | 0,002 |
Массовая | 0,0001 |
Массовая | 0,0003 |
Гарантийный | |
14.2: Кислоты: свойства и примеры
Цели обучения
- Изучить свойства кислот.
Многие люди любят пить кофе. Чашка с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Через некоторое время накапливаются известковые отложения, которые замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и пропустить его через цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускоряет процесс пивоварения до исходной скорости.Только не забудьте пропустить воду в процессе заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень часто встречаются в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток.Некоторые кислоты являются сильными электролитами, потому что они полностью ионизируются в воде, давая большое количество ионов. Другие кислоты представляют собой слабые электролиты, которые существуют в основном в неионизированной форме при растворении в воде.
- Кислоты имеют кислый вкус. Лимоны, уксус и кислые конфеты содержат кислоты.
- Кислоты изменяют цвет определенных кислотно-щелочных индикаторов. Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что серия активности — это список металлов в порядке убывания их реакционной способности.
 Металлы, которые находятся выше водорода в ряду активности, будут заменять водород кислоты в реакции однократного замещения, как показано ниже:
Металлы, которые находятся выше водорода в ряду активности, будут заменять водород кислоты в реакции однократного замещения, как показано ниже:
\ [\ ce {Zn} \ left (s \ right) + \ ce {H_2SO_4} \ left (aq \ right) \ rightarrow \ ce {ZnSO_4} \ left (aq \ right) + \ ce {H_2} \ left (g \ right) \ label {eq1} \] - Реакция взаимодействия кислоты и основания с образованием соединения соли и воды.Когда равные моли кислоты и основания объединяются, кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначенное как соль, и вода.
Вам не составит труда назвать несколько распространенных кислот (но вы можете обнаружить, что перечисление оснований немного сложнее). Ниже приведен частичный список некоторых распространенных кислот, а также некоторые химические формулы:
Имя химика | Общее название | Использует |
|---|---|---|
соляная кислота, HCl | соляная кислота (используется в бассейнах) и желудочная кислота HCl | Используется при очистке (рафинировании) металлов, при обслуживании плавательных бассейнов и для уборки дома. |
серная кислота, H 2 SO 4 | Используется в автомобильных аккумуляторах и при производстве удобрений. | |
азотная кислота, HNO 3 | Используется при производстве удобрений, взрывчатых веществ и при добыче золота. | |
уксусная кислота, HC 2 H 3 O 2 | уксус | Основной ингредиент в уксусе. |
угольная кислота, H 2 CO 3 | отвечает за «шипение» в газированных напитках | В качестве ингредиента газированных напитков. |
лимонная кислота, C 6 H 8 O 7 | Используется в продуктах питания и диетических добавках. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. | |
ацетилсалициловая кислота, C 6 H 4 (OCOCH 3 ) CO 2 H | аспирин | Активный ингредиент аспирина. |
Что именно делает кислоту кислотой и что заставляет основание действовать как основание? Взгляните на формулы, приведенные в таблице выше, и сделайте предположение.
соляная кислота
Соляная кислота — это сильная коррозионная минеральная кислота, которая используется во многих промышленных целях.{-} (водн.)} \]
Соляная кислота поэтому может использоваться для получения хлоридных солей. Соляная кислота — сильная кислота, так как полностью диссоциирует в воде. Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Серная кислота
Серная кислота — это сильная коррозионная сильная минеральная кислота с молекулярной формулой \ (\ ce {h3SO4} \). Серная кислота является дипротоновой кислотой и имеет широкий спектр применения, включая использование в бытовых кислотных очистителях водостока, [ в качестве электролита в свинцово-кислотных аккумуляторах и в различных чистящих средствах.Это также центральное вещество в химической промышленности.
Рисунок \ (\ PageIndex {1} \): Капли концентрированной серной кислоты быстро разлагают кусок хлопкового полотенца путем обезвоживания. (CC BY-SA 3.0; Токсичный ходок).
Поскольку гидратация серной кислоты термодинамически благоприятна (и сильно экзотермична), а ее сродство к воде достаточно велико, серная кислота является отличным дегидратирующим агентом. Концентрированная серная кислота обладает очень сильным обезвоживающим свойством, удаляя воду (\ (\ ce {h3O} \)) из других соединений, включая сахар и другие углеводы, и выделяя углерод, тепло и пар.Серная кислота ведет себя как обычная кислота в реакции с большинством металлов, выделяя газообразный водород (уравнение \ ref {Eq1}).
\ [\ ce {M + h3SO4 → M (SO4) + h3} \ label {Eq1} \]
Азотная кислота
Азотная кислота (\ (\ ce {HNO3} \)) — очень коррозионная минеральная кислота, которая также широко используется в качестве сильного окислителя. Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем реакции диоксида азота (\ (\ ce {NO_2 (g)} \)) с водой.
\ [\ ce {3 NO2 (г) + h3O (l) → 2 HNO3 (ag) + NO (г)} \]
Азотная кислота реагирует с большинством металлов, но детали зависят от концентрации кислоты и природы металла. Разбавленная азотная кислота ведет себя как обычная кислота в реакции с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет газ \ (\ ce {h3} \)):
\ [\ ce {Mg + 2 HNO3 → Mg (NO3) 2 + h3} \]
\ [\ ce {Mn + 2 HNO3 → Mn (NO3) 2 + h3} \]
\ [\ ce {Zn + 2 HNO3 → Zn (NO3) 2 + h3} \]
Азотная кислота — это едкая кислота и мощный окислитель.Основная опасность, которую он представляет, — это химический ожог, так как он выполняет кислотный гидролиз с белками (амидом) и жирами (сложным эфиром), что, следовательно, разлагает живую ткань (рисунок \ (\ PageIndex {2} \)). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином
.
Рисунок \ (\ PageIndex {2} \): ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).
Угольная кислота
Угольная кислота представляет собой химическое соединение с химической формулой \ (\ ce {h3CO3} \), а также иногда называют растворы углекислого газа в воде (газированная вода), потому что такие растворы содержат небольшие количества \ (\ ce {h3CO3 (водн.)} \).Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии углекислота вызывает растворение известняка с образованием бикарбоната кальция, что приводит к образованию многих особенностей известняка, таких как сталактиты и сталагмиты. Угольная кислота представляет собой полипротонную кислоту, в частности, она дипротонна, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Когда диоксид углерода растворяется в воде, он находится в химическом равновесии (обсуждается в главе 15), образуя угольную кислоту:
\ [\ ce {CO2 + h3O <=> h3CO3} \]
Реакцию можно подтолкнуть к тому, чтобы реагенты генерировали \ (\ ce {CO2 (g)} \) из раствора, что является ключом к пузырькам, наблюдаемым в газированных напитках (рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {3} \): стакан газированной воды. (CC BY-SA 3.0; Невит Дильмен).
Муравьиная кислота
Муравьиная кислота (\ (\ ce {HCO2H} \)) — простейшая карбоновая кислота, которая является важным промежуточным продуктом в химическом синтезе и встречается в природе, особенно у некоторых муравьев. Слово «муравейник» происходит от латинского слова «муравей», formica, что указывает на его раннее выделение путем перегонки муравьиных тел. Муравьиная кислота широко встречается в природе в виде конъюгированного с ней формиата основания.
Лимонная кислота
Лимонная кислота (\ (\ ce {C6H8O7} \)) — слабая органическая трикарбоновая кислота, которая в природе встречается в цитрусовых.Цитрат-ион является промежуточным звеном в цикле TCA (цикл Кребса), центральном метаболическом пути для животных, растений и бактерий. Поскольку это одна из наиболее сильных пищевых кислот, лимонная кислота чаще всего используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Рисунок \ (\ PageIndex {4} \): лимоны, апельсины, лаймы и другие цитрусовые содержат высокую концентрацию лимонной кислоты (CC BY-SA 2.5; Андре Карват).
Ацетилсалициловая кислота
Ацетилсалициловая кислота (также известная как аспирин) — это лекарство, используемое для лечения боли, лихорадки и воспалений.Аспирин в виде листьев ивы использовался для улучшения здоровья уже не менее 2400 лет.
Рисунок \ (\ PageIndex {5} \): шариковая модель молекулы аспирина. (Общественное достояние; Бен Миллс).
Аспирин — белое кристаллическое слабокислотное вещество.
Сводка
Был дан краткий обзор ключевых аспектов некоторых кислот, с которыми обычно сталкиваются студенты. Кислоты представляют собой особый класс соединений из-за свойств их водных растворов.
Добавления и авторства
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Таблица прочности кислот и оснований
Таблица прочности кислот и оснований
Таблица кислот и оснований
Прочность
Ка | Кислота | База | ||
Имя | Формула | Формула | Имя | |
Большой | хлорная | HClO 4 | ClO 4 — | Перхлорат-ион |
3.2 * 10 9 | Hydroiodic | HI | И- | Йодид |
1,0 * 10 9 | Бромистоводородная кислота | HBr | Br- | Бромид |
1.3 * 10 6 | Кислота соляная | HCl | Cl- | Хлорид |
1,0 * 10 3 | Серная кислота | H 2 SO 4 | HSO 4 — | Ион сероводорода |
2.4 * 10 1 | Азотная кислота | HNO 3 | НЕТ 3 — | Нитрат-ион |
——— | Hydronium | H 3 O + | H 2 O | Вода |
5.4 * 10 -2 | Щавелевая кислота | HO 2 C 2 O 2 H | HO 2 C 2 O 2 — | Ион оксалата водорода |
1.3 * 10 -2 | Сернистая кислота | H 2 SO 3 | HSO 3 — | Ион сероводорода |
1,0 * 10 -2 | Ион сероводорода | HSO 4 — | СО 4 2- | Сульфат-ион |
7.1 * 10 -3 | Фосфорная кислота | H 3 PO 4 | H 2 PO 4 — | Дигидроген |
7.2 * 10 -4 | Азотистая кислота | HNO 2 | НЕТ 3 — | Нитрит-ион |
6,6 * 10 -4 | Плавиковая кислота | HF | Ф — | Ион фтора |
1.8 * 10 -4 | Methanoic | HCO 2 H | HCO 2 — | метаноат |
6,3 * 10 -5 | Бензойная кислота | C 6 H 5 COOH | C 6 H 5 COO- | Бензоат-ион |
5.4 * 10 -5 | Ион оксалата водорода | HO 2 C 2 O 2- | O 2 C 2 O 2 2- | Ион оксалата |
1.8 * 10 -5 | Ethanoic | CH 3 COOH | CH 3 COO | Ethanoate |
4,4 * 10 -7 | Угольная кислота | CO 3 2- | HCO 3 — | Ион карбоната водорода |
1.1 * 10 -7 | Сероводородная кислота | H 2 S | ГС- | Ион сероводорода |
6,3 * 10 -8 | Дигидроген | H 2 PO 4 — | HPO 4 2- | Ион фосфата водорода |
6.2 * 10 -8 | Ион сероводорода | ГС — | С 2- | Сульфит-ион |
2,9 * 10 -8 | Хлорноватистая кислота | HClO | ClO — | Гипохлорит-ион |
6.2 * 10 -10 | Синильная кислота | HCN | ЦН — | Цианид-ион |
5,8 * 10 -10 | Ион аммония | NH 4 + | NH 3 | Аммиак |
5.8 * 10 -10 | Борная кислота | H 3 BO 3 | H 2 BO 3 — | Дигидроген |
4,7 * 10 -11 | Ион карбоната водорода | HCO 3 — | CO 3 2- | Карбонат-ион |
4.2 * 10 -13 | Ион фосфата водорода | HPO 4 2- | PO 4 3- | Фосфат-ион |
1,8 * 10 -13 | Дигидроген | H 2 BO 3 — | ГБО 3 2- | Ион борат водорода |
1.3 * 10 -13 | Ион сероводорода | ГС- | С 2- | Сульфид-ион |
1,6 * 10 -14 | Ион борат водорода | ГБО 3 2- | БО 3 3- | Борат-ион |
——— | вода | H 2 O | OH- | Гидроксид |
1.Сильные кислоты перечислены в верхнем левом углу.
стороны таблицы и имеют значения Ka> 1
2. Кислота со значениями меньше единицы считается слабой.
3. Сильные основания перечислены в правом нижнем углу таблицы и становятся слабее.
по мере продвижения к началу таблицы.
Риск для здоровья соляной кислоты: вдыхание паров, тумана и дыма
соляная кислота
Синонимы водного раствора хлористого водорода включают хлористоводородную кислоту, соляную кислоту и соляную кислоту.
История соляной кислоты
Соляная кислота (HCl) была впервые обнаружена около 800 г. н.э. алхимиком Джабиром ибн Хайяном (Гебер) путем смешивания поваренной соли с купоросом (серной кислотой). Джабир открыл многие важные химические вещества и записал свои открытия в более чем 20 книгах, в которых на протяжении сотен лет содержались его химические знания о соляной кислоте и других основных химических веществах. Изобретение Джабиром растворяющей золото царской водки, состоящей из соляной и азотной кислот, вызвало большой интерес у алхимиков, искавших философский камень.
Хлористый водород
Хлористый водород получают в промышленных масштабах с помощью любой из следующих реакций: нагретый газообразный водород с хлоридом кальция, серная кислота с хлоридом натрия, хлорид натрия с диоксидом серы и паром и водород, сжигаемый в хлоре. Хлористый водород может образовываться при сгорании многих пластиков. Соляная кислота (соляная кислота) — компонент коммерческих химикатов, используемых для очистки и дезинфекции бассейнов. Хлороводород используется для очистки, травления и гальваники металлов; при переработке минеральных руд; при добыче нефтяных скважин; при дублении кожи; и при рафинировании жиров, мыла и пищевых масел и в качестве дигестата для отбора проб тканей.Он также используется в производстве полимеров и пластмасс, резины, удобрений, красителей, красителей и пигментов.
соляная кислота в желудке
Не многие люди знают о естественной форме соляной кислоты, вырабатываемой слизистой оболочкой желудка, которая разрушает соединительную ткань и клеточные мембраны в пище, так что на нее легче воздействовать пищеварительными ферментами. Соляная кислота также убивает большинство бактерий, попадающих в организм с пищей. Это может быть причиной гастроэзофагеальной рефлюксной болезни и простого несварения олеокислоты.
Применение соляной кислоты
Применения HCl широко используется в качестве лабораторного реактива (чистота реактива 34-37%). Часто образец не растворяется в воде и должен быть обработан кислотами или смесью кислот для облегчения растворимости. Образцы тканей перевариваются в HCl, и этот дигестат исследуется на наличие металлов.
Что такое соляная кислота?
Хлороводородная кислота представляет собой бесцветную коррозионную жидкость, которая дымится в воздухе при высоких концентрациях 25% или более и превращается в газообразный хлористый водород, образуя плотные белые пары из-за конденсации с атмосферной влагой.Пар вызывает коррозию, а концентрация в воздухе выше 5 частей на миллион может вызвать раздражение. Хлористый водород коммерчески доступен в виде безводного газа или водных растворов (соляная кислота). При нагревании выделяется большое количество паров соляной кислоты. Если концентрация соляной кислоты в воздухе составляет 0,035%, у людей будет боль в горле и груди и затруднение дыхания в течение 10 минут. Вдыхание большого количества газа или тумана соляной кислоты может привести к смерти.
В виде водного раствора HCl экзотермически реагирует с органическими основаниями (амины, амиды) и неорганическими основаниями (оксидами и гидроксидами металлов). Реагирует экзотермически с карбонатами (включая известняк и строительные материалы, содержащие известняк) и гидрокарбонатами с образованием диоксида углерода. Реагирует с сульфидами, карбидами, боридами и фосфидами с образованием токсичных или легковоспламеняющихся газов. Реагирует со многими металлами (включая алюминий, цинк, кальций, магний, железо, олово и все щелочные металлы) с образованием легковоспламеняющегося газообразного водорода.Интенсивно Реагирует с уксусным ангидридом, 2-аминоэтанолом, гидроксидом аммония, фосфидом кальция, хлорсульфоновой кислотой, 1,1-дифторэтиленом, этилендиамином, этиленимином, олеумом, хлорной кислотой, b-пропиолактоном, оксидом пропилена, смесью перхлорат серебра и четыреххлористого углерода, гидроксид натрия. , фосфид урана (IV), винилацетат, карбид кальция, карбид рубидия, ацетилид цезия, ацетилид рубидия, борид магния, сульфат ртути (II) [Льюис]. Смеси с концентрированной серной кислотой могут с опасной скоростью выделять токсичный газообразный хлористый водород.Проходит очень энергичную реакцию с фосфидом кальция [Mellor 8: 841 (1946-1947)].
Воздействие соляной кислоты на рабочем месте
Согласно EPA, профессиональное воздействие может быстро привести к отеку и спазму горла и удушью. Материал чрезвычайно разрушает ткани слизистых оболочек и верхних дыхательных путей. Вдыхание паров соляной кислоты и тумана вызывает жжение в носу, горле и гортани, раздражение, боль и воспаление, кашель, чихание, ощущение удушья, одышку, охриплость голоса, спазмы гортани, отек верхних дыхательных путей, сужение бронхов, бронхит, грудную клетку. боли, а также головная боль и сердцебиение.Вдыхание высоких концентраций может привести к коррозионным ожогам, некрозу бронхиального эпителия, сужению гортани и бронхов, перфорации носоглотки, закрытию голосовой щели, особенно при продолжительном воздействии. Может быть смертельным при вдыхании.
https://cfpub.epa.gov/ncea/iris/iris_documents/documents/subst/0396_summary.pdf# nameddest=rfc Примечание: астматики (5 / пол) подвергались воздействию 0,8 или 1,8 ppm HCl в течение 45 минут, и тесты функции легких, проведенные сразу после воздействия, сравнивались с исходными уровнями (Stevens et al., 1992). Никаких эффектов, связанных с воздействием, не наблюдалось ни в субъективных симптомах, ни в тестах функции легких, включая объем форсированного выдоха за 1 секунду, форсированную жизненную емкость, максимальный поток при 50 и 75% жизненной емкости, респираторное сопротивление и пиковую скорость потока. Это единственное доступное исследование контролируемого воздействия HCl на человека.
Был проведен тест с использованием 30-дюймового вытяжного шкафа Sentry Air без воздуховодов, модель № SS-330-DCH в соответствии с методом тестирования NIOSH 7903 для проверки концентрации в воздухе неорганических кислот, в данном случае HCl.(Этот метод можно просмотреть на веб-сайте NIOSH: ttp: //www.cdc.gov/niosh/docs/2003-154/pdfs/7903.pdf) Целью тестирования было определить эффективность кислотного газа Sentry Air Systems. фильтрующий материал, позволяющий поддерживать концентрацию соляной кислоты в окружающей среде до минимума, в то время как внутренняя часть вытяжки подвергалась воздействию большого количества паров соляной кислоты.
Примечание. Этот метод больше не следует использовать, поскольку он классифицирован как исторический документ и был заменен методами NIOSH 7906, 7907 и 7908.Методы замены (7906, 7907 и 7908) позволяют собирать вдыхаемые фракции кислых аэрозолей с помощью предварительного фильтра и могут обеспечить более низкие пределы обнаружения кислых газов и паров из-за более высоких скоростей отбора проб.
Результаты этого испытания однозначно рекомендуют фильтр кислого газа для использования в приложениях, связанных с использованием или потенциальным воздействием соляной кислоты. Фильтр удалил, насколько это возможно, всю кислоту из обрабатываемого воздушного потока и снизил потенциальное воздействие на оператора с более чем 50 ppm в Месте 1 до концентрации в Месте 2, которая меньше, чем пределы обнаружения используемых методов анализа. (примерно 0.003 частей на миллион). Не было обнаружено соляной кислоты в окружающей атмосфере помещения на протяжении всего испытания (Местоположение 4), а также не было обнаружено ни в месте дыхания оператора (Местоположение 3), ни на выходе из вытяжного шкафа (Местоположение 2). Принимая во внимание потенциальную ошибку в анализе пробы и пределы обнаружения метода анализа, похоже, что фильтр удалил> 99,99% паров соляной кислоты.
Технические средства контроля для соляной кислоты
Наши бесканальные защитные кожухи, такие как модель 330, показанная здесь, затягивают респираторные опасности в фильтры — там, где они задерживаются, — в то время как пользователям предоставляется соответствующее освещение и хорошая видимость через прозрачную верхнюю часть и створку устройства.
30-дюймовый широкий бесканальный вытяжной шкаф
Sentry Air, модель № SS-330-DCH с фильтром кислых газов 10 фунтов, фильтр 300-PFS с CFP + 10 фунтов кислого газа сочетает мощный воздушный поток с прочным и компактным корпусом для оптимальной защиты органов дыхания и окружающей среды. Этот вытяжной шкаф предназначен для вытягивания вредных частиц вверх и от зоны дыхания оператора в камеру фильтра. В зависимости от области применения в этой камере предусмотрена либо HEPA-фильтрация [эффективность до 99,97% по частицам размером 0,3 мкм и более, сделанная из огнестойких материалов], либо фильтрация ASHRAE [эффективность до 95% по частицам 0.5 микрон и более, изготовленные из огнестойких материалов] активированный уголь или специальные фильтрующие материалы [т. Е. Кислый газ, ртуть, альдегид, аммиак. Регулировка скорости и флуоресцентный свет входят в стандартную комплектацию этого устройства.
Другие типичные применения этого вытяжного шкафа включают химический контроль дыма, сдерживание фармацевтических смесей, пайку, легкое удаление пыли, биологические применения, использование растворителей или эпоксидных смол и многие другие применения, которые требуют удаления дыма и твердых частиц.
Свяжитесь с нами:
Для получения дополнительной информации о контроле за опасными испарениями свяжитесь с Sentry Air и поговорите с одним из наших специалистов по применению. Позвоните по телефону 800.799.4609, напишите по адресу [email protected] или посетите наш веб-сайт.
Что такое соляная кислота? Факты и использование
Соляная кислота — одно из названий соляной кислоты, сильной коррозионной кислоты. Он также известен как духи соли или acidum salis . «Мюриатический» означает «относящийся к рассолу или соли».Химическая формула соляной кислоты — HCl. Кислота широко доступна в магазинах товаров для дома.
Использование соляной кислоты
Соляная кислота имеет много коммерческого и домашнего применения, в том числе:
- Промышленный синтез винилхлорида и поливинилхлорида (ПВХ)
- Пищевая добавка
- Производство желатина
- Удаление накипи
- Обработка кожи
- Бытовая уборка (в разбавленном виде)
- Травление стали
- Производство неорганических химических соединений
- Контроль pH воды, продуктов питания и лекарств
- Регенерирующие ионообменные смолы
- Очистка поваренной соли
- Строительство здания
- Для растворения горных пород при добыче нефти
- Естественно встречается в желудочной кислоте для переваривания пищи
Примечание о концентрации
Соляная кислота не является чистой соляной кислотой, и ее стандартная концентрация отсутствует.Важно проверить этикетку продукта, чтобы узнать концентрацию. Некоторые промышленные поставщики предлагают соляную кислоту, которая содержит 31,5 процента HCl по массе (20 Baumé). Однако другие распространенные разведения включают 29 процентов и 14,5 процента.
Производство соляной кислоты
Соляную кислоту получают из хлористого водорода. Хлористый водород из любого из множества процессов растворяется в воде с получением соляной или соляной кислоты.
Безопасность соляной кислоты
Важно прочитать и следовать советам по безопасности, указанным на емкости с кислотой, потому что это химическое вещество является очень коррозионным и реактивным.Необходимо надевать защитные перчатки (например, латексные), очки, обувь и химически стойкую одежду. Кислоту следует использовать под вытяжным шкафом или в хорошо вентилируемом помещении. Прямой контакт может вызвать химические ожоги и повредить поверхности. Воздействие может необратимо повредить глаза, кожу и органы дыхания. Реакция с окислителями, такими как хлорный отбеливатель (NaClO) или перманганат калия (KMnO 4 ), приведет к образованию токсичного газообразного хлора. Кислоту можно нейтрализовать основанием, например бикарбонатом натрия, а затем смыть большим количеством воды.
Соляная кислота — это то же самое, что соляная кислота?
Обновлено 26 марта 2020 г.
Кевин Бек
Проверено: Lana Bandoim, B.S.
«Мюриатик» — это не то слово, которое вы, вероятно, читали или слышали, если вы не изучаете историю науки или серьезно не фанат химии. Следовательно, соляная кислота вряд ли вам знакома — по крайней мере, не под этим названием. Но, как вы увидите, соляная кислота используется очень часто.
Современное и гораздо более распространенное название того же вещества — соляная кислота, и если вы когда-либо работали с ней целенаправленно, вы знаете о ее эффектах.
Соляная или соляная кислота имеет химическую формулу HCl и считается сильной кислотой. Поскольку это вещество недорогое и его легко получить в значительных количествах, это вещество используется в промышленности, академических лабораториях и других учреждениях. Соляная кислота для бассейнов по-прежнему широко маркируется и продается как таковая, но по большей части преобладает менее креативное, но более легкое для запоминания название.Соляная кислота использует для очистки бетона, например, террас у бассейнов или тротуаров, поэтому ее можно найти в магазинах товаров для дома.
Соляная кислота, помимо того, что, скорее всего, помогает в аспектах вашего собственного пищеварения, даже когда вы читаете это, используется в производстве металлов, нефтепродуктов, фармацевтических препаратов и многого другого.
Его химическая универсальность делает его чрезвычайно распространенным реагентом в химических реакциях, и его легко производить в массовых количествах с надежно точной концентрацией.Читайте дальше, чтобы вы могли полностью «переварить» все, что нужно знать об этом универсальном водном растворе.
Что такое кислоты и основания?
Кислота представляет собой молекулу, которая отдает протон (H + или ион водорода) в водном растворе, то есть при смешивании с водой. Молекулы H 2 O могут принять эти протоны, чтобы стать ионами гидроксония (H 3 O +), поскольку протоны не существуют в одиночку долго, если им есть с чем соединиться. Основание — это молекула, которая принимает протон или, что эквивалентно с точки зрения химии, отдает ионы гидроксида (ОН-) в растворе.
Молекула или элемент, остающийся, когда кислота отдает протон, называется сопряженным основанием кислоты. В случае HCl это, следовательно, хлорид-ион (Cl —). Один только Cl представляет собой элемент , хлор, , галоген.
Реакция газообразной соляной кислоты с водой в водном растворе выражается формулой
HCl (г) + H 2 O (л) ⟶ H 3 O + (водн.) + Cl — (водн. )
Эта реакция почти полностью завершается в большинстве условий (то есть почти вся HCl растворена), поскольку соляная кислота является сильной кислотой.
История и открытие соляной кислоты
Соляная кислота была открыта алхимиком Джабиром ибн Хайяном примерно в 800 году н. Э. Или более 1200 лет назад. Сегодня алхимию называют «лженаукой», но ее практикующие, тем не менее, работали с реальными веществами и иногда получали полезные результаты.
- Название соляная кислота происходит от латинского слова «соленый»; концентрированная соленая вода является реагентом в одном из процессов производства соляной кислоты.
Во время своего открытия мир находился за много веков от понимания того, что вообще такое кислоты. Но любое вещество со свойствами соляной кислоты, быстро и убедительно продемонстрированное, несомненно, приобретет большое значение для цивилизации, и именно это произошло с HCl.
Свойства соляной кислоты
Хлористый водород сам по себе существует как бесцветный газ без запаха при комнатной температуре, но в вакууме. На воздухе HCl образует густые белые пары, поскольку легко вступает в реакцию с молекулами воды.
Соляная кислота очень едкая и очень токсичная . Если вы работаете с этим веществом, независимо от молярности (меры концентрации), вам следует использовать средства защиты глаз и кожи.
HCl имеет молекулярную массу (MW) 36,46 грамма на моль (г / моль). Более 95 процентов этой массы потребляется атомом хлора, но равное количество атомов H и Cl существует в конъюгированной (неповрежденной) форме кислоты. Он не является легко воспламеняемым, поэтому, несмотря на другие опасности для биологических систем, вероятность его возгорания маловероятна.
Производство соляной кислоты
HCl можно синтезировать несколькими способами. Один распространенный промышленный синтез включает сжигание газообразного водорода и газообразного хлора внутри камеры, в которую газы вводятся под давлением через сопло.
Полученный таким образом солянокислый газ затем постепенно и осторожно охлаждается до жидкого состояния и разбавляется до любой концентрации, требуемой спецификациями. Эта реакция представлена формулой:
HCl можно также получить промышленным способом реакцией хлорида натрия и серной кислоты:
2NaCl + H 2 SO 4 ⟶ 2HCl + Na 2 SO 4
HCl можно также синтезировать из хлорида натрия, диоксида серы, воздуха и водяного пара:
4NaCl + 2SO 2 + 2H 2 O + O 2 ⟶ 2Na 2 SO 4 + 4HCl
Использование соляной кислоты
Те же свойства, которые делают HCl опасным при работе, если не принять меры предосторожности, являются предпочтительными в определенных условиях.Точно так же, как ножи потенциально очень опасны, но также чрезвычайно полезны и универсальны, коррозионные свойства соляной кислоты можно использовать в тщательно контролируемых условиях.
Следующий список представляет собой обзор некоторых из основных применений соляной кислоты в современном обществе. Обратите внимание, что при продаже для бассейнов (см. Ниже) она по-прежнему обозначается как «соляная кислота».
Производство стали и металлов: Сталелитейная и металлургическая промышленность используют соляную кислоту для «протравливания» стали с целью удаления поверхностных оксидов.Большая часть стали также очищается кислотой перед цинкованием, лужением и другими покрытиями.
Фармацевтическое производство: Фармацевтическая промышленность использует HCl для различных целей. Он может служить катализатором или реагентом в химических реакциях. Он отлично подходит для точного контроля pH; это важно для некоторых лекарств, чтобы иметь возможность адекватного доступа к определенным физиологическим пространствам (например, крови, лимфатической жидкости), поскольку некоторые из них более кислые, чем другие.
Пищевые добавки и пищевая промышленность: Пищевая промышленность использует соляную кислоту в различных продуктах, хотя подавляющее большинство ее составляет производство обычных «сладких» пищевых ингредиентов кукурузного сиропа с высоким содержанием фруктозы (HFCS). HCl также используется для производства витаминных добавок.
Водоподготовка: Одно из применений соляной кислоты — регулирование pH воды в бассейне и аналогичных параметров (например, «горячие ванны»), а также кислотности промышленных сточных вод, чтобы она наносила минимальный ущерб водные организмы в водных путях, в которые они выбрасываются.
Добыча нефти и природного газа: В нефтяной (нефтегазовой) промышленности соляная кислота используется для подкисления нефтяных и газовых скважин. Более низкий pH увеличивает добычу нефти и газа за счет растворения минералов в коренных породах, отделяющих бурильщиков от их карьеров.
Эти минералы, карбонат кальция и карбонат магния, уступают место образованию пор в нефтесодержащих породах. Соляная кислота также содержится в жидкостях, предназначенных для гидроразрыва («гидроразрыва») горных сланцевых пластов для доступа к природному газу и нефти.
Демонстрация реакции с соляной кислотой
Многие металлы реагируют с HCl с образованием хлоридов этих металлов и высвобождением газообразного водорода в процессе. Это происходит посредством реакции замещения или реакции одинарного замещения, в которой химически активный металл занимает место иона водорода, который связан с ионом хлорида.
Примером является реакция элементарного магния с HCl с образованием хлорида магния и вышеупомянутого газа H 2 :
Mg ( s ) + 2 HCl ( водн. ) ⟶ MgCl 2 ( водн. ) + H 2 ( г )
Опасности соляной кислоты и советы по безопасности
Соляная кислота звучит как страшное вещество, и на самом деле это может быть.Однако вы можете быть удивлены, узнав, что соляная кислота — это обычная жидкость, используемая в нескольких отраслях промышленности по всему миру. Ежегодно во всем мире производится около 20 миллионов тонн соляной кислоты, и вы даже можете найти ее у себя дома! Эти советы по безопасности соляной кислоты помогут вам безопасно и надлежащим образом обращаться с этим токсичным веществом, независимо от того, сталкиваетесь ли вы с ним дома или на рабочем месте.
Соляная кислота, ее применение и свойства
Соляная кислота — водорастворимая жидкость от бесцветного до светло-желтого цвета с резким раздражающим запахом.Соляная кислота, производимая еще в 16, -м, веке, исторически была известна как « соляной спирт» и иногда ее называли соляной кислотой . Он используется для различных целей и доступен в концентрациях от 10 до 34 процентов в зависимости от области применения. Соляная кислота используется для:
- Травление стали
- Производство органических соединений (ПВХ, активированный уголь, аскорбиновая кислота и фармацевтические препараты)
- Производство химикатов для очистки воды
- Регулирующий pH воды
- Обработка кожи
- Очистка соли
- Бытовые чистящие средства
- Строительство здания
- Кислотная обработка нефтяных скважин
- Производство желатиновых изделий
Опасности для безопасности и здоровья, связанные с соляной кислотой
Соляная кислота — опасная жидкость, которую необходимо использовать с осторожностью.Сама кислота вызывает коррозию, а ее концентрированные формы выделяют кислые туманы, которые также опасны. Если кислота или туман попадут на кожу, глаза или внутренние органы, повреждение может быть необратимым или даже смертельным в тяжелых случаях. Важно использовать средства индивидуальной защиты.
Правила безопасного обращения с соляной кислотой
Безопасность имеет первостепенное значение при работе с опасными химическими веществами, такими как соляная кислота. Агентство по охране окружающей среды регулирует соляную кислоту как токсичное вещество, и с ней следует обращаться как с таковым.При использовании соляной кислоты любой концентрации рекомендуется носить следующие средства защиты:
- Респиратор паровой
- Резиновые перчатки
- Сапоги
- Полный костюм
- Маска для лица
При использовании соляной кислоты на рабочем месте настоятельно рекомендуется иметь доступ к промывочной станции на случай случайного воздействия. Вам также следует ознакомиться со всей информацией MSDS по соляной кислоте, прежде чем связываться с вами.
При использовании в доме бытовых чистящих средств с соляной кислотой строго следуйте указаниям на этикетке и инструкциям по технике безопасности. (Обычно рекомендуется сначала разбавить чистящее средство, чтобы снизить его концентрацию.) По-прежнему важно носить защитную одежду при использовании разбавленной кислоты, чтобы гарантировать, что она не попадет на вашу кожу, глаза или рот.
Правильный уход при воздействии соляной кислоты
В зависимости от концентрации соляной кислоты, с которой вы работаете, случайное воздействие может произойти при контакте с кожей, попадании в глаза, проглатывании или вдыхании кислотных паров.Каждый из этих видов воздействия может представлять серьезную опасность для вашего здоровья, и с ним следует немедленно бороться.
Контакт с кожей — При попадании соляной кислоты на кожу немедленно промойте большим количеством воды в течение не менее 15 минут и снимите всю загрязненную одежду. В случае серьезного контакта с кожей используйте воду, дезинфицирующее мыло и антибактериальный крем. Немедленно обратитесь за медицинской помощью.
Контакт с глазами — При попадании соляной кислоты или кислого тумана в глаза немедленно промойте их большим количеством воды в течение не менее 15 минут.Немедленно обратитесь за медицинской помощью.
Проглатывание — При проглатывании не вызывать рвоту. Немедленно обратитесь за медицинской помощью.
Вдыхание — При вдыхании паров или тумана соляной кислоты немедленно обратитесь на свежий воздух и за медицинской помощью.
Хранение и утилизация соляной кислоты
Соляную кислоту следует хранить в прохладном, сухом, хорошо вентилируемом помещении вдали от источников влаги. Держите подальше от несовместимых материалов, таких как окислители, органические материалы, металлы и щелочи.Соляная кислота может разъедать металлические поверхности. Хранить контейнер плотно закрытым и хранить в надежном месте.
Узнайте больше о безопасности соляной кислоты от экспертов MSDS
Если вы встретите соляную кислоту в разбавленных бытовых чистящих средствах дома или в концентрированных формах на рабочем месте, безопасность чрезвычайно важна при обращении с этой токсичной, коррозионной жидкостью. Для получения дополнительной информации об использовании, безопасности или утилизации соляной кислоты выполните поиск в нашей базе данных паспортов безопасности материалов.
Соляная кислота — Энциклопедия Нового Света
| Соляная кислота | |||
|---|---|---|---|
| Общие | |||
| Систематическое название | Соляная кислота | ||
| Другие названия | Соляная кислота | Молекулярная формула | HCl в воде (H 2 O) |
| Молярная масса | 36,46 г / моль (HCl) | ||
| Внешний вид | От бесцветной до светло-желтой жидкости | ||
| CAS номер | [7647-01-0] | ||
| Свойства | |||
| Плотность, фаза | 1.18 г / см³, 37% раствор. | ||
| Растворимость в воде | Полностью смешивается. | ||
| Температура плавления | −26 ° C (247 K) 38% раствор. | ||
| Температура кипения | 110 ° C (383 K), 20,2% раствор; 48 ° C (321 K), 38% раствор. | ||
| Кислотная диссоциация Константа p K a | −8,0 | ||
| Вязкость | 1,9 мПа · с при 25 ° C, 31.5% раствор | ||
| Опасности | |||
| Паспорт безопасности материала | Внешний паспорт безопасности | ||
| NFPA 704 | 0 3 1 32–38% раствор 32–38% | Сильно агрессивен. | |
| Температура вспышки | Невоспламеняющийся. | ||
| Заявление о R / S | R34, R37, S26, S36, S45 | ||
| Номер RTECS | MW4025000 | ||
| Страница дополнительных данных | |||
| Структура и свойства | |||
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газовое | ||
| Спектральные данные | УФ, ИК, ЯМР, МС | ||
| Родственные соединения | |||
| Другие анионы | HF, HBr, HI | ||
| Другие катионы | Н / д | ||
| Родственные кислоты | Бромистоводородная кислота Плавиковая кислота Йодоводородная кислота Серная кислота | ||
| Если не указано иное, данные приведены для материалов в их стандарте состояние (при 25 ° C, 100 кПа) Заявление об отказе от ответственности и ссылки | |||
Химическое соединение соляная кислота (или соляная кислота ) представляет собой водный (водный) раствор газообразного хлористого водорода (HCl). ).Эта сильная кислота очень агрессивна, и при обращении с ней необходимо соблюдать соответствующие меры безопасности. Это основной компонент желудочной кислоты. Он обычно используется в химических исследовательских лабораториях и на производственных предприятиях. Его применение включает крупномасштабное производство определенных соединений (таких как винилхлорид для поливинилхлоридного (ПВХ) пластика), удаление ржавчины и окалины с металлов, добычу нефти и переработку руды. Меньшие масштабы включают производство желатина и других ингредиентов в продуктах питания, а также обработку кожи.Ежегодно производится около 20 миллионов метрических тонн соляной кислоты.
История
Соляная кислота была впервые обнаружена около 800 года н.э. в году алхимиком Джабиром ибн Хайяном (Гебер) путем смешивания поваренной соли с купоросом (серной кислотой). Джабир открыл многие важные химические вещества и записал свои открытия в более чем 20 книгах, в которых на протяжении сотен лет содержались его химические знания о соляной кислоте и других основных химических веществах. Изобретение Джабиром растворяющей золото царской водки, состоящей из соляной и азотной кислот, вызвало большой интерес у алхимиков, искавших философский камень.
Джабир ибн Хайян, средневековый рукописный рисунок.
В средние века соляная кислота была известна европейским алхимикам как спирт соли или acidum salis. Газообразный HCl получил название морской кислый воздух. Старое (предсистематическое) название соляная кислота имеет то же происхождение ( соляная кислота означает «относящийся к рассолу или соли»), и это название иногда используется до сих пор. Известное производство было зарегистрировано Базилием Валентином, каноником-алхимиком бенедиктинского монастыря Санкт-Петер в Эрфурте, Германия, в пятнадцатом веке.В семнадцатом веке Иоганн Рудольф Глаубер из Карлштадта-на-Майне, Германия, использовал хлорид натрия и серную кислоту для получения сульфата натрия в процессе Мангейма, выделяя газообразный хлористый водород. Джозеф Пристли из Лидса, Англия, получил чистый хлористый водород в 1772 году, а в 1818 году Хэмфри Дэви из Пензанса, Англия, доказал, что химический состав включает водород и хлор.
Во время промышленной революции в Европе спрос на щелочные вещества, такие как кальцинированная сода, увеличился, и новый промышленный процесс производства соды Николя Леблан (Иссундан, Франция) сделал возможным дешевое крупномасштабное производство.В процессе Леблана соль превращается в кальцинированную соду с использованием серной кислоты, известняка и угля. Хлористый водород выделяется как побочный продукт. До Закона о щелочах 1863 года избыток HCl сбрасывался в воздух. После принятия закона производители кальцинированной соды были обязаны поглощать отработанный газ водой, производя соляную кислоту в промышленных масштабах.
Когда в начале двадцатого века процесс Leblanc был эффективно заменен процессом Solvay без побочного продукта соляной кислоты, соляная кислота уже полностью утвердилась в качестве важного химического вещества во многих областях применения.Коммерческий интерес инициировал другие методы производства, которые все еще используются сегодня, как описано ниже. Сегодня большая часть соляной кислоты производится путем абсорбции хлористого водорода из промышленных органических соединений.
Соляная кислота включена в список прекурсоров Таблицы II в соответствии с Конвенцией о борьбе с незаконным оборотом наркотических средств и психотропных веществ 1988 года из-за ее использования в производстве таких наркотиков, как героин, кокаин и метамфетамин.
Химия
Кислотное титрование.
Хлористый водород (HCl) представляет собой монопротоновую кислоту, что означает, что каждая молекула может диссоциировать (ионизировать) только один раз с высвобождением одного иона H + (одного протона). В водной соляной кислоте H + присоединяется к молекуле воды с образованием иона гидроксония, H 3 O + :
- HCl + H 2 O ⇌ H 3 O + + Cl —
Молекулярная модель хлористого водорода.
Другой образующийся ион — это хлорид-ион Cl —.Поэтому соляную кислоту можно использовать для получения солей, называемых хлоридами , , такими как хлорид натрия. Соляная кислота — сильная кислота, так как полностью диссоциирует в воде.
Монопротоновые кислоты имеют одну константу кислотной диссоциации, K a , которая указывает уровень диссоциации в воде. Для сильной кислоты, такой как HCl, K a больше. Были предприняты теоретические попытки отнести K к к HCl. Когда хлоридные соли, такие как NaCl, добавляются к водной HCl, они практически не влияют на pH, что указывает на то, что Cl — является чрезвычайно слабым сопряженным основанием и что HCl полностью диссоциирует в водном растворе.Для средних и сильных растворов соляной кислоты предположение о том, что молярность H + (единица концентрации) равна молярности HCl, является превосходным и соответствует четырем значащим цифрам.
Из семи распространенных сильных кислот в химии, все они неорганические, соляная кислота является монопротоновой кислотой, которая с наименьшей вероятностью вступает в мешающую окислительно-восстановительную реакцию. Это одна из наименее опасных для обращения сильных кислот; несмотря на свою кислотность, он производит менее реактивные и нетоксичные хлорид-ионы.Растворы соляной кислоты средней концентрации достаточно стабильны, сохраняя свою концентрацию с течением времени. Эти характеристики, а также тот факт, что он доступен в виде чистого реагента, означают, что соляная кислота является отличным подкисляющим реагентом и кислотным титрантом (для определения количества неизвестного количества основания при титровании). Титранты с сильными кислотами полезны, потому что они дают более четкие конечные точки при титровании, что делает титрование более точным. Соляная кислота часто используется в химическом анализе и для переваривания образцов для анализа.Концентрированная соляная кислота растворяет некоторые металлы с образованием окисленных хлоридов металлов и газообразного водорода. Он будет производить хлориды металлов из основных соединений, таких как карбонат кальция или оксид меди (II). Он также используется в качестве простого кислотного катализатора некоторых химических реакций.
Физические свойства
Физические свойства соляной кислоты, такие как точки кипения и плавления, плотность и pH, зависят от концентрации или молярности HCl в растворе кислоты. Они могут варьироваться от значений для воды при 0% HCl до значений для дымящей соляной кислоты при более 40% HCl.
| Конц. (по массе) c: кг HCl / кг | Конц. (мас. / об.) c: кг HCl / м 3 | Конц. Baumé | Плотность ρ: кг / л | Молярность M | pH | Вязкость η: мПа · с | Теплота| : кДж / (кг · К) | Давление пара | P HCl : Па Точка кипения | точка б.п. Точка плавления | т.пл. |
| 10% | 104,80 | 6,6 | 1,048 | 2,87 M | -0,5 | 1,16 | 3,47 | 0,527 | 103 ° C | -18% C | |
| 219.60 | 13 | 1.098 | 6.02 M | -0,8 | 1,37 | 2,99 | 27,3 | 108 ° C | -59 ° C | ||
| 30% | 344.70 | 19 | 1,149 | 9,45 M | -1,0 | 1,70 | 2,60 | 1,410 | 90 ° C | -52 ° C | |
| 32% | 370,88 | 1,159 | 10,17 M | -1,0 | 1,80 | 2,55 | 3,130 | 84 ° C | -43 ° C | ||
| 34% | 397,46 | 21 | 1,169 | 10,90 M 1.0 | 1,90 | 2,50 | 6,733 | 71 ° C | -36 ° C | ||
| 36% | 424,44 | 22 | 1,179 | 11,64 M | -1,1 | 1.99 | 14,100 | 61 ° C | -30 ° C | ||
| 38% | 451,82 | 23 | 1,189 | 12,39 M | -1,1 | 2,10 | 2,43 | 28,000 ° C | -26 ° C |
Исходные температура и давление для приведенной выше таблицы составляют 20 ° C и 1 атмосферу (101 кПа).
Соляная кислота как бинарная (двухкомпонентная) смесь HCl и H 2 O имеет азеотроп с постоянным кипением при 20,2% HCl и температуре 108,6 ° C (227 ° F). Существует четыре эвтектических точки постоянной кристаллизации для соляной кислоты между кристаллической формой HCl · H 2 O (68 процентов HCl), HCl · 2H 2 O (51 процент HCl), HCl · 3H 2 O (41 процент HCl), HCl · 6H 2 O (25 процентов HCl) и лед (0 процентов HCl). Также есть метастабильная эвтектическая точка на 24.8 процентов между льдом и HCl · 3H 2 O кристаллизация
Производство
Соляную кислоту получают растворением хлористого водорода в воде. Хлористый водород может быть получен разными способами, и, таким образом, существует несколько различных предшественников соляной кислоты. Крупномасштабное производство соляной кислоты почти всегда интегрируется с производством других химических веществ в промышленных масштабах.
Промышленный рынок
Соляная кислота производится в растворах с содержанием HCl до 38% (концентрированная).Химически возможны более высокие концентрации до чуть более 40 процентов, но при этом скорость испарения настолько высока, что при хранении и обращении требуются дополнительные меры предосторожности, такие как давление и низкая температура. Таким образом, массовая продукция промышленного класса составляет от 30 до 34 процентов, что оптимизировано для эффективной транспортировки и ограниченной потери продукта парами HCl. Растворы для бытовых целей, в основном для очистки, обычно составляют от 10 до 12 процентов, при этом настоятельно рекомендуется разбавлять их перед использованием.
Основными производителями по всему миру являются Dow Chemical с производительностью 2 млн метрических тонн в год (2 млн тонн в год) в пересчете на газ HCl и FMC, Georgia Gulf Corporation, Tosoh Corporation, Akzo Nobel и Tessenderlo с производительностью 0.От 5 до 1,5 млн т / год каждая. Общее мировое производство, в целях сравнения, выраженное в HCl, оценивается в 20 Мт / год, из которых 3 Мт / год — за счет прямого синтеза, а остальное — как вторичный продукт в результате органического и аналогичного синтезов. Безусловно, больше всего соляной кислоты потребляется производителем самостоятельно. Объем открытого мирового рынка оценивается в 5 млн т / год.
Применения
Соляная кислота — сильная неорганическая кислота, которая используется во многих промышленных процессах. Приложение часто определяет необходимое качество продукта.
Регенерация ионообменников
Важным применением высококачественной соляной кислоты является регенерация ионообменных смол. Катионный обмен широко используется для удаления ионов, таких как Na + и Ca 2+ , из водных растворов с получением деминерализованной воды.
- Na + заменяется на H 3 O +
- Ca 2+ заменяется на 2 H 3 O +
Ионообменники и деминерализованная вода используется во всех химических производствах, производстве питьевой воды и многих пищевых производствах.
pH Контроль и нейтрализация
Соляная кислота часто применяется для регулирования щелочности (pH) растворов.
- OH — + HCl → H 2 O + Cl —
В промышленности, требующей чистоты (пищевая, фармацевтическая, питьевая вода), высококачественная соляная кислота используется для контроля pH потоков технологической воды. В менее требовательных отраслях промышленности соляной кислоты технического качества достаточно для нейтрализации стоков и очистки бассейнов.
Травление стали
Травление является важным этапом обработки поверхности металла для удаления ржавчины или окалины оксида железа с железа или стали перед последующей обработкой, такой как экструзия, прокатка, гальваника и другие методы. HCl технического качества с концентрацией обычно 18 процентов является наиболее часто используемым травильным агентом для травления марок углеродистой стали.
- Fe 2 O 3 + Fe + 6 HCl → 3 FeCl 2 + 3 H 2 O
Отработанная кислота уже давно повторно используется в качестве растворов хлорида железа, но высокие уровни тяжелых металлов в травильном растворе уменьшили эту практику.
Однако в последние годы промышленность травления стали разработала процессы регенерации соляной кислоты, такие как распылительный обжиговой аппарат или процесс регенерации HCl в псевдоожиженном слое, которые позволяют извлекать HCl из отработанного травильного раствора. Наиболее распространенным процессом регенерации является процесс пирогидролиза по следующей формуле:
- 4 FeCl 2 + 4 H 2 O + O 2 → 8 HCl + 2 Fe 2 O 3
За счет рекуперации отработанной кислоты создается замкнутый кислотный цикл.Оксид железа, являющийся побочным продуктом процесса регенерации, является ценным побочным продуктом, используемым во множестве вторичных производств.
HCl не является обычным травильным агентом для марок нержавеющей стали.
Производство неорганических соединений
Многие продукты могут быть получены с помощью соляной кислоты в обычных кислотно-основных реакциях, приводящих к неорганическим соединениям. К ним относятся химические вещества для обработки воды, такие как хлорид железа (III) и хлорид полиалюминия (PAC).
- Fe 2 O 3 + 6 HCl → 2 FeCl 3 + 3 H 2 O
Хлорид железа (III) и ПАУ используются в качестве флоккулирующих и коагулирующих агентов в очистка сточных вод, производство питьевой воды и производство бумаги.
Другие неорганические соединения, производимые с соляной кислотой, включают хлорид кальция, хлорид никеля (II) для гальваники и хлорид цинка для гальванической промышленности и производства аккумуляторов.
Производство органических соединений
Наибольшее потребление соляной кислоты приходится на производство органических соединений, таких как винилхлорид для ПВХ, а также МДИ и ТДИ для полиуретана. Часто это внутреннее использование с потреблением соляной кислоты местного производства, которая никогда не попадает на открытый рынок.Другие органические соединения, полученные с помощью соляной кислоты, включают бисфенол А для поликарбоната, активированный уголь и аскорбиновую кислоту, а также многочисленные фармацевтические продукты.
Другие области применения
Соляная кислота является основным химическим веществом и поэтому используется в большом количестве небольших применений, таких как обработка кожи, уборка дома и строительство зданий. Кроме того, способ стимулирования добычи нефти заключается в закачке соляной кислоты в породу нефтяной скважины, растворении части породы и создании крупнопористой структуры.Кислотная обработка нефтяных скважин — распространенный процесс в нефтедобывающей промышленности Северного моря.
Многие химические реакции с участием соляной кислоты применяются при производстве продуктов питания, пищевых ингредиентов и пищевых добавок. Типичные продукты включают аспартам, фруктозу, лимонную кислоту, лизин, гидролизованный (растительный) белок в качестве пищевого усилителя и при производстве желатина. Пищевая (особо чистая) соляная кислота может применяться при необходимости для конечного продукта.
Физиология и патология
Соляная кислота составляет большую часть желудочной кислоты, пищеварительной жидкости человека.В сложном процессе и при большой энергетической нагрузке он секретируется париетальными клетками (также известными как оксинтические клетки). Эти клетки содержат обширную секреторную сеть (называемую канальцами), из которой HCl секретируется в просвет желудка. Они являются частью фундальных желез (также известных как кислородные железы) в желудке.
Механизмы безопасности, предотвращающие повреждение эпителия пищеварительного тракта соляной кислотой, следующие:
- Отрицательные регуляторы ее высвобождения
- Толстый слой слизи, покрывающий эпителий
- Бикарбонат натрия, секретируемый эпителиальными клетками желудка и поджелудочной железы
- Структура эпителия (плотные соединения)
- Достаточное кровоснабжение
- Простагландины (множество различных эффектов: они стимулируют секрецию слизи и бикарбоната, поддерживают целостность эпителиального барьера, обеспечивают адекватное кровоснабжение, стимулируют заживление поврежденной слизистой оболочки)
Когда по разным причинам эти механизмы не работают, может развиться изжога или пептические язвы.Препараты, называемые ингибиторами протонной помпы, не позволяют организму вырабатывать избыток кислоты в желудке, в то время как антациды нейтрализуют имеющуюся кислоту.
В некоторых случаях в желудке вырабатывается недостаточно соляной кислоты. Эти патологические состояния обозначаются терминами гипохлоргидрия и ахлоргидрия. Потенциально они могут привести к гастроэнтериту.
Химическое оружие
Фосген (COCl 2 ) был обычным боевым химическим веществом, используемым во время Первой мировой войны. Основной эффект фосгена возникает в результате растворения газа в слизистых оболочках глубоко в легких, где он превращается гидролизом на угольную кислоту и коррозионную соляную кислоту.Последний разрушает альвеолярно-капиллярные мембраны, так что легкое заполняется жидкостью (отек легких).
Соляная кислота также частично ответственна за вредное воздействие горчичного газа или образование пузырей. В присутствии воды, например, на влажной поверхности глаз или легких, иприт распадается с образованием соляной кислоты.
Безопасность
| Этикетки для опасных грузов | |
|---|---|
Соляная кислота в высоких концентрациях образует кислые туманы.И туман, и раствор оказывают разъедающее действие на ткани человека, потенциально повреждая органы дыхания, глаза, кожу и кишечник. При смешивании соляной кислоты с обычными окислителями, такими как отбеливатель (NaClO) или перманганат (KMnO 4 ), образуется токсичный газовый хлор. Чтобы свести к минимуму риски при работе с соляной кислотой, следует принять соответствующие меры предосторожности, в том числе надеть резиновые или ПВХ перчатки, защитные очки и химически стойкую одежду.
Опасность растворов соляной кислоты зависит от концентрации.В следующей таблице приведена классификация растворов соляной кислоты ЕС:
| Концентрация по весу | Классификация | R-фразы |
|---|---|---|
| 10% –25% | Раздражающее ( Xi ) | R36 / 37/38 |
| > 25% | Коррозийный ( C ) | R34 R37 |
См. Также
Ссылки
- Chang, Raymond. 2006. Химия, 9 изд.Нью-Йорк: McGraw-Hill Science / Engineering / Math. ISBN 0073221031.
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Продвинутая неорганическая химия, 4-е изд. Нью-Йорк: Вили. ISBN 0471027758.
- Гайтон, Артур К. и Джон Э. Холл. 2000. Учебник медицинской физиологии . Филадельфия: Сондерс. ISBN 072168677X.
- Лиде, Дэвид Р., изд. 2005. CRC Handbook of Chemistry and Physics, 86-е изд. Бока-Ратон: CRC Press. ISBN 0849304865.
- McMurry, J., и R.C. Фэй. 2004. Химия, 4-е изд. Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall. ISBN 0131402080.
- Перри Р., Д. Грин и Дж. Мэлони. 1984. Perry’s Chemical Engineers ‘Handbook, 6-е изд. Нью-Йорк: Макгроу-Хилл. ISBN 0070494797.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия
в соответствии со стандартами New World Encyclopedia .

 )
)
 Внешний вид
Внешний вид Массовая доля мышьяка (As), % , не более
Массовая доля мышьяка (As), % , не более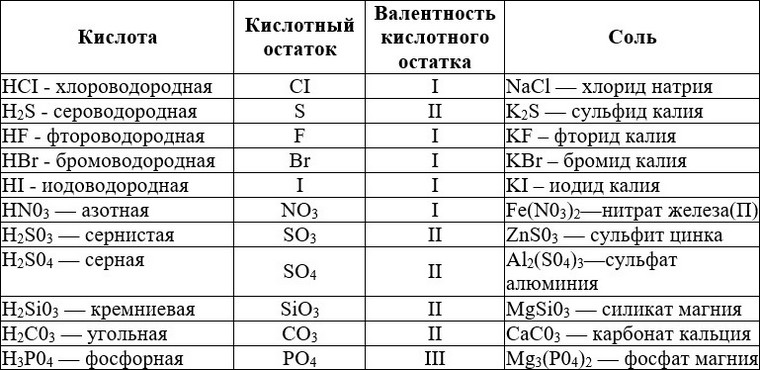 Химическая стойкость. Температурная применимость. Коррозионная стойкость.
Химическая стойкость. Температурная применимость. Коррозионная стойкость. Что это такое?
Что это такое?


