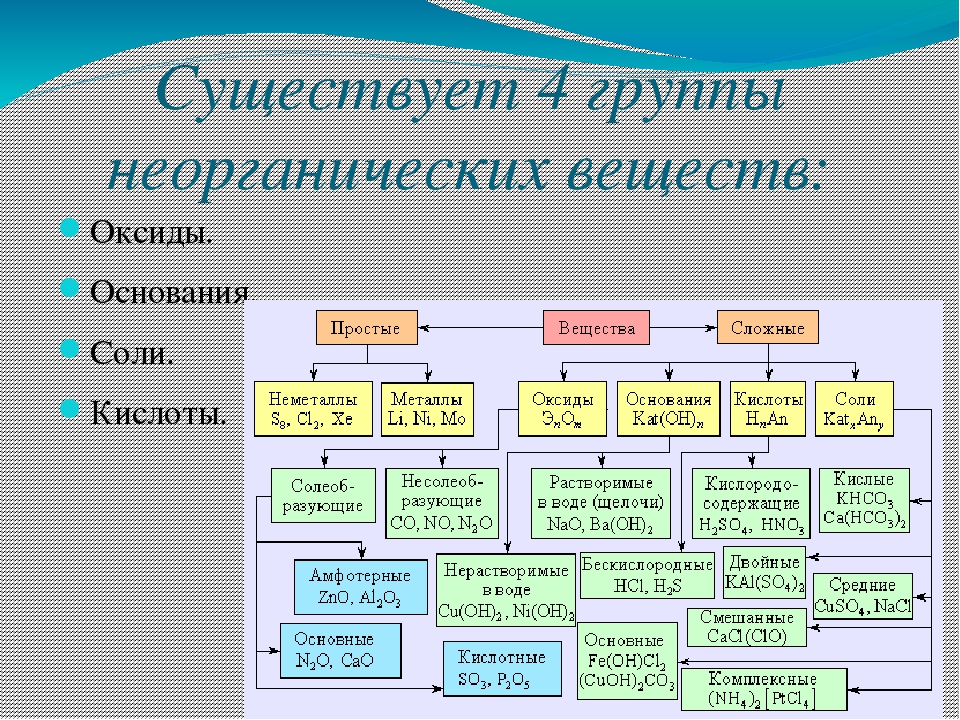
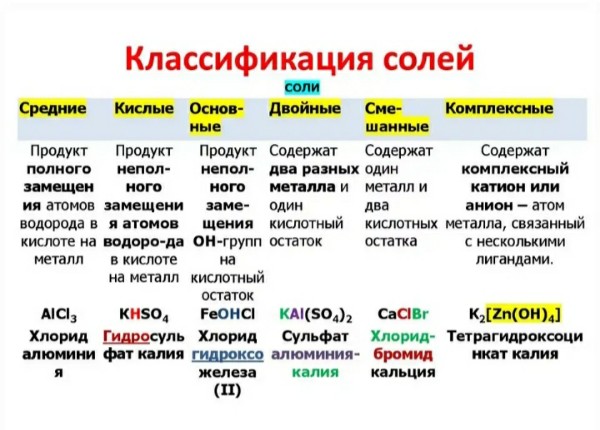
Содержание
Группы химических элементов — это… Что такое Группы химических элементов?
Группа химических элементов — термин, используемый ИЮПАК для описания номенклатурной классификации химических элементов[1].
Названия групп химических элементов, утверждённые ИЮПАК
- Щелочные металлы — металлы первой группы: Li, Na, K, Rb, Cs, Fr.
- Щелочноземельные металлы — металлы второй группы: Be, Mg, Ca, Sr, Ba, Ra.
- Пниктогены (пниктиды[2]) — элементы пятнадцатой группы: N, P, As, Sb, Bi.
- Халькогены — элементы шестнадцатой группы: O, S, Se, Te, Po.
- Галогены (галоиды[2]) — элементы семнадцатой группы: F, Cl, Br, I, At.
- Инертные газы — элементы восемнадцатой группы: He, Ne, Ar, Kr, Xe, Rn.
- Лантаноиды (лантаниды[2]) — элементы 57—71: La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
- Актиноиды (актиниды[2]) — элементы 89—103: Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
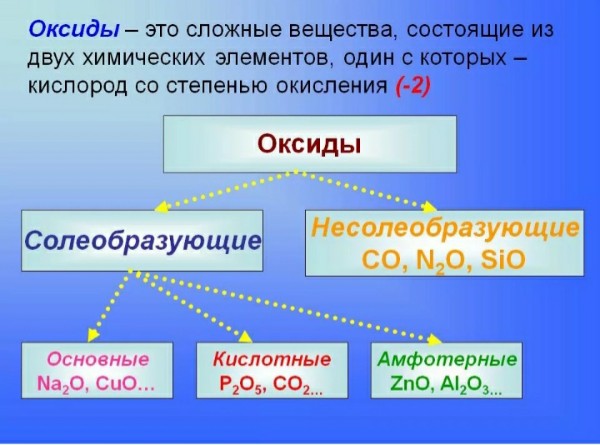
- Редкоземельные элементы — Sc, Y и лантаноиды.
- Переходные металлы — элементы 3—12 групп.
Другие группы химических элементов
Многие другие названия для групп элементов не утверждены ИЮПАК, но употребляются в различных областях науки. Например:
- Платиновая группа — Ru, Rh, Pd, Os, Ir, Pt.
- Благородные металлы — термин, который в основном используется для описания элементов, не подвергающихся коррозии — Au, Ag и металлы платиновой группы.
- Тяжёлые металлы — термин, использующийся для описания элементов с высокими значениями атомного веса.
- Природные металлы — металлы, находящиеся в природе; не являются искусственно полученными.
- Постпереходные металлы — металлы, у которых наблюдается полное заполнение d-подоболочки: Zn, Ga, Cd, In, Sn, Hg, Tl, Pb, Bi.
- Лёгкие металлы — термин, иногда использующийся для описания некоторых металлов p-блока: алюминий, галлий, индий, олово, таллий, свинец и висмут (иногда в эту группу включают также германий, сурьму и полоний).
- Трансурановые элементы, трансураны — элементы, следующие за ураном (атомный номер больше 92).
- Трансплутониевые элементы — элементы, следующие за плутонием (атомный номер больше 94).
- Трансфермиевые элементы — элементы, следующие за фермием (атомный номер больше 100).
- Трансактиноидные элементы, трансактиноиды — элементы, следующие за актиноидами (атомный номер больше 103).
- Суперактиноиды — гипотетически возможная группа элементов, с атомными номерами 121—153 (которые входят в g-блок).
- Тяжёлый атом — термин, используемый в компьютерной химии для описания всех элементов, кроме водорода и гелия.
- Металлы — термин, используемый в астрофизике для описания всех элементов, кроме водорода и гелия.
Геохимические группы элементов
Классификация Гольдшмидта
- Атмофильные элементы — склонные к накоплению в атмосфере Земли, включают в себя водород, азот и инертные газы.
- Халькофильные элементы — элементы сульфидных руд.
 К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po.
К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po. - Литофильные элементы — обладающие сродством к силикатным минералам и расплавам. К ним относятся Al, At, B, Ba, Be, Br, Ca, Cl, Cr, Cs, F, I, Hf, K, Li, Mg, Na, Nb, O, P, Rb, Sc, Si, Sr, Ta, Th, Ti, U, V, Y, Zr, W, лантаноиды.
- Сидерофильные элементы обладают сродством к железу. К ним относятся Au, Co, Fe, Ir, Mn, Mo, Ni, Os, Pd, Pt, Re, Rh, Ru.
Другие классификации
- Петрогенные элементы — основные элементы, составляющие породы и минералы: O, Si, Ti, Al, Mg, Fe, Ca, K, Mn, P, Na, K
- Редкие и рассеянные элементы — все остальные элементы
Биохимические группы элементов
- Биологически значимые элементы
- Макроэлементы — суточное поступление в организм человека более 200 мг
- Микроэлементы — бор, фтор, кремний, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, мышьяк, селен, молибден, иод
- Биологически инертные элементы
Примечания
Группы химических элементов — это.
 .. Что такое Группы химических элементов?
.. Что такое Группы химических элементов?
Группа химических элементов — термин, используемый ИЮПАК для описания номенклатурной классификации химических элементов[1].
Названия групп химических элементов, утверждённые ИЮПАК
- Щелочные металлы — металлы первой группы: Li, Na, K, Rb, Cs, Fr.
- Щелочноземельные металлы — металлы второй группы: Be, Mg, Ca, Sr, Ba, Ra.
- Пниктогены (пниктиды[2]) — элементы пятнадцатой группы: N, P, As, Sb, Bi.
- Халькогены — элементы шестнадцатой группы: O, S, Se, Te, Po.
- Галогены (галоиды[2]) — элементы семнадцатой группы: F, Cl, Br, I, At.
- Инертные газы — элементы восемнадцатой группы: He, Ne, Ar, Kr, Xe, Rn.
- Лантаноиды (лантаниды[2]) — элементы 57—71: La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
- Актиноиды (актиниды[2]) — элементы 89—103: Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
- Редкоземельные элементы — Sc, Y и лантаноиды.

- Переходные металлы — элементы 3—12 групп.
Другие группы химических элементов
Многие другие названия для групп элементов не утверждены ИЮПАК, но употребляются в различных областях науки. Например:
- Платиновая группа — Ru, Rh, Pd, Os, Ir, Pt.
- Благородные металлы — термин, который в основном используется для описания элементов, не подвергающихся коррозии — Au, Ag и металлы платиновой группы.
- Тяжёлые металлы — термин, использующийся для описания элементов с высокими значениями атомного веса.
- Природные металлы — металлы, находящиеся в природе; не являются искусственно полученными.
- Постпереходные металлы — металлы, у которых наблюдается полное заполнение d-подоболочки: Zn, Ga, Cd, In, Sn, Hg, Tl, Pb, Bi.
- Лёгкие металлы — термин, иногда использующийся для описания некоторых металлов p-блока: алюминий, галлий, индий, олово, таллий, свинец и висмут (иногда в эту группу включают также германий, сурьму и полоний).

- Трансурановые элементы, трансураны — элементы, следующие за ураном (атомный номер больше 92).
- Трансплутониевые элементы — элементы, следующие за плутонием (атомный номер больше 94).
- Трансфермиевые элементы — элементы, следующие за фермием (атомный номер больше 100).
- Трансактиноидные элементы, трансактиноиды — элементы, следующие за актиноидами (атомный номер больше 103).
- Суперактиноиды — гипотетически возможная группа элементов, с атомными номерами 121—153 (которые входят в g-блок).
- Тяжёлый атом — термин, используемый в компьютерной химии для описания всех элементов, кроме водорода и гелия.
- Металлы — термин, используемый в астрофизике для описания всех элементов, кроме водорода и гелия.
Геохимические группы элементов
Классификация Гольдшмидта
- Атмофильные элементы — склонные к накоплению в атмосфере Земли, включают в себя водород, азот и инертные газы.
- Халькофильные элементы — элементы сульфидных руд.
 К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po.
К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po. - Литофильные элементы — обладающие сродством к силикатным минералам и расплавам. К ним относятся Al, At, B, Ba, Be, Br, Ca, Cl, Cr, Cs, F, I, Hf, K, Li, Mg, Na, Nb, O, P, Rb, Sc, Si, Sr, Ta, Th, Ti, U, V, Y, Zr, W, лантаноиды.
- Сидерофильные элементы обладают сродством к железу. К ним относятся Au, Co, Fe, Ir, Mn, Mo, Ni, Os, Pd, Pt, Re, Rh, Ru.
Другие классификации
- Петрогенные элементы — основные элементы, составляющие породы и минералы: O, Si, Ti, Al, Mg, Fe, Ca, K, Mn, P, Na, K
- Редкие и рассеянные элементы — все остальные элементы
Биохимические группы элементов
- Биологически значимые элементы
- Макроэлементы — суточное поступление в организм человека более 200 мг
- Микроэлементы — бор, фтор, кремний, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, мышьяк, селен, молибден, иод
- Биологически инертные элементы
Примечания
Группы химических элементов — это.
 .. Что такое Группы химических элементов?
.. Что такое Группы химических элементов?
Группа химических элементов — термин, используемый ИЮПАК для описания номенклатурной классификации химических элементов[1].
Названия групп химических элементов, утверждённые ИЮПАК
- Щелочные металлы — металлы первой группы: Li, Na, K, Rb, Cs, Fr.
- Щелочноземельные металлы — металлы второй группы: Be, Mg, Ca, Sr, Ba, Ra.
- Пниктогены (пниктиды[2]) — элементы пятнадцатой группы: N, P, As, Sb, Bi.
- Халькогены — элементы шестнадцатой группы: O, S, Se, Te, Po.
- Галогены (галоиды[2]) — элементы семнадцатой группы: F, Cl, Br, I, At.
- Инертные газы — элементы восемнадцатой группы: He, Ne, Ar, Kr, Xe, Rn.
- Лантаноиды (лантаниды[2]) — элементы 57—71: La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
- Актиноиды (актиниды[2]) — элементы 89—103: Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
- Редкоземельные элементы — Sc, Y и лантаноиды.
- Переходные металлы — элементы 3—12 групп.
Другие группы химических элементов
Многие другие названия для групп элементов не утверждены ИЮПАК, но употребляются в различных областях науки. Например:
- Платиновая группа — Ru, Rh, Pd, Os, Ir, Pt.
- Благородные металлы — термин, который в основном используется для описания элементов, не подвергающихся коррозии — Au, Ag и металлы платиновой группы.
- Тяжёлые металлы — термин, использующийся для описания элементов с высокими значениями атомного веса.
- Природные металлы — металлы, находящиеся в природе; не являются искусственно полученными.
- Постпереходные металлы — металлы, у которых наблюдается полное заполнение d-подоболочки: Zn, Ga, Cd, In, Sn, Hg, Tl, Pb, Bi.
- Лёгкие металлы — термин, иногда использующийся для описания некоторых металлов p-блока: алюминий, галлий, индий, олово, таллий, свинец и висмут (иногда в эту группу включают также германий, сурьму и полоний).

- Трансурановые элементы, трансураны — элементы, следующие за ураном (атомный номер больше 92).
- Трансплутониевые элементы — элементы, следующие за плутонием (атомный номер больше 94).
- Трансфермиевые элементы — элементы, следующие за фермием (атомный номер больше 100).
- Трансактиноидные элементы, трансактиноиды — элементы, следующие за актиноидами (атомный номер больше 103).
- Суперактиноиды — гипотетически возможная группа элементов, с атомными номерами 121—153 (которые входят в g-блок).
- Тяжёлый атом — термин, используемый в компьютерной химии для описания всех элементов, кроме водорода и гелия.
- Металлы — термин, используемый в астрофизике для описания всех элементов, кроме водорода и гелия.
Геохимические группы элементов
Классификация Гольдшмидта
- Атмофильные элементы — склонные к накоплению в атмосфере Земли, включают в себя водород, азот и инертные газы.
- Халькофильные элементы — элементы сульфидных руд.
 К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po.
К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po. - Литофильные элементы — обладающие сродством к силикатным минералам и расплавам. К ним относятся Al, At, B, Ba, Be, Br, Ca, Cl, Cr, Cs, F, I, Hf, K, Li, Mg, Na, Nb, O, P, Rb, Sc, Si, Sr, Ta, Th, Ti, U, V, Y, Zr, W, лантаноиды.
- Сидерофильные элементы обладают сродством к железу. К ним относятся Au, Co, Fe, Ir, Mn, Mo, Ni, Os, Pd, Pt, Re, Rh, Ru.
Другие классификации
- Петрогенные элементы — основные элементы, составляющие породы и минералы: O, Si, Ti, Al, Mg, Fe, Ca, K, Mn, P, Na, K
- Редкие и рассеянные элементы — все остальные элементы
Биохимические группы элементов
- Биологически значимые элементы
- Макроэлементы — суточное поступление в организм человека более 200 мг
- Микроэлементы — бор, фтор, кремний, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, мышьяк, селен, молибден, иод
- Биологически инертные элементы
Примечания
Группы химических элементов — это.
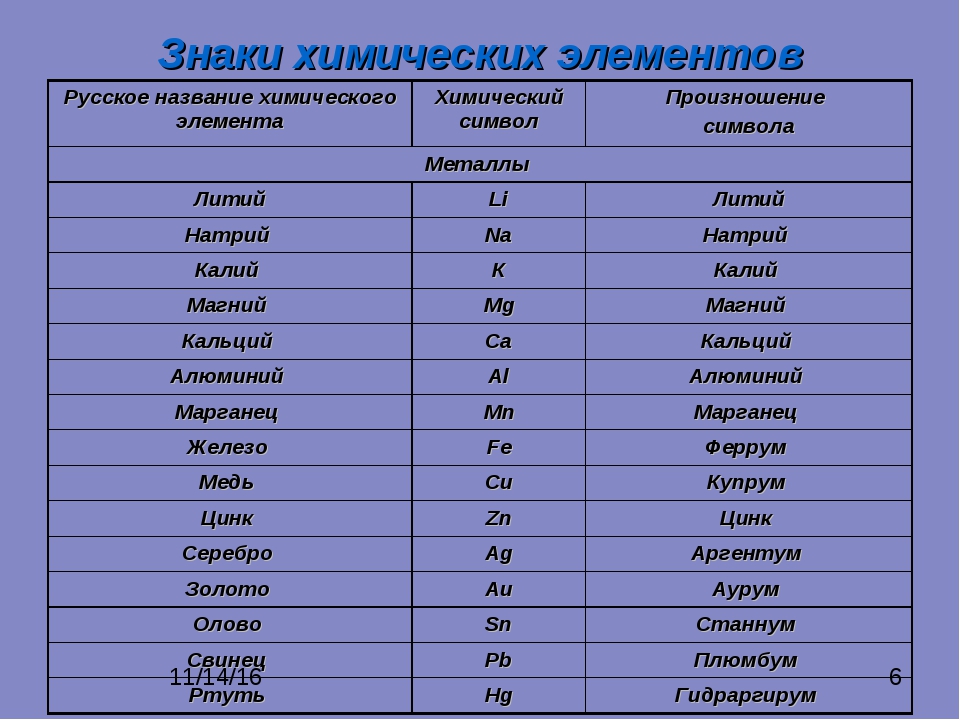 .. Что такое Группы химических элементов?
.. Что такое Группы химических элементов?
Группа химических элементов — термин, используемый ИЮПАК для описания номенклатурной классификации химических элементов[1].
Названия групп химических элементов, утверждённые ИЮПАК
- Щелочные металлы — металлы первой группы: Li, Na, K, Rb, Cs, Fr.
- Щелочноземельные металлы — металлы второй группы: Be, Mg, Ca, Sr, Ba, Ra.
- Пниктогены (пниктиды[2]) — элементы пятнадцатой группы: N, P, As, Sb, Bi.
- Халькогены — элементы шестнадцатой группы: O, S, Se, Te, Po.
- Галогены (галоиды[2]) — элементы семнадцатой группы: F, Cl, Br, I, At.
- Инертные газы — элементы восемнадцатой группы: He, Ne, Ar, Kr, Xe, Rn.
- Лантаноиды (лантаниды[2]) — элементы 57—71: La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
- Актиноиды (актиниды[2]) — элементы 89—103: Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
- Редкоземельные элементы — Sc, Y и лантаноиды.
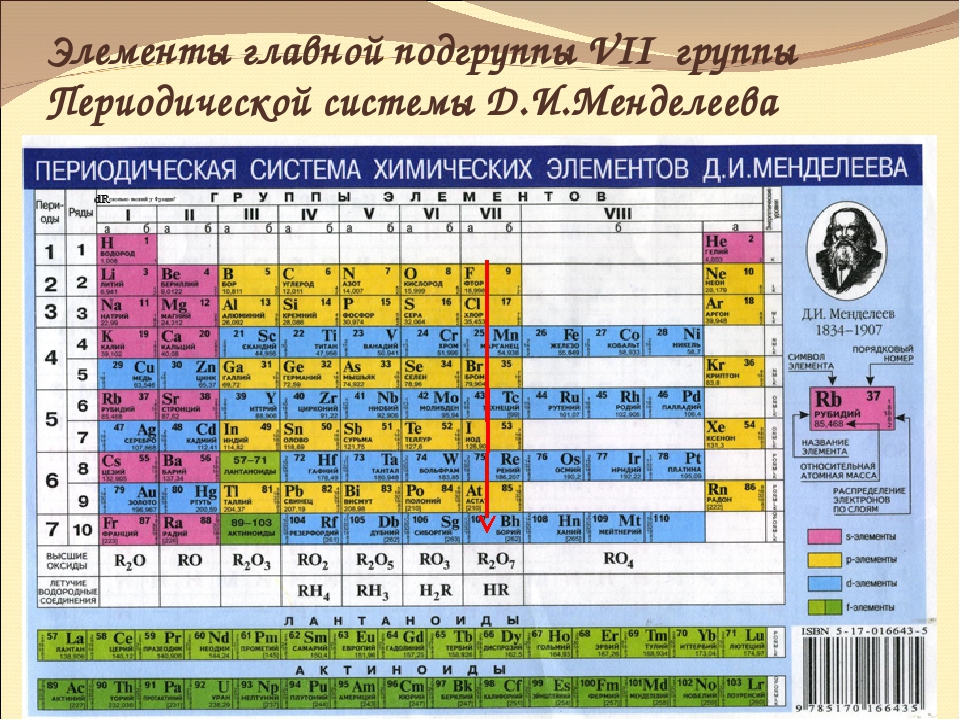
- Переходные металлы — элементы 3—12 групп.
Другие группы химических элементов
Многие другие названия для групп элементов не утверждены ИЮПАК, но употребляются в различных областях науки. Например:
- Платиновая группа — Ru, Rh, Pd, Os, Ir, Pt.
- Благородные металлы — термин, который в основном используется для описания элементов, не подвергающихся коррозии — Au, Ag и металлы платиновой группы.
- Тяжёлые металлы — термин, использующийся для описания элементов с высокими значениями атомного веса.
- Природные металлы — металлы, находящиеся в природе; не являются искусственно полученными.
- Постпереходные металлы — металлы, у которых наблюдается полное заполнение d-подоболочки: Zn, Ga, Cd, In, Sn, Hg, Tl, Pb, Bi.
- Лёгкие металлы — термин, иногда использующийся для описания некоторых металлов p-блока: алюминий, галлий, индий, олово, таллий, свинец и висмут (иногда в эту группу включают также германий, сурьму и полоний).

- Трансурановые элементы, трансураны — элементы, следующие за ураном (атомный номер больше 92).
- Трансплутониевые элементы — элементы, следующие за плутонием (атомный номер больше 94).
- Трансфермиевые элементы — элементы, следующие за фермием (атомный номер больше 100).
- Трансактиноидные элементы, трансактиноиды — элементы, следующие за актиноидами (атомный номер больше 103).
- Суперактиноиды — гипотетически возможная группа элементов, с атомными номерами 121—153 (которые входят в g-блок).
- Тяжёлый атом — термин, используемый в компьютерной химии для описания всех элементов, кроме водорода и гелия.
- Металлы — термин, используемый в астрофизике для описания всех элементов, кроме водорода и гелия.
Геохимические группы элементов
Классификация Гольдшмидта
- Атмофильные элементы — склонные к накоплению в атмосфере Земли, включают в себя водород, азот и инертные газы.
- Халькофильные элементы — элементы сульфидных руд.
 К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po.
К ним относятся S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po. - Литофильные элементы — обладающие сродством к силикатным минералам и расплавам. К ним относятся Al, At, B, Ba, Be, Br, Ca, Cl, Cr, Cs, F, I, Hf, K, Li, Mg, Na, Nb, O, P, Rb, Sc, Si, Sr, Ta, Th, Ti, U, V, Y, Zr, W, лантаноиды.
- Сидерофильные элементы обладают сродством к железу. К ним относятся Au, Co, Fe, Ir, Mn, Mo, Ni, Os, Pd, Pt, Re, Rh, Ru.
Другие классификации
- Петрогенные элементы — основные элементы, составляющие породы и минералы: O, Si, Ti, Al, Mg, Fe, Ca, K, Mn, P, Na, K
- Редкие и рассеянные элементы — все остальные элементы
Биохимические группы элементов
- Биологически значимые элементы
- Макроэлементы — суточное поступление в организм человека более 200 мг
- Микроэлементы — бор, фтор, кремний, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, мышьяк, селен, молибден, иод
- Биологически инертные элементы
Примечания
Урок №58.
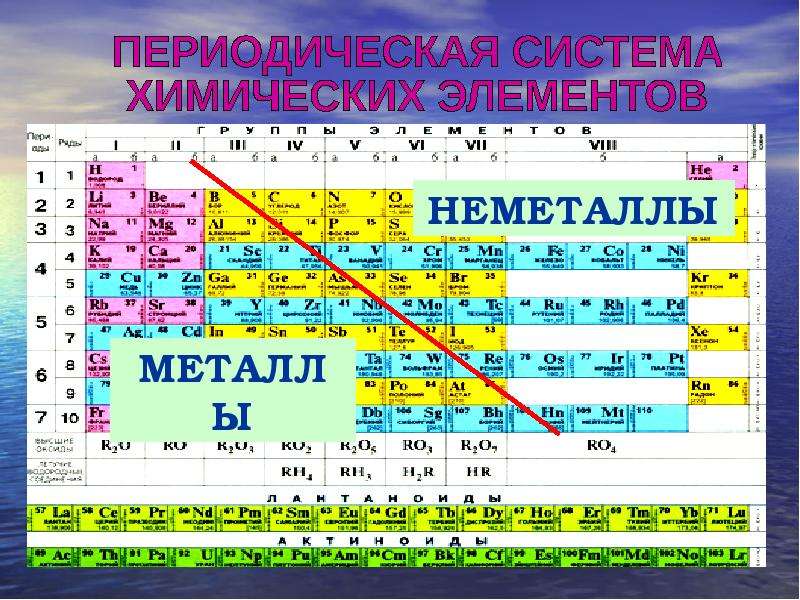
 Периодическая таблица химических элементов (короткая форма): А- и Б-группы, периоды
Периодическая таблица химических элементов (короткая форма): А- и Б-группы, периоды
ПЕРИОДИЧЕСКАЯ
ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Графическим изображением периодического закона
является периодическая таблица. Она содержит 7 периодов и 8 групп.
Короткая
форма таблицы Д.И. Менделеева.
Полудлинный
вариант таблицы Д.И. Менделеева.
Существует ещё и длинный вариант таблицы, он похож
на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы
таблицы.
Оригинал таблицы Д. И. Менделеева
1.
Период
– химические элементы,
расположенные в строчку (1 – 7)
Малые
(1,
2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) –
состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и
третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой
период незавершен.
Все периоды (кроме первого) начинаются щелочным
металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных
масс элементов наблюдается усиление неметаллических и ослабление металлических
свойств. В больших периодах переход свойств от активного металла к благородному
газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах
(через 8 элементов). Кроме того, в малых периодах слева направо
валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале
валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к
рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у
серебра, потом снова возрастает.
2.
Группы — вертикальные столбцы элементов с одинаковым
числом валентных электронов, равным номеру группы. Различают главные (А) и
побочные подгруппы (Б).
Главные
подгруппы состоят из элементов малых и больших
периодов.
Побочные
подгруппы состоят из элементов только больших
периодов.
В главных подгруппах сверху вниз металлические
свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных
групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента
(кроме N, O,
F).
Общими для элементов главных и побочных подгрупп
являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов
элементов I
— III
групп (кроме бора) преобладают основные свойства, с IV по VIII — кислотные.
Группа | I | II | III | IV | V | VI | VII | VIII (кроме инертных газов) |
Высший оксид | Э2О | ЭО | Э2О3 | ЭО2 | Э2О5 | ЭО3 | Э2О7 | ЭО4 |
Гидрат высшего оксида | ЭОН | Э(ОН)2 | Э(ОН)3 | Н2ЭО3 | Н3ЭО4 | Н2ЭО4 | НЭО4 | Н4ЭО4 |
Для элементов главных подгрупп общими
являются формулы водородных соединений. Элементы главных подгрупп I — III групп образуют твердые вещества —
Элементы главных подгрупп I — III групп образуют твердые вещества —
гидриды (водород в степени окисления — 1), а IV — VII групп — газообразные. Водородные
соединения элементов главных подгрупп IV группы (ЭН4) — нейтральны, V группы (ЭН3) —
основания, VI
и VII
групп (Н2Э и НЭ) — кислоты.
Основные группы пищевых продуктов и их значение в питании
Человек использует в пищу разнообразные продукты, которые необходимы ему для роста, движения, здоровья. Чтобы расти, нужен белок, жиры; для движения и поддержания температуры тела нужны углеводы, для здоровья костей и зубов – кальций, фосфор. Для здоровья – витамины. Где же находятся эти вещества?
Можно выделить несколько основных групп пищевых продуктов: мясо и мясопродукты; рыба и рыбопродукты; яйца; молоко и молочные продукты; хлеб и хлебобулочные изделия, крупы, макаронные изделия; бобовые; овощи, фрукты и ягоды; орехи и грибы; кондитерские изделия; пищевые жиры; напитки.
Мясо и мясопродукты. Эта группа продуктов включает говядину, баранину, свинину, мясо птиц (куриц, цыплят, индейки), кроликов, а также различные виды сосисок, сарделек, колбас и колбасных изделий. Общее для всех этих продуктов — высокое содержание белка, железа и витамина В12. При этом белки мяса и мясопродуктов обладают высоким качеством. Вот почему мясо рекомендуется ежедневно включать в питание детей. Но колбасы, сардельки и сосиски содержат значительно больше жира и соли, чем мясо. При их изготовлении используется ряд пищевых добавок. Свинина и особенно баранина также содержат больше жира, чем говядина, причем в них преобладает трудноусвояемый (тугоплавкий) жир. Доля жира в курином мясе, как правило, ниже, чем в говядине и тем более свинине и баранине. Поэтому в рационе школьников должны преобладать блюда из птицы и говядины, тогда как баранину, свинину, колбасы, сосиски и сардельки следует использовать ограниченно — не чаще 1-2 раз в неделю.
Эта группа продуктов включает говядину, баранину, свинину, мясо птиц (куриц, цыплят, индейки), кроликов, а также различные виды сосисок, сарделек, колбас и колбасных изделий. Общее для всех этих продуктов — высокое содержание белка, железа и витамина В12. При этом белки мяса и мясопродуктов обладают высоким качеством. Вот почему мясо рекомендуется ежедневно включать в питание детей. Но колбасы, сардельки и сосиски содержат значительно больше жира и соли, чем мясо. При их изготовлении используется ряд пищевых добавок. Свинина и особенно баранина также содержат больше жира, чем говядина, причем в них преобладает трудноусвояемый (тугоплавкий) жир. Доля жира в курином мясе, как правило, ниже, чем в говядине и тем более свинине и баранине. Поэтому в рационе школьников должны преобладать блюда из птицы и говядины, тогда как баранину, свинину, колбасы, сосиски и сардельки следует использовать ограниченно — не чаще 1-2 раз в неделю.
Рыба и рыбопродукты. Пищевая ценность рыбы и рыбопродуктов близка к мясу. Эта группа — также важнейшие источники высококачественного белка, легкоусвояемого железа и витамина В12. Более того, поскольку в рыбе меньше, чем в мясе, соединительной ткани, то рыба и ее белки легче перевариваются и усваиваются детьми и подростками. В этом одна из причин того, что в вечернее время рекомендуются блюда из рыбы, а не из мяса: желудок и кишечник тоже должны отдыхать ночью, а не заниматься перевариванием пищи. Несмотря на отмеченное сходство в химическом составе рыбы и мяса, первая содержит некоторые пищевые вещества, отсутствующие в мясе. Это прежде всего микроэлемент «йод». Рыбы богаче мяса витаминами РР и В6.
Эта группа — также важнейшие источники высококачественного белка, легкоусвояемого железа и витамина В12. Более того, поскольку в рыбе меньше, чем в мясе, соединительной ткани, то рыба и ее белки легче перевариваются и усваиваются детьми и подростками. В этом одна из причин того, что в вечернее время рекомендуются блюда из рыбы, а не из мяса: желудок и кишечник тоже должны отдыхать ночью, а не заниматься перевариванием пищи. Несмотря на отмеченное сходство в химическом составе рыбы и мяса, первая содержит некоторые пищевые вещества, отсутствующие в мясе. Это прежде всего микроэлемент «йод». Рыбы богаче мяса витаминами РР и В6.
Третьим важным источником белка в питании человека служат куриные яйца. Но, помимо белка, этот продукт содержит немало и других полезных веществ: жир, витамины А, В12. При этом все пищевые вещества яйца быстро и хорошо всасываются. Поэтому яйца – полезны для детей, если, конечно, они не вызывают аллергию (что бывает нередко).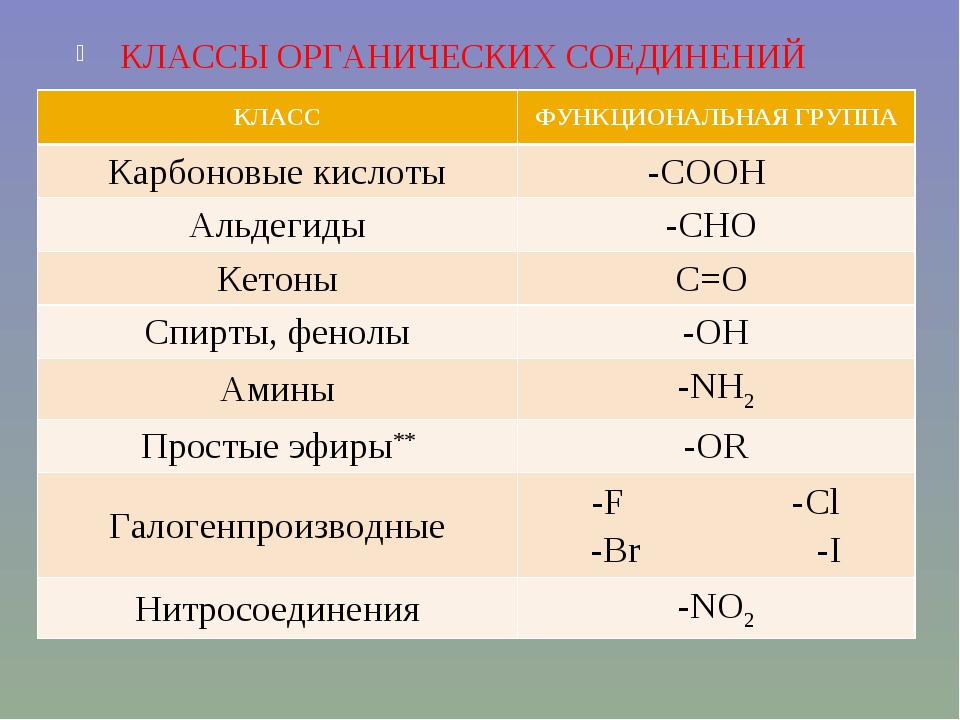 Увлекаться яйцами, однако, не следует. Хороша «золотая середина» — 1-2 яйца в день, не чаще 2-3 раз в неделю.
Увлекаться яйцами, однако, не следует. Хороша «золотая середина» — 1-2 яйца в день, не чаще 2-3 раз в неделю.
Следующая группа продуктов — близкие «родственники» первых трех групп. Речь идет о молоке и молочных продуктах, которые «роднит» с мясом и рыбой наличие в них высококачественного белка. Но белок — это не единственное достоинство указанной группы продуктов. Кальций и витамин В2 вы получаете в основном из молока и молочных продуктов. В день вы должны выпивать не менее двух стаканов молока или кефира. Еще выше содержание кальция и витамина В2 в таких продуктах, как творог и сыр, которые являются «природными концентратами» этих веществ.
Кальций особенно необходим детям и подросткам, так как в этот период происходит интенсивное формирование костей и зубов, требующее значительных количеств кальция
Следует особо подчеркнуть важную роль кисломолочных продуктов (кефира, ряженки, йогуртов, простокваш и др.). Эти напитки не только содержат перечисленные пищевые вещества (белок, Са, витамин В2 и др. ), но и несут в себе полезные микроорганизмы, «поддерживающие жизнь», которые очень полезны для организма
), но и несут в себе полезные микроорганизмы, «поддерживающие жизнь», которые очень полезны для организма
Хлеб и хлебобулочные продукты, крупы, макаронные изделия. И хлеб, и крупы могут служить источником практически всех основных пищевых веществ — белка, жира, углеводов, некоторых витаминов (В,, В2, РР), минеральных солей (магния, железа, селена и др.). В них имеются растительные волокна, необходимые для нормальной работы кишечника и желчевыделительной системы. Однако в этих продуктах преобладают углеводы (главным образом крахмал), тогда как содержание белка и жира существенно ниже. Более того, белки хлеба характеризуются значительно более низкой биологической ценностью, чем белки мяса, рыбы, молочных продуктов. Поэтому хлеб и крупы должны сочетаться в рационе с мясом, рыбой, молоком и другими продуктами животного происхождения. Традиционное же увлечение хлебом, кашами, блюдами из макарон и вермишели, к сожалению, достаточно часто имеющее место в питании, безусловно, не может быть признано полезным, так как сопровождается избыточным весом. Ассортимент хлеба, круп, макаронных изделий весьма широк. Предпочтение надо отдавать хлебу из муки грубого помола (ржаной, обойной), так как в нем выше содержание растительных волокон, витаминов В,, В2, PP. Среди круп на первое место по пищевой ценности следует поставить гречневую и овсяную, которые содержат большее количество полезных веществ (белков, жиров, углеводов, витаминов, минеральных солей), чем другие крупы. Пищевая ценность манной крупы ниже, чем гречневой и овсяной. Однако ее вкусовые качества позволяют ей занимать достойное место среди других круп.
Ассортимент хлеба, круп, макаронных изделий весьма широк. Предпочтение надо отдавать хлебу из муки грубого помола (ржаной, обойной), так как в нем выше содержание растительных волокон, витаминов В,, В2, PP. Среди круп на первое место по пищевой ценности следует поставить гречневую и овсяную, которые содержат большее количество полезных веществ (белков, жиров, углеводов, витаминов, минеральных солей), чем другие крупы. Пищевая ценность манной крупы ниже, чем гречневой и овсяной. Однако ее вкусовые качества позволяют ей занимать достойное место среди других круп.
Овощи и фрукты служат важными источниками ряда минеральных солей (калия, железа), сахаров, растительных волокон, органических кислот, улучшающих процесс пищеварения, некоторых витаминов, в частности витамина С. И овощи, и фрукты наиболее полезны в свежем виде, так как любой вид кулинарной обработки снижает содержание в них витаминов, в первую очередь С.
Вместе с тем овощи и фрукты полезны и в виде различных блюд, а также соков, пищевая ценность которых очень высока. Овощи (морковь, свекла, капуста, томаты, огурцы) широко используются при приготовлении салатов, винегретов, первых блюд (борщей, щей), а фрукты и ягоды — при приготовлении компотов, киселей.
Овощи (морковь, свекла, капуста, томаты, огурцы) широко используются при приготовлении салатов, винегретов, первых блюд (борщей, щей), а фрукты и ягоды — при приготовлении компотов, киселей.
Кондитерские изделия. Эта группа продуктов служит в основном источником углеводов и энергии. Учитывая вашу высокую двигательную активность и связанный с этим большой расход энергии, кондитерские изделия не могут считаться для детей ненужными. Кроме того, нельзя рассматривать питание только как процесс поставки в организм пищевых веществ. Питание — это еще и источник радости, положительных эмоций, и кондитерские изделия в этом отношении доставляют немало удовольствия детям всех возрастов
Пищевые жиры. Эта группа продуктов включает жиры животного происхождения — сливочное масло, сливки, животные жиры (говяжий, бараний) и растительные масла (подсолнечное, кукурузное, соевое, оливковое и др.), а также маргарины. Эти продукты нужны и как источник витаминов А, Е, D, и как необходимые компоненты в формировании вкуса и аромата блюд в процессе их приготовления .
Чтобы пища приносила пользу, надо выполнять правила здорового питания.
- Пища должна быть разнообразной (растительной и животной).
- Необходимо поддерживать нормальный вес.
- Больше употреблять фруктов и овощей.
- Меньше употреблять сладкого, соленого, копченого, газированных напитков.
- Не используйте в пищу немытые овощи, фрукты и ягоды.
- Соблюдайте режим питания.
Избыток углеводов, особенно Сахаров, может привести также к избыточной массе тела. Поэтому конфеты, шоколад, пирожные и т.п. должны присутствовать в рационе школьников, но в разумных количествах. Сахар служит одной из важных причин развития кариеса, который, в свою очередь, может вести в дальнейшем к болезням суставов, почек и др. Сахар и конфеты повышают частоту развития кариеса особенно существенно, если дети едят их не после приема основных блюд, а между приемами пищи, когда зубная эмаль не защищена от сахара другими пищевыми веществами
Г. Гейне: «Человек есть то, что он ест».
Гейне: «Человек есть то, что он ест».
В этих словах подчеркивается исключительная роль питания в формировании и тела, и поведения человека. Характер питания оказывает огромное влияние на физическое развитие человека, особенно в детском и подростковом возрасте.
Правильное питание абсолютно необходимо для обеспечения нормального кроветворения, зрения, полового развития, поддержания нормального состояния кожных покровов. Без нормального питания не может работать ни один внутренний орган: ни сердце, ни желудок, ни печень, ни почки. Более того, здоровое питание выполняет еще и защитную функцию, повышая устойчивость детей и взрослых к инфекциям, ядам, радиоактивному
Диоксины и их воздействие на здоровье людей
История вопроса
Диоксины являются загрязнителями окружающей среды. Они входят в состав «грязной дюжины» – группы опасных химических веществ, известных как стойкие органические загрязнители. Диоксины вызывают особое беспокойство в связи с их высоким токсическим потенциалом. Эксперименты показывают, что они воздействуют на целый ряд органов и систем.
Эксперименты показывают, что они воздействуют на целый ряд органов и систем.
Попав в организм человека, диоксины долгое время сохраняются в нем благодаря своей химической устойчивости и способности поглощаться жировыми тканями, в которых они затем откладываются. Период их полураспада в организме оценивается в 7-11 лет. В окружающей среде диоксины имеют тенденцию накапливаться в пищевой цепи. Концентрация диоксинов увеличивается по мере следования по пищевой цепи животного происхождения.
Химическое название диоксина – 2,3,7,8- тетрахлородибензо пара диоксин (ТХДД). Название «диоксины» часто используется для семейства структурно и химически связанных полихлорированных дибензо-пара-диоксинов (ПХДД) и полихлорированных дибензофуранов (ПХДФ). Некоторые диоксиноподобные полихлорированные бифенилы (ПХБ) с похожими токсическими свойствами также входят в понятие «диоксины». Выявлено 419 типов относящихся к диоксинам соединений, но лишь 30 из них имеют значительную токсичность, а самыми токсичными являются ТХДД.
Источники диоксинового загрязнения
Диоксины образуются, главным образом, в результате промышленных процессов, но могут также образовываться и в результате естественных процессов, таких как извержения вулканов и лесные пожары. Диоксины являются побочными продуктами целого ряда производственных процессов, включая плавление, отбеливание целлюлозы с использованием хлора и производство некоторых гербицидов и пестицидов. Основными виновниками выбросов диоксинов в окружающую среду часто являются неконтролируемые мусоросжигательные установки (для твердых и больничных отходов) из-за неполного сжигания отходов. Существуют технологии, позволяющие осуществлять контролируемое сжигание отходов при низких выбросах.
Несмотря на локальное образование диоксинов, их распространение в окружающей среде носит глобальный характер. Диоксины можно обнаружить в любой части мира практически в любой среде. Самые высокие уровни этих соединений обнаруживаются в почвах, осадочных отложениях и пищевых продуктах, особенно в молочных продуктах, мясе, рыбе и моллюсках. Незначительные уровни обнаруживаются в растениях, воде и воздухе.
Незначительные уровни обнаруживаются в растениях, воде и воздухе.
Во всем мире имеются обширные запасы отработанных промышленных масел на основе ПХБ, многие из которых содержат высокие уровни ПХДФ. Длительное хранение и ненадлежащая утилизация этих материалов может приводить к выбросам диоксина в окружающую среду и загрязнению пищевых продуктов людей и животных. Утилизировать отходы на основе ПХБ без загрязнения окружающей среды и популяций людей не просто. С такими материалами необходимо обращаться как с опасными отходами, и лучшим способом их утилизации является сжигание при высоких температурах в специально оборудованных местах.
Случаи диоксинового загрязнения
Многие страны контролируют пищевые продукты на наличие диоксинов. Это способствует раннему выявлению загрязнения и часто позволяет предотвратить крупномасштабные последствия. Во многих случаях загрязнение диоксинами происходит через загрязненный корм для животных, например случаи повышенного уровня содержания диоксинов в молоке или корме для животных были увязаны с гранулами глины, жиров или цитрусовых, используемых при изготовлении животных кормов.
Некоторые случаи диоксинового загрязнения были более значительными, с более широкими последствиями для многих стран.
В конце 2008 года Ирландия сняла с продажи многочисленные тонны свинины и продуктов из свинины, так как во взятых образцах свинины были обнаружены уровни диоксинов, превышающие безопасный уровень в 200 раз. Это привело к снятию с продажи в связи с химическим загрязнением одной из самых крупных партий пищевых продуктов. Оценки риска, проведенные Ирландией, показали, что проблемы для общественного здравоохранения нет. Было прослежено, что источником загрязнения были зараженные корма.
В 1999 году высокие уровни диоксинов были обнаружены в домашней птице и яйцах из Бельгии. Затем загрязненные диоксином продукты животного происхождения (домашняя птица, яйца, свинина) были обнаружены в некоторых других странах. Источником был корм для животных, загрязненный в результате незаконной утилизации отработанных промышленных масел на основе ПХБ.
В 1976 году на химическом заводе в Севесо, Италия, произошел выброс больших количеств диоксинов.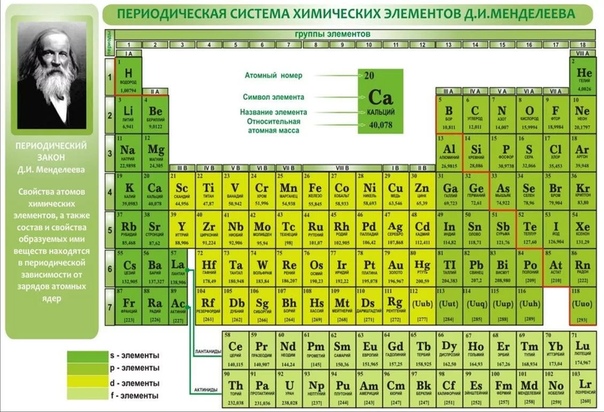 Облако ядовитых химических веществ, включая ТХДД, вырвалось в воздух и, в конечном итоге, заразило территорию в 15 квадратных километров, на которой проживало 37 000 человек.
Облако ядовитых химических веществ, включая ТХДД, вырвалось в воздух и, в конечном итоге, заразило территорию в 15 квадратных километров, на которой проживало 37 000 человек.
Экстенсивные исследования среди подвергшегося воздействию населения продолжаются для определения долговременных последствий этого инцидента на здоровье людей.
Проводятся также экстенсивные исследования последствий для здоровья ТХДД в связи с его присутствием в некоторых партиях гербицида Эйджент Ориндж (Agent Orange), использовавшегося в качестве дефолианта во время войны во Вьетнаме. До сих пор исследуется его связь с определенными типами рака, а также с диабетом.
Несмотря на то, что воздействию диоксинов могут подвергаться все страны, большинство сообщений о случаях загрязнения поступает из промышленно развитых стран, где для выявления проблем, связанных с диоксинами, имеются надлежащий мониторинг за загрязнением пищевых продуктов, более высокий уровень осведомленности об опасности и лучшие нормативные средства управления.
Было зарегистрировано также несколько случаев преднамеренного отравления людей. Самым значительным из них является случай отравления Виктора Ющенко, Президента Украины, лицо которого было обезображено хлоракне.
Последствия воздействия диоксинов на здоровье человека
Кратковременное воздействие на человека высоких уровней диоксинов может привести к патологическим изменениям кожи, таким как хлоракне и очаговое потемнение, а также к изменениям функции печени. Длительное воздействие приводит к поражениям иммунной системы, формирующейся нервной системы, эндокринной системы и репродуктивных функций.
В результате хронического воздействия диоксинов у животных развиваются некоторые типы рака. В 1997 и 2012 годах Международное агентство ВОЗ по исследованию рака (МАИР) сделало оценку ТХДД. На основе данных о животных и эпидемиологических данных о людях ТХДД был классифицирован МАИР как «известный человеческий канцероген». Однако ТХДД не оказывает воздействия на генетический материал, и существует такой уровень воздействия, ниже которого риск развития рака становится незначительным.
В связи с повсеместным распространением диоксинов все люди подвергаются его воздействию и имеют определенный уровень диоксинов в организме, который приводит к так называемой нагрузке на организм. Нынешнее обычное фоновое воздействие, в среднем, не имеет последствий для здоровья человека. Однако из-за высокого токсического потенциала этого класса соединений необходимо принимать меры для снижения уровня фонового воздействия.
Чувствительные подгруппы
Наиболее чувствителен к воздействию диоксина развивающийся плод. Новорожденный ребенок с быстро развивающимися системами органов может также быть более уязвимым перед определенными воздействиями. Некоторые люди или группы людей могут подвергаться воздействию более высоких уровней диоксинов из-за своего питания (например, жители некоторых частей мира, употребляющие в пищу много рыбы) или своего рода деятельности (например, работники целлюлозно-бумажной промышленности, мусоросжигательных заводов, свалок опасных отходов).
Профилактика и контроль воздействия диоксинов
Надлежащее сжигание загрязненных материалов является наилучшим доступным методом профилактики и контроля воздействия диоксинов. С помощью этого метода можно также уничтожать отработанные масла на основе ПХБ. В процессе сжигания требуются высокие температуры – свыше 850°С. Для уничтожения больших количеств загрязненных материалов необходимы еще более высокие температуры – 1000° и выше.
Наилучшим путем предотвращения или снижения уровня воздействия диоксинов на людей является принятие мер, ориентированных на источник, например, строгий контроль промышленных процессов для максимально возможного снижения уровня выделяемых диоксинов. Это является обязанностью национальных правительств. Комиссия «Кодекс Алиментариус» приняла в 2001 году Кодекс практики по мерам, ориентированным на источник, для уменьшения загрязнения пищевых продуктов химикатами (CAC/RCP 49-2001) и в 2006 году был принят Кодекс практики для предотвращения и снижения уровня загрязнения пищевых продуктов и кормов диоксинами и диоксиноподобными ПХБ (CAC/RCP 62-2006).
Более 90% случаев воздействия диоксинов на людей происходит через пищевые продукты, главным образом, через мясные и молочные продукты, рыбу и моллюсков. Следовательно, защита пищевых продуктов имеет решающее значение. В дополнение к принятию ориентированных на источник мер для уменьшения выбросов диоксина, необходимо также не допускать вторичного загрязнения пищевых продуктов в пищевой цепи. Решающее значение для производства безопасных пищевых продуктов имеют надлежащие средства управления и практика во время первичного производства, обработки, распределения и продажи.
Как отмечается в приведенных выше примерах, первопричиной загрязнения пищевых продуктов часто является загрязненный корм для животных.
Необходимы системы мониторинга за загрязнением пищевых продуктов, не допускающие превышение приемлемых уровней. Производители кормов и пищевых продуктов несут ответственность за обеспечение безопасного сырья и безопасных производственных процессов, а национальные правительства должны контролировать безопасность продовольственного снабжения и принимать меры для защиты здоровья населения.
Национальные правительства должны контролировать безопасность пищевых продуктов и принимать меры для охраны здоровья населения. В случае подозрения на загрязнение страны должны иметь планы действий в чрезвычайных обстоятельствах для выявления, задержания и утилизации загрязненных кормов и пищевых продуктов. Население, подвергшееся воздействию, необходимо обследовать с точки зрения уровня воздействия (например, измерить уровень загрязнителей в крови или материнском молоке) и его последствий (например, установить клиническое наблюдение для выявления признаков плохого состояния здоровья).
Что должны делать потребители для снижения риска воздействия?
Удаление жира с мяса и потребление молочных продуктов с пониженным содержанием жира может уменьшить воздействие диоксиновых соединений. Сбалансированное питание (включающее фрукты, овощи и злаки в надлежащих количествах) также позволяет избежать чрезмерного воздействия диоксина из какого-либо одного источника. Эта долговременная стратегия направлена на уменьшение нагрузки на организм и имеет особую значимость для девушек и молодых женщин, так как способствует уменьшению воздействия на развивающийся плод, а затем на находящегося на грудном вскармливании ребенка.
Что необходимо для выявления и измерения уровня диоксинов в окружающей среде и пищевых продуктах?
Для проведения количественного химического анализа диоксинов необходимы современные методы, доступные только в ограниченном числе лабораторий в мире. Стоимость таких анализов очень высока и зависит от типа образца – от более 1000 долларов США за анализ одной биологической пробы до нескольких тысяч долларов США за проведение всесторонней оценки выбросов из мусоросжигательной установки.
Разрабатывается все большее число методов биологического скрининга (на основе клеток или антител). Использование таких методов для исследований образцов пищевых продуктов пока еще не в достаточной степени легализировано. Такие методы скрининга позволят проводить большее число анализов по более низкой стоимости. В случае позитивного скрининг-теста для подтверждения результатов необходимо проводить более сложные химические анализы.
Деятельность ВОЗ, связанная с диоксинами
В 2015 г. ВОЗ впервые опубликовала оценки глобального бремени болезней пищевого происхождения. В этом контексте рассматривались последствия воздействия диоксинов на репродуктивную способность и функцию щитовидной железы. Рассмотрение только в этих 2 плоскостях позволяет предположить, что в некоторых частях мира такое воздействие может в значительной мере усугублять бремя болезней пищевого происхождения
ВОЗ впервые опубликовала оценки глобального бремени болезней пищевого происхождения. В этом контексте рассматривались последствия воздействия диоксинов на репродуктивную способность и функцию щитовидной железы. Рассмотрение только в этих 2 плоскостях позволяет предположить, что в некоторых частях мира такое воздействие может в значительной мере усугублять бремя болезней пищевого происхождения
Уменьшение воздействия диоксина является важной целью общественного здравоохранения. С целью разработки руководства по допустимым уровням воздействия ВОЗ провела ряд совещаний экспертов для определения приемлемого уровня поступления диоксинов в организм человека.
В 2001 году Совместный экспертный комитет Продовольственной и сельскохозяйственной организации Организации Объединенных Наций (ФАО)/ВОЗ по пищевым добавкам (СЭКПД) провел усовершенствованную всестороннюю оценку риска воздействия ПХДД, ПХДФ и «диоксиноподобных» ПХБ.
Для оценки долговременных или кратковременных рисков для здоровья, связанных с этими веществами, необходимо оценивать общее или среднее поступление через несколько месяцев, а приемлемый уровень поступления необходимо оценивать, как минимум, через один месяц. В предварительном порядке эксперты установили приемлемый уровень ежемесячного поступления в 70 пикограмм/кг в месяц. Это то количество диоксинов, которое может поступать в организм человека на протяжении всей его жизни без обнаруживаемых последствий для здоровья.
В предварительном порядке эксперты установили приемлемый уровень ежемесячного поступления в 70 пикограмм/кг в месяц. Это то количество диоксинов, которое может поступать в организм человека на протяжении всей его жизни без обнаруживаемых последствий для здоровья.
ВОЗ в сотрудничестве с ФАО через Комиссию «Кодекс Алиментариус» разработала «Кодекс практики для предотвращения и снижения уровня загрязнения пищевых продуктов и кормов диоксинами и диоксиноподобными ПХБ». Этот документ представляет собой руководство для соответствующих национальных и региональных органов в области принятия превентивных мер.
ВОЗ также отвечает за Программу мониторинга и оценки загрязнения пищевых продуктов в рамках Глобальной системы мониторинга окружающей среды. Эта программа, известная под названием GEMS/Food, предоставляет информацию об уровнях и тенденциях загрязнителей в пищевых продуктах через сеть участвующих в ней лабораторий более чем из 50 стран мира. Диоксины включены в эту программу.
ВОЗ также проводит периодические исследования уровней содержания диоксинов в материнском молоке, главным образом в европейских странах. Эти исследования позволяют оценить воздействие на людей диоксинов из всех источников. Последние данные свидетельствуют о том, что за последние два десятилетия меры, введенные в ряде стран для контроля выбросов диоксина, привели к значительному уменьшению воздействия этих соединений. Данных из развивающихся стран не достаточно для анализа тенденций во времени.
ВОЗ также проводит периодические исследования уровней содержания диоксинов в материнском молоке. Эти исследования позволяют оценить воздействие на людей диоксинов из всех источников. Недавние данные свидетельствуют о том, что за последние два десятилетия меры, введенные в ряде стран для контроля выбросов диоксинов, привели к значительному уменьшению воздействия этих соединений.
ВОЗ продолжает эти исследования в сотрудничестве с Программой ООН по окружающей среде (ЮНЕП), в контексте «Стокгольмской конвенции» — международного соглашения о сокращении выбросов определенных устойчивых органических загрязнителей, включая диоксины. Рассматривается возможность принятия ряда мер по сокращению выделения диоксинов в процессе сжигания и производства. ВОЗ и ЮНЕП проводят глобальные обследования грудного молока, в том числе во многих развивающихся странах, в целях мониторинга мировых тенденций загрязнения диоксинами и эффективности мер, осуществляемых в рамках Стокгольмской конвенции.
Рассматривается возможность принятия ряда мер по сокращению выделения диоксинов в процессе сжигания и производства. ВОЗ и ЮНЕП проводят глобальные обследования грудного молока, в том числе во многих развивающихся странах, в целях мониторинга мировых тенденций загрязнения диоксинами и эффективности мер, осуществляемых в рамках Стокгольмской конвенции.
Диоксины присутствуют в виде сложной смеси в окружающей среде и пищевых продуктах. Для оценки потенциального риска всей смеси по отношению к этой группе загрязнителей применяется понятие токсической эквивалентности.
ВОЗ установила факторы токсической эквивалентности (ФТЭ) диоксинов и родственных соединений и проводит их регулярную переоценку на консультациях экспертов. Установлены значения ВОЗ-ФТЭ, которые применяются для людей, млекопитающих, птиц и рыб.
функциональных групп | Введение в химию
Цель обучения
- Опишите важность функциональных групп для органических молекул
Ключевые моменты
- Функциональные группы — это совокупности атомов, которые прикрепляют углеродный скелет органической молекулы и придают определенные свойства.
- Каждый тип органических молекул имеет свой особый тип функциональной группы.
- Функциональные группы в биологических молекулах играют важную роль в образовании таких молекул, как ДНК, белки, углеводы и липиды.
- Функциональные группы включают: гидроксил, метил, карбонил, карбоксил, амино, фосфат и сульфгидрил.
Условия
- гидрофобизатор, обладающий сродством к воде; не может впитаться или намокать водой
- гидрофильный, обладающий сродством к воде; может впитывать или намокать водой
Расположение функциональных групп
Функциональные группы — это группы атомов, которые встречаются в органических молекулах и придают этим молекулам определенные химические свойства.Когда показаны функциональные группы, органическая молекула иногда обозначается как «R». Функциональные группы находятся вдоль «углеродной основы» макромолекул, которая образована цепями и / или кольцами атомов углерода с периодическим замещением таким элементом, как азот или кислород. Молекулы с другими элементами в углеродной основе являются замещенными углеводородами. Каждый из четырех типов макромолекул — белков, липидов, углеводов и нуклеиновых кислот — имеет свой собственный характерный набор функциональных групп, который в значительной степени способствует его различным химическим свойствам и его функциям в живых организмах.
Молекулы с другими элементами в углеродной основе являются замещенными углеводородами. Каждый из четырех типов макромолекул — белков, липидов, углеводов и нуклеиновых кислот — имеет свой собственный характерный набор функциональных групп, который в значительной степени способствует его различным химическим свойствам и его функциям в живых организмах.
Свойства функциональных групп
Функциональная группа может участвовать в определенных химических реакциях. Некоторые из важных функциональных групп в биологических молекулах включают: гидроксильные, метильные, карбонильные, карбоксильные, амино, фосфатные и сульфгидрильные группы. Эти группы играют важную роль в образовании таких молекул, как ДНК, белки, углеводы и липиды.
Классификация функциональных групп
Функциональные группы обычно классифицируются как гидрофобные или гидрофильные в зависимости от их заряда или полярности.Примером гидрофобной группы является молекула неполярного метана. Среди гидрофильных функциональных групп есть карбоксильная группа, содержащаяся в аминокислотах, некоторых боковых цепях аминокислот и головках жирных кислот, которые образуют триглицериды и фосфолипиды. Эта карбоксильная группа ионизируется, высвобождая ионы водорода (H + ) из группы COOH, в результате чего образуется отрицательно заряженная группа COO —; это способствует гидрофильности любой молекулы, на которой он находится. Другие функциональные группы, такие как карбонильная группа, имеют частично отрицательно заряженный атом кислорода, который может образовывать водородные связи с молекулами воды, снова делая молекулу более гидрофильной.
Эта карбоксильная группа ионизируется, высвобождая ионы водорода (H + ) из группы COOH, в результате чего образуется отрицательно заряженная группа COO —; это способствует гидрофильности любой молекулы, на которой он находится. Другие функциональные группы, такие как карбонильная группа, имеют частично отрицательно заряженный атом кислорода, который может образовывать водородные связи с молекулами воды, снова делая молекулу более гидрофильной.
Примеры функциональных групп Показанные здесь функциональные группы встречаются во многих различных биологических молекулах, где «R» — это органическая молекула.
Водородные связи между функциональными группами
Водородные связи между функциональными группами (внутри одной и той же молекулы или между разными молекулами) важны для функции многих макромолекул и помогают им правильно складываться и сохранять соответствующую форму, необходимую для правильного функционирования. Водородные связи также участвуют в различных процессах распознавания, таких как спаривание комплементарных оснований ДНК и связывание фермента с его субстратом.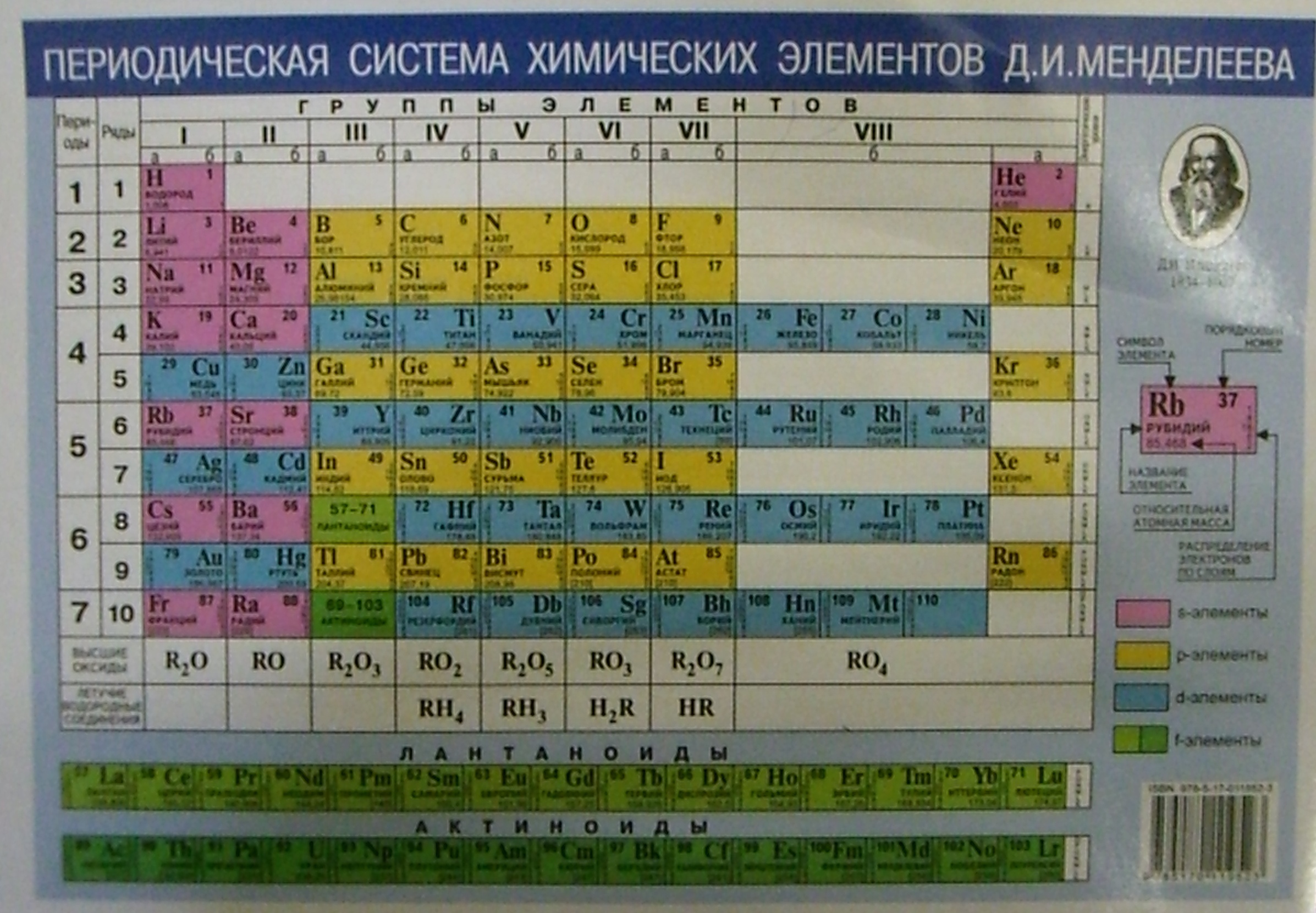
Водородные связи в ДНК Водородные связи соединяют две цепи ДНК вместе, создавая структуру двойной спирали.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Имена, свойства и реакции функциональных групп
Функциональные группы
Функциональные группы относятся к определенным атомам, связанным определенным образом, что придает соединению определенные физические и химические свойства.
Цели обучения
Определите термин «функциональная группа» применительно к органическим молекулам.
Основные выводы
Ключевые моменты
- Функциональные группы часто используются для «функционализации» соединения, придавая ему физические и химические свойства, отличные от его исходной формы.
- Функциональные группы будут вступать в реакции одного и того же типа независимо от соединения, частью которого они являются; однако присутствие определенных функциональных групп в непосредственной близости может ограничивать реакционную способность.

- Функциональные группы могут использоваться, чтобы отличать похожие соединения друг от друга.
Ключевые термины
- функциональная группа : Определенная группа элементов, которая характерна для класса соединений и определяет некоторые свойства и реакции этого класса.
- функционализация : Добавление определенных функциональных групп для придания соединению новых желаемых свойств.
Роль функциональных групп
В органической химии функциональная группа — это определенная группа атомов или связей внутри соединения, которая отвечает за характерные химические реакции этого соединения.Одна и та же функциональная группа будет вести себя аналогичным образом, претерпевая аналогичные реакции, независимо от соединения, частью которого она является. Функциональные группы также играют важную роль в номенклатуре органических соединений; объединение названий функциональных групп с названиями исходных алканов позволяет различать соединения.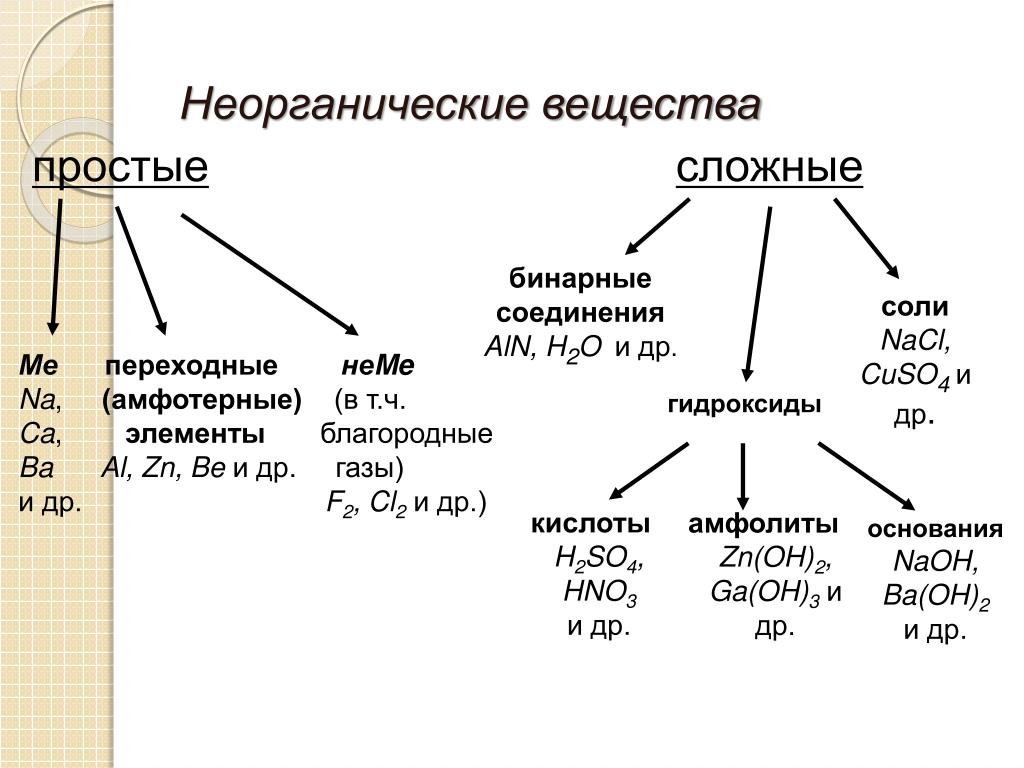
Атомы функциональной группы связаны вместе и с остальной частью соединения ковалентными связями. Первый атом углерода, который присоединяется к функциональной группе, называется альфа-углеродом; второй — бета-углерод; третий — гамма-углерод и т. д.Точно так же функциональная группа может называться первичной, вторичной или третичной, в зависимости от того, присоединена ли она к одному, двум или трем атомам углерода.
Классификация спиртов : Спирты представляют собой общую функциональную группу (-ОН). Их можно разделить на первичные, вторичные или третичные, в зависимости от того, к скольким атомам углерода присоединен центральный углерод.
Функциональные группы и реакционная способность
Функциональные группы играют важную роль в управлении органическими реакциями.Алкильные цепи часто нереактивны, и направление сайт-специфических реакций затруднено; ненасыщенные алкильные цепи с наличием функциональных групп обеспечивают более высокую реакционную способность и специфичность.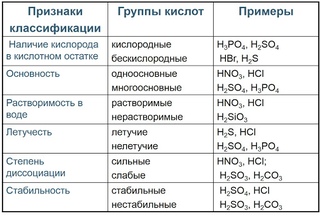 Часто соединения функционализируются определенными группами для конкретной химической реакции. Функционализация относится к добавлению функциональных групп к соединению путем химического синтеза. С помощью обычных методов синтеза к поверхности можно прикрепить любое органическое соединение. В материаловедении функционализация используется для достижения желаемых свойств поверхности; функциональные группы также можно использовать для ковалентного связывания функциональных молекул с поверхностями химических устройств.
Часто соединения функционализируются определенными группами для конкретной химической реакции. Функционализация относится к добавлению функциональных групп к соединению путем химического синтеза. С помощью обычных методов синтеза к поверхности можно прикрепить любое органическое соединение. В материаловедении функционализация используется для достижения желаемых свойств поверхности; функциональные группы также можно использовать для ковалентного связывания функциональных молекул с поверхностями химических устройств.
В органической химии наиболее распространенными функциональными группами являются карбонилы (C = O), спирты (-OH), карбоновые кислоты (CO 2 H), сложные эфиры (CO 2 R) и амины (NH 2 ). Важно уметь распознавать функциональные группы, а также физические и химические свойства, которые они дают соединениям.
Урок по функциональным группам органической химии : Это видео дает отличный обзор различных функциональных групп в органической химии.
Спирты
Спирты — это функциональные группы, характеризующиеся наличием группы -ОН.
Цели обучения
Определить общие свойства функциональной группы спирта
Основные выводы
Ключевые моменты
- Благодаря наличию группы -ОН, спирты могут образовывать водородные связи. Это приводит к более высоким температурам кипения по сравнению с их исходными алканами.
- Спирты полярны по своей природе. Это объясняется разницей в электроотрицательности между атомами углерода и кислорода.
- В химических реакциях спирты часто не могут покинуть молекулу самостоятельно; чтобы уйти, они часто становятся протонированными в воду, которая является лучшей уходящей группой. Спирты также могут депротонироваться в присутствии сильного основания.
Ключевые термины
- алкан : Любой из насыщенных углеводородов, включая метан, этан и соединения с длинной углеродной цепью, известные как парафины и т.
 Д., Которые имеют химическую формулу формы Cnh3n + 2.
Д., Которые имеют химическую формулу формы Cnh3n + 2. - альдегид : Любой из большого класса реакционноспособных органических соединений (R · CHO), имеющих карбонильную функциональную группу, присоединенную к одному углеводородному радикалу и атому водорода.
- карбоновая кислота : Любой из класса органических соединений, содержащих карбоксильную функциональную группу — углерод с двойной связью с кислородом и одинарной связью с другим кислородом, который, в свою очередь, связан с водородом.
- уходящая группа : В органической химии вид, который покидает родительскую молекулу после реакции замещения.
Спирты — это органические соединения, в которых гидроксильная функциональная группа (-ОН) связана с атомом углерода.Спирты представляют собой важный класс молекул, которые используются во многих научных, медицинских и промышленных целях.
Номенклатура спиртов
Согласно системе номенклатуры IUPAC, спирт называют, отбрасывая конец «-e» родительской углеродной цепи (в большинстве случаев алкан, алкен или алкин) и добавляя «-ол» в качестве окончания. Если необходимо указать расположение гидроксильной группы, число вставляется между названием исходного алкана и «-ol» (пропан-1-ол) или перед названием IUPAC (1-пропанол).Если присутствует группа с более высоким приоритетом, такая как альдегид, кетон или карбоновая кислота, тогда необходимо использовать префикс «гидрокси-» вместо окончания «-ол».
Если необходимо указать расположение гидроксильной группы, число вставляется между названием исходного алкана и «-ol» (пропан-1-ол) или перед названием IUPAC (1-пропанол).Если присутствует группа с более высоким приоритетом, такая как альдегид, кетон или карбоновая кислота, тогда необходимо использовать префикс «гидрокси-» вместо окончания «-ол».
Спирты классифицируются как первичные, вторичные или третичные в зависимости от количества атомов углерода, связанных с атомом углерода, который несет гидроксильную группу.
Спиртовая функциональная группа : Спирты характеризуются наличием -ОН-группы, которая обычно имеет изогнутую форму, как у воды.
Структура и физические свойства спиртов
По структуре спирт похож на воду, так как имеет изогнутую форму. Это геометрическое расположение отражает эффект отталкивания электронов и увеличивающийся стерический объем заместителей на центральном атоме кислорода. Как и вода, спирты полярны и содержат несимметричное распределение заряда между атомами кислорода и водорода. Высокая электроотрицательность кислорода по сравнению с углеродом приводит к укорачиванию и усилению связи -ОН.Присутствие групп -ОН позволяет образовывать водородные связи с другими группами -ОН, атомами водорода и другими молекулами. Поскольку спирты способны образовывать водородные связи, их температуры кипения выше, чем у их исходных молекул.
Высокая электроотрицательность кислорода по сравнению с углеродом приводит к укорачиванию и усилению связи -ОН.Присутствие групп -ОН позволяет образовывать водородные связи с другими группами -ОН, атомами водорода и другими молекулами. Поскольку спирты способны образовывать водородные связи, их температуры кипения выше, чем у их исходных молекул.
Спирты могут участвовать во многих химических реакциях. Они часто подвергаются депротонированию при наличии сильного основания. Такое поведение слабой кислоты приводит к образованию соли алкоксида и молекулы воды. Сами по себе гидроксильные группы не считаются хорошими уходящими группами.Часто их участие в реакциях нуклеофильного замещения инициируется протонированием атома кислорода, что приводит к образованию водного фрагмента — более удаляемой группы. Спирты могут реагировать с карбоновыми кислотами с образованием сложного эфира, и они могут окисляться до альдегидов или карбоновых кислот.
Спирты находят множество применений в нашем повседневном мире. Они содержатся в напитках, антифризах, антисептических средствах и топливе. Их можно использовать в качестве консервантов для образцов в науке, а в промышленности в качестве реагентов и растворителей, поскольку они обладают способностью растворять как полярные, так и неполярные вещества.
Они содержатся в напитках, антифризах, антисептических средствах и топливе. Их можно использовать в качестве консервантов для образцов в науке, а в промышленности в качестве реагентов и растворителей, поскольку они обладают способностью растворять как полярные, так и неполярные вещества.
эфиров
Эфиры представляют собой класс органических соединений, характеризующихся атомом кислорода, связанным с двумя алкильными или арильными группами.
Цели обучения
Определите термин «эфир» применительно к органическим соединениям.
Основные выводы
Ключевые моменты
- Эфиры имеют относительно низкие температуры кипения из-за их неспособности образовывать водородные связи друг с другом.
- Из-за разницы в электроотрицательности атомов кислорода и углерода в эфире молекула слабо полярна.
- Хотя в целом они имеют низкую реакционную способность, две неподеленные пары электронов на атоме кислорода действительно придают молекуле эфира некоторую реактивность; молекула эфира вступает в реакцию с сильными кислотами и служит основанием Льюиса.

Ключевые термины
- алкен : ненасыщенный алифатический углеводород с одной или несколькими двойными связями углерод-углерод.
- сложный эфир : соединение, чаще всего образующееся при конденсации спирта и кислоты с удалением воды.Он содержит функциональную группу C = O, присоединенную через углерод к другому атому кислорода.
- эфир : Соединение, содержащее атом кислорода, связанный с двумя углеводородными группами.
- амид : любое производное оксикислоты, в котором гидроксильная группа заменена амино или замещенной аминогруппой; особенно такие производные карбоновой кислоты, карбоксамиды.
Структура эфиров
Эфиры — это класс органических соединений, содержащих эфирную группу.Эфирная группа — это атом кислорода, связанный с двумя алкильными или арильными группами. Они следуют общей формуле R-O-R ’. Связь C-O-C характеризуется валентными углами, составляющими 104,5 градуса, с расстояниями C-O, составляющими около 140 мкм.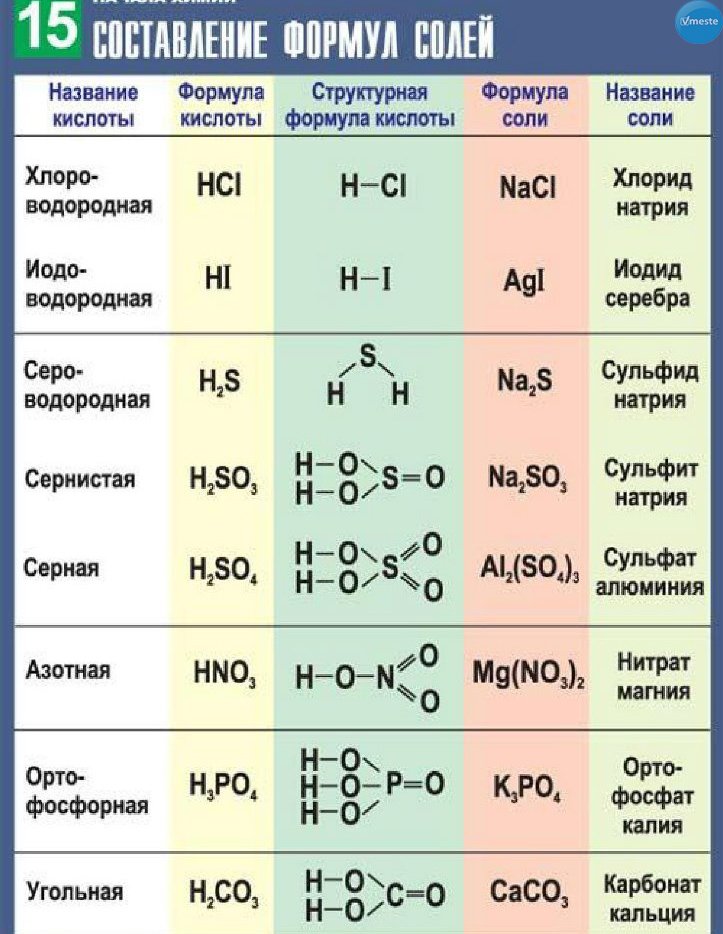 Кислород эфира более электроотрицателен, чем атомы углерода. Таким образом, альфа-атомы водорода более кислые, чем в обычных углеводородных цепях.
Кислород эфира более электроотрицателен, чем атомы углерода. Таким образом, альфа-атомы водорода более кислые, чем в обычных углеводородных цепях.
Эфиры : Общая структура эфира. Простой эфир характеризуется кислородной связью с двумя алкильными или арильными группами, представленными здесь R и R ’.Заместители могут быть, но не обязательно, одинаковыми.
Номенклатура эфиров
Существует два способа называть эфиры. Наиболее распространенный способ — определить алкильные группы по обе стороны от атома кислорода в алфавитном порядке, а затем написать «эфир». Например, этилметиловый эфир — это эфир, который имеет этильную группу и метильную группу по обе стороны от атома кислорода. Если две алкильные группы идентичны, простой эфир называется ди [алкил] эфиром. Например, диэтиловый эфир — это эфир с этильной группой на каждой стороне атома кислорода.
Другой способ наименования эфиров — это формальный метод IUPAC. Таким образом, форма следующая: [короткая алкильная цепь] [окси] [длинная алкильная цепь]. Например, название этилметилового эфира по ИЮПАК — метоксиэтан.
Например, название этилметилового эфира по ИЮПАК — метоксиэтан.
В циклических эфирах основа соединения известна как оксациклоалкан. «Окса» является индикатором замещения углерода в кольце кислородом. Примером является оксациклопентан, пятичленное кольцо, в котором имеется , четыре, атома углерода и один атом кислорода.
Тетрагидрофуран (THF) : обычное название циклического эфира «оксациклопентан» — тетрагидрофуран или THF. Это обычный органический растворитель, который смешивается с водой.
Свойства эфиров
Эфиры довольно неполярны из-за наличия алкильной группы по обе стороны от центрального кислорода. Присутствие прилегающих к нему объемных алкильных групп означает, что атом кислорода в значительной степени неспособен участвовать в образовании водородных связей. Следовательно, простые эфиры имеют более низкие температуры кипения по сравнению со спиртами с аналогичной молекулярной массой.Однако по мере того, как алкильная цепь простых эфиров становится длиннее, разница в точках кипения становится меньше. Это связано с эффектом усиления ван-дер-ваальсовых взаимодействий по мере увеличения количества атомов углерода и, следовательно, количества электронов. Две неподеленные пары электронов, присутствующие на атомах кислорода, позволяют эфирам образовывать водородные связи с водой. Эфиры более полярны, чем алкены, но не так полярны, как сложные эфиры, спирты или амиды сопоставимых структур.
Это связано с эффектом усиления ван-дер-ваальсовых взаимодействий по мере увеличения количества атомов углерода и, следовательно, количества электронов. Две неподеленные пары электронов, присутствующие на атомах кислорода, позволяют эфирам образовывать водородные связи с водой. Эфиры более полярны, чем алкены, но не так полярны, как сложные эфиры, спирты или амиды сопоставимых структур.
Реакция
Эфиры имеют относительно низкую химическую активность, но они все же более активны, чем алканы.Хотя они сопротивляются гидролизу, они часто расщепляются кислотами, что приводит к образованию алкилгалогенида и спирта. Эфиры склонны к образованию пероксидов в присутствии кислорода или воздуха. Общая формула — R-O-O-R ’. Эфиры могут служить основаниями Льюиса и Бренстеда, отдавать электроны в реакциях или принимать протоны. Эфиры могут быть образованы в лаборатории путем дегидратации спиртов (2R-OH → ROR + H 2 O при высокой температуре), нуклеофильного замещения алкилгалогенидов алкоксидами (R-ONa + R’-X → RO-R ‘ + NaX) или электрофильное присоединение спиртов к алкенам (R 2 C = CR 2 + R-OH → R 2 CH-C (-OR) -R 2 ) .
Альдегиды и кетоны
Альдегиды и кетоны — это классы органических соединений, содержащие карбонильную (C = O) группу.
Цели обучения
Определить общие свойства кетонов и альдегидов
Основные выводы
Ключевые моменты
- Карбонильная функциональная группа представляет собой углерод, связанный двойной связью с кислородом. В зависимости от расположения карбонильной группы ее называют по-разному; кетоны содержат карбонил внутри соединения, а альдегиды содержат карбонил на конце органического соединения.
- Кетоны и альдегиды могут подвергаться кетоенольной таутомерии. Это относится к равновесию между двумя возможными таутомерами. Взаимопревращение двух форм включает движение протона и смещение связывающих электронов. Это равновесие дает соединениям большую реакционную способность.
- Кетоны и альдегиды участвуют во множестве реакций. Они могут подвергаться реакциям окисления, в которых они окисляются до соответствующих карбоновых кислот.

Ключевые термины
- таутомерия : форма изомерии, при которой существует динамическое равновесие между несколькими изомерами, например, между енолом и кетоном.
- окислить : Увеличить валентность (положительный заряд) элемента за счет удаления электронов.
- альдегид : органическое соединение, содержащее формильную группу, которая представляет собой функциональную группу со структурой R-CHO.
- sp2 : Гибридная орбиталь, которая образуется, когда для двойной связи требуется одна пи-связь, и только три σ-связи образуются на один атом углерода. Орбиталь 2s смешана только с двумя из трех орбиталей 2p.
- кетон : соединение, содержащее атом кислорода, соединенный с атомом углерода двойной связью.
В органической химии карбонильная группа — это функциональная группа, которая имеет углеродную двойную связь с атомом кислорода: C = O.
Кето-енольные таутомеры : Существует равновесие между кетонными и енольными формами, которое включает сдвиг двойной связи и движение протона.
Кетоны
Когда в молекулу помещается карбонильная функциональная группа, она называется кетоном. Кетоны представляют собой органические соединения со структурой RC (= O) R ’, где R и R’ могут быть различными углеродсодержащими заместителями.Правила номенклатуры ИЮПАК диктуют, что молекулы кетонов называются путем изменения суффикса родительской молекулы углерода на «-он». Если положение кетона должно быть указано, то число помещается между названием родительской цепи и префиксом «-one» (например, пропан-2-он) или в начале имени IUPAC. Приставки «оксо-» и «кето-» используются для описания функциональной группы кетона.
Кетон : Кетон — это тип органического соединения, в котором карбонильная группа связана с двумя другими атомами углерода в основной углеродной цепи.
Кетоновый углерод sp 2 гибридизирован, и он принимает тригональную плоскую геометрию вокруг кетонового углерода. Таким образом, валентные углы C – C – O и C – C – C составляют примерно 120 градусов. Из-за карбонильной группы кетоны полярны и способны взаимодействовать с другими соединениями через водородные связи; эта способность к водородным связям делает кетоны более растворимыми в воде, чем родственные метиленовые соединения. Кетоны обычно не являются донорами водородных связей и, как правило, не проявляют межмолекулярного притяжения с другими кетонами.В результате кетоны часто более летучие, чем спирты и карбоновые кислоты сравнимой молекулярной массы. Кетоны содержат альфа-водороды, которые участвуют в кето-енольной таутомерии. В присутствии сильного основания будет происходить образование енолята и последующее депротонирование енолята.
Таким образом, валентные углы C – C – O и C – C – C составляют примерно 120 градусов. Из-за карбонильной группы кетоны полярны и способны взаимодействовать с другими соединениями через водородные связи; эта способность к водородным связям делает кетоны более растворимыми в воде, чем родственные метиленовые соединения. Кетоны обычно не являются донорами водородных связей и, как правило, не проявляют межмолекулярного притяжения с другими кетонами.В результате кетоны часто более летучие, чем спирты и карбоновые кислоты сравнимой молекулярной массы. Кетоны содержат альфа-водороды, которые участвуют в кето-енольной таутомерии. В присутствии сильного основания будет происходить образование енолята и последующее депротонирование енолята.
Альдегиды
Альдегид : Альдегид характеризуется наличием карбонильной функциональной группы на конце углеродного скелета соединения.
Альдегид — это органическое соединение, которое содержит карбонильную группу с центральным углеродом, связанным с водородом и группой R (R-CHO). Альдегиды отличаются от кетонов тем, что карбонил расположен в конце углеродного скелета, а не между двумя атомами углерода в основной цепи. Подобно кетонам, альдегиды sp 2 гибридизированы и могут существовать в кето- или еноловом таутомере. Альдегиды называют, отбрасывая суффикс родительской молекулы и добавляя суффикс «-al». Например, трехуглеродная цепь с альдегидной группой на концевом атоме углерода будет пропаналом. Если в соединении есть функциональные группы более высокого порядка, можно использовать префикс «оксо-», чтобы указать, какой атом углерода является частью альдегидной группы.Если необходимо указать расположение альдегида, можно использовать число между родительской цепочкой и суффиксом или в начале имени соединения.
Альдегиды отличаются от кетонов тем, что карбонил расположен в конце углеродного скелета, а не между двумя атомами углерода в основной цепи. Подобно кетонам, альдегиды sp 2 гибридизированы и могут существовать в кето- или еноловом таутомере. Альдегиды называют, отбрасывая суффикс родительской молекулы и добавляя суффикс «-al». Например, трехуглеродная цепь с альдегидной группой на концевом атоме углерода будет пропаналом. Если в соединении есть функциональные группы более высокого порядка, можно использовать префикс «оксо-», чтобы указать, какой атом углерода является частью альдегидной группы.Если необходимо указать расположение альдегида, можно использовать число между родительской цепочкой и суффиксом или в начале имени соединения.
Сходства альдегидов и кетонов
Как альдегиды, так и кетоны находятся в равновесии со своими енольными формами; енольная форма определяется как алкен с гидроксильной группой, присоединенной к одному из атомов углерода, составляющих двойную связь. Кето-форма преобладает в равновесии для большинства кетонов. Однако енольная форма важна для некоторых реакций, поскольку депротонированная енолятная форма является сильным нуклеофилом.Равновесие сильно термодинамически обусловлено, и при комнатной температуре предпочтение отдается кето-форме. Взаимное превращение может катализироваться присутствием кислоты или основания.
Кето-форма преобладает в равновесии для большинства кетонов. Однако енольная форма важна для некоторых реакций, поскольку депротонированная енолятная форма является сильным нуклеофилом.Равновесие сильно термодинамически обусловлено, и при комнатной температуре предпочтение отдается кето-форме. Взаимное превращение может катализироваться присутствием кислоты или основания.
Кето-енольная таутомерия : Взаимопревращение двух форм может катализироваться кислотой или основанием.
Спектроскопия кетонов и альдегидов
Как кетоны, так и альдегиды можно идентифицировать спектроскопическими методами. Они демонстрируют сильные полосы поглощения CO около 1700 см -1 .В спектроскопии ЯМР карбонильный водород показывает сильный пик поглощения, и любое взаимодействие с протонами на альфа-углероде также будет показывать сильные сигналы.
Кетоны и альдегиды могут быть легко восстановлены до спиртов, обычно в присутствии сильного восстанавливающего агента, такого как боргидрид натрия. В присутствии сильных окислителей они могут окисляться до карбоновых кислот. Как электрофилы, они подвергаются атаке нуклеофилов, что означает, что они участвуют во многих реакциях нуклеофильного присоединения.
В присутствии сильных окислителей они могут окисляться до карбоновых кислот. Как электрофилы, они подвергаются атаке нуклеофилов, что означает, что они участвуют во многих реакциях нуклеофильного присоединения.
Карбоновые кислоты
Карбоновые кислоты — это органические кислоты, которые содержат атом углерода, который участвует как в гидроксильной, так и в карбонильной функциональной группе.
Цели обучения
Распознавать общие свойства карбоновых кислот
Основные выводы
Ключевые моменты
- Карбоновые кислоты используются в качестве предшественников для образования других соединений, таких как сложные эфиры, альдегиды и кетоны.
- Карбоновые кислоты могут образовывать водородные связи сами с собой, особенно в неполярных растворителях; это приводит к усилению стабилизации соединений и повышению их точек кипения.
- Поскольку они содержат как гидроксильные, так и карбонильные функциональные группы, карбоновые кислоты участвуют в образовании водородных связей как акцепторы водорода и как доноры водорода.
Ключевые термины
- нитрил : любой из класса органических соединений, содержащих цианофункциональную группу (-C≡N).
- олефин : любой из класса ненасыщенных углеводородов с открытой цепью, таких как этилен; алкен только с одной двойной связью углерод-углерод.
- сложный эфир : соединение, чаще всего образующееся при конденсации спирта и кислоты с удалением воды.Он содержит функциональную группу C = O, присоединенную через углерод к другому атому кислорода.
Карбоксильная группа (COOH) представляет собой функциональную группу, состоящую из карбонильной группы (C = O) с гидроксильной группой (O-H), присоединенной к тому же атому углерода. Карбоксильные группы имеют формулу -C (= O) OH, обычно обозначаемую как -COOH или CO 2 H. Карбоновые кислоты — это класс молекул, которые характеризуются наличием одной карбоксильной группы. В качестве доноров протонов карбоновые кислоты характеризуются как кислоты Бренстеда-Лоури. Кислоты с двумя или более карбоксильными группами называются дикарбоновыми, трикарбоновыми и т. Д. Соли и сложные эфиры карбоновых кислот называются карбоксилатами. Карбоксилат-ионы стабилизированы резонансом. Эта повышенная стабильность приводит к повышенной кислотности по сравнению со спиртами. Обычно в номенклатуре ИЮПАК карбоновые кислоты имеют суффикс «-ойная кислота», хотя суффикс «-иновая кислота» является наиболее часто используемым.
Кислоты с двумя или более карбоксильными группами называются дикарбоновыми, трикарбоновыми и т. Д. Соли и сложные эфиры карбоновых кислот называются карбоксилатами. Карбоксилат-ионы стабилизированы резонансом. Эта повышенная стабильность приводит к повышенной кислотности по сравнению со спиртами. Обычно в номенклатуре ИЮПАК карбоновые кислоты имеют суффикс «-ойная кислота», хотя суффикс «-иновая кислота» является наиболее часто используемым.
Карбоновая кислота : Карбоновые кислоты — это органические оксикислоты, характеризующиеся наличием по крайней мере одной карбоксильной группы, которая имеет формулу -C (= O) OH, обычно обозначаемую как -COOH или -CO2H.
Физические свойства карбоновых кислот
Карбоновые кислоты действуют как акцепторы водородных связей за счет карбонильной группы, так и как доноры водородных связей за счет гидроксильной группы. В результате они часто участвуют в водородных связях. Карбоновые кислоты обычно существуют в виде димерных пар в неполярных средах из-за их тенденции к «самоассоциации». Эта склонность к образованию водородных связей придает им повышенную стабильность, а также более высокие температуры кипения по сравнению с кислотой в водном растворе.Карбоновые кислоты — полярные молекулы; они, как правило, растворимы в воде, но по мере удлинения алкильной цепи их растворимость уменьшается из-за возрастающей гидрофобной природы углеродной цепи. Карбоновые кислоты характеризуются как слабые кислоты, что означает, что они не полностью диссоциируют с образованием катионов H + в нейтральном водном растворе.
Эта склонность к образованию водородных связей придает им повышенную стабильность, а также более высокие температуры кипения по сравнению с кислотой в водном растворе.Карбоновые кислоты — полярные молекулы; они, как правило, растворимы в воде, но по мере удлинения алкильной цепи их растворимость уменьшается из-за возрастающей гидрофобной природы углеродной цепи. Карбоновые кислоты характеризуются как слабые кислоты, что означает, что они не полностью диссоциируют с образованием катионов H + в нейтральном водном растворе.
Водородная связь между карбоновыми кислотами : Водородные связи карбоновых кислот между собой, придавая им повышенный уровень стабильности.
Спектроскопия карбоновых кислот
Карбоновые кислоты можно охарактеризовать с помощью ИК-спектроскопии; они демонстрируют резкую полосу, связанную с колебанием связи C-O между 1680 и 1725 см -1 . Кроме того, появляется широкий пик в области 2500–3000 см –1 . По данным спектроскопии ЯМР 1 H гидроксильный водород появляется в области 10–13 м.д., хотя часто он либо расширен, либо не наблюдается из-за обмена со следами воды.
По данным спектроскопии ЯМР 1 H гидроксильный водород появляется в области 10–13 м.д., хотя часто он либо расширен, либо не наблюдается из-за обмена со следами воды.
Применение и реакционная способность карбоновых кислот
Карбоновые кислоты используются в производстве полимеров, фармацевтических препаратов, растворителей и пищевых добавок.Как таковые, они часто производятся в промышленных масштабах. Карбоновые кислоты обычно получают окислением альдегидов и углеводородов и катализируемым основанием дегидрированием спиртов. Их можно производить в лаборатории для небольших реакций путем окисления первичных спиртов или альдегидов, окислительного расщепления олефинов и путем гидролиза нитрилов, сложных эфиров или амидов.
Карбоновые кислоты широко используются в качестве прекурсоров для получения других соединений. Под воздействием основания карбоновая кислота депротонируется и образует карбоксилатную соль.Они также реагируют со спиртами с образованием сложных эфиров и могут вступать в реакции восстановления путем гидрирования или использования восстанавливающих агентов.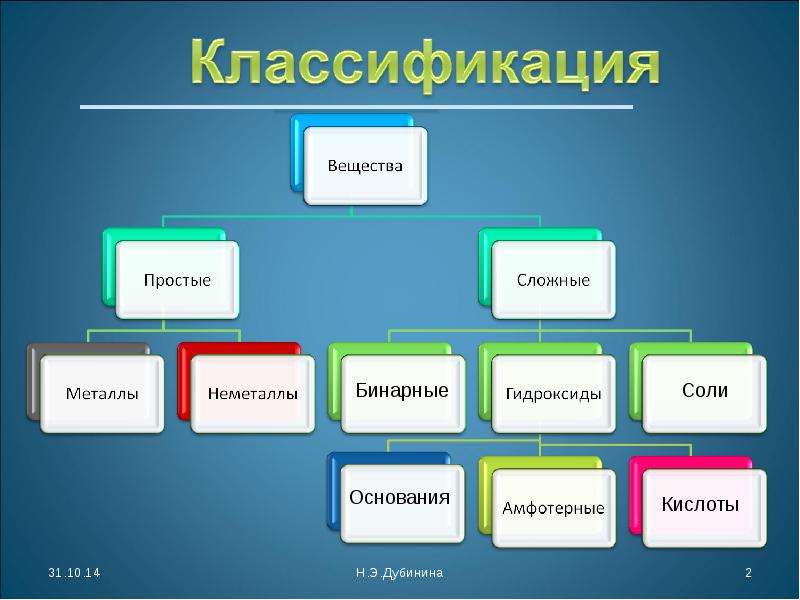 Также существуют различные специализированные реакции, в которых участвуют карбоновые кислоты, которые приводят к образованию аминов, альдегидов и кетонов.
Также существуют различные специализированные реакции, в которых участвуют карбоновые кислоты, которые приводят к образованию аминов, альдегидов и кетонов.
Сложные эфиры
Сложные эфиры представляют собой функциональные группы, полученные конденсацией спирта с карбоновой кислотой, и названы на основе этих компонентов.
Цели обучения
Определите общие свойства сложноэфирной функциональной группы
Основные выводы
Ключевые моменты
- Сложные эфиры — это функциональная группа, обычно встречающаяся в органической химии.Они характеризуются углеродом, связанным с тремя другими атомами: одинарной связью с углеродом, двойной связью с кислородом и одинарной связью с кислородом. Односвязанный кислород связан с другим углеродом.
- Названия сложных эфиров образованы от исходного спирта и исходной кислоты. Хотя простые эфиры часто называют своими общими названиями, все сложные эфиры могут быть названы с использованием систематического названия ИЮПАК, основанного на названии кислоты, за которым следует суффикс «-оате».

- Сложные эфиры реагируют с нуклеофилами у карбонильного углерода.Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов. Связи C-H, прилегающие к карбонилу, слабо кислые, но подвергаются депротонированию сильными основаниями.
Ключевые термины
- карбоновая кислота : Любой из класса органических соединений, содержащих карбоксильную функциональную группу — углерод с одной двойной связью с кислородом и одинарной связью с другим кислородом, который, в свою очередь, связан с водородом.
- спирт : Класс органических соединений, содержащих гидроксильную функциональную группу.
- нуклеофил : соединение или функциональная группа, которая притягивает центры положительного заряда и отдает электроны; жертвует электронную пару электрофилу для образования связи.
Сложные эфиры являются важной функциональной группой в органической химии, и их обычно обозначают как RCOOR ’или RCO 2 R’.
Сложные эфиры : Сложный эфир характеризуется ориентацией и связью показанных атомов, где R и R ’оба представляют собой инициированные углеродом цепи различной длины, также известные как алкильные группы.
Как обычно, R и R ’обе представляют собой алкильные группы или группы, начинающиеся с углерода. Сложные эфиры являются производными карбоновых кислот, в которых гидроксильная (ОН) группа заменена алкоксильной (O-R) группой. Обычно их синтезируют путем конденсации карбоновой кислоты со спиртом:
[латекс] \ text {RCO} _2 \ text {H} + \ text {R} ‘\ text {OH} \ rightarrow \ text {RCO} _2 \ text {R}’ + \ text {H} _2 \ text {O} [/ латекс]
Сложные эфиры встречаются повсеместно. Большинство встречающихся в природе жиров и масел представляют собой сложные эфиры жирных кислот и глицерина.Сложные эфиры обычно ароматные, а эфиры с достаточно низкой молекулярной массой, чтобы быть летучими, обычно используются в качестве отдушек и содержатся в эфирных маслах и феромонах.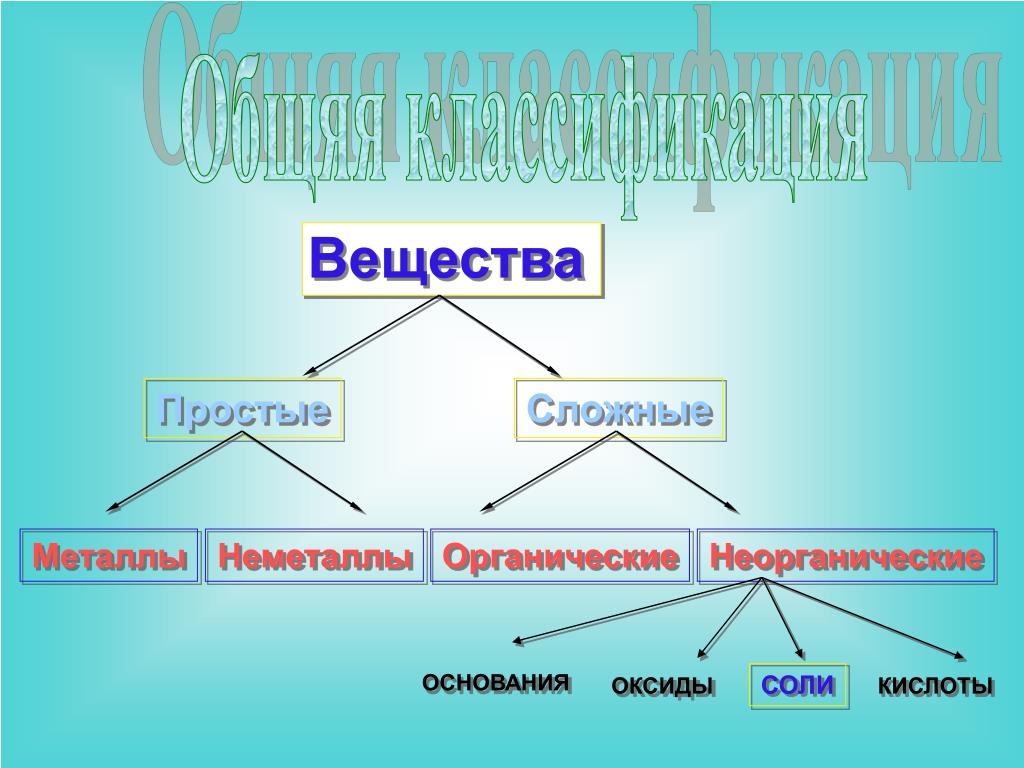 Полимеризованные сложные эфиры или полиэфиры являются важными пластиками, мономеры которых связаны сложноэфирными звеньями, например:
Полимеризованные сложные эфиры или полиэфиры являются важными пластиками, мономеры которых связаны сложноэфирными звеньями, например:
CO 2 RCO 2 RCO 2 R… и т. Д.
Номенклатура
Слово «сложный эфир» было придумано в 1848 году немецким химиком Леопольдом Гмелином, вероятно, как сокращение от немецкого Essigäther , означающего уксусный эфир.
Названия сложных эфиров образованы от исходного спирта и кислоты. Например, сложный эфир, образованный этанолом и этановой кислотой, известен как этилэтаноат; «Этанол» восстанавливается до «этил», а «этановая кислота» восстанавливается до «этаноата». Другие примеры названий сложных эфиров включают метилпропаноат из метанола и пропановой кислоты и бутилоктаноат из бутана и октановой кислоты.
Этилэтаноат : Название этилэтаноат происходит от компонентов, из которых он синтезируется: этанола и этановой кислоты.На этой диаграмме красная часть молекулы представляет собой часть, ранее относившуюся к этанолу (минус H), а зеленая часть молекулы представляет часть этановой кислоты (минус OH). Этерификация — это форма дегидратационного синтеза, поэтому компоненты H и OH удаляются в виде воды.
Этерификация — это форма дегидратационного синтеза, поэтому компоненты H и OH удаляются в виде воды.
В случае сложных эфиров, образованных из обычных карбоновых кислот, иногда используются более разговорные термины. Например, этановая кислота более широко известна как уксусная кислота, и поэтому ее сложные эфиры содержат в своих названиях «ацетат» вместо «этаноат».Другие такие замены включают «формиат» вместо «метаноат», «пропионат» вместо «пропаноат» и «бутират» вместо «бутаноат».
Химические формулы органических сложных эфиров обычно записываются в формате RCO 2 R ’, где R и R’ представляют собой углеводородные части карбоновой кислоты и спирта, соответственно. Например, бутилацетат, систематически известный как этановая кислота, является производным бутанола и уксусной кислоты и обозначается как CH 3 CO 2 C 4 H 9 .Обычны альтернативные представления, включая BuOAc и CH 3 COOC 4 H 9 . Циклические сложные эфиры известны как лактоны.
Циклические сложные эфиры известны как лактоны.
Конструкция и склеивание
Сложные эфиры содержат карбонильный центр, который дает валентные углы C-C-O и O-C-O 120 градусов из-за sp 2 гибридизации. В отличие от амидов, сложные эфиры представляют собой структурно гибкие функциональные группы, поскольку вращение вокруг связей C-O-C имеет более низкий энергетический барьер. Их гибкость и низкая полярность влияют на их физические свойства в макроскопическом масштабе; они имеют тенденцию быть менее жесткими, что приводит к более низкой температуре плавления, и более летучими, что приводит к более низкой температуре кипения, чем соответствующие амиды.PK a альфа-атомов водорода или атомов водорода, присоединенных к атому углерода, примыкающему к карбонилу, в сложных эфирах составляет около 25, что делает их по существу некислотными, за исключением присутствия очень сильных оснований.
Физические свойства и характеристики
Сложные эфиры более полярны, чем простые эфиры, но менее полярны, чем спирты.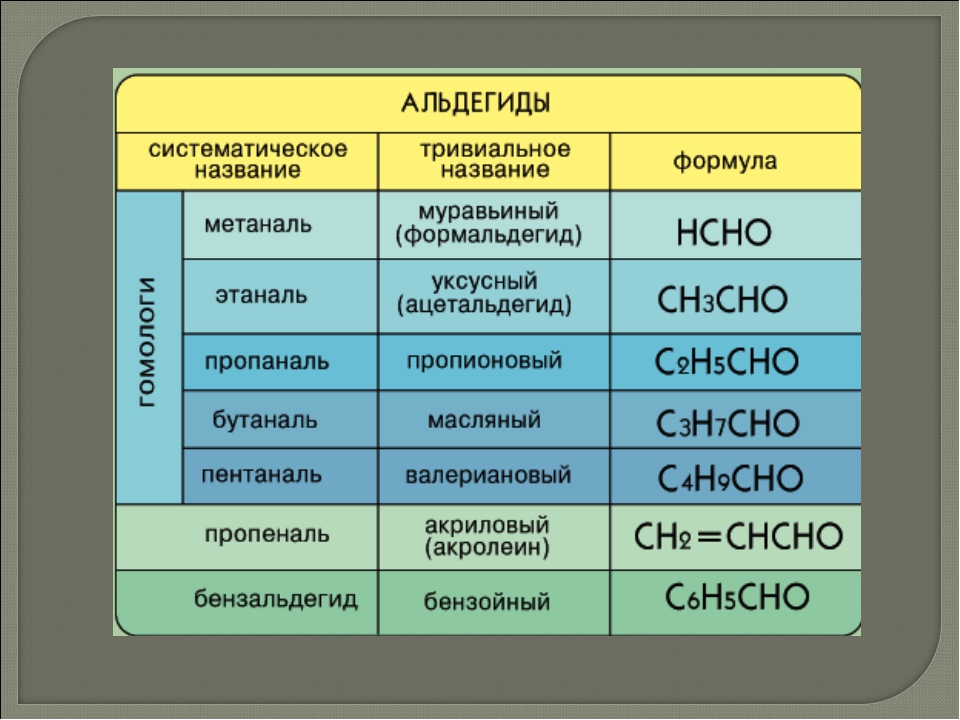 Они участвуют в водородных связях как акцепторы водородных связей, но не могут действовать как доноры водородных связей, в отличие от их родительских спиртов и карбоновых кислот.Эта способность участвовать в образовании водородных связей придает некоторую растворимость в воде в зависимости от длины присоединенных алкильных цепей. Поскольку в них нет атомов водорода, связанных с атомами кислорода, в отличие от спиртов и карбоновых кислот, сложные эфиры не связываются самостоятельно. Следовательно, сложные эфиры более летучие, чем карбоновые кислоты аналогичной молекулярной массы.
Они участвуют в водородных связях как акцепторы водородных связей, но не могут действовать как доноры водородных связей, в отличие от их родительских спиртов и карбоновых кислот.Эта способность участвовать в образовании водородных связей придает некоторую растворимость в воде в зависимости от длины присоединенных алкильных цепей. Поскольку в них нет атомов водорода, связанных с атомами кислорода, в отличие от спиртов и карбоновых кислот, сложные эфиры не связываются самостоятельно. Следовательно, сложные эфиры более летучие, чем карбоновые кислоты аналогичной молекулярной массы.
Характеристики и анализ
Сложные эфиры обычно идентифицируются с помощью газовой хроматографии с учетом их летучести. В ИК (инфракрасном) спектрах сложных эфиров наблюдается интенсивная резкая полоса в диапазоне 1730–1750 см –1 , приписываемая νC = O, или колебанию связи C = O.Этот пик изменяется в зависимости от функциональных групп, присоединенных к карбонилу. Например, бензольное кольцо или двойная связь в сочетании с карбонилом уменьшит волновое число примерно до 30 см -1 .
Реакционная способность
Сложные эфиры реагируют с нуклеофилами у карбонильного углерода. Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов, таких как амины, алкоксиды, источники гидридов и литийорганические соединения. Электрофильность карбонила может увеличиваться, если он протонирован; в кислой среде сложный эфир может гидролизоваться водой с образованием карбоновой кислоты и спирта.
Связи C-H, прилегающие к карбонилу, слабо кислые, но подвергаются депротонированию с помощью сильных оснований. Этот процесс обычно инициирует реакции конденсации. Карбонильный кислород слабоосновен (меньше, чем в амидах), но может образовывать аддукты с кислотами Льюиса.
Амины
Амины — это соединения, характеризующиеся наличием атома азота, неподеленной пары электронов и трех заместителей.
Цели обучения
Определите общие свойства аминов
Основные выводы
Ключевые моменты
- Из-за неподеленной пары электронов амины являются основными соединениями.
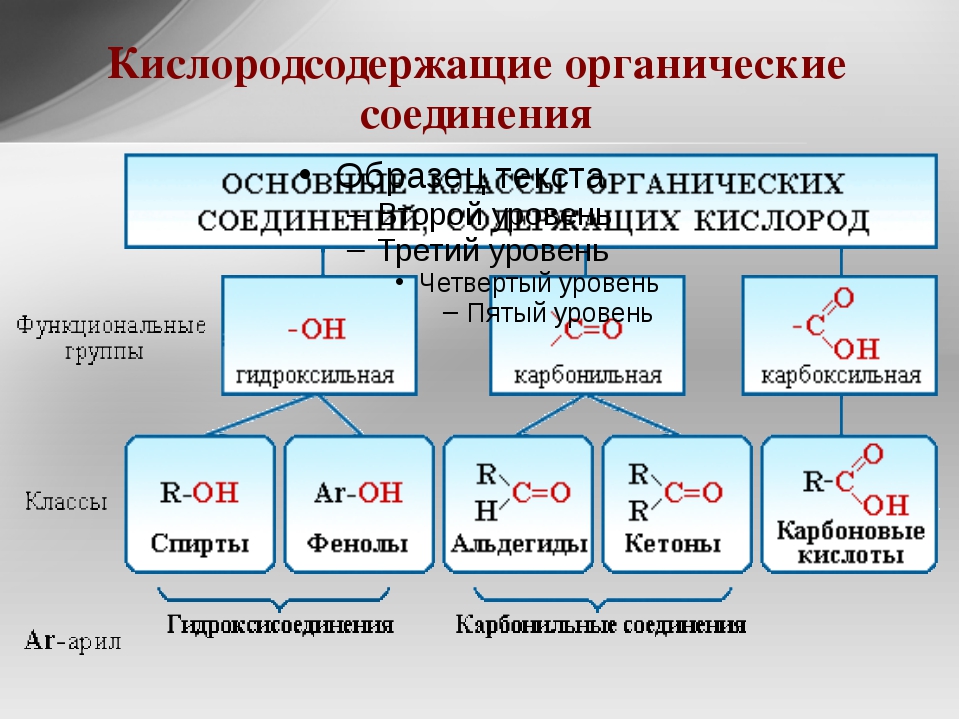 На основность соединения могут влиять соседние атомы, стерический объем и растворимость соответствующего катиона, который должен быть образован.
На основность соединения могут влиять соседние атомы, стерический объем и растворимость соответствующего катиона, который должен быть образован. - Аминовые соединения могут образовывать водородную связь, что обеспечивает им растворимость в воде и повышенных температурах кипения.
- Общая структура амина — атом азота с неподеленной парой электронов и тремя заместителями. Однако азот может связываться с четырьмя заместителями, оставляя положительный заряд на атоме азота. Эти заряженные частицы могут служить промежуточными продуктами для важных реакций.
Ключевые термины
- алифатических : из класса органических соединений, в которых атомы углерода расположены в разомкнутой цепи.
- хиральный : Буквально «рука»; относится к соединению, в котором центральные атомы связаны с несколькими различными заместителями, так что зеркальное отображение соединения не идентично исходному.
- амин : Органические соединения или функциональная группа, содержащая основной атом азота с неподеленной парой.

- инверсия : для вторичного или третичного амина, связанного с тремя разными заместителями, переворот трех связей вокруг центрального атома азота, приводящий к противоположному стереоизомеру.
Функциональная группа амина содержит основной атом азота с неподеленной парой электронов. По существу, группа является производной аммиака, в которой один или несколько атомов водорода заменены углеродсодержащим заместителем. Соединения с группой азота, присоединенной к карбонилу в структуре, называются амидами, и они имеют структуру R-CO-NR’R ».Аминные группы, связанные с ароматической (сопряженной циклической) структурой, известны как ароматические амины. Ароматическая структура эффективно снижает щелочность амина, в то время как присутствие аминогруппы значительно снижает реакционную способность кольца из-за эффекта донорства электронов. Префикс «амино-» или суффикс «-амин» используется при названии аминового соединения. Органическое соединение с несколькими аминогруппами называется диамин, триамин, тетрамин и т. Д.
Д.
Структура амина
Амины обычно делятся на категории в зависимости от среды их связывания.Амины, в которых один из трех атомов водорода замещен алкильным или ароматическим заместителем, называются первичными аминами. Вторичные амины — это амины, которые имеют два заместителя и один водород, связанный с азотом. Третичные амины — это амины, атомы водорода которых полностью заменены органическими заместителями. Наконец, циклические амины — это такие амины, в которых азот включен в кольцевую структуру, что фактически делает его вторичным или третичным амином. Общая структура амина содержит атом азота, неподеленную пару электронов и три заместителя.Однако возможно наличие четырех органических заместителей у азота, что делает его катионом аммония с заряженным азотным центром.
Третичный амин : Центральный углерод присоединен к аминогруппе и трем другим атомам углерода.
Физические свойства аминов
Амины способны образовывать водородную связь. В результате точки кипения этих соединений выше, чем у соответствующих фосфинов, но ниже, чем у соответствующих спиртов, которые имеют более сильную водородную связь.Амины также обладают некоторой растворимостью в воде. Однако растворимость уменьшается с увеличением количества атомов углерода из-за увеличения гидрофобности соединения по мере увеличения длины цепи. Алифатические амины, которые представляют собой амины, связанные с алкильной цепью, проявляют растворимость в органических полярных растворителях. Ароматические амины, которые представляют собой амины, которые участвуют в сопряженном кольце, отдают свою неподеленную пару электронов бензольному кольцу, и, таким образом, их способность участвовать в водородных связях уменьшается.Это приводит к снижению их растворимости в воде и высокой температуре кипения.
В результате точки кипения этих соединений выше, чем у соответствующих фосфинов, но ниже, чем у соответствующих спиртов, которые имеют более сильную водородную связь.Амины также обладают некоторой растворимостью в воде. Однако растворимость уменьшается с увеличением количества атомов углерода из-за увеличения гидрофобности соединения по мере увеличения длины цепи. Алифатические амины, которые представляют собой амины, связанные с алкильной цепью, проявляют растворимость в органических полярных растворителях. Ароматические амины, которые представляют собой амины, которые участвуют в сопряженном кольце, отдают свою неподеленную пару электронов бензольному кольцу, и, таким образом, их способность участвовать в водородных связях уменьшается.Это приводит к снижению их растворимости в воде и высокой температуре кипения.
Кислотность и щелочность аминов
Амины типа NHRR ’и NR’R’ R ”’ являются хиральными молекулами и могут подвергаться инверсии. Поскольку барьер для инверсии достаточно низкий (~ 7 ккал / моль), эти соединения не могут быть разделены оптически. Амины являются основаниями, и их основность зависит от электронных свойств заместителей (алкильные группы усиливают основность; арильные группы уменьшают ее), стерических затруднений и степени сольватации протонированного амина.В общем, действие алкильных групп увеличивает энергию неподеленной пары электронов, тем самым повышая основность. Таким образом, можно ожидать, что основность амина будет увеличиваться с увеличением числа алкильных групп в амине. Кроме того, действие ароматического кольца делокализует неподеленную пару электронов на азоте в кольцо, что приводит к снижению основности. Сольватация протонированных аминов изменяется при их превращении в соединения аммония. Обычно соли соединений аммония проявляют следующий порядок растворимости в воде: первичный аммоний (RNH 3 + )> вторичный аммоний (R 2 NH 2 + )> третичный аммоний (R 3 NH + ).Соли четвертичного аммония обычно демонстрируют самую низкую растворимость из ряда.
Амины являются основаниями, и их основность зависит от электронных свойств заместителей (алкильные группы усиливают основность; арильные группы уменьшают ее), стерических затруднений и степени сольватации протонированного амина.В общем, действие алкильных групп увеличивает энергию неподеленной пары электронов, тем самым повышая основность. Таким образом, можно ожидать, что основность амина будет увеличиваться с увеличением числа алкильных групп в амине. Кроме того, действие ароматического кольца делокализует неподеленную пару электронов на азоте в кольцо, что приводит к снижению основности. Сольватация протонированных аминов изменяется при их превращении в соединения аммония. Обычно соли соединений аммония проявляют следующий порядок растворимости в воде: первичный аммоний (RNH 3 + )> вторичный аммоний (R 2 NH 2 + )> третичный аммоний (R 3 NH + ).Соли четвертичного аммония обычно демонстрируют самую низкую растворимость из ряда.
Получение амина и реакционная способность
Образование имина : первичный амин реагирует с альдегидом с образованием имина.
В промышленности амины получают из аммиака путем алкилирования спиртами. Их также можно получить восстановлением нитрилов до аминов с использованием водорода в присутствии никелевого катализатора. Амины довольно реактивны благодаря своей основности, а также своей нуклеофильности.Большинство первичных аминов являются хорошими лигандами и реагируют с ионами металлов с образованием координационных комплексов. Одной из наиболее важных реакций аминов является их образование иминов или органических соединений, в которых азот участвует в двойной связи, при взаимодействии с кетонами или альдегидами.
Применение аминов
Амины повсеместно встречаются в биологии. Многие важные молекулы основаны на аминах, например, нейротрансмиттеры и аминокислоты. Их применение в мире включает в себя использование в качестве исходного материала для красителей и моделей для создания лекарств.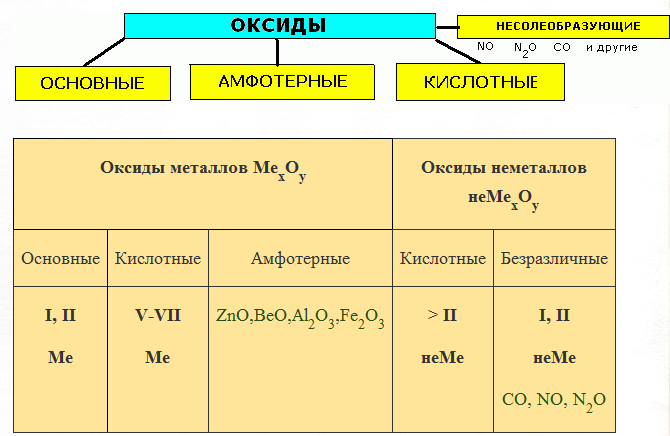 Они также используются для обработки газа, например, для удаления CO 2 из дымовых газов.
Они также используются для обработки газа, например, для удаления CO 2 из дымовых газов.
24.1: Функциональные группы и классы органических соединений
Цели обучения
- Знать основные классы органических соединений и определять важные функциональные группы.
Ранее вы познакомились с несколькими структурными единицами, которые химики используют для классификации органических соединений и прогнозирования их реакционной способности. Эти функциональные группы, которые определяют химическую реакционную способность молекулы при заданном наборе условий, могут состоять из одного атома (например, Cl) или группы атомов (например, CO 2 H).Основные семейства органических соединений характеризуются своими функциональными группами. Рисунок \ (\ PageIndex {1} \) суммирует пять семейств, представленных в предыдущих главах, дает примеры соединений, которые содержат каждую функциональную группу, и перечисляет суффикс или префикс, используемый в систематической номенклатуре соединений, содержащих каждую функциональную группу.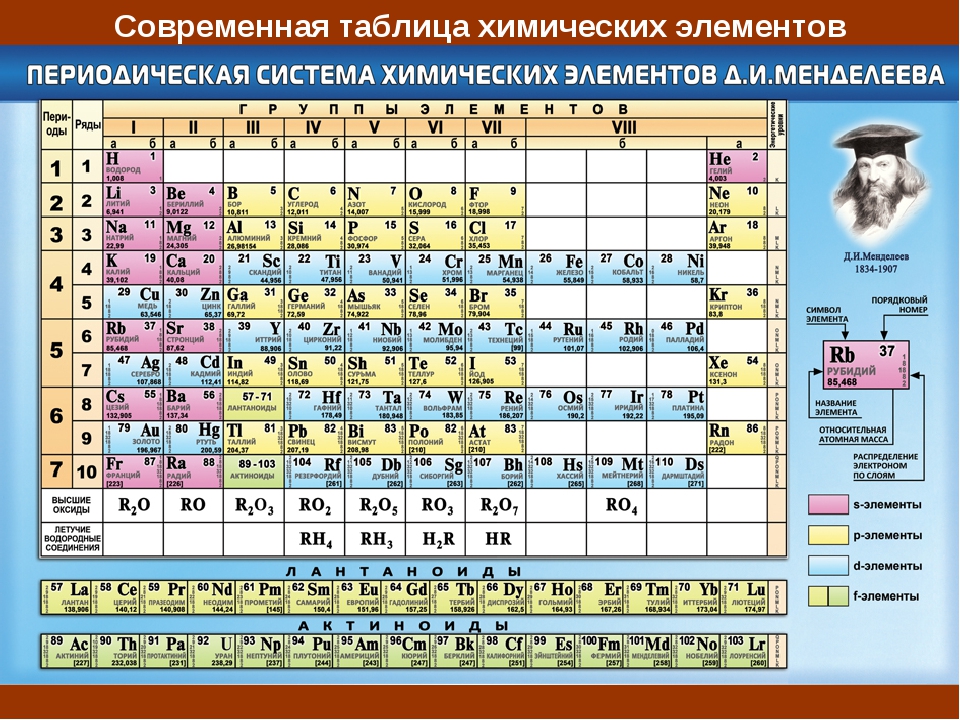
Рисунок \ (\ PageIndex {1} \): основные классы органических соединений
Первое семейство, указанное на рисунке \ (\ PageIndex {1} \), — это углеводороды.К ним относятся алканы с общей молекулярной формулой C n H 2n +2 , где n — целое число; алкены, представленные C n H 2n ; алкины, представленные C n H 2n-2 ; и арены. Галогензамещенные алканы, алкены и арены образуют второе основное семейство органических соединений, которое включает алкилгалогениды и арилгалогениды. Кислородсодержащие органические соединения, третье семейство, можно разделить на два основных типа: те, которые содержат по крайней мере одну связь C – O, которые включают спирты, фенолы (производные бензола) и простые эфиры, и те, которые содержат карбонильную группу. (C = O), которые включают альдегиды, кетоны и карбоновые кислоты.Производные карбоновых кислот, четвертое перечисленное семейство, представляют собой соединения, в которых ОН функциональной группы –CO 2 H заменен либо на алкоксигруппу (–OR) с образованием сложного эфира, либо на амидо (–NRR ‘, где R и R ‘могут быть H и / или алкильными группами), образуя амид.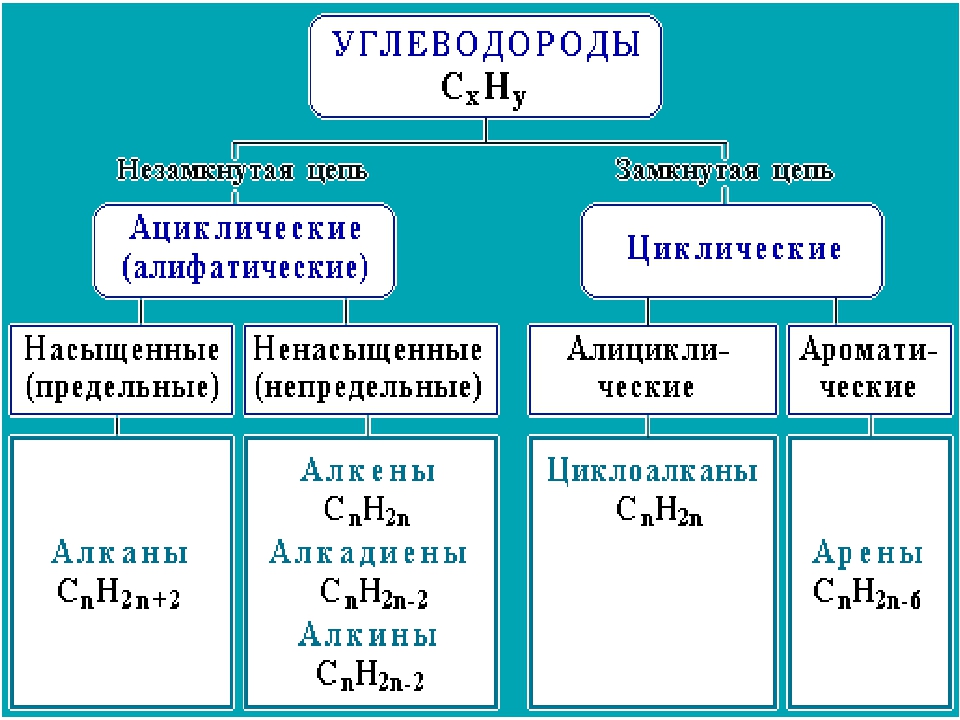 Пятое семейство азотсодержащих органических соединений включает амины; нитрилы, которые имеют связь C≡N; нитросоединения, содержащие группу –NO 2 .
Пятое семейство азотсодержащих органических соединений включает амины; нитрилы, которые имеют связь C≡N; нитросоединения, содержащие группу –NO 2 .
Систематическая номенклатура органических соединений указывает положения заместителей с использованием наименьших цифр, возможных для идентификации их положений в углеродной цепи исходного соединения.Если два соединения имеют одинаковое систематическое название, то это одно и то же соединение. Хотя систематические названия предпочтительнее, потому что они недвусмысленны, многие органические соединения известны под своими общими названиями, а не систематическими названиями. В общей номенклатуре используется префиксная форма — для соединения, которое не содержит атомов углерода, кроме атомов в функциональной группе, и ацет — для тех, которые имеют один дополнительный атом углерода [два в случае ацетона, (CH 3 ) 2 C = O]. Таким образом, метаналь и этаналь, соответственно, являются систематическими названиями формальдегида и ацетальдегида.
Напомним, что в систематической номенклатуре ароматических соединений положения групп, присоединенных к ароматическому кольцу, обозначены числами, начиная с 1 и продолжаясь по кольцу в направлении, дающем наименьшие возможные числа. Например, положение первой группы CH 3 в диметилбензоле обозначено цифрой 1, но вторая группа CH 3 , которая может быть помещена в любое из трех положений, дает 1,2-диметилбензол, 1 , 3-диметилбензол или 1,4-диметилбензол (Рисунок \ (\ PageIndex {2} \)).Напротив, в общей номенклатуре префиксы орто-, мета- и пара- используются для описания относительного положения групп, присоединенных к ароматическому кольцу. Если группы CH 3 в диметилбензоле, обычное название которого — ксилол, соседствуют друг с другом, это соединение обычно называют орто-ксилолом, сокращенно о-ксилолом. Если они расположены напротив друг друга на кольце, соединение обычно называют пара-ксилолом или п-ксилолом. Когда расположение является промежуточным между орто- и пара-соединениями, название — мета-ксилол или м-ксилол.
Рисунок \ (\ PageIndex {2} \): Общая номенклатура для замен ароматических колец
Мы начинаем обсуждение структуры и реакционной способности органических соединений с изучения структурных вариаций простых насыщенных углеводородов, известных как алканы. Эти соединения служат каркасом, к которому наиболее часто присоединяются различные функциональные группы.
Сводка
Функциональные группы определяют химическую реакционную способность органической молекулы.Функциональные группы — это структурные единицы, которые определяют химическую реакционную способность молекулы при заданном наборе условий. Органические соединения подразделяются на несколько основных категорий в зависимости от содержащихся в них функциональных групп. В систематических названиях органических соединений числа указывают положения функциональных групп в основной углеводородной структуре. Многие органические соединения также имеют общие названия, в которых используется префиксная форма — для соединения, которое не содержит углеродов, кроме атомов углерода в функциональной группе и ацетате, — для тех, которые имеют один дополнительный атом углерода.
Концептуальные проблемы
- Могут ли два вещества иметь одно и то же систематическое название и быть разными соединениями?
- Считается ли кратная связь углерод-углерод функциональной группой?
4.4: Функциональные группы — Chemistry LibreTexts
Результаты обучения
- Опишите важность и назначение функциональных групп в органических реакциях.
- Идентифицируйте и назовите функциональные группы в соединениях.
При существовании более двадцати миллионов известных органических соединений было бы очень сложно запомнить химические реакции для каждого из них. К счастью, молекулы со сходными функциональными группами имеют тенденцию вступать в сходные реакции. Функциональная группа определяется как атом или группа атомов в молекуле, которая имеет аналогичные химические свойства всякий раз, когда она появляется в различных соединениях. Даже если другие части молекулы совершенно разные, определенные функциональные группы имеют тенденцию реагировать определенным образом.
Мы уже рассмотрели алканы, но они, как правило, не реагируют. В первую очередь мы используем алканы в качестве источника энергии при их сжигании. В то время как большинство функциональных групп включают в себя атомы, отличные от углерода и водорода, мы также рассмотрим некоторые из них, которые включают только углерод и водород. Некоторые из наиболее распространенных функциональных групп представлены в следующих разделах.
Органические молекулы сильно различаются по размеру, и, сосредотачиваясь на функциональных группах, мы хотим направить наше внимание на атомы, входящие в функциональную группу.В результате в некоторых примерах используется сокращение R. Буква R используется в молекулярных структурах для обозначения « R est молекулы». Он состоит из группы атомов углерода и водорода любого размера. Он используется как сокращение, поскольку группа атомов углерода и водорода не влияет на функциональность соединения. В некоторых молекулах вы увидите R, R ’или R’ ’, что указывает на то, что группы R в молекуле могут отличаться друг от друга. Например, R может быть –CH 2 CH 3 , а R ’- –CH 2 CH 2 CH 2 CH 3 .
Например, R может быть –CH 2 CH 3 , а R ’- –CH 2 CH 2 CH 2 CH 3 .
Алкены и алкины
Алкены — это углеводороды, которые содержат одну или несколько двойных связей между соседними атомами углерода. Алкины содержат одну или несколько тройных связей между соседними атомами углерода. Наличие двойной или тройной связи приводит к реакционной способности, отсутствующей в алканах, и алкины (см. Рисунок ниже) претерпевают характерные реакции, которые будут рассмотрены позже.
Рисунок \ (\ PageIndex {1} \): Алкены (слева) содержат одну или несколько двойных связей, а алкины (справа) содержат одну или несколько тройных связей.
Ароматические углеводороды
Дополнительная функциональная группа, содержащая только углерод и водород, представляет собой ароматическое кольцо, представляющее собой шестикарбонатное кольцо с альтернативными двойными связями. Ароматическое кольцо также показано в виде кольца с кружком в середине, представляющим двойные связи. Ароматические кольца (см. Рисунок ниже) содержатся во многих соединениях, включая стероиды и лекарства.
Ароматические кольца (см. Рисунок ниже) содержатся во многих соединениях, включая стероиды и лекарства.
Рисунок \ (\ PageIndex {2} \): ароматические кольца содержат чередующиеся двойные связи.
Спирты
Функциональная группа спирта включает атом кислорода, который связан с одним атомом водорода и одним атомом углерода.Атом углерода будет частью более крупной органической структуры. Один из способов обозначить общий алкоголь — использовать формулу \ (\ ce {R-OH} \). \ (\ ce {R} \) представляет собой любой органический фрагмент, в котором атом углерода непосредственно связан с явно указанной функциональной группой (в данном случае \ (\ ce {OH} \)). Группа \ (\ ce {R} \) обычно представляет собой цепочку атомов углерода.
Рисунок \ (\ PageIndex {3} \): Первичные, вторичные и третичные спирты.
Спирты можно разделить на первичные, вторичные или третичные в зависимости от характеристик углерода, к которому они присоединены.В первичном спирте углерод, связанный непосредственно с атомом кислорода, также связан ровно с одним атомом углерода, а другие связи обычно идут с атомами водорода. Во вторичном спирте углерод связан с двумя другими атомами углерода, а в третичном спирте углерод связан с тремя другими атомами углерода. Тип используемого алкоголя определяет продукт определенных реакций. Обратите внимание на названия спиртов, как показано на рисунке выше. Расположение группы \ (\ ce {-OH} \) указывается номером атома углерода, к которому она присоединена.
Во вторичном спирте углерод связан с двумя другими атомами углерода, а в третичном спирте углерод связан с тремя другими атомами углерода. Тип используемого алкоголя определяет продукт определенных реакций. Обратите внимание на названия спиртов, как показано на рисунке выше. Расположение группы \ (\ ce {-OH} \) указывается номером атома углерода, к которому она присоединена.
Мы уже знакомы с несколькими распространенными спиртами. Например, этанол \ (\ left (\ ce {CH_3CH_2OH} \ right) \) — это алкоголь, присутствующий в алкогольных напитках. Он также широко используется в промышленном производстве других химикатов. Метанол \ (\ left (\ ce {CH_3OH} \ right) \) используется как присадка к бензину или альтернатива. Кроме того, метанол можно использовать для производства формальдегида, который используется в производстве пластмасс, красок и других полезных веществ. Изопропанол широко известен как медицинский спирт.Помимо промышленного использования изопропанол используется для очистки различных поверхностей, включая компьютерные мониторы, доски и даже кожу (например, перед взятием крови).
эфиров
Функциональная группа эфира состоит из атома кислорода, который образует одинарные связи с двумя атомами углерода.
Рисунок \ (\ PageIndex {4} \): Эфиры
Эфиры являются хорошими растворителями для других органических соединений из-за их низкой реакционной способности. Они легко растворяют неполярные молекулы.Диэтиловый эфир, пожалуй, самый известный эфир. Он широко используется как растворитель и как ингаляционный анестетик.
Хотя сами эфиры относительно инертны, они могут превращаться в пероксиды после длительного воздействия кислорода. Пероксиды очень реактивны и часто взрывоопасны при повышенных температурах. Многие коммерчески доступные эфиры содержат небольшое количество поглотителя перекиси, растворенного в них, чтобы помочь предотвратить этот тип угрозы безопасности.
Тиол
Тиольная функциональная группа содержит атом серы, связанный с атомом водорода.Он очень похож на функциональную группу спирта с серой, заменяющей O.
Рисунок \ (\ PageIndex {5} \): Тиол
Тиолы также называют меркаптанами, что происходит от латинского слова «улавливание ртути» из-за прочных связей, которые он образует с ртутьсодержащими соединениями. Некоторые тиоловые соединения имеют характерный запах, похожий на запах тухлых яиц. Их часто добавляют в природный газ, который сам по себе не имеет запаха, как способ обнаружения утечек, поскольку его запах может быть обнаружен людьми в очень небольших количествах.Тиоловая группа также присутствует в аминокислоте цистеине, что будет обсуждаться позже.
Амины
Амин состоит из атома азота, связанного с некоторой комбинацией атомов углерода и водорода.
Рисунок \ (\ PageIndex {6} \): Амины
Как и спирты, амины можно разделить на первичные, вторичные и третичные. Однако правила присвоения этих категорий немного отличаются. В спирте атом кислорода всегда связан ровно с одним атомом углерода, поэтому мы смотрим на разветвление на соседнем атоме углерода, а не на сам атом кислорода.В нейтральном амине азот может быть связан с одним, двумя или тремя атомами углерода, и именно так мы решаем, называть его первичным, вторичным или третичным амином.
Нейтральные амины — слабые основания, потому что неподеленная пара на азоте может действовать как акцептор протонов. Многие амины меньшего размера имеют очень сильный и неприятный запах. Например, удачно названные соединения кадаверин и путресцин представляют собой дурно пахнущие амины, образующиеся в процессе распада после смерти.
Амины служат для самых разных целей.Дифениламин действует как стабилизатор для некоторых типов взрывчатых веществ. Амины входят в состав некоторых смазочных материалов, в проявителях и входят в состав гидроизоляционных тканей. Некоторые амины, например новокаин, используются в качестве анестетиков. Многие фармацевтические соединения содержат амины, в том числе 8 из 10 лекарств, которые чаще всего выписывались в 2012 году.
Альдегиды
Очень распространенным структурным компонентом органических структур является карбонил , который представляет собой просто атом углерода и атом кислорода, соединенные двойной связью.Реакционная способность карбонилов в первую очередь определяется поляризацией связи \ (\ ce {C = O} \), но окружающие атомы также играют роль в ее конкретных реакционных путях. Хотя карбонил является компонентом многих функциональных групп, он сам по себе не является функциональной группой.
Рисунок \ (\ PageIndex {7} \): Альдегид
Альдегид представляет собой карбонил, в котором атом углерода связан по крайней мере с одним атомом водорода. Другая группа, присоединенная к карбонилу, может быть \ (\ ce {R} \) — группой или атомом водорода.Поскольку атом водорода настолько мал, частичный положительный заряд на углероде карбонила очень легко поддается другим молекулам, что делает альдегиды особенно реактивным типом карбонила. Альдегиды — универсальные реагенты для самых разных органических синтезов. Многие альдегиды также обладают отличительным вкусом и ароматом. Например, аромат корицы в первую очередь связан с молекулой коричного альдегида, а ванилин является альдегидом, наиболее ответственным за запах и вкус ванильного экстракта.
Особый альдегид — это молекула, в которой карбонил связан с двумя атомами водорода. Эта молекула, называемая формальдегидом, имеет множество применений. Сам по себе он может использоваться как консервант для тканей или как очень агрессивное дезинфицирующее средство. Он также используется в качестве предшественника различных материалов, включая пластмассы, смолы и другие полимеры.
Рисунок \ (\ PageIndex {8} \): Примеры молекул с альдегидными функциональными группами.
Кетоны
Рисунок \ (\ PageIndex {9} \): Кетон
Кетон включает карбонил, в котором атом углерода образует одинарные связи с двумя \ (\ ce {R} \) — группами.Кетоны подвергаются большинству тех же реакций, что и альдегиды, но они, как правило, немного менее реактивны. Самый простой кетон — это ацетон, в котором карбонильный углерод связан с двумя \ (\ ce {CH_3} \) группами. Этот кетон обычно используется для удаления лака с ногтей и служит промышленным растворителем. Метилэтилкетон используется в качестве средства для снятия краски и растворителя. Кетоны также используются в производстве различных полимеров в качестве строительного материала или растворителя. \ (\ Ce {R} \) — группа в кетоне может быть такой же или другой, как показано в примере.
Рисунок \ (\ PageIndex {10} \): два примера кетонов.
Карбоновые кислоты
Карбоновые кислоты представляют собой другую карбонилсодержащую функциональную группу, в которой атом углерода связан с группой \ (\ ce {OH} \) с одной стороны и либо с атомом углерода, либо с атомом водорода с другой.
Рисунок \ (\ PageIndex {11} \) : Карбоновая кислота
Как следует из названия, карбоновые кислоты являются слабыми кислотами. Группа \ (\ ce {OH} \), которая напрямую связана с карбонилом, будет ионизироваться в небольшой степени при растворении в воде.Причина этого — относительная стабильность образующегося аниона. Карбоксилат-ион (см. Рисунок ниже), в котором отрицательный заряд распространяется на два разных атома кислорода через резонансные структуры, более стабилен, чем изолированный анион с кислородным центром. Карбоновая кислота и карбоксилат-ион взаимозаменяемы. Карбоксилат-ионы часто присутствуют в аминокислотах.
Рисунок \ (\ PageIndex {12} \): Карбоксилат-ион
Карбоновые кислоты используются в различных средах. Муравьиная кислота действует как защитное химическое вещество для многих жалящих насекомых и растений.Уксусная кислота придает уксусу характерный запах и вкус и является основным строительным материалом для биологии и промышленности. Карбоновые кислоты с более длинными углеродными цепями (жирные кислоты) используются животными как способ хранения энергии и широко используются при производстве мыла. Некоторые соединения содержат несколько карбоновых кислот в одной молекуле. Например, лимонной кислоты (три карбоксильные группы) особенно много в цитрусовых, и она используется в качестве ароматизатора и консерванта во многих пищевых продуктах и напитках.
Рисунок \ (\ PageIndex {13} \): Карбоновые кислоты
Сложные эфиры
Сложный эфир похож на карбоновую кислоту тем, что он содержит карбонил, в котором углерод связан с одним дополнительным атомом кислорода и одним атомом углерода или водорода. Однако второй атом кислорода связан с другим углеродом, а не с кислым атомом водорода. Структурно карбоновые кислоты и сложные эфиры связаны друг с другом так же, как спирты и простые эфиры.
Рисунок \ (\ PageIndex {14} \): Сложный эфир
Сложные эфиры могут быть образованы путем нагревания карбоновых кислот и спиртов в присутствии кислотного катализатора.Этот процесс обратим, и исходные материалы можно регенерировать путем реакции сложного эфира с водой в присутствии слабого основания.
Некоторые сложные эфиры имеют очень приятный запах, поэтому их используют при производстве многих духов. Пропилацетат придает запах грушам, а изоамилацетат придает запах бананам. Этот эфир также служит сигналом тревоги для медоносных пчел. Сложные эфиры используются при производстве тканей (полиэфиров) и оргстекла. Анестетики, такие как прокаин и бензокаин, также содержат сложные эфиры.
Амиды
Амид представляет собой карбонил, в котором углерод присоединен к одному атому азота и одному атому углерода или водорода. В качестве альтернативы мы могли бы определить амид как амин, в котором один из атомов углерода, присоединенный к азоту, является частью карбонила.
Рисунок \ (\ PageIndex {15} \): Амид
Амид может быть образован путем объединения карбоновой кислоты и амина. Только первичные и вторичные амины могут быть использованы для образования амидов, поскольку они содержат водород, который можно заменить карбонильным углеродом; третичные амины не образуют амидов.Амид, показанный на рисунке выше, образовался из карбоновой кислоты и первичного амина.
Амиды используются в качестве красителей в цветных мелках, карандашах и чернилах. Они работают в бумажной, пластмассовой и резиновой промышленности. Полиакриламид — очень широко используемый амид; он участвует в очистке питьевой воды и сточных вод, а также в производстве пластмасс. Амид Кевлар широко используется для производства бронежилетов, а нейлон — еще один тип полимера на основе амида.
Галоалканы
Галогеналканы, также известные как алкилгалогениды, представляют собой группу химических соединений, состоящих из алкана с одним или несколькими атомами водорода, замещенными атомом галогена (атом группы 17).Существует довольно большая разница между структурными и физическими свойствами галогеналканов и структурными и физическими свойствами алканов. A
Рисунок \ (\ PageIndex {16} \): Амид
Галоалканы содержатся в огнетушителях, хладагентах, пропеллентах, растворителях и лекарствах. Они также являются значительным источником загрязнения, и их использование в некоторых продуктах было сокращено или полностью исключено. Хлорфторуглероды (ХФУ) использовались в качестве хладагентов в кондиционерах, но оказались основной причиной разрушения озонового слоя.Исследования и разработки альтернатив начались в 1970-х годах. Гидрохлорфторуглероды (ГХФУ) используются в течение многих лет, поскольку они наносят меньший ущерб озоновому слою, но многие страны согласились ликвидировать ГХФУ к 2020 году.
Авторы и авторство
Фонд CK-12 Шарон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Эллисон Султ, Ph.D. (Кафедра химии, Университет Кентукки)
функциональных групп
функциональных групп
Функциональные группы
Стереоизомеры (кратковременно и неоптические!)
Геометрические изомеры — это стереоизомеры, которые отличаются друг от друга и разделены, потому что они не могут свободно вращаться из-за множественной связи или кольцевой структуры.Геометрические изомеры обычно не являются оптическими изомерами, если они не имеют хиральных центров. Эти изомеры могут накладываться на их зеркальные изображения, если отсутствуют хиральные центры. Изомеры являются диастереомерами в соответствии с приведенным здесь определением.
Существует два соглашения об именах. В более старом методе используются цис- и транс-, что хорошо работает для примера, приведенного выше, потому что есть два атома H и два атома Cl.Но это не сработает, если задействованы четыре разных атома. В более новом методе заместители для каждого атома C ранжируются в соответствии с правилами последовательности Кана-Ингольда-Прелога. (Кэри, Органическая химия, стр. 268-272). Если двое с более высоким рейтингом находятся на одной стороне двойной связи, этот изомер — Z (для немецкого слова zusammen , что вместе означает вместе ).
Другой изомер — E (для e ntgegen означает напротив ). Вкратце, правила последовательности ранжируют заместители в порядке убывания атомного номера, и если два или более атомов, связанных с атомом C, одинаковы, второй атом определяет порядок.
Функциональные группы
В органической химии преобладает «подход функциональных групп», при котором органические молекулы, как считается, состоят из:
- Инертный углеводородный скелет, на который прикреплены или наложены функциональные группы (FG).
Подход функциональных групп « работает» , потому что свойства и химический состав конкретной функциональной группы (FG) могут быть в значительной степени независимыми от окружающей среды.
Следовательно, необходимо знать химию только нескольких общих функций, чтобы предсказать химическое поведение тысяч реальных органических химикатов.
Органические молекулы также называются с использованием подхода функциональных групп:
2-гексанон
2-гексанол
2-хлоргексан
Правило состоит в том, что функции принимают свои отличительные особенности, когда они разделены группами –Ch3–.Таким образом, карбонил, C = O, и гидрокси, OH, карбоновой кислоты, RCOOH, являются частью одной функции и НЕ являются «спиртом плюс кетон»:
Несколько слов о функционально-групповом подходе
Подход функциональных групп является на 100% эмпирическим, поскольку он определяется экспериментом и опытом, а не теорией (например, в отличие от VSEPR).
Многофункциональное соединение, такое как молекула лекарственного средства морфин, может иметь несколько функциональных групп и хиральных центров:
Алкан | Алкильные и иногда арильные (ароматические) функции представлены R-метилом: Ch4– Этил: Ch4Ch3– Пропил: Ch4Ch3Ch3– Изопропил: (Ch4) 2CH– Фенил: C6H5– и т. Д. |
Алкилгалогенид | Алкилгалогениды [галогеналканы] состоят из алкильной группы, присоединенной к галогену: F, Cl, Br, I. Хлор-, бром- и йодоалкилгалогениды часто подвержены реакциям элиминирования и / или нуклеофильного замещения. |
Первичный спирт | Первичные спирты имеют функцию -ОН, присоединенную к группе R-Ch3-.Первичные спирты могут быть окислены до альдегидов и карбоновых кислот. (Остановить окисление на стадии альдегида может быть сложно.) Первичные спирты могут быть обозначены в тексте как: RCh3OH |
Вторичный спирт | Вторичные спирты имеют -ОН-функцию, присоединенную к группе R2CH-. Вторичные спирты могут окисляться до кетонов. Вторичные спирты могут быть обозначены в тексте как: R2CHOH |
Третичный спирт | Третичные спирты имеют -ОН-функцию, присоединенную к группе R3C-.Третичные спирты устойчивы к окислению подкисленным дихроматом калия (VI), K. Третичные спирты могут быть обозначены в тексте как: R3COH |
Альдегид | Альдегиды имеют водород и алкильную (или ароматическую) группу, присоединенную к карбонильной группе. Альдегиды могут быть обозначены в тексте как: RCHO Альдегиды легко окисляются до карбоновых кислот и могут восстанавливаться до первичных спиртов. Альдегиды можно отличить от кетонов по положительным результатам испытаний с раствором Фелингса (кирпично-красный осадок) или реактивом Толленса (серебряное зеркало).Альдегиды дают красно-оранжевый осадок с 2,4-динитрофенилгидразином. |
Кетон | Кетоны имеют пару алкильных или ароматических групп, связанных с карбонильной функцией. Кетоны могут быть обозначены в тексте как: RCOR Кетоны можно отличить от альдегидов, дав отрицательные результаты испытаний с раствором Фелинга (кирпично-красный осадок) или реактивом Толленса (серебряное зеркало). Кетоны образуют красно-оранжевый осадок с 2,4-динитрофенилгидразином. |
Карбоновая кислота | Карбоновые кислоты имеют алкильные или ароматические группы, присоединенные к гидроксикарбонильной группе. Карбоновые кислоты могут быть обозначены в тексте как: RCOOH Карбоновые кислоты — это слабые кислоты Бренстеда, которые выделяют CO2 из карбонатов и гидрокарбонатов. |
Карбонильная функция | Карбонильная группа является суперфункцией, потому что многие общие функциональные группы основаны на карбониле, в том числе: альдегиды, кетоны, карбоновые кислоты, сложные эфиры, амиды, ацил (кислотные) хлориды, ангидриды кислот |
Сложный эфир | Сложные эфиры имеют пару алкильных или ароматических групп, связанных с карбонильной + связывающей кислородной функцией.Сложные эфиры могут отображаться в тексте как: RCOOR или (иногда) ROCOR. карбоновая кислота + спирт -> сложный эфир + вода Это равновесие, катализируемое кислотой. |
Амид | Первичные амиды (показаны) имеют алкильную или ароматическую группу, присоединенную к амино-карбонильной группе. Первичные амиды могут быть обозначены в тексте как: RCONh3 Вторичные амиды имеют алкильную или арильную группу, присоединенную к азоту: RCONHR Третичные амиды имеют две алкильные или арильные группы, присоединенные к азоту: RCONR2 |
Первичный амин | Первичные амины имеют алкильную или ароматическую группу и два атома водорода, присоединенные к атому азота.Первичные амины могут быть обозначены в тексте как: RNh3 Первичные амины — это основные функции, которые могут быть протонированы до соответствующего иона аммония. Первичные амины также являются нуклеофильными. |
Вторичный амин | Вторичные амины имеют пару алкильных или ароматических групп и водород, присоединенный к атому азота. Вторичные амины могут быть обозначены в тексте как: R2NH Вторичные амины — это основные функции, которые могут быть протонированы до соответствующего иона аммония.Вторичные амины также являются нуклеофильными. |
Третичный амин | Третичные амины имеют три алкильные или ароматические группы, присоединенные к атому азота. Третичные амины могут быть обозначены в тексте как: R3N Третичные амины — это основные функции, которые могут быть протонированы до соответствующего иона аммония. Третичные амины также являются нуклеофильными. |
Нитрил | Нитрилы (или органоцианиды) имеют алкильную (или ароматическую) группу, присоединенную к функциональной группе углерод-тройная связь-азот.Нитрилы могут быть обозначены в тексте как: RCN Обратите внимание, что существует проблема с номенклатурой нитрилов / цианидов. Если соединение названо нитрилом, то считается и включен углерод нитрила, но когда соединение названо цианидом, это не так. Например: Ch4Ch3CN называют пропаннитрилом или этилцианидом (цианоэтаном). |
Карбоксилат-ион или соль | Карбоксилат-ионы представляют собой конъюгированные основания карбоновых кислот, т.е.депротонированная карбоновая кислота. Карбоксилат-ионы могут отображаться в тексте как: RCOO– Когда включен противоион, отображается соль. Соли могут быть обозначены в тексте как: RCOONa |
Аминокислота | Аминокислоты, строго альфа-аминокислоты, имеют карбоновую кислоту, аминогруппу и водород, присоединенные к одному и тому же атому углерода. Есть 20 природных аминокислот. Все, кроме глицина (R = H), являются хиральными, и только L-энантиомер встречается в природе.Аминокислоты могут быть обозначены в тексте как: R-CH (Nh3) COOH |
Алкен | Алкены состоят из двойной связи C = C. Алкены могут быть представлены в тексте как: Замещенный моно: RCH = Ch3 1,1-дизамещенный: R2C = Ch3 1,2-дизамещенный: RCH = CHR Алканы плоские, поскольку нет вращения вокруг связи C = C. Алкены представляют собой реактивные центры, богатые электронами, и они восприимчивы к электрофильному присоединению. |
транс-алкен | транс-алкены представляют собой 1,2-дизамещенные группы с двумя группами R, X или другими на противоположных сторонах функции C = C. Из-за отсутствия вращения связи C = C цис- и транс-геометрические изомеры не [термически] взаимопревращаются. |
цис-алкен | цис-алкены представляют собой 1,2-дизамещенные группы с двумя группами R, X или другими на одной стороне функции C = C.Из-за отсутствия вращения связи C = C цис- и транс-геометрические изомеры не подвергаются [термическому] взаимопревращению. |
Эфир | Простые эфиры имеют пару алкильных или ароматических групп, присоединенных к связывающему атому кислорода. Эфиры могут быть обозначены в тексте как: Эфиры ROR на удивление нереактивны и очень полезны в качестве растворителей для многих многих (но не всех) классов реакций. |
От Марка Р.Выщелачивание 1999-2008
R представляет собой группу на основе углерода.
Подробнее Номенклатура:
Спирты и эфиры: номенклатура
Простые спирты называются производными исходного алкана с использованием суффикса -ol по следующим простым правилам:
- Выберите самую длинную непрерывную углеродную цепь, содержащую гидроксильную группу, и получите имя родителя, заменив -e, оканчивающееся на -ol.
- Пронумеруйте углеродную цепь, начиная с конца, ближайшего к гидроксильной группе.
- Пронумеруйте заместители и напишите название, перечислив заместители в алфавитном порядке.
Простые эфиры называют либо путем идентификации двух органических остатков и добавления слова эфир, либо, если присутствует другая функциональность, эфирный остаток называют алкоксизаместителем, как показано ниже:
Альдегиды и кетоны: номенклатура
Простые альдегиды и кетоны названы с использованием стандартных правил номенклатуры, которые мы использовали в прошлом, со следующими конкретными изменениями:
- Альдегиды названы путем замены конца -e исходного алкана суффиксом -al; суффикс для кетонов — -он.
- Пронумеруйте заместители и напишите название, перечислив заместители в алфавитном порядке.
- Когда альдегид является заместителем в кольце, его называют -карбальдегидной группой.
- Когда группа -COR становится заместителем в другой цепи, ее называют ацильной группой, и в названии используется суффикс -yl.
- Когда карбонильная группа становится заместителем в другой цепи, ее называют оксогруппой.
Номенклатура карбоновых кислот
Простые карбоновые кислоты названы как производные исходного алкана с использованием суффикса -ойная кислота
- Выберите самую длинную непрерывную углеродную цепь, содержащую группу карбоновой кислоты, и получите исходное имя, заменив -e, оканчивающееся на -oic acid.
- Пронумеруйте углеродную цепь, начиная с конца, ближайшего к группе карбоновой кислоты.
- Пронумеруйте заместители и напишите название, перечислив заместители в алфавитном порядке.
- Заместители карбоновых кислот, присоединенные к кольцам, названы с использованием суффикса -карбоновая кислота.
Выбранная родительская цепь должна содержать карбонильную группу.
Пронумеруйте углеродную цепь, начиная с конца, ближайшего к карбонильной группе.
Номенклатура алифатических аминов
Простые амины называются производными исходного алкана с использованием суффикса -амин или с использованием -амино для обозначения пронумерованного заместителя по следующим правилам:
- Выберите самую длинную непрерывную углеродную цепь, содержащую аминогруппу, и получите исходное имя, заменив -e, оканчивающееся на -амин , или указав азот в качестве заместителя амино .Пронумеруйте углеродную цепь , начиная с конца, ближайшего к аминогруппе , или , чтобы дать наименьшее число в первой точке различия .
- Пронумеруйте заместители и напишите название, перечислив заместители в алфавитном порядке.
Таким образом, в следующем примере вы должны пронумеровать от конца, ближайшего к азоту, образуя названия: 3-метилпентанамин (или 1-амино-3-метилпентан ) и 5-метил-2-гексанамин (или 2-амино-5-метил-2-гексан ) соответственно.
В этом примере, однако, вы набираете номер, чтобы дать наименьшее число в первой точке разницы , что дает название 5-амино-2,3-диметилгексан (не 2-амино-4,5-диметилгексан) .
Множественные заместители у азота названы с использованием простых множителей:
Амины далее подразделяются на «первичные, вторичные, третичные и четвертичные» в зависимости от количества заместителей у азота:
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Функциональных групп в органической химии
Функциональные группы — это группы атомов внутри молекул, которые участвуют в химических реакциях, характерных для этих молекул.Функциональные группы могут относиться к любым молекулам, но обычно вы слышите о них в контексте органической химии. Символы R и R ‘относятся к присоединенной водородной или углеводородной боковой цепи или иногда к любой группе атомов.
Это алфавитный список важных функциональных групп:
Ациловая группа
Функциональные группы Ацильная функциональная группа является частью структуры, выделенной зеленым цветом.
Тодд Хелменстайн
Ацильная группа представляет собой функциональную группу с формулой RCO-, где R связан с атомом углерода одинарной связью.
Функциональная группа ацилгалогенидов
Функциональные группы Это общая структура айклгалогенидной функциональной группы, где X представляет собой атом галогена.
Тодд Хелменстайн
Ацилгалогенид представляет собой функциональную группу с формулой R-COX, где X представляет собой атом галогена.
Функциональная группа альдегидов
Альдегидная функциональная группа имеет формулу RCHO. Он имеет префикс aldo- и суффикс -al.
Бен Миллс
Алкенильная функциональная группа
Алкенильная функциональная группа представляет собой тип углеводородной функциональной группы на основе алкена.Он характеризуется двойной связью.
Бен Миллс
Алкильная функциональная группа
Изопропильная группа является примером алкильной группы.
Су-но-Г
Алкинильная функциональная группа
Алкинильная функциональная группа представляет собой углеводородную функциональную группу на основе алкина. Он характеризуется тройной связью.
Бен Миллс
Функциональная группа азидов
Формула азидной функциональной группы: RN 3 .
Функциональная группа азо- или диимида
Это структура азо- или диимидной функциональной группы.Бен Миллс
Формула азо- или диимидной функциональной группы: RN 2 R ‘.
Бензиловая функциональная группа
Бензильная функциональная группа представляет собой углеводородную функциональную группу, полученную из толуола.
Бен Миллс
Функциональная группа Bromo
Бром-функциональная группа представляет собой бромалкан, характеризующийся связью углерод-бром.
Бен Миллс
Бутиловая функциональная группа
Это химическая структура бутильной функциональной группы.
Тодд Хелменстайн
Молекулярная формула бутильной функциональной группы: R-C 4 H 9 .
Карбонатная функциональная группа
Функциональная группа карбонатного эфира имеет формулу ROCOOR и является производной карбоната.
Бен Миллс
Карбонильная функциональная группа
Карбонильная функциональная группа основана на кетонной группе. Он имеет формулу RCOR ‘. Префикс для этой группы — кето- или оксо- или ее суффикс -он.
Бен Миллс
Функциональная группа карбоксамида
Функциональная группа карбоксамида представляет собой амид.
Бен Миллс
Формула карбоксамидной группы — RCONR 2 .
Карбоксильная функциональная группа
Винилацетат содержит карбоксильную группу.
Бачика / Getty Images
Формула карбоксильной функциональной группы — RCOOH. В его основе — карбоновая кислота.
Карбоксилатная функциональная группа
Формула карбоксилатной функциональной группы — RCOO-. Карбоксилатная группа основана на карбоксилате и имеет префикс карбокси или суффикс -оат.
Бен Миллс
Функциональная группа хлора
Функциональная группа хлора представляет собой хлоралкан.Он характеризуется связью углерод-хлор.
Бен Миллс
Цианатная функциональная группа
Формула цианатной функциональной группы — ROCN.
Бен Миллс
Функциональная группа дисульфидов
Формула дисульфидной функциональной группы — RSSR ‘.
InfoCan, Википедия Commons
Формула сложноэфирной функциональной группы — RCOOR ‘.
Бен Миллс
Эфирная функциональная группа
Общая формула простой эфирной функциональной группы — ROR ‘.
Бен Миллс
Этиловая функциональная группа
Функциональные группы Это химическая структура этильной функциональной группы.Тодд Хелменстайн
Молекулярная формула этильной функциональной группы: C 2 H 5 .
Функциональная группа фторсодержащих материалов
Функциональная группа фтора представляет собой фторалкан. Он содержит связь углерод-фтор.
Бен Миллс
Функциональная группа Halo
Функциональная группа галогена относится к любому галогеналкану или алкану, содержащему атом галогена, такого как хлор, бром или фтор. Функциональная группа галогена содержит связь углерод-галоген.Бен Миллс
Галоформил функциональная группа
Галоформильная функциональная группа представляет собой ацилгалогенид, характеризующийся двойной связью углерод-кислород и связью углерод-галоген.
Бен Миллс
Функциональная группа гептила
Это химическая структура функциональной группы гептила.
Тодд Хелменстайн
Молекулярная формула гептильной функциональной группы: R-C 7 H 15 .
Гексильная функциональная группа
Это химическая структура гексильной функциональной группы.Тодд Хелменстайн
Молекулярная формула гексильной функциональной группы: R-C 6 H 13 .
Функциональная группа гидразона
Функциональные группы Это общая структура функциональной группы гидразона.
Тодд Хелменстайн
Функциональная группа гидразона имеет формулу R 1 R 2 C = NNH 2 .
Гидроперокси функциональная группа
Формула функциональной гидропероксигруппы — ROOH.В его основе — гидропероксид.
Гидроксильная функциональная группа
Гидроксильная функциональная группа представляет собой кислородсодержащую группу на основе спирта или группы ОН.
Бен Миллс
Функциональная группа имида
Формула для имидной функциональной группы: RC (= O) NC (= O) R ‘.
InfoCan, Википедия Commons
Функциональная группа йода
Функциональная группа йода представляет собой йодалкан со связью углерод-йод.
Бен Миллс
Изоцианатная функциональная группа
Формула изоцианатной функциональной группы — RNCO.Бен Миллс
Группа изотиоцианатов
Формула изотиоцианатной группы — RNCS.
Бен Миллс
Функциональная группа кетонов
Это общая структура функциональной группы кетона.
Тодд Хелменстайн
Кетон представляет собой карбонильную группу, связанную с двумя атомами углерода, где ни R 1 , ни R 2 не могут быть атомами водорода.
Функциональная группа «Метокси»
Функциональные группы Это общая химическая структура функциональной группы метокси.Тодд Хелменстайн
Метоксигруппа представляет собой простейшую алкоксигруппу. Метоксигруппа в реакциях обычно обозначается сокращением -OMe.
Метильная функциональная группа
Это химическая структура метильной функциональной группы.
Тодд Хелменстайн
Молекулярная формула метильной функциональной группы: R-CH 3
Нитратная функциональная группа
Азотная кислота является основой нитратной группы.
МОЛЕКУУЛ / НАУЧНАЯ ФОТОБИБЛИОТЕКА / Getty Images
Общая формула нитрата — RONO 2 .
Нитрил функциональная группа
Формула функциональной группы нитрила — RCN.
Бен Миллс
Нитро-функциональная группа
Это двумерная структура нитрофункциональной группы.
Бен Миллс
Формула нитрофункциональной группы: RNO 2 .
Нонильная функциональная группа
Это химическая структура нонильной функциональной группы.
Тодд Хелменстайн
Молекулярная формула нонильной функциональной группы: R-C 9 H 19 .
Октильная функциональная группа
Это химическая структура октильной функциональной группы.
Тодд Хелменстайн
Молекулярная формула октильной функциональной группы: R-C 8 H 17 .
Пентильная функциональная группа
Это химическая структура пентильной функциональной группы.
Тодд Хелменстайн
Молекулярная формула пентильной функциональной группы: R-C 5 H 11 .
Функциональная группа перокси
Формула перокси-функциональной группы — ROOR.Пероксигруппа основана на перекиси.
Бен Миллс
Фенильная функциональная группа
Фенильная функциональная группа представляет собой углеводородную функциональную группу, производную от бензола.
Бен Миллс
Фосфатная функциональная группа
Это двумерная структура фосфатной функциональной группы.
Бен Миллс
Формула для фосфатной функциональной группы: ROP (= O) (OH) 2 .
Фосфин или функциональная группа фосфинов
Формула фосфина: R 3 P.
Группа фосфодиэфиров
Фосфодиэфирная группа представляет собой разновидность фосфата.
Бен Миллс
Формула фосфодиэфирной группы: HOPO (OR) 2 .
Группа фосфоновых кислот
Это двумерная структура фосфоновой кислоты или фосфонофункциональной группы.
Бен Миллс
Формула функциональной группы фосфоновой кислоты: RP (= O) (OH) 2 .
Группа первичных аминов
Первичный амин является одной из функциональных групп амина.Бен Миллс
Формула первичного амина: RNH 2 .
Первичная группа кетимина
Формула первичной кетиминовой группы — RC (= NH) R ‘. Это разновидность первичного имина.
Бен Миллс
Функциональная группа пропил
Это химическая структура пропильной функциональной группы.
Тодд Хелменстайн
Молекулярная формула пропильной функциональной группы: R-C 3 H 7 .
Пиридильная функциональная группа
Пиридильная функциональная группа является производным пиридина.Бен Миллс
Формула пиридильной группы: RC 5 H 4 N. Расположение азота в кольце варьируется.
Вторичная группа алдимина
Вторичная альдиминовая функциональная группа имеет формулу RC (= NR ‘) H. Это разновидность имина.
Бен Миллс
Группа вторичного амина
Вторичная аминогруппа — это разновидность амина.
Бен Миллс
Формула вторичного амина: R 2 NH.
Вторичная группа кетимина
Формула вторичной функциональной группы кетимина — RC (= NR) R ‘.Вторичный кетимин — это разновидность вторичного имина.
Бен Миллс
Сульфидная группа
Формула сульфидной или тиоэфирной функциональной группы — RSR ‘.
Функциональная группа сульфонов
Это двумерная структура сульфоновой или сульфонильной функциональной группы.
Бен Миллс
Формула сульфоновой функциональной группы: RSO 2 R ‘.
Функциональная группа сульфоновой кислоты
Это двумерная структура сульфоновой кислоты или сульфофункциональной группы.Бен Миллс
Формула функциональной группы сульфоновой кислоты: RSO 3 H.
Функциональная группа сульфоксидов
Формула сульфоксидной или сульфинильной функциональной группы — RSOR ‘.
Бен Миллс
Группа третичного амина
Группа третичного амина представляет собой тип амина.
Бен Миллс
Формула третичного амина: R 3 N.
Тиоцианатная функциональная группа
Формула тиоцианатной функциональной группы — RSCN.Бен Миллс
Функциональная группа тиолов
Формула тиоловой или сульфгидрильной функциональной группы — RSH.
Бен Миллс
Функциональная группа винила
Функциональные группы Это химическая структура винильной или этенильной функциональной группы.
Тодд Хелменстайн
Молекулярная формула винильной функциональной группы: C 2 H 3 . Он также известен как этенильная функциональная группа.
.
