Содержание
Общая характеристика элементов металлов — урок. Химия, 8–9 класс.
Металлы в природе
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами.
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Ряд активности металлов
| \(Li, K, Ba, Ca, Na, \) | \(Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb\) | h3 | \(Cu, Hg, Ag, Pt, Au\) |
активные металлы | металлы средней активности | неактивные металлы |
Металлические элементы, образующие химически активные металлы (Li–Mg), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).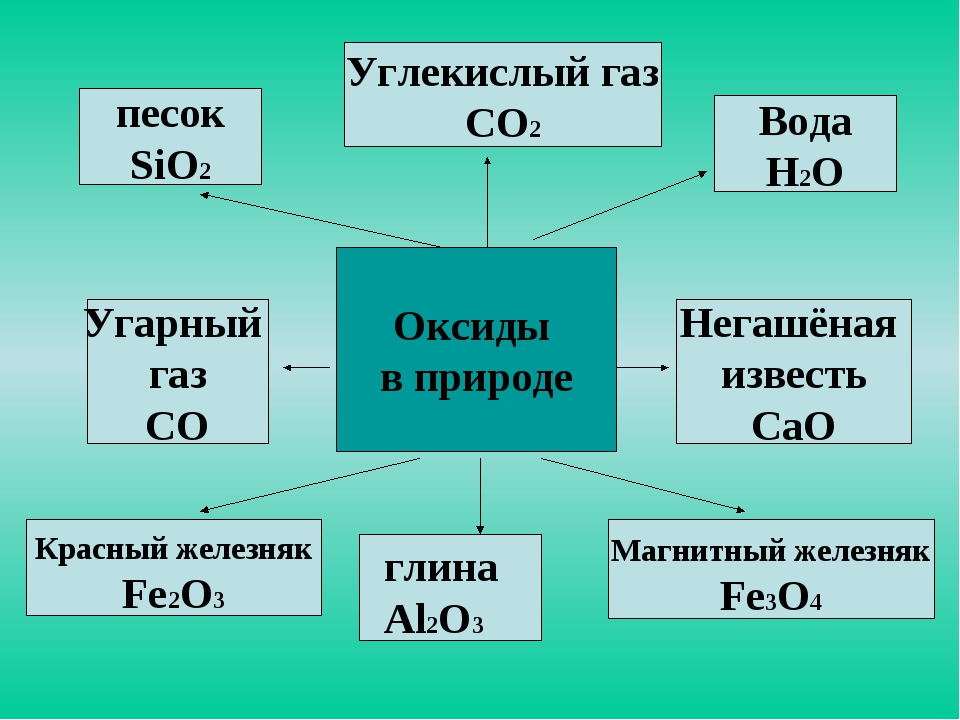
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.
Рис. \(1\). Сильвин — хлорид калия KCl с примесями | Рис. \(2\). Галит состоит из хлорида натрия NaCl
| Рис. \(3\). Кальцит состоит из карбоната кальция CaCO3 |
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca3(PO4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в природе чаще всего встречаются в виде оксидов и сульфидов.
Рис. \(4\). Минерал корунд состоит из оксида алюминия Al2O3 | Рис. \(5\). Оксид железа(\(III\)) Fe2O3 образует минерал гематит | Рис. \(6\). Минерал галенит cостоит из сульфида свинца(\(II\)) PbS |
Металлические элементы, образующие химически неактивные металлы (Cu–Au), в природе чаще всего встречаются в виде простых веществ.
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.
Рис. \(10\). Минерал халькозин состоит из сульфида меди \(I\)) Cu2S | Рис. \(11\). Гидроксокарбонат меди(\(II\)) Cu(OH)2CO3 малахит | Рис. \(12\). Минерал киноварь состоит из сульфида ртути(\(II\)) HgS |
Положение элементов металлов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов выделены красным цветом
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.
Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
Источники:
Рис. 3. Кальцит https://cdn.pixabay.com/photo/2015/04/18/13/22/calcite-728720_960_720.jpg
Рис. 6. Галенит https://cdn.pixabay.com/photo/2014/05/04/18/16/galena-337703_960_720.jpg
Рис. 7. Самородное золото https://upload.wikimedia.org/wikipedia/commons/4/46/Stringer156_nugget.jpg
Рис. 8. Самородное серебро https://cdn.pixabay.com/photo/2019/08/28/20/06/silver-4437577_960_720.jpg
Рис. 10. Минерал халькозин https://upload.wikimedia.org/wikipedia/commons/5/5f/Chalcocite.jpg
Рис. 11. Малахит https://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/MoreMalachite.jpg/1024px-MoreMalachite.jpg
Рис. 12. Киноварь https://upload.wikimedia.org/wikipedia/commons/c/c7/Cinnabar.jpg
Фианит | RusGems
Фианит один из самых распространенных и известных материалов на ювелирном рынке. Оксид циркония – минерал, который крайне редко встречается в природе, но масштабно синтезируется. По химическому составу фианит представляет собой диоксид циркония(ZrO2), с добавками оксида иттрия.
Стоит отметить, что фианит разрабатывался в середине прошлого века советскими учеными как новый перспективный материал для использования в сфере микроэлектроники, высокоточной оптике и медицине (особоострые скальпели, долговечный и инертный материал для протезирования). Однако, уникальный набор оптических свойств и твердость полученного материала быстро привлекли внимание ювелирного рынка. Сейчас фианит широко известен и массово используется в первую очередь как имитация бриллиантов.
Компания RusGems занимается выращиванием кристаллов фианитов уже более 20 лет. На данный момент ассортимент выпускаемых цветов насчитывает более 90 прозрачных фианитов и более 10 молочных фианитов повышенной твердости (9 по шкале Мооса).
| Свойства | Фианит RusGems |
|---|---|
| Показатель преломления | 2,1-2,2 |
| Дисперсия | 0,06 |
| Твердость по Моосу | 8,5 |
| Плотность, г/см3 | 6,5-10 |
Компания RusGems, эксперт в производстве синтетических камней, предлагает не только популярные светлые цвета, имитирующие различные фантазийные цвета бриллиантов, но и уникальные виды фианита с александритовым эффектом (эффектом смены цвета в зависимости от освещения):
| Номер | Цвет на белой люминесцентной лампе | Цвет на солнце или при свете свечи |
|---|---|---|
| №8 | синий | зеленый |
| №9 | лавандовый | малиновый |
| №10 | желтый | розовый |
А также фианиты с эффектом смены цвета соответствующие популярным натуральным камням, таким как зултанит и некоторые разновидности гранатов.
Флагманом среди выпускаемых цветов является, конечно, изумрудный цвет. Именно настоящий изумрудный цвет, то есть зеленый цвет средней насыщенности с голубым оттенком. Причем насыщенность голубого оттенка технологи компании RusGems могут регулировать в зависимости от пожеланий клиента.
Работа по поиску и производству новых интересных для ювелирного рынка цветов фианита в компании RusGems ведется постоянно. В 2016 году ассортимент пополнился на данный момент уже ставшими популярными цветами: морганитовым, кунцитовым, green melon (fancy diamond) и royal diamond. Мы стремимся к тому, чтобы палитра выпускаемых нами цветов удовлетворила вкус любого, даже самого искушенного клиента.
Читать далее…
Свернуть…
Диоксины и их воздействие на здоровье людей
История вопроса
Диоксины являются загрязнителями окружающей среды. Они входят в состав «грязной дюжины» – группы опасных химических веществ, известных как стойкие органические загрязнители. Диоксины вызывают особое беспокойство в связи с их высоким токсическим потенциалом. Эксперименты показывают, что они воздействуют на целый ряд органов и систем.
Диоксины вызывают особое беспокойство в связи с их высоким токсическим потенциалом. Эксперименты показывают, что они воздействуют на целый ряд органов и систем.
Попав в организм человека, диоксины долгое время сохраняются в нем благодаря своей химической устойчивости и способности поглощаться жировыми тканями, в которых они затем откладываются. Период их полураспада в организме оценивается в 7-11 лет. В окружающей среде диоксины имеют тенденцию накапливаться в пищевой цепи. Концентрация диоксинов увеличивается по мере следования по пищевой цепи животного происхождения.
Химическое название диоксина – 2,3,7,8- тетрахлородибензо пара диоксин (ТХДД). Название «диоксины» часто используется для семейства структурно и химически связанных полихлорированных дибензо-пара-диоксинов (ПХДД) и полихлорированных дибензофуранов (ПХДФ). Некоторые диоксиноподобные полихлорированные бифенилы (ПХБ) с похожими токсическими свойствами также входят в понятие «диоксины». Выявлено 419 типов относящихся к диоксинам соединений, но лишь 30 из них имеют значительную токсичность, а самыми токсичными являются ТХДД.
Выявлено 419 типов относящихся к диоксинам соединений, но лишь 30 из них имеют значительную токсичность, а самыми токсичными являются ТХДД.
Источники диоксинового загрязнения
Диоксины образуются, главным образом, в результате промышленных процессов, но могут также образовываться и в результате естественных процессов, таких как извержения вулканов и лесные пожары. Диоксины являются побочными продуктами целого ряда производственных процессов, включая плавление, отбеливание целлюлозы с использованием хлора и производство некоторых гербицидов и пестицидов. Основными виновниками выбросов диоксинов в окружающую среду часто являются неконтролируемые мусоросжигательные установки (для твердых и больничных отходов) из-за неполного сжигания отходов. Существуют технологии, позволяющие осуществлять контролируемое сжигание отходов при низких выбросах.
Несмотря на локальное образование диоксинов, их распространение в окружающей среде носит глобальный характер. Диоксины можно обнаружить в любой части мира практически в любой среде. Самые высокие уровни этих соединений обнаруживаются в почвах, осадочных отложениях и пищевых продуктах, особенно в молочных продуктах, мясе, рыбе и моллюсках. Незначительные уровни обнаруживаются в растениях, воде и воздухе.
Самые высокие уровни этих соединений обнаруживаются в почвах, осадочных отложениях и пищевых продуктах, особенно в молочных продуктах, мясе, рыбе и моллюсках. Незначительные уровни обнаруживаются в растениях, воде и воздухе.
Во всем мире имеются обширные запасы отработанных промышленных масел на основе ПХБ, многие из которых содержат высокие уровни ПХДФ. Длительное хранение и ненадлежащая утилизация этих материалов может приводить к выбросам диоксина в окружающую среду и загрязнению пищевых продуктов людей и животных. Утилизировать отходы на основе ПХБ без загрязнения окружающей среды и популяций людей не просто. С такими материалами необходимо обращаться как с опасными отходами, и лучшим способом их утилизации является сжигание при высоких температурах в специально оборудованных местах.
Случаи диоксинового загрязнения
Многие страны контролируют пищевые продукты на наличие диоксинов. Это способствует раннему выявлению загрязнения и часто позволяет предотвратить крупномасштабные последствия. Во многих случаях загрязнение диоксинами происходит через загрязненный корм для животных, например случаи повышенного уровня содержания диоксинов в молоке или корме для животных были увязаны с гранулами глины, жиров или цитрусовых, используемых при изготовлении животных кормов.
Во многих случаях загрязнение диоксинами происходит через загрязненный корм для животных, например случаи повышенного уровня содержания диоксинов в молоке или корме для животных были увязаны с гранулами глины, жиров или цитрусовых, используемых при изготовлении животных кормов.
Некоторые случаи диоксинового загрязнения были более значительными, с более широкими последствиями для многих стран.
В конце 2008 года Ирландия сняла с продажи многочисленные тонны свинины и продуктов из свинины, так как во взятых образцах свинины были обнаружены уровни диоксинов, превышающие безопасный уровень в 200 раз. Это привело к снятию с продажи в связи с химическим загрязнением одной из самых крупных партий пищевых продуктов. Оценки риска, проведенные Ирландией, показали, что проблемы для общественного здравоохранения нет. Было прослежено, что источником загрязнения были зараженные корма.
В 1999 году высокие уровни диоксинов были обнаружены в домашней птице и яйцах из Бельгии. Затем загрязненные диоксином продукты животного происхождения (домашняя птица, яйца, свинина) были обнаружены в некоторых других странах. Источником был корм для животных, загрязненный в результате незаконной утилизации отработанных промышленных масел на основе ПХБ.
Источником был корм для животных, загрязненный в результате незаконной утилизации отработанных промышленных масел на основе ПХБ.
В 1976 году на химическом заводе в Севесо, Италия, произошел выброс больших количеств диоксинов. Облако ядовитых химических веществ, включая ТХДД, вырвалось в воздух и, в конечном итоге, заразило территорию в 15 квадратных километров, на которой проживало 37 000 человек.
Экстенсивные исследования среди подвергшегося воздействию населения продолжаются для определения долговременных последствий этого инцидента на здоровье людей.
Проводятся также экстенсивные исследования последствий для здоровья ТХДД в связи с его присутствием в некоторых партиях гербицида Эйджент Ориндж (Agent Orange), использовавшегося в качестве дефолианта во время войны во Вьетнаме. До сих пор исследуется его связь с определенными типами рака, а также с диабетом.
Несмотря на то, что воздействию диоксинов могут подвергаться все страны, большинство сообщений о случаях загрязнения поступает из промышленно развитых стран, где для выявления проблем, связанных с диоксинами, имеются надлежащий мониторинг за загрязнением пищевых продуктов, более высокий уровень осведомленности об опасности и лучшие нормативные средства управления.
Было зарегистрировано также несколько случаев преднамеренного отравления людей. Самым значительным из них является случай отравления Виктора Ющенко, Президента Украины, лицо которого было обезображено хлоракне.
Последствия воздействия диоксинов на здоровье человека
Кратковременное воздействие на человека высоких уровней диоксинов может привести к патологическим изменениям кожи, таким как хлоракне и очаговое потемнение, а также к изменениям функции печени. Длительное воздействие приводит к поражениям иммунной системы, формирующейся нервной системы, эндокринной системы и репродуктивных функций.
В результате хронического воздействия диоксинов у животных развиваются некоторые типы рака. В 1997 и 2012 годах Международное агентство ВОЗ по исследованию рака (МАИР) сделало оценку ТХДД. На основе данных о животных и эпидемиологических данных о людях ТХДД был классифицирован МАИР как «известный человеческий канцероген». Однако ТХДД не оказывает воздействия на генетический материал, и существует такой уровень воздействия, ниже которого риск развития рака становится незначительным.
В связи с повсеместным распространением диоксинов все люди подвергаются его воздействию и имеют определенный уровень диоксинов в организме, который приводит к так называемой нагрузке на организм. Нынешнее обычное фоновое воздействие, в среднем, не имеет последствий для здоровья человека. Однако из-за высокого токсического потенциала этого класса соединений необходимо принимать меры для снижения уровня фонового воздействия.
Чувствительные подгруппы
Наиболее чувствителен к воздействию диоксина развивающийся плод. Новорожденный ребенок с быстро развивающимися системами органов может также быть более уязвимым перед определенными воздействиями. Некоторые люди или группы людей могут подвергаться воздействию более высоких уровней диоксинов из-за своего питания (например, жители некоторых частей мира, употребляющие в пищу много рыбы) или своего рода деятельности (например, работники целлюлозно-бумажной промышленности, мусоросжигательных заводов, свалок опасных отходов).
Профилактика и контроль воздействия диоксинов
Надлежащее сжигание загрязненных материалов является наилучшим доступным методом профилактики и контроля воздействия диоксинов. С помощью этого метода можно также уничтожать отработанные масла на основе ПХБ. В процессе сжигания требуются высокие температуры – свыше 850°С. Для уничтожения больших количеств загрязненных материалов необходимы еще более высокие температуры – 1000° и выше.
Наилучшим путем предотвращения или снижения уровня воздействия диоксинов на людей является принятие мер, ориентированных на источник, например, строгий контроль промышленных процессов для максимально возможного снижения уровня выделяемых диоксинов. Это является обязанностью национальных правительств. Комиссия «Кодекс Алиментариус» приняла в 2001 году Кодекс практики по мерам, ориентированным на источник, для уменьшения загрязнения пищевых продуктов химикатами (CAC/RCP 49-2001) и в 2006 году был принят Кодекс практики для предотвращения и снижения уровня загрязнения пищевых продуктов и кормов диоксинами и диоксиноподобными ПХБ (CAC/RCP 62-2006).
Более 90% случаев воздействия диоксинов на людей происходит через пищевые продукты, главным образом, через мясные и молочные продукты, рыбу и моллюсков. Следовательно, защита пищевых продуктов имеет решающее значение. В дополнение к принятию ориентированных на источник мер для уменьшения выбросов диоксина, необходимо также не допускать вторичного загрязнения пищевых продуктов в пищевой цепи. Решающее значение для производства безопасных пищевых продуктов имеют надлежащие средства управления и практика во время первичного производства, обработки, распределения и продажи.
Как отмечается в приведенных выше примерах, первопричиной загрязнения пищевых продуктов часто является загрязненный корм для животных.
Необходимы системы мониторинга за загрязнением пищевых продуктов, не допускающие превышение приемлемых уровней. Производители кормов и пищевых продуктов несут ответственность за обеспечение безопасного сырья и безопасных производственных процессов, а национальные правительства должны контролировать безопасность продовольственного снабжения и принимать меры для защиты здоровья населения.
Национальные правительства должны контролировать безопасность пищевых продуктов и принимать меры для охраны здоровья населения. В случае подозрения на загрязнение страны должны иметь планы действий в чрезвычайных обстоятельствах для выявления, задержания и утилизации загрязненных кормов и пищевых продуктов. Население, подвергшееся воздействию, необходимо обследовать с точки зрения уровня воздействия (например, измерить уровень загрязнителей в крови или материнском молоке) и его последствий (например, установить клиническое наблюдение для выявления признаков плохого состояния здоровья).
Что должны делать потребители для снижения риска воздействия?
Удаление жира с мяса и потребление молочных продуктов с пониженным содержанием жира может уменьшить воздействие диоксиновых соединений. Сбалансированное питание (включающее фрукты, овощи и злаки в надлежащих количествах) также позволяет избежать чрезмерного воздействия диоксина из какого-либо одного источника. Эта долговременная стратегия направлена на уменьшение нагрузки на организм и имеет особую значимость для девушек и молодых женщин, так как способствует уменьшению воздействия на развивающийся плод, а затем на находящегося на грудном вскармливании ребенка.
Что необходимо для выявления и измерения уровня диоксинов в окружающей среде и пищевых продуктах?
Для проведения количественного химического анализа диоксинов необходимы современные методы, доступные только в ограниченном числе лабораторий в мире. Стоимость таких анализов очень высока и зависит от типа образца – от более 1000 долларов США за анализ одной биологической пробы до нескольких тысяч долларов США за проведение всесторонней оценки выбросов из мусоросжигательной установки.
Разрабатывается все большее число методов биологического скрининга (на основе клеток или антител). Использование таких методов для исследований образцов пищевых продуктов пока еще не в достаточной степени легализировано. Такие методы скрининга позволят проводить большее число анализов по более низкой стоимости. В случае позитивного скрининг-теста для подтверждения результатов необходимо проводить более сложные химические анализы.
Деятельность ВОЗ, связанная с диоксинами
В 2015 г. ВОЗ впервые опубликовала оценки глобального бремени болезней пищевого происхождения. В этом контексте рассматривались последствия воздействия диоксинов на репродуктивную способность и функцию щитовидной железы. Рассмотрение только в этих 2 плоскостях позволяет предположить, что в некоторых частях мира такое воздействие может в значительной мере усугублять бремя болезней пищевого происхождения
ВОЗ впервые опубликовала оценки глобального бремени болезней пищевого происхождения. В этом контексте рассматривались последствия воздействия диоксинов на репродуктивную способность и функцию щитовидной железы. Рассмотрение только в этих 2 плоскостях позволяет предположить, что в некоторых частях мира такое воздействие может в значительной мере усугублять бремя болезней пищевого происхождения
Уменьшение воздействия диоксина является важной целью общественного здравоохранения. С целью разработки руководства по допустимым уровням воздействия ВОЗ провела ряд совещаний экспертов для определения приемлемого уровня поступления диоксинов в организм человека.
В 2001 году Совместный экспертный комитет Продовольственной и сельскохозяйственной организации Организации Объединенных Наций (ФАО)/ВОЗ по пищевым добавкам (СЭКПД) провел усовершенствованную всестороннюю оценку риска воздействия ПХДД, ПХДФ и «диоксиноподобных» ПХБ.
Для оценки долговременных или кратковременных рисков для здоровья, связанных с этими веществами, необходимо оценивать общее или среднее поступление через несколько месяцев, а приемлемый уровень поступления необходимо оценивать, как минимум, через один месяц. В предварительном порядке эксперты установили приемлемый уровень ежемесячного поступления в 70 пикограмм/кг в месяц. Это то количество диоксинов, которое может поступать в организм человека на протяжении всей его жизни без обнаруживаемых последствий для здоровья.
В предварительном порядке эксперты установили приемлемый уровень ежемесячного поступления в 70 пикограмм/кг в месяц. Это то количество диоксинов, которое может поступать в организм человека на протяжении всей его жизни без обнаруживаемых последствий для здоровья.
ВОЗ в сотрудничестве с ФАО через Комиссию «Кодекс Алиментариус» разработала «Кодекс практики для предотвращения и снижения уровня загрязнения пищевых продуктов и кормов диоксинами и диоксиноподобными ПХБ». Этот документ представляет собой руководство для соответствующих национальных и региональных органов в области принятия превентивных мер.
ВОЗ также отвечает за Программу мониторинга и оценки загрязнения пищевых продуктов в рамках Глобальной системы мониторинга окружающей среды. Эта программа, известная под названием GEMS/Food, предоставляет информацию об уровнях и тенденциях загрязнителей в пищевых продуктах через сеть участвующих в ней лабораторий более чем из 50 стран мира. Диоксины включены в эту программу.
ВОЗ также проводит периодические исследования уровней содержания диоксинов в материнском молоке, главным образом в европейских странах. Эти исследования позволяют оценить воздействие на людей диоксинов из всех источников. Последние данные свидетельствуют о том, что за последние два десятилетия меры, введенные в ряде стран для контроля выбросов диоксина, привели к значительному уменьшению воздействия этих соединений. Данных из развивающихся стран не достаточно для анализа тенденций во времени.
ВОЗ также проводит периодические исследования уровней содержания диоксинов в материнском молоке. Эти исследования позволяют оценить воздействие на людей диоксинов из всех источников. Недавние данные свидетельствуют о том, что за последние два десятилетия меры, введенные в ряде стран для контроля выбросов диоксинов, привели к значительному уменьшению воздействия этих соединений.
ВОЗ продолжает эти исследования в сотрудничестве с Программой ООН по окружающей среде (ЮНЕП), в контексте «Стокгольмской конвенции» — международного соглашения о сокращении выбросов определенных устойчивых органических загрязнителей, включая диоксины. Рассматривается возможность принятия ряда мер по сокращению выделения диоксинов в процессе сжигания и производства. ВОЗ и ЮНЕП проводят глобальные обследования грудного молока, в том числе во многих развивающихся странах, в целях мониторинга мировых тенденций загрязнения диоксинами и эффективности мер, осуществляемых в рамках Стокгольмской конвенции.
Рассматривается возможность принятия ряда мер по сокращению выделения диоксинов в процессе сжигания и производства. ВОЗ и ЮНЕП проводят глобальные обследования грудного молока, в том числе во многих развивающихся странах, в целях мониторинга мировых тенденций загрязнения диоксинами и эффективности мер, осуществляемых в рамках Стокгольмской конвенции.
Диоксины присутствуют в виде сложной смеси в окружающей среде и пищевых продуктах. Для оценки потенциального риска всей смеси по отношению к этой группе загрязнителей применяется понятие токсической эквивалентности.
ВОЗ установила факторы токсической эквивалентности (ФТЭ) диоксинов и родственных соединений и проводит их регулярную переоценку на консультациях экспертов. Установлены значения ВОЗ-ФТЭ, которые применяются для людей, млекопитающих, птиц и рыб.
Снижение выбросов оксидов азота | Сиб Контролс
Снижение выбросов оксидов азота в атмосферу.
Что такое оксиды азота NOx?
Термин NO относится к семейству химических веществ, загрязняющих воздух — оксидов азота. NO представляет собой семь различных соединений, хотя наиболее опасным является только одно — диоксид азота. Диоксид азота (NO2) – это опасный загрязнитель воздуха, который может вступать в реакцию с озоном. Данная реакция может приводить к образование кислотных дождей. NO2 представляет собой красновато-коричневый газ с горьким запахом, похожий на запах хлора. NO2 также обычно называют оксидом азота и дейтеоксидом азота, который обладает высокой реактивной способностью.
NO представляет собой семь различных соединений, хотя наиболее опасным является только одно — диоксид азота. Диоксид азота (NO2) – это опасный загрязнитель воздуха, который может вступать в реакцию с озоном. Данная реакция может приводить к образование кислотных дождей. NO2 представляет собой красновато-коричневый газ с горьким запахом, похожий на запах хлора. NO2 также обычно называют оксидом азота и дейтеоксидом азота, который обладает высокой реактивной способностью.
NO является промежуточным продуктом при производстве азотной кислоты. Азотная кислота является нитрующим реагентом при производстве химических взрывчатых веществ, отбеливателем для муки, замедлителем окисления акрилатов и окислителем в ракетном топливе. Оксид азота использовался в различных ракетных установках в многочисленных беспилотных космических исследованиях и до сих пор используется для космических путешествий в системах орбитального маневрирования космических кораблей.
Где встречается Оксид азота?
NO2 в естественном виде в окружающей среде можно встретить в дыхании бактерий, вулканах, молнии, а также в стратосфере. По оценкам ученых, каждая средняя вспышка молнии превращает около 7 кг азота в оксид азота. Каждый год во всем мире, в среднем, происходит 1,4 миллиарда вспышек молнии, что дает много естественного оксида азота, однако из этих же источников NO2, принято считать остаточным газом в атмосфере Земли, где он выполняет функцию поглощения солнечного света и регулирования химического состава тропосферы, в частности концентрацию озона. По сравнению с выбросами NO2 от естественных процессов, количество выбросов NO2 от сжигания горючего ископаемого больше, более чем в три раза.
Основной причиной образования NO2 является двигатель внутреннего сгорания. Двигатели внутреннего сгорания используются для работы автомобилей, катеров, кораблей, мотоциклов, локомотивов, вертолетов, самолетов и многого другого. Дополнительные источники образования оксида азота — печи, газовые, керосиновые обогреватели и сигаретный дым. Наиболее заметными историческими причинами образования диоксида азота были ядерные испытания, что стало причиной появления печально известных красноватых грибовидных облаков. Их образования связано с высокими температурами ядерных реакций, так как кислород и азот не реагируют между собой при температуре окружающей среды. При высоких температурах они подвергаются эндотермической реакции с образованием оксидов или диоксидов азота.
Дополнительные источники образования оксида азота — печи, газовые, керосиновые обогреватели и сигаретный дым. Наиболее заметными историческими причинами образования диоксида азота были ядерные испытания, что стало причиной появления печально известных красноватых грибовидных облаков. Их образования связано с высокими температурами ядерных реакций, так как кислород и азот не реагируют между собой при температуре окружающей среды. При высоких температурах они подвергаются эндотермической реакции с образованием оксидов или диоксидов азота.
Почему требуется снижать выбросы оксида азота?
У людей, регулярно подвергающихся воздействию NO2, повышается риск заболевания легких. Чаще всего страдают те, кто работает в сельском хозяйстве и подвергается воздействию NO2 в результате разложения растений в силосохранилищах. На самом деле, это заболевание настолько распространено, что это заболевание легких называют «болезнью силосных ям». Данное заболевание легких, вызванное NO2, может привести, в некоторых случаях, к преждевременной смерти и, в меньшей степени, к эмфиземе или бронхиту. Также известно, что NO2 может накапливаться в организме людей и приводить к сердечнососудистым заболеваниям.
Также известно, что NO2 может накапливаться в организме людей и приводить к сердечнососудистым заболеваниям.
В результате жаркой и солнечной погоды, ЛОВ (Летучие Органические Вещества) и оксид азота взаимодействуют между собой, и образуется смог. Смог (приземный озон) наносит ущерб растительности и снижает урожайность. Когда оксид азота и диоксид серы вступают в реакцию с другими составляющими воздуха, образуется кислотный дождь. Кислотный дождь наносит ущерб автомобилям, зданиям и историческим памятникам. Для окружающей среды влияние кислотных дождей наиболее заметно в водной среде, включая ручьи, реки, озера и болота, где воздействие на рыб и дикую природу может быть чрезвычайно опасным.
Когда кислотные дожди попадают в почву, они способны вытягивать соединения алюминия из глинистых пород почвы и переносить их в подземные воды. Животные, которые наиболее чувствительны к кислотным дождям и алюминию, как правило, молодые особи. При определенных уровнях pH, вызванных кислотным дождем, икринки рыб не способны к дальнейшему развитию, и даже более старые особи рыб погибают в данной среде. Животные с более высокой чувствительностью к уровням pH пострадают больше всего. Важно помнить, что экосистемы являются целостными и воздействие на один вид не будет ограничено данным видом. Кислотный дождь не только откладывает алюминий в почве, но и лишает ее минералов и питательных веществ, которые поддерживают здоровый рост растений.
Животные с более высокой чувствительностью к уровням pH пострадают больше всего. Важно помнить, что экосистемы являются целостными и воздействие на один вид не будет ограничено данным видом. Кислотный дождь не только откладывает алюминий в почве, но и лишает ее минералов и питательных веществ, которые поддерживают здоровый рост растений.
Растения, которые подвергаются воздействию кислотных дождей, не погибают сразу, сначала их листья становятся коричневого цвета, они становятся более восприимчивыми к воздействию низких температур и меньше способны поглощать солнечный свет, что в дальнейшем приводит к их гибели.
В то время как большое количество кислоты находится в жидкой форме, кислота также может находиться и в частицах пыли. Это называется сухим осаждением. Эти кислоты особенно агрессивны по отношению к металлам, краске и камню, вызывая быстрое разрушение. Часто эмоциональный ущерб, причиняемый кислотной пылью, так же велик, как и финансовый ущерб, так как различные памятники архитектуры чрезвычайно подвержены разрушению.
Все влияние оксида азота, описанное в данной статье, показывает, что уменьшение выбросов NOx, NO2 и кислотных дождей имеет важное значение для сохранения здоровья, как окружающей среды, так и всего населения Земли. При этом также важно знать, что затраты на охрану окружающей среды препятствуют получению сверх прибылей коммерческой деятельности.
Мы можем предложить решения по борьбе с выбросами, которые имеют разумные капитальные затраты, низкие эксплуатационные расходы, практически не требуют затрат на обслуживание и имеет небольшие размеры, чтобы обеспечить учет всех потребностей предприятий по защите окружающей среды.
Итак, как мы можем уменьшить выбросы оксида азота NO и появление кислотных дождей?
Существует много вариантов переработки NO в зависимости от комбинации ЛОВ. Предлагаемая системы переработки включают в себя: термоокислитель, углеродный адсорбер, систему селективного каталитического восстановления или скруббер.
Термический окислитель (также известный как камера дожига, или печь дожига, или термический окислитель прямого сжигания) — это технологическая установка для снижения выбросов ЛОВ, которая разлагает опасные газы при высоких температурах. В результате работы установки выделяется тепло (которое может быть в дальнейшем утилизировано), водяной пар и углекислый газ. Существует много различных типов технологий термоокислителей, доступных для решения конкретных задач по уничтожению опасных веществ, таких как PTO, TO, каталитические рекуперативные окислители и многие другие.
Углеродный адсорбер является одной из наиболее распространенных технологий снижения загрязнения воздуха. Углеродные адсорберы необходимы, когда Вы пытаетесь одновременно снизить выбросы ЛОВ и выбросы NO, и при этом восстановить растворитель. В углеродном адсорбере загрязненный технологический поток проходит через слой активированного угля. Углерод в активированном угле действует как адсорбер, удаляя ЛОВ из технологического потока, затем удерживая их на поверхности или в порах углерода.
При выборе углеродного адсорбера нужно учитывать состав Вашего технологического потока. Для того чтобы углеродный адсорбер был наиболее эффективен, технологический поток должен быть с низким содержанием влаги и твердых частиц, так как углерод является пористым материалом, поры которого могут легко забиться. Если в технологическом потоке слишком много влаги или слишком много твердых частиц, мы можем порекомендовать систему предварительной фильтрации и / или сушильную камеру для обеспечения большей эффективности при переработке ЛОВ.
Система селективного каталитического восстановления (СКВ) предусматривает катализатор восстановления оксида азота и систему впрыска аммиака. Каталитическая реакция аммиака через селективный каталитический восстановитель (СКВ) уменьшает выброс оксида азота путем преобразования его в основные и безвредные элементы атмосферного воздуха: азот, кислород и воду. Катализатор поставляется в различных вариантах в зависимости от применения. Система впрыска аммиака позволяет вводить аммиак в процесс, для соединения с оксидом азота и уменьшения его выбросов.
Регулятор расхода аммиака (РСА) и инъекционная решетка аммиака (ИРА) для впрыска водного раствора аммиака в газовый поток контролирует подачу безводного аммиака в соответствии с системой анализа оксида азота и аммиака (NH3). Как и в случае с углеродными адсорберами, ИРА склонны к засорению, поэтому необходимо учитывать их эффективность для обеспечения долгосрочной эксплуатации. Ключом к этой оптимальной и продолжительной производительности является конструкция системы и правильное понимание всех вопросов, связанных с воздушным потоком, для обеспечения правильного смешивания аммиака во время переработки ЛОВ и NO.
Термин «Скруббинг» часто используется неправильно для обозначения удаления ЛОВ. Важно знать, что существует много типов скрубберов, но наиболее эффективным для удаления оксида азота является влажный скруббер.
Влажный скруббер использует жидкость (в основном воду) для удаления загрязняющих веществ из воздушного потока. Жидкость забирает твердые и газообразные загрязняющие частицы из воздуха.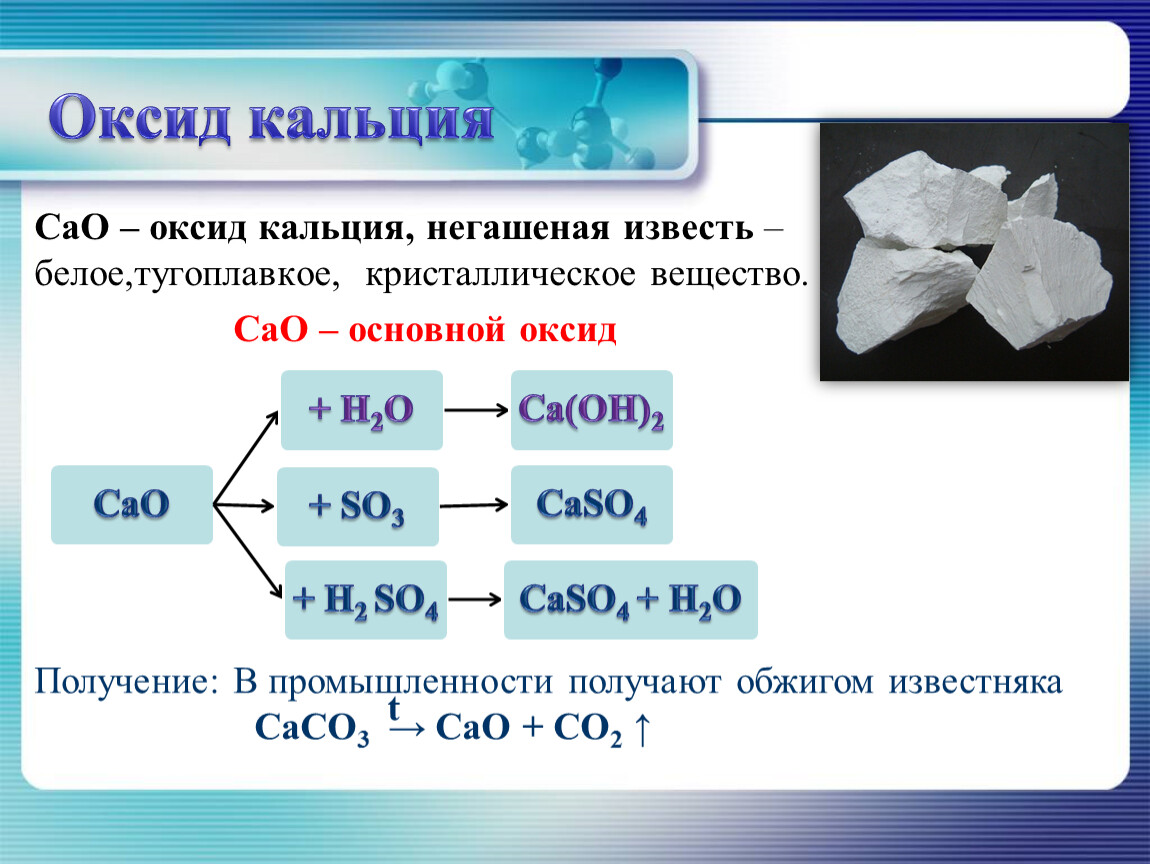 Влажные скрубберы — это универсальное оборудование для снижения загрязнений, которое проектируется индивидуально, для достижения максимальной эффективности удаления NO и ЛОВ из воздуха, выбрасываемого в атмосферу.
Влажные скрубберы — это универсальное оборудование для снижения загрязнений, которое проектируется индивидуально, для достижения максимальной эффективности удаления NO и ЛОВ из воздуха, выбрасываемого в атмосферу.
Жидкость, содержащая ЛОВ, собирается в форме конденсата и затем может быть использована для дальнейшей переработки. Влажные скрубберы чрезвычайно эффективны в своей конструкции, так как они часто являются единственной системой, которая может использоваться для обработки, как твердых частиц, так и газов в одном устройстве контроля загрязнений.
Статьи из серии «Снижение выбросов опасных загрязнителей воздуха»:
Часть 1: БTEк — бензол, толуол, этилбензол и ксилол.
Часть 2: Переработка хлора.
Часть 3: NOx — это загрязняющие воздух оксиды азота.
Часть 4: Переработка свинца.
Часть 5: Промышленные воздушные скрубберы для переработки аммиака.
Часть 6: SOx — это соединения молекул серы и кислорода, включая моноксид серы, диоксид серы и триоксид серы.
Часть 7: Углеводороды — метан, этан, пропан, бутан, пентан, гексан.
Часть 8: Метилмеркаптан, также известный как метантиол.
Часть 9: H2S – высококоррозионноактивный сероводород.
Часть 10: Диметилсульфид – метилтиометан.
Часть 11: Серная кислота – H2SO4.
Часть 12: Оксид этилена – EtO.
Компания Сиб Контролс может предложить множество индивидуальных решений, чтобы наилучшим образом соответствовать эксплуатационным особенностям производств у своих клиентов. В некоторых случаях требуется более низкие капитальные вложения при более высоких эксплуатационных затратах для тех систем, которые не нуждаются в непрерывной работе, или могут потребоваться чуть более высокие капитальные вложения с более низкими эксплуатационными затратами для тех систем, которые действительно нуждаются в постоянной работе. Мы можем предложить комплексные интегрированные решения с разными системами очистки воздуха, такими как: термоокислители, системы адсорбции углерода или системы фильтрации.
Для отправки запроса на термические окислители, печи дожига и другие системы снижения выбросов опасных веществ в атмосферу отправьте нам, пожалуйста, письмо на электронную почту, указанную на странице «Контакты» или заполните контактную форму «Написать нам», расположенную справа на текущей странице данного сайта.
Почему редкоземельные элементы стали оружием в экономической войне США и Китая
Редкоземельные металлы превратились в ключевой элемент в торговой войне между Соединенными Штатами и Китаем.
В начале августа 2019 г. Ассоциация китайской редкоземельной промышленности выступила с протестом против новых тарифов, введенных президентом Трампом: китайцы обвинили американскую администрацию в экономическом «запугивании». Они отметили, что новые пошлины должны быть оплачены (в той или иной форме) потребителями и рынком США.
Разозлить китайское лобби редкоземельных элементов — дело не шуточное. В настоящее время около 80% редких металлов, используемых в США, импортируется из Китая. Несмотря на то, что производство в США остаётся одним из крупнейших в мире (15.000 тонн в 2018 году, немного меньше, чем в Австралии), объём его всё же незначителен по сравнению с производством в Китае: 120.000 тонн в год.
Несмотря на то, что производство в США остаётся одним из крупнейших в мире (15.000 тонн в 2018 году, немного меньше, чем в Австралии), объём его всё же незначителен по сравнению с производством в Китае: 120.000 тонн в год.
Что такое редкоземельные элементы и в чём их ценность?
Редкоземельными считаются 17 элементов таблицы Менделеева, в частности скандий, иттрий и 15 других элементов лантаноидной группы металлов, включая такие как неодим, диспрозий и гольмий.
Все редкоземельные элементы — металлы. Они обладают схожими свойствами и их можно обнаружить в геологических отложениях. Иногда их также называют «редкоземельными оксидами», поскольку обычно они встречаются в природе в виде оксидных соединений.
«Несмотря на название, дело вовсе не в их редкости: их так называют, потому что они сильно разбросаны в земной коре по сравнению с некоторыми другими элементами или композитами, такими как пирит или золото», — поясняет профессор наноминералогии из Тринити-колледжа Дублина Хуан Диего Родригес-Бланко.
Редкоземельные элементы ценятся из-за их использования в производстве бытовой электроники и технологиях, связанных с возобновляемыми источниками энергии (такими как ветряные турбины и электромобили). С распространением высокотехнологичной продукции растёт и спрос на редкоземельные металлы.
«И это, в свою очередь, порождает конкуренцию на уровне геополитики: эти элементы крайне важны для развития новых технологий, что резко повышает их ценность [для промышленности и экономики]», — говорит Родригес-Бланко.
Крупнейшее месторождение редкоземельных металлов расположено в Баян-Обо, на севере Китая. На его долю приходится примерно половина объема производства редкоземельных металлов с 2005 года.
«Голмий используется для изготовления панелей управления в атомной промышленности и микроволновых печах. Неодим используется для изготовления мощных магнитов, роботов, автомобилей, жестких дисков и ветряных турбин», — рассказывает Родригес-Бланко. Кроме того редкоземельные элементы используются в аэрокосмической и военной отрасли, для производства высокостойкого стекла, топливных присадок и лазеров.
В дополнение к высоким технологиям, редкоземельные элементы используются в медицинских исследованиях, а также в лечении некоторых видов онкологических болезней (рака легких, простаты и костей).
Все их ищут, но не все находят
Хотя эти элементы и не являются «редкими», процесс их извлечения и последующей обработки — очень сложный и дорогостоящий. По данным Геологической службы США (USGS), несмотря на то, что они достаточно часто встречаются в земной коре, они широко рассеяны по земному шару. Это означает, что трудно найти значительный объём редкоземельных элементов для последующей добычи.
Именно поэтому для добычи используются агрессивные методы, как например извлечение из руды с помощью органических растворителей, магнитное деление и добыча при сверхвысоких температурах около 1000°C.
«Это очень неэффективные и экологически агрессивные методы, при которых более 50% элементов теряется в процессе разложения породы», — сказал Родригес-Бланко.
Во многих случаях сточные воды рудника содержат больше редкоземельных металлов, чем сами горные породы. Почему бы не подвергнуть переработке эти воды? Дело в том, что «эффективных методов для этого не существует: они настолько дороги, что их применение бессмысленно», — говорит наш эксперт.
Почему бы не подвергнуть переработке эти воды? Дело в том, что «эффективных методов для этого не существует: они настолько дороги, что их применение бессмысленно», — говорит наш эксперт.
Всего 1% редкоземельных элементов подвергается переработке.
В то же время, добыча этих полезных ископаемых сопряжена с высокими экологическими издержками. В некоторых процессах для разделения и сжигания при высоких температурах используются кислоты, выделяющие CO₂, что приводит к загрязнению окружающей среды.
«Редкоземельные элементы часто содержат радиоактивный элемент — торий. Хотя концентрация этого металла невысокая, мы не знаем, как контакт с ним влияет на окружающую среду и людей во время добычи», — сетует геолог.
Ключевой элемент в международной торговле
Китай осознает, что обладает мощным оружием в торговой войне против США, поскольку американская сторона сильно зависит от китайского экспорта редкоземельных элементов.
Визит китайского президента Си Цзиньпина на завод по переработке руды в конце мая дал повод для всевозможных догадок и взбудоражил международные рынки редкоземельных элементов.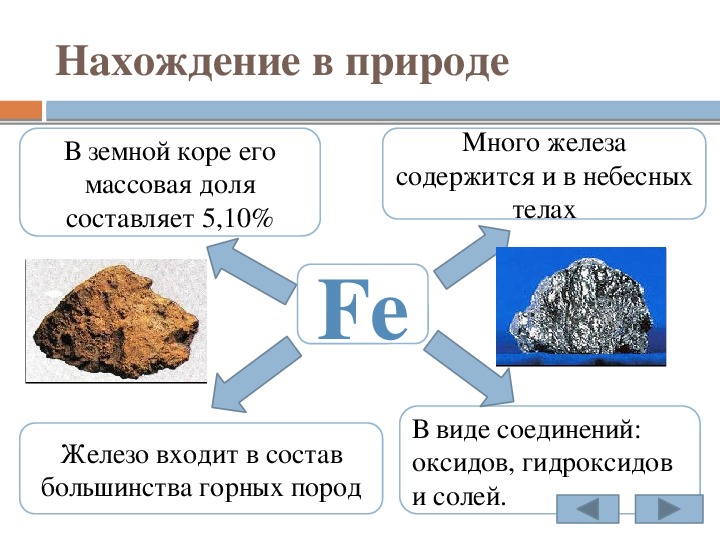
По данным властей США, на долю Китая приходится около 36,7% известных мировых запасов редкоземельных металлов и 70,6% мирового производства этих металлов. Если бы Пекин вдруг заявил, что экспорт этих элементов прекращается, было бы очень непросто достичь уровня их производства, необходимого для поддержки индустрии стран Запада.
Коммунистическая партия Китая намекнула, что рассматривает возможность ограничения экспорта редкоземельных металлов. «Не стоит недооценивать способность Китая противостоять нападкам. Не говорите потом, что мы вас не предупреждали», — говорится в материале центрального органа Компартии Китая «Жэньминь Жибао».
В мире есть страны, обладающие крупными запасами редкоземельных элементов, которые, в случае их грамотной добычи, могут удовлетворить потребности американского и европейского рынков и положить конец китайской гегемонии на этом рынке.
Но добыча этих элементов, по словам нашего эксперта, требует проведение ряда серьёзных исследований: «Особенностью редкоземельных металлов является то, что их месторождения имеют совершенно иную природу, а методы их добычи не могут быть просто перенесены их одной страны в другую».
Так, способ извлечения минералов, задействованный в китайском Баян-Обо, оказался бы совершенно бесполезным на австралийском месторождении, поясняет Родригес-Бланко.
Химические соединения алюминия – aluminium-guide.com
Ниже представлен краткий обзор важнейших химических соединений алюминия, которые находятся в природных условиях, а также их промышленного применения.
Что такое химическое соединение?
Химическое соединение алюминия – это вещество, которое образовано из двух или более химических элементов, одним из которых является алюминий. Эти элементы связаны между собой химически, то есть путем ковалентных, ионных или металлических связей. Химическое соединение имеет фиксированный химический состав и постоянную химическую формулу.
Алюминиевые сплавы обычно не являются химическими соединениями. Они являются гомогенными или гетерогенными смесями входящих в них химических элементов или соединений. Поэтому они не имеют фиксированного химического состава и не имеют химической формулы.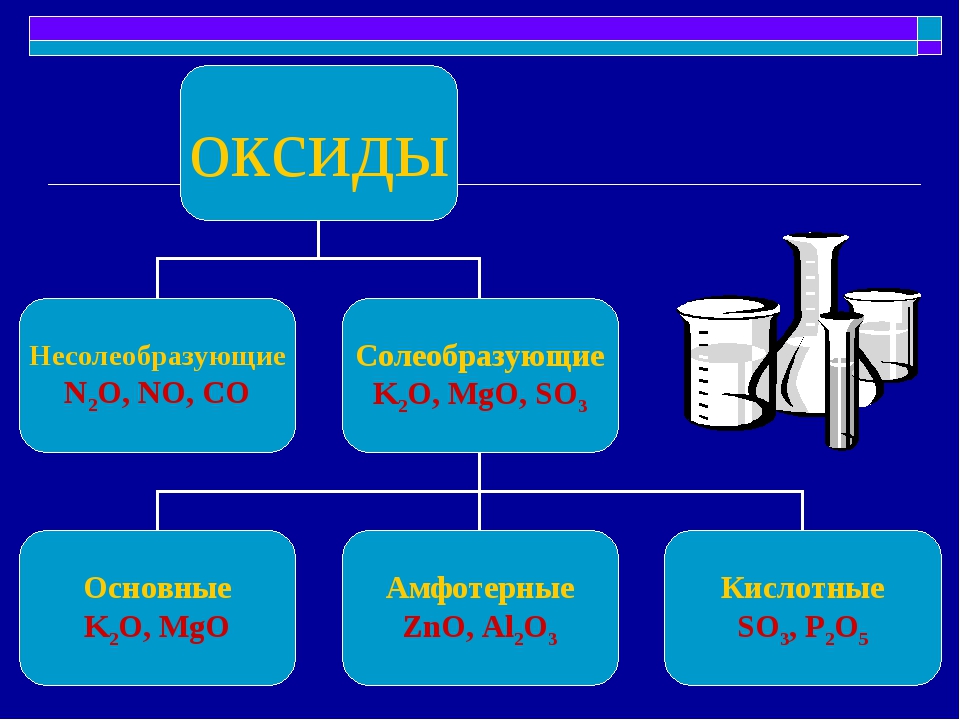
Классификация соединений алюминия
Современная классификация соединений алюминия из Энциклопедии Алюминия [4] представлена ниже.
Классификация соединений алюминия [4]
Алюминий в природе
Алюминий является самым распространенным (более 8 % по массе) природным металлическим элементом, а также третьим природным элементом среди всех химических элементов (после кислорода и кремния). Однако из-за высокой химической активности алюминия он почти всегда находится в соединениях с другими элементами и очень редко встречается в природе в виде чистого металла.
Таблица – Доля химических элементов в земной коре
Металлический алюминий
Чистый алюминий – это серебристо-белый, ковкий, пластичный металл с атомным номером 13 и относительной атомной массой 26,98. За небольшими исключениями он находится в химических соединениях в виде Al+3.
Этот металл обладает амфотерными свойствами. Он реагирует с минеральными кислотами и сильными щелочами. Хотя алюминий является одним из самых химически активных промышленных металлов, он имеет очень высокое сопротивление коррозии. При контакте свежей алюминиевой поверхности с кислородом, водой или другими окислителями на ней мгновенно вырастает плотная оксидная пленка (Al2O3), которая обеспечивает металлу высокую стойкость к коррозии. Эта оксидная пленка растворяется в щелочных растворах с выделением водорода и образованием растворимых щелочноземельных алюминатов [1].
Хотя алюминий является одним из самых химически активных промышленных металлов, он имеет очень высокое сопротивление коррозии. При контакте свежей алюминиевой поверхности с кислородом, водой или другими окислителями на ней мгновенно вырастает плотная оксидная пленка (Al2O3), которая обеспечивает металлу высокую стойкость к коррозии. Эта оксидная пленка растворяется в щелочных растворах с выделением водорода и образованием растворимых щелочноземельных алюминатов [1].
Эта оксидная пленка является стойкой к некоторым кислотам (например, азотной кислоте) и предотвращает дальнейшее химическое воздействие на металл. Однако она растворяется в некоторых кислотах (например, в соляной кислоте или горячей серной кислоте), а также в щелочных растворах, что делает возможным дальнейшие химические реакции на поверхности алюминия.
При повышенных температурах алюминий реагирует:
- с водой (выше 180 ºС) с образованием гидроксида Al(OH)3 и водорода H2;
- со многими оксидами металлов с образованием оксида Al2O3 и металла, восстановленного из его оксида.

Последняя реакция применяется при производстве некоторых металлов (алюмотермия), например, марганца и некоторых сплавов, например, ферротитана.
Природные соединения
Минералы
Природные минералы являются химическими соединениями. Алюминий присутствует во многих минералах – более 270 видов – в комбинациях с кислородом, кремнием, щелочными и щелочноземельными металлами и фтором, а также в виде гидроксидов, сульфатов и фосфатов. Например, полевые шпаты – наиболее распространенные минералы земной коры (около 50 %) – являются алюминосиликатами [1]. Ниже представлены важнейшие минералы алюминия из фундаментальной энциклопедии про алюминий [4]
Важнейшие минералы алюминия [4]
Металлический алюминий в природе
Природный металлический алюминий иногда находят как минорную фазу в условиях недостатка кислорода, например, внутри некоторых вулканов. Он также встречается в таких минералах, как берилл, криолит, гранат, шпинель и бирюза [1].
Драгоценные камни
Примеси в кристаллах оксида Al2O3, такие как хром или кобальт дают драгоценные камни рубин и сапфир, соответственно. Чистый оксид Al2O3 известен как корунд – один из самых твердых материалов.
Рубин
Бокситы
Хотя алюминий и является очень распространенным природным элементом, большинство алюминиевых минералов не могут быть экономически выгодными источниками этого металла. Почти весь металлический первичный алюминий производится из руды, которая называется бокситом (или бокситами) с обобщенной химической формулой (AlOx(OH)3-2x) [1].
Бокситы происходят в природе как продукты выветривания коренных пород с низким содержанием железа и кремния в тропических климатических условиях. Природные бокситы содержат различные гидратированные формы оксида алюминия, которые имеют различные кристаллические системы, а также различаются по степени гидратации (количеству молекул воды на одну молекулу Al2O3).
Производство глинозема
Около 90 % алюминиевых руд – бокситов – идет на производство первичного алюминия, остальные 10 % – на другие промышленные применения.
Промышленное производство первичного алюминия имеет две основных стадии:
- производство из исходной бокситной руды чистого оксида алюминия – глинозема;
- электрохимическое восстановление этого оксида до металлического алюминия в ванне расплавленного криолита.
Бокситы
Боксит не является минералом и химическим соединением. Это наименование – боксит (или, чаще, бокситы) – применяется для обозначения различных типов алюминиевых руд, которые содержат соединения алюминия, в основном – различные виды гидроксидов.
Промышленные бокситы содержит три основных типа гидроксидных минералов:
- гибсит: Al2O3·3H2O
- богемит – Al2O3·H2O
- диаспор – Al2O3·H2O.
Эти типы гидроксидов значительно различаются по таким физическим свойствам, как:
- содержание воды,
- кристаллическая система
- твердость,
- плотность,
- температура дегидратации
- растворимость в технологических растворах.

Обычно природные залежи бокситов состоят из одного из этих типов гидроксидов, хотя в некоторых случаях одна и та же алюминиевая руда может содержать смешанные гидроксиды.
Бокситы различаются по цвету от кремового до темно коричневого при высоком содержании железа.
Типичный боксит
В состав типичного боксита для промышленного производства алюминия входят следующие соединения:
- оксид алюминия – Al2O3: 40-60 %
- оксид кремния – SiO2: 1-6 %
- оксид железа – Fe2O3: 2-25 %
- оксид титана – TiO2: 1-5 %
- оксиды кальция и магния – CaO + MgO: 0,2-0,6 %
- оксиды других элементов: от 0,01 до 0,4 % (каждого).
Глинозем
Почти весь глинозем получают из бокситов, которые содержат около 50 % оксида Al2O3 в виде гидроксидов. Эту алюминиевую руду обрабатывают в растворе каустической соды под давлением, чтобы растворить оксид алюминия в виде алюмината, и отделить его от красного осадка, содержащего оксиды железа и другие основные примеси. Затем из этого раствора алюмината осаждают кристаллы гидроксида алюминия.
Затем из этого раствора алюмината осаждают кристаллы гидроксида алюминия.
При температуре ниже 700 ºС в технологической массе содержатся следующие различные типы соединений алюминия – его гидроксидов:
- гиббсит
- байерит
- нордстрандид
- диаспор
- богемит.
Завершающей технологической операцией производства глинозема является обжиг полученной на предыдущих этапах смеси гидроксидов. Обжиг (кальцинация) производится при температуре 1200 ºС с получением на выходе чистого глинозема с содержанием оксида Al2O3 более 99 %.
Глинозем
Для промышленного производства 1 тонны алюминия требуется около 2 тонн глинозема.
Соединениями алюминия, которые являются наиболее важными для неметаллургических отраслей промышленности – являются его:
- оксид;
- сульфат и
- силикат.
Оксид алюминия
Кислородное соединение алюминия
Оксид алюминия – это одно из его кислородных соединений. Чистый оксид – это белый порошок в виде частиц различной формы и размеров. Из-за своих амфотерных свойств этот оксид растворяется в минеральных кислотах и сильных щелочах. Он может иметь различные модификации. Наиболее стабильным является его альфа-модификация «корунд» (альфа-Al2O3).
Чистый оксид – это белый порошок в виде частиц различной формы и размеров. Из-за своих амфотерных свойств этот оксид растворяется в минеральных кислотах и сильных щелочах. Он может иметь различные модификации. Наиболее стабильным является его альфа-модификация «корунд» (альфа-Al2O3).
Типы оксидов
При дегидратации гидроксидов образуется серия типов оксида Al2O3, которые еще содержат небольшую долю гидроксильных групп и сохраняют некоторую химическую активность. Все оксиды, которые получены при пониженных температурах называют переходными модификациями. При температуре 1400 ºС все переходные модификации превращаются в альфа-модификацию [1].
Анодный оксид
Анодный оксид получают путем электрохимического оксидирования алюминия. Это соединение представляет собой наноструктурированный материал с уникальной структурой. Анодный алюминиевый оксид состоит из цилиндрических пор, которые обеспечивают ему широкое применение в технике. Он является термически и механически устойчивым, оптически прозрачным и обладает высокими электроизоляционными свойствами. Размер пор и толщина анодного оксидного слоя легко регулируется параметрами технологии, что дает возможность его применения не только как защитного декоративного покрытия для алюминиевых изделий, но и как основу для нанотехнологий.
Структура анодного оксидного покрытия
Гидроксиды
Известны различные формы гидроксидов алюминия. Наиболее изученными формами являются тригидроксид Al(OH)3 и оксид-гидроксид AlO(OH). Кроме этих кристаллических форм известны еще несколько других типов [1].
Гидроксид Al(OH)3 применяется в больших объемах для очистки сточных вод, а также для производства других соединений алюминия, в том числе его солей.
Сульфат алюминия
Структура и состав
Сульфат алюминия может существовать с различными пропорциями воды. Обычной формой этого соединения является Al2(SO4)3·18H2O. Он почти нерастворим в обезвоженном спирте, но хорошо растворяется в воде. При температуре выше 770 ºС разлагается до оксида алюминия.
Применение
Находит применение в следующих отраслях промышленности и областях жизни [1, 2]:
- системы очистки воды и обработки сточных вод;
- производство бумаги;
- противопожарная защитная одежда;
- очистка масел и жиров;
- гидроизоляция бетона;
- производство антиперспирантов;
- выделка кож;
- производство красок;
- в сельскохозяйственных пестицидах;
- производство химикатов;
- средство для повышения кислотности почв;
- производство косметики и мыла;
- в медицинских препаратах.
Квасцы
Сульфат алюминия входит в комбинацию с сульфатами одновалентных металлов с образованием двойных солей, которые называются квасцами. Наиболее важным из этих солей является алюминиевый сульфат калия. Это химическое соединение также известно как калиевые квасцы. Эти квасцы имеют широкое применение с глубокой древности в производстве кожи, лекарств, тканей и красок.
Глины
Глины состоят в основном из алюмосиликатов.
Хлорид
При взаимодействии газообразного хлора с расплавленным алюминием образуется хлорид алюминия. Это соединение наиболее часто применяется как катализатор в реакциях синтеза различных органических соединений. Гидратированный хлорид AlCl3∙H2O, применяется как антипреспирант или дезодорант. Это соединение является одной из нескольких алюминиевых солей, которые применяются к косметической промышленности.
Гексагидратная форма хлорида алюминия применяется:
- для защитной обработки древесины,
- как дезинфицирующее средство в животноводстве и при производстве мяса;
- очистке сырой нефти
- производство бумаги
Гидрид алюминия
С водородом алюминий образует гидрид AlH3, который широко применяется в органической химии, в том числе, в виде литиевого гидрида алюминия (LiAlH4). Это соединение получают при взаимодействии хлорида алюминия с хлоридом лития.
Интерметаллические соединения
Интерметаллид (интерметаллическое соединение) — это химическое соединение двух или более металлов. Интерметаллиды, как это и должно быть у химических соединений, имеют фиксированное соотношение между своими компонентами. Обычно в интерметаллических соединениях связь между атомами – металлическая.
Интерметаллические соединения имеет большое значение для микроструктуры и свойств алюминиевых сплавов. Например, железо и кремний являются примесями, которые всегда присутствуют в алюминии. Поскольку растворимость железа в твердом алюминии очень мала, то фазы Al-Fe или Al-Fe-Si можно найти в микроструктуре даже сверхчистого алюминия. Этими фазами могут быть интерметаллические соединения FeAl3, Fe3SiAl12, Al2Si2Al9 или FeAl6.
В алюминиевых сплавах насчитывается несколько десятков фаз, которые являются интерметаллическими соединениями. В сложных сплавах типа 2014 (система Al-Cu-Mg-Mn-Fe-Si) эти соединения имеют вид типа (Mn,Fe)3SiAl12 [3].
Таблица – Интерметаллические соединения алюминия [2]
Источники:
1. http://www.inchem.org/documents/ehc/ehc/ehc194.htm
2. Handbook of Aluminum: Vol. 1: Physical Metallurgy and Processes / ed. G. E. Totten, D. S. MacKenzie – 2003.
3. Aluminium and Aluminium Alloys /ed. J.R. Davis – ASM International, 1993.
4. Тринадцатый элемент: Энциклопедия /А. Дроздов – Библиотека РУСАЛа, 2007
Классный урок на «Радио России – Тамбов», эфир 15 мая 2020 года — ВЕСТИ / Тамбов
Алюминий. Получение алюминия. Физические и химические свойства. Применение.
Сегодня я хочу рассказать о самом распространённом металле в земной коре, о алюминии. Алюминий по распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию.
Элемент алюминий расположен в III группе, главной подгруппе, 3 периоде периодической системы, порядковый номер 13, относительная атомная масса Ar(Al) → 27.
Название элемента образовано от латинского алюмен, так в древности называли квасцы, которые использовали для крашения тканей. Данный элемент носил несколько названий. Так, английский химик и физик Гемфри Дэви, предполагая присутствие его в глиноземе, называл алюминумом. В русской химической литературе 19 века встречаются следующие названия алюминия: глинозем, алумий, алюминий и глиний.
Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл.
Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера, т. е. он является переходным элементом и его соединения являются амфотерными.
Давайте вспомним, что такое амфотерность.
Амфотерность (от др.-греч. ἀμφότεροι «двойственный; обоюдный») — способность химических соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Аl является р-элементом на внешнем уровне его электронной оболочки три электрона. В основном состоянии 2 эл. на 3s-подуровне и 1 эл. на 3р.
В возбужденном состоянии на внешнем уровне алюминия находится три неспаренных электрона. Поэтому в соединениях с ковалентной связью алюминий проявляет валентность равную III.
Нахождение в природе
В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений.
Процент содержания алюминия в земной коре составляет 8,13% массы земной коры.
Совместно с кремнием он образует такие известные вам породы и минералы, как алюмосиликаты, слюду, глину. Особое место среди минералов занимает криолит Na3[AlF6] (гексафторалюминат натрия), без которого алюминий вряд ли был вторым после железа по значению металлом. Почему? Об этом мы узнаем чуть позже.
Целая группа природных веществ в качестве основного компонента содержит оксид алюминия: это бокситы – основное сырьё для производства алюминия;
корунд – одно из самых твёрдых природных веществ. Его мелкокристаллические непрозрачные разновидности серовато-чёрного цвета называют наждаком и применяют в качестве абразивного материала.
Эту же формулу имеет и другое природное соединение — глинозём.
Наиболее драгоценными корундами являются рубины и сапфиры. Их окраска обусловлена различными примесями. Так, ион Сr3+ придаёт камню красный цвет (рубин), а ионы Тi 4+, Fe2+, Fe3+ придают синий цвет (сапфир).
Эти разновидности благородного корунда наряду с алмазом и изумрудом занимают высшее место в классификации драгоценных камней и применяют для изготовления ювелирных изделий.
В настоящее время рубины и сапфиры получают искусственно и используют для технических целей, например, для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
Получение алюминия
Каждый из нас держал в руках изделия из алюминия, так как сейчас из этого металла делают множество приборов, корпуса телефонов, посуду и многое другое. Такую распространённость в наше время алюминий получил благодаря своей лёгкости, прочности и высокой устойчивости к коррозии (к окислению на воздухе).
Однако так было не всегда.
С начала открытия алюминия датским физиком Хансом Эрстедом в 1825 году и до конца 19 века ещё не было известно о простом получении его из руды и поэтому алюминий получали восстановлением из его хлорида щелочными металлами калием или натрием. Такой способ был очень дорог, а полученный металл стоял дороже золота.
В 18-19 веках алюминий был главным ювелирным металлом.
Так в 1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И. Менделеева, подарили ему весы из золота и алюминия.
С конца 19 века и по сей день Al получают методом электрометаллургии из оксида алюминия, содержащегося в глинозёме и бокситах.
Кристаллическая решётка оксида алюминия состоит из сильно поляризованных атомов алюминия и кислорода, силы притяжения между которыми весьма велики. Это обуславливает высокую температуру плавления оксида алюминия – около 2050 оС. Сложность достижения такой высокой температуры и энергоемкость процесса долгое время относили алюминий к числу труднодоступных металлов.
В конце XIX века американский студент –химик Чарльз Мартин Холл обнаружил, что глинозём можно растворить при 950 оС в расплавленном минерале криолите (вот почему он важен для получения алюминия) и электролизом выделить из полученного раствора алюминий. Независимо от Мартина Холла в том же году это открытие сделал французский металлург Поль Луи Туссен Эру.
Для того, чтобы иметь более точное представление об электролизе Al2O3 в криолите Na3AlF6 , необходимо уточнить схему электролитической диссоциации Al2O3. Как же он диссоциирует ?
Мы знаем, что гидроксид алюминия Al(ОН)3 обладает амфотерными свойствами и его кислотную форму можно представить в виде ортоалюминиемой кислоты Н3AlO3. Этой кислоте соответствует алюминат анион AlO33-. Формулу алюминиемой соли этой кислоты можно записать AlAlO3. Так ведь это и есть оксид алюминия.
Таким образом, в расплаве криолита он диссоциирует, на катион металла и анион кислотного остатка.
Поэтому на катоде (отрицательно заряженном электроде) идёт восстановление катиона Al3+ до свободного металла.
Катод (-): Al3+ +3е = Al
На графитовом аноде (положительно заряженном электроде) окисляется алюминат анион AlO33-. При этом происходит следующий электродный процесс:
Анод(+): 4AlO33- -12 е = 2Al2O3 + 3O2
При суммировании левых и правых частей электродных процессов получается молекулярное уравнение электролиза:
Процесс проводят в специальных электролитических ваннах, которые одновременно являются катодом. Анодом служат угольные брикеты. Температуру плавления криолита в электролизёре поддерживают благодаря очень большой силе тока, которая достигает 250 кА при напряжении около 4 В. Очевидно, что получение алюминия – очень энергоемкий процесс. Кислород, выделяющийся на аноде, реагирует с углеродом, превращаясь в СО2. При этом угольный анод постепенно «сгорает».
Физические свойства алюминия
Алюминий как простое вещество представляет собой серебристо-белый металл, достаточно лёгкий (плотность 2,7 г/см3) и относительно легкоплавкий (на бытовой газовой плите с температурой пламени 850оС алюминиевый чайник расплавится, так как температура плавления его 660 оС).
На воздухе поверхность металла покрыта тонкой, но очень прочной оксидной плёнкой, предохраняющей его от дальнейшего окисления.
Алюминий очень пластичен, его можно прокатывать в фольгу толщиной 0,001 мм. По электро- и теплопроводности он уступает лишь серебру и меди.
По сравнению с перечисленными металлами алюминий дешевле. Казалось бы, вот замечательный материал для изготовления высоковольтных линий электропередач! Но мягкость и пластичность алюминия привели бы к тому, что через год под собственной тяжестью провода провисли бы до земли. Поэтому в технике, где требуется и прочность конструкции, наряду с лёгкостью и высокой электропроводностью, используют не чистый алюминий, а его сплавы (например с магнием, марганцем, медью и никелем — дюралюминий или с кремнием – силумин).
Рассмотрим химические свойства алюминия.
В электрохимическом ряду напряжений металлов алюминий близок к щелочным и щелочноземельным металлам и проявляет себя как химически активный металл.
В некоторых случаях от протекания возможных при нормальных условиях реакций (например с водой) его спасает оксидная плёнка. В химических реакциях он проявляет восстановительные свойства. Для алюминия во всех соединениях характерна единственно возможная степень окисления +3.
Порошкообразный алюминий легко взаимодействует с простыми веществами (неметаллами).
- С галогенами (с такими как Cl2 и Вr2). Реакция протекает бурно при комнатной температуре:
2Al + 3Сl2 → 2AlСl 3 хлорид алюминия
2Al + 3 Вr2 → 2AlВr2 бромид алюминия
Очень интересно протекает реакция алюминия с йодом.
Если смешать порошок алюминия и йода то реакция не начнётся, для инициации реакции в смесь добавляют каплю воды, от которой происходит смачивание компонентов и смесь загорается сама собой с выделением фиолетового дыма из паров йода, таким образом вода в этой реакции является катализатором.
- Для начала реакции с другими неметаллами (с S, C, N2, Р), требуется нагревание, зато дальнейшее взаимодействие, сопровождается выделением большого количества теплоты.
При этом образуются бинарные соединения
2Al + 3S → Al2S3 сульфид алюминия
4Al + 3C → Al4C3 карбид алюминия
2Al +N2 → 2AlN нитрид алюминия
Al + P → AlP фосфид алюминия
- С водородом Al непосредственно не реагирует.
При нагревании на воздухе алюминий окисляется с поверхности, не загораясь, и образуется оксид алюминия Al2O3.
4Аl + 3O2 = 2Al2O3 +Q
Алюминий соединяется с кислородом воздуха и при обычной температуре, на его поверхности тотчас образуется тончайшая, плотная плёнка, она трудно проницаема для кислорода и предохраняет металл от дальнейшего окисления.
Если же сильно нагреть фольгу алюминия или порошок алюминия, то они воспламеняются и сгорают ослепительным пламенем.
Способность порошка алюминия гореть ослепительным пламенем используется в пиротехнике – производстве бенгальских огней, салютов, фейерверков.
Алюминий реагирует со сложными веществами:
1.Так очищенный от оксидной плёнки алюминий способен реагировать с водой. От защитной плёнки можно избавиться механически (очистив поверхность наждачной бумагой) и химически, погрузив алюминий на несколько минут в раствор кислоты, щёлочи или в жидкую ртуть. В результате реакции с водой образуется гидроксид алюминия и водород.
2Al + 6H2O = 2Al(OH)3 + 3H2
- Одно из важнейших химических свойств алюминия – способность вытеснять металлы из их оксидов – используют в металлургии. Этим способом получают хром, железо, марганец, ванадий, титан, цирконий. Этот метод получения простых веществ металлов называется алюмотермией:
2Al + Cr2O3 = Al2O3 + 2Cr
Для получения высоких температур, используют реакцию, сгорания термитной смеси — смеси оксида железа (II и III) и порошка алюминия:
8Al + 3Fe3O4 =4 Al2O3 + 9Fe
Выделяющейся в этой реакции теплоты достаточно для расплавления получающегося железа, потому этот процесс используют для сварки и резки стальных изделий.
3. Как активный металл алюминий реагирует с растворами кислот с выделением водорода.
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб.) = Al2(SO4)3 + 3H2
А вот концентрированные серная и азотная кислоты пассивируют алюминий при обычной температуре, образуя на поверхности металла, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
С разбавленной азотной кислотой алюминий реагирует с образованием оксида азота (II):
Al + 4HNO3(разб.) = Al(NO3)3 + NO↑ + 2H2O
При нагревании Al растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
2Al + 6H2SO4(конц) = 4Al2(SO4)3 + 3SО2↑ + 6H2O
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2↑ + 3H2O
- Алюминий – амфотерныйметалл, поэтому он взаимодействует со щелочами.
При нагревании с конц. растворами щелочей алюминий образует комплексные соли (тетрагидроксоалюминаты), при этом выделяется водород.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
Применение
Большую часть производимого алюминия (его производство в мире стоит на 2-м месте после выплавки чугуна и стали) используют для производства сплавов. Они легки, относительно прочны, электропроводны, коррозионноустойчивы, поэтому находят широкое применение в различных областях техники и быту.
Сплавы алюминия используют в самолёто- и ракетостроении. Недаром алюминий называют крылатым металлом.
Алюминий используют для получения металлов, методом алюмотермии.
В строительстве: гофрированными листами алюминиевых сплавов покрывают крыши, а также строят из них различные складские помещения.
Высокая электрическая проводимость чистого алюминия используется в электротехнике. Из сплавов алюминия изготовляют электропровода.
Порошок алюминия сохраняет металлический блеск и используется как краска «серебрянка». Она не только придает красивый внешний вид изделиям и сооружениям, но и защищает их от химического разрушения.
Для защиты от солнечных лучей алюминиевой краской покрывают цистерны, предназначенные для перевозки нефтепродуктов и других горючих веществ.
Исследуя влияние алюминия на различные пищевые продукты, ученые установили, что при контакте пищи с алюминием не разрушаются витамины. Это открытие послужило причиной широкого применения алюминия в пищевой промышленности, в виде посуды из алюминия, а также в косметике и бытовой химии. Из алюминия изготавливают разнообразную аппаратуру, предназначенную для переработки пищевых продуктов в сахарной, кондитерской, маслобойной и других отраслях промышленности.
Сегодня на уроке мы узнали об алюминии: положение этого элемента в Периодической системе, строение его атома, нахождение в природе, физические и химические свойства металла алюминия, получение и применение алюминия.
Оксид | химическое соединение | Британника
Оксид , любой из большого и важного класса химических соединений, в котором кислород сочетается с другим элементом. За исключением более легких инертных газов (гелий [He], неон [Ne], аргон [Ar] и криптон [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
Как металлы, так и неметаллы могут достигать своих высших степеней окисления (т. Е. Отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом.Щелочные металлы и щелочноземельные металлы, а также переходные металлы и постпереходные металлы (в их более низких степенях окисления) образуют ионные оксиды, то есть соединения, содержащие анион O 2-. Металлы с высокой степенью окисления образуют оксиды, связи которых имеют более ковалентную природу. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионного к ковалентному наблюдается по мере перехода таблицы Менделеева от металлов слева к неметаллам справа.Такое же изменение наблюдается в реакции оксидов с водой и, как следствие, кислотно-щелочном характере продуктов. Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих ион OH — ) и образующихся основных растворов, тогда как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. таблицу).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
| Источник: Источник: W.Робинсон, Дж. Одом и Х. Хольцкло-младший, Химия: концепции и модели, округ Колумбия, Хит и Ко, 1992. | |||||||
| реакция оксидов с водой и кислотно-основной характер гидроксидов | Na 2 O дает NaOH (сильное основание). | MgO дает Mg (OH) 2 (слабое основание) | Al 2 O 3 не реагирует | SiO 2 не реагирует | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Cl 2 O 7 дает HClO 4 (сильная кислота) |
| связь в оксидах | Na 2 O ионный | MgO ионный | Al 2 O 3 ионный | SiO 2 ковалентный | P 4 O 10 ковалентный | SO 3 ковалентный | Cl 2 O 7 ковалентный |
Некоторые органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами.Таким образом, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические простые эфиры.
Оксиды металлов
Оксиды металлов — это твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас
Щелочные металлы и щелочноземельные металлы образуют три различных типа бинарных кислородных соединений: (1) оксиды, содержащие ионы оксидов, O 2-, (2) пероксиды, содержащие ионы пероксидов, O 2 2-, которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 —, которые также имеют ковалентные связи кислород-кислород, но с одним отрицательным зарядом меньше, чем ионы пероксида. Щелочные металлы (которые имеют степень окисления +1) образуют оксиды M 2 O, пероксиды M 2 O 2 и супероксиды MO 2 .(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2MNO 3 + 10M + тепло → 6M 2 O + N 2
Обычное получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2
И оксиды щелочных металлов, и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M (OH) 2 (где M = металл группы 2)
Таким образом, эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-основных реакциях с образованием солей и воды; Например,
M 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1).
Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Периодические тренды оксидов тщательно изучены. В любой данный период связывание в оксидах прогрессирует от ионного к ковалентному, и их кислотно-основной характер изменяется от сильно основного до слабоосновного, амфотерного, слабокислого и, наконец, сильнокислого. В общем, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO
CoO + 2H 3 O + → Co 2+ + 3H 2 O.Оксиды со степенью окисления +5, +6 и +7 являются кислыми и реагируют с растворами гидроксида с образованием солей и воды; Например,
CrO 3 + 2OH — → CrO 4 2− + H 2 О.
Эти оксиды с степенью окисления +4 обычно являются амфотерными (от греческого amphoteros, «в обоих направлениях»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды растворяются не только в кислых, но и в основных растворах.Например, оксид ванадия (VO 2 ) представляет собой амфотерный оксид, растворяющийся в кислоте с образованием синего иона ванадила, [VO] 2+ , и в основании с образованием желто-коричневого гипованадат-иона, [V 4 O 9 ] 2-. Амфотеризм среди оксидов основной группы в основном обнаруживается с металлоидными элементами или их ближайшими соседями.
| 1968 | «Аноды со стабильными размерами» с оксидным покрытием для хлорщелочной промышленности: H.Пиво, Бельг. Пат. 710551 (1968), US 362492 (1972), US 4052271 (1977) |
| A. Martinsons et al., US 3562008 (1971) | |
| V. Hock et al., US 5055169 (1991) | |
| 1972 | США 3634736, Standard Oil Co . Огайо . (США): пастовые электроды из активированного угля или карбидов или боридов металлов (например, BC, WC) |
| US 3652902, IBM (США), пластины из активированного угля, разделенные пористой инертной прокладкой, пропитанной КОН или H 2 SO 4 | |
| 1983 | EP 0078404, CD 1196683 (1985): электроды с керамическим оксидным покрытием и псевдоемкость |
| 1986 | US 4633372, Standard Oil Co . Огайо . (США): полиоксометаллат, адсорбированный на активированном угле, например, H 5 (PV 2 Mo 10 O 40 ), (NH 4 ) 6 (P 2 Mo 18 O 62 ) |
| 1988 | Нитрид молибдена, полученный реакцией химического осаждения из паровой фазы между MoCl 5 и NH 3 при 500… 800 ° C или реактивным пиролизом распылением MoO 3 |
| США 4766522, Hughes Aircraft Co .(США): оксиды Pt и Ir в твердом электролите | |
| 1990 | JP 2085387, Japan Gore Tex Inc . (Япония): углеродный порошок, поддерживающий металл семейства Pt или порошок RuO 2 , IrO 2 или PbO 2 , связанный ПТФЭ или ионообменной смолой, например, сополимер тетрафторэтиленсульфонилфторида и винилового эфира |
| 1992 | US 5079674, Motorola (США): оксиды, хлориды, нитриды и другие соли Ru, Ta, Rh, Zr, Co, Ni, Mo, W, V, нанесенные на пористый углерод и связанные в матрице из фторполимер |
| US 5136474, Giner Inc. (США): Порошки RuO 2 на связке PTFE на Nafion 117 | |
| США 5151848, ВВС США : Титан, покрытый RuO 2 и пропитанный твердым полимерным электролитом персульфоновой кислотой при давлении 1000 бар | |
| 1994 | WO 9407272, Pinnacle Research Institute (США): биполярные электроды из RuO 2 / Ti; см. текст |
| DE 4313474, EP 0622815, Dornier (Daimler Group, Германия): гидрат оксида рутения термическим и осажденным методами на никелевой и углеродной бумажной основе | |
| JP 6345441, Japan Energy Corp .: Гидрат оксида рутения RuO 2 · x H 2 O с однородным размером частиц за счет восстановления предшественника рутения (V или более) в водном растворе | |
| США 551164, Институт Фронцевича (Киев, Украина) ): Халькогениды висмута, например, Bi 2 Te 3 , Bi 2 Se 3 | |
| 1995 | US 5429893, Motorola (США): электроды из оксида металла и активированного угля в водной и неводный раствор |
| US 5392191, Motorola (США): оксиды V, Zr, Hf, Ti, Nb, Sc со связанным хлором (MO 1.68 Cl 0,68 ), смешанный с углеродом и полимером | |
| US 5388025, Motorola (США): металлоцен, порфирин металла, ацетилацетонат металла, металлоорганический полимер, бипиридин металла, например ацетилацетонат марганца, фталоцианин никеля | |
| 1996 | JP 8268722, Sumitomo Metal Mining Co . (Япония): порошок RuO 2 для толстопленочных резисторов. Водный раствор частиц RuO 2 в КОН или NaOH выпаривают, а оставшиеся частицы RuO 2 , покрытые гидроксидом, обжигают при 200–1000 ° C, промывают и сушат |
| Pinnacle Research (США ): Исследование нитридов молибдена, титана и железа. 9815961: Dornier & amp; ZSW (Германия): Перовскиты для суперконденсаторов | |
| 2000 | US 6025020: Углеродный порошок или углеродные волокна в целлюлозной матрице в качестве шаблона для высокодисперсного аморфного гидрата RuO 2 (нагреванием источника рутения в паровая атмосфера при & lt; 500 ° C) |
| 2002 | WO 0235635, Kim Kwang Bum (Корея): Производство тонкопленочного электрода из гидрата RuO 2 |
| DE 10053276, Dornier (Германия): Наноструктурированный пленочный электрод из игольчатых элементов (напр.g., Al 2 O 3 ), закрепленный на поверхности | |
| US 6496357, Ness Capacitor Co . (Корея): аморфный диоксид марганца. Токоприемник: никель, медь или алюминий. Электролит: соли лития и аммония в пропиленкарбонате или ацетонитриле, например, LiBF 4 , LiClO 4 , LiPF 6 , Et 4 NBF 4 , Et 4 NPF 6 , Et 4 NClO 4 , MeEt 3 NBF 4 |
Natural Oxide — обзор
4.1 Номенклатура
Фосфор — пятивалентный элемент, а его естественный оксид — P 2 O 5 , пятиокись фосфора. Это очень гигроскопичный порошок, который легко реагирует с водой с образованием фосфорной кислоты (H 3 PO 4 ) в сильно экзотермической реакции. Эта кислота при взаимодействии с различными щелочными соединениями образует фосфаты. Эти и другие модифицированные соединения представляют собой линейные или цепные, циклические или кольцевые полимеры и кристаллы с разветвленной цепью. Поскольку эти соединения являются полимерными, фосфаты могут обеспечивать непрерывную структуру и, следовательно, образовывать хорошую керамику.Для получения подробной информации читатель отсылается к книге « Topics in Phosphorus Chemistry » Вестмана [1]. Из-за разнообразия полимерных соединений, образованных фосфором, в химии фосфатов используется систематическая номенклатура.
Линейные или цепные полимеры представлены формулой:
(4.1) Mn + 2PnO3n + 1x,
, где M — валентный катион x , а n — целое число. Обозначение nx представляет количество атомов фосфора в молекуле или «длину цепи».Для n = 1 используется префикс «орто», а для n = 2 — префикс «пиро». Таким образом, если M представляет собой водород ( x = 1) и n = 1, формула (4.1) дает H 3 PO 4 , которая представляет собой ортофосфорную кислоту, обычно называемую просто фосфорной кислотой. Для n = 2 формула дает H 4 P 2 O 7 , т.е. пирофосфорную кислоту. Если M — одновалентный металл, такой как натрий, формула дает Na 3 PO 4 (ортофосфат натрия) для n = 1 и Na 3 P 2 O 7 (пирофосфат натрия) для n = 2.Если M представляет собой двухвалентный металл, такой как кальций ( x = 2), формула дает Ca 3 (PO 4 ) 2 (ортофосфат кальция) для n = 1 и Ca 4 ( P 2 O 7 ) 2 , что аналогично Ca 2 P 2 O 7 (пирофосфат кальция), для n = 2. Как и в случае фосфорной кислоты, поскольку большинство соединений, упомянутых в этой книге, являются ортофосфатами, мы опустим префикс «орто» и будем просто называть ортофосфаты фосфатами.Таким образом, ортофосфат натрия будет фосфатом натрия, а ортофосфат кальция будет называться фосфатом кальция. Для n = 3, 4 и т.д. используются термины триполифосфат, тетраполифосфат и т.д., а соответствующими кислотами являются триполифосфорная и тетраполифосфорная кислоты.
Фосфаты с кольцевой или циклической структурой представлены общей формулой:
(4,2) MPO3xn,
, где n > 2. Для этих соединений используется префикс «мета».Таким образом, H 3 PO 3 , Na 3 PO 3 и Ca 3 (PO 3 ) 2 представляют собой метафосфорную кислоту, метафосфат натрия и метафосфат кальция соответственно.
Формула (4.1) записана для одного катиона в молекуле. В цепи может быть более одного катиона. В случае ортофосфатов примеры включают различные гидрофосфаты или продукты, такие как фосфат магния-калия или алюмофосфаты цинка, которые обсуждались в главе 2.Обобщение формулы (4.1) для ортофосфатов можно сделать, заменив M на AB, где общая валентность A и B равна x , а n = 1. Таким образом, общая формула принимает вид
(4.3) AmBnPO4mx + ny / 3.
Когда A = B = M, и, следовательно, x = y , мы получаем формулу (4.1) с m + n = 3. Запись A = Mg, B = K, m = 1 и n = 1 в формуле (4.3), мы получаем MgKPO 4 , поскольку в этом случае x = 2 и y = 1, что является нейтральным и нерастворимым соединением.Как обсуждалось в главе 2, такие молекулы с более чем одним катионом образуют CBPC. Если и A, и B представляют собой H с суффиксом больше 1, то эти соединения являются кислыми фосфатами и могут использоваться в качестве компонентов для производства керамики. Примерами являются растворимые соединения металлов, такие как KH 2 PO 4 , (NH 4 ) 2 HPO 4 или Al (H 2 PO 4 ) 3 . Таким образом, соединения с более чем одним типом катиона могут быть связующими компонентами или конечными керамическими изделиями, в зависимости от того, являются ли они растворимыми и кислыми или нерастворимыми и нейтральными.
Периодические тенденции и оксиды
Оксиды
Основные оксиды
Оксид-ион является сильно основным анионом из-за его очень маленького размера и высокого заряда. Поскольку гидроксид-ион является самым сильным основанием, которое может оставаться в воде, оксид-ион количественно реагирует с водой с образованием гидроксид-ионов. Это пример свойства выравнивания очень сильных оснований.
Согласно обобщенным правилам растворимости, в воде растворяются только оксиды металлов некислотного и слабокислого катиона.Растворение является сильно экзотермическим, с образованием гидроксида катиона. Эти водные растворы сильно щелочны. Оксиды металлов, которые проявляют такое поведение, называются основными оксидами, потому что они действуют как основания. Оксиды некислотных катионов настолько реактивны с водой, что их редко можно увидеть. Эти оксиды нельзя получить путем дегидратации гидроксида при высокой температуре.
Чаще встречаются оксиды слабокислых катионов. Известь, CaO является примером. Известь можно получить коммерчески путем термического разложения известняка.
Оксиды слабокислых катионов экзотермически реагируют с водой с образованием гидроксида.
Гидроксиды слабокислых катионов не расплываются.
Оксиды слабокислых катионов и умеренно кислых катионов нерастворимы в воде. Эти оксиды не вводят в раствор значительных количеств иона O 2–, поэтому гидроксид-ионы не образуются. Хотя эти оксиды существенно не изменяют pH воды, они по-прежнему являются основаниями и нейтрализуют сильные кислоты.
FeO + 2 H 3 O + (водн.) Fe 2+ (водн.) + 3 H 2 O
Кислотные оксиды (ангидриды кислот)
Многие ковалентные оксиды очень кислых катионов (гипотетически) обладают кислотными свойствами.
Многие из этих оксидов растворяются в воде с образованием оксоаниона, в котором элемент имеет ту же степень окисления, что и оксид.
Оксид будет растворимым, если его реакция с водой дает сильную или очень сильную кислоту, потому что эти кислоты ионизируются, полностью сдвигая равновесие в сторону растворения.Если реакция с водой дает умеренно кислую оксикислоту, оксид может быть растворимым или нерастворимым. Если образующаяся оксокислота является слабокислой, оксид обычно, но не всегда, нерастворим в воде.
Некоторые кислотные оксиды, такие как оксиды серы и азота, являются загрязнителями воздуха, поскольку они вступают в реакцию с влагой воздуха с образованием кислотных дождей.
Нерастворимые в воде оксиды классифицируются как кислые, если они реагируют с основаниями с образованием солей.
Есть несколько оксидов, таких как NO 2 и ClO 2 , в которых центральный атом
степень окисления не соответствует степени окисления этого элемента в стабильной или
известная оксокислота.Такие оксиды образуют смесь оксокислот или анионов путем диспропорционирования 2 NO 2 + 2 OH — NO 2 — + NO 3 — + H 2 O
Амфотерные оксиды
Некоторые оксиды проявляют как кислотные, так и основные свойства.
Общие правила
В общем, электроположительный характер центрального атома оксида будет определять, будет ли
оксид будет кислым или основным. Чем более электроположен центральный атом, тем щелочнее оксид.Чем электроотрицательнее центральный атом, тем кислотнее оксид. Электроположительный символ увеличивается справа
влево по периодической таблице и увеличивается вниз по столбцу.
Результирующая граница между основными и кислотными оксидами проходит по диагонали.
| Свойства s — и p -Блочные элементы | ||||||
| Ли | Be | B | С | N | O | F |
| Na | мг | Al | Si | -п. | S | Класс |
| К | Ca | Ga | Ge | As | SE | рублей |
| руб. | Sr | В | Sn | Сб | Te | I |
| CS | Ba | Tl | Пб | Bi | Po | в |
| Основные оксиды | Амфотерные оксиды | Кислые оксиды | ||||
Есть три оксида неметаллов из верхней правой части таблицы Менделеева, CO, NO и N 2 O, которые имеют
такие низкие степени окисления для центрального атома, что они дают нейтральные водные растворы.
Поскольку кислотность катиона быстро возрастает с зарядом, d -блокирующие элементы, которые
проявлять широкий спектр степеней окисления, может иметь один или несколько оксидов, которые проявляют только
основные свойства и один или несколько оксидов, которые проявляют только кислотные свойства. Чем выше
степень окисления более кислый соответствующий оксид. Хром является примером такого элемента.
| Оксид | Окислительное число | Категория |
| CrO | Кр 2+ | базовый |
| Cr 2 O 3 | Кр 3+ | амфотерный |
| CrO 3 | Кр 6+ | кислая |
Основные оксиды реагируют с кислыми оксидами с образованием солей оксоанионов.
Поскольку вода не содержит солей оксоанионов, которые являются слишком основными, чтобы сохраняться в
может образоваться вода. Эти реакции кислотных и основных анионов имеют важное практическое значение.
применения, например, для контроля газообразных кислотных оксидов, которые при выбросе в атмосферу
приводят к кислотному дождю. Ca (OH) 2 + SO 2 + 1/2 O 2 CaSO 4 + H 2 O
Эти реакции также используются в производстве таких материалов, как бетон, стекло и керамика.
Части Периодической таблицы
Группа 2A (или IIA ) периодической таблицы — щелочные соединения .
земные металлы : бериллий (Be), магний (Mg), кальций (Ca),
стронций (Sr), барий (Ba) и радий (Ra). Они тяжелее и
менее реакционноспособен, чем щелочные металлы Группы 1А. Имя приходит
из-за того, что оксиды этих металлов давали основные растворы
при растворении в воде, и они оставались твердыми при температурах
доступный древним алхимикам.Как и элементы Группы 1А,
щелочноземельные металлы слишком реактивны, чтобы их можно было найти в природе в их
элементальная форма.
Щелочноземельные металлы имеют два валентных электрона на орбиталях самых высоких энергий.
( нс 2 ). Они меньше, чем щелочные металлы
того же периода и, следовательно, имеют более высокую энергию ионизации. В большинстве случаев щелочноземельные металлы ионизированы.
для формирования заряда 2+.
Щелочноземельные металлы имеют гораздо более высокие температуры плавления, чем щелочные металлы.
металлы: бериллий плавится при 1287 ° C, магний при 649 ° C, кальций при 839 ° C,
стронций при 768 ° C, барий при 727 ° C и радий при 700 ° C. Они есть
более твердые металлы, чем элементы группы 1А, но мягкие и легкие
по сравнению со многими переходными металлами.
Соли металлов группы 2А менее растворимы в воде, чем соли металлов
Группа 1А из-за более высокой плотности заряда на катионах 2+;
тем не менее, многие соли Группы 2А, по крайней мере, умеренно растворимы.
Некоторые соли Группы 2A прочно связываются с молекулами воды и кристаллизуются в виде гидратов ;
среди них — английская соль, MgSO 4 7H 2 O и гипс,
CaSO 4 2H 2 О.
Бериллий (Be, Z = 4).
Бериллий — серебристо-белый мягкий металл. Его название происходит от
греческое слово, обозначающее минерал берилл, beryllo . Он находится в
земная кора при концентрации 2.6 частей на миллион, что делает его 47-м по количеству
обильный элемент. Первичные руды
бериллия являются бериллами [силикат бериллия-алюминия, Be 3 Al 2 (SiO 3 ) 6 ]
и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ].
Бериллы ювелирного качества включают изумруды и аквамарин; зеленый цвет
из этих драгоценных камней происходит из следовых количеств хрома.
Из-за своего небольшого размера и высокой плотности заряда бериллий связывает
через ковалентную связь вместо ионной связи.Элементаль
бериллий очень инертен по отношению к воздуху и воде даже при высоких
температуры.
Из бериллия делают окна для рентгеновских трубок (это
прозрачен для рентгеновских лучей) и используется в сплавах с другими металлами, такими как
медь и никель, для изготовления искробезопасных инструментов и часовых пружин.
Бериллий также используется в оболочках для ядерного оружия и в ядерной энергетике.
электростанции из-за его способности отражать нейтроны. Бериллий
накапливается в костях; длительное воздействие бериллия приводит к
воспаление легких и одышка (состояние, называемое бериллиозом).
Магний (Mg, Z = 12).
Магний — серебристо-белый относительно мягкий металл. Название элемента происходит от
Магнезия, район в Фессалии в центральной Греции. Он находится в
земная кора с концентрацией 2,3%, что делает ее 7-й по величине
обильный элемент. Большое количество магния также присутствует в
минералы в мантии Земли. Его получают из морской воды, карналита.
[MgKCl 3 6H 2 O], доломит
[смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Магний, легированный алюминием и следами других металлов, используется в
автомобилестроение и авиастроение; магниевые сплавы также используются в других
легкие устройства, такие как лестницы, фотоаппараты, велосипедные рамы, жесткий диск
приводы и т. д. Магний окисляется легче, чем железо, и
используется в расходных анодах для защиты железных труб и других
структуры, которые легко подвержены коррозии.
Магний горит на воздухе бриллиантом.
белое пламя
и используется в фейерверках и зажигательных бомбах.(Это было
используется в одноразовых лампах-вспышках, но это использование было вытеснено другими
виды освещения.) Магниевые костры ставить очень сложно
наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с
азот с образованием нитрида магния (Mg 3 N 2 ), и
с водой для получения гидроксида магния и газообразного водорода.
Магний содержится в ряде знакомых соединений. Магний
оксид MgO используется в огнеупорных кирпичах, которые способны
выдерживает высокие температуры в каминах и печах (магний
оксид плавится при 2800 ° С).Гептагидрат сульфата магния, MgSO 4 7H 2 O,
более известная как английская соль, это
миорелаксант и легкое слабительное. Гидроксид магния, Mg (OH) 2 ,
также известное как молоко магнезии, слабительное и антацидное средство.
(«Молоко» в «молоке магнезии» относится к тому факту, что магний
гидроксид плохо растворяется в воде, он имеет тенденцию к образованию мелового, белого цвета.
суспензия, внешне похожая на молоко, но значительно
физиологические эффекты.)
Зеленые растения содержат молекулу, называемую
хлорофилл, состоящий из плоского кольца атомов углерода и азота
с большим открытым пространством посередине, в котором связан ион магния,
удерживается на месте атомами азота. В
Молекула хлорофилла поглощает солнечный свет, и в процессе
фотосинтез, энергия света преобразуется в химическую
энергия, которую завод может использовать для питания множества процессов.
В органической химии магний реагирует с бромалканами.
(углеводороды, содержащие связи углерод-бром) с образованием магнийорганических соединений
реактивы Гриньяра (в честь их первооткрывателя Виктора
Гриньяр, лауреат Нобелевской премии по химии 1912 г.). Эти соединения чрезвычайно полезны при формировании
новый углерод-углерод
связи, и часто используются в синтезе органических соединений. Реагенты Гриньяра, как известно, чувствительны к воде, поэтому необходимо соблюдать осторожность.
приняты для обеспечения того, чтобы аппарат, в котором протекает реакция
выполняется очень сухо.
Кальций (Ca, Z = 20).
Кальций — относительно мягкий металл серебристого цвета. Название элемента происходит от
латинское слово, обозначающее лайм, calx . Он находится в
земная кора с концентрацией 4,1%, что делает ее 5-й по величине
обильный элемент. Основными источниками кальция являются кальцит и известняк.
[карбонат кальция, CaCO 3 ], ангидрит [кальций
сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция,
CaSO 4 2H 2 O],
и доломит [смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ].
Соли кальция образуют твердые части тела большинства живых
существа, из раковин морских организмов и кораллов кораллов
рифы (в виде кальция
карбонат, CaCO 3 ) к костям и зубам наземных
существа (в виде гидроксиапатита
кристаллы, Ca 3 (PO 4 ) 2 ] 3 Ca (OH) 2 ).
Поскольку кальций образует такие твердые минералы, он полезен в строительстве
материалы, такие как штукатурка, раствор и цемент.Строительный раствор изготавливается из оксида кальция, CaO, также известного как известь, или негашеная известь. Когда оксид кальция обрабатывается водой, он образует гидроксид кальция,
Ca (OH) 2 , или гашеная известь, поглощающая углекислый газ из
воздух и постепенно образует карбонат кальция, CaCO 3 .
Известь, нагретая водородом в кислороде, горит ярко-белым.
свет, который можно сфокусировать в узкий луч, видимый на большом
расстояния. Такое освещение использовалось в маяках, в
съемку, а в театрах ставить софиты (оставив актера «в
в центре внимания «).
Хлорид кальция — это расплывчатый (он поглощает достаточно воды из
воздух, который растворяется в растворе) и используется для удаления влаги
с воздуха в сырых подвалах. (Потребовался бы более сильный человек
что я сопротивляюсь тому, чтобы называть свежеоткрытую коробку хлористого кальция,
не вёл себя должным образом как «молодой расплывающийся организм».)
«Жесткая вода» содержит растворенные минералы, имеющие 2+ или 3+ заряда,
такой как кальций и магний; эти соли вызывают некоторые мыла и
моющие средства для выпадения в осадок в виде «мыльной пены»; эти минералы выпадают в осадок
со временем образует «накипь» в воде
обогреватели и кастрюли.Кальций можно удалить водой
смягчители, которые обменивают ионы кальция на ионы натрия, которые имеют
1+ и не выпадают в осадок.
Стронций (Sr, Z = 38).
Стронций — блестящий, относительно мягкий металл. Название элемента происходит от
Стронтиан, город в Шотландии, где был добыт минерал стронтианит.
открыли, из которого впервые был выделен стронций.Он находится в
земная кора с концентрацией 370 частей на миллион, что делает ее 16-м по величине
обильный элемент. Встречается в рудах целестита [стронция
сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
Соли стронция при нагревании дают ярко-красный цвет и
по этой причине используется в фейерверках и осветительных ракетах. Радиоактивный
стронций-90 (бета-излучатель) образуется при ядерных взрывах; поскольку
он химически похож на кальций, он включается в кости
у людей, которые подвергаются этому.Стронций-90 — бета-излучатель,
и препятствует выработке красных кровяных телец.
Барий (Ba, Z = 56).
Барий — блестящий мягкий металл. Название элемента происходит от
греческое слово barys , что означает «тяжелый», применительно к
высокая плотность некоторых минералов бария. Он находится в
земная кора с концентрацией 500 ppm, что делает ее 14-й по величине
обильный элемент.Он содержится в рудах барита [сульфат бария,
BaSO 4 ] и витерит [карбонат бария, BaCO 3 ].
Барий был обнаружен в
1500-х годов в виде «болонских камней» (ныне известных как барий
сульфат, BaSO 4 ), обнаруженный недалеко от Болоньи, Италия. Эти
камни светились как при свете, так и при нагревании.
Соли бария при нагревании приобретают зеленый цвет и используются в
фейерверк (в виде нитрата бария, Ba (NO 3 ) 2 ).
Сульфат бария, BaSO 4 , ядовит, но это так
нерастворим в том, что он проходит через тело до абсорбции
барий может иметь место. Используется при диагностике некоторых
проблемы с кишечником в виде «бариевых клизм»: сульфат бария
непрозрачен для рентгеновских лучей и может использоваться для рентгена пищеварительной системы.
тракт.
Радий (Ra, Z = 88).
Радий — мягкий блестящий радиоактивный металл.Имя элемента
произошло от латинского слова «луч», , радиус , так как
способность светиться в темноте слабым голубым светом. Он находится в
земной коры с концентрацией 0,6 ppt (частей на триллион), что делает ее
84-й элемент по распространенности. Он содержится в следовых количествах в
урановые руды, но коммерчески используемый радий легче получить из
отработавшее ядерное топливо.
Радий был открыт
Пьера и Марии Кюри в 1898 году; они добыли миллиграмм радия
из трех тонн урановой руды.Радий производится в
радиоактивный распад урана-235, урана-238, тория-232 и
плутоний-241. После его открытия и до опасностей
радиация были поняты, радий использовался во многих шарлатанских лекарствах и
запатентованные лекарства. Из радия сделали светящиеся в темноте часы
лица начала 1900-х годов; альфа-частицы, испускаемые радием
ударил частицы сульфида цинка, заставив их светиться, но остановился
по корпусу часов по стеклу в циферблате.Многие из
рабочие, рисовавшие эти циферблаты, заболели или умерли от
лучевая болезнь.
Список литературы
Джон Эмсли, Элементы , 3-е издание.
Оксфорд: Clarendon Press, 1998.
Джон Эмсли, Строительные блоки природы:
Путеводитель по элементам от А до Я . Оксфорд: Оксфордский университет
Пресс, 2001.
Дэвид Л.Хейзерман, Исследование
Химические элементы и их соединения . Нью-Йорк: TAB
Книги, 1992.
оксидов азота | UCAR Center for Science Education
Оксид азота (NO) и диоксид азота (NO 2 ) — два газа, молекулы которых состоят из атомов азота и кислорода. Эти оксиды азота вносят свой вклад в проблему загрязнения воздуха, играя роль в образовании как смога, так и кислотных дождей.Они выбрасываются в атмосферу Земли как из естественных, так и из антропогенных источников.
Оксид азота — это бесцветный горючий газ с легким запахом. Двуокись азота — это темно-красно-оранжевый газ, который ядовит, но не воспламеняется. Он вместе с аэрозолями отвечает за красновато-коричневый цвет смога. В высоких концентрациях он очень токсичен и может вызвать серьезное повреждение легких. Двуокись азота является сильным окислителем и поэтому очень реактивна с другими соединениями.
Источники оксидов азота
По оценкам ученых, природа ежегодно производит от 20 до 90 миллионов тонн оксидов азота на Земле.Природные источники включают вулканы, океаны, биологический распад и удары молний. В результате деятельности человека в нашу атмосферу ежегодно попадает еще 24 миллиона тонн оксидов азота.
Четыре представления химики используют для диоксида азота (NO 2 ).
Кредит: UCAR (Рэнди Рассел)
И NO, и NO 2 образуются во время высокотемпературного горения в атмосфере, когда кислород соединяется с азотом. Выхлопные газы легковых и грузовых автомобилей являются основными источниками оксидов азота, как и выбросы электростанций.Выхлопные газы автомобилей содержат больше NO, чем NO 2 , но как только NO попадает в атмосферу, он быстро соединяется с кислородом воздуха с образованием NO 2 .
Окиси азота как загрязнители
Оксиды азота, по крайней мере, частично ответственны за несколько типов загрязнения воздуха. Двуокись азота придает свой цвет красновато-коричневой дымке, которую мы называем смогом. Фотодиссоциация диоксида азота под действием солнечного света производит оксид азота и озон в тропосфере, который является еще одним компонентом смога.Серия химических реакций превращает летучие органические соединения (ЛОС) в вещества, которые соединяются с диоксидом азота с образованием ПАН (пероксиацитилнитрата), еще одного элемента в смоге. Двуокись азота в воздухе также вступает в реакцию с водяным паром с образованием азотной кислоты, одного из типов кислот в кислотных дождях.
Концентрация диоксида азота в незагрязненном воздухе составляет около 10 частей на миллиард (ppb). В смоге концентрация повышается в двадцать раз до примерно 200 частей на миллиард.
Использование оксидов азота
Хотя оксиды азота получили сомнительное признание в качестве загрязнителей, они также с успехом используются в некоторых промышленных процессах.Оксид азота производится в больших масштабах и впоследствии используется для производства азотной кислоты (HNO 3 ). Чтобы создать оксид азота для промышленного использования, химики объединяют аммиак (NH 3 ) с кислородом (O 2 ), выделяя воду (H 2 O) в качестве побочного продукта. Соединения азота, полученные из азотной кислоты, используются для создания химических удобрений, взрывчатых веществ и других полезных веществ.
Химические формы уранаОписание общих соединений урана. Химические формы уранаУран может принимать различные химические формы. В природе уран обычно находится в виде оксида, например, в минеральной уране оливково-зеленого цвета. Оксид урана также является химической формой, наиболее часто используемой для ядерного топлива. Уран-фторсодержащие соединения также широко используются при переработке урана, из которых наиболее распространены гексафторид урана (UF 6 ) и тетрафторид урана (UF 4 ). В чистом виде уран — металл серебристого цвета. Оксиды урана — U3 O 8 и UO 2 Наиболее распространенными формами оксида урана являются U 3 O 8 и UO 2 . Обе оксидные формы представляют собой твердые вещества, которые имеют низкую растворимость в воде и относительно стабильны в широком диапазоне условий окружающей среды. Октаоксид триурана (U 3 O 8 ) является наиболее стабильной формой урана и наиболее часто встречающейся в природе формой. Диоксид урана (UO 2 ) — это форма, в которой уран чаще всего используется в качестве топлива для ядерных реакторов.При температуре окружающей среды UO 2 постепенно преобразуется в U 3 O 8 . Из-за их стабильности оксиды урана обычно считаются предпочтительной химической формой для хранения или захоронения. Гексафторид урана (UF6 ) Гексафторид урана (UF 6 ) представляет собой химическую форму урана, которая используется в процессе обогащения урана. В разумном диапазоне температуры и давления он может быть твердым, жидким или газообразным.Твердый UF 6 представляет собой белый плотный кристаллический материал, напоминающий каменную соль. Гексафторид урана не реагирует с кислородом, азотом, углекислым газом или сухим воздухом, но он реагирует с водой или водяным паром (включая влажность в воздухе). Когда UF 6 вступает в контакт с водой, например с водяным паром в воздухе, UF 6 и вода вступают в реакцию, образуя коррозионный фтористый водород (HF) и фтористое соединение урана, называемое фторидом уранила (UO 2 F 2 ).По этой причине UF 6 всегда обрабатывается в герметичных контейнерах и технологическом оборудовании. Хотя UF 6 очень удобен для обработки, он не считается предпочтительной формой для длительного хранения или захоронения из-за его относительной нестабильности. Тетрафторид урана (UF4 ) Тетрафторид урана (UF 4 ) часто называют зеленой солью из-за его характерного цвета. Как правило, он является промежуточным звеном при превращении UF 6 либо в оксид урана (U 3 O 8 или UO 2 ), либо в металлический уран, поскольку он может быть легко преобразован в любую из этих форм.UF 4 представляет собой твердое вещество, состоящее из агломерирующих частиц с текстурой, похожей на пищевую соду. Он нелетуч, негигроскопичен, но мало растворим в воде. После воздействия воды UF 4 медленно растворяется и подвергается гидролизу, образуя несколько возможных соединений урана и фтороводород (HF). Время гидролиза может быть значительным. Хотя он и не так стабилен, как оксиды урана, несколько недавних исследований показали, что UF 4 может быть пригодным для захоронения. Металлический уранМеталлический уран тяжелый, серебристо-белый, податливый, пластичный и более мягкий, чем сталь. Это один из самых плотных известных материалов (19 г / см 3 ), он в 1,6 раза плотнее свинца. Металлический уран не так стабилен, как U 3 O 8 или UO 2 , поскольку он подвержен окислению поверхности. На воздухе он тускнеет, а оксидная пленка препятствует дальнейшему окислению массивного металла при комнатной температуре. |
