Содержание
Общая характеристика оксидов — урок. Химия, 8–9 класс.
Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
В оксидах химический элемент кислород находится в степени окисления \(–2\).
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
Примеры оксидов:
h3O — оксид водорода, или вода.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
CO2 — оксид углерода(\(IV\)), двуокись углерода или углекислый газ.
Как вы уже знаете, углекислый газ нужен зелёным растениям для фотосинтеза. Оксид углерода(\(IV\)), находящийся в твёрдом агрегатном состоянии, называют сухим льдом.
CO — оксид углерода(\(II\)), угарный газ.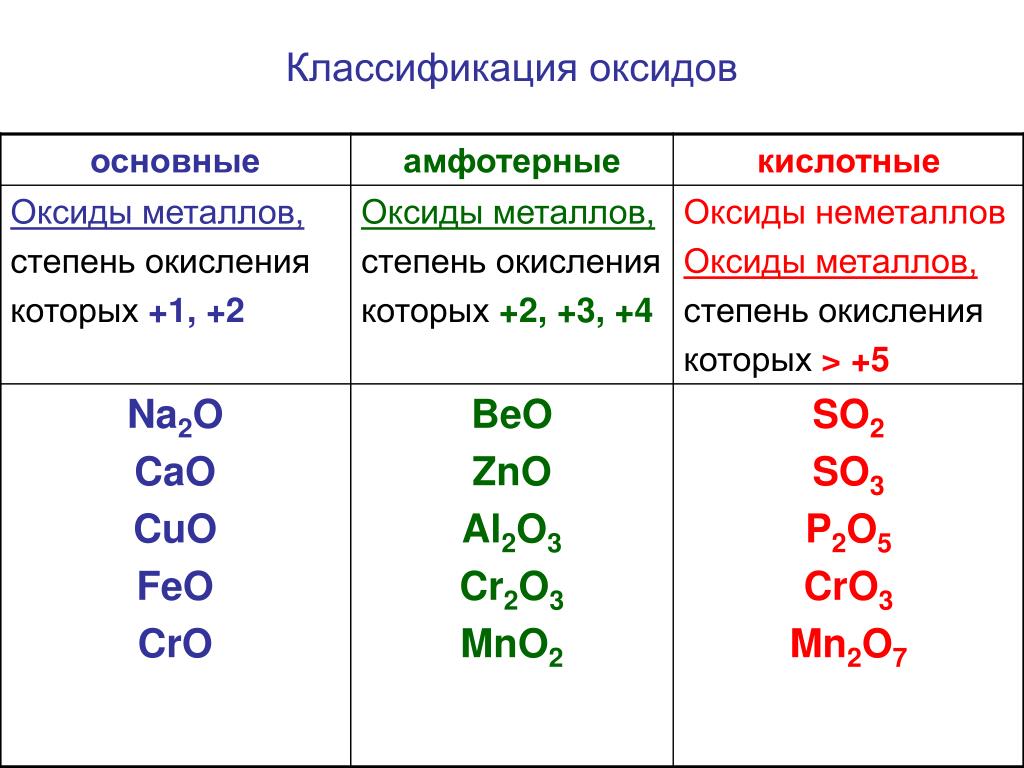
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
Fe2O3 — оксид железа(\(III\)).
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
SiO2 — оксид кремния(\(IV\)).
В природе встречается в виде кварцевого песка, кварца, горного хрусталя.
Классификация оксидов
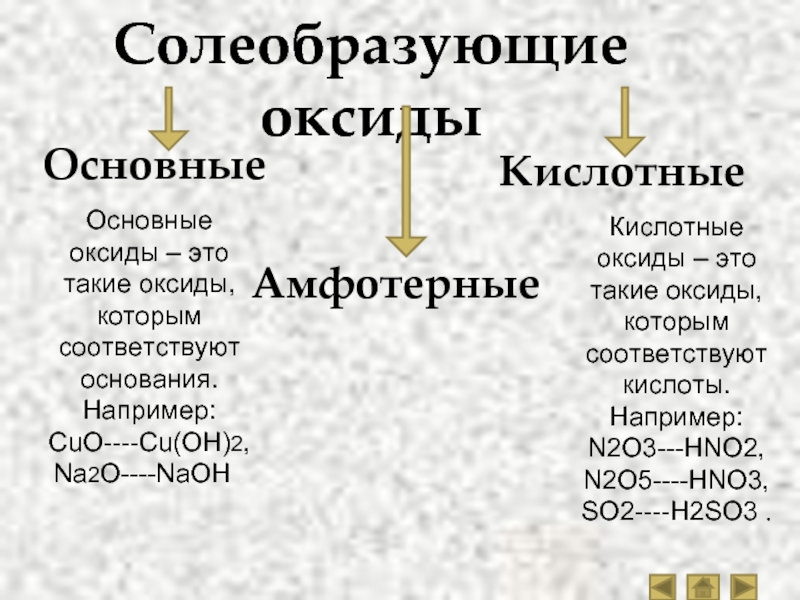
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
- Основные оксиды.

Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основный оксид, является невысокой: \(+1\) или \(+2\).
Примеры основных оксидов:
оксид натрия Na2O, оксид меди(\(II\)) CuO.
- Кислотные оксиды.
Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду.
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы(\(VI\)) SO3, оксид азота(\(IV\)) NO2.
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от \(+5\) до \(+8\). Например, оксид хрома(\(VI\)) CrO3 и оксид марганца(\(VII\)) Mn2O7.
- Амфотерные оксиды.
Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
Амфотерные свойства проявляет оксид цинка ZnO, оксид алюминия Al2O3, оксид бериллия BeO.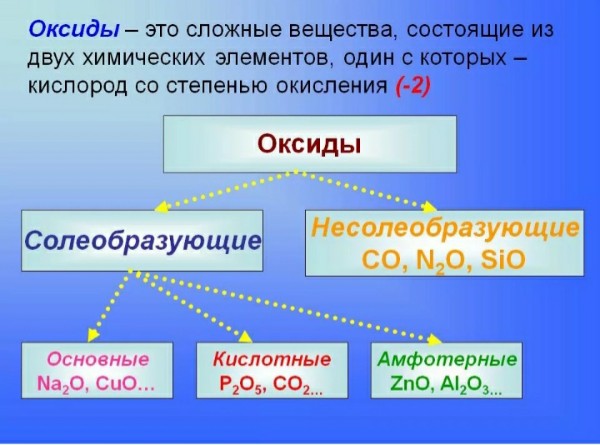
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
Например, хром может проявлять валентность равную двум, трём, шести.
Амфотерными свойствами обладает именно оксид хрома(\(III\)) Cr2O3.
- Несолеобразующие оксиды.
Несолеобразующие оксиды — оксиды, не реагирующие с кислотами или основаниями при обычных условиях.
К ним относятся: оксид углерода(\(II\)) CO, оксид кремния(\(II\)) SiO ,оксид азота(\(I\)) N2O, оксид азота(\(II\)) NO.
Они не имеют кислотных гидроксидов, не вступают в реакции с образованием солей.
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Например: Na2O — оксид натрия, Al2O3 — оксид алюминия.
Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например: Cu2O — оксид меди(\(I\)), CuO — оксид меди(\(II\)), FeO — оксид железа(\(II\)), Fe2O3 — оксид железа(\(III\)), Cl2O7 — оксид хлора(\(VII\)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Например: монооксид углерода CO, диоксид углерода CO2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ CO, серный ангидрид SO3 и т.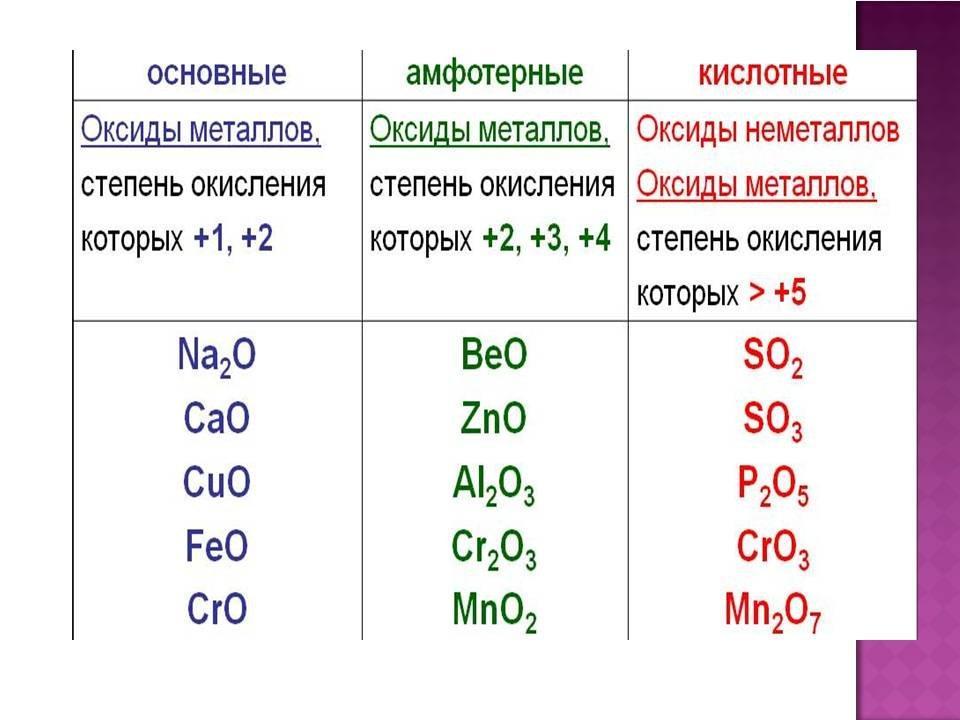 д.
д.
Химические свойства основных оксидов | CHEMEGE.RU
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CaO + H2O → Ca(OH)2
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи.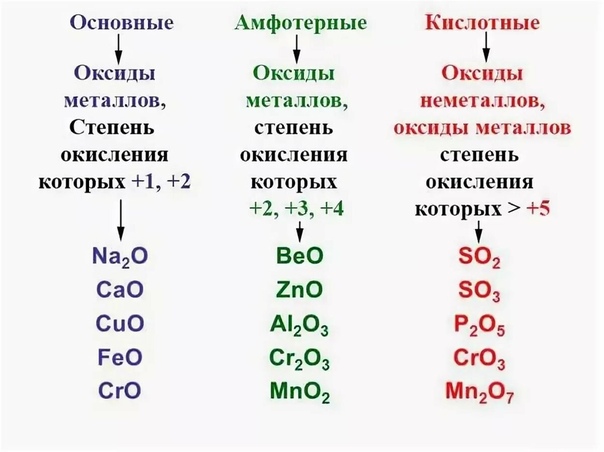 При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
K2O + Al2O3 → 2KAlO2
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2—. Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:
Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe2+ можно окислить до иона Fe3+).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
Реакция протекает только при нагревании.
FeO + C = Fe + CO
Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe2O3 + CO = Al2O3 + CO2
CuO + CO = Cu + CO2
4.2. Восстановление водородом.
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O
4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например, оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.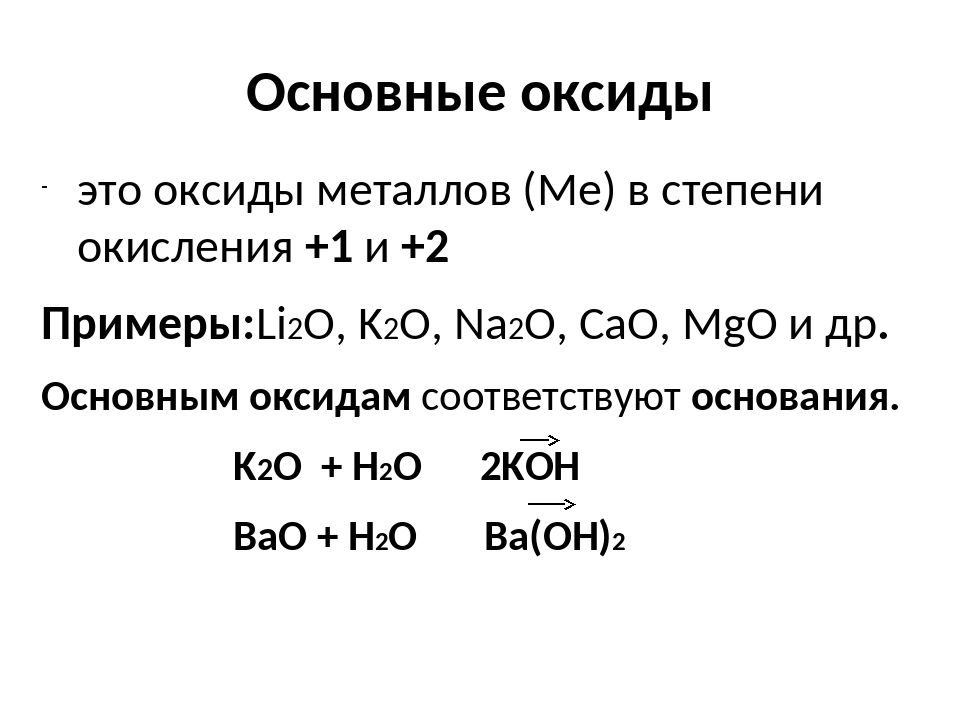
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например, аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe2+, Cr2+, Mn2+ и др.) могут выступать в качестве восстановителей.
Например, оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O2 = 2Fe2O3
Оксиды.
Изучение нового материала
1.Изучите текст
Оксиды – это сложные вещества, которые состоят из двух элементов, одним, из которых является кислород. Почти все химические элементы образуют оксиды, исключением являются лишь некоторые инертные элементы. Известны химические элементы, которые непосредственно с кислородом не соединяются. К ним относится золото Аu и некоторые другие. Оксиды этих элементов получают косвенным путём.
К ним относится золото Аu и некоторые другие. Оксиды этих элементов получают косвенным путём.
Химическая природа оксидов проявляется в их отношении к кислотам и щелочам.
В связи с этим оксиды можно разделить на следующие группы
— солеобразующие, которые реагируют с образованием солей с кислотами или щелочами;
— несолеобразующие, которые не образуют солей с кислотами или щелочами.
В свою очередь, солеобразующие оксиды подразделяются на кислотные (реагируют со щелочами), основные (реагируют с кислотами) и амфотерные (реагируют как с кислотами, так и с щелочами).
Кислотные оксиды — это оксиды, которые реагируют со щелочами с образованием соли и воды, но они не реагируют с кислотами. Например, при взаимодействии кислотного оксида – оксида углерода (IV) с гидроксидом натрия образуются карбонат натрия и вода:
CO2 + 2NaOH = Na2CO3 + h3O
К кислотным оксидам относятся, как правило, оксиды неметаллов (например, SO2, CO2, P2O5), и те оксиды металлов, в которых металл находится в валентности более III (например, Mn2O7, CrO3).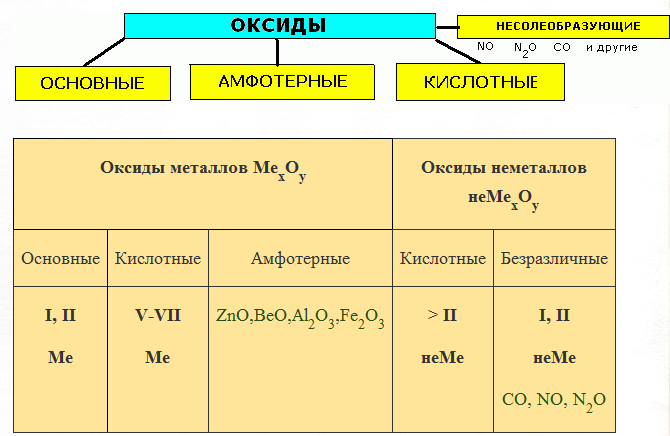
Кислотным оксидам соответствуют кислоты. Оксиду серы (IV) соответствуют сернистая кислота, оксиду углерода(IV) — угольная, оксиду фосфора(V) – ортофосфорная, оксиду марганца(VII) – марганцовая, оксиду хрома(VI) – хромовая.
Основные оксиды — это оксиды, которые реагируют с кислотами с образованием соли и воды, но не реагируют со щелочами. Например, при взаимодействии оксида магния с соляной кислотой образуются хлорид магния и вода:
MgO + 2HCl = MgCl2 + h3O
Основные оксиды образуют, как правило, металлы с валентностью – I, II или III. Основным оксидам соответствуют основания. Например, оксиду натрия соответствует гидроксид натрия NaOH, оксиду бария – гидроксид бария, оксиду меди(II) – гидроксид меди(II).
Третья группа солеобразующих оксидов – амфотерные оксиды. Эти оксиды проявляют двойные свойства, т.е свойства и кислотных, и основных оксидов. Значит, они способны реагировать как со щелочами, так и с кислотами.К амфотерным оксидам относятся, например, оксид алюминия, оксид цинка, оксид бериллия, оксид хрома(III):Al2O3, ZnO, BeO, Cr2O3
Несолеобразующие, или безразличные оксиды не реагируют с образованием солей ни с кислотами, ни со щелочами. К такому виду оксидов относятся, например, оксиды азота N2O и NO, оксид углерода(II) – СО.
К такому виду оксидов относятся, например, оксиды азота N2O и NO, оксид углерода(II) – СО.
л
2.просмотрите видео урок
отношение к воде, кислотам и щелочам.
ПЛАН ОТВЕТА:
- Определение
- Классификация
- несолеобразующие
- солеобразующие
- основные
- кислотные
- амфотерные
- Химические свойства
- взаимодействие с водой
- взаимодействие с кислотами
- взаимодействие со щелочами
Оксиды – это сложные вещества, молекулы которых состоят из двух элементов, один из которых кислород, причём атомы кислорода не связаны друг с другом.
Все оксиды разделяют на две группы: солеобразующие и несолеобразующие.
Несолеобразующие оксиды не образуют солей в химических реакциях. К ним относятся: оксид азота(I), оксид азота(II), оксид кремния(IV).
Солеобразующие оксиды могут взаимодействовать с кислотами или щелочами с образованием солей. В зависимости от состава, а следовательно, и свойств они подразделяются на основные, кислотные и амфотерные.
Основные оксиды – это оксиды, которые при взаимодействии с кислотами образуют соль и воду. Они образованы элементами-металлами с валентностью 1 и 2. в качестве гидроксидов им соответствуют основания. К основным оксидам относятся оксид натрия, оксид кальция, оксид меди(), оксид железа().
Кислотные оксиды реагируют со щелочами с образованием соли и воды. Они образованы элементами-неметаллами, например, оксид серы(IV),оксид серы(VI), оксид фосфора(V) и переходными элементами, проявляющими валентность V, VI, VII, например, оксид хрома(VI), оксид марганца(VII). В качестве гидроксида кислотным оксидам соответствуют кислоты.
Амфотерными оксидами называют оксиды, которые реагируют и с кислотами и со щелочами с образованием соли и воды. Они образованы переходными элементами. Например, оксид алюминия, оксид цинка.
Химические свойства:
Оксиды взаимодействуют с водой, если соответствующий им гидроксид растворим в воде.
При взаимодействии основного оксида с водой образуется щёлочь, например, при взаимодействии оксида натрия с водой образуется гидроксид натрия (щёлочь), а оксид меди(II) с водой не реагирует, т.к. ему соответствует нерастворимое основание.
При взаимодействии кислотного оксида с водой образуется кислота, например, при взаимодействии оксида серы(VI) с водой образуется серная кислота, а оксид кремния(IV) с водой не реагирует, т.к. кремниевая кислота нерастворима в воде.
Амфотерные оксиды с водой не реагируют, т.к. им соответствуют нерастворимые гидроксиды.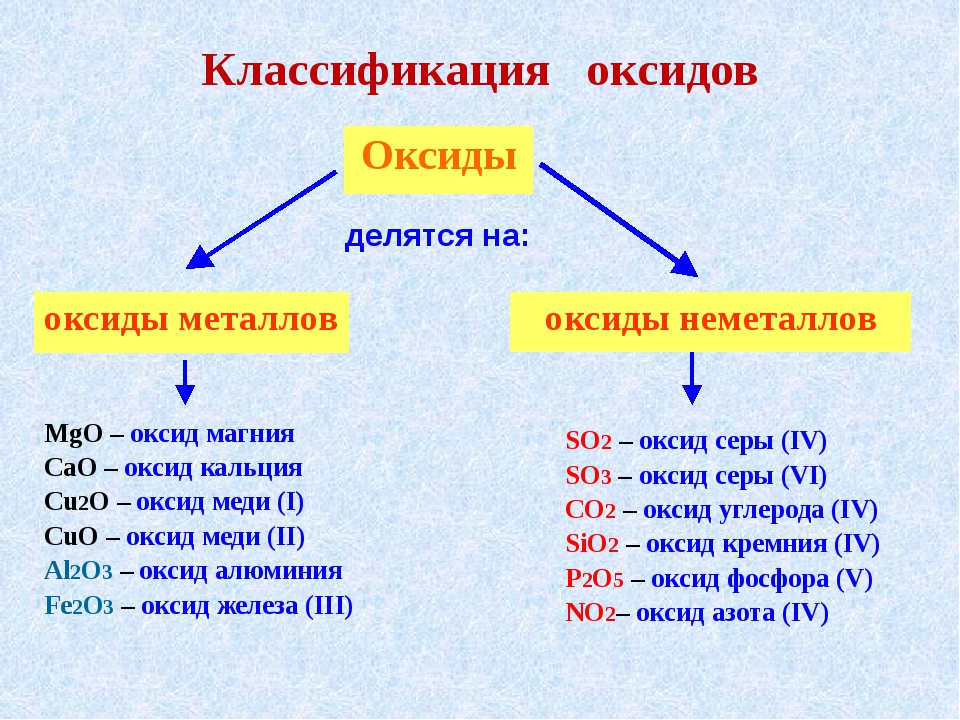
Основные оксиды взаимодействуют с растворимыми кислотами с образованием соли и воды, например, при взаимодействии оксида меди(II) с соляной кислотой образуются хлорид меди(II) и вода.
Все кислотные оксиды взаимодействуют со щелочами с образованием соли и воды, причём образуется соль той кислоты, которая соответствует данному оксиду. Например, при взаимодействии оксида углерода(IV) с гидроксидом кальция образуются карбонат кальция и вода.
Амфотерные оксиды могут реагировать и с кислотами и со щелочами. Например, оксид цинка при взаимодействии с соляной кислотой образует хлорид цинка и воду, а при взаимодействии с гидроксидом натрия – цинкат натрия и воду.
Na2O + H2O = 2NaOH
CuO + H2O ?
SO3 + H2O = H2SO4
SiO2 + H2O ?
CuO + 2HCl = CuCl2 + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
Дополнительно знать:
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
BaO + H2O = Ba(OH)2
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3
P2O5 + 3H2O = 2H3РО4
3NO2 + H2O = 2HNO3 + NO
Оксиды неметаллов | Образовательная социальная сеть
«Оксиды неметаллов»
Цель урока:
Образовательные:
углубить, систематизировать, обобщить знания учащихся об оксидах, способах их получения, свойствах и областях применения,
свойствах и областях применения, упражнять учащихся в выполнении заданий ЕГЭ по химии по данной теме,
Развивающие:
развивать логическое мышление учащихся,
развивать умение анализировать, обобщать, делать выводы,
развивать правильно и последовательно излагать свои мысли,
Воспитательные:
создание комфортности присутствия на уроке,
воспитание эстетического отношения к предмету,
воспитание отстаивать свою точку зрения, подкрепляя ее имеющимися или приобретенными знаниями
Оборудование: таблица «Оксиды», ПК с медиапроектором, коллекция «Минералы», раздаточный материал – карточки с заданиями;
лабораторное оборудование: спиртовка, спички, пробиркодержатель, ложечка для сжигания веществ; вещества: медная проволока, этанол.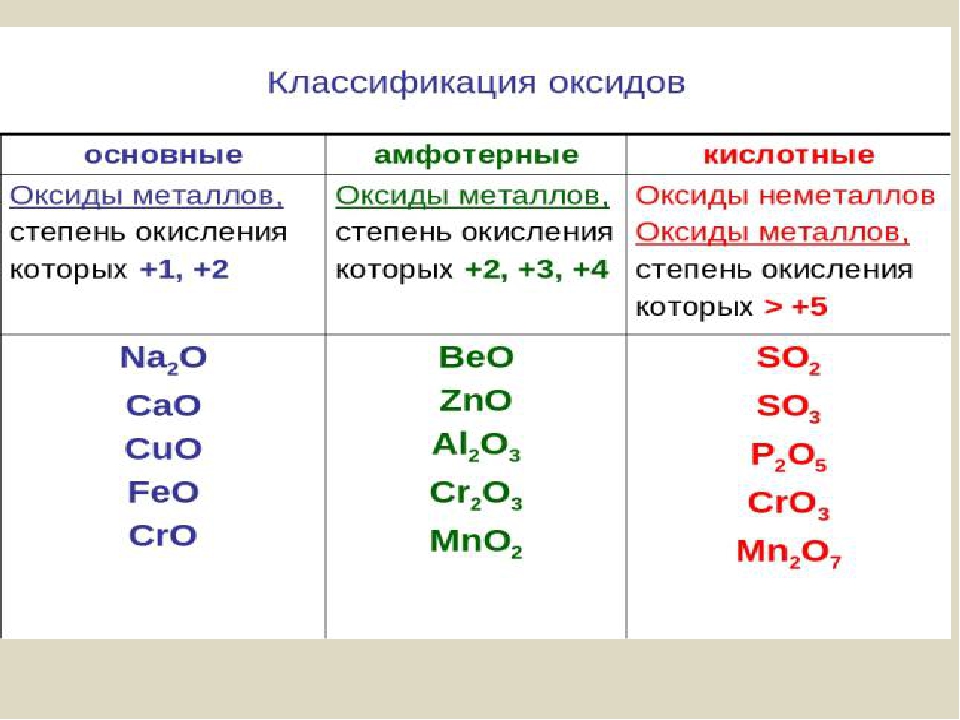
Ход урока
I. Организационный момент.
Сегодня на уроке рассмотрим свойства, классификацию, физические и химические свойства оксидов.
II. Изучение основного содержания:
1) Сообщение темы и цели урока.
-Сегодня на уроке рассмотрим свойства, классификацию, физические и химические свойства оксидов
1. Фронтальный опрос учащихся по вопросам:
— Вещества подразделяют на простые и сложные, укажите их отличия?
— Перечислите классы неорганических соединений.
— Дайте определение понятию «Оксиды».
— Перечислите виды оксидов.
— Дайте определения понятий основных, кислотных, амфотерных оксидов.
2. Классификация оксидов
Классификация оксидов
Оксиды подразделяются на солеобразующие и несолеобразующие.
Солеобразующими называют такие оксиды, которые в результате химических реакций способны образовывать соли.
— Дайте определение понятию «Соли».
Несолеобразующие оксиды такой способностью не обладают.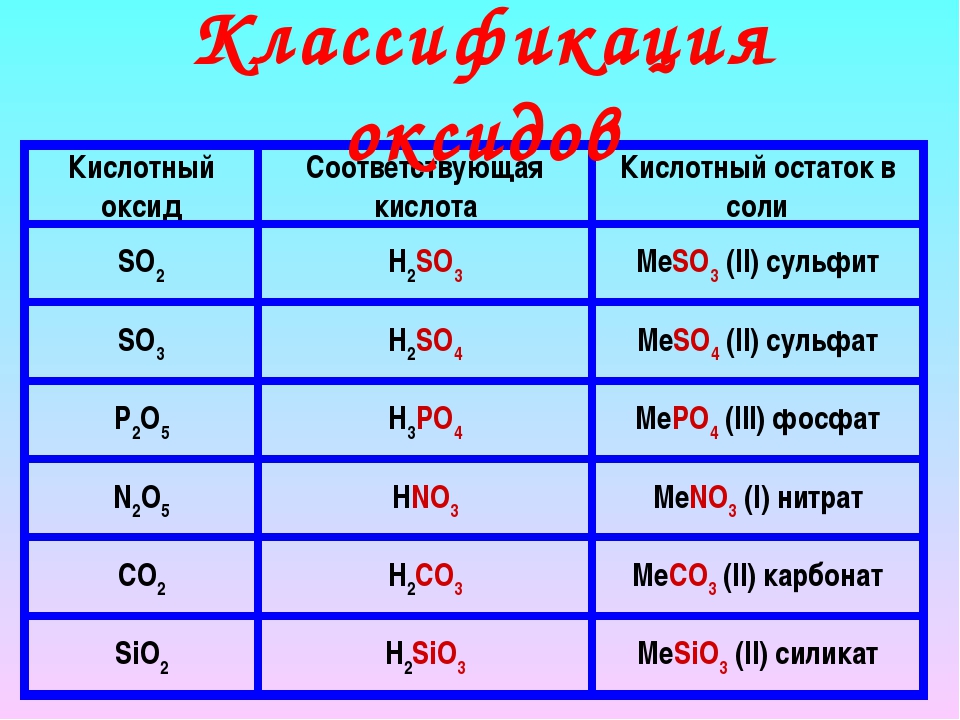 Примером несолеобразующих оксидов могут служить следующие вещества: CO, N2O, NO.
Примером несолеобразующих оксидов могут служить следующие вещества: CO, N2O, NO.
Солеобразующие оксиды, в свою очередь подразделяются на основные, кислотные и амфотерные.
— Какие оксиды относят к основными ?
Основными оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения воды) соответствуют основания.
Например: Основные оксиды Соответствующая гидратная форма(основание)
Na2O → NaOH
BaO→ BaOH
СaO→ СaOH
— Дайте определение понятию «Основания».
— Какие элементы образуют основные оксиды?
Основные оксиды образуют металлы при проявлении ими невысокой валентности (обычно I или II).
Оксиды таких металлов, как Li,Na, K, Rb, Cs, Fr , Ca , Sr, Ba взаимодействуют с водой с образованием растворимых в воде оснований — щелочей. Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей (косвенным путем).
— Какие оксиды относят к кислотными ?
Кислотными оксидами называются такие оксиды, которым в качестве гидратов соответствуют кислоты. Кислотные оксиды называют также ангидридами кислот.
Например: кислотные оксиды соответствующая гидратная форма (кислота)
SO3 → h3SO4
Р2О3→ h4РO4
СrО3→ h3CrO4
— Дайте определение понятию «Кислоты»
— Какие элементы образуют кислотные оксиды?
Кислотные оксиды образуют неметаллы и металлы при проявлений ими высокой валентности. Например, оксид марганца (VII) — кислотный оксид, так как в качестве гидрата ему соответствует кислота HMnO4 и это оксид металла с высокой валентностью.
Большинство кислотных оксидов могут взаимодействовать с водой непосредственно и при этом образовывать кислоты.
Например: СrО3 + h3O → h3CrO4
Р2О3 + h3O → h4РO4
SO3 + h3O → h3SO4
Некоторые оксиды непосредственно с водой не взаимодействуют.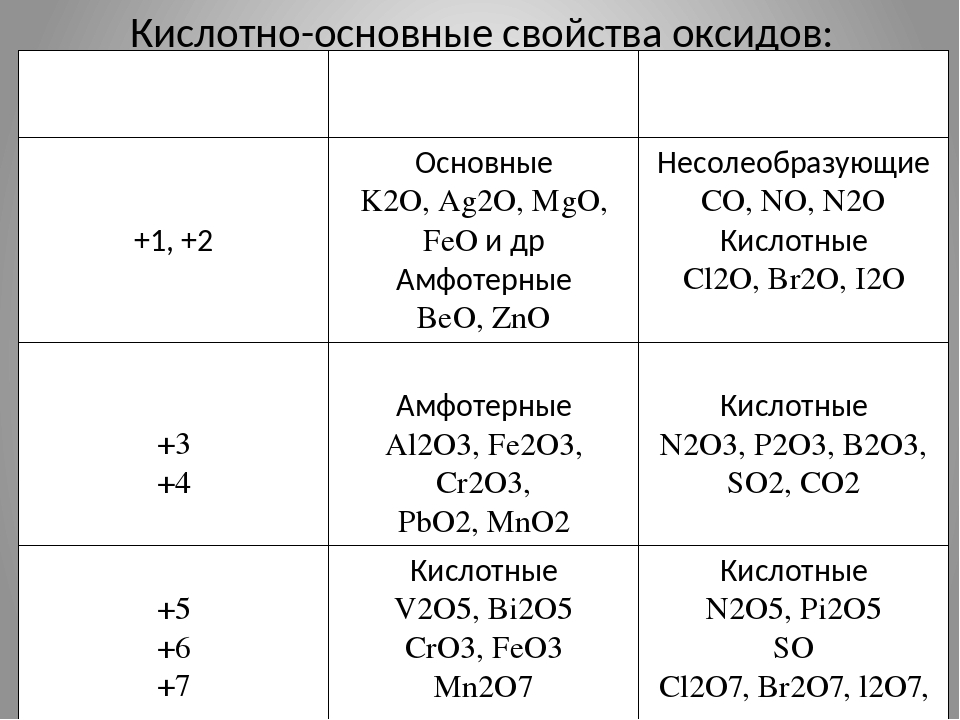 Такого типа оксиды сами могут быть получены из кислот. Например:
Такого типа оксиды сами могут быть получены из кислот. Например:
h3SiO3→ SiO2 + h3O (температура)
Это подтверждает названия кислотных оксидов — ангидриды, то есть «не содержащие воду».
Оксиды SO2 и CO2 реагирую с водой обратимо: СО2 + h3O ↔ h3CO3
SО2 + h3O ↔ h3SO3
Это подтверждает названия кислотных оксидов — ангидриды, то есть «не содержащие воду».
— Назовите особенности амфотерных оксидов.
Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий проявляют свойства как основных (в кислой среде), так и кислотных (в щелочной среде) оксидов.
— Какие элементы образуют амфотерные оксиды?
К амфотерным оксидам относятся только оксиды некоторых металлов.
Например: BeO, Al2O3, PbO, SnO, ZnO, PbO2, SnO2, Сr2О3
PbO + 2HNO3→ Pb(NO3)2 + h3O
а) В кислой среде PbO (оксид свинца (II)) проявляет свойства основного оксида
б) в щелочной среде PbO проявляет свойства кислотного оксида.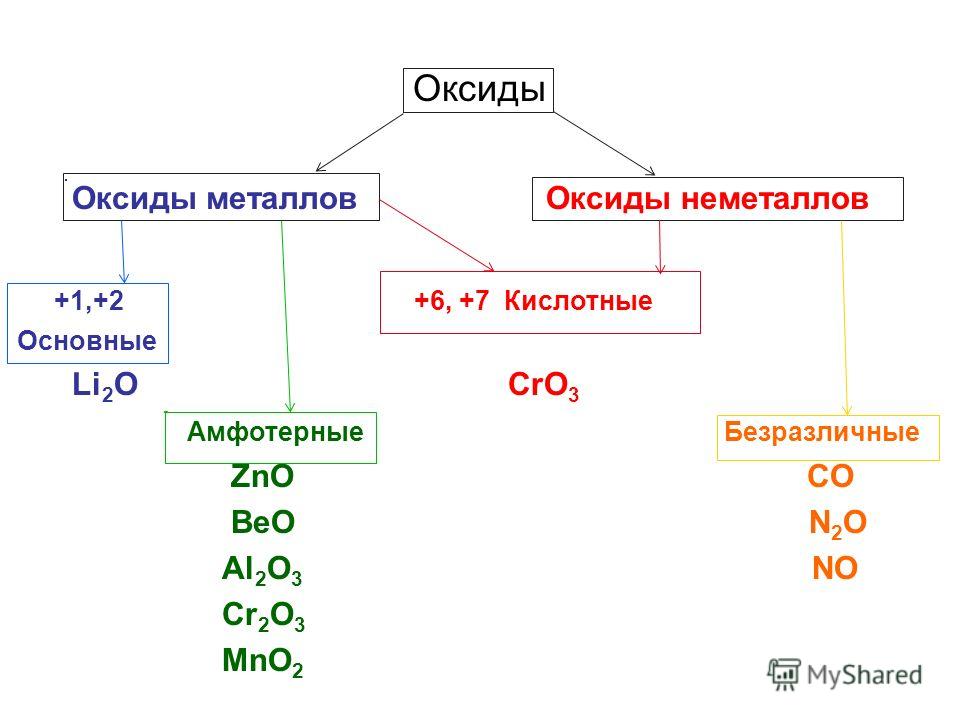
t
PbO + 2NaOHтв → Na2 PbO2 + h3O
Амфотерные оксиды с водой непосредственно не взаимодействуют, следовательно, их гидратные формы получают косвенно — из солей. Несолеобразующие (индифферентные) оксиды — небольшая группа оксидов, не вступающая в химические реакции с образованием солей. К ним относятся: CO, N2O, NO , SiO2.
2. Получение оксидов.
— Назовите способы получения оксидов
1) окисление металлов: 2Cu + O2 = 2CuO
оксид меди (II) черный налет
Демонстрационный опыт — окисление меди кислородом в пламени спиртовки
2) окисление неметаллов: C + O2 = CO2
оксид углерода (IV)
3) разложение кислот: Н2SО4 = SО2 + Н2О
оксид серы (IV)
4) разложение солей: CaCО3 = CaО + CО2
оксид кальция (II)
5) разложение оснований: Fe(ОН)2 = FeО + Н2О
оксид железа (II)
7) горение сложных веществ: C2H5OH + 3О2 → 2CО2 + 3Н2О
Демонстрационный опыт – горение C2H5OH (этанол) в ложечке для сжигания веществ
3. Химические свойства оксидов.
Химические свойства оксидов.
1) Основные оксиды.
а) взаимодействие с кислотами: BaO + 2HCl = BaCl2 + h3O
оксид бария (II)
б) взаимодействие с водой: MgO + h3O = Mg(OH)2
оксид магния (II)
в) взаимодействие с кислотным оксидом: CaO + CO2 = CaCO3
оксид кальция (II)
г) взаимодействие с амфотерным оксидом: Na2O + ZnO = Na2ZnO2
цинкат натрия
2) Кислотные оксиды.
а) взаимодействие с водой: SO3 + h3O = h3SO4
оксид серы (VI)
б) взаимодействие с основанием: Ca(OH)2 + CO2 = CaCO3 + h3O
гидроксид кальция (II)
в) взаимодействие с основным оксидом: CO2 + CaO = CaCO3
карбонат кальция
3) Амфотерные оксиды.
а) взаимодействие с кислотами: ZnO + 2HCl = ZnCl2 + h3O
хлорид цинка
б) взаимодействие с основаниями: ZnO + 2NaOH = Na2ZnO2 + h3O
гидроксид натрия
4. Применение оксидов:
Сообщения учащихся:
Fe2O3 – оксид железа (III) – темно-красного цвета – гематит или красный железняк – для изготовления красок.
Fe3O4 – оксид железа (II, III) – минерал магнетит или магнитный железняк, хороший проводник электричества – для получения и изготовления электродов.
CaO – оксид кальция (II) – порошок белого цвета – «негашеная» известь, используют в строительстве.
Al2O3 – оксид алюминия (III) – минерал твердый корунд – как полирующее средство.
SO2 – оксид серы (IV) или сернистый газ – бесцветный газ, имеющий удушливый запах, убивает микроорганизмы, плесневые грибки – окуривают подвалы, погреба, при перевозке и хранении фруктов и ягод.
CO2 – оксид углерода (IV), углекислый газ. Твердый оксид углерода – сухой лед. Для изготовления соды, сахара, газированных напитков, в жидком виде в огнетушителях.
SiO2 – оксид кремния (IV) – твердое, тугоплавкое вещество в природе в двух видах:
1) кристаллический кремнезем – в виде минерала кварца и его разновидностей: горный хрусталь, халцедон, агат, яшма, кремень – используют в силикатной промышленности, строительстве.
2) аморфный кремнезем SiO2 ∙ nh3O – минерал опал.
Применяют соединения оксида кремния в ювелирном деле, изготовлении химической посуды, кварцевых ламп.
Для создания цветных стекол используют следующие оксиды:
Cо2O3 – синий цвет , Cr2O3 – зеленый цвет, MnO2 – розовый цвет.
5. Закрепление. Выполнение теста. (Приложение № 1)
IV. Домашнее задание:
1И.И. Новошинский, Н.С. Новошинская «Химия» (базовый уровень), Глава VI, §22
2. Закончите уравнения химических реакций, дайте название веществам:
а) P + O2 →
б) Al + O2 →
в) h3SO4 + Fe2O3 →
г) BaO + HCl →
д) C2h5 + O2 →
V. Закрепление:
По вопросам основного содержания:
1. Основные способы получения оксидов.
2. Химические свойства:
— основных оксидов;
— кислотных оксидов;
— амфотерных оксидов.
3. Области применения оксидов.
Приложение №1.
Характерные химические свойства: оксидов: основных, амфотерных, кислотных.
Вариант 1.
1. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) вода и медь
4) оксид кальция и гидроксид натрия
Ответ: 4, т.к. оксид серы (VI) – кислотный, взаимодействует с основаниями, основными оксидами, водой.
2. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) гидроксидом натрия и оксидом кальция
2) оксидом кальция и оксидом серы (IV)
3) кислородом и водой
4) хлоридом натрия и оксидом азота (IV)
Ответ: 1, т.к. оксид углерода (IV) – кислотный, взаимодействует с основаниями, основными оксидами, водой.
3. Оксид серы (IV) взаимодействует с
1) СО2 2) Н2О 3) Na2SO4 4) НС1
Ответ:,2. т.к. оксид серы (IV) – кислотный, взаимодействует с основаниями, основными оксидами, водой.
4. Формулы кислотного, основного, амфотерного оксидов, соответственно
1)MnO2, CO2, Al2O3 2)CaO, SO2, BeO 3)Mn2O7, CaO, ZnO 4) MnO, CuO, CO2
Ответ: 3,т.к. Mn2O7 – кислотный, CaO — основный, ZnO — амфотерный
5. Способны взаимодействовать между собой
1) SiO2 и Н2О 2) СО2 и h3SO4 3) CO2 и Са(ОН)2 4) Na2O и Са(ОН)2
Ответ: 3, CO2 – кислотный оксид, Са(ОН)2 -основание, кислотные оксиды взаимодействуют с основаниями
6. Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО2 2) SO3 3) ВаО 4) NО
Ответ: 4,т.к. NО несолеобразующий
7. Реагирует с соляной кислотой, но не с водой, оксид
1) SiО2 2) N2O3 3) Na2О 4) Fе2Оз
Ответ: 4, т.к. Fе2Оз — амфотерный оксид с большим преобладанием основных свойств, взаимодействует с кислотами, не реагирует с водой (Fе(ОН)з – не растворим в воде).
8. Амфотерность оксида свинца (II) подтверждается его способностью
1) растворяться в кислотах
2) восстанавливаться водородом
3) реагировать с оксидом кальция
4) взаимодействовать как с кислотами, так и с щелочами
Ответ: 4; т.к. амфотерные оксиды могут взаимодействовать как с кислотами, так и с щелочами
9. Верны ли следующие суждения о свойствах оксидов алюминия и хрома (III)?
А. Эти оксиды проявляют амфотерные свойства.
Б. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: 1, т.к. оксиды алюминия и хрома (III) проявляют амфотерные
10. Между собой взаимодействуют
1) СuО и FeO 2) СО2 и ВаО 3) Р2О5 и NO 4) СгО3 и SO3
Ответ: 2, т.к. СО2 – кислотный, а ВаО — основный
Характерные химические свойства: оксидов: основных, амфотерных, кислотных.
Вариант 2.
1. Реакция возможна между
1) Н2О и А12О3 2) СО и СаО 3) Р2О3 и SO2 4) Н2О и ВаО
Ответ: 4, т.к. ВаО — основный оксид, взаимодействует с водой.
2. И с раствором гидроксида натрия, и с соляной кислотой реагирует оксид
1) SiО2 2) Al2O3 3) СО2 4) MgO
Ответ: 2; т.к. взаимодействовать с щелочами и кислотами могут амфотерные оксиды, Al2O3 — амфотерный оксид.
3. Реакция возможна между
1) ВаО и Nh4 2) А12О3 и Н2О 3) Р2О5 и НС1 4) MgO и SO3
Ответ: 4; т.к. MgO — основный оксид ,а SO3 – кислотный оксид.
4. Оксид натрия не взаимодействует с
1) Н2О 2) СО2 3) CaO 4) А12О3
Ответ: 3; т.к. оксид натрия основный и CaO основный.
5. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) водой и оксидом кальция
2) кислородом и водой
3) сульфатом калия и гидроксидом натрия
4) оксидом кремния (IV) и водородом
Ответ: 1; т.к. оксид углерода (IV) — кислотный, реагирует с водой, основаниями, основными оксидами. Оксид кальция — основный
6. Основные свойства наиболее выражены у оксида, формула которого
1) Fe2O3 2) FeO 3) Cr2O3 4) СrО3
Ответ: 2; т.к. Fe2O3 и Cr2O3 – амфотерные, а СrО3 – кислотный.
7. Какие из двух оксидов могут взаимодействовать между собой?
1) СаО и СrО 2) СаО и NO 3) К2O и СО2 4) SiO2 и SO2
Ответ: 3; т.к. К2O — основный ,а СО2 — кислотный оксид
8. Оксид фосфора (V)
1) не проявляет кислотно-основных свойств
2) проявляет только основные свойства
3) проявляет только кислотные свойства
4) проявляет как основные, так и кислотные свойства
Ответ: 3; т.к. оксид фосфора (V) – кислотный.
9. Между собой взаимодействуют
1) SO3 и А12Оз 2) СО и ВаО 3) Р2О5 и SCl4 4) ВаО и SO2
Ответ: 1; т.к. SO3 — — кислотный оксид, а А12Оз — амфотерный.
10. Верны ли следующие суждения об оксидах цинка и алюминия?
А. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
Б. Эти оксиды взаимодействуют как с кислотами, так и со щелочами.
1) верно толь ко А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: 2; т.к. оксиды цинка и алюминия — амфотерные.
Оксиды: их классификация и химические свойства
Билет № 17
1. Оксиды: их классификация и химические свойства (взаимодействие с водой, кислотами и щелочами)
Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород (в степени окисления −2).
Оксиды делят на кислотные, осно́вные, амфотерные и несолеобразующие (безразличные).
Кислотным оксидам соответствуют кислоты. Кислотными свойствами обладают большинство оксидов неметаллов и оксиды металлов в высшей степени окисления, например CrO3.
Многие кислотные оксиды реагируют с водой с образованием кислот. Например, оксид серы (IV), или серни́стый газ, реагирует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
Кислотные оксиды реагируют со щелочами с образованием соли и воды. Например, оксид углерода (IV), или углекислый газ, реагирует с гидроксидом натрия с образованием карбоната натрия (соды):
CO2 + 2NaOH = Na2CO3 + H2O
Осно́вным оксидам соответствуют основания. К осно́вным относятся оксиды щелочных металлов (главная подгруппа I группы),
магния и щелочноземельных (главная подгруппа II группы, начиная с кальция), оксиды металлов побочных подгрупп в низшей степени окисления (+1 +2).
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием оснований. Так, оксид кальция реагирует с водой, получается гидроксид кальция:
CaO + H2O = Ca(OH)2
Основные оксиды реагируют с кислотами с образованием соли и воды. Оксид кальция реагирует с соляной кислотой, получается хлорид
кальция:
CaO + 2HCl = CaCl2 + H2O
Амфотерные оксиды реагируют и с кислотами, и со щелочами. Так, оксид цинка реагирует с соляной кислотой, получается хлорид цинка:
ZnO + 2HCl = ZnCl2 + H2O
Оксид цинка взаимодействует и с гидроксидом натрия с образованием цинката натрия:
ZnO + 2NaOH = Na2ZnO2 + H2O
С водой амфотерные оксиды не взаимодействуют. Поэтому оксидная пленка цинка и алюминия защищает эти металлы от коррозии.
Несолеобразующим (безразличным) оксидам не соответствуют гидроксиды, они не реагируют с водой. Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относится оксид азота (II) NO.
Иногда к несолеобразующим относят угарный газ, но это неудачный пример, т.к. этот оксид реагирует с гидроксидом натрия с образованием соли:
CO + NaOH = HCOONa
(эта реакция не для запоминания! Изучается в 10–11 классах)
2. Задача. Вычисление массы продукта реакции, если известно количество вещества одного из исходных веществ.
Пример:
Сколько г хлорида цинка можно получить, имея 0,5 моль соляной кислоты?
Решение:
- Записываем уравнение реакции.
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
0,5 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль - Составляем пропорцию:
0,5 моль — х моль
2 моль — 1 моль - Находим x:
x = 0,5 моль • 1 моль / 2 моль = 0,25 моль - Находим молярную массу хлорида цинка:
M(ZnCl2) = 65 + 35,5 • 2 = 136 (г/моль) - Находим массу соли:
m (ZnCl2) = M • n = 136 г/моль • 0,25 моль = 34 г
Ответ: 34 г.
автор: Владимир Соколов
Оксиды, их классификация. Cвойства оксидов в свете ТЭД
Оксиды
– это сложные вещества, состоящие из двух элементов, одним из которых является
кислород в степени окисления -2. Следовательно, оксиды – это бинарные
соединения.
По
агрегатному состоянию они бывают жидкими, примером такого оксида
является вода, или оксид водорода, примером твердого оксида
является уже известный вам оксид кремния (IV),
или песок, а также различные разновидности кварца;
примером газообразных оксидов являются углекислый газ, или оксид
углерода (IV), а также угарный газ,
или оксид углерода (II).
По
химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Несолеобразующие
оксиды не реагируют с кислотами и основаниями, а также не образуют солей. К
несолеобразующим оксидам относятся такие оксиды, как оксид углерода (II)
– CO, оксид азота (I)
– N2O
и оксид азота (II)
– NO. К солеобразующим
оксидам относятся основные, амфотерные и кислотные.
Основные
оксиды – это оксиды, которым соответствуют основания. К
основным оксидам относятся оксиды металлов I
и II A
группы, а также оксиды металлов с небольшими степенями
окисления (+1, +2). Кроме того, все основные оксиды являются твёрдыми
веществами. Например, оксид магния (MgO) –
это основный оксид, потому что магний – металл II
A группы,
ему соответствует основание Mg(OH)2.
CrO – тоже основный оксид,
т.к. у хрома степень окисления в данном случае +2, этому оксиду соответствует
основание – Cr(OH)2.
Na2O
– основный оксид, т.к. натрий – металл I
A группы,
ему соответствует основание NaOH.
Основные
оксиды вступают в реакции обмена с кислотами. При
этом образуется соль и вода. Для того чтобы в этом убедиться, проведём
эксперимент: поместим в пробирку немного порошка оксида меди (II),
как видите, он чёрного цвета, в эту пробирку нальём раствора серной кислоты и
слегка нагреем. Постепенно проходит реакция, т.к. порошок начинает
растворяться. Чтобы убедиться в том, что в результате реакции образуется соль,
несколько капель содержимого пробирки поместим на предметное стекло и выпарим,
после чего на стекле появляются кристаллы соли.
CuO
+ H2SO4 = CuSO4 + H2O
CuO
+ 2H+ = Cu2+ + H2O
Основные
оксиды вступают в реакции соединения с кислотными оксидами, при этом образуются
соли. Например, при взаимодействии оксида натрия с оксидом
фосфора (V) образуется соль –
фосфат натрия, в результате взаимодействия оксида магния с оксидом серы (VI)
образуется соль – сульфат магния, а при взаимодействии оксида кальция с оксидом
углерода (IV) образуется соль –
карбонат кальция.
3Na2O
+ P2O5 = 2Na3PO4
MgO
+ SO3 = MgSO4
CaO
+ CO2
= CaCO3
Основные
оксиды вступают в реакции соединения с водой с образованием щелочей. Если
образуется нерастворимое основание, то такая реакция не идёт. Например,
если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а
затем поместим в первую пробирку оксид кальция, а в другую оксид меди (II),
то реакция у нас идёт только в первой пробирке, т.к. образовалась щёлочь и
лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к.
оксид меди (II) не реагирует с водой,
ведь Cu(OH)2
– нерастворимое в воде основание.
CaO
+ H2O = Ca(OH)2
CaO
+ H2O = Ca2+ + 2OH—
CuO
+ H2O
≠
Кислотные
оксиды – это оксиды, которым соответствуют кислоты. К
кислотным оксидам относятся оксиды неметаллов и оксиды металлов с большими
степенями окисления. Например, оксиду азота (V)
соответствует азотная кислота, оксиду фосфора (V)
– фосфорная кислота, оксиду серы (IV)
– сернистая кислота, оксиду серы (VI)
– серная кислота, оксиду кремния (IV)
– кремниевая кислота, оксиду углерода (IV)
– угольная кислота, оксиду хрома (VI)
– хромовая кислота, оксиду марганца (VII)
– марганцевая кислота.
N2O5
→ HNO3
P2O5
→ H3PO4
SO2
→ H2SO3
SO3
→ H2SO4
SiO2
→ H2SiO3
CO2
→ H2CO3
CrO3
→ H2CrO4
Mn2O7
→ HMnO4
Кислотные
оксиды вступают в реакции обмена с основаниями,
при этом образуется соль и вода. Если через пробирку с известковой водой
пропустить углекислый газ, то известковая вода мутнеет, следствие образования
соли – карбоната кальция.
CO2
+ Ca(OH)2 = CaCO3↓ + H2O
CO2
+ Ca2+ + 2OH— = CaCO3↓ + H2O
Кислотные
оксиды вступают в реакции соединения с основными оксидами,
при этом образуются соли. Например, в результате взаимодействия оксида
серы (IV) и оксида калия
образуется соль – сульфит калия, в результате взаимодействия оксида
кремния (IV) с оксидом натрия при
нагревании, образуется соль – силикат натрия, при взаимодействии оксида
азота (V) с оксидом бария,
образуется соль – нитрат бария.
SO2
+ K2O = K2SO3
SiO2
+ Na2O = Na2SiO3
N2O5
+ BaO = Ba(NO3)2
Кроме
этого, кислотные оксиды вступают в реакции соединения с водой, при этом образуются
кислоты, однако эти реакции возможные, если оксид растворим в воде.
Для этого подтверждения, нальём в одну пробирку дистиллированной воды, а в
другую – раствор углекислого газа (газированной воды). В первую пробирку
добавим оксида кремния (IV).
А затем в каждую из пробирок добавим несколько капель лакмуса. В первой
пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит, во
второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что
оксид кремния (IV) не растворим в воде.
SiO2
+ H2O
≠
CO2
+ H2O
↔ H2CO3
Реакции оксидов основной группы — Химия LibreTexts
Реакции с элементами 1-й группы
Элементы 1-й группы состоят из лития, натрия, калия, рубидия, цезия и франция. Эти элементы называются щелочными металлами, потому что они сильно реагируют с водой и создают ионы гидроксида и газообразный водород, оставляя щелочной раствор.
2M (s) + 2H 2 O → 2M + (вод.) + 2OH — (вод.) + H 2 (г) M = металл 1 группы
Металлы 1 группы очень реакционноспособны с кислород и должны храниться вдали от кислорода, чтобы не окислиться.Эти щелочные металлы быстро реагируют с кислородом с образованием нескольких различных ионных оксидов.
Оксиды: O 2-, пероксиды: O 2 2 —, супероксиды: O 2 — 0. Обычный оксид M 2 O может быть образован с щелочными металлами, как правило, путем ограничения подачи кислорода. При избытке кислорода щелочные металлы могут образовывать пероксиды, M 2 O 2 , или супероксиды, MO 2 . Литий: Реагирует с кислородом с образованием 2Li 2 O, оксида лития. Реакции показаны ниже. 4Li (s) + O 2 (g) → 2Li 2 O (s) Натрий: Реагирует с кислородом с образованием в основном пероксида натрия, Na 2 O 2 . Na 2 O 2 вместе с Li 2 O 2 используется в устройствах аварийного дыхания на подводных лодках и космических кораблях. Реакции показаны ниже. 2Na (s) + O 2 (g) → Na 2 O 2 (s) Остальная часть группы, K, Rb, Cs и Fr, образует супероксиды. M (s) + O 2 (g) → MO 2 (s) M = K, Rb, Cs, Fr Оксиды, пероксиды и супероксиды металлов, которые растворяются в воде, реагируют с водой с образованием основного решения. Ион оксида с водой: O 2- (водн.) + H 2 O (л) → 2OH — (водн.) Ион пероксида с водой: O 2 2- (водн.) + 2H 2 O (л) → H 2 O 2 (водн.) + 2OH — (водн.) Супероксид-ион с водой: 2O 2 — (водн.) + 2H 2 O (л) → H 2 O 2 (вод.) + 2OH — (вод.) + O 2 (г) Tl Элементы группы 14 состоят из углерода, кремния, германия, олова и свинца.Углерод — единственный неметаллический элемент группы 14. Кремний в основном неметаллический. Германий — это металлоид или полуметалл. Олово и свинец обладают в основном металлическими свойствами. Углерод: Реагирует с кислородом с образованием оксидов. Основными формами оксидов углерода являются оксид углерода CO и диоксид углерода CO 2 . Двуокись углерода является основным продуктом горения органических материалов, а также побочным продуктом дыхания. Во время фотосинтеза углерод соединяется с водой с образованием углеводов. 6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2 Углерод является строительным блоком для многих органических соединений. Двуокись углерода — единственный оксид, образующийся при сжигании углерода в избытке воздуха. Реакции показаны ниже. C (s) + O 2 (g) → CO 2 2C (s) + O 2 (g) → 2CO Кремний: образует только один стабильный оксид с эмпирической формулой SiO 2 , кремнезем.В кремнеземе каждый атом Si связан с четырьмя атомами O, а каждый атом O — с двумя атомами Si, образуя сетку ковалентного твердого тела с сеткой связей –Si – O – Si–. Германий: образует диоксид германия, который представляет собой твердое вещество с ковалентной сеткой, подобное диоксиду кремния. Олово: образует два первичных оксида, SnO и SnO 2 . При нагревании SnO на воздухе его можно превратить в SnO 2 . SnO 2 применяется как ювелирное абразивное вещество. Реакции показаны ниже. Sn (s) + O 2 (g) → SnO 2 (s) 2Sn (s) + O 2 (g) → 2SnO (s) Свинец: образует несколько форм оксиды.Наиболее известными оксидами свинца являются желтый оксид свинца PbO, красно-коричневый диоксид свинца PbO 2 и красный свинец Pb 3 O 4 . Реакции показаны ниже. 2Pb (с) + O 2 (г) → 2PbO (с) Pb (с) + O 2 (г) → PbO 2 (с) 3Pb (с) + 2O 2 (г) → Pb 3 O 4 (с) Реакции с элементами 15 группы Элементы группы 15 состоят из азота, фосфора, мышьяка, сурьмы и висмута.Азот и фосфор — неметаллы, мышьяк и сурьма — металлоиды, а висмут — металл. Азот: образует группы оксидов, в которых степень окисления N может иметь любое значение от +1 до +5. Все эти оксиды являются газами при комнатной температуре, за исключением твердого N 2 O 5 . Получение оксидов азота: реакции показаны ниже. N 2 O NH 4 NO 3 (с) —∆ → N 2 O (г) + 2H 2 O (г) NO 3Cu (с) + 8H + (водн.) + 2НО 3 — (водн.) → 3Cu 2 + (водн.) + 2НО (г) + 4H 2 O (л) N 2 O 3 2NO (г) + N 2 O 4 (г) —20 ° C → 2N 2 O 3 (л) NO 2 2Pb (NO 3 ) 2 ( с) —∆ → 2PbO (с) + 4NO 2 (г) + O 2 (г) 2NO (г) + O 2 (г) <=> 2NO 2 (г) N 2 O 4 2NO 2 (г) <=> N 2 O 4 (г) N 2 O 5 4HNO 3 (l) + P 4 O 10 ) —10 ° C → 4HPO 3 (с) + 2N 2 О 5 (т) Реакции с элементами группы 14
оксидов | Введение в химию
Цель обучения
- Обсудите химические свойства оксидов.
Ключевые моменты
- Оксиды металлов обычно содержат анион кислорода в степени окисления -2.
- Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенным путем.
- Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха.
- Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Условия
- пассивация Самопроизвольное образование твердой нереактивной поверхностной пленки (обычно оксида или нитрида), которая препятствует дальнейшей коррозии.
- оксид — бинарное химическое соединение кислорода с другим химическим элементом.
- кокс Твердый остаток от обжига угля в коксовой печи; используется в основном в качестве топлива и при производстве стали, а ранее в качестве бытового топлива.
Химические свойства оксидов
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент в своей химической формуле.Оксиды металлов обычно содержат анион кислорода в степени окисления -2. Большая часть земной коры состоит из твердых оксидов в результате окисления элементов кислородом воздуха или воды. При сжигании углеводородов образуются два основных оксида углерода: монооксид углерода (CO) и диоксид углерода (CO 2 ). Даже материалы, которые считаются чистыми элементами, часто имеют оксидное покрытие. Например, алюминиевая фольга образует тонкую пленку из Al 2 O 3 (называемую пассивирующим слоем), которая защищает фольгу от дальнейшей коррозии.
Кислород демонстрирует высокую реактивность
Из-за своей электроотрицательности кислород образует прочные химические связи почти со всеми элементами с образованием соответствующих оксидов. Благородные металлы (такие как золото или платина) ценятся, потому что они сопротивляются прямому химическому соединению с кислородом, а такие вещества, как оксид золота (III), должны образовываться косвенными путями. Двумя независимыми путями коррозии элементов являются гидролиз и окисление кислородом. Сочетание воды и кислорода еще более агрессивно.Практически все элементы горят в атмосфере кислорода или богатой кислородом среде. В присутствии воды и кислорода (или просто воздуха) некоторые элементы, например натрий, быстро и даже опасно реагируют с образованием гидроксидных продуктов. Отчасти по этой причине щелочные и щелочноземельные металлы не встречаются в природе в их металлической форме. Цезий настолько реактивен с кислородом, что используется в качестве геттера в электронных лампах. Растворы калия и натрия используются для дезоксигенации и обезвоживания некоторых органических растворителей.
Пассивация
Поверхность большинства металлов состоит из оксидов и гидроксидов в присутствии воздуха. Как упоминалось выше, хорошо известным примером является алюминиевая фольга, покрытая тонкой пленкой оксида алюминия, которая пассивирует металл, замедляя дальнейшую коррозию. Слой оксида алюминия может быть увеличен до большей толщины с помощью процесса электролитического анодирования. Хотя твердые магний и алюминий медленно реагируют с кислородом в STP, они, как и большинство металлов, горят на воздухе, создавая очень высокие температуры.
Полимерные и мономерные молекулярные структуры
Оксиды большинства металлов имеют полимерную структуру с поперечными связями M-O-M. Поскольку эти поперечные связи являются прочными, твердые вещества, как правило, нерастворимы в растворителях, хотя они подвержены воздействию кислот и оснований. Формулы часто обманчиво просты. Многие из них нестехиометрические. В этих оксидах координационное число оксидного лиганда составляет 2 для большинства электроотрицательных элементов и 3–6 для большинства металлов.
Диоксид кремния Диоксид кремния (SiO 2 ) — один из наиболее распространенных оксидов на поверхности Земли.Как и большинство оксидов, он имеет полимерную структуру.
Хотя большинство оксидов металлов являются полимерными, некоторые оксиды представляют собой мономерные молекулы. Самые известные молекулярные оксиды — это углекислый газ и окись углерода. Пятиокись фосфора представляет собой более сложный молекулярный оксид с обманчивым названием, формула которого P 4 O 10 . Некоторые полимерные оксиды (диоксид селена и триоксид серы) деполимеризуются с образованием молекул при нагревании. Тетроксиды редки, и известно только пять примеров: четырехокись рутения, четырехокись осмия, четырехокись гассия, четырехокись иридия и четырехокись ксенона.Известно много оксианионов, таких как полифосфаты и полиоксометаллаты. Оксикатионы встречаются реже, например, нитрозоний (NO + ). Конечно, известно много соединений как с оксидами, так и с другими группами. Для переходных металлов известно много оксокомплексов, а также оксигалогенидов.
Кислотно-основные реакции
Оксиды подвержены действию кислот и оснований. Те, на кого воздействуют только кислоты, являются основными оксидами; те, на которые воздействуют только основания, являются кислыми оксидами. Оксиды, которые реагируют как с кислотами, так и с основаниями, являются амфотерными.Металлы имеют тенденцию образовывать основные оксиды, неметаллы — кислые оксиды, а амфотерные оксиды образуются элементами, расположенными на границе между металлами и неметаллами (металлоидами).
Другие окислительно-восстановительные реакции
Металлы «извлекаются» из оксидов путем химического восстановления. Распространенным и дешевым восстановителем является углерод в виде кокса. Наиболее ярким примером является выплавка железной руды.
Оксиды, такие как оксид железа (III) (или ржавчина, состоящая из гидратированных оксидов железа (III) Fe 2 O 3 · nH 2 O и оксид-гидроксид железа (III) FeO (OH), Fe (OH) 3 ), образуются при соединении кислорода с железом.
Оксиды металлов можно восстанавливать органическими соединениями. Этот окислительно-восстановительный процесс является основой многих важных преобразований в химии, таких как детоксикация лекарств ферментами P450 и производство этиленоксида, который превращается в антифриз. В таких системах металлический центр передает оксидный лиганд органическому соединению с последующей регенерацией оксида металла, часто кислородом воздуха.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Что такое оксид? Определение и примеры
Оксид — это ион кислорода со степенью окисления, равной -2 или O 2-. Любое химическое соединение, содержащее O 2- в качестве аниона, также называется оксидом. Некоторые люди более широко применяют этот термин для обозначения любого соединения, в котором кислород выступает в качестве аниона. Оксиды металлов (например, Ag 2 O, Fe 2 O 3 ) являются наиболее распространенной формой оксидов, составляющей большую часть массы земной коры.Эти оксиды образуются, когда металлы реагируют с кислородом воздуха или воды. Хотя оксиды металлов являются твердыми веществами при комнатной температуре, образуются также газообразные оксиды. Вода — это оксид, который является жидкостью при нормальной температуре и давлении. Некоторые из оксидов, обнаруженных в воздухе, — это диоксид азота (NO 2 ), диоксид серы (SO 2 ), монооксид углерода (CO) и диоксид углерода (CO 2 ).
Ключевые выводы: определение оксидов и примеры
- Оксид относится либо к аниону кислорода 2 — (O 2-), либо к соединению, содержащему этот анион.
- Примеры обычных оксидов включают диоксид кремния (SiO 2 ), оксид железа (Fe 2 O 3 ), диоксид углерода (CO 2 ) и оксид алюминия (Al 2 O 3 ). .
- Оксиды обычно бывают твердыми или газообразными.
- Оксиды образуются естественным образом, когда кислород воздуха или воды реагирует с другими элементами.
Образование оксидов
Большинство элементов образуют оксиды. Благородные газы могут образовывать оксиды, но это происходит редко.Благородные металлы устойчивы к взаимодействию с кислородом, но в лабораторных условиях образуют оксиды. Естественное образование оксидов включает окисление кислородом или гидролиз. Когда элементы горят в богатой кислородом среде (например, металлы в термитной реакции), они легко образуют оксиды. Металлы также реагируют с водой (особенно щелочными металлами) с образованием гидроксидов. Большинство металлических поверхностей покрыто смесью оксидов и гидроксидов. Этот слой часто пассивирует металл, замедляя дальнейшую коррозию от воздействия кислорода или воды.Железо в сухом воздухе образует оксид железа (II), но гидратированные оксиды железа (ржавчина) Fe 2 O 3-x (OH) 2x образуются, когда присутствуют и кислород, и вода.
Номенклатура
Соединение, содержащее оксид-анион, можно просто назвать оксидом. Например, CO и CO 2 оба являются оксидами углерода. CuO и Cu 2 O — оксид меди (II) и оксид меди (I) соответственно. В качестве альтернативы для обозначения можно использовать соотношение между катионом и атомами кислорода.Для именования используются греческие числовые префиксы. Итак, вода или H 2 O — это монооксид дигидрогена. CO 2 — диоксид углерода. СО — диоксид углерода.
Оксиды металлов также могут быть названы с использованием суффикса -a . Al 2 O 3 , Cr 2 O 3 и MgO представляют собой, соответственно, оксид алюминия, оксид хрома и магнезию.
Для оксидов используются специальные названия, основанные на сравнении более низких и высоких степеней окисления кислорода. Под этим наименованием O 2 2- представляет собой пероксид, а O 2 — представляет собой супероксид.Например, H 2 O 2 — это перекись водорода.
Структура
Оксиды металлов часто образуют структуры, подобные полимерам, где оксид связывает вместе три или шесть атомов металла. Полимерные оксиды металлов обычно нерастворимы в воде. Некоторые оксиды являются молекулярными. К ним относятся все простые оксиды азота, а также оксид углерода и диоксид углерода.
Что не является оксидом?
Чтобы быть оксидом, степень окисления кислорода должна быть -2, и кислород должен действовать как анион.Следующие ионы и соединения технически не являются оксидами, поскольку не соответствуют этим критериям:
- Дифторид кислорода (OF 2 ) : Фтор более электроотрицателен, чем кислород, поэтому он действует как катион (O 2+ ), а не как анион в этом соединении.
- Диоксигенил (O 2 + ) и его соединения : Здесь атом кислорода находится в степени окисления +1.
Источники
- Чатман, С.; Zarzycki, P .; Россо, К. М. (2015). «Самопроизвольное окисление воды на гранях кристаллов гематита (α-Fe2O3)». Прикладные материалы и интерфейсы ACS . 7 (3): 1550–1559. DOI: 10.1021 / am5067783
- Cornell, R.M .; Швертманн, У. (2003). Оксиды железа: структура, свойства, реакции, встречаемость и использование (2-е изд.). DOI: 10.1002 / 3527602097. ISBN 9783527302741.
- Кокс, П.А. (2010). Оксиды переходных металлов. Введение в их электронную структуру и свойства .Издательство Оксфордского университета. ISBN 9780199588947.
- Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
- ИЮПАК (1997). Сборник химической терминологии (2-е изд.) («Золотая книга»). Составлено А. Д. Макнотом и А. Уилкинсоном. Научные публикации Блэквелла, Ox ford.
Проверка pH оксидов | Эксперимент
В этом эксперименте студенты тестируют образцы различных оксидов в воде с универсальным индикаторным раствором, наблюдая, что их pH меняется.Они основывают идею о том, что растворимые оксиды металлов являются щелочными, а оксиды неметаллов — кислотными.
Сам эксперимент довольно короткий, но до и после практической работы должно быть достаточно времени для обсуждения.
Оборудование
Аппарат
- Защита глаз
- Пробирки, 6 шт.
- Штатив для пробирок
- Таблица цветов pH
Химическая промышленность
- Доступ к следующим решениям (см. Примечания 10 и 11 ниже):
- Азотная (V) кислота (обозначенная как «Оксид азота и вода»), 0.2 М (РАЗДРАЖАЮЩИЙ)
- Фосфорная (V) кислота (обозначенная как «оксид фосфора (V) и вода»), 0,2 M
- Серная кислота (VI) (обозначенная «Диоксид серы и вода»), 0,2 M
- Гидроксид калия (с пометкой «Оксид калия и вода»), 0,2 М (РАЗДРАЖАЮЩИЙ)
- Гидроксид натрия (обозначенный как «Оксид натрия и вода»), 0,2 М (РАЗДРАЖАЮЩИЙ)
- Известковая вода (с маркировкой «Оксид кальция и вода»)
- Универсальный индикаторный раствор (ВОСПЛАМЕНЯЮЩИЙСЯ), полный диапазон, во флаконе-капельнице (или флакон с пипеткой-капельницей)
Примечания по технике безопасности, охране труда и технике
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда пользуйтесь защитными очками.
- Азотная (V) кислота, HNO 3 (водный), (РАЗДРАЖАЮЩИЙ) — см. CLEAPSS Hazcard HC067 и CLEAPSS Recipe Book RB061.
- Фосфорная (V) кислота, H 3 PO 4 (водн.) — см. CLEAPSS Hazcard HC072 и CLEAPSS Recipe Book RB065.
- Серная (VI) кислота, H 2 SO 4 (водн.) — см. CLEAPSS Hazcard HC098a и книгу рецептов CLEAPSS RB098.
- Раствор гидроксида калия, КОН (водный), (РАЗДРАЖАЮЩИЙ) — см. CLEAPSS Hazcard HC091b и книгу рецептов CLEAPSS RB071.
- Раствор гидроксида натрия, NaOH (водн.), (РАЗДРАЖАЮЩИЙ) — см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
- Известковая вода, Ca (OH) 2 (водный), (рассматривается как РАЗДРАЖАТЕЛЬ) — см. CLEAPSS Hazcard HC018 и CLEAPSS Recipe Book RB020.
- Универсальный индикаторный раствор (ЛЕГКО ВОСПЛАМЕНЯЮЩИЙСЯ) — см. CLEAPSS Hazcard HC032 и CLEAPSS Recipe Book RB000.
- Растворы могут быть предоставлены в небольших бутылочках-капельницах с этикетками или в небольших конических колбах с капельной пипеткой.Если времени мало, растворы могут быть предоставлены в промаркированных пробирках.
- Концентрация растворов не является критической (подходит 0,1 или 0,2 М). Однако они должны быть менее 0,5 М. При предлагаемых концентрациях растворы фосфорной и серной кислот представляют минимальную опасность. Однако может быть целесообразно обозначить растворы как РАЗДРАЖАЮЩИЕ.
Процедура
- Поместите 2 см 3 образцов каждого раствора «оксида и воды» в отдельные пробирки.
- К каждой пробе добавить 3 капли раствора универсального индикатора. Обратите внимание на цвет индикатора в каждом образце.
- Запишите результаты в подходящую таблицу, указав название оксида, цвет универсального индикатора, pH и то, является ли оксид кислотным, щелочным или нейтральным в воде.
Учебные заметки
Растворы не упоминаются и не обозначаются как «раствор оксидов», поскольку оксиды не растворяются — они реагируют с водой.Подход «оксид и вода» позволяет сосредоточить внимание на основной теме обучения без необходимости охватывать другой набор реакций (хотя они могут быть охвачены соответствующей группой студентов).
Обычно оксиды металлов являются основными, а оксиды неметаллов — кислотными. Некоторые оксиды металлов реагируют с водой с образованием щелочных растворов. Важно отметить, что некоторые оксиды металлов не вступают в реакцию с водой. Они испытывают нейтральность в воде, потому что они нерастворимы, но они все еще являются основаниями, потому что реагируют с кислотами.Оксиды неметаллов реагируют с водой с образованием кислот.
Дополнительная информация
Это ресурс из проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Этот сборник из более чем 200 практических занятий демонстрирует широкий спектр химических концепций и процессов. Каждое упражнение содержит исчерпывающую информацию для учителей и технических специалистов, включая полные технические примечания и пошаговые инструкции. Практическая химия сопровождает практическую физику и практическую биологию.
© Фонд Наффилда и Королевское химическое общество
Проверено на здоровье и безопасность, 2016 г.
Оксидные минералы — обзор
6.2.4 Минералогия
В целом конкреции состоят из смеси оксидных минералов Mn и Fe, аморфных компонентов и различных второстепенных силикатных фаз. Наиболее распространенными фазами Mn являются тодорокит (манганит 10 Å), бирнессит (манганит 7 Å) и δ-MnO 2 (также известный как вернадит; Burns and Burns, 1977).Другие минералы Mn, такие как пиролюзит, псиломелан, криптомелан и литиофорит, которые в изобилии встречаются в наземных месторождениях Mn, менее распространены в глубоководных конкрециях (Таблица 6.4). В конкрециях северного ИОНФ преобладает тодорокит, шероховатая структура поверхности, они относительно богаты Mn, Ni и Cu и связаны с радиоляционными отложениями, богатыми монтмориллонитом, хлоритом и иллитом. Напротив, конкреции южного ИОНФ имеют δ-MnO 2 в качестве доминирующего минерала, имеют гладкую структуру поверхности, относительно богаты Fe и Co и связаны с килями фораминифер, цеолитов и глинистых минералов (хлорита и иллит; Рао, 1987).Независимо от типа зародышей, тодорокит является основным минералом конкреций IONF (рис. 6.4) и незначительным присутствием бирнессита (рис. 6.6; Sarkar et al., 2008).
Таблица 6.4. Основные минералы марганца в Мировом океане Конкреции
| Минералы | Диагностические признаки | Mn | Fe | Mn / Fe | Ni | Cu | Co | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Манганит 10 Å, шаг d 9.6, | 20,0 | 9,50 | 2,10 | 0,84 | 0,69 | 0,13 | 0,08 | 0,10 | |||
| (Na, Ca, Mn 2+ 2) Mn 12 3H 2 O | [3MnO 2 Mn (OH) 2 xH 2 O] и буссерит | ||||||||||
| Birness227 d-интервал 7.2) | |||||||||||
| Na 0.7 Ca 0,3 Mn 7,0 O 14,2 · 8H 2 O | CaO 3,38, Na 2 O 2,82, K 2 O 0,76, MgO 3,06, SiO 2 0,06 | 77,62 | 0,12 | — | — | 0,05 | — | — | |||
| δ-MnO 2 | Неупорядоченный бирнессит (вернадит) d-зазоры 2,4 Å, 1,4 Å | 14,7 0,25 | 0,08 | 0.36 | 0,14 | 0,05 |
Все элементы в мас.%. Состав бирнессита в оксиде (мас.%).
Составлено из Burns and Burns (1977), Chukhrov et al. (1978), Cronan (1980), Rao (1987) и Mukhopadhyay (1988).
Рисунок 6.6. Сканирующая электронная микрофотография конкреций IONF, показывающая пластинчатые кристаллы бирнессита.
Мёссбауэровская спектроскопия подтвердила, что Fe в конкрециях встречается в основном в виде оксигидроксида железа, вероятно, представляющего собой смесь гетита (α-FeOOH) и лепидокрокита (γ-FeOOH).Другими Fe-содержащими минералами являются гематит (α-Fe 2 O 3 ), маггемит (γ-Fe 2 O 3 ) и акаганеит (β-FeOOH), в то время как оксигидроксид железа может присутствовать в незначительных количествах. суммы. Фазы Fe являются либо очень мелкозернистыми, либо аморфным гидратированным полимером оксигидроксида железа (FeOOH · xH 2 O; Johnson and Glasby, 1969; Burns and Burns, 1977). Из-за изоструктурного характера эпитаксиальные срастания FeOOH · xH 2 O и δ-MnO 2 могут объяснять тесную ассоциацию δ-MnO 2 и тодорокита (Burns and Burns, 1977; Rao and Nath, 1988 ).Сообщалось, что большая часть Mn в конкрециях IONF находится в форме Mn (IV), а железо присутствует только в виде Fe (III) в парамагнитной или суперпарамагнитной фазе (Pattan and Mudholkar, 1991).
Общие акцессорные минералы в конкрециях — кварц, полевой шпат, пироксены, амфиболы, глинистые минералы, цеолиты, биотит, оливин, рутил, магнетит, ильменит, барит, сфен, кальцит, арагонит и апатит. Концентрация обломочного кварца в некоторых богатых Mn слоях конкреций IONF свидетельствует о спорадических притоках обломков в определенные интервалы геологического прошлого (Ghosh, 1982).Минеральные группы, такие как цеолиты (обычно филлипсит) и глина (преимущественно монтмориллонит-хлорит), представляют собой продукты изменений подводных вулканитов и имеют аутигенное происхождение (Iyer and Sudhakar, 1993a; Ghosh and Mukhopadhyay, 1995). Бадделеит (ZrO 2 ) встречается в конкрециях IONF в виде отдельных изолированных зерен от субокруглой до эллиптической формы или в виде кластеров, образующих мелкие субидиоморфные кристаллы (<3 мкм). Их способ возникновения, структурные особенности и состав предполагают обломочное и, возможно, аутигенное происхождение (Nayak et al., 2011).
Используя структуру ближнего края поглощения рентгеновских лучей (XANES) и спектроскопию поглощения рентгеновских лучей (EXAFS), Manceau et al. (2014) измеряли второстепенные элементы гидрогенных и диагенетических конкреций Тихого океана. Они сообщили, что в гидрогенетическом конкреции Mn определяется как Fe-вернадит, нанокомпозитный материал, состоящий из срастания фероксигита (δ-FeOOH) и монодисперсных слоев филломанганата без промежуточного слоя Mn (вернадита). Напротив, в диагенетическом конкреции Mn определяется преимущественно как богатый магнием вернадит 10 Å, который состоит из случайных срастаний вернадита и продукта его превращения — тодорокита.Аналогичным образом, с использованием спектроскопии тонкой структуры поглощения рентгеновских лучей с микропространством, методов дифракции микрорентгеновских лучей и спектроскопии микро-XANES был изучен конкреция возрастом ~ 3,7 млн лет из южной части Тихого океана (Marcus et al., 2015). Результаты показали, что оксигидроксиды Fe превратились в более стабильные фазы за миллионы лет, в то время как Ti и V были пространственно коррелированы с Fe и, как было обнаружено, адсорбируются Fe-содержащими минералами.
В нескольких исследованиях наблюдалась региональная изменчивость минералогии конкреций.Например, тодорокит является основным минералом в конкрециях из более глубоких океанических бассейнов и встречается в менее окислительных условиях. Более окисленная фаза, δ-MnO 2 , обычна в конкрециях на небольших глубинах на возвышенностях, например, на вершине (и на склоне) подводных гор и абиссальных холмов. Бирнессит расположен между двумя ранее упомянутыми фазами (таблица 6.4). Однако отклонения от этого правила были отмечены в зоне Кларион-Клиппертон (CCZ) (Glasby, Thijssen, 1982), в некоторых местах IONF (Mukhopadhyay, 1988), в бассейне Мадагаскара и плато Блейк (Cronan, 1975).Это связано с тем, что минералогия конкреций также определяется конкретной средой формации, такой как преобладающая степень окисления, вызванная придонными водными течениями [антарктическая донная вода (AABW), глубоководная вода Северной Атлантики (NADW) и другие водные массы], относительные скорости диагенетическое снабжение металлом (обогащение Mn) и фазовое превращение (преобразование δ-MnO 2 после осаждения в тодорокит) посредством внутриузлового диагенеза.
Включение переходных металлов в конкреции контролируется атомным соотношением таких металлов по отношению к Mn.В IONF тодорокит связан с кремнистым осадком, который характеризует биологическую продуктивность от высокой до умеренной. Тодорокит залегает на большей глубине и позволяет легко заменить Mn 2+ на Ni и Cu. Напротив, δ-MnO 2 , бирнессит и FeOOH встречаются на относительно небольшой глубине воды, в основном в ассоциации с пелагическими отложениями, проявляющими низкую биологическую активность. Такая ситуация способствует включению Со и Pb в больших количествах в фазу Mn 4+ в бирнессите и фазу Fe 3+ в FeOOH (Burns and Burns, 1977).Аналогичная ситуация с CCZ предполагает, что повышенная биологическая продуктивность может способствовать повышенному высвобождению ионов двухвалентных металлов в осадочную колонку. Это может повлиять на усиление образования и стабилизации тодорокита в конкрециях, что приведет к росту конкреций высокого содержания (Glasby and Thijssen, 1982). Таким образом, представляется, что биологическая продуктивность, минералогия и химический состав взаимосвязаны и объясняют отмеченные различия в конкрециях IONF.
Оксид — обзор | Темы ScienceDirect
3.3.3.3.2. (I) Лиганды, содержащие донорные атомы 16-й группы
Оксиды . Все указанные диоксиды AnO 2 (An = Am, Cm, Bk и Cf) обладают структурой флюорита. Интересно, что параметры решетки, определенные для AmO 2 , не согласовывались. 976–978 Морсс и соавторы 979 сообщили об исследовании дифракции нейтронов и магнитной восприимчивости диоксида Cm, полученного прокаливанием оксалата Cm III .На основании параметра решетки стехиометрия этого материала составила CmO 1,99 ± 0,01 , что указывает на то, что материал по существу содержал только Cm IV . Тем не менее, эффективный парамагнитный момент оказался равным (3,36 ± 0,06) μ B , значение, которое ранее приписывалось присутствию Cm III . Эти данные, возможно, предполагают, что для Am и Cm следует рассматривать фазы AnO 2 ± x , как это было сделано для Pu. Оксиды могут быть получены путем нагревания различных оксоанионных комплексов (например,g., нитраты, оксалаты и т. д.) в воздухе или кислороде при температуре выше 600 ° C. Другие бинарные оксиды неизвестны.
Трехкомпонентные оксиды типов M 2 AmO 3 (M = Li, Na), MAmO 3 и Li 2 AnO 6 (Am = Am, Cm). Их получают нагреванием диоксидов с оксидом щелочного или щелочноземельного металла при высоких температурах в вакууме или в азоте. Недавно появились сообщения о тройных оксидах BaCmO 3 905 и Cm 2 CuO 4 906 .
Гидроксиды . Попытки охарактеризовать Am (OH) 4 пока не увенчались успехом. Сообщается, что осадок, представляющий собой Am (OH) 4 , был получен нагреванием Am (OH) 3 при 90 ° C в 0,2 М NaOH с NaOCl или в 7 М КОН с пероксидисульфатом. 980 Растворение этого осадка в серной или азотной кислоте приводит к смеси Am III , Am V и Am VI . Было высказано предположение, что AmO 2 (OH) 2 осаждается в слабощелочных концентрированных растворах NaCl в инертной атмосфере, но он еще не охарактеризован. 981,982
Карбонаты и карбоксилаты . Сообщается только об одном комплексе карбоната Am IV . Из данных комбинированной спектроскопии и циклической вольтамперометрии в растворах бикарбоната / карбоната, 983 был сделан вывод, что Am (CO 3 ) 5 6- является предельным карбонатным комплексом Am IV . Его образование согласуется с константой стабильности, ожидаемой на основе констант аналогичных пентакарбонатных форм более легких актинидов.Твердые карбонаты Am IV не известны, но ограничивающий комплекс, вероятно, изоструктурен аналогичному карбонату Pu IV , показанному выше.
Прочие . Единственный известный четырехвалентный силикат трансплутония, 241 AmSiO 4 , получают взаимодействием Am (OH) 4 с избытком SiO 2 в растворе NaHCO 3 при 230 ° C. Это твердое вещество запатентовано для использования в промышленных альфа-источниках.
Полиоксометаллаты недавно были использованы для стабилизации Am IV .Chartier et al. сообщил о спектроскопических свидетельствах образования AmP 2 W 17 O 61 6− и Am (P 2 W 17 O 61 ) 2 16− по их оптической плотности. полосы при 789 нм и 560 нм соответственно. 928 Однако образование красного комплекса Cm IV в растворе фосфовольфрамата было достигнуто за счет использования пероксидисульфата в качестве окислителя. 447 Косяков и др. продемонстрировал, что в таких растворах Cm IV восстанавливается намного быстрее, чем может быть объяснено радиолитическими эффектами, в то время как Am IV в таких растворах является гораздо более стабильным, снижаясь со скоростью, приписываемой только радиолитическим эффектам. . 446
Комплексная научная оценка (ISA) для оксидов азота, оксидов серы и твердых частиц — экологические критерии | Комплексные научные оценки (ISA)
Выпуск
Двуокись азота (NO 2 ) — это один из группы высокореактивных газов, известных как «оксиды азота» или «оксиды азота».«В настоящем стандарте используется термин« оксиды азота »для обозначения всех форм соединений окисленного азота (NO Y ), включая оксид азота (NO), диоксид азота (NO 2 ) и все другие соединения, содержащие окисленный азот. образован из NO и NO 2 . Национальный стандарт качества окружающего воздуха EPA в настоящее время использует NO 2 в качестве индикатора для более крупной группы оксидов азота.
Диоксид серы (SO 2 ) является одним из группы газов с высокой реакционной способностью, известных как «оксиды серы» или «оксиды серы».«Оксиды серы определены здесь как включающие моноксид серы (SO), диоксид серы (SO 2 ), триоксид серы (SO 3 ), монооксид серы (S 2 O) и сульфат (SO 4 . 2−). Однако SO, SO 3 и S 2 O присутствуют на гораздо более низких уровнях окружающей среды, чем SO 2 и SO 4 2-, и поэтому не включены в ISA. Национальный стандарт качества окружающего воздуха EPA в настоящее время использует SO 2 в качестве индикатора для более крупной группы оксидов серы.
Твердые частицы (ТЧ) представляют собой сложную смесь чрезвычайно мелких частиц и капель жидкости, взвешенных в воздухе. Твердые частицы состоят из некоторых или всех следующих компонентов: нитрата (NO 3-), SO 4 2-, аммония (NH 4+ ), металлов, минералов (пыли), а также органических и органических веществ. элементарный углерод (C). Национальный стандарт качества окружающего воздуха EPA в настоящее время использует PM 2,5 и PM 10 в качестве индикатора для более крупной группы твердых частиц.
Прямое воздействие газообразных SO X и NO Y в окружающем воздухе на растительность, включая повреждение листьев и растений. Однако существует мало свидетельств того, что такие эффекты возникают при нынешних уровнях воздействия в США.Кроме того, NO Y , SO X и PM на текущих уровнях, которые наблюдаются в США, способствуют общему осаждению азота и серы. В свою очередь, осаждение азота и серы вызывает изменение биогеохимии и физиологии организмов из нескольких таксономических групп (например,грамм.; диатомовые водоросли, лишайники, травянистые растения и деревья), что приводит к снижению биоразнообразия наземных, пресноводных, водно-болотных и эстуарных экосистем в США
Действия EPA
Закон о чистом воздухе требует от EPA периодически анализировать научные данные по шести основным загрязнителям воздуха, включая оксиды азота, оксиды серы, твердые частицы, оксид углерода, озон и свинец. Центр оценки общественного здоровья и окружающей среды Агентства по охране окружающей среды (бывший Национальный центр экологической оценки) разрабатывает комплексные научные оценки (ISA), которые обобщают научные данные, относящиеся к здоровью и благополучию человека (e.g., климат, видимость, экосистема), вызванные этими загрязнителями. МСА обеспечивают всестороннюю оценку наиболее актуальной для политики научной литературы, опубликованной после последнего обзора национальных стандартов качества окружающего воздуха (NAAQS), и в сочетании с другими техническими оценками, таким образом, предоставляют политически значимую научную информацию, необходимую для проведения обзора адекватности. действующего NAAQS.
EPA впервые установило вторичный NAAQS для оксидов азота в 1971 году, среднегодовое значение NO 2 при 0.053 частей на миллион (53 частей на миллиард) для защиты от фитотоксичности растений. EPA впервые установило вторичный NAAQS для оксидов серы в 1971 году, в среднем за 3 часа SO 2 на уровне 500 частей на миллиард, также для защиты от фитотоксичности растений. В 2012 году EPA совместно проанализировало вторичный NAAQS для оксидов азота и серы из-за связанных с ними продуктов трансформации в окружающем воздухе, вклада в осаждение азота и серы и их совместного вклада в экологические последствия. В этом обзоре EPA решило сохранить вторичный NAAQS для NO 2 и SO 2 .
В декабре 2012 года Агентство по охране окружающей среды США объявило о своих окончательных решениях по последней проверке вторичного NAAQS для твердых частиц. Агентство по охране окружающей среды США сохранило 24-часовые и годовые стандарты PM 2,5 и 24-часовые стандарты PM 10 для решения проблемы заметного и незаметного воздействия на благосостояние.
В 2020 году Агентство по охране окружающей среды выпустило обновление к версии 2008 года Интегрированной научной оценки для оксидов азота и серы — Экологические критерии (окончательные) . Из-за перекрытия воздействия загрязнителей воздуха на экосистемы, твердые частицы были добавлены в отчет таким образом, что экологические оценки были объединены в единый отчет о критериях, названный Интегрированная научная оценка (ISA) для оксидов азота, оксидов азота. Экологические критерии содержания серы и твердых частиц (окончательный отчет) , выпущенный в октябре 2020 года.
