Содержание
Особенности органических соединений — Справочник химика 21
Свойства органических соединений. Особенностью органических соединений являются их физические и химические свойства, определяемые характером связи в их молекулах. Вследствие промежуточного характера углерода ковалентные связи в молекулах органических соединений преимущественно мало полярны. Это в большинстве случаев обусловливает и малую полярность самих молекул органических соединений. Большинство органических соединений характеризуется кристаллическими решетками молекулярного типа, непрочность которых обусловливает значительную летучесть и легкоплавкость веществ, и отсутствием электропроводности как в индивидуальном, так и в растворенном состояниях. Таким образом, органические соединения являются преимущественно неэлектролитами и химически сравнительно мало активны. [c.75]
Изомерия и ковалентная связь — главные особенности органических соединений. Явления изомерии, многообразие органических соединений объясняет теория химического строения веществ А. М. Бутлерова. [c.176]
Явления изомерии, многообразие органических соединений объясняет теория химического строения веществ А. М. Бутлерова. [c.176]
Ядерный магнитный резонанс. Все рассмотренные нами до сих пор методы атомного и молекулярного спектрального анализа относились к оптическим областям спектра. Но оказалось, что и в радиоволновой области в определенных условиях можно получать ценные сведения о структуре химических, особенно органических, соединений. Метод ядерного магнитного резонанса, первые практические применения которого имеют всего 10 — 15-летнюю давность, стал в настоящее время одним из основных методов установления структуры органических соединений. Одновременно быстро увеличивается круг его применения для целей качественного и количественного анализа, особенно в случае сложных задач, когда применение других методов мало эффективно. Уже в настоящее время в ряде производств сложных органических соединений в химико-фармацевтической промышленности и производстве красителей для цветных фотоматериалов ход производства и качество готовой продукции контролируется методом ядерного магнитного резонанса. Несомненно, что и в ближайшем будущем применение этого метода в аналитических целях будет стремительно расти. [c.342]
Несомненно, что и в ближайшем будущем применение этого метода в аналитических целях будет стремительно расти. [c.342]
Теория радикалов правильно отмечала одну из особенностей органических соединений — существование в них устойчивых группировок атомов, остающихся незатронутыми при химических превращениях. Однако Я. Берцелиус и его последователи считали эту устойчивость абсолютной и не могли поэтому объяснить со своих позиций тех весьма многочисленных и важных превращений органических веществ, при которых радикалы изменяются путем замещения или изомеризации. Точно так же представления Я. Берцелиуса о наличии заряженных полюсов в органических молекулах были слишком прямолинейными, негибкими, хотя в своей сути они перекликаются с современными представлениями о поляри- [c.20]
Теория типов пыталась свести все многообразие органических соединений к немногим простейшим типам, выводя из них все вещества путем замещения. Относя спирты к типу воды, амины к типу аммиака, теория типов подчеркивала и выдвигала на первый план то общее, что присуще гомологическому ряду, — функциональную группу (в приведенных примерах гидроксил, аминогруппа). Тем самым теория типов подчеркивала новую, не замечавшуюся сторонниками теории радикалов особенность органических соединений наличие определенных группировок атомов— функциональных групп, оказывающих решающее влияние на химический характер соединения. [c.21]
Относя спирты к типу воды, амины к типу аммиака, теория типов подчеркивала и выдвигала на первый план то общее, что присуще гомологическому ряду, — функциональную группу (в приведенных примерах гидроксил, аминогруппа). Тем самым теория типов подчеркивала новую, не замечавшуюся сторонниками теории радикалов особенность органических соединений наличие определенных группировок атомов— функциональных групп, оказывающих решающее влияние на химический характер соединения. [c.21]
К особенностям органических соединений можно также отнести существование гомологических рядов, у которых каждый последующий член может быть произведен от предыдущего добавлением одной определенной для данного ряда группы атомов. Например, в гомологическом ряду предельных углеводородов такой группой является СНз. Гомологический ряд характеризуется общей формулой, например С Н2ч+2, для предельных углеводородов. Члены гомологического ряда имеют определенную общность в химических свойствах. В то же время происходит закономерное изменение физических свойств элементов по мере увеличения числа групп.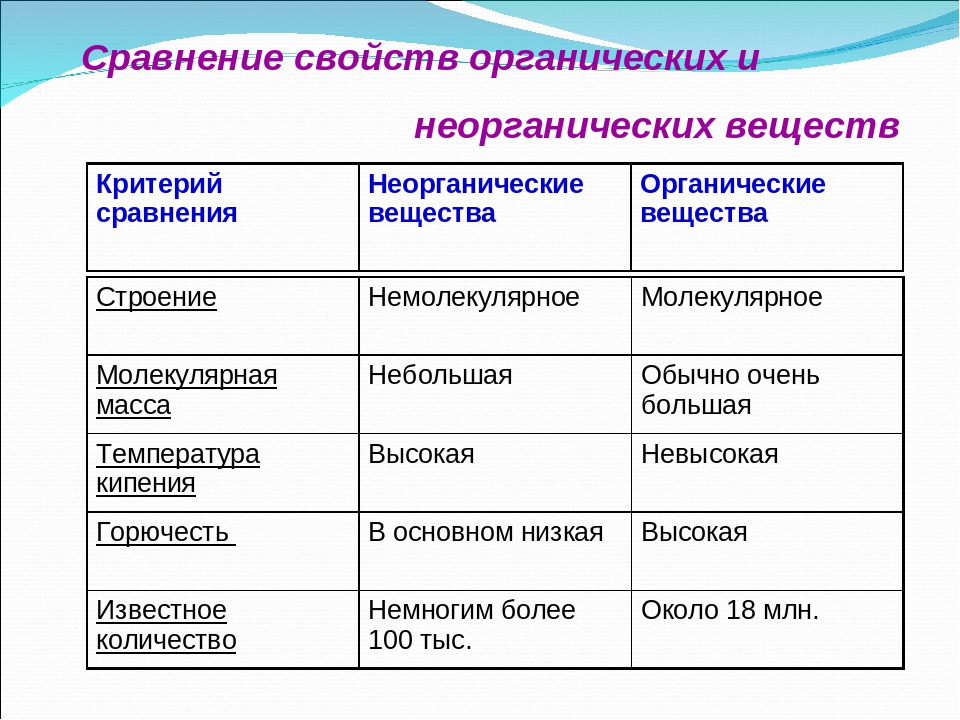 [c.298]
[c.298]
Отличительные особенности органических соединений 451 [c.451]
I. Все особенности органических соединений определяются. ежде всего, свойствами элемента углерода. [c.453]
Одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах. В подавляющем большинстве эти связи имеют ярко выраженный ковалентный характер. Поэтому органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом. Время, необходимое для завершения реакций между органическими веществами, обычно измеряется часами, а иногда и днями. Вот почему в органической химии применение различных катализаторов имеет особенно больщое значение. [c.550]
Особенность органических соединений как веществ с ковалентными связями сказывается не только на их физических, но и на химических свойствах.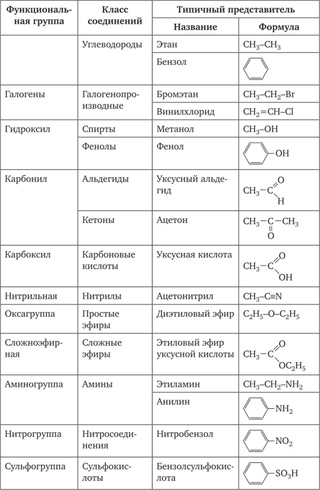 Реакции в растворах электролитов неорганических соединений протекают с большой скоростью (практически мгновенно), например [c.136]
Реакции в растворах электролитов неорганических соединений протекают с большой скоростью (практически мгновенно), например [c.136]
Особенности органических соединений. Органические соединения очень многочисленны и разнообразны, их число превышает 4 млн. Разнообразие органических соединений в значительной мере обусловлено способностью атомов углерода образовывать ковалентные связи друг с другом. Вследствие высокой прочности связей углерод — углерод образуются цепи, состоящие из большого числа углеродных атомов. Цепи могут быть как открытыми, так и замкнутыми (циклы). Углерод взаимодействует со многими другими атомами. С водородом углерод образует соединения, называемые углеводородами. Разнообразие органических соединений также обусловлено явлением изомерии, которое заключается в существовании веществ одинаковых по составу и [c.297]
Все специфические особенности органических соединений проявляют уже так называемые углеводороды — вещества, состоящие только из углерода и водорода. Но, как мы увидим дальше (стр. 35, 36), все более сложные органические соединения можно рассматривать как производные углеводородов. На это еще обратил внимание известный немецкий ученый-материалист К- Шорлеммер (1871 г.), который предложил органическую химию характеризовать как химию углеводородов и их производных. Такое определение наиболее правильно отражает особенности органической химии оно указывает, что ее предметом является более высоко организованная материя, по сравнению с неорганической химией, предметом которой являются элементы и их соединения. [c.13]
Но, как мы увидим дальше (стр. 35, 36), все более сложные органические соединения можно рассматривать как производные углеводородов. На это еще обратил внимание известный немецкий ученый-материалист К- Шорлеммер (1871 г.), который предложил органическую химию характеризовать как химию углеводородов и их производных. Такое определение наиболее правильно отражает особенности органической химии оно указывает, что ее предметом является более высоко организованная материя, по сравнению с неорганической химией, предметом которой являются элементы и их соединения. [c.13]
Особенности органических соединений. Изомерия [c.219]
ОСОБЕННОСТИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ХИМИЯ ПОЛИМЕРОВ [c.369]
Особенности органических соединений. [c.369]
Важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии (см. 15.3). [c.272]
В зависимости от характера анализируемого материала различают анализ неорганических и органических веществ. Выделение анализа органических веществ в отдельный раздел аналитической химии связано с некоторыми особенностями органических соединений по сравнению с неорганическими. Часто первый этап анализа состоит в переведении пробы в раствор. При анализе неорганических материалов растворителем чаще всего служит вода или водные растворы кислот или щелочей. Полученный раствор содержит катионы и анионы подлежащих определению элементов. Для их обнаружения применяют реагенты, которые взаимодействуют с определяемыми ионами, как правило, очень быстро, причем в большинстве случаев реакции доходят до конца. При анализе органических соединений нередко необходимо провести предварительную минерализацию пробы, т. е. разрушить ее органическую часть прокаливанием или обработкой концентрированными кислотами. Нерастворимые в воде органические соединения иногда растворяют в органических растворителях реакции между органическими соединениями обычно протекают медленно и почти никогда не доходят до конца, причем они могут протекать по нескольким направлениям с образованием разнообразных продуктов реакции.
Выделение анализа органических веществ в отдельный раздел аналитической химии связано с некоторыми особенностями органических соединений по сравнению с неорганическими. Часто первый этап анализа состоит в переведении пробы в раствор. При анализе неорганических материалов растворителем чаще всего служит вода или водные растворы кислот или щелочей. Полученный раствор содержит катионы и анионы подлежащих определению элементов. Для их обнаружения применяют реагенты, которые взаимодействуют с определяемыми ионами, как правило, очень быстро, причем в большинстве случаев реакции доходят до конца. При анализе органических соединений нередко необходимо провести предварительную минерализацию пробы, т. е. разрушить ее органическую часть прокаливанием или обработкой концентрированными кислотами. Нерастворимые в воде органические соединения иногда растворяют в органических растворителях реакции между органическими соединениями обычно протекают медленно и почти никогда не доходят до конца, причем они могут протекать по нескольким направлениям с образованием разнообразных продуктов реакции.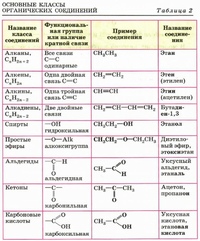 Б анализе применяют и некоторые другие [c.13]
Б анализе применяют и некоторые другие [c.13]
ОСОБЕННОСТИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. [c.460]
I. ОСОБЕННОСТИ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ. [c.460]
Все изложенное выше свидетельствует о том, что масс-спектрометрический метод позволяет получать много информации, касающейся структурных особенностей органических соединений. К сожалению, этот метод не столь универсален. Поэтому при решении структурно-аналитических задач он чаще всего используется в совокупности с другими физико-химическими методами, такими, как УФ-, ИК-, ЯМР-спектроскопия. В отличие от этих методов, которые дают сведения о наличии тех или иных функциональных групп, масс-спектрометрия представляет информацию о молекулярной массе, элементном составе, других особенностях структуры и позволяет рассматривать молекулу как субстанцию в целом. [c.199]
В настоящее время еще далеко не выявлены все те большие возможности в исследовании структурных особенностей органических соединений, которые заложены в самом полярографическом методе. Больше того, в некоторых случаях, правда, довольно редких, эти возможности даже подвергаются сомнениям это связано, в первую очередь, с тем, что результаты полярографических определений иногда пытаются применить к анализу структурных особенностей органических молекул без учета механизма электродного процесса и некоторых усложняющих его моментов, вызванных адсорбцией и кинетическими ограничениями (см. разд. 2.1). Учет же этих факторов практически всегда приводит полярографические характеристики органических соединений в соответствие со структурными фрагментами их молекул. [c.48]
Больше того, в некоторых случаях, правда, довольно редких, эти возможности даже подвергаются сомнениям это связано, в первую очередь, с тем, что результаты полярографических определений иногда пытаются применить к анализу структурных особенностей органических молекул без учета механизма электродного процесса и некоторых усложняющих его моментов, вызванных адсорбцией и кинетическими ограничениями (см. разд. 2.1). Учет же этих факторов практически всегда приводит полярографические характеристики органических соединений в соответствие со структурными фрагментами их молекул. [c.48]
Неограниченная сложность строения и многообразие молекул органических соединений. Достаточно назвать природные биополимеры — белки, полисахариды, синтетические полимеры — капрон, лавсан, полиэтилен и т. д., вета-мины, гормоны и особенно нуклеиновые кислоты, молекулярная масса которых доходит до 41 о . Эта особенность органических соединений обусловлена способностью атома углерода образовывать бесконечно длинные цепи [c. 12]
12]
В области теории электрокатализа главной проблемой является, по-видимому, разработка критериев для более целенаправленного поиска электрохимически активных и стабильных соединений, если учесть многообразие неорганических и особенно органических соединений. [c.130]
Отличительные особенности органических соединений. Как уже указывалось, число изученных в настоящее время соединений углерода чрезвычайно велико. Но при всем многообразии природных органических веп сств, они обычно состоят из небольшого числа элементов в их состав, кроме углерода, почти всегда входит водород, часто кислород и азот, иногда сера и фосфор. Эти элементы были названы органогенами (т. е. элементами, порождающими органические молекулы) . [c.451]
Отличительной особенностью органических соединений является их многочисленность — известно более Hie rn миллионов органических соединений. Эта особенность объясняется способностью атомов углерода соединяться друг с другом с образованием прочных и длинных цепей, а также циклов.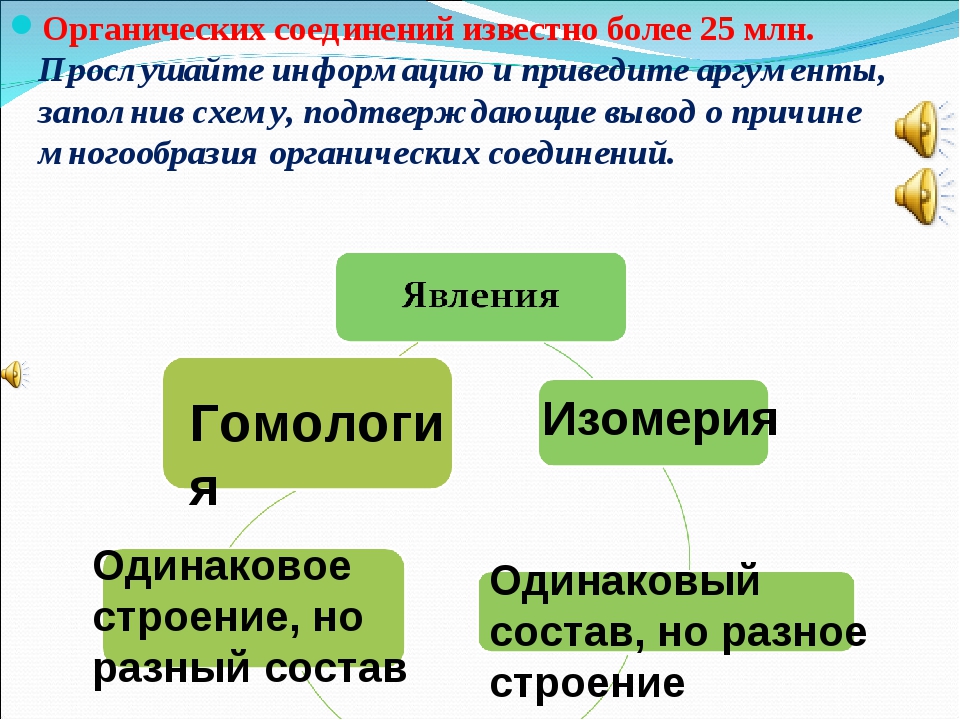 Кроме того, атомы углерода способны присоединять к себе атомы любых других элементов, причем мпоговале.птные атомы — кислорода, азота, серы — иногда входят в состав цепей и циклов, образуемых атомами углерода. Все это обусловило исключительное мн0. 00бразие органических соединений. [c.136]
Кроме того, атомы углерода способны присоединять к себе атомы любых других элементов, причем мпоговале.птные атомы — кислорода, азота, серы — иногда входят в состав цепей и циклов, образуемых атомами углерода. Все это обусловило исключительное мн0. 00бразие органических соединений. [c.136]
Пластинки из любого материала должны быть предварительно тщательно обезжирены и промыты дистиллированной водой. Стеклянные пластинки рекомендуется промывать хромовой смесью. Обезжиренные, промытые и высушенные пластинки надо нредо.хра-нять от пыли и загрязнений, особенно органическими соединениями, Хранить их следует в эксикаторе. [c.135]
В специальных учебных пособиях и руководствах приводится много примеров и упражнений по расшифровке спектров ЯМР, особенно органических соединений. Рассмотрим здесь только один из таких примеров. На рис. 11.2 представлен спектр ПМР полученного ацетилированием ароматического соединения. Брутто-формула соединения СюН1зЫ02, т. е. оно относится к производным ряда С Нгя-8 и кроме бензольного кольца содержит, очевидно, двойную связь С = 0 ацетильной группы СН3СО. В спектре ПМР видно шесть сигналов. Самый интенсивный синглетный сигнал при 2,1 м.д. относится к протонам ацетильной группы. Один из заместителей, несомненно, содержит этильную группу, дающую в спектре квартет (6 = 4 м.д.) и триплет (6=1,4 м.д.). Судя по химическому сдвигу протонов группы —СНг, она не связана непосредственно с бензольным кольцом, а связана с атомом кис- [c.34]
е. оно относится к производным ряда С Нгя-8 и кроме бензольного кольца содержит, очевидно, двойную связь С = 0 ацетильной группы СН3СО. В спектре ПМР видно шесть сигналов. Самый интенсивный синглетный сигнал при 2,1 м.д. относится к протонам ацетильной группы. Один из заместителей, несомненно, содержит этильную группу, дающую в спектре квартет (6 = 4 м.д.) и триплет (6=1,4 м.д.). Судя по химическому сдвигу протонов группы —СНг, она не связана непосредственно с бензольным кольцом, а связана с атомом кис- [c.34]
В первой половине и особенно в 50-х годах прошлого столетия в западноевропейских странах были сделаны попытки создать теории, объясняющие специфические особенности органических соединений (теориярадикалов, Л. Гей-Люссак, 1815, Ф. Велер и Ю. Либих, 1832 теория типов. Ж- Дюма, Ш. Жерар, А. Лоран, А. Кекуле и др., 1840—1854). В кратком курсе нет возможности рассмотреть все эти теории. Укажем, что хотя они и сыграли значительную роль в развитии органической химии, ни одна из них не оказалась [c. 18]
18]
В классе углеводов приходится встречаться со всеми наиболее сложными особенностями органических соединений. Моносахариды способны существовать в ряде таутомерных форм. Присутствие в их молекулах многих асимметрических атомов приводит к появлению большого числа стереоизомеров. Так, вещество состава eHijOg реально существует в природе в виде двух структурных типов, содержащих неразветвленную углеродную цепь (третий структурный тип с формулой П1 в природе не найден) [c.281]
В тех случаях, когда необходимое меченое соединение невозможно получить непосредственным облучением неактивного вещества, приходится прибегать к тем или иным методам синтеза. Обычный химический синтез, легко осуществляемый в наиболее простых случаях, становится чрезвычайно трудоемким при получопии сложных, особенно органических соединений. В этом отношении представляют интерес специальные методы синтеза, основанные на изотопном обмене, радиационно-химических процессах, реакциях горячих атомов и т. п. [7]. Это совершенно новая и весьма перспективная область исследования, возможности которой, невидимому, выходят далеко за рамки задачи получения меченых соединений. [c.12]
Интересная органическая химия. Интересные факты о химии.
В эту самую минуту
Пока Вы читаете данную статью, Ваши глаза используют органическое соединение – ретиналь, который преобразует световую энергию в нервные импульсы. Пока Вы сидите в удобной позе, мышцы спины поддерживают правильную осанку благодаря химическому расщеплению глюкозы с высвобождением требуемой энергии. Как Вы понимаете, пробелы между нервными клетками так же заполнены органическими веществами – медиаторами (или нейространсмиттерами), которые помогают всем нейронам стать одним целым. И данная слаженная система работает без участия Вашего сознания! Так глубоко, как биологи, только химики-органики понимают, насколько филигранно создан человек, как логично устроены внутренние системы органов и их жизненный цикл. Отсюда следует, что изучение органической химии – основа понимания нашей жизни! А качественное изучение – это путь в будущее, ибо новые лекарства создаются прежде всего в химических лабораториях. Наша кафедра желает познакомить Вас поближе с этой прекрасной наукой.
Отсюда следует, что изучение органической химии – основа понимания нашей жизни! А качественное изучение – это путь в будущее, ибо новые лекарства создаются прежде всего в химических лабораториях. Наша кафедра желает познакомить Вас поближе с этой прекрасной наукой.
11-цис-ретиналь, поглощает свет
серотонин – нейромедиатор
Органическая химия как наука
Органическая химия как наука возникла в конце девятнадцатого века. Она возникла на перекрещивании разных сфер жизни – от получения пищи до лечения миллионов людей, не подозревающих о роли химии в их жизни. Химия занимает уникальное место в структуре понимания Вселенной. Это наука о молекулах, но органическая химия является чем-то большим, чем это определение. Органическая химия в буквальном смысле сама себя создает, словно растет. Органическая химия, занимаясь изучением не только природных молекул имеет возможность самой создавать новые вещества, структуры, материи.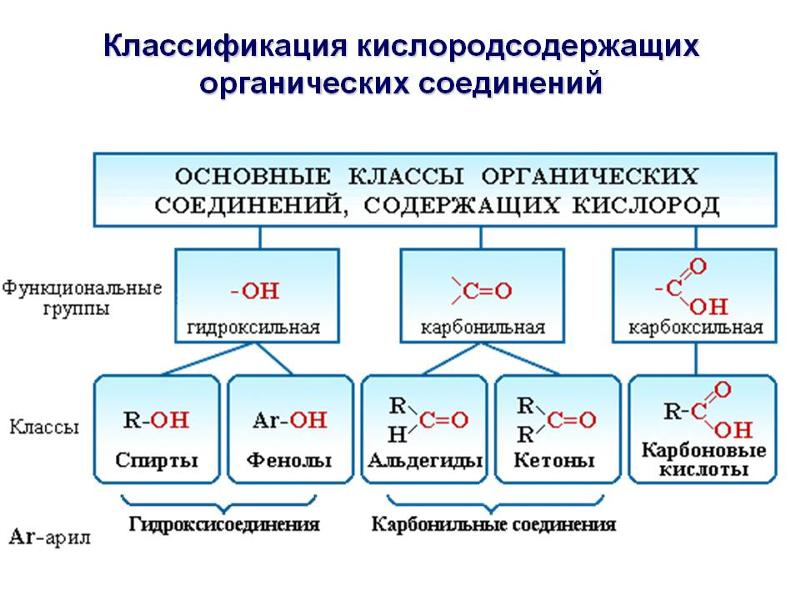 Данная особенность подарила человечеству полимеры, красители для одежды, новые лекарства, духи. Некоторые считают, что синтетические материалы могут нанести вред человеку, либо быть экологически опасными. Однако, как порой отличить черное от белого, так и установить тонкую грань между «опасностью для человека» и «коммерческой выгодой» очень сложно. В этом вопросе так же поможет кафедра Органического синтеза и нанотехнологий (ОСиНТ).
Данная особенность подарила человечеству полимеры, красители для одежды, новые лекарства, духи. Некоторые считают, что синтетические материалы могут нанести вред человеку, либо быть экологически опасными. Однако, как порой отличить черное от белого, так и установить тонкую грань между «опасностью для человека» и «коммерческой выгодой» очень сложно. В этом вопросе так же поможет кафедра Органического синтеза и нанотехнологий (ОСиНТ).
Органические соединения
Органическая химия формировалась, как наука о жизни, ранее считалось, что она сильно отличается от неорганической химии в лаборатории. Затем ученые полагали, что органическая химия – это химия Углерода, особенно соединений каменного угля. В наше время органическая химия объединяет все соединения Углерода как живой, так и не живой природы.
Доступные для нас органические соединения получаются либо из живых организмов, либо из ископаемых материалов (нефть, уголь). Примером субстанций из природных источников являются эфирные масла – ментол (вкус мяты) и цис-жасмон (аромат цветков жасмина). Эфирные масла получают перегонкой с водяным паром; подробности раскроются при обучении на нашей кафедре.
Примером субстанций из природных источников являются эфирные масла – ментол (вкус мяты) и цис-жасмон (аромат цветков жасмина). Эфирные масла получают перегонкой с водяным паром; подробности раскроются при обучении на нашей кафедре.
- Ментол
- Цис-жасмон
- Хинин
Уже в 16 веке был известен алкалоид – хинин, который получают из коры хинного дерева (Южная Америка) и используют против малярии.
Иезуиты, что открыли данное свойство хинина, конечно же не знали его структуры. Тем более в те времена не стоял вопрос о синтетическом получении хинина – что удалось осуществить только в 20 столетии! Ещё любопытная история, связанная с хинином – это открытие фиолетового пигмента мовеина Уильямом Перкиным в 1856 году. Зачем он это сделал и какие результаты его открытия – так же можно узнать на нашей кафедре.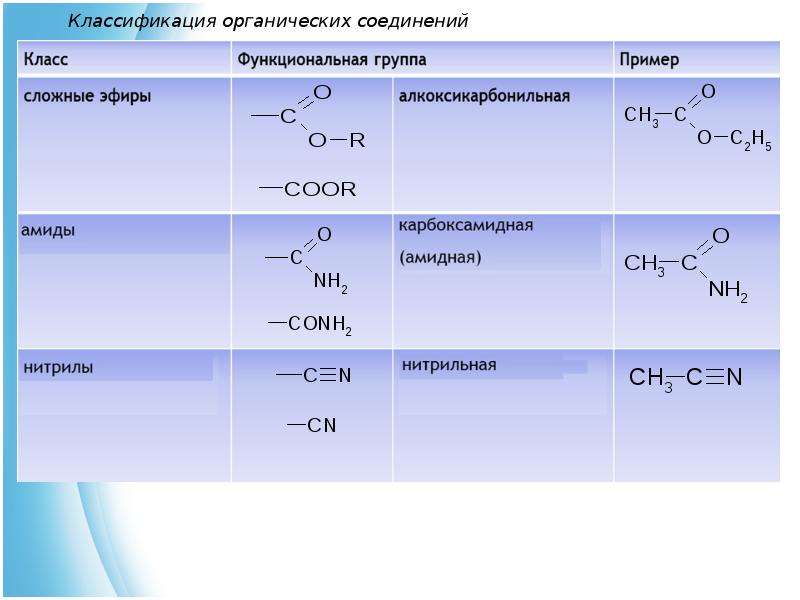
Но вернемся к истории становления органической химии. В 19 веке (времена У. Перкина) основным источником сырья для химической промышленности был уголь. Сухая перегонка угля давала коксовый газ, который использовался для обогрева и приготовления пищи, каменноугольную смолу, богатую на ароматические карбоциклические и гетероциклические соединения (бензол, фенол, анилин, тиофен, пиридин). На нашей кафедре Вам расскажут, чем они отличаются и какое они имеют значение в органическом синтезе.
Бензол, пиридин, фенол, анилин, тиофен
Фенол обладает антисептическими свойствами (тривиальное название – карболовая кислота), а анилин стал основой развития красочной промышленности (получение анилиновых красителей). Данные красящие вещества по-прежнему коммерчески доступны, например, Бисмарк-Браун (коричневый) показывает, что большая часть ранних трудов по химии была проведена в Германии:
Бисмарк-Браун
Однако в 20 столетии, нефть опередила уголь в качестве основного источника органического сырья и энергии, поэтому газообразные метан (природный газ), этан, пропан стали доступным энергетическим ресурсом.
В тоже время, химическая промышленность разделилась на массовую и тонкую. Первая занимается производством красок, полимеров – веществ, не имеющих сложное строение, однако, производимых в огромном количестве. А тонкая химическая промышленность, правильнее сказать – тонкий органический синтез занимается получением лекарств, ароматов, вкусовых добавок, в гораздо меньших объемах, что, однако более прибыльно. В настоящее время известно около 16 миллионов органических соединений. Сколько ещё возможно? В этой области, органический синтез не имеет ограничений. Представьте себе, что Вы создали самую длинную алкильную цепь, однако Вы можете легко добавить ещё один углеродный атом. Этот процесс бесконечен. Но не следует думать, что все эти миллионы соединений – обычные линейные углеводороды; они охватывают все виды молекул с удивительно разнообразными свойствами.
Алифатические соединения
Свойства органических соединений
Каковы же физические свойства органических соединений?
Они могут быть кристаллическими как сахар, или пластичными как парафин, взрывоопасными как изооктан, летучими как ацетон.
- Сахароза
- Изооктан (2,3,5-триметилпентан)
Окраска соединений так же может быть самая разнообразная. Человечество уже столько синтезировало красителей, что создается впечатление, что уже не осталось таких цветов, какие нельзя получить с помощью синтетических красителей.
К примеру, можно составить такую таблицу ярко окрашенных веществ:
Однако кроме этих характеристик, органические вещества обладают запахом, который помогает их дифференцировать. Любопытный пример – защитная реакция скунсов. Запах секрета скунсов обуславливают сернистые соединения – тиолы:
Компоненты секретов скунсов
Но самый ужасный запах был «унюхан» в городе Фрайбурге (1889), во время попытки синтеза тиоацетона разложением тримера, когда пришлось эвакуировать население города, поскольку «неприятный запах, которых быстро распространился по большой площади в городе, вызывает обмороки, рвоту и тревожные состояния». Лабораторию закрыли.
Лабораторию закрыли.
Но этот опыт решили повторить химики научной станции Ессо (Esso) к югу от Оксфорда. Передадим им слово:
«В последнее время, проблемы запаха вышли за пределы наших худших ожиданий. Во времена ранних экспериментов, пробка выскочила из бутылки с отходами и сразу была заменена, а наши колеги из соседней лаборатории (200 ярдов) немедленно почувствовали тошноту и рвоту.
Двое из наших химиков, которые просто изучали крекинг незначительных количеств тритиоацетона нашли себя как объект враждебных взглядов в ресторане и были посрамлены, когда официантка распылила дезодорант вокруг них. Запахи «бросили вызов» ожидаемым эффектам разбавления, поскольку работники лаборатории не считали запахи невыносимыми… и по-настоящему отрицали свою ответственность, так как они работали в закрытых системах. Чтобы убедить их в обратном, они были распределены с другими наблюдателями по всей территории лаборатории на расстояниях до четверти мили. Затем одна капля ацетон гем-дитиола, а позже маточного раствора перекристаллизации тритиоацетона была размещена на часовом стекле в вытяжном шкафу. Запах был обнаружен по ветру в считанные секунды». Т.е. запах этих соединений усиливается при понижении концентрации.
Затем одна капля ацетон гем-дитиола, а позже маточного раствора перекристаллизации тритиоацетона была размещена на часовом стекле в вытяжном шкафу. Запах был обнаружен по ветру в считанные секунды». Т.е. запах этих соединений усиливается при понижении концентрации.
Существует два претендета на эту ужасную вонь – дитиол пропан (вышеуказанный гем-дитиол), либо 4-метил-4сульфанил-пентанон-2:
Вряд ли кто-то найдется чтобы определить из них лидера.
Однако, неприятный запах имеет свою область применения. Природный газ, что поступает в наши дома содержит небольшое количество ароматизатора – третбутил тиола. Небольшое количество – это столько, что люди способны почувствовать одну часть тиола в 50 миллиардах частей метана.
Напротив, некоторые другие соединения имеют восхитительные запахи. Чтобы искупить честь сернистых соединений мы должны сослаться на трюфель, который хрюшки могут унюхать через метр почвы и чей вкус и запах настолько восхитительны что они стоят дороже, чем золото.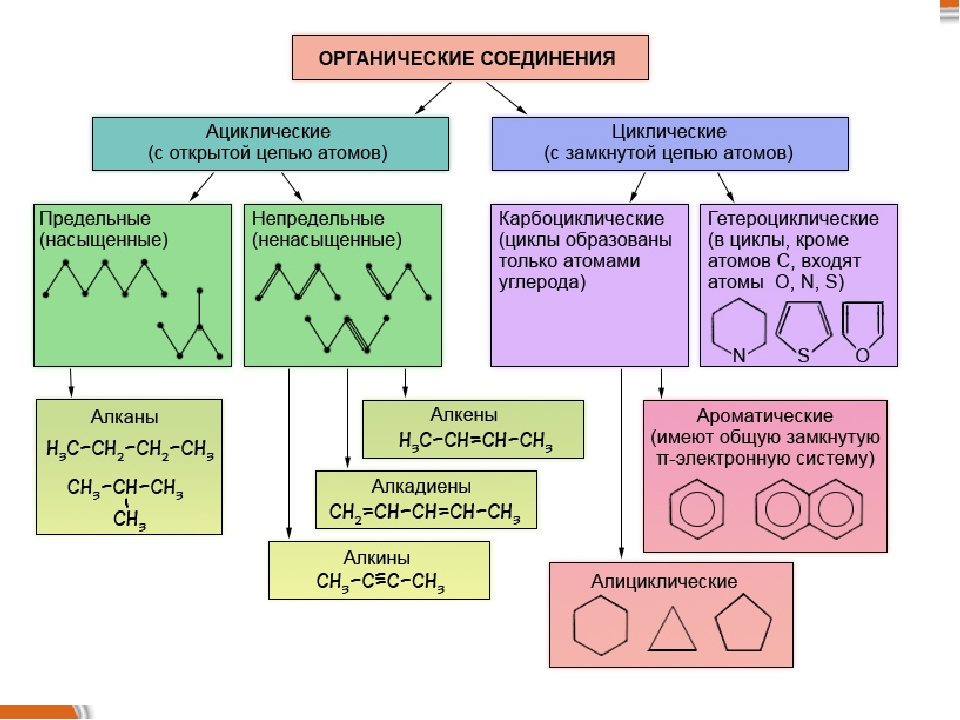 За аромат роз отвечают дамаскеноны. Если Вы имеете возможность понюхать запах одной капли, то Вы, вероятно, будете разочарованы, так как она пахнет как скипидар, или камфора. А на следующее утро Ваша одежда (и Вы в том числе) будете очень сильно благоухать розами. Так же, как и тритиоацетон, этот запах усиливается при разведении.
За аромат роз отвечают дамаскеноны. Если Вы имеете возможность понюхать запах одной капли, то Вы, вероятно, будете разочарованы, так как она пахнет как скипидар, или камфора. А на следующее утро Ваша одежда (и Вы в том числе) будете очень сильно благоухать розами. Так же, как и тритиоацетон, этот запах усиливается при разведении.
Компонент аромата трюфелей
Демаскенон – аромат роз
А как насчет вкуса?
Всем известно, что дети могут попробовать на вкус бытовую химию (средство для чистки ванны, туалета и т.д.). Перед химиками встала задача, чтобы несчастные дети больше не захотели попробовать какую-то химию в яркой упакове. Обратите внимание, что это сложное соединение является солью:
Битрекс денатониум бензоат
Некоторые другие вещества оказывают «странное» воздействие на человека, вызывая комплексы психических ощущений – галюцинации, эйфорию и т.д. К ним относятся наркотики, этиловый спирт. Они очень опасны, т.к. вызывают зависимость и уничтожают человека как личность.
Давайте не забывать и о других существах. Известно, что кошки любят спать в любое время. Недавно ученые получили из спинномозговой жидкости бедных кошек вещество, позволяющее им быстро засыпать. Оно так же действует и на человека. Это удивительно простое соединение:
Инициатор сна – цис-9,10-октадеценоамид
Подобная структура, носящая название Коньюгированная Линолевая Кислота (КЛК) обладает противоопухолевыми свойствми:
КЛК- противораковое средство цис-9-транс-11 сопряженная линолевая кислота
Ещё одна любопытная молекула – ресвератол, может быть отвечает за благотворное влияние красного вина в профилактике сердечных заболеваний:
Ресвератол из шкурки виноградинок
В качестве третьего примера «съедобных» молекул (после КЛК и ресвератрола) возьмем витамин С. Моряки дальнего плавания времен эпохи Великих Географических Открытий страдали заболеванием скорбут (цингой), когда происходят дегенеративные процессы мягких тканей, особенно ротовой полости. Нехватка данного витамина и вызывает цингу. Аскорбиновая кислота (тривиальное название витамина С) является универсальным антиоксидантом, она нейтрализует свободные радикалы, защищая людей от рака. Некоторые считают, что большие дозы витамина С защищают нас от простуды, но это ещё не доказано.
Витамин С
Органическая химия и промышленность
Витами С в больших колличествах получают в Швейцарии, на фармацевтическом заводе Roshe (не путать с РошеноМ). Во всем мире объемы промышленности органического синтеза исчисляются как килограмами (мелкотоннажные производства), так и миллионами тонн (крупнотоннажные производства). Это хорошая новость для студентов-органиков, т.к. дефицита рабочих мест (равно как и переизбытка выпускников) тут нет. Другими словами профессия инженера-химика очень актуальна.
Некоторые простые соединения можно получать как из нефти, так и из растений. Этиловый спирт используют в качестве сырья для получения резины, пластмасс, других органических соединений. Его можно получить каталитической гидратацией этилена (из нефти), либо путем ферментации отходов сахарной промышленности (как в Бразилии, где использование этанола в качестве топлива позволило улучшить экологическую ситуацию).
Стоит отдельно упомянуть полимерную промышленность. Она поглощает наибольшую часть продуктов переработки нефти в виде мономеров (стирол, акрилаты, винилхлорид, этилен). Производство синтетических волокон имеет оборот более чем 25 миллионов тонн в год. В получение поливинилхлорида вовлечено около 50 000 людей с годовым выпуском 20 миллионов тонн.
Следует так же упомянуть производство клеев, герметиков, покрытий. Например, известным суперклеем (на основе метил цианоакрилата) Вы можете приклеить почти все.
Цианоакрилат – основной компонент суперклея
Пожалуй, наиболее известным красителем является индиго, который раньше выделяли из растений, а сейчас получают синтетически. Индиго – это цвет синих джинсов. Для окраски полиэфирных волокон используются, к примеру, бензодифураноны (как дисперсол), которые придают ткани отличный красный цвет. Для окрашивания полимеров используют фталоцианины в виде комплексов с железом, или медью. Они так же находят применение в качестве компонента активного слоя CD, DVD, Blu Ray дисков. Новый класс «высокопроизводительных» красителей на основе DPP (1,4-diketopyrrolo[3,4-c]pyrroles) разработан Ciba-Geidy.
Индиго
Фотография сначала была черно-белой: галоиды серебра взаимодействуя со светом высвобождали атомы металла, которые и воспроизводили изображение. Окрашенные фотографии в цветной пленке марки Кодак возникали как следствие химической реакции между двумя бесцветными реагентами. Один из них, как правило ароматический амин:
От фотоискусства можно легко перейти в сладкую жизнь.
Подсластители, такие как классический сахар получают в огромных масштабах. Другие подсластители, как аспартам (1965) и сахарин (1879) производятся в аналогичных объемах. Аспартам представляет собой дипептид из двух натуральных аминокислот:
Фармацевтические компании производят лекарственные субстанции от многих болезней. Примером коммерчески успешного, революционного препарата является Ранитидин (от язвенной болезни) и Силденафил (Виагра, надеемся Вы в курсе кому и зачем она нужна).
Успех этих препаратов связан как с лечебной эффективностью, так и прибыльностью:
Это еще не всё. Это только начало
Ещё осталось много интересного об органической химии, поэтому обучение на кафедре ОСиНТ является приоритетным не только для любителей химии, но и для абитуриентов, которым интересен окружающий мир, которые желают расширить рамки своего восприятия и раскрыть свой потенциал.
Всё о поступлении на специальность Химические технологии и инженерия
Поступление
на 1 курс
Все самое важное для абитуриента
смотрите здесь
Подробнее
Продолжение обучения
Поступление на 2-4 курс, в магистратуру и аспирантуру. Все формы обучения!
Подробнее
Наши
галереи
Лучше 1 раз увидеть
Чем 100 раз услышать!
Смотрите наши фотографии
Подробнее
Вот несколько последних статей:
Говорили о том какой бывает этиловый спирт из чего его делают, как фальсифицируют и проводят анализы, и чего стоит остерегаться.…
Глицерин применение – пищевые продукты, косметика и взрывчатые вещества Читая этикетки косметических средств, мы зачастую замечаем в их составе глицерин.…
Не так давно Пепси объявила, что они больше не будут использовать подсластитель аспартам, искусственный сахарозаменитель, в диетической Пепси (на территории…
По доброй традиции встреча Нового года у большинства людей не обходится без открытой бутылки шампанского. Напиток в бокале с его…
СОСТАВ КРАСКИ ДЛЯ ВОЛОС КРАСИТЕЛИ И ПИГМЕНТЫ Сегодня, стойкая краска для волос широко используются, либо чтобы прикрыть седые волосы, либо…
Поделиться
Контрольная работа по теме «Теория строения А. М. Бутлерова», химия, 10 класс | Материал по химии (10 класс) по теме:
КОНТРОЛЬНАЯ РАБОТА 1
Вариант 1
- Сформулируйте основные положения теории А. М. Бутлерова. Какие вещества называют гомологами, и какие – изомерами?
- К каким классам относятся соединения, чьи формулы приведены ниже?
а) CH C – Ch3 – Ch4 б) Ch4 – C – Ch3 – C – Ch4
O O O
в) Ch4 – Ch3 — Ch3 – C – H г) C2H5 д) Nh3
- Дайте названия следующим соединениям:
а) Ch4 – C = O б) Ch4 – CH – Ch3 – Ch4
OH NO2
Составьте структурную формулу вещества, название которого 2-метил-гептен-2.
- Найдите среди предлагаемых ниже соединений гомологи и изомеры. Определите вид изомерии.
Ch4
а) Ch4 – CH – Ch4 б) Ch4 – C – Ch4 в) Ch4 – Ch3 – Ch3 – Ch4 г) Ch4Cl
Ch4 Ch4
КОНТРОЛЬНАЯ РАБОТА 1
Вариант 2
- Сформулируйте несколько определений науки органической химии. Каковы особенности органических соединений?
- К каким классам относятся соединения, чьи формулы приведены ниже?
а) HO – Ch3 – COOH б) Ch3 – CH – Ch4
Ch3 – Ch3
в) Ch4 – O – Ch3 – Ch4 г) д) Ch4 – CH = CH – Ch3 – Ch4
- Дайте названия следующим соединениям:
а) Ch4 – Ch3 – CH – Ch4 б) Ch4 – CH — Ch4
Br Nh3
Составьте структурную формулу вещества, название которого 2-хлор-гексин-3.
- Найдите среди предлагаемых ниже соединений гомологи и изомеры. Определите вид изомерии.
а) Ch4 – CH – Ch3 – Ch3 – Ch3 –Ch4 б) Ch4 – Ch3 – Ch3 – Ch3 – O – Ch3 –Ch4
OH
в) Ch4 – Ch3 – Ch3 – O – Ch3 – Ch3 –Ch4 г) Ch4 – OH
КОНТРОЛЬНАЯ РАБОТА 1
Вариант 3
- Рассмотрите валентные возможности атома углерода. Дайте понятие - и -связи. Что такое гибридизация? Какую форму имеют гибридные орбитали?
- К каким классам относятся соединения, чьи формулы приведены ниже?
а) Ch4 – CH – CH – CH – Ch4 б) Ch4 – Ch3 – Ch3 – Ch3 – Ch3 – Ch3 – Ch3 – Ch4
OH OH OH
H
O
в) Nh3 – Ch3 – Ch3 – Ch3 – COOH г) Ch4 – C – O – Ch4 д)
- Дайте названия следующим соединениям:
а) Ch3 = C – Ch4 б) Ch4 – Ch3 – CH – CH – Ch3 – Ch4
Ch4 Ch4 Ch4
Составьте структурную формулу вещества, название которого 3-метил-бутанол-2.
- Найдите среди предлагаемых ниже соединений гомологи и изомеры. Определите вид изомерии.
а) Ch3 = CH – C = Ch3 б) CH C – Ch3 – Ch3 – Ch4
Ch4
CH – CH
в) Ch3 = C – C = Ch3 г) CH CH
Ch4 Ch4 Ch3
Строение органических веществ — урок. Химия, 8–9 класс.
Атомы углерода отличаются от атомов других элементов тем, что способны образовывать устойчивые химические связи друг с другом. Они могут связываться в цепи разной длины. Цепи бывают линейные и разветвлённые. Атомы углерода соединяются также в циклы разной величины.
Между атомами углерода могут образовываться одинарные, двойные и тройные связи.
Молекулы органических веществ состоят обычно из атомов неметаллов, поэтому в них присутствуют ковалентные связи. Число ковалентных связей, которые образует атом, определяет его валентность.
В основе органической химии лежит теория химического строения органических веществ А. М. Бутлерова. Её основные положения:
Атомы в молекулах органических веществ соединены в определённом порядке в соответствии с их валентностью.
Углерод в органических соединениях всегда четырёхвалентен, кислород — двухвалентен, а водород и галогены — одновалентны.
В молекуле метилового спирта атом углерода соединён ковалентными связями с четырьмя другими атомами, атом кислорода — с двумя, а каждый атом водорода образует одну ковалентную связь.
Свойства веществ зависят не только от состава молекул, но и от порядка соединения атомов в них,
т. е. от химического строения.
Рассмотрим второе положение на примере вещества, имеющего состав: C2h5Cl2.
Состав веществ одинаковый, а порядок соединения атомов в них разный. В молекуле первого вещества атомы хлора соединены с разными атомами углерода, а в молекуле второго — с одним. Свойства веществ отличаются. Так, температура кипения первого вещества — \(–96,7\) °С, а второго — \(–42,0\) °С.
При составлении структурных формул органических веществ сначала записывают символы углерода, связывая их между собой; затем с учётом четырёхвалентности атома углерода записывают символы других элементов.
Структурная формула углеводорода, состоящего из трёх атомов углерода и восьми атомов водорода, строится следующим образом:
Урок 2. неорганические соединения клетки. углеводы и липиды. регулярные и нерегулярные биополимеры — Биология — 10 класс
Химические вещества и их роль в живой природе
Органические вещества клетки. Углеводы. Липиды
Необходимо запомнить
ВАЖНО!
Живые системы – клетки, ткани, организмы – состоят из тех же химических элементов, что и объекты неживой природы, что свидетельствует о единстве и взаимосвязи живой и неживой материи. Но соотношение элементов в живом и неживом веществе существенно отличается.
Живые организмы имеют сходный химический состав (одни и те же химические элементы и вещества в близких количествах), что является доказательством родства всего живого на Земле.
К неорганическим соединениям относятся относительно простые соединения, которые встречаются и в неживой природе: вода, минеральные соли, ионы.
Органические соединения, основой строения которых являются атомы углерода, составляют отличительный признак живого. Из органических соединений всеобщее биологическое значение имеют белки, нуклеиновые кислоты, углеводы и липиды.
Особенности химической организации живой материи:
– 98 % элементного состава приходится на углерод, кислород, водород и азот;
– большое содержание воды;
– наличие органических веществ.
Углеводы – органические вещества с общей формулой Сn(Н2О)m.
Липиды – органические соединения с различной структурой, нерастворимые в воде, но растворимые в органических растворителях.
Общие функции углеводов и липидов: энергетическая, структурная, запасающая, защитная. Кроме того, липиды выполняют ещё терморегуляторную функцию и являются гормонами.
Группы химических элементов в клетке
Биологическая роль воды
Интересные факты
Регулярные и нерегулярные биополимеры
Отличительные свойства органических соединений и особенности органических реакций
Многообразие органических соединений обусловлено специфическими особенностями углерода сравнительно с другими химическими элементами:
1. Углерод способен соединяться с большинством других элементов. Это свойство углерода, связанное с его положением в периодической системе элементов Д. И. Менделеева, обусловлено его почти электронейтральным характером и способностью образовывать ковалентные связи.
2. Атомы углерода способны также соединяться друг с другом, образуя углеродные цепи различного вида (прямые, разветвленные, замкнутые в цикл). Таким же свойством обладают некоторые другие элементы, однако все они образуют цепи лишь с небольшим числом звеньев. Так, для кислорода известны цепи максимально из трех атомов, для азота — из четырех, для кремния — из шести атомов. Для углерода, в отличие от всех остальных элементов, способность атомов соединяться друг с другом, по-видимому, совершенно не ограничена. В настоящее время получены высокомолекулярные продукты углеводородного характера, углеродная цепь которых состоит из сотен и тысяч углеродных атомов (полиэтилен, полиизобутилен и др.).
3. На определенной стадии усложнения органических веществ появляется возможность изомерии; вследствие этого одному и тому же составу соответствует не одно, а несколько веществ, отличающихся друг от друга только химическим строением.
Хотя число органических соединений чрезвычайно велико иони весьма разнообразны, можно выделить ряд общих характерных свойств, отличающих органические соединения от неорганических.
Почти все органические соединения, за исключением сравнительно немногих (например, четыреххлористого углерода, фторуглеродов), горючи. Большинство неорганических соединений не горит.
Органические соединения обычно представляют собой газы, жидкости или низкоплавкие твердые вещества. Огромное большинство твердых органических веществ плавится в интервале сравнительно невысоких температур (от комнатной до 400 °С). Большая часть неорганических соединений представляет собой твердые вещества, плавящиеся при весьма высоких температурах.
В качестве примеров типично неорганического и типично органического вещества можно взять хлористый натрий и хлористый этил, молекулярные веса которых примерно одинаковы (58,44 и 64,51):
Такие резкие отличия в физических свойствах типично органических и типично неорганических соединений обусловлены отличием в их строении, а именно: неорганические соединения большей частью построены ионно, а органические соединения — ковалентно.
Особенности строения органических соединений как соединений с ковалентными связями находят свое отражение не только в физических, но и в химических свойствах. Так, реакции неорганических соединений (электролитов) в водных растворах, например
NaCl + AgNO3 ——> AgCl + NaNO3
протекают с большой скоростью, практически мгновенно, в то время как реакции органических соединений, например
С2Н5Cl + NaOH ——> NaCl + С2Н5ОН
идут значительно медленнее. Другой отличительной особенностью органических реакций является то, что они редко протекают количественно. Если реакции нейтрализации, осаждения, окисления и восстановления неорганических веществ протекают с количественным выходом, то при органических реакциях очень хорошим считается выход 85—90% от теоретического.
Типично неорганические соединения реагируют в виде ионов, которые образуются вследствие электролитической диссоциации. Это обусловливает большую скорость неорганических реакций, так как время реакции определяется только числом столкновений противоположно заряженных ионов в единицу времени, а это число составляет примерно 1011 в секунду.
Для того чтобы понять причины медленного протекания реакций ковалентно построенных органических соединений, необходимо выяснить механизм этих реакций.
Течение химических реакций в общем случае определяется двумя факторами: изменением свободной энергии системы и скоростью превращения. Первый фактор — термодинамический, второй — кинетический.
Для практически необратимых реакций решающее значение имеет скорость превращения; поэтому термодинамически менее выгодное, но все же возможное направление часто доминирует вследствие его большей скорости. При достаточно быстро протекающих обратимых реакциях главным фактором является термодинамический, так как положение равновесия не зависит от скорости его установления, а определяется лишь отношением констант скорости прямого и обратного процесса. В случае медленно протекающих обратимых реакций играют роль оба фактора.
Органические реакции лишь в сравнительно редких случаях протекают до стадии установления равновесия; вследствие этого результаты сложных процессов чаще определяются кинетикой составляющих реакций, чем термодинамикой. Однако в общем случае заметное влияние оказывают оба фактора, что в большой мере затрудняет изучение и трактовку течения химических реакций.
Согласно основному уравнению кинетики химических реакций
константа скорости k является функцией температуры T, числа столкновений Z между реагирующими молекулами, вероятностного фактора Р и энергии активации Е (R — газовая постоянная, е — основание натуральных логарифмов). Термохимические исследования показывают, что энергии активации реакций органических соединений в большинстве случаев меньше энергий их диссоциации на ионы. Таким образом, органические реакции обычно протекают не через стадию образования ионов, а иными путями.
Представление о причинах характерных особенностей органических реакций дает теория переходного состояния, или активного комплекса.
Теория переходного состояния может быть уяснена, например, из рассмотрения бимолекулярной реакции замещения:
При взаимодействии реагента Z с молекулой XY возможны самые различные столкновения этих двух частиц. Однако в простейшем случае химическая реакция происходит легче всего, если Z приближается к молекуле XY вдоль ее оси (или под небольшим углом к этой оси) с той стороны, где расположен X:
В определенный момент сближения этих двух частиц между Z и X образуется слабая связь при одновременном ослаблении связи X—Y:
В этом состоянии X уже в известной мере связан с Z и в то же время еще не потерял связи с Y. Такое состояние и носит название переходного состояния, или активного комплекса.
Так как для достижения такого состояния при сближении частиц Z и XY необходима затрата энергии, в частности, на растягивание связи X—Y и на преодоление отталкивания атома Z молекулой XY, то переходное состояние соответствует максимуму на кривой, изображающей энергетическое состояние реагирующей системы (рис. 14). При дальнейшем сближении Z и X между ними образуется ковалентная связь, а связь X с Y окончательно разрывается:
Этот процесс сопровождается понижением энергии реагирующей системы. Точка R на кривой (рис. 14) соответствует энергии системы, когда Z и XY удалены друг от друга (I), точка Р — аналогичной системе ZX и Y (III), точка Т — энергии переходного состояния (II). Разность между энергией переходного состояния Т и энергией первоначальной системы R составляет энергию активации Е данной реакции. Таким образом, энергия активации представляет собой энергию, необходимую для приведения двух реагирующих частиц в состояние активного комплекса.
С точки зрения изложенных представлений, органическая реакция, например действие щелочи на хлористый этил, протекает следующим образом:
Следует отметить, что переходное состояние является принципиально неустойчивой системой. Оно соответствует максимуму на энергетической кривой, и поэтому такую систему нельзя рассматривать как какое-то промежуточное соединение. Всякое промежуточное химическое соединение, пусть малоустойчивое, соответствует относительному минимуму энергии, для перехода из которого в конечное состояние необходимо вновь преодолеть некоторый энергетический барьер (второй максимум — второе переходное состояние). Промежуточные соединения являются настоящими химическими соединениями, переходное же состояние не является химическим соединением в обычном смысле слова, поэтому к нему неприменимы такие понятия и закономерности, связанные с настоящими химическими соединениями, как валентность, постоянство атомных расстояний и углов валентностей и т. д.
За исключением ряда специальных случаев, первостепенное значение в органических реакциях играет энергия активации Е. Входя в показатель степени основного кинетического уравнения, Е самым существенным образом определяет скорость реакции, причем сравнительно небольшие изменения Е изменяют скорость реакции в десятки раз.
Необходимо, однако, указать, что расчетный аппарат теории переходного состояния в настоящее время находится на низком уровне, и в большинстве случаев невозможно вычисление энергии активации с такой степенью точности, чтобы можно было объяснить (не говоря уже о предсказании) преобладающее протекание одних органических реакций сравнительно с другими возможными. В связи с этим в настоящее время единственным способом составить суждение о факторах, определяющих энергию активации, например конкурирующих органических реакций, являются чисто качественные сопоставления строения активных комплексов конкурирующих реакций и сравнительная оценка их энергии.
В развитие основных положений теории химического строения о связи реакционной способности органических веществ с их химическим строением в органической химии были созданы представления о гетеролитических и гомолитических реакциях.
Для гетеролитических реакций характерен такой разрыв химических связей у реагирующих веществ, при котором электронная пара, осуществляющая ковалентную связь, целиком остается у одного из двух ранее связанных атомов, например:
Частным случаем гетеролитических реакций являются ион-ные реакции, протекающие не через активный комплекс, а с образованием свободных ионов как кинетически независимых частиц.
Для гомолитических реакций характерен разрыв химических связей с разделением электронной пары, осуществлявшей ковалентную связь, например:
Частным случаем гомолитических реакций являются свобод-норадикальные реакции, протекающие с образованием свободных радикалов как кинетически независимых частиц.
Гетеролитические реакции, в том числе и протекающие через стадию образования свободных органических ионов, весьма многочисленны. К ним, по-видимому, относится большая часть известных в настоящее время органических реакций, например реакции этерификации и гидролиза, протекающие в присутствии кислотных и основных катализаторов, присоединение галоидов к олефинам в полярных растворителях, присоединение синильной кислоты и ряда других реагентов к альдегидам и кетонам, разнообразные прототропные таутомерные превращения и многие другие реакции.
Следует отметить, что огромное большинство органических гетеролитических реакций, в том числе и ионных, протекает значительно медленнее ионных неорганических реакций. Причина этого явления становится понятной, например, при рассмотрении взаимодействия альдегидов с синильной кислотой:
Как установлено, первая стадия этой реакции заключается в присоединении аниона CN— к карбонильному углеродному атому альдегида:
Эта стадия реакции представляет собой процесс взаимодействия не аниона с катионом, а аниона с нейтральной молекулой; следовательно, она будет протекать медленнее тех процессов, в которых участвуют только ионы.
Таким образом, несмотря на то, что вторая стадия циангид-ринной реакции, представляющая собой взаимодействие аниона с протоном
протекает практически мгновенно, в целом присоединение HCN к альдегидам или к кетонам протекает сравнительно медленно. Наличием стадии взаимодействия иона с нейтральной молекулой и объясняется медленность большинства ионных органических реакций сравнительно с ионными неорганическими реакциями.
Открытие гомолитических и, в частности, свободнорадикаль-ных реакций сыграло важную роль в развитии теории химического строения. Оказалось, что многие органические реакции, в частности распад диазосоединений, распад перекисей, реакции галоидирования, нитрования и окисления парафинов и алицик-лических углеводородов, протекают с образованием свободных радикалов. Свободные радикалы, как правило, более активны, чем молекулы с четным числом валентных электронов. Они легко взаимодействуют не только друг с другом (рекомбинация и диспропорционирование), но и главным образом с недиссо-циированными молекулами, образуя при этом новый свободный радикал, который в свою очередь реагирует с молекулой и т. д. Таким образом, свободный радикал, возникнув однажды, вызывает цепь превращений, которая обрывается рекомбинацией радикалов или каким-либо другим способом.
Простым примером цепной органической реакции может служить хлорирование метана, происходящее на свету
Развитие учения о цепных реакциях является крупным достижением современной химической науки. В настоящее время это учение развивается главным образом школами Н. Н. Семенова в СССР и Хиншельвуда в Англии. Н, Н. Семеновым, в частности, создана теория разветвленных цепных реакций.
Теория цепных реакций способствовала устранению упрощенных представлений о многих органических реакциях как о более или менее легко происходящих непосредственных перегруппировках связей при встрече двух молекул и дала ключ к выяснению механизма большого числа органических реакций.
Предыдущая страница |
Сдедующая страница
СОДЕРЖАНИЕ
Ароматические углеводороды — Что такое Ароматические углеводороды?
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
Ароматические углеводороды (арены) — класс углеводородов, содержащих бензольные ядра, которые могут быть конденсированными и иметь насыщенные боковые цепи.
К наиболее важным аренам относятся бензол (С6Н6) и его гомологи.
Это углеводороды, молекулы которых содержат 1 или несколько бензольных колец, и другие углеводородные группы (алифатические, нафтеновые, полициклические).
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С6Н6.
Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный 6-угольник .
Каждый атом углерода связан с одним атомом водорода.
Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
Для передачи строение молекулы бензола используют формулы Кекуле, которые предложил в 1865 г. немецкий химик Август Кекуле.
Важными аренами являются и гомологи бензола (толуол С6Н5СНз, ксилолы С6Н4(СНз)2, дурол, мезитилен, этилбензол), кумол, нафталин C10H8, антрацен С14Н10 и их производные.
Ароматические углеводороды — исходное сырье для промышленного получения кетонов, альдегидов и кислот ароматического ряда, и других веществ.
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения.
Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно.
Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам: он не обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы — единого «пи»-электронного облака.
25.1: Общие характеристики органических молекул
Цели обучения
- Для распознавания состава и свойств, типичных для органических и неорганических соединений.
В этом тексте используются органические вещества, чтобы проиллюстрировать различия между ионной и ковалентной связью и продемонстрировать тесную связь между структурами соединений и их химической реакционной способностью. Вы узнали, например, что хотя NaOH и спирты (ROH) имеют в своей формуле ОН, NaOH является ионным соединением, которое полностью диссоциирует в воде с образованием основного раствора, содержащего ионы Na + и OH —, тогда как спирты — это ковалентные соединения, которые не диссоциируют в воде и вместо этого образуют нейтральные водные растворы.Вы также узнали, что амин (RNH 2 ) с неподеленными парами электронов является основанием, тогда как карбоновая кислота (RCO 2 H) с диссоциируемым протоном является кислотой.
Ученые 18-го и начала 19-го веков изучали соединения, полученные из растений и животных, и назвали их органическими , поскольку они были изолированы от «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были помечены как неорганические .В течение многих лет ученые считали, что органические соединения могут производиться только живыми организмами, поскольку они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Велер синтезировал мочевину из неорганических исходных материалов. Он прореагировал цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), ожидая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
\ [AgOCN + NH_4Cl \ rightarrow AgCl + NH_4OCN \ label {25.1.1} \]
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, легко выделяемое из мочи. Этот результат привел к серии экспериментов, в которых из неорганических исходных материалов были получены самые разные органические соединения. Теория жизненной силы постепенно исчезла, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия изучает химию углеродных соединений, а неорганическую химию изучает химию всех других элементов.Может показаться странным, что мы разделяем химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 оставшихся элементов. Однако такое разделение кажется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов.Органические продукты — это, как правило, продукты, выращенные без синтетических пестицидов и удобрений. Органическая химия — это химия соединений углерода.
Углерод уникален среди других элементов тем, что его атомы могут образовывать стабильные ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Полученные молекулы могут содержать от одного до миллионов атомов углерода. Ранее мы исследовали органическую химию, разделив ее соединения на семейства на основе функциональных групп.Мы начинаем с простейших членов семьи, а затем переходим к молекулам, которые являются органическими в первоначальном смысле, то есть они созданы и обнаружены в живых организмах. Эти сложные молекулы (все содержащие углерод) определяют формы и функции живых систем и являются предметом биохимии.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул.Тем не менее полезно сравнить типичные члены каждого класса, как в Table \ (\ PageIndex {1} \).
| Органическое | гексан | Неорганическое | NaCl |
|---|---|---|---|
| низкая температура плавления | −95 ° С | высокая температура плавления | 801 ° С |
| низкая температура кипения | 69 ° С | высокая температура кипения | 1,413 ° С |
| низкая растворимость в воде; высокая растворимость в неполярных растворителях | не растворим в воде; растворим в бензине | большая растворимость в воде; низкая растворимость в неполярных растворителях | растворим в воде; не растворим в бензине |
| легковоспламеняющиеся | легковоспламеняющийся | негорючий | негорючий |
| водные растворы не проводят электричество | непроводящий | водные растворы проводят электричество | проводящий в водном растворе |
| демонстрируют ковалентную связь | ковалентные связи | демонстрируют ионную связь | ионные связи |
Однако имейте в виду, что для каждой категории в этой таблице есть исключения.Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице \ (\ PageIndex {1} \) также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворитель, который используется для экстракции соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в Таблице \ (\ PageIndex {1} \).
Ключевые вынос
- Органическая химия — это изучение соединений углерода, почти все из которых также содержат атомы водорода.
6 Важные характеристики органических соединений
Органические соединения обладают некоторыми очень специфическими характеристиками и свойствами, когда речь идет о химических реакциях, которым они подвергаются. Поскольку органические соединения находят очень широкое применение в химической и фармацевтической промышленности, их способность вступать в реакции и образовывать другие соединения и смеси представляет огромный интерес для химиков и инженеров-химиков.Мы обсудим 6 наиболее важных характеристик и свойств органических соединений и то, как эти характеристики влияют на реакции, которым они подвергаются.
Ковалентная природа: Атомы углерода образуют стабильные ковалентные связи друг с другом. Одинарная ковалентная связь углерод-углерод имеет энергию 346 кДж / моль. Эта высокая энергия указывает на прочную связь. Большинство органических соединений стабильны благодаря прочным углерод-углеродным связям. Поскольку они имеют ковалентную природу, они не ионизируются в растворе и не проводят электричество.
Полярность и растворимость неполярных соединений: Связи углерод-водород неполярны, как и связи углерод-углерод. Это связано с почти равной электроотрицательностью двух элементов. Большинство органических соединений неполярны, если только соединения не состоят из очень электроотрицательных элементов, таких как хлор, или групп, подобных гидроксильной группе.
Поскольку большинство органических соединений неполярны, они не могут образовывать связи с молекулами воды. Таким образом, большинство органических соединений нерастворимы в воде.Например, бензин, керосин и парафиновое масло не растворяются в воде. Если органическое соединение содержит полярные группы, водородные связи могут образовываться между полярными группами в молекулах органического соединения и молекулами воды. Это позволяет соединению растворяться в воде. Например, молекула этанола содержит полярную гидроксильную группу, поэтому она растворима в воде.
Неполярные вещества удерживаются вместе только слабыми межмолекулярными силами, такими как силы Ван-дер-Ваальса, и поэтому они могут легко смешиваться.Вот почему большинство органических соединений растворяются только в неполярных растворителях, таких как бензол или эфир.
Низкие точки плавления и кипения: Органические соединения обычно имеют более низкие температуры плавления и кипения, чем неорганические соединения. Это связано с тем, что эти соединения обладают относительно слабыми межмолекулярными связями, которые можно легко разорвать под действием тепловой энергии. Многие из них (в основном с низкой относительной молекулярной массой) склонны к летучести и кипят при температурах ниже 300- o C.
Термическая нестабильность: Многие органические соединения термически нестабильны, разлагаясь на более простые молекулы при нагревании до температур выше 500-— ° С. Однако это свойство иногда имеет коммерческое значение, например, при крекинге нефти. Это свойство очень полезно при фракционной перегонке сырой нефти.
Воспламеняемость: Большинство органических соединений огнеопасны и образуются экзотермически при обильном поступлении воздуха с образованием оксида углерода (IV) и воды.Таким образом, большинство видов топлива, таких как древесина, уголь, нефть, бензин и природный газ, являются органическими, и их сжигание является нашим основным источником тепловой энергии.
Реакционная способность : Реакции с участием органических соединений имеют тенденцию протекать намного медленнее, чем ионные реакции, обычно встречающиеся в неорганической химии. Обычно они требуют нагревания, тщательного перемешивания и катализатора для ускорения реакции.
Свойства органических соединений
Органические соединения — это соединения, химическая формула которых содержит по крайней мере один атом углерода, а также часто содержит атом водорода.Связи, образующиеся между атомами углерода и водорода с образованием углеводорода, очень прочные, и образующееся в результате соединение часто важно для живых существ.
Свойства органических соединений
1. Трудно выделить свойства органических соединений, поскольку единственным требованием является наличие атома углерода. Важно отметить, что есть несколько неорганических соединений, которые все еще содержат углерод, хотя связь очень слабая; это отсутствие единства в определении и классификации органических соединений лежит в основе проблемы, когда дело доходит до описания их свойств.
2. Таким образом, термин «органические соединения» действительно применяется к молекулам, которые содержат «значительное» количество атомов углерода, которое все же не является точным и измеримым числом.
3. Некоторые исследователи считают, что органические соединения должны содержать связи углерод-углерод или углерод-водород, чтобы соответствовать требованиям.
4. Теория витализма применяется к свойствам органических соединений, которая утверждает, что существует жизненная сила, присутствующая в органических соединениях, которые необходимы для живых существ, и эта сила отсутствует в неживых (и, следовательно, неорганических ) вещи.
5. Свойства органических соединений настолько разнообразны, что они были разделены на разные классы.
6. Углеводороды, например, содержат алканы и алкены и имеют высокую склонность к горению; по этой причине большинство известных нам источников топлива — это углеводороды.
7. Органические соединения содержат так называемые функциональные группы, структурную единицу, состоящую из групп атомов в молекуле, которые связаны с остальной частью молекулы ковалентной связью; эта связь образуется между функциональной группой и атомом углерода основной части молекулы.
8. Эти функциональные группы присутствуют во всех органических соединениях и помогают создавать химические свойства молекулы.
9. Размер — еще одно свойство органических соединений, которое может сильно варьироваться от одного соединения к другому.
10. Органические соединения, особенно те, которые важны для различных областей биологии, часто содержат длинные цепочки атомов углерода, которые могут закручиваться вокруг друг друга; различные атомы могут образовывать связи с этими атомами углерода, создавая вариации в молекуле и ее функциональных группах.
Классы органических соединений | Безграничная химия
Органические молекулы и функциональные группы
Функциональные группы — это группы молекул, прикрепленных к органическим молекулам и придающие им определенные свойства или функции.
Цели обучения
Опишите важность функциональных групп для органических молекул
Основные выводы
Ключевые моменты
- Функциональные группы — это совокупности атомов, которые прикрепляют углеродный скелет органической молекулы и придают определенные свойства.
- Каждый тип органической молекулы имеет свой особый тип функциональной группы.
- Функциональные группы в биологических молекулах играют важную роль в образовании таких молекул, как ДНК, белки, углеводы и липиды.
- Функциональные группы включают: гидроксил, метил, карбонил, карбоксил, амино, фосфат и сульфгидрил.
Ключевые термины
- гидрофобный : не имеет сродства к воде; не может впитаться или намокать водой
- гидрофильный : имеет сродство к воде; может впитывать или намокать водой
Расположение функциональных групп
Функциональные группы — это группы атомов, которые встречаются в органических молекулах и придают этим молекулам определенные химические свойства.Когда показаны функциональные группы, органическая молекула иногда обозначается как «R». Функциональные группы находятся вдоль «углеродной основы» макромолекул, которая образована цепями и / или кольцами атомов углерода с периодическим замещением таким элементом, как азот или кислород. Молекулы с другими элементами в углеродной основе являются замещенными углеводородами. Каждый из четырех типов макромолекул — белков, липидов, углеводов и нуклеиновых кислот — имеет свой собственный характерный набор функциональных групп, который в значительной степени способствует его различным химическим свойствам и его функциям в живых организмах.
Свойства функциональных групп
Функциональная группа может участвовать в определенных химических реакциях. Некоторые из важных функциональных групп в биологических молекулах включают: гидроксильные, метильные, карбонильные, карбоксильные, амино, фосфатные и сульфгидрильные группы. Эти группы играют важную роль в образовании таких молекул, как ДНК, белки, углеводы и липиды.
Классификация функциональных групп
Функциональные группы обычно классифицируются как гидрофобные или гидрофильные в зависимости от их заряда или полярности.Примером гидрофобной группы является молекула неполярного метана. Среди гидрофильных функциональных групп есть карбоксильная группа, содержащаяся в аминокислотах, некоторых боковых цепях аминокислот и головках жирных кислот, которые образуют триглицериды и фосфолипиды. Эта карбоксильная группа ионизируется, высвобождая ионы водорода (H + ) из группы COOH, что приводит к образованию отрицательно заряженной группы COO —; это способствует гидрофильности любой молекулы, на которой он находится. Другие функциональные группы, такие как карбонильная группа, имеют частично отрицательно заряженный атом кислорода, который может образовывать водородные связи с молекулами воды, снова делая молекулу более гидрофильной.
Примеры функциональных групп : Показанные здесь функциональные группы встречаются во многих различных биологических молекулах, где «R» — это органическая молекула.
Водородные связи между функциональными группами
Водородные связи между функциональными группами (внутри одной и той же молекулы или между разными молекулами) важны для функции многих макромолекул и помогают им правильно складываться и сохранять соответствующую форму, необходимую для правильного функционирования. Водородные связи также участвуют в различных процессах распознавания, таких как спаривание комплементарных оснований ДНК и связывание фермента с его субстратом.
Водородные связи в ДНК : Водородные связи соединяют две нити ДНК вместе, создавая структуру двойной спирали.
Химическая основа жизни
Углерод — самый важный элемент для живых существ, поскольку он может образовывать множество различных видов связей и образовывать важные соединения.
Цели обучения
Объясните свойства углерода, которые позволяют ему служить строительным блоком для биомолекул
Основные выводы
Ключевые моменты
- Все живые существа содержат углерод в той или иной форме.
- Углерод является основным компонентом макромолекул, включая белки, липиды, нуклеиновые кислоты и углеводы.
- углерода позволяет ему связываться множеством различных способов и со многими различными элементами.
- Углеродный цикл показывает, как углерод перемещается через живые и неживые части окружающей среды.
Молекулярная структура
Ключевые термины
- правило октетов : Правило, согласно которому атомы теряют, приобретают или делятся электронами, чтобы иметь полную валентную оболочку из 8 электронов (есть некоторые исключения).
- углеродный цикл : физический цикл углерода в биосфере, геосфере, гидросфере и атмосфере Земли; включает такие процессы, как фотосинтез, разложение, дыхание и карбонизация
- макромолекула : очень большая молекула, особенно используемая в отношении крупных биологических полимеров (например, нуклеиновых кислот и белков)
Углерод — четвертый по распространенности элемент во Вселенной и строительный блок жизни на Земле.На Земле углерод циркулирует по суше, океану и атмосфере, создавая так называемый углеродный цикл. Этот глобальный углеродный цикл можно разделить на два отдельных цикла: геологические углеродные циклы протекают в течение миллионов лет, тогда как биологический или физический углеродный цикл длится от нескольких дней до тысяч лет. В неживой окружающей среде углерод может существовать в виде двуокиси углерода (CO 2 ), карбонатных пород, угля, нефти, природного газа и мертвого органического вещества.Растения и водоросли превращают углекислый газ в органическое вещество в процессе фотосинтеза, энергии света.
Углерод присутствует во всем живом. : Все живые существа содержат углерод в той или иной форме, и углерод является основным компонентом макромолекул, включая белки, липиды, нуклеиновые кислоты и углеводы. В этом листе углерод присутствует во многих формах, в том числе в целлюлозе, формирующей структуру листа, и в хлорофилле, пигменте, который делает лист зеленым.
Углерод важен для жизни
В процессе метаболизма пищи и дыхания животное потребляет глюкозу (C 6 H 12 O 6 ), которая соединяется с кислородом (O 2 ) с образованием диоксида углерода (CO 2 ), воды. (H 2 O) и энергия, которая выделяется в виде тепла.Животное не нуждается в углекислом газе и выбрасывает его в атмосферу. С другой стороны, растение использует реакцию, противоположную реакции животного, посредством фотосинтеза. Он потребляет углекислый газ, воду и энергию солнечного света для производства собственной глюкозы и газообразного кислорода. Глюкоза используется для получения химической энергии, которую растение метаболизирует аналогично животному. Затем растение выбрасывает оставшийся кислород в окружающую среду.
Клетки состоят из множества сложных молекул, называемых макромолекулами, которые включают белки, нуклеиновые кислоты (РНК и ДНК), углеводы и липиды.Макромолекулы — это подмножество органических молекул (любой углеродсодержащей жидкости, твердого вещества или газа), которые особенно важны для жизни. Основным компонентом всех этих макромолекул является углерод. Атом углерода обладает уникальными свойствами, которые позволяют ему образовывать ковалентные связи с четырьмя различными атомами, что делает этот универсальный элемент идеальным для использования в качестве основного структурного компонента или «скелета» макромолекул.
Структура углерода
Отдельные атомы углерода имеют неполную внешнюю электронную оболочку.С атомным номером 6 (шесть электронов и шесть протонов) первые два электрона заполняют внутреннюю оболочку, оставляя четыре во второй оболочке. Следовательно, атомы углерода могут образовывать четыре ковалентные связи с другими атомами, чтобы удовлетворить правилу октетов. Например, молекула метана имеет химическую формулу CH 4 . Каждый из четырех его атомов водорода образует одну ковалентную связь с атомом углерода, разделяя пару электронов. Это приводит к заполнению самой внешней оболочки.
Структура метана : Метан имеет тетраэдрическую геометрию, в которой каждый из четырех атомов водорода расположен на расстоянии 109.5 ° друг от друга.
Органическая химия — Американское химическое общество
Что такое органическая химия?
Органическая химия — это изучение структуры, свойств, состава, реакций и получение углеродсодержащих соединений. Большинство органических соединений содержат углерод и водород, но они также могут включать любое количество других элементов (например, азот, кислород, галогены, фосфор, кремний, серу).
Первоначально ограничиваясь изучением соединений, продуцируемых живыми организмами, органическая химия была расширена за счет включения антропогенных веществ (например,г., пластмассы).
Чем занимаются химики-органики?
Органическая химия — это высокоразвитая наука, которая позволяет химикам создавать и исследовать молекулы и соединения. Химики-органики тратят много времени на разработку новых соединений и поиск лучших способов синтеза существующих.
Где используется органическая химия?
Органические соединения повсюду вокруг нас. Многие современные материалы хотя бы частично состоят из органических соединений. Они играют ключевую роль в экономическом росте и лежат в основе областей биохимии, биотехнологии и медицины.Примеры того, где вы можете найти органические соединения, включают агрохимикаты, покрытия, косметику, моющие средства, красители, продукты питания, топливо, нефтехимические продукты, фармацевтические препараты, пластмассы и резину.
Какие отрасли нанимают химиков-органиков?
Биотехнологии
Практически все продукты биотехнологии («биотехнологии») являются результатом органической химии. Биотехнология предполагает использование живых организмов и биопроцессов для создания или модификации продуктов для конкретного использования. Например, биотехнологическая компания может производить семена для сельскохозяйственных культур, устойчивых к болезням, или растений, устойчивых к засухе.
Общие области занятости в биотехнологии включают:
- Здравоохранение
- Растениеводство и сельское хозяйство
- Непищевые виды использования сельскохозяйственных культур
- Потребительские товары (например, биоразлагаемые пластмассы, растительное масло)
- Экологический сектор
- Биотопливо
Потребительские товары
Большинство потребительских товаров, которые мы используем, содержат органическую химию. Возьмем, к примеру, косметическую промышленность. Органическая химия изучает, как кожа реагирует на метаболические факторы и факторы окружающей среды, и химики разрабатывают соответствующие продукты.
Другие примеры повседневных товаров, связанных с органической химией, включают мыло, пластмассовые изделия, парфюмерию, уголь и пищевые добавки.
Органическая промышленная химия
Решающее значение для современной мировой экономики, органическая промышленная химия фокусируется на преобразовании сырья (например, нефти, природного газа, воздуха, воды, металлов и минералов) в потребительские и промышленные продукты.
Сегодня органическая промышленная химия основана в основном на нефти и природном газе. Поскольку это ограниченное сырье, промышленность уделяет большое внимание изучению того, как преобразовать возобновляемые ресурсы (например,г., растения) в промышленные органические химикаты.
Основные отрасли органической промышленной химии включают:
- Резиновые и пластмассовые изделия
- Текстильные изделия и одежда
- Нефтепереработка
- Целлюлоза и бумага
- Первичные металлы
Нефть
Самыми крупными объемами нефтепродуктов являются мазут и бензин. Нефть также является сырьем для многих химических продуктов (например, фармацевтических препаратов, растворителей, удобрений, пестицидов и пластмасс).
Нефтяную промышленность обычно делят на три основных компонента:
- Upstream — Разведка и добыча
- Мидстрим — Транспорт
- Downstream — Переработка сырой нефти, переработка и очистка природного газа, создание нефтехимических продуктов
Фармацевтика
Фармацевтическая промышленность разрабатывает, производит и продает лекарства, используемые в качестве лекарств для людей или животных. Некоторые фармацевтические компании имеют дело с торговыми марками (т.е., имеет торговое название и может производиться и продаваться только компанией, владеющей патентом) и / или генерическими (т.е. химически эквивалентными, более дешевыми версиями фирменного препарата) лекарствами и медицинскими устройствами (действующими агентами). о заболеваниях без химического взаимодействия с организмом).
Фармацевтические препараты (фирменные наименования и генерики) и медицинские устройства подпадают под действие многих национальных законов и постановлений, касающихся патентования, тестирования, обеспечения безопасности, эффективности, мониторинга и маркетинга.
Правительство
Федеральные ведомства (e.g., Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, Управление по патентам и товарным знакам), а также государственные и местные органы власти нанимают химиков-органиков в областях специализации, указанных выше.
Глава 5 — Введение в органическую химию — Химия
Глава 5 — Введение в органическую химию
Это содержимое также можно загрузить в виде интерактивного PDF-файла. Для интерактивного PDF-файла требуется Adobe Reader для полной функциональности.
Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Разделы:
5,1 Боль, удовольствие и органическая химия
5,2 Рисование органических молекул
В поисках лучшей структуры Льюиса
5.3. Различные представления органических молекул
Молекулярные формулы
Структурные формулы и трехмерные модели
Скелетные или линейные формулы
Сокращенный чертеж органической структуры
5.4 Стереоизомеры, энантиомеры и хиральность
Хиральность
Талидомид — История непредвиденных последствий
5.5 Важность хиральности в белковых взаимодействиях
5.6 Распознавание общих органических функциональных групп
Алканы
Алкены и Алкины
Ароматические углеводороды
Алкилгалогениды
Спирты, фенолы и тиолы
Эфиры и сульфиды
Амины
Органические фосфаты
Альдегиды и кетоны
Карбоновые кислоты и их производные
Нитрилы
Практика распознавания функциональных групп в молекулах
5.7 Краткий обзор номенклатуры органических продуктов
5.8 Ссылки
5,1 Боль, удовольствие и органическая химия
перец Хабанеро (источник: https://www.flickr.com/photos/jeffreyww/)
Жаркий августовский вечер в парке в центре Северного Гудзона, штат Висконсин, деревни с населением чуть менее 4000 человек на реке Санта-Крус на западной окраине штата. Очередь людей сидит за столиками, расставленными внутри брезентовой палатки.Перед ликующей толпой друзей, родственников и соседей эти храбрые души готовятся к битве. . .с фруктовой тарелкой.
К несчастью для участников, рассматриваемый фрукт — хабанеро, один из самых острых сортов перца чили, обычно встречающихся на рынках Северной Америки. В этом конкретном мероприятии команды из пяти человек будут соревноваться, чтобы первыми съесть полный фунт перца. Когда начинается еда, сначала все кажется хорошо. Однако в течение тридцати секунд то, что начинает происходить, становится полностью предсказуемым и понятным для любого, кто когда-либо по ошибке налил слишком много острого соуса на обеденную тарелку.
Лица краснеют, пот и слезы текут, выпивается обильное количество холодной воды.
Хотя технически участники соревнуются друг с другом, реальный противник в этом соревновании — причина всей боли и страданий — это химическое соединение «капсаицин», источник тепла в остром перце чили.
Состоящий из четырех элементов: углерода, водорода, кислорода и азота, капсаицин вырабатывается растением перца для отпугивания голодных млекопитающих.Молекула связывается с белком-рецептором млекопитающих под названием TrpV1 и активирует его, который в нормальных условиях должен определять высокие температуры и посылать сигнал в мозг — «жарко, держись подальше!» Эта стратегия работает достаточно хорошо для всех видов млекопитающих, кроме Во-первых, мы, люди (по крайней мере, некоторые из нас), кажется, одиноки в своей склонности искать ожог острого перца в своей пище.
Интересно, что у птиц также есть белок теплового рецептора, который очень похож на рецептор TrpV1 у млекопитающих, но птицы совсем не чувствительны к капсаицину.В этом есть эволюционная логика: перец полезнее, если его будет есть птица, а не млекопитающее, потому что птица может распространять семена перца на гораздо более обширной территории. Область рецептора, отвечающая за чувствительность к капсаицину, кажется довольно специфичной. В 2002 году ученым удалось вставить небольшой сегмент (чувствительного к капсаицину) гена рецептора TrpV1 крысы в нечувствительную куриную версию гена, и полученный химерный (смешанный вид) рецептор оказался чувствительным к капсаицину ( Cell ). 2002 , 108 , 421).
Вернувшись на Пепперфест в Северном Гудзоне, люди с немного более здравым смыслом отказываются от болезненных последствий перегрузки капсаицином и вместо этого предаются более приятным химическим явлениям. Маленькая девочка, наслаждающаяся рожком мороженого, частично реагирует на химическое действие другого органического соединения, называемого ванилином.
Что такого в капсаицине и ванилине, что заставляет эти два соединения оказывать столь разительно разные эффекты на наше сенсорное восприятие? Оба производятся растениями, и оба состоят из элементов углерода, водорода, кислорода и (в случае капсаицина) азота.С момента зарождения химии как науки химики были очарованы — и на протяжении большей части этой истории озадачены — бесчисленными свойствами соединений, которые происходят от живых существ. К этим соединениям применялся термин «органические» от греческого organikos , и считалось, что они содержат некую «жизненную силу», которая отличает их от «неорганических» соединений, таких как минералы, соли и металлы. , Что позволило им действовать по совершенно другому набору химических принципов.Как иначе, как не под действием «жизненной силы», такая небольшая подгруппа элементов могла объединиться, чтобы образовать соединения с таким количеством различных свойств?
Сегодня, как вы, вероятно, уже знаете, термин «органический» в применении к химии относится не только к молекулам живых существ, но и ко всем соединениям, содержащим элемент углерод, независимо от их происхождения. Начиная с начала 19 века, когда химики в ходе тщательных экспериментов узнали о составе и свойствах «органических» соединений, таких как жирные кислоты, уксусная кислота и мочевина, и даже выяснили, как синтезировать некоторые из них, начиная с исключительно «неорганических» компонентов. , они начали понимать, что концепция «жизненной силы» не действительна, и что свойства как органических, так и неорганических молекул на самом деле можно понять, используя одни и те же фундаментальные химические принципы.
Они также начали более полно ценить уникальные свойства элемента углерода, который делает его настолько важным в химии живых существ, что это требует отдельного химического подполя. Углерод образует четыре стабильные связи либо с другими атомами углерода, либо с водородом, кислородом, азотом, серой, фосфором или галогеном. Характерные способы связывания углерода позволяют ему служить скелетом или каркасом для построения больших сложных молекул, которые включают цепи, разветвления и кольцевые структуры.
Хотя «органическая химия» больше не означает исключительно изучение соединений из живых существ, тем не менее именно желание понять химию жизни и повлиять на нее является движущей силой большей части работы химиков-органиков, независимо от того, является ли их целью изучение чего-то принципиально нового о реакционной способности углерод-кислородной связи, чтобы открыть новый лабораторный метод, который можно использовать для синтеза жизненно важного лекарства, или лучше понять сложный химический танец, который происходит в активном центре фермента или рецепторного белка.Хотя люди веками ели острый перец и продукты со вкусом ванили, мы только сейчас, в последние несколько десятилетий, начинаем понимать, как и почему один из них вызывает жгучую боль, а другой — чистое вкусовое удовольствие. Мы понимаем, что точное геометрическое расположение четырех элементов в капсаицине позволяет ему поместиться внутри связывающего кармана теплового рецептора TrpVI, но на сегодняшний день у нас еще нет подробного трехмерного изображения белка TrpVI, связанного с капсаицином.Мы также знаем, что различное расположение атомов углерода, водорода и кислорода в ванилине позволяет ему связываться со специфическими обонятельными рецепторами, но, опять же, еще многое предстоит узнать о том, как именно это происходит.
В этой главе вы познакомитесь с некоторыми из самых фундаментальных принципов органической химии. С концепциями, о которых мы узнаем, мы можем начать понимать, как углерод и очень небольшое количество других элементов в периодической таблице могут предсказуемым образом объединяться для создания практически безграничного химического репертуара.
По мере прочтения вы поймете, что в главе содержится множество обзоров тем, которые вы, вероятно, уже изучили на вводном курсе химии, но, вероятно, также будет несколько новых для вас понятий, а также некоторые темы. которые вам уже знакомы, но освещены более подробно и с большим упором на биологически значимые органические соединения.
Мы начнем с напоминания о том, как химики изображают связи в органических молекулах с помощью схемы рисования «структура Льюиса», сосредотачиваясь на концепции «формального заряда».Мы рассмотрим общие схемы связывания шести элементов, необходимых для всех форм жизни на Земле: углерода, водорода, азота, кислорода, серы и фосфора, а также галогенов (фтора, хлора, брома и йода). Затем мы продолжим изучение некоторых базовых навыков, связанных с рисованием и обсуждением органических молекул: понимание схемы рисования «линейная структура» и другие полезные способы сокращения и упрощения структурных чертежей, изучение функциональных групп и изомеров и рассмотрение как систематически называть простые органические молекулы.Наконец, мы соберем все это вместе с обзором структур наиболее важных классов биологических молекул — липидов, углеводов, белков и нуклеиновых кислот, на которые мы будем постоянно ссылаться на протяжении всей оставшейся части книги.
( Вернуться к началу )
5.2 Рисование органических молекул
Как видно из приведенных выше молекул капсаицина и ванилина, наиболее распространенными атомами, обнаруженными в органических соединениях, являются углерод и водород.Другие атомы, которые обычно образуют ковалентные связи в органических структурах, также включают кислород, азот, серу и фосфор. Реже галогены, такие как хлор, бром и йод, также могут быть включены в органические молекулы. Вспомните из главы 4, что правило октетов помогло нам определить, что углерод обычно образует четыре ковалентные связи, азот и фосфор — по три, кислород и сера — по две, а галогены — только по одной связи. Водород является исключением из правила октетов, поскольку это самый маленький элемент, а его валентная оболочка заполнена двумя электронами.Таким образом, водород может образовывать одну связь с другим атомом. Сера и фосфор также могут иметь образцы связывания, которые являются исключениями из правила октетов. Оба они имеют расширенную орбитальную связь с фосфором, который также обычно образует пять ковалентных связей, а сера способна образовывать четыре или шесть ковалентных связей. Таблица 5.1 дает графическое представление этих шаблонов. Когда вы рисуете органические молекулы, важно обращать внимание на правила связывания, чтобы все атомы достигли своих предпочтительных состояний связывания.
Таблица 5.1: Паттерны ковалентной связи атомов, обычно встречающиеся в органических молекулах
* Примечание: водород на самом деле не следует правилу октетов, поскольку его валентная оболочка заполнена 2 e —
В поисках лучшей структуры Льюиса
Продвигаясь вперед в изучении органических молекул, мы обнаруживаем, что они становятся намного более сложными, чем простые ионные и ковалентные соединения, обсуждаемые в главе 3.Из-за этой сложности органические соединения часто имеют более одного конкретного структурного состояния, в котором они могут существовать, и нередко молекула может перемещаться туда и обратно между этими состояниями. Когда электроны в молекуле могут перемещаться из одной области молекулы в другую, чтобы создать эти альтернативные структуры. Это определяется как резонанс , и результирующие состояния из этих сдвигов как резонансные структуры . Обратите внимание, что резонансные структуры дают химикам более конкретное представление о молекулах.Однако настоящие молекулы не существуют в том или ином структурном состоянии. Вместо этого они существуют в более аморфном переходном состоянии, которое находится где-то посередине между всеми возможными комбинациями. Некоторые резонансные формы могут быть более стабильными, чем другие, и будут иметь большее влияние на общую структуру молекулы, чем другие резонансные формы. Таким образом, нам нужен способ точно предсказать, какие резонансные структуры могут возникать внутри молекулы и какие состояния будут наиболее стабильными.Это может быть сделано с использованием формального метода заряда построения структур Льюиса. Формальный заряд на атоме рассчитывается как количество валентных электронов атома за вычетом количества электронов, которыми атом «владеет». Количество электронов, принадлежащих атому, можно рассчитать, сложив количество неподеленных электронов + половину количества общих электронов. Помните, что 2 e — используются для каждой линии, проведенной между двумя атомами (одна линия = 2 e — ).Например, если кислород связан с двумя другими атомами, мы могли бы вычислить формальный заряд кислорода, вычтя количество электронов, «принадлежащих» кислороду, из количества электронов его валентной оболочки:
Что, если кислород связан вот так?
Как бы вы рассчитали формальный сбор?
Это не предпочтительная конфигурация для кислорода, но поскольку кислород настолько электроотрицателен, он может нести отрицательный формальный заряд легче, чем атомы с меньшей электроотрицательностью.
Теперь рассмотрим структуру фосфатного аниона (PO 4 3- ). Это наиболее распространенная форма фосфора, обнаруженная во всех живых организмах на планете, включая человека. Он обычно включается в органические молекулы, такие как ДНК, белки и АТФ (аденозинтрифосфат), хранилище энергии клетки (рис. 5.1).
Рис. 5.1. Структуры аденозинтрифосфата (АТФ) и дезоксирибонуклеиновой кислоты (ДНК). Ион фосфата является важным компонентом обоих (A.) Структура АТФ и (В) структура ДНК.
Схема модели ДНК предоставлена: Zephyris — Собственная работа, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=15027555
Как нам нарисовать структуру Льюиса для фосфат-иона?
(1) Определите наименее электроотрицательный элемент (ы) в молекуле. Это будет центральный атом (атомы), вокруг которого связаны другие, более электроотрицательные атомы. (Обратите внимание, что водород никогда не может быть центральным атомом, поскольку он может образовывать только одну ковалентную связь).
Для PO 4 3- перечислите все атомы с фосфором в центре. Кроме того, перечислите любые дополнительные электроны из-за отрицательного заряда всей молекулы и ваши ожидания относительно связывающей способности каждого атома по достижению октета. Обратите внимание, что у нас есть четыре атома кислорода, которые должны связываться с фосфором. Таким образом, мы ожидаем, что P будет находиться в состоянии связи 5 для этой молекулы (т.е. 3 будет недостаточно). Обратите внимание, что неподеленная пара электронов в P расщеплена, и каждый электрон используется для расширенной орбитальной связи с другими атомами.
(2) Подсчитайте общее количество валентных электронов, присутствующих в молекуле. Для этого сложите все валентные электроны для каждого присутствующего атома.
- Если на молекуле нет общего заряда, это число будет представлять общее количество валентных электронов в молекуле.
- Если в молекуле имеется отрицательный заряд, добавьте дополнительные электроны к количеству валентных электронов для всех присутствующих атомов, чтобы вычислить общее количество валентных электронов в молекуле.Эта молекула будет существовать как анион.
- Если молекула имеет чистый положительный заряд, вычтите общий положительный заряд из числа валентных электронов для всех присутствующих атомов, и это будет представлять общее количество валентных электронов в молекуле. Эта молекула будет существовать в виде катиона.
(3) Постройте оболочку для связанных атомов с центральным атомом (ами) и вычислите формальный заряд (ы).
Поместите связи между внешними атомами и центральным атомом
Добавьте все оставшиеся электроны, чтобы завершить правило октета / дуэта (или расширенные орбитали, если необходимо) для оставшихся атомов
Если у вас закончатся электроны до того, как все атомы заполнили валентные оболочки, начните создавать двойные связи там, где это необходимо
Вычислите формальный заряд каждого атома в молекуле, а затем используйте полученную сумму для вычисления формального заряда всей молекулы.
Посмотрите видеоурок выше, который поможет вам нарисовать структуру Льюиса фосфата. Вы увидите, что вам нужно начать с центрального фосфора. Обратите внимание, что вместо октета необходимо использовать расширенное правило орбиталей, чтобы иметь возможность связываться со всеми атомами кислорода. Мы знаем, что для фосфора он образует 5 связей в расширенном орбитальном формате (таблица 5.1) и потребует всего 10 электронов вместо обычных 8, которые мы привыкли видеть с помощью правила октетов.Итак, начните с рисования этих 5 облигаций. Вы заметите, что вам нужно создать одну двойную связь с одним из атомов кислорода, чтобы завершить 5 связей. После этого заполните неподеленную пару электронов для всех атомов, пока не получите в общей сложности 32 электрона. (убедитесь, что каждый кислород достигает состояния октета. Затем вычислите формальные заряды на каждом атоме. Как показано выше, кислород, который имеет две связанные пары электронов и две пары заимствованных, имеет формальный заряд ноль, в то время как атомы кислорода, которые имеют одну связанную пара электронов и три неподеленные пары имеют формальный заряд 1 — .Если мы вычислим формальный заряд фосфора, мы увидим, что P имеет 5 валентностей e минус электроны неподеленной пары и половина электронов связанной пары. P не имеет неподеленных пар и имеет 10 связанных парных электронов. Таким образом, половина 10 = 5. 5 — 5 = 0. Таким образом, P имеет формальный заряд ноль. Поскольку три атома кислорода имеют заряд 1 —, а два других атома равны нулю, общий заряд молекулы составляет 3 —. Завершенная структура Льюиса для фосфата должна выглядеть так:
(4) При необходимости изобразите резонансные структуры.
Для нашей фосфатной (PO 4 3- ) структуры, приведенной выше, если мы рассмотрим каждый из атомов кислорода в молекуле, они по своей сути не отличаются друг от друга. Таким образом, каждый кислород, окружающий фосфор, должен иметь равные возможности для образования двойной связи. Мы показали, что двойная связь образуется в нижнем положении, но у нее есть равновероятная вероятность образования с любым из трех других атомов кислорода. Таким образом, мы можем показать структуру с положением двойной связи во всех других возможных конформациях:
На самом деле ни одна из резонансных структур не представляет собой истинную структуру.Истинная структура находится где-то посередине между всеми возможными резонансными формами. Однако рисование резонансных структур дает ученым возможность обсудить истинную конформацию структуры и дает возможность предсказать химическую реакционную способность молекулы.
(Вернуться к началу)
5.3. Различные представления органических молекул
Молекулярные формулы
Органические молекулы, по сравнению с простыми солями и ковалентными соединениями, показанными в главах 3 и 4, могут быть довольно большими и разветвленными структурами с множеством ответвлений.Таким образом, важно понимать, как рисовать органические молекулы, чтобы вы могли понять трехмерную форму молекулы. Молекулярная формула — это самый простой способ представить соединение, подсчитав все различные типы атомов и перечислив их по порядку. Например, сахар глюкоза содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Тогда молекулярная формула будет записана как C 6 H 12 O 6 . По соглашению первым указывается углерод, на втором месте водород, затем кислород, азот, сера, фосфор и, наконец, любые галогены.Однако для органической химии молекулярные формулы не дают много информации. Они просто предоставляют номера каждого типа атомов, присутствующих в молекуле, но они ничего не говорят вам о том, как атомы соединяются вместе в пространстве. Таким образом, молекулярные формулы очень редко используются в органической химии, потому что они не дают полезной информации о связи в молекуле. Одно из немногих мест, где вы можете встретить их, — это уравнения горения простых углеводородов, например:
C 5 H 12 + 😯 2 → 5CO 2 + 6H 2 O
В подобных случаях порядок связывания в органической молекуле не имеет значения.Однако для большинства биологически важных реакций форма молекулы обычно имеет решающее значение для функции молекулы, очень похоже на ключ, вставляемый в замок. Таким образом, порядок склеивания становится очень важным. Например, C 5 H 12 , показанные в приведенном выше уравнении, могут быть связаны вместе более чем одним способом:
Две вышеуказанные структуры представляют действительные структуры с молекулярной формулой C 5 H 12 .Однако каждая из этих структур представляет собой отдельную молекулу с немного разными химическими свойствами. Когда соединения имеют одну и ту же молекулярную формулу, но имеют другой порядок связывания атомов, они известны как структурные изомеры . (вы также можете увидеть термин конституциональные изомеры ). Перечислили ли мы все возможные структурные изомеры для формулы C 5 H 12 ? Нет! Используйте приведенный ниже пример, чтобы увидеть, можете ли вы создать третий структурный изомер.
(Вернуться к началу)
Структурные формулы и трехмерные модели
Структурная формула показывает, как связаны различные атомы, и может быть более полезной, чем просто написание молекулярной формулы для соединения. Существуют различные способы рисования структурных формул, и вам необходимо знать все из них. Они включают отображаемую формулу, сокращенные формулы и линейные структуры.
Отображаемые формулы
Отображаемая формула показывает все связи в молекуле в виде отдельных линий, причем каждый атом записан в конце каждой строки с использованием его элементной аббревиатуры из периодической таблицы.Все структуры C 6 H 12 , приведенные выше, записаны в отображаемых формулах . Вы должны помнить, что каждая линия представляет собой пару общих электронов. Например, на рисунке 5.2 ниже показана отображаемая формула метана рядом с трехмерными изображениями.
Рисунок 5.2: Три различных представления CH 4 Слева — модель мяча и клюшки, в центре — отображаемая формула, а справа — модель заполнения пространства.
Обратите внимание, что отображаемая формула метана не представляет трехмерную форму молекулы, показанную на диаграмме заполнения пространства справа. Метан не плоский с углами связи 90 °. Несоответствие между тем, что вы рисуете, и тем, как на самом деле выглядит молекула, может привести к проблемам, если вы не будете осторожны. Таким образом, для органической химии важно начать думать о структурах в их трехмерной форме. Чем больше вы практикуетесь, тем больше вы сможете визуализировать и вращать молекулу в своей голове.Например, рассмотрим простую молекулу с молекулярной формулой CH 2 Cl 2 . Вы можете подумать, что существует два разных способа расположения этих атомов, если начертите отображаемую формулу.
Но эти две структуры на самом деле абсолютно одинаковые. Наше моделирование VSEPR из главы 4 показало, что углерод принимает тетраэдрическое подтверждение, где каждый валентный угол составляет 109 o . Молекула не плоская, в плоскости бумаги.Посмотрите видео ниже, чтобы увидеть, как они выглядят как модели вращающихся шариков и клюшек.
Одна конструкция на самом деле представляет собой простое вращение другой. Рассмотрим немного более сложную молекулу: C 2 H 5 Cl. Отображаемая формула может быть записана как:
Но, опять же, это точно так же. Посмотрите на модели ниже.
Продолжая практиковаться в составлении структурных формул, вы научитесь лучше распознавать и различать изомеры, которые действительно отличаются друг от друга, и версии одной и той же молекулы, написанные с разных трехмерных точек зрения.
Краткие формулы
Для чего-либо, кроме самых простых молекул, рисование полностью отображаемой формулы может быть громоздким и занимать слишком много места, особенно все связи углерод-водород. Вы можете упростить — или упростить — формулу , написав, например, CH 3 или CH 2 вместо отображения всех связей C-H. Например, этановая (C 2 H 4 O 2 ) кислота может быть представлена в полностью отображаемой форме, частично конденсированной форме и полностью конденсированной форме.
Обратите внимание, что частично конденсированная структура по-прежнему дает очень четкую картину того, где каждый из атомов связан в пространстве. Однако с полностью уплотненной структурой может быть сложно точно увидеть рисунки склеивания. Полностью конденсированная форма содержит больше информации о порядке связывания, чем молекулярная формула, так что атомы, которые непосредственно связаны с соседним атомом, размещаются рядом с этим атомом в конденсированной форме, а не просто подсчет всех видов атомов как в молекулярной формуле.
Работая в обратном направлении, мы можем использовать конденсированную структуру этановой кислоты в качестве примера для воссоздания частично конденсированной структуры. Если посмотреть на положение первого углерода, становится очевидным, что с первым углеродом связаны три атома водорода и один углерод:
Обратите внимание, что это удовлетворяет правилу октетов для первого углерода (четыре связи с другими атомами). Три атома водорода также имеют одинарные связи с первым углеродом. Второму углероду теперь присвоена одна связь с первым углеродом.Нам нужно назначить оставшиеся три облигации.
Из сжатой формулы ясно, что первый кислород присоединен ко второму углероду, однако после этого мы не уверены в положении второго кислорода.
Мы можем ясно сделать вывод, что последний атом водорода связан со вторым кислородом, поскольку он находится в этом положении. Однако, поскольку кислород может образовывать две связи, мы не можем быть уверены, основываясь только на одной конденсированной структуре, что второй кислород связан со вторым углеродом или с первым кислородом.
Если вы не уверены, какой атом к какому связан, лучше всего выделить потенциальные структуры и оценить их потенциальную правильность.
Из анализа вышеупомянутых потенциальных структур ясно, что ни одна из структур не удовлетворяет правилу октетов для одного или нескольких атомов в молекуле, как в настоящее время написано. Однако нижняя структура менее удовлетворительна, чем верхняя структура, поскольку у второго углерода отсутствуют 2 ковалентные связи, в то время как все другие атомы удовлетворяют требованиям связывания октетов.На верхней диаграмме и у второго атома углерода, и у первого атома кислорода отсутствует одна связь. Эта структура может легко удовлетворять правилу октетов, помещая в молекулу двойную связь между углеродом 2 и кислородом 1. Принимая во внимание, что решение для недостающих двух углеродных связей для второго углерода в нижней структуре нелегко исправить. Таким образом, верхняя структура является более вероятной структурой, чем нижняя структура с добавлением двойной связи между углеродом и кислородом.
Хотя конденсированные структуры легче написать, чем отображаемые или частично конденсированные структуры, они могут оказаться немного более сложными для определения трехмерного рисунка связи атомов.
Линейные или скелетные формулы
В строке или скелетной формуле все атомы водорода не показаны, и все атомы углерода не помечены, а указаны в конце или изгибе в каждой линии, оставляя только углеродный скелет с присоединенными к нему функциональными группами. . Любые гетероатомы (любой другой атом, кроме углерода или водорода) и атомы водорода, присоединенные к гетероатомам, показаны в конденсированной форме.Например, отображаемая структура, частично конденсированная структура и формула линии для 2-бутанола (C 4 H 10 O) выглядят следующим образом:
На линейной или скелетной диаграмме можно сделать следующие допущения:
есть атом углерода на каждом стыке линий и в конце каждой линии.
, к каждому углероду присоединено достаточно атомов водорода, чтобы общее количество связей на этом углероде равнялось 4.
: все гетероатомы (и атомы водорода, присоединенные к гетероатомам) показаны в сжатом формате на скелетной структуре.
В органической химии и биохимии ученые склонны использовать комбинацию этих различных форматов для представления химических структур. Важно научиться рисовать и интерпретировать все возможные изображения.
Как рисовать структурные формулы в 3-х измерениях
Бывают случаи, когда важно иметь возможность показать точное трехмерное расположение частей некоторых молекул при использовании структурного представления.Для этого облигации обозначаются условными обозначениями:
Например, вы можете захотеть показать трехмерное расположение групп вокруг углерода, который имеет группу -ОН в 2-бутаноле.
(Вернуться к началу)
Сокращенные чертежи органических структур
Часто при рисовании органических структур химики находят удобным использовать букву «R» для обозначения части молекулы за пределами интересующей области.Если мы просто хотим в целом сослаться на функциональную группу, не показывая, например, конкретную молекулу, мы можем использовать «группы R», чтобы сосредоточить внимание на интересующей группе:
Группа R представляет собой удобный способ сокращения структур больших биологических молекул, особенно когда нас интересует что-то, что происходит конкретно в одном месте молекулы. Например, в главе 15, когда мы рассматриваем биохимические окислительно-восстановительные реакции с участием молекулы флавина, мы будем сокращать большую часть структуры флавина (т. Е.R = FAD), который вообще не меняется в интересующих реакциях:
В качестве альтернативы мы можем использовать символ «разрыва», чтобы указать, что мы смотрим на небольшой кусок или участок более крупной молекулы. Это обычно используется в контексте групп рисования на больших полимерах, таких как белки или ДНК.
Наконец, группы R можно использовать для краткой иллюстрации ряда родственных соединений, таких как семейство антибиотиков на основе пенициллина.
Правильное использование сокращений — очень важный навык, который нужно развивать при изучении органической химии в биологическом контексте, потому что, хотя многие биомолекулы очень большие и сложные (и их рисование занимает вечность!), Обычно мы сосредотачиваемся только на одной небольшой части молекулы. где происходят изменения.
Как правило, вы никогда не должны сокращать любой атом, участвующий в событии разрыва или образования связи. , которое проиллюстрировано: сокращает только ту часть молекулы, которая не участвует в интересующей реакции.
Например, углерод № 2 в реагенте / продукте, приведенном ниже, наиболее определенно участвует в изменениях связывания, и поэтому его не следует включать в группу «R».
Если вы не уверены, рисовать ли часть конструкции или сокращать ее, самое безопасное, что можно сделать, — это нарисовать ее.
(Вернуться к началу)
5.4 Стереоизомеры, энантиомеры и хиральность
Как видно из раздела 5.3, органическая химия включает в себя бесконечно разнообразные структуры, возникающие в результате того, как атомы собраны в трехмерном пространстве. Предоставления только молекулярной формулы соединения часто недостаточно для определения соединения, поскольку многие молекулярные формулы имеют многочисленные структурные изомеры. Например, молекулярная формула C 2 H 6 O, молекула всего из 9 атомов, может относиться к диметиловому эфиру или этанолу, в зависимости от того, находится ли кислород в середине или на конце углеродной цепи.
Помните, что структурных изомеров имеют одинаковые атомы, но порядок, в котором атомы связаны друг с другом, отличается, что приводит к различным физическим и химическим свойствам. Например, этанол является жидким при комнатной температуре, а диэтиловый эфир — газом.
Если атомы соединения, соединенного вместе, имеют одинаковый порядок, но их трехмерное расположение в пространстве отличается, они считаются изомером особого типа, называемым стереоизомером . Молекулы сахара глюкоза и галактоза являются стереоизомерами. Они различаются положением одной -ОН-группы, как показано на диаграмме ниже:
Существует особый вид стереоизомеров, называемый энантиомерами , которые являются зеркальным отображением друг друга, но не могут накладываться друг на друга. Это означает, что как бы вы ни повернули их в космосе, вы никогда не сможете положить их друг на друга и получить одно и то же соединение. Одним из примеров является 2-бутанол, который можно представить в виде пары энантиомеров (рис.5.3).
Рис. 5.3: Энантиомеры 2-бутанола. Энантиомеры показаны в трехмерной структурной формуле, отображаемой на верхней диаграмме, и модели мяча и клюшки на нижней диаграмме.
(Вернуться к началу)
Хиральность
Считается, что
энантиомеры обладают свойством c хиральность . Хиральность — это термин, применяемый к объектам, которые являются зеркальными отражениями, но не могут быть наложены друг на друга.Термин «хиральный» происходит от греческого слова «рукоятка», т.е. праворукость или леворукость. Ваши руки хиральны: ваша правая рука является зеркальным отражением вашей левой руки, но если вы положите одну руку поверх другой, обе ладони опущены, вы увидите, что они не накладываются друг на друга. (Рис 5.4). Таким образом, хиральные объекты являются зеркальным отображением друг друга, но не могут накладываться друг на друга. Углерод становится хиральным, когда к нему присоединяются четыре разных заместителя. В приведенном выше примере вы заметите, что к центральному углероду присоединены четыре разные группы: группа -ОН, группа -H, группа -CH 3 и группа -CH 2 CH 3 .
Рисунок 5.4: Природа хиральности. Углерод становится хиральным, когда к нему присоединяются четыре различных заместителя. Как бы вы ни повернули молекулу слева, вы не можете наложить ее на молекулу справа.
Источник: Chirality with hands.jpg: Неизвестная производная работа: — πϵρ ήλιο ℗ — Chirality with hands.jpg
Стереоизомеры, которые не являются энантиомерами, такие как глюкоза и галактоза, показанные выше, – имеют хиральные центры и не могут накладываться друг на друга, но они не являются зеркальным отображением друг друга.Энантиомерами называют только стереоизомеры, которые также являются зеркальными отражениями и не могут накладываться друг на друга. Энантиомеры очень трудно отделить друг от друга. Они практически идентичны по своим физическим и химическим свойствам. У них одинаковая молекулярная масса, одинаковая полярность, одинаковые температуры плавления и кипения и т. Д. На самом деле энантиомеры настолько похожи, что даже имеют одно и то же имя! На рисунке 5.3 показаны два энантиомера 2-бутанола. Обе молекулы представляют собой 2-бутанол. Но это , а не , точно такая же молекула, точно так же, как ваш левый ботинок не , а точно такой же, как ваш правый.Они являются неперекрывающимися зеркальными отображениями друг друга. Как нам сообщить об этой разнице?
Одно небольшое различие между энантиомерами — это направление вращения поляризованного света при попадании на молекулу. Один энантиомер будет вращать свет по часовой стрелке, а другой — против часовой стрелки. Версия по часовой стрелке называется «D» для правовращающего (или правостороннего), а версия против часовой стрелки называется «L» для левовращающего (или левостороннего).Однако вращение света нельзя использовать в качестве прогнозирующего способа для определения абсолютной стереоконфигурации молекулы (то есть вы не можете сказать, какой энантиомер будет вращать свет вправо или влево, пока вы действительно не проведете эксперимент).
Таким образом, необходима другая система для описания абсолютной конфигурации. Система приоритетов Кана-Ингольда-Прелога (CIP) была разработана для определения абсолютной стереоконфигурации энантиомеров как зловещей (S) или прямой (R). В этой системе группам, которые присоединены к хиральному углероду, отдается приоритет на основе их атомного номера ( Z ).Атомам с более высоким атомным номером (большим количеством протонов) дается более высокий приоритет (то есть S> P> O> N> C> H).
Для определения стереохимии поместите группу с наименьшим приоритетом подальше от вас, чтобы остальные три удерживаемые группы были обращены к вам.
Назначьте приоритет остальным группам.
Правила этой системы стереохимической номенклатуры на первый взгляд довольно просты. В качестве первого примера мы будем использовать простой трехуглеродный сахарный глицеральдегид.Попробуйте сделать модель стереоизомера глицеральдегида, показанную ниже. Если у вас нет набора для химического моделирования, простой альтернативой являются зубочистки и мармеладки. Убедитесь, что вы делаете правильный энантиомер!
Первое, что мы должны сделать, это присвоить приоритет каждому из четырех заместителей, связанных с хиральным углеродом . В этой системе номенклатуры приоритеты основаны на атомном номере, причем более высокие атомные номера имеют более высокий приоритет.Сначала мы рассмотрим атомы, которые непосредственно связаны с хиральным углеродом: это H, O (в гидроксиле), C (в альдегиде) и C (в группе CH 2 OH).
Два приоритета просты: водород с атомным номером 1 является самым низким (№4) приоритетом, а гидроксильный кислород с атомным номером 8 является приоритетом №1. Углерод имеет атомный номер 6. Какая из двух групп «C» является приоритетной №2, альдегид или CH 2 OH? Чтобы определить это, мы отодвигаем еще одну связь от стереоцентра: для альдегида у нас есть двойная связь с кислородом, а в группе CH 2 OH мы имеем одинарную связь с кислородом.Если атом одинаковый, двойные связи имеют более высокий приоритет, чем одинарные. Следовательно, альдегидной группе присвоен приоритет №2, а группе CH 2 OH — приоритет №3. Распределив приоритеты, мы затем убеждаемся, что группа приоритета №4 (водород) направлена назад от нас, в плоскость страницы (это уже так).
Затем мы обводим круг, определяемый группами приоритетов №1, №2 и №3, в порядке возрастания. В нашем примере с глицеральдегидом этот круг повернут по часовой стрелке, что говорит нам о том, что этот углерод имеет конфигурацию «R», и что эта молекула является (R) -глицеральдегидом.Для (S) -глицеральдегида круг, описываемый приоритетными группами №1, №2 и №3, направлен против часовой стрелки (но сначала мы должны перевернуть молекулу так, чтобы буква H указывала на плоскость страницы) .
В случае 2-бутанола (рис. 5.5) легко назначить первый и четвертый приоритеты. -OH является первым приоритетом, а -H — четвертым приоритетом. Как вы назначаете 2-й и 3-й приоритет, если оба эти атома являются углеродом? Если приоритет для присоединенного атома такой же, вам нужно перейти на следующий уровень и оценить приоритет там.Для 2-бутанола одна группа — -CH 3 , а одна группа — -CH 2 CH 3 . В первой ситуации, если мы посмотрим на следующий уровень, этот углерод связан с тремя другими атомами водорода (все с очень низким приоритетом). Во второй ситуации углерод связан с двумя атомами водорода и одним углеродом. Поскольку C имеет более высокий приоритет, чем H, группа -CH 2 CH 3 будет иметь более высокий приоритет над группой -CH 3 . Как только всем группам будет присвоен приоритет, вы можете определить, в каком направлении будет двигаться приоритет.Если она направлена по часовой стрелке, молекуле будет присвоено обозначение «R». Приоритет движения против часовой стрелки обозначается буквой «S». В нашем примере 2-бутанол слева показывает приоритет движения в направлении против часовой стрелки, отдавая S-энантиомер. Молекула справа показывает R-энантиомер с приоритетом, движущимся по часовой стрелке.
Рисунок 5.5: Стереохимия 2-бутанола. Систему приоритета CIP можно использовать для определения абсолютной стереоконформации энантиомеров
(Вернуться к началу)
Талидомид — История непредвиденных последствий
Интересно, что энантиомеры имеют одинаковые физические свойства и точно такие же химические свойства, за исключением при взаимодействии с другими хиральными молекулами.Таким образом, хиральные молекулы потенциально сильно различаются в физиологии и медицине. Например, в 1960-х годах в Западной Европе широко прописывали лекарство под названием талидомид для облегчения утреннего недомогания беременных женщин.
Талидомид ранее использовался в других странах в качестве антидепрессанта и считался безопасным и эффективным. Однако вскоре врачи поняли, что что-то пошло не так: многие дети, рожденные женщинами, принимавшими талидомид во время беременности, страдали серьезными врожденными дефектами.
B aby , рожденный от матери, принимавшей талидомид во время беременности.
Позже исследователи поняли, что проблема заключалась в том, что талидомид поставлялся в виде смеси двух различных изомерных форм, называемой рацемической смесью .
Один из изомеров является эффективным лекарством, а другой вызывает побочные эффекты. Обе изомерные формы имеют одинаковую молекулярную формулу и одинаковую связь между атомами, поэтому они не являются просто структурными изомерами.Они отличаются расположением в трехмерном пространстве одного тетраэдрического хирального углерода. Таким образом, эти две формы талидомида представляют собой энантиомеров .
Обратите внимание, что рассматриваемый углерод имеет четыре разных заместителя (два из них просто связаны кольцевой структурой). Тетраэдрические атомы углерода с четырьмя различными группами заместителей называются стереоцентрами .
Глядя на структуры того, что мы называем двумя изомерами талидомида, вы можете не полностью убедиться, что на самом деле это две разные молекулы.Чтобы убедиться, что они действительно разные, давайте создадим обобщенную картину тетраэдрического стереоцентра углерода с четырьмя заместителями, обозначенными R 1 -R 4 . Два стереоизомера нашей упрощенной модели выглядят так:
Если вы внимательно посмотрите на рисунок выше, вы заметите, что молекула A и молекула B являются зеркальными отображениями друг друга (линия с надписью «σ» представляет собой зеркальную плоскость). Более того, , они не могут быть наложены друг на друга. : если мы возьмем молекулу A, перевернем ее и поместим рядом с молекулой B, мы увидим, что две структуры не могут быть наложены друг на друга.Это две разные молекулы!
Если вы сделаете модели двух стереоизомеров талидомида и сделаете то же самое, вы увидите, что они тоже являются зеркальными изображениями и не могут быть наложены друг на друга (это поможет посмотреть на цветную версию рисунка ниже).
Талидомид представляет собой хиральную молекулу .
Вот еще несколько примеров хиральных молекул, которые существуют в виде пар энантиомеров. В каждом из этих примеров есть один стереоцентр, обозначенный стрелкой.(Многие молекулы имеют более одного стереоцентра, но мы вернемся к этому чуть позже!)
Вот несколько примеров молекул, которые являются ахиральными (не хиральными). Обратите внимание, что ни одна из этих молекул не имеет стереоцентра (атома, связанного с четырьмя разными заместителями).
При оценке молекулы на хиральность важно понимать, что использование штрихового / сплошного рисунка клина не обязательно означает, что молекула хиральна.Иногда хиральные молекулы рисуют без использования клиньев. И наоборот, клинья могут использоваться для атомов углерода, которые не являются стереоцентрами — посмотрите, например, на рисунки глицина и цитрата на рисунке выше. Просто потому, что вы видите пунктирные и сплошные клинья в структуре, не следует автоматически предполагать, что вы смотрите на стереоцентр.
Стереоцентрами могут быть и другие элементы, помимо углерода. Фосфорный центр фосфат-иона и органических фосфатных эфиров, например, является тетраэдрическим и, таким образом, потенциально является стереоцентром.
Возникли проблемы с визуализацией хиральности и энантиомеров? Может быть полезно посмотреть этот
видеоурок
(Вернуться к началу)
5.5 Важность хиральности в белковых взаимодействиях
Талидомид, который использовался в 1960-х годах для лечения депрессии и утреннего недомогания, продавался в виде смеси 50:50 как R-, так и S-энантиомеров — это называется рацемической смесью .«Волнистая» связь в химической структуре указывает на рацемическую смесь — таким образом, рацемический ( R / S ) талидомид будет иметь вид:
Проблема с рацемическим талидомидом, как мы узнали выше, заключается в том, что только R-энантиомер является эффективным лекарством, тогда как S-энантиомер вызывает мутации у развивающегося плода. Как такое, казалось бы, тривиальное структурное изменение приводит к такому драматическому (и в данном случае трагическому) различию в биологической активности? Практически все лекарства работают, так или иначе взаимодействуя с важными белками в наших клетках: они могут связываться с белками рецепторов боли, например, блокировать передачу болевых сигналов или закупорить активный сайт фермента, который участвует в синтезе холестерин.Белки представляют собой хиральные молекулы и очень чувствительны к стереохимии: так же, как перчатка для правой руки не поместится на вашей левой руке, белок, способный прочно связываться с ( R ) -талидомид, может вообще не связываться. к ( S ) -талидомид (это поможет просмотреть цветную версию рисунка ниже).
Вместо этого, похоже, что ( S ) -талидомид каким-то образом взаимодействует с белком, участвующим в развитии растущего плода, в конечном итоге вызывая наблюдаемые врожденные дефекты.
Рис. 5.5. Сайты связывания лекарств на белках стереоспецифичны.
Источник: www.kshitij-iitjee.com/Study/Chemistry/Part2/Chapter3/109.jpg
Безрецептурный болеутоляющий ибупрофен в настоящее время продается в виде рацемической смеси, но эффективен только энантиомер S .
К счастью, энантиомер R не вызывает каких-либо опасных побочных эффектов, хотя его присутствие, похоже, увеличивает количество времени, необходимое для ( S ) -ибупрофена, чтобы подействовать.
С помощью своего инструктора вы можете непосредственно ощутить биологическое значение стереоизомерии. Карвон — это хиральная молекула растительного происхождения, которая пахнет мятой в форме R и тмином (специей) в форме S .
Два энантиомера по-разному взаимодействуют с белками рецепторов запаха в вашем носу, генерируя передачу различных химических сигналов в обонятельный центр вашего мозга.
(Вернуться к началу)
5.6 Распознавание общих органических функциональных групп
Число известных органических соединений довольно велико. Фактически, органических соединений известно во много раз больше, чем всех других (неорганических) соединений, открытых к настоящему времени, всего около 7 миллионов органических соединений. К счастью, органические химические вещества состоят из относительно небольшого числа схожих частей, объединенных по-разному, что позволяет нам предсказать, как соединение, которое мы никогда раньше не видели, может реагировать, сравнивая, как известно, как реагируют другие молекулы, содержащие такие же типы частей.
Эти части органических молекул называются функциональными группами и состоят из определенных схем связи с атомами, наиболее часто встречающимися в органических молекулах (C, H, O, N, S и P). Идентификация функциональных групп и способность предсказывать реакционную способность на основе свойств функциональных групп является одним из краеугольных камней органической химии.
Функциональные группы — это определенные атомы, ионы или группы атомов, обладающие согласованными свойствами.Функциональная группа составляет часть более крупной молекулы.
Например, -ОН, гидроксильная группа, которая характеризует спирты, представляет собой кислород с присоединенным водородом. Его можно найти на любом количестве различных молекул.
Так же, как элементы обладают отличительными свойствами, функциональные группы имеют характерный химический состав. Функциональная группа -ОН в одной молекуле будет иметь тенденцию реагировать аналогично, хотя, возможно, и не идентично, с -ОН в другой молекуле.
Органические реакции обычно происходят в функциональной группе, поэтому изучение реакционной способности функциональных групп подготовит вас к пониманию многих других вещей об органической химии.
Функциональные группы — это структурные единицы в органических соединениях, которые определяются определенными связями между определенными атомами. Структура капсаицина, соединения, обсуждаемого в начале этой главы, включает несколько функциональных групп, обозначенных на рисунке ниже и объясненных в этом разделе.
По мере того, как мы прогрессируем в изучении органической химии, становится чрезвычайно важно иметь возможность быстро распознавать наиболее распространенные функциональные группы, потому что являются ключевыми структурными элементами, определяющими реакцию органических молекул .Пока мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами. Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению того, как различные функциональные группы ведут себя в органических реакциях. Ниже приводится краткое введение в основные органические функциональные группы.
(Вернуться к началу)
Алканы
«По умолчанию» в органической химии (по существу, не хватает каких-либо функциональных групп) дается термин алкан , характеризующийся одинарными связями между углеродом и углеродом или между углеродом и водородом.Метан, CH 4 , представляет собой природный газ, который вы можете сжигать в своей печи. Октан, C 8 H 18 , входит в состав бензина.
Алкены и алкины
Алкены (иногда называемые олефинами) имеют двойные углерод-углеродные связи, а алкины имеют тройные углерод-углеродные связи. Этен, простейший пример алкена, представляет собой газ, который служит клеточным сигналом в фруктах для стимулирования созревания.(Если вы хотите, чтобы бананы созрели быстро, положите их в бумажный пакет вместе с яблоком — яблоко выделяет газ этен (также называемый этиленом), запускающий процесс созревания бананов). Этин, обычно называемый ацетиленом, используется в качестве топлива в сварочных горелках.
В главе 6 мы изучим природу связи алкенов и алкинов и узнаем, что связь в алкенах является плоской тригональной, а в алкинах — линейной. Кроме того, многие алкены могут принимать две геометрические формы: цис или транс .Формы цис и транс данного алкена представляют собой разные изомеры с разными физическими свойствами, потому что, как мы узнаем в главе 6, существует очень высокий энергетический барьер для вращения вокруг двойной связи. В приведенном ниже примере разница между алкенами цис и транс очевидна.
Алканы, алкены и алкины классифицируются как углеводороды , потому что они состоят исключительно из атомов углерода и водорода.Говорят, что алканы — это насыщенных углеводородов , потому что атомы углерода связаны с максимально возможным числом атомов водорода — другими словами, они насыщены атомами водорода. Углерод с двойной и тройной связью в алкенах и алкинах имеет меньшее количество атомов водорода, связанных с ними — поэтому они обозначаются как ненасыщенные углеводороды . Как мы увидим в более поздней главе, водород может быть добавлен к двойным и тройным связям в реакции, называемой «гидрирование».
(Вернуться к началу)
Ароматические углеводороды
Ароматическая группа представлена бензолом (который раньше был широко используемым растворителем в органической лаборатории, но оказался канцерогенным) и нафталином, соединением с характерным запахом «нафталина». Ароматические группы представляют собой плоские (плоские) кольцевые структуры и широко распространены в природе.
Когда углерод алкана связан с одним или несколькими галогенами, группа называется алкилгалогенидом или галогеналканом .Хлороформ является полезным растворителем в лаборатории и был одним из первых анестетиков, используемых в хирургии. Хлордифторметан использовался в качестве хладагента и в аэрозольных распылителях до конца двадцатого века, но его использование было прекращено после того, как было обнаружено, что он оказывает вредное воздействие на озоновый слой. Бромэтан представляет собой простой алкилгалогенид, часто используемый в органическом синтезе. Алкилгалогенидные группы в биомолекулах встречаются довольно редко.
Спирты, фенолы и тиолы
В функциональной группе спирта углерод связан одинарной связью с группой ОН (группа ОН, когда она является частью более крупной молекулы, называется гидроксильной группой ).За исключением метанола, все спирты можно разделить на первичные, вторичные или третичные. В первичном спирте углерод, связанный с группой ОН, также связан только с одним другим углеродом. Во вторичном спирте и третичном спирте углерод связан с двумя или тремя другими атомами углерода соответственно. Когда гидроксильная группа непосредственно связана с ароматическим кольцом, полученная группа называется фенолом . Серный аналог спирта называется тиолом (от греческого thio — сера).
Обратите внимание, что определение фенола гласит, что гидроксильный кислород должен быть непосредственно, присоединен к одному из атомов углерода ароматического кольца. Следовательно, соединение, указанное ниже, представляет собой , а не фенол — это первичный спирт.
Это различие важно, потому что, как мы увидим позже, существует значительная разница в реакционной способности спиртов и фенолов
(Вернуться к началу)
Эфиры и сульфиды
В функциональной группе эфира кислород связан с двумя атомами углерода.Ниже представлена структура диэтилового эфира, распространенного лабораторного растворителя, а также одного из первых соединений, которые будут использоваться в качестве анестетика во время операций. Серный аналог простого эфира называется тиоэфиром или сульфидом .
(Вернуться к началу)
Амины
Амины характеризуются атомами азота с одинарными связями с водородом и углеродом.Так же, как существуют первичные, вторичные и третичные спирты, существуют первичные, вторичные и третичные амины. Аммиак — это особый случай, когда нет атомов углерода.
Одним из наиболее важных свойств аминов является то, что они являются основными и легко протонируются с образованием катионов аммония. В случае, когда азот имеет четыре связи с углеродом (что несколько необычно для биомолекул), его называют ионом четвертичного аммония.
Примечание. Пусть вас не смущает то, как термины «первичный», «вторичный» и «третичный» применяются к спиртам и аминам — определения разные.В спиртах имеет значение, со сколькими другими атомами углерода связан углерод спирта , в то время как в аминах важно то, с каким количеством атомов углерода связан азот .
(Вернуться к началу)
Органические фосфаты
Фосфат и его производные функциональные группы повсеместно встречаются в биомолекулах. Фосфат, связанный с одной органической группой, называется сложным фосфатным эфиром ; когда он имеет две связи с органическими группами, он называется сложным диэфиром фосфата.Связь между двумя фосфатами создает фосфатный ангидрид.
Альдегиды и кетоны
Существует ряд функциональных групп, содержащих двойную связь углерод-кислород, которую обычно называют карбонилом . Кетоны и альдегиды представляют собой две тесно связанные функциональные группы на основе карбонила, которые реагируют очень похожим образом. В кетоне атом углерода карбонила связан с двумя другими атомами углерода.В альдегиде , карбонильный углерод с одной стороны связан с водородом, а с другой стороны — с углеродом. Исключением из этого определения является формальдегид, в котором карбонильный углерод связан с двумя атомами водорода.
(Вернуться к началу)
Карбоновые кислоты и их производные
Когда карбонильный углерод связан с одной стороны с углеродом (или водородом), а с другой стороны с кислородом, азотом или серой, функциональная группа считается одним из «производных карбоновой кислоты», обозначение, которое описывает набор связанных функциональных групп.Основным членом этого семейства является функциональная группа карбоновой кислоты , в которой карбонил связан с гидроксильной группой. Форма карбоксилат-иона внесла в раствор H + . Другие производные — это сложные эфиры карбоновых кислот (обычно называемые просто «сложные эфиры»), тиоэфиры, амиды, ацилфосфаты, хлорангидриды и ангидриды кислот . За исключением хлорангидридов и ангидридов кислот, производные карбоновых кислот очень часто встречаются в биологических молекулах и / или метаболических путях, и их структура и реакционная способность будут обсуждаться более подробно в следующих главах.
Наконец, нитрильная группа характеризуется тройной связью углерод-азот, как показано в структуре ацетонитрила.
Практика распознавания функциональных групп в молекулах
Одно соединение часто содержит несколько функциональных групп, особенно в биологической органической химии. Например, шестиуглеродные молекулы сахара, глюкоза и фруктоза, содержат альдегидные и кетоновые группы соответственно, и обе содержат пять спиртовых групп.Соединение с несколькими спиртовыми группами часто называют «полиолом» .
Гормон тестостерон, аминокислота фенилаланин и метаболит гликолиза дигидроксиацетонфосфат содержат несколько функциональных групп, как указано ниже.
Хотя это ни в коем случае не полный список, этот раздел охватывает большинство важных функциональных групп, с которыми мы столкнемся в биохимии.Таблица 5.2 содержит сводку по всем группам, перечисленным в этом разделе.
Таблица 5.2 Общие органические функциональные группы
Упражнение 5.6.1
Укажите функциональные группы (кроме алканов) в следующих органических соединениях. Укажите, являются ли спирты и амины первичными, вторичными или третичными.
Упражнение 5.6.2
Нарисуйте по одному примеру каждого соединения, подходящего к описанию ниже, используя линейные структуры.Обязательно укажите местонахождение всех ненулевых официальных сборов. Все атомы должны иметь полные октеты (фосфор может превышать правило октетов). На эти вопросы есть много возможных правильных ответов, поэтому обязательно проверьте свои конструкции у своего инструктора или репетитора.
a) соединение с молекулярной формулой C 6 H 11 NO, которое включает функциональные группы алкена, вторичного амина и первичного спирта
b) ион с молекулярной формулой C 3 H 5 O 6 P 2- , который включает альдегидные, вторичные спиртовые и фосфатные функциональные группы.
c) Соединение с молекулярной формулой C 6 H 9 NO, которое имеет амидную функциональную группу, а не имеет алкеновую группу.
(Вернуться к началу)
5.7 Краткий обзор номенклатуры органических продуктов
Международный союз теоретической и прикладной химии разработал систему (IUPAC, обычно произносится как eye -you-pack ) для обозначения органических соединений.Хотя система IUPAC удобна для обозначения относительно небольших простых органических соединений, она обычно не используется для обозначения биомолекул, которые, как правило, довольно большие и сложные. Тем не менее, неплохо (даже для биологов) ознакомиться с базовой структурой системы ИЮПАК и уметь рисовать простые структуры на основе их названий ИЮПАК.
Название органического соединения обычно начинается с определения того, что называется «родительской цепью» , которая является самой длинной прямой цепью атомов углерода.Мы начнем с простейших структур алканов с прямой цепью. CH 4 называется метаном , а C 2 H 6 этаном . В приведенной ниже таблице указаны названия длинноцепочечных алканов: обязательно сохраните их в памяти, поскольку они являются основой для остальной части номенклатурной системы ИЮПАК (и также широко используются для именования биомолекул).
Названия алканов с прямой цепью:
1 углерод: метан
2 атома углерода: этан
3 атома углерода: пропан
4 атома углерода: бутан
5 атомов углерода: пентан
6 атомов углерода: гексан
7 атомов углерода: гептан
8 атомов углерода: октан
9 атомов углерода: нонан
10 атомов углерода: декан
Заместители, ответвляющиеся от основной родительской цепи, расположены по углеродному номеру, причем используются наименьшие возможные номера (например, обратите внимание, что соединение слева называется 1-хлорбутаном, а не 4-хлорбутаном).Когда заместителями являются небольшие алкильные группы, используются термины метил , этил и пропил .
Другие общие названия углеводородных заместителей включают изопропил, трет -бутил и фенил .
Обратите внимание, что в приведенном ниже примере «этильная группа» (выделена синим цветом) не рассматривается как заместитель, скорее она включена как часть родительской цепи, а метильная группа рассматривается как заместитель.Название IUPAC для углеводородов с прямой цепью всегда основано на самой длинной из возможных родительских цепей , которая в данном случае состоит из четырех атомов углерода, а не трех.
Циклические алканы называются циклопропаном, циклобутаном, циклопентаном, циклогексаном и т. Д .:
В случае нескольких заместителей используются префиксы ди , три и тетра .
Функциональные группы имеют характерные суффиксы.Например, у спиртов к названию родительской цепи добавлено « ol », а также число, обозначающее расположение гидроксильной группы. Кетоны обозначаются как « один ».
Алкены обозначаются окончанием «ен», и при необходимости указываются расположение и геометрия двойной связи. Соединения с кратными двойными связями называются диенами, триенами и т. Д.
Некоторые группы могут присутствовать только на концевом атоме углерода, и, таким образом, номер позиции не требуется: альдегиды оканчиваются на «al», карбоновые кислоты — на «oic acid», а карбоксилаты — на «oate».
Простые эфиры и сульфиды обозначаются двумя группами по обе стороны от кислорода или серы.
Если амид имеет незамещенную группу –NH 2 , суффикс будет просто «амид». В случае замещенного амида группа, присоединенная к амидному азоту, названа первой вместе с буквой « N », чтобы пояснить, где находится эта группа. Обратите внимание, что обе структуры, представленные ниже, основаны на трехуглеродной (пропановой) родительской цепи.
Для сложных эфиров суффикс — «оат». Группа, связанная с кислородом, называется первой.
Все примеры, которые мы видели до сих пор, были простыми в том смысле, что в каждой молекуле присутствовала только одна функциональная группа. Конечно, в системе ИЮПАК гораздо больше правил, и, как вы можете себе представить, наименование ИЮПАК более крупных молекул с множеством функциональных групп, кольцевых структур и заместителей может очень быстро стать очень громоздким.Незаконный наркотический кокаин, например, имеет название ИЮПАК «метил (1 R , 2 R , 3 S , 5 S ) -3- (бензоилокси) -8-метил-8-азабицикло [ 3.2.1] октан-2-карбоксилат »(это название включает обозначения для стереохимии).
Вы можете понять, почему система IUPAC не так часто используется в биохимии — молекулы слишком большие и сложные. Еще одна сложность заключается в том, что даже вне биологического контекста многие простые органические молекулы известны почти повсеместно под их «общим названием», а не именами ИЮПАК.Соединения уксусной кислоты, хлороформа и ацетона — лишь несколько примеров.
В биохимии обычно используются несистематические названия (например, «кокаин», «капсаицин», «пируват» или «аскорбиновая кислота»), а когда используется систематическая номенклатура, она часто специфична для рассматриваемого класса молекулы: разные системы имеют эволюционировали, например, для жиров и углеводов. В этом тексте мы не будем особо сосредотачиваться на номенклатуре ИЮПАК или любой другой номенклатурной системе, но если вы предпримете более углубленное исследование в области органической или биологической химии, вы можете ожидать более детального изучения одной или нескольких систем именования.
(Вернуться к началу)
Артикул:
Материалы Главы 5 были адаптированы и изменены из следующих ресурсов Creative Commons, если не указано иное:
1. Викиучебники. (2015) Органическая химия. Доступно по адресу: https://en.wikibooks.org/wiki/Organic_Chemistry.
2. Кларк, Дж. (2014) Как рисовать органические молекулы. Доступно по адресу: http://chem.libretexts.org/Core/Organic_Chemistry/Fundamentals/How_to_Draw_Organic_Molecules
3.Содерберг, Т.
(2016).
Органическая химия с акцентом на биологию. Опубликовано по лицензии Creative Commons by-NC-sa 3.0.
4. Аноним. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
Органические соединения
Химические соединения живых существ известны как органических соединений из-за их связи с организмами и потому, что они являются углеродсодержащими соединениями.Органические соединения, которые представляют собой соединения, связанные с жизненными процессами, являются предметом органической химии. Среди многочисленных типов органических соединений во всем живом есть четыре основные категории: углеводы, липиды, белки и нуклеиновые кислоты.
Углеводы
Почти все организмы используют углеводов в качестве источников энергии. Кроме того, некоторые углеводы служат конструкционными материалами. Углеводы — это молекулы, состоящие из углерода, водорода и кислорода; отношение атомов водорода к атомам кислорода и углерода составляет 2: 1.
Простые углеводы, обычно называемые сахарами , могут быть моносахаридами, , если они состоят из одиночных молекул, или дисахаридами, , если они состоят из двух молекул. Наиболее важным моносахаридом является глюкоза, углевод с молекулярной формулой C 6 H 12 O 6 . Глюкоза — это основная форма топлива для живых существ. В многоклеточных организмах он растворим и транспортируется жидкостями организма ко всем клеткам, где метаболизируется, чтобы высвободить свою энергию.Глюкоза является исходным материалом для клеточного дыхания и основным продуктом фотосинтеза (см. Главы 5 и 6).
Три важных дисахарида также содержатся в живых организмах: мальтоза, сахароза и лактоза. Мальтоза представляет собой комбинацию двух ковалентно связанных единиц глюкозы. Сахароза столовая образуется путем связывания глюкозы с другим моносахаридом, называемым фруктозой. (Рисунок 2-2 показывает, что при синтезе сахарозы образуется молекула воды. Поэтому процесс называется реакцией дегидратации . Обратный процесс — это гидролиз, процесс, в котором молекула расщепляется и добавляется вода.) Лактоза состоит из единиц глюкозы и галактозы.
Рисунок 2-2 Молекулы глюкозы и фруктозы объединяются, образуя дисахарид сахарозу.
Сложные углеводы известны как полисахариды . Полисахариды образуются путем связывания бесчисленных моносахаридов. Среди наиболее важных полисахаридов — крахмал, который состоит из сотен или тысяч единиц глюкозы, связанных друг с другом.Крахмал служит формой хранения углеводов. Большая часть населения мира удовлетворяет свои потребности в энергии с помощью крахмала в виде риса, пшеницы, кукурузы и картофеля.
Два других важных полисахарида — это гликоген и целлюлоза. Гликоген также состоит из тысяч единиц глюкозы, но эти единицы связаны другим образом, чем в крахмале. Гликоген — это форма, в которой глюкоза хранится в печени человека. Целлюлоза используется в основном как структурный углевод.Он также состоит из единиц глюкозы, но единицы не могут высвобождаться одна из другой, за исключением нескольких видов организмов. Древесина состоит в основном из целлюлозы, как и стенки растительных клеток. Хлопчатобумажная ткань и бумага — это товарные целлюлозные продукты.
Липиды
Липиды — это органические молекулы, состоящие из атомов углерода, водорода и кислорода. Отношение атомов водорода к атомам кислорода в липидах намного выше, чем в углеводах. Липиды включают стероиды (материал, из которого состоят многие гормоны), воски и жиров.
Молекулы жира состоят из молекулы глицерина и одной, двух или трех молекул жирных кислот (см. Рис. 2-3). Молекула глицерина содержит три гидроксильные (–ОН) группы. Жирная кислота представляет собой длинную цепочку атомов углерода (от 4 до 24) с карбоксильной (–COOH) группой на одном конце. Все жирные кислоты в жире могут быть одинаковыми или разными. Они связаны с молекулой глицерина в процессе удаления воды.
Некоторые жирные кислоты имеют в своих молекулах одну или несколько двойных связей.Жиры, в состав которых входят эти молекулы, представляют собой ненасыщенных жиров. Другие жирные кислоты не имеют двойных связей. Жиры, в состав которых входят эти жирные кислоты, представляют собой насыщенных жиров. В большинстве случаев, связанных со здоровьем человека, потребление ненасыщенных жиров предпочтительнее насыщенных жиров.
Жиры, хранящиеся в клетках, обычно образуют прозрачные масляные капли, называемые шариками , потому что жиры не растворяются в воде. Растения часто хранят жиры в своих семенах, а животные — в больших прозрачных шариках в клетках жировой ткани.Жиры в жировой ткани содержат много концентрированной энергии. Следовательно, они служат резервным источником энергии для организма. Фермент липаза расщепляет жиры на жирные кислоты и глицерин в пищеварительной системе человека.
Рис. 2-3 Молекула жира создается путем объединения молекулы глицерина с тремя молекулами жирных кислот. (Две насыщенные жирные кислоты и одна ненасыщенная жирная кислота показаны для сравнения.) Сконструированная молекула находится внизу.
Белки
Белки, среди самых сложных из всех органических соединений, состоят из аминокислот (см. Рис. 2-4), которые содержат атомы углерода, водорода, кислорода и азота.Некоторые аминокислоты также содержат атомы серы, фосфора или других микроэлементов, таких как железо или медь.
Рисунок 2-4 Структура и химический состав аминокислот. Когда две аминокислоты соединяются в дипептид, –OH одной аминокислоты удаляется, а –H второй удаляется. Итак, вода удалена. Дипептидная связь (справа) образует соединение аминокислот вместе.
Многие белки огромны и чрезвычайно сложны. Однако все белки состоят из длинных цепочек относительно простых аминокислот.Есть 20 видов аминокислот. Каждая аминокислота (см. Левую иллюстрацию на рис. 2-4) имеет амино (–NH 2 ) группу, карбоксильную (–COOH) группу и группу атомов, называемую –R группой (где R обозначает радикал ). Аминокислоты различаются в зависимости от природы группы –R, как показано на средней иллюстрации рисунка 2-4. Примерами аминокислот являются аланин, валин, глутаминовая кислота, триптофан, тирозин и гистидин.
Удаление молекул воды связывает аминокислоты с образованием белка.Процесс называется синтезом дегидратации , а побочным продуктом синтеза является вода. Связи между аминокислотами составляют пептидных связей, и небольшие белки часто называют пептидами.
Все живое зависит от белков. Белки — это основные молекулы, из которых построены живые существа. Некоторые белки растворены или взвешены в водянистом веществе клеток, а другие включены в различные структуры клеток.Белки также являются поддерживающими и укрепляющими материалами в тканях вне клеток. Кости, хрящи, сухожилия и связки состоят из белков.
Одна из важнейших функций белков — это фермент. Ферменты катализируют химические реакции, происходящие в клетках. Они не расходуются в реакции; скорее, они остаются доступными для катализа последующих реакций.
Каждый вид производит белки, уникальные для этого вида. Информация для синтеза уникальных белков находится в ядре клетки.Так называемый генетический код определяет аминокислотную последовательность в белках. Следовательно, генетический код регулирует химию, происходящую внутри клетки. Белки также могут служить резервным источником энергии для клетки. Когда аминогруппа удаляется из аминокислоты, полученное соединение богато энергией.
Нуклеиновые кислоты
Как и белки, нуклеиновых кислот — очень большие молекулы. Нуклеиновые кислоты состоят из более мелких единиц, называемых нуклеотидами. Каждый нуклеотид содержит молекулу углевода (сахар), фосфатную группу и азотсодержащую молекулу, которая в силу своих свойств является азотистым основанием .
У живых организмов есть две важные нуклеиновые кислоты. Один тип — это дезоксирибонуклеиновая кислота , ДНК или . Другой — это рибонуклеиновая кислота, или РНК. ДНК находится в основном в ядре клетки, в то время как РНК обнаруживается как в ядре, так и в цитоплазме , — полужидкое вещество, составляющее объем клетки (см. Главу 3).
ДНК и РНК
отличаются друг от друга по своим компонентам.
