Содержание
Сульфат кальция — это
Сульфат кальция что это такое
Сульфа́т ка́льция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
Находится в природе в виде дигидрата CaSO4 ∙ 2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Безводный сульфат кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2О и CaSO4 · 2H2О. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды.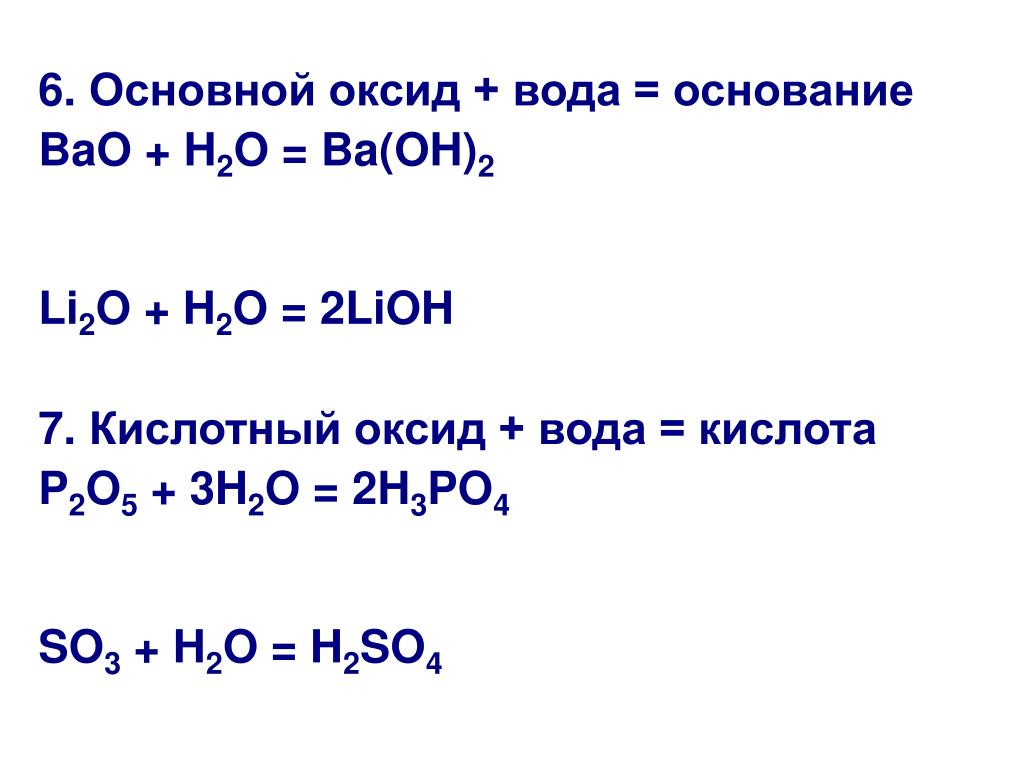 Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
В индустриальных масштабах добывают в составе природных минералов, например гипса, селенита или алебастра или получают синтетическим путём — сплавлением CaCl2 с K2SO4.
В аналитической химии может быть получен воздействием серной кислоты на оксид, карбонат, оксалат или ацетат кальция.
Образуется в результате окисления сульфида кальция при нагреве до 700—800 °C по реакции CaS + 2O2 = CaSO4.
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO4 · 2H2О = CaSO4 · 0,5H2О + 1,5H2О. Значительные объёмы полученного таким путём алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела.
При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO4 · 2H2О = CaSO4 · 0,5H2О + 1,5H2О. Значительные объёмы полученного таким путём алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.» [1] .
Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.» [1] .
Регистрационный номер CAS:
- ангидрат 7778-18-9 [2] ;
- полугидрат 10034-76-1 [3] ;
- двугидрат 10101-41-4 [4] .
Применение
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
Источник:
http://dic.academic.ru/dic.nsf/ruwiki/94813
Сульфат кальция
Сульфат кальция широко распространен в природе в виде дигидрата — гипса (селепит) СаSO4∙2Н2O и в безводном состоянии в виде ангидрита (карстонит, муриацит).
В питьевой воде сульфат кальция нередко содержится в растворенном состоянии и обусловливает поэтому постоянную или неустранимую жесткость воды (т. е. ту жесткость, которая не исчезает после кипячения). Однако растворимость сульфата кальция в воде все же невелика. При 18 °С она составляет 202 мг в 100 г воды и лишь незначительно изменяется с температурой. Кривая его растворимости имеет плоский максимум между 30 и 40 °С. Присутствие других сульфатов понижает растворимость СаSO4, однако наличие в воде других солей, а также кислот, не исключая и серной кислоты, наоборот, довольно значительно повышает растворимость сульфата кальция. С серной кислотой СаSO4 довольно легко образует растворимые в воде продукты присоединения, например СаSO4∙Н2SO4 и СаSO4∙3Н2SO4, которые были выделены в свободном состоянии. С сульфатами щелочных металлов СаSO4 образует труднорастворимые двойные соли, встречающиеся также в природе, например глауберит Na2SO4∙СаSO4 и сингенит К2SO4∙СаSO4∙Н2О.
С сульфатами щелочных металлов СаSO4 образует труднорастворимые двойные соли, встречающиеся также в природе, например глауберит Na2SO4∙СаSO4 и сингенит К2SO4∙СаSO4∙Н2О.
Из водных растворов при температуре ниже 66 ºC сульфат кальция всегда кристаллизуется в виде дигидрата СаSO4∙2Н2O (гипс), образующего шестигранные моноклинные призмы удельного веса 2,32. Кристаллы гипса имеют заметную склонность к образованию двойников (в форме ласточкиного хвоста). Гипс распространен в природе в очень больших количествах; иногда встречаются большие, красивые, правильные кристаллы, а чаще — порода, состоящая из мелких и мельчайших кристаллов и имеющая волокнистое, зернистое или совершенно плотное строение. Гипсовые породы встречаются во всех геологических формациях, но главным образом они распространены в пермской формации или диасе, в триасе и четвертичной формации, иногда образуя мощные залегания и штоки.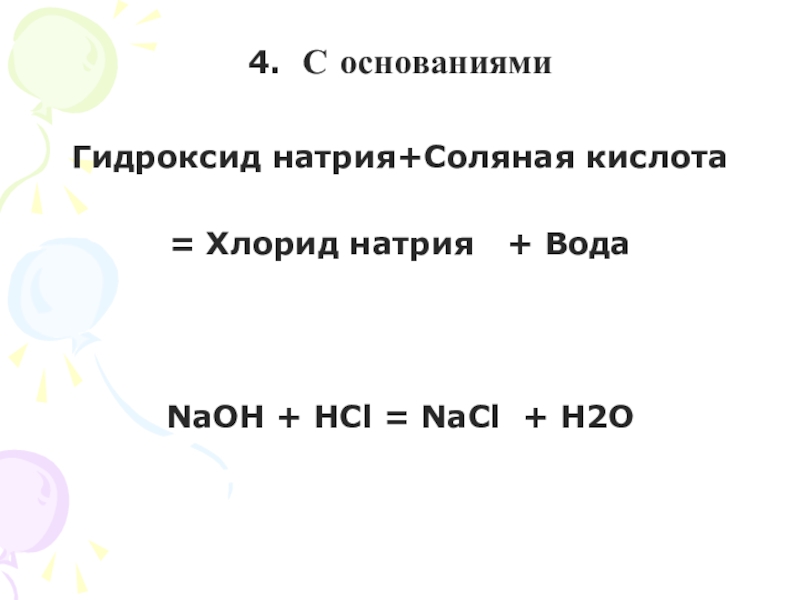 Гипс легко отличить, по его незначительной твердости (1,5-2) и прекрасно выраженной способности раскалываться (спайности). Подобно всем минералам, кристаллизующимся в моноклинной системе, он обладает двойным лучепреломлением. Разновидностями гипса являются мариенелос, или фрауенглас, и алебастр. Последний очень похож на белый мрамор, но вследствие незначительной теплопроводности не дает при прикосновении, подобно мрамору, ощущения холода. Чистый гипс бесцветен, или, если он представляет кристаллический агрегат, имеет болый цвет. Различные примеси иногда сообщают ему серую, желтоватую, коричневатую или красноватую, а иногда даже почти черную окраску.
Гипс легко отличить, по его незначительной твердости (1,5-2) и прекрасно выраженной способности раскалываться (спайности). Подобно всем минералам, кристаллизующимся в моноклинной системе, он обладает двойным лучепреломлением. Разновидностями гипса являются мариенелос, или фрауенглас, и алебастр. Последний очень похож на белый мрамор, но вследствие незначительной теплопроводности не дает при прикосновении, подобно мрамору, ощущения холода. Чистый гипс бесцветен, или, если он представляет кристаллический агрегат, имеет болый цвет. Различные примеси иногда сообщают ему серую, желтоватую, коричневатую или красноватую, а иногда даже почти черную окраску.
При нагревании до 100 °С гипс отщепляет 3/4 своей кристаллизационной воды и переходит в метастабильный семигидрат (полугидрат) СаSO4∙1/2Н2О. При обычной температуре последний снова поглощает воду с заметным разогреванием. Если его замесить с водой в виде жидкого теста, то он довольно скоро застывает, образуя твердую массу, состоящую из тонковолокнистых, переплетенных между собой кристаллов гипса. На этом свойстве основано применение гипса в строительном деле, а также при изготовлении скульптур (для отливок). Применяемый в этих случаях жженый гипс («штукатурный») обычно содержит еще меньше воды, чем полугидрат; однако он не должен быть полностью обезвожен. Если гипс настолько сильно обжечь, что он отдаст всю воду, то он теряет способность в дальнейшем «схватываться», т. е. присоединять воду. Таной гипс называют «пережженым». Природный безводный сульфат кальция — ангидрит — также не способен «схватываться». Однако при очень длительном выдерживании в присутствии воды ангидрит все-таки переходит в гипс. Значительная часть встречающегося в природе гипса образовалась таким путем. Иногда, наоборот, природный ангидрит образуется из гипса. Из подлых растворов ангидрит кристаллизуется при температуре выше 66 ºС. Однако если раствор содержит одновременно и другие соли, то ангидрит может выделяться и при значительно более низких температурах. Так, из раствора, который одновременно насыщеп хлористым натрием, сульфат кальция выделяется в виде ацгидрита уже выше 30 °С.
На этом свойстве основано применение гипса в строительном деле, а также при изготовлении скульптур (для отливок). Применяемый в этих случаях жженый гипс («штукатурный») обычно содержит еще меньше воды, чем полугидрат; однако он не должен быть полностью обезвожен. Если гипс настолько сильно обжечь, что он отдаст всю воду, то он теряет способность в дальнейшем «схватываться», т. е. присоединять воду. Таной гипс называют «пережженым». Природный безводный сульфат кальция — ангидрит — также не способен «схватываться». Однако при очень длительном выдерживании в присутствии воды ангидрит все-таки переходит в гипс. Значительная часть встречающегося в природе гипса образовалась таким путем. Иногда, наоборот, природный ангидрит образуется из гипса. Из подлых растворов ангидрит кристаллизуется при температуре выше 66 ºС. Однако если раствор содержит одновременно и другие соли, то ангидрит может выделяться и при значительно более низких температурах. Так, из раствора, который одновременно насыщеп хлористым натрием, сульфат кальция выделяется в виде ацгидрита уже выше 30 °С.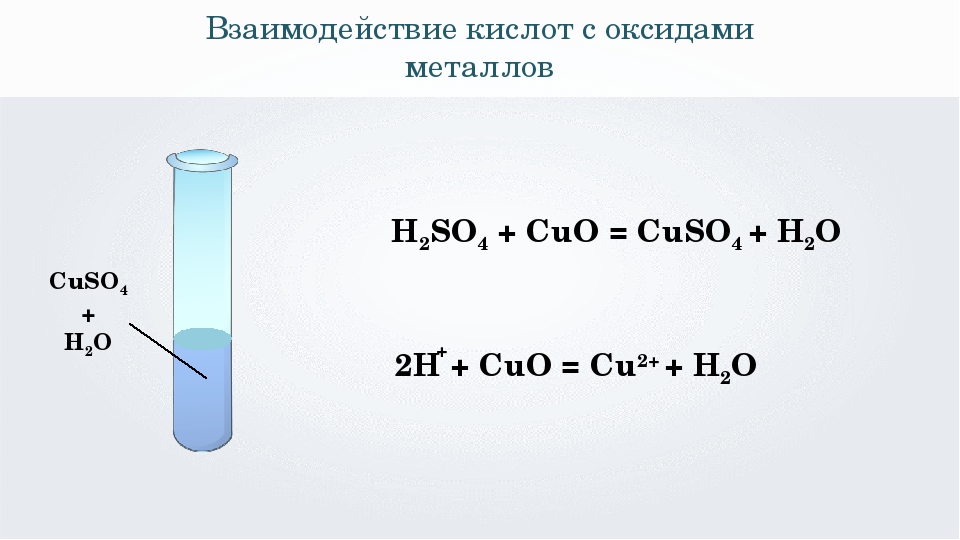 Кроме ангидрита, существует еще одна модификация безводного сульфата кальция. Она растворима лучше, чем ангидрит, и поэтому неустойчива.
Кроме ангидрита, существует еще одна модификация безводного сульфата кальция. Она растворима лучше, чем ангидрит, и поэтому неустойчива.
Природный ангидрит встречается в виде прослоек в залежах каменной соли, а иногда составляет промежуточный слой между залежами каменной соли и калийных солей. Он чрезвычайно распространен и встречается почти в каждой геологической формации, большей частью в смеси с гипсом, который образовался из него. Ангидрит кристаллизуется в ромбической системе, хорошо раскалывается, однако не в такой степени, как гипс. Он превосходит гипс по твердости (3-3,5) и плотности. Его удельный вес равен 2,8-3. В чистом состоянии он бесцветен, однако нередко бывает окрашен примесями в синеватый, синевато-серый и другие цвета.
Если гипс или ангидрит нагреть выше 1000 °С, то они начинают выделять трехокись серы. Получающийся продукт (твердый раствор СаО в СаSO4) отличается способностью поглощать воду; при замешивании с небольшим количеством воды он скорее, чем раствор из извести и песка, образует очень твердую, плотную массу, устойчивую к выветриванию. На этом свойстве основано использование гипса, обожженного при высоких температурах (1300 °C), для изготовления цементирующих растворов (гипс для строительных растворов, гипс для затирки каменных полов) которые были известны еще древним египтянам. Кроме того, «штукатурный гипс» широко применяют для изготовления форм для керамических изделий, а именно для литья фарфора (для чего он осабенно удобен благодаря своей пористости). Тонко размолотый необожженный гипс служит добавкой к минеральным краскам (в обойном производстве и в бумажной промышленности).
На этом свойстве основано использование гипса, обожженного при высоких температурах (1300 °C), для изготовления цементирующих растворов (гипс для строительных растворов, гипс для затирки каменных полов) которые были известны еще древним египтянам. Кроме того, «штукатурный гипс» широко применяют для изготовления форм для керамических изделий, а именно для литья фарфора (для чего он осабенно удобен благодаря своей пористости). Тонко размолотый необожженный гипс служит добавкой к минеральным краскам (в обойном производстве и в бумажной промышленности).
Применение
Природный ангидрит применяют в производстве вяжущих материалов. Сульфат кальция применяют для изготовления фигур, слепков, как строительный материал (гипс) и в медицине (кальций). Из гипса изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др. Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Алебастр при смешении с водой твердеет, образуя дигидрат и широко используется в строительстве. Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объема. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.
Алебастр при смешении с водой твердеет, образуя дигидрат и широко используется в строительстве. Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объема. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.
Дополнительно
Находится в природе в виде дигидрата CaSO4 ∙ 2h3O (гипс, селенит) и в безводном состоянии — ангидрит.
Безводный сульфат кальция — бесцветные кристаллы, плотность 2,96 г/см³, температура плавления 1450 °C. Очень медленно присоединяет воду. В воде растворим незначительно. При повышении температуры до 220°C двуводный гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Однако если обжиг вести при температуре вышЕ-220°C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при затворении водой. В промышленных условиях также получают полугидрат сульфата кальция (алебастр)CaSO4 ∙ 0,5h3O путем нагревания дигидрата примерно до 140°C, по уравнению реакции: CaSO4·2h3О = CaSO4·0,5h3О + 1,5h3О.
В промышленных условиях также получают полугидрат сульфата кальция (алебастр)CaSO4 ∙ 0,5h3O путем нагревания дигидрата примерно до 140°C, по уравнению реакции: CaSO4·2h3О = CaSO4·0,5h3О + 1,5h3О.
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Источник:
http://himiya.gosstandart.info/slozhnye-veshchestva/soli/sulfat-kalciya/
Сульфат кальция (Е516)
Сульфат кальция на самом деле очень известное и широко распространенное вещество, наиболее известное в народе, как гипс. По достоинству вяжущие свойства этого продукта изначально оценили врачи, и только в прошлом столетии он нашел применение в пищевой промышленности, как пищевая добавка, маркируемая знаком Е516.
Как же используется сульфат кальция в изготовлении продуктов? Какие последствия влечет за собой его употребление? Где еще используется данная добавка? Все это можно узнать, прочитав следующую статью.
Свойства сульфата кальция и основные характеристики
К другим наименованиям такой пищевой добавки относятся: гипс, кальций сернокислый, ангидрит, селенит, Calcium sulfate, Е516.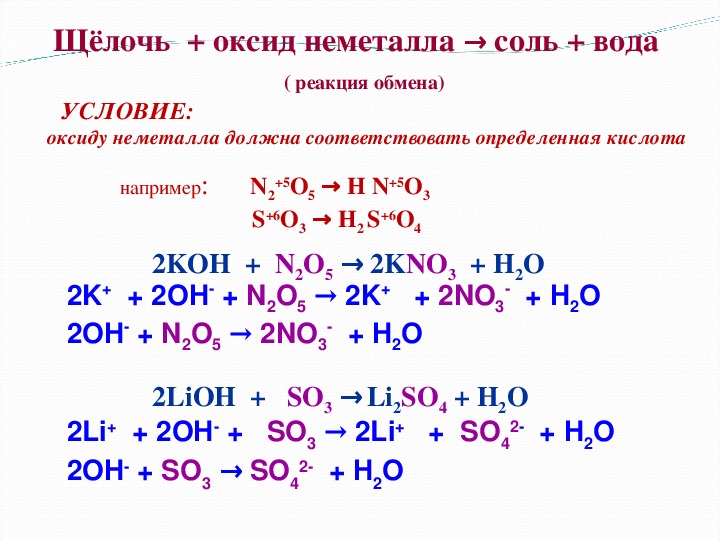 На французском языке его название звучит, как sulfate de calcium, а на немецком – calciumsulfat.
На французском языке его название звучит, как sulfate de calcium, а на немецком – calciumsulfat.
- Свойства сульфата кальция и основные характеристики
- Основные производители и стандартная упаковка сульфата кальция
- Применение в разных сферах
- Полезные и вредные свойства добавки Е516
- В заключение
Это вещество замечательным образом соединяет в себе свойства стабилизатора и эмульгатора. В природе также существует его аналог – серной кислоты кальциевая соль. В естественной среде сульфат кальция формируется из обезвоженных гипсовых отложений, содержится в гипсе и селените, как дигидрат. Жесткость водопроводной воды напрямую связана с концентрацией в ней сульфата калия.
В промышленных масштабах такую добавку получают путем сплавления сульфата калия с хлоридом кальция. В результате такой реакции выпадает осадок, который и является сульфатом кальция.
По внешнему виду это вещество более всего напоминает белый или слегка желтоватый кристаллический порошок горьковато-соленого вкуса и без запаха. Его химический состав включает в себя сернокислый кальций и различные примеси: фториды, селен и другие. Молекулярную формулу вещества можно обозначить в виде: CaSO4.
Его химический состав включает в себя сернокислый кальций и различные примеси: фториды, селен и другие. Молекулярную формулу вещества можно обозначить в виде: CaSO4.
Этот пищевой эмульгатор практически не растворяется в воде и абсолютно не растворим в этиловом спирте. Однако обладает хорошей растворимостью в глицерине, кислой среде и солях аммония.
Данная пищевая добавка является влаговпитывающим веществом. Она способна поглощать до семи процентов воды от общей массы. Плавится при очень высоких температурах, гигроскопична.
Основные производители и стандартная упаковка сульфата кальция
В Российской Федерации такую добавку производит только одно предприятие, которое находится в Удмуртии в городе Глазов – Чепецкий механический завод.
Основными ведущими мировыми производителями сульфата кальция являются:
- компания Bassermann minerals GmbH & Co.KG, зарегистрированная в Германии;
- корпорация Dr. Paul Lohmann GmbH KG, также находящаяся в Германии;
- польская компания «Alwernia» Spółka Akcyjna.

Самым главным поставщиком данного вещества на мировой рынок является Китай. Эта прерогатива полностью принадлежит корпорации Foodchem International Corporation.
Наиболее приемлемыми стандартными упаковками для такого вещества считаются контейнеры «биг бэг» мягкие, полипропиленовые мешки, бумажные многослойные пакеты, картонно-навивные барабаны. Помимо этого, пищевая добавка Е516 предварительно герметично зашивается в полиэтиленовые пакеты.
Применение в разных сферах
Наиболее распространенными областями применения сульфата кальция являются пищевая отрасль, медицина и косметологическая промышленность.
В сфере приготовления продуктов питания эта пищевая добавка используется как самостоятельное вещество или в совокупности с другими эмульгаторами и стабилизаторами.
Высокая влаговпитывающая способность сульфата кальция обеспечивает ему широкое применение при сушке грибов и овощей, при изготовлении различных пряностей, молока, соусов и других изделий.
Такую пищевую добавку используют в различных целях:
- для улучшения структуры растительной ткани, большей сохранности полезных веществ, а также повышения термостойких свойств применяется для консервирования томатов;
- для регулирования кислотности в виноградном сусле применяют французские виноделы при изготовлении вин;
- для улучшения текстуры и качества сгустка используется для приготовления тофу, домашнего сыра и творога;
- для нормализации pH уровня в солодовом заторе при изготовлении пива;
- в качестве питательного вещества для различных микроорганизмов в производстве хлебопекарных дрожжей;
- для повышения пластичности теста и его эластичности, улучшения качества муки и защите ее от порчи применяется в изготовлении хлебобулочных изделий;
- для связывания компонентов при производстве замороженных продуктов из рыбы.
К тому же данное вещество часто применяется в диетологии в качестве заменителя соли.
В медицинской сфере сернокислый кальций используют для изготовления хирургических фиксирующих повязок. В недалеком прошлом это был единственный материал, который использовался для оттисков зубов в стоматологической практике.
Широко распространен сульфат кальция в косметологической промышленности. Его применяют в качестве одного из компонентов для приготовления альгинатных масок с морскими водорослями.
Вещество разводят в воде, наносят на лицо, а после снимают также, как и резиновую маску. Благодаря своим пластифицирующим свойствам сульфат кальция способствует быстрому застыванию такой маски.
При совмещении порошка сернокислого кальция с водой, получают вязкую гомогенную субстанцию, которую наносят на лицо и тело, получая так называемую питательную термическую маску.
После застывания полученная смесь имеет свойство нагреваться, что способствует лучшему раскрытию пор и ускорению проникновения необходимых веществ в клетки кожи. Можно найти данное вещество в декоративной косметике в качестве матирующего компонента, а также в скрабах, где он популярен как абразив.
Сульфат кальция считается повсеместно разрешенным продуктом, максимальная суточная доза его не регламентируется.
Полезные и вредные свойства добавки Е516
Пищевая добавка Е516 является легкоусвояемой и абсолютно безопасной для организма человека. Часто его применяют при нехватке кальция, для его скорейшего пополнения. Однако при этом следует учитывать, что кальций способен усваиваться только в компании с другими веществами – особенно с витамином D. Продукты питания содержат в себе небольшое количество такой добавки.
Сульфат кальция, полученный путем химического синтеза, может содержать в себе некоторое количество примесей, которые могут нанести организму вред, особенно принятые в завышенных дозировках.
Поэтому таким продуктом лучше не злоупотреблять. Тем более, что переизбыток кальция также небезопасен для здоровья человека, как и его нехватка. В итоге это может привести к гиперкальциемии, которая повлечет за собой негативные и неприятные последствия.
- Почему нельзя самостоятельно садиться на диету
- 21 совет, как не купить несвежий продукт
- Как сохранить свежесть овощей и фруктов: простые уловки
- Чем перебить тягу к сладкому: 7 неожиданных продуктов
- Ученые заявили, что молодость можно продлить
В заключение
Сульфат кальция является абсолютно безопасной пищевой добавкой для здоровья человека, а потому ее применение даже в пищевой отрасли одобрено и разрешено во всех странах мира.
Благодаря своим стабилизирующим и эмульгирующим, а также высоким влаговпитывающим свойствам, кальций сернокислый широко применяется в медицине и в косметологической промышленности.
Благодаря ему, можно значительно повысить уровень кальция в организме, однако использовать его необходимо только в совокупности с витаминами, потому что в чистом виде он не усваивается организмом человека.
Источник:
http://foodandhealth.ru/dobavki/sulfat-kalciya-e516/
Сульфат кальция
Сульфат кальция (кальциевая соль серной кислоты) – неорганическое соединение, представленное бесцветными или светло-желтыми кристаллами без четко выраженного запаха с ромбическим строением решетки. Вещество не растворяется в этаноле. Растворимость сульфата кальция в воде незначительна и она только падает с повышением ее температуры.
Вещество не растворяется в этаноле. Растворимость сульфата кальция в воде незначительна и она только падает с повышением ее температуры.
В природе содержание сульфата кальция определяет естественную жесткость воды.
В окружающей среде сульфат кальция представлен дигидратом (гипсом, селенитом). В безводном состоянии – минералом ангидритом, образующимся в осадочных толщах в результате естественного обезвоживания отложений гипса. Перед применением сырье очищается от посторонних примесей (стронция, силикатов) и прокаливается при температуре 110 градусов Цельсия, чтобы обеспечить освобождение гипса от воды. В итоге получается гемигидрат, который иначе называется «парижским пластырем».
Получение сульфата кальция в промышленных масштабах осуществляется с помощью добычи вещества, находящегося в составе природных минералов (селенита, гипса, алебастра).
Также получение сульфата кальция может происходить синтетическим путем – реакцией сплавления CaCl2(хлористого кальция) с K2SO4 (сульфатом калия).
Химическая формула вещества – CaSO4.
Зарегистрирован в качестве пищевой добавки Е516.
Применение сульфата кальция
Минерал, состоящий из дигидрата сульфата кальция (гипса) имеет длительную историю своего применения: первые упоминания относительно использования вещества датируются 1961 годом в области клинического применения. В те годы материал использовался при восстановлении различных повреждений кости туберкулезного и травматического происхождения. По сообщениям специалистов, сульфат кальция полностью резорбировался уже через пять недель.
Материал действительно обладает способностью к полному рассасыванию в естественных условиях, благодаря чему с успехом используется в стоматологии, имплантологии, ортопедии.
В пищевой индустрии сульфат кальция применяется в качестве добавки-эмульгатора (вещества, обеспечивающего создание эмульсий из других заведомо не смешивающихся жидкостей), отвердителя, осушителя, улучшителя хлеба и муки, коагулянта. Используется в производстве сыра тофу, пива, кондитерских изделий, биологически активных добавок, консервированных овощей, вина (для подкисления сусла). Зачастую сульфат кальция добавляют в пищевые продукты в качестве заменителя соли.
Зачастую сульфат кальция добавляют в пищевые продукты в качестве заменителя соли.
Помимо пищевой промышленности сульфат кальция используется в медицине, строительстве. Созданные искусственным образом кристаллы сернокислого кальция, легированные марганцем и самарием, применяются как термолюминесцентный материал.
Влияние на здоровье
По результатам многочисленных исследований и наблюдений пищевая добавка сульфат кальция был признан безвредным и разрешенным к употреблению, как в пищевых, так и в медицинских целях. Максимально допустимая норма потребления сульфата кальция также не установлена.
Источник:
http://www.neboleem.net/sulfat-kalcija.php
Сульфат кальция – удобрение, применяемое в различных отраслях
Удобрение, применяемое в различных отраслях
Сульфат кальция – это кальциевая соль серной кислоты, на вид – это бесцветные кристаллы. В природе встречается в виде дигидрата. Впервые его начали применять в 60-х годах прошлого века для восстановления костных повреждений. Имеет свойство полностью рассасываться через 5 недель. В соединении с водой сульфат кальция имеет свойство застывать.
Имеет свойство полностью рассасываться через 5 недель. В соединении с водой сульфат кальция имеет свойство застывать.
Применяется в медицине (для гипсов), строительстве изготавливают сухую штукатурку, элементы декора. В пищевой промышленности – это добавка эмульгатор. Он улучшает качество мучных изделий, может служить подкислителем для сусла в виноделии.
В качестве удобрения широко используется и в сельском хозяйстве.
Известные факты, что почва – важный инструмент для работника сельского хозяйства. Азот является главным фактором урожая. Его действие зависит от наличия серы. Удобряя почву, мы не только подкармливаем растение, но и заботимся о плодородности почвы.
Нехватка серы в почве приводит к слабому урожаю, понижению сопротивления растений, понижает содержание жиров, простого сахара, вызывает концентрацию нитратов в растениях.
Сера влияет на состояние азота, увеличивает количество урожая, повышает устойчивость растений к болезням, а также устойчивость растений к засухе, жаре.
Кальций способствуют развитию, укрепляет и развивает корневую систему, повышает выносливость растений, активизирует энзимы, противодействует органическим кислотам.
Сульфат кальций удобрение обладает рядом полезных свойств:
- не окисляет почву;
- постепенно растворяется;
- легко усваивается;
- нейтрализует токсичный алюминий;
- улучшает физические свойства почвы;
- понижает уровень соли в почве.
Главной идеей удобрения почвы – оптимизировать этот процесс (ограничить в почве химические соединения), забота о ее состоянии, предотвращение истощения, экономное использование средств защиты.
Используют это удобрение перед посевной, его смешивают с почвой. В вегетационный период растения удобряют перед формированием стебля, зерновые культуры перед кущением. Озимые следует удобрять осенью, чтобы было время для его растворения. Возможно добавлять его в вегетационный период. Весеннее удобрение почвы осуществляют перед посевом и в период вегетации.
Хранить удобрение сульфат кальция нужно согласно инструкции по эксплуатации. На земле в поле лучше прикрывать пленкой. Хотя под воздействием влаги может взяться комками, а верхний слой взяться коркой, но от этого оно не потеряет своих химических свойств. Если храните не прикрытым, то лучше его перед использованием перемешать.
Источник:
http://topxlist.ru/sulfat-kaltsiya-udobrenie-primenyaemoe-v-razlichnyih-otraslyah/
Химия
СОЛИ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
5. Важнейшие химические
свойства
6. Специфические свойства
7. Задания
8. Ответы
|
|
КЛАССИФИКАЦИЯ
По химическому составу соли классифицируют
на
средние, кислые, основные и двойные.
Отдельным типом солей являются комплексные соли
(соли с комплексными катионами или анионами) . В формулах этих солей
комплексный ион заключён в квадратные скобки.
Комплексные ионы
— это сложные ионы, состоящие из ионов элемента (комплексообразователя)
и связанных с ним нескольких молекул или ионов (лигандов).
Примеры комплексных
солей приведены ниже.
а) С комплексным анионом:
K2[PtCl]4
— тетрахлороплатинат(II)
калия,
K2[PtCl]6
— гексахлороплатинат(IV)
калия,
К3[Fe(CN)6]
— гексацианоферрат(III)
калия.
б) С комплексным катионом:
[Cr(NH3)6]Cl3
— хлорид гексаамминхрома (III),
[Ag(NH3)2]Cl
— хлорид диамминсеребра (I)
[Cu(NH3)4]SO4
— сульфат тетраамминмеди
(II)
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые соли при растворении в воде
диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl → Na+ +
Cl—
K2SO4 → 2K+
+ SO42-
Al(NO3)3 → Al3+ + 3NO3—
ВАЖНЕЙШИЕ
СПОСОБЫ ПОЛУЧЕНИЯ СОЛЕЙ
1. Металл + неметалл = соль
2Fe + 3Cl2
= 2FeCl3
2. Металл + кислота = соль + водород
Zn + 2HCl
= ZnCl2 + H2↑
3. Металл + соль = другой металл + другая соль
(согласно электрохимическому ряду напряжений металлов)
Fe + CuSO4 = Cu + FeSO4
4. Кислота + основный (амфотерный) оксид = соль
+ вода
3H2SO4+Al2O3=Al2(SO4)3+
3H2O
5. Кислота + основание = соль + вода
H2SO4
+ 2NaOH = Na2SO4
+ 2H2O
При неполной нейтрализации многоосновной кислоты основанием
получают кислую соль:
H2SO4
+ NaOH = NaHSO4
+ H2O
При неполной нейтрализации многокислотного основания кислотой
получают основную соль:
Zn(OH)2
+ HCl = ZnOHCl +
H2O
6. Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 + H2SO4
= BaSO4 + 2HCl
7. Основный (амфотерный) оксид + кислота = соль
+ вода
CaO + 2HCl = CaCl2 +H2O
8. Основный оксид + кислотный оксид = соль
Li2O+CO2 = Li2CO3
9. Кислотный оксид + основание = соль + вода
SO3 + 2NaOH = Na2SO4
+ H2O
10. Щёлочь + соль = основание + другая соль
CuSO4 + 2NaOH
= Cu(OH)2
+ Na2SO4
11. Реакция обмена между солями: соль(1) + соль
(2) = соль(3) + соль(4)
NaCl + AgNO3 =Na NO3
+ AgCl
12. Кислые соли могут быть получены
действием избытка кислоты на средние соли и оксиды:
Na2SO4
+ H2SO4
= 2NaHSO4
Li2O
+ 2H2SO4
= 2LiHSO4 + H2O
13. Основные соли получают при осторожном
добавлении небольших количеств щелочей к растворам средних солей:
AlCl3 + 2NaOH = Al(OH)2Cl +
2NaCl
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Соль + щёлочь = другая соль + другое
основание
CuCl2 + 2KOH = 2KCl + Cu(OH)2
2. Соль + кислота = другая соль + другая кислота
BaCl2 +
H2SO4
= BaSO4 + 2HCl
3. Соль(1) + соль (2) = Соль(3) + соль(4)
Na2SO4 + BaCl2
=2NaCl + BaSO4
4. Соль + металл = другая соль + другой металл
(согласно электрохимическому ряду напряжений металлов)
Zn + Pb(NO3)2
= Pb + Zn(NO3)2
5. Некоторые соли разлагаются при нагревании
CaCO3 = CaO + CO2
KNO3 = KNO2
+ O2
СПЕЦИФИЧЕСКИЕ ХИМИЧЕСКИЕ
СВОЙСТВА
Специфические химические свойства солей зависят от
того, какой катион и какой анион образуют данную соль.
|
|
|
|
Ag+
Cu2+
Ba2+
Fe3+
Al3+
Ca2+
|
Ag+
Ba2+
2H+
2H+
3Ag+
2H+
|
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
соли, назовите их, определите тип.
1) КNO2
2)
LiOH 3) CaS 4) CuSO4 5) P2O5
6) Al(OH)2Cl 7) NaHSO3 8) H2SO4
Задание 2. С какими из перечисленных веществ
может реагировать а) BaCl2 б)
CuSO4 в)
Na2CO3?
1)Na2O 2)HCl 3)H2O 4) AgNO3 5)HNO3
6)Na2SO4 7)BaCl2 8)Fe
9)Cu(OH)2 10) NaOH
ОТВЕТЫ.
Наверх
Что льют кислоту в воду или наоборот. Неправильное смешивание концентрированной серной кислоты с водой (как это выглядит на практике)
Как смешать два жидких вещества? Например, какую-нибудь кислоту и воду? Казалось бы эта задача из серии «дважды два – четыре». Что может быть проще: слить две жидкости вместе, в какой-нибудь подходящей емкости, и все дела! Или влить одну жидкость в емкость, где уже находится другая. Увы, это та самая простота, которая, по меткому народному выражению, хуже воровства. Поскольку дело может закончиться крайне печально!
Инструкция
Имеется две емкости, в одной из них содержится концентрированная серная кислота, в другой – вода. Как их правильно смешать? Лить кислоту в воду или, наоборот, воду в кислоту? Ценой неверного решения в теории может стать низкая оценка, а на практике — в лучшем случае, сильный ожог.
Почему? А потому, что концентрированная серная кислота, во-первых, гораздо плотнее воды, а во-вторых, чрезвычайно гигроскопична. Иными словами, она активно поглощает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость с концентрированной серной кислотой начнут приливать воду, первые же порции воды «растекутся» по поверхности кислоты (поскольку вода гораздо менее плотная), и кислота начнет жадно поглощать ее, выделяя тепло. А этого тепла будет так много, что вода буквально «вскипит» и брызги полетят во все стороны. Естественно, не миновав незадачливого экспериментатора. Обжечься и «чистым» кипятком не очень приятно, а если учесть, что в водяных брызгах наверняка будет еще кислота. Перспектива становится совсем невеселой!
Именно поэтому многие поколения учителей-химиков заставляли своих учеников буквально зазубривать правило: «Сначала вода, потом – кислота! Иначе случится большая беда!» Концентрированную серную кислоту следует добавлять в воду, маленькими порциями, при перемешивании. Вот тогда вышеописанная неприятная ситуация не произойдет.
Резонный вопрос: с серной-то кислотой понятно, а как быть с другими кислотами? Как правильно смешивать их с водой? В каком порядке? Необходимо знать плотность кислоты. Если она плотнее воды, например, концентрированная азотная, ее точно так же, как серную, следует приливать в воду, соблюдая вышеуказанные условия (понемногу, при перемешивании). Ну, а если плотность кислоты очень незначительно отличается от плотности воды, как в случае с уксусной кислотой, тут уж без разницы.
Внимание, только СЕГОДНЯ!
Все интересное
Повышенное внимание и осторожность, а также соблюдение особых мер безопасности — необходимое условие при работе с кислотами. К работе с кислотами допускаются лица, достигшие 18 лет, при этом обязательным условием является прохождение курса…
Сернистая кислота — это неорганическая кислота средней силы. Из-за неустойчивости нельзя приготовить ее водный раствор с концентрацией более 6%, иначе она начнет распадаться на серный ангидрид и воду. Химические свойства сернистой кислотыСернистая…
Серная кислота — маслянистая бесцветная жидкость, не имеющая запаха. Относится к сильным кислотам и растворяется в воде в любых соотношениях. Имеет колоссальное применение в промышленности. Серная кислота — довольно тяжелая жидкость, ее плотность…
Серная кислота по физическим свойствам – тяжелая маслянистая жидкость. Она не имеет запаха и цвета, гигроскопична, хорошо растворяется в воде. Раствор с содержанием h3SO4 менее 70% обычно называют разбавленной серной кислотой, более 70% –…
Хлористоводородная (соляная, HCl) кислота – это бесцветная, очень едкая и ядовитая жидкость, раствор хлорного водорода в воде. При сильной концентрации (38% от общей массы при температуре 20оС окружающей среды) — «дымится», туман и пары…
Серная кислота имеет химическую формулу h3SO4. Это тяжелая маслянистая жидкость, бесцветная или с желтоватым оттенком, который ей придают примеси ионов металлов, например, железа. Серная кислота очень гигроскопична, легко поглощает водяные пары.…
Серная кислота входит в пятерку самых сильных кислот. Необходимость в нейтрализации этой кислоты возникает, в частности, в случае ее утечки и при возникновении угрозы отравления ей. Инструкция 1Молекула серной кислоты состоит из двух атомов…
С давних времен, объясняя, как смешивать концентрированную серную кислоту с водой, учителя заставляли учеников запоминать правило: «Сначала вода, потом – кислота!» Дело в том, что если поступить наоборот, первые же порции более легкой…
Серная кислота, имеющая химическую формулу h3SO4, представляет собою тяжелую, плотную жидкость маслянистой консистенции. Очень гигроскопична, легко смешивается с водой, при этом обязательно следует лить кислоту в воду, ни в коем случае не наоборот.…
В любом автомобиле есть источник тока, этим источником является аккумулятор. Т. к. аккумулятор – это элемент многоразового использования, то его можно подзаряжать и менять в нем электролит. Раньше, в автомобилях применялись как кислотные, так и…
Сульфаты железа – это неорганические химические вещества, они делятся на разновидности. Существует двухвалентный сульфат железа(2) и трехвалентный сульфат железа(3). Есть много способов получения этих сернокислых солей. Вам понадобитсяЖелезо,…
Что происходит, если кислоту соединить с какой-либо солью? Ответ на этот вопрос зависит от того, какая это кислота и какая соль. Химическая реакция (то есть превращение веществ, сопровождающееся изменением их состава) между кислотой и солью может…
Как смешать два жидких вещества? Например, какую-нибудь кислоту и воду? Казалось бы эта задача из серии «дважды два – четыре». Что может быть проще: слить две жидкости вместе, в какой-нибудь подходящей емкости, и все дела! Или влить одну жидкость в емкость, где уже находится другая. Увы, это та самая простота, которая, по меткому народному выражению, хуже воровства. Поскольку дело может закончиться крайне печально!
Инструкция
Имеется две емкости, в одной из них содержится концентрированная серная кислота, в другой – вода. Как их правильно смешать? Лить кислоту в воду или, наоборот, воду в кислоту? Ценой неверного решения в теории может стать низкая оценка, а на практике — в лучшем случае, сильный ожог.
Почему? А потому, что концентрированная серная кислота, во-первых, гораздо плотнее воды, а во-вторых, чрезвычайно гигроскопична. Иными словами, она активно поглощает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость с концентрированной серной кислотой начнут приливать воду, первые же порции воды «растекутся» по поверхности кислоты (поскольку вода гораздо менее плотная), и кислота начнет жадно поглощать ее, выделяя тепло. А этого тепла будет так много, что вода буквально «вскипит» и брызги полетят во все стороны. Естественно, не миновав незадачливого экспериментатора. Обжечься и «чистым» кипятком не очень приятно, а если учесть, что в водяных брызгах наверняка будет еще кислота. Перспектива становится совсем невеселой!
Именно поэтому многие поколения учителей-химиков заставляли своих учеников буквально зазубривать правило: «Сначала вода, потом – кислота! Иначе случится большая беда!» Концентрированную серную кислоту следует добавлять в воду, маленькими порциями, при перемешивании. Вот тогда вышеописанная неприятная ситуация не произойдет.
Резонный вопрос: с серной-то кислотой понятно, а как быть с другими кислотами? Как правильно смешивать их с водой? В каком порядке? Необходимо знать плотность кислоты. Если она плотнее воды, например, концентрированная азотная, ее точно так же, как серную, следует приливать в воду, соблюдая вышеуказанные условия (понемногу, при перемешивании). Ну, а если плотность кислоты очень незначительно отличается от плотности воды, как в случае с уксусной кислотой, тут уж без разницы.
В разделе на вопрос Что произойдет если кислоту налить в воду, и наоборот если воду в кислоту заданный автором Профайл удалён
лучший ответ это Нужно наливать серную кислоту в воду тогда все будет ОК.
А если наоборот… то как минимум разорвет пробирку, а как максимум — тебе будет больно, когда начнет кис-та брызгать и обжигать тебя.
вода легче серной кислоты. Температура плавления равна 10,37 °С при теплоте плавления 10,5 кДж/моль. Это много. — если вливать воду в серную кислоту, то вода закипит в процессе вливания и начнет разбрызгиваться.
Ответ от Дёминов Анатолий
[гуру]
Начинает кипеть и брызгаться…
Ответ от электросварщик
[гуру]
реакция))) но при наливании воды в кислоту лучше близко не стоять и не вдыхать и глазки туды не засовывать…. перами обозжет
Ответ от Невроз
[гуру]
слышали такое выражение кислота ходит в гости…
Ответ от Колосовые
[гуру]
слабый раствор кислоты либо воды… =))
Ответ от Їерчилль
[гуру]
Второе можно производить только в комбинезоне химзащиты.
Ответ от Анатолий Подплетний
[гуру]
В первом случае-кислота тяжелее и сразу уходит на дно остается только помешать и будет элекролит! А во втором случае легкая вода начнет разбрызгивать и повыжигает глаза если нет очков!!
Ответ от ******
[гуру]
То ли будешь зрячая — то ли наоборот! Воду в кислоту — НЕЛЬЗЯ КАТЕГОРИЧЕСКИ! Выброс в виде брызг — глаза — лицо — ожоги -слепота — потеря красоты — инвалид по дурости!!
Ответ от Михаил Бармин
[гуру]
Диссоциация (растворение происходит с выделением большого количества тепла. На до вливать вещество с большей плотностью в вещество с меньше плотностью, что приведет к лучшему перемешиванию и меньшей скорости, иначе ВЫБРОС раствора и ПОРАЖЕНИЕ ГЛАЗ!!
Ответ от Ира Юшинова
[новичек]
Смотря какую кислоту. В случае с азотной и соляной ничего страшного не произойдет, кислоты просто нагреются. Соляная нагреется сильнее. В случае с серной реакция будет идти с большим выделением тепла. В первом случае серная кислота опустится на дно, так у воды меньшая плотность и реакция будет проходить безопасно. Во втором случае реакция будет проходить на поверхности с большим выделением тепла. Похожее происходит, когда на раскаленную сковородку капнуть воды. Но в конце концов кислота поглотит воду.
Вы помните это правило безопасности
, рассказанное на школьных уроках химии?
Я тут подумал намедни, а ЧТО будет с Германией и её «швулями»
при ВЛИВАНИИ в эту страну концентрированного потока исламистов
?
Как вы думаете, получится раствор
или взрыв
?!
Возможно вы спросите, а кто такие немецкие «швули»
?
Послушайте рассказ этой девушки:
По утверждению самих немцев, количество «швулей»
в Германии уже давно перевалило за миллион человек
!
В 2001 году, 14 лет назад, немецкое правительство и церковь узаконили гомосексуальные браки
. Как результат, в Германии более 400 тысяч только официально зарегистрированных однополых браков
.
Рост мужского гомосексуализма прямо пропорционален росту эмансипации.
Это Германия, XXI век.
Немецкому обществу навязан очередной миф и стереотип. Сегодня немецкое общество — это общество социальной амнезии. Ему свойственны безропотное следование приказам и установкам, индифферентность личности, комформизм на пару с униформизмом и духовное порабощение. А так же резкий перепад духовного климата (сегодня ещё здравствуют люди, помнящие, как гомосексуалистов сажали в КZ). И это покорно-бездумное состояние человека «массы» сделало его лёгкой добычей демагогии и предрассудка.
Декларируя всеобщее равенство, демократия не терпит разнообразия, если речь не идёт о гомосексуалистах, транссексуалах и травеститах. Им позволена «цветущая множественность»
, а остальных гуманно придушат подушкой политкорректности. На гомосексуализм сегодня в Германии стандартное нейрофизиологическое реакция, как и на все приказы, что спускаются сверху.
Приказано любить — полюбим. Семьдесят лет назад приказали не любить — нелюбили.
Гомосексуализм в Германии стал маргинальным феноменом общественной жизни. В атмосфере вседозволенности он превратился в пандемию.
Институт семьи рухнул под совместным натиском гомосексуалистов, феминисток и атеистов. Мораль и традиция выдавлены в маргинез.
Не только в Германии, но и в других странах мира усилились приметы тотальной болезненности.
Человечество все больше отдаляется от той нормы, которую Эрих Фромм называл «здоровой». Приметами такой жизни являются все возрастающая отчужденность между людьми, усиление эгоцентризма, релятивизация и разрушение традиционных морально-этических ценностей, нарастающая хаотичность жизни, гедонизм и меркантилизм. Источник.
Это была одна сторона медали
, а это другая. Она называется «вливание концентрированного потока мусульман в Германию»
:
И если вновь прибывшие мусульмане
вот так обходятся с полицейскими Германии, то я даже представить себе не могу, какая будет у них реакция на немецких «швулей»
!
А ведь и те, и другие в равной степени пригреты и обласканы
правительством новой Германии!
На мой взгляд, такая «забота»
о немецкой нации со стороны канцлера Германии Ангелы Меркель, это на порядок круче замысел, чем чья-то задумка свести в России воедино бойцов ВДВ и питерских геев!
Как думаете, друзья, смогут ли мусульмане вылечить
Гейропу и Германию от содомии
?
АНЕКДОТ в ТЕМУ от Владимира Вольфовича:
Однажды утром Штирлиц зашёл к Мюллеру. Настроение у того было мрачнее тучи.
— Господин группенфюрер, что случилось? Русские уже в пригородах Берлина?
— Штирлиц, бросьте ваши дурацкие шутки! Мне приснился страшный сон — Германия 2015 года!
— И что же, там всё так плохо?
— Не то слово! Представляете, у нас в Германии канцлер — баба, министр иностранных дел — педераст, на заводах Даймлер-Бенц работают турки, Германия оплачивает долги греков и испанцев, вместо факельных шествий — гей-парады, мы платим деньги евреям и выполняем команды негра из Америки!
При смешивании концентрированной серной кислоты и воды выделяется много тепла. Для химика этот факт очень важен, поскольку и в лаборатории, и в промышленности часто приходится готовить разбавленные растворы серной кислоты. Для этого нужно смешивать концентрированную серную кислоту с водой — не всегда, но часто.
Как смешать концентрированную серную кислоту и воду
?
Во всех учебниках и практикумах настоятельно рекомендуют лить серную кислоту в воду
(тонкой струйкой и при хорошем перемешивании) — а не наоборот: нельзя лить воду в концентрированную серную кислоту!
Почему? Серная кислота более тяжелая, чем вода.
Если лить кислоту тонкой струйкой в воду, то кислота опустится на дно. Тепло, которое выделится при смешивании, рассеется — пойдет на нагрев всей массы раствора, поскольку над слоем кислоты, которая опустилась на дно сосуда, расположено большое количество воды.
Тепло рассеется, раствор нагреется — и ничего плохого не произойдет, особенно, если в процессе добавлении кислоты к воде жидкость хорошо перемешивать.
А что будет, если сделать неправильно
, — в концентрированную серную кислоту добавить воду? Когда первые порции воды попадут в серную кислоту, они останутся на поверхности (поскольку вода легче, чем концентрированная серная кислота). Выделится много
тепла, которое пойдет на нагрев маленького количества
воды.
Вода резко вскипит, в результате полетят брызги серной кислоты и образуется едкий аэрозоль. Эффект может быть примерно такой, как при добавлении воды на горячую сковородку с маслом. Брызги серной кислоты могут попасть в глаза, на кожу и одежду. Аэрозоль серной кислоты не только очень неприятен при вдыхании, но и опасен для легких.
Если стекло не термостойкое — сосуд может треснуть.
Чтобы это правило было легче запомнить, придумывают специальные стишки вроде:
«Сначала вода, а потом кислота — иначе случиться большая беда!».
Используют также специальные фразы для запоминания — «мемы», например:
«Чай с лимоном».
Книги — хорошо, но решил заснять, как выглядит результат неправильного смешивания концентрированной серной кислоты и воды на практике.
Разумеется, со всеми мерами предосторожности: начиная от защитных очков, заканчивая использованием небольших количеств веществ.
Провел несколько экспериментов — я пробовал смешивать серную кислоту с водой (и правильно, и неправильно). Во обоих случаях наблюдался лишь сильный разогрев. А закипания, разбрызгивания, и подобного не происходило.
Для примера, опишу один из экспериментов, проведенный в пробирке. Концентрированной серной кислоты взял 20 мл, воды 5 мл. Обе жидкости комнатной температуры.
Начал добавлять к серной кислоте воду. Вода закипела лишь в момент, когда приливал первые порции воды к кислоте. Новые порции воды погасили кипение. Едкий аэрозоль полетел (к этому я был не готов, пришлось на несколько секунд отойти). Попробовал перемешать алюминиевой проволочкой (то, что было под рукой). Эффекта ноль. Измерил температуру термометром. Оказалось 80 градусов по Цельсию. Эксперимент удался едва ли.
Новый эксперимент провел в колбе: чтобы поверхность соприкосновения двух жидкостей была максимальной (это обеспечит более резкое выделение тепла), а толщина слоя воды над серной кислотой — минимальной. Воду добавлял не всю сразу, а небольшими порциями (чтобы тепло пошло на кипение воды, а не на нагрев всей массы воды).
Итак, в коническую колбу налил около 10-15 мл концентрированной серной кислоты. Воды использовал около 10 мл.
Пока готовился к опыту, кислота под палящим солнцем разогрелась до 36-37 градусов (что градусов на 20 выше, чем начальная температура кислоты в прошлом опыте). Вода в пробирке тоже слегка нагрелась, но не так сильно.
Думаю, это сыграло большую роль в успехе опыта.
При добавлении основной порции воды в серную кислоту заметно летели брызги и едкий аэрозоль. К счастью, их сносило ветром, который дул с моей стороны, поэтому я даже ничего не ощутил.
В итоге, температура в пробирке поднялась выше 100 градусов!
Какие можно сделать выводы? Если нарушить правило, что нельзя добавлять воду к концентрированной серной кислоте
, разбрызгивание происходит не всегда, но оно возможно — особенно, когда вода и кислота теплые. Особенно — если добавлять воду медленно, небольшими порциями и в широкой посуде.
При работе с бОльшими количествами воды и кислоты вероятность резкого разогрева и разбрызгивания возрастает (напоминаю: мы взяли всего несколько миллилитров).
Опыт, который демонстрирует, что нельзя добавлять воду в концентрированную серную кислоту
, описан в практикуме авторов Рипан и Четяну .
Приведу цитату:
Если в концентрированную серную кислоту наливать воду, то первые капли воды, попавшие в нее, моментально превращаются в пар и из сосуда вылетают брызги жидкости. Это происходит по той причине, что вода, обладая небольшим удельным весом, не погружается в кислоту, а кислота ввиду малой теплоемкости не поглощает выделившейся теплоты. При вливании горячей воды наблюдается более сильное разбрызгивание серной кислоты.
Опыт
. Смешивание воды с концентрированной Н 2 SO 4
. Стаканчик с концентрированной серной кислотой ставят на дно большого стакана, прикрытого воронкой. Теплую воду вливают при помощи пипетки (рис. 161). При вливании горячей воды внутренние стенки большого стакана и воронки моментально покрываются брызгами жидкости.
Рис. 161
За неимением стеклянной воронки можно воспользоваться картонной, внутрь которой вводят пипетку с водой.
Если в стакан с водой приливать по каплям или тонкой струей концентрированную серную кислоту, то можно заметить, как более тяжелая серная кислота опускается на дно стакана.
При смешивании концентрированной Н 2 SO 4 со льдом можно одновременно наблюдать два явления: гидратацию кислоты, сопровождающуюся выделением тепла, и плавление льда, сопровождающееся поглощением тепла. Поэтому в результате смешивания можно наблюдать либо повышение, либо понижение температуры. Так, при смешивании 1 кг льда с 4 кг кислоты температура повышается почти до 100°, а при смешивании 4 кг льда с 1 кг кислоты температура снижается почти до -20°.
Решение задачи
1. Поскольку при сжигании Х были получены только углекислый газ и вода, Х могло содержать углерод, водород и кислород. Найдем количество образовавшихся при сгорании Х веществ: n(СО2) = 10,08 / 22,4 = 0,45 моль; n(Н2О) = 3,6 /18 = 0,2 моль. Следовательно, количество углерода и водорода, содержащееся в сжигаемой навеске Х равно: n(С) = 0,45 моль; n(Н) = 0,4 моль; n(О) = (6,6 — (0,45 × 12 + 0,4 × 1)) / 16 = 0,05 моль. Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
2-3. Поскольку соединение содержит один атом кислорода, оно может быть спиртом, альдегидом, кетоном или простым эфиром. Х реагирует с аммиачным раствором оксида серебра(I), при нагревании его с гидроксидом меди(II) наблюдается выпадение красного осадка. Эти реакции указывают на наличие альдегидной группы в составе Х (Х можно отнести к классу альдегидов).
Т.к. вещество Х обесцвечивает бромную воду, оно может содержать в составе молекулы кратные связи (Х можно отнести к непредельным соединениям). Поскольку при окислении перманганатом калия образуется бензойная кислота (Х можно отнести к ароматическим соединениям), единственным соединением, которое удовлетворяет всем условиям, является 3‑фенилпропеналь (коричный альдегид).
3.Уравнения описанных в условии задачи реакций:
4. Коричный альдегид может существовать в виде цис- и транс-изомеров.
95% успеха состоит с правильной воды для опрыскиваня.
Очень похожая ситуация и в сельском хозяйстве, где аграрии используют воду для опрыскивания из речек, скважин, озёр и прочее.
Рабочий раствор составляется только с 5% действующих веществ, а остальные 95% это вода.
Именно от такой воды, от её характеристик зависит, насколько эффективно сработает тот или другой препарат. Значит, смело можна заявить – качество воды очень важно и за ней необходимо следить!
Основные факторы, которые влияют на качество воды:
— уровень жесткости
— показатель рН
— мутность
— температура
Смоделируем ситуацию. Агроном купил новую технику, купил нужные и лучшие семена, хорошо рассчитал технологическую карту, но не учёл качество воды.
Напоминает бочку Либиха, где ограниченым фактором, который не позволит ей наполниться до края является – качество воды. С первыми двумя факторами трудно разобраться без знаний химии, а вот с последними ситуация проще.
Мутность.
Такая вода встречается, когда набирается вода с речек или озёр, и проблема не только в химическом составе, но и в удобстве использования. Органические остатки вступают в реакцию с пестицидами и результат в основном не удовлетворительный, а ещё попадают остатки растений, водоростли, разные виды животных, которые живут в воде (рыбы, лягушкт и т.п.) и самые простые организмы. Использовать осмос или дистилированную воду невероятно дорого. Монтаж собственной скважины, в нужном для вас месте – сэкономит время и расходы на логистику. И главное – вода будет чистой.
Но, появляется новая проблема — температура.
Вода из скважины холодная и в среднем её ткмпература 12 °С. Порошкообразные вещества в такой воде очень плохо растворяются, и как следствие, теряется концентрация рабочего раствора. Есть один вариант, это подогреть воду на протяжении дня, заблаговременно набрать у опреелённые ёмкости.
Вот и дошли к двум самым важным факторам рН и жесткость.
Определить, что важнее невозможно, так как каждый с этих факторов играет свою роль на эффективность препарта, поэтому решать нужно сразу две проблемы. Значение рН характеризирует кислотность (Концентрация ионов водорода) или щёлочность любого раствора в диапазоне от 0 до 14, до 7 рН среда кислая, 7 рН нейтральная, а выше 7 рН щелочная. Большинство пестицидов является кислотами и соответственно для эффективной работы им необходимо нейтральная или кислая среда, но уж никак не щёлочная. Если пестициды попадают в щёлочную среду происходит щелочной гидролиз – деградация пестицида до неактивных (нетоксичных) форм. Жесткость воды – это общий термин, который характеризирует сумму ионов Кальция (Ca2+) и Магния (Mg2+ ) и других металов. Чем больше концентрацияэтих и других металов, тем жестче будет вода. При использовании слишком жесткой воды свыше 300 ррм заключается опасность в том, что свободные и «сильные» ионы Кальция и Магния замещают более слабые ионі действующего вещества (пестицидов).
Несколько маленьких и незаметных отверствий в большой бочке, не позволят наполнить её наполнить её и получить ожидаемый результат. Для начала скважину сдклать, позже воду нужно подогркть, а ещё и рН в ней не подходит, о жесткости вообще хотелось бы забыть, но если начали, нужно разбираться, что и как!
Способов для решения выше перечисленных проблем есть несколько. Один из них начали использовать в Америке вначале 90х годов, где в качестве подкислителя использовали сульфат аммония.
То что он действительно работает, это да, но не с желаемым эффектом. С его использованием обнаружили один из минусов – в первую очередь это растворимость. Сульфат амония не растворяется полностью в холодной воде и как результат – нерастворимый осадок. Ещё один из минусов – это логистика, норма расхода сульфат аммония в среднем 4кг на 100 литров воды, и вот когда нужно обработать, к примеру, 300 га это уже 1200 кг, вряд ли кто-то захочет потратить весь день, чтобы таким способом «улучшать» характеристику воды. И на последок, хотя наверное один из важных минусов – «экономия»! Если подсчитать все логистические услуги, хранение, погрузочные работы и затраты времени на ожидания (пока растворится «подкислитель») — получается не экономия, а лишь перерасход денег.
Есть один продукт, который как помогает избежать этих проблем. Способ эффективный но есть несколько но …
Лимонная кислота, которая действительно окисляет воду и делает это иногда слишком хорошо. А еще она уменьшает жесткость воды, но по сравнению со специальными кондиционерами воды лимонная кислота справляется не очень эффективна. Кажется, что все хорошо, низкая норма расхода (100г на 100л воды), не дорогая (примерно 1кг — 25грн), уменьшает показатели рН и жесткость, меньшие затраты на логистику, какие же могут быть минусы? К сожалению они есть. Лимонную кислоту используют в виде порошка, что с ней происходит без тщательного перемешивания — известно. Уменьшение жесткости происходит за счет взаимодействия с кальцием (Са) при этом образуется соль — Цитрат кальция (Ca3 (C6H5O7) 2), которая очень сильно снижает усвояемость основных питательных элементов. Рабочий раствор в котором есть лимонная кислота, при взаимодействии с листовой поверхностью сильно сушит письмо, что приводит к снижению усвояемости основных минералов.
Цитрат кальция (соль) сама по себе тоже может выпадать в осадок, забивая форсунки и фильтра потому что она нерастворимая. Среди прочего, что лимонная кислота просто оседает, она еще и отрицательно влияет на изделия из металла и резины. Такие металлы, как силумин и алюминий вообще не «дружат» с лимонной кислотой, через некоторое время они превращаются в порошок.
В системах опрыскивателя есть элементы именно из таких металлов и поэтому, использовать лимонную кислоту в качестве подкислителя крайне опасно. С резиной подобная ситуации, со временем она теряет упругость и превращается в пасту. Негативные последствия можно увидеть на примерах стиральных машин, которые часто промывают лимонной кислотой, чтобы избавиться от неприятного запаха или плесени. Одно дело стиральная машина, стоит 500 $, а что же с опрыскивателем, цена которого иногда более 200000 $? И еще один из важных факторов — это рН земли. Для полноценного усвоения растениями наиболее доступных элементов — рН земли должен быть от 7 и выше (зависит от минералов, которые вносятся), а как удерживать этот показатель в норме, если мы постоянно заливаем водный раствор с рН ниже 5, что в свою очередь приводит к подкисление земле Кто-то может подумать — тогда почему бы не добавлять меньшую норму лимонной кислоты? Тогда рН потребуется. Возможно и так, но как тогда быть с жесткостью?
Такая ситуация приводит к использованию «управленческих костылей», и увеличение количества переменных параметров приводит к использованию все большего и большего количества разнообразных костылей, каждый из которых решает одну проблему, то способствует появлению новой, для решения которой нужна своя костыль.
Специалисты компании Агротека создали карту с показателями жесткости и рН воды:
Для решения сразу всех проблем — существуют комплексные адъюванты, в нашем случае кондиционер жесткости воды и регулятор pH — Аквалайт.
В работе с этим продуктом «но» не существуют. Его стала формула помогает подобрать необходимую норму препарата для того, чтобы снизить рН до необходимой отметки и параллельно буферизует избыточную жесткость. Аквалайт является раствором, поэтому проблем с растворимостью в холодной воде не существует. Нормы расхода начинаются с 50 мл на 100 л воды помогает уменьшить затраты на логистику, а 5ти литровая канистра позволяет для удобного использования.
Вариантов, как подготовить воду для максимально эффективного применения много, выбор за вами.
Что же выберете сегодня? Сэкономить деньги и приобрести «народный продукт» или использовать старые технологии и тратить драгоценное время при обработке? Или же выбрать лучший вариант — комплексный адъювант который поможет решить все проблемы с подготовкой воды. Выбор за Вами.
С умным подходом — большой доход обеспечен.
За более подробной информацией о регуляторе рН и кондиционер жесткости воды Аквалайт, обращайтесь к специалистам компании Агротека.
Тел.: +38 (044) 221 8870, моб.: +38 (050) 221 8810
что это и как влияет на вкус кофе
Чашка фильтр-кофе на 98,5% состоит из воды, а её качество имеет большое значение для кофе.
Общая и карбонатная жесткость — ключевые параметры, которые определяют качество воды. За общую жесткость отвечают хлорид кальция (CaCl2), сульфат кальция (CaSO4), хлорид магния (MgCl2) и сульфат магния (MgSO4). За карбонатную — бикарбонат калия (KHCO3) и бикарбонат натрия (NaHCO3).
Соли магния и кальция помогают извлечь из кофе больше вкуса и не выпадают в осадок при кипячении воды. А вот с бикарбонатами все не так просто. Вода, которая перенасыщена карбонатами, образует накипь. При кипячении воды соли выпадают в осадок и могут привести к поломке кофемашины.
Казалось бы, выбирайте воду с низким содержанием карбонатов, и проблема решена. Но недостаточное количество карбоната кальция в воде может вызвать коррозию бойлера и трубок. А главное — содержание бикарбонатов влияет на воспринимаемую кислотность кофе.
Мы уже рассказывали о том, как состав воды влияет на экстракцию. Теперь разбираемся, как карбонатная жесткость влияет на pH воды и вкус кофе.
Как карбонатная жесткость влияет на pH воды
Чтобы стабилизировать pH воды, нужна буферная система. А основная буферная система в воде — это как раз бикарбонаты Ca(HCO3)2. Если в воде будет много бикарбонатов, они «уничтожат» положительную кислотность кофе.
В кофе насчитывается более 40 органических кислот. От вида и соотношения кислот зависит вкус напитка: будет ли это приятная искристая кислотность или неприятная уксусная. Для этого в индустрии спешелти проводят эксперименты с ферментацией — процессом, при котором количество кислот в кофе увеличивается.
От вида и соотношения кислот в кофе зависит вкус напитка. А состав воды определяет экстракцию этих кислот
Большинство кислот в кофе слабые. Это значит, что даже незначительные отклонения в составе воды могут сильно повлиять на вкусовые свойства. Если взять воду с разным исходным ppm — уровнем минерализации — ppm кофе на выходе будет одинаковым, а вот вкус разным. Все потому, что разная вода по-разному растворяет вещества из кофе.
Итак, вкус кофе меняется в зависимости от параметров воды. Когда уровень pH понижается, растет кислотность воды, и кофе получается кислым. Если уровень pH повышается, во вкусе кофе появляется горечь. Чтобы уровень pH оставался стабильным, в воде должны содержаться бикарбонаты. Нужно только подобрать оптимальное соотношение минеральных веществ в воде.
Как подобрать допустимый диапазон карбонатной жесткости
Specialty Coffee Association выпустила стандарты, согласно которым допустимый диапазон карбонатной жесткости: ± 40 ppm. Карбонатная жесткость измеряется по шкале KH, а общая — по шкале GH.
Целевые показатели воды от SCA
Спецификация расплывчата, непонятно, что означает «плюс-минус» в отношении диапазона KH. Максвелл Колонна-Дэшвуд и Кристофер Хэндон в книге «Вода для кофе. Наука. История. Руководство» провели серию экспериментов, чтобы проверить, что будет со вкусом кофе при разных соотношениях общей и карбонатной жесткости воды.
Максимальная общая жесткость и минимальная карбонатная жесткость (точка А)
Проблема. Недостаточно буфера, чтобы экстрагировать сильные кислоты.
Кислотность в кофе получается очень приглушенной.
Максимальная карбонатная жесткость и минимальная общая жесткость (точка B)
Проблема. Не экстрагируются сложные вкусоароматические вещества. Не сформировалось тело напитка. Буфер нейтрализовал слабые положительные кислоты.
Вкус плоский, едкий, пережаренный.
Минимальная общая жесткость и минимальная карбонатная жесткость (точка С)
Проблема. Вода становится слишком пустой. Она не может извлечь нужное количество соединений из кофе из-за недостаточного количества минералов. Плохо сформированное тело кофе.
Вкус пустой, слегка уксусный.
Максимальная карбонатная жесткость и максимальная общая жесткость (точка D)
Проблема. Из-за максимальной KH вероятность образования накипи резко возрастает. Чтобы компенсировать такую высокую буферную способность, требуется очень высокая экстракция, поэтому GH тоже должна быть высокой. Из-за высокого содержания минеральных веществ вода быстро переэкстрагирует кофе.
Вкус горький, терпкий, пустой.
Итак, чтобы получить сбалансированный вкус, в кофе должны быть кальций, магний и небольшое содержание буфера.
Исследуя карту воды, Максвелл Колонна-Дэшвуд и Кристофер Хэндон постарались найти границы для каждого параметра. Эти точки не являются конкретными значениями, но находятся в пределах погрешности около 10 ppm
Как показали эксперименты Максвелла Колонна-Дэшвуда и Кристофера Хэндона, для стабильного вкуса кофе в воде должно быть сохранено небольшое количество буфера. В качестве отправной точки вы можете использовать соотношение GH и KH 2:1.
Если баланс нарушен, проверьте состав воды и параметры водоподготовки. Для домашнего приготовления кофе выбирайте бутилированную воду с карбонатной жесткостью 50-70 мг/л при рН 7,0. Бариста могут менять параметры водоподготовки для кофемашины в сторону уменьшения или увеличения солей в воде.
Мы уже рассказывали о том, как выбрать воду для кофе, как контролировать качество воды, которая попадает в кофемашину и как измерить вкус кофе по специальным параметрам. Чтобы понять, как состав вашей воды влияет на готовый напиток, ориентируйтесь на вкус кофе. Экспериментируйте, пробуйте разную воду и меняйте параметры водоподготовки с учетом желаемого вкуса. Так вы сможете получить кофе с яркой приятной кислотности.
Что запомнить
-
В воде должно содержаться небольшое количество бикарбонатов — до 70 ppm. Они помогают держать pH воды под контролем, что положительно влияет на приятную кислотность кофе.
-
Правильно подбирайте воду для заваривания кофе. Обращайте внимание на показатель «гидрокарбонат» на этикетке, оптимальное значение — 50-70 мг/л при рН 7,0.
-
Важно не оценивать общую и карбонатную жесткость по отдельности. Их соотношение влияет на вкус кофе. Рекомендуемое соотношение GH и KH 2:1.
-
При высоком содержании карбоната киcлотность будет не цитрусово-ягодной, а плоской и землистой. При низком содержании карбоната вкус получается уксусным и кислым.
Аромат и витамины сохранятся до весны. Пять полезных рецептов из клубники | Кухня: рецепты | Кухня
Клубничная пора в разгаре. Читатели поделились с UFA.AIF.RU рецептами, как заготовить ягоду впрок, чтобы по максимуму сохранились витамины, а также блюдами из свежей клубники.
Клубничный сорбе
Гульназ Арсланова, город Уфа:
«Сорбе на зиму я заготавливаю уже пару лет, и с домочадцами его потом едим, как мороженое. Этот рецепт мне понравился ещё в студенческие годы, а сейчас это лакомство с удовольствием уплетают мои дети. Иногда заливаем им творог или оладьи. Главное — аромат ягод в сорбе сохраняется до самой весны».
Фото: milaclub.com
Ингредиенты: клубника — 1 кг, сахар — 700 гр.
Способ приготовления: клубнику моем, убираем плодоножки. Ягоды и сахар выкладываем в кухонный комбайн и взбиваем в течение двух-трех минут, до растворения сахара. Полученную смесь помещаем в контейнер с крышкой и убираем в морозильник. Всё, сорбе готов.
Есть и другой вариант рецепта.
Ингредитенты: клубника — 200 гр., сахарная пудра — 100 гр., крахмал — 1,5 ст. л.
Способ приготовления: Клубнику в блендере нужно прокрутить до однородной массы. Добавить сахарную пудру с крахмалом и снова прокрутить. Полученную массу выложить в пластиковый контейнер с крышкой и поставить в морозильник на 1-1,5 часа. Сорбе готов к употреблению. Клубнику можно заменить лесными или другими ягодами. Также можно по вкусу менять пропорции крахмала и сахарной пудры.
Сырой джем – максимум витаминов
Татьяна Сысоева, Салават:
«Клубника сочетается с сочным апельсином. И рецепт этот прост: полезный сырой джем, не требующий варки. Хотя он получается не таким густым, зато все витамины сохраняются.
Фото: domosedkam.ru
Ингредиенты: клубника — 700 гр., апельсин — 350 гр., кислота лимонная (либо 2 ст. л. лимонного сока) — 0,5 ч.л., песок сахарный — 1 кг.
Способ приготовления: отборные спелые и целые ягоды без порчи засыпаем в сито или дуршлаг, тщательно промываем. Ждём, когда вся вода стечёт. Хвостики аккуратно удаляем. Апельсины тщательно очищаем от перепонок и косточек, делим на дольки, измельчаем в блендере до пюреобразной консистенции. К полученной смеси добавляем клубнику, прокручиваем. Массу выкладываем в большую миску из нержавейки или в эмалированную посуду, добавляем сок лимона или лимонную кислоту, плюс сахар. И перемешиваем до полного растворения сахара. Сырой клубничный джем готов! Перед тем, как уложить его в банки, пусть постоит при комнатной температуре 2-3 часа.
Банки и крышки простерилизовать. Сырой джем ещё раз перемешать стерилизованной ложкой и расфасовать по банкам. Мы им поливаем ленивые вареники, каши, творог, сырники, блины или оладьи. Из него также можно готовить кисель.
Правда, хранить его можно в холодильнике не более двух месяцев. Если решили сготовить его на более длительное хранение, то сахар нужно добавлять в пропорции 2 кг сахара на 1 кг перемолотых ягод».
Чай с сушеной клубникой
Марина Борисова, Уфа:
«Этот чай получается восхитительным! И, пожалуй, самый лучший способ заготовить ягоды на зиму. А как приятно потом вылавливать из чая ломтики с умопомрачительным вкусом! Сушить ломтиками ягоды мне подсказала соседка по саду. Чай по такому рецепту сначала понравился всем моим знакомым, которые таким же образом стали его заготавливать. Несколько банок будущего чая я каждое лето вручаю своим родственникам, приезжающим погостить ко мне.
Фото: Грядки мои
Ингредиенты: на 1 кг клубники — 30 гр. листьев клубники, мяты и мелисы.
Способ приготовления: отбираем спелые, целые ягодки, удаляем плодоножки и моем в холодной проточной воде. Нужно, чтобы вся вода с ягод стекла. Нарезаем пластинками по два-три миллиметра толщиной и выкладываем их на решётку сушилки (в моем случае это электросушилка), оставляя между ломтиками небольшое пространство. Сушим при температуре 40 градусов, меняя местами верхние и нижние решетки. Точно также высушиваем мытые листья. Всё аккуратно перемешиваем и храним в герметичной банке».
Клубничное варенье с мятой и лимоном
Кира Минина, Дюртюли:
«Клубника, мята и лимон очень интересно сочетаются друг с другом. Из них можно приготовить потрясающе вкусное варенье с дольками лимона, сваренное на мятном сиропе. У него ещё одно бесспорное преимущество – ягоды клубники даже после варки остаются целыми и не развариваются. Варенье понравится всем без исключения: и домочадцам, и гостям.
Фото: gastronom.ru
Ингредиенты: клубника — 4 кг., мята — средний пучок, сахар — 3 кг., крупный лимон — 1 шт.
Способ приготовления: клубнику сложить в дуршлаг и вымыть под проточной холодной водой. Удалить хвостики. Лимон тщательно промыть, нарезать небольшими дольками с кожурой, косточки удалить. Промыть пучок мяты, нарубить ножом листики и стебли и, уложив в миску, залить кипятком в 350 мл. Настоять 20 минут, процедить отвар через сито. Эту воду используем для приготовления сахарного сиропа: налить в кастрюлю, положить сахар, перемешать и поставить на огонь. Пусть закипит и сахар растворится.
Варенье лучше варить в большой кастрюле из нержавейки. Клубнику и лимон выкладываем туда, заливаем кипящим сиропом, накрываем крышкой и даём настояться варенью в течение шести часов. Далее ягоды нужно выбрать шумовкой в другую ёмкость. Клубничный сироп доводим до кипения и увариваем в течение восьми минут. Затем ягоды соединяем с сиропом и даём варенью настояться ещё шесть часов, затем доводим до кипения. В стерильные банки сначала нужно уложить ягоды, затем залить сиропом варенья и герметично закатать крыши.
Мне нравится этот рецепт, хоть с ним и приходится несколько повозиться, но целыми ягодами из варенья потом можно будет украшать десерты или добавлять в выпечку».
Салат с печеньем и фруктами
Ольга Попкова, город Бирск:
«Актуален в жаркий день, если вы собираете гостей или проводите детский праздник. Как говорится, дёшево и сердито, а главное — оригинально. Таким салатом кормят детвору многие мои знакомые мамочки, которые в своё время подглядели его на дне рождения моего сына».
Фото: АиФ/ Гюзель Ибрагимова
Ингредиенты: песочное печенье (лучше шоколадное), клубника — 1 кг, апельсины — 2 шт., сахар — 50 гр., морковь — 1 шт.
Способ приготовления: морковь трём на средней тёрке, выкладываем в тарелку и засыпаем сахаром. Перемешиваем. Апельсин режем кубиками, удаляя косточки. Высыпаем сверху и добавляем чуть-чуть корицы. Сверху украшаем клубникой и посыпаем толчёным или раскрошенным шоколадным печеньем.
«Во всем нужно знать меру»
Главный диетолог Минздрава Башкирии Рушания Ялалова:
«Отказаться от приготовления компотов, полакомиться приготовленным мамой или бабушкой любимым вареньем из ягод земляники или клубники, сложно. Да и нужно ли? Просто во всём нужно знать меру. Правда, хранить консервированные продукты домашнего изготовления можно только год.
При тепловой обработке антигенность овощей, фруктов и ягод снижается, а аллергические свойства продукта могут меняться в процессе приготовления пищи. Поэтому в сыром виде многие продукты переносятся даже хуже, чем после тепловой обработки. Но помните: при кулинарной обработке продуктов рекомендуется использовать герметичные крышки и сокращать сроки готовки.
Фрукты и ягоды являются важными составляющими составными частями пищевого рациона человека. Они имеют малую калорийность в связи с низким содержанием углеводов и отсутствием жира. Являются основным источником поступления витаминов С, P, каротина, нормализуют обмен веществ, предупреждают развитие ожирения, атеросклероза и сахарного диабета. Также оказывают благоприятное влияние на пищеварение за счёт наличия клетчатки и пектина в этих продуктах: возбуждают секреторную деятельность пищеварительных желёз и повышают двигательную функцию кишечника».
{-} (aq) \]
Это обратимая реакция. Небольшая часть молекул воды распадается с образованием ионов водорода и гидроксид-ионов. Некоторые из этих ионов водорода и гидроксида затем снова взаимодействуют вместе с образованием молекул воды.
Это называется равновесием и присутствует в воде и всех водных растворах.
В воде и нейтральных растворах концентрация ионов водорода равна концентрации гидроксид-ионов.
Все кислые растворы содержат больше ионов водорода, чем гидроксид-ионов.
Все щелочные растворы содержат больше гидроксид-ионов, чем ионов водорода.
Разбавление кислот и оснований
Добавление воды к кислоте или основанию изменит ее pH. Вода в основном состоит из молекул воды, поэтому добавление воды к кислоте или основанию снижает концентрацию ионов в растворе.
Когда кислый раствор разбавляется водой, концентрация ионов H + уменьшается, а pH раствора увеличивается до 7.
Чтобы изменить pH на 1, требуется десятикратное разбавление (например, добавление 9 см. 3 воды на 1 см 3 кислоты).Кислота становится менее кислой.
Аналогично, когда щелочь разбавляется водой, концентрация ионов OH — уменьшается. Это приводит к падению pH щелочи до 7, делая раствор менее щелочным при добавлении большего количества воды.
Урок по кислотам, щелочам и водным наукам
Одним из самых интересных разделов химии является изучение кислот и оснований. Это также очень практический аспект химии, поскольку мы используем кислоты и основания каждый день! Например, хотя слово «кислый», вероятно, не приходит в голову, когда вы откусываете помидор, на самом деле вы ощущаете кислый сок.Одна из характеристик кислот — кислый вкус. Основы же горькие на вкус. Кислый или горький вкус — это один из простых способов определить, являются ли еда или напитки кислыми или щелочными, хотя использовать вкусовой тест с другими продуктами небезопасно.
При растворении в воде кислоты отдают ионов водорода (H +) . Ионы водорода — это атомы водорода, которые потеряли электрон и теперь имеют только протон, что дает им положительный электрический заряд. Основания, с другой стороны, смешанные с водой дают гидроксид-ионов (OH-) .Если раствор имеет высокую концентрацию ионов H +, то он кислый. Если раствор имеет высокую концентрацию ионов ОН-, то он является основным.
Во многих кислотно-щелочных реакциях образующийся продукт представляет собой воду и соль. Если объединить соляную кислоту (HCL) и основной гидроксид натрия (NaOH), то получится H 2 O (вода) и NaCl (хлорид натрия, поваренная соль). Ионы H + в кислоте присоединяются и нейтрализуются ионами OH- основания с образованием H 2 O.
Одним из самых простых способов показать, как кислоты и основания взаимодействуют друг с другом (и продемонстрировать их различные свойства), является создание пищевой соды и уксуса «вулкана» . Чтобы вызвать сильную сыпь, используйте небольшую пластиковую бутылку (подойдут безалкогольные напитки объемом 20 унций). Наполните бутылку наполовину (от 1 до 1,5 стакана) уксусом. Чтобы вызвать сыпь, бросьте в бутылку «бомбу» из пищевой соды — оберните одну столовую ложку пищевой соды в небольшой кусочек папиросной бумаги, завязав концы ниткой.Вы должны увидеть мгновенное извержение! Пищевая сода нейтрализует кислоту в уксусе. При этом выделяется углекислый газ, который вызывает шипение в вашем вулкане. (Кислый раствор нейтрализуется при добавлении к нему основания, а щелочной раствор нейтрализуется добавлением кислоты.)
Для другого эксперимента с реакцией поместите таблетку Алка-Зельцера на дно канистры из прозрачной пластиковой пленки (такого типа, когда крышка помещается внутри, а не закрывается снаружи).Наполните канистру теплой водой, а затем быстро закройте крышку и наблюдайте за кислотно-щелочной реакцией!
Шкала pH используется для измерения количества ионов H + в растворе. Кислоты имеют pH ниже 7; основания имеют pH выше . Сильные кислоты имеют самый низкий уровень pH (0-4), а сильные основания — самые высокие уровни pH (10-14). Нейтральные растворы имеют pH 7, и они не являются ни кислыми, ни основными. Дистиллированная вода нейтральна, потому что ионы H + и OH- сбалансированы.
Litmus — природный кислотно-щелочной индикатор, получаемый из одного вида лишайников.Если у вас есть красная и синяя лакмусовая бумага, вы можете протестировать разные растворы на предмет кислотности или щелочности. Синяя лакмусовая бумажка становится красной , когда раствор кислый; красная лакмусовая бумажка превращается в синюю в в базовых решениях. Попробуйте протестировать средство для мытья окон, чистящее средство для унитаза, апельсиновый и яблочный сок — налейте немного каждого из них в отдельные пробирки, небольшие стаканы или баночки. Используйте лакмусовую бумажку, чтобы определить, какие кислоты, а какие — основания. Вот уровни pH некоторых других веществ, которые вы можете проверить: лимонного сока (2), уксуса (3), молока (6), яичных белков (8), пищевой соды (9) и аммиака (10).Кровь человека имеет идеальный pH 7,4; даже небольшие колебания могут серьезно повлиять на наш организм.
Вы также можете сделать свой собственный индикатор pH. — используйте блендер, чтобы смешать одну часть измельченной красной капусты с двумя частями кипящей воды и использовать сок для тестирования различных растворов. Кислоты превращают пигменты в индикаторе в красноватый цвет; основы сделают пигменты голубоватыми или желто-зелеными.
Урок естествознания: хорошая вода
Вода иногда может казаться простой и скучной, но у нее есть некоторые интересные физические свойства! Вода в точке замерзания весит около 62 фунтов на кубический фут; замерзает при 0 ° по Цельсию и закипает при 100 °; и составляет около 60% нашего тела и 83% нашей крови! Что касается того, на что она способна, то воду называют «универсальным растворителем », потому что она может растворять больше веществ, чем любая другая жидкость, даже самая сильная кислота.
Химический состав воды: H 2 O — два атома водорода и один кислород. То, как эти атомы соединяются вместе, образуя молекулу воды, придает воде особые свойства. Два атома H образуют слабые водородные связи с кислородом; они прикрепляются к вершине молекулы, как уши Микки Мауса.
Эта молекулярная структура придает молекуле воды полярность или однобокий электрический заряд, который притягивает другие атомы.Конец молекулы с двумя атомами H заряжен положительно. Другой конец, с кислородом, заряжен отрицательно. Так же, как в магните, где северные полюса притягиваются к южным полюсам (противоположности притягиваются), положительный конец молекулы воды будет соединяться с отрицательным концом других молекул.
Вода — единственное природное вещество, которое может существовать во всех трех состояниях материи — твердом, жидком и газообразном — при температурах, обычно встречающихся на Земле. Многие другие вещества необходимо перегреть или охладить, чтобы изменить состояние.Твердое состояние воды (то есть лед) менее плотное, чем жидкое состояние, поэтому лед плавает.
Вещества Polar легко растворяются в воде, «универсальном растворителе». Это потому, что один конец полярной молекулы заряжен более положительно, а один конец — более отрицательно. Положительно заряженный конец полярной молекулы будет притягиваться к отрицательно заряженному концу молекулы воды, и наоборот. Точно так же положительные ионы притягиваются к отрицательному концу молекулы воды и наоборот.Это молекулярное притяжение позволяет такому количеству веществ легко растворяться в воде — молекулы окружены молекулами воды. Масло и другие неполярные растворы не имеют положительно или отрицательно заряженных концов, поэтому молекулы воды будут притягиваться друг к другу, а не к маслу. Вот почему масло не смешивается с водой.
Выдающийся ученый: сэр Хамфри Дэви (1778-1829)
Дэви родился в графстве Корнуолл, Англия, 17 декабря 1778 года.Он получил там образование и стал учеником хирурга-аптекаря, когда умер его отец. Через несколько лет он переехал в Бристоль и стал суперинтендантом медицинского учреждения. В возрасте 22 лет он написал Researches, Chemical and Philosophical о своей работе по воздействию закиси азота (позже известной как веселящий газ). Он экспериментировал с газом, даже сам вдыхал его — одна из предполагаемых причин болезни, от которой он страдал к концу своей жизни.
Следующая его работа была в области электрохимии.Его использование электролиза (пропускание электрического тока через вещество, чтобы разбить его на части) привело его к правильному предположению о том, что элементы в соединении удерживаются вместе электрическими силами.
Дэви выделил элементы натрий, магний, калий, кальций, бор (вместе с Гей-Люссаком) и барий. Он также определил, что хлор является элементом, а не кислородным соединением, и дал ему свое название (от греческого слова «желто-зеленый»). Он экспериментировал с йодом, доказал, что алмазы образованы углеродом, и справедливо предположил, что кислоты содержат водород.В целом Дэви выделил больше элементов, чем любой другой химик до -го и века.
Хотя он был известен своими работами в области химии, Дэви был более известен своим изобретением безопасной шахтерской лампы. Метан в угольных шахтах взорвался бы при контакте с пламенем свечей, которые шахтеры использовали для освещения, что привело к гибели людей и ущербу. Дэви попросили найти решение. Он придумал дизайн лампы, которая окружала пламя тонкой проволочной сеткой. Некоторое количество света все еще могло светить, но вызванное пламенем только содержало взрывы в камере, где газ попал в лампу; марля не позволяла теплу пламени распространиться на внешние газы.Метод Дэви был использован в более поздних усовершенствованиях освещения шахт.
За свою жизнь Дэви был удостоен множества наград. Он был избран членом Королевского общества в 1803 году; два года спустя он получил престижную медаль Копли; а в 1820 году он был избран ее президентом. Кроме того, он получил награду от Наполеона Бонапарта, которого впечатлила его работа в области электрохимии. Он был посвящен в рыцари в 1812 году при принце-регенте (в то время как Георг III страдал от приступов безумия) и получил титул баронета.
Кислоты и Основания
Кислоты, основания и шкала pH
Термины кислота и основание описывают химические характеристики многих веществ, которые мы используем ежедневно. Кислые вещи кислые на вкус. Обычные или щелочные вещества имеют мыльный вкус. Сильные кислоты вызывают коррозию, а сильные основания — едкие; оба могут вызвать серьезное повреждение кожи, которое похоже на ожог. Однако слабые кислоты и основания обычны и относительно безвредны для нас.Что делает вещество кислым или основным? Следующее уравнение — хорошее место для начала:
2 H 2 O & Равновесие; 1 H 3 O + + 1 OH —
Начнем с двух молекул воды и переместим несколько атомов водорода. Одна молекула воды приобретает водород и, следовательно, принимает положительный заряд, в то время как другая молекула воды теряет атом водорода и, следовательно, становится отрицательно заряженной. H 3 O + называется ионом гидроксония, и он делает вещи кислыми.OH — называется гидроксил-ионом, и он делает вещи основными. Однако в воде существует баланс между гидроксониями и гидроксилами, поэтому они нейтрализуют заряды друг друга. Чистая вода не является ни кислой, ни щелочной; он нейтрален.
Так как же что-то становится кислым или щелочным? Это происходит, когда гидроксоний и гидроксилы не сбалансированы. Если положительно заряженных гидроксониев больше, чем отрицательно заряженных гидроксилов, то вещество кислое. Если отрицательно заряженных гидроксилов больше, чем положительно заряженных гидроксониев, то вещество становится основным.pH фактически означает «потенциал (или мощность) водорода».
Примечание : Иногда люди пишут H + как сокращение для H 3 O + , и это может вызвать путаницу, потому что иногда, когда люди пишут H + , они действительно имеют в виду только H + и не H 3 O + . Следите за этим и попросите разъяснений!
Когда мы растворяем кислоты в воде, мы создаем избыток гидроксония.Когда мы растворяем основания в воде, мы создаем избыток гидроксилов. Вот два примера. Уксус, слабая кислота, имеет химическую формулу CH 3 COOH. При растворении в воде он превращается в CH 3 COO — и H + . Ионы H + объединяются с молекулами воды с образованием H 3 O + , поэтому раствор становится кислым. Теперь давайте посмотрим на щелок, сильное основание с химической формулой NaOH (гидроксид натрия). Если мы добавим NaOH в воду, он диссоциирует на Na + и OH — .Натрий не делает ничего важного, но гидроксилы делают раствор более щелочным.
Последний вопрос: почему сильные кислоты и сильные основания такие противные? Это потому, что они не сбалансированы. У них либо слишком много положительных зарядов, и они ищут отрицательные, чтобы восстановить баланс, либо у них слишком много отрицательных зарядов, и они ищут положительные, чтобы восстановить баланс. Это заставляет их очень быстро реагировать на все, с чем они контактируют. Когда положительные и отрицательные стороны равны, они нейтрализуют друг друга.
Что такое pH ?: pH — это шкала, по которой мы измеряем силу кислот и оснований. pH обозначает потенциал водорода и является приблизительно отрицательным значением логарифма молярной концентрации ионов водорода по основанию 10, поэтому pH = -log 10 [H + ]
Шкала pH — это показатель кислотности по 14-балльной шкале, где 7 — нейтральная средняя точка. pH представляет собой логарифмическую шкалу (как шкала Рихтера для землетрясений), поэтому pH 4 в 10 раз более кислый, чем pH 5, и в 100 раз более кислый, чем pH 6.Вы можете купить электронные pH-метры или pH-индикаторную бумагу в любой биологической или лабораторной компании, которая может быть использована для точного измерения кислотного или основного качества веществ, которые вы хотите проверить. Попробуйте это моделирование, чтобы определить pH некоторых распространенных веществ.
Дополнительный мини-эксперимент : Сделайте свой собственный индикатор pH, используя сок красной капусты. Смешайте 2 стакана нарезанных листьев красной капусты и 1 стакан воды в кухонном комбайне или электрическом блендере, пока кусочки не станут крошечными и однородными.Процедите твердые частицы и оставьте жидкость. Если у вас нет блендера, вы также можете крупно нарезать капусту и варить ее в воде около 5 минут, пока жидкость не станет темно-фиолетовой. Эта фиолетовая жидкость изменит цвет в зависимости от кислотности или щелочности веществ, которые вы хотите проверить. Добавьте около 10 капустного сока примерно к 1 столовой ложке исследуемого вещества. Какого цвета капустный сок превращается в кислоту, такую как белый уксус? Какого цвета капустный сок превращается в основу, такую как пищевая сода и водный раствор?
Проверьте pH различных веществ и создайте соответствующую цветовую шкалу pH.Сравните свои результаты с диаграммой здесь.
Вы также можете сделать индикаторную бумагу, окунув полоски белого бумажного полотенца, кофейные фильтры или белую плотную бумагу в капустный сок, пока они не станут фиолетовыми. Когда фиолетовые полоски высохнут, используйте зубочистку, соломинку для соды или пипетку, чтобы нанести на полоски каплю тестового раствора. Как результаты соотносятся с вашей диаграммой pH?
Вода, кислоты и основания
Вода,
Кислоты и основания
Кислотно-основная химия
воды
В химии водных растворов преобладают
равновесие между нейтральными молекулами воды и ионами, которые они
форма.
2 H 2 O ( л )
H 3 O + ( водн. ) + OH — ( водн. )
Строгое соблюдение правил записи равновесия
постоянные выражения этой реакции дают следующие
результат.
Это законное выражение константы равновесия, но оно
не учитывает огромную разницу между
концентрации нейтральных молекул H 2 O и H 3 O +
и ионы OH — в равновесии.
Измерения способности воды проводить электрический ток.
В настоящее время предполагается, что чистая вода при температуре 25 o C содержит 1,0 x
10 -7 моль на литр каждого из этих ионов.
[H 3 O + ] =
[OH — ] = 1,0 x 10 -7 M
При той же температуре концентрация нейтрального H 2 O
молекул составляет 55,35 моль.
Соотношение концентраций H + (или OH — )
ион до концентрации нейтральных молекул H 2 O
следовательно, 1.8 х 10 -9 .
Другими словами, только около 2 частей на миллиард (ppb)
молекулы воды диссоциируют на ионы при комнатной температуре.
Равновесная концентрация молекул H 2 O составляет
намного больше, чем концентрации H 3 O +
и ионов OH — , что он эффективно постоянен. Мы
поэтому поместите член [H 2 O] в равновесие
постоянна для реакции и тем самым значительно упрощает
расчет равновесия.Начнем с перестановки равновесия
постоянное выражение для диссоциации воды, чтобы дать
следующее уравнение.
[H 3 O + ] [OH — ] = K c
x [H 2 O] 2
Затем заменим член в правой части этого уравнения
с константой, известной как водная диссоциация
константа равновесия , K w .
[H 3 O + ] [OH — ] = K w
В чистой воде при 25 ° C [H 3 O + ] и
Концентрация ионов [OH — ] составляет 1,0 x 10 -7 M .
Таким образом, значение K w при 25 ° C составляет
1,0 x 10 -14 .
| [1,0 x 10 -7 ] [1,0 x 10 -7 ] | = | 1.0 х 10 -14 | (при 25 ° C) |
Хотя K w определяется в терминах
диссоциации воды, это выражение константы равновесия
одинаково справедливо для растворов кислот и оснований, растворенных в
вода. Независимо от источника H 3 O +
и ионов OH — в воде, продукте
концентрация этих ионов в равновесии при 25 ° C всегда
1.0 x 10 -14 .
Сильные кислоты и
H 3 O +
и ОН —
Концентрации ионов
Предположим, мы добавляем достаточно сильной кислоты в стакан с водой, чтобы
увеличить концентрацию ионов H 3 O + до 0.010 М .
Согласно принципу Ле-Шателье, это должно стимулировать
равновесие между водой и ее ионами слева, уменьшая
количество ионов H 3 O + и OH — в
решение.
2 H 2 O ( л )
H 3 O + ( водн. ) + OH — ( водн. )
Потому что так много ионов H 3 O + в
в этом растворе изменение концентрации этого иона слишком велико.
маленький, чтобы заметить.Когда система возвращается в состояние равновесия, H 3 O +
концентрация ионов по-прежнему составляет около 0,010 M . Более того,
когда реакция возвращается к равновесию, продукт H 3 O +
и концентрации ионов OH — снова равны K w .
[H 3 O + ] [OH — ] =
1 х 10 -14
Таким образом, раствор возвращается к равновесию, когда
диссоциация воды настолько мала, что ион OH —
концентрация всего 1.0 x 10 -12 M .
Таким образом, добавление кислоты в воду влияет на
концентрация как H 3 O + , так и OH —
ионы. Поскольку это источник этого иона, добавление кислоты в воду
увеличивает концентрацию H 3 O +
ион. Однако добавление кислоты к воде снижает степень
вода диссоциирует. Следовательно, это приводит к значительному
снижение концентрации иона ОН — .
Как и следовало ожидать, обратный эффект наблюдается, когда
основание добавляется в воду. Поскольку мы добавляем базу, OH —
концентрация ионов увеличивается. Как только система вернется к
равновесие, продукт H 3 O + и OH —
концентрация ионов снова равна K w .
Разумеется, единственный способ добиться этого — уменьшить
концентрация иона H 3 O + .
Что происходит при сочетании кислоты и основания?
У химиков есть три отдельные теории относительно того, что представляет собой кислота и основание, но нет разногласий в том, что они нейтрализуют друг друга. Когда они соединяются в водном растворе, они производят соль. Кислоты и основания могут сочетаться и другими способами, и когда это происходит, продукт не всегда является солью. Например, когда вы добавляете цинк к аммиаку, в результате реакции образуется комплексный ион. До появления теории кислот и оснований Льюиса это даже не считалось кислотно-основной реакцией.
TL; DR (слишком долго; не читал)
В водных растворах кислоты и основания объединяются, чтобы нейтрализовать друг друга и образовать соль. Кислотно-основные реакции, которые не происходят в воде, обычно также приводят к образованию солей, но они также могут давать комплексные ионы.
Кислоты Донат H +; Базы жертвуют OH-
Согласно теории, выдвинутой Сванте Аррениусом. физик и химик, лауреат Нобелевской премии, кислота в растворе отдает ион H + в воде. Ионы не плавают свободно, а вместо этого присоединяются к молекулам воды, образуя ионы гидроксония (H 3 O + ).PH раствора, который относится к «силе водорода», является мерой количества присутствующих ионов. pH — это отрицательный логарифм концентрации, поэтому чем ниже pH, тем выше концентрация этих ионов и тем кислотнее раствор. С другой стороны, основания отдают ионы гидроксида (OH — ). Когда в растворе преобладают гидроксид-ионы, его pH выше 7 (нейтральная точка) и раствор является щелочным. Кислоты и основания, которые ведут себя таким образом, известны как кислоты и основания Аррениуса.Хлористый водород (HCl) является примером кислоты Аррениуса, а гидроксид натрия (NaOH) является основанием Аррениуса.
Аррениусовы кислоты и основания объединяются с образованием солей
Когда вы объединяете аррениусовую кислоту и основание в одном растворе, положительно заряженные ионы гидроксония объединяются с ионами гидроксида с образованием воды, а оставшиеся ионы объединяются с образованием соли. Если все доступные ионы объединяются таким образом, раствор становится pH-нейтральным, что означает, что кислота и основание нейтрализуют друг друга.Самый известный пример — растворение хлористого водорода и гидроксида натрия в растворе с образованием свободных ионов натрия (Na + ) и хлорида (Cl — ). Они объединяются в NaCl или обычную поваренную соль. Этот процесс называется гидролизом.
Брёнстед-Лоури обобщает кислотно-щелочную реакцию
Пара химиков, Йоханнес Николаус Бронстед и Томас Мартин Лоури, независимо друг от друга представили более обобщенную концепцию кислот и оснований в 1923 году. В их теории кислота — это соединение, которое жертвует протон (H + ), а основание — это соединение, которое его принимает.Эта концепция расширяет определение Аррениуса, чтобы учесть кислотно-основные реакции, которые не происходят в водном растворе. Например, согласно определению Бренстеда-Лоури, реакция между аммиаком и хлористым водородом с образованием соли хлорида аммония является кислотно-щелочной реакцией, которая не включает обмен ионов гидроксония или гидроксида. Согласно определению Аррениуса, это не считается кислотно-щелочной реакцией. Кислотно-основные реакции Бренстеда-Лоури не всегда производят воду, но они все же дают соли.
Льюис обобщает еще больше
Также в 1923 году Г. Льюис из Калифорнийского университета в Беркли изменил определение кислот и оснований, чтобы учесть реакции, которые нельзя было объяснить с помощью концепции Бренстеда-Лоури. В теории Льюиса основания являются донорами электронных пар, а кислоты — акцепторами электронных пар. Эта концепция помогает объяснить реакции, которые происходят не только между твердыми телами и жидкостями, но и газами, как кислотно-основные реакции. Согласно этой теории, продукт реакции не может быть солью.Например, реакция между ионами цинка и аммиаком дает тетраамминцинк, комплексный ион.
Zn 2+ + 4NH 3 → [Zn (NH 3 ) 4 ] 4+ .
Что происходит при смешивании кислот и оснований?
Что происходит?
pH — это показатель кислотности или щелочности раствора. Как показано на изображении выше, различные количества кислот и оснований в растворах будут давать разный цвет при воздействии на индикатор.Сок краснокочанной капусты — это отличный и легкий в употреблении индикаторный раствор, который показывает различные цвета в широком диапазоне pH. Индикатор станет красновато-розовым в присутствии кислоты, зеленовато-желтым в присутствии основания и синим в присутствии нейтрального раствора.
Когда кислоты и основания смешиваются в нужных количествах, они реагируют вместе с образованием нового вещества с нейтральным pH. Добавление молока магнезии к уксусу должно показать изменение цвета с розового на синий, а затем на зеленый по мере того, как основа становится в избытке (т.е. когда присутствует больше основания, чем кислоты). Точно так же при добавлении уксуса в «Молоко магнезии» цвет должен измениться с зеленого на синий, а затем на розовый, поскольку кислота добавляется в избытке.
Как вы думаете, что происходит, когда кислота и основание смешиваются вместе?
Что происходит?
pH — это показатель кислотности или щелочности раствора. Как показано на изображении выше, различные количества кислот и оснований в растворах будут давать разный цвет при воздействии на индикатор.Сок краснокочанной капусты — это отличный и легкий в употреблении индикаторный раствор, который показывает различные цвета в широком диапазоне pH. Индикатор станет красновато-розовым в присутствии кислоты, зеленовато-желтым в присутствии основания и синим в присутствии нейтрального раствора.
Когда кислоты и основания смешиваются в нужных количествах, они реагируют вместе с образованием нового вещества с нейтральным pH. Добавление молока магнезии к уксусу должно показать изменение цвета с розового на синий, а затем на зеленый по мере того, как основа становится в избытке (т.е. когда присутствует больше основания, чем кислоты). Точно так же при добавлении уксуса в «Молоко магнезии» цвет должен измениться с зеленого на синий, а затем на розовый, поскольку кислота добавляется в избытке.
Как вы думаете, что происходит, когда кислота и основание смешиваются вместе?
Почему это важно?
Кислотно-основные реакции — очень распространенные химические реакции, которые используются каждый день для выполнения множества функций. Индикаторы — это растворы пигментов, которые вступают в реакцию с растворами кислот и / или оснований и меняют цвет.Индикаторы очень полезны для измерения pH (показателя кислотности), вызванного присутствием в растворе определенных химических веществ. Например, pH бассейна проверяется с помощью индикаторов. Слишком кислая или щелочная вода может повредить наши глаза, поэтому операторы бассейнов должны следить за тем, чтобы хлорированная вода в бассейне была безопасной для наших глаз. Эти индикаторы pH могут быть жидкостями, которые добавляются к пробе воды, или они могут быть помещены в полоски бумаги, которые окунаются в воду. Полученный цвет, который появляется на тест-полоске или в образце воды, затем сравнивается со стандартной цветовой диаграммой, которая сообщает вам, какой pH представляет цвет.
Многие обычные бытовые вещества являются кислотами или основаниями, как и многие продукты, которые мы едим. В пищевых продуктах количество кислоты / основания влияет на вкус пищи, в том числе на то, какие продукты вместе вкусны. Кислые продукты содержат кислоты; горькие на вкус часто содержат основания. Основой являются многие бытовые чистящие средства, мыло, шампунь, средства для стирки, отбеливатель и т. Д. Многие думают, что кислоты более опасны, чем основания, хотя на самом деле оба они одинаково опасны в концентрированной форме. Многие бытовые чистящие средства могут вызвать ожоги кожи и повредить одежду, и с ними следует обращаться осторожно.Обычно самая сильная кислота, встречающаяся в доме, — это уксус. Хотя сам по себе он не опасен, он будет ужален, если попадет в порезы, царапины или вам в глаза. Однако длительное воздействие даже слабой кислоты, такой как уксус, может повредить кожу и привести к образованию волдырей и повреждений.
Почему это важно?
Кислотно-основные реакции — очень распространенные химические реакции, которые используются каждый день для выполнения множества функций. Индикаторы — это растворы пигментов, которые вступают в реакцию с растворами кислот и / или оснований и меняют цвет.Индикаторы очень полезны для измерения pH (показателя кислотности), вызванного присутствием в растворе определенных химических веществ. Например, pH бассейна проверяется с помощью индикаторов. Слишком кислая или щелочная вода может повредить наши глаза, поэтому операторы бассейнов должны следить за тем, чтобы хлорированная вода в бассейне была безопасной для наших глаз. Эти индикаторы pH могут быть жидкостями, которые добавляются к пробе воды, или они могут быть помещены в полоски бумаги, которые окунаются в воду. Полученный цвет, который появляется на тест-полоске или в образце воды, затем сравнивается со стандартной цветовой диаграммой, которая сообщает вам, какой pH представляет цвет.
Многие обычные бытовые вещества являются кислотами или основаниями, как и многие продукты, которые мы едим. В пищевых продуктах количество кислоты / основания влияет на вкус пищи, в том числе на то, какие продукты вместе вкусны. Кислые продукты содержат кислоты; горькие на вкус часто содержат основания. Основой являются многие бытовые чистящие средства, мыло, шампунь, средства для стирки, отбеливатель и т. Д. Многие думают, что кислоты более опасны, чем основания, хотя на самом деле оба они одинаково опасны в концентрированной форме. Многие бытовые чистящие средства могут вызвать ожоги кожи и повредить одежду, и с ними следует обращаться осторожно.Обычно самая сильная кислота, встречающаяся в доме, — это уксус. Хотя сам по себе он не опасен, он будет ужален, если попадет в порезы, царапины или вам в глаза. Однако длительное воздействие даже слабой кислоты, такой как уксус, может повредить кожу и привести к образованию волдырей и повреждений.
Дальнейшие исследования
- Повторите эксперимент, используя другие жидкости, такие как яблочный сок, апельсиновый сок, другие фруктовые соки, безалкогольные напитки или газированные напитки.
- Что произойдет, если вы добавите в эти жидкости индикатор краснокочанной капусты? Что он говорит вам о составе фруктовых соков и недиетических безалкогольных напитков? Почему важно регулярно чистить зубы, если вы пьете эти жидкости?
- Проверьте другие обычные бытовые жидкости и продукты, чтобы определить, являются ли они кислотами или щелочами.ВНИМАНИЕ: бытовые чистящие средства опасны и должны проверяться только взрослыми.
Для получения дополнительной информации по этой теме ознакомьтесь с этими ресурсами Let’s Talk Science:
- Как писать секретные сообщения? (Практические занятия) — Узнайте, как писать и раскрывать секретные сообщения в этом практическом занятии по химии.
- Что такое кислотный дождь? (STEM в контексте) — Кислотный дождь — это любые осадки с необычно низким pH. Это может быть дождь, снег, туман и т. Д. Но что такое низкий pH и почему это проблема?
Дальнейшие исследования
- Повторите эксперимент, используя другие жидкости, такие как яблочный сок, апельсиновый сок, другие фруктовые соки, безалкогольные напитки или газированные напитки.
- Что произойдет, если вы добавите в эти жидкости индикатор краснокочанной капусты? Что он говорит вам о составе фруктовых соков и недиетических безалкогольных напитков? Почему важно регулярно чистить зубы, если вы пьете эти жидкости?
- Проверьте другие обычные бытовые жидкости и продукты, чтобы определить, являются ли они кислотами или щелочами. ВНИМАНИЕ: бытовые чистящие средства опасны и должны проверяться только взрослыми.
Для получения дополнительной информации по этой теме ознакомьтесь с этими ресурсами Let’s Talk Science:
- Как писать секретные сообщения? (Практические занятия) — Узнайте, как писать и раскрывать секретные сообщения в этом практическом занятии по химии.
- Что такое кислотный дождь? (STEM в контексте) — Кислотный дождь — это любые осадки с необычно низким pH. Это может быть дождь, снег, туман и т. Д. Но что такое низкий pH и почему это проблема?
СИЛЬНЫЕ И СЛАБЫЕ КИСЛОТЫ На этой странице объясняются термины «сильный» и «слабый» применительно к кислотам. В рамках этого он определяет и объясняет, что подразумевается под pH, K a и pK a . Важно, чтобы вы не путали слова сильный и слабый с терминами концентрированный и разбавленный . Как вы увидите ниже, сила кислоты зависит от ее доли, которая прореагировала с водой с образованием ионов. Концентрация говорит вам о том, сколько исходной кислоты растворено в растворе. Совершенно возможно получить концентрированный раствор слабой кислоты или разбавленный раствор сильной кислоты.Читать дальше . . . Сильные кислоты Объяснение термина «сильная кислота» Мы собираемся использовать определение кислоты Бренстеда-Лоури. | ||||||||||||||||||||||||
Примечание: Если вы не знаете, что такое теория кислот Бренстеда-Лоури, вам следует прочитать о теориях кислот и оснований на другой странице этого раздела. Вам не нужно тратить время на чтение кислот и оснований Льюиса для целей данной страницы. Используйте кнопку НАЗАД в браузере, когда будете готовы вернуться на эту страницу. | ||||||||||||||||||||||||
Когда кислота растворяется в воде, протон (ион водорода) передается молекуле воды с образованием иона гидроксония и отрицательного иона в зависимости от того, с какой кислоты вы начинаете. В общем случае. . . Все эти реакции обратимы, но в некоторых случаях кислота настолько хорошо выделяет ионы водорода, что мы можем рассматривать реакцию как одностороннюю.Кислота ионизирована практически на 100%. Например, когда хлористый водород растворяется в воде с образованием соляной кислоты, обратная реакция происходит так мало, что мы можем написать: В любой момент времени практически 100% хлористого водорода прореагирует с образованием ионов гидроксония и хлорид-ионов. Хлористый водород описывается как сильная кислота . Сильная кислота — это кислота, ионизированная практически на 100% в растворе. К другим распространенным сильным кислотам относятся серная и азотная кислоты. Вы можете найти уравнение ионизации, записанное в упрощенной форме: Это показывает, что хлористый водород, растворенный при расщеплении воды, дает ионы водорода в растворе и ионы хлорида в растворе. Эта версия часто используется в этой работе, чтобы все выглядело проще. Если вы его используете, помните, что на самом деле участвует вода и что когда вы пишете H + (водн.) , вы на самом деле имеете в виду ион гидроксония, H 3 O + . | ||||||||||||||||||||||||
Примечание: Вы должны выяснить, что ваши экзаменаторы предпочитают по этому поводу. Вы вряд ли найдете это в своей программе, но вам следует посмотреть последние экзаменационные работы и схемы оценок. Если вы сдаете экзамен в Великобритании и у вас нет копий учебной программы и прошлых работ, вам следует их иметь! Перейдите по этой ссылке, чтобы узнать, как их получить. | ||||||||||||||||||||||||
Сильные кислоты и pH pH — это мера концентрации ионов водорода в растворе.Сильные кислоты, такие как соляная кислота, в концентрациях, которые вы обычно используете в лаборатории, имеют pH от 0 до 1. Чем ниже pH, тем выше концентрация ионов водорода в растворе. Определение pH | ||||||||||||||||||||||||
Примечание: Если вас попросят определить pH во время экзамена, просто запишите это выражение черным цветом. Никогда. не пытайтесь определить это словами — это пустая трата времени, и вы, скорее всего, что-то пропустите (например, упоминание о том, что концентрация должна быть в моль дм -3 ).В приведенном выше выражении квадратные скобки означают это, поэтому вам не нужно об этом упоминать. | ||||||||||||||||||||||||
Определение pH сильной кислоты Предположим, вам нужно было вычислить pH 0,1 моль дм -3 соляной кислоты. Все, что вам нужно сделать, это определить концентрацию ионов водорода в растворе, а затем с помощью калькулятора преобразовать ее в значение pH. С сильными кислотами это просто. Соляная кислота — сильная кислота, ионизированная практически на 100%. Каждый моль HCl реагирует с водой с образованием 1 моль ионов водорода и 1 моль хлорид-ионов Это означает, что если концентрация кислоты составляет 0,1 моль дм -3 , то концентрация ионов водорода также составляет 0,1 моль дм -3 . Используйте свой калькулятор, чтобы преобразовать это значение в pH. Мой калькулятор требует, чтобы я ввел 0,1, а затем нажал кнопку «журнал». Возможно, вам захочется, чтобы вы делали это в другом порядке.Тебе нужно узнать! журнал 10 [0,1] = -1 Но pH = — log 10 [0,1] — (-1) = 1 pH этой кислоты 1. | ||||||||||||||||||||||||
Примечание: Если вы хотите увидеть больше примеров и попробовать себя (с приведенными полностью отработанными решениями), вас может заинтересовать моя книга расчетов по химии. Это также включает в себя немного более запутанную проблему преобразования pH обратно в концентрацию ионов водорода. | ||||||||||||||||||||||||
Слабые кислоты Объяснение термина «слабая кислота» Слабая кислота — это кислота, которая не полностью ионизируется при растворении в воде. Этановая кислота — типичная слабая кислота. Он реагирует с водой с образованием ионов гидроксония и этаноат-ионов, но обратная реакция более успешна, чем прямая. Ионы очень легко реагируют с преобразованием кислоты и воды. В любой момент времени только около 1% молекул этановой кислоты преобразовались в ионы.Остальные остаются в виде простых молекул этановой кислоты. Большинство органических кислот слабые. Фтористый водород (растворяется в воде с образованием плавиковой кислоты) — это слабая неорганическая кислота, которую вы можете встретить в других местах. | ||||||||||||||||||||||||
Примечание: Если вы заинтересованы в дальнейшем изучении органических кислот, вы найдете их объяснения в другом месте на сайте. Тем не менее, было бы неплохо сначала прочитать оставшуюся часть этой страницы. Если вы хотите узнать, почему фтороводород является слабой кислотой, вы можете узнать, перейдя по этой ссылке. Эти страницы находятся в совершенно разных частях этого сайта. Если вы перейдете по любой ссылке, используйте кнопку НАЗАД, чтобы вернуться на эту текущую страницу. | ||||||||||||||||||||||||
Сравнение сильных сторон слабых кислот Положение равновесия реакции между кислотой и водой варьируется от одной слабой кислоты к другой. Чем левее он лежит, тем слабее кислота. | ||||||||||||||||||||||||
Примечание: Если вы не понимаете положение равновесия, пройдите по этой ссылке, прежде чем идти дальше. Вам также необходимо знать константы равновесия, K c для однородных равновесий. Нет смысла читать эту страницу, если вы этого не сделаете! Если вы перейдете по любой ссылке, используйте кнопку НАЗАД, чтобы вернуться на эту текущую страницу. | ||||||||||||||||||||||||
Константа диссоциации кислоты, К а Вы можете измерить положение равновесия, написав константу равновесия для реакции.Чем ниже значение константы, тем левее положение равновесия. Диссоциация (ионизация) кислоты является примером гомогенной реакции. Все присутствует в одной и той же фазе — в данном случае в растворе в воде. Поэтому вы можете написать простое выражение для константы равновесия, K c . Вот опять равновесие: Вы могли бы ожидать, что константа равновесия будет записана как: Однако, если вдуматься, в этом есть что-то странное. Внизу выражения находится термин, обозначающий концентрацию воды в растворе. Это не проблема — за исключением того, что число будет очень большим по сравнению со всеми другими числами. В 1 дм 3 раствора должно быть около 55 молей воды. | ||||||||||||||||||||||||
Примечание: 1 моль воды весит 18 г. 1 дм 3 раствора содержит примерно 1000 г воды. Разделите 1000 на 18, чтобы получить примерно 55. | ||||||||||||||||||||||||
Если у вас была слабая кислота с концентрацией около 1 моль дм -3 , и только около 1% ее прореагировало с водой, количество молей воды упадет только примерно на 0,01. Другими словами, если кислота слабая, концентрация воды практически постоянна. В этом случае нет особого смысла включать его в выражение, как если бы это была переменная. Вместо этого определяется новая константа равновесия, которая не учитывает ее.Эта новая константа равновесия называется K a . Вы можете найти выражение K a , написанное иначе, если будете работать с упрощенной версией равновесной реакции: Это может быть написано с государственными символами или без них. На самом деле это то же самое, что и предыдущее выражение для K a ! Помните, что, хотя мы часто пишем H + для ионов водорода в растворе, на самом деле мы говорим об ионах гидроксония. Эта вторая версия выражения K a не так точна, как первая, но ваши экзаменаторы вполне могут с ней согласиться. Выяснить! Чтобы взять конкретный общий пример, равновесие диссоциации этановой кислоты правильно записывается как: Выражение K a : Если вы используете более простую версию равновесия. . . .. . выражение K a : | ||||||||||||||||||||||||
Примечание: Поскольку вы, вероятно, встретите обе эти версии в зависимости от того, где вы читаете о K a , вам будет разумно привыкнуть к использованию любой из них. Однако для целей экзамена используйте то, что предпочитают ваши экзаменаторы. | ||||||||||||||||||||||||
В таблице приведены некоторые значения K a для некоторых простых кислот:
Это все слабые кислоты, потому что значения K a очень малы. Они перечислены в порядке уменьшения силы кислоты — значения K и становятся меньше по мере того, как вы спускаетесь по таблице. Однако, если вы не очень довольны числами, это не сразу очевидно.Поскольку числа состоят из двух частей, слишком много, чтобы быстро подумать! Чтобы избежать этого, числа часто преобразуются в новую, более простую форму, называемую pK a . Введение в pK a pK a имеет точно такое же отношение к K a , как pH к концентрации ионов водорода: Если вы используете свой калькулятор для всех значений K и в таблице выше и конвертируете их в значения pK и , вы получите:
| ||||||||||||||||||||||||
Примечание: Обратите внимание, что в отличие от K a , pK a не имеет единиц измерения. | ||||||||||||||||||||||||
Обратите внимание, что чем слабее кислота, тем больше значение pK a .Теперь легко увидеть тенденцию к более слабым кислотам по мере того, как вы идете вниз по таблице. Запомните это:
| ||||||||||||||||||||||||
Примечание: Если вам нужно знать о K a и pK a , вам, скорее всего, потребуется уметь проводить с ними вычисления. | ||||||||||||||||||||||||


