Содержание
Оксиды кислотные — Справочник химика 21
Оксиды кислотные — оксиды, которым соответствуют кислоты. [c.375]
Оксиды кислотные, основные и амфотерные 65. [c.187]
Периодичность изменения химических свойств элементов на примере их бинарных соединений с водородо.м и оксидов. Кислотные, основные и амфотерные свойства. [c.302]
Основной оксид Кислотный оксид [c.70]
Оксиды. Группы оксидов кислотные и основные. Номенклатура и химические свойства. [c.91]
Амфотерный оксид + Кислотный оксид = Соль Например [c.251]
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на оснбвные, кислотные и амфотерные. Оснбвные оксиды образуют соли при взаимодействии с кислотами или кисл/отными оксидами. Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами. [c.26]
Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами. [c.26]
Кислотные оксиды Кислотный, Амфотерный Основной (ангидриды кислот) отчасти амфо- оксид оксид [c.456]
Основный оксид + Кислотный оксид = Соль [c.249]
Известно, что в каждой паре кислотный оксид/кислотный гидроксид степень окисления кислотообразующего элемента одна и та же. Составьте соответствующие пары из следующих наборов оксидов и гидроксидов [c.9]
Основный оксид Амфотерный оксид Кислотный оксид [c.319]
Оксиды азота 1) и (II) — ЫгО и N0 — являются нейтральными, у других оксидов кислотные свойства усиливаются с возрастанием степени окисления [c.471]
Комм. К какому типу оксидов (кислотным, основным или амфотерным) относится оксид ванадия(У) Дайте характеристику его окислительно-восстановительных свойств. При ответе используйте результаты опыта Пз и справочные данные. [c.242]
[c.242]
Деление оксидов на оснбвные и кислотные базируется на их собственном отношении к кислотам и щелочам, а также на свойствах соответствующих им гидроксидов. Большая группа оксидов по этим признакам относится к амфотер-ным. Элементы, образующие амфотерные оксиды, характеризуются средними значениями ОЭО в пределах 1,4 — 1,8 и степенями окисления (+2) — (+4). Если при степени окисления +2, +3 электроотрицательность менее 1,4, то оксиды (й отвечающие им гидроксиды) обладают оснбвными свойствами. Так, ОЭО [Са(+2)] составляет 1,0, ОЭО лантаноидов [Ьп (+3)] равна 1,2 — 1,3. Если при степени окисления +4 электроотрицательность элемента больше 1,8, оксид обладает кислотными свойствами. Например, ОЭО С(+4), 81(+4), Се(+4) равны соответственно 2,6, 1,9 и 2,0. Если электроотрицательность элемента находится в пределах 1,4 — 1,8 или даже несколько превышает этот интервал, а степень окисления + 1, оксид принадлежит к оснбвным (у Ag ОЭО 1,9). Когда же степени окисления элементов превышают +4 и значения ОЭО высоки, соответствующие оксиды кислотные.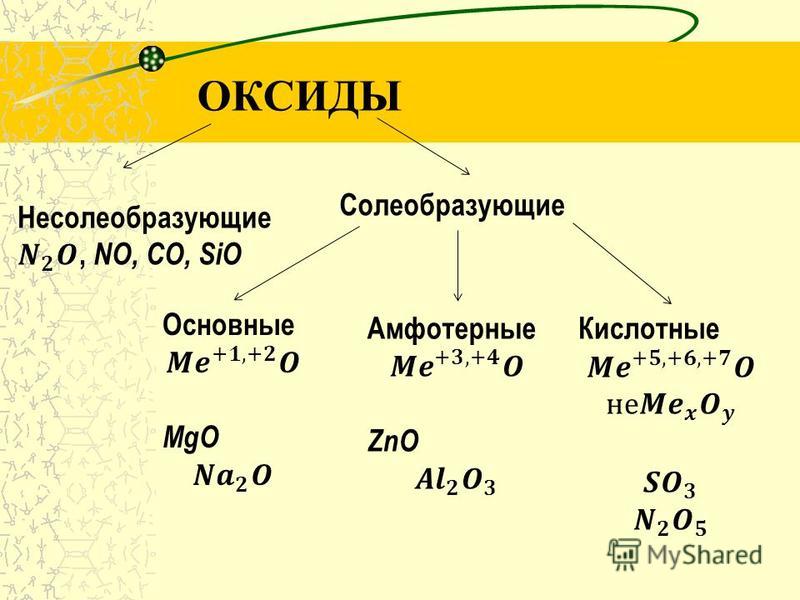 [c.267]
[c.267]
Среди катализаторов имеются металлы, оксиды, кислотные катализаторы, в том числе цеолиты, больше всего Ре-содержащих систем. Предполагают, что кислород в железооксидных системах имеет особые свойства, облегчающие отщепление атомов водорода и образование радикалов СН3. [c.602]
Свойства стекла зависят от природы и количественного соотношения оксидов. Кислотные оксиды придают стеклу высокую механическую, термическую и химическую стойкость. Оксиды щелочных металлов снижают вязкость расплавленного стекла, механическую и химическую стойкость, твердость наоборот, оксиды щелочноземельных металлов повышают вязкость и химическую стойкость. Наиболее широко применяют стекла, в состав которых входят только оксиды натрия, кальция, магния и кремния. Введение оксида калия вместо оксида натрия, а также оксида свинца вместо оксидов кальция и магния придает стеклу блеск и большую прозрачность, увеличивает коэффициент преломления (хрусталь и оптические стекла). В стекле для химической посуды снижают содержание оксидов щелочных металлов и заменяют частично оксид кремния на оксид бора и оксид алюминия, что повышает химическую и термическую стойкость. [c.108]
В стекле для химической посуды снижают содержание оксидов щелочных металлов и заменяют частично оксид кремния на оксид бора и оксид алюминия, что повышает химическую и термическую стойкость. [c.108]
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на основные, кислотные и амфотерные. Основные оксиды образуют соли при взаимодействии с кислотами или кислотными оксидами. Кислотные оксиды образуют соль при взаимодействии с основаниями или основными оксидами. Амфотерные оксиды образуют соли при взаимодействии как с кислотами или кислотными оксидами, так и с основаниями или основными оксидами. [c.23]
Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые оксиды (кислотные) образуют соли только в реакциях со щелочами или [c.54]
Как видно из табл. 25, низшие оксиды марганца тугоплавки и нелетучи, тогда как его высшие оксиды, наоборот, легкоплавки и летучи.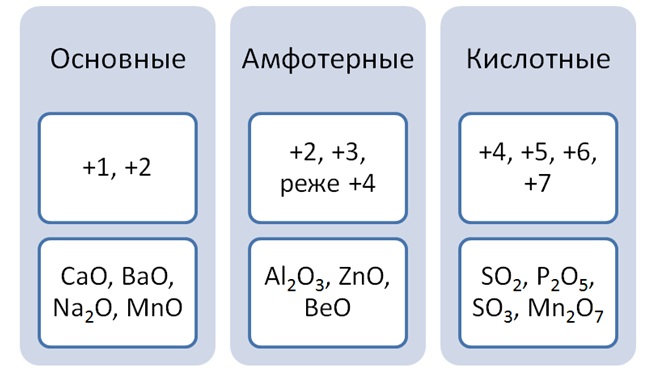 Это указывает на ионный характер низших и ковалентный характер высших оксидов марганца. Наиболее устойчивым из оксидов марганца является диоксид. Низшие оксиды марганца обладают восстановительными, а высшие — окислительными свойствами, В соответствии с этим низшие оксиды марганца имеют основный характер, диоксид—амфотерный, а высшие оксиды — кислотный характер. Что касается оксидов рения, то низшие из них изучены enie недостаточно в связи с их неустойчивостью высшие же оксиды рения легкоплавки и летучи, что свидетельствует об их ковалентной природе, обладают кислотным характером и окислительными свойствами, однако последние выражены у них слабее, чем у соответствуюишх оксидов марганца. [c.292]
Это указывает на ионный характер низших и ковалентный характер высших оксидов марганца. Наиболее устойчивым из оксидов марганца является диоксид. Низшие оксиды марганца обладают восстановительными, а высшие — окислительными свойствами, В соответствии с этим низшие оксиды марганца имеют основный характер, диоксид—амфотерный, а высшие оксиды — кислотный характер. Что касается оксидов рения, то низшие из них изучены enie недостаточно в связи с их неустойчивостью высшие же оксиды рения легкоплавки и летучи, что свидетельствует об их ковалентной природе, обладают кислотным характером и окислительными свойствами, однако последние выражены у них слабее, чем у соответствуюишх оксидов марганца. [c.292]
При разложении проб растворы гидроксидов, карбонатов щелочных металлов или аммиака применяют значительно реже, чем кислоты. Эти соединения используют для перевода в раствор анионов при этом многае неорганические катионы и органические соединения, входящие в состав образца, остаются в осадке. Гидрокснд натрия (или калия) растворяет некоторые металлы (алюминий) и оксиды кислотного характера (WOз, М0О3, [c.73]
Гидрокснд натрия (или калия) растворяет некоторые металлы (алюминий) и оксиды кислотного характера (WOз, М0О3, [c.73]
В подгруппу входят три элемента V, КЬ и Та. Электронная структура (п — 1) Высшая и наиболее характерная степень окисления +5, но бывают и промежуточные +2, +3, +4. Высшие оксиды кислотного типа, но по мере снижения степени окисления возрастают основные свойства УО — основный оксид, легко растворимый в кислотах, УгОз — амфотерный оксид, мало растворимый в кислотах, УгО, — также амфотерный оксид, а У2О5 — ангидрид типичной кислоты НУО3. [c.181]
Са(0Н)2 + СОг = СаСОз + HjO Основный оксид + Кислотный оксид — Соль (4) [c.179]
В XVUI в. были предприняты неоднократные попытки усовершенствовать химические символы. Но до начала 1780-х годов ученые не пытались найти принцип построения формул соединений, отражающих их качественный и количественный состав. И вот в 1782 г. французский химик Л. Гитон де Морво (1737—1816) создал номенклатуру на основе флогистонной теории. Но это был уже вчерашний день науки, так как в это время А. Лавуазье обосновал кислородную теорию горения. Крупнейшие ученые того времени К. Бертолле, А. де Фуркруа (1755— 1809), а затем и Гитон де Морво в 80-е годы стали соратниками Лавуазье и в 1786—1787 гг. разработали новую систему химической номенклатуры — Опыт химической номенклатуры , опубликованную в 1787 г. В этой работе авторы предлагали соединения кислорода с другими элементами называть оксидами , соли — по их кислотам (так, соли серной кислоты именовались сульфаты , азотной — нитраты ). Оксиды кислотные ( кислоты ,по определению авторов номенклатуры) назывались по радикалу с окончанием ная (по мнению Лавуазье кислоты состоят из кислорода, дающего кислотность, и радикала — серы, азота, фосфора и т. д.) серная, азотная, фосфорная. Если один и тот же радикал образует несколько кислот , то изменялось окончание у менее насыщенной кислородом — истая , у более насыщенной — ная . Например, сернистая и серная. [c.90]
Но это был уже вчерашний день науки, так как в это время А. Лавуазье обосновал кислородную теорию горения. Крупнейшие ученые того времени К. Бертолле, А. де Фуркруа (1755— 1809), а затем и Гитон де Морво в 80-е годы стали соратниками Лавуазье и в 1786—1787 гг. разработали новую систему химической номенклатуры — Опыт химической номенклатуры , опубликованную в 1787 г. В этой работе авторы предлагали соединения кислорода с другими элементами называть оксидами , соли — по их кислотам (так, соли серной кислоты именовались сульфаты , азотной — нитраты ). Оксиды кислотные ( кислоты ,по определению авторов номенклатуры) назывались по радикалу с окончанием ная (по мнению Лавуазье кислоты состоят из кислорода, дающего кислотность, и радикала — серы, азота, фосфора и т. д.) серная, азотная, фосфорная. Если один и тот же радикал образует несколько кислот , то изменялось окончание у менее насыщенной кислородом — истая , у более насыщенной — ная . Например, сернистая и серная. [c.90]
По химическим свойствам зола и шлак разделяются на кислые, основные и нейтральные в зависимости от соотношения оксидов кисльк — SiO , TiO , Р О основных СаО, MgO, FeO, К О и амфотерных. К кислым относятся зола и шлак, у которых отношение содержания кислых оксидов к суммарному содержанию основных и амфотерных оксидов (кислотность) больше единищ>1. Если отношение содержания основных оксидов к сумме кислых и амфотерных (основность) больше единищ.1, то зола и шлак называются основными, в других случаях — нейтральными. [c.124]
К кислым относятся зола и шлак, у которых отношение содержания кислых оксидов к суммарному содержанию основных и амфотерных оксидов (кислотность) больше единищ>1. Если отношение содержания основных оксидов к сумме кислых и амфотерных (основность) больше единищ.1, то зола и шлак называются основными, в других случаях — нейтральными. [c.124]
В [259] показано, что введение в ПВХ оксидов металлов [10-50%(масс.)] различной природы (переходных и непереходных, кислотных и основных) значительно изменяет количество и соотношение ароматических продуктов разложения полимера, но их качественный состав остается постоянным. В присутствии оксидов кислотного характера (TIO2, М0О3, Ре20з) возрастает количество выделяющихся при пиролизе алифатических и аро- [c.150]
Амфотерный оксид, кислотные и основные свойства равновы-раженны. Белый, имеет ионное строение (А1 +)2(0 )з. Тугоплавкий, термически устойчивый. Аморфный гигроскопичен и химически активен, кристаллический химически пассивен.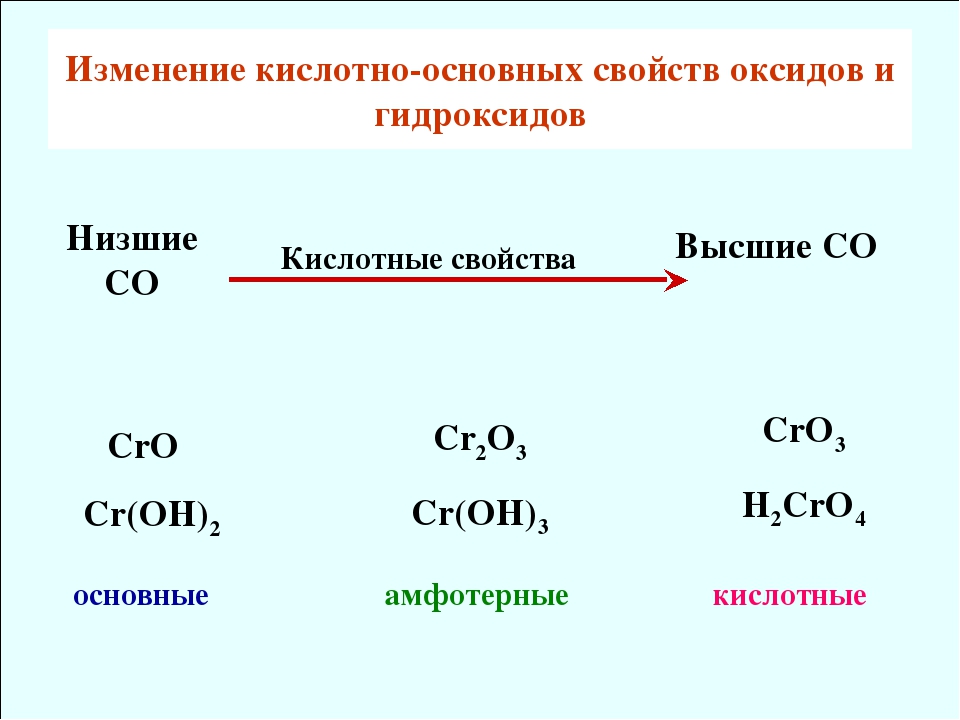 Не реагирует с водой, разбавленными кислотами и щелочами. Переводится в раствор концентрированными кислотами и щелочами, реагирует со щелочами и карбонатом натрия при сплавлении. Применяется как сырье в производстве алюминия, для изготовления огнеупорных, химически стойких и абразивных материалов, особо чистый AI2O3 — для изготовления рубиновых лазеров. [c.138]
Не реагирует с водой, разбавленными кислотами и щелочами. Переводится в раствор концентрированными кислотами и щелочами, реагирует со щелочами и карбонатом натрия при сплавлении. Применяется как сырье в производстве алюминия, для изготовления огнеупорных, химически стойких и абразивных материалов, особо чистый AI2O3 — для изготовления рубиновых лазеров. [c.138]
Применение в неорганическом анализе. Оксиды кислотного характера, например WO3, МоОо, GeOj, VjOj, растворяют в растворе гидроксида натрия или калия, М0О3 и WO3 — в концентрированном растворе аммиака. Некоторые вольфраматы разлагаются концентрированным раствором гидроксида натрия, что использовано при переработке низкосортных вольфрамовых руд [4.512] и фосфата циркония [4.513.]. [c.111]
Изменение кислотно-основных свойств оксидов и гидроксидов элементов 1Б-группы подчиняется общему правилу с ростом степени окисления кислотный характер возрастает, а при движении по группе сверху вниз уменьшается. Так, кислотный характер амфотерных СигО и Ag20 у первого оксида выражен очень слабо, а у второго — практически не проявляется, поэтому их часто относят к основным оксидам. Кислотный характер у СиО и Си (ОН) 2 уже вполне отчетлив, хотя и не превалирует над основным в оксиде золота (III) Аы20з и гидроксиде АиО(ОН) кислотные свойства выражены наиболее отчетливо, последнее соединение носит даже название золотой кислоты за ее способность образовывать комплексные анионы — гидроксоаураты (III) [Аи(0Н)4Г- [c.394]
Так, кислотный характер амфотерных СигО и Ag20 у первого оксида выражен очень слабо, а у второго — практически не проявляется, поэтому их часто относят к основным оксидам. Кислотный характер у СиО и Си (ОН) 2 уже вполне отчетлив, хотя и не превалирует над основным в оксиде золота (III) Аы20з и гидроксиде АиО(ОН) кислотные свойства выражены наиболее отчетливо, последнее соединение носит даже название золотой кислоты за ее способность образовывать комплексные анионы — гидроксоаураты (III) [Аи(0Н)4Г- [c.394]
Кислотные оксиды
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.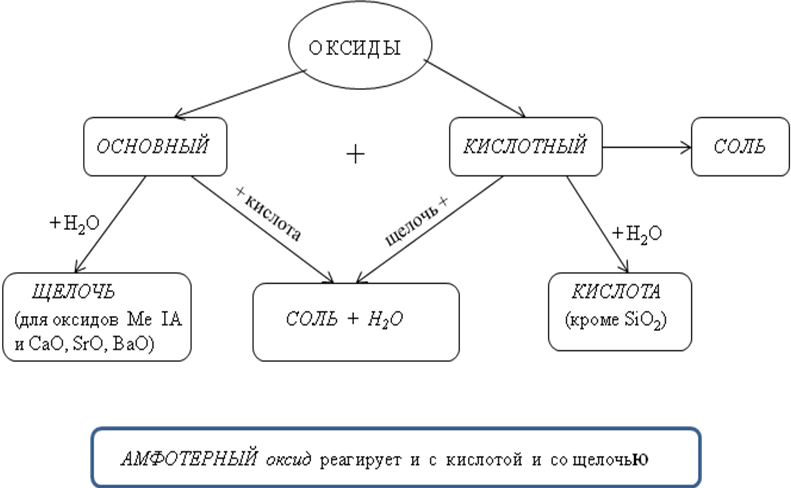
Чтобы получить подробное описание элемента, кликните по его названию.
Подготовка к ЦТ и ЕГЭ по химии
Классификация и свойства оксидов
Как вы уже знаете, все вещества делятся на простые и сложные. В свою очередь сложные вещества делятся на четыре класса: оксиды, основания, кислоты и соли. Каждое из неорганических соединений так или иначе является представителем какого-либо одного класса веществ, хотя есть и исключения. Так, например, пероксид бария BaO2 хотя и относится к классу оксидов, проявляет свойства солей.
Оксидами же называются сложные вещества, состоящие из двух элементов, один из которых кислород, т.е. оксид – это соединение элемента с кислородом.
Название оксидов образуется от названия элемента, входящего в состав оксида. Например, BaO – оксид бария. Если образующий оксид элемент имеет переменную валентность, то после названия элемента в скобках указывается его валентность римской цифрой. Например, FeO – оксид железа (I), Fe2О3 – оксид железа (III).
Элементы, обладающие постоянной валентностью, образуют только основные, кислотные или амфотерные оксиды. Элементы с переменной валентностью могут образовывать различные оксиды.
Все оксиды делятся на солеобразующие и несолеобразующие. Немногочисленные несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся оксид азота N2O (I), оксид азота NO (II), оксид кремния (II) и оксид углерода (II).
По своим химическим свойствам оксиды делятся на основные, кислотные и амфотерные.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами:
CuO + H2SO4 = CuSO4 + H2O
Растворимые в воде основные оксиды (оксиды металлов I и IIA группы из периодической системы) вступают в реакцию с водой, образуя основания:
CaO + H2O = Ca(OH) 2
Большинство основных оксидов с водой не взаимодействуют, но им также соответствуют основания, которые можно получить косвенным путем.
Основные оксиды реагируют с кислотными оксидами, образуя соли:
Na2O + SO3 = Na2SO4
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Кислотные оксиды также называются ангидридами кислот. Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (B2O3; Mn2O7).
Многие кислотные оксиды соединяются с водой, образуя кислоты:
N2O3 + H2O = 2HNO2
SO3 + H2O = H2SO4
Не все ангидриды реагируют с водой, в этом случае соответствующие им кислоты добываются косвенным путем.
Кислотные оксиды реагируют с основными оксидами с образованием соли:
CO2 + CaO = CaCO3
Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:
CO2 + Ba(ОН)2= BaCO3 + H2O
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. Соединения этих оксидов с водой могут иметь кислотные и основные свойства одновременно, например – Al2O3, Cr2O3, MnO2; Fe2O3 ZnO. К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:
Соединения этих оксидов с водой могут иметь кислотные и основные свойства одновременно, например – Al2O3, Cr2O3, MnO2; Fe2O3 ZnO. К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O (при нагревании)
ZnO + 2NaOH + H2O= Na2[Zn(OH)4] (в растворе)
Так как далеко не все амфотерные оксиды растворимы в воде, то доказать амфотерность таких оксидов заметно сложнее. Например, оксид алюминия (III) в реакции сплавления его с дисульфатом калия проявляет основные свойства, а при сплавлении с гидроксидами – кислотные:
Al2O3 + 3K2S2O7 = 3K2SO4 + A12(SO4)3
Al2O3 + 2KOH = 2KAlO2 + H2O
У различных амфотерных оксидов двойственность свойств может быть выражена в различной степени.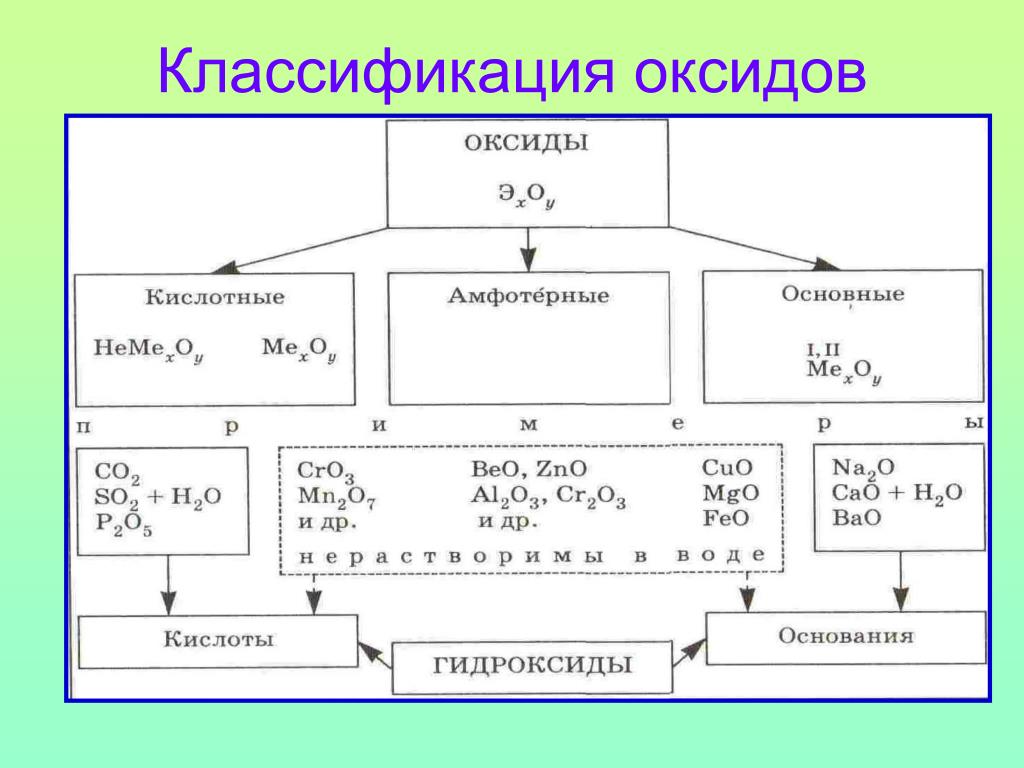 Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) – Fe2O3 – обладает преимущественно основными свойствами.
Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) – Fe2O3 – обладает преимущественно основными свойствами.
Способы получения оксидов из простых веществ – это либо прямая реакция элемента с кислородом:
2Ca + O2 = 2CaO
либо разложение сложных веществ:
а) оксидов
4CrO3 = 2Cr2O3 + 3O2
б) гидроксидов
Ca(OH)2 = CaO + H2O
в) кислот
H2CO3 = H2O + CO2
г) солей
CaCO3 = CaO +CO2
А также взаимодействие кислот – окислителей с металлами и неметаллами:
Cu + 4HNO3(конц) = Cu(NO3) 2 + 2NO2 + 2H2O
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
ХиМиК.ru — ОКСИДЫ — Химическая энциклопедия
ОКСИДЫ, соединения
элементов с кислородом. В оксидах степень окисления атома кислорода —2. К оксидам относятся
К оксидам относятся
все соед. элементов с кислородом, кроме содержащих атомы О, соединенные друг
с другом (пероксиды, надпероксиды, озо-ниды), и соед. фтора с кислородом (OF2
и др.). Последние следует называть не оксидами, а фторидами кислорода, т. к.
степень окисления кислорода в них положительная.
При комнатной т-ре большинство
оксиды-твердые в-ва (СаО, Fe2O3 и др.), нек-рые-жидкости (Н2О,
Сl2О7 и др.) и газы (NO, SO2 и др.). Хим. связь
в оксидах-ионная и ионно-ковалент-ная. Т-ры плавления и кипения оксидов понижаются с возрастанием
в них доли ковалентной связи. Многим оксидам в твердом состоянии присущ полиморфизм.
Нек-рые оксиды элементов III, IV, V гр. (напр., В, Si, As, Р) образуют рентгеноаморфные
стекла. Оксиды s- и p-элементов (напр., MgO, Аl2О3,
SiO2)-диэлектрики, оксиды переходных металлов (Fe, Сг и др. ) часто обладают
) часто обладают
св-вами полупроводников. Нек-рые оксиды-пьезоэлектрики (напр., кварц), ферромагнетики
[оксиды Fe, Cr(IV) и др.]. Вследствие своей многочисленности, разнообразия св-в
и доступности оксиды представляют исключительно важный класс неорг. в-в.
Большинство оксидов-солеобразующие;
при солеобразовании, протекающем обычно при нагр. (напр., Na2O +
SiO2
Na2SiO3), степени окисления элементов не изменяются. Известно
неск. несолеобразующих оксидов (напр., NO), не вступающих в подобные р-ции. Солеобразующие
оксиды подразделяют на основные, кислотные и амфотерные. Элемент основного оксида (Li2O,
BaO и др.) при образовании соли (напр., ВаО + SO3
BaSO4) становится катионом, элемент кислотного оксида (напр., SO3,
NO2, P2O5) входит в состав кислородсодержащего
аниона соли. Амфотерные оксиды (напр., ZnO, BeO, А12О3) могут
Амфотерные оксиды (напр., ZnO, BeO, А12О3) могут
реагировать и как основные оксиды, и как кислотные, напр.:
Уменьшение степени окисления
элемента и увеличение радиуса его иона делает оксид более основным, наоборот, увеличение
степени окисления и уменьшение ионного радиуса-более кислотным (напр., МnО-
основной оксид, Мn2О7-кислотный). Многие оксиды, напр. Рb3О4,
Fe3O4, содержащие элемент в разных степенях окисления,
являются двойными оксидами: (PbII2, PbIV)O4,
(FeII, FeIII2)O4. Среди оксидов, особенно
среди оксидов d-элементов, много нестехиометрич. соединений.
Оксиды щелочных и щел.-зем.
металлов активно реагируют с водой, образуя щелочи, напр.: К2О
+ Н2О
2КОН; нек-рые кислотные оксиды -ангидриды неорганических кислот-активно взаимод.
с водой, давая к-ты, напр.: SO3 + Н2О H2SO4.
Большинство оксидов металлов в компактном состоянии при комнатной т-ре с водой не
реагируют. Основные оксиды обычно быстро реагируют с к-тами в р-ре с образованием
солей, напр.:
Восстановители (С, Н2,
активные металлы, в частности Mg, Al) при нагр. восстанавливают многие оксиды до
металла, напр.:
При сильном нагревании
оксидов с углеродом часто образуются карбиды (напр., СаО + ЗС СаС2
+ СО), при хлорировании смеси оксидов с углем-хлориды (напр., В2О3
+ ЗС + + ЗСl2
2ВСl3 + 3СО).
Оксиды широко распространены
в природе. В очень больших кол-вах встречаются Н2О и SiO2.
Мн. минералы являются оксидами (гематит Fe2O3, магнетит
Fe3O4, касситерит SnO2 и др. ).
).
Многие оксиды образуются при
взаимод. простых в-в с кислородом (Li2O, СаО, La2O3,
SO2 и др.). Оксиды металлов обычно получают термич. разложением гидроксидов,
карбонатов, нитратов и др. солей кислородсодержащих к-т (напр., СаСО3
СаО + СО2), анодным окислением металлов, оксиды неметаллов — окислением
кислородом водородсодержащих соед. неметаллов (напр., 2H2S 4+ 3О2 2SO2
+ 2H2O). В пром-сти в больших кол-вах получают СаО, Аl2О3,
MgO, SO3, CO, CO2, NO и другие оксиды. Используют оксиды как огнеупоры
(SiO2, MgO, Al2O3 и др.), адсорбенты (SiO2-сшгака-гель,
Аl2О3 и др.), катализаторы (V2O5,
Al2O3 и др.), в произ-ве строит. материалов, стекол, фарфора,
фаянса, магн. материалов, пьезоэлектриков и др. Оксиды металлов (Fe, Ni, Al, Sn
материалов, пьезоэлектриков и др. Оксиды металлов (Fe, Ni, Al, Sn
и др.)-сырье в произ-ве металлов, оксиды неметаллов (напр., S, Р, N)- в произ-ве
соответствующих к-т.
С. И. Дракин.
Получение. Свойства — Оксиды — Важнейшие классы неорганических соединений — Неорганическая химия
9 января 2007
Основные оксиды. К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов:
1. Окисление металлов при нагревании в атмосфере кислорода:
2Mg + О2 = 2МgО,
2Сu + О2 = 2СuО.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2О, К2О крайне труднодоступны.
2. Обжиг сульфидов:
2CuS + ЗО2 = 2СuО + 2SО2,
4FeS2 + 11О2 = 2Fе2О3 + 8SО2.
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
3. Разложение гидроксидов:
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот:
| to | ||
| 2Рb(NО3)2 | = | 2PbО + 4NO2+O2 |
| to | ||
| 4FеSО4/> | = | 2Fe2O3 + 4SO4 + O2 |
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
| to | ||
| [ZnOH]2 | = | 2ZnO + CO2 + H2 O |
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2–, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2–, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
Основные оксиды при нагревании могут вступать в реакции кислотными и амфотерными оксидами, с кислотами:
ВаО + SiO2 = ВаSiO3,
МgО + Аl2О3 = Мg(AlO2)2,
ZnО + Н2SО4 = ZnSО4 + Н2О.
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
| to | ||
| Fe2O3+2Al/> | = | Al 2O3 + 2Fe |
| to | ||
| 3CuO+2NH3 | = | 3Cu + N2+3H2O |
Кислотные оксиды. Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
| to | ||
| 2ZnS+3O2 | = | 2ZnO + 2SO2 |
| to | ||
| K2Cr2O7+H2SO4 | = | 2CrO3↓+ K2So4+H2O |
| Nа2SiO3 + 2НСl | = | 2NаСl + SiO2↓ + Н2О |
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, с щелочами:
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
| 2SO2+O2 | to | 2SO3 |
SО2 + 2Н2S = 3S + 2Н2О,
4CrO3 + С2Н5ОН = 2Сr2О3 + 2СО2 + ЗН2О.
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Аl2О3 + 6НСl = 2АlСl3 + ЗН2О,
Аl2О3 + 2NаОН + ЗН2О = 2Nа[Аl(ОН)4].
К числу амфотерных оксидов относятся оксид алюминия Аl2О3, оксид хрома (III) Сr2О3, оксид бериллия ВеО, оксид цинка ZnО, оксид железа (III) Fe2О3 и ряд других.
Идеально амфотерным оксидом является вода Н2О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
Сu2+ + Н2О Сu(ОН)+ + Н+,
СО32- + Н2О НСО3– + ОН–.
Coreapp.ai — decentralized online education platform
Изучение нового материала
1.Изучите текст
Оксиды – это сложные вещества, которые состоят из двух элементов, одним, из которых является кислород. Почти все химические элементы образуют оксиды, исключением являются лишь некоторые инертные элементы. Известны химические элементы, которые непосредственно с кислородом не соединяются. К ним относится золото Аu и некоторые другие. Оксиды этих элементов получают косвенным путём.
Химическая природа оксидов проявляется в их отношении к кислотам и щелочам.
В связи с этим оксиды можно разделить на следующие группы
— солеобразующие, которые реагируют с образованием солей с кислотами или щелочами;
— несолеобразующие, которые не образуют солей с кислотами или щелочами.
В свою очередь, солеобразующие оксиды подразделяются на кислотные (реагируют со щелочами), основные (реагируют с кислотами) и амфотерные (реагируют как с кислотами, так и с щелочами).
Кислотные оксиды — это оксиды, которые реагируют со щелочами с образованием соли и воды, но они не реагируют с кислотами. Например, при взаимодействии кислотного оксида – оксида углерода (IV) с гидроксидом натрия образуются карбонат натрия и вода:
CO2 + 2NaOH = Na2CO3 + h3O
К кислотным оксидам относятся, как правило, оксиды неметаллов (например, SO2, CO2, P2O5), и те оксиды металлов, в которых металл находится в валентности более III (например, Mn2O7, CrO3).
Кислотным оксидам соответствуют кислоты. Оксиду серы (IV) соответствуют сернистая кислота, оксиду углерода(IV) — угольная, оксиду фосфора(V) – ортофосфорная, оксиду марганца(VII) – марганцовая, оксиду хрома(VI) – хромовая.
Основные оксиды — это оксиды, которые реагируют с кислотами с образованием соли и воды, но не реагируют со щелочами. Например, при взаимодействии оксида магния с соляной кислотой образуются хлорид магния и вода:
MgO + 2HCl = MgCl2 + h3O
Основные оксиды образуют, как правило, металлы с валентностью – I, II или III. Основным оксидам соответствуют основания. Например, оксиду натрия соответствует гидроксид натрия NaOH, оксиду бария – гидроксид бария, оксиду меди(II) – гидроксид меди(II).
Третья группа солеобразующих оксидов – амфотерные оксиды. Эти оксиды проявляют двойные свойства, т.е свойства и кислотных, и основных оксидов. Значит, они способны реагировать как со щелочами, так и с кислотами.К амфотерным оксидам относятся, например, оксид алюминия, оксид цинка, оксид бериллия, оксид хрома(III):Al2O3, ZnO, BeO, Cr2O3
Несолеобразующие, или безразличные оксиды не реагируют с образованием солей ни с кислотами, ни со щелочами. К такому виду оксидов относятся, например, оксиды азота N2O и NO, оксид углерода(II) – СО.
л
2.просмотрите видео урок
Основные классы неорганических соединений. Типы оксидов и гидроксидов, их свойства (основные, кислотные, амфотерные) на примере реакций.
Теоретические
вопросы на конференц–неделю.
Весна
2017г
Оксиды
— соединения,
содержащие только элемент и кислород
в степени окисления -2. Оксидами не
являются
перекиси Na2O2,
H2O2,
BaO2
и фторид кислорода O+2F2.
Оксиды
делятся на:
—
Основные оксиды.
Оксиды, которым соответствуют основные
гидроксиды. Это оксиды металлов в степени
окисления+1 и +2, кроме ZnO
и BeO.
Примерами основных оксидов могут служить
оксид кальция СаО и оксид магния MgO.
Оксид кальция взаимодействует с водой,
образуя гидроксид кальция Са(ОН)2:
СаО
+ Н2О
= Са(ОН)2.
Оксид
магния малорастворим в воде; однако ему
соответствует основание — гидроксид
магния Mg(OH)2,
который можно получить из оксида магния
косвенным путем.
—
Амфотерные оксиды.
Оксиды, которым соответствует амфотерные
гидроксиды. Это оксиды металлов в
степенях окисления +3 и +4, а также ZnO
и BeO.
Например, амфотерными оксидами являются
Fe2O3,
Al2O3,
TiO2,
BeO,
Cr2O3.
Амфотерные
оксиды реагируют с сильными кислотами,
образуя соли этих кислот. Такие реакции
являются проявлением основных свойств
амфотерных оксидов, например:
ZnO
+ H2SO4→
ZnSO4+
H2O
Они
также реагируют с сильными щелочами,
проявляя этим свои кислотные свойства,
например:
ZnO
+ 2NaOH → Na2ZnO2
+ H2O
—
Несолеобразующие оксиды.
Несолеобразующие оксиды не реагируют
с кислотами и щелочами, иногда их называют
безразличными оксидами. К несолеобразующим
оксидам относится, например, оксид азота
(I) N2О.
Нет такой кислоты или основания, которые
отвечали бы этому оксиду.
—
Кислотные оксиды.
Оксиды, которым соответствуют кислотные
гидроксиды. Кислотными считаются все
оксиды неметаллов, кроме несолеобразующих,
и оксиды металлов со степенями окисления
+5, +6, +7. Примерами кислотных оксидов
могут служить триоксид серы SO3
и диоксид кремния SiO2.
Первый из них взаимодействует с водой,
образуя серную кислоту H2SO4:
SO3
+ Н2О
= H2SO4.
Диоксид
кремния с водой не взаимодействует, но
ему соответствует кремниевая кислота
H2SiО3,
которую можно получить из SiO2
косвенным путем.
Гидроксиды.
В состав гидроксидов входят атомы
водорода, кислорода и еще некоего
элемента. В зависимости от характера
гидроксидов, их изображают либо как
R(OH)n
или как HxROy.
Гидроксиды
делятся на:
—
Основные гидроксиды
или основания.
Это соединения вида Me(OH)n,
проявляющие определенный набор свойств
(основных свойств). Основаниями являются
гидроксиды металлов в степенях окисления
+1 и +2, кроме Zn(OH)2
и Be(OH)2.
Например, основаниями являютсяMg(OH)2,
KOH,
Ba(OH)2,
Cu(OH)2,
LiOH.
Оснóвные гидроксиды
содержат
гидроксогруппы ОН—,
способные замещаться на кислотные
остатки:
NaOH+Al2(SO4)3=Na2SO4+Al(OH)3
—
Амфотерные гидроксиды.
Гидроксиды, проявляющие свойства
оснований и кислот. Амфотерными являются
гидроксиды вида Me(OH)n,
где степень окисления металла+3 или +2(в
случае Be
и Zn).
Например, амфотерными гидроксидами
являютсяAl(OH)3,
Fe(OH)3,
Zn(OH)2,
Be(OH)2,
Cr(OH)3.
—
Кислотные гидроксиды
или кислородосодержащие кислоты. Имеют
общий вид HxROy,
где R
– неметалл или металл в степени окисления
+5, +6, +7. Примерами кислородосодержащих
кислот могут бытьHNO3,
H2SO4,
HMnO4,
H2CrO4,
H2SiO3.
При
записи формулы кислотного гидроксида
атомы водорода ставят на первое место,
учитывая его электролитическую
диссоциацию в воде:
SO2(OH)2
→ H2SO4
PO(OH)3
→ H3PO4
NO2(OH)
→ HNO3
CO(OH)2
→ H2CO3
Стоит
заметить, что кислоты бывают и
бескислородными, но они не являются
гидроксидами. Бескислородные кислоты:
Бескислородные кислоты:
HCl, HBr, HI, H2S,
HF.
Какие факторы делают амфотерные оксиды способными реагировать как с кислотами, так и с щелочами?
Основные оксиды
Металлический характер увеличивается справа налево и сверху вниз в Периодической таблице.
Самые металлические элементы образуют самые основные оксиды.
Даже если оксиды нерастворимы в воде, мы все равно называем их основными оксидами, потому что они вступают в реакцию с кислотами.
# «MgO (s) + 2HCl (водн.) → MgCl» _2 «(водн.)» + «H» _2 «O» (l) «#
Кислые оксиды
Неметаллический символ увеличивается слева направо и снизу вверх в Периодической таблице.
Самые неметаллические элементы образуют наиболее кислые оксиды.
Они реагируют с водой с образованием оксокислот. Например,
# «SO» _2 «(вод.)» + «H» _2 «O (l)» → «H» _2 «SO» _3 «(вод. )» #
)» #
Даже если оксид нерастворим в воде, мы все равно относим его к кислому, если он реагирует с основаниями с образованием солей. Например,
# «TeO» _2 «(s)» + «2NaOH (водн.)» → «Na» _2 «TeO» _3 «(водн.)» + «H» _2 «O (l)» #
Амфотерные оксиды
Некоторые оксиды реагируют как с кислотами, так и с основаниями, то есть они амфотерные .»-» «(водн.)» #
Более легкие элементы групп 2 и 13, некоторые из # «d» # — блочных элементов и более тяжелые элементы групп 14 и 15 содержат амфотерные оксиды.
Самые основные оксиды находятся в нижнем левом углу Периодической таблицы, а самые кислые оксиды — в верхнем правом углу, поэтому неудивительно, что граница между кислотными и основными оксидами проходит по диагонали.
Амфотеризм и степени окисления
Амфотеризм зависит от степени окисления оксида.
Нет простого способа предсказать, какие элементы будут амфотерными.
Амфотерный характер оксида, вероятно, отражает способность металла поляризовать окружающие ионы оксида, то есть вносить значительный ковалентный характер в связь # «M-O» #.
Эта способность увеличивается с увеличением степени окисления, поскольку положительный характер центрального атома увеличивается.
Однако в группе 15 амфотерными являются только оксиды с более низкой степенью окисления.
Оксиды с более высокой степенью окисления слишком кислые, чтобы быть амфотерными.
Многие переходные металлы образуют амфотерные оксиды, но трудно предсказать, какой из их оксидов будет амфотерным.
Мы можем сказать, что амфотерная природа оксида сильно зависит от степени окисления металла.
Кислотность катиона быстро повышается с увеличением заряда, поэтому переходные металлы с различными степенями окисления могут иметь кислые, основные или амфотерные оксиды.»-» #
Свойства кислот и оснований
Свойства кислот и оснований
Некоторые свойства кислот:
- Вкус у них кисловатый, лимонный, апельсиновый.

- Их растворимость в воде высока.
- Их водные растворы проводят электрический ток.
- Соединения, включая CO 3 -2 и HCO 3 —, производят газ CO 2 ;
Пример:
CaCO 3 + 2HNO 3 → Ca (NO 3 ) 2 + CO 2 (г) + H 2 O
NaHCO 3 + HCl → NaCl + CO 2 (г) + H 2 O
- Они реагируют с активными металлами с образованием соли и газа H 2 .
Пример:
Zn + H 2 SO 4 (раствор) → ZnSO 4 (раствор) + H 2 (г)
Mg + 2HCl → MgCl 2 + H 2
2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2
Исключениями из этого свойства являются некоторые металлы, такие как Au, Pt, Ag, Cu и Hg.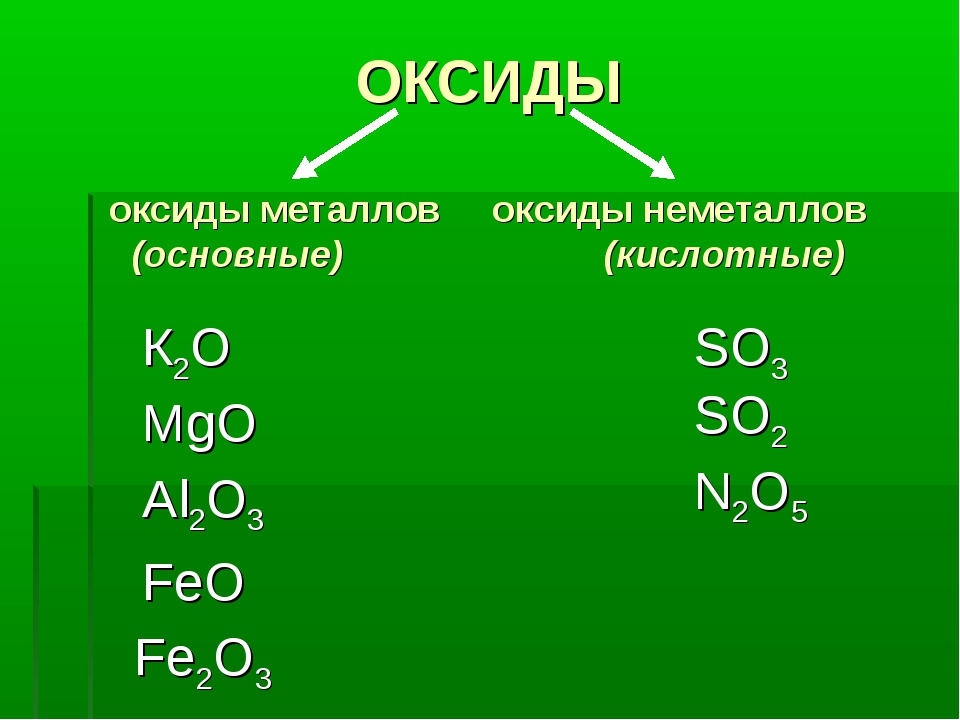 Их называют благородными металлами. Они не образуют газ H 2 в реакции с кислотами.Однако некоторые благородные металлы реагируют с HNO 3 и H 2 SO 4 и не образуют H 2 .
Их называют благородными металлами. Они не образуют газ H 2 в реакции с кислотами.Однако некоторые благородные металлы реагируют с HNO 3 и H 2 SO 4 и не образуют H 2 .
Пример:
Cu + HCl → реакции не происходит
Cu + 2H 2 SO 4 → CuSO 4 + SO 2 + 2H 2 O
3Cu + 8HNO 3 → 3Cu (NO 3 ) 2 + 2NO + 4H 2 O
- Кислоты превращают синюю лакмусовую бумажку в красную.
- Кислоты реагируют с основаниями с образованием соли и воды.Этот тип реакции называется реакцией нейтрализации .
H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O
2HCl + Ba (OH) 2 → BaCl 2 + 2H 2 O
HCl + NaOH → NaCl + H 2 O
Некоторые свойства оснований:
- Их вкус горький, как шампунь.

- Их растворы с водой проводят электрический ток.
- Когда мы касаемся элементарной материи, мы чувствуем ее скользкой.
- Их растворимость в воде мала по отношению к кислотам.
- Базы превращаются из красной лакмусовой бумаги в синюю.
- Не реагируют с металлами. Однако некоторые металлы, такие как Zn и Al, реагируют с основаниями и образуют газ H 2 и соль. Эти металлы называются амфотерными металлами. Они ведут себя как кислота для основания и основание для кислоты.
Пример:
2Al + 6NaOH → 2Na 3 AlO 3 + 3H 2
Zn + 2NaOH → Na 2 ZnO 2 + H 2
- Они реагируют с кислотами с образованием соли и воды.(Реакции нейтрализации)
Оксиды
Соединения любого элемента с водой называются оксидами . Мы исследуем их под четырьмя заголовками; кислые и основные оксиды, нейтральные оксиды, амфотерные оксиды и пероксиды;
1) Кислые оксиды: Это оксиды, которые соединяются с основаниями и образуют соли. SO 2 , SO 3 , CO 2 , N 2 O 5 являются примерами кислотных оксидов.
SO 2 , SO 3 , CO 2 , N 2 O 5 являются примерами кислотных оксидов.
SO 3 + 2 NaOH → Na 2 SO 4 + H 2 O
Кислотно-оксидная основа, соленая вода
CO 2 + 2 NaOH → Na 2 CO 3 + H 2 O
Кислотно-оксидная основа, соленая вода
Кислотные оксиды соединяются с водой и образуют кислоты.
SO 2 + H 2 O → H 2 SO 3
SO 3 + H 2 O → H 2 SO 4
CO 2 + H 2 O → H 2 CO 3
2) Основные оксиды: Они соединяются с кислотами и образуют соли. Оксиды металлов проявляют это свойство как; Na 2 O, CaO.
Na 2 O + 2HCl → 2NaCl + H 2 O
Основная оксидно-кислая соленая вода
CaO + 2HCl → CaCl 2 + H 2 O
Основная оксидно-кислая соленая вода
Основные оксиды соединяются с водой и образуют основания.
Na 2 O + H 2 O → 2NaOH
BaO + H 2 O → Ba (OH) 2
3) Нейтральные оксиды: Не вступают в реакцию с кислотами и основаниями. Нейтральные оксиды не вступают в реакцию с водой и образуют кислоту или основание. NO, N 2 O и CO являются некоторыми примерами нейтральных оксидов.
4) Амфотерные оксиды: Эти оксиды реагируют с кислотами и основаниями и образуют соли. ZnO и Al 2 O 3 являются примерами амфотерных оксидов.Примеры этих реакций приведены ниже;
ZnO + 2HCl → ZnCl 2 + H 2 O
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
A l2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
Al2O3 + 6NaOH → 2Na 3 AlO 3 + 3H 2 O
5) Пероксиды: Соединения, содержащие в своей структуре (O 2 ) -2 , называются пероксидами.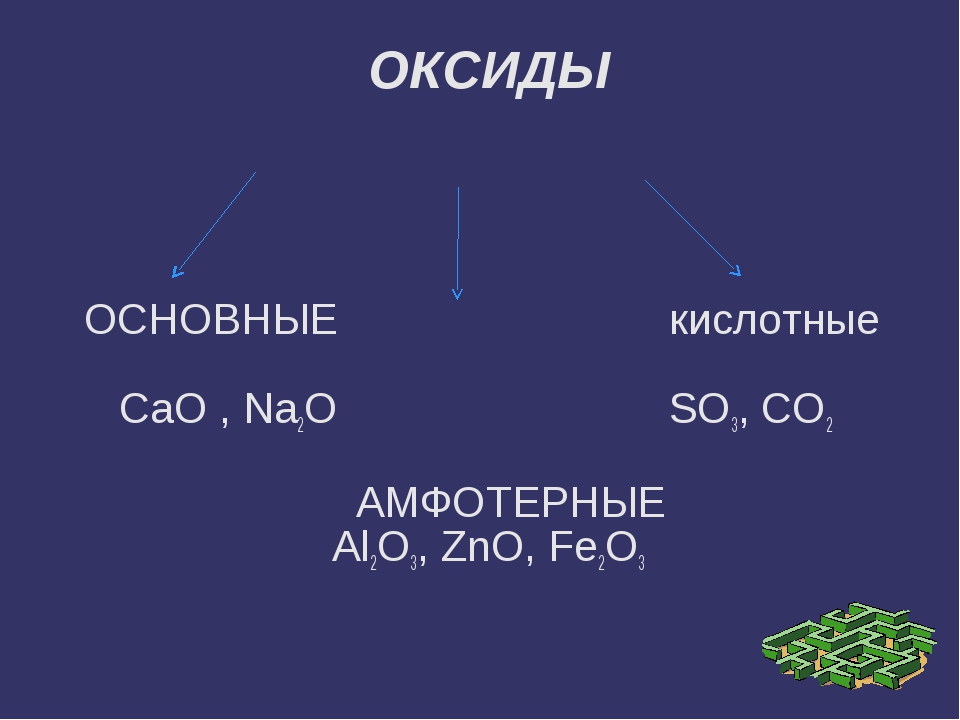 Примеры пероксидов приведены ниже;
Примеры пероксидов приведены ниже;
H 2 O 2 : Пероксид водорода
Na 2 O 2 : Пероксид натрия
Пример: Какие из следующих утверждений верны для водного раствора серной кислоты H 2 SO 4 ?
I. Превращает лакмусовую бумажку в красный.
II. Проводит электрический ток.
III. При реакции с Mg образуется газ H 2 .
IV. Осуществляет реакцию нейтрализации водным раствором NH 3 .
Решение:
Кислота превращает синюю лакмусовую бумажку в красную. Я верно.
Все кислые водные растворы проводят электрический ток, так что II верно.
Некоторые металлы вступают в реакцию с кислотами, и образуется газ H 2 , Mg является одним из металлов III.
NH 3 — основание, а H 2 SO 4 — кислота, когда они объединяются, происходит реакция нейтрализации.IV тоже верно.
Кислоты и основания, экзамены и решения проблем
| Кислоты и Основания <Пред. | Далее> Сильные стороны кислот и оснований |
|---|
Узнайте о кислотно-основном характере оксидов
Амфотерные оксиды — это оксиды, которые обладают как кислотными, так и основными свойствами и могут действовать как кислоты и основания. Эти оксиды реагируют с кислотами или основаниями и образуют соль и воду (реакция нейтрализации).Такие элементы, как алюминий, переходные металлы, такие как цинк, титан, медь, золото, и элементы p-блока, такие как германий, сурьма, висмут, образуют амфотерные оксиды. Ниже приведены реакции и примеры некоторых амфотерных оксидов.
В кислой среде: ZnO + h3SO4 → ZnSO4 + h3O {\ rm {ZnO}} \, {\ rm {+}} {\ kern 1pt} {\ kern 1pt} {{\ rm {H}} _ {\ rm {2}}} {\ rm {S}} {{\ rm {O}} _ {\ rm {4}}} {\ kern 1pt} \ to {\ rm {ZnS}} {{\ rm {O }} _ {\ rm {4}}} {\ kern 1pt} {\ rm {+}} {\ kern 1pt} {{\ rm {H}} _ {\ rm {2}}} {\ rm {O }} ZnO + h3 SO4 → ZnSO4 + h3 O
В основной среде: ZnO + 2NaOH + h3O → Na2 [Zn (OH) 4] {\ rm {ZnO}} {\ kern 1pt} {\ kern 1pt} {\ rm {+}} {\ kern 1pt} {\ rm {2NaOH}} {\ kern 1pt} {\ rm {+}} {\ kern 1pt} {{\ rm {H}} _ {\ rm {2}}} {\ rm {O}} \ to {\ rm {N}} {{\ rm {a}} _ {\ rm {2}}} \ left [{{\ rm {Zn}} { {\ left ({{\ rm {OH}}} \ right)} _ {\ rm {4}}} \ right] ZnO + 2NaOH + h3 O → Na2 [Zn (OH) 4]
В кислой среде: Al2O3 + 6HCl → 2AlCl3 + 3h3O {\ rm {A}} {{\ rm {l}} _ {\ rm {2}}} {{\ rm {O}} _ {\ rm {3} }} {\ kern 1pt} {\ kern 1pt} {\ rm {+}} {\ kern 1pt} {\ kern 1pt} {\ rm {6HCl}} \ to {\ rm {2AlC}} {{\ rm { l}} _ {\ rm {3}}} {\ kern 1pt} {\ rm {+}} {\ kern 1pt} {\ rm {3}} {{\ rm {H}} _ {\ rm {2 }}} {\ rm {O}} Al2 O3 + 6HCl → 2AlCl3 + 3h3 O
В основной среде: Al2O3 + 2NaOH + 3h3O → 2Na [Pb (OH) 4] {\ rm {A}} {{\ rm {l}} _ {\ rm {2}}} {{\ rm {O}} _ {\ rm {3}}} {\ kern 1pt} {\ rm {+}} {\ kern 1pt} {\ rm {2NaOH}} {\ kern 1pt} {\ rm {+ 3}} {{\ rm {H}} _ {\ rm {2}} } {\ rm {O}} \ to {\ rm {2Na}} \ left [{{\ rm {Pb}} {{\ left ({{\ rm {OH}}} \ right)} _ {\ rm {4}}}} \ right] Al2 O3 + 2NaOH + 3h3 O → 2Na [Pb (OH) 4]
Нейтральные оксиды — это оксиды, которые не проявляют ни кислотных, ни основных свойств или не образуют солей с кислотами и основаниями, и называются нейтральными оксидами.Вода — амфотерный оксид водорода. Примеры и реакции некоторых нейтральных оксидов приведены ниже.
Окись углерода: 2C (S) + O2 (г) → 2CO (г) {\ rm {2}} {{\ rm {C}} _ {\ left ({\ rm {S}} \ right )}} {\ kern 1pt} {\ rm {+}} {\ kern 1pt} {{\ rm {O}} _ {\ rm {2}}} _ {\ left ({\ rm {g}} \ right)} \ to {\ rm {2C}} {{\ rm {O}} _ {\ left ({\ rm {g}} \ right)}} 2C (S) + O2 (g) → 2CO (г)
Закись азота: 2N2 + O2 → 2N2O {\ rm {2}} {{\ rm {N}} _ {\ rm {2}}} {\ rm {+}} {\ kern 1pt} {\ kern 1pt} {{\ rm {O}} _ {\ rm {2}}} \ to {\ rm {2}} {{\ rm {N}} _ {\ rm {2}} } {\ rm {O}} 2N2 + O2 → 2N2 O
Вода: 2h3 (г) + O2 (г) → 2h3O (l) {\ rm {2}} {{\ rm {H }} _ {\ rm {2}}} _ {\ left ({\ rm {g}} \ right)} {\ kern 1pt} {\ rm {+}} {\ kern 1pt} {{\ rm {O }} _ {\ rm {2}}} _ {\ left ({\ rm {g}} \ right)} \, \ to {\ rm {2}} {{\ rm {H}} _ {\ rm {2}}} {{\ rm {O}} _ {\ left ({\ rm {l}} \ right)}} 2h3 (g) + O2 (g) → 2h3 O (l) Взаимодействие с другими людьми
Амфотерные оксиды — CoolGyan.Org
Оксиды бывают кислыми, основными, амфотерными или нейтральными. Амфотерный оксид — это оксид, который может действовать как кислота или основание. Обычно неметаллические оксиды являются кислотными, а оксиды металлов — основными. Некоторые неметаллические оксиды нейтральны, а некоторые металлические или полуметаллические оксиды являются амфотерными. Из этих обобщений есть ряд исключений.
Что такое амфотерные оксиды?
“ Амфотерные оксиды — это оксиды, которые ведут себя как кислотные, так и основные оксиды.Амфотерные оксиды обладают свойствами как кислотных, так и основных оксидов, которые нейтрализуют как кислоты, так и основания ».
Амфотерные оксиды растворяются в воде с образованием щелочных растворов. Щелочные растворы содержат ионы гидроксида. Таким образом, оксид алюминия (Al 2 O 3 ) реагирует с соляной кислотой с образованием хлорида алюминия и воды. С раствором гидроксида натрия образует алюминат натрия (NaAlO 2 ) и воду. Другие распространенные примеры амфотерных оксидов включают ZnO, SnO и PbO.
Рекомендуемые видео
Как определить амфотерные оксиды?
Оксиды — это соединения металлов или неметаллов с кислородом. Есть четыре типа оксидов. Разница между этими четырьмя 0типами заключается в их химических реакциях. Амфотерные оксиды классифицируются как оксиды металлов, которые реагируют как с кислотами, так и с основаниями с образованием солей и воды. Амфотерные оксиды, среди многих других, включают оксид свинца и оксид цинка. Примеры включают аминокислоты и белки, которые имеют классы аминов и карбоновых кислот и молекул, которые могут быть самоионизированными, например, вода.
Амфотерные оксиды — это кислородные соединения, которые обладают как кислотными, так и основными характеристиками. Эти оксиды подвергаются реакции нейтрализации с образованием воды и соли при взаимодействии с кислотой. Это демонстрирует основные свойства соединений. Точно так же щелочь реагирует с образованием соли и воды, демонстрируя кислотные свойства. Пример: оксид алюминия.
Все оксиды могут быть получены путем нагревания элемента в кислороде. Реакция водных растворов тригалогенидов металлов с гидроксидом дает оксиды в гидратированной форме.Спускаясь вниз по группе, происходит переход от кислых оксидов через амфотерные к основным из-за усиления металлического характера соответствующих элементов.
Оксиды элементов 13 группы
Оксиды | Недвижимость |
B 2 O 3 | Слабокислый |
Al 2 O 3 | Амфотерный |
Ga 2 O 3 | Амфотерный |
дюйм 2 O 3 | Слабое основание |
Tl 2 O 3 | Основная, окислительная |
Примеры амфотерных оксидов
Слово амфотерный означает и кислоту, и основание.Амфотерные оксиды обладают как кислотными, так и основными свойствами. Оксиды алюминия и цинка являются примерами. Они образуют соли, когда вступают в реакцию с кислотами. Они также реагируют со щелочами с образованием сложных солей.
Примеры:
ZnO (т) + 2HNO 3 (водн.) → Zn (NO 3 ) 2 (водн.) + H 2 O (л)
ZnO (т.) + 2NaOH (водн.) → Na 2 ZnO 2 (водн.) + H 2 O (л)
Al 2 O 3 (т.) + 6HCl (водн.) → 2AlCl 3 (водн.) + 3H 2 O (л)
Al 2 O 3 (т) + 2NaOH (водн.) → 2NaAlO 2 (водн.) + H 2 O (л)
Цинкаты и алюминаты имеют окончание -ат, чтобы показать, что их ионы являются составными ионами, содержащими кислород, скорее как сульфаты, карбонаты и нитраты, что указывает на то, что ионы — это ZnO 2 2-, а ионы алюмината — это AlO 3 — .Ионы записываются как Zn (OH) 4 2- и Al (OH) 4 —. Обратите внимание, что цинкат и алюминат натрия растворимы в воде.
Амфотерные оксиды в Периодической таблице
В определенный период оксиды прогрессируют от сильноосновных до слабоосновных, амфотерных и слабокислых до сильнокислых, например. Na 2 O, MgO, Al 2 O 3 , P 4 O 10 , SO 3 , Cl 2 O 7 .Кислотность также увеличивается с увеличением степени окисления, например. MnO
Существует тенденция изменения кислотности оксидов в периодической таблице. Обычно за период наблюдается тенденция к основным → амфотерным → кислым. В следующей таблице показана тенденция изменения кислотности оксидов за период 3.
Na 2 O | MgO | Al 2 O 3 | SiO 2 | пол. 4 O 18 | СО 2 | Класс 2 O 7 |
Сильно простой | Базовый | Амфотерный | Слабокислый | Кислый | Кислый | Сильно кислый |
Самые основные оксиды находятся в нижней части групп I и II.Основность имеет тенденцию к увеличению вниз по периодической группе. Таким образом, для Группы V кислотность оксидов составляет NO 2 (кислая), P 2 O 3 (кислая), As 2 O 3 (амфотерная). Sb 2 O 3 (амфотерный), Bi 2 O 3 (основной).
В основных группах элементов основность оксидов возрастает с увеличением порядкового номера вниз по группе, например. BeO Любые оксиды вступают в реакцию, то есть они амфотерные, как с кислотами, так и с основаниями. Например, амфотерный оксид — это Al 2 O3. Амфотерные оксиды находятся в более легких элементах групп 2 и 13, некоторых элементах d-блока и более тяжелых элементах групп 14 и 15. Амфотерный оксид — это оксид, который может действовать как кислота или как основание, образуя соль и воду в реакции.Степени окисления, открытые для химических веществ, основаны на амфотерии. Амфотерные оксиды и гидроксиды образуются, когда металлы имеют несколько степеней окисления. Амфотерные оксиды классифицируются как оксиды металлов, которые реагируют как с кислотами, так и с основаниями с образованием солей и воды. Амфотерные оксиды, среди многих других, включают оксид свинца и оксид цинка. Амфипротические молекулы, которые могут отдавать или принимать протон (H + ), относятся к одному из видов амфотерных частиц. Идея кислоты и основания может быть хорошо понята из идеи Бренстеда-Лоури об амфотерных соединениях. HCl и Cl — образуют сопряженную кислотно-основную пару в примере 1, показанном выше, поскольку они различаются протоном. Точно так же другая пара сопряженных кислот и оснований также образует NH 4 + и NH 3 в примере 2. Основное существование аминов зависит от подачи одной пары азота для донорства.Группа высвобождения электронов, такая как -CH 3 , увеличивает основность амина за счет увеличения плотности электронов над азотом, что В воде основные оксиды обычно нерастворимы. Многие из них образуют щелочные растворы в воде. К щелочным металлам кислород очень реактивен.Щелочное название дано щелочным металлам, потому что оксиды этих металлов вступают в реакцию с водой с образованием простого или щелочного гидроксида металла. Литий производит оксид, натрий производит перекись, а супероксид образуется калием, цезием и рубидием. Оксиды 4-й группы Углерод Часто задаваемые вопросы об амфотерных оксидах
Как определить амфотерные оксиды?
Как образуются амфотерные оксиды?
Какие примеры амфотерных оксидов?
Является ли HCl амфотерным?
Что является более основным по природе?
способствует передаче неподеленных электронных пар. (CH 3 ) 2 NH — тогда самый простой. Растворимы ли основные оксиды в воде?
Какой элемент реагирует с кислородом, образуя щелочной раствор?
Оксиды 4-й группы
и диоксиды кремния | Диоксиды Ge, Sn, Pb
| Оксиды
Ge, Sn, Pb | Pb 3 O 4
Диоксиды углерода и кремния кислые; в
диоксиды и оксиды остальной группы 4 являются амфотерными.
1.
оксиды углерода и кремния; кислотные оксиды.
CO часто считается нейтральным | ||
CO | HCOO (водн.) | |
Хотя углекислый газ является кислым | ||
CO 2 (водн.) | H + (водн.) | |
Диоксид кремния кислый, но | ||
SiO 2 | SiO 3 2 (водн.) | |
Реакция кремнезема с | ||
500 или С | ||
SiO 2 | CaSiO 3 (л) | |
шлак | ||
Верх
2.Оксиды германия, олова и свинца; амфотерные оксиды.
Спецификация Edexcel, похоже, включает оксиды германия, полностью
неважно, и исключить те из олова, которые, возможно, более важны.
К счастью, они ведут себя более или менее одинаково для всех трех элементов, хотя
баланс между кислотными и основными свойствами меняется с каждым элементом.
Важное примечание.
Растворы веществ, описываемых как
germanates, stannates или plumbates, то есть продукты из
реакция оксидов со щелочью часто не очень хорошо охарактеризована.Формулы для них были предложены много десятилетий назад, но мало что было сделано.
на них, и в любом случае их состав может изменяться в зависимости от того, как
они сделаны. Таким образом, плюмбаты (II), полученные в результате реакции PbO с
щелочь, может быть представлена [Pb (OH) 6 ] 4 , HPbO 2
, PbO 2 2 или PbO 3 4
. То, что учителя говорят о себе, обычно связано с тем, что они
учили или тому, что написано в их любимом учебнике.Любые признанные
представление приемлемо на экзамене.
(а) Диоксиды MO 2 . тепло GeO 2 [Ge (OH) 6 ] 2 (водн.) Соответствующая реакция для тепло SnO 2 [Sn (OH) 6 ] 2 (водн.) Реакция с оксидом свинца (IV) ПБО 2 Na 2 PbO 3 (т) GeO 2 GeCl 4 (водн.) SnO 2 SnCl 4 (водн.) <0 o С ПБО 2 PbCl 4 (л) (б) GeO GeO 2 2 (водн.) SnO SnO 2 2 (водн.) PbO PbO 2 2 (водн.) Их основные свойства проявляются в реакции с концентрированной HCl: кроме GeO GeCl 2 (водн.) SnO SnCl 2 (водн.) Хлорид свинца (II) не растворяется в PbO PbCl 2 (т) PbCl 2 (т) PbCl 3 (водн.) PbCl 2 (т) PbCl 4 2 (водн.) Верх
Кислотный характер диоксидов снижает Ge
(s) + 2OH (водн.)
+ 2H 2 O (л)
для оксида олова (IV) требуется концентрированный раствор щелочи:
(s) + 2OH (водн.)
+ 2H 2 O (л)
требует расплавленной щелочи и дает несколько иной продукт:
(т) + 2NaOH (л)
+ H 2 O (г)
Основной характер диоксидов иллюстрируется их реакцией с
концентрированная HCl.Использование концентрированной кислоты подавляет гидролиз
хлорид произведен.
(т) + 4HCl (водн.)
+ 2H 2 O (л)
(т) + 4HCl (водн.)
+ 2H 2 O (л)
(т) + 4HCl (водн.)
+ 2H 2 O (л)
Верх
оксиды МО. Показаны их кислотные свойства.
по реакции с водной щелочью:
(s) + 2OH (водн.)
+ H 2 O (л)
(s) + 2OH (водн.)
+ H 2 O (л)
(s) + 2OH (водн.)
+
H 2 O (л)
в случае PbO это обозначается просто как H + (водн.).
(s) + 2H + (водн.)
+ H 2 O (л)
(s) + 2H + (водн.)
+ H 2 O (л)
вода; в присутствии концентрированной HCl образует растворимые комплексы:
(т) + 2HCl (водн.)
+ H 2 O (л)
+ Cl (водн.)
+ 2Cl (водн.)
(c) Тетроксид трисвинца,
Пб 3 О 4 . Это прекрасное
Алый порошок представляет собой смешанный оксид, содержащий ионы свинца (II) и свинца (IV). Это
ведет себя как PbO 2 .2PbO.
С разбавленной азотной кислотой часть PbO реагирует как основание с образованием нитрата свинца (II);
PbO 2 остается, так как он недостаточно щелочной, чтобы реагировать с азотной кислотой.
в этих условиях:
PbO 2 ,2PbO | PbO 2 (т) |
Его реакция со щелочью несущественна.
Верх
Содержание каталога неорганических веществ
Содержание химии
Главная
Приведите по два примера каждого из следующих оксидов: (a) Кислые оксиды (b) Основные оксиды (c) Амфотерные оксиды (d) Нейтральные оксиды. Укажите, какой из следующих оксидов, например, от (a) до (d)
Нажмите, чтобы оценить этот пост!
[Всего: 0 Среднее: 0]
(i) Взаимодействие с водой с образованием основания
(ii) Взаимодействие с основанием с образованием соли и воды
(iii) Взаимодействие с кислотами и основаниями с образованием соли и воды.
Решение:
Кислый оксид:
Неметаллы реагируют с кислородом с образованием кислотных соединений оксидов, которые удерживаются вместе ковалентными связями. Эти соединения также можно назвать ангидридами кислот. Ангидриды кислот обычно имеют низкие температуры плавления и кипения, за исключением таких соединений, как B 2 O 3 и SiO 2 , которые имеют высокие температуры плавления и образуют гигантские молекулы.
Примеры: NO, CO 2
SO 3 + H 2 O -> H 2 SO 4
B 2 O 3 + H 2 O -> 2H 3 БО 3
Основной оксид:
Металлы реагируют с кислородом с образованием основных соединений кислорода. Эти соединения обычно имеют ионную природу. Группы 1, 2 и лантаноиды образуют основные соединения кислорода, когда они реагируют с кислородом. Во время образования этих соединений выделяется большое количество энергии.Эти соединения легко вступают в реакцию с водой, за некоторыми исключениями.
Примеры: M 2 O 3 , MO 2 , ThO 2
Na 2 O + H 2 O -> 2NaOH
Амфотерный оксид:
Амфотерный оксид — это соединение кислорода, которое проявляет как кислотные, так и основные характеристики. Эти оксиды при взаимодействии с кислотой претерпевают реакцию нейтрализации с образованием воды и соли.В этом проявляется основное свойство соединений. Аналогично реагирует с щелочью с образованием соли и воды, проявляя кислотные свойства. Пример: оксид алюминия.
Кислотные характеристики:
Al 2 O 3 + 6HCl -> 2Al 3+ + 6Cl- + 3H 2 O
Основные характеристики:
Al 2 O 3 + 2OH — + 3H 2 O -> 2 [Al (OH) 4 ] —
Нейтральные оксиды:
Некоторые соединения реагируют с кислородом с образованием оксидов, которые не обладают ни кислотными, ни основными характеристиками.Такие соединения называются нейтральными соединениями кислорода.
Пример: NO, CO
1. Основные оксиды реагируют с водой с образованием оснований.
2. Кислый оксид реагирует с основанием с образованием соли и воды.
3. Амфотерный оксид реагирует с кислотами и основаниями с образованием соли и воды.
Амфотерные оксиды Архивы — Фактор
Наука> Химия> Элементы третьего ряда> Гидроксиды элементов третьего ряда
В данной статье мы исследуем гидроксиды элементов третьего ряда.
Различные типы гидроксидов элементов третьего ряда классифицируются в зависимости от способа их диссоциации. Согласно теории Аррениуса, кислота — это вещество, которое дает ионы H + в водной среде, а основание — это вещество, которое дает ионы OH — в водной среде.
Давайте использовать M-O-H в качестве общей формулы для представления гидроксисоединения элементов третьего ряда. Режим ионизации определяет природу гидроксида, является ли он кислотным или основным.
Типы гидроксисоединений:
Основное гидроксисоединение:
Гидроксисоединения, дающие ионы OH — в водной среде, называются основными гидроксидами.
M — O — H (водн.) → M + + OH —
Это возможно, если у элемента очень низкий потенциал ионизации. Валентные электроны слабо удерживаются атомом. Из-за очень низкой энтальпии ионизации и электроотрицательности атом металла не может удерживать валентные электроны.Электронная пара между M и O больше притягивается к более электроотрицательному кислороду. Связь M-O становится слабой, а связь O-H становится прочной. Таким образом, связь между M и OH разрывается
например гидроксид натрия NaOH и гидроксид магния Mg (OH) 2 являются основными гидроксисоединениями.
NaOH (водн.) → Na + + OH —
Mg (OH) 2 (водн.) → Mg 2 + + 2 OH —
Оба гидроксида дают ионы OH — в водной среде.
Кислотные гидроксисоединения (оксикислоты):
Гидроксисоединения, которые дают ионы ОН — в водной среде, называются основными гидроксидами.
M — O — H (водн.) → MO — + H +
Это возможно, когда элемент имеет больший потенциал ионизации. Валентные электроны прочно удерживаются атомом. Из-за более высокой энтальпии ионизации и электроотрицательности атом металла сильно удерживает валентные электроны. Электронная пара между M и O тянется к более электроотрицательному элементу M.В результате связка M-O-H ведет себя как основание.
Связь
M-O становится прочной, а связь O-H становится слабой. Таким образом, связь между МО и Н разрывается, что приводит к образованию ионов Н + в водной среде.
Гидроксисоединения, которые дают ионы H + в водной среде, называются кислыми гидроксисоединениями или оксикислотами. Если предполагается, что M-O-H является кислородной кислотой, тогда связь O-H разрывается в водной среде, и это дает ионы H + .
например Si (OH) 4 кремния, P (OH) 3 и PO (OH) 3 фосфора, SO (OH) 2 и SO 2 (OH) 2 серы, ClOH , ClO (OH), ClO 2 (OH) и ClO 3 (OH) хлора являются кислыми гидроксисоединениями.
Амфотерное гидроксисоединение:
Гидроксисоединение, которое действует как кислота, а также как основание и может нейтрализовать кислоту, а также основание, производящее соль и воду, называется амфотерным гидроксидом.
Al (OH) 3 алюминия представляет собой амфотерный оксид. Он нейтрализует кислоту, а также основание, образуя соль и воду.
Al (OH) 3 (в качестве основания) + 3HCl → AlCl 3 + 3 H 2 O
Al (OH) 3 (в виде кислоты) + NaOH → NaAlO 2 (метаалюминат натрия) +2 H 2 O
Таким образом, природа гидроксидов или оксикислот в основном определяется ионизационным потенциалом элементов.
Тенденции кислотно-основного поведения гидроксисоединений:
Видно, что по мере продвижения от Na к Cl по третьему ряду основной характер гидроксисоединений постепенно снижается, а кислотный характер постепенно увеличивается.
Тенденцию кислотно-основного поведения гидроксисоединений третьего ряда можно резюмировать следующим образом.
| Элементы | Na | Mg | Al | Si | P | S | Cl |
| Гидроксисоединения | Si (OH) 4 | PO (OH) 3 | SO 2 (OH) 2 | ClO 3 (OH) | |||
| Кислота | Очень сильно щелочная | Сильно щелочная | Амфотерная | Очень слабокислая | Слабокислая | Сильно кислая | Очень сильно кислая |
Пояснение:
Природа гидроксисоединения в основном зависит от потенциала ионизации элементов.Тенденция такова, что по мере увеличения потенциала ионизации третьего ряда возрастает электроотрицательный характер, уменьшается размер атома. Вдоль третьей строки разница в электроотрицательности элемента M и кислорода уменьшается.
Если потенциал ионизации элементов низкий, то такое гидроксисоединение дает ионы OH — в водной среде и, следовательно, является основным по своей природе.
M — O — H (водн.) → M + + OH —
NaOH и Mg (OH) 2 являются основными.Na и Mg обладают низким потенциалом ионизации. Связи Na — O и Mg — O слабее связи O-H. Таким образом, связь между M и O разрывается с образованием ионов OH —.
NaOH (водн.) → Na + + OH —
Mg (OH) 2 (водн.) → Mg 2 + + 2 OH —
Если потенциал ионизации элемента больше, то такое гидроксисоединение дает ионы H + в водной среде и, следовательно, имеет кислую природу.
M — O — H (водн.) → M O — + H +
Si (OH) 4 кремния, P (OH) 3 и PO (OH 3 фосфора, SO (OH) 2 и SO 2 (OH) 2 серы, ClOH , ClO (OH), ClO 2 (OH) и ClO 3 (OH) хлора являются кислыми гидроксисоединениями.
Al (OH) 3 является амфотерным. Он нейтрализует кислоту, а также основание, производя соль и воду. Следовательно, он проявляет оба свойства, следовательно, это амфотерный оксид.
Научные причины:
Гидроксисоединение натрия NaOH — сильное основание.
Гидроксисоединения, которые дают ионы ОН — в водной среде, называются основными гидроксидами.
M — O — H (водн.) → M + + OH —
Это возможно, если у элемента очень низкий потенциал ионизации. Валентные электроны слабо удерживаются атомом. Из-за очень низкого потенциала ионизации и электроотрицательности атом металла не может удерживать валентные электроны.Электронная пара между M и O больше притягивается к более электроотрицательному кислороду. Связь M-O становится слабой, а связь O-H становится прочной.
Натрий — самый сильный электроположительный элемент. Na имеет более низкий потенциал ионизации и меньшую электроотрицательность. Связь Na-O легче разрывается в водной среде, и гидроксид натрия ионизируется как
NaOH (водн.) → Na + + OH —
Mg (OH) 2 является слабоосновным, чем NaOH.
Гидроксисоединения, которые дают ионы ОН — в водной среде, называются основными гидроксидами.
M — O — H (водн.) → M + + OH —
Это возможно, если у элемента очень низкий потенциал ионизации. Валентные электроны слабо удерживаются атомом. Из-за очень низкого потенциала ионизации и электроотрицательности атом металла не может удерживать валентные электроны. Электронная пара между M и O больше притягивается к более электроотрицательному кислороду.Связь M-O становится слабой, а связь O-H становится прочной.
Na имеет более низкий потенциал ионизации и меньшую электроотрицательность, чем у Mg. Таким образом, связь Na-O относительно слабая, чем связь Mg-O. Связь Na-O разрывается легче, чем связь Mg-O в водной среде. Таким образом, Mg (OH) 2 является слабоосновным, чем NaOH.
Гидроксид алюминия — амфотерное соединение.
Гидроксисоединение, которое действует как кислота, а также как основание и может нейтрализовать кислоту, а также основание, производящее соль и воду, называется амфотерным гидроксидом.
Al (OH) 3 алюминия представляет собой амфотерный оксид. Он нейтрализует кислоту, а также основание, образуя соль и воду.
Al (OH) 3 (в качестве основания) + 3HCl → AlCl 3 + 3 H 2 O
Al (OH) 3 (в виде кислоты) + NaOH → NaAlO 2 (метаалюминат натрия) + 2 H 2 O
Действует как основание при обработке сильной кислотой. При обработке сильным основанием действует как кислота. Из-за двойного характера Al (OH) 3 является амфотерным по своей природе.
Атомный размер алюминия меньше, чем у натрия и магния, и больше, чем у кремния, фосфора, серы и хлора. Потенциал ионизации алюминия больше, чем у натрия и магния, и меньше, чем у кремния, фосфора, серы и хлора. Электроотрицательность алюминия больше, чем у натрия и магния, и меньше, чем у кремния, фосфора, серы и хлора. Таким образом, в гидроксиде алюминия связи Al — O и O — H имеют одинаковую прочность. Следовательно, разрыв связи зависит от атакующего реагента.Следовательно, гидроксид алюминия является амфотерным соединением.
Ортокремниевая кислота Si (OH) 4 очень слабая кислота.
Электроотрицательность кремния 1,8 ед. Потенциал ионизации кремния выше, чем у алюминия.
Si — O — ковалентная связь с ионным характером. Следовательно, связь Si-O является прочной. Атом кислорода притягивает к себе общий электрон в связи O — H, и при делении образует ионы H + . Однако связь O-H не разрывается в воде.
Ортокремниевая кислота реагирует с сильной щелочью при нагревании.
H 4 SiO 4 + 2 NaOH → Na 2 Si 3 + 3 H 2 O
Гидроксисоединения фосфора, серы и хлора являются кислыми.
Фосфор, сера и хлор — это неметаллы с меньшим размером атома, высоким зарядом ядра, высоким потенциалом ионизации и высокой электроотрицательностью. Эти элементы очень мало или практически не имеют тенденции отдавать электрон кислороду.
Таким образом, в структуре M — O — H кислород пытается притягивать к себе пару электронов между O — H. Это высвобождает ионы H + в водном растворе.
Структуры гидроксисоединений фосфора или оксикислот фосфора:
Фосфорная кислота (P (OH) 3 OR H 3 PO 3 ) и фосфорная кислота (PO (OH) 3 OR (H 3 PO 4 )
H 3 PO 3 + 2 NaOH → Na 2 HPO 3 + 2 H 2 O
H 3 PO 4 + 3 NaOH → Na 3 PO 4 + 3 H 2 O
Фосфорная кислота имеет негидрированный атом кислорода, поэтому связь O-H легко разрывается.Следовательно, фосфорная кислота сильнее фосфористой кислоты.
Структуры гидроксисоединений серы или оксикислот серы:
Серная кислота SO (OH) 2 OR (H 2 SO 3 ) и серная кислота SO 2 (OH) 2 OR (H 2 SO 4 )
H 2 SO 3 + 2 NaOH → Na 2 SO 3 + 2 H 2 O
H 2 SO 4 + 2 NaOH → Na 2 SO 4 + 2 H 2 O
Эти оксикислоты серы обладают сильной кислотностью из-за большей IP серы.Серная кислота имеет два негидрированных атома кислорода, тогда как в серной кислоте есть один негидрированный атом кислорода, следовательно, серная кислота сильнее серной кислоты.
”Большой номер окисления. Больше кислой природы ». В H 2 SO 4 номер окисления. центрального атома Сера составляет +6, а в H 2 SO 3 составляет +4.
