Содержание
Как определить тип оксида?
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
1) несолеобразующие
2) основные
3) кислотные
4) амфотерные
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
Оксид неметалла | Оксид металла |
1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам | 1) Степень окисления металла равна +1, +2 Вывод: оксид металла основный Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!! |
2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 | 2) Степень окисления металла +3, +4, Вывод: оксид амфотерный. Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов |
3) Степень окисления металла +5,+6,+7 Вывод: оксид кислотный. |
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.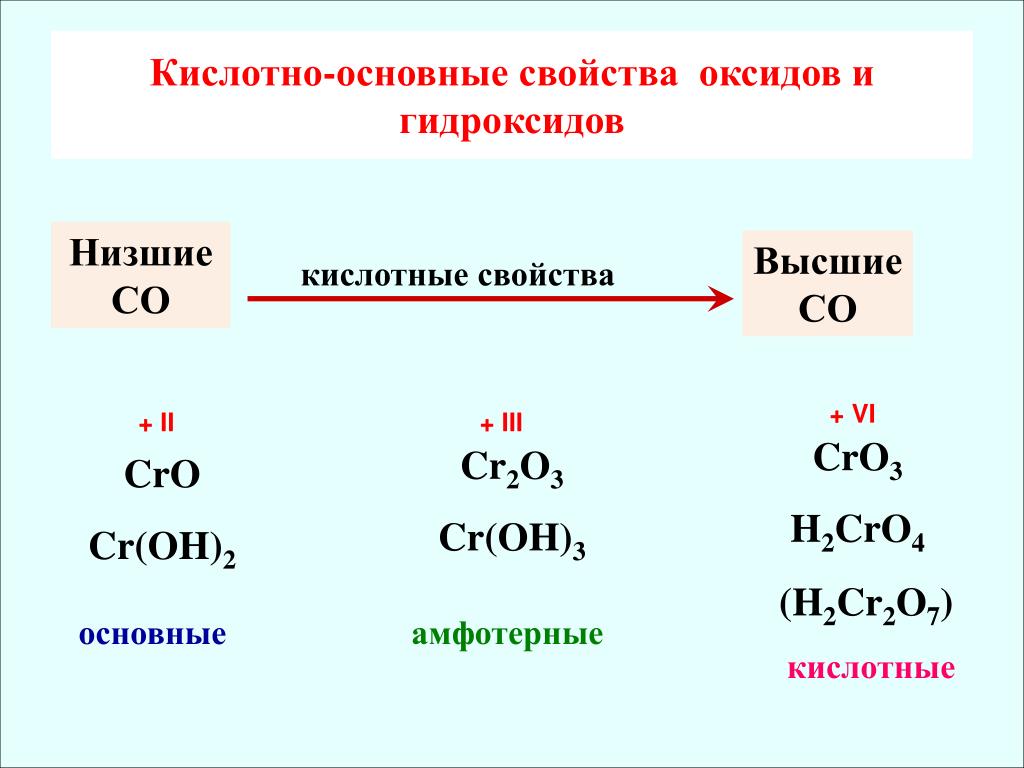
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Подборка полезной теории по химии
Химия — предмет, который сдают будущие медики, биологи и технологи. Многие считают его непонятным, но если разобраться в основах, писать реакции и решать задачи будет несложно. Этому учат на курсах подготовки к ЕГЭ. Там преподаватели начинают с нуля и доходят до самых сложных тем. В этой статье мы разберем теорию по ЕГЭ, которую должен знать каждый старшеклассник.
Этому учат на курсах подготовки к ЕГЭ. Там преподаватели начинают с нуля и доходят до самых сложных тем. В этой статье мы разберем теорию по ЕГЭ, которую должен знать каждый старшеклассник.
Соли
Соли — первая часть теории по химии для подготовки к ЕГЭ. Способы получения солей:
- кислотный оксид + основный оксид: SO3 + Na2O → Na2SO4;
- основание + кислота: HCl + NaOH → NaCl + h3O;
- кислота + основный или амфотерный оксид: 2HCl + CuO → CuCl2 + h3O;
- основание + кислотный оксид: CO2 + Cu(OH)2 → CuCO2 + 2h3O;
- кислота + соль: CaCO3 + h3SO4 → CaSO4 + 2h3O + CO2;
- окисление оксидов: 2Na2SO3 + O2 → 2Na2SO4;
- металл + неметалл: Ca + S → CaS;
- металл + кислота: Fe + 2HCl → FeCl2 + h3.
Следующая часть теории по химии по солям — химические свойства:
- диссоциация: CaCl2 → Ca2+ + 2Cl–;
- с кислотными и амфотерными оксидами: K2CO3 + SiO2 → K2SiO3 + CO2↑;
- c кислотами: KCl + h3SO4 → K2SO4 + HCl;
- с щелочами: CuSO4 + 2KOH → Cu(OH)2 + K2SO4;
- с солями: CuSO4 + BaCl2 → BaSO4↓+ CuCl2;
- с металлами, более активными чем металл соли: CuSO4 + Fe → FeSO4 + Cu;
- разложение: 2AgNO3 → 2Ag +2NO2 + O2;
- окисление: 2KI— + 2Cu+2Cl2 → 2KCl + 2Cu+Cl + I20.
Кислоты
Первая часть теории по кислотам в химии — способы получения:
- кислотный оксид + вода: SO3 + h3O → h3SO4;
- неметалл + водород: h3 + Cl2 → 2HCl;
- электролиз солей: 2CuSO4 + 2h3O → 2Cu + 2h3SO4 + O2;
- кислота + соль: CaCO3 + h3SO4 → CaSO4 + 2h3O + CO2;
- окисление оксидов: P + 5HNO3 → h4PO4 + 5NO2 + h3O.
Вторая часть теории по кислотам — химические свойства:
- диссоциация: HCl → H+ + Cl–;
- с основаниями и амфотерными гидроксидами: Cu(OH)2 + 2HBr → CuBr2 + 2h3O;
- с основными и амфотерными оксидами: CuO + 2HBr → CuBr2 + h3O;
- окисление: 2HI— + 2Cu+2Cl2 → 2HCl + 2Cu+Cl + I20;
- с солями: CaCO3 + 2HCl → CaCl2 + h3O + CO2;
- с металлами, стоящими в ряду активности до водорода: Fe + 2HCl → FeCl2 + h3;
- разложение при нагревании: 2HNO2 → NO + h3O + NO2.
Основания
Теория по химии по основаниям включает в себя способы получения:
- основные оксиды + вода: Na2O + h3O → 2NaOH;
- металл + вода: 2K + 2h3O → 2KOH + h3;
- электролиз некоторых солей щелочных металлов: 2NaCl + 2h3O → 2NaOH + h3↑ + Cl2↑;
- щелочь + соль: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.
Далее разберем теорию по химическим свойствам оснований. Первая реакция относится ко всем типам, остальные — только к щелочам:
- с кислотами: NaOH + h4PO4 → Nah3PO4 + h3O;
- с амфотерными оксидами и гидроксидами в расплаве: NaOH + Al(OH)3 → NaAlO2 + 2h3O. И в растворе: NaOH + Al(OH)3 → Na[Al(OH)4];
- с кислотными оксидами: 2NaOH + CO2 → Na2CO3 + h3O;
- с солями: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4;
- с металлами: 2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3;
- с неметаллами: 2NaOH +Cl2 → NaCl + NaClO + h3O.
Оксиды
Теорию по химии по оксидам мы начнем изучать со способов получения:
- окисление металлов: 4Al + 3O2 → 2Al2O3;
- окисление неметаллов: S + O2 → SO2;
- окисление бинарных соединений: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2;
- разложение гидроксидов: h3SO3 → h3O + SO2;
- разложение солей при нагревании: Li2CO3 → CO2 + Li2O.
Теорию по химическим свойствам разных типов оксидов представим в таблице:
|
Основные
|
Амфотерные
|
Кислотные
|
|
Al2O3 + 6HCl → 2AlCl3 + 3H2O
|
Na2O + SO2 → Na2SO3
|
SO3 + H2O → H2SO4
|
|
CaO + H2O → Ca(OH)2
|
Al2O3 + 2NaOH → 2NaAlO2 + H2O
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
|
3SO3 + Al2O3 → Al2(SO4)3
|
|
K2O + Al2O3 → 2KAlO2
|
Al2O3 + Na2O → 2NaAlO2
|
SO3 + CuO → CuSO4
|
|
CaO + 3C → CaC2 + CO
|
Na2CO3 + Al2O3 → 2NaAlO2 + CO2
|
CaCO3 + SiO2 → CaSiO3 + CO2
|
|
3ZnO + 2Al → Al2O3 + 3Zn
| 2SO2 + O2 → 2SO3 | |
|
4FeO + O2 → 2Fe2O3
|
Электролиз растворов солей
Следующий важный раздел — теория электролиза по химии. Электролиз — процессы окисления и восстановления, которые происходят при пропускании тока. Если рассматриваются растворы, то вода часто участвует в реакции. Варианты катодных процессов:
Электролиз — процессы окисления и восстановления, которые происходят при пропускании тока. Если рассматриваются растворы, то вода часто участвует в реакции. Варианты катодных процессов:
- если металл активный (до Al включительно в ряду напряжения), то восстанавливается водород, образуется щелочная среда: 2h3O + 2ē → h3 + 2OH—;
- если металл средней активности (от Al до h3), то восстанавливаются и водород, и металл: Fe2+ + 2ē → Fe0 и 2H+2O +2ē → h30 + 2OH—;
- если металл неактивный (после водорода), то восстанавливается только он: Cu2+ + 2ē → Cu0.
Анодные процессы при электролизе:
- кислотный остаток, не содержащий кислорода: 2Cl— – 2ē → Cl20;
- в случае кислотного остатка, содержащего кислород, или иона F— окисляется вода: 2h3O-2 – 4ē → O20 + 4H+;
- окисление гидроксид-иона: 4O-2H– – 4ē → O20 + 2h3O;
- в случае с остатком карбоновой кислоты окислению подвергается углерод: 2Ch4C+3OO– –2ē → 2C+4O2+ Ch4-Ch4.

Пример написания суммарной реакции электролиза:
- 2Cu2+SO4 + 2h3O-2 → 2Cu0 + 2h3SO4 + O20
- Катод (–): 2H+2O +2ē → h30 + 2OH–
- Анод (+): 2Cl– – 2ē → Cl20
Гидролиз солей
Последняя тема по химии — гидролиз солей, то есть реакция с водой. Он идет в тех случаях, когда ионы соли способны образовать с ионами H+ и OH— (они получаются при диссоциации воды) малорастворимые электролиты. Из этого следует, что соли, образованные сильным основанием и сильной кислотой (например, NaCl), не гидролизуются. Существуют необратимые реакции, но они в школьном курсе не рассматриваются. Как правило, они связаны с взаимным гидролизом нескольких солей. Рассмотрим теорию по обратимому гидролизу для ЕГЭ по химии. В этом случае гидролиз идет по слабому месту. Если это кислота, то по аниону, а если основание — по катиону. В случае, когда обе части соли являются «слабыми», гидролиз идет и по катион
- соль образована сильным основанием и слабой кислотой.
 Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;
Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH; - соль образована слабым основанием и сильной кислотой. Реакция идет по катиону: Nh5Cl + HOH ↔ Nh5OH + HCl;
- соль образована слабым основанием и слабой кислотой. Гидролиз идет и по аниону, и по катиону, среда ближе к нейтральной: Ch4COONh5 + HOH ↔ Ch4COOH + Nh5OH.
Мы разобрали основные классы неорганических соединений, а также гидролиз и электролиз в химии. Надеемся, что эта шпаргалка поможет вам подготовиться и сдать ЕГЭ. Но не забывайте о важности фундаментальных знаний, которые можно получить в школе или на курсах. Мы уверены, что у вас все получится, и вы обязательно поступите в вуз мечты.
Амфотерные оксиды
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Свойства оксидов | ЕГЭ по химии
Химические свойства оксидов: основных, амфотерных, кислотных
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления ($–2$).
Общая формула оксидов: $Э_{m}O_n$, где $m$ — число атомов элемента $Э$, а $n$ — число атомов кислорода. Оксиды могут быть твердыми (песок $SiO_2$, разновидности кварца), жидкими (оксид водорода $H_2O$), газообразными (оксиды углерода: углекислый $CO_2$ и угарный $CO$ газы). По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие.
Несолеобразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и не образуют солей. Их немного, в их состав входят неметаллы.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Среди солеобразующих оксидов различают оксиды основные, кислотные, амфотерные.
Основные оксиды — это такие оксиды, которым соответствуют основания. Например: $CaO$ соответствует $Ca(OH)_2, Na_2O — NaOH$.
Типичные реакции основных оксидов:
1. Основный оксид + кислота → соль + вода (реакция обмена):
$CaO+2HNO_3=Ca(NO_3)_2+H_2O$.
2. Основный оксид + кислотный оксид → соль (реакция соединения):
$MgO+SiO_2{→}↖{t}MgSiO_3$.
3. Основный оксид + вода → щелочь (реакция соединения):
$K_2O+H_2O=2KOH$.
Кислотные оксиды — это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов:
N2O5 соответствует $HNO_3, SO_3 — H_2SO_4, CO_2 — H_2CO_3, P_2O_5 — H_3PO_4$, а также оксиды металлов с большим значением степеней окисления: ${Cr}↖{+6}O_3$ соответствует $H_2CrO_4, {Mn_2}↖{+7}O_7 — HMnO_4$.
Типичные реакции кислотных оксидов:
1. Кислотный оксид + основание → соль + вода (реакция обмена):
$SO_2+2NaOH=Na_2SO_3+H_2O$.
2. Кислотный оксид + основный оксид → соль (реакция соединения):
$CaO+CO_2=CaCO_3$.
3. Кислотный оксид + вода → кислота (реакция соединения):
$N_2O_5+H_2O=2HNO_3$.
Такая реакция возможна, только если кислотный оксид растворим в воде.
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Это $ZnO, Al_2O_3, Cr_2O_3, V_2O_5$. Амфотерные оксиды с водой непосредственно не соединяются.
Типичные реакции амфотерных оксидов:
1. Амфотерный оксид + кислота → соль + вода (реакция обмена):
$ZnO+2HCl=ZnCl_2+H_2O$.
2. Амфотерный оксид + основание → соль + вода или комплексное соединение:
$Al_2O_3+2NaOH+3H_2O{=2Na[Al(OH)_4],}↙{\text»тетрагидроксоалюминат натрия»}$
$Al_2O_3+2NaOH={2NaAlO_2}↙{\text»алюминат натрия»}+H_2O$.
Оксиды основные — Справочник химика 21
Оксиды основные — оксиды, которым соответствуют основания. [c.375]
[c.375]
Для солеобразующих оксидов (основных, кислотных, амфотерных) фактор эквивалентности определяется числом катионов соответствующего оксиду основания или анионов соответствующей оксиду кислоты и их зарядом. [c.13]
Другими весьма эффективными химическими методами глубокой очистки веществ являются методы избирательного окисления или восстановления по отношению к очищаемому веществу или примесям. В качестве окислителя используется кислород, галогены, в особенности хлор (метод избирательного хлорирования). При использовании кислорода обычно стремятся с его помощью химически связать и удалить примеси, находящиеся в очищаемом веществе. Но иногда лучшая очистка достигается переводом в оксид основного элемента с последующим его восстановлением. [c.12]
Поверхность АУ геометрически и химически неоднородна. В зависимости от способа получения и обработки угля поверхность содержит различные привитые к ней атомы и группировки, например водород, различные оксиды основного и кислого характера. [c.166]
[c.166]
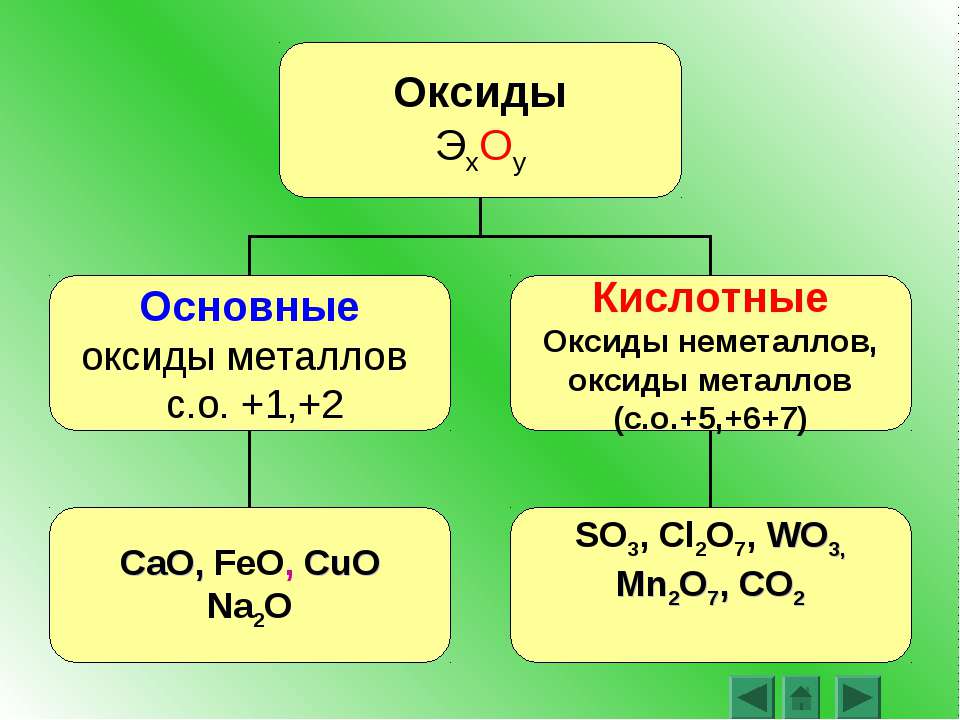
Характер оксида Основной Амфотерный Кислотный [c.94]
Различают основные, кислотные и амфотерные оксиды. Основные (или солеобразные) оксиды характеризуются ионной или [c.256]
Оксиды — это бинарные соединения, молекулы которых состоят из двух элементов, один из которых кислород. Различают основные, кислотные и амфотерные оксиды. Основным оксидам соответствуют основания, кислотным — кислоты, а амфотерные проявляют двойственность. [c.134]
Согласно первой теории малая добавка легирующего элемента должна окисляться с образованием ионов определенной степени окисления и, растворяясь в оксиде основного металла, уменьшать в нем число дефектов решетки. [c.364]
По химическим свойствам простые вещества, как известно, также подразделяются на металлы и неметаллы. С этими двумя классами генетически связаны соответствующие ряды характеристических соединений оксидов (основных и кислотных), гидроксидов (оснований и кислот). Отличительной особенностью этих рядов является способность к взаимодействию с образованием солей, т. е. к взаимной нейтрализации в широком смысле слова. Чем ярче выражены металлические и неметаллические свойства простых веществ, тем активнее взаимодействие между ними и их характеристическими соединениями. Таким образом, в химии ярко проявляется симметричность относительно кислотно-основного взаимодействия, причем каждый из генетических типов базируется на одном из двух классов простых веществ. [c.39]
Отличительной особенностью этих рядов является способность к взаимодействию с образованием солей, т. е. к взаимной нейтрализации в широком смысле слова. Чем ярче выражены металлические и неметаллические свойства простых веществ, тем активнее взаимодействие между ними и их характеристическими соединениями. Таким образом, в химии ярко проявляется симметричность относительно кислотно-основного взаимодействия, причем каждый из генетических типов базируется на одном из двух классов простых веществ. [c.39]
Способы получения. Ре, Со и N1 в свободном виде — термическое восстановление их оксидов (основной способ) водородом, оксидом углерода (II), углеродом, алюминием и другими восстановителями [c.493]
Таким образом, амфотерным оксидам присущи свойства как основных, так и кислотных оксидов. Отметим, что у различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, т. е. у этого оксида основная и кислотная функции выражены примерно в одинаковой мере. Оксид железа (III) — РезОд — обладает преимущественно основными свойствами кислотные свойства проявляет, только взаимодействуя со щелочами при высоких температурах [c.196]
е. у этого оксида основная и кислотная функции выражены примерно в одинаковой мере. Оксид железа (III) — РезОд — обладает преимущественно основными свойствами кислотные свойства проявляет, только взаимодействуя со щелочами при высоких температурах [c.196]
Понятие об оксидах (основных и кислотных). [c.222]
Свойства основных оксидов. Основные оксиды при нагревании могут вступать в реакции с кислотными и ам-фотерными оксидами, с кислотами. Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой [c.166]
Оксиды лантаноидов Э.Рз характеризуются высокими энтальпиями и энергиями Гиббса образования (AG/ = —1600 кДж/моль) и тугоплавкостью (т. пл. порядка 2000°С). Оксиды—основные соединения. В воде они практически не растворяются, но взаимодействуют с ней, образуя гидроксиды и выделяя тепло. Оксиды Э2О3 хорошо растворяются в НС и HNO3, но, будучи прокалены, как и А1Рз, теряют химическую активность. Со щелочами не взаимодействуют. Окраска оксидов определяется электронной конфигурацией иона (см. выше). [c.645]
Со щелочами не взаимодействуют. Окраска оксидов определяется электронной конфигурацией иона (см. выше). [c.645]
Оснбены.чи называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам отвечают основания. Например, оксиду кальция СаО отвечает основание гидроксид кальция Са(0Н)2 оксиду кадмия dO — гидроксид кадмия d(0H)2- [c.31]
Получение из кристаллогидратов безводных галогенидов, не содб ржащих оксидов, основных солей и окси-галогенидов, является трудоемкой операцией. Объясняется это тем, что отщепляющиеся нары воды могут взаимодействовать с уже частично обезвоженной солью, например [c.58]
Оксиды лантаноидов лучше всего получать термическим разложением нитратов, карбонатов, оксалатов или гидроксидов. Все оксиды обладают высокой температурой плавления и очень устойчивы по отношению к кислороду и воздуху. При высоких температурах низшие оксиды СеаОз, РггОз и ТЬгОз переходят в высшие СеОа, Pг60 J и ТЬ40,. Все они энергично соединяются с водой, образуя нерастворимые гидроксиды. Являясь оксидами основного характера, они легко растворяются не только в растворах сильных, но и слабых кислот, таких, как уксусная, муравьиная, хромовая и т. п. [c.67]
Все они энергично соединяются с водой, образуя нерастворимые гидроксиды. Являясь оксидами основного характера, они легко растворяются не только в растворах сильных, но и слабых кислот, таких, как уксусная, муравьиная, хромовая и т. п. [c.67]
Например, подзолистые почвы, типичные для северных районов нашей страны, образуются в условиях малого содержания органических остатков (гуминовых веществ) и большой влажности, вымывающей оксиды основного характера (КО и К2О). Частицы оксидов типа К2О3, высокодисперсные и покрытые в этих условиях защитными коллоидами — гуминовыми кислотами, также вымываются. Остающиеся коагели характеризуются высоким содержанием 8102 и малым количеством питательных веществ, необходимых для растений. [c.283]
СцдО — оксид основного характера, но может проявлять и амфотерные свойства,- растворяясь в концентрированных растворах щелочей [c.388]
Например, подзолистые почвы, типичные для средних районов нашей страны, образуются в условиях малого содержания органического вещества и большой влажности, которая способствует вымыванию оксидов основного характера (МО и МаО). Частицы оксидов типа М2О3, защищенные гуминовыми кислотами, также вымываются в этих условиях. Остающиеся коагели характеризуются высоким содержанием ЗЮг и малым содержанием питательных веществ, необходимых для растений. [c.340]
Частицы оксидов типа М2О3, защищенные гуминовыми кислотами, также вымываются в этих условиях. Остающиеся коагели характеризуются высоким содержанием ЗЮг и малым содержанием питательных веществ, необходимых для растений. [c.340]
Основные оксиды. Основными называются такие оксиды, которым соответствуют основания. Например, NajO, СаО, FeO, NiO являются основными оксидами, так как им соответствуют основания NaOH, a(OH)a, Fe(0H)2, Ni(OH)a. Некоторые основные оксиды при взаимодействии с водой образуют основания. Например [c.124]
Помимо оксидов основного, кислотного и амфотерпого типа, можно выделить так называемые несолеобразующие оксиды, которые не образуют с водой гидратных форм и не могут быть ни основными, ни кислотными. Примером таких соединений служит N0. Обычно к несолеобразующим оксидам относят СО, хотя при высоких давлениях оксид углерода может взаимодействовать со щелочами, [c.24]
Химические свойства. Ае20 — оксид основного характера [c.404]
Ае20 — оксид основного характера [c.404]
Этилен- и пропиленгликоли продукты находят широкое применение в качестве растворителей, антифризов и др. Мировой объем их производства превышает 15 млн. тонн в год [1]. В настоящее время гликолю получают путем некаталитической гидратации а-оксидов, которую осуществляют при 140-200°С и 20-40 ат, с использованием 8-10 кратного массового избытка воды по отношению к а-оксиду. Основными недостатками этого процесса являются низкий выход моногликоля (менее 90%), а также высокие энергозатраты при вьщелении гликолей из разбавленных (12-15%) водных растворов. Одним из основных путей повышения эффективности процесса гидратации является использование гетерогенных катализаторов [2-6]. [c.66]
Этилен- и пропиленгликоль находят широкое применение в качестве полупродуктов для синтеза полимерных материалов и антифризов. Мировой объем их производства превышает 15 млн т в год [1]. В настояшее время в основным промышленным способом получения гликолей является гфоцесс некаталитической гидратации а-оксидов, осуществляемый при 140-200°С и 20-40 атм, с использованием 8-10 кратного массового избытка воды по отношению к а-оксиду. Основными недостатками этого процесса являются низкий выход моногликоля (менее 90%), а также высокие энергозатраты при выделении гликолей из разбавленных (12-15%-х) водных растворов. В связи с этим актуальной задачей является разработка про- [c.139]
Основными недостатками этого процесса являются низкий выход моногликоля (менее 90%), а также высокие энергозатраты при выделении гликолей из разбавленных (12-15%-х) водных растворов. В связи с этим актуальной задачей является разработка про- [c.139]
Пигменты, используемые для получения красок и чернил, чаще всего состоят из различных солей и оксидов. Основной карбонат свинца (свинцовые белила) Pb(OH)j РЬСОз долгое время служил практически единственным белым пигментом, однако в настоящее время почти полностью вытеснен различными нетоксичными пигментами, например диоксидом титана ТЮз- Последний не только безвреден, но, кроме того, обладает приблизительно в 5— 10 раз больщей отражающей способностью (белизной), чем свинцовые белила. Среди других белых пигментов можно указать ZnO, ZnS и литопон (смесь BaS04 и ZnS). Многие современные пигменты состоят из органических комплексов и относятся к классу красителей, и все же некоторые традиционно употребляемые краски по-прежнему изготовляют на основе простых солей и оксидов. Кирпично-красную краску получают из пигмента оксида железа существуют также желтый, коричневый и черный оксиды железа, которые используют для изготовления других красок. Ранее широко применяли краски на основе таких пигментов, как желтый dS, желтый РЬСгО , голубой Ред [Ре(С№ ]з и красный HgS, но в настоящее время больщинство их исчезло из продажи из-за высокой стоимости и других недостатков. Наиболее распространенный черный пигмент, применяемый для изготовления красок и чернил,— это элементарный углерод в виде сажи. [c.256]
Кирпично-красную краску получают из пигмента оксида железа существуют также желтый, коричневый и черный оксиды железа, которые используют для изготовления других красок. Ранее широко применяли краски на основе таких пигментов, как желтый dS, желтый РЬСгО , голубой Ред [Ре(С№ ]з и красный HgS, но в настоящее время больщинство их исчезло из продажи из-за высокой стоимости и других недостатков. Наиболее распространенный черный пигмент, применяемый для изготовления красок и чернил,— это элементарный углерод в виде сажи. [c.256]
Химические свойства Ag20 — оксид основного характера [c.404]
Кислотно-основные свойства оксидов и гидроксидов изменяются в полном соответствии со схемой Косселя угольная Н2СО3 и кремниевые кислоты ЗЮг лНгО являются слабыми, у ОеОг пНгО кислотная диссоциация преобладает над основной, а в оксидах ЗпОг и РЬОг превалируют основные свойства, хотя оба оксида также образуют станнаты (КагЗпОз) и плюмбаты (ЫааРЬОз). В двухвалентном состоянии у оксидов основные свойства гораздо сильнее и эта тенденция от Се и РЬ еще более заметна. [c.146]
[c.146]
Оксид диметиланилина может быть конечным продуктом окисления или же интермедиантом в реакции метаболизма диметиланилина. Для ряда соединений, например импрамина, никотршамида и др., образование Л -оксидов — основной путь их метаболизма. [c.515]
Оксиды. — Химия — Подготовка к ЕГЭ
ОКСИДЫ
Оксидами называются сложные вещества, в состав которых входят атомы кислорода и какого-нибудь другого элемента. Иначе говоря, оксид – это соединение элемента с кислородом.
Оксиды можно получить как при непосредственном взаимо-действии кислорода с другим элементом, так и косвенным путем (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твердом (кремний-оксид(II), халцедон, аметист, горный хрусталь), жидком (вода), газообразном (угарный газ, углекислый газ) состояниях.
По химическим свойствам все оксиды подразделяют на солеобразующие и несолеобразующие или безразличные.
Несолеобразующими оксидами называют такие оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей. Несолеобразующих оксидов немного. К ним относятся: СО, NO, N2О,SiО.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами, основаниями и образуют при этом соль и воду, например: оксид калия – K2O, оксид натрия – Na2O.
Среди солеобразующих оксидов различают оксиды основные, кислотные и амфотерные.
А) Основные оксиды
Основными оксидами называются такие, которые при взаимодействии с кислотами образуют соль и воду. Соединения этих оксидов с водой относятся к классу оснований (гидроксидов).
Примерами основных оксидов могут служить Na2O, CaO, BaO, FeO, CuO, которым соответствуют основания (гидроксиды) NaOH, Ca(OH)2 , Ba(OH)2 и т. д. К основным оксидам относятся оксиды металлов с небольшими степенями окисления(+1 и +2),то есть оксиды металлов I и II группы периодической системы. Все основные оксиды представляют собой твердые вещества.
д. К основным оксидам относятся оксиды металлов с небольшими степенями окисления(+1 и +2),то есть оксиды металлов I и II группы периодической системы. Все основные оксиды представляют собой твердые вещества.
2
Химические свойства основных оксидов.
1. Основный оксид + кислота → соль + вода (реакция обмена).
CuO + 2HNO3 = Cu (NO3)2 + H2O
Основный оксид + кислотный оксид → соль (реакция соединения).
CaO + N2O5 = Ca (NO3)2
Основный оксид + вода → щелочь (реакция соединения).
K2O + H2O = 2KOH
Эта реакция протекает только в том случае, если образуется растворимое основание, поэтому
CuO + H2O ≠ т.к. Cu(OH)2 – нерастворимое основание.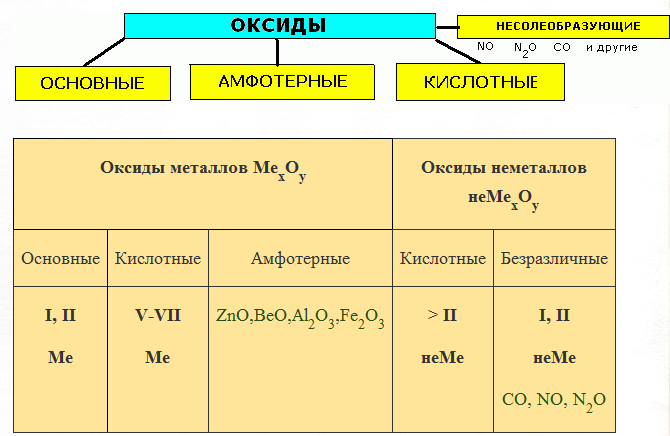
Основной оксид + амфотерный оксид = соль (реакция соединения).
Оксиды ртути, серебра и благородных металлов распадаются при нагревании.
2HgO = 2Hg + O2
Основные оксиды могут вступать в окислительно- восстановительные реакции.
Fe2O3 + 2Al = 2Fe + Al2O3
2PbO + C = 2Pb + CO2
MnO + CO = Mn + CO2
CuO + H2 = Cu + H2O
Б) Кислотные оксиды.
Кислотными оксидами называются такие, которые при взаимодействии с основаниями образуют соль и воду. Соединения этих оксидов с водой относятся к классу кислот. Например, SO3, P2O5, CrO3 являются кислотными оксидами, которым соответ-ствуют кислоты H2SO4, H3PO4 и H2CrO4. Кислотные оксиды иначе называют ангидридами кислот.
К кислотным оксидам относятся оксиды неметаллов, а также оксиды металлов с большим значением степеней окисления, например:
CrO3 – H2CrO4
Mn2O7 – HMnO4
Химические свойства кислотных оксидов.
1. Кислотный оксид + щелочь → соль + вода (реакция обмена).
SO2 + 2NaOH = Na2SO4 + H2O
Кислотный оксид + основный оксид → соль (реакция соединения).
FeO + SO2 = FeSO3
3. Кислотный оксид + вода → кислота (реакция соединения).
SO3 + H2O = H2SO4
Эта реакция возможна только в том случае, если кислотный оксид растворим в воде, поэтому
SiO2 + H2O ≠ т.к. SiO2 – нерастворимый оксид.
4. Вступают в окислительно – восстановительные реакции
CO2 + C = 2CO2
CO2 + 2Mg = C + 2MgO
SO2 + 2H2S = 3S + 2H2O
5. Вступают в реакцию замещения с солями, если менее летучий оксид вытесняет более летучий.
CaCO3 + SiO2 = CaSiO2 + CO2 (при нагревании).
6. Несолеобразующий оксид СО кислотно-основных свойств не проявляет, однако взаимодействует с расплавом щёлочи при нагревании и давлении, образуя формиаты. При этом СО проявляет псевдокислотные свойства CO + NaOH = HCOONa.
В) Амфотерные оксиды
К амфотерным оксидам относятся такие, которые взаимодействуют с кислотами и основаниями с образованием соли и воды. Соединения этих оксидов с водой могут иметь как кислотные, так и основные свойства. Примеры указанных оксидов — Al2O3, Cr2O3, ZnO, (Fe2O3 – амфотерный, но слабо выражены кислотные свойства).
Химические свойства амфотерных оксидов.
1. Амфотерный оксид + кислота → соль + вода
4
Al2O3 + 6HBr = 2AlBr3 + 3H2O
2. Амфотерный оксид + кислотный оксид → соль
ZnO + SO3 = ZnSO4
3. Амфотерный оксид + щелочь → соль + вода
Al2O3 + 2NaOH( твёрдый ) =t 2NaAlO2 + H2O и
Al2O3 + 2NaOH( раствор ) + 3H2O = 2Na[Al(OH)4]
4.Амфотерный оксид + основный оксид → соль
ZnO + K2O = 2K2ZnO2
5. Амфотерные оксиды не реагируют с водой.
Получение оксидов.
Простое вещество + кислород
2C + O2 = 2CO
Разложение некоторых кислот (устойчивы к нагреванию сероводородная и фосфорная кислоты)
H2SiO3 → H2O + SiO2
Разложение при нагревании нерастворимых оснований
Cu(OH)2 → CuO + H2O
Разложение при нагревании некоторых солей
CaCO3 → CaO + CO2
Окисление (горение) сложных веществ
C6H12O6 + 6O2 = 6CO2 + H2O
Окисление сложных веществ
2NO + O2 = 2NO2
7. Реакция замещения, в ходе которых химически более активный металл вытесняет менее активный из его оксида.
Al + Fe2O3 = Al2O3 + Fe,
8. Обработка металлической стружки сильной кислотой
Cu + 4HNO3 (конц.) = Cu (NO3)2 + 2NO2+ 2H2O,
6.1 Важнейшие классы неорганических веществ
Раздел 6. Важнейшие классы неорганических веществ, их
свойства и способы получения
6.1.
Оксиды и основания, их свойства и способы
Оксидами называют сложные вещества, состоящие из
двух элементов, одним из которых является кислород, находящийся в степени
окисления -2. Примерами оксидов являются Al2O3 — оксид алюминия, SiO2 — оксид кремния, NO — оксид азота(II).
Согласно международной номенклатуре
рассматриваемые соединения называют оксидами
с указанием степени окисления элемента, если этот элемент образует несколько
оксидов. При написании названия степень окисления обозначается римскими
цифрами в скобках, например, FeO – оксид железа (II), Fe2O3 – оксид железа (III), SO2 – оксид серы (IV), SO3 – оксид серы (VI). Очень часто в
литературе встречаются и тривиальные названия оксидов – сурик (Pb3O4),
веселящий газ (N2O), железная окалина (Fe3O4)
и многие др.
Оксиды подразделяются на солеобразующие и
несолеобразующие. Солеобразующие оксиды принято делить на основные, амфотерные и
кислотные.
От оксидов следует отличать пероксиды, например H2O2,
Na2O2 и надперокиды КО2, СsО2. В
этих соединениях степень окисления кислорода по абсолютной величине меньше двух
и может быть дробной.
Основные оксиды
Основные оксиды образуются только
металлами, им в качестве гидратов соответствуют основания. Например, CaO, FeO,
CuO являются основными оксидами, поскольку им соответствуют основания Ca(OH)2,
Fe(OH)2, Cu(OH)2.
Получение основных оксидов
Основные оксиды получаются:
·
окислением
металлов кислородом:
при окислении щелочных металлов кислородом
только литий образует Li2O. Натрий дает пероксид (Na2O2),
остальные — надпероксиды (КО2 ,
RbO2 , CsO2).
·
разложением
при нагревании кислородных соединений: гидроксидов, нитратов, карбонатов:
2
Fe(OH)3 → Fe2O3 + 3 H2O,
2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2,
CaCO3 → CaO + CO2 (кроме карбонатов щелочных металлов).
·
обжигом
сульфидов:
2 ZnS + 3 O2 → 2 ZnO + 2 SO2.
Химические свойства основных оксидов
Оксиды щелочных и щелочноземельных металлов непосредственно
реагируют с водой:
Na2 O + H2 O → 2 NaOH,
Основные оксиды взаимодействуют с кислотами, образуя соль и воду,
например:
FeO + 2 HCl → FeCl2 + H2O;
Основные оксиды реагируют также с кислотными оксидами:
Основные оксиды могут также вступать в
окислительно–восстановительные реакции:
Fe2O3 + 3 C → 2 Fe + 3 CO,
Кислотные оксиды
Кислотные оксиды образуются неметаллами
(SO2, SO3, CO2, P4O10 и т.д.) или переходными металлами,
находящимися в высоких степенях окисления (например, CrO3, Mn2O7).
Кислотные оксиды получают теми же
способами, что и основные оксиды. Например:
4 FeS2 + 11O2 → 2 Fe2O3 + 8 SO2,
Zn2(OH)2CO3 → 2 ZnO + CO2 + H2O,
а также
разложением кислот:
H2SiO3 → SiO2 + H2O.
Химические
свойства кислотных оксидов
1. Некоторые кислотные оксиды образуют кислоты при взаимодействии
с водой:
N2O5 + H2O → 2 HNO3.
Некоторые кислотные оксиды являются ангидридами кислот. Например, SO3 – ангидрид серной кислоты, SO2 – ангидрид сернистой кислоты, CO2 – ангидрид угольной кислоты, P4O10 является ангидридом трех кислот
(метафосфорной НРО3, ортофосфорной Н3РО4,
пирофосфорной Н4Р2О7).
2. Кислотные оксиды взаимодействуют с основными, образуя соли:
SO3 + СаO → CaSO4.
3. Кислотные оксиды взаимодействуют с основаниями, образуя соль и
воду:
CO2 + 2 NaOH → Na2CO3 + H2O.
4. Как и другие типы оксидов, кислотные оксиды могут вступать в
окислительно–восстановительные реакции:
CO2 + 2 Mg → C + 2 MgO,
SO2 + 2 H2S → 3 S + 2H2O.
Амфотерные оксиды
Амфотерные оксиды обладают двойственными
свойствами, т.е. в зависимости от условий проявляют основные или кислотные
свойства. К ним относятся: ZnO, Al2O3, BeO, Cr2O3 и т. д. Амфотерные оксиды с водой не
взаимодействуют, но реагируют и с кислотами, и с основаниями. Например:
ZnO + H2SO4 → ZnSO4 + H2,
ZnO+ 2 NaOH + H2O → Na2[Zn(OH)4].
Амфотерные оксиды могут взаимодействовать
как с основными, так и с кислотными оксидами:
Амфотерные оксиды при сплавлении со
щелочами или карбонатами щелочных металлов образуют соли:
ZnO + 2
NaOH → Na2ZnO2 + H2O,
Al2O3 + 2 NaOH → 2 NaAlO2 + H2O.
Al2O3 + Na2CO3 → 2 NaAlO2 + CO2
Физические свойства оксидов очень
разнообразны. Все основные и амфотерные оксиды, а также некоторые кислотные
оксиды (SiO2, Р4О10 и др.) являются твердыми веществами.
Многие кислотные оксиды при обычной температуре являются газами (SO2,
CO2) или жидкостями (Cl2O7, Mn2O7).
Свойства несолеобразующих
оксидов (СO, NO, N2O
и др.) будут описаны в следующих разделах, которые посвящены химии
соответствующих элементов.
Следует упомянуть о смешанных оксидах (Pb2O3,
Pb3O4 и
др.), в которых один и тот же элемент (Pb) находится в различных степенях
окисления. Эти соединения можно также отнести к солям: Pb+2Pb+4O3,
Pb2+2Pb+4O2.
Основаниями
с точки зрения теории электролитической диссоциации являются соединения, при
диссоциации которых в качестве анионов образуются гидроксо-группы ОН–.
Свойствами оснований могут обладать не только гидроксиды металлов, но и
некоторые другие вещества, например, NH3, молекула которого может
присоединить протон:
Номенклатура оснований
По международной номенклатуре основания принято
называть гидроксидами
элементов: NaOH –
гидроксид натрия, CsOH – гидроксид цезия.
Если элемент может образовывать несколько
оснований, то в названиях в скобках римской цифрой указывается его степень
окисления. Например, Fe(OH)2 –
гидроксид железа (II), Fe(OH)3 –
гидроксид железа (III).
Большинство оснований мало растворимы в
воде. Растворимые в воде основания называются щелочами . Щелочами являются, например,
NaOH, KOH, Ba(OH)2.
Получение
оснований
Общим способом получения оснований является
реакция обмена между солью и щелочью:
Cu(NO3)2 + 2 KOH → Cu(OH)2 ↓ + 2KNO3 ,
Na2CO3 + Ba(OH)2 → BaCO3 ↓ + 2 NaOH.
Щелочи образуются при взаимодействии
щелочных и щелочноземельных металлов, а также их оксидов с водой:
2 Na +
2 H2O → 2 NaOH + H2 ↓,
В промышленности щелочи обычно получают
электролизом водных растворов хлоридов:
2 KCl +
2 H2O → 2 KOH + H2↓ + Cl2↓.
Свойства
оснований
Растворы щелочей изменяют окраску
индикаторов: бесцветный фенолфталеин переходит в малиновый цвет, метилоранж – в
желтый, лакмус – в синий.
Большинство малорастворимых в воде
оснований при нагревании легко разлагаются:
Щелочи термически устойчивы и плавятся без
разложения. Исключение составляет гидроксид лития, который также разлагается
при нагревании:
Как щелочи, так и нерастворимые основания
могут реагировать с кислотами (реакция нейтрализации):
NaOH +
2 HCl → NaCl + H2O,
2
Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Взаимодействие оснований с кислотными и
амфотерными оксидами рассмотрено в разделе 8.1.
Амфотерные гидроксиды взаимодействуют как
с кислотами, так и с основаниями. Например:
Al(OH)3 + 3 HCl → AlCl3 + H2O
Al(OH)3 + 3 NaOH → Na3[Al(OH)6]
В водных растворах, содержащих щелочь,
наряду с [Al(OH)6]3–, существуют и другие ионы, в
частности, [Al(OH)5]2–, [Al(OH)4]–,
[Al О(OH)4]3– и
др. В гидрооксокомплексах алюминия содержатся также молекулы Н2О,
которые в формулах обычно не указывают.
К амфотерным гидроксидам относятся Zn(OH)2,
Al(OH)3, Cr(OH)3, Be(OH)2, Pb(OH)2 и др.
В заключение следует отметить способность
щелочей взаимодействовать с некоторыми неметаллами и оксидами:
6 KOH +
3 S → K2SO3 + 2 K2S + 3 H2O,
6 NaOH
+ 3 Cl2 → 5 NaCl + NaClO3 + 3 H2O,
2 KOH +
NO2 → KNO2 + KNO3 + H2O.
1. Из приведённого перечня
выберите оксиды, назовите их, определите тип.
1)Na2O2 2) Li2O 3) Al 2O3 4) FeO 5) P2O5 6) CO2 7) OF2 8) MgO
2)Оксид лития (основный)
3)Оксид алюминия (амфотерный)
4)Оксид железа (II)
(основный)
5)Оксид фосфора (V)
(кислотный)
6)Оксид углерода (IV)
(кислотный)
8) Оксид магния (основный)
__________________________________________________________________
2.
С
какими из перечисленных веществ может реагировать а) Li2O б)CO2 в)Al2O3
1)Na2O 2)SO3 3)H2O 4)NaOH 5)H2SO4 6)Na2SO4 7)O2 8) AlCl3
Li2O реагирует с веществами
2,3,5
CO2 реагирует с веществами 1,3,4
Al2O3 реагирует с веществами 4,5
__________________________________________________________________
3.
Из приведённого перечня выберите
основания, назовите их, определите тип.
1) NaOH 2) Li2O 3) Ba(OH)2 4)
CuSO4 5)
P2O5 6)
Al(OH)3 7) HCl 8) C2H5OH
1)
Гидроксид натрия – однокислотное растворимое основание
3) Гидроксид бария – двухкислотное растворимое
основание
6) Гидроксид алюминия – трёхкислотное
нерастворимое основание
__________________________________________________________________
4.
С какими из перечисленных веществ может реагировать а) NaOH б) Cu(OH)2
1)Na2O 2)SO3 3)H2O 4)NaOH 5)H2SO4 6)Na2SO4 7) HCl 8) AlCl3
NaOH реагирует с веществами 2,5,7,8
Cu(OH)2 реагирует с веществами 5,7
__________________________________________________________________
5. На 47 г оксида
калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося
нитрата калия.
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(K2O) =
2Ar(K) + 1Ar(O) = 2•39 + 1•16 = 94,
Mr(HNO3) =
1Ar(H) + 1Ar(N) + 3Ar(O)
= 1•1 + 1•14 + 3•16 = 63,
Mr(KNO3) =
1Ar(K) + 1Ar(N) + 3Ar(O)
= 1•39 + 1•14 + 3•16 = 101.
Для
удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших
в реакцию, дано в избытке, какое – в недостатке.
47/94
= х1/126, х1 = 63 г.
Следовательно,
азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету
необходимо 63 г, поэтому расчет ведем по HNO3:
40/126
= х/202, х = 64 г.
Ответ. m(КNO3) = 64 г.
____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Закончите уравнения реакций в молекулярном и ионном
виде:
2. Напишите
уравнения двух реакций получения: а) гидроксида цезия, б) гидроксида железа (III).
3. С помощью каких
реакций можно получить оксид никеля (II) NiO из
сульфата никеля (II) NiSO4 ?
4. Напишите
уравнения реакций всех способов получения оксида хрома (III), оксида углерода (IV),
оксида кальция.
5. С какими из
следующих веществ будет реагировать оксид углерода (IV):
Напишите уравнения соответствующих реакций.
6. С какими из
следующих веществ будет реагировать гидроксид калия:
Напишите уравнения соответствующих реакций в
молекулярном и ионном виде.
7. С какими из
следующих веществ будет реагировать оксид цинка:
Напишите уравнения соответствующих реакций
в молекулярном и ионном виде.
8. Можно ли
приготовить раствор, содержащий одновременно следующие вещества:
9. Оксид натрия
массой 12,4 г растворили в воде. Какой
объем оксида углерода (IV), измеренный
при нормальных условиях, потребуется для нейтрализации полученного гидроксида
натрия, если при этом образуется кислая соль?
10.
Сколько
граммов гидроксида железа (III) надо
разложить, чтобы получить 0,95 г оксида железа (III)?
1. | |
б) P2O5, Mn2O7, SiO2 | |
2. | |
3. | |
4. | |
а) оксид алюминия, оксид железа (II), оксид углерода (IV) | б) оксид бария, оксид азота (V), оксид |
в) оксид алюминия, оксид железа(III), оксид | г) оксид цинка, оксид калия, оксид |
5. | |
6. | |
а) кислотным и основным | б) основным и кислотным |
в) кислотным и амфотерным | г) основным и амфотерным |
7. | |
в) основными оксидами | |
8. | |
а)NaOH, Ca(OH)2, Mg(OH)2 | б) KOH, NH4OH, Cu(OH)2 |
в) NaOH, | |
9. | |
а) растворимыми солями меди | б) слабыми кислотами |
в) основными оксидами | г) амфотерными гидроксидами |
10. | |
а) калия и воды | б) карбоната натрия и гидроксида бария |
в) хлорида алюминия и гидроксида | г) оксида натрия и воды |
Здравствуйте, я знаю, что такое амфотерные оксиды, но какой фактор определяет, является ли оксид амфотерным?
Основные оксиды
Металлический характер увеличивается справа налево и сверху вниз в Периодической таблице.
Самые металлические элементы образуют самые основные оксиды.
Даже если оксиды нерастворимы в воде, мы все равно называем их основными оксидами, потому что они вступают в реакцию с кислотами.
# «MgO (s) + 2HCl (водн.) → MgCl» _2 «(водн.)» + «H» _2 «O» (l) «#
Кислые оксиды
Неметаллический символ увеличивается слева направо и снизу вверх в Периодической таблице.
Самые неметаллические элементы образуют наиболее кислые оксиды.
Они реагируют с водой с образованием оксокислот. Например,
# «SO» _2 «(вод.)» + «H» _2 «O (l)» → «H» _2 «SO» _3 «(вод.)» #
Даже если оксид нерастворим в воде, мы все равно относим его к кислому, если он реагирует с основаниями с образованием солей. Например,
# «TeO» _2 «(s)» + «2NaOH (водн.)» → «Na» _2 «TeO» _3 «(водн.)» + «H» _2 «O (l)» #
Амфотерные оксиды
Некоторые оксиды реагируют как с кислотами, так и с основаниями, то есть они амфотерные .»-» «(водн.)» #
Более легкие элементы групп 2 и 13, некоторые из # «d» # — блочных элементов и более тяжелые элементы групп 14 и 15 содержат амфотерные оксиды.
Самые основные оксиды находятся в нижнем левом углу Периодической таблицы, а самые кислые оксиды — в верхнем правом углу, поэтому неудивительно, что граница между кислотными и основными оксидами проходит по диагонали.
Амфотеризм и степени окисления
Амфотеризм зависит от степени окисления оксида.
Нет простого способа предсказать, какие элементы будут амфотерными.
Амфотерный характер оксида, вероятно, отражает способность металла поляризовать окружающие ионы оксида, то есть придавать значительный ковалентный характер связи # «M-O» #.
Эта способность увеличивается с увеличением степени окисления, поскольку положительный характер центрального атома увеличивается.
Однако в группе 15 амфотерными являются только оксиды с более низкой степенью окисления.
Оксиды с более высокой степенью окисления слишком кислые, чтобы быть амфотерными.
Видеоурок: Реакции оксидов
Стенограмма видео
В этом видео мы узнаем, что
оксид является кислотным, основным, амфотерным и нейтральным. Посмотрим на химические
уравнения того, как некоторые оксиды реагируют с кислотами. Во-первых, давайте спросим себя, что такое
оксид? Оксид — это соединение, которое
содержит кислород элемента, связанный с другим элементом.Например, в углекислом газе
кислород связан с углеродом. Некоторые часто встречающиеся оксиды
о которых вы, возможно, слышали, оксид железа (III), который является основным компонентом
ржавчина, диоксид серы, который иногда используется в качестве консерванта, диазот
монооксид, который является названием ИЮПАК, а общее название — закись азота, это
веселящий газ, вода, диоксид кремния или кремнезем, который является основным компонентом песка,
оксид алюминия и оксид магния.
Возможно, вы добыли магний
оксид в лаборатории. Щипцы содержат магний
лента в пламени горелки Бунзена. Происходит сильно экзотермическая реакция
при этом выделяется много тепла и света, поскольку магний реагирует с кислородом в
воздух для производства оксида магния. Все оксиды можно разделить на
одна из четырех групп: кислотные, основные, амфотерные или нейтральные оксиды. Давайте рассмотрим это и начнем
с кислыми оксидами.Кислотные оксиды — это те, которые при
они реагируют с водой с образованием кислот. Эти оксиды содержат неметаллы из
группы с 14 по 17 периодической таблицы. Общее уравнение неметалла
оксид плюс вода реагируют с образованием кислоты. Давайте посмотрим на несколько примеров.
Когда диоксид серы вступает в реакцию с
вода, образуется сернистая кислота, h3SO3. Когда оксид неметалла, углерод
диоксид, реагирует с водой, образуется углекислота или h3CO3.Эти две реакции могут происходить в
окружающая среда, когда в атмосфере много SO2 и CO2. Жидкая вода и капли дождя могут
взаимодействуют с диоксидом углерода и диоксидом серы в атмосфере и производят
две кислоты — угольная и сернистая. Эти две кислоты являются компонентами
кислотный дождь. Последний пример того, когда неметалл
оксид взаимодействует с водой с образованием кислоты — это реакция диоксида азота
газ с водой для получения азотной кислоты.Если несколько капель универсального
индикатор добавлялся в растворы этих кислот, он становился красно-оранжевым, показывая, что
что оксиды неметаллов SO2, CO2 и NO2, когда они реагируют с водой, действительно
производят кислоты.
Теперь давайте посмотрим на основные
оксиды. Основной оксид — это оксид, который
при реакции с водой образует основание или щелочь. Обычно основные оксиды содержат
металлы из первой или второй группы периодической таблицы.Общее уравнение — оксид металла
плюс вода реагирует с образованием основания или щелочи. Щелочь — это вещество, содержащее
гидроксид-ион ОН-. Вот два примера уравнений
где оксиды металлов производят гидроксиды или щелочные растворы. В первом случае оксид натрия реагирует
с водой с образованием гидроксида натрия, а во втором оксид кальция реагирует с
вода для производства гидроксида кальция. Гидроксид натрия хорошо растворим
в воде, в то время как гидроксид кальция мало растворим.Тем не менее, если несколько капель
к этим растворам добавлялся универсальный индикатор, он становился сине-фиолетовым,
подтверждение того, что растворы являются щелочными или щелочными, и доказательство того, что эти оксиды
действительно реагирует с водой с образованием оснований или щелочей.
До сих пор мы видели, что неметаллический
оксиды или кислые оксиды реагируют с водой с образованием кислот и оксидов металлов или
основные оксиды реагируют с водой с образованием основания.Кислые оксиды также могут действовать как
кислоты и реагируют с основанием с образованием соли и воды. И основные оксиды могут действовать как
основания в результате реакции с кислотой с образованием соли и воды. Применяется общее правило: кислота
реагирует с основанием с образованием соли и воды. Чуть позже в этом видео мы
конкретно посмотрите, как основные оксиды реагируют с кислотами с образованием соли и
вода. А пока перейдем к третьему
тип оксида, амфотерные оксиды.
Амфотерные оксиды в отличие от кислых
и основные оксиды, обычно не растворяются в воде и не реагируют с ней. Тем не менее, они показывают как кислотные
и основные свойства. Они ведут себя как кислота, когда
реагируют с основанием, и они ведут себя как основание, когда реагируют с кислотой. Эти оксиды содержат такие металлы, как
медь, цинк, свинец, бериллий, алюминий и олово. Мы видели минуту назад, что когда
Реакция взаимодействия кислоты и основания с образованием соли и воды.Так как амфотерные оксиды могут
ведут себя как кислоты или основания, есть два общих уравнения, на которые следует обратить внимание. Когда эти оксиды ведут себя как
кислота, уравнение представляет собой амфотерный оксид плюс основание, что дает соль и воду. И когда они реагируют как база,
уравнение — амфотерный оксид плюс кислота, дающие соль и воду.
Рассмотрим пример для
каждый. Оксид алюминия амфотерный. Не растворяется и не реагирует
с водой и может действовать как кислота или щелочь.Когда он реагирует с основанием, таким как
производятся гидроксид натрия, алюминат натрия, соль и вода. Обратите внимание, что эта формула
упрощение. Алюминий может образовывать довольно сложные
ионы в растворе. Формула натрия здесь
алюминат на самом деле является формулой твердого безводного продукта. Но алюминат натрия в
присутствие воды хорошо растворимо и поэтому будет реагировать с водой с образованием гидратированного
соединение сложной формулы, на которое мы здесь не будем смотреть.Когда этот амфотерный оксид реагирует
с кислотой образуется соль хлорида алюминия. Эта двойственная природа амфотерного
оксиды указаны по их названию. Слово амфотерный происходит от
Греческое слово amphoteroi, означающее и то, и другое.
Перейдем к последнему типу
оксид, нейтральные оксиды. Нейтральные оксиды не показывают кислых
или основные свойства и не вступают в реакцию с кислотами или основаниями. Есть только несколько известных нейтральных
оксиды, в том числе оксид углерода, оксид азота и оксид азота.Опять же, нейтральные оксиды не
вступают в реакцию с кислотами или основаниями. А теперь давайте посмотрим конкретно
о том, как основные оксиды реагируют с кислотами с образованием соли и воды, а также еще кое-что.
примеры того, как амфотерные оксиды могут действовать как основания, реагировать с кислотами и производить
соль и вода. Когда оксид натрия реагирует с
соляная кислота, хлорид натрия и вода. Обратите внимание, что анион в кислоте
и катион в основном оксиде определяет, какая соль образуется.
Вы можете угадать, в чем состоит кислота?
это следующее уравнение? Оксид магния в значительной степени
не растворим в воде. Однако в разбавленном, подогретом кислотном
раствора, он может реагировать с образованием соли и воды, в данном случае нитрата магния.
и вода. Катион магния в соли
продукт поступает из оксида, а NO3 или нитрат-ион должен происходить из
кислота. Есть два нитрат-иона, которые
означает, что в кислоте должно быть два положительных заряда или два иона H +.Объединяя эти ионы вместе, мы
получаем, получаем две HNO3, которые представляют собой азотную кислоту. Ранее мы видели пример того, как
амфотерный оксид может действовать как основание и реагировать с кислотой. Рассмотрим еще один пример.
Реакция оксида цинка (II) с
серная кислота производит соль сульфата цинка и воду. Опять же, катион в соли приходит
из оксида, а анион в соли происходит из кислоты. До сих пор мы рассматривали типы
оксидов, как они реагируют, и мы рассмотрели множество уравнений.Прежде чем приступить к практическому примеру,
давай сделаем что-нибудь немного другое. Давайте посмотрим, насколько разные
элементы реагируют с кислородом с образованием оксидов, и как это дает нам общее представление о
ряды реактивности для элементов.
Некоторые элементы реагируют с кислородом
более энергично, чем другие. У золота низкая реактивность с
кислород. Мы говорим, что это инертно и не
реагировать. Серебро и ртуть очень медленные
и устойчивы к реакции с кислородом.К этому добавлено больше металлов.
список в определенном порядке, и это основано на увеличении реакционной способности с кислородом, в
другими словами, увеличение легкости, с которой эти элементы реагируют при увеличении
энергия. Элементы в крайнем правом углу
серия легко и энергично реагирует с кислородом, требуя мало энергии для
подвергаются этой реакции, причем металлический калий является наиболее активным, или мы говорим
наиболее реактивный.
Важно знать, что все
эти металлы можно заставить реагировать с кислородом при правильных условиях, даже
золото. Но здесь мы говорим об их
естественная реактивность. Чем более реактивен элемент,
тем более вероятно, что он будет обнаружен в природе связанным с кислородом или другими элементами. Этот список здесь называется
ряд реактивности. Он показывает общую тенденцию или порядок
с которой элементы реагируют с кислородом.Вы заметите, что написаны только металлы
на этом ряду реактивности. Но неметаллы также могут реагировать с
кислород. С силой, с которой водород
реагирует между железом и цинком. Давайте подробнее рассмотрим
удельная реактивность четырех неметаллов. Однако имейте в виду, что эти
неметаллы могут быть помещены в верхний ряд реактивности среди металлов,
согласно их относительной реакционной способности с кислородом.
Известно много оксидов
хлор. Однако хлор не реагирует.
с кислородом в воздухе и в нормальных условиях. Энергия необходима, чтобы вызвать
реакция. Из этих четырех неметаллов хлор
наименее реактивный. Углерод также обычно не
самопроизвольно реагируют с кислородом. Подумайте об угле на
барбекю. Сначала его нужно нагреть до красного
горячий.Тогда он среагирует и загорится
кислород в воздухе. Сера немного больше реагирует
энергично. Он загорится при перегреве
горелка Бунзена. Фосфор, однако, довольно сильно реагирует.
энергично и самовоспламеняется в кислороде воздуха. Фосфор самый реактивный
к кислороду от элементов этой серии. Итак, из их реакции с кислородом,
мы можем сделать вывод об увеличении реакционной способности хлора и углерода, серы и
фосфор.Пришло время взглянуть на
пример, прежде чем мы суммируем все, что мы узнали.
Для определения pH различных
оксидов, был поставлен эксперимент. Три мензурки были заполнены 0,5
литров деионизированной воды и несколько капель универсального индикатора. Шпатель следующего оксида
затем добавляли в каждый стакан. Какого цвета будет каждое решение
перейти на следующее добавление оксида? (A) A: синий, B: зеленый и C:
красный.(B) A: зеленый, B: красный и C:
синий. (C) A: синий, B: красный и C:
зеленый. (D) A: красный, B: зеленый и C:
синий. Или (E) A: красный, B: синий и C:
зеленый.
Оксид — это соединение, состоящее
кислорода, связанного с другим элементом. P2O10, который был добавлен в первую
стакан, представляет собой оксид неметалла, потому что он состоит из неметаллического фосфорного связующего
к кислороду. MgO и Al2O3 являются примерами
оксидов металлов, потому что Mg, магний, является металлом, а Al, алюминий, также
металл.И эти металлы связаны с
кислород. В общем, когда оксид неметалла
реагирует с водой, образуется кислота. Обычно это происходит, когда неметаллический
входит в группы с 14 по 17 периодической таблицы. Когда металл в оксиде металла
из первой или второй групп периодической таблицы, например, магний и оксид
реагирует с водой, обычно образуется щелочь или раствор щелочи.
Обратите внимание, однако, что есть
всегда исключения из правил.Например, оксид бериллия не
растворим в воде и не реагирует с водой при нормальных условиях. Другие оксиды металлов, содержащие
металлы, не входящие в первую или вторую группу периодической таблицы, например,
медь, цинк, свинец, алюминий и олово, когда они помещены в воду, они не
обычно реагируют и обычно нерастворимы. Теперь оксид магния тоже не
очень растворим в воде, но крошечные его количества растворяются и вступают в реакцию с водой с образованием
производят щелочной или щелочной раствор.
Нам сказали, что универсальный
индикатор был добавлен в каждый стакан для определения pH. Универсальный индикатор красный в
очень кислая область шкалы pH, затем оранжево-желтая, затем зеленая около нейтральной
точка, затем синяя, и на дальнем конце спектра в очень основной области она
фиолетовый. Мы видели, что когда неметалл
оксид вступает в реакцию с водой, в стакане А образуется кислота. Таким образом, индикатор
станет красным в стакане A.В химическом стакане B в виде металла образуется щелочь или основание.
оксид вступает в реакцию с водой, поэтому индикатор приобретает пурпурно-синий цвет. И в стакане C, когда металл
оксид добавляется, реакции не происходит.
Оксид алюминия является примером
амфотерный оксид. И опять же, обычно это не так.
растворимы, и они обычно не реагируют с водой, хотя могут реагировать с кислотами
и базы. Потому что нет реакции с
воды, pH воды в этом стакане останется нейтральным, а индикатор
станет зеленым.Итак, изменение цвета в каждом стакане
из-за добавления оксида будет A: красный, B: синий и C: зеленый.
Подведем итоги того, что у нас есть
научился. Оксид — это соединение, содержащее
кислород связан с другим элементом. Когда оксид неметалла реагирует с
вода, образуется кислота. Когда оксид металла реагирует с
вода, производится база. Когда помещается амфотерный оксид
в воде не растворяется и не вступает в реакцию.И когда помещается нейтральный оксид
в воде тоже нет реакции. Это общие тенденции. Когда оксид неметалла реагирует с
основание, соль и вода производятся. Также производится соль и вода.
когда оксид металла реагирует с кислотой. И для амфотерных оксидов, которые могут
реагируют с кислотой или основанием, потому что они действуют как кислоты или основания, опять же соль и
вода — это продукты.
Определение амфотерного — Химический словарь
Что означает амфотерный?
Амфотерное соединение — это соединение, которое может реагировать как с кислотами, так и с основаниями.
Амфотерное поведение относится к кислотам и основаниям, определенным в смысле Бренстеда-Лоури и в более широком смысле Льюиса.
Слово амфотерный происходит от греческого языка, где Амфо означает и , или оба вида — то есть амфотерные соединения могут реагировать как с кислотами, так и с основаниями.
Примеры амфотерного поведения
Пример 1а: Вода реагирует с кислотой:
H 2 O + HCl ⇌ H 3 O + + Cl —
Пример 1b: Вода реагирует с основанием:
H 2 O + NH 3 ⇌ NH 4 + + OH —
Пример 2а: Гидроксид бериллия реагирует с кислотой:
Be (OH) 2 (т) + H 2 S0 4 (водн.) → BeS0 4 (т) + 2H 2 O (л)
Пример 2b: Гидроксид бериллия реагирует с основанием:
Be (OH) 2 (т. Е.) + 2OH — (водн.) → [Be (OH) 4 ] 2- (водн.)
Пример 3а: Оксид алюминия реагирует с кислотой:
Al 2 O 3 (s) + 6H 3 0 + (водный) + 3H 2 O (l) → 2 [Al (OH 2 ) 6 ] 3+ (водн.)
Пример 3b: Оксид алюминия реагирует с основанием:
Al 2 O 3 (с) + 2OH — (вод.) + 3H 2 O (л) → 2 [Al (OH) 4 ] — (вод.)
Амфотерные вещества
Ниже приведены примеры амфотерных веществ:
- Вода, аминокислоты, ионы гидрокарбоната и ионы гидросульфата
- Оксиды и гидроксиды металлов и металлоидов, включая: алюминий, сурьму, мышьяк, сурьму, висмут, бериллий, хром, кобальт, медь, галлий, германий, золото, железо, свинец, серебро, теллур, олово, цинк
Обратите внимание, что элементы в левой части таблицы Менделеева склонны к образованию чисто основных оксидов и гидроксидов, в то время как элементы справа образуют чисто кислые оксиды.Элементы, которые образуют амфотерные оксиды, как правило, находятся в центре таблицы Менделеева.
Иногда вещества, которые мы обычно считаем кислотой или основанием, могут проявлять амфотерное поведение.
Например, H 2 SO 4 представляет собой кислоту при изучении в воде, но действует как основание в суперкислоты, реагируя с суперкислотой.
См. Также амфипротический.
Начальная активность кислых, основных и амфотерных оксидов в реакции CO 2 с CS 2 с образованием COS
М. Сугиока, А. Икеда, К. Амура: J. Japan Petrol. Inst. , 22, , 120 (1979).
CAS
Google Scholar
L. Németh, G. Gáti, S. Horváth, I. Szabados, A. Gaál, S. László, P. Pelyva, L. Vécsey, L. Nagy: Hung. Патент 185 221 (1980).
L. Németh, T. Mároly, E. Grovcsik, J. Kerti, A. Kerekes: Hung. Патент 189 188; Патент России 1 355120; Патент ГДР 230885 (1985).
L. Németh, G. Gáti, A. Gervasini, A. Auroux, G. Mink, I.S. Пап, Т. Секели: J. Applied Catal. , 64, , 143 (1990).
Артикул
Google Scholar
Г. Минк, И. Бертоти, Л. Немет, Г. Гати, М. Мохай, Т. Секели: Surf. Интерфейс Anal. , 12, , 262 (1988).
Артикул
Google Scholar
A. Auroux, A. Gervasini, L. Németh, G. Gáti, I.S. Пап, Г. Минк: Прибой. Интерфейс Anal. , 19, , 529 (1992).
CAS
Статья
Google Scholar
г. Норка: React. Кинет. Катал. Lett. , 68, , 221 (1999).
CAS
Google Scholar
A. Auroux, A. Gervasini: J. Phys. Chem. , 94 , 6371 (1990).
CAS
Статья
Google Scholar
A. Gervasini, A. Auroux: J. Catal. , , 131, , 190 (1991).
CAS
Статья
Google Scholar
Термохимические таблицы JANAF , третье издание, часть I – II. (1985).
R.T. Сандерсон: Chemical Periodicity , Рейнхольд, Нью-Йорк, 1960.
Google Scholar
A.L. Allred: J. Inorg. Nucl. Chem. , 17, , 215 (1961).
CAS
Статья
Google Scholar
Trends in Oxides Chemistry Tutorial
Сноски
1 Мы будем рассматривать только «нормальные» оксиды. Помимо нормального оксида Na 2 O, натрий также образует ионный пероксид Na 2 O 2 .
Однако следует отметить, что при сгорании натрия Na 2 O также будет реагировать с O 2 с образованием Na 2 O 2 , поэтому основным продуктом сгорания натрия является Na 2 . О 2 .
2 Ограничение подачи кислорода во время горения дает низший оксид, P 4 O 6 вместо P 5 O 10
3 При сгорании фосфора в избытке кислорода образуется оксид фосфора P 4 O 10 .
4 При сгорании серы образуется диоксид серы SO 2 (г) .
Окисление SO 2 до SO 3 кислородом происходит самопроизвольно, но очень медленно:
SO 2 (г) + ½O 2 (г) → SO 3 (л)
5 Некоторые оксиды хлора склонны к взрыву: ClO 2 , Cl 2 O, Cl 2 O 3 и Cl 2 O 7 .
Они более чувствительны к ударам, чем термически.
Несмотря на это, ClO 2 и Cl 2 O используются в коммерческих целях в качестве отбеливающих агентов, в частности, для отбеливания бумаги и муки.
В промышленных масштабах ClO 2 получают экзотермической реакцией хлората натрия в количестве примерно 4 моль л. -1 H 2 SO 4 , содержащем 0,05-0,25 моль л иона хлорида -1 с диоксидом серы:
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4
Cl 2 O можно получить обработкой свежеприготовленного желтого оксида ртути газообразным хлором или раствор хлора в четыреххлористом углероде:
2Cl 2 + 2HgO → HgCl 2 .HgO + Cl 2 O
6 Существует только одна формула оксида алюминия, Al 2 O 3 , известная как оксид алюминия, однако существует ряд полиморфов и гидратированных разновидностей.
Существует 2 формы безводного Al 2 O 3 , известные как α -Al 2 O 3 и γ -Al 2 O 3 .
α -Al 2 O 3 очень твердый и устойчивый к гидратации и воздействию кислот.
γ -Al 2 O 3 более мягкий, легко впитывает воду и растворяется в кислотах.
Существует несколько гидратированных форм оксида алюминия, включая AlO.OH и Al (OH) 3 , но их получают в щелочных растворах, а не в реакции оксида алюминия с водой.
7 Реакция протекает в холодной воде. Если используется горячая вода, образуется ряд продуктов, таких как PH 3 , фосфорная кислота и элемент P.
8 Эта реакция протекает легко, что делает P 4 O 10 хорошим осушающим агентом, но при этом образуется смесь кислот, в зависимости от количества воды и других условий.
9 Нет сомнений в том, что газообразный SO 2 растворяется в воде, но кислота H 2 SO 3 не была выделена. Тем не менее, это уравнение обычно используется для описания реакции.
10 Двуокись углерода, CO 2 , является кислым оксидом, а монооксид углерода, CO, является нейтральным оксидом.
11 Диоксид азота, NO 2 , является кислым оксидом, но оксид азота, NO, и закись азота, N 2 O, являются нейтральными оксидами.
Узнайте об амфотерной субстанции | Chegg.com
Амфотерные оксиды — это оксиды металлов, которые реагируют с кислотами как основание и реагируют с основаниями как кислоты. Эта реакция вызывает образование воды и соли. Оксид свинца, оксид цинка и оксид алюминия являются некоторыми примерами амфотерных оксидов. Элементы, расположенные в центре периодической таблицы, обычно образуют амфотерные оксиды. Элементы, которые находятся слева от таблицы Менделеева, образуют основные оксиды, а элементы, которые находятся справа от таблицы Менделеева, образуют кислые оксиды.
Некоторые примеры и реакции амфотерных оксидов:
Оксид свинца: В соляной кислоте оксид свинца образует хлорид свинца (II) и воду.
PbO + 2HCl → PbCl2 + h3O \ rm PbO + 2 HCl \ rightarrow PbCl_2 + H_2OPbO + 2HCl → PbCl2 + h3 O
В таких основаниях, как гидроксид натрия, и в присутствии воды оксид свинца образует комплекс свинца натрия. гидроксид.
PbO + 2NaOH + h3O → Na2 [Pb (OH) 4] \ rm PbO + 2 NaOH + H_2O \ rightarrow Na_2 [Pb (OH) _4] PbO + 2NaOH + h3 O → Na2 [Pb (OH) 4 ]
Оксид цинка: В кислотах, таких как серная кислота, оксид цинка образует сульфат цинка и воду.
ZnO + h3SO4 → ZnSO4 + h3O \ rm ZnO + H_2SO_4 \ rightarrow \ ZnSO_4 \ + H_2OZnO + h3 SO4 → ZnSO4 + h3 O
В таких основаниях, как гидроксид натрия, оксид цинка образует комплекс, называемый гидроксидом цинка натрия. .
ZnO + 2 NaOH + h3O → Na2 [Zn (OH) 4] \ rm ZnO + 2 \ NaOH \ + H_2O \ rightarrow \ Na_2 [Zn (OH) _4] ZnO + 2 NaOH + h3 O → Na2 [ Zn (OH) 4]
Оксид алюминия: Когда оксид алюминия реагирует с соляной кислотой, образуются хлорид алюминия и вода.
Al2O3 + 6 HCl → 2 AlCl3 +3 h3O \ rm Al_2O_3 + 6 \ HCl \ rightarrow \ 2 \ AlCl_3 \ + 3 \ H_2OAl2 O3 +6 HCl → 2 AlCl3 +3 h3 O
Если алюминий оксид вступает в реакцию с основанием, таким как гидроксид натрия, образуется алюминат натрия.
Al2O3 + 2 NaOH +3 h3O → 2 Na2 [Al (OH) 4] \ rm Al_2O3 + 2 \ NaOH \ + 3 \ H_2O \ rightarrow \ 2 \ Na_2 [Al (OH) _4] Al2 O3 + 2 NaOH +3 h3 O → 2 Na2 [Al (OH) 4]
Определение амфотерного оксида в химии
Амфотерный оксид — это оксид, который может действовать как кислота или основание в реакции с образованием соли и воды. Амфотеризм зависит от степени окисления, доступной химическим веществам. Поскольку металлы имеют несколько степеней окисления, они образуют амфотерные оксиды и гидроксиды.
Примеры амфотерного оксида
Металлы, демонстрирующие амфотеризм, включают медь, цинк, свинец, олово, бериллий и алюминий.
Al 2 O 3 представляет собой амфотерный оксид. При взаимодействии с HCl он действует как основание с образованием соли AlCl 3 . При взаимодействии с NaOH он действует как кислота с образованием NaAlO 2 .
Обычно оксиды средней электроотрицательности являются амфотерными.
Амфипротические молекулы
Амфипротические молекулы представляют собой тип амфотерных частиц, которые отдают или принимают H + или протон.Примеры амфипротических разновидностей включают воду (которая самоионизируется), а также белки и аминокислоты (которые имеют группы карбоновых кислот и аминов).
Например, ион гидрокарбоната может действовать как кислота:
HCO 3 — + OH — → CO 3 2- + H 2 O
или в качестве основы:
HCO 3 — + H 3 O + → H 2 CO 3 + H 2 O
Имейте в виду, что хотя все амфипротические виды являются амфотерными, не все амфотерные виды являются амфипротическими.Примером является оксид цинка ZnO, который не содержит атома водорода и не может отдавать протон. Атом Zn может действовать как кислота Льюиса, принимая электронную пару от OH−.
Связанные термины
Слово «амфотерный» происходит от греческого слова amphoteroi , что означает «оба». Термины «амфихромный» и «амфихромный» относятся к кислотно-щелочному индикатору, который дает один цвет при взаимодействии с кислотой и другой цвет при взаимодействии с основанием.
Использование амфотерных видов
Амфотерные молекулы, которые имеют как кислотные, так и основные группы, называются амфолитами. В основном они встречаются в виде цвиттерионов в определенном диапазоне pH. Амфолиты можно использовать в изоэлектрической фокусировке для поддержания стабильного градиента pH.
.

