| 30.0061 г/моль | |
| Физические свойства | |
|---|---|
| Состояние (ст. усл.) | бесцветный газ |
| Плотность | 0,00134 (газ) г/см³ |
| Термические свойства | |
| Температура плавления | −163.6 °C |
| Температура кипения | −151. 7 °C 7 °C |
| Энтальпия образования (ст. усл.) | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| Рег. номер CAS | |
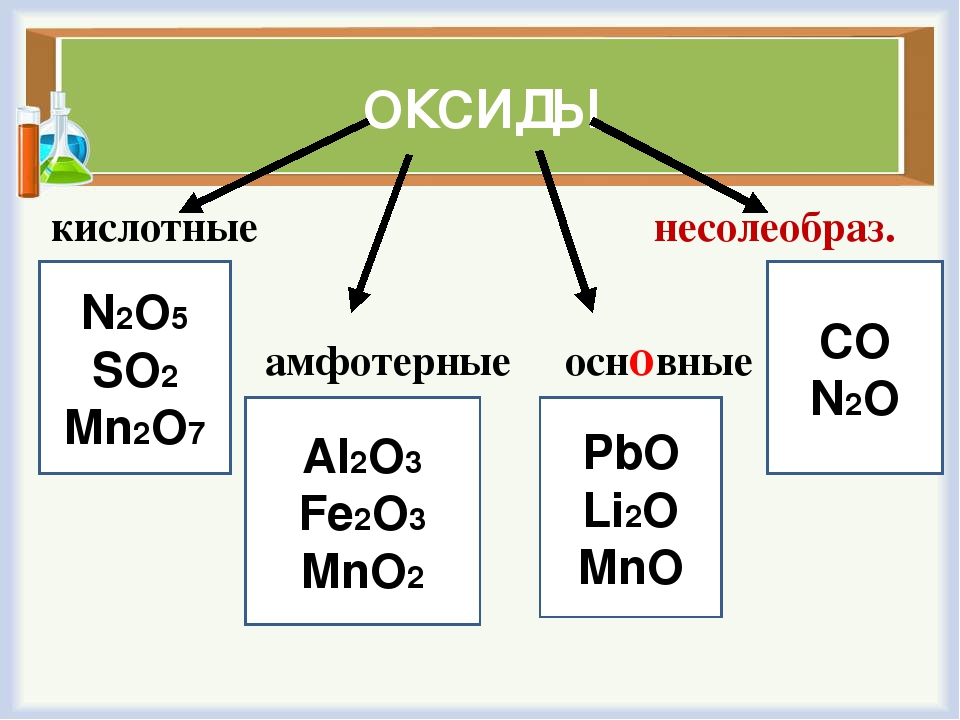
Оксид неметалла | Оксид металла |
1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl 2 O не относится к несолеобразующим оксидам | 1) Степень окисления металла равна +1, +2 Вывод: оксид металла основный Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!! |
2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl 2 O относится к кислотным оксидам, несмотря на степень окисления хлора +1 | 2) Степень окисления металла +3, +4, Вывод: оксид амфотерный. Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов |
3) Степень окисления металла +5,+6,+7 Вывод: оксид кислотный. |
Примеры:
Задание:
определите тип оксида MgO.
Решение:
MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ:
MgO – основный оксид.
Задание:
определите тип оксида Mn 2 O 7
Решение:
Mn 2 O 7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ:
Mn 2 O 7 – кислотный оксид
Задание:
определите тип оксида Cr 2 O 3 .
Решение:
Cr 2 O 3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ:
Cr 2 O 3 – амфотерный оксид.
Задание:
определите тип оксида N 2 O.
Решение:
N 2 O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ:
N 2 O – несолеобразующий оксид.
Задание:
определите тип оксида BeO.
Решение:
оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ:
BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться
классификация и химические свойства. Химические свойства кислотных оксидов
Оксиды неметаллов
В оксидах неметаллов связь между атомами ковалентная полярная.
Среди оксидов молекулярного строения есть газообразные — СO2, СО, N2O,
NO, NO2, Сl2O, СIO2 и др.; жидкие (летучие) SO3, N2O3, Сl2O6, Сl2O7; твердые
(летучие) — Р2O5, N2O5, SeO2; твердый, очень тугоплавкий нелетучий оксид
SiO2 — вещество с атомной кристаллической решеткой.
Оксиды неметаллов, как вы знаете, делят на два подкласса:
несолеобразующие и солеобразующие. К несолсобразующим оксидам относят
8Ю, 1М20, N0, СО. Все остальные оксиды неметаллов являются
солеобразующими, кислотными.
Оксиды серы. Сера образует два оксида — SO2 и SO3. Оба оксида
являются кислотными, т.е. взаимодействуют со щелочами, основными
оксидами и водой. (Напишите уравнения соответствующих реакций.)
При горении серы, полном сгорании сероводорода и обжиге сульфидов
образуется оксид серы(IV), который часто называют сернистым газом.
(Напишите уравнения соответствующих реакций.) Он хорошо растворяется в
воде, образуя слабую сернистую кислоту. Она неустойчива и разлагается на
исходные вещества:
Н2O + SO2 ⇄ Н2SO3
При взаимодействии со щелочами сернистый газ образует два ряда солей
— средние, или сульфиты, и кислые — гидросульфиты. (Почему!)
Гидросульфит натрия NaHSO3 и сульфит натрия Na2SO3, как и сам
сернистый газ, используют для отбеливания шерсти, шелка, бумаги и
соломы, а также в качестве консервирующих средств для сохранения свежих
плодов и фруктов.
Оксиды азота. Азот образует немало оксидов, из которых наиболее
известны оксиды со всем спектром степеней окисления азота от +1 до +5:
N2O, NO, N2O3, NO2 (или N2O4) и N2O5.
Оксиды азота(I), (II) N2O и NO — несолеобразующие оксиды; остальные
— солеобразующие кислотные оксиды.
Оксид азота(II) NO токсичен. Представляет собой бесцветный газ, без
запаха, почти не растворим в воде. Оксид азота(II) легко окисляется
кислородом воздуха в оксид азота(IV):
2NO + O2 = 2NO2
Оксид азота(IV) NO2 — весьма токсичный бурый газ. Если растворять
NO2 в воде в присутствии кислорода, то образуется азотная кислота:
4NO2 + O2 + 2Н2O = 4НNO3
Аналогично оксид NO2 реагирует с растворами щелочей:
4NO2 + 2Са(ОН)2 = Са(NO3)2 + Са(NO2)2 + 2Н2O
Оксид азота(V) N2O5 — бесцветные кристаллы при температуре ниже
33,3 °С. Это типичный кислотный оксид, которому соответствует азотная
кислота. Взаимодействует с водой, щелочами,
оксидами металлов. (Напишите уравнения соответствующих реакций.)
Оксид фосфора(V). Оксид фосфора(V), или фосфорный ангидрид,
образуется при горении фосфора в виде густого белого дыма, состоящего из
мелких белых кристалликов:
4Р + 5O2 = 2Р2O5
Это типичный кислотный оксид, который взаимодействует с водой,
образуя фосфорную кислоту, а также с основными оксидами и щелочами с
образованием различных солей: средних, или фосфатов, и кислых —
гидрофосфатов и дигидрофосфатов:
Р2O5 + 6NaOН = 2Na3РO4 + 3Н2O
Р2O5 + 4NаОН = 2Na2НРO4 + Н2O
Р2O5 + 2NaОН + Н2O = 2NaН2РO4
Оксиды углерода. Углерод образует два оксида: оксид угле-рода(II) СО
Углерод образует два оксида: оксид угле-рода(II) СО
и оксид углерода(IV) С02.
Оксид углерода(II) имеет ряд синонимов: угарный газ, окись углерода,
монооксид углерода. Это газ без цвета, запаха и вкуса; плохо растворим в
воде. Как следует из тривиального названия, угарный газ очень ядовит, так
как соединяется с гемоглобином крови и лишает его способности переносить
кислород. Первая помощь при угаре — это свежий воздух.
Оксид углерода(II) является сильным восстановителем, поэтому горит:
2СО + O2 = 2СO2
Он также восстанавливает металлы из их оксидов и потому применяется
в пирометаллургии. Основой доменного процесса являются реакции,
суммарное уравнение которых имеет вид:
Fе2O3 + 3СО = 2Fе + 3СO2
Оксид углерода(IV) имеет много синонимических названий: углекислый
газ, угольный ангидрид, диоксид углерода и даже химически неверное
название «углекислота».
В промышленности СO2 получают обжигом известняка, горением кокса
или углеводородного сырья. В лаборатории углекислый газ получают
действием соляной кислоты на мрамор (рис. 7.5):
7.5):
СаСО3 + 2НСl = СаСl2 + Н2O + СO2
Рис. 7.5. Получение углекислого газа в лабораторных условиях
Молекула углекислого газа образована двумя двойными полярными
ковалентными связями:
О=С=О
Из-за линейного строения несмотря на полярность связей молекула в
целом неполярная, поэтому углекислый газ малорастворим в воде (0,88
объема СO2 в 1 объеме воды при температуре 20 °С). При охлаждении под
давлением углекислый газ превращается в сухой лед — твердую
снегообразную массу, которую в промышленности прессуют и используют
для охлаждения продуктов, прежде всего мороженою.
Углекислый газ при обычных условиях не имеет цвета, запаха и
примерно в 1,5 раза тяжелее воздуха.
По свойствам это типичный кислотный оксид, поэтому взаимодействует
со щелочами, основными оксидами и водой:
СO2 + ВаО = ВаСO3
СO2 + Са(ОН)2 = СаСO3 + Н2O
Последняя реакция является качественной реакцией на углекислый газ,
так как сопровождается помутнением известковой воды (цв. вклейка, рис.
27), которое, однако, исчезает при дальнейшем пропускании углекислого газа
из-за превращения нерастворимого карбоната кальция в растворимый
гидрокарбонат:
СаС03 + С02 + Н20 = Са(НСО,)2
Рис. 27. Качественная реакция на углекислый газ: а – до пропускания; б – после
27. Качественная реакция на углекислый газ: а – до пропускания; б – после
пропускания CO2
Углекислый газ применяют в производстве сахара (для очистки сока
свеклы), соды, мочевины, для приготовления газированных напитков, при
тушении пожаров (рис. 7.6), в газовых лазерах. Твердый СО, — хладагент.
Рис. 7.6. Для тушения пожаров используют углекислотный огнетушитель
Оксид кремния(IV). Многие минералы образованы оксидом
кремния(IV) SiO2. К ним относятся горный хрусталь, кварц, кремнезем.
Оксид кремния(IV) составляет основу таких полудрагоценных камней, как
агат, аметист, яшма (цв. вклейка, рис. 28).
Рис.28. Кристаллы кварца (а) и поперечный разрез агата (б)
Диоксид кремния — твердое кристаллическое вещество полимерного
строения, в котором каждый атом кремния связан с четырьмя атомами
кислорода прочными связями:
Это типичный кислотный оксид, который в воде не растворяется. Его
гидроксиды — кремниевые кислоты — получают косвенными методами.
Диоксид SiO2 взаимодействует со щелочами, образуя силикаты:
SiO2 + 2КОН = К2 SiO 3 + Н2O
Диоксид кремния сплавляют
образованием силикатов:
с
основными
оксидами
также
с
SiO 2 + СаО = Са SiO3
С кислотами (за исключением плавиковой кислоты) диоксид кремния не
взаимодействует.
Монокристаллы диоксида кремния применяют в генераторах
ультразвука, звуковоспроизводящей аппаратуре и т.п. Такие кристаллы
выращивают в гидротермальных условиях из расплавов SiO 2. Природный SiO
2 — сырье в производстве кремния, кварцевого стекла, компонент керамики,
обычного стекла и цемента. Из расплавленного кварца изготавливают
различную кварцевую химическую посуду, которая выдерживает высокую
температуру и не трескается при резком охлаждении.
Вопросы
1. Какие типы оксидов образуют неметаллы? Какое агрегатное состояние для них
характерно?
2. Какие типы кристаллических решеток характерны для твердых оксидов неметаллов?
Какие из оксидов имеют полимерное строение?
3. Напишите формулы оксидов серы, а также уравнения реакций, характеризующие их
свойства.
4. Напишите формулы оксидов азота, а также уравнения реакций, характеризующие их
свойства.
5. Напишите формулы оксидов углерода, а также уравнения реакций, характеризующие
их свойства.
6. Напишите уравнения реакций, с помощью которых можно осуществить следующие
превращения:
а) FеS2 ⟶ SO, ⟶ Na2SO3 ⟶ SO2 ⟶ SO3 ⟶ Н2SO4 ⟶ Na2SO4 ⟶ ВаSO4
б) N2 ⟶ Nh4 ⟶ NO ⟶ NO2 ⟶ НNО3 ⟶ Сu(NO3)3 ⟶ NO2
в) СаСO3 ⟶ СО2 ⟶ СаСO3 ⟶ Са(НСO3)2 ⟶ СаСО3 ⟶ СO2
г) SiO2 ⟶ Si ⟶ Мg2Si ⟶ Sih5 ⟶ SiO2 ⟶ Мg2SiO3
Рассмотрите процессы в свете теории электролитической диссоциации и окисления-
восстановления.
7. Сравните строение и свойства оксидов углерода(IV) и кремния(IV).
«Оксиды неметаллов»
Цель урока:
Образовательные:
углубить, систематизировать, обобщить знания учащихся об оксидах, способах их получения, свойствах и областях применения,
свойствах и областях применения, упражнять учащихся в выполнении заданий ЕГЭ по химии по данной теме,
Развивающие:
развивать логическое мышление учащихся,
развивать умение анализировать, обобщать, делать выводы,
развивать правильно и последовательно излагать свои мысли,
Воспитательные:
создание комфортности присутствия на уроке,
воспитание эстетического отношения к предмету,
воспитание отстаивать свою точку зрения, подкрепляя ее имеющимися или приобретенными знаниями
Оборудование:
таблица «Оксиды», ПК с медиапроектором, коллекция «Минералы», раздаточный материал – карточки с заданиями;
лабораторное оборудование: спиртовка, спички, пробиркодержатель, ложечка для сжигания веществ; вещества: медная проволока, этанол.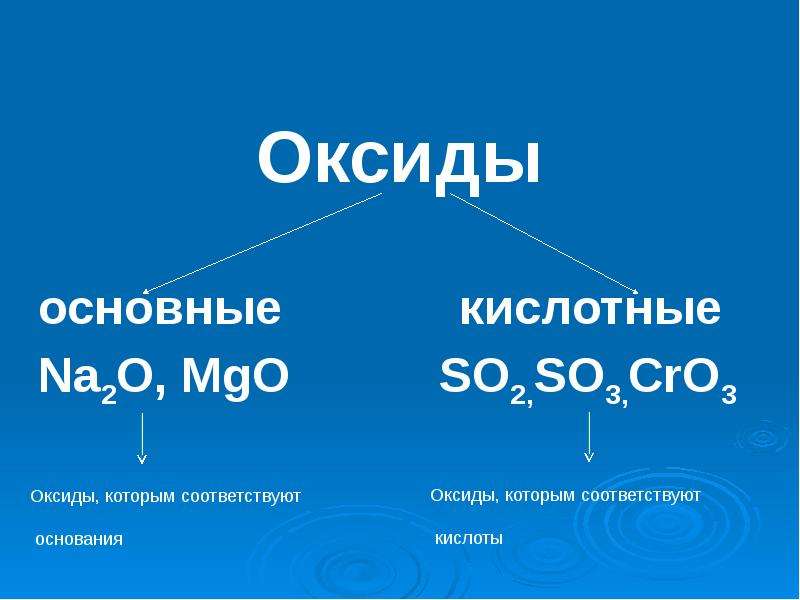
Ход урока
I. Организационный момент.
Сегодня на уроке рассмотрим свойства, классификацию, физические и химические свойства оксидов.
II. Изучение основного содержания:
1) Сообщение темы и цели урока.
Сегодня на уроке рассмотрим свойства, классификацию, физические и химические свойства оксидов
1. Фронтальный опрос учащихся по вопросам:
— Вещества подразделяют на простые и сложные, укажите их отличия?
— Перечислите классы неорганических соединений.
— Дайте определение понятию «Оксиды».
— Перечислите виды оксидов.
— Дайте определения понятий основных, кислотных, амфотерных оксидов.
2. Классификация оксидов
Классификация оксидов
Оксиды подразделяются на солеобразующие и несолеобразующие.
Солеобразующими называют такие оксиды, которые в результате химических реакций способны образовывать соли.
Дайте определение понятию «Соли».
Несолеобразующие оксиды такой способностью не обладают. Примером несолеобразующих оксидов могут служить следующие вещества: CO, N
Примером несолеобразующих оксидов могут служить следующие вещества: CO, N
2
O, NO.
Солеобразующие оксиды, в свою очередь подразделяются на основные, кислотные и амфотерные.
Какие оксиды относят к основными?
Основными оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения воды) соответствуют основания.
Например: Основные оксиды Соответствующая гидратная форма(основание)
Na
2
O → NaOH
BaO→ BaOH
СaO→ СaOH
Дайте определение понятию «Основания».
Какие элементы образуют основные оксиды?
Основные оксиды образуют металлы при проявлении ими невысокой валентности (обычно I или II).
Оксиды таких металлов, как Li,Na, K, Rb, Cs, Fr , Ca , Sr, Ba взаимодействуют с водой с образованием растворимых в воде оснований — щелочей. Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей (косвенным путем).
Какие оксиды относят к кислотными?
Кислотными оксидами называются такие оксиды, которым в качестве гидратов соответствуют кислоты. Кислотные оксиды называют также ангидридами кислот.
Кислотные оксиды называют также ангидридами кислот.
Например: кислотные оксиды соответствующая гидратная форма (кислота)
SO
3
→ H
2
SO
4
Р
2
О
3
→ H
3
РO
4
СrО
3
→ H
2
CrO
4
Дайте определение понятию «Кислоты»
Какие элементы образуют кислотные оксиды?
Кислотные оксиды образуют неметаллы и металлы при проявлений ими высокой валентности. Например, оксид марганца (VII) — кислотный оксид, так как в качестве гидрата ему соответствует кислота HMnO
4
и это оксид металла с высокой валентностью.
Большинство кислотных оксидов могут взаимодействовать с водой непосредственно и при этом образовывать кислоты.
Например: СrО
3
+ H
2
O → H
2
CrO
4
Р
2
О
3
+ H
2
O → H
3
РO
4
SO
3
+ H
2
O → H
2
SO
4
Некоторые оксиды непосредственно с водой не взаимодействуют. Такого типа оксиды сами могут быть получены из кислот. Например:
H
2
SiO
3
→ SiO
2
+ H
2
O (температура)
Оксиды SO
2
и CO
2
реагирую с водой обратимо: СО
2
+ H
2
O ↔ H
2
CO
3
SО
2
+ H
2
O ↔ H
2
SO
3
Это подтверждает названия кислотных оксидов — ангидриды, то есть «не содержащие воду».
Назовите особенности амфотерных оксидов.
Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий проявляют свойства как основных (в кислой среде), так и кислотных (в щелочной среде) оксидов.
Какие элементы образуют амфотерные оксиды?
К амфотерным оксидам относятся только оксиды некоторых металлов.
Например: BeO, Al
2
O
3
, PbO, SnO, ZnO, PbO
2
, SnO
2
, Сr
2
О
3
PbO + 2HNO
3
→ Pb(NO
3
)
2
+ H
2
O
а) В кислой среде PbO (оксид свинца (II)) проявляет свойства основного оксида
б) в щелочной среде PbO проявляет свойства кислотного оксида.
T
PbO + 2NaOH
тв
→ Na
2
PbO
2
+ H
2
O
Амфотерные оксиды с водой непосредственно не взаимодействуют, следовательно, их гидратные формы получают косвенно — из солей. Несолеобразующие (индифферентные) оксиды — небольшая группа оксидов, не вступающая в химические реакции с образованием солей. К ним относятся: CO, N
2
O, NO , SiO
2
.
2. Получение оксидов.
Назовите способы получения оксидов
1) окисление металлов: 2Cu + O
2
= 2CuO
оксид меди (II) черный налет
Демонстрационный опыт — окисление меди кислородом в пламени спиртовки
2) окисление неметаллов: C + O
2
= CO
2
оксид углерода (IV)
3) разложение кислот: Н
2
SО
4
= SО
2
+ Н
2
О
оксид серы (IV)
4) разложение солей: CaCО
3
= CaО + CО
2
оксид кальция (II)
5) разложение оснований: Fe(ОН)
2
= FeО + Н
2
О
оксид железа (II)
7) горение сложных веществ: C
2
H
5
OH + 3О
2
→ 2CО
2
+ 3Н
2
О
Демонстрационный опыт – горение C
2
H
5
OH (этанол) в ложечке для сжигания веществ
3. Химические свойства оксидов.
Химические свойства оксидов.
1) Основные оксиды.
а) взаимодействие с кислотами: BaO + 2HCl = BaCl2 + h3O
оксид бария (II)
б) взаимодействие с водой: MgO + H
2
O = Mg(OH)
2
оксид магния (II)
в) взаимодействие с кислотным оксидом: CaO + CO
2
= CaCO
3
оксид кальция (II)
г) взаимодействие с амфотерным оксидом: Na
2
O + ZnO = Na
2
ZnO
2
цинкат натрия
2) Кислотные оксиды.
а) взаимодействие с водой: SO
3
+ H
2
O = H
2
SO
4
оксид серы (VI)
б) взаимодействие с основанием: Ca(OH)
2
+ CO
2
= CaCO
3
+ H
2
O
гидроксид кальция (II)
в) взаимодействие с основным оксидом: CO
2
+ CaO = CaCO
3
карбонат кальция
3) Амфотерные оксиды.
а) взаимодействие с кислотами: ZnO + 2HCl = ZnCl
2
+ h3O
хлорид цинка
б) взаимодействие с основаниями: ZnO + 2NaOH = Na
2
ZnO
2
+ H
2
O
гидроксид натрия
4. Применение оксидов:
Сообщения учащихся:
Fe
2
O
3
– оксид железа (III) – темно-красного цвета – гематит или красный железняк – для изготовления красок.
Fe
3
O
4
– оксид железа (II, III) – минерал магнетит или магнитный железняк, хороший проводник электричества – для получения и изготовления электродов.
CaO – оксид кальция (II) – порошок белого цвета – «негашеная» известь, используют в строительстве.
Al
2
O
3
– оксид алюминия (III) – минерал твердый корунд – как полирующее средство.
SO
2
– оксид серы (IV) или сернистый газ – бесцветный газ, имеющий удушливый запах, убивает микроорганизмы, плесневые грибки – окуривают подвалы, погреба, при перевозке и хранении фруктов и ягод.
CO
2
– оксид углерода (IV), углекислый газ. Твердый оксид углерода – сухой лед. Для изготовления соды, сахара, газированных напитков, в жидком виде в огнетушителях.
SiO
2
– оксид кремния (IV) – твердое, тугоплавкое вещество в природе в двух видах:
1) кристаллический кремнезем – в виде минерала кварца и его разновидностей: горный хрусталь, халцедон, агат, яшма, кремень – используют в силикатной промышленности, строительстве.
2) аморфный кремнезем SiO
2
∙ nH
2
O – минерал опал.
Применяют соединения оксида кремния в ювелирном деле, изготовлении химической посуды, кварцевых ламп.
Для создания цветных стекол используют следующие оксиды:
Cо
2
O
3
– синий цвет, Cr
2
O
3
– зеленый цвет, MnO
2
– розовый цвет.
5. Закрепление. Выполнение теста. (Приложение № 1)
IV. Домашнее задание:
1И.И. Новошинский, Н.С. Новошинская «Химия» (базовый уровень), Глава VI, §22
2. Закончите уравнения химических реакций, дайте название веществам:
а) P + O
2
→
б) Al + O
2
→
в) H
2
SO
4
+ Fe
2
O
3
→
г) BaO + HCl →
д) C
2
H
4
+ O
2
→
V. Закрепление:
По вопросам основного содержания:
1. Основные способы получения оксидов.
2. Химические свойства:
— основных оксидов;
— кислотных оксидов;
— амфотерных оксидов.
3. Области применения оксидов.
Приложение №1.
Вариант 1.
1. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) вода и медь
4) оксид кальция и гидроксид натрия
Ответ: 4, т. к. оксид серы (VI) – кислотный, взаимодействует с
к. оксид серы (VI) – кислотный, взаимодействует с
основаниями, основными оксидами,
водой.
2. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) гидроксидом натрия и оксидом кальция
2) оксидом кальция и оксидом серы (IV)
3) кислородом и водой
4) хлоридом натрия и оксидом азота (IV)
Ответ: 1, т.к. оксид углерода (IV) – кислотный, взаимодействует с
основаниями, основными оксидами
, водой.
3. Оксид серы (IV) взаимодействует с
1) СО
2
2) Н
2
О 3) Na
2
SO
4
4) НС1
Ответ:,2. т.к. оксид серы (IV) – кислотный, взаимодействует с основаниями, основными оксидами,
водой.
4. Формулы кислотного, основного, амфотерного оксидов, соответственно
1)MnO
2
, CO
2
, Al
2
O
3
2)CaO, SO
2
, BeO 3)Mn
2
O
7
, CaO, ZnO 4) MnO, CuO, CO
2
Ответ: 3,т.к. Mn
2
O
7
– кислотный, CaO — основный, ZnO — амфотерный
5. Способны взаимодействовать между собой
1) SiO
2
и Н
2
О 2) СО
2
и H
2
SO
4
3) CO
2
и Са(ОН)
2
4) Na
2
O и Са(ОН)
2
Ответ: 3, CO
2
– кислотный оксид, Са(ОН)
2
-основание, кислотные оксиды взаимодействуют с основаниями
6. Ни с водой, ни с раствором гидроксида натрия не реагирует
Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО
2
2) SO
3
3) ВаО 4) NО
Ответ: 4,т.к. NО несолеобразующий
7. Реагирует с соляной кислотой, но не с водой, оксид
1) SiО
2
2) N
2
O
3
3) Na
2
О 4) Fе
2
Оз
Ответ: 4, т.к. Fе
2
Оз — амфотерный оксид с большим преобладанием основных свойств, взаимодействует с кислотами, не реагирует с водой (Fе(ОН)з – не растворим в воде).
8. Амфотерность оксида свинца (II) подтверждается его способностью
1) растворяться в кислотах
2) восстанавливаться водородом
3) реагировать с оксидом кальция
4) взаимодействовать как с кислотами, так и с щелочами
Ответ: 4; т.к. амфотерные оксиды могут взаимодействовать как с кислотами, так и с щелочами
9. Верны ли следующие суждения о свойствах оксидов алюминия и хрома (III)?
А. Эти оксиды проявляют амфотерные свойства.
Б. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: 1, т. к. оксиды алюминия и хрома (III) проявляют амфотерные
к. оксиды алюминия и хрома (III) проявляют амфотерные
10.
Между собой взаимодействуют
1) СuО и FeO 2) СО
2
и ВаО 3) Р
2
О
5
и NO 4) СгО
3
и SO
3
Ответ: 2, т.к. СО
2
– кислотный, а ВаО — основный
Характерные химические свойства: оксидов: основных, амфотерных, кислотных.
Вариант 2.
1. Реакция возможна между
1) Н
2
О и А1
2
О
3
2) СО и СаО 3) Р
2
О
3
и SO
2
4) Н
2
О и ВаО
Ответ: 4, т.к. ВаО — основный оксид, взаимодействует с водой.
2. И с раствором гидроксида натрия, и с соляной кислотой реагирует оксид
1) SiО
2
2) Al
2
O
3
3) СО
2
4) MgO
Ответ: 2; т.к. взаимодействовать с щелочами и кислотами могут амфотерные оксиды, Al
2
O
3
— амфотерный оксид.
3. Реакция возможна между
1) ВаО и NH
3
2) А1
2
О
3
и Н
2
О 3) Р
2
О
5
и НС1 4) MgO и SO
3
Ответ: 4; т.к. MgO — основный оксид,а SO
3
– кислотный оксид.
4. Оксид натрия не взаимодействует с
1) Н
2
О 2) СО
2
3) CaO 4) А1
2
О
3
Ответ: 3; т. к. оксид натрия основный и CaO основный.
к. оксид натрия основный и CaO основный.
5.
Оксид углерода (IV) реагирует с каждым из двух веществ:
1) водой и оксидом кальция
2) кислородом и водой
3) сульфатом калия и гидроксидом натрия
4) оксидом кремния (IV) и водородом
Ответ: 1; т.к. оксид углерода (IV) — кислотный, реагирует с водой, основаниями, основными оксидами. Оксид кальция — основный
6. Основные свойства наиболее выражены у оксида, формула которого
1) Fe
2
O
3
2) FeO 3) Cr
2
O
3
4) СrО
3
Ответ: 2; т.к. Fe
2
O
3
и Cr
2
O
3
– амфотерные, а СrО
3
– кислотный.
7. Какие из двух оксидов могут взаимодействовать между собой?
1) СаО и СrО 2) СаО и NO 3) К
2
O и СО
2
4) SiO
2
и SO
2
Ответ: 3; т.к. К
2
O — основный,а СО
2
— кислотный оксид
8. Оксид фосфора (V)
1) не проявляет кислотно-основных свойств
2) проявляет только основные свойства
3) проявляет только кислотные свойства
4) проявляет как основные, так и кислотные свойства
Ответ: 3; т. к. оксид фосфора (V) – кислотный.
к. оксид фосфора (V) – кислотный.
9. Между собой взаимодействуют
1) SO
3
и А1
2
Оз 2) СО и ВаО 3) Р
2
О
5
и SCl
4
4) ВаО и SO
2
Ответ: 1; т.к. SO
3
— — кислотный оксид, а А1
2
О
з
— амфотерный.
10. Верны ли следующие суждения об оксидах цинка и алюминия?
А. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
Б. Эти оксиды взаимодействуют как с кислотами, так и со щелочами.
1) верно толь ко А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: 2; т.к. оксиды цинка и алюминия — амфотерные.
Оксидами
называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе.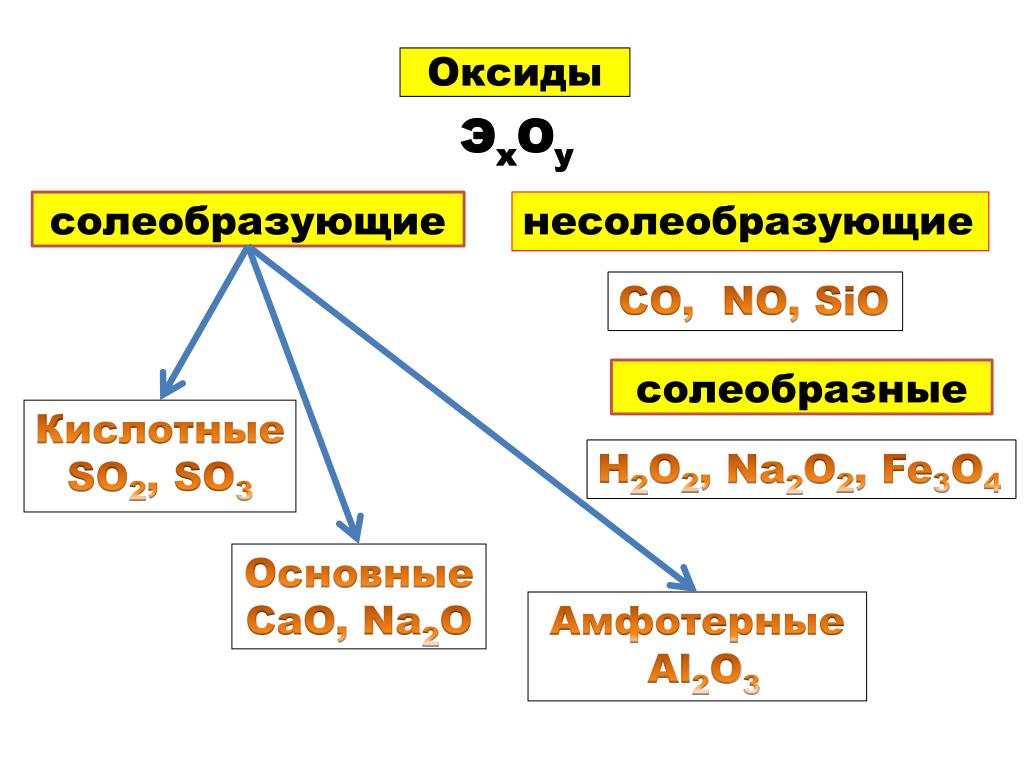 Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Они бывают солеобразующими и несолеобразующие.
Солеобразующие оксиды
– это такие оксиды, которые в результате химических реакций образуют соли. Это оксиды металлов и неметаллов, которые при взаимодействии с водой образуют соответствующие кислоты, а при взаимодействии с основаниями – соответствующие кислые и нормальные соли. Например,
оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl 2 + H 2 O.
В результате химических реакций можно получать и другие соли:
CuO + SO 3 → CuSO 4 .
Несолеобразующими оксидами
называются такие оксиды, которые не образуют солей. Примером могут служить СО, N 2 O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова «
основание»
), кислотными и амфотерными.
Основными оксидами
называются такие оксиды металлов, которым соответствуют гидроксиды, относящиеся к классу оснований. К основным оксидам относятся, например, Na 2 O, K 2 O, MgO, CaO и т.д.
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na 2 O + H 2 O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na 2 O + SO 3 → Na 2 SO 4 .
3. Реагируют с кислотами, образуя соль и воду:
CuO + H 2 SO 4 → CuSO 4 + H 2 O.
4. Реагируют с амфотерными оксидами:
Li 2 O + Al 2 O 3 → 2LiAlO 2 .
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO 2 , SO 3 , P 2 O 5 , N 2 O 3 , Cl 2 O 5 , Mn 2 O 7 и т. д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO 3 + H 2 O → H 2 SO 4 .
Но не все кислотные оксиды непосредственно реагируют с водой (SiO 2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO 2 + CaO → CaCO 3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO 2 + Ba(OH) 2 → BaCO 3 + H 2 O.
В состав амфотерного оксида
входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства.
Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH) 2 и H 2 ZnO 2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl 2 + H 2 O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + H 2 O => Na 2 .
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле . Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Остались вопросы? Хотите знать больше об оксидах?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные СO 2 , SO 2 , N 2 O, СО, NO и др. , жидкие (летучие) SO 3 , N 2 O 3 , твердые (летучие) Р 2 O 5 , N 2 O 5 , SeO 2 . Твердый, очень тугоплавкий оксид SiO 2 — вещество с атомной кристаллической решеткой.
, жидкие (летучие) SO 3 , N 2 O 3 , твердые (летучие) Р 2 O 5 , N 2 O 5 , SeO 2 . Твердый, очень тугоплавкий оксид SiO 2 — вещество с атомной кристаллической решеткой.
Оксиды неметаллов делят на две группы: несолеобразующие и солеобразующие. К несолеобразующим оксидам относятся SiO, N 2 O, NO, NO 2 , CO. Все остальные оксиды неметаллов являются солеобразующими, кислотными. При растворении их в воде образуются гидраты оксидов — гидроксиды, по своему характеру являющиеся кислотами. Кислоты и кислотные оксиды в результате химических реакций образуют соли, в которых неметалл сохраняет степень окисления.
Например:
Кислотный оксид SiO 2 нерастворим в воде, но ему также соответствует гидрат в виде кислоты H 2 SiO 3 и соли:
Оксиды и соответствующие им гидроксиды — кислоты, в которых неметалл проявляет степень окисления, равную номеру группы, т. е. высшее ее значение, называют высшими. Рассматривая Периодический закон, мы уже характеризовали их состав и свойства, например:
В пределах одной главной подгруппы, например VI группы, действует следующая закономерность изменения свойств высших оксидов и гидроксидов.
Если неметалл образует два или более кислотных оксидов, а значит, и соответствующих кислородсодержащих кислот, то их кислотные свойства усиливаются с увеличением степени окисления неметалла.
- !!! Оксиды такого состава неизвестны; НСlO 2 даже в водном растворе быстро разлагается.
Оксиды и кислоты, в которых неметалл имеет высшую степень окисления, могут проявлять только окислительные свойства.
Особенности сильнейших окислителей азотной кислоты HNO 3 и концентрированной серной кислоты H 2 SO 4 проявляются в реакциях с металлами, неметаллами, органическими веществами. Эти их свойства мы рассмотрим в § 20.
Оксиды и кислоты, где неметалл имеет промежуточную степень окисления, могут проявлять и окислительные, и восстановительные свойства.
Бинарные соединения кислорода с неметаллическими элементами — это большая группа веществ, которые входят в класс оксидов. Многие оксиды неметаллов всем хорошо известны. Это, например, углекислый газ, вода, двуокись азота. В нашей статье мы рассмотрим их свойства, выясним области применения бинарных соединений и их влияние на окружающую среду.
В нашей статье мы рассмотрим их свойства, выясним области применения бинарных соединений и их влияние на окружающую среду.
Общая характеристика
Практически все неметаллические элементы, за исключением фтора, аргона, неона и гелия, могут образовывать оксиды. Большинство элементов имеют несколько оксидов. Например, сера образует два соединения: двуокись серы и серный ангидрид. Это вещества, в которых валентность сульфура равна четырем и шести соответственно. Водород и бор имеют только по одному оксиду, а наибольшее количество бинарных веществ с кислородом характерно для азота. Высшими называются такие окислы, в которых степень окисления атома неметалла равна номеру группы, где находится элемент в периодической системе. Так, CO 2 и SO 3 — это высшие оксиды углерода и серы. Некоторые соединения могут подвергаться дальнейшему окислению. Например, угарный газ в таком случае превращается в диоксид углерода.
Строение и физические свойства
Практически все известные оксиды неметаллов состоят из молекул, между атомами которых образуются ковалентные связи. Сами частицы вещества могут быть как полярными (например, у диоксида серы), так и неполярными (молекулы углекислого газа). Двуокись кремния, представляющая собой природную форму песка, имеет атомное строение. Агрегатное состояние ряда кислотных оксидов может быть различным. Так, окислы карбона, такие как монооксид и диоксид углерода, — газообразны, а бинарные кислородные соединения водорода (H 2 O) или серы в высшей степени окисления (SO 3) представляют собой жидкости. Особенностью воды является то, что оксид относится к несолеобразующим. Их еще называют безразличными.
Сами частицы вещества могут быть как полярными (например, у диоксида серы), так и неполярными (молекулы углекислого газа). Двуокись кремния, представляющая собой природную форму песка, имеет атомное строение. Агрегатное состояние ряда кислотных оксидов может быть различным. Так, окислы карбона, такие как монооксид и диоксид углерода, — газообразны, а бинарные кислородные соединения водорода (H 2 O) или серы в высшей степени окисления (SO 3) представляют собой жидкости. Особенностью воды является то, что оксид относится к несолеобразующим. Их еще называют безразличными.
Трехокись серы или серный ангидрид — это кристаллическое белое вещество. Оно быстро поглощает из воздуха влагу, поэтому диоксид серы хранят в запаянных колбах из стекла. Вещество используется в качестве осушителя воздуха и в производстве сульфатной кислоты. Окислы фосфора или кремния являются твердыми кристаллическими веществами. Взаимное превращение агрегатного состояния характерно для оксидов азота. Так, соединение NO 2 — это газ бурого цвета, а соединение с формулой N 2 O 4 имеет вид бесцветной жидкости или белого твердого вещества. При нагревании жидкость превращается в газ, а его охлаждение приводит к образованию жидкой фазы.
При нагревании жидкость превращается в газ, а его охлаждение приводит к образованию жидкой фазы.
Взаимодействие с водой
Известны реакции кислотных оксидов с водой. Продуктами реакций будут соответствующие кислоты:
SO 3 + H 2 O = H 2 SO 4 — сульфатная кислота
К ним можно отнести взаимодействие пятиокиси фосфора, а также диоксидов серы, азота, углерода с молекулами H 2 O. Однако оксид кремния непосредственно с водой не реагирует. Чтобы получить силикатную кислоту, применяют косвенный способ. Сначала SiO 2 сплавляют со щелочью, например, с гидроксидом натрия. На полученную среднюю соль — силикат натрия, действуют сильной кислотой, например хлоридной.
В результате выпадает белый студенистый осадок кремниевой кислоты. Двуокись кремния может при нагревании реагировать с солями, при этом образуются летучие кислотные оксиды. К кислотным оксидам относятся несколько соединений азота, серы и фосфора, которые занимают ведущее место в загрязнении воздуха.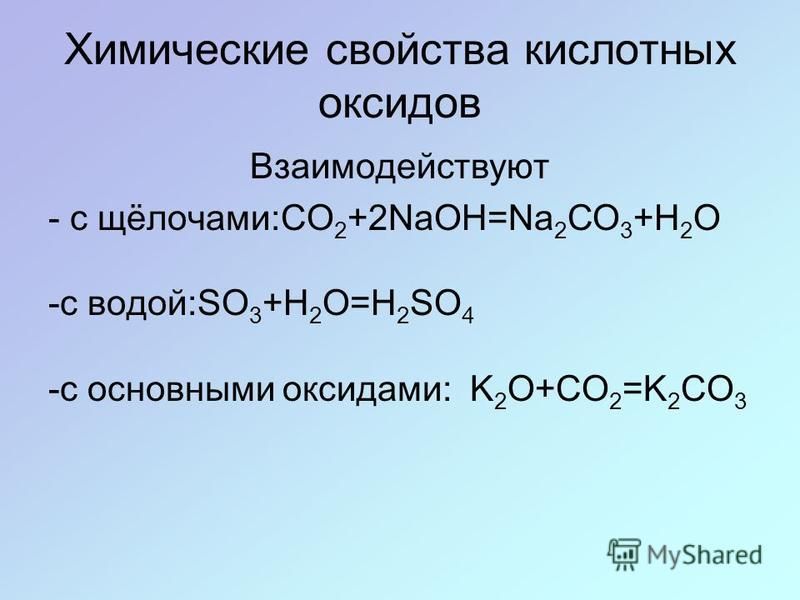 Они взаимодействуют с атмосферной влагой, что приводит к образованию серной, нитратной и азотистой кислоты. Их молекулы вместе с дождем или снегом попадают на растения и почву. Кислотные осадки не только вредят посевам, снижая их урожайность, но также негативно влияют на здоровье людей. Они разрушают постройки из известняка или мрамора, вызывают коррозию металлических конструкций.
Они взаимодействуют с атмосферной влагой, что приводит к образованию серной, нитратной и азотистой кислоты. Их молекулы вместе с дождем или снегом попадают на растения и почву. Кислотные осадки не только вредят посевам, снижая их урожайность, но также негативно влияют на здоровье людей. Они разрушают постройки из известняка или мрамора, вызывают коррозию металлических конструкций.
Безразличные окислы
К кислотным оксидам относится группа соединений, которые не могут вступать в реакции ни с кислотами, ни со щелочами и не образуют соли. Всем вышеперечисленным соединениям не соответствуют ни кислоты, ни основания, то есть они являются несолеобразующими. Таких соединений немного. Например, к ним относится угарный газ, закись азота и его монооксид — NO. Он, наряду с диоксидом азота и двуокисью серы, участвует в образовании смога над большими промышленными предприятиями и городами. Предотвратить образование токсичных окислов можно, если снизить температуру сгорания топлива.
Взаимодействие со щелочами
Способность к реакциям со щелочами — важная особенность кислотных оксидов. Например, при взаимодействии гидроксида натрия и трехокиси серы образуется соль (сульфат натрия) и вода:
Например, при взаимодействии гидроксида натрия и трехокиси серы образуется соль (сульфат натрия) и вода:
SO 3 + 2NaOH → Na 2 SO 4 + H 2 O
К кислотным оксидам относится двуокись азота. Ее интересной особенностью является реакция со щелочью, в продуктах обнаруживаются соли двух видов: нитраты и нитриты. Это объясняется способностью оксида азота (IV) при взаимодействии с водой образовывать две кислоты — азотную и азотистую. Двуокись серы также взаимодействует со щелочами, при этом образуются средние соли — сульфиты, а также вода. Соединение, попадая в воздух, сильно загрязняет его, поэтому на предприятиях, использующих топливо с примесью SO 2 , отработанные промышленные газы очищают, распыляя в них негашеную известь или мел. Также можно пропускать диоксид серы через известковую воду или раствор сульфита натрия.
Роль бинарных кислородных соединений неметаллических элементов
Многие кислотные оксиды имеют важное практическое значение. Например, углекислый газ используют в огнетушителях, так как он не поддерживает горение.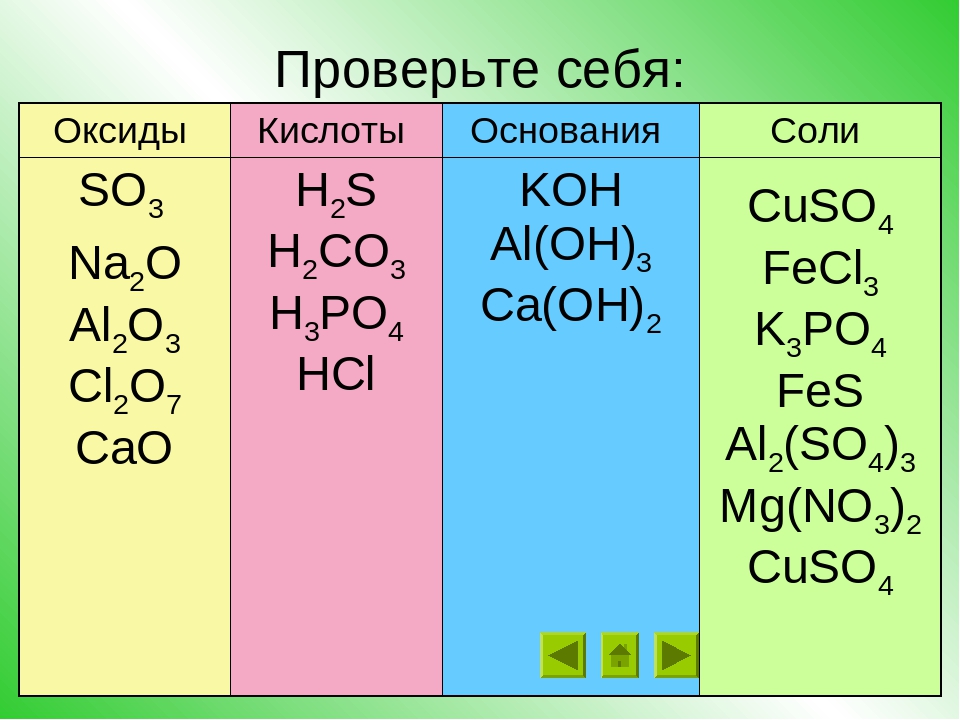 Окись кремния — песок, широко используется в строительной промышленности. Угарный газ является исходным сырьем для получения метилового спирта. К кислотным оксидам относится пятиокись фосфора. Это вещество применяют в производстве ортофосфорной кислоты.
Окись кремния — песок, широко используется в строительной промышленности. Угарный газ является исходным сырьем для получения метилового спирта. К кислотным оксидам относится пятиокись фосфора. Это вещество применяют в производстве ортофосфорной кислоты.
Бинарные кислородные соединения неметаллов влияют на организм человека. Большинство из них являются токсичными. О вредном влиянии угарного газа мы говорили ранее. Также доказано негативное воздействие оксидов азота, особенно двуокиси азота, на дыхательную и сердечно-сосудистую систему. К кислотным оксидам относится углекислый газ, который не считают ядовитым веществом. Но если его объемная доля в воздухе превышает 0,25%, у человека возникают симптомы удушья, которые могут иметь летальный исход вследствие остановки дыхания.
В нашей статье мы изучили свойства кислотных оксидов и привели примеры их практического значения в жизни человека.
Химические свойства оксидов
Конспект к уроку «Химические свойства оксидов»
Оксиды — неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода.
Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода.
Бывают:
солеобразующие (способны образовывать соли)
несолеобразующие (не могут образовывать соли, например, NO, N2O, SiO, CO).
Солеобразующие оксиды делятся на:
- кислотные (образованы неметаллами или металлами со степенью окисления +5, +6,+7) СО2, Mn2O7, CrO3.
- основные (образованы металлами 1 и 2 группы) CuO, Na2O.
- амфотерные (образованы металлами со степенью окисления +3, но не всегда) Al2O3, ZnO, PbO, SnO, Fe2O3, BeO.
Химические свойства основных оксидов
1. Взаимодействие с водой (только основные оксиды, которым соответствуют растворимые гидроксиды )
CaO + h3O → Ca(OH)2
2. Взаимодействие с кислотными оксидами и кислотами
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
Хотя бы одному из оксидов должен соответствовать сильный гидроксид или сильная кислота.
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи.
K2O + Al2O3 → 2KAlO2
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями
FeO + C = Fe + CO
CuO + CO = Cu + CO2
CuO + h3 = Cu + h3O
3FeO + 2Al = Al2O3 + 3Fe
CuO + Mg = Cu + MgO
3CuO + 2Nh4 = 3Cu + 3h3O + N2
5. Взаимодействие оксидов металлов с окислителями
4FeO + O2 = 2Fe2O3
Химические свойства кислотных оксидов
1. Взаимодействие с основными оксидами и основаниями
При этом хотя бы одному из оксидов должен соответствовать сильный гидроксид или кислота.
SO3 + CuO = CuSO4
SO3 + Cu(OH)2 = CuSO4 + h3O
SO2 + 2NaOH = Na2SO3 + h3O
SO2 + Na2O = Na2SO3
2. Взаимодействие с водой (оксиды, которым соответствуют неустойчивые кислоты, реагируют с водой обратимо)
Взаимодействие с водой (оксиды, которым соответствуют неустойчивые кислоты, реагируют с водой обратимо)
Исключение— оксид кремния.
SO3 + h3O = h3SO4
3. Взаимодействие с амфотерными оксидами и гидроксидами (только оксиды сильных или средних кислот).
3SO3 + Al2O3 = Al2(SO4)3
3SO3 + 2Al(OH)3 = Al2(SO4)3 + 3h3O
4. Взаимодействие с солями летучих кислот (менее летучие вытесняют более летучие)
CaCO3 + SiO2 = CaSiO3 + CO2
5. Оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3). Также оксиды могут выступать в роли восстановителей.
2SO2 + O2 = 2SO3
Химические свойства амфотерных оксидов
1. Взаимодействие с кислотами и кислотными оксидами
При этом амфотерные оксиды взаимодействуют с сильными и средними кислотами и их оксидами.
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3h3O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
2. Амфотерные оксиды не взаимодействуют с водой
Амфотерные оксиды не взаимодействуют с водой
3. Взаимодействие со щелочами
амфотерный оксид + щелочь = соль + вода (расплав)
Al2O3 + 2NaOH = 2NaAlO2 + h3O
амфотерный оксид + щелочь = комплексная соль(раствор)
ZnO + 2NaOH + h3O = Na2[Zn(OH)4]
4. Взаимодействие с основными оксидами
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
(в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей).
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Химические свойства несолеобразующих оксидов
Несолеобразующие оксиды могут реагировать с водородом
N2O + h3 = N2 + Н2O 2NO + 2 Н2 = N2 + 2 Н2OРеагируют с кислородом
2CO + О2 = 2CО22NO + О2 = 2NО2
При взаимодействии угарного газа с хлором при нагревании над активированным углем образуется фосген
2CO + Cl2 = 2COCl2
Оксид азота (I) — при нагревании разлагается 2N2O = 2N2 + О2
Химические свойства оксидов
Оксиды бывают:
- солеобразующие
- основные (Na2O, MgO),
- кислотные (SO3, CO2, Mn2O7),
- амфотерные (Al2O3, ZnO)
- несолеобразующие (NO, N2O, CO)
1. Основные оксиды реагируют с кислотами, кислотными оксидами, водой (только оксиды активных металлов)
Основные оксиды реагируют с кислотами, кислотными оксидами, водой (только оксиды активных металлов)
2. Кислотные оксиды реагируют с водой (кроме SiO2), щелочами, основными оксидами.
3. Амфотерные оксиды реагируют с кислотами, щелочами, кислоными оксидами, основными оксидами (при сплавлении)
4. Несолеобразующие оксиды — не реагируют ни с водой, ни с кислотами, ни со щелочами.
Давайте порассуждаем вместе
1. Какое из веществ взаимодействует с водой при комнатной температуре?
1) оксид кремния (IV)
2) оксид меди (II)
3) оксид серы (VI)
4) сера
Ответ: №3, т.к. SO3 + H2O = H2SO4 , кислотные оксиды реагируют с водой с образованием кислот, исключение SiO2.
2. Какое из веществ не взаимодействует с соляной кислотой
1) оксид углерода (IV)
2) оксид кальция
3) нитрат серебра
4) кальций
Ответ: №1, т.
к. с кислотами не взаимодействует кислотный оксид CO2
3. Оксид кальция не взаимодействует с
1) оксидом углерода (IV)
2) гидроксидом натрия
3) водой
4) хлороводородом
Ответ: №2, т.к. основные оксиды не реагируют со щелочами.
4. Соляная кислота реагирует с каждым из оксидов
1) CaO и CO2
2) SO3 и SiO2
3) CO и NO
4) MgO и ZnO
Ответ: №4 с кислотами реагируют основные (MgO) и амфотерные оксиды (ZnO)
MgO + 2HCl = MgCl2 + H2O
ZnO + 2HCl = ZnCl2 + H2O
5. Оксид магния реагирует с каждым из веществ
1) HCl и SO3
2) SO3 и NaOH
3) NaOH и H2О
4) H2SO4 и KCl
Ответ: №1, т.
к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3)
MgO + 2HCl = MgCl2 + H2O
MgO + SO3 = MgSO4
6. Оксид серы (IV) реагирует с
1) NaOH
2) NaCl
3) H2SO4
4) P2O5
Ответ: №1, т.к. оксид серы (IV) является кислотным оксидом и может реагировать со щелочью
NaOH + SO2 = Na2SO3 + H2O
7. С водным раствором гидроксида калия реагируют
1) алюминий
2) медь
3) натрий
4) сульфат меди (II)
5) сульфат натрия
Ответ: 1, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
CuSO4 — растворимая соль, со щелочью дает осадок Cu(OH)2 синего цвета CuSO4 + 2KOH = Cu(OH)2 + K2SO4
8. С разбавленным водным раствором серной кислоты реагируют
С разбавленным водным раствором серной кислоты реагируют
1) алюминий
2) медь
3) оксид меди (II)
4) хлорид калия
5) хлорид бария
Ответ: 1, 3, 5, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
CuO — основный оксид, реагирует с кислотами CuO + H2SO4 = CuSO4 + H2O
BaCl2 — растворимая соль, дает с серной кислотой белый осадок сульфата бария BaCl2 + H2SO4 = 2HCl + BaSO4
9. С водными растворами каких веществ реагирует углекислый газ
1) хлорид натрия
2) карбонат натрия
3) гидроксид кальция
4) соляная кислота
5) гидроксид натрия
Ответ: 2, 3, 5, т.
к. CO2 — кислотный оксид, он реагирует с растворами карбонатов с образованием кислых солей Na2CO3 + CO2 + H2O = 2NaHCO3
Ca(OH)2 и NaOH — щелочи реагируют с кислотными оксидами Ca(OH)2 + CO2 = CaCO3 + H2O ; 2NaOH + CO2 = Na2CO3 + H2O
10. С водным раствором гидроксида натрия реагируют
1) алюминий
2) хлор
3) оксид железа (II)
4) оксид серы (IV)
5) серебро
Ответ: 1, 2, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Cl2 — активный неметалл — галоген реагирует со щелочью и на холоду и при нагревании
Cl2 + 2NaOH = NaCl + NaClO + h3O (холод)
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O (нагрев)
SO2 — кислотный оксид реагирует со щелочью SO2 + 2NaOH = Na2SO3 + H2O
11. С водным раствором азотной кислоты реагируют
С водным раствором азотной кислоты реагируют
1) медь
2) углекислый газ
3) оксид магния
4) серная кислота
5) оксид алюминия
Ответ: 1,3, 5, т.к. азотная кислота сильный окислитель, она реагирует даже с металлами, стоящими после водорода, выделяя оксиды азота
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
MgO и Al2O3 — основный и амфотерный оксиды соответственно, они реагируют с кислотами с образованием соли и воды
MgO + 2HNO3 = Mg(NO3)2 + H2O
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
12. Оксид железа (II) взаимодействует с раствором
1) аммиака
2) бромоводорода
3) карбоната калия
4) хлорида натрия
Ответ: №2, т.
к. основные оксиды реагируют с кислотами
FeO + 2HBr = FeBr2 = H2O
Урок 15. свойства оксидов неметаллов. свойства серной и азотной кислот. водородные соединения неметаллов — Химия — 11 класс
Химия, 11 класс
Урок № 15. Свойства оксидов неметаллов. Свойства серной и азотной кислот. Водородные соединения неметаллов
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению соединений неметаллов: оксидам неметаллов, кислородсодержащим кислотам и водородным соединениям неметаллов.
Глоссарий
Азотная кислота – HNO3 — представляет собой бесцветную «дымящуюся» на воздухе жидкость. Приобретает на воздухе желтоватый цвет из-за разложения на двуокись азота.
Аммиак – NH3 – бинарное химическое соединение азота с водородом, бесцветный токсичный газ с резким характерным запахом, 10%-ный раствор аммиака используют в медицине, называют нашатырным спиртом.
Высшие оксиды – оксиды, в которых элементы проявляют свою наибольшую валентность
Метан – CH4 — бинарное химическое соединение водорода и углерода. Бесцветный газ без запаха, основной компонент природного газа.
Серная кислота – H2SO4 – сильная двухосновная кислота. При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Мировое производство серной кислоты около 200 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений.
Сернистый газ – SO2 – оксид серы IV. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Токсичен. Один из основных компонентов вулканических газов.
Токсичен. Один из основных компонентов вулканических газов.
Серный газ – SO3 – оксид серы VI. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. Весьма токсичен. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Сероводород – SH2 – бинарное химическое соединение водорода и серы. Бесцветный газ со сладковатым вкусом, обеспечивающий запах протухших куриных яиц.
Силан – SiH4 — бинарное химическое соединение водорода и кремния. Бесцветный газ с неприятным запахом.
Угарный газ – CO – монооксид углерода, оксид углерода II, бесцветный чрезвычайно токсичный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей. Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом.
Углекислый газ – CO2 – диоксид углерода, оксид углерода IV, бесцветный газ, почти без запаха, но в больших концентрациях приобретает кисловатый запах, знакомый нам по газировке. Является одним из парниковых газов.
Фосфин – PH3 — бинарное химическое соединение водорода и фосфора. Бесцветный ядовитый газ без запаха, однако примеси могут дать ему запах тухлой рыбы.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
– 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Соединения неметаллов с кислородом и водородом
Неметаллы (углерод, кислород, азот, сера, галогены) могут образовывать соединения как с кислородом (оксиды), так и с водородом. Водородные соединения являются газами или жидкостями, например, вода, аммиак, сероводород, соляная кислота. Оксиды могут быть газами (углекислый или сернистый газ), жидкостями (оксид хлора(VI) и (VIII)) или твёрдыми телами (оксид фосфора(V)).
Оксиды неметаллов
Типичными примерами оксидов неметаллов являются:
Сернистый газ (SO2), серный газ (SO3), угарный газ (CO), углекислый газ (CO2), оксид фосфора V (P2O5), оксид азота I (NO), оксид азота II (NO2).
Оксиды неметаллов подразделяют на две группы – несолеобразующие (SiO, N2O, NO, CO, S2O, H2O) и солеобразующие (остальные).
Несолеобразующих оксидов немного, их обыкновенно образуют одновалентные и двухвалентные неметаллы.
Солеобразующие оксиды неметаллов при взаимодействии с водой дают соответствующую им кислоту. Исключение составляет оксид кремния IV, который нерастворим в воде. Соответствующую ему кремниевую кислоту получают косвенным путём — взаимодействием растворимых силикатов щелочных металлов с кислотами.
Высшие оксиды – это оксиды, в которых неметалл проявляет степень окисления, равную номеру группы.
Кислотные свойства оксидов. В пределах одного периода с увеличением номера группы наблюдается увеличение кислотных свойств высших оксидов и соответствующих им кислот. Например, для неметаллов третьего периода, кремниевая кислота является слабой, а хлорная кислота является одной из самых сильных.
Такая закономерность вытекает из периодического закона Менделеева. В периоде радиус атома неметалла уменьшается с увеличением номера группы, а заряд неметалла при этом увеличивается. Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
В периоде радиус атома неметалла уменьшается с увеличением номера группы, а заряд неметалла при этом увеличивается. Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
В пределах одной главной подгруппы происходит ослабление кислотных свойств оксидов и кислот с увеличением номера периода.
Соединения неметаллов с водородом
Кроме соединений с кислородом, неметаллы образуют соединения с водородом. Например, метан (CH4), аммиак (NH3), вода (H2O), плавиковая кислота (HF), соляная кислота (HCl). Эти соединения представляют собой газы или жидкости.
В периодах слева направо кислотные свойства водородных соединений неметаллов в водных растворах усиливаются. Это связано с тем, что в этом направлении у атомов элементов увеличивается заряд ядра и уменьшается радиус.
В группах сверху вниз, по мере увеличения атомного радиуса, отрицательно заряженные анионы неметаллов всё слабее притягивают положительно заряженные ионы водорода. Таким образом, отщепление ионов водорода происходит проще и кислотность увеличивается.
Таким образом, отщепление ионов водорода происходит проще и кислотность увеличивается.
Кислородосодержащие кислоты
Некоторые из рассматриваемых соединений при взаимодействии с водой образуют кислородосодержащие кислоты, такие как серная, азотная, фосфорная кислоты.
Азотная кислота также относится к кислородосодержащим кислотам, но не образуется при растворении соответствующих оксидов в воде. Для синтеза этой кислоты требуется более сложный процесс: смесь оксидов азота реагируют с водой с поглощением кислорода.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на определение участников реакции.
Условие задания:
Оксид с формулой XO2 прореагировал с 14 г CaO (оксид неметалла был взят в избытке), при этом образовалось 30 г соли CaXO3.
1) Укажите порядковый номер элемента X.
2) Какая масса (в граммах) оксида неметалла прореагировала?
3) Укажите степень окисления неметалла в оксиде XO2 (без знака)
4) Укажите максимальную степень окисления элемента X (без знака)
Шаг первый:
Составим уравнение реакции оксида неметалла с основным оксидом:
XO2 + CaO → CaXO3
Стехиометрическое соотношение CaO к CaXO3 – 1:1
Шаг второй:
Определим количество вещества CaO: M(CaO) = 56 г/моль. Количество вещества n = m/M. n(CaO) = 14/56 = 0,25 моль.
Количество вещества n = m/M. n(CaO) = 14/56 = 0,25 моль.
Шаг третий
Определим молярную массу элемента X. Поскольку стехиометрическое соотношение CaO к CaXO3 – 1:1, то n(CaXO3) = 0,25 моль. Определим молярную массу соединения CaXO3. M = m/n. M(CaXO3) = 30/0,25 = 120 г/моль. Молярная масса CaXO3 слладывается из атомарных масс образующих соединение элементов. Получаем уравнение:
M(Ca) + M(X) + 3*M(O) = 120
40 + M(X) + 48 = 120
M(X) = 32 г/моль
Шаг четвёртый
Определяем элемент X. Находим в таблице Менделеева элемент с молярной массой 32 г/моль. Это сера, элемент с порядковым номером 16.
Шаг пятый
Определяем массу прореагировавшего XO2. Исходя из материального баланса:
m(XO2) + m(CaO) = m(CaXO3)
m(CaO) и m(CaXO3) известны из условия задачи. Определяем m(XO2).
m(XO2) = 30 – 14 = 16 г.
Шаг шестой
Определеяем степень окисления неметалла в оксиде XO2 (без знака). Степень окисления кислорода в оксидах = -2. Значит, степень окисления X = +4. Без знака: 4.
Шаг седьмой
Определяем максимальную степень окисления элемента X (без знака). Мы определили, что элемент X – это сера. Максимальную степень окисления элементы проявляют в высших оксидах. Высший оксид для серы это SO3. Степень окисления серы в нём = +6. Без знака: 6.
Ответ:
Порядковый номер элемента X – 16. Это сера.
m(XO2) = 16 г. Степень окисления неметалла в оксиде XO2 (без знака): 4. Максимальную степень окисления элемента X (без знака): 6.
- Решение задачи на установление соответствия между оксидами неметаллов и соответствующим им кислотам.
Условие задания:
Соедините между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
Шаг первый:
Определим среди предложенных соединений оксиды неметаллов. Это Cl2O, SO2, SO3, CO2. Остальные соединения не являются оксидами.
Это Cl2O, SO2, SO3, CO2. Остальные соединения не являются оксидами.
Шаг второй:
Определим соответствующие им кислоты. Такие кислоты получаются при взаимодействии оксидов с водой:
Cl2O + H2O → 2 HClO
SO2 + H2O → H2SO3
SO3 + H2O → H2SO3
CO2 + H2O → H2CO3
Шаг четвёртый:
Соединяем между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
Ответ:
Урок 32. Химические свойства оксидов – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 32 «Химические свойства оксидов» из курса «Химия для чайников» узнаем о всех химических свойствах кислотных и основных оксидов, рассмотрим с чем они реагируют и что при этом образуется.
Так как химический состав кислотных и основных оксидов различен, они отличаются своими химическими свойствами.
1. Химические свойства кислотных оксидов
а) Взаимодействие с водой
Вы уже знаете, что продукты взаимодействия оксидов с водой называются «гидроксиды»:
Поскольку оксиды, вступающие в эту реакцию, делятся на кислотные и основные, то и образующиеся из них гидроксиды также делятся на кислотные и основные. Таким образом, кислотные оксиды (кроме SiO2) реагируют с водой, образуя кислотные гидроксиды, которые являются кислородсодержащими кислотами:
Каждому кислотному оксиду соответствует кислородсодержащая кислота, относящаяся к кислотным гидроксидам. Несмотря на то что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но ее получают другими способами.
б) Взаимодействие с щелочами
Все кислотные оксиды реагируют со щелочами по общей схеме:
В образующейся соли валентность атомов металла такая же, как и в исходной щелочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в квадратных скобках), то в составе образующейся соли будет остаток этой кислоты — NO3 с валентностью, равной I:
Поскольку все кислотные оксиды реагируют со щелочами с образованием солей и воды, этим оксидам можно дать другое определение.
Кислотными называются оксиды, реагирующие со щелочами с образованием солей и воды.
в) Реакции с основными оксидами
Кислотные оксиды реагируют с основными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:
Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4, то в составе образующейся соли будет остаток этой кислоты — РO4 с валентностью, равной III.
2. Химические свойства основных оксидов
а) Взаимодействие с водой
Вы уже знаете, что в результате взаимодействия основных оксидов с водой образуются основные гидроксиды, которые иначе называются основаниями:
К таким основным оксидам относятся оксиды: Li2O, Na2O, K2O, CaO, BaO.
При написании уравнений соответствующих реакций следует помнить, что валентность атомов металла в образующемся основании равна его валентности в исходном оксиде.
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) Взаимодействие с кислотами
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
Следует помнить, что в образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Поскольку все основные оксиды реагируют с кислотами с образованием солей и воды, этим оксидам можно дать другое определение.
Основными называются оксиды, реагирующие с кислотами с образованием солей и воды.
в) Взаимодействие с кислотными оксидами
Основные оксиды реагируют с кислотными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Поскольку рассмотренные нами кислотные и основные оксиды в результате различных реакций образуют соли, их называют солеобразующими. Существует, однако, небольшая группа оксидов, которые в аналогичных реакциях не образуют солей, поэтому их называют несолеобразующими.
Краткие выводы урока:
- Все кислотные оксиды реагируют со щелочами с образованием солей и воды.
- Все основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные и основные оксиды являются солеобразующими. Несолеобразующие оксиды — CO, N2О, NO.

- Основания и кислородсодержащие кислоты являются гидроксидами.
Надеюсь урок 32 «Химические свойства оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
ЕГЭ. Химические свойства оксидов
Химические свойства оксидов
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Щелочь |
Реакция идет, если образуется растворимое основание, а также Ca(OH)2:
CaO + H2O → Ca(OH)2
MgO + H2O → Реакция не идет, ак как Mg(OH)2 нерастворим*
|
| Амфотерный оксид | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота |
Все реакции идут за исключением SiO2 (кварц, песок):
SiO2 + H2O → реакция не идет
|
* Источник: [2] «Я сдам ЕГЭ. Курс самоподготовки», стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
CO2 + SO3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO2, SO2, о них подробнее ниже):
Na2O + SO3 → Na2SO4
CaO + CO2 → CaCO3
Na2O + ZnO → Na2ZnO2
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Na2O + HNO3 → NaNO3 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H2SiO3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO2 + 2H2S → 3S + 2H2O
SO3 + H2S → SO2 + H2O
SiO2 + 4HF(нед.) → SiF4 + 2H2O
С кислотами-окислителями (только если оксид можно окислить):
SO2 + HNO3 + H2O → H2SO4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
SiO2 + 2NaOH → Na2SiO3 +H2O
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3 (если CO2 в избытке)
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
(кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
(кислота: H2BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
(кислота: HAlO2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO2 + CaCO3 → CaSiO3 + CO2
P2O5 + 3CaCO3 → Ca3(PO4)2 + 3CO2
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
ZnO + 2KHCO3 → K2ZnO2 + 2CO2 + H2O
SiO2 + K2SO3 → K2SiO3 + SO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO3 + CO2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H2:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
CuO + H2 → Cu + H2O
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
ZnO + H2 → Zn + H2O
PbO + C → Pb + CO
PbO + CО → Pb + CO2
PbO + H2 → Pb + H2O
FeO + C → Fe + CO
FeO + CО → Fe + CO2
FeO + H2 → Fe + H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3CО → 2Fe + 3CO2
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
2. Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
CaO + 3C → CaC2 + 3CO
2Al2O3 + 9C → Al4C3 + 6CO
3. Восстановление более активным металлом:
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3.
4. Некоторые оксиды неметаллов также возможно восстановить до свободного неметалла:
2P2O5 + 5C → 4P + 5CO2
SO2 + C → S + CO2
2NO + C → N2 + CO2
2N2O + C → 2N2 + CO2
SiO2 + 2C → Si + 2CO
Только оксиды азота и углерода реагируют с водородом:
2NO + 2H2 → N2 + 2H2O
N2O + H2 → N2 + H2O
SiO2 + H2 → реакция не идет.
В случае углерода восстановления до простого вещества не происходит:
CO + 2H2 <=> CH3OH (t, p, kt)
Особенности свойств оксидов CO
2 и SO2
1. Не реагируют с амфотерными гидроксидами:
CO2 + Al(OH)3 → реакция не идет
2. Реагируют с углеродом:
CO2 + C → 2CO
SO2 + C → S + CO2
3. С сильными восстановителями SO2 проявляет свойства окислителя:
SO2 + 2H2S → 3S + 2H2O
SO2 + 4HI → S + 2I2 + 2H2O
SO2 + 2C → S + CO2
SO2 + 2CO → S + 2CO2 (Al2O3, 500°C)
4. Сильные окислители окисляют SO2:
SO2 + Cl2 <=> SO2Cl2
SO2 + Br2 <=> SO2Br2
SO2 + NO2 → SO3 + NO
SO2 + H2O2 → H2SO4
5SO2 + 2KMnO4 +2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + 2KMnO4 + 4KOH → 2K2MnO4 +K2SO4 + 2H2O
SO2 + HNO3 + H2O → H2SO4 + NO
6. Оксид углерода (IV) CO2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
Оксид углерода (IV) CO2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
CO2 + 2Mg → 2MgO + C (t)
Особенности свойств оксидов азота (N
2O5, NO2, NO, N2O)
1. Необходимо помнить, что все оксиды азота являются сильными окислителями. Совсем необязательно помнить какие продукты образуются в подобных реакциях, так как подобные вопросы возникают только в тестах. Нужно лишь знать основные восстановители, такие как C, CO, H2, HI и йодиды, H2S и сульфиды, металлы (и т.д.) и знать, что оксиды азота их с большой вероятностью окислят.
2NO2 + 4CO  → N2 + 4CO2
2NO2 + 2S → N2 + 2SO2
2NO2 + 4Cu → N2 + 4CuO
N2O5 + 5Cu → N2 + 5CuO
2N2O5 + 2KI → I2 + 2NO2 + 2KNO3
N2O5 + H2S → 2NO2 + S + H2O
2NO + 2H2 → N2 + 2H2O
2NO + C → N2 + CO2
2NO + Cu → N2 + 2Cu2O
2NO + Zn → N2 + ZnO
2NO + 2H2S → N2 + 2S + 2H2O
N2O + H2 → N2 + H2O
2N2O + C → 2N2 + CO2
N2O + Mg → N2 + MgO
2. Могут окисляться сильными окислителями (кроме N2O5, так как степень окисления уже максимальная):
Могут окисляться сильными окислителями (кроме N2O5, так как степень окисления уже максимальная):
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
NO + KMnO4 + H2SO4 → HNO3 + K2SO4 + MnSO4 + H2O
5N2O + 2KMnO4 + 3H2SO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O.
3. Несолеобразующие оксиды N2O и NO не реагируют ни с водой, ни с щелочами, ни с обычными кислотами (кислотами-неокислителями).
Химические свойства CO как сильного восстановителя
1. Реагирует с некоторыми неметаллами:
2CO + O2 → 2CO2
CO + 2H2 <=> CH3OH (t, p, kt)
CO + Cl2 <=> COCl2 (фосген)
2. Реагирует с некоторыми сложными соединениями:
Реагирует с некоторыми сложными соединениями:
CO + KOH → HCOOK
CO + Na2O2 → Na2CO3
CO + Mg → MgO + C (t)
3. Восстанавливает некоторые металлы (средней и малой активности) и неметаллы из их оксидов:
CO + CuO → Cu + CO2
3CO + Fe2O3 → 2Fe + 3CO2
3CO + Cr2O3 → 2Cr + 3CO2
2CO + SO2 → S + 2CO2 (Al2O3, 500°C)
5CO + I2O5 → I2 + 5CO2
4CO + 2NO2 → N2 + 4CO2
3. С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
Химические свойства SiO
2
1. Взаимодействует с активными металлами:
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
2. Взаимодействует с углеродом:
Взаимодействует с углеродом:
SiO2 + 2C → Si + 2CO
(Согласно пособию «Курс самоподготовки» Каверина, SiO2 + CO → реакция не идет)
3 С водородом SiO2 не взаимодействует.
4. Реакции с растворами или расплавами щелочей, с оксидами и карбонатами активных металлов:
SiO2 + 2NaOH → Na2SiO3 +H2O
SiO2 + CaO → CaSiO3
SiO2 + BaO → BaSiO3
SiO2 + Na2CO3 → Na2SiO3 + CO2
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + Cu(OH)2 → реакция не идет (из оснований оксид кремния реагирует только с щелочами).
5. Из кислот SiO2 взаимодействует только с плавиковой кислотой:
SiO2 + 4HF → SiF4 + 2H2O.
Свойства оксида P
2O5 как сильного водоотнимающего средства
HCOOH + P2O5 → CO + H3PO4
2HNO3 + P2O5 → N2O5 + 2HPO3
2HClO4 + P2O5 → Cl2O7 + 2HPO3.
Термическое разложение некоторых оксидов
В вариантах экзамена такое свойство оксидов не встречается, но рассмотрим его для полноты картины:
Основные:
4CuO → 2Cu2O + O2 (t)
2HgO → 2Hg + O2 (t)
Кислотные:
2SO3 → 2SO2 + O2 (t)
2N2O → 2N2 + O2 (t)
2N2O5 → 4NO2 + O2 (t)
Амфотерные:
4MnO2 → 2Mn2O3 + O2 (t)
6Fe2O3 → 4Fe3O4 + O2 (t).
Особенности оксидов NO
2, ClO2 и Fe3O4
1. Диспропорционирование: оксидам NO2 и ClO2 соответствуют две кислоты, поэтому при взаимодействии с щелочами или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла в случае NO2 и хлорат и хлорит в случае ClO2:
2N+4O2 + 2NaOH → NaN+3O2 + NaN+5O3 + H2O
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
В аналогичных реакциях с кислородом образуются только соединения с N+5, так как он окисляет нитрит до нитрата:
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
2Cl+4O2 + H2O → HCl+3O2 + HCl+5O3
2ClO2 + 2NaOH → NaClO2 + NaClO3 + H2O
2. Оксид железа (II,III) Fe3O4 (FeO·Fe2O3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Оксид железа (II,III) Fe3O4 (FeO·Fe2O3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 4H2O.
Основная информация о NO2 | Агентство по охране окружающей среды США
На этой странице:
Что такое NO
2 и как он попадает в воздух?
Двуокись азота (NO 2 ) является одним из группы высокореактивных газов, известных как оксиды азота или оксиды азота (NO x ). Другие оксиды азота включают азотистую кислоту и азотную кислоту. NO 2 используется как индикатор для большей группы оксидов азота.
NO 2 в первую очередь попадает в воздух в результате сгорания топлива.NO 2 образуется в результате выбросов легковых, грузовых автомобилей и автобусов, электростанций и внедорожного оборудования.
Воздействие NO
2
Воздействие на здоровье
Воздух для дыхания с высокой концентрацией NO 2 может вызывать раздражение дыхательных путей в дыхательной системе человека. Такое воздействие в течение коротких периодов времени может усугубить респираторные заболевания, особенно астму, что приведет к респираторным симптомам (таким как кашель, хрипы или затрудненное дыхание), госпитализации и обращению в отделения неотложной помощи.Более длительное воздействие повышенных концентраций NO 2 может способствовать развитию астмы и потенциально повышать восприимчивость к респираторным инфекциям. Люди, страдающие астмой, а также дети и пожилые люди, как правило, подвергаются большему риску воздействия на здоровье NO 2 .
NO 2 вместе с другими NO x вступает в реакцию с другими химическими веществами в воздухе с образованием твердых частиц и озона. Оба они также вредны при вдыхании из-за воздействия на дыхательную систему.
Воздействие на окружающую среду
NO 2 и другие NO x взаимодействуют с водой, кислородом и другими химическими веществами в атмосфере с образованием кислотных дождей. Кислотные дожди наносят вред уязвимым экосистемам, таким как озера и леса.
Нитратные частицы, образующиеся в результате NO x , делают воздух мутным и трудным для просмотра. Это влияет на многие национальные парки, которые мы посещаем ради просмотра.
NO x в атмосфере способствует загрязнению прибрежных вод биогенными веществами.
Что делается для уменьшения загрязнения NO
2 ?
Национальные и региональные правила EPA по сокращению выбросов NO 2 и NO x помогут правительствам штатов и местным органам власти соответствовать Национальному стандарту качества окружающего воздуха (NAAQS).
EPA определяет районы, где качество воздуха не соответствует национальным стандартам NO 2 . Для этих областей правительства штатов, местных властей и племен разрабатывают планы по сокращению количества NO 2 в воздухе.
Для этих областей правительства штатов, местных властей и племен разрабатывают планы по сокращению количества NO 2 в воздухе.
Характеристика роли оксида азота и его клинического применения — FullText — Cardiology 2012, Vol. 122, № 1
Аннотация
Оксид азота (NO) давно известен как фактор релаксации эндотелия. Это сосудорасширяющее средство, регулирующее тонус сосудов, кровяное давление и гемодинамику, роль которого используется в терапии донорами нитратов при стенокардии, сердечной недостаточности, легочной гипертензии и эректильной дисфункции. Кроме того, его мощные антиоксидантные, противовоспалительные и антитромботические свойства обладают антиатерогенным и антиатеротромботическим действием.Передача сигналов NO модулирует сократимость и метаболизм скелетных мышц и миокарда и тесно связана с передачей сигналов инсулина. Сосудистые и мышечные сигналы NO координируют потребность скелетных мышц и миокарда в энергии с предложением и имеют решающее значение для гомеостаза всего тела как углеводов, так и жирных кислот. Передача сигналов NO в митохондриях лежит в основе метаболического эффекта NO, который при низких физиологических уровнях связывает потребность клеток в энергии с энергоснабжением митохондрий, благотворно влияя на окислительный стресс митохондрий и обработку кальция.Митохондрии также являются местом возникновения опасных для жизни вредных эффектов, возникающих из-за чрезмерного уровня NO, связанного с воспалением. NO-дефицитные состояния характеризуются клеточным старением, окислительным стрессом, воспалением, эндотелиальной дисфункцией, сосудистыми заболеваниями, инсулинорезистентностью и сахарным диабетом 2 типа. Ожидается, что NO-обогащающая терапия принесет пользу не только с точки зрения гемодинамики, но и с точки зрения метаболизма. Напротив, необходимы стратегии для ограничения чрезмерного количества NO при таких состояниях, как септический шок.
Передача сигналов NO в митохондриях лежит в основе метаболического эффекта NO, который при низких физиологических уровнях связывает потребность клеток в энергии с энергоснабжением митохондрий, благотворно влияя на окислительный стресс митохондрий и обработку кальция.Митохондрии также являются местом возникновения опасных для жизни вредных эффектов, возникающих из-за чрезмерного уровня NO, связанного с воспалением. NO-дефицитные состояния характеризуются клеточным старением, окислительным стрессом, воспалением, эндотелиальной дисфункцией, сосудистыми заболеваниями, инсулинорезистентностью и сахарным диабетом 2 типа. Ожидается, что NO-обогащающая терапия принесет пользу не только с точки зрения гемодинамики, но и с точки зрения метаболизма. Напротив, необходимы стратегии для ограничения чрезмерного количества NO при таких состояниях, как септический шок.
© 2012 S. Karger AG, Базель
Введение
Оксид азота (NO) наиболее известен своим действием на сосуды. Кроме того, NO играет ключевую роль в клеточном метаболизме и способствует согласованию потребности ткани в энергии с ее предложением [1]. Передача физиологических сигналов NO имеет решающее значение для метаболического и сердечно-сосудистого гомеостаза. Нарушение регуляции сигнальных путей NO связано с патогенезом кардиометаболических нарушений [2].
Кроме того, NO играет ключевую роль в клеточном метаболизме и способствует согласованию потребности ткани в энергии с ее предложением [1]. Передача физиологических сигналов NO имеет решающее значение для метаболического и сердечно-сосудистого гомеостаза. Нарушение регуляции сигнальных путей NO связано с патогенезом кардиометаболических нарушений [2].
История
NO имеет увлекательную и яркую научную историю. На основании открытий и по сей день характеристики NO охватывают весь диапазон, когда он считается токсичным загрязнителем воздуха, компонентом взрывчатых веществ, провоспалительным и прооксидантным медиатором или здоровым регулятором здоровья сосудов и обмена веществ.
NO, бесцветный токсичный газ, был впервые изучен британским теологом и химиком Джозефом Пристли в 1772 году.
В середине 19 века французский химик Теофиль-Жюль Пелуз работал со взрывчатыми веществами, такими как пушистый хлопок и другие нитросульфаты.Его ученик, итальянский химик Асканио Собреро, открыл нитроглицерин (тринитрат глицерина) в 1847 году и заметил в то время, что воздействие незначительных количеств этого химического вещества воспроизводимо вызывает сильные головные боли. Другой ученик Пелуза, химик и инженер Альфред Нобель, соединил это очень нестабильное соединение с кизельгуром и запатентовал его в 1867 году как более стабильный коммерческий взрывной динамит, на котором он сделал свое состояние. Случайное наблюдение в то время заключалось в том, что фабричные рабочие, страдающие стенокардией, которые были вовлечены в производство нитроглицерина, обнаруживали, что их состояние улучшалось в течение рабочей недели, но ухудшалось по воскресеньям после отмены нитроглицерина [3].
Другой ученик Пелуза, химик и инженер Альфред Нобель, соединил это очень нестабильное соединение с кизельгуром и запатентовал его в 1867 году как более стабильный коммерческий взрывной динамит, на котором он сделал свое состояние. Случайное наблюдение в то время заключалось в том, что фабричные рабочие, страдающие стенокардией, которые были вовлечены в производство нитроглицерина, обнаруживали, что их состояние улучшалось в течение рабочей недели, но ухудшалось по воскресеньям после отмены нитроглицерина [3].
Интересно, что связи Нобеля с NO идут дальше. В 1879 году британский врач Уильям Мюррелл представил нитроглицерин для лечения стенокардии. Позже Нобель страдал стенокардией, но отказался от лечения нитроглицерином. Почти 100 лет спустя, в 1977 году, Ферид Мурад обнаружил, что благотворное фармакологическое действие нитроглицерина на гладкие мышцы сосудов связано с высвобождением NO [3]. В своем последнем завещании Альфред Нобель завещал свое состояние на учреждение пяти ежегодных премий для лиц, приносящих «величайшее благо человечеству». Одна из таких Нобелевских премий позже должна была быть присуждена за «NO как сигнальная молекула в сердечно-сосудистой системе», которую журнал Science за 1992 назвал «молекулой года»; Нобелевская премия по физиологии и медицине 1998 г. была присуждена совместно Фериду Мураду, Роберту Ф. Ферчготту, которые вместе с Джоном Завадски в 1980 г. признали важность эндотелиального расслабляющего фактора в индуцированной ацетилхолином вазодилатации, и Луи Дж. Игнарро, который и Salvador Moncada идентифицировали релаксирующий фактор эндотелиального происхождения как NO в 1987 г. [4].
Одна из таких Нобелевских премий позже должна была быть присуждена за «NO как сигнальная молекула в сердечно-сосудистой системе», которую журнал Science за 1992 назвал «молекулой года»; Нобелевская премия по физиологии и медицине 1998 г. была присуждена совместно Фериду Мураду, Роберту Ф. Ферчготту, которые вместе с Джоном Завадски в 1980 г. признали важность эндотелиального расслабляющего фактора в индуцированной ацетилхолином вазодилатации, и Луи Дж. Игнарро, который и Salvador Moncada идентифицировали релаксирующий фактор эндотелиального происхождения как NO в 1987 г. [4].
С момента открытия роли NO в передаче сигналов в клетке, NO стал одной из наиболее изученных молекул в новейшей истории. По NO и его разнообразным физиологическим эффектам опубликовано около 115 000 научных статей [5].
Синтаза оксида азота
NO продуцируется во многих тканях четырьмя различными изоформами NO-синтазы (NOS):
(1) нейрональный NOS-1 (nNOS),
(2) индуцибельный NOS-2 (iNOS),
(3) эндотелиальный NOS-3 (eNOS) и
(4) митохондриальный NOS (mtNOS) [6].
В то время как iNOS индуцируется, eNOS и nNOS выражаются конститутивно, непрерывно вырабатывая NO. Экспрессия NOS в ткани менее строгая, чем подразумевается в номенклатуре, и все три изоформы могут быть конститутивными или индуцибельными [6].
NOS состоит из домена редуктазы и оксигеназы. Сцепление редуктазного домена одного мономера NOS с оксигеназным доменом его партнера необходимо для правильного производства NO. Димеру NOS требуется никотинамидадениндинуклеотидфосфатоксидаза (NADH / NADPH), кофактор тетрагидробиоптерина (BH 4 ) и кислород (O 2 ) для превращения его субстрата, L -аргинин, в L высвобождение окисленного азота на конце L -аргинин, NO [6]:
(NOS димер)
L -аргинин → L -цитруллин + NO ·
Молекулярный O 2 вместо L -аргинин становится субстратом для несвязанного мономера NOS, образуя супероксид O 2 — · вместо NO, тем самым увеличивая прооксидантный стресс.
Сигнализация оксида азота
NO Биодоступность
NO представляет собой простой по структуре, низкомолекулярный, высоколипофильный свободный радикал. Он чрезвычайно реакционноспособен, легко образует другие оксиды азота, что сокращает биодоступность NO во времени и пространстве:
• NO имеет очень короткий период полураспада;
• NO может перемещаться только на ограниченные расстояния до окисления [7].
Продукты реакции нитритов и нитратов NO, производные S- или N-нитрозопротеинов и железо-нитрозильные комплексы — это не просто инертные продукты метаболизма.Их можно восстановить, чтобы высвободить свободный NO несколькими путями [7].
Таким образом, биодоступность NO зависит не только от радикала NO, но и от NO-содержащих соединений. Эти продукты NO служат пулами хранения биоактивного NO и, по-видимому, участвуют в процессах, связанных с NO, поскольку они, в отличие от NO, могут перемещаться через кровообращение в удаленные ткани [7].
Внутриклеточная сигналосома
Цитозольные оксиданты ограничивают биоактивность NO даже внутриклеточно, препятствуя его диффузии к молекулярным мишеням, удаленным от NOS более чем на 100 мкм [8].Эта ограниченная диффузия в сочетании со специфической субклеточной локализацией NOS придает специфичность и эффективность передаче сигналов NO, ограничивая его действие белками-мишенями, совместно локализованными с NOS в сложных мультипротеиновых сигнализомах.
NO Сигнализация
NO сигналы через три механизма:
(1) Активация гуанилатциклазы. Связываясь со своей гемовой группой, NO активирует растворимую гуанилатциклазу, которая продуцирует 3′-5′-циклический гуанозинмонофосфат (цГМФ) из гуанозин-5′-трифосфата (GTP), количество которого пропорционально количеству NO.цГМФ активирует протеинкиназу G (цГК) в качестве нижестоящего эффектора [9]:
(NO: гуанилатциклаза)
GTP → цГМФ → активированный эффектор цГК
(2) S-нитрозилирование. NO ковалентно и обратимо образует S-нитрозотиоловые группы с реакционноспособными цистеиновыми тиолами в широком диапазоне белков-мишеней [10].
NO ковалентно и обратимо образует S-нитрозотиоловые группы с реакционноспособными цистеиновыми тиолами в широком диапазоне белков-мишеней [10].
(3) Митоген-активируемые протеинкиназы (MAPK). Внутриклеточное образование пероксинитрита приводит к активации MAPK.
Большинство эффектов NO опосредовано S-нитрозилированием независимым от цГМФ образом [10].
Функции оксида азота
NO — мощная сигнальная молекула, ключевой детерминант эндотелиальной функции, метаболизма и здоровья сосудов, также влияющий на нервную и иммунную системы. Защитные эффекты проявляются при концентрациях NO от пико- до наномолярных. При более высоких концентрациях NO и его производные становятся цитотоксичными.
Митохондрии
Воздействие NO на митохондрии имеет большое значение для физиологии клеток и их гибели. Митохондрии являются первичными клеточными мишенями для NO.
mtNOS связан с митохондриями в нескольких участках митохондриальной цепи переноса электронов (ETC), в первую очередь в Комплексе I (НАДН-дегидрогеназа) [11] и Комплексе IV (цитохром с оксидаза, CcOX) [12].
mtNOS сильно активируется при активации ETC и Комплекса I, который служит источником электронов для производства NO. Напротив, инактивация Комплекса I прекращает нормальную активность mtNOS [11].
Метаболизм
NO, производный от mtNOS, эффективно контролирует митохондриальное дыхание, потребление O 2 , трансмембранный протонный градиент и потенциал, а также синтез аденозинтрифосфата (АТФ) [12].
Резко, NO снижает митохондриальный окислительный метаболизм [13]:
(1) Физиологические уровни NO быстро и обратимо связываются и ингибируют несколько комплексов ETC, наиболее чувствительной мишенью является Комплекс IV [12]. Результатом является временное снижение митохондриального дыхания, вызванное NO, с частичной деполяризацией митохондриальной мембраны [14]. Поскольку mtNOS получает свои электроны из комплекса I, существует реципрокная регуляция между mtNOS и митохондриальной ETC [11].
(2) Очень высокие уровни NO, генерируемые при воспалительной индукции iNOS, конкурируют с O 2 , вызывая NO-зависимую гипоксию («нитроксию») [15]. Нитроксия способствует образованию высоких уровней активных форм кислорода (АФК) / активных форм азота (РНС) [12]. NO / RNS может затем остановить митохондриальное дыхание во многих участках, необратимо ингибируя комплексы ETC за счет производства АТФ, с цитотоксическим эффектом [16].
Нитроксия способствует образованию высоких уровней активных форм кислорода (АФК) / активных форм азота (РНС) [12]. NO / RNS может затем остановить митохондриальное дыхание во многих участках, необратимо ингибируя комплексы ETC за счет производства АТФ, с цитотоксическим эффектом [16].
Хронически NO увеличивает клеточный окислительный метаболизм [13]:
(1) Передача сигналов NO-гуанилатциклазы увеличивает митохондриальный биогенез в различных типах клеток.NO увеличивает экспрессию сиртуина-1 [17], а с помощью 5′-AMP-активированной протеинкиназы (AMPK) -α1 синергетически активирует коактиватор рецептора-γ, активируемый пролифератором пероксисом (PGC) -1α, главный регулятор митохондриогенеза [13 ].
Образование АТФ посредством окислительного фосфорилирования митохондрий увеличивается в связи со стимулированным NO / cGMP увеличением содержания митохондрий [13] в различных тканях.
(2) NO модулирует содержание митохондрий и энергетический баланс всего тела в ответ на физиологические стимулы, такие как упражнения или воздействие холода, действуя как объединяющий молекулярный переключатель, запускающий весь митохондриогенный процесс [13].
Реактивные формы кислорода
Митохондрии являются основным внутриклеточным источником АФК. Нормальное окислительное фосфорилирование постоянно приводит к низким уровням ROS / RNS, поскольку несколько окислительно-восстановительных центров ETC пропускают электроны, чтобы частично восстановить O 2 до супероксид-аниона [18]. От 0,4 до 4% потребляемого O 2 превращается в супероксид.
Митохондриальный мембранный потенциал является основным параметром, регулирующим продукцию АФК [18]. Поскольку физиологический NO снижает этот потенциал, NO снижает продукцию ROS [12].Однако нарушение функции mtNOS, избыток или дефицит NO и нарушение регуляции сигнальных путей NO увеличивают продукцию ROS / RNS при одновременном снижении уровней антиоксидантов [19].
Эффективные митохондрии
Любое увеличение потребности в энергии сопровождается скоординированным повышением окислительного метаболизма, который увеличивает потенциал митохондриальной мембраны и, следовательно, образование АФК.
Парадоксально, что передача сигналов NO / цГМФ снижает окислительный метаболизм в любом отдельном митохондрии, увеличивая при этом клеточную митохондриальную функцию.Однако в процессе NO / cGMP делает митохондрии «эффективными» с организованной ETC, которая генерирует достаточное количество АТФ, одновременно снижая потребление кислорода, митохондриальный потенциал и продукцию ROS.
Результат — большая выгода. Тренировки с упражнениями увеличивают потребность в энергии, но также стимулируют NO, поскольку пары NO требуют выработки энергии клетками и всем телом [20]. Вместо ожидаемого увеличения АФК окислительный стресс снижается за счет «эффективных» митохондрий, предупреждая вызванное АФК клеточное старение, защищая целостность митохондрий, теломер или эндоплазматического ретикулума.
Митохондриальный кальций
Митохондриальный энергетический гомеостаз реагирует на изменения митохондриального Ca 2+ . Ключевые митохондриальные ферменты, как в цикле трикарбоновых кислот, активируются более высоким внутримитохондриальным Ca 2+ , увеличивая предоставление восстанавливающих эквивалентов ETC и увеличивая митохондриальный потенциал и генерацию АТФ [16].
Цитоплазматические сигналы Ca 2+ соответствуют более высокой потребности в энергии от секреторной, сократительной или другой работы.Таким образом, первичная функция захвата митохондриальным Ca 2+ , по-видимому, заключается в зависимой от Ca 2+ координации выработки энергии митохондриями с потреблением энергии клетками.
Захват Ca 2+ митохондриями частично обусловлен потенциалом митохондриальной мембраны. Чрезмерное накопление митохондриального Ca 2+ связано с заболеванием.
Снижение митохондриального потенциала ограничивает митохондриальный Ca 2+ . Такие условия не только снижают метаболическую активность митохондрий, но также защищают от вредной перегрузки Ca 2+ [16].
NO / cGMP снижает митохондриальный потенциал, тем самым уменьшая митохондриальный Ca 2+ [14]. Фактически, NO обеспечивает отрицательную обратную связь по поглощению митохондриальным Ca 2+ : тогда как более высокий митохондриальный Ca 2+ активирует mtNOS, увеличение NO ингибирует дыхание, снижает митохондриальный потенциал и дополнительно ограничивает поглощение Ca 2+ [14].
Cell Protection
Предварительное ишемическое кондиционирование обеспечивает мощную кардиопротекцию против реперфузионного ишемического повреждения миокарда.Физиологические уровни NO участвуют в цитопротективных эффектах раннего и позднего прекондиционирования. Не только eNOS-, но и NO, происходящий из экзогенных доноров нитратов, может влиять на цитопротекцию эндотелия и миокарда [21].
NO / cGMP может защищать от перехода митохондриальной проницаемости и апоптоза, вызванного множеством поражений. Благодаря взаимодействию с компонентами ETC, такими как CcOX, NO влияет на генерацию низкоуровневых АФК и другие механизмы защиты митохондрий, тем самым запуская передачу сигналов выживания адаптивных клеток [15,21].
Смерть клеток
Высокие концентрации NO цитотоксичны:
(1) Избыточные NO и RNS, такие как пероксинитрит, могут вызывать нитрование тирозина митохондриальных компонентов и играть ключевую роль в апоптозе [19].
(2) Передача сигналов ROS / RNS, происходящих из NO, изменение проницаемости митохондрий или повреждение ДНК могут активировать митохондриальные пути к апоптозу или некрозу.
(3) Необратимое подавление митохондриального дыхания на нескольких участках за счет чрезмерного количества NO может подавлять апоптоз и вызывать некроз за счет истощения энергии.Последующая глубокая митохондриальная недостаточность способствует коварной, прогрессирующей и фатальной недостаточности органов-мишеней при сепсисе, связанной с признаками ускоренного и рефрактерного анаэробного метаболизма [22].
Скелетные мышцы
Передача сигналов NO в скелетных мышцах участвует в контроле нескольких функций, включая
• метаболизм мышц,
• связь возбуждения-сокращения и сократимость,
• иммунная функция,
• рост клеток и
• нейротрансмиссия.
Метаболически активная скелетная мышца — самая многочисленная ткань, составляющая примерно 40% от нормальной массы тела, что делает ее критическим фактором в метаболизме всего тела [23]. Таким образом, БДУ скелетных мышц играет ключевую роль в гомеостазе глюкозы и липидов в организме.
Глюкоза
Более высокая экспрессия и активность NOS в скелетных мышцах улучшают действие инсулина посредством передачи сигналов NO / cGMP / cGK [23].
Повышается чувствительность к инсулину
• косвенно по мере увеличения NO
— микрососудистая перфузия скелетных мышц, доставка питательных веществ и инсулина к тканям-мишеням [23],
— антиоксидантное и противовоспалительное действие,
— синтез инсулина- сенсибилизирующий адипонектин;
• непосредственно, поскольку NO / cGK блокирует ингибирующее взаимодействие малой GTPase Rho / Rho киназы с субстратом рецептора инсулина (IRS) -1 [24].
Напротив, чрезмерная провоспалительная индукция iNOS / NO снижает чувствительность миоцитов к инсулину через прооксидантные пути.
Поглощение глюкозы и внутриклеточные запасы энергии миоцитов также стимулируются передачей сигналов NO / cGMP / cGK и производными от NOS ROS посредством механизмов, которые отличаются от захвата глюкозы, зависимого от сокращения, инсулина, AMPK или p38 MAPK, но дополняют его.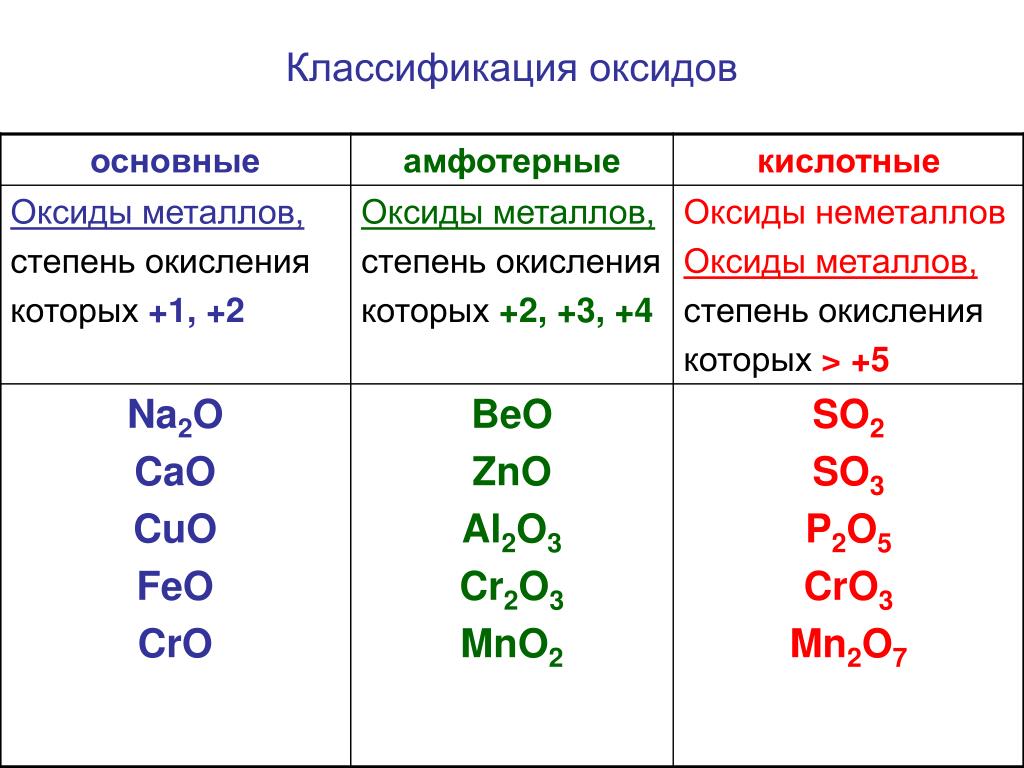 пути [23,25].
пути [23,25].
NO стимулирует окисление глюкозы в скелетных и сердечных мышцах, печени и жировой ткани посредством цГМФ-зависимых механизмов.
Жирные кислоты
Повышенная физиологическая передача сигналов NO / цГМФ усиливает катаболизм жирных кислот [13]. Он ускоряет липолиз адипоцитов, одновременно стимулируя окисление жирных кислот в скелетных и сердечных мышцах за счет активации AMPK и экспрессии PGC-1α [26].
Потребление кислорода
NO снижает потребность миоцитов в энергии [23] на
• снижает сократимость. NO снижает чувствительность миофиламента к Ca 2+ за счет нитрозирования целевых белков, подавления субмаксимальной и изометрической силы скелетных мышц, уменьшения скорости сокращения и ускорения релаксации;
• подавление метаболизма.НЕТ снижает гликолиз. Он снижает митохондриальное дыхание, расщепление креатинфосфата и перенос высокоэнергетических фосфатов.
Сократительная дисфункция
Отказ сердечной помпы — это опасная для жизни реакция на тяжелое воспаление при миокардите, отторжении трансплантата сердца, сепсисе или травме. Избыточная индукция iNOS / NO / cGMP / cGK в миокарде имеет глубокий отрицательный инотропный эффект [27], поскольку
Избыточная индукция iNOS / NO / cGMP / cGK в миокарде имеет глубокий отрицательный инотропный эффект [27], поскольку
• ингибирует аэробные ферменты, включая CcOX,
• снижает уровень цАМФ, тем самым снижая приток Ca 2+ через L-тип Ca 2+ каналов и
• фосфорилирует тропонин I, снижая чувствительность миофиламентов к Ca 2+ .
Потеря миоцитов
Заболевания человека, от сердечной недостаточности до рака, вызывают катаболизм скелетных мышц за счет провоспалительной индукции чрезмерного iNOS / NO, что ухудшает дифференцировку миоцитов и связано с апоптозом миоцитов. Также существует значительная связь между распространением iNOS, апоптозом кардиомиоцитов и кардиомиопатией.
Сосудистая сеть
Сосудистый NO продуцируется эндотелиальными клетками.
Расширение сосудов
NO является наиболее мощным эндогенным сосудорасширяющим средством, преимущественно проводящим сосуды, а не микроциркуляторное русло.
Передача сигналов NO / cGMP / cGK выполняет вазодилатацию посредством
• аутокринного увеличения NO и BH 4 в эндотелии [9],
• паракринной релаксации нижележащих гладкомышечных клеток сосудов (VSMC) на
( 1) снижение цитоплазматических концентраций Ca 2+ и
(2) снижение чувствительности миофибриллярного Ca 2+ [9,24].
NO опосредует вазодилатацию, опосредованную потоком, и противодействует вазоконстрикторным эффектам. Он противодействует жесткости сосудов и снижает кровяное давление.NO является критическим модулятором кровотока, сосудистого тонуса и артериального давления [28].
Восстановление сосудов и ангиогенез
Эндотелий постоянно подвергается механическим, химическим или ишемическим воздействиям. В месте повреждения эндотелиальные стволовые клетки и клетки-предшественники костного мозга (EPC) участвуют в процессах восстановления, нормализуя функцию эндотелия. NO защищает функциональную способность EPC участвовать в восстановлении сосудов и ангиогенезе [29].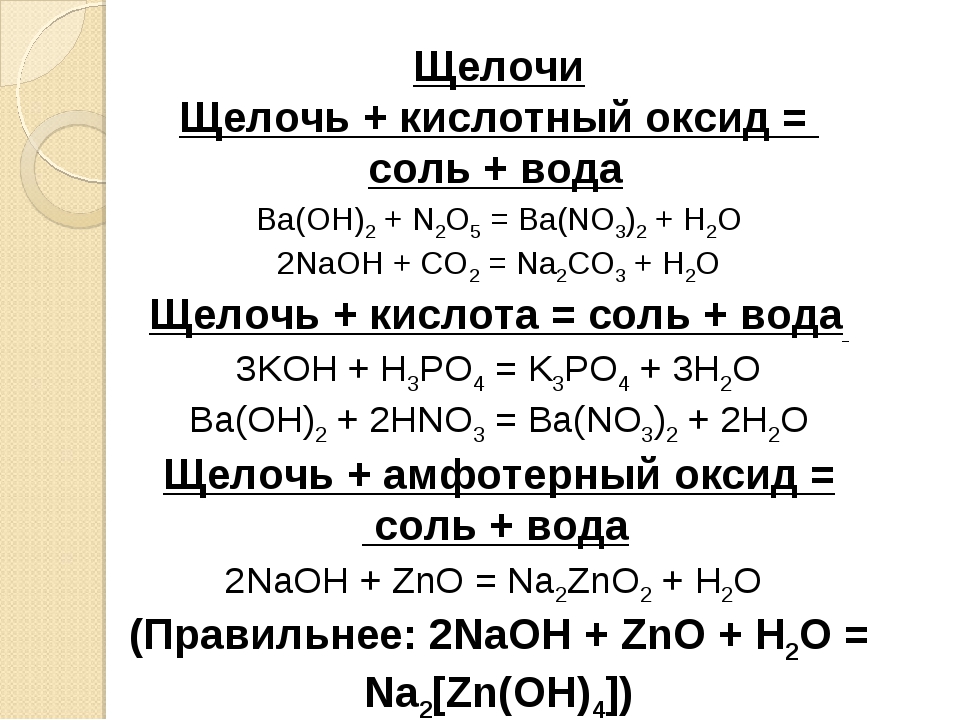
Ингибирование активации тромбоцитов
NO подавляет активацию, агрегацию и адгезию тромбоцитов к эндотелию посредством цГМФ-зависимых [9] и независимых механизмов.
Окислительный стресс
Физиологический уровень NO снижает окислительный стресс. NO подавляет производство супероксида, инактивируя NADH / NADPH оксидазу. NO увеличивает эндогенный антиоксидантный потенциал, индуцируя эндотелиальную супероксиддисмутазу (SOD), внеклеточную SOD в VSMC, миокардиальную SOD, митохондриальный синтез S-нитрозоглутатиона [11] и активность тиоредоксина [30], тем самым препятствуя окислительной инактивации NO. NO ингибирует окисление липопротеидов низкой плотности (ЛПНП).
Напротив, индукция высоких уровней NO / iNOS является очень прооксидантной.NO, реагируя с супероксидом, образует окислитель анион пероксинитрит (ONOO — ):
NO + O 2 — · → ONOO —
Пероксинитрит вызывает перекисное окисление липидов и нитрозирование аминокислотных остатков в клетках мембраны, передача сигналов и выживаемость клеток [30]. Пероксинитрит также оказывает провоспалительное действие.
Пероксинитрит также оказывает провоспалительное действие.
Противовоспалительное и антиатерогенное действие
Физиологические уровни NO обладают противовоспалительным действием. Предотвращая активацию провоспалительных цитокинов, NO защищает кровеносные сосуды от эндогенного повреждения, препятствуя ранним и более поздним стадиям атерогенеза сосудов кондуита [28].NO
• задерживает старение эндотелиальных клеток и провоспалительную передачу сигналов, связанных со старением,
• снижает апоптоз эндотелиальных клеток,
• ингибирует транскрипцию ядерного фактора-B,
• ингибирует окислительно-восстановительную адгезию клеток сосудов, индуцированную цитокинами -1, молекула внутриклеточной адгезии-1 и хемоаттрактантный белок-1 моноцитов, предотвращающий адгезию лейкоцитов к эндотелию,
• снижает проницаемость эндотелия, уменьшая приток окисленных липопротеидов в стенку сосудов,
• препятствует миграции лейкоцитов в сосуды стенка за счет снижения экспрессии факторов, включая молекулы поверхностной адгезии CD11 / CD18 и P-селектин,
• сильно подавляет активацию воспалительных клеток и активность моноцитов,
• блокирует миграцию VSMC,
• препятствует пролиферации VSMC,
• подавляет синтез и секрецию протеиназ внеклеточного матрикса, которые деградируют белки внеклеточного матрикса,
• увеличивает экспрессию тканевого ингибитора матриксных металлопротеиназ,
• ингибирует трансактивацию гена, регулируемую трансформирующим фактором роста β / Smad [31,32].
Причины пониженного содержания NO
Пониженная биоактивность NO отражает дисбаланс между его синтезом и распадом. Также может быть нарушена реакция VSMC на NO. При этом задействованные патофизиологические механизмы многофакторны и различаются по этиологии.
Снижение экспрессии eNOS
При запущенной ишемической болезни сердца (ИБС) экспрессия eNOS может быть снижена из-за снижения транскрипции и / или вызванной цитокинами или липидами нестабильности мРНК eNOS [33], нарушающей высвобождение NO.
Снижение активности eNOS
Полиморфизм гена
Полиморфизм гена eNOS, такой как Glu298 → Asp, может снизить активность фермента и базальную продукцию NO. Эта замена ответственна за значительную частоту эндотелиальной дисфункции, гипертонии, вазоспастической стенокардии, ИБС и сердечно-сосудистой смертности [34].
Аргиназа
L -Дефицит аргинина встречается редко, но может возникать при повышенном метаболизме L -аргинина. Аргиназы гидролизуют L -аргинин, тем самым снижая активность eNOS, конкурируя за L -аргинин.Аргиназа играет важную роль в патогенезе снижения NO и эндотелиальной дисфункции с провоспалительными состояниями, старением и такими заболеваниями, как сахарный диабет (СД) [35].
Аргиназы гидролизуют L -аргинин, тем самым снижая активность eNOS, конкурируя за L -аргинин.Аргиназа играет важную роль в патогенезе снижения NO и эндотелиальной дисфункции с провоспалительными состояниями, старением и такими заболеваниями, как сахарный диабет (СД) [35].
Асимметричный диметиларгинин
Эндогенно продуцируемые конкурентные ингибиторы L -аргинина, такие как асимметричный диметиларгинин (ADMA) и N-монометиларгинин, могут создавать относительный дефицит природного субстрата для eNOS, тем самым сокращая выработку NO. Эти эндогенные ингибиторы активности NOS могут быть ответственны за эндотелиальную дисфункцию у людей с факторами риска ИБС и / или ИБС [9,33].
Пониженная доступность кофактора
BH 4 очень подвержен окислению. Дефицит BH 4 разъединяет NOS, тем самым снижая выход NO, увеличивая продукцию ROS и вызывая эндотелиальную дисфункцию [9].
Снижение периода полураспада NO
После высвобождения период полураспада NO уменьшается из-за окислительного стресса, вызывая эндотелиальную дисфункцию. Супероксид поглощает NO с образованием пероксинитрита и других прооксидантов [33]. Миелопероксидаза каталитически потребляет NO.
Супероксид поглощает NO с образованием пероксинитрита и других прооксидантов [33]. Миелопероксидаза каталитически потребляет NO.
Смешанные эффекты
Окислительный стресс также подавляет выработку NO, нарушая экспрессию и активность eNOS. Окисленный ЛПНП напрямую инактивирует NO и снижает высвобождение NO [31].
Воспаление
Воспаление снижает биодоступность NO [32].
Фактор некроза опухоли — α . Провоспалительный фактор некроза опухоли (TNF) -α подавляет экспрессию eNOS. Он подавляет производство NO, опосредованное напряжением сдвига. TNF-α и интерлейкин-1β увеличивают экспрессию iNOS с перекрестной активацией протеинкиназы A, подавляя экспрессию cGK.TNF-α увеличивает окислительный стресс за счет увеличения экспрессии NADH / NADPH, подрывая биодоступность NO [36].
Ангиотензин II. Провоспалительная активация ангиотензина II сильно увеличивает прооксидантный стресс за счет стимуляции сосудистых / лейкоцитарных НАДН / НАДФН. Он также снижает действие NO / cGMP / cGK, стимулируя фосфодиэстеразу (PDE), которая увеличивает гидролиз cGMP, снижая уровни и действие cGMP / cGK [9].
Он также снижает действие NO / cGMP / cGK, стимулируя фосфодиэстеразу (PDE), которая увеличивает гидролиз cGMP, снижая уровни и действие cGMP / cGK [9].
Эндотелин-1. Высокий уровень воспалительного эндотелина (ЕТ) -1 снижает продукцию NO за счет действия рецептора ЕТA.ЕТ-1 также индуцирует эндотелиальный НАДН / НАДФН, увеличивая окислительный стресс за счет биодоступности NO.
Rho / Rho Kinase. Воспалительные цитокины и вазоконстрикторы передают сигнал через киназу RhoA / Rho. Киназа RhoA / Rho подавляет как активность, так и экспрессию eNOS, вызывая быстрое и длительное снижение продукции NO [24].
Глюкокортикоиды. Стресс-активация кортизола значительно снижает экспрессию eNOS дозозависимым образом и снижает вызванное агонистами высвобождение NO.Глюкокортикоиды также нарушают синтез BH 4 .
Инсулинорезистентность
В нормальных физиологических условиях инсулин стимулирует выработку NO в эндотелиальных клетках.
Резистентность к инсулину вызывает нарушения внутриклеточной передачи сигнала, которые снижают биодоступность NO:
нарушение пути фосфатидилинозитол-3-киназа-Akt
↓
снижение активации eNOS
↓
снижение биодоступности NO.
Например, модель на мышах для нокаута рецептора инсулина или IRS-1, в дополнение к ожидаемым метаболическим дефектам, вызывает нарушение эндотелий-зависимой релаксации сосудов и гипертензии.У IRS-1/2-нулевых мышей развивается атеросклероз. Мутация IRS-1 (Arg792) создает аномальную вазореактивность, более низкую экспрессию eNOS и более высокую частоту ИБС [37].
По мере того, как инсулинорезистентность ухудшается и прогрессирует до метаболического синдрома, компоненты синдрома вторично ухудшают биодоступность NO [38], как показано в таблице 1.
Таблица 1
Факторы, снижающие биодоступность NO
Напряжение сдвига
Физиологически Наиболее важными детерминантами образования NO и местной регуляции кровотока являются напряжение сдвига жидкости и пульсирующее растяжение. Напряжение ламинарного сдвига, тангенциальная механическая сила увлечения, создаваемая потоком жидкости по эндотелиальной поверхности, является одним из наиболее важных физиологических стимулов для высвобождения NO из сосудистого эндотелия [39]. Напряжение ламинарного сдвига вызывает множественные синергетические механизмы повышения NO
Напряжение ламинарного сдвига, тангенциальная механическая сила увлечения, создаваемая потоком жидкости по эндотелиальной поверхности, является одним из наиболее важных физиологических стимулов для высвобождения NO из сосудистого эндотелия [39]. Напряжение ламинарного сдвига вызывает множественные синергетические механизмы повышения NO
• быстро, активируя eNOS и высвобождение NO для расширения кровеносных сосудов, снижая напряжение сдвига до нормального уровня, и
• хронически, увеличивая экспрессию eNOS.
Функция эндотелия сохраняется при устойчивом ламинарном потоке приблизительно при 12 дин / см 2 на эндотелии или колебательном потоке, который остается однонаправленным.
Производство NO и функция эндотелиальных клеток нарушаются
• застой,
• низкий чистый поток,
• низкое напряжение сдвига примерно при 0,4 дин / см 2 ,
• турбулентность,
• локальные градиенты сдвига ,
• быстро меняющийся поток и
• колебательный поток с изменением направления потока,
, которые способствуют воспалительной активации, окислительному стрессу и атерогенезу [40]. Кроме того, снижение эластичности артериальной стенки и более высокое пульсовое давление отрицательно влияют на влияние сигнала потока на стенку сосуда.
Кроме того, снижение эластичности артериальной стенки и более высокое пульсовое давление отрицательно влияют на влияние сигнала потока на стенку сосуда.
Хотя вся сосудистая сеть подвержена идентичным факторам риска, ранний атеросклероз развивается в областях бифуркаций, ветвей и внутренних искривлений, где характеристики кровотока являются сложными и связаны с нарушенными и / или низкими условиями напряжения сдвига. Присутствие системных факторов риска дополнительно изменяет региональный эндотелиальный фенотип и очаговую предрасположенность к атеросклерозу [40].
Бездействие. Отсутствие физической активности связано с низким чистым кровотоком, низким напряжением сдвига и застоем.Бездействие порождает дефицит NO, резистентность к инсулину и ее воспалительные и катаболические пути. Продолжительный отдых снижает экспрессию eNOS и нарушает эндотелий-зависимую вазодилатацию [41]. Даже кратковременный сидячий образ жизни нарушает функцию эндотелия в отсутствие других сердечно-сосудистых факторов риска.
Старение клеток. Стареющие клетки обладают провоспалительной, прооксидантной и инсулинорезистентностью. С возрастом старение клеток становится преобладающей причиной нарушения биодоступности NO.Связанная со старением кардиометаболическая дисфункция в значительной степени усугубляется бездействием.
Факторы сердечно-сосудистого риска
Все традиционные, а также новые маркеры сердечно-сосудистого риска, включая
• отсутствие физической активности,
• увеличение веса и ожирение,
• состояние после приема пищи с высоким содержанием жиров и углеводов,
• оксидативный стресс,
• инфекция / воспаление, повышенный уровень С-реактивного белка и провоспалительных цитокинов,
• психический стресс,
• инсулинорезистентность, гипергликемия, метаболический синдром, DM,
• дислипидемия,
• гипергликемия ,
• гипертония,
• семейный анамнез преждевременного атеросклеротического заболевания,
• установленная ИБС, периферическое / цереброваскулярное заболевание и сердечная недостаточность,
• возраст и
• потребление сигарет,
активируют различные пути, нарушающие НЕТ биодоступности [42].
Проявления восстановленного NO
Пониженная физиологическая сигнализация NO и повышенное образование супероксида дисфункциональными NOS являются патогенами и вносят вклад в клиническое течение кардиометаболического заболевания [43].
Нарушение функции сосудов
Нарушение биодоступности NO является ключевым признаком сосудистой дисфункции [42].
Эндотелиальная дисфункция
Снижение биодоступности NO ослабляет NO-зависимую вазодилатацию, вызванную кровотоком в проводящих и резистентных сосудах, определяя эндотелиальную дисфункцию [42].
Нарушение биодоступности NO и эндотелиальная дисфункция являются необходимой первой стадией перехода от нормальной функции сосудов к сужению сосудов, воспалению, атерогенезу, явному атеросклерозу и тромбозу. Аномальный плечевой или коронарный вазодилататорный ответ эндотелия на усиление кровотока является основным независимым предиктором прогрессирования атероматозного заболевания и частоты сердечно-сосудистых событий у лиц с риском ИБС [42].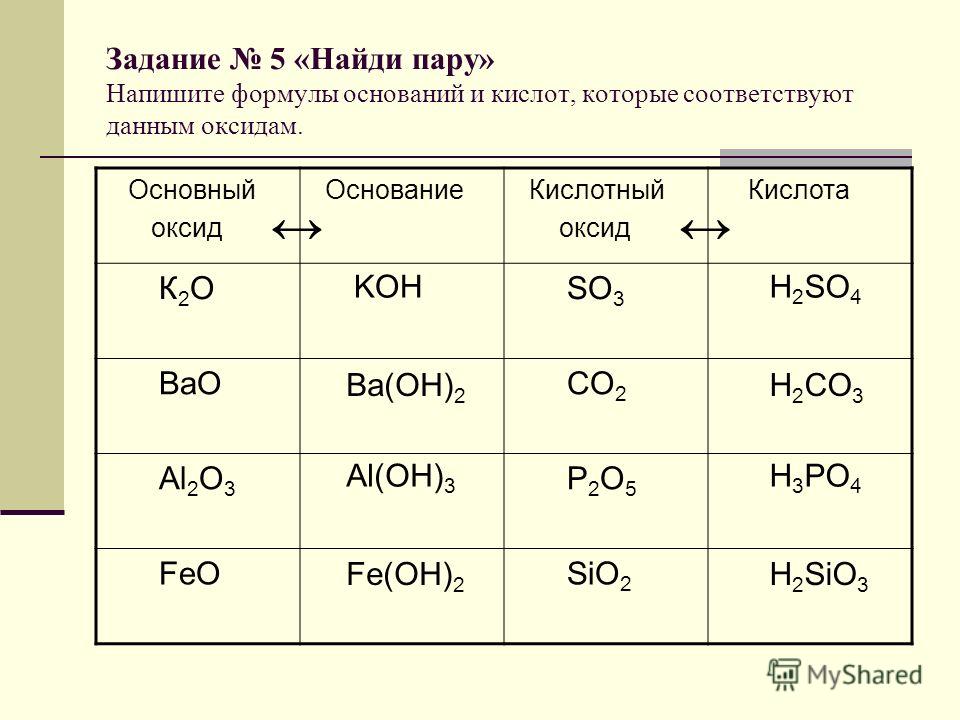
Сужение сосудов
Снижение биодоступности NO приводит к потере других эндогенных вазодилататоров, включая гиперполяризующий фактор эндотелия и простациклин, с увеличением количества вазоконстрикторов [42].
Индуцированная потоком вазодилатация ослабевает с возрастом из-за нарушения биодоступности NO и усиления вазоконстрикции, одного из самых ранних маркеров сосудистой дисфункции. У пациентов с гиперхолестеринемией и коронарным атеросклерозом коронарные и системные артерии могут сужаться во время упражнений, что отражает как потерю сосудорасширяющей способности, так и повышенную чувствительность к вазоконстрикторам, таким как норадреналин и ЕТ-1 [39].
Мыши с дефицитом гена eNOS страдают гипертонией [44].Снижение передачи сигналов NO способствует клиническому течению системной и легочной гипертензии. Разработка ЕТ-1, сосудосуживающих простаноидов и ангиотензина II вызывает сокращение VSMC, задержку соли и воды и митогенные эффекты, способствуя развитию гипертензии [42].
Воспаление
Нарушение Биодоступность NO способствует воспалению. Воспаление сосудов увеличивается у мышей eNOS (- / -) [45]. Повышающая регуляция и активация ядерного фактора-B и протеина-активатора-1 инициируют высвобождение воспалительных цитокинов, таких как TNF-α и интерлейкин-1.По мере того как Т-лимфоциты мигрируют в интиму сосудов, они продуцируют дополнительные цито- и хемотаксические факторы, а также молекулы адгезии, чтобы рекрутировать VSMC и моноциты, инициируя атерогенез [42].
Атерогенез
Биодоступность NO обратно пропорциональна прогрессированию атероматозного сосудистого заболевания [43].
Дисфункциональный эндотелий порождает эндотелиальный фенотип, который способствует ремоделированию сосудов. Хронически недостаточная активность NO способствует утолщению медиального слоя, гиперплазии миоинтимы и увеличению жесткости сосудов кондуита [42].
В отсутствие NO продолжающаяся выработка провоспалительных факторов способствует дальнейшей адгезии Т-клеток и моноцитов, образованию пенистых клеток, перевариванию внеклеточного матрикса, миграции и пролиферации VSMC, инициируя и ускоряя образование атеросклеротических бляшек [33].
Атеротромбоз
Недостаточная активность NO в сосудах приводит к потере антитромботических факторов. Снижается экспрессия тромбомодулина на клеточной поверхности, что ослабляет антикоагуляцию.Сниженный уровень NO и простациклин способствует усиленной активации и агрегации тромбоцитов [42].
Дефицит NO увеличивает протромботические факторы. Увеличивается продукция фибринолитического антагониста ингибитора активатора плазминогена-1 [42]. Дисфункциональные эндотелиальные клетки производят мощный тканевой фактор коагулянта. Эти события повышают риск атеротромбоза, особенно на более поздних стадиях заболевания, что приводит к разрыву бляшек, образованию тромбов и острым ишемическим синдромам [33,43].
Частота сердечно-сосудистых событий среди пациентов с тяжелой коронарной эндотелиальной дисфункцией составляет 14% в течение 2 лет наблюдения и примерно 20% в течение 8 лет, по сравнению с <5% для лиц с нормальной функцией эндотелия [13].
Аномальный метаболизм в мышцах
Аномальная функция NOS / NO снижает содержание митохондрий в мышцах, окислительное фосфорилирование и аэробную нагрузочную способность [39].
Мутантные eNOS-null (- / -) мыши имеют сниженный митохондриогенез и скорость метаболизма, но ускоренный набор веса по сравнению с дикими типами.Их мозг, почки, печень, сердце и икроножная мышца демонстрируют заметно уменьшенное содержание и размер митохондрий при значительно более низком потреблении кислорода и содержании АТФ. Заметно более низкое бета-окисление в субарколеммальных митохондриях таких мышей связано со значительным увеличением содержания эктопических внутримиоцеллюлярных липидов по сравнению с контролем, что является риском развития инсулинорезистентности [2].
Дисфункциональная передача сигналов NO способствует нарушению работоспособности при инсулинорезистентности: в то время как дисфункциональная NOS снижает опосредованное NO рекрутирование капилляров, питательный скелетный кровоток и поглощение глюкозы во время упражнений, резистентность к инсулину снижает перфузию мышц, поглощение глюкозы и восстановление гликогена во время восстановления, снижая функциональную активность. физическая нагрузка, анаэробный порог и пиковое потребление кислорода.Он также снижает термогенез, вызванный приемом пищи, вызывая тенденцию к увеличению веса по сравнению с людьми с нормальным метаболизмом [23].
физическая нагрузка, анаэробный порог и пиковое потребление кислорода.Он также снижает термогенез, вызванный приемом пищи, вызывая тенденцию к увеличению веса по сравнению с людьми с нормальным метаболизмом [23].
Инсулинорезистентность
Дисфункциональная БДУ связывает сосудистые и метаболические пути, сердечно-сосудистые и метаболические заболевания [44]. Дефицитный NO участвует в патогенезе инсулинорезистентности. При инсулинорезистентных состояниях снижена экспрессия NOS эндотелия и скелетных мышц с пониженной активностью [23].
Потеря экспрессии NOS в эндотелиальных и скелетных мышцах вызывает инсулинорезистентность, гиперлипидемию и нарушение инсулино-стимулированного захвата глюкозы [44].Мыши eNOS (- / -) инсулинорезистентны [45] с повышенным уровнем триглицеридов и свободных жирных кислот. Снижение доступности NO, вызванное введением ADMA мышам дикого типа, снижает чувствительность к инсулину в течение нескольких часов.
Пониженная биодоступность NO и эндотелиальная дисфункция развиваются на ранней стадии, до непереносимости углеводов, и могут представлять собой раннюю связь не только с инсулинорезистентностью и гипергликемией, но и с кардиометаболическими патофизиологическими последствиями метаболического синдрома.
NO-направленная терапия
Физиологические уровни NO играют ключевую роль в метаболическом и сердечно-сосудистом гомеостазе. Хорошо сохраненная передача сигналов NO предсказывает хорошую митохондриальную функцию, переносимость физической нагрузки, эндотелиальную функцию, чувствительность к инсулину и отсутствие кардиометаболических заболеваний.
В условиях дефицита системного NO экзогенная доставка NO является привлекательным вариантом для улучшения кардиометаболического здоровья. Ряд изменений образа жизни и медицинских вмешательств, которые увеличивают биодоступность NO, также улучшают чувствительность к инсулину и кардиометаболический риск и являются высокоэффективными методами лечения сердечно-сосудистых заболеваний [46].
NO имеет общую черту с историей Златовласки; хотя слишком мало — это плохо, слишком много — разрушительно. НИКАКАЯ биодоступность не должна быть правильной.
Диета
Системные уровни NO генерируются не только за счет эндогенных NOS. Диета — это безопасный и недорогой способ увеличения биодоступности NO.
Диета — это безопасный и недорогой способ увеличения биодоступности NO.
Ограничение калорийности вызывает экспрессию eNOS и образование цГМФ. Это сопровождается усилением экспрессии Sirt1 и митохондриогенеза [17,47].
Полифенолы черного, зеленого, улун или белого чая, включая галлат эпигаллокатехина, способствуют каталитической активности eNOS. Употребление чая может обратить вспять эндотелиальную дисфункцию и благотворно повлиять на контроль веса и чувствительность к инсулину.
Полифенолы красного вина, включая ресвератрол, кверцетин и галловую кислоту, усиливают экспрессию eNOS и продукцию NO, что, в свою очередь, значительно усиливает функцию циркулирующих EPC, оказывая положительный кардиометаболический эффект.
Употребление какао, богатого флавонолами, увеличивает циркулирующий NO с васкулопротекторным, инсулино-сенсибилизирующим действием.В целом, флавоноиды, полученные из фруктов и овощей, повышают биологическую активность NO.
Потребление зеленых листовых овощей повышает уровень васкулопротекторных нитрозосоединений. Овощи, основной источник нитратов в рационе, повышают уровень биоактивных оксидов азота в тканях и плазме крови, повышая кровяное давление и обращая вспять предиабетический фенотип.
Овощи, основной источник нитратов в рационе, повышают уровень биоактивных оксидов азота в тканях и плазме крови, повышая кровяное давление и обращая вспять предиабетический фенотип.
Exercise
Кардиометаболические потери от бездействия обратимы даже у пожилых людей [1]. Поскольку скелетные мышцы представляют собой наиболее многочисленную ткань, за исключением чрезмерного увеличения жировых отложений, адаптация NO в скелетных, сердечных мышцах и сосудистой системе является причиной многих значительных кардиометаболических преимуществ тренировок.
Тренировки с упражнениями усиливают экспрессию и активацию эндотелиальной и скелетной БДУ, полностью согласовывая более высокий запас энергии с повышенным спросом. Вызванное упражнениями повторяющееся увеличение ламинарного сдвигового кровотока, а также диффузии ацетилхолина из нервно-мышечных соединений, усиливает передачу сигналов NO, эндотелиальную функцию, плотность капилляров и питательный кровоток, одновременно регулируя окислительный метаболизм, скорость метаболизма, чувствительность к инсулину и поглощение глюкозы и снижая инцидент DM. Физические упражнения ослабляют аномальную вазоконстрикцию коронарных артерий, опосредованную норэпинефрином, даже у пациентов с ИБС и повышают парасимпатический вход в сердце.
Физические упражнения ослабляют аномальную вазоконстрикцию коронарных артерий, опосредованную норэпинефрином, даже у пациентов с ИБС и повышают парасимпатический вход в сердце.
Повышение NO, опосредованное упражнениями, также улучшает целостность теломеров и эффективность митохондрий, снижая окислительный стресс и провоспалительную передачу сигналов.
Эффект от упражнений наиболее выражен в сосудистых руслах, затрагивающих рабочие группы мышц. Однако из-за изменений частоты сердечных сокращений, пульсового давления, вязкости и кровотока связанное с физической нагрузкой напряжение сдвига сосудов системно повышает биоактивность NO, в том числе у пациентов с гипертонией, ИБС и сердечной недостаточностью [39].
Интенсивность
Умеренные упражнения (25–75% максимального потребления кислорода) повышают уровни нитритов / нитратов в плазме, активность СОД и функцию эндотелия. Легкие упражнения не влияют. Однако интенсивные физические тренировки (максимальное потребление кислорода> 75%) усиливают окислительный стресс, сводя на нет пользу от упражнений.
Время
НИКАКИЕ тренировочные адаптации снижают артериальное давление в состоянии покоя всего за 4 недели [23]:
• Краткосрочные адаптации в основном сосредоточены на NO-опосредованном расширении сосудов.
• Более длительные (от недель до лет) адаптации влекут за собой NO-опосредованное ремоделирование сосудов, например увеличение диаметра сосудов.
Фармакологические подходы к увеличению NO
Вдыхание NO используется в ограниченном количестве, например, при легочной гипертензии и у новорожденных.
Чаще всего используются донорские препараты NO, включая органические нитраты и нитропруссид натрия, для обеспечения стабильной доставки NO для его сосудистых / гемодинамических эффектов в ряде приложений, включая стенокардию, сердечную недостаточность, легочную гипертензию, гипертонический криз или эректильную функцию. дисфункция.Их долгосрочное использование ограничивается развитием проблем с толерантностью к нитратам и токсичностью.
Высокая реакционная способность
NO позволила разработать новые доноры NO с различными режимами или скоростью высвобождения NO. Однако, несмотря на значительные исследовательские усилия, ни один новый донор NO не получил одобрения для клинического использования [8].
Однако, несмотря на значительные исследовательские усилия, ни один новый донор NO не получил одобрения для клинического использования [8].
Ряд лекарств действительно увеличивают биодоступность NO или его последующую передачу сигналов.
Ингибирование ангиотензинпревращающего фермента
Традиционно ингибиторы ангиотензинпревращающего фермента (АПФ) проявляют свое действие, подавляя превращение ангиотензина I в ангиотензин II, тем самым уменьшая местные, сосудистые и системные побочные эффекты последнего.
Ингибиторы АПФ также улучшают продукцию NO эндотелиального происхождения, функцию эндотелия, релаксацию VSMC и эластичность сосудов, оказывая благотворное влияние на гемодинамику. Ингибиторы АПФ
• снижают инактивацию оксидантами NO,
• повышают уровни брадикинина, увеличивая продукцию NO,
• повышают экспрессию и активность eNOS,
• снижают уровни ADMA в плазме и
• повышают уровни нитратов и нитритов в плазме .
Хотя они не могут обратить вспять атеросклероз, ингибиторы АПФ клинически стабилизируют и замедляют прогрессирование атерогенеза, уменьшая клинические сердечно-сосудистые события и инсульт.Ингибиторы АПФ улучшают чувствительность к инсулину и метаболизм глюкозы, а также снижают частоту впервые возникшего СД 2 типа у лиц с высоким риском до 14% [48].
Блокада рецепторов ангиотензина II
Хотя механизмы действия ингибиторов АПФ и блокаторов рецепторов ангиотензина (БРА) различаются, их клинические эффекты схожи, и БРА обладают многими полезными эффектами ингибиторов АПФ.
БРА улучшают функцию эндотелия, обратную эндотелиальную дисфункцию и обладают васкулопротекторным действием, вероятно, из-за антагонизма сосудистой ренин-ангиотензин-альдостероновой системы с пониженным действием рецептора AT 1 , пониженным окислительным стрессом, противовоспалительной модуляцией, пониженными уровнями в плазме ADMA и повышенная биодоступность NO.
Сопутствующее повышение уровней ангиотензина II в плазме и тканях при терапии БРА может обеспечивать защиту сосудов также посредством беспрепятственной стимуляции рецептора AT 2 , эффекты которой могут частично опосредоваться посредством образования NO и брадикинина. Эти благоприятные сосудистые эффекты также наблюдаются у пациентов с артериальной гипертензией и ИБС и не зависят от эффекта снижения артериального давления.
БРА улучшают чувствительность к инсулину и толерантность к глюкозе, а также снижают вероятность появления нового СД 2 типа [49].
β-Адренергическая блокада
Вазодилатирующие β-адреноблокаторы третьего поколения обладают благоприятным метаболическим и васкулопротекторным действием. Различные препараты обладают различными эффектами:
• Небиволол, β-блокатор, высоко селективный в отношении β1-адренорецепторов, вызывает расширение сосудов за счет увеличения активности eNOS, высвобождения NO, биодоступности и эндотелиальной функции. Он снижает активность NADH / NADPH и окислительный стресс, повышает уровень адипонектина и снижает системную инсулинорезистентность [50].
• Целипролол, селективный β1-блокатор, стимулирует экспрессию eNOS и обладает β2-стимулирующими свойствами. Он вызывает расширение сосудов и может улучшить действие инсулина.
• Карведилол — блокатор α1-, β1- и β2-адренорецепторов, усиливающий активность eNOS. Обладает вспомогательной сосудорасширяющей способностью, противоишемическим и антиоксидантным действием. Карведилол улучшает функцию эндотелия и чувствительность к инсулину и может снизить частоту СД 2 типа.
Ингибиторы ФДЭ-5
Ингибиторы ФДЭ-5, которые включают силденафил, варденафил и тадалафил, могут иметь потенциальную пользу для здоровья сосудов и обмена веществ [51].
PDE-5 присутствует в большом количестве в большинстве сосудистых русел, особенно в VSMC кавернозного тела и легочной артерии. ФДЭ-5 опосредует распад цГМФ.
За счет увеличения внутриклеточного цГМФ ингибирование ФДЭ-5 оказывает сильное вазодилататорное действие. Ингибиторы PDE-5 могут также улучшать экспрессию и активность eNOS и высвобождать эндогенные вазодилататоры, такие как аденозин и брадикинин, которые, в свою очередь, могут запускать высвобождение NO. Таким образом, ингибиторы ФДЭ-5 эффективно усиливают кровоток в половом члене и снижают сопротивление легочных сосудов и используются в терапии эректильной дисфункции и легочной гипертензии соответственно.
Ингибиторы ФДЭ-5 защищают эндотелиальную функцию в целом у пациентов с хронической сердечной недостаточностью и ИБС. Они могут оказывать антиоксидантное действие и улучшать чувствительность к инсулину и функцию β-клеток поджелудочной железы.
Ингибиторы редуктазы 3-гидрокси-3-метилглутарил-коэнзима A
Ингибиторы 3-гидрокси-3-метилглутарил-кофермента A (HMGCoA) редуктазы, также называемые статинами, являются единственными гиполипидемическими препаратами, которые убедительно доказали свою эффективность в спасении жизней. . В систематическом обзоре 97 рандомизированных контролируемых исследований гиполипидемических вмешательств использование статинов было наиболее благоприятной фармакологической стратегией снижения уровня липидов, которая снижала риски общей и сердечной смертности.
Как следует из названия, статины ингибируют HMG-CoA редуктазу, которая катализирует лимитирующую стадию синтеза холестерина в печени, превращение HMG-CoA в мевалонат. За счет конкурентного связывания с печеночной HMG-CoA редуктазой статины препятствуют синтезу холестерина и изопреноидов.
Действие статинов на дислипидемию не объясняет всех наблюдаемых улучшений в снижении сосудистого риска. eNOS играет важную роль в обеспечении их полезных плейотропных эффектов.Однако статины могут различаться по своей эффективности для увеличения высвобождения NO:
• в эндотелиальных клетках статины увеличивают период полужизни мРНК eNOS без изменения транскрипции гена eNOS;
• статины могут увеличивать активность eNOS за счет усиления фосфорилирования eNOS с помощью Akt;
• статины могут усиливать активацию eNOS, способствуя индуцированной агонистом ассоциации eNOS с шаперонным белком теплового шока 90;
• статины предотвращают подавление активности eNOS окисленными ЛПНП, а
• статины снижают уровни кавеолина плазмалеммы, тем самым снижая опосредованное кавеолином ингибирование eNOS [52].
Ингибирование iNOS
Слишком малое количество NO в течение длительного времени вызывает кардиометаболические нарушения. С другой стороны, острая воспалительная индукция iNOS, например, во время сепсиса, анафилактического или кардиогенного шока или отторжения трансплантата, резко повышает уровень NO. Избыточный NO нарушает функцию митохондрий и является цитотоксичным. Он может вызывать глубокую вазодилатацию, рефрактерную гипотензию, острую катехоламинорезистентную сердечную помпу и отказ нескольких конечных органов [22].
Ожидается, что такая острая гемодинамическая декомпенсация выиграет от ингибирования избыточной продукции NO. В отличие от пагубного воздействия неселективного ингибирования NOS, избирательное ингибирование iNOS может иметь терапевтические перспективы. В различных исследованиях на животных избирательное ингибирование iNOS, по-видимому, ослабляет дисфункцию органов, вызванную сепсисом, и улучшает выживаемость [53].
Заключение
Состояние сосудов и метаболизм взаимосвязаны. Анаболический метаболизм требует не только поступления питательных веществ, но и доставки по сосудам питательных веществ и анаболических гормонов, таких как инсулин, к тканям-мишеням.
И рецептор инсулина, и NOS экспрессируются в эндотелии сосудов, где они регулируют тонус сосудов, а также в скелетных и сердечных мышцах, где они участвуют в метаболических процессах. Фактически, рецептор инсулина и БДУ тесно связаны анатомически и функционально. Взаимно инсулин активирует NOS, тогда как передача сигналов NO / cGMP / cGK увеличивает чувствительность к инсулину. Неудивительно, что сохранение нормальной передачи сигналов NO коррелирует с опосредованным инсулином гомеостазом глюкозы.
Напротив, стресс и воспаление — это катаболические процессы. Воспалительные процессы отдают предпочтение использованию питательных веществ инсулино-независимыми иммунными органами за счет потребностей инсулинозависимых тканей, таких как мускулатура. Воспаление порождает не только резистентность к анаболическому действию инсулина, но и сосудистую дисфункцию с нарушением доставки питательных веществ, по сути, параллельное нарушение метаболической-сосудистой передачи инсулина и передачи сигналов NO. Эта связь между NO и передачей сигналов инсулина проиллюстрирована моделями нокаута мышиного рецептора инсулина или IRS-1, которые развивают эндотелиальную дисфункцию вместе с инсулинорезистентностью.Это также очевидно на мышиных моделях с нокаутом eNOS, которые приобретают инсулинорезистентность вместе с эндотелиальной дисфункцией. На практике эндотелиальная дисфункция снижает чувствительность к инсулину, инсулинорезистентность ухудшает функцию эндотелия, а степень эндотелиальной дисфункции коррелирует с тяжестью инсулинорезистентности и способствует ее ухудшению.
Любой субстрат хронического стресса и воспаления, даже связанный с возрастом, будет, таким образом, иметь параллельные проявления дисфункциональной передачи сигналов NO и инсулинорезистентности, влияющих на многие ткани, включая сосудистую сеть, миокард и мускулатуру.Возникающая в результате сосудистая дисфункция и метаболические нарушения со временем перерастают в кардиометаболические заболевания, как показано в таблице 2.
Таблица 2
Параллельное развитие сосудистых и метаболических заболеваний
Серьезный характер кардиометаболических заболеваний требует профилактических и терапевтических мер. Терапевтические изменения в образе жизни, такие как ограничение калорий, поддержание оптимальной массы тела, противовоспалительная диета, богатая полифенолами, нитратами и нитрозосоединениями, и регулярные умеренные физические нагрузки — это стратегии, которые увеличивают биодоступность NO и эффективно предотвращают и / или обращают вспять системные прогрессирование кардиометаболических нарушений.
Кроме того, для эффективной профилактики или вмешательства могут потребоваться фармакологические меры. Установленные доноры NO используются при лечении стенокардии, кардиомиопатии или легочной гипертензии, но не применяются при инсулинорезистентном метаболическом заболевании. Тем не менее, сложная связь NO-инсулин дает основание для будущих исследований методов лечения такого заболевания на основе NO. Возможные методы лечения могут быть нацелены на высвобождение небольших физиологических количеств NO, или увеличение экспрессии / активности конституциональной NOS, или усиление регуляции нижестоящей передачи сигналов NO-cGMP.
В настоящее время ряд фармакологических вмешательств, включая статины, ингибиторы АПФ / БРА и вазодилатирующие β-блокаторы, одновременно усиливают биоактивность NO и эндотелиальную функцию в сочетании с улучшением чувствительности к инсулину. Многие из них доказали свою пользу в улучшении прогноза сердечно-сосудистой системы, снижении макрососудистых заболеваний и смертности, а также в снижении риска развития СД 2 типа. Комбинированная терапия с такими агентами, где показано, может демонстрировать не только дополнительные положительные эффекты, но и положительный синергизм.
Список литературы
- Spier SA, Delp MD, Stallone JN, Dominguez JM 2nd, Muller-Delp JM: Тренировки с физической нагрузкой усиливают вызванную потоком вазодилатацию в артериях сопротивления скелетных мышц у старых крыс: роль PGI2 и оксида азота.Am J Physiol Heart Circ Physiol 2007; 292: h4119 – h4127.
- Clementi E, Nisoli E: оксид азота и митохондриальный биогенез: ключ к долгосрочному регулированию клеточного метаболизма. Comp Biochem Physiol A Mol Integr Physiol 2005; 142: 102 – e110.
- Марш Н., Марш А. Краткая история нитроглицерина и оксида азота в фармакологии и физиологии.Clin Exp Pharmacol Physiol 2000; 27: 313-319.
- Нобелевская премия по физиологии и медицине. Nobelprize.org. 2012. http://www.nobelprize.org/nobel_prizes/medicine/.
- Игнарро LJ: Предисловие к этому специальному выпуску журнала по химии и биологии оксида азота.Arch Pharm Res 2009; 32: 1099–1101.
- Kone BC, Kuncewicz T, Zhang W, Yu ZY: Взаимодействие белков с синтазами оксида азота: контроль правильного времени, нужного места и нужного количества оксида азота. Am J Physiol Renal Physiol 2003; 285: F178 – F190.
- Lundberg JO: Метаболиты оксида азота и сердечно-сосудистые заболевания.Маркеры, посредники или и то, и другое? Дж. Ам Колл Кардиол 2006; 47: 580–581.
- Миллер М.Р., Мегсон Иллинойс: Последние разработки в препаратах доноров оксида азота. Br J Pharmacol 2007; 151: 305–321.
- Munzel T, Feil R, Mulsch A, Lohmann SM, Hofmann F, Walter U: Физиология и патофизиология сосудистой передачи сигналов, контролируемых гуанозин-3 ‘, 5’-циклической монофосфат-зависимой протеинкиназой.Циркуляция 2003 г .; 108: 2172–2183.
- Лима Б., Forrester MT, Hess DT, Stamler JS: S-нитрозилирование в сердечно-сосудистой передаче сигналов. Circ Res 2010; 106: 633–646.
- Parihar MS, Nazarewicz RR, Kincaid E, Bringold U, Ghafourifar P: Ассоциация митохондриальной активности синтазы оксида азота с комплексом дыхательной цепи I.Biochem Biophys Res Commun 2008; 1; 366: 23–28.
- Gutierrez J, Ballinger SW, Darley-Usmar VM, Landar A: Свободные радикалы, митохондрии и окисленные липиды: новая роль в передаче сигнала в сосудистых клетках. Circ Res 2006; 99: 924–932.
- Nisoli E, Carruba MO: оксид азота и митохондриальный биогенез.J Cell Sci 2006; 119: 2855–2862.
- Дедкова Е.Н., Блаттер Л.А.: Модуляция митохондриального Са2 + оксидом азота в культивируемых эндотелиальных клетках сосудов крупного рогатого скота. Am J Physiol Cell Physiol 2005; 289: C836 – C845.
- Erusalimsky JD, Moncada S: Оксид азота и митохондриальная передача сигналов: от физиологии к патофизиологии.Артериосклер Thromb Vasc Biol 2007; 27: 2524–2531.
- Дюшен М.Р.: Роль митохондрий в здоровье и болезнях. Диабет 2004; 53 (приложение 1): S96 – S102.
- Guarente L: Митохондрии — связующее звено между старением, ограничением калорийности и сиртуинами? Cell 2008; 132: 171–176.
- Gutierrez J, Ballinger SW, Darley-Usmar VM, Landar A: Свободные радикалы, митохондрии и окисленные липиды: новая роль в передаче сигнала в сосудистых клетках. Circ Res 2006; 99: 924–932.
- Зенебе В.Дж., Назаревич Р.Р., Парихар М.С., Гафурифар П. Гипоксия / реоксигенация изолированных митохондрий сердца крысы вызывает высвобождение цитохрома с и окислительный стресс; доказательства участия митохондриальной синтазы оксида азота.J Mol Cell Cardiol 2007; 43: 411–419.
- Мицуиси М., Мияшита К., Ито Н: цГМФ спасает митохондриальную дисфункцию, вызванную глюкозой и инсулином в миоцитах. Biochem Biophys Res Commun 2008; 21; 367: 840–845.
- Rakhit RD, Mojet MH, Marber MS, Duchen MR: Митохондрии как мишени для защиты, индуцированной оксидом азота, во время имитации ишемии и реоксигенации в изолированных кардиомиоцитах новорожденных.Circulation 2001; 103: 2617–2623.
- Краузер ЭД: Митохондриальная дисфункция при септическом шоке и синдроме полиорганной дисфункции. Митохондрия 2004; 4: 729–741.
- Kingwell BA: Регулирование метаболизма, опосредованное оксидом азота, во время упражнений: влияние тренировок на здоровье и сердечно-сосудистые заболевания.FASEB J 2000; 14: 1685–1696.
- Бегум Н., Санду О.А., Ито М., Ломанн С.М., Смоленский А.: Активная киназа Rho (ROK-альфа) связывается с субстратом-1 рецептора инсулина и ингибирует передачу сигналов инсулина в гладкомышечных клетках сосудов. J. Biol Chem. 2002; 277: 6214–6222.
- Хигаки Ю., Хиршман М.Ф., Фуджи Н., Гудиер Л.Дж .: Оксид азота увеличивает поглощение глюкозы по механизму, который отличается от инсулина и путей сокращения в скелетных мышцах крыс.Диабет 2001; 50: 241–247.
- Jobgen WS, Fried SK, Fu WJ, Meininger CJ, Wu G: Регулирующая роль пути аргинина-оксида азота в метаболизме энергетических субстратов. J Nutr Biochem 2006; 17: 571–588.
- Финкель М.С., Оддис К.В., Джейкоб Т.Д., Уоткинс С.К., Хаттлер Б.Г., Симмонс Р.Л.: Отрицательные инотропные эффекты цитокинов на сердце, опосредованные оксидом азота.Science 1992; 257: 387–389.
- Хайден М.Р., Тьяги СК: Сахарный диабет 2 типа — это сосудистое заболевание (атеросклеропатия) с гипергликемией поздним проявлением? Роль БДУ, NO и окислительно-восстановительного стресса. Кардиоваск Диабетол 2003; 2: 2.
- Aicher A, Heeschen C, Mildner-Rihm C, Urbich C, Ihling C, Technau-Ihling K, Zeiher AM, Dimmeler S: Существенная роль эндотелиальной синтазы оксида азота для мобилизации стволовых клеток и клеток-предшественников.Нат Мед 2003; 9: 1370–1376.
- Левонен А.Л., Патель Р.П., Брукс П., Го Ю.М., Джо Х., Партасарати С., Андерсон П.Г., Дарли-Усмар В.М.: Механизмы передачи клеточных сигналов оксидом азота и пероксинитритом: от митохондрий до киназ МАР. Антиоксидный окислительно-восстановительный сигнал 2001; 3: 215–229.
- Förstermann U: Оксид азота и окислительный стресс при сосудистых заболеваниях.Арка Пфлюгерса 2010; 459: 923–939.
- Kim F, Pham M, Maloney E, Rizzo NO, Morton GJ, Wisse BE, Kirk EA, Chait A, Schwartz MW: воспаление сосудов, инсулинорезистентность и снижение выработки оксида азота предшествуют возникновению периферической инсулинорезистентности. Артериосклер Thromb Vasc Biol 2008; 28: 1982–1988.
- Кук JP: Вызывает ли ADMA эндотелиальную дисфункцию? Артериосклер Thromb Vasc Biol 2000; 20: 2032–2037.
- Коломбо М.Г., Андреасси М.Г., Парадосси Ю., Ботто Н., Манфреди С., Мазетти С., Росси Г., Клерико А., Бьяджини А. Доказательства ассоциации общего варианта гена синтазы эндотелия оксида азота (Glu298 → полиморфизм Asp) с наличием , степень и тяжесть ишемической болезни сердца.Сердце 2002,87: 525–528.
- Ромеро MJ, Platt DH, Tawfik HE, Labazi M, El-Remessy AB, Bartoli M, Caldwell RB, Caldwell RW: Дисфункция коронарных сосудов, вызванная диабетом, связана с повышенной активностью аргиназы. Circ Res 2008; 102: 95–102.
- Ким Ф., Галлис Б., Корсон М. А.: TNF-альфа ингибирует поток и передачу сигналов инсулина, приводя к продукции NO в эндотелиальных клетках аорты.Am J Physiol Cell Physiol 2001; 280: C1057 – C1065.
- Дандона П., Алджада А., Чаудхури А., Моханти П., Гарг Р.: Метаболический синдром. Комплексная перспектива, основанная на взаимодействии ожирения, диабета и воспаления. Циркуляция 2005; 111: 1448–1454.
- Hsueh WA, Quinones MJ: Роль эндотелиальной дисфункции в инсулинорезистентности.Am J Cardiol 2003; 92 (доп.): 10J – 17J.
- Kingwell BA: Регулирование метаболизма, опосредованное оксидом азота, во время упражнений: влияние тренировок на здоровье и сердечно-сосудистые заболевания. FASEB J 2000; 14: 1685–1696.
- Davies PF, Civelek M, Fang Y, Guerraty MA, Passerini AG: Эндотелиальная гетерогенность, связанная с региональной атерозависимостью и адаптацией к нарушенному кровотоку in vivo.Семин Тромб Хемост 2010; 36: 265–275.
- Суворава Т., Лауэр Н., Койда Г.: Отсутствие физической активности вызывает эндотелиальную дисфункцию у здоровых молодых мышей. Дж. Ам Колл Кардиол 2004; 44: 1320–1327.
- Либби П. Воспаление при атеросклерозе.Природа 2002; 420: 868–874.
- Widlansky ME, Gokce N, Keaney JJ, Vita JA: Клинические последствия эндотелиальной дисфункции. Дж. Ам Колл Кардиол 2003; 42: 1149–1160.
- Duplain H, Burcelin R, Sartori C, Cook S, Egli M, Lepori M, Vollenweider P, Pedrazzini T, Nicod P, Thorens B, Scherrer U: инсулинорезистентность, гиперлипидемия и гипертония у мышей, лишенных эндотелиальной синтазы оксида азота.Тираж 2001; 104: 342–345.
- Rizzo NO, Maloney E, Pham M, Luttrell I, Wessells H, Tateya S, Daum G, Handa P, Schwartz MW, Kim F: Снижение передачи сигналов NO-cGMP способствует воспалению сосудов и резистентности к инсулину, вызванной кормлением с высоким содержанием жиров. Артериосклер Thromb Vasc Biol 2010; 30: 758–765.
- Zhang Y, Janssens SP, Wingler K, Schmidt HH, Moens AL: Модуляция эндотелиальной синтазы оксида азота: новая сердечно-сосудистая терапевтическая стратегия. Am J Physiol Heart Circ Physiol 2011; 301: H634 – H646.
- Nisoli E, Tonello C, Cardile A, Cozzi V, Bracale R, Tedesco L, Falcone S, Valerio A, Cantoni O, Clementi E, Moncada S, Carruba MO: ограничение калорий способствует биогенезу митохондрий, вызывая экспрессию eNOS.Наука 2005; 310: 314–317.
- Jankowski P, Safar ME, Benetos A: Плейотропные эффекты лекарств, ингибирующих систему ренин-ангиотензин-альдостерон. Curr Pharm Des 2009; 15: 571–584.
- Javed U, Deedwania PC: Блокаторы рецепторов ангиотензина: новая роль у пациентов с высоким риском.Cardiol Clin 2008; 26: 507–526.
- Камп О, Метра М., Бугатти С., Беттари Л., Дей Кас А., Петрини Н., Дей Кас Л.: Небиволол: гемодинамические эффекты и клиническое значение комбинированной бета-блокады и высвобождения оксида азота. Наркотики 2010; 70: 41–56.
- Schwartz BG, Levine LA, Comstock G, Stecher VJ, Kloner RA: Сердечное использование ингибиторов фосфодиэстеразы-5.J Am Coll Cardiol 2012; 59: 9–15.
- Liao JK, Laufs U: Плейотропные эффекты статинов. Annu Rev Pharmacol Toxicol 2005; 45: 89–118.
- Heemskerk S, Masereeuw R, Russel FG, Pickkers P: Селективное ингибирование iNOS для лечения вызванного сепсисом острого повреждения почек.Нат Рев Нефрол 2009; 5: 629–640.
Автор Контакты
T. Barry Levine, MD
ABLE Medical Consulting
Pittsburgh, PA 15217 (США)
Электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Получено: 13 февраля 2012 г.
Принято: 1 марта 2012 г.
Опубликовано в Интернете: 19 июня 2012 г.
Дата выпуска: июнь 2012 г.
Количество страниц для печати: 14
Количество рисунков: 0
Количество столов: 2
ISSN: 0008-6312 (печатный)
eISSN: 1421-9751 (онлайн)
Для дополнительной информации: https: // www.karger.com/CRD
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако с учетом продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Руководство для начинающих по NOx, NO и NO2 как загрязнителям воздуха
Знакомство с семейством оксидов азота: NOx, NO и NO
2
Встречайте азот, обычно обозначаемый просто химическим обозначением N. Когда два атома азота соединяются вместе, они образуют газообразный азот ( N 2 ). Газообразный азот не имеет запаха, цвета и вкуса. Он негорючий и не поддерживает горение. Интересный факт: азот составляет 78% атмосферы Земли. Вы, наверное, помните, как в школе узнали об азотном цикле и о том, как он важен для всей жизни на Земле.
Познакомьтесь с другом азота, кислородом ( O ), высокореактивным неметаллическим окислителем, который легко образует оксиды с большинством элементов и других соединений.При нормальном давлении и температуре молекулы кислорода связываются с образованием дикислорода ( O 2 ), который присутствует в атмосфере.
Кислород является третьим по численности элементом во Вселенной и, конечно же, имеет решающее значение для нашего дальнейшего существования. Интересный факт: самый распространенный цвет полярных сияний (бледно-желтовато-зеленый) в северном сиянии создается молекулами кислорода, расположенными примерно в 60 милях над землей. Как это круто!
Когда азот встречается с кислородом
При комнатной температуре азот является очень неактивным газом — можно сказать, кушеткой.Но между этими двумя могут летать искры. При наличии молнии или искры азот соединяется с кислородом с образованием нескольких различных оксидов.
Окись азота или окись азота (NO) и двуокись азота (NO 2 ) являются наиболее распространенными. NO и NO 2 представляют собой два вида газов и называются оксидами азота (NO x ). Молекулы NO x содержат атомы азота и кислорода.
В чем разница между NO
x , NO и NO 2 ?
- Оксиды азота (NO x ) — собирательный термин, используемый для обозначения монооксида азота (оксида азота или NO) и диоксида азота (NO 2 )
- Окись азота (NO) — бесцветный газ и один из основных оксидов азота
- Двуокись азота (NO 2 ) — это красновато-коричневый газ с резким едким запахом и одним из нескольких оксидов азота.
Источники NO
x — NO и NO 2
Теперь, когда вы официально познакомились с NO x , NO и NO 2 — как образуются оксиды азота и откуда они берутся?
Оксиды азота образуются в результате реакции азота и кислорода в воздухе во время горения, особенно при высоких температурах. При нормальных температурах газы кислорода и азота не взаимодействуют друг с другом.
Окислы азота образуются естественным путем при ударе молнии.Молния может достигать температуры примерно 30 000 кельвинов (53 540 градусов по Фаренгейту). Вы можете спросить, сколько раз молния ударяет по земле? Каждую секунду на поверхность земли попадает около 100 молний. В дне 86400 секунд, а в году 365 дней — вы делаете математические вычисления… скажем так, это много.
В крупных городах оксиды азота образуются при сжигании топлива в мобильных и стационарных источниках. При сжигании бензина в автомобилях в атмосферу выделяются оксиды азота (мобильный источник).Стационарные выбросы происходят от угольных электростанций, котлов электростанций.
Оксид азота — эндогенный ингибитор секреции кислоты в изолированных желудочных железах человека | BMC Gastroenterology
Бредт Д.С., Снайдер С.Х .: Выделение синтетазы оксида азота, фермента, требующего кальмодулина. Proc Natl Acad Sci U S. A. 1990, 87: 682-5.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Паласиос М., Ноулз Р.Г., Палмер Р.М., Монкада С. Оксид азота из L-аргинина стимулирует растворимую гуанилатциклазу в надпочечниках. Сообщения о биохимических и биофизических исследованиях. 1989, 165: 802-9.
CAS
Статья
Google Scholar
Ферчготт Р.Ф., Завадски Ю.В. Обязательная роль эндотелиальных клеток в расслаблении гладкой мускулатуры артерий ацетилхолином. Природа. 1980, 288: 373-6.
CAS
Статья
PubMed
Google Scholar
Игнарро Л.Дж., Буга Г.М., Вуд К.С., Бирнс Р.Э., Чаудхури Г.: Расслабляющий фактор эндотелия, продуцируемый и высвобождаемый из артерии и вены, представляет собой оксид азота. Труды Национальной академии наук Соединенных Штатов Америки. 1987, 84: 9265-9.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Монкада С., Палмер Р.М., Хиггс Э.А.: Оксид азота: физиология, патофизиология и фармакология. Фармакологические обзоры.1991, 43: 109-42.
CAS
PubMed
Google Scholar
Калатаюд С., Санс М.Дж., Канет А., Белло Р., де Рохас Ф.Д., Эсплугес СП: Механизмы гастропротекции у крыс трансдермальным нитроглицерином. Британский журнал фармакологии. 1999, 127: 1111-8.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Уоллес Дж. Л., Грейнджер Д. Н.: Клеточные и молекулярные основы защиты слизистой оболочки желудка.Журнал FASEB. 1996, 10: 731-40.
CAS
PubMed
Google Scholar
Браун Дж. Ф., Хэнсон П. Дж., Уиттл Б. Дж.: Доноры оксида азота увеличивают толщину геля слизи в желудке крысы. Европейский журнал фармакологии. 1992, 223: 103-4. 10.1016 / 0014-2999 (92)
-Н.
CAS
Статья
PubMed
Google Scholar
Takeuchi K, Ohuchi T, Miyake H, Niki S, Okabe S: Эффекты ингибиторов синтазы оксида азота на дуоденальную щелочную секрецию у анестезированных крыс.Европейский журнал фармакологии. 1993, 231: 135-8. 10.1016 / 0014-2999 (93)
-Д.
CAS
Статья
PubMed
Google Scholar
Sababi M, Nilsson E, Holm L: Секреция слизи и щелочи в двенадцатиперстной кишке крысы: эффекты индометацина, N-омега-нитро-L-аргинина и люминальной кислоты. Гастроэнтерология. 1995, 109: 1526-34.
CAS
Статья
PubMed
Google Scholar
Холм М., Йоханссон Б., Петтерссон А., Фандрикс Л.: Кислотно-индуцированный выход оксида азота слизистой оболочки двенадцатиперстной кишки параллелен секреции бикарбоната у анестезированной свиньи. Acta Physiologica Scandinavica. 1998, 162: 461-8. 10.1046 / j.1365-201X.1998.0307f.x.
CAS
Статья
PubMed
Google Scholar
Билски Дж., Контурэк П.С., Контурак С.Дж., Цешковски М., Чарнобильски К. Роль эндогенного оксида азота в контроле секреции желудочного сока, кровотока и высвобождения гастрина у находящихся в сознании собак.Регуляторные пептиды. 1994, 53: 175-84. 10.1016 / 0167-0115 (94)
-Х.
CAS
Статья
PubMed
Google Scholar
Brown JF, Hanson PJ, Whittle BJ: Донор оксида азота, S-нитрозо-N-ацетилпеницилламин, ингибирует секреторную активность в изолированных париетальных клетках крыс. Сообщения о биохимических и биофизических исследованиях. 1993, 195: 1354-9. 10.1006 / bbrc.1993.2192.
CAS
Статья
Google Scholar
Като С., Китамура М., Королькевич Р.П., Такеучи К. Роль оксида азота в регуляции секреции желудочной кислоты у крыс: эффекты доноров NO и ингибитора синтазы NO. Британский журнал фармакологии. 1998, 123: 839-46.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ким Х., Ким К.Х .: Влияние донора оксида азота и ингибиторов синтазы оксида азота на секрецию кислоты изолированными желудочными железами кролика.Фармакология. 1996, 53: 331-9.
CAS
Статья
PubMed
Google Scholar
Molero M, Hernandez IM, Lobo P, Cardenas P, Romero R, Chacin J: Модуляция оксидом азота секреции желудочной кислоты у жаб. Acta Physiologica Scandinavica. 1998, 164: 229-36. 10.1046 / j.1365-201X.1998.00413.x.
CAS
Статья
PubMed
Google Scholar
Хасебе К., Хори С., Яно С., Ватанабе К.: Ингибирующее действие N (омега) -нитро-L-аргинина на желудочную секрецию, вызванную стимуляторами секреции и стимуляцией блуждающего нерва в изолированном желудке.Европейский журнал фармакологии. 1998, 350: 229-36. 10.1016 / S0014-2999 (98) 00248-9.
CAS
Статья
PubMed
Google Scholar
Hasebe K, Horie S, Komasaka M, Yano S, Watanabe K: Стимулирующие эффекты доноров оксида азота на секрецию желудочного сока в изолированном желудке мыши. Eur J Pharmacol. 2001, 420: 159-64. 10.1016 / S0014-2999 (01) 00995-5.
CAS
Статья
PubMed
Google Scholar
Каваути С., Сугамото С., Фурукава О., Мимаки Х., Такеучи К. Стимуляция оксидом азота секреции желудочной кислоты в слизистой оболочке фундального отдела лягушки in vitro. J. Physiol Pharmacol. 2001, 52: 93-105.
CAS
PubMed
Google Scholar
Hirsch DP, Tiel-Van Buul MM, Tytgat GN, Boeckxstaens GE: Эффект L-NMMA на постпрандиальную преходящую релаксацию нижнего пищеводного сфинктера у здоровых добровольцев. Dig Dis Sci. 2000, 45: 2069-75.10.1023 / А: 1005611221617.
CAS
Статья
PubMed
Google Scholar
Konturek JW, Fischer H, Gromotka PM, Konturek SJ, Domschke W. Эндогенный оксид азота в регуляции секреторной и моторной активности желудка у людей. Пищевая фармакология и терапия. 1999, 13: 1683-91. 10.1046 / j.1365-2036.1999.00598.x.
CAS
Статья
Google Scholar
Berg A, Kechagias S, Sjostrand SE, Ericson AC: Морфологическая поддержка паракринного ингибирования секреции желудочной кислоты оксидом азота у людей. Сканд Дж Гастроэнтерол. 2001, 36: 1016-21. 10.1080 / 003655201750422594.
CAS
Статья
PubMed
Google Scholar
Berglindh T, Obrink KJ: Способ получения изолированных желез из слизистой оболочки желудка кролика. Acta Physiol Scand. 1976, 96: 150-9.
CAS
Статья
PubMed
Google Scholar
Fellenius E, Elander B, Wallmark B, Haglund U, Helander HF, Olbe L: микрометод для изучения секреторной функции кислоты в изолированных кислородных железах человека из гастроскопической биопсии. Clin Sci (Лондон). 1983, 64: 423-31.
CAS
Статья
Google Scholar
Haglund U, Elander B, Fellenius E, Leth R, Rehnberg O, Olbe L: эффекты стимуляторов секреции изолированных желудочных желез человека. Сканд Дж Гастроэнтерол. 1982, 17: 455-60.
CAS
Статья
PubMed
Google Scholar
Батлер А.Р., Глайдвелл С., МакГиннис Дж., Биссет В.И.: Дальнейшие исследования токсичности нитропруссида натрия. Clin Chem. 1987, 33: 490-2.
CAS
PubMed
Google Scholar
Клэнси Р., Лещинска Дж., Амин А., Левартовски Д., Абрамсон С.Б. Оксид азота стимулирует АДФ-рибозилирование актина в сочетании с ингибированием полимеризации актина в нейтрофилах человека.Журнал биологии лейкоцитов. 1995, 58: 196-202.
CAS
PubMed
Google Scholar
Forte TM, Machen TE, Forte JG: ультраструктурные изменения в оксинтических клетках, связанные с секреторной функцией: гипотеза рециклинга мембран. Гастроэнтерология. 1977, 73: 941-55.
CAS
PubMed
Google Scholar
Макдональд Л.Дж., Мурад Ф .: Оксид азота и передача сигналов цГМФ.Достижения в фармакологии (Нью-Йорк). 1995, 34: 263-75.
CAS
Статья
Google Scholar
Hanafy KA, Krumenacker JS, Murad F: NO, нитротирозин и циклический GMP в передаче сигнала. Med Sci Monit. 2001, 7: 801-19.
CAS
PubMed
Google Scholar
Чен Д., Марвик Р., Роннинг К., Андерссон К., Валдум Х.Л., Хакансон Р. Вызванная гастрином секреция панкреастатина и гистамина из клеток ECL и кислоты из париетальных клеток в изолированном желудке крысы с сосудистой перфузией.Эффекты изобутилметилксантина и альфа-фторметилгистидина. Регуляторные пептиды. 1996, 65: 133-138.
CAS
Статья
PubMed
Google Scholar
Salvemini D, Masini E, Pistelli A, Mannaioni PF, Vane J: Оксид азота: регуляторный медиатор реактивности тучных клеток. Журнал сердечно-сосудистой фармакологии. 1991, 17: S258-S264.
CAS
Статья
Google Scholar
Peh KH, Moulson A, Wan BY, Assem EK, Pearce FL: Роль оксида азота в высвобождении гистамина из базофилов человека и тучных клеток брюшины крысы. Европейский журнал фармакологии. 2001, 425: 229-238. 10.1016 / S0014-2999 (01) 01205-5.
CAS
Статья
PubMed
Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Оксид азота (NOx) Загрязнение | ADEQ Arizona Department of Environmental Quality
Оксиды азота (NO x ) — это группа газов с высокой реакционной способностью, включая диоксид азота, азотистую кислоту и азотную кислоту.Для установления стандартов EPA использует диоксид азота (NO 2 ) в качестве «индикаторного загрязнителя», что означает, что если в воздухе присутствует загрязнение диоксидом азота, то же самое и с другими оксидами азота.
В частности, диоксид азота обычно образуется при сгорании топлива, например, в автомобилях, электростанциях и внедорожном оборудовании. Оксиды азота, образующиеся из этих источников, соединяются с летучими органическими соединениями (ЛОС), образуя приземный озон, вредный вид озона. Наименьшее и наиболее вредное загрязнение твердыми частицами, известное как PM 2.5 , также образуется из оксидов азота в сочетании с летучими органическими соединениями, оксидами серы, аммиаком и твердыми частицами.
В конечном итоге загрязнение оксидами азота влияет на видимость, способность дышать, качество воды, кислотные дожди и температуру Земли.
Воздействие на здоровье и благополучие
Было доказано, что диоксид азота сам по себе вызывает неблагоприятные респираторные эффекты, включая воспаление дыхательных путей и астму. Люди, живущие вблизи основных дорог, подвергаются высокому риску, учитывая, что выбросы NO 2 примерно на 30-100 процентов выше, чем в районах, удаленных от дорог.
Семейство оксидов азота может реагировать с аммиаком, летучими органическими соединениями и другими соединениями с образованием загрязнения PM 2,5 , которое легко проникает в чувствительные и глубокие части легких, вызывая респираторные заболевания, такие как эмфизема и бронхит. NO x также может усугубить ранее существовавшее сердечное заболевание, что приведет к преждевременной смерти.
Плохой тип озона, приземный, образуется в результате реакции NO x и ЛОС с солнечным светом и теплом. Приземный озон действует как плотный барьер, не позволяющий загрязнению выйти из верхних слоев атмосферы.Это загрязнение приближается к Земле, задерживает тепло и снижает видимость. Определенные группы, такие как дети, пожилые люди и люди с заболеваниями легких, особенно подвержены риску воздействия озона на уровне земли, который может вызвать затрудненное дыхание и другие респираторные проблемы.
Планы по производству оксидов азота
В стране нет зон недостижения по стандартам NO x 2010 года. Поскольку все области страны достигают стандартов, Аризона представила необходимую инфраструктуру — SIP.
2010 NO 2 Инфраструктура SIP | Скачать>
Глоссарий: оксиды азота (NO
ABC — DEF — GHI — JKL — MNO — PQRS — TUV — WXYZ
Языки: Deutsch [de] English [en] Español [es] Français [fr]
NO х )
Аналогичные термины : оксид азота (NO), диоксид азота (NO 2 ).
Определение:
NO x — общий термин для группы высокореактивных газов, все
из которых содержат азот и кислород в различных количествах [например,
азотная
оксид ( NO ) и
диоксид азота ( NO 2 )].
Многие оксиды азота не имеют цвета и запаха. Однако один общий
загрязнитель, диоксид азота (NO 2 ) вместе с частицами в воздухе часто может быть
виден как красновато-коричневый слой над многими городскими районами.
Оксиды азота образуются при сжигании топлива […]. Основными источниками NOx являются:
автотранспортные средства, электроэнергетика и другие промышленные, коммерческие и
бытовые источники, сжигающие топливо.
В атмосфере оксиды азота могут способствовать образованию
фотохимический озон (смог) и имеет последствия для здоровья.Они также приводят к кислоте
дождь и способствуют глобальному потеплению.

 Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель. В лабораторных условиях он образуется сразу при нескольким опытах:
В лабораторных условиях он образуется сразу при нескольким опытах:



 Но реакции протекают не так, как с обычными оксидами — они всегда окислительно — восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO 2 при растворении в воде диспропорционирует с образованием 2-х кислот — азотной и азотистой:
Но реакции протекают не так, как с обычными оксидами — они всегда окислительно — восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO 2 при растворении в воде диспропорционирует с образованием 2-х кислот — азотной и азотистой: При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
При его взаимодействии с гидразином и его производными выделяется большое количество энергии: В природе он образуется в атмосфере при грозовых разрядах:
В природе он образуется в атмосфере при грозовых разрядах:
 С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как эссенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как эссенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др. Поэтому указанные изоформы принято также подразделять на конститутивную (cNOS) и индуцибельную (iNOS) синтазы оксида азота.
Поэтому указанные изоформы принято также подразделять на конститутивную (cNOS) и индуцибельную (iNOS) синтазы оксида азота. По сути, монооксид азота является локальным тканевым гормоном. NO играет ключевую роль в подавлении активности бактериальных и опухолевых клеток путем либо блокирования некоторых их железосодержащих ферментов, либо путем повреждения их клеточных структур оксидом азота или свободными радикалами, образующимися из оксида азота. Одновременно в очаге воспаления накапливается супероксид, который вызывает повреждение белков и липидов клеточных мембран, что и объясняет его цитотоксическое действие на клетку-мишень. Следовательно, NO, избыточно накапливаясь в клетке, может действовать двояко: с одной стороны вызывать повреждение ДНК и с другой — давать провоспалительный эффект.
По сути, монооксид азота является локальным тканевым гормоном. NO играет ключевую роль в подавлении активности бактериальных и опухолевых клеток путем либо блокирования некоторых их железосодержащих ферментов, либо путем повреждения их клеточных структур оксидом азота или свободными радикалами, образующимися из оксида азота. Одновременно в очаге воспаления накапливается супероксид, который вызывает повреждение белков и липидов клеточных мембран, что и объясняет его цитотоксическое действие на клетку-мишень. Следовательно, NO, избыточно накапливаясь в клетке, может действовать двояко: с одной стороны вызывать повреждение ДНК и с другой — давать провоспалительный эффект. Повреждение ДНК под действием NO является одной из причин развития
Повреждение ДНК под действием NO является одной из причин развития

 Степень окисления азота +5, а валентность равна IV.
Степень окисления азота +5, а валентность равна IV. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках. Прежде всего, следует запомнить четыре типа оксидов:
Прежде всего, следует запомнить четыре типа оксидов:
 д.
д.