Содержание
Количество теплоты
Внутренняя энергия тела может изменяться за счет работы внешних сил. Для характеристики изменения внутренней энергии при теплообмене вводится величина, называемая количеством теплоты и обозначаемая Q.
|
В международной системе единицей количества теплоты, также как работы и энергии, является джоуль: [Q] = [A] = [E] = 1 Дж.
На практике еще иногда применяется внесистемная единица количества теплоты – калория. 1 кал. = 4,2 Дж.
Следует отметить, что термин «количество теплоты» неудачен. Он был введен в то время, когда считалось, что в телах содержится некая невесомая, неуловимая жидкость – теплород. Процесс теплообмена, якобы, заключается в том, что теплород, переливаясь из одного тела в другое, переносит с собой и некоторое количество теплоты. Сейчас, зная основы молекулярно-кинетической теории строения вещества, мы понимаем, что теплорода в телах нет, механизм изменения внутренней энергии тела иной. Однако, сила традиций велика и мы продолжаем пользоваться термином, введенным на основе неверных представлений о природе теплоты. Вместе с тем, понимая природу теплообмена, не следует полностью игнорировать неверные представления о нем. Напротив, проводя аналогию между потоком тепла и потоком гипотетической жидкости теплорода, количеством теплоты и количеством теплорода, можно при решении некоторых классов задач наглядно представить протекающие процессы и верно решить задачи. В конце-концов, верные уравнения, описывающие процессы теплообмена, были в свое время получены на основе неверных представлений о теплороде, как носителе теплоты.
Процесс теплообмена, якобы, заключается в том, что теплород, переливаясь из одного тела в другое, переносит с собой и некоторое количество теплоты. Сейчас, зная основы молекулярно-кинетической теории строения вещества, мы понимаем, что теплорода в телах нет, механизм изменения внутренней энергии тела иной. Однако, сила традиций велика и мы продолжаем пользоваться термином, введенным на основе неверных представлений о природе теплоты. Вместе с тем, понимая природу теплообмена, не следует полностью игнорировать неверные представления о нем. Напротив, проводя аналогию между потоком тепла и потоком гипотетической жидкости теплорода, количеством теплоты и количеством теплорода, можно при решении некоторых классов задач наглядно представить протекающие процессы и верно решить задачи. В конце-концов, верные уравнения, описывающие процессы теплообмена, были в свое время получены на основе неверных представлений о теплороде, как носителе теплоты.
|
Рассмотрим более подробно процессы, которые могут протекать в результате теплообмена.
Нальем в пробирку немного воды и закроем ее пробкой. Подвесим пробирку к стержню, закрепленному в штативе, и подведем под нее открытое пламя. От пламени пробирка получает некоторое количество теплоты и температура жидкости, находящейся в ней, повышается. При повышении температуры внутренняя энергия жидкости увеличивается. Происходит интенсивный процесс ее парообразования. Расширяющиеся пары жидкости совершают механическую работу по выталкиванию пробки из пробирки.
Проведем еще один опыт с моделью пушки, изготовленной из отрезка латунной трубки, которая укреплена на тележке. С одной стороны трубка плотно закрыта эбонитовой пробкой, сквозь которую пропущена шпилька. К шпильке и трубке припаяны провода, оканчивающиеся клеммами, на которые может подаваться напряжение от осветительной сети. Модель пушки, таким образом, представляет собой разновидность электрического кипятильника.
К шпильке и трубке припаяны провода, оканчивающиеся клеммами, на которые может подаваться напряжение от осветительной сети. Модель пушки, таким образом, представляет собой разновидность электрического кипятильника.
Нальем в ствол пушки немного воды и закроем трубку резиновой пробкой. Подключим пушку к источнику тока. Электрический ток, проходя через воду, нагревает ее. Вода закипает, что приводит к ее интенсивному парообразованию. Давление водяных паров растет и, наконец, они совершают работу по выталкиванию пробки из ствола пушки.
Пушка, вследствие отдачи, откатывается в сторону, противоположную вылету пробки.
Оба опыта объединяют следующие обстоятельства. В процессе нагревания жидкости различными способами, температура жидкости и, соответственно, ее внутренняя энергия увеличивались. Для того, чтобы жидкость кипела и интенсивно испарялась, необходимо было продолжать ее нагревание.
Пары жидкости за счет своей внутренней энергии совершили механическую работу.
Исследуем зависимость количества теплоты, необходимой для нагревания тела, от его массы, изменения температуры и рода вещества. Для исследования данных зависимостей будем использовать воду и масло. (Для измерения температуры в опыте применяется электрический термометр, изготовленный из термопары, подключенной к зеркальному гальванометру. Один спай термопары опущен в сосуд с холодной водой для обеспечения постоянства его температуры. Другой спай термопары измеряет температуру исследуемой жидкости).
Опыт состоит из трех серий. В первой серии исследуется для постоянной массы конкретной жидкости (в нашем случае – воды) зависимость количества теплоты, необходимого для ее нагревания, от изменения температуры. О количестве теплоты, полученной жидкостью от нагревателя (электрической плитки), будем судить по времени нагревания, предполагая, что между ними существует прямо пропорциональная зависимость. Чтобы результат эксперимента соответствовал этому предположению, необходимо обеспечить стационарный поток тепла от электроплитки к нагреваемому телу. Для этого электроплитка была включена в сеть заранее, так чтобы к началу опыта температура ее поверхности перестала изменяться. Для более равномерного нагрева жидкости во время опыта, будем помешивать ее при помощи самой термопары. Будем фиксировать показания термометра через равные промежутки времени до тех пор, пока световой зайчик не дойдет до края шкалы.
Чтобы результат эксперимента соответствовал этому предположению, необходимо обеспечить стационарный поток тепла от электроплитки к нагреваемому телу. Для этого электроплитка была включена в сеть заранее, так чтобы к началу опыта температура ее поверхности перестала изменяться. Для более равномерного нагрева жидкости во время опыта, будем помешивать ее при помощи самой термопары. Будем фиксировать показания термометра через равные промежутки времени до тех пор, пока световой зайчик не дойдет до края шкалы.
Сделаем вывод: между количеством теплоты, необходимым для нагревания тела и изменением его температуры, существует прямая пропорциональная зависимость.
Во второй серии опытов будем сравнивать количества теплоты, необходимые для нагревания одинаковых жидкостей разной массы при изменении их температуры на одну и ту же величину.
Для удобства сравнения получаемых величин массу воды для второго опыта возьмем в два раза меньше, чем в первом опыте.
Вновь будем фиксировать показания термометра через равные промежутки времени.
Сравнивая результаты первого и второго опытов можно сделать следующие выводы.
|
В третьей серии опытов будем сравнивать количества теплоты, необходимые для нагревания равных масс различных жидкостей, при изменении их температуры на одну и ту же величину.
Будем нагревать на электроплитке масло, масса которого равна массе воды в первом опыте. Будем фиксировать показания термометра через равные промежутки времени.
Результат опыта подтверждает вывод о том, что количество теплоты, необходимое для нагревания тела, прямо пропорционально изменению его температуры и, кроме того, свидетельствует о зависимости этого количества теплоты от рода вещества.
Поскольку в опыте использовалось масло, плотность которого меньше плотности воды и для нагревания масла до некоторой температуры потребовалось меньшее количество теплоты, чем для нагревания воды, можно предположить, что количество теплоты, необходимое для нагревания тела, зависит от его плотности.
Чтобы проверить это предположение, будем одновременно нагревать на нагревателе постоянной мощности одинаковые массы воды, парафина и меди.
Через одно и то же время температура меди оказывается примерно в 10 раз, а парафина примерно в 2 раза выше температуры воды.
Но медь имеет большую, а парафин меньшую плотность, чем вода.
Опыт показывает, что величиной, характеризующей скорость изменения температуры веществ, из которых изготовлены тела, участвующие в теплообмене, является не плотность. Эта величина называется удельной теплоемкостью вещества и обозначается буквой c.
Для сравнения удельных теплоемкостей различных веществ служит специальный прибор. Прибор состоит из стоек, в которых крепится тонкая парафиновая пластинка и планка с пропущенными сквозь нее стержнями. На концах стержней укреплены алюминиевый, стальной и латунный цилиндры равной массы.
Прибор состоит из стоек, в которых крепится тонкая парафиновая пластинка и планка с пропущенными сквозь нее стержнями. На концах стержней укреплены алюминиевый, стальной и латунный цилиндры равной массы.
Нагреем цилиндры до одинаковой температуры, погрузив их в сосуд с водой, стоящий на горячей электроплитке. Закрепим горячие цилиндры на стойках и освободим их от крепления. Цилиндры одновременно прикасаются к парафиновой пластине и, плавя парафин, начинают погружаться в нее. Глубина погружения цилиндров одинаковой массы в парафиновую пластину, при изменении их температуры на одну и ту же величину, оказывается разной.
Опыт свидетельствует о том, что удельные теплоемкости алюминия, стали и латуни различны.
Проделав соответствующие опыты с плавлением твердых тел, парообразованием жидкостей, сгоранием топлива получаем следующие количественные зависимости.
|
|
|
|
Во всех формулах, позволяющих рассчитывать количество теплоты для различных тепловых процессов, стоят коэффициенты пропорциональности, называемые удельными величинами, то есть приходящимися на единицу других величин. Удельные величины являются характеристиками веществ, а не тел.
|
|
Чтобы получить единицы удельных величин, их надо выразить из соответствующих формул и в полученные выражения подставить единицы теплоты – 1 Дж, массы – 1 кг, а для удельной теплоемкости – и 1 К.
Получаем единицы: удельной теплоемкости – 1 Дж/кг·К, остальных удельных теплот: 1 Дж/кг.
Количество теплоты
Количество теплоты — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Внутренняя энергия тела может изменяться за счет работы внешних сил. Для характеристики изменения внутренней энергии при теплообмене вводится величина, называемая количеством теплоты и обозначаемая Q.
В международной системе единицей количества теплоты, также как работы и энергии, является джоуль: [Q] = [A] = [E] = 1 Дж.
На практике еще иногда применяется внесистемная единица количества теплоты – калория. 1 кал. = 4,2 Дж.
Количество теплоты, передаваемое от одного тела к другому, может идти на нагревание тела, плавление, парообразование, либо выделяться при противоположных процессах – остывании тела, кристаллизации, конденсации. Теплота выделяется при сгорании топлива.
Между массой вещества и количеством теплоты, необходимым для его нагревания, существует прямая пропорциональная зависимость.
- Количество теплоты, необходимое для нагревания тела или выделяющееся при его охлаждении, прямо пропорционально массе тела и изменению его температуры:
Q = cmΔT,
где с — удельная теплоемкость [Дж/кг·К], m — масса тела [кг], ΔT — изменение температуры [К]
- Количество теплоты, необходимое для превращения жидкости в пар или выделяющееся при его конденсации, прямо пропорционально массе жидкости:
Q = Lm,
где L — удельная теплота парообразования [Дж/кг], m — масса тела [кг]
- Количество теплоты, необходимое для плавления тела или выделяющееся при его кристаллизации, прямо пропорционально массе этого тела:
Q = λm,
где λ (лямбда) — удельная теплота плавления [Дж/кг], m — масса тела [кг]
- Количество теплоты, выделяющееся при сгорании топлива, прямо пропорционально его массе:
Q = qm,
где q — удельная теплота сгорания [Дж/кг], m — масса тела [кг]
Удельная теплоемкость вещества показывает, чему равно количество теплоты, необходимое для нагревания или выделяющееся при охлаждении 1 кг вещества на 1 К.
Удельные теплоты парообразования, плавления, сгорания показывают, какое количество теплоты требуется для парообразования, плавления или выделяется при конденсации, кристаллизации, сгорании 1 кг вещества.
Другие заметки по физике
Формула количества теплоты в физике
Содержание:
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем,
что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом
случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система
микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии,
Количество энергии,
которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой).
Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики.
Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $\delta Q$. Обратим внимание,
что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом.
Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$\delta Q=C d T(1)$$
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$\delta Q=c m d T=\nu c_{\mu} d T(2)$$
где $c=\frac{C}{m}$ – удельная теплоемкость тела, m – масса тела,
$c_{\mu}=c \cdot \mu$ — молярная теплоемкость,
$\mu$ – молярная масса вещества,
$\nu=\frac{m}{\mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты
($\Delta Q$), которое получает тело при увеличении его температуры на величину
$\Delta t = t_2 — t_1$ можно вычислить как:
$$\Delta Q=c m \Delta t(3)$$
где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности
($\Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты,
которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты
($\delta Q$) равное:
$$\delta Q=\lambda d m$$
где $\lambda$ – удельная теплота плавления, dm – элемент массы тела.
При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества.
При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$\delta Q=r d m$$
где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$
где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 —
количество теплоты части воды температурой t1 и массой m1;
Q2=cm2t2— количество теплоты части воды температурой t2 и массой m2.
Из уравнения (1.1) следует:
$$
\begin{array}{l}
\mathrm{cmt}=\mathrm{cm}_{1} t_{1}+\mathrm{~cm}_{2} t_{2} \rightarrow \mathrm{mt}=\mathrm{m}_{1} t_{1}+\mathrm{~m}_{2} t_{2} \rightarrow \\
\rightarrow \rho \mathrm{Vt}=\rho V_{1} t_{1}+\rho \mathrm{V}_{2} t_{2} \rightarrow \mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2)
\end{array}
$$
При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$
V=V_{1}+V_{2}(1. 3)
3)
$$$
Так, мы получаем систему уравнений:
$$
\left\{\begin{array}{c}
V t=V_{1} t_{1}+V_{2} t_{2} \\
V=V_{1}+V_{2}
\end{array}\right.
$$
Решив ее получим:
$$
\begin{array}{l}
V_{1}=\frac{\left(t_{2}-t\right)}{t_{2}-t_{1}} V \\
V_{2}=\frac{\left(t-t_{1}\right)}{t_{2}-t_{1}} V
\end{array}
$$
Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$
\begin{array}{l}
V_{1}=\frac{(60-40)}{60-10} 200=80 \text { (л) } \\
V_{2}=\frac{(40-10)}{60-10} 200=120 \text { (л) }
\end{array}
$$
Ответ. V1=80 л, V2=120 л.
Слишком сложно?
Формула количества теплоты не по зубам? Тебе ответит эксперт через 10 минут!
Пример
Задание. Теплоемкость тела изменяется по линейному закону (рис.1) в зависимости от абсолютной температуры в
рассматриваемом интервале $T_{1} \leq T \leq T_{2}$ .
Какое количество теплоты получает тело, если T1=300 К, T2=400 К. {*}\right)
{*}\right)
\end{array}
$$
Ответ. $\Delta Q$=1700 Дж
Читать дальше: Формула напряженности магнитного поля.
Количество теплоты: нагревание, охлаждение, плавление, кристаллизация, парообразование, конденсация, горение. Термодинамическая система
Тестирование онлайн
Количество теплоты. Основные понятия
Количество теплоты
Термодинамика
Раздел молекулярной физики, который изучает передачу энергии, закономерности превращения одних видов энергии в другие. В отличие от молекулярно-кинетической теории, в термодинамике не учитывается внутреннее строение веществ и микропараметры.
Термодинамическая система
Это совокупность тел, которые обмениваются энергией (в форме работы или теплоты) друг с другом или с окружающей средой. Например, вода в чайнике остывает, происходит обмен теплотой воды с чайником и чайника с окружающей средой. Цилиндр с газом под поршнем: поршень выполняет работу, в результате чего, газ получает энергию, и изменяются его макропараметры.
Количество теплоты
Это энергия, которую получает или отдает система в процессе теплообмена. Обозначается символом Q, измеряется, как любая энергия, в Джоулях.
В результате различных процессов теплообмена энергия, которая передается, определяется по-своему.
Нагревание и охлаждение
Этот процесс характеризуется изменением температуры системы. Количество теплоты определяется по формуле
Удельная теплоемкость вещества с измеряется количеством теплоты, которое необходимо для нагревания единицы массы данного вещества на 1К. Для нагревания 1кг стекла или 1кг воды требуется различное количество энергии. Удельная теплоемкость — известная, уже вычисленная для всех веществ величина, значение смотреть в физических таблицах.
Теплоемкость вещества С — это количество теплоты, которое необходимо для нагревания тела без учета его массы на 1К.
Плавление и кристаллизация
Плавление — переход вещества из твердого состояния в жидкое. Обратный переход называется кристаллизацией.
Обратный переход называется кристаллизацией.
Энергия, которая тратится на разрушение кристаллической решетки вещества, определяется по формуле
Удельная теплота плавления известная для каждого вещества величина, значение смотреть в физических таблицах.
Парообразование (испарение или кипение) и конденсация
Парообразование — это переход вещества из жидкого (твердого) состояния в газообразное. Обратный процесс называется конденсацией.
Удельная теплота парообразования известная для каждого вещества величина, значение смотреть в физических таблицах.
Горение
Количество теплоты, которое выделяется при сгорании вещества
Удельная теплота сгорания известная для каждого вещества величина, значение смотреть в физических таблицах.
Для замкнутой и адиабатически изолированной системы тел выполняется уравнение теплового баланса. Алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующим в теплообмене, равна нулю:
Q1+Q2+. ..+Qn=0
..+Qn=0
Урок 23. внутренняя энергия. работа. количество теплоты — Физика — 10 класс
Физика, 10 класс
Урок 23. Внутренняя энергия. Работа. Количество теплоты
Список вопросов, рассмотренных в уроке: внутренняя энергия; способы изменения внутренней энергии; различные виды теплообмена; уравнение теплового баланса; работа в термодинамике; нахождение численного значения работы в различных тепловых процессах.
Глоссарий по теме
Термодинамическая система представляет собой систему тел, которые взаимодействуют и обмениваются энергией и веществом.
Состояние равновесия — это состояние системы, в которой нет теплообмена между телами, составляющими систему.
Термодинамический процесс — процесс изменения состояния системы, который изменяет параметры системы.
Внутренняя энергия представляет собой сумму кинетической энергии хаотичного теплового движения и потенциальной энергии взаимодействия всех молекул, составляющих тело.
Теплоемкость представляет собой энергию, которая численно равна количеству тепла, которое выделяется или поглощается, когда температура тела изменяется на 1 К.
Теплопередача- это передача энергии от одного тела другому без выполнения работы.
Количество тепла является количественной мерой изменения внутренней энергии во время теплообмена.
Работа в термодинамике — это взаимодействие системы с внешними объектами, в результате чего изменяются параметры системы.
Список литературы
Г.Я. Мякишев., Б. Буховцев., Н. Н. Соцкий. Физика.10. Учебник для образовательных организаций М .: Просвещение, 2017. — С. 243-254.
Рымкевич А.П. Сборник задач по физике. 10-11 класс М.: Дрофа, 2009.- с.75-84
Основное содержание урока
Внутренняя энергия тела — это полная энергия всех молекул, которые его составляют. Внутренняя энергия идеального газа пропорциональна его температуре.
U = 3/2 · ν · R · T
Чтобы изменить внутреннюю энергию вещества, надо сообщить ему некоторое количество тепла или совершить работу.
Работа в термодинамике равна изменению внутренней энергии системы: A = ΔU.
Работа газа в изобарном процессе равна A = P · ΔV. Если газ расширяется, то А > 0, если газ сжимается, то А < 0.
Кроме того, работа газа может быть определена с использованием графика давления в зависимости от объема.
Работа газа численно равна площади под графиком давления.
Количество теплоты — это энергия, которую система получает или теряет во время теплообмена.
Количество тепла для различных термических процессов определяется по-разному.
При нагревании и охлаждении: Q = c_ ∙ m ∙ ΔT;
Во время плавления и кристаллизации: Q = ℷ ∙ m;
Во время испарения и конденсации; Q = r ∙ m;
При сжигании: Q = q ∙ m.
Для замкнутой и адиабатически изолированной системы тел выполняется уравнение теплового баланса: Q1 + Q2 + … + Qn = 0
Выражение для внутренней энергии одноатомного идеального или разреженного реального газа имеет следующий вид:
U = 3/2 ν ∙ R ∙ T
Для идеального газа из молекул с двумя, тремя или более атомами необходимо учитывать кинетическую энергию вращения молекул (они больше не могут считаться материальными точками), поэтому выражение для их внутренней энергии отличается от U = 3/2 ν ∙ R ∙ T числовым коэффициентом.
Для двухатомного газа (например, O2, CO и т. д.):
U = 5/2 ν ∙ R ∙ T
Для газа с тремя атомами или более (например, O3, Ch5):
U = 3ν · R · T
Изменить внутреннюю энергию вещества можно, передав ему некоторое количество тепла или выполнить над ним работу.
Существует три типа теплопередачи:
1) Теплопроводность представляет собой процесс переноса энергии от более теплого тела к менее нагретому телу с прямым контактом или от более нагретых частей тела к менее нагретым, осуществляемый хаотично движущимися частицами тела (атомы, молекулы, электроны , и т.д.). Простым примером является нагревание чашки, в которую выливают горячий чай.
2) Конвекция — это своего рода передача тепла, в которой внутренняя энергия передается снизу вверх струями или потоками жидкости или газа. Пример: нагревание воды в чайнике, который стоит на горячей плите.
3) Лучистый обмен или излучение — это процесс передачи энергии через электромагнитное излучение. Простой пример: солнечный свет.
Механическая работа изменяет механическую энергию тела. Термодинамическая работа изменяет внутреннюю энергию газа.
Если газ расширяется, то работа газа считается положительной. Если он сжат, то отрицательной.
Формула для нахождения работы газа в изобарном процессе имеет следующий вид:
A = p · ΔV
Для изотермического процесса формула принимает следующий вид: A = ν ∙ R ∙ T ∙ ln (V_2 / V_1)
Разбор тренировочных заданий
1. Объём газа, расширяющегося при постоянном давлении 100 кПа, увеличился на 20 литров. Работа, выполняемая газом в этом процессе, — _____.
Варианты ответов:
2000 Дж;
20 000 Дж;
200 Дж;
50 МДж.
Правильный вариант / варианты (или правильные комбинации вариантов): 3) 2000 Дж.
Совет: используйте формулу работы.
2. Чтобы из 5 кг снега, при температуре 0ºС, получить воду при 20ºС, необходимо сжигать в печке с КПД 40% __ кг дров.
Решение: при сгорании дров выделится количество теплоты:
из этого количества на полезную работу пойдёт только:
Для плавления снега необходимо количество теплоты:
для нагревания воды понадобится:
Согласно уравнению теплового баланса:
Отсюда следует:
Подставим числовые значения в формулу:
Ответ: 0,5175 кг.
Количество теплоты, удельная теплоемкость
От чего зависит количество теплоты
Внутренняя энергия тела изменяется при совершении работы или теплопередаче. При явлении теплопередачи внутренняя энергия передается теплопроводностью, конвекцией или излучением.
Каждое тело при нагревании или охлаждении (при теплопередаче) получает или теряет какое-то количество энергии. Исходя из этого, принято это количество энергии назвать количеством теплоты.
Итак, количество теплоты — это та энергия, которую отдает или получает тело в процессе теплопередачи.
Какое количество теплоты необходимо для нагревания воды? На простом примере можно понять, что для нагревания разного количества воды потребуется разное количество теплоты. Допустим, возьмем две пробирки с 1 литром воды и с 2-мя литрами воды. В каком случае потребуется большее количество теплоты? Во втором, там, где в пробирке 2 литра воды. Вторая пробирка будет нагреваться дольше, если мы подогреваем их одинаковым источником огня.
Таким образом, количество теплоты зависит от массы тела. Чем больше масса, тем большее количество теплоты требуется для нагрева и, соответственно, на охлаждение тела требуется большее время.
От чего еще зависит количество теплоты? Естественно, от разности температур тел. Но это еще не все. Ведь если мы попытаемся нагреть воду или молоко, то нам потребуется разное количество времени. Т.е получается, что количество теплоты зависит от вещества, из которого состоит тело.
В итоге получается, что количество теплоты, которое нужно для нагревания или количество теплоты, которое выделяется при остывании тела, зависит от его массы, от изменения температуры и от вида вещества, из которого состоит тело.
В чем измеряется количество теплоты
За единицу количества теплоты принято считать 1 Джоуль. До появления единицы измерения энергии ученые считали количество теплоты калориями. Сокращенно эту единицу измерения принято писать — “Дж”
Калория — это количество теплоты, которое необходимо для того, чтобы нагреть 1 грамм воды на 1 градус Цельсия.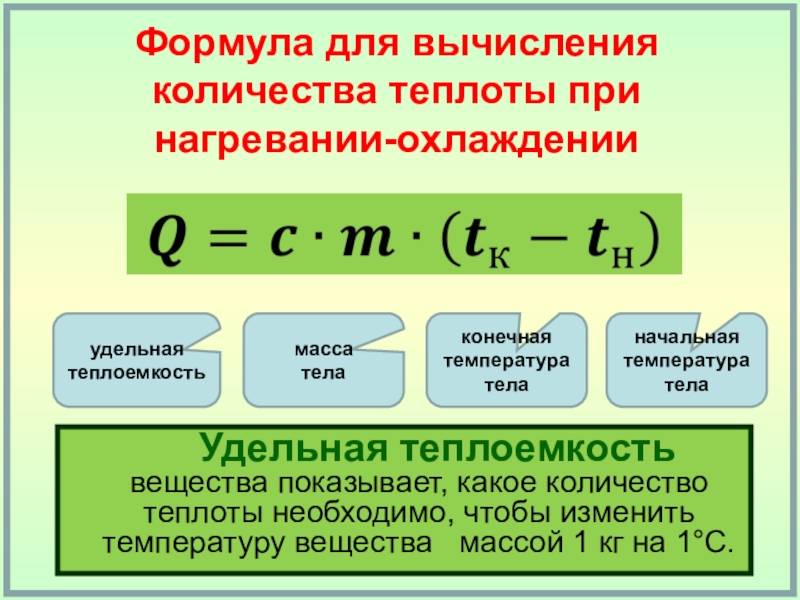 Сокращенно единицу измерения калории принято писать — “кал”.
Сокращенно единицу измерения калории принято писать — “кал”.
1 кал = 4,19 Дж.
Обратите внимание, что в этих единицах энергии принято отмечать пищевую ценность продуктов питания кДж и ккал.
1 ккал = 1000 кал.
1 кДж = 1000 Дж
1 ккал = 4190 Дж = 4,19 кДж
Что такое удельная теплоемкость
Каждое вещество в природе имеет свои свойства, и для нагрева каждого отдельного вещества требуется разное количество энергии, т.е. количества теплоты.
Удельная теплоемкость вещества — это величина, равная количеству теплоты, которое нужно передать телу с массой 1 килограмм, чтобы нагреть его на температуру 1 0C
Удельная теплоемкость обозначается буквой c и имеет величину измерения Дж/кг*
Например, удельная теплоемкость воды равна 4200 Дж/кг*0C. То есть это то количество теплоты, которое нужно передать 1 кг воды, чтобы нагреть ее на 1 0C
Следует помнить, что удельная теплоемкость веществ в разных агрегатных состояниях различна. То есть для нагревания льда на 1 0C потребуется другое количество теплоты.
То есть для нагревания льда на 1 0C потребуется другое количество теплоты.
Как рассчитать количество теплоты для нагревания тела
Например, необходимо рассчитать количество теплоты, которое нужно потратить для того, чтобы нагреть 3 кг воды с температуры 15 0С до температуры 85 0С. Нам известна удельная теплоемкость воды, то есть количество энергии, которое нужно для того, чтобы нагреть 1 кг воды на 1 градус. То есть для того, чтобы узнать количество теплоты в нашем случае, нужно умножить удельную теплоемкость воды на 3 и на то количество градусов, на которое нужно увеличить температуры воды. Итак, это 4200*3*(85-15) = 882 000.
В скобках мы рассчитываем точное количество градусов, отнимая от конечного необходимого результата начальное
Итак, для того, чтобы нагреть 3 кг воды с 15 до 85 0С, нам потребуется 882 000 Дж количества теплоты.
Количество теплоты обозначается буквой Q, формула для его расчета выглядит следующим образом:
Q=c*m*(t2-t1).
Разбор и решение задач
Задача 1. Какое количество теплоты потребуется для нагрева 0,5 кг воды с 20 до 50 0С
Дано:
m = 0,5 кг.,
с = 4200 Дж/кг*0С,
t1 = 20 0С,
t2 = 50 0С.
Величину удельной теплоемкость мы определили из таблицы.
Решение:
количество теплоты определяется по формуле Q=c*m*(t2-t1).
Подставляем значения:
Q=4200*0,5*(50-20) = 63 000 Дж = 63 кДж.
Ответ: Q=63 кДж.
Задача 2. Какое количество теплоты потребуется для нагревания алюминиевого бруска массой 0,5 кг на 85 0С?
Дано:
m = 0,5 кг.,
с = 920 Дж/кг*0С,
t1 = 0 0С,
t2 = 85 0С.
Решение:
количество теплоты определяется по формуле Q=c*m*(t2-t1).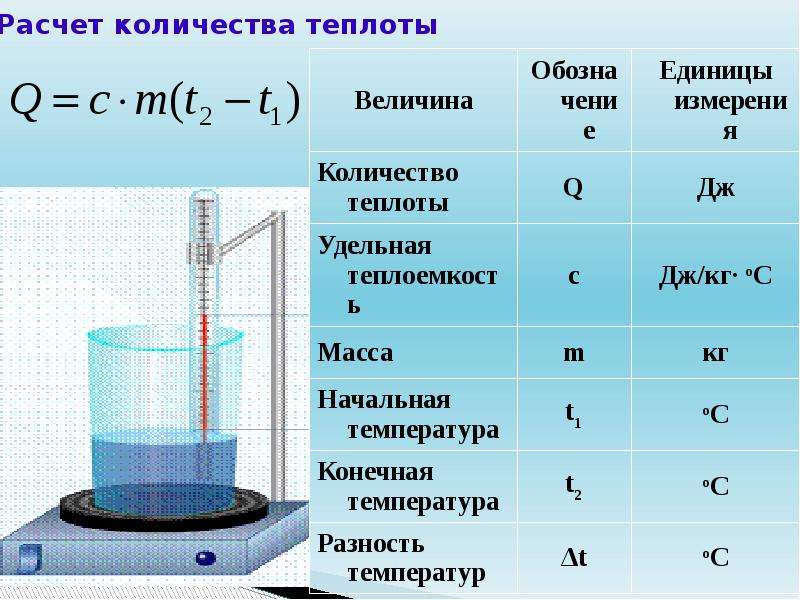
Подставляем значения:
Q=920*0,5*(85-0) = 39 100 Дж = 39,1 кДж.
Ответ: Q= 39,1 кДж.
Единицы теплоты
“…- Сколько попугаев в тебе поместится, такой у тебя рост.
– Очень надо! Я не стану глотать столько попугаев!…”
Из м/ф “38 попугаев”
В соответствии с международными правилами СИ (международная система единиц измерения) количество тепловой энергии или количество тепла измеряется в Джоулях [Дж], также существуют кратные единицы килоДжоуль [кДж] = 1000 Дж., МегаДжоуль [МДж] = 1 000 000 Дж, ГигаДжоуль [ГДж] = 1 000 000 000 Дж. и пр. Эта единица измерения тепловой энергии является основной международной единицей и наиболее часто используется при проведении научных и научно-технических расчётов.
Однако, все из нас знают или хотя бы раз слышали и другую единицу измерения количества теплоты (или просто тепла) это калория, а также килокалория, Мегакалория и Гигакалория, что означают приставки кило, Гига и Мега, смотреть пример с Джоулями выше. В нашей стране исторически сложилось так, что при расчёте тарифов за отопление, будь то отопление электроэнергией, газовыми или пеллетными котлами принято считать стоимость именно одной Гигакалории тепловой энергии.
В нашей стране исторически сложилось так, что при расчёте тарифов за отопление, будь то отопление электроэнергией, газовыми или пеллетными котлами принято считать стоимость именно одной Гигакалории тепловой энергии.
Так что же такое Гигакалория, килоВатт, килоВатт*час или килоВатт/час и Джоули и как они связаны между собой?, вы узнаете в этой статье.
Итак, основная единица тепловой энергии это, как уже было сказано, Джоуль. Но прежде чем говорить об единицах измерения необходимо в принципе на бытовом уровне разъяснить что такое тепловая энергия и как и для чего её измерять.
Всем нам с детства известно, чтобы согреться (получить тепловую энергию) нужно что-то поджечь, поэтому все мы жгли костры, традиционное топливо для костра – это дрова. Таким образом, очевидно, при горении топлива (любого: дрова, уголь, пеллеты, природный газ, солярка) выделяется тепловая энергия (тепло). Но, чтобы нагреть, к примеру, различные объёмы воды требуется разное количество дров (или иного топлива). Ясно, что для нагрева двух литров воды достаточно нескольких пален в костре, а чтобы приготовить полведра супа на весь лагерь, нужно запастись несколькими вязанками дров. Чтобы не измерять такие строгие технические величины, как количество теплоты и теплота сгорания топлива вязанками дров и вёдрами с супом, теплотехники решили внести ясность и порядок и договорились выдумать единицу количества теплоты. Чтобы эта единица была везде одинаковая её определили так: для нагрева одного килограмма воды на один градус при нормальных условиях (атмосферном давлении) требуется 4 190 калорий, или 4,19 килокалории, следовательно, чтобы нагреть один грамм воды будет достаточно в тысячу раз меньше теплоты – 4,19 калории.
Ясно, что для нагрева двух литров воды достаточно нескольких пален в костре, а чтобы приготовить полведра супа на весь лагерь, нужно запастись несколькими вязанками дров. Чтобы не измерять такие строгие технические величины, как количество теплоты и теплота сгорания топлива вязанками дров и вёдрами с супом, теплотехники решили внести ясность и порядок и договорились выдумать единицу количества теплоты. Чтобы эта единица была везде одинаковая её определили так: для нагрева одного килограмма воды на один градус при нормальных условиях (атмосферном давлении) требуется 4 190 калорий, или 4,19 килокалории, следовательно, чтобы нагреть один грамм воды будет достаточно в тысячу раз меньше теплоты – 4,19 калории.
Калория связана с международной единицей тепловой энергии – Джоулем следующим соотношением:
1 калория = 4,19 Джоуля.
Таким образом, для нагрева 1 грамма воды на один градус потребуется 4,19 Джоуля тепловой энергии, а для нагрева одного килограмма воды 4 190 Джоулей тепла.
В технике, наряду с единицей измерения тепловой (и всякой другой) энергии существует единица мощности и, в соответствии с международной системой (СИ) это Ватт. Понятие мощности также применимо и к нагревательным приборам. Если нагревательный прибор способен отдать за 1 секунду 1 Джоуль тепловой энергии, то его мощность равна 1 Ватт. Мощность, это способность прибора производить (создавать) определённое количество энергии (в нашем случае тепловой энергии) в единицу времени. Вернёмся к нашему примеру с водой, чтобы нагреть один килограмм (или один литр, в случае с водой килограмм равен литру) воды на один градус Цельсия (или Кельвина, без разницы) нам потребуется мощность 1 килокалория или 4 190 Дж. тепловой энергии. Чтобы нагреть один килограмм воды за 1 секунду времени на 1 грдус нам нужен прибор следующей мощности:
4190 Дж./1 с. = 4 190 Вт. или 4,19 кВт.
Если мы хотим нагреть наш килограмм воды на 25 градусов за ту же секунду, то нам потребуется мощность в двадцать пять раз больше т.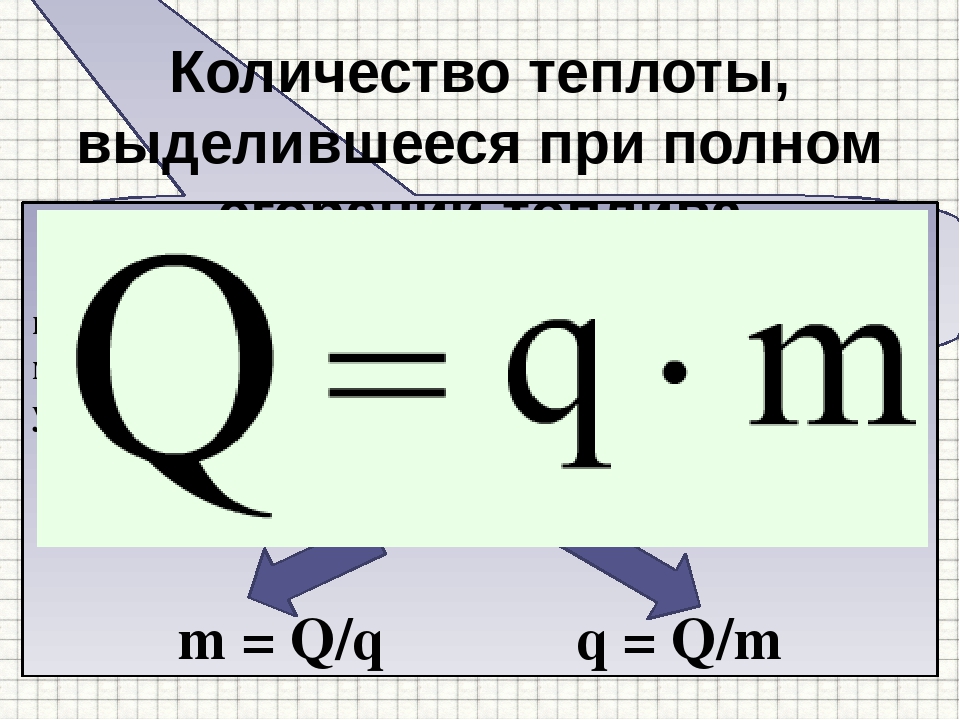 е.
е.
4,19*25 =104,75 кВт.
Таким образом, можно сделать вывод, что пеллетный котёл мощностью 104,75 кВт. нагревает 1 литр воды на 25 градусов за одну секунду.
Раз мы добрались до Ватт и килоВатт, следует и о них словечко замолвить. Как уже было сказано Ватт – это единица мощности, в том числе и тепловой мощности котла, но ведь кроме пеллетных котлов и газовых котлов человечеству знакомы и электрокотлы, мощность которых измеряется, разумеется, в тех же килоВаттах и потребляют они не пеллеты и не газ, а электроэнергию, количество которой измеряется в килоВатт часах. Правильное написание единицы энергии килоВатт*час (именно, килоВатт умножить на час, а не разделить), запись кВт/час – является ошибкой!
В электрокотлах электрическая энергия преобразуется в тепловую (так называемое, Джоулево тепло), и , если котёл потребил 1 кВт*час электроэнергии, то сколько же он выработал тепла? Чтобы ответить на это простой вопрос, нужно выполнить простой расчёт.
Преобразуем килоВатты в килоДжоули/секунды (килоДжоуль в секунду), а часы в секунды: в одном часе 3 600 секунд, получим:
1 кВт*час =[ 1 кДж/с]*3600 c. =1 000 Дж *3600 с = 3 600 000 Джоулей или 3,6 МДж.
=1 000 Дж *3600 с = 3 600 000 Джоулей или 3,6 МДж.
Итак,
1 кВт*час = 3,6 МДж.
В свою очередь, 3,6 МДж/4,19 = 0,859 Мкал = 859 ккал = 859 000 кал. Энергии (тепловой).
Теперь перейдём к Гигакалории, цену которой на различных видах топлива любят считать теплотехники.
1 Гкал = 1 000 000 000 кал.
1 000 000 000 кал. = 4,19*1 000 000 000 = 4 190 000 000 Дж.= 4 190 МДж. = 4,19 ГДж.
Или зная, что 1 кВт*час = 3,6 МДж пересчитаем 1 Гигакалорию на килоВатт*часы:
1 Гкал = 4190 МДж/3,6 МДж = 1 163 кВт*часов!
Если прочитав данную статью вы решили, проконсультироваться со специалистом нашей компании по любому вопросу, связанному с теплоснабжением, то вам Сюда!
Тепло — Химия LibreTexts
Тепло — это количество энергии , которое передается от одной системы к ее окружению из-за разницы температур.
История теплопередачи
В 1822 году Жан-Батист Жозеф Фурье основал закон теплопередачи Фурье. Он смог прийти к этому закону с помощью математических выражений и показал, как теплопроводность в телах может быть проанализирована с помощью математических рядов. Закон Фурье о теплопередаче гласит, что скорость передачи тепла через тело пропорциональна отрицательному градиенту температуры в теле.
Он смог прийти к этому закону с помощью математических выражений и показал, как теплопроводность в телах может быть проанализирована с помощью математических рядов. Закон Фурье о теплопередаче гласит, что скорость передачи тепла через тело пропорциональна отрицательному градиенту температуры в теле.
Первый закон термодинамики
Первый закон термодинамики, также известный как закон сохранения Ene rgy , гласит, что полная энергия остается постоянной между взаимодействиями системы и ее окружения. По сути, энергии не может быть создано или уничтожено . Математическая модель этого приведена ниже.
\ [q_ {System} + q_ {Surroundings} = 0 \]
Когда две системы или тела соединяются, тепло как энергия передается от более горячего тела к более холодному телу .В результате молекулы более горячего тела теряют кинетическую энергию в пользу более холодного тела. Затем это приводит к потоку тепла между телами, более холодное тело будет иметь повышенную температуру, а более горячее тело понизится.
Затем это приводит к потоку тепла между телами, более холодное тело будет иметь повышенную температуру, а более горячее тело понизится.
Факторы, от которых зависит количество тепла, необходимое для изменения температуры вещества:
- Величина изменения температуры
- Количество вещества
- Тип вещества
- Компоненты: тип атомов / молекул
Смена фаз и нагрев
Во-первых, тепло вызывает разницы в температуре , когда тепло течет от одного тела к другому.Теплообмен может также вызвать изменение состояния вещества . Например, нагревание H 2 O (s) (лед) заставит молекулы двигаться с большей скоростью. Увеличение скорости нарушило бы межмолекулярные силы и заставило бы твердое тело превратить фазу в жидкость, где межмолекулярные силы не такие сильные и ограничивающие, как в твердом теле.
Можно также посмотреть на фазовые диаграммы, чтобы увидеть, как тепло и давление влияют на изменения фаз. Фазовая диаграмма — это графическое представление условий температуры и давления, при которых твердые тела, жидкости и газы существуют либо в виде отдельных фаз, либо состояний вещества, либо в виде двух или более фаз, находящихся в равновесии друг с другом. На следующем рисунке показан пример фазовой диаграммы:
Фазовая диаграмма — это графическое представление условий температуры и давления, при которых твердые тела, жидкости и газы существуют либо в виде отдельных фаз, либо состояний вещества, либо в виде двух или более фаз, находящихся в равновесии друг с другом. На следующем рисунке показан пример фазовой диаграммы:
Можно также посмотреть на кривые нагрева, чтобы увидеть изменение температуры по мере добавления тепла. Ниже приведен пример кривой нагрева. Обратите внимание, что при изменении фазы температура не меняется.
Тепл. Ед.
калорий — это количество тепла, необходимое для изменения температуры 1 г воды на 1 градус Цельсия. килокалорий (1 кКал = 1000 кал) — это единица тепла, с которой мы обычно сталкиваемся в повседневной жизни, например, на обратной стороне коробки с хлопьями. Обратите внимание, что калории обозначаются строчной буквой «c», а килокалории обозначаются заглавной буквой «C».
Калория также связана с единицей энергии СИ, джоулей .
1 кал = 4,184 джоулей
Британская тепловая единица (БТЕ) также используется для определения количества тепла, необходимого для подъема одного фунта воды на один градус по Фаренгейту.
1 БТЕ = 252 калории = 1055 джоулей
Тепловая мощность
Теплоемкость — это количество тепла, обычно выражаемое в Джоулях или калориях, необходимое для изменения системы на 1 градус Цельсия. Удельная теплоемкость — это количество тепла, необходимое для подъема 1 грамма вещества на 1 градус Цельсия.
Например, удельная теплоемкость H 2 O (л) составляет 4,18 Дж / г ° C.
- \ (C_p \) обозначает удельную теплоемкость для удельной теплоемкости при постоянном давлении.
- \ (C_v \) обозначает удельную теплоемкость для удельной теплоемкости при постоянном объеме.
Расчет количества тепла
Чтобы рассчитать количество тепла, необходимое для подъема чего-либо при определенном изменении температуры, нам потребуется определенная информация.
- Изменение температуры
- Количество вещества (только для использования с C p или C v )
- Обычно дается в граммах или молях вещества.
- Удельная теплоемкость или теплоемкость
Теперь мы можем использовать следующую формулу для определения количества необходимого тепла.
\ [q = m \, C_p \, \ Delta {T} \]
или
\ [q = C_p \ Delta {T} \]
Где,
- \ (q \) = Количество тепла
- \ (m \) = Масса вещества
- \ (\ Delta {T} \) = Изменение температуры
- \ (C_p \) = удельная / молярная теплоемкость
- \ (C \) = Теплоемкость (не зависит от массы)
Помните, что вам не всегда нужно использовать удельную или молярную теплоемкость.Для нахождения энергии можно использовать обычную теплоемкость, и в этом случае количество вещества не является необходимой информацией. Это когда вы использовали бы второе уравнение.
Упражнение \ (\ PageIndex {1} \)
Учитывая 500 г H 2 O (л) , сколько тепла требуется для повышения температуры H 2 O (л) с 8 ° C до 88 ° C?
- Ответ
Ответы находятся в разделе прикрепленных файлов.
Список литературы
- Биндель, Т. Х., Фочи, Дж. К. «Управляемое открытие: закон удельной теплоты». J. Chem. Educ. 1997 : 74, 955.
- Кимбро, Дорис Р. «Теплоемкость, температура тела и гипотермия». J. Chem. Educ. 1998 : 75, 48.
- Петруччи и др. Общие принципы химии и современные приложения . 9 изд. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2007
- Engel, et al. Физическая химия для наук о жизни . Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2008
- Смит, Э. Брайан. Основы химической термодинамики .
 5-е изд. Лондон: Imperial College Press, 2004
5-е изд. Лондон: Imperial College Press, 2004 - Stolen, et al. Химическая термодинамика материалов макроскопические и микроскопические аспекты . Западный Суссекс, Англия: John Wiley & Sons Ltd, 2004
- «тепло». Британская энциклопедия. 2008. Британская энциклопедия онлайн. 31 мая 2008 г.,
- «удельная теплоемкость.»Encyclopdia Britannica. 2008. Encyclopdia Britannica Online. 31 мая 2008 г.
- «Британская тепловая единица». Британская энциклопедия. 2008. Британская энциклопедия онлайн. 31 мая 2008 г.,
- «Теплопередача», Интернет-энциклопедия Microsoft® Encarta® 2008 uk.encarta.msn.com © 1997-2008
- AP HS Chemistry . Интернет. 11 марта 2010 г. http://aphschem.blogspot.com/2009/10…curve-lab.html Unit Operations in Food Processing — R. L. Earle. NZIFST — Новозеландский институт пищевых наук и технологий .Интернет. 11 марта 2010 г.
Как рассчитать количество выделяемого тепла
Обновлено 12 февраля 2020 г.
Клэр Гиллеспи
Проверено: Lana Bandoim, B.S.
Некоторые химические реакции выделяют энергию за счет тепла. Другими словами, они передают тепло своему окружению. Они известны как экзотермических реакций: «Экзо» относится к внешним или внешним, а «термический» означает тепло.
Некоторые примеры экзотермических реакций включают горение (горение), реакции окисления (ржавление) и реакции нейтрализации между кислотами и щелочами. Многие предметы повседневного обихода, такие как грелки для рук и самонагревающиеся банки для кофе и других горячих напитков, подвергаются экзотермическим реакциям.
TL; DR (слишком долго; не читал)
Для расчета количества тепла, выделяемого в химической реакции, используйте уравнение Q = mc ΔT , где Q — тепловая энергия перенесенная (в джоулях), м — масса нагреваемой жидкости (в килограммах), c — удельная теплоемкость жидкости (джоуль на килограмм градусов Цельсия), а ΔT — изменение температуры жидкости (градусы Цельсия).
Разница между теплом и температурой
Важно помнить, что температура и тепло — это не одно и то же. Температура — это мера того, насколько что-то горячее, измеряется в градусах Цельсия или Фаренгейта, а тепла — это мера тепловой энергии, содержащейся в объекте, измеряется в джоулях.
Когда тепловая энергия передается объекту, его повышение температуры зависит от:
- массы объекта
- вещества, из которого сделан объект
- количества энергии, приложенной к объекту
Чем больше тепловой энергии переносится на объект, тем больше увеличивается его температура.
Удельная теплоемкость
Удельная теплоемкость ( c ) вещества — это количество энергии, необходимое для изменения температуры 1 кг вещества на 1 единицу температуры. Различные вещества имеют разную удельную теплоемкость, например, вода имеет удельную теплоемкость 4 181 джоулей / кг градусов Цельсия, кислород имеет удельную теплоемкость 918 джоулей / кг градусов Цельсия, а свинец имеет удельную теплоемкость 128 джоулей / кг градусов C.
Калькулятор тепловой энергии
Для расчета энергии, необходимой для повышения температуры вещества с известной массой, используется формула удельной теплоемкости:
Q — переданная энергия в джоулях, м — масса веществ в кг, c — удельная теплоемкость в Дж / кг градусов C, а ΔT — изменение температуры в градусах C в формуле удельной теплоемкости.
Калькулятор тепловыделения
Представьте, что 100 г кислоты были смешаны со 100 г щелочи, что привело к повышению температуры с 24 до 32 градусов Цельсия.
Уравнение реакции нейтрализации между кислотой и щелочью может быть уменьшено до:
H + + OH — -> h3O
Используемая формула: Q = mc ∆T
Масса = м = 100 г + 100 г / 1000 г на кг = 0,2 г (одна значащая цифра)
Удельная теплоемкость воды = c = 4,186 Дж / кг градусов C
Изменение температуры = ΔT = 24 градуса C — 32 градуса C = -8 градусов C
Q = (0.2 кг) (4,186 Дж / кг ° C) (-8 ° C)
Q = -6,688 Дж, что означает выделение 6688 джоулей тепла.
Урок физики
На предыдущей странице мы узнали, что тепло делает с объектом, когда оно накапливается или выделяется. Прирост или потеря тепла приводят к изменениям температуры, изменению состояния или выполнения работы. Тепло — это передача энергии. Когда объект приобретает или теряет его, внутри этого объекта будут соответствующие изменения энергии. Изменение температуры связано с изменением средней кинетической энергии частиц внутри объекта.Изменение состояния связано с изменением внутренней потенциальной энергии, которой обладает объект. А когда работа сделана, происходит полная передача энергии объекту, над которым она выполняется. В этой части Урока 2 мы рассмотрим вопрос . Как измерить количество тепла, полученного или выделенного объектом?
Удельная теплоемкость
Предположим, что несколько объектов, состоящих из разных материалов, нагреваются одинаково.Будут ли предметы нагреваться одинаково? Ответ: скорее всего, нет. Разные материалы будут нагреваться с разной скоростью, потому что каждый материал имеет свою удельную теплоемкость. Удельная теплоемкость относится к количеству тепла, необходимому для изменения температуры единицы массы (скажем, грамма или килограмма) на 1 ° C. В учебниках часто указывается удельная теплоемкость различных материалов. Стандартные метрические единицы — Джоуль / килограмм / Кельвин (Дж / кг / К). Чаще используются единицы измерения — Дж / г / ° C.Используйте виджет ниже, чтобы просмотреть удельную теплоемкость различных материалов. Просто введите название вещества (алюминий, железо, медь, вода, метанол, дерево и т. Д.) И нажмите кнопку «Отправить»; результаты будут отображаться в отдельном окне.
Удельная теплоемкость твердого алюминия (0,904 Дж / г / ° C) отличается от удельной теплоемкости твердого железа (0,449 Дж / г / ° C). Это означает, что для повышения температуры данной массы алюминия на 1 ° C потребуется больше тепла, чем для повышения температуры той же массы железа на 1 ° C.Фактически, для повышения температуры образца алюминия на заданное количество потребуется примерно вдвое больше тепла по сравнению с тем же изменением температуры того же количества железа. Это связано с тем, что удельная теплоемкость алюминия почти вдвое больше, чем у железа.
Теплоемкость указана из расчета на грамм или на килограмм . Иногда значение указывается из расчета на моль, и в этом случае оно называется молярной теплоемкостью. Тот факт, что они перечислены на основе на сумму , указывает на то, что количество тепла, необходимое для повышения температуры вещества, зависит от того, сколько вещества имеется.Эту истину, несомненно, знает всякий, кто варил на плите кастрюлю с водой. Вода закипает при температуре 100 ° C на уровне моря и при слегка пониженной температуре на возвышенностях. Чтобы довести кастрюлю с водой до кипения, ее сначала нужно поднять до 100 ° C. Это изменение температуры достигается за счет поглощения тепла горелкой печи. Быстро замечаешь, что для того, чтобы довести до кипения полную кастрюлю с водой, требуется значительно больше времени, чем для того, чтобы довести до кипения наполовину полную. Это связано с тем, что полная кастрюля с водой должна поглощать больше тепла, чтобы вызвать такое же изменение температуры.Фактически, требуется вдвое больше тепла, чтобы вызвать такое же изменение температуры в двойной массе воды.
Удельная теплоемкость также указана из расчета на K или на ° C. Тот факт, что удельная теплоемкость указана из расчета на градус , указывает на то, что количество тепла, необходимое для повышения данной массы вещества до определенной температуры, зависит от изменения температуры, необходимого для достижения этой конечной температуры.Другими словами, важна не конечная температура, а общее изменение температуры. Для изменения температуры воды с 20 ° C до 100 ° C (изменение на 80 ° C) требуется больше тепла, чем для повышения температуры того же количества воды с 60 ° C до 100 ° C (изменение на 40 ° C). ° С). Фактически, для изменения температуры данной массы воды на 80 ° C требуется вдвое больше тепла по сравнению с изменением на 40 ° C. Человек, который хочет быстрее довести воду до кипения на плите, должен начать с теплой водопроводной воды вместо холодной.
Это обсуждение удельной теплоемкости заслуживает одного заключительного комментария. Термин «удельная теплоемкость» в некоторой степени похож на неправильное обозначение . Этот термин означает, что вещества могут иметь способность содержать вещь , называемую теплотой. Как уже говорилось ранее, тепло — это не то, что содержится в объекте. Тепло — это то, что передается к объекту или от него. Объекты содержат энергию в самых разных формах. Когда эта энергия передается другим объектам с разной температурой, мы называем переданную энергию тепловой или тепловой энергией .Хотя это вряд ли приживется, более подходящим термином будет удельная энергоемкость.
Связь количества тепла с изменением температуры
Удельная теплоемкость позволяет математически связать количество тепловой энергии, полученной (или потерянной) образцом любого вещества, с массой образца и ее результирующим изменением температуры. Связь между этими четырьмя величинами часто выражается следующим уравнением.
Q = m • C • ΔT
где Q — количество тепла, переданного объекту или от объекта, m — масса объекта, C — удельная теплоемкость материала, из которого состоит объект, а ΔT — результирующее изменение температуры объекта. Как и во всех других ситуациях в науке, значение дельта (∆) для любой величины вычисляется путем вычитания начального значения количества из окончательного значения количества. В этом случае ΔT равно T конечный — T начальный .При использовании приведенного выше уравнения значение Q может быть положительным или отрицательным. Как всегда, положительный и отрицательный результат расчета имеет физическое значение. Положительное значение Q указывает, что объект получил тепловую энергию из окружающей среды; это соответствовало бы повышению температуры и положительному значению ΔT. Отрицательное значение Q указывает на то, что объект выделяет тепловую энергию в окружающую среду; это соответствовало бы снижению температуры и отрицательному значению ΔT.
Знание любых трех из этих четырех величин позволяет человеку вычислить четвертое количество. Обычная задача на многих уроках физики включает решение проблем, связанных с отношениями между этими четырьмя величинами. В качестве примеров рассмотрим две проблемы ниже. Решение каждой проблемы разработано для вас. Дополнительную практику можно найти в разделе «Проверьте свое понимание» внизу страницы.
Пример задачи 1 |
Как и любая проблема в физике, решение начинается с определения известных величин и соотнесения их с символами, используемыми в соответствующем уравнении. В этой задаче мы знаем следующее:
м = 450 г
С = 4,18 Дж / г / ° C
T начальная = 15 ° C
T окончательная = 85 ° C
Мы хотим определить значение Q — количество тепла.Для этого мы использовали бы уравнение Q = m • C • ΔT. Буквы m и C известны; ΔT можно определить по начальной и конечной температуре.
T = T окончательный — T начальный = 85 ° C — 15 ° C = 70 ° C
Зная три из четырех величин соответствующего уравнения, мы можем подставить и решить для Q.
Q = m • C • ΔT = (450 г) • (4,18 Дж / г / ° C) • (70 ° C)
Q = 131670 Дж
Q = 1.3×10 5 J = 130 кДж (округлено до двух значащих цифр)
Пример задачи 2 |
По сравнению с предыдущей проблемой это гораздо более сложная проблема. По сути, эта проблема похожа на две проблемы в одной. В основе стратегии решения проблем лежит признание того, что количество тепла, теряемого водой (Q вода ), равно количеству тепла, полученного металлом (Q металл ). Поскольку значения m, C и ΔT воды известны, можно вычислить Q water .Это значение Q воды равно значению металла Q . Как только значение металла Q известно, его можно использовать со значением m и ΔT металла для расчета металла Q . Использование этой стратегии приводит к следующему решению:
Часть 1: Определение потерь тепла водой
Дано:
м = 50,0 г
С = 4,18 Дж / г / ° C
T начальная = 88,6 ° C
Т финальный = 87.1 ° С
ΔT = -1,5 ° C (T конечный — T начальный )
Решить для Q воды :
Q вода = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (-1,5 ° C)
Q вода = -313,5 Дж (без заземления)
(Знак — означает, что вода теряет тепло)
Часть 2: Определите стоимость металла C
Дано:
Q металл = 313.5 Дж (используйте знак +, так как металл нагревается)
m = 12,9 г
T начальный = 26,5 ° C
T окончательная = 87,1 ° C
ΔT = (T конечный — T начальный )
Решить для C металл :
Переставьте Q из металла = m из металла • C из металла • ΔT из металла , чтобы получить C из металла = Q из металла / (м из металла • ΔT из металла )
C металл = Q металл / (м металл • ΔT металл ) = (313.5 Дж) / [(12,9 г) • (60,6 ° C)]
C металл = 0,40103 Дж / г / ° C
C металл = 0,40 Дж / г / ° C (округлено до двух значащих цифр)
Тепло и изменения состояния
Приведенное выше обсуждение и соответствующее уравнение (Q = m • C • ∆T) связывает тепло, полученное или потерянное объектом, с результирующими изменениями температуры этого объекта. Как мы узнали, иногда тепло накапливается или теряется, но температура не меняется.Это тот случай, когда вещество претерпевает изменение состояния. Итак, теперь мы должны исследовать математику, связанную с изменениями состояния и количества тепла.
Чтобы начать обсуждение, давайте рассмотрим различные изменения состояния, которые можно наблюдать для образца вещества. В таблице ниже перечислены несколько изменений состояния и указаны имена, обычно связанные с каждым процессом.
Процесс | Изменение состояния |
Плавка | От твердого до жидкого |
Замораживание | От жидкости к твердому веществу |
Испарение | От жидкости к газу |
Конденсация | Газ — жидкость |
Сублимация | Твердое тело в газ |
Депонирование | Газ в твердое вещество |
В случае плавления, кипения и сублимации к образцу вещества должна быть добавлена энергия, чтобы вызвать изменение состояния.Такие изменения состояния называют эндотермическими. Замораживание, конденсация и осаждение экзотермичны; энергия высвобождается образцом материи, когда происходят эти изменения состояния. Таким образом, можно заметить, что образец льда (твердая вода) тает, когда его помещают на горелку или рядом с ней. Тепло передается от горелки к образцу льда; энергия приобретается льдом, вызывая изменение состояния. Но сколько энергии потребуется, чтобы вызвать такое изменение состояния? Есть ли математическая формула, которая могла бы помочь в определении ответа на этот вопрос? Безусловно, есть.
Количество энергии, необходимое для изменения состояния образца материи, зависит от трех вещей. Это зависит от того, что такое субстанция, от того, сколько субстанции претерпевает изменение состояния, и от того, какое изменение состояния происходит. Например, для плавления льда (твердая вода) требуется другое количество энергии, чем для плавления железа. И для таяния льда (твердая вода) требуется другое количество энергии, чем для испарения того же количества жидкой воды. И, наконец, для плавления 10 требуется другое количество энергии.0 граммов льда по сравнению с таянием 100,0 граммов льда. Вещество, процесс и количество вещества — это три переменные, которые влияют на количество энергии, необходимое для того, чтобы вызвать конкретное изменение состояния. Используйте виджет ниже, чтобы исследовать влияние вещества и процесса на изменение энергии. (Обратите внимание, что теплота плавления — это изменение энергии, связанное с изменением состояния твердое-жидкое.)
Значения удельной теплоты плавления и удельной теплоты испарения указаны из расчета на количество .Например, удельная теплота плавления воды составляет 333 Дж / грамм. Чтобы растопить 1,0 грамм льда, требуется 333 Дж энергии. Чтобы растопить 10 граммов льда, требуется в 10 раз больше энергии — 3330 Дж. Такое рассуждение приводит к следующим формулам, связывающим количество тепла с массой вещества и теплотой плавления и испарения.
Для плавления и замораживания: Q = m • ΔH сварка
Для испарения и конденсации: Q = m • ΔH испарение
где Q представляет количество энергии, полученной или высвобожденной во время процесса, m представляет собой массу образца, ΔH плавления представляет собой удельную теплоту плавления (на грамм) и ΔH испарения представляет собой удельную теплоемкость плавления. испарение (из расчета на грамм).Подобно обсуждению Q = m • C • ΔT, значения Q могут быть как положительными, так и отрицательными. Значения Q положительны для процесса плавления и испарения; это согласуется с тем фактом, что образец вещества должен набирать энергию, чтобы плавиться или испаряться. Значения Q отрицательны для процесса замораживания и конденсации; это согласуется с тем фактом, что образец вещества должен терять энергию, чтобы замерзнуть или конденсироваться.
В качестве иллюстрации того, как можно использовать эти уравнения, рассмотрим следующие два примера задач.
Пример задачи 3 |
Уравнение, связывающее массу (48,2 грамма), теплоту плавления (333 Дж / г) и количество энергии (Q): Q = m • ΔH fusion .Подстановка известных значений в уравнение приводит к ответу.
Q = м • ΔH сварка = (48,2 г) • (333 Дж / г)
Q = 16050,6 Дж
Q = 1,61 x 10 4 Дж = 16,1 кДж (округлено до трех значащих цифр)
Пример Задачи 3 включает в себя довольно простой расчет типа plug-and-chug. Теперь мы попробуем пример задачи 4, который потребует более глубокого анализа.
Пример задачи 4 |
В этой задаче лед тает, а жидкая вода остывает. Энергия передается от жидкости к твердому телу. Чтобы растопить твердый лед, на каждый грамм льда необходимо передать 333 Дж энергии. Эта передача энергии от жидкой воды ко льду охлаждает жидкость.Но жидкость может охладиться только до 0 ° C — точки замерзания воды. При этой температуре жидкость начнет затвердевать (замерзнуть), а лед полностью не растает.
Мы знаем следующее о льду и жидкой воде:
Информация о льду:
м = 50,0 г
ΔH плавление = 333 Дж / г
Информация о жидкой воде:
С = 4.18 Дж / г / ° C
T начальный = 26,5 ° C
T окончательный = 0,0 ° C
ΔT = -26,5 ° C (T конечный — T начальный )
Энергия, полученная льдом, равна энергии, потерянной из воды.
Q лед = -Q жидкая вода
Знак — указывает, что один объект получает энергию, а другой объект теряет энергию. Мы можем вычислить левую часть приведенного выше уравнения следующим образом:
Q лед = m • ΔH плавление = (50.0 г) • (333 Дж / г)
Q лед = 16650 Дж
Теперь мы можем установить правую часть уравнения равной m • C • ΔT и начать подставлять известные значения C и ΔT, чтобы найти массу жидкой воды. Решение:
16650 Дж = -Q жидкая вода
16650 Дж = -м жидкая вода • C жидкая вода • ΔT жидкая вода
16650 Дж = -м жидкая вода • (4.18 Дж / г / ° C) • (-26,5 ° C)
16650 Дж = -м жидкая вода • (-110,77 Дж / ° C)
м жидкая вода = — (16650 Дж) / (- 110,77 Дж / ° C)
м жидкая вода = 150,311 г
м жидкая вода = 1,50×10 2 г (округлено до трех значащих цифр)
Еще раз о кривых нагрева и охлаждения
На предыдущей странице Урока 2 обсуждалась кривая нагрева воды.Кривая нагрева показывала, как температура воды увеличивалась с течением времени по мере нагрева образца воды в твердом состоянии (т. Е. Льда). Мы узнали, что добавление тепла к образцу воды может вызвать либо изменение температуры, либо изменение состояния. При температуре плавления воды добавление тепла вызывает преобразование воды из твердого состояния в жидкое состояние. А при температуре кипения воды добавление тепла вызывает преобразование воды из жидкого состояния в газообразное.Эти изменения состояния произошли без каких-либо изменений температуры. Однако добавление тепла к образцу воды, не имеющей температуры фазового перехода, приведет к изменению температуры.
Теперь мы можем подойти к теме кривых нагрева на более количественной основе. На диаграмме ниже представлена кривая нагрева воды. На нанесенных линиях есть пять помеченных участков.
Три диагональных участка представляют собой изменения температуры пробы воды в твердом состоянии (участок 1), жидком состоянии (участок 3) и газообразном состоянии (участок 5).Две горизонтальные секции представляют изменения в состоянии воды. На участке 2 проба воды тает; твердое вещество превращается в жидкость. В секции 4 образец воды подвергается кипению; жидкость превращается в газ. Количество тепла, передаваемого воде в секциях 1, 3 и 5, связано с массой образца и изменением температуры по формуле Q = m • C • ΔT. А количество тепла, переданного воде в секциях 2 и 4, связано с массой образца и теплотой плавления и испарения по формулам Q = m • ΔH fusion (раздел 2) и Q = m • ΔH испарение (раздел 4).Итак, теперь мы попытаемся вычислить количество тепла, необходимое для перевода 50,0 граммов воды из твердого состояния при -20,0 ° C в газообразное состояние при 120,0 ° C. Для расчета потребуется пять шагов — по одному шагу для каждого раздела приведенного выше графика. Хотя удельная теплоемкость вещества зависит от температуры, в наших расчетах мы будем использовать следующие значения удельной теплоемкости:
Твердая вода: C = 2,00 Дж / г / ° C
Жидкая вода: C = 4,18 Дж / г / ° C
Газообразная вода: C = 2.01 Дж / г / ° C
Наконец, мы будем использовать ранее сообщенные значения ΔH fusion (333 Дж / г) и ΔH испарения (2,23 кДж / г).
Раздел 1 : Изменение температуры твердой воды (льда) с -20,0 ° C до 0,0 ° C.
Используйте Q 1 = m • C • ΔT
, где m = 50,0 г, C = 2,00 Дж / г / ° C, T начальная = -200 ° C и T конечная = 0,0 ° C
Q 1 = m • C • ΔT = (50.0 г) • (2,00 Дж / г / ° C) • (0,0 ° C — -20,0 ° C)
Q 1 = 2,00 x10 3 Дж = 2,00 кДж
Раздел 2 : Таяние льда при 0,0 ° C.
Используйте Q 2 = m • ΔH сварка
, где m = 50,0 г и ΔH плавление = 333 Дж / г
Q 2 = м • ΔH плавление = (50,0 г) • (333 Дж / г)
Q 2 = 1,665 x10 4 Дж = 16.65 кДж
Q 2 = 16,7 кДж (округлено до 3 значащих цифр)
Раздел 3 : Изменение температуры жидкой воды с 0,0 ° C на 100,0 ° C.
Используйте Q 3 = m • C • ΔT
, где m = 50,0 г, C = 4,18 Дж / г / ° C, T начальная = 0,0 ° C и T конечная = 100,0 ° C
Q 3 = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (100,0 ° C — 0,0 ° C)
Q 3 = 2.09 x10 4 Дж = 20,9 кДж
Раздел 4 : Кипячение воды при 100,0 ° C.
Используйте Q 4 = m • ΔH испарение
, где m = 50,0 г и ΔH испарение = 2,23 кДж / г
Q 4 = m • ΔH испарение = (50,0 г) • (2,23 кДж / г)
Q 4 = 111,5 кДж
Q 4 = 112 кДж (округлено до 3 значащих цифр)
Раздел 5 : Изменение температуры жидкой воды со 100.От 0 ° C до 120,0 ° C.
Используйте Q 5 = m • C • ΔT
, где m = 50,0 г, C = 2,01 Дж / г / ° C, T начальная = 100,0 ° C и T конечная = 120,0 ° C
Q 5 = m • C • ΔT = (50,0 г) • (2,01 Дж / г / ° C) • (120,0 ° C — 100,0 ° C)
Q 5 = 2,01 x10 3 J = 2,01 кДж
Общее количество тепла, необходимое для превращения твердой воды (льда) при -20 ° C в газообразную воду при 120 ° C, является суммой значений Q для каждого участка графика.То есть
Q итого = Q 1 + Q 2 + Q 3 + Q 4 + Q 5
Суммирование этих пяти значений Q и округление до нужного количества значащих цифр приводит к значению 154 кДж в качестве ответа на исходный вопрос.
В приведенном выше примере есть несколько особенностей решения, над которыми стоит задуматься:
- Первое: длинная задача была разделена на части, каждая из которых представляет собой одну из пяти частей графика.Поскольку было вычислено пять значений Q, они были обозначены как Q 1 , Q 2 и т. Д. Такой уровень организации требуется в многоступенчатой задаче, такой как эта.
- Секунда: внимание было уделено знаку +/- на ΔT. Изменение температуры (или любой величины) всегда рассчитывается как конечное значение величины за вычетом начального значения этой величины.
- Третий: На протяжении всей проблемы внимание уделялось подразделениям.Единицы Q будут либо в Джоулях, либо в килоджоулях, в зависимости от того, какие количества умножаются. Отсутствие внимания к устройствам — частая причина сбоев в подобных проблемах.
- Четвертый: На протяжении всей задачи внимание уделялось значащим цифрам. Хотя это никогда не должно становиться основным акцентом какой-либо проблемы в физике, это, безусловно, деталь, на которую стоит обратить внимание.
Здесь, на этой странице, мы узнали, как рассчитать количество тепла, задействованного в любом процессе нагрева / охлаждения и в любом процессе изменения состояния.Это понимание будет иметь решающее значение, когда мы перейдем к следующей странице Урока 2, посвященной калориметрии. Калориметрия — это наука, связанная с определением изменений энергии системы путем измерения теплообмена с окружающей средой.
Проверьте свое понимание
1. Вода имеет необычно высокую удельную теплоемкость. Какое из следующих утверждений логически следует из этого факта?
а.По сравнению с другими веществами горячая вода вызывает сильные ожоги, потому что она хорошо проводит тепло.
б. По сравнению с другими веществами вода при нагревании быстро нагревается до высоких температур.
c. По сравнению с другими веществами, образец воды требует значительного количества тепла, чтобы изменить ее температуру на небольшое количество.
2. Объясните, почему в больших водоемах, таких как озеро Мичиган, в начале июля может быть довольно прохладно, несмотря на то, что температура наружного воздуха около или выше 90 ° F (32 ° C).
3. В таблице ниже описан термический процесс для различных объектов (выделен красным жирным шрифтом). Для каждого описания укажите, набирается или теряется тепло объектом, является ли процесс эндотермическим или экзотермическим, и является ли Q для указанного объекта положительным или отрицательным значением.
| Процесс | Получено или потеряно тепло? | Эндо- или экзотермический? | Q: + или -? | |
а. | Кубик льда помещают в стакан с лимонадом комнатной температуры, чтобы охладить напиток. | |||
г. | Холодный стакан лимонада стоит на столе для пикника под жарким полуденным солнцем и нагревается до 32 ° F. | |||
г. | Конфорки электрической плиты выключаются и постепенно остывают до комнатной температуры. | |||
г. | Учитель вынимает из термоса большой кусок сухого льда и опускает его в воду. Сухой лед возгоняется, образуя газообразный диоксид углерода. | |||
e. | Водяной пар в увлажненном воздухе ударяется о окно и превращается в каплю росы (каплю жидкой воды). |
4. Образец металлического цинка массой 11,98 грамма помещают в баню с горячей водой и нагревают до 78,4 ° C. Затем его удаляют и помещают в чашку из пенополистирола, содержащую 50,0 мл воды комнатной температуры (T = 27,0 ° C; плотность = 1,00 г / мл). Вода прогревается до температуры 28.1 ° С. Определите удельную теплоемкость цинка.
5. Джейк берет из туалета банку с газировкой и выливает ее в чашку со льдом. Определите количество тепла, теряемого содой комнатной температуры при плавлении 61,9 г льда (ΔH fusion = 333 Дж / г).
6. Теплота сублимации (ΔH сублимация ) сухого льда (твердый диоксид углерода) составляет 570 Дж / г. Определите количество тепла, необходимое для превращения 5,0-фунтового мешка сухого льда в газообразный диоксид углерода.(Дано: 1,00 кг = 2,20 фунта)
7. Определите количество тепла, необходимое для повышения температуры 3,82-граммового образца твердого пара-дихлорбензола с 24 ° C до жидкого состояния при 75 ° C. Пара-дихлорбензол имеет температуру плавления 54 ° C, теплоту плавления 124 Дж / г и удельную теплоемкость 1,01 Дж / г / ° C (твердое состояние) и 1,19 Дж / г / ° C (жидкое состояние).
Удельная теплоемкость
Цель обучения
- Рассчитать изменение температуры вещества с учетом его теплоемкости и энергии, используемой для его нагрева.
Ключевые моменты
- Теплоемкость — это отношение количества тепловой энергии, переданной объекту, к результирующему увеличению его температуры.
- Молярная теплоемкость — это количество тепла, необходимое для повышения температуры одного моля чистого вещества на один градус К.
- Удельная теплоемкость — это количество тепла, необходимое для повышения температуры одного грамма чистого вещества на один градус К.
Условия
- теплоемкость — способность вещества поглощать тепловую энергию; количество тепла, необходимое для повышения температуры одного моля или грамма вещества на один градус Цельсия без какого-либо изменения фазы.{-1} [/ латекс]). Теплоемкость — это обширное свойство, что означает, что она зависит от размера / массы образца. Например, для образца, содержащего в два раза больше вещества, чем для другого образца, потребуется вдвое больше тепловой энергии (Q) для достижения такого же изменения температуры ([латекс] \ Delta T [/ latex]), которое требуется для изменения температура первого образца.
Молярная и удельная теплоемкость
Есть две производные величины, которые определяют теплоемкость как интенсивное свойство (т.е., независимо от размера образца) вещества. Их:
- молярная теплоемкость, которая представляет собой теплоемкость на моль чистого вещества. Молярная теплоемкость часто обозначается CP для обозначения теплоемкости в условиях постоянного давления, а также CV для обозначения теплоемкости в условиях постоянного объема. Единицами молярной теплоемкости являются [латекс] \ frac {J} {K \ bullet mol} [/ латекс].
- удельная теплоемкость, часто называемая просто удельной теплоемкостью, которая представляет собой теплоемкость на единицу массы чистого вещества.Он обозначен как c P и c V , и его единицы измерения указаны в [latex] \ frac {J} {g \ bullet K} [/ latex].
Тепло, энтальпия и температура
Зная молярную теплоемкость или удельную теплоемкость чистого вещества, можно рассчитать количество тепла, необходимое для повышения / понижения температуры этого вещества на заданную величину. Применяются следующие две формулы:
[латекс] q = mc_p \ Delta T [/ латекс]
[латекс] q = nC_P \ Delta T [/ латекс]
В этих уравнениях м — это масса вещества в граммах (используется при расчетах с удельной теплоемкостью), а n — это количество молей вещества (используется при расчетах с молярной теплоемкостью).
Пример
Молярная теплоемкость воды CP равна 75,2
[латекс] \ frac {J} {mol \ bullet K} [/ latex] . Сколько тепла нужно, чтобы поднять температуру 36 граммов воды с 300 до 310 К?Нам дана молярная теплоемкость воды, поэтому нам нужно преобразовать данную массу воды в моль:
[латекс] \ text {36 грамм} \ times \ frac {\ text {1 mol} H_2O} {\ text {18 g}} = \ text {2.0 mol} H_2O [/ latex]
Теперь мы можем подставить наши значения в формулу, которая связывает тепло и теплоемкость:
[латекс] q = nC_P \ Delta T [/ латекс]
[латекс] q = (2.0 \; \ text {mol}) \ left (75.2 \; \ frac {J} {mol \ bullet K} \ right) (10 \; K) [/ latex]
[латекс] q = 1504 \; J [/ латекс]
Интерактивный: определение удельной и скрытой теплоты Удельная теплоемкость — это мера тепловой энергии, необходимой для повышения температуры определенного количества вещества на один кельвин. Скрытая теплота плавления описывает количество тепла, необходимое для плавления твердого вещества. Когда твердое тело плавится, температура в основном остается постоянной до тех пор, пока все твердое вещество не расплавится.Вышеупомянутое моделирование демонстрирует удельную теплоемкость и скрытую теплоту.
Учебник по удельной теплоемкости Этот урок связывает тепло с изменением температуры. В нем обсуждается, как количество тепла, необходимое для изменения температуры, зависит от массы и задействованного вещества, и эта взаимосвязь представлена удельной теплоемкостью вещества C.Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Тепло
Тепло
Тепло
Тепло — это способ передачи энергии между системами
и его окружение, которое часто, но не всегда, меняет
температура системы. Тепло не сохраняется, может быть
либо созданы, либо уничтожены. В метрической системе тепло
измеряется в единицах калорий , которые определяются как
количество тепла, необходимое для повышения температуры одного грамма
вода от 14.5 o C до 15,5 o C.В системе СИ единицей тепла является джоуль .
Тепловая мощность
Теплоемкость вещества — это количество тепла.
требуется для повышения температуры определенного количества чистого
вещества на один градус (Цельсия или Кельвина). Калорийность была
определяется так, чтобы теплоемкость воды была равна единице.Удельная теплоемкость
Удельная теплоемкость вещества — это количество
калорий, необходимых для повышения температуры грамм на 1 o C.Поскольку один градус по шкале Цельсия равен одному Кельвину,
удельная теплоемкость в метрической системе может быть указана в единицах измерения
либо кал / г- o ° С, либо кал / г-К. Единицы теплоемкости
в системе СИ — Дж / г-К. Поскольку в
калорийность, удельная теплоемкость воды составляет 4,184 Дж / г-К.Легкость, с которой вещество приобретает или
теряет тепло, также может быть описано с точки зрения его молярной теплоты
емкость , которая является теплом, необходимым для повышения температуры
один моль вещества либо на 1 o ° C, либо на 1
К.В метрической системе единицами молярной теплоемкости являются
поэтому либо кал / моль- o ° C, либо кал / моль-K. В СИ
В системе единицы молярной теплоемкости — Дж / моль-К.Скрытая тепло
Когда лед нагревается, тепло, которое изначально поступает в систему
используется для растапливания льда. Когда лед тает, температура остается
постоянная при 0 o C. Количество тепла, необходимое для плавления
лед исторически назывался скрытой теплотой плавления .Как только лед растает, температура воды медленно
увеличивается с 0 o C до 100 o C. Но однажды
вода закипает, тепло, которое попадает в образец, используется для
преобразовать жидкость в газ и температуру образца
остается постоянным, пока жидкость не испарится. Количество тепла
требуется для кипячения или испарения жидкости, исторически
называется скрытой теплотой испарения .Более 200 лет назад Джозеф Блэк выделил разумных
тепло и скрытое тепло .Тепло, поднимающее
температура системы может быть определена, но тепло, которое приводит к
изменение состояния системы с твердого на жидкое или
переход от жидкости к газу скрыт. Как скрытое изображение на
фотографическая пленка, которая не была проявлена, или скрытые отпечатки пальцев
что не видно невооруженным глазом, скрытая теплота — это
тепло, которое поступает в систему без изменения температуры
система.Тепло и кинетика
Молекулярная теорияСистема — небольшая часть Вселенной в
которые нас интересуют, например, вода в стакане или газ
застряли в поршне и цилиндре, как показано на рисунках ниже. окружение все остальное
другими словами, остальная вселенная.Система и ее окружение разделены границей .
Тепло передается через границу между системой и ее
окружение.Одним из фундаментальных принципов кинетической теории является
предположение, что средняя кинетическая энергия скопления газа
частиц зависит от температуры газа и ничего больше.Газ становится теплее тогда и только тогда, когда средняя кинетическая энергия
количество частиц газа увеличивается. Тепло, когда повышается температура
системы, увеличивает скорость, с которой
частицы системы движутся, как показано на рисунке ниже.Калькулятор удельной теплоемкости
Этот калькулятор удельной теплоемкости представляет собой инструмент, который определяет теплоемкость нагретого или охлажденного образца. Удельная теплоемкость — это количество тепловой энергии, которое необходимо подать на образец весом 1 кг, чтобы повысить его температуру на 1 K .Прочтите, чтобы узнать, как правильно применить формулу теплоемкости для получения достоверного результата.
Как рассчитать удельную теплоемкость
- Определите, хотите ли вы нагреть образец (дать ему немного тепловой энергии) или охладить (отобрать немного тепловой энергии).
- Укажите количество подаваемой энергии как положительное значение. Если вы хотите охладить образец, введите вычтенную энергию как отрицательное значение. Например, предположим, что мы хотим уменьшить тепловую энергию образца на 63000 Дж.Тогда
Q = -63000 Дж. - Определите разницу температур между начальным и конечным состоянием образца и введите ее в калькулятор теплоемкости. Если образец остынет, разница будет отрицательной, а если нагретой — положительной. Допустим, мы хотим охладить образец на 3 градуса. Тогда
ΔT = -3 K. Вы также можете перейти в расширенный режим , чтобы ввести начальное и конечное значения температуры вручную. - Определите массу образца.Примем
м = 5 кг. - Рассчитайте удельную теплоемкость как
c = Q / (мΔT). В нашем примере это будет равноc = -63000 Дж / (5 кг * -3 K) = 4200 Дж / (кг · K). Это типичная теплоемкость воды.
Если у вас возникли проблемы с единицами измерения, воспользуйтесь нашими калькуляторами преобразования температуры или веса.
Формула теплоемкости
Формула для определения теплоемкости выглядит так:
c = Q / (мΔT)Q— количество подводимого или отведенного тепла (в джоулях),м— масса образца, аΔT— разница между начальной и конечной температурами.Теплоемкость измеряется в Дж / (кг · К).Типовые значения удельной теплоемкости
Вам не нужно использовать калькулятор теплоемкости для большинства обычных веществ. Ниже приведены значения удельной теплоемкости некоторых из самых популярных.
- лед:
2,100 Дж / (кг · К) - вода:
4200 Дж / (кг · К) - водяной пар:
2,000 Дж / (кг · К) - базальт:
840 Дж / (кг · К) - гранит:
790 Дж / (кг · К) - алюминий:
890 Дж / (кг · К) - железо:
450 Дж / (кг · К) - медь:
380 Дж / (кг · К) - свинец:
130 Дж / (кг · К)
Имея эту информацию, вы также можете рассчитать, сколько энергии вам нужно подать на образец, чтобы повысить или понизить его температуру.Например, вы можете проверить, сколько тепла вам нужно, чтобы довести до кипения воду, чтобы приготовить макароны.
Хотите знать, что на самом деле означает результат? Воспользуйтесь нашим калькулятором потенциальной энергии, чтобы проверить, насколько высоко вы поднимете образец с таким количеством энергии. Или проверьте, насколько быстро может двигаться образец, с помощью этого калькулятора кинетической энергии.
Что такое удельная теплоемкость при постоянном объеме?
Удельная теплоемкость — это количество тепла или энергии, необходимое для изменения одной единицы массы вещества постоянного объема на 1 ° C .Формула:
Cv = Q / (ΔT ⨉ m).Какова формула удельной теплоемкости?
Формула для удельной теплоемкости,
C, вещества с массойм, равнаC = Q / (м ⨉ ΔT). ГдеQ— добавленная энергия, аΔT— изменение температуры. Удельная теплоемкость во время различных процессов, таких как постоянный объем,Cvи постоянное давление,Cp, связаны друг с другом отношением удельной теплоемкости,ɣ = Cp / Cv, или газовой постояннойR = Cp - CV.В каких единицах указывается удельная теплоемкость?
Удельная теплоемкость измеряется в Дж / кг K или Дж / кг C , поскольку это тепло или энергия, необходимая во время процесса постоянного объема для изменения температуры вещества единицы массы на 1 ° C или 1 ° K. .
Какое значение удельной теплоемкости воды?
Удельная теплоемкость воды составляет 4179 Дж / кг K , количество тепла, необходимое для повышения температуры 1 г воды на 1 градус Кельвина.
В каких британских единицах измерения удельной теплоемкости?
Удельная теплоемкость измеряется в БТЕ / фунт ° F в британских единицах и в Дж / кг K в единицах СИ.
Какое значение удельной теплоемкости меди?
Удельная теплоемкость меди 385 Дж / кг K . Вы можете использовать это значение для оценки энергии, необходимой для нагрева 100 г меди на 5 ° C, то есть Q = m x Cp x ΔT = 0,1 * 385 * 5 = 192,5 Дж.
Какое значение удельной теплоемкости алюминия?
Удельная теплоемкость алюминия 897 Дж / кг K .Это значение почти в 2,3 раза больше теплоемкости меди. Вы можете использовать это значение для оценки энергии, необходимой для нагрева 500 г алюминия на 5 ° C, то есть Q = m x Cp x ΔT = 0,5 * 897 * 5 = 2242,5 Дж.
Тепло, работа и энергия
Тепло (энергия)
Единица измерения тепла (или энергии) в системе СИ составляет джоуль (Дж) .
С разницей температур
Другими единицами измерения тепла являются британская тепловая единица — британская тепловая единица (количество тепла, поднимающее 1 фунт воды на 1 o F ) и Калорийность (количество тепла, чтобы поднять 1 грамм воды на 1 o C ( или 1 K )).
калорий определяется как количество тепла, необходимое для изменения температуры одного грамма жидкой воды на один градус Цельсия (или один градус Кельвина).
1 кал = 4,184 Дж
1 Дж = 1 Вт · с
= (1 Вт · с) (1/3600 ч / с)
= 2,78 10 -4 Вт · ч
= 2,78 10 -7 кВтч
Тепловой поток (мощность)
Теплопередача только в результате разницы температур называется тепловым потоком . Единицы СИ для теплового потока: Дж / с или ватт (Вт) — то же, что и мощность. Один ватт определяется как 1 Дж / с .
Удельная энтальпия
Удельная энтальпия — это мера полной энергии в единицах массы. Обычно используются единицы СИ: Дж / кг или кДж / кг .
Термин относится к общей энергии, обусловленной давлением и температурой текучей среды (например, воды или пара) в любой данный момент времени и при любых условиях.В частности, энтальпия — это сумма внутренней энергии и работы, совершаемой под действием приложенного давления.
Тепловая мощность
Теплоемкость системы составляет
- количество тепла, необходимое для изменения температуры всей системы на один градус .
Удельная теплоемкость
Удельная теплоемкость (= удельная теплоемкость) — это количество тепла, необходимое для изменения температуры на одну единицу массы вещества на на один градус .
Удельная теплоемкость может быть измерена в Дж / г K, Дж / кг K , кДж / кг K, кал / гK или БТЕ / фунт o F и более .
Никогда не используйте табличные значения теплоемкости без проверки единиц фактических значений!
Удельную теплоемкость для обычных продуктов и материалов можно найти в разделе «Свойства материала».
Удельная теплоемкость — постоянное давление
Энтальпия — или внутренняя энергия — вещества зависит от его температуры и давления.
Изменение внутренней энергии относительно изменения температуры при фиксированном давлении — это удельная теплоемкость при постоянном давлении — c p .
Удельная теплоемкость — постоянный объем
Изменение внутренней энергии относительно изменения температуры при фиксированном объеме — это удельная теплоемкость при постоянном объеме — c v .
Если давление не является чрезвычайно высоким, работой, выполняемой приложением давления к твердым телам и жидкостям, можно пренебречь, а энтальпия может быть представлена только компонентом внутренней энергии.Можно сказать, что теплота постоянного объема и теплоты постоянного давления равны.
Для твердых и жидких веществ
c p = c v (1)
Удельная теплоемкость представляет собой количество энергии, необходимое для подъема 1 кг вещества на 1 o C (или 1 K) , и ее можно рассматривать как способность поглощать тепло. Единицы измерения удельной теплоты в системе СИ: Дж / кг · К (кДж / кг, o C) .Вода имеет большую удельную теплоемкость 4,19 кДж / кг o C по сравнению со многими другими жидкостями и материалами.
- Вода — хороший теплоноситель!
Количество тепла, необходимое для повышения температуры
Количество тепла, необходимое для нагрева объекта от одного температурного уровня до другого, может быть выражено как:
Q = c p m dT ( 2)
, где
Q = количество тепла (кДж)
c p = удельная теплоемкость (кДж / кг · К)
м масса = масса = )
dT = разница температур между горячей и холодной стороной (K)
Пример воды для отопления
Рассмотрим энергию, необходимую для нагрева 1.0 кг воды от 0 o C до 100 o C при удельной теплоемкости воды 4,19 кДж / кг o C :
Q = (4,19 кДж / кг o C ) (1,0 кг) ((100 o C) — (0 o C))
= 419 (кДж)
Work
С технической точки зрения работа и энергия — одно и то же, но работа — это результат, когда направленная сила (вектор) перемещает объект в одном направлении.
Объем выполненной механической работы можно определить с помощью уравнения, полученного из механики Ньютона
Работа = Приложенная сила x Расстояние, перемещенное в направлении силы
или
W = F л (3)
, где
W = работа (Нм, Дж)
F = приложенная сила (Н)
l = длина или пройденное расстояние (м)
Рабочий стол также может быть описан как произведение приложенного давления и перемещенного объема:
Работа = Приложенное давление x Вытесненный объем
или
W = p A l (3b)
где
p = приложенное давление (Н / м 2 , Па)
A = под давлением площадь (м 2 )
l = длина или расстояние, на которое зона давления перемещается под действием приложенной силы (м)
Пример — Работа, выполняемая силой
Работа, выполняемая силой 100 Н перемещение тела 50 м можно рассчитать как
W = (100 Н) (50 м)
= 5000 (Нм, Дж)
Единица измерения работы — джоуль, J, который определяется как количество работы, выполненной, когда сила 1 ньютон действует на расстоянии 1 м в направлении силы.
1 Дж = 1 Нм
Пример — Работа под действием силы тяжести
Работа, выполненная при подъеме массы 100 кг на высоте 10 м может быть рассчитана как
W = F г ч
= mgh
= (100 кг) (9,81 м / с 2 ) (10 м)
= 9810 (Нм, J) (Нм, J) 912
, где
F г = сила тяжести — или вес (Н)
г = ускорение свободного падения 9.81 (м / с 2 )
h = высота (м)
В британских единицах измерения единичная работа выполняется при весе 1 фунт f (фунт-сила) поднимается вертикально против силы тяжести на расстояние 1 фут . Единица называется фунт-фут .
Поднят объект массой 10 снарядов 10 футов . Проделанная работа может быть рассчитана как
W = F г h
= m g h
= (10 пробок) (32.17405 фут / с 2 ) (10 футов)
= 3217 фунтов f футов
Пример — Работа, связанная с изменением скорости
Работа, выполненная при массе 100 кг ускоряется от от скорости 10 м / с до скорости 20 м / с можно рассчитать как
W = (v 2 2 — v 1 2 ) м / 2
= ((20 м / с) 2 — (10 м / с) 2 ) (100 кг) / 2
= 15000 (Нм, Дж)
где
v 2 = конечная скорость (м / с)
v 1 = начальная скорость (м / с)
Energy
Energy — это способность делать работа (перевод с греческого — «работа внутри»).Единицей измерения работы и энергии в системе СИ является джоуль, определяемый как 1 Нм .
Движущиеся объекты могут выполнять работу, потому что обладают кинетической энергией.

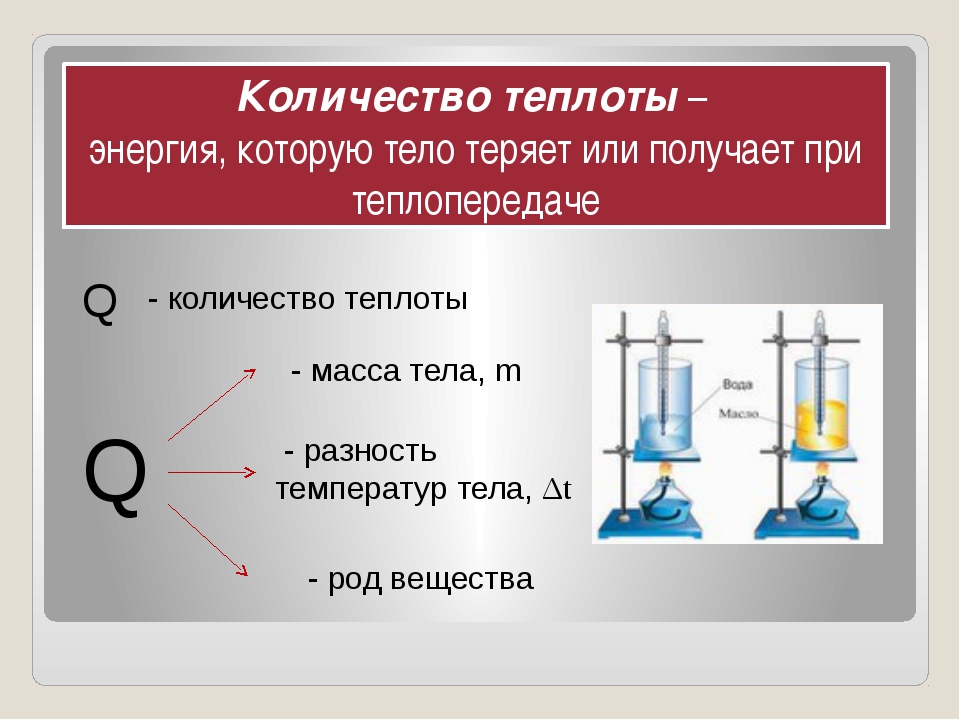 Теплота выделяется при сгорании топлива.
Теплота выделяется при сгорании топлива.


 5-е изд. Лондон: Imperial College Press, 2004
5-е изд. Лондон: Imperial College Press, 2004