Содержание
Явление гомологии и гомологические ряды
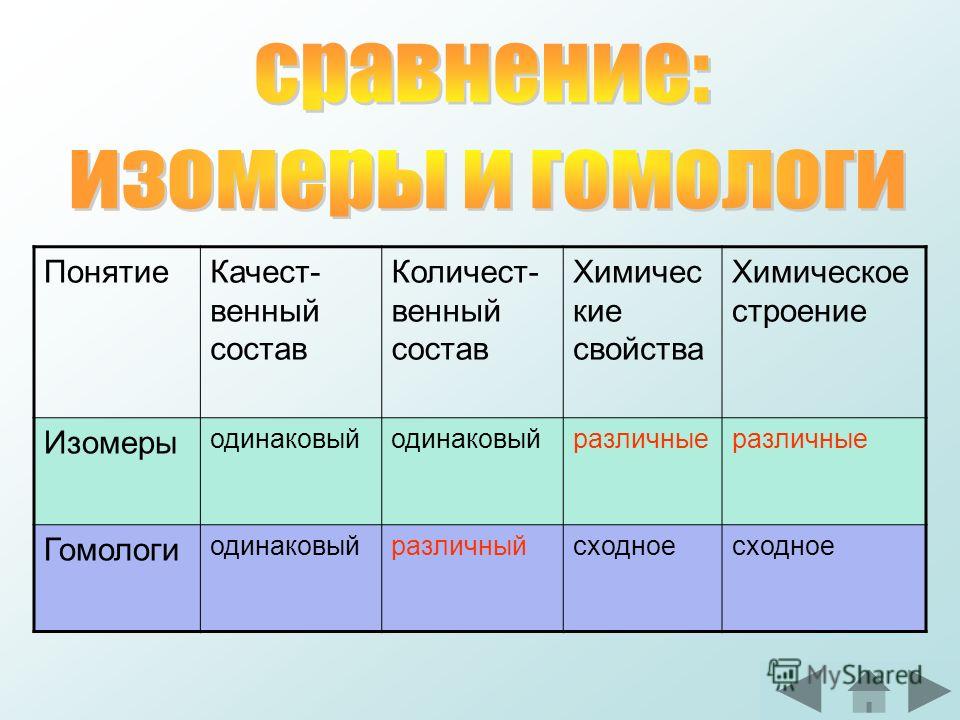
При выводе каждого следующего члена полученного нами ряда веществ мы отнимали от молекулы предыдущего вещества атом водорода и замещали его на остаток —СН3, т. е. прибавляли группу —СН2—, содержащую один атом углерода и два атома водорода. Так как состав метана можно выразить формулой С1Н2+2, то состав следующего члена ряда выразится формулой С2Н2·2+2 и т. д. если допустить, что атомы углерода могут соединяться в молекулах в неограниченном количестве, то мы получим бесконечный ряд веществ, состав которых может быть выражен общей формулой CnH2n+2. Такой бесконечный ряд веществ, каждый последующий член которого отличается от предыдущего на группу СН2, носит название гомологического ряда; каждый член этого ряда является гомологом предыдущих и, естественно, гомологом первого члена ряда — метана.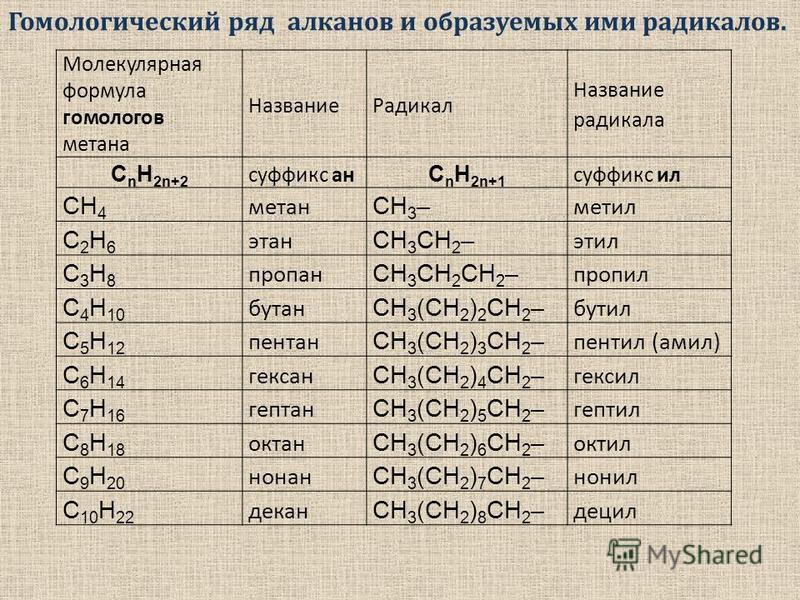 Разница в составе двух соседних членов гомологического ряда (группа СН2) носит название гомологической разности. Все члены гомологического ряда обладают сходными химическими свойствами вследствие сходства их химического строения. Таким образом, гомологами называются вещества, отличающиеся друг от друга по составу на любое число групп СН2, обладающие сходным химическим строением и, следовательно, сходными химическими свойствами.
Разница в составе двух соседних членов гомологического ряда (группа СН2) носит название гомологической разности. Все члены гомологического ряда обладают сходными химическими свойствами вследствие сходства их химического строения. Таким образом, гомологами называются вещества, отличающиеся друг от друга по составу на любое число групп СН2, обладающие сходным химическим строением и, следовательно, сходными химическими свойствами.
Каждый последующий гомолог может быть выведен из предыдущего путем замещения на метильную группу атома водорода, связанного с углеродным атомом углеродного скелета, или путем внедрения метиленовой группы между двумя углеродными атомами скелета.
Понятие гомологии играет важнейшую роль в систематизации и классификации материала органической химии, позволяя свести рассмотрение огромного числа отдельных органических соединений к рассмотрению целых гомологических рядов, все члены которых обладают сходным химическим строением, а следовательно, и сходными химическими свойствами (гомологический ряд углеводородов, ряд спиртов, ряд кислот и т. д.). Подробнее о гомологии см. в книге Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
д.). Подробнее о гомологии см. в книге Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
Предыдущая страница |
Сдедующая страница
СОДЕРЖАНИЕ
Еще по теме:
Гомология в химии — это… Что такое Гомология в химии?
Гомология органических соединений, или закон гомологов, состоит в том, что вещества одной химической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишь на nCH2, оказываются сводными и во всем своем остальном хим. характере, а различие их физических свойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе, определяемой числом n групп СН2. Такие хим. сходственные соединения образуют так наз. гомологический ряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от состава первого члена ряда и числа атомов углерода; напр. ряд предельных углеводородов выражается формулою СnH2n+2, ряд олефинов СnH2n, ряд ацетилена СnH2n-2, ряд бензола СnH2n-1, ряд предельных одноатомных спиртов СnH2n+2O, аминов СnH2n+3N, нитрилов CnH2n-1N, альдегидов CnH2nO, одноосновных кислот СnH2nО2, двухосновных кислот CnH2n-2O4 и т. п. Для примера приведем несколько членов ряда предельных углеводородов: метан СН4, этан C2H6, пропан С3Н8, бутан С4Н10, пентан С5H12, гексан C6H14 и т. д. Сходство между членами (гомологами) каждого ряда таково, что, зная свойства и превращения одного, можно наперед знать свойства и превращения и всех прочих членов этого ряда. С другой стороны, если имеем гомологический ряд, в котором недостает некоторых промежуточных членов, то на основании правильности изменения физических свойств при последовательном переходе от низших членов ряда к высшим является возможность с точностью предсказать все свойства этих недостающих и еще неизвестных членов. Отсюда — важность закона гомологов, ибо он не только обобщает состав соединений, позволяя изображать ряды их общими формулами, но и их свойства и приводит их в закономерную зависимость от состава. Все члены гомологических рядов производятся от простейшего по составу через последовательное замещение водорода в нем группою СН3 (метил) и не только численно, но и фактически, на опыте, могут быть получены из него таким путем, чем устанавливается генетическая связь между всеми членами одного Г.
п. Для примера приведем несколько членов ряда предельных углеводородов: метан СН4, этан C2H6, пропан С3Н8, бутан С4Н10, пентан С5H12, гексан C6H14 и т. д. Сходство между членами (гомологами) каждого ряда таково, что, зная свойства и превращения одного, можно наперед знать свойства и превращения и всех прочих членов этого ряда. С другой стороны, если имеем гомологический ряд, в котором недостает некоторых промежуточных членов, то на основании правильности изменения физических свойств при последовательном переходе от низших членов ряда к высшим является возможность с точностью предсказать все свойства этих недостающих и еще неизвестных членов. Отсюда — важность закона гомологов, ибо он не только обобщает состав соединений, позволяя изображать ряды их общими формулами, но и их свойства и приводит их в закономерную зависимость от состава. Все члены гомологических рядов производятся от простейшего по составу через последовательное замещение водорода в нем группою СН3 (метил) и не только численно, но и фактически, на опыте, могут быть получены из него таким путем, чем устанавливается генетическая связь между всеми членами одного Г. ряда. Физические свойства в рядах гомологов изменяются таким образом, что большею частью удельные веса и объемы, температуры кипения и плавления, теплоты горения и образования, эквиваленты лучепреломления и пр. возрастают постепенно от члена к члену, по мере увеличения числа атомов углерода; иногда происходит и обратное, примеры чему представляются в уменьшении удельных весов бензольных углеводородов, предельных одноосновных кислот и др. с увеличением числа атомов С; иногда, наконец, свойство изменяется так, что для первых членов ряда величина его падает, а затем вновь возрастает, как это наблюдается для удельного веса предельных одноатомных спиртов или для температуры плавления нормальных предельных одноосновных кислот, где влияние состава представляется еще более сложным. Часто первый член ряда представляет отступление от общей правильности. Так, гомологическая разность температуры кипения предельных спиртов вообще близка к 19°, очень медленно уменьшаясь с увеличением С, а разность между температурой кипения СН4O и C2H6O равна 14°; то же представляет удельный вес бензола, слишком большой сравнительно с прочими членами его ряда.
ряда. Физические свойства в рядах гомологов изменяются таким образом, что большею частью удельные веса и объемы, температуры кипения и плавления, теплоты горения и образования, эквиваленты лучепреломления и пр. возрастают постепенно от члена к члену, по мере увеличения числа атомов углерода; иногда происходит и обратное, примеры чему представляются в уменьшении удельных весов бензольных углеводородов, предельных одноосновных кислот и др. с увеличением числа атомов С; иногда, наконец, свойство изменяется так, что для первых членов ряда величина его падает, а затем вновь возрастает, как это наблюдается для удельного веса предельных одноатомных спиртов или для температуры плавления нормальных предельных одноосновных кислот, где влияние состава представляется еще более сложным. Часто первый член ряда представляет отступление от общей правильности. Так, гомологическая разность температуры кипения предельных спиртов вообще близка к 19°, очень медленно уменьшаясь с увеличением С, а разность между температурой кипения СН4O и C2H6O равна 14°; то же представляет удельный вес бензола, слишком большой сравнительно с прочими членами его ряда. Так как по мере усложнения частиц вследствие введения метильных групп на место водорода гомологическая разность состава СН2, оставаясь постоянною, все менее и менее отражается на процентном составе, то и величина изменения физических свойств между двумя соседними членами (гомологическая разность их свойств) становится все меньшею и меньшею при переходе от низших гомологов к высшим; оттого при графическом изображении изменения физических свойств в зависимости от состава с помощью прямоугольной системы координат, нанося состав по оси абсцисс, а свойства по оси ординат, получаются большею частью кривые, стремящиеся стать параллельными оси абсцисс. Г. органических соединений была выяснена в 50 годах Жераром (см.). Им были впервые установлены гомологические ряды, которые и легли в основу его системы классификации органических соединений. Впоследствии Г. усложнилась вследствие открытия многочисленных случаев изомерии. Гомологические ряды Жерара расчленились в гомологические порядки.
Так как по мере усложнения частиц вследствие введения метильных групп на место водорода гомологическая разность состава СН2, оставаясь постоянною, все менее и менее отражается на процентном составе, то и величина изменения физических свойств между двумя соседними членами (гомологическая разность их свойств) становится все меньшею и меньшею при переходе от низших гомологов к высшим; оттого при графическом изображении изменения физических свойств в зависимости от состава с помощью прямоугольной системы координат, нанося состав по оси абсцисс, а свойства по оси ординат, получаются большею частью кривые, стремящиеся стать параллельными оси абсцисс. Г. органических соединений была выяснена в 50 годах Жераром (см.). Им были впервые установлены гомологические ряды, которые и легли в основу его системы классификации органических соединений. Впоследствии Г. усложнилась вследствие открытия многочисленных случаев изомерии. Гомологические ряды Жерара расчленились в гомологические порядки.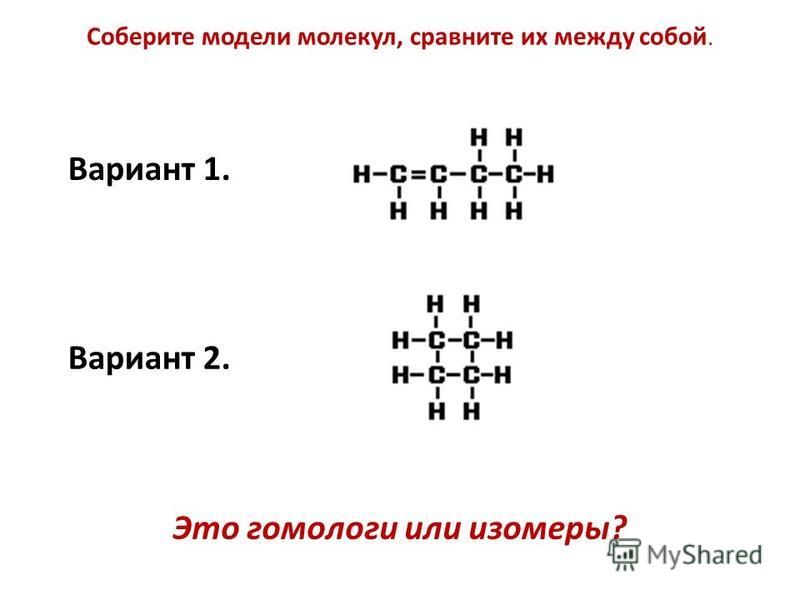 Так, напр., Г. ряд предельных одноатомных спиртов CnH2n+2O распался на порядки первичных, вторичных и третичных спиртов CnH2n+1CH2(НО), (CnH2n+1)2-CH(НО) и (СnH2n+1)3C(НО), которые, в свою очередь, в зависимости от изомерии остатков СnH2n+1 дают новые порядки, напр. первичные спирты образуют порядки нормальных СН3-(СН2)n-СН2(НО) и изоспиртов (СН3)2-CH(СН2)n-СН2(НО) (n = 0, 1, 2…) и т. д.
Так, напр., Г. ряд предельных одноатомных спиртов CnH2n+2O распался на порядки первичных, вторичных и третичных спиртов CnH2n+1CH2(НО), (CnH2n+1)2-CH(НО) и (СnH2n+1)3C(НО), которые, в свою очередь, в зависимости от изомерии остатков СnH2n+1 дают новые порядки, напр. первичные спирты образуют порядки нормальных СН3-(СН2)n-СН2(НО) и изоспиртов (СН3)2-CH(СН2)n-СН2(НО) (n = 0, 1, 2…) и т. д.
П. П. Рубцов. Δ.
|
Класс
| Название урока |
Ссылка на учебные материалы
|
|
10
|
Формирование органической химии как науки.
|
https://resh.edu.ru/subject/lesson/6149/main/170400/
|
|
10
|
Алканы. Состав, строение, гомологический ряд, изомерия, номенклатура
|
https://resh.edu.ru/subject/lesson/6151/main/150012/
|
|
10
|
Физические и химические свойства алканов (на примере метана и этана). Применение на основе свойств
|
https://vk.com/video-130001791_456239025
|
|
10
|
Решение задач на нахождение молекулярной формулы газообразного углеводорода
|
https://www.
|
|
10
|
Алкены. Состав, строение, гомологический ряд, изомерия, номенклатура
|
https://resh.edu.ru/subject/lesson/5412/main/212567/
|
|
10
|
Физические и химические свойства этилена. Применение на базе свойств. Полиэтилен
|
https://resh.edu.ru/subject/lesson/5412/main/212567/
|
|
10
|
Синтетические полимеры. Конденсационные полимеры. Пенопласты
|
https://resh.edu.ru/subject/lesson/6095/main/150826/
|
|
10
|
Алкины.
|
|
|
10
|
Физические и химические свойства ацетилена. Применение на базе свойств. Поливинилхлорид
|
|
|
10
|
Бензол: состав, строение, свойства, применение
|
https://resh.edu.ru/subject/lesson/4775/main/150497/
|
|
10
|
Природные источники углеводородов. Состав нефти и продукты её переработки
|
https://resh.edu.ru/subject/lesson/6148/main/170465/
|
|
10
|
Природный и попутный нефтяной газы, их состав и использование
|
https://resh.
|
|
10
|
Предельные одноатомные спирты. Состав, строение, изомерия, номенклатура. Физиологическое действие метанола и этанола на организм человека
|
https://resh.edu.ru/subject/lesson/4769/main/150554/
|
|
10
|
Свойства метанола и этанола. Применение
|
https://resh.edu.ru/subject/lesson/4769/main/150554/
|
|
10
|
Этиленгликоль и глицерин как представители предельных многоатомных спиртов
|
|
|
10
|
Фенол: строение, свойства, применение
|
https://resh.
|
|
10
|
Метаналь и этаналь – представители предельных альдегидов
|
https://resh.edu.ru/subject/lesson/4776/main/150608/
|
|
10
|
Уксусная кислота как представитель предельных одноосновных карбоновых кислот
|
https://vk.com/video-130001791_456239031
|
|
10
|
Сложные эфиры и жиры. Мыла. Состав, строение, свойства, получение, применение
|
https://resh.edu.ru/subject/lesson/5952/main/150635/
|
|
10
|
Углеводы.
|
https://resh.edu.ru/subject/lesson/6150/main/150691/
|
|
10
|
Сахароза. Крахмал и целлюлоза. Искусственные волокна
|
https://resh.edu.ru/subject/lesson/5413/main/150717/
|
|
10
|
Генетическая связь между классами органических соединений
|
|
|
10
|
Натуральный каучук. Синтетические каучуки
|
https://resh.edu.ru/subject/lesson/6152/main/150853/
|
|
10
|
Аминокислоты как амфотерные органические соединения
|
https://resh.
|
|
10
|
Белки. Состав, структуры белка. Химические свойства. Биохимические функции
|
https://resh.edu.ru/subject/lesson/4743/main/150746/
|
|
10
|
Лекарства. Витамины
|
https://resh.edu.ru/subject/lesson/5452/main/150815/
|
|
10
|
Гормоны. Ферменты
| https://www.youtube.com/ |
|
10
|
Азотосодержащие гетероциклические соединения. Нуклеиновые кислоты
|
https://resh.
|
|
10
|
Органическая химия, человек и природа
|
https://resh.edu.ru/subject/lesson/4823/main/150937/
|
|
11
|
Современная модель строения атома. Электронная конфигурация атома
|
https://resh.edu.ru/subject/lesson/6479/main/150993/
|
|
11
|
Законы сохранения массы и энергии в химии
|
https://resh.edu.ru/subject/lesson/6479/main/150993/
|
|
11
|
Валентность и валентные возможности атомов
|
https://resh.
|
|
11
|
Пространственное строение молекул
|
https://resh.edu.ru/subject/lesson/5911/main/151057/
|
|
11
|
Электронная природа химической связи. Ковалентная связь
|
|
|
11
|
Ионная связь. Металлическая связь. Водородная связь
|
|
|
11
|
Кристаллические и аморфные вещества. Кристаллические решётки. Причины многообразия веществ
|
https://resh.
|
|
11
|
Гомогенные и гетерогенные реакции. Скорость реакций, её зависимость от различных факторов
|
|
|
11
|
Обратимость реакций. Химическое равновесие и его смещение под действием различных факторов
|
|
|
11
|
Дисперсные системы
|
https://resh.edu.ru/subject/lesson/4939/main/151137/
|
|
11
|
Электролитическая диссоциация.
| https://www.youtube.com/ |
|
11
|
Реакции в растворах электролитов
|
|
|
11
|
рН раствора. Гидролиз солей
|
https://resh.edu.ru/subject/lesson/5912/main/92794/
|
|
11
|
Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов
|
|
|
11
|
Принципы химического производства.
|
https://resh.edu.ru/subject/lesson/3514/main/151433/
|
|
11
|
Обзор металлических элементов А- и В- групп
|
https://resh.edu.ru/subject/lesson/5814/main/151240/
|
|
11
|
Общая характеристика и способы получения металлов
|
https://resh.edu.ru/subject/lesson/3493/main/151216/
|
|
11
|
Медь. Цинк. Титан. Хром
|
https://resh.edu.ru/subject/lesson/3534/main/151269/
|
|
11
|
Сплавы металлов
|
https://resh.
|
|
11
|
Коррозия металлов
|
https://resh.edu.ru/subject/lesson/3479/main/151190/
|
|
11
|
Неметаллы. Общая характеристика
|
https://resh.edu.ru/subject/lesson/5939/main/151324/
|
|
11
|
Химические свойства неметаллов
|
https://resh.edu.ru/subject/lesson/5939/main/151324/
|
|
11
|
Электролиз растворов и расплавов солей. Применение электролиза
|
https://resh.
|
|
11
|
Классификация химических реакций
|
https://resh.edu.ru/subject/lesson/4938/main/151110/
|
|
11
|
Свойства оксидов неметаллов. Свойства серной и азотной кислот. Водородные соединения металлов
|
https://resh.edu.ru/subject/lesson/5913/main/151350/
|
|
11
|
Правила безопасной работы с химическими веществами, средствами бытовой химии
|
https://resh.edu.ru/subject/lesson/3504/main/151489/
|
|
11
|
Моющие и чистящие средства.
|
https://resh.edu.ru/subject/lesson/3504/main/151489/
|
|
11
|
Химическое загрязнение окружающей среды и его последствия. Охрана гидросферы, почвы, атмосферы, флоры и фауны от химического загрязнения
|
https://resh.edu.ru/subject/lesson/3504/main/151489/
|
|
11
|
Генетическая связь неорганических и органических веществ
|
https://resh.edu.ru/subject/lesson/4960/main/151378/
|
Гомологи гомология — Справочник химика 21
Соединения, сходные по химическим свойствам, состав которых отличается друг от друга иа группу СН , называются гомологами.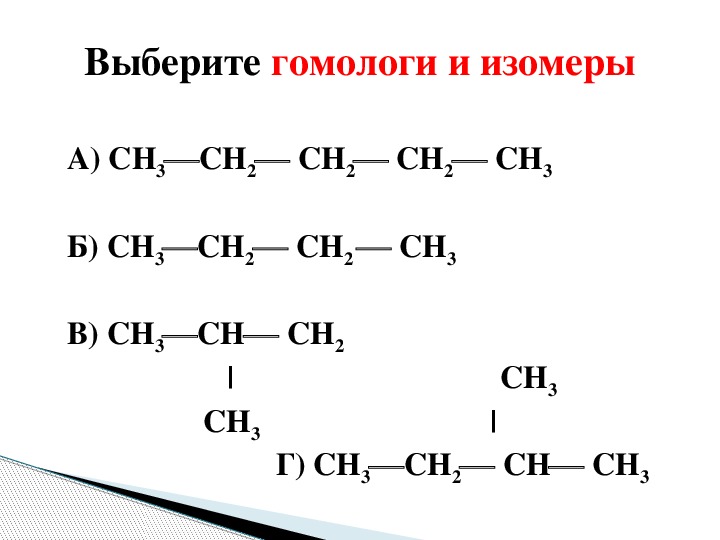 Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд. Группа СНг называется гомологической разностью. [c.276]
Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд. Группа СНг называется гомологической разностью. [c.276]
Соединения, имеющие одинаковые функциональные группы, но отличающиеся числом атомов углерода, обладают весьма похожими физическими и химическими свойствами. Такие соединения называют гомологами. Гомологи — это соединения, принадлежащие одному классу, но отличающиеся друг от друга по составу на целое число групп —СНз. Совокупность всех гомологов образует гомологический ряд. [c.268]
Ряд соединений, обладающих сходным химическим строением, сходными свойствами и отличающихся друг от друга на одну или несколько групп СНа, называется гомологическим рядом, члены этого ряда носят название гомологов (гомология — подобие), разница в составе двух соседних членов ряда — группа СНг — называется гомологической разностью состава. [c. 34]
34]
К н альдегиды Н и альдегиды гомологи гомологи [c.105]
Р Я кетоны R кетоны гомологи гомологи [c.105]
Между сходственными соединениями самый замечательный отдел составляют гомологи, — это ряд соединений, имеюш,их обыкновенно огромный ряд одинаковых реакций, продукты которых суть также гомологи гомологи, кроме сходства реакций, имеют еш,е тот признак, что по составу отличаются на С Н . Открытие гомологов, как известно, принадлежит Жерару. Примеры их столь известны, что не стоит и приводить их. Ряд гомологов можно всегда обозначить обш,ею формулою. Например, ряд гомологов бензойной кислоты С Н >0 можно обозначить обш,ей формулой С Н » 80 . [c.43]
Между сходственными соединениями самый замечательный отдел составляют гомологи, — это ряд соединений, имеющих, обыкновенно, огромный ряд одинаковых реакций, продукты которых суть также гомологи гомологи кроме сходства реакций имеют еще тот признак, что по составу отличаются на С»Н .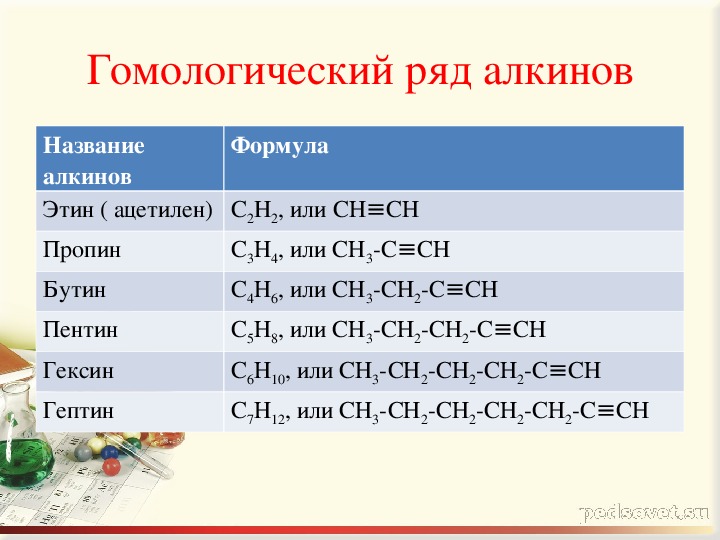 Открытие гомологов, как известно, принадлежит Жерару. Примеры их столь известны, что не стоит [c.112]
Открытие гомологов, как известно, принадлежит Жерару. Примеры их столь известны, что не стоит [c.112]
Исходя из этих соображений, Менделеев следующим образом сформулировал определение гомологии Гомологи имеют одинаковое химическое отправление, дают одинаковые типические реакции, и продукты этих реакций суть тоже гомологи. При этом сходстве в свойствах гомологи имеют различие в составе на СН или на пС Р… [c.19]
Чарлет, Ланио и Джонс нашли среди конденсированных ароматических углеводородов, кроме нафталина и его гомологов, гомологи фенантрена, хризена, бензфенантрена, бензантрацена и пирена. Все эти углеводороды относятся к классу конденсированных через 2 общих углеродных атома, и хотя в нефти были найдены дифенил и 3-метилдифенил, связанные через 1 углеродный атом в каждом кольце, однако углеводороды этого типа не играют в нефти большой роли. [c.122]
Соединения, образующие го.мологпческий ряд, называются гомологами. Гомологи обладают сходным строением, общими химическими свойствами. Их физические свойства закономерно меняются с увеличением молекулярного веса (стр. 43). [c.34]
Гомологи обладают сходным строением, общими химическими свойствами. Их физические свойства закономерно меняются с увеличением молекулярного веса (стр. 43). [c.34]
Понятие гомологии является очень широким и включает в себя строгую гомологию, гомологию с заменами, гомологию с делениями и вставками и т.п.. Кроме того, различают глобальную и локальную постановки задач поиска гомологии. Для решения задач поиска строгой гомологии наиболее эффективными являются методы, связанные с 1-граммным разложением и с построением позиционных деревьев решение задач выравнивания обеспечи- [c.34]
Технологическая карта урока по химии «Алканы»
Сидельникова И.М., учитель химии
МБОУ «Никифоровская СОШ №1»
Технологическая карта урока по химии
Тема урока: «Алканы. Строение молекулы метана. Гомологический ряд алканов. Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств»
Закономерности изменения физических свойств»
Цель урока: организация условий достижения учащимися образовательных результатов по заданной теме:
— приобретение учебной информации,
— контроль усвоения теории,
— применение знаний и умений,
— формирование метапредметных УУД (регулятивных, познавательных, коммуникативных).
Задачи урока: освоение учащимися предметного (теоретического и практического) содержания по теме «Алканы. Строение молекулы метана. Гомологический ряд алканов. Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств»:
— знание определений понятий, понимание взаимосвязей между ними,
— умение применять эти знания и умения для решения практических задач,
— контроль уровня освоения материала,
— развитие метапредметных универсальных учебных действий.
Планируемые образовательные результаты:
Предметные
Знать: особенности электронного и пространственного строение молекулы алканов на примере метана, гомологический ряд предельных углеводородов, изомерию и номенклатуру алканов. Понимать: тетраэдрическое строение молекулы метана на основе представлений о гибридизации; Уметь: называть вещества по «тривиальной» и международной номенклатуре;
Понимать: тетраэдрическое строение молекулы метана на основе представлений о гибридизации; Уметь: называть вещества по «тривиальной» и международной номенклатуре;
применять правила систематической международной номенклатуры как средства различения и идентификации веществ по их составу и строению. Характеризовать строение алканов; различать гомологи и изомеры, составлять формулы и называть их; конструировать модели молекул алканов;
Метапредметные:
Регулятивные
Постановка учащимися учебной задачи на основе сопоставления того, что известно и ранее усвоено, и того, что еще неизвестно. Выбор, принятие и сохранение учебной цели и задач. Составление плана достижения цели, осознанный выбор наиболее эффективных способов решения учебных и познавательных задач. Осуществление самоконтроля и самооценки, осознание качества и уровня усвоения. Саморегуляция учебной деятельности.
Познавательные
Сравнение, обобщение, конкретизация, анализ. Самостоятельное выделение и формулирование познавательной цели. Поиск и выделение необходимой информации. Умение определять понятия, создавать общения, устанавливать аналогии.
Самостоятельное выделение и формулирование познавательной цели. Поиск и выделение необходимой информации. Умение определять понятия, создавать общения, устанавливать аналогии.
Умение структурировать знания и устанавливать причинно-следственные связи, строить логическое рассуждение, умозаключение и делать выводы. Рефлексия способов и условий действия, контроль и оценка процесса и результатов деятельности.
Коммуникативные
Планирование учебного сотрудничества и совместной деятельности с учителем и сверстниками. Умение работать индивидуально и в группе: находить общее решение и разрешать конфликты на основе согласования позиций и учета интересов. Умение формулировать собственное мнение и позицию. Осознанное и произвольное построение речевых высказываний. Восприятие выступлений учащихся. Участие в обсуждении содержания материала. Взаимоконтроль, взаимопроверка, распределение обязанностей в группе. Формирование и развитие компетентности в области использования ИКТ.
Личностные
Формирование целостного мировоззрения, соответствующего современному уровню развития науки. Формирование ответственного отношения к учению, готовности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию. Осознанное осмысление обучающимися связи между целью учебной деятельности и ее мотивом. Осознание возникающих трудностей и стремление к их преодолению. Освоение новых видов деятельности. Формирование ценности безопасного образа жизни, усвоение правил индивидуального и коллективного безопасного поведения.
Организационная структура урока
|
Типовые этапы урока
|
Задачи этапа
|
Деятельность учителя
|
Деятельность учащихся
|
|
Организационный момент
|
Положительный настрой на урок.
|
Приветствует учащихся, проверяет готовность учащихся к уроку.
|
Приветствуют учителя, проверяют готовность к уроку.
|
|
Вхождение в тему урока и создание условий для осознанного восприятия нового материала
|
Повторение и актуализация опорных знаний. Мотивация учебной деятельности.
|
Организует работу по актуализации опорных знаний через выполнение задания по решению задачи на нахождение молекулярной формулы алкана.
Предлагает ответить на вопросы:
1. Какая валентность характерна для атома «С» в органических веществах?
2. Сколько атомов «С» и «Н» входит в состав полученного углеводорода?
Предлагает составить структурную формулу метана и ответить на вопрос интернет-урока №1. «Гомологический ряд алканов. Строение, номенклатура и изомерия алканов»:
Почему алканы часто называют предельными углеводородами?
|
Решают задачи на нахождение молекулярной формулы алкана по его плотности и массовым долям элементов, входящих в его состав.
(для контроля и наглядности один ученик работает у доски).
Отвечают на вопросы учителя (фронтальная работа).
Составляют структурную формулу метана в тетради и отвечают на поставленный вопрос.
|
|
Определение темы, цели и задач урока. Самоопределение в деятельности.
|
Предлагает
вспомнить определение гомологии (гомолог) и изомерии (изомеры) и её виды.
Подводит итог того, что ученики уже многое знают о строении органических веществ. Нацеливает на систематизацию материала. Помогает учащимся сформулировать тему, цель и задачи урока.
|
Работают в парах с материалом МЭО и ЭФУ (используют материал МЭО –
Делают вывод о полученных ранее знаниях.
Определяют тему урока «Алканы. Строение молекулы метана. Гомологический ряд алканов. Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств», ставят цель урока и намечают пути ее достижения через формулировку задач урока.
| |
|
Организация и самоорганизация учащихся в ходе усвоения материала. Организация обратной связи.
|
Организация деятельности учащихся по освоению учебной информации на уровне «знание».
|
Объясняет новую тему в режиме обсуждения с учащимися материала ЭФУ и МЭО занятие 2, интернет-урока №1. «Гомологический ряд алканов. Строение, номенклатура и изомерия алканов»
Организует индивидуальную работу по выполнению интерактивного теста ( ЭФУ)
|
Учащиеся самостоятельно работают с заданием в МЭО и электронным учебником
(Габриелян О. С. Химия. Базовый уровень. 10 класс) Выделяют в ЭФУ цветом особо важную информацию, делают заметки и закладки.
Определяют общую формулу алканов, признаки по которым углеводороды можно отнести к данному классу органических веществ. Формулируют определение алканов.
Работают с электронным учебником (Габриелян О. С. Химия. Базовый уровень. 10 класс) выполняют тест
«Гомологический ряд метана».
Комментируют правильность выполнения теста.
|
|
Первичное осмысление и закрепление связей и отношений объектов. Организация деятельности учащихся по освоению учебной информации на уровне «понимания».
|
Организует работу в группах по изучению учебных модулей и выполнению предложенного задания.
|
Работают в 3-х группах: изучают модули «Строение алканов на примере молекулы метана», «Гомологический ряд алканов. Виды изомерии предельных углеводородов», «Физические свойства алканов» (используют материал МЭО — интернет-урока №1. «Гомологический ряд алканов. Строение, номенклатура и изомерия алканов»
и ЭФУ — параграф 3). Анализируют строение и физические свойства алканов.
По результатам работы делают опорные конспекты.
Каждая группа представляет результаты своей работы. Сравнивают с эталоном (Слайды 13-22 презентации к уроку).
| |
|
Практикум
|
Организация деятельности учащихся по освоению учебной информации на уровне «умения».
|
Организует работу с шаро-стержневыми моделями. Напоминает учащимся о необходимости соблюдения техники безопасности при работе с шаро-стержневыми моделями.
Организует просмотр видео «Модели молекул метана и других углеводородов»
Организует работу в парах по «Изготовление моделей молекул алканов».
Акцентирует внимание школьников на правильности составления формул изомеров и их отличии от гомологов. Обобщение знаний проводится при выполнении заданий на составление формул гомологов и изомеров.
Предлагает выполнить задания из МЭО
Интернет-урок 2. Теория химического строения А.М.Бутлерова. Изомерия и изомеры и Занятие 2. Алканы и циклоаллканы Интернет-урок 1. Гомологический ряд алканов. Строение, номенклатура и изомерия алканов.
|
Повторяют общие правила техники безопасности при работе с шаро-стержневыми моделями.
(Работают с электронным учебником (Габриелян О. С. Химия. Базовый уровень. 10 класс) просмотр динамической шаро-стержневой модели молекулы метана) и просмотр обучающего видео «Модели молекул метана и других углеводородов»
Составляют модели изомеров гексана, называют их по систематической номенклатуре. При этом вспоминают определение изомерии (изомеры) и её видов.
Выполняют задание и составляют формулы изомеров пентана с последующей взаимопроверкой.
Выполняют задание и дают название алкана по систематической номенклатуре с последующей самомопроверкой.
Пытаются ответить на проблемный вопрос: Почему алканы часто называют предельными углеводородами?
|
|
Проверка полученных результатов
|
Организация деятельности учащихся по предъявлению результата освоения учебной информации.
|
Организует состязание между группами на быстроту нахождения ответов на задания.
|
Делятся на 2 группы.
Отвечают на предложенные вопросы.
|
|
Подведение итогов. Домашнее задание.
|
Проведение самоанализа и самооценки собственной деятельности. Обеспечить понимание учащимися цели, содержания и способов выполнения домашнего задания.
|
Делает выводы о работе учащихся.
Выставляет отметки в Дневник.ру
Сообщает и записывает домашнее задание, комментирует его выполнение.
|
Рефлексируют, анализируют, какие умения и навыки отработали и закрепили.
Отмечают домашнее задание в электронном учебнике.
|
Используемая литература:
- Видео «Модели молекул метана и других углеводородов»
- Габриелян О. С. Химия. 10 класс, Базовый уровень. ЭФУ – М.: Дрофа, 2018.
- Мобильное электронное образование
- Хомченко И.Г. Общая химия: Учебник. – М.: ООО «Издательство Новая Волна», 1998.- 464
ГОМОЛОГИЧЕСКИЕ РЯДЫ • Большая российская энциклопедия
В книжной версии
Том 7. Москва, 2007, стр. 388
Скопировать библиографическую ссылку:
Авторы: Л. И. Беленький
ГОМОЛОГИ́ЧЕСКИЕ РЯДЫ́, последовательности химич. соединений с однотипным строением и одинаковыми функциональными группами; каждый член таких последовательностей – гомолог – отличается от соседнего на постоянную структурную единицу, или гомологич. разность, обычно на метиленовую группу $\ce{Ch3}$, как, напр., в Г. р. алканов (общая формула $C_nH_{2n+2}, n=1, 2, \ldots$), алкенов $(C_nH_{2n}, n=2, 3, …)$, насыщенных одноосновных карбоновых кислот $(C_nH_{2n+1}\text{COOH}, n= 0, 1, 2, …)$. Понятие о Г. р., сформулированное Ш. Жераром в 1840-е гг., имеет большое значение в органич. химии, т. к. служит основой классификации органич. соединений.
Существование Г. р. обусловлено способностью атомов углерода соединяться между собой и одновременно с атомами др. элементов ковалентными связями в прочные цепи и циклы. В значительно меньшей степени такой способностью обладают атомы некоторых др. химич. элементов, напр. кремния, который образует Г. р. силанов $\ce{Si_{n}H_{2n +2} (n=1-8)}$ и кремния галогенидов.
Гомологи имеют одинаковые химические и закономерно изменяющиеся физич. свойства. Так, темп-ры кипения соседних гомологов для Г. р. соединений с неразветвлённой цепью в середине ряда $(С_5–С_{14})$ отличаются на 20–30 °C, а каждой добавленной группе $СН_2$ соответствует увеличение теплоты сгорания на 630–660 кДж/моль. У высших членов ряда различия в свойствах соседних гомологов сглаживаются. Иногда химич. и физич. свойства первых членов Г. р. существенно отличаются от свойств пр. членов Г. р., напр. взаимодействие формальдегида со щелочами протекает иначе, чем в случае др. альдегидов, муравьиная кислота значительно сильнее, метанол существенно более токсичен, чем их гомологи.
Некоторые молекулы могут входить в неск. различных Г. р., напр. циклопропан входит в Г. р., образуемый циклическими, или ядерными, гомологами (циклопропан, циклобутан, циклопентан, циклогексан и т. д.), и в ряд цепных гомологов (циклопропан, метилциклопропан, этилциклопропан и др.). Высокомолекулярные соединения образуют полимергомологич. ряды, каждый член которых – полимергомолог – отличается от других числом структурных звеньев (степенью полимеризации).
Наряду с Г. р. в органич. химии выделяют винилогич., генетич. и изологич. ряды. Винилогич. ряды образуют соединения с одинаковыми функциональными группами и сопряжёнными двойными связями; каждый член винилогич. ряда отличается от соседних на виниленовую группу $\ce{СH=СH}$, напр. первыми членами винилогич. ряда альдегидов являются ацетальдегид $\ce{Ch4COH}$, кротоновый $\ce{Ch4СH=СHCOH}$ и сорбиновый $\ce{Ch4СH=СHСH=СHCOH}$ альдегиды. Генетич. ряды образуют органич. соединения с одинаковым числом атомов углерода в молекуле, но с разными функциональными группами, напр. в генетич. ряд этана $\ce{C2H6}$ входят этилхлорид $\ce{C2H5Cl}$, этанол $\ce{C2H5OH}$, этиламин $\ce{C2H5Nh3}$, ацетальдегид $\ce{Ch4CHO}$, уксусная кислота $\ce{Ch4COOH}$ и др. Изологич. ряды образуют органич. соединения, отличающиеся друг от друга только степенью ненасыщенности, напр. этан $\ce{C2H6}$, этилен $\ce{C2h5}$, ацетилен $\ce{C2h3}$.
Гомологи, изомеры. Задачи 5 — 6
Задача 5.
Составить по 2 гомолога и по 2 изомера для каждого вида изомерии
Решение:
например гептадиен-1,3 СН3-СН2-СН2-СН=СН-СН=СН2
гомологи:
СН3-СН2-СН=СН-СН=СН2 гексадиен-1,3
СН3-СН2-СН2-СН2-СН=СН-СН=СН2 октадиен-1,3
изомеры углеродного скелета:
СН3-СН (СН3)-СН=СН-СН=СН2 5-метилгексадиен-1,3
СН3-СН2-СН=С(СН3)-СН=СН2 3-метилгексадиен-1,3
положения кратных связей
СН3-СН2-СН=СН-СН2-СН=СН2 гептадиен-1,4
СН3-СН=СН-СН2-СН2-СН=СН2 гептадиен-1,5
межклассовая изомерия
СН3-СН2-СН2-СН2-СН2-С СН гептин-1
СН3-СН2-СН2-С С-СН2-СН3 гептин-3
Горение этана
Задача 6.
Этан C2H6 объёмом (н. у.) 2,24 дм3 сожгли в избытке кислорода. Рассчитайте: объёмы (н. у.) прореагировавшего кислорода и образовавшегося углекислого газа.
Решение:
22,4 л – молярный объем газов (Vm) при нормальных условиях.
Уравнение реакции:
2С2Н6 + 7О2 = 4СО2 + 6Н2О
или
С2Н6 + 7/2О2 = 2СО2 + 3Н2О
Из уравнения реакции вытекает, что в реакции учавствуют 1 моль С2Н6, 3,5 моль О2 и 2 моль СО2
Рассчитаем колличество С2Н6 по условию задачи, получим:
n(C2H6) = V(C2H6)/Vm = 2,24л/22,4л/моль = 0,1 моль.
Тогда
n(O2) = 3,5n(C2H6) = 3,5 . 0,1 = 0,35 моль;
n(СO2) = 2n(C2H6) = 2 . 0,1 = 0,2 моль.
Теперь рассчитаем объёмы (н. у.) прореагировавшего кислорода и образовавшегося углекислого газа, получим:
V(O2) = n(O2) . Vm = 0,35 . 22,4 = 7,84 л;
V(СO2) = n(СO2) * Vm = 0,2 . 22,4 = 4,48 л.
Ответ: V(O2) = 7,84 л; V(СO2) = 4,48 л.
Гомологическая серия
: определение и идентификация — видео и стенограмма урока
Что такое гомологичная серия?
Гомологическая серия в органической химии представляет собой группу органических соединений (соединений, содержащих атомы C), которые отличаются друг от друга одной метиленовой (Ch3) группой. Например, метан, этан и пропан являются частью гомологического ряда. Единственное различие между этими молекулами состоит в том, что они имеют разное количество групп Ch3.
Каждый член гомологического ряда называется гомологом , что также может быть записано как «гомолог».» Например, метан и этан являются гомологами и принадлежат к одному гомологическому ряду. Они отличаются друг от друга на одну группу Ch3. Формула метана — Ch5, а формула этана — C2 H6.
Химические свойства
Гомологи обладают схожими химическими свойствами, поскольку функциональная группа молекулы не изменяется. Помните, что функциональная группа — это просто область молекулы, которая реакционноспособна или может изменяться в химических реакциях. Поскольку функциональная группа одинакова для каждой молекулы в гомологичном ряду, гомологи обладают сходной реакционной способностью.Некоторыми примерами функциональных групп в гомологическом ряду являются спирты (-OH), карбоновые кислоты (-COOH), альдегиды (COH), кетоны (C = O) и амины (N), среди многих других. Поэтому, когда вы хотите идентифицировать гомологи, функциональная группа будет такой же. Единственное, что изменится, — это длина углеродной цепи.
Физические свойства
Итак, если функциональная группа не меняется, чем интересны гомологические серии? Что они могут рассказать нам о молекулах? Причина, по которой гомологические ряды интересны при изучении химии, заключается в том, что если есть изменение в физических свойствах, это связано с дополнительной метиленовой группой.
Например, точка кипения пентана составляет 36,1 ° C, в то время как точка кипения гомолога гексана составляет 68,7 ° C. Что вызывает такой скачок температуры кипения на 30 градусов? Оба являются алканами (все атомы C и H связаны одинарными связями). У них нет разных функциональных групп, поэтому это не может быть причиной увеличения. Повышение температуры кипения происходит из-за увеличения лондонских сил дисперсии или притяжения между молекулами. В гексане больше атомов углерода и водорода, чем в пентане, поэтому у него больше лондонских дисперсионных сил.Чтобы разрушить притяжение и перевести молекулы из жидкого состояния в газовое, требуется больше энергии, поэтому температура кипения увеличивается.
Другие типы гомологичных серий
Гомологические серии не ограничиваются только органическими соединениями. Есть некоторые неорганические молекулы, которые тоже могут иметь гомологические ряды! Например, у силанов есть гомологические ряды. Вместо того, чтобы различаться по количеству метиленовых групп, они различаются по количеству групп Sih3.
Краткое содержание урока
Гомологический ряд в органической химии — это группы молекул, которые имеют одинаковую базовую структуру, включая одну и ту же функциональную группу .Они различаются только количеством метиленовых (Ch3) групп . Химические свойства гомологических рядов аналогичны, потому что они имеют одну и ту же функциональную группу. Однако физические свойства гомологов отличаются из-за увеличенных лондонских сил дисперсии . Другие молекулы, помимо органических соединений, также могут иметь гомологический ряд. Один из примеров — силаны.
2.8: Углеводороды и гомологичные серии
Задача обучения
- углеводороды классифицируются как насыщенные и ненасыщенные
- классифицирует углеводороды как алканы, алкены, алкины, циклоалканы или ароматические углеводороды (арены)
- применить гомологичный ряд к органическим молекулам с 1-10 атомами углерода
Классификация углеводородов
Углеводороды — это органические соединения, которые содержат только углерода и водорода.Присущая углеводородам способность связываться с самими собой известна как катенация, и позволяет углеводородам образовывать более сложные молекулы, такие как циклогексан и бензол. Связь происходит из-за того, что характер связи между атомами углерода совершенно неполярный.
Четыре основных класса углеводородов: алканы, алкены, алкины и арены. Ароматические соединения получили свои названия из-за того, что многие из этих соединений на заре открытия были сгруппированы, потому что они были маслами с ароматным запахом.Ниже приводится краткое изложение классификации углеводородов.
Насыщенные углеводороды (алканы) являются простейшими из углеводородов. Они полностью состоят из одинарных связей и насыщены водородом. Общая формула для насыщенных углеводородов: C n H 2n +2 (при условии нециклической структуры). Насыщенные углеводороды являются основой нефтяного топлива и встречаются как линейные, так и разветвленные. В простейших алканах атомы углерода связаны в прямую цепь; они называются нормальными алканами.Они названы в соответствии с количеством атомов углерода в цепи. Самый мелкий алкан — метан:
Ненасыщенные углеводороды имеют двойные и / или тройные связи между атомами углерода. Алкены с двойной связью называются алкенами и имеют общую формулу C n H 2n (при условии нециклических структур). Те, которые содержат тройные связи, называются алкинами и имеют общую формулу C n H 2n-2 . Наименьший алкен — этен — имеет два атома углерода и также известен под своим общим названием этилен, а самый маленький алкин — этин, также известный как ацетилен.
Циклоалканы — это углеводороды, содержащие одно или несколько углеродных колец, к которым присоединены атомы водорода. Приставка «цикло» добавляется к имени для обозначения кольцевой структуры. Общая формула насыщенного углеводорода, содержащего одно кольцо, — C n H 2n .
Ароматические углеводороды, также известные как арены, представляют собой углеводороды, содержащие по крайней мере одно ароматическое кольцо. Ароматические соединения содержат бензольное звено. Сам бензол состоит из шести атомов углерода в кольце с чередующимися одинарными и двойными связями C – C:
Для большинства соединений для выяснения их структуры потребуется информация, выходящая за рамки химической формулы.Однако соотношение C: H в химической формуле может дать представление о химической структуре.
Например, давайте рассмотрим некоторые из возможных структур и химических формул углеводородов, содержащих шесть атомов углерода.
Насыщенный алкан имеет самое высокое отношение водорода к углероду. Ненасыщенный алкен и шестичленное алкановое кольцо имеют одну и ту же химическую формулу. Важно помнить об этих отношениях. Ненасыщенный алкин имеет более низкое отношение водорода к углероду, чем алкены со второй пи-связью.Бензольные кольца имеют самое низкое отношение водорода к углероду — 1: 1.
Упражнение
1. Классифицируйте следующие соединения: насыщенные и ненасыщенные. Для ненасыщенных углеводородов уточните классификацию, указав, является ли соединение алкеном, алкином или ареном.
- Ответ
1.
Количество атомов углерода, непрерывно связанных вместе, является важной структурной характеристикой и описывается с помощью гомологичной серии.На первом курсе по органической химии обычно все, что нужно запомнить, — это первые десять имен гомологической серии. Конечно, ваш профессор установит стандарт. Большинство префиксов знакомы по греческим префиксам бинарных ковалентных соединений. Возможно, вам незнакомы префиксы для первых четырех длин углеродной цепи. Интересно, что три из этих углеводородов часто встречаются в повседневной жизни. Метан является основным компонентом метеоризма и является ингредиентом, который воспламеняется при зажигании пукает — не пытайтесь это делать дома.Пропан и бутан являются газами при комнатной температуре. Они хранятся под давлением для создания жидкого состояния. Пропан — это топливо для барбекю, а бутан используется в зажигалках. Суффикс «анэ» используется для различения самой длинной непрерывной углеродной цепи, в то время как более короткие углеродные ответвления (заместители) обозначаются суффиксом «ил».
Упражнение
2. Заполните приведенную ниже таблицу.
| Концентрированная структурная формула | Химическое название |
| пропан | |
| C 6 H 6 | |
| Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3 |
- Ответ
2.
Концентрированная структурная формула Химическое название Канал 3 Канал 2 Канал 3 пропан C 6 H 6 бензол Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3 гексан
Авторы и авторство
Что такое гомологичная серия?
В химии гомологический ряд — это группа соединений, которые имеют один и тот же основной химический состав, но различаются количеством итераций определенного аспекта их структуры.Гомологические ряды часто упоминаются в органической химии, где соединения могут различаться длиной их углеродной цепи. Эти различия могут влиять на физические свойства химикатов, такие как температура кипения.
Повторяющийся блок
Определяющей характеристикой гомологической серии является повторяющийся блок. Например, алкановая группа содержит повторяющееся звено Ch3. Это означает, что соединения идентичны, за исключением количества единиц Ch3 в соединении.Органические соединения также имеют функциональные группы, которые определяют основные свойства соединения. Все соединения в гомологичном ряду имеют одну и ту же функциональную группу с разным количеством повторяющихся звеньев.
Реакция гомологации
Реакция гомологации — это реакция, в которой количество повторяющихся групп соединения увеличивается. В результате соединение становится другим членом своего гомологического ряда. Например, процесс гомологации Ardnt-Eistert используется для увеличения количества повторяющихся звеньев в карбоновой кислоте.В этом случае процесс включает в себя ряд различных реакций, которые изменяют конфигурацию и перегруппировку атомов в молекуле.
Алкановая серия
Алкановая серия представляет собой органическую гомологичную серию, состоящую из повторяющихся единиц Ch3. Каждый алкан имеет два атома водорода в дополнение к его единицам Ch3. Например, первый алкан — это метан, имеющий формулу Ch5. Второй алкан — этан, имеющий два атома углерода. Следовательно, он имеет формулу C2H6; он имеет две группы Ch3 и два дополнительных атома водорода.
Точка кипения
Температура кипения соединений в гомологичном ряду увеличивается по мере добавления дополнительных единиц. Это происходит потому, что площадь поверхности соединения увеличивается, когда увеличивается длина соединения. Функциональная группа соединения определяет его начальную точку кипения. Затем, когда гомологический ряд удлиняется, точка кипения становится немного выше с каждым последующим увеличением повторяющейся единицы.
Гомологичное определение и примеры
Гомологичное определение
прил., həˈmɒləɡəs
Имеющие похожие или соответствующие характеристики. Например, гомологичные структуры — это структуры, имеющие сходные анатомические особенности, но они не обязательно имеют одинаковую функцию.
Гомологичное определение
Что такое гомологичное? В общей науке слово « гомологичный » используется для обозначения степени сходства. Это может быть должность, структура, функция или характеристики. В химии , гомологичный относится к серии молекул или соединений, которые различаются на постоянное приращение.Например, алканы представляют собой гомологичный ряд углеводородов: метан, этан, пропан и так далее.
Они имеют аналогичные химические свойства, которые следуют тенденциям. Например, с увеличением длины их цепи (добавлением CH 2 ) температура кипения также увеличивается.
Что означает гомологичный в биологии и генетике? По сути, оба они определяют гомологичность как наличие соответствующих частей, сходных структур или одинаковых анатомических положений.
В биологии он используется, например, для обозначения частей или структур тела, указывающих на общее эволюционное происхождение, как в « гомологичных структурах ».
В генетике он используется для обозначения пары хромосом, которые имеют аналогичную структуру. Называемые гомологичными хромосомами , они представляют собой хромосомы, которые расположены парами на основе соответствующей длины хромосомы и последовательности гена.
Этимология: от греческого homologos , что означает «согласный», «корреспондент».
Сравнить: гетерологичен.
Гомологичный и гетерологичный
И гетерологичный, и гомологичный являются описательными словами, но имеют противоположные значения. В то время как гомологичный относится к биологическим объектам, имеющим соответствующие или похожие признаки, гетерологичный используется для описания объекта, признаки которого заметно отличаются друг от друга.
Например, гетерологичная опухоль — это опухоль, содержащая цитологические элементы или ткань, отличную от места образования опухоли.Напротив, гомологичная опухоль представляет собой опухоль, состоящую из клеток или ткани, напоминающих ткань, в которой она образуется. (Ссылка 1)
Гомологические примеры
Гомологические структуры
Гомологичные структуры — это части тела организмов, которые имеют одинаковые анатомические особенности, что указывает на общего предка или происхождение в результате развития. У них может быть одна и та же черта, но они не обязательно выполняют одну и ту же функцию. Например, передние конечности летучих мышей и человека являются гомологичными структурами.
Кости передних конечностей летучих мышей такие же, как у людей. Это указывает на общий предковый организм. На рисунке ниже показаны анатомические особенности передних конечностей различных животных. Не только летучие мыши и люди имеют одинаковые компоненты костей передних конечностей.
Кошки, киты, ящерицы и птицы имеют одинаковые или соответствующие кости передних конечностей, а именно плечевую, лучевую, локтевую, запястную и фаланги. Однако у этих передних конечностей у разных животных разные основные функции.
Например, летучие мыши используют свои передние конечности в основном для скольжения. Птицы используют их для полета. Кошки и ящерицы используют их для прогулок и лазанья.
Киты используют их для купания. У людей отсутствует мембрана крыльев, и они двуногие, поэтому их руки могут выполнять множество, но ограниченный набор функций, например тянуться, хвататься, лазать, плавать и так далее.
Гомологичные хромосомы
Гомологичные хромосомы — это парные хромосомы.Хромосомы в паре имеют одинаковую последовательность гена, локусы и расположение центромеры. У них одинаковая хромосомная длина. Тем не менее они могут различаться по аллелям.
Клетка человека, например, имеет в общей сложности 46 хромосом в ядре. Половина из них (23 хромосомы) принадлежит матери, а другая половина (23 хромосомы) — отцу. При оплодотворении эти хромосомы объединяются, образуя новое ядро внутри зиготной клетки, которое впоследствии вырастает и превращается в нового человека.Каждая клетка человеческого тела будет содержать эти два набора хромосом.
22 из этих пар аутосомы и гомологичны. Оставшаяся пара — это пара половых хромосом. Две X-хромосомы также гомологичны, но пара половых хромосом, состоящая из X и Y, будет не гомологичной, а гетерологичной. На диаграмме ниже показан пример.
Связанные термины
Ссылки
- гетерологичная опухоль. (2020). TheFreeDictionary.Com. https: // медицинский словарь.thefreedictionary.com/heterologous+tumor
© BiologyOnline. Контент предоставлен и модерируется редакторами BiologyOnline.
Гомологическая серия — OBHS Science
Гомологическая серия — это группа соединений, которые имеют одну и ту же общую формулу, имеют сходные химические свойства и имеют постепенное изменение физических свойств по мере увеличения количества атомов углерода в соединении.
Соглашение об именах соединений гомологического ряда обычно представляет собой название, данное количеству атомов углерода, а окончание определяется конкретной серией.
например алканы ….. C2H6 называется этаном. Eth- означает два атома углерода и -ane означает, что это алкан.
Номерной ряд выглядит следующим образом:
| Количество атомов углерода | Название | пример | формула | |||||
| 1 | метан | метан | метан | eth- | этен | C 2 H 4 | ||
| 3 | prop- | пропанол | C 3 H 7 OH | но | бутан | C 4 H 10 |
Для вашего GCSE вам необходимо знать следующие серии.Вы должны уметь вспомнить имена, формулы и структуру следующих примеров.
Алканы
Это насыщенные углеводороды. Изготовлен из одинарных ковалентно связанных атомов водорода и углерода.
Общая формула, C n H 2n + 2
метан, CH 4,
этан, C 2 H 6 ,
пропан, C 3 H 8 ,
бутан , C 4 H 10 ,
По мере увеличения длины цепи температура кипения также увеличивается.Их можно разделить фракционной перегонкой.
Алкены
Это ненасыщенные углеводороды, содержащие двойную ковалентную связь
Названия оканчиваются на -ен
Общая формула, C n H 2n
этен, C 2 H 4 ,
пропен, C 3 H6,
Спирты
Все они имеют группу -OH, которая является спиртовой группой на конце углеродной цепи
Названия оканчиваются на -ol
Общая формула, C n H 2n + 1 OH
метанол, CH 3 OH,
этанол C 2 H 5 OH,
пропанол, C 3 H 7 OH,
Карбоновые кислоты
Содержат группу -COOH
Названия оканчиваются на -ойную кислоту
Метановая кислота, HCOOH, иногда называемая муравьиной кислотой
этановая кислота, CH 3 COOH,
иногда называется цетиковая кислота
пропановая кислота, C 2 H 5 COOH,
Гомологичная серия — обзор
Прогнозирование удерживания
Прогнозирование удерживания в пределах гомологического ряда возможно благодаря линейным отношениям, которые обычно наблюдаются между удерживанием параметры, log k, и углеродное число аналитов, n (Рисунок 2).Наклоны линий B для различных серий гомологов, хроматографированных в одних и тех же условиях, очень похожи, тогда как точки пересечения A могут различаться:
Рис. 2. Графики зависимости log k от числа атомов углерода, n , аналита для ВЭЖХ на полифункциональном диоксиде кремния, связанном с C 18 , с чистым метанольным элюентом при 25 ° C: n -алканы (□), метил- n -алканоаты (•) и n -алканолы (○ ). (Перепечатано из Tchapla A, Herson S, Lessellier E и Colin H (1993) Общий взгляд на механизмы взаимодействия молекул в обращенно-фазовой жидкостной хроматографии. Journal of Chromatography A 656: 81–112, с разрешения Elsevier Science.)
[6] logk = A + Bn
Иногда наблюдаются линейные корреляции между параметрами удерживания и дескрипторами молекулярной массы аналитов, которые не являются гомологами. Хороший прогноз удерживания в ряду связанных неполярных аналитов, таких как полиароматические углеводороды (ПАУ) или алкилбензолы, можно получить, используя объем Ван-дер-Ваальса в качестве структурного дескриптора.
Дескрипторы объемности могут учитывать разделение аналитов, когда дисперсионные взаимодействия (взаимодействия Лондона) являются единственными взаимодействиями, эффективными в данной хроматографической системе, или когда различия в полярных взаимодействиях между аналитами несущественны.
Способность аналита принимать участие в полярных взаимодействиях трудно охарактеризовать с помощью одного дескриптора. Следовательно, простой QSRR, включающий дескрипторы полярности аналита, например дипольные моменты редки.
Обычно в хроматографии (за исключением аффинной хроматографии) влияние формы молекул на удерживание имеет второстепенное значение по сравнению с эффектами размера и полярности молекул. В случае плоских / неполярных изомеров ПАУ удерживание линейно связано с дескриптором формы (степенью удлинения молекулы аналита).
Имеется множество отчетов о хороших показателях индекса молекулярной связности (индекса Рэндича) и его модификациях при прогнозировании удерживания конгенерированных аналитов, включая изомеры. Корреляции хороши, когда удерживание происходит на неполярных стационарных фазах, но не когда задействованы полярные фазы. В то время как на неполярных фазах неспецифические дисперсионные взаимодействия определяют различия в удерживании между аналитами, более специфические полярные взаимодействия становятся дискриминационными в случае полярных фаз (и полярных аналитов).
Использование замещающих электронных констант для получения простого QSRR с реальной способностью предсказания удерживания редко удавалось. Более широкое применение в этом отношении находят константы гидрофобности заместителей Ханса, π, и константы фрагментарной гидрофобности Реккера или Ханса-Лео, f . Суммы этих констант (плюс поправки из-за внутримолекулярных взаимодействий) хорошо учитывают удерживание в системах жидкостной хроматографии с обращенной фазой.
Что касается последних систем, даже лучшие прогнозы дает эмпирический параметр — логарифм коэффициента разделения n -октанол – вода, log P .Другой полезный эмпирический предсказатель удерживания иногда оказывается точкой кипения, T b , например, точкой кипения изомерных углеводородов в газовой хроматографии.
Прогнозирование удерживания различных замещенных производных исходных соединений в данной системе разделения может быть основано на правиле Мартина:
[7] logks = logkp + ∑i = 1nτi
В уравнении [7] k P — это Параметр удерживания исходного соединения k S представляет собой соответствующее значение для производного, несущего n заместителей, а сумма представляет собой приращения удерживания, обусловленные отдельными заместителями τ i .Имея соответствующие значения для представляющих интерес функциональных групп, нужно только определить удерживание родительской структуры, чтобы иметь возможность рассчитать удержание производного инструмента. Чтобы получить надежные прогнозы, в уравнение [7] вводятся поправочные коэффициенты для учета взаимных взаимодействий между заместителями (электронных, стерических, водородных связей). Однако в случае полифункциональных аналитов взаимодействия между заместителями делают прогнозы удерживания довольно ограниченными.
Полуэмпирическое описание систем ВЭЖХ с обращенной фазой, позволяющее прогнозировать относительное удерживание и селективность в пределах ряда аналитов, было разработано Jandera.Подход заключается в определении индексов взаимодействия, а также структурных липофильных и полярных индексов. Подходящий набор стандартных контрольных аналитов необходим для калибровки шкалы удерживания (или селективности).
Многопараметрический QSRR, основанный на линейных отношениях энергии сольватации (LSER), обладает высокой предсказательной силой в отношении удерживания обращенно-фазовой ВЭЖХ. Модель, разработанная Абрахамом и его сотрудниками для прогнозирования коэффициента распределения n -октанол – вода, log P , оказывается полезной также в случае log k из обращенно-фазовой жидкостной хроматографии:
[8] logk = c0 + c1Vx + c2π2H + c3∑α2H + c4∑β2H + c5R2
В уравнении [8] V x — это так называемый характеристический объем Макгоуэна, который можно вычислить просто по молекулярной структуре; π2H — диполярность / поляризуемость аналита, которая может быть определена с помощью газохроматографических и других измерений; Α2H — эффективная или суммарная кислотность водородной связи; ∑β2H — эффективная или суммарная основность водородной связи; и R 2 представляет собой избыточную молярную рефракцию, которая может быть получена из измерений показателя преломления и является дополнительной величиной.Структурные дескрипторы на основе LSER доступны для большого количества соединений.
Экспериментально определенный ионный радиус I r и энергия ионизации E i , сопровождаемая атомной массой, A m , дают уравнение трехпараметрической регрессии, предсказывающее капиллярную электрофоретическую подвижность катионы металлов. Уравнение QSRR указывает, что атомная масса приближается к факторам замедления (отрицательный вклад в подвижность), тогда как ионный радиус является приблизительной мерой эффективного заряда аналита.Энергия ионизации может играть роль вторичного, но существенного поправочного коэффициента к эффективному заряду. К сожалению, нет хороших QSRR для прогнозирования удерживания ХЭ органических аналитов.
Типичный многопараметрический подход к прогнозированию удерживания неизвестного соединения на основе структурных особенностей и хроматографических свойств других репрезентативных соединений состоит в создании множества дескрипторов аналита, которые затем подвергаются регрессии по данным удерживания. Структурные дескрипторы обычно получают методами вычислительной химии для оптимизированных по энергии конформаций.Были разработаны программные системы, которые производят и обрабатывают сотни квантово-химических, молекулярных моделей, топологических и полуэмпирических аддитивно-конститутивных дескрипторов после создания эскиза молекулы на компьютере. Соблюдая все правила и рекомендации для значимой статистики, выбирается минимальное количество дескрипторов (некоррелированных), которые необходимы для создания уравнения QSRR с хорошей предсказательной способностью. Дескрипторы, которые в конечном итоге служат для предсказания удержания новых аналитов, иногда имеют неясный физический смысл.Например, трудно придать определенный физический смысл таким дескрипторам, о которых сообщается в прогнозном QSRR как «площадь поверхности положительно заряженной части молекулы, деленная на общую площадь поверхности» или «общая энтропия молекулы при 300 К, деленная на количество атомов ». Тем не менее, для некоторых групп соединений прогноз удерживания с помощью QSRR достаточно надежен для целей идентификации, особенно когда нет лучшей альтернативы. Примерные прогнозные QSRR относятся к полихлорированным дибензофуранам и бифенилам, анаболическим стероидам, стимуляторам и наркотикам, используемым в качестве допинговых агентов, производным барбитуровой кислоты, полиароматическим и нитрированным полиароматическим углеводородам и т. Д.
Существуют QSRR с полезной предсказательной силой, которые содержат только физически интерпретируемые термины. ВЭЖХ с обращенной фазой удержание простых ароматических растворенных веществ на типичных колонках с октадециловым диоксидом кремния было связано с дескриптором молекулярной объемности (полной энергией), дескриптором полярности (локальный диполь) и энергией наивысшей занятой молекулярной орбитали аналитов. Хороший прогноз удерживания около 50 ароматических кислот методом жидкостной хроматографии был реализован с использованием в качестве регрессоров вычисленного теоретического логарифма коэффициента распределения n -октанол – вода (log P ), дипольного момента, главных осей эллипсоида, суммы заряды на атомах кислорода и азота, энергия наивысшей занятой молекулярной орбитали (ВЗМО) и электрофильная сверхделокализация для ароматического атома углерода.
На рисунке 3 проиллюстрирована прогностическая эффективность QSRR для 216 точек данных удерживания ВЭЖХ. Точки даны для 36 аналитов, хроматографированных в шести элюентах на неподвижной фазе диола. Элюенты — гептан, содержащий 0,5% тетрагидрофурана, диоксана, этанола, пропанола, октанола и диметилформамида. На рисунке 3 экспериментально измеренные данные log k сопоставлены со значениями, предсказанными уравнением [9]:
Рисунок 3. График log k, предсказанным уравнением [9], в сравнении с экспериментальными данными, определенными на колонке с диолом для 36 производных халкона с гептаном. элюент, содержащий 0.5% тетрагидрофуран, диоксан, этанол, пропанол, октанол или диметилформамид. (Перепечатано с разрешения Аззауи К. и Морин-Аллори Л. (1996) Сравнение и количественная оценка механизмов хроматографического удерживания на трех стационарных фазах с использованием соотношений удерживания структуры. Chromatographia 42: 389–395. Copyright Friedrich Vieweg & amp; Sohn.)
[9] logk = 0,100поляризуемостьаналит − 0,400logPanalyte − 0,330EHOMOanalyte + 1,106EHOMOeluent + 0,401ELUMOeluent
со значениями n = 216, R = 0.97, с = 0,097 и F = 655. В этом уравнении n — количество точек данных, используемых для вывода уравнения регрессии, R — коэффициент множественной корреляции, s — стандартная ошибка оценки и F — значение F-критерия значимости; E LUMO обозначает энергию самой низкой незанятой молекулярной орбитали, а E HOMO обозначает энергию самой высокой занятой молекулярной орбитали.
Рисунок 3 реалистично отражает фактическую прогностическую силу QSRR.Прогнозирующие уравнения QSRR обычно сохраняются в семействе аналитов, для которого они были получены, и могут использоваться для предварительной идентификации хроматографических пиков.
В последние годы для построения модели 3D-QSRR для прогнозирования данных удерживания применялся метод трехмерной количественной взаимосвязи структуры и биологической активности, известный как сравнительный анализ молекулярного поля (CoMFA). Модель CoMFA 3D-QSRR получается путем систематического отбора проб стерических и электростатических полей, окружающих набор молекул аналита, а затем коррелирует различия в этих полях с соответствующими различиями в удерживании.
Недавно появилось несколько отчетов о прогнозировании удержания данных из структурных дескрипторов с помощью нейронных сетей (NN). К настоящему времени прогнозы, предоставленные NN, имеют такую же надежность, что и прогнозы, полученные на основе регрессионных моделей.
Гомологическая серия | Химия, 11 класс, Органическая химия
Все органические соединения разделены на различные семейства или группы в зависимости от их структуры и химических свойств.
Гомологическая серия определяется как семейство или группа структурно схожих органических соединений, все члены которых содержат одну и ту же функциональную группу, демонстрируют градацию физических и сходных химических свойств и любые два соседних члена которых отличаются на: CH 2 группа .Отдельные члены такой серии называются гомологами , а феномен — гомологией.
Алканы составляют гомологичную серию.
CH 4 Метан
C 2 H 6 Этан
C 3 H 8 Пропан
C 4 H 10 Бутан
Эти углеводороды могут быть представлены той же общей формулой C n H 2n + 2 Где n — количество атомов углерода.
Любые два соседних члена этого класса отличаются группой CH 2 .
Если атом водорода заменить гидроксильной группой, то есть ОН, мы получим новый гомологический ряд. Этот гомологический ряд называется спиртов.
Общая формула этого гомологического ряда: C n H 2n + 1 OH.
CH 3 OH Метанол
C 2 H 5 OH Этанол
C 3 H 7 OH Пропанол
Характеристики гомологической серии
1) Каждую гомологическую серию можно представить общей формулой.
2) Все члены данной гомологической серии обладают одной и той же функциональной группой.
Для Ex: Функциональная группа спиртов — это гидроксильная группа, то есть -ОН группа.
Функциональная группа альдегида представляет собой альдегидную группу, то есть группу -CHO.
Функциональная группа кетонов представляет собой кетоновую группу, то есть -CO-группу.
3) Последовательные члены гомологического ряда отличаются группой -CH 2 .
4) Отдельные члены гомологической серии могут быть получены с помощью общих методов подготовки, разработанных для этой серии.
5) Физические свойства, такие как плотность, точка плавления, точка кипения членов гомологического ряда, демонстрируют регулярную градацию с увеличением молекулярной массы.
6) Химические свойства членов гомологического ряда схожи, хотя первый член может значительно отличаться от остальных членов.
.

 Теория строения органических соединений А. М. Бутлерова
Теория строения органических соединений А. М. Бутлерова youtube.com/watch?v=bXg1VcU9hBk
youtube.com/watch?v=bXg1VcU9hBk Состав, строение, гомологический ряд, изомерия, номенклатура
Состав, строение, гомологический ряд, изомерия, номенклатура edu.ru/subject/lesson/6148/main/170465/
edu.ru/subject/lesson/6148/main/170465/ edu.ru/subject/lesson/5727/main/150581/
edu.ru/subject/lesson/5727/main/150581/ Классификация, состав. Значение углеводов для жизни человека. Глюкоза
Классификация, состав. Значение углеводов для жизни человека. Глюкоза edu.ru/subject/lesson/4743/main/150746/
edu.ru/subject/lesson/4743/main/150746/ edu.ru/subject/lesson/6296/main/212593/
edu.ru/subject/lesson/6296/main/212593/ edu.ru/subject/lesson/6332/main/151024/
edu.ru/subject/lesson/6332/main/151024/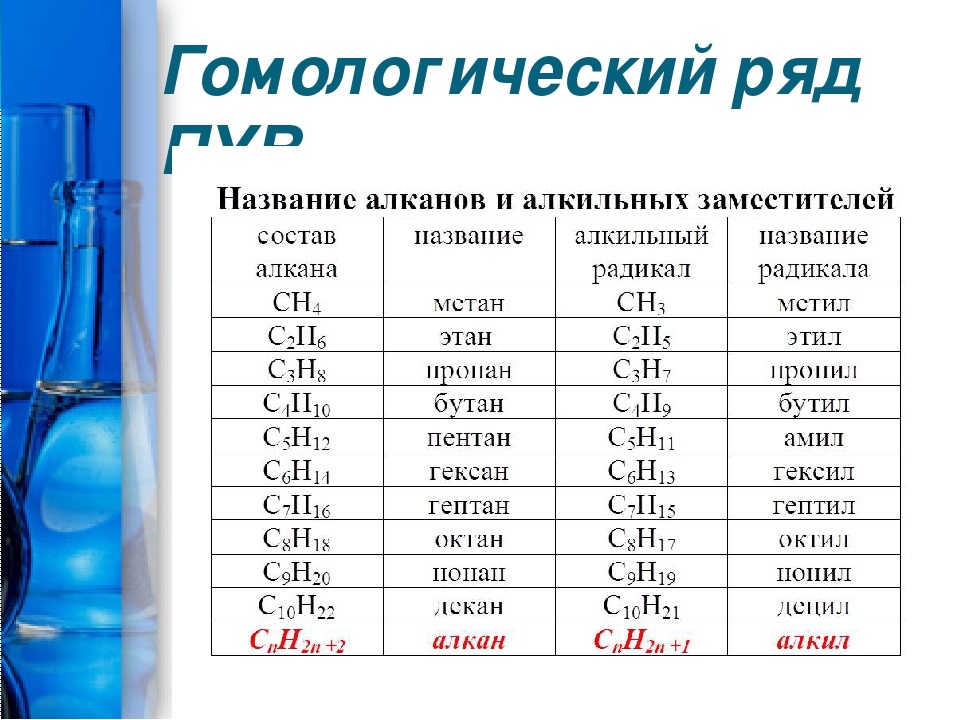 edu.ru/subject/lesson/5581/main/151084/
edu.ru/subject/lesson/5581/main/151084/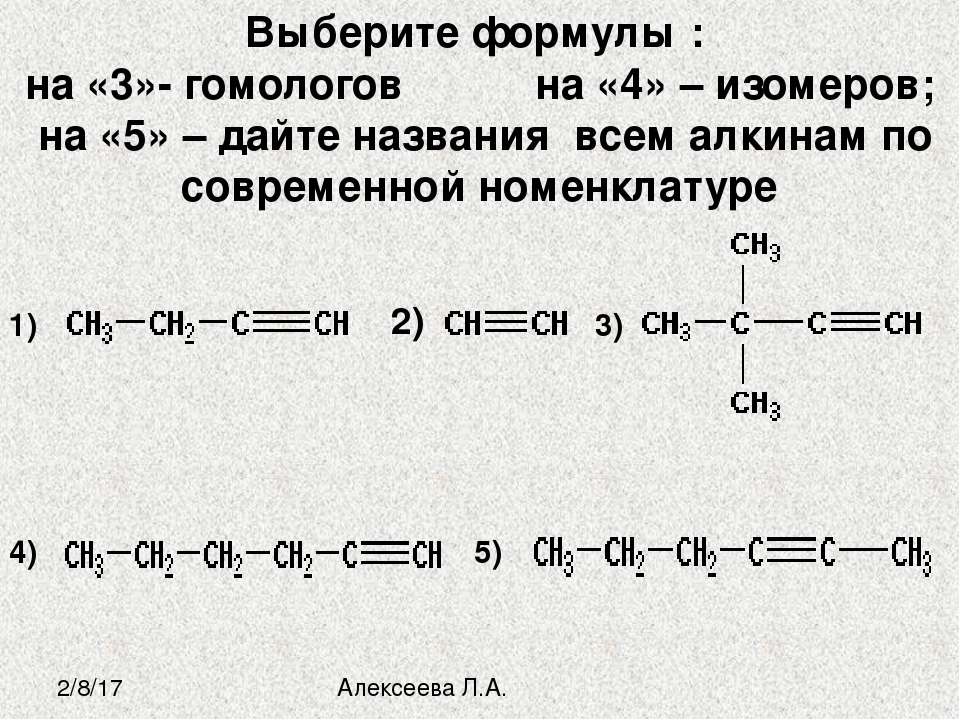 Реакции в растворах электролитов
Реакции в растворах электролитов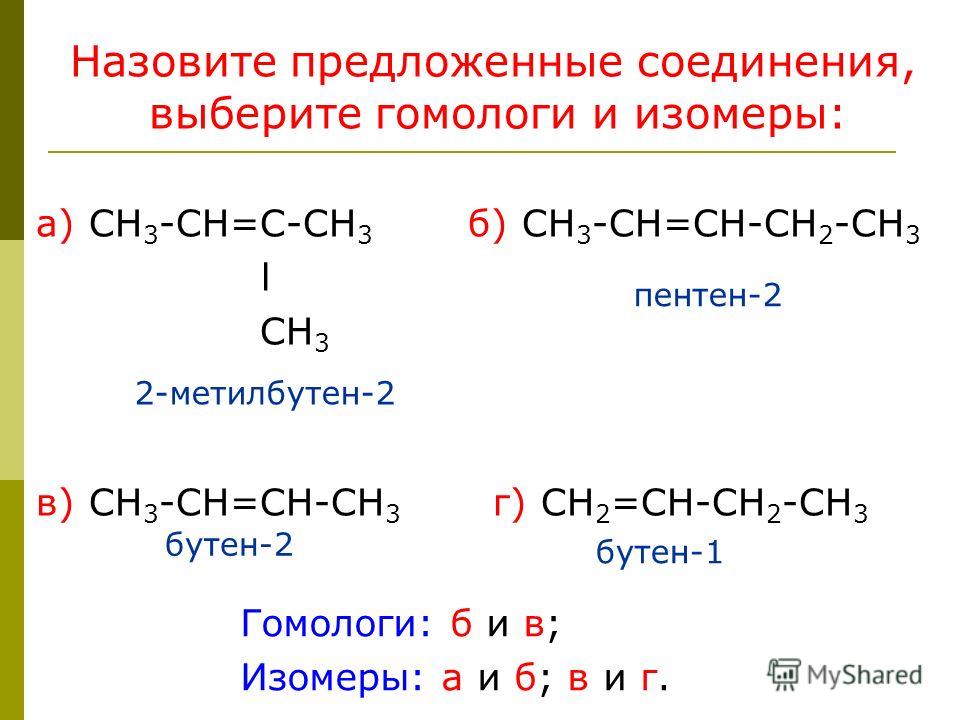 Промышленное получение металлов. Производство чугуна и стали
Промышленное получение металлов. Производство чугуна и стали edu.ru/subject/lesson/4961/main/151297/
edu.ru/subject/lesson/4961/main/151297/ edu.ru/subject/lesson/3523/main/151163/
edu.ru/subject/lesson/3523/main/151163/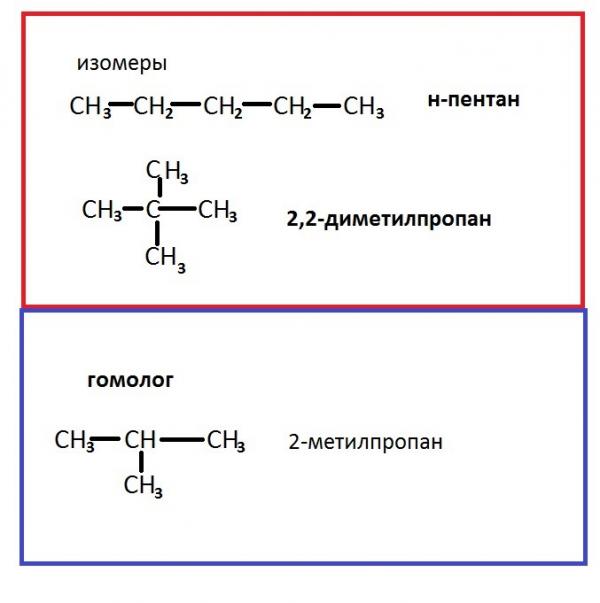 Средства борьбы с бытовыми насекомыми. Средства личной гигиены и косметики
Средства борьбы с бытовыми насекомыми. Средства личной гигиены и косметики