Содержание
Расчёт мольной доли
Расчёт мольной доли (φ) вещества
Для характеристи состава многокомпонентной системы (смеси веществ или раствора) часто требуется определить мольную долю (φ) отдельного компонента в этой системе.
Мольная доля вещества – содержание вещества в смеси (растворе), выраженное отношением числа молей этого вещества к общему числу молей всех веществ, содержащихся в смеси.
Мольная доля φ(компонента) в смеси вычисляется по формуле:
φ(компонента) = ν(компонента) / сумма ν(компонентов смеси).
Задача 1. Какова мольная доля пропана в пропан-бутановой смеси, если его массовая доля в этой смеси составляет 75%?
Задача 2. Синтетический каучук марки СКC-30 (сополимер бутадиена-1,3 и стирола) содержит 23,5% (по массе) звеньев стирола. Определите мольную долю звеньев бутадиена-1,3 в этом сополимере.
Решение
Сополимер бутадиена-1,3 и стирола образуется по схеме:
nCH2=CH–CH=CH2 + mCH2=СН–C6H5 [(–CH2–CH=CH–CH2–)x(–CH2–CH(C6H5)–)y]n+m
1 ≤ x
По условию задачи ω(–CH2–CH(C6H5)–) = 23,5%, то есть 100 г сополимера содержат 23,5 г звеньев стирола C8H8 и 76,5 г бутадиеновых звеньев C4H6.
Найдём количество вещества C4H6 в 100 г сополимера:
ν(C4H6) = m(C4H6) / M(C4H6) = 76,5 г / 54 г/моль = 1,42 моль.
Определим количество вещества C8H8:
ν(C8H8) = m(C8H8) / M(C8H8) = 23,5 г / 104 г/моль = 0,22 моль.
Мольную долю звеньев бутадиена-1,3 рассчитаем по формуле:
φ(C4H6) = ν(C4H6) / [ν(C4H6) + ν(C8H8)] = 1,42 / 1,64 = 0,87 или 87%.
Ответ: φ(C4H6) = 0,87 (87%)
Концентрации и доли. Как переводить концентрации? In-chemistry.ru
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
\Large w_{i}=\frac{m_{i}}{m}, \;\;\;\;\;(1)
где \Large w_{i} — массовая доля компонента i в смеси,
\Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть \Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
\Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
\Large w_{с} = \frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно \Large m_{1} и \Large m_{2}.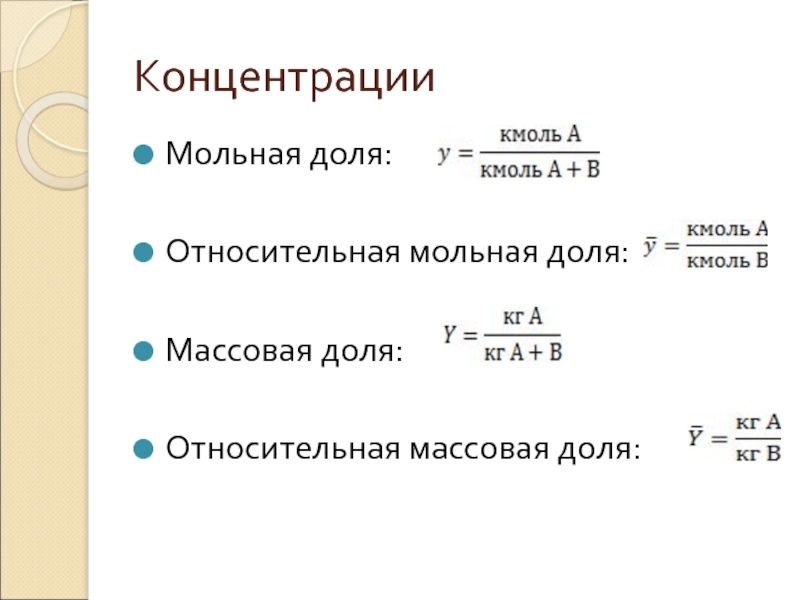 Массу полученного после смешения раствора обозначим \Large m и найдём:
Массу полученного после смешения раствора обозначим \Large m и найдём:
\Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим \Large m_{гл. 1} и \Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
\Large m_{гл. 1} = w_{1}\cdot m_{1} = 0.25 \cdot 200 г = 50 г
\Large m_{гл. 2} = w_{2}\cdot m_{2} = 0.1 \cdot 300 г = 30 г
Таким образом, общая масса глюкозы \Large m_{гл}:
\Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
\Large \phi_{B}=\frac{V_{B}}{\sum{V_{i}}}, \; \;\;\;\; (2)
где \Large \phi_{B} — объёмная доля компонента B;
\Large V_{B} — объём компонента B;
\Large \sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
\Large \phi_{H_{2}SO_{4}} = \frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = \frac{1 \: объём}{1 \: объём + 6 \: объёмов} = \frac{1 \: объём}{7 \: объёмов} = 0.143, \: или \: 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
(Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
\Large 100\% — 21\% — 1\% = 78\%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
\Large x_{B} = \frac{n_{B}}{\sum{n_{i}}}, \;\;\;\;\;(3)
где \Large x_{B} — мольная доля компонента B;
\Large n_{B} — количество компонента B, моль;
\Large \sum{n_{i}} — сумма количеств всех компонентов. г/_{моль}} = 125 \: моль
г/_{моль}} = 125 \: моль
Затем считаем сумму количеств:
\Large \sum {n} = 107.14 \: моль + 31.25 \: моль + 125 \: моль = 263.39 \: моль
И находим мольную долю каждого компонента:
\Large y_{N_{2}} = \frac {107.14 \: моль}{263.39 \: моль} = 0.4068, \: или \: 40.68 \%;
\Large y_{O_{2}} = \frac {31.25 \: моль}{263.39 \: моль} = 0.1186, \: или \: 11.86 \%;
\Large y_{He} = \frac {125 \: моль}{263.39 \: моль} = 0.4746, \: или \: 47.46 \%;
Проверяем:
\Large 40.68 \% + 11.86 \% + 47.46 \% = 100\%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси.
Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
\Large c_{B} = \frac{n_{B}}{V} \; \; \;\;\; (4)
где \Large n_{B} — количество вещества компонента B, моль;
\Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
\Large n_{сахарозы} = \frac{24 \: г}{342 \: г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
\Large c_{сахарозы} = \frac{0.0702 \: моль}{0.568 \: л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Рассчитывается нормальная концентрация по формуле:
\Large c_{N} = z \cdot c_{B} = z \cdot \frac{n_{B}}{V}= \frac{1}{f_{eq}} \cdot \frac {n_{B}}{V} \; \;\;\;\; (5)
где \Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности \Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
\Large n_{KMnO_{4}}=\frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = \frac{40 \: г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
\Large c_{N_{KMnO_{4}}}= z \cdot \frac{n_{KMnO_{4}}}{V} = 3 \cdot \frac{0.253 \: моль}{1 \: л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг.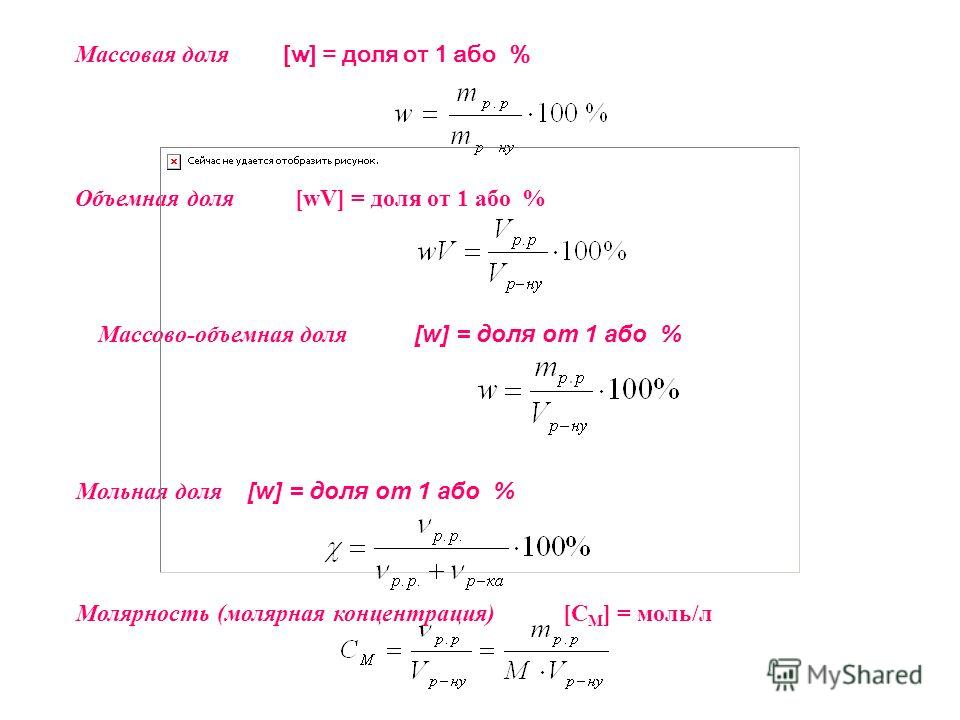 Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
\Large m_{B} = \frac{n_{B}}{m_{A}}, \;\;\;\;\; (6)
где \Large n_{B} — количество вещества компонента B, моль;
\Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Потому что в формуле расчёта молярной концентрации участвует объём раствора, а жидкости, как известно, в большинстве своём расширяются с ростом температуры.
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
\Large \rho_{B}=\frac{m_{B}}{V}, \;\;\;\;\; (7)
где \Large m_{B} — масса растворенного вещества, г;
\Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
\Large \rho_{ KMnO_{4} }=\frac{m_{ KMnO_{4} }}{V} =\frac{40 \: г}{1 \: л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, \large \omega, % | Мольная доля, \large x , % | Объёмная доля, \large \phi, % | Молярная концентрация, \large c, моль/л | Нормальная концентрация, \large c_{N} , моль-экв/л | Моляльная концентрация, \large m, моль/кг | Массовая концентрация, \large \rho, г/л | |
| Массовая доля, \large \omega, % | = | \large \omega_{B}=\frac{x_{B} \cdot M(B)}{\sum x_{i} \cdot M_{i}} | Для газов: \omega = \frac{\phi_{A} \cdot M(A)}{\sum (M_{i} \cdot \phi_{i})} | \large \omega_{B}= \frac{c_{B} \cdot M(B)}{\rho} | \large \omega_{B}=\frac{c_{N} \cdot M(B)}{\rho \cdot z} | \large \omega_{B}= \frac{\gamma_{B}}{\rho} | |
| Мольная доля, \large x , % | \large x_{B}=\frac{\frac{\omega_{B}}{M(B)}}{\sum \frac{\omega_{i}}{M_{i}}} | = | \large x_{B}=\frac{m_{B}}{m_{B}+\frac{1}{M(A)}} | ||||
| Объёмная доля, \large \phi, % | Для газов: \large \phi_{A}=\frac{\frac{\omega_{A}}{M(A)}}{\sum \frac{\omega_{i}}{M_{i}}} | = | |||||
| Молярная концентрация, \large c, моль/л | \large c_{B}=\frac{\rho \cdot \omega_{B}}{M(B)} | = | \large c_{B}=\frac{c_{N}}{z} | ||||
| Нормальная концентрация, \large c_{N} , моль-экв/л | \large c_{N}=\frac{\rho \cdot \omega_{B} \cdot z}{M(B)} | \large c_{N}=c_{B} \cdot z | = | ||||
| Моляльная концентрация, \large m, моль/кг | \large m_{B}=\frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, \large \gamma, г/л | \large \gamma_{B}=\rho \cdot \omega_{B} | = |
Таблица будет пополняться.
Концентрация массовая: что это такое и как правильно рассчитать
Концентрация смеси выражает содержание в ней составляющих компонентов. Показатель дает возможность определить содержание конкретного вещества в растворе. Чаще всего используются такие виды концентрации растворов: массовая, объемная, массовые доли, молярная концентрация.
Что такое раствор?
Большинство веществ, которые нас окружают, не являются чистыми. Как правило, это смеси, которые содержат в своем составе несколько компонентов, находящихся в одном или разных состояниях (жидкость, газ, твердое вещество). Смеси, которые имеют однородный состав, называются гомогенными, если состав неоднородный, – гетерогенными. Гомогенные смеси – это растворы, когда одно вещество (растворитель) полностью растворяет другое. Растворитель является компонентом раствора, который в получившейся смеси сохраняет свое состояние, как правило, его количество наибольшее.
Растворы могут быть газовыми, жидкими, твердыми.
Концентрация раствора бывает качественной и количественной. Качественная концентрация определяет растворы насыщенные, ненасыщенные, перенасыщенные. Количественная концентрация раствора выражается через доли вещества, которые входят в его состав.
Массовая концентрация
Показатель характеризует растворенное вещество. Массовая концентрация выражается в граммах, которые содержатся в 100 грамм раствора.
Каждая смесь может содержать разное количество растворителя и растворенного вещества. Если количество второго в отношении растворителя достаточно большое, раствор будет концентрированный, если меньше – слабый.
Концентрация раствора – важная характеристика при его описании. Важно установить, процентное содержание растворенного вещества в полученном растворе. Так, если масса раствора 110 г, масса вещества 10 г, то для расчета его концентрации нужно 10/110х100%. В результате получится, что концентрация раствора составляет около 9,09 процентных единиц.
Используется концентрация растворов, чтобы описать массовую долю вещества, которое в нем растворяется (w), как отношение его массы е общей массе всего раствора.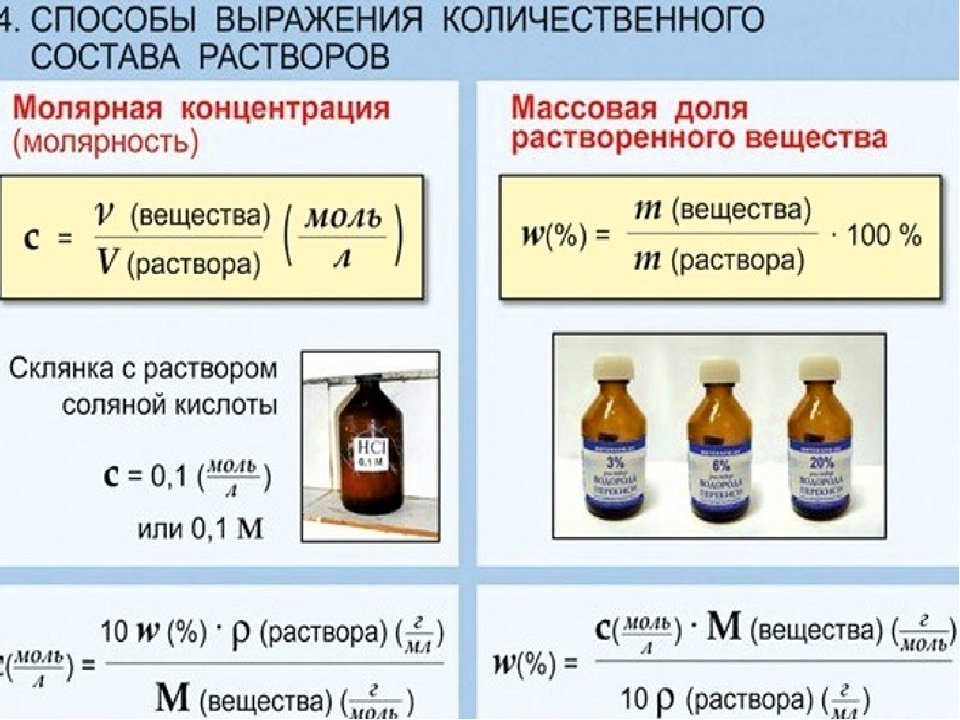 Выражается массовая доля в процентах или долях, как единица безразмерная.
Выражается массовая доля в процентах или долях, как единица безразмерная.
Если раствор имеет массу 200 г, в нем содержится 50 г растворенного вещества, то массовая доля последнего будет составлять 25% или 0,25 доли (50/200=0,25). Также можно рассчитать массовую долю растворителя. Для этого требуется выполнить такие действия: 200-50=150 г, а затем 150/200=0,75. Таким образом, массовая доля растворителя составит 75% или 0,75 долей.
Отсюда следует, что для расчета массовой доли веществ в составе раствора используется следующая формула: w(вещества) = m(вещества)/m(раствора). Зная массовую долю вещества, можно найти его массу по формуле: m(вещества) =w(вещества) х m(раствора).
Сумма массовых концентраций раствора (растворителя включительно) образует его плотность. Если химическое вещество чистое, массовая концентрация такая же, как и его плотность (масса/объем). Отсюда следует, что массовая концентрация компонента в смеси – это его плотность.
Вам могут быть интересны следующие товары
Вам могут быть интересны услуги
Массовая доля и молярная концентрация вещества в растворе Решение расчётных задач — книга
Массовая доля и молярная концентрация вещества в растворе Решение расчётных задач — книга | ИСТИНА – Интеллектуальная Система Тематического Исследования НАукометрических данных
Массовая доля и молярная концентрация вещества в растворе Решение расчётных задачкнига
- Авторы:
Бердоносов П.
 С.,
С.,Бердоносов С.С.
- Год издания:
2018 - Место издания:
Филиал МГУ в г Баку Баку - Объём:
32 страниц
- Тираж:
50 экз. - Учебное пособие без грифа
- Аннотация:
Данная разработка написана в помощь студентам 1 -го курса филиала
химфака МГУ имени М.В.Ломоносова в г. Баку (республика Азербайджан).
Надеемся, что она поможет студентам приобрести надёжный навык
использования алгебраических приемов при решении задач на определение
массовой доли растворённого вещества и молярной концентрации и
продемонстрирует тесное взаимодействие химии и математики. Авторы
Авторы
разработки, опираясь на свой многолетний опыт преподавания химии,
рассмотрели наиболее рациональные (по их мнению) приёмы решения
типичных задач по данной теме. Нужно отметить, что умение решать такие
задачи важно для всех разделов химии. Надеемся, что знакомство с
разработкой повысит качество обучения и будет полезно в будущей
практической деятельности выпускников-химиков. - Добавил в систему:
Бердоносов Петр Сергеевич
Пересчёт молярной концентрации (млн-1) в массовую (мг/м3)
Определяемый компонент:
Выберите компонентАзот (N2)Аргон (Ar)Водород (h3)Кислород (O2)Воздух (-)Криптон (Kr)Ксенон (Xe)Неон (Ne)Монооксид улерода (CO)Моноокись углерода (CO2)Гелий (He)Вода (h3O)Неон (Ne)Метан (Ch5)Этан (C2H6)Этилен (C2h5)Ацетилен (C2h3)Пропан (C3H8)Пропилен (C3H6)н-бутан (n-C4h20)2–метилпропан (C4h20)1–бутен (C4H8)Цис–2–бутен (C4H8)Транс–2–бутен (C4H8)2–метилпропен (C4H8)1–пентен (C5h20)н–пентан (C5h22)2–метилбутан (C5h22)2,2–диметилпропан (C5h22)2–метилпентан (C6h24)3–метилпентан (C6h24)2,2–диметилбутан (C6h24)2,3–диметилбутан (C6h24)н-гексан (C6h24)н–гептан (C7h26)н–октан (С8Н18)н–нонан (С9Н20)н–декан (С10Н22)Пропадиен (C3h5)1,2–бутадиен (C4H6)1,3–бутадиен (С4Н6)Циклопентан (C5h20)Метилциклопентан (C6h22)Этилциклопентан (C7h24)Циклогексан (C6h22)Метилциклогексан (C7h24)Этилциклогексан (C8h26)Бензол (C6H6)Толуол (C7H8)Этилбензол (C8h20)о–ксилол (C8h20)Метанол (Ch4OH)Цианид водорода (HCN)Окись азота (NO)Двуокись азота (NO2)Монооксид диазота (N2O)Диоксид серы (SO2)Аммиак (Nh4)Хлористый водород (HCl)Этанол (C2H5OH)Сероводород (h3S)Метилмеркаптан (Ch4SH)Этилмеркаптан (C2H5SH)Диметилсульфид (C2H6S)Изо-пропилмеркаптан (i-C3H7SH)Пропилмеркаптан (C3H7SH)Метилэтилсульфид (C3H8S)Бутилмеркаптан (C4H9SH)Изо-бутилмеркаптан (i-C4H9SH)Втор-бутилмеркаптан (втор-C4H9SH)Трет-бутилмеркаптан (трет-C4H9SH)Диэтилсульфид (C4h20S)Карбонилсульфид (COS)Дисульфид углерода (CS2)
Молярная доля компонента:
[ppm (млн-1)]
Массовая доля компонента:
[мг/м3]
Определяемый компонент:
Выберите компонентАзот (N2)Аргон (Ar)Водород (h3)Кислород (O2)Воздух (-)Криптон (Kr)Ксенон (Xe)Неон (Ne)Монооксид улерода (CO)Моноокись углерода (CO2)Гелий (He)Вода (h3O)Неон (Ne)Метан (Ch5)Этан (C2H6)Этилен (C2h5)Ацетилен (C2h3)Пропан (C3H8)Пропилен (C3H6)н-бутан (n-C4h20)2–метилпропан (C4h20)1–бутен (C4H8)Цис–2–бутен (C4H8)Транс–2–бутен (C4H8)2–метилпропен (C4H8)1–пентен (C5h20)н–пентан (C5h22)2–метилбутан (C5h22)2,2–диметилпропан (C5h22)2–метилпентан (C6h24)3–метилпентан (C6h24)2,2–диметилбутан (C6h24)2,3–диметилбутан (C6h24)н-гексан (C6h24)н–гептан (C7h26)н–октан (С8Н18)н–нонан (С9Н20)н–декан (С10Н22)Пропадиен (C3h5)1,2–бутадиен (C4H6)1,3–бутадиен (C4H6)Циклопентан (C5h20)Метилциклопентан (C6h22)Этилциклопентан (C7h24)Циклогексан (C6h22)Метилциклогексан (C7h24)Этилциклогексан (C8h26)Бензол (C6H6)Толуол (C7H8)Этилбензол (C8h20)о–ксилол (C8h20)Метанол (Ch4OH)Цианид водорода (HCN)Окись азота (NO)Двуокись азота (NO2)Монооксид диазота (N2O)Диоксид серы (SO2)Аммиак (Nh4)Хлористый водород (HCl)Этанол (C2H5OH)Сероводород (h3S)Метилмеркаптан (Ch4SH)Этилмеркаптан (C2H5SH)Диметилсульфид (C2H6S)Изо-пропилмеркаптан (i-C3H7SH)Пропилмеркаптан (C3H7SH)Метилэтилсульфид (C3H8S)Бутилмеркаптан (C4H9SH)Изо-бутилмеркаптан (i-C4H9SH)Втор-бутилмеркаптан (втор-C4H9SH)Трет-бутилмеркаптан (трет-C4H9SH)Диэтилсульфид (C4h20S)Карбонилсульфид (COS)Дисульфид углерода (CS2)
Массовая доля компонента:
[мг/м3]
Молярная доля компонента:
[ppm (млн-1)]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. 1 Молоко с пониженным (слава) и нормальным (справа) содержанием жира | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. 2 Объемные доли основных компонентов воздуха | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. 3 Купание в Мертвом море | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
Молярная доля,. мольная доля — Справочник химика 21
В 1 кг воды растворено 666 г КОН плотность раствора равна 1,395 г/мл. Найти а) массовую долю КОН б) молярность в) моляльность г) мольные доли щелочи и воды. [c.113]
Мольную долю называют также молярной, или молекулярной, допей или дробью. Мольный процент равен 100 Ni. [c.296]
Мольный процент равен 100 Ni. [c.296]
Выразить концентрацию водного раствора через молярность, моляльность, мольные доли и нормальность. [c.161]
Значения парциальных молярных энтальпий На н Нщ раствора определенного состава могут быть легко найдены по изотермической кривой на диаграмме энтальпия — мольная доля [c.29]
Молярная доля (мольная дол я) х(А) вещества А — это отношение какой-либо молярной величины к одноименной молярной величине, принятой за исходную. [c.13]
Если составы смесей выражены через мольную долю Xi, концентрацию i или молярность т,-, тогда активности выражают в такой форме [c.222]
Растворы. Растворимость веществ и ее зависимость от температуры, давления, природы растворителя. Способы выражения концентрации растворов массовая доля, мольная доля, молярная концентрация. Твердые растворы. Сплавы. [c.501]
[c.501]
Какой из способов выражения концентрации раствора— указание процентного состава, моляльности, молярности или мольной доли компонентов—не зависит от температуры в той области ее изменения, где не происходит фазовых превращений раствора [c.221]
Количественный состав раствора выражается с помощью понятия концентрация , под которым понимается содержание растворенного вещества в единице массы или объема раствора. Чаще всего для выражения состава раствора используют массовую долю, молярную концентрацию (молярность) и мольную долю. [c.89]
Следует отметить, что молярной (или мольной) долей компонента к, Хк называют величину, равную отношению числа молей Nк данного компонента к общему числу молей системы [c.27]
При количественных расчетах и графич. представлении результатов С. удобнее использовать вместо абсолютных молярных концентраций мольные доли, обозначив через /1, /2, 1, Р. мольные доли Mi и М2 в мономерной смеси и сополимере. [c.223]
мольные доли Mi и М2 в мономерной смеси и сополимере. [c.223]
Объясняется этот парадокс различным выбором стандартных состояний при определении /а и /в, с одной стороны, и /а и /в — с другой. Как известно, для растворов одного электролита стандартное состояние для каждой концентрационной шкалы (молярности, моляльности, мольные доли) выбирается таким образом, чтобы средний ионный коэффициент активности стремился к единице, [c.112]
Для получения экстраполяционных соотношений часто используют концентрацию, выраженную в молярных долях X,. При этом концентрационные зависимости измеряемых характеристик растворов также имеют линейный вид, аналогичный уравнениям (4.43-4.45). При условии, что +Хз = 1, концентрации и 2 можно выразить через мольную долю растворенного вещества как [c.155]
Концентрация, выранотношением числа молей щ г-го компонента к общему числу молей т = N всех компонентов раствора, называется молярной или мольной долей -го компонента [c. 11]
11]
Растворимость мелкокристаллических веществ в воде при различных температурах представлена на рис. 10-5. Они выражены в граммах растворенного вещества на 100 г раствора, т. е. в весовых процентах. Растворимости часто выражают также в моляльностях, молярностях и мольных долях. [c.269]
Основное расчетное уравнение (1.79) связывает фугитивность /г компонента гомогенной смеси с его мольной долей щ, фугитивностью в чистом виде /г и значениями парциального молярного объема Vi на интервале давлений от нуля до р. [c.35]
Рассчитаем массовую долю каждого компонента путем деления произведения мольной доли и молярной массы каждого компонента на усредненную по мольным долям относительную молярную массу (нанример, для мотана массовая доля равна 14,66/17,60- 0,833). [c.169]
Как и концентрацию, активность можно выражать в шкале моляльности, молярности или мольной доли. В расчетах концентрация, активность и коэффициент актив>1ости должны выражаться в одной и той же шкале. Состояние раствора, в котором все три величины равны единице, принято в качестве стандартного. [c.10]
Состояние раствора, в котором все три величины равны единице, принято в качестве стандартного. [c.10]
Здесь концентрация выражена в моляльностях, но можно вывести аналогичные выражения в. молярностях или мольных долях (ср. гл. 8). Для того чтобы использовать это соотношение, необходимо понять смысл етандартного состояния и уметь связывать активность с концентрацией. [c.347]
Какой из способов выражения концентрации раствора— указание процентного состава, моляльности, молярности или мольной доли компонентов — лучше B ei о подходит для а) определения степени завершенности химических реакций, протекающих в растворе б) наблюдения за влиянием растворенного вещества на коллигативные свойства растворителя, в) исследования реакций с участием газов [c.221]
Из этого рассмотрения следует общий вывод о том, что реакция будет ускоряться в растворителях, которые способствуют ассоциации реагентов. Величина, которую следует ожидать для такого рода аффектов, может быть определена для неионных реакций с использованием простой модели раствора. Если принять, что А, В,. .. и X образуют идеальный раствор с растворителем 3, который подчиняется закону Рауля во всем диапазоне составов, то можно написать соотношение между мольной долей Ж г-го компонента смеси и его равновесным давлением пара над раствором р1 = Х1ри где р — давление пара чистого -го вещества при температуре Т. Переходя к концентрациям, имеем для идеальных газов р1 = С рЕТ, в то время как для разбавленных растворов Ж где Уд — молярный объем растворителя, а Сз = 1/Уз — его копцептрация (С относится к раствору, Сга — к газу). [c.432]
Если принять, что А, В,. .. и X образуют идеальный раствор с растворителем 3, который подчиняется закону Рауля во всем диапазоне составов, то можно написать соотношение между мольной долей Ж г-го компонента смеси и его равновесным давлением пара над раствором р1 = Х1ри где р — давление пара чистого -го вещества при температуре Т. Переходя к концентрациям, имеем для идеальных газов р1 = С рЕТ, в то время как для разбавленных растворов Ж где Уд — молярный объем растворителя, а Сз = 1/Уз — его копцептрация (С относится к раствору, Сга — к газу). [c.432]
Это соотношение выполняется только, еслп выразптъ копцеит зацпи в моляльно-стях или мольных долях в обоих случаях на величину концентрации не влияет изменение давления. Если же использовать молярность (т. е. величину концентрации в моль1л), иа величину которой влияет изменение давления (благодаря сжимаемости раствора), то необходимо ввести соответствующую поправку, которая может быть найдена из соотношения [c. 439]
439]
Решение. 1. Определим молярную массу каждого компонента ПО данным 4.5.1 и рассчитаем усредненную по мольным долям молярную массу, суммируя произведения мольных долей и л олярных масс для каждого компонента в соответствии с табл. П2. [c.168]
Молярная доля и молярный процент
Цель обучения
- Вычислить мольную долю и мольный процент для данной концентрации смеси
Ключевые моменты
- Мольная доля описывает количество молекул (или молей) одного компонента, деленное на общее количество молекул (или молей) в смеси.
- Мольная доля полезна, когда два реакционноспособных компонента смешиваются вместе, так как соотношение двух компонентов известно, если известна мольная доля каждого.
- Умножение мольной доли на 100 дает мольный процент, который описывает то же самое, что и мольная доля, только в другой форме. Мольные доли могут быть получены из различных концентраций, включая составы молярности, молярности и массовых процентов.

Условия
- мольная доля Отношение количества молей одного компонента в смеси к общему количеству молей.
- моль — основная единица измерения количества вещества в системе СИ; количество вещества, которое содержит столько элементарных объектов, сколько атомов в 0.012 кг углерода-12.
Молярная доля
В химии мольная доля, x i , определяется как количество молей компонента, n i , деленное на общее количество молей всех компонентов в смеси, n тот :
[латекс] x_ {i} = \ frac {n_ {i}} {n_ {tot}} [/ латекс]
Мольные доли безразмерны, а сумма всех мольных долей в данной смеси всегда равна 1.
Свойства мольной доли
Мольная доля очень часто используется при построении фазовых диаграмм. Имеет ряд преимуществ:
- Он не зависит от температуры, в отличие от молярной концентрации, и не требует знания плотности фазы (фаз).

- Смесь с известными мольными долями может быть приготовлена путем взвешивания соответствующих масс компонентов.
- Мера симметричная; в мольных долях x = 0.1 и x = 0,9, роли «растворителя» и «растворенного вещества» обратимы.
- В смеси идеальных газов мольную долю можно выразить как отношение парциального давления к общему давлению смеси.
Мольная доля в растворе хлорида натрия Мольная доля увеличивается пропорционально массовой доле в растворе хлорида натрия.
Молярный процент
Умножение мольной доли на 100 дает молярный процент, также называемый процентом количество / количество (сокращенно n / n%).Для общей химии все мольные проценты смеси составляют в сумме 100 мольных процентов. Мы можем легко преобразовать молярный процент обратно в мольную долю, разделив на 100. Таким образом, мольная доля 0,60 равна 60,0% молярной доли.
Расчеты с молярной долей и мольным процентом
Молярная доля в смесях
Смесь газов была образована путем объединения 6,3 моль O 2 и 5,6 моль N 2 . Какая мольная доля азота в смеси?
Какая мольная доля азота в смеси?
Сначала мы должны найти общее количество молей с n итого = n N2 + n O2 .
[латекс] n_ {всего} = 6,3 \ моль + 5,6 \ моль = 11,9 \ моль [/ латекс].
Далее мы должны разделить родинки N 2 на общее количество родинок:
[латекс] x (\ text {мольная доля}) = (\ frac {\ text {моль} N_2} {\ text {моль} N_2 + \ text {моль} O_2}) = (\ frac {5.6 \ text { молей}} {11.9 \ text {moles}}) = 0,47 [/ латекс]
Мольная доля азота в смеси составляет 0,47.
Молярная доля в растворах
Молярная доля также может применяться в случае растворов.Например, 0,100 моль NaCl растворяют в 100,0 мл воды. Какая мольная доля NaCl?
Нам дано количество молей NaCl, но объем воды. Сначала мы преобразуем этот объем в массу, используя плотность воды (1,00 г / мл), а затем преобразуем эту массу в моль воды:
[латекс] 100 \ мл \ H_2O \ times (\ frac {1.0g} {1mL}) = 100. 0 \ g \ H_2O \ times (\ frac {1 \ text {moles}} {18.0 г}) = 5.55 \ text {молес} H_2O [/ латекс]
0 \ g \ H_2O \ times (\ frac {1 \ text {moles}} {18.0 г}) = 5.55 \ text {молес} H_2O [/ латекс]
С помощью этой информации мы можем найти общее количество присутствующих родинок: 5.55 + 0,100 = 5,65 моль. Если разделить моли NaCl на общее количество молей, мы найдем мольную долю этого компонента:
[латекс] x = (\ frac {0.100 \ text moles} {5.65 \ text moles}) = 0,0176 [/ latex]
Мы находим, что мольная доля NaCl составляет 0,0176.
Молярная доля с многокомпонентными смесями
Мольные доли также могут быть найдены для смесей, состоящих из нескольких компонентов. К ним относятся не иначе, чем раньше; опять же, общая мольная доля смеси должна быть равна 1.
Например, раствор образуется при смешивании 10,0 г пентана (C 5 H 12 ), 10,0 г гексана (C 6 H 14 ) и 10,0 г бензола (C 6 H 6 ). Какая мольная доля гексана в этой смеси?
Сначала мы должны определить количество молей, присутствующих в 10,0 г каждого компонента, с учетом их химической формулы и молекулярной массы. Количество молей каждого находится путем деления его массы на соответствующую молекулярную массу.Мы обнаружили, что имеется 0,138 моль пентана, 0,116 моль гексана и 0,128 моль бензола.
Количество молей каждого находится путем деления его массы на соответствующую молекулярную массу.Мы обнаружили, что имеется 0,138 моль пентана, 0,116 моль гексана и 0,128 моль бензола.
Мы можем найти общее количество молей, взяв сумму всех молей: 0,138 + 0,116 + 0,128 = 0,382 общих молей. Если разделить моли гексана на общее количество молей, мы вычислим мольную долю:
[латекс] x = (\ frac {0,116 \ text {moles}} {0,382 \ text {moles}}) = 0,303 [/ латекс]
Мольная доля гексана составляет 0,303.
Молярная доля от моляльности
Мольную долю можно также рассчитать по моляльности.Если у нас есть 1,62 м раствор столового сахара (C 6 H 12 O 6 ) в воде, какова мольная доля столового сахара?
Поскольку нам дана моляльность, мы можем преобразовать ее в эквивалентную мольную долю, которая уже является массовым отношением; помните, что моляльность = моль растворенного вещества / кг растворителя. Учитывая определение моляльности, мы знаем, что у нас есть раствор, содержащий 1,62 моля сахара и 1,00 кг (1000 г) воды. Поскольку мы знаем количество молей сахара, нам нужно найти количество молей воды, используя его молекулярную массу:
Поскольку мы знаем количество молей сахара, нам нужно найти количество молей воды, используя его молекулярную массу:
[латекс] 1000 \ г \ H_2O \ times (\ frac {1 \ моль} {18.0 \ g}) = 55,5 \ text {moles} H_2O [/ latex]
Общее количество молей — это сумма молей воды и сахара, или 57,1 молей всего раствора. Теперь мы можем найти мольную долю сахара:
[латекс] x = (\ frac {1,62 \ text {молей сахара}} {57,1 \ text {молей раствор}}) = 0,0284 [/ латекс]
При мольной доле 0,0284 мы видим, что имеем 2,84% раствор сахара в воде.
Молярная доля от массового процента
Мольную долю можно также рассчитать из массовых процентов.Какова мольная доля коричной кислоты с мольным процентом 50,00% мочевины в коричной кислоте? Молекулярная масса мочевины составляет 60,16 г / моль, а молекулярная масса коричной кислоты составляет 148,16 г / моль.
Во-первых, мы предполагаем общую массу 100,0 г, хотя можно принять любую массу. Это означает, что у нас есть 50,0 г мочевины и 50,0 г коричной кислоты. Затем мы можем вычислить количество присутствующих молей, разделив каждый на его молекулярный вес. У нас 0,833 моль мочевины и 0,388 моль коричной кислоты, так что у нас 1.Всего 22 моля.
Затем мы можем вычислить количество присутствующих молей, разделив каждый на его молекулярный вес. У нас 0,833 моль мочевины и 0,388 моль коричной кислоты, так что у нас 1.Всего 22 моля.
Чтобы найти мольную долю, разделим количество молей коричной кислоты на общее количество молей:
[латекс] x = (\ frac {.388 \ text {моль коричной кислоты}} {1,22 \ text {моль раствор}}) = 0,318 [/ латекс]
Мольная доля коричной кислоты составляет 0,318.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Конспект лекций RMP
Конспект лекций RMP
Переменные процесса: состав
Большинство материальных потоков в технологических установках представляют собой смеси соединений.Мы описываем
состав потока по-разному.
Состав фракций
Доли композиции могут быть основаны на массе или на молях.
Вы переводите «дробь» в «процент», умножая на
100.
Используемые единицы измерения массы не имеют значения, пока верхний
и внизу соотношения используются те же единицы:
ПРИМЕР: Поток содержит 20 г газообразного кислорода, 70 г азота, 5
г гелия и 5 г водорода.Найти массовую и мольную доли, масса
и составы в мольных процентах.
Во-первых, вам нужно найти массу каждого компонента (заданную), общую массу (добавить
их вверх). Вам также необходимо рассчитать количество молей каждого компонента (разделить
масса по молекулярной массе) и общее количество молей.
Теперь у вас есть все необходимое для расчета фракций состава.
Результаты дроби можно проверить, сложив их — они должны равняться 1,0.
Умножьте фракции на 100, чтобы получить процентный состав.
Единица концентрации, часто встречающаяся при использовании в окружающей среде, составляет частей на
млн или стр / мин . Это граммы растворенного вещества в 1 миллион граммах
решение. PPM (или ppb) — это особый вид массовой доли.
PPM (или ppb) — это особый вид массовой доли.
Часто вам дают состав в процентном или дробном виде, но
для решения проблемы вам необходимо знать массы отдельных компонентов
(если только перевести в молярный состав). Позаботьтесь об этом, приняв
основа 1 кг, 100 моль и др.и работать оттуда. Ведь если
смесь состоит из 21 мольного процента кислорода, не имеет значения, если у вас есть 5
г или 30 фунтов или 200 моль — процентный или фракционный состав такой же.
ПРИМЕР: Воздух содержит около 78 мольных процентов азота, 21 молярный процент.
кислород и 1 процент аргона. Каков его массовый состав?
Вы не знаете, сколько у вас воздуха (общее количество молей или общая масса), но это
не имеет значения. Поэтому выберите базовую сумму, при которой
расчет легкий.Когда составы даны в процентах, за основу принимается 100
всегда хорошо, так как не требует умножения или деления. Я думаю, я буду
работать в фунтах-молях.
ОСНОВА: 100 моль воздуха ЗАПИШИТЕ!
Средняя молекулярная масса смеси рассчитывается из
молярный состав и молекулярная масса.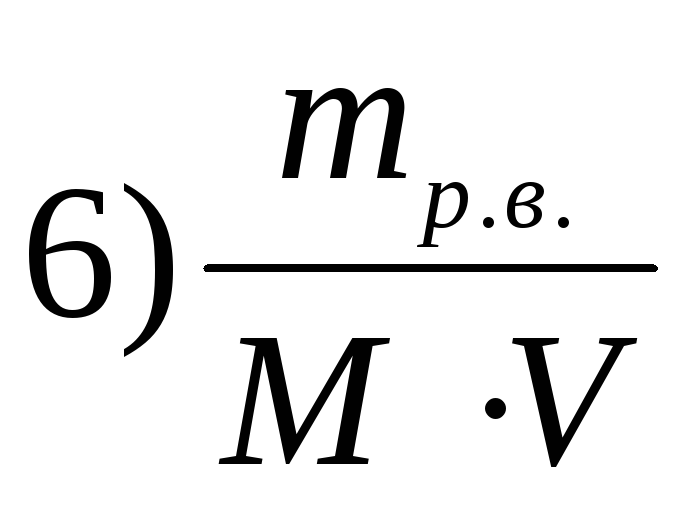 Это средневзвешенное значение
Это средневзвешенное значение
— молекулярные массы усредняются с использованием мольных долей в качестве веса.
ПРИМЕР: Рассчитайте средний молекулярный вес воздуха.
Предположим, что воздух состоит на 79 мол.% Азота и 21 мол.% Кислорода.
ОСНОВА: 1 гмоль воздуха.
Таким образом, после учета значащих цифр ответ будет 29 г / моль.
НЕ следует пытаться рассчитать среднюю плотность или средний удельный вес.
с использованием средневзвешенного арифметического. Если вы посмотрите, что это делает, единицы
не получается. Вы должны использовать взвешенное гармоническое среднее.
Концентрация
Часто используются термины «состав» и «концентрация».
взаимозаменяемо.На этом этапе мы хотим прояснить разницу.
Концентрация основана на объеме и является одним из способов выражения
состав. Массовая концентрация — это
масса компонента на единицу объема, аналогично молярная концентрация равна
молей на единицу объема.
ПРИМЕР: Если я растворю 1 г соли в 1000 л воды, что будет
концентрация смеси?
Предположим, что добавочные объемы .
Концентрация — это граммы растворенного вещества, деленные на объем смеси (вода и
растворенное вещество).
Чтобы упростить задачу, обратите внимание, что объем соли, вероятно, очень велик.
намного меньше, чем у воды; следовательно, пренебрежем громкостью
соль. НАПИШИТЕ «Предположим, что количество соли незначительно».
Если бы это была важная проблема, мы, вероятно, захотели бы вернуться и
обосновать наше предположение, посмотрев плотность соли и оценив, как
Во многом предположение изменило ответ.
В этом примере я предполагал дополнительные объемы. Вообще говоря, если мы
добавить 1 м 3 компонента A к 1 м 3 компонента B, мы
не может быть гарантированно получить 2 м 3 смеси.Когда это правда,
мы говорим, что «объемы прибавляются» или что «объем добавляется».
Объемы складываются только в том случае, если смесь «идеальная». Детали
Детали
Идеальность будет обсуждаться в термодинамике ЧЭ, но пока
обычно принимают идеальных решений. Это, наверное, нормально, если все
компоненты аналогичны, и если температура и давление не
крайность, но необходимо заявить об идеальности.
Когда концентрация рассчитывается в гмоль / литр, она называется
Молярность , сокращенно М.
ПРИМЕР: Сколько КОН содержится в 5 мл 2 М раствора?
Концентрация — это граммы растворенного вещества, деленные на объем смеси (вода и
растворенное вещество).
Вы ДОЛЖНЫ иметь возможность переключаться между объемным, массовым и молярным составом и
течет быстро и без борьбы. Иначе все проблемы в этом классе
займет намного больше времени, чем следовало бы.
Умный инженер обычно будет работать с проблемами в массе или кроте.
единиц, конвертируя при необходимости в единицы объема и обратно.Пытаюсь работать
Проблемы в основном в единицах объема часто являются источником проблем.
Ссылки:
- Р.М. Felder & R.W. Rousseau, Элементарные основы химии
Процессы (2-е изд.), Джон Вили, 1986, стр. 50-55. - Д.М. Химмельблау, Основные принципы и расчеты в химической
Engineering (6-е изд.), Prentice Hall, 1996, стр. 16-17, 22-26.
R.M. Цена
Оригинал: 02.06.94
Изменено: 24.08.95, 14.08.96, 26.08.98; 24.05.2004
Авторские права 1998, 2004 Р.М. Прайс — Все права защищены.
Калькулятор мольной доли
Наш калькулятор мольной доли — удобный инструмент, который вычисляет мольную долю ваших растворов двумя разными методами. Неважно, знаете ли вы только общее количество молей в растворе , или ваша задача требует , чтобы вы работали с растворителями и растворенными веществами — мы здесь для вас, чтобы помочь!
В приведенном ниже тексте мы подробно рассмотрим формулу мольной доли , вычислим мольную долю газа и преобразуем мольную долю в молярность .
Эй! Возможно, вам также пригодятся наши калькуляторы молярности и молярности. 😉
Как пользоваться калькулятором мольной доли?
Наш инструмент можно использовать двумя способами — все зависит от ваших исходных данных. Во-первых, несколько важных определений:
- Раствор — небольшая часть раствора, растворенная в растворителе. Смесь может содержать несколько различных растворенных веществ;
- Растворитель — большая часть раствора, которая растворяет растворенное вещество; и
- Раствор — гомогенная смесь как минимум двух веществ ( гомогенный означает, что вы не можете различить части смеси).
⚫ Метод № 1
Это метод, который вы будете использовать, если вам предоставлены следующие данные:
- Число молей растворенного вещества ; и
- Число молей растворителя .

Этот метод работает лучше всего, если в смеси только одно растворенное вещество . Вы по-прежнему можете использовать этот метод для нескольких растворенных веществ, однако вам просто нужно добавить моль других растворенных веществ к молям растворителя.
⚫ Метод № 2
Если вы уже знаете количество молей всего раствора, то это то, что вам нужно! Этот метод также удобнее, когда в одном растворе растворено несколько растворенных веществ.
- Число молей растворенного вещества ; и
- Количество молей раствора .
🔔 Вы можете использовать калькулятор несколько раз, чтобы узнать мольную долю нескольких веществ, растворенных в одном растворе!
Помните! Сумма всех мольных долей всегда равна 1 .
Как рассчитать мольную долю раствора?
Это часть текста, где мы рассказываем вам, как самостоятельно пользоваться формулой мольной доли . Это может показаться страшным, но это не так сложно, как вы думаете:
Это может показаться страшным, но это не так сложно, как вы думаете:
Молярная доля ( X растворенного вещества ) = моль растворенного вещества / общее количество моль раствора ,
или
Мольная доля ( X растворенного вещества ) = моль растворенного вещества / (моль растворенного вещества + моль растворителя) .
Как рассчитать мольную долю раствора с несколькими растворенными веществами?
Правильная расширенная версия формулы выглядит следующим образом:
Мольная доля ( X растворенного вещества ) = моль растворенного вещества / (моль растворенного вещества 1 + моль растворенного вещества n ... + моль растворителя)
Где n — количество растворенных веществ в растворе. Вам нужно добавить ровно столько растворенных веществ , сколько у вас есть в вашей смеси.
Вы уже знаете, как рассчитать молярную массу и титровать раствор и его вещества? 👩🏽🔬 👨🏻🔬
Как рассчитать мольную долю газа?
Мольную долю газа можно рассчитать аналогично методу № 2: основной принцип остается неизменным — мы просто меняем переменные.
Молярная доля ( X a ) = P a / P t
Где:
- X — мольная доля газа А;
- Па — парциальное давление газа А; и
- Pt — парциальное давление всех присутствующих газов = Pa + Pb + Pc … и т. Д.
Может потребоваться вычислить молярную массу газа.
Как найти мольный процент?
Молярный процент (n / n%) равен молярная доля, умноженная на 100 !
n / n% = мольная доля * 100
Как преобразовать мольную долю в молярность?
Вам нужно будет использовать оба метода, представленные в нашем калькуляторе мольной доли.
Рассчитайте мольную долю по формуле мольной доли.
Необходимо принять, что общее количество молей в растворе равно 1 (метод №2).
Рассчитайте количество молей растворителя (метод №1).
Найдите расчетную массу молей растворителя:
масса = моль * молярная масса.Возьмите количество молей растворенного вещества, рассчитанное в пункте 2, и разделите их на расчетную массу растворителя:
моль растворенного вещества / масса растворителя = моляльность.
Как рассчитать мольные доли с использованием массового процента
Вы можете определить концентрацию растворенного вещества в растворе как процентное отношение веса к весу, процентное отношение веса к объему или процентное отношение объема к объему. В этом контексте вес является синонимом массы, поэтому массовый процент означает относительный вес растворенного вещества к весу раствора, и вы можете выразить его как «процент по весу». Однако также принято относить вес к объему и выражать результат как «процентное отношение веса к объему».«В любом случае, если вы знаете химические формулы растворенного вещества и растворителя (которым обычно является вода), весовой процент позволяет рассчитать, сколько молей растворенного вещества присутствует в растворе. Исходя из этого, можно определить молярность раствора, которая представляет собой количество молей растворенного вещества на литр раствора.
Однако также принято относить вес к объему и выражать результат как «процентное отношение веса к объему».«В любом случае, если вы знаете химические формулы растворенного вещества и растворителя (которым обычно является вода), весовой процент позволяет рассчитать, сколько молей растворенного вещества присутствует в растворе. Исходя из этого, можно определить молярность раствора, которая представляет собой количество молей растворенного вещества на литр раствора.
TL; DR (слишком долго; не читал)
Если вы знаете весовой процент раствора, вы можете найти вес Разделите полученное значение на его молекулярную массу, чтобы найти количество молей, и разделите на объем раствора, чтобы найти молярность.
Процент по весу в зависимости от процента по весу к объему
Вы можете выразить процент по весу раствора как x процент растворенного вещества по весу. Это предпочтительный метод выражения концентрации коммерческих кислотных растворов. Например, коммерческая концентрированная соляная кислота обычно представляет собой раствор с концентрацией 37 процентов по массе. Более разумно выражать очень разбавленные водные растворы, такие как те, которые используются в биологических исследованиях, как процентное отношение веса к объему. Поскольку вода имеет плотность 1 г / мл, это составляет процент по весу, поскольку данное количество миллилитров воды весит это количество граммов.
Например, коммерческая концентрированная соляная кислота обычно представляет собой раствор с концентрацией 37 процентов по массе. Более разумно выражать очень разбавленные водные растворы, такие как те, которые используются в биологических исследованиях, как процентное отношение веса к объему. Поскольку вода имеет плотность 1 г / мл, это составляет процент по весу, поскольку данное количество миллилитров воды весит это количество граммов.
Молярность раствора в процентах по весу
Предположим, у вас есть x-процентный раствор, который весит W граммов. Тогда вес растворенного вещества будет W s = x / 100 • W. Найдите молекулярную массу соединения и разделите это число на W s , чтобы найти количество молей, которое у вас имеется. Чтобы определить молярность, измерьте объем раствора и разделите его на количество молей. Для этого расчета необходимо сначала перевести единицы веса в граммы и единицы объема в литры.
Примеры молярности
Какова молярность 900 миллилитров 37-процентного раствора HCl?
Вес растворенного вещества в растворе 37/100 • 50 г = 18,5 г. HCl состоит из одного атома водорода (атомный вес 1 г / моль) и одного атома хлора (атомный вес 35 г / моль), поэтому его молекулярный вес составляет 36 г / моль. Разделите это на массу раствора, чтобы получить 0,51 моль. Чтобы найти молярность, разделите это число на объем, равный 0,09 литра.Ответ 5,7 моль / литр.
Какова молярность 3 унций 3-процентного солевого раствора?
Можно предположить, что это отношение веса к объему. Если вы переводите объем в литры, это упрощает вычисления, поэтому используйте это преобразование: 1 унция = 0,03 литра. У вас 0,09 литра раствора или 90 миллилитров. Поскольку вода весит 1 грамм на миллилитр, вес образца составляет 90 грамм. Это 3-процентный раствор, поэтому вес растворенного вещества составляет 3/100 • 90 = 2. 7 г.
7 г.
Химическая формула соли — NaCl, и, учитывая, что атомные массы натрия и хлора составляют 23 г / моль и 35 г / моль соответственно, ее молекулярная масса составляет 58 г / моль.
Разделите молекулярную массу на массу растворенного вещества в растворе, чтобы найти количество молей: 2,7 г ÷ 58 г / моль = 0,047 моль.
Разделите на объем раствора, чтобы найти молярность: M = (0,047 моль ÷ 0,09 литра) = 0,52 моль / литр.
Как рассчитать мольную долю
Обновлено 15 декабря 2020 г.
Крис Дезиел
При анализе растворов химики измеряют концентрации компонентов в молях.Мольная доля растворенного вещества — это отношение количества молей этого растворенного вещества к общему количеству молей растворенного вещества и растворителя в растворе. Поскольку это отношение молей к молям, мольная доля является безразмерным числом и, конечно, всегда меньше единицы.
Формула мольной доли проста. В любом растворе мольная доля растворенного вещества A составляет:
\ text {мольная доля A} = \ frac {\ text {моль A}} {\ text {общее количество моль}}
и мольная доля растворитель:
\ text {мольная доля растворителя} = \ frac {\ text {моль растворителя}} {\ text {общее количество моль}}
В некоторых ситуациях вам может не быть указано количество моль напрямую. Вы можете рассчитать его, если знаете химические формулы соединений, их вес или объем. Для этого полезно знать, что такое родинка.
Вы можете рассчитать его, если знаете химические формулы соединений, их вес или объем. Для этого полезно знать, что такое родинка.
TL; DR (слишком долго; не читал)
Формула мольной доли для раствора, содержащего одно или несколько растворенных веществ: Мольная доля каждого растворенного вещества = Количество молей этого растворенного вещества, деленное на общее количество молей всех растворенных веществ и растворителя.
Определение моля
Каждый элемент в периодической таблице имеет характеристическую массу, и в силу этого каждое соединение также имеет характеристическую массу.На атомном уровне масса измеряется в атомных единицах массы, но химикам нужен способ выразить массу в макроскопических терминах. С этой целью они определяют моль любого элемента или соединения как число Авогадро (6,022 × 10 23 ) атомов или молекул. Масса этого множества частиц, измеренная в граммах, равна молекулярной массе, измеренной в атомных единицах массы.
Таким образом, определение моля — это масса любого соединения, измеренная в граммах, которая равна массам составляющих элементов, измеренным в атомных единицах массы.Чтобы вычислить количество молей соединения, которое у вас есть, вы разделите массу на массу одного моля соединения, которую вы можете вычислить из периодической таблицы.
Использование уравнения мольных долей
Формула мольных долей особенно проста для понимания и использования, если вам известно количество молей всех растворенных веществ и растворителя. Например, предположим, что у вас есть 2 моля четыреххлористого углерода (CCl4), 3 моля бензола (C 6 H 6 ) и 4 моля ацетона (C 3 H 6 O).Общее количество молей в растворе равно 9. Уравнение мольной доли говорит вам, что мольная доля четыреххлористого углерода составляет 2/9 = 0,22. Точно так же мольная доля бензола составляет 3/9 = 0,33, а мольная доля ацетона составляет 4/9 = 0,44.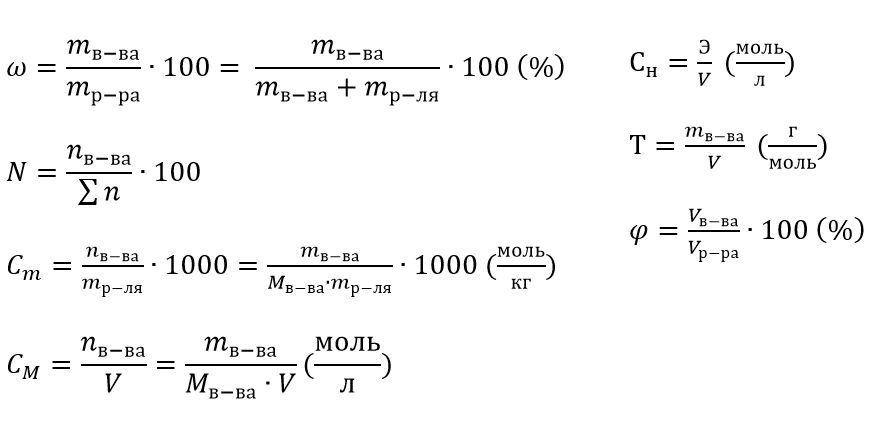
Все усложняется, если вы знаете массу только одного или нескольких компонентов раствора, но немного больше. Все, что вам нужно сделать, это преобразовать массу компонента в число молей, и это простая арифметическая задача, если вы знаете химическую формулу.
Пример мольной доли Задача
Предположим, вы растворили 77 граммов четыреххлористого углерода (CCl 4 ) в 78 граммах ацетона (C 3 H 6 O). Каковы мольные доли каждого соединения в растворе?
Не поддавайтесь желанию разделить массу четыреххлористого углерода на массу ацетона. Так как они почти одинаковы, результат будет 0,5 для каждого соединения, что даст неверный результат для ацетона. Во-первых, вам нужно преобразовать массы в количество молей каждого соединения, и для этого вам нужно найти атомные массы каждого из элементов в периодической таблице.
Атомная масса углерода составляет 12,0 а.е.м. (округление до одного десятичного знака), а хлора — 35,5 а. е.м., поэтому один моль четыреххлористого углерода весит 154 грамма. У вас 77 грамм, что составляет 77/154 = 0,5 моля.
е.м., поэтому один моль четыреххлористого углерода весит 154 грамма. У вас 77 грамм, что составляет 77/154 = 0,5 моля.
Учитывая, что атомная масса водорода равна 1 а.е.м., а кислорода 16 а.е.м., молярная масса ацетона составляет 58 граммов. У вас 78 граммов, что составляет 1,34 моля. Это означает, что общее количество молей в растворе составляет 1,84. Теперь вы готовы рассчитать мольные доли с помощью уравнения мольных долей.
\ text {мольная доля тетрахлорметана} = \ frac {0,5 \ text {моль}} {1.84 \ text {моль}} = 0,27 \\\ text {} \\\ text {мольная доля ацетона} = \ frac {1.34 \ text {moles}} {1.84 \ text {moles}} = 0.73
13.3: Единицы концентрации — Chemistry LibreTexts
Целью обучения этого модуля является описание концентрации раствора таким образом, чтобы наиболее подходящий для конкретной проблемы или приложения.
Существует несколько различных способов количественного описания концентрации раствора.Например, молярность была введена в главе 4 как удобный способ описания концентраций раствора для реакций, которые проводятся в растворе. Мольные доли, введенные в главе 10, используются не только для описания концентраций газа, но и для определения давления пара смесей подобных жидкостей. В примере 4 рассматриваются методы расчета молярности и мольной доли раствора, когда массы его компонентов известны.
Мольные доли, введенные в главе 10, используются не только для описания концентраций газа, но и для определения давления пара смесей подобных жидкостей. В примере 4 рассматриваются методы расчета молярности и мольной доли раствора, когда массы его компонентов известны.
| Пример 4 |
|---|
Коммерческий уксус по существу представляет собой раствор уксусной кислоты в воде.Бутылка уксуса содержит 3,78 г уксусной кислоты на 100,0 г раствора. Предположим, что плотность раствора составляет 1,00 г / мл.
Задано : масса вещества и масса и плотность раствора Запрошено : молярность и мольная доля Стратегия :
Раствор : A Молярность — это количество молей уксусной кислоты на литр раствора. Мы можем рассчитать количество молей уксусной кислоты, разделив ее массу на ее молярную массу.Объем раствора равен его массе, деленной на его плотность. Расчеты следующие: \ [моль \; CH_3CO_2H = \ dfrac {3.78 \; \ cancel {g} \; CH_3CO_2H} {60,05 \; \ cancel {г} / моль} = 0,0629 \; моль \] \ [объем = \ dfrac {масса} {плотность} = \ dfrac {100,0 \; \ cancel {g} \; решение} {1.00 \; \ cancel {g} / mL} = 100 \; мл \] \ [молярность \; из\; CH_3CO_2H = \ dfrac {моль \; CH_3CO_2H} {\ text {литровый раствор}} = \ dfrac {0,0629 \; моль \; CH_3CO_2H} {(100 \; \ cancel {mL}) (1 \; L / 1000 \; \ cancel {mL})} = 0,629 \; M \; CH_3CO_2H \] Этот результат имеет интуитивный смысл. B Чтобы рассчитать мольную долю уксусной кислоты в растворе, нам необходимо знать количество молей уксусной кислоты и воды. Количество молей уксусной кислоты равно 0.0629 моль, как рассчитано в части (а). Мы знаем, что в 100,0 г уксуса содержится 3,78 г уксусной кислоты; следовательно, раствор также содержит (100,0 — 3,78 г) = 96,2 г воды. Имеем \ [молей \; H_2O = \ dfrac {96.2 \; \ cancel {g} \; H_2O} {18.02 \; \ cancel {g} / mol} = 5,34 \; моль \; H_2O \] Мольная доля \ (X \) уксусной кислоты — это отношение количества молей уксусной кислоты к общему количеству молей присутствующих веществ: \ [X_ {CH_3CO_2H} = \ dfrac {моль \; CH_3CO_2H} {моль \; CH_3CO_2H + моль \; H_2O} = \ dfrac {0. Этот ответ тоже имеет смысл. Молей воды примерно в 100 раз больше, чем молей уксусной кислоты, поэтому соотношение должно быть примерно 0,01. |
| Упражнение 5 |
|---|
Раствор газа \ (HCl), растворенный в воде (продается как «соляная кислота», раствор, используемый для очистки поверхностей кладки), имеет 20,22 г \ (HCl \) на 100,0 г раствора, а его плотность составляет 1,10 г / мл.
Ответ :
|
Концентрация раствора также может быть описана его моляльностью (м), числом молей растворенного вещества на килограмм растворителя:
\ [\ text {моляльность (m)} = \ dfrac {\ text {моль растворенного вещества}} {\ text {килограмм растворителя}} \ tag {13.5} \]
Таким образом, молярность имеет тот же числитель, что и молярность (число молей растворенного вещества) но другой знаменатель (килограмм растворителя, а не литр раствора). Для разбавленных водных растворов молярность и молярность почти одинаковы, поскольку разбавленные растворы в основном являются растворителями. Таким образом, поскольку плотность воды в стандартных условиях очень близка к 1,0 г / мл, объем 1,0 кг \ (H_2O \) в этих условиях очень близок к 1,0 л, а 0,50 М раствор \ (KBr \) в воде, например, имеет примерно ту же концентрацию, что и раствор 0,50 моль.
Для разбавленных водных растворов молярность и молярность почти одинаковы, поскольку разбавленные растворы в основном являются растворителями. Таким образом, поскольку плотность воды в стандартных условиях очень близка к 1,0 г / мл, объем 1,0 кг \ (H_2O \) в этих условиях очень близок к 1,0 л, а 0,50 М раствор \ (KBr \) в воде, например, имеет примерно ту же концентрацию, что и раствор 0,50 моль.
Другой распространенный способ описания концентрации — это отношение массы растворенного вещества к общей массе раствора.{9} \ tag {13.8} \]
В науках о здоровье концентрация раствора часто выражается в частях на тысячу (ppt), обозначенных как пропорции. Например, адреналин, гормон, вырабатываемый в условиях сильного стресса, доступен в виде раствора 1: 1000 или одного грамма адреналина на 1000 г раствора.
На этикетках бутылок с коммерческими реагентами содержание часто указывается в процентах по массе. Например, серная кислота продается в виде 95% -ного водного раствора или 95 г \ (H_2SO_4 \) на 100 г раствора. Части на миллион и части на миллиард используются для описания концентраций сильно разбавленных растворов. Эти измерения соответствуют миллиграммам и микрограммам растворенного вещества на килограмм раствора соответственно. Для разбавленных водных растворов это равно миллиграммам и микрограммам растворенного вещества на литр раствора (при плотности 1,0 г / мл).
Части на миллион и части на миллиард используются для описания концентраций сильно разбавленных растворов. Эти измерения соответствуют миллиграммам и микрограммам растворенного вещества на килограмм раствора соответственно. Для разбавленных водных растворов это равно миллиграммам и микрограммам растворенного вещества на литр раствора (при плотности 1,0 г / мл).
| Пример 5 |
|---|
Несколько лет назад миллионы бутылок с минеральной водой были загрязнены бензолом на уровне частей на миллион.Этот инцидент привлек большое внимание, поскольку смертельная концентрация бензола у крыс составляет 3,8 промилле. Образец минеральной воды объемом 250 мл содержит 12,7 частей на миллион бензола. Поскольку загрязненная минеральная вода представляет собой очень разбавленный водный раствор, мы можем предположить, что ее плотность составляет приблизительно 1,00 г / мл.
Дано : объем образца, концентрация растворенного вещества и плотность раствора Запрошено : молярность растворенного вещества и масса растворенного вещества в 250 мл Стратегия :
Решение : а. A Чтобы рассчитать молярность бензола, нам нужно определить количество молей бензола в 1 л раствора. Мы знаем, что раствор содержит 12,7 промилле бензола. Поскольку 12,7 частей на миллион эквивалентно 12,7 мг / 1000 г раствора, а плотность раствора составляет 1,00 г / мл, раствор содержит 12.{2 +} \) находятся в стакане воды на 8 унций. Ответ : 4,3 × 10-8 M; 2 × 10-6 г |
Как химики решают, какие единицы концентрации использовать для конкретного применения? Хотя молярность обычно используется для выражения концентраций для реакций в растворе или для титрования, у нее есть один недостаток: молярность — это число молей растворенного вещества, деленное на объем раствора, а объем раствора зависит от его плотности, которая является функцией температуры. Поскольку мерная стеклянная посуда калибруется при определенной температуре, обычно 20 ° C, молярность может отличаться от исходного значения на несколько процентов, если раствор готовится или используется при существенно другой температуре, например 40 ° C или 0 ° C. Для многих приложений это может не быть проблемой, но для точной работы эти ошибки могут стать важными. Напротив, мольная доля, моляльность и массовый процент зависят только от масс растворенного вещества и растворителя, которые не зависят от температуры.
Поскольку мерная стеклянная посуда калибруется при определенной температуре, обычно 20 ° C, молярность может отличаться от исходного значения на несколько процентов, если раствор готовится или используется при существенно другой температуре, например 40 ° C или 0 ° C. Для многих приложений это может не быть проблемой, но для точной работы эти ошибки могут стать важными. Напротив, мольная доля, моляльность и массовый процент зависят только от масс растворенного вещества и растворителя, которые не зависят от температуры.
Мольная доля не очень полезна для экспериментов, включающих количественные реакции, но она удобна для расчета парциального давления газов в смесях, как мы видели в главе 10. Как вы узнаете в разделе 13.5, мольные доли также полезны для расчет давления пара некоторых типов растворов. Моляльность особенно полезна для определения того, как такие свойства, как температура замерзания или кипения раствора, меняются в зависимости от концентрации растворенного вещества. Поскольку массовые проценты и части на миллион или миллиард — это просто разные способы выражения отношения массы растворенного вещества к массе раствора, они позволяют нам выразить концентрацию вещества, даже если молекулярная масса вещества неизвестна. .Единицы ppb или ppm также используются для выражения очень низких концентраций, например, остаточных примесей в пищевых продуктах или загрязнителей в исследованиях окружающей среды.
.Единицы ppb или ppm также используются для выражения очень низких концентраций, например, остаточных примесей в пищевых продуктах или загрязнителей в исследованиях окружающей среды.
В таблице 13.5 приведены различные единицы измерения концентрации и типичные области применения для каждой из них. Когда молярная масса растворенного вещества и плотность раствора известны, на практике становится относительно легко преобразовать единицы концентрации, которые мы обсудили, как показано в Примере 6.
Таблица 13.5 Различные единицы измерения концентраций растворов *
| Единица | Определение | Приложение |
|---|---|---|
| * Молярность раствора зависит от температуры, но другие единицы, показанные в этой таблице, не зависят от температура. | ||
| молярность (M) | моль растворенного вещества / литр раствора (моль / л) | Используется для количественных реакций в растворе и титрования; масса и молекулярная масса растворенного вещества и объем раствора известны. |
| мольная доля (X) | моль растворенного вещества / общее количество присутствующих моль (моль / моль) | Используется для парциальных давлений газов и давлений паров некоторых растворов; масса и молекулярная масса каждого компонента известны. |
| моляльность (м) | моль растворенного вещества / кг растворителя (моль / кг) | Используется для определения того, как коллигативные свойства изменяются в зависимости от концентрации растворенного вещества; массы и молекулярная масса растворенного вещества известны. |
| массовый процент (%) | [масса растворенного вещества (г) / масса раствора (г)] × 100 | Полезно, когда массы известны, но молекулярные массы неизвестны. |
| частей на тысячу (ppt) | [масса растворенного вещества / масса раствора] × 103 (г растворенного вещества / кг раствора) | Используемое в науках о здоровье соотношение растворов обычно выражается в виде пропорции, например 1 : 1000. |
| частей на миллион (ppm) | [масса растворенного вещества / масса раствора] × 106 (мг растворенного вещества / кг раствора) | Используется для следовых количеств; массы известны, но молекулярные массы могут быть неизвестны. |
| частей на миллиард (ppb) | [масса растворенного вещества / масса раствора] × 109 (мкг растворенного вещества / кг раствора) | Используется для следовых количеств; массы известны, но молекулярные массы могут быть неизвестны. |
| Пример 6 |
|---|
Водка по существу представляет собой раствор чистого этанола в воде. Типичная водка продается как «крепость 80», что означает, что она содержит 40,0% этанола по объему. Плотность чистого этанола 0,789 г / мл при 20 ° C. Если мы предположим, что объем раствора — это сумма объемов компонентов (что не совсем правильно), вычислите следующее для этанола в водке крепостью 80.
Задано : объемный процент и плотность Запрошено : массовый процент, мольная доля, молярность и молярность Стратегия :
Решение : Ключом к решению этой проблемы является использование плотности чистого этанола для определения массы этанола (\ (CH_3CH_2OH \)), сокращенно EtOH, в заданном объеме раствора. Затем мы можем рассчитать количество молей этанола и концентрацию этанола в любых требуемых единицах измерения. \ [масса \; из\; EtOH = (40,0 \; \ cancel {mL}) \ left (\ dfrac {0,789 \; g} {\ cancel {mL}} \ right) = 31,6 \; грамм\; EtOH \] Если принять плотность воды 1,00 г / мл, масса воды будет 60,0 г. Теперь у нас есть вся информация, необходимая для расчета концентрации этанола в растворе. B Массовый процент этанола — это отношение массы этанола к общей массе раствора, выраженное в процентах: \ [\% EtOH = \ left (\ dfrac {масса \; of \; EtOH } {масса \; of \; solution} \ right) (100) = \ left (\ dfrac {31.6 \; \ cancel {g} \; EtOH} {31.6 \; \ cancel {g} \; EtOH +60.0 \ ; \ cancel {g} \; H_2O} \ right) (100) = 34,5 \% \] C Мольная доля этанола — это отношение количества молей этанола к общему количеству молей веществ в решение. \ [моль \; EtOH = (31,6 \; \ cancel {g \; EtOH}) \ left (\ dfrac {1 \; mol} {46.07 \; \ cancel {g \; EtOH}} \ right) = 0,686 \; mol \; CH_3CH_2OH \] Аналогично, количество молей воды равно \ [моль \; H_2O = (60.0 \; \ cancel {g \; H_2O}) \ left (\ dfrac {1 \; mol \; H_2O} {18.02 \; \ cancel {g \; H_2O}} \ right) = 3.33 \; моль \; H_2O \] Таким образом, мольная доля этанола составляет \ [X_ {EtOH} = \ dfrac {0.686 \; \ cancel {mol}} {0,686 \; \ cancel {mol} + 3.33 \; \ cancel {mol}} = 0.171 \] D Молярность раствора — это количество молей этанола на литр раствора. Нам уже известно количество молей этанола на 100,0 мл раствора, поэтому молярность составляет \ [M_ {EtOH} = \ left (\ dfrac {0,686 \; моль} {100 \; \ cancel {mL}} \ right) \ left (\ dfrac {1000 \; \ cancel {mL}} {L} \ right) = 6,86 \; M \] Моляльность раствора — это количество молей этанола на килограмм растворителя. \ [m_ {EtOH} = \ left (\ dfrac {0.686 \; mol \; EtOH} {60.0 \; \ cancel {g} \; H_2O} \ right) \ left (\ dfrac {1000 \; \ cancel {g}} {kg} \ right) = \ dfrac {11.4 \; моль \; EtOH} {кг \; H_2O} = 11,4 \; m \] |
| Упражнение 7 |
|---|
Раствор готовят путем смешивания 100,0 мл толуола с 300,0 мл бензола. Плотность толуола и бензола составляет 0,867 г / мл и 0,874 г / мл соответственно.Предположим, что объем раствора — это сумма объемов компонентов. Рассчитайте следующее для толуола.
Ответ :
M M 3,59 м толуола |
Авторы и авторство
Домашнее задание
— Как рассчитать массу растворителя, исходя из концентрации молярной доли?
И ваш учитель, и ваш ответ неверны!
Есть два шага к этой проблеме. Во-первых, нам нужно преобразовать массовые доли в мольные. Во-вторых, нам нужно преобразовать базис на сумму в базис на объем . «По количеству» — это слово, которое я придумал для всех единиц, таких как массовая доля, мольная доля, моляльность и т. Д., Которые выражаются на количество (будь то моль или масса) вещества (будь то общее или растворитель). «Объемные» единицы включают такие параметры, как молярность, граммы на литр и т. Д., Где за основу берется объем раствора. Для преобразования количественной основы в объемную необходимо знать плотность раствора!
Во-первых, нам нужно преобразовать массовые доли в мольные. Во-вторых, нам нужно преобразовать базис на сумму в базис на объем . «По количеству» — это слово, которое я придумал для всех единиц, таких как массовая доля, мольная доля, моляльность и т. Д., Которые выражаются на количество (будь то моль или масса) вещества (будь то общее или растворитель). «Объемные» единицы включают такие параметры, как молярность, граммы на литр и т. Д., Где за основу берется объем раствора. Для преобразования количественной основы в объемную необходимо знать плотность раствора!
Пошагово:
- Преобразование в массовую долю
$$ 0.325 \ frac {\ mathrm {mol \; \ ce {h3SO4}}} {\ mathrm {mol \; total}} \ Rightarrow \ frac {0.325 \; \ mathrm {mol \; \ ce {h3SO4}}} {( 1-0.325) \; \ mathrm {mol \; \ ce {h3O}}} $$
$$ \ frac {0.325 \; \ mathrm {mol \; \ ce {h3SO4}}} {(1-0.325) \; \ mathrm {mol \; \ ce {h3O}}} \ times \ frac {98. 1 \ mathrm {\ frac {g \; \ ce {h3SO4}} {mol \; \ ce {h3SO4}}}} {18 \ mathrm {\ frac {g \; \ ce {h3O}} {mol \; \ ce { h3O}}}} = 2.62 \ mathrm {\ frac {g \; \ ce {h3SO4}} {g \; \ ce {h3O}}} \ Rightarrow \ frac {2.62} {2.62 + 1} \ mathrm {\ frac {g \; \ ce {h3SO4}} {g \; total}} = 0,724 \ mathrm {\ frac {g \; \ ce {h3SO4}} {g \; total}} \ Rightarrow (1-0.724) \ mathrm {\ frac {g \; \ ce {h3O}} {g \; total}} = 0,276 \ mathrm {\ frac {g \; \ ce {h3O}} {g \; total}} $$
1 \ mathrm {\ frac {g \; \ ce {h3SO4}} {mol \; \ ce {h3SO4}}}} {18 \ mathrm {\ frac {g \; \ ce {h3O}} {mol \; \ ce { h3O}}}} = 2.62 \ mathrm {\ frac {g \; \ ce {h3SO4}} {g \; \ ce {h3O}}} \ Rightarrow \ frac {2.62} {2.62 + 1} \ mathrm {\ frac {g \; \ ce {h3SO4}} {g \; total}} = 0,724 \ mathrm {\ frac {g \; \ ce {h3SO4}} {g \; total}} \ Rightarrow (1-0.724) \ mathrm {\ frac {g \; \ ce {h3O}} {g \; total}} = 0,276 \ mathrm {\ frac {g \; \ ce {h3O}} {g \; total}} $$
Этот шаг довольно легко выполнить, используя информацию в задаче. В 100 г раствора содержится 72,4 грамма серной кислоты. Все идет нормально.
- Преобразование в объемную основу
Но на этом этапе проблема становится очень сложной:
… какова масса воды (в граммах) в 100 мл раствора?
Здесь написано 100 мл , а не 100 г.Это значительно усложняет задачу. Это также делает неправильным ответ вашего учителя:
Учитель не убежден в этом ответе и говорит, что он неправильный, потому что общее количество должно быть 100 г
Общее количество не обязательно должно составлять 100 г, потому что мы, очевидно, имеем дело со 100 мл раствора. В зависимости от плотности раствора общая масса будет больше или меньше 100 г.
В зависимости от плотности раствора общая масса будет больше или меньше 100 г.
Согласно Википедии, серная кислота с массовой долей 0,7 имеет плотность 1.60 кг / л и при массовой доле 0,78 имеет плотность 1,70 кг / л. Предположим, массовая доля 0,724 имеет плотность ~ 1,65 кг / л.
$$ 0,276 \ mathrm {\ frac {g \; \ ce {h3O}} {g \; total}} \ times \ frac {1650 \ mathrm {\; g \; total}} {\ mathrm {L}} = 46 \ mathrm {\ frac {g \; \ ce {h3O}} {L}} $$
По окончательному числу теперь легко увидеть, что если на литр воды 430 грамм, то в 100 мл 46 грамм воды .
.

 Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. С.,
С., Авторы
Авторы
 Концентрация — это отношение количества данного компонента к количеству всего раствора. Чаще всего встречаются четыре вида концентраций: массовая, объемная и мольная доли, а также молярная концентрация.
Концентрация — это отношение количества данного компонента к количеству всего раствора. Чаще всего встречаются четыре вида концентраций: массовая, объемная и мольная доли, а также молярная концентрация.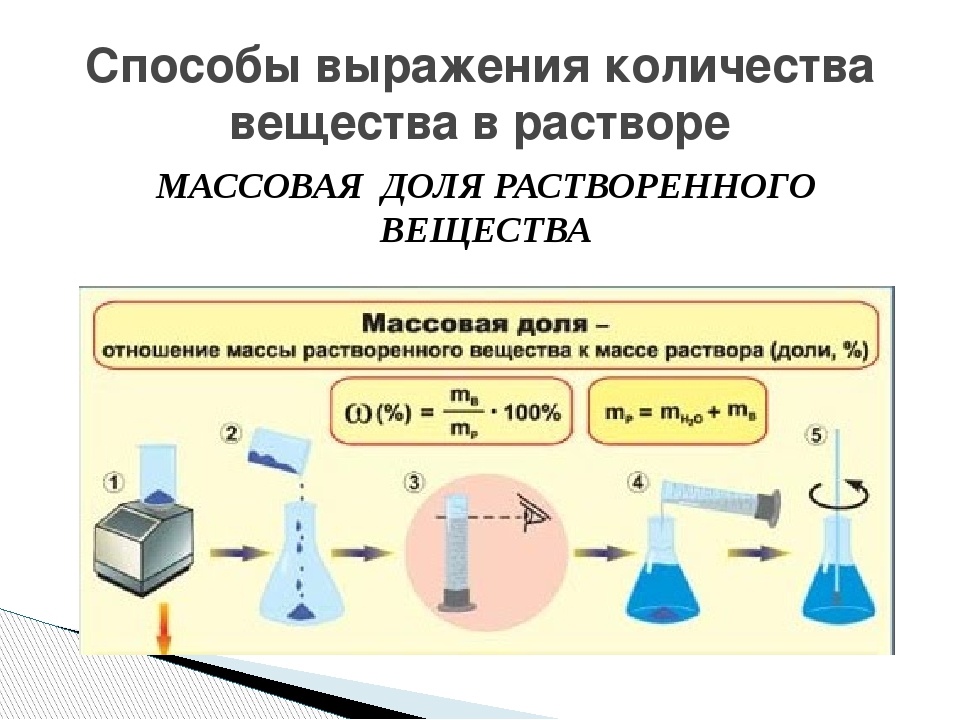 Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».
Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».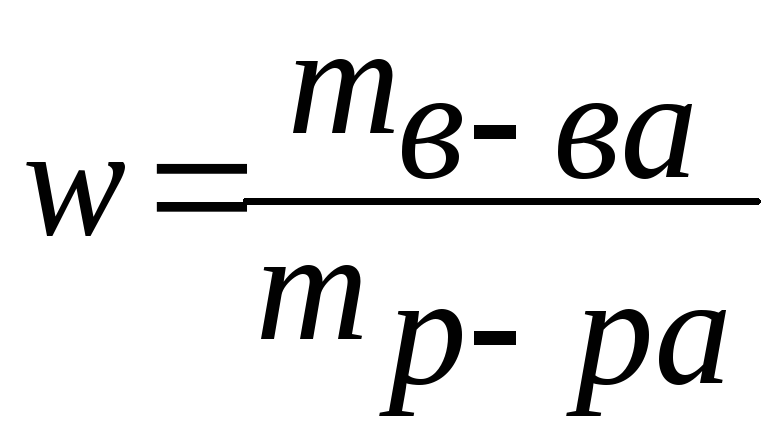 Массовая доля сахара в растворе вычисляется по формуле (1):
Массовая доля сахара в растворе вычисляется по формуле (1):
 Каким количеством растворителя необходимо разбавить 240 г 65 %-го раствора, чтобы получить 40 %-й раствор?
Каким количеством растворителя необходимо разбавить 240 г 65 %-го раствора, чтобы получить 40 %-й раствор? Обозначим массу добавленного растворителя за x и перепишем выражение для массовой доли вещества во втором растворе, приравняв его к 40 %, как сказано в условии задачи:
Обозначим массу добавленного растворителя за x и перепишем выражение для массовой доли вещества во втором растворе, приравняв его к 40 %, как сказано в условии задачи: Например, когда говорят: «в воздухе содержится 21 % кислорода», имеют в виду именно объемную долю: φ(O2) = 21 % (рис. 2).
Например, когда говорят: «в воздухе содержится 21 % кислорода», имеют в виду именно объемную долю: φ(O2) = 21 % (рис. 2). е., фактически, не имеет размерности. Это обусловлено тем, что при вычислении долей мы делим друг на друга одинаковые величины: массы, объемы, количества веществ, а значит, их размерности сокращаются. Следующий вид концентраций имеет собственную размерность.
е., фактически, не имеет размерности. Это обусловлено тем, что при вычислении долей мы делим друг на друга одинаковые величины: массы, объемы, количества веществ, а значит, их размерности сокращаются. Следующий вид концентраций имеет собственную размерность.
 При этом молярные концентрации этой соли составляют соответственно 3,3 моль/л и 0,5 моль/л. Таким образом, массовые доли различаются примерно в 5,5 раз, а молярности — в 6,6 раз. Это объясняется тем, что воды двух морей имеют разную плотность: у Мертвого моря она настолько велика, что в нем почти невозможно утонуть; плотность человеческого тела меньше плотности такого солевого раствора (рис. 3).
При этом молярные концентрации этой соли составляют соответственно 3,3 моль/л и 0,5 моль/л. Таким образом, массовые доли различаются примерно в 5,5 раз, а молярности — в 6,6 раз. Это объясняется тем, что воды двух морей имеют разную плотность: у Мертвого моря она настолько велика, что в нем почти невозможно утонуть; плотность человеческого тела меньше плотности такого солевого раствора (рис. 3). Поэтому в медицине нашатырный спирт используется для того, чтобы вернуть в сознание человека, упавшего в обморок. Обычно — это 5,6 М раствор аммиака в воде, имеющий плотность 0,95 г/мл. Чему равна массовая доля аммиака в нашатырном спирте такой концентрации?
Поэтому в медицине нашатырный спирт используется для того, чтобы вернуть в сознание человека, упавшего в обморок. Обычно — это 5,6 М раствор аммиака в воде, имеющий плотность 0,95 г/мл. Чему равна массовая доля аммиака в нашатырном спирте такой концентрации? При этом не забудем перевести литры в миллилитры, чтобы избежать конфликта размерностей:
При этом не забудем перевести литры в миллилитры, чтобы избежать конфликта размерностей: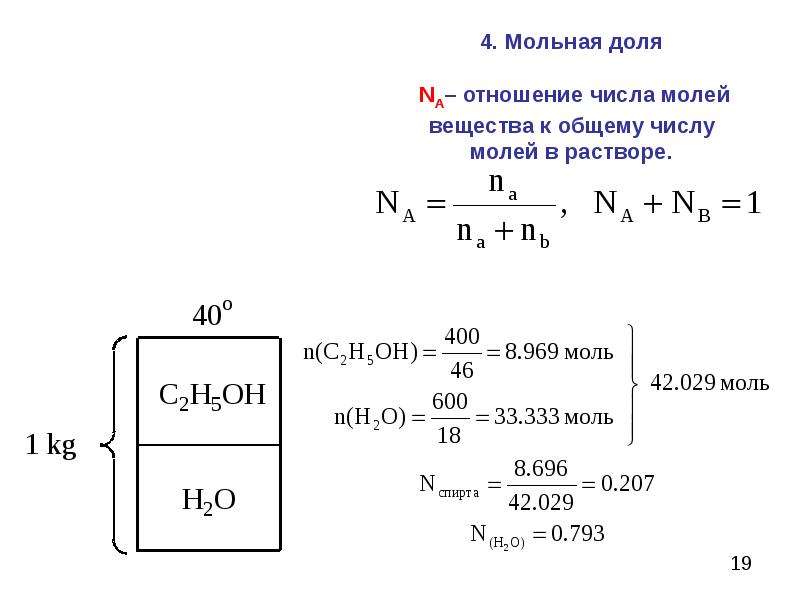 Чему равна массовая доля мяты в таком коктейле? Можно ли посчитать массовую долю воды в нем?
Чему равна массовая доля мяты в таком коктейле? Можно ли посчитать массовую долю воды в нем? Смешали 60 г 30 %-го раствора и 170 г 45 %-го раствора. Определите массовую долю растворенного вещества в новом растворе.
Смешали 60 г 30 %-го раствора и 170 г 45 %-го раствора. Определите массовую долю растворенного вещества в новом растворе.




 Если 100,0 г водного раствора (равного 100 мл) содержит 3,78 г уксусной кислоты, то 1 л раствора будет содержать 37,8 г уксусной кислоты, что немного больше, чем \ (\ frac {1} {2} \) крот. Однако имейте в виду, что масса и объем раствора связаны его плотностью; концентрированные водные растворы часто имеют плотность более 1,00 г / мл.
Если 100,0 г водного раствора (равного 100 мл) содержит 3,78 г уксусной кислоты, то 1 л раствора будет содержать 37,8 г уксусной кислоты, что немного больше, чем \ (\ frac {1} {2} \) крот. Однако имейте в виду, что масса и объем раствора связаны его плотностью; концентрированные водные растворы часто имеют плотность более 1,00 г / мл. {−2} \]
{−2} \]
 0 мл раствора. Рассчитайте массу воды в 100,0 мл раствора.
0 мл раствора. Рассчитайте массу воды в 100,0 мл раствора.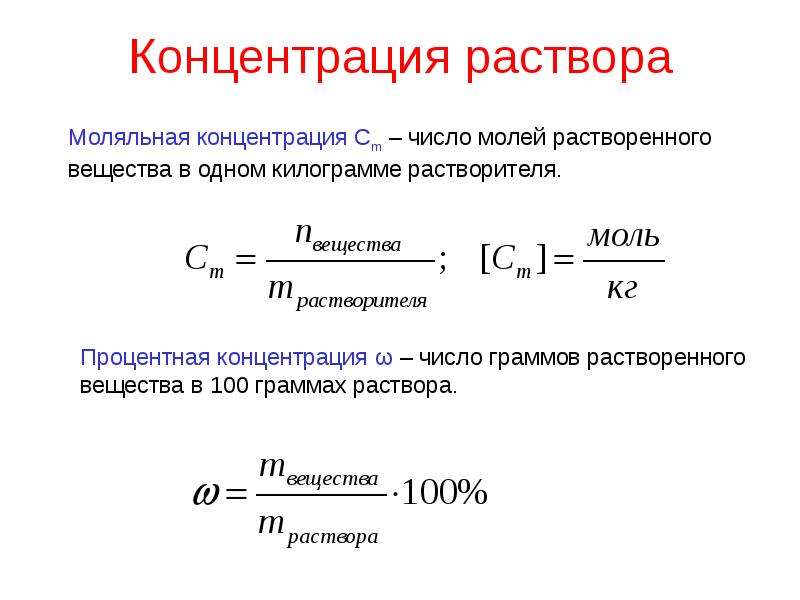 A Поскольку нам дан объемный процент, мы предполагаем, что у нас есть 100.0 мл раствора. Таким образом, объем этанола будет составлять 40,0% от 100,0 мл или 40,0 мл этанола, а объем воды будет составлять 60,0% от 100,0 мл или 60,0 мл воды. Масса этанола получается из его плотности:
A Поскольку нам дан объемный процент, мы предполагаем, что у нас есть 100.0 мл раствора. Таким образом, объем этанола будет составлять 40,0% от 100,0 мл или 40,0 мл этанола, а объем воды будет составлять 60,0% от 100,0 мл или 60,0 мл воды. Масса этанола получается из его плотности: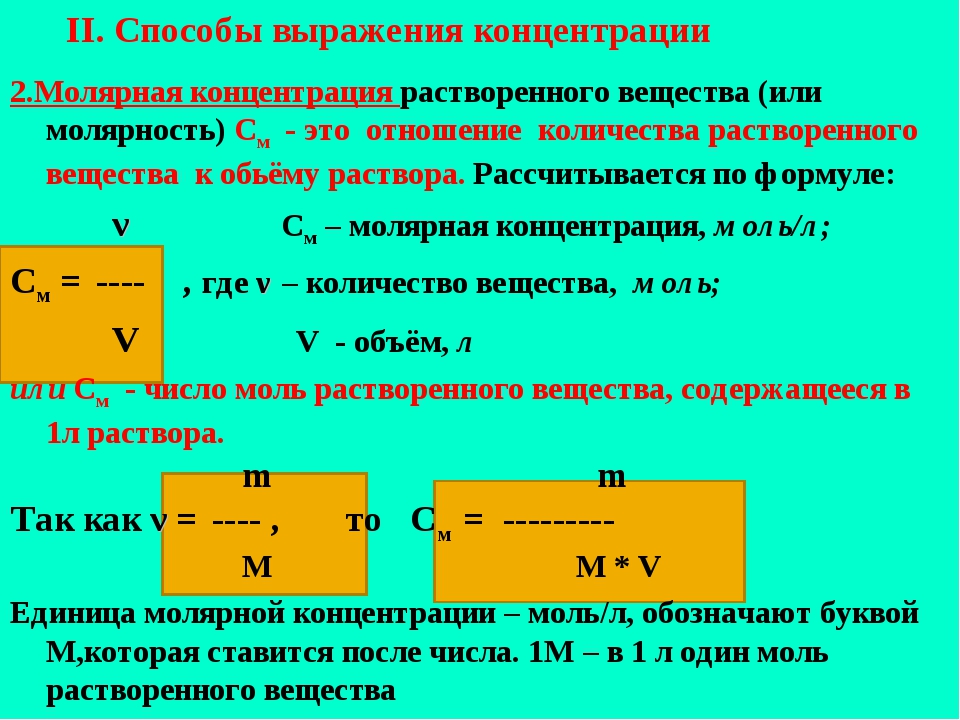 Поскольку 40,0 мл этанола имеет массу 31,6 г, мы можем использовать молярную массу этанола (46,07 г / моль) для определения количества молей этанола в 40,0 мл:
Поскольку 40,0 мл этанола имеет массу 31,6 г, мы можем использовать молярную массу этанола (46,07 г / моль) для определения количества молей этанола в 40,0 мл: Потому что мы знаем количество молей этанола в 60.0 г воды, расчет снова прост:
Потому что мы знаем количество молей этанола в 60.0 г воды, расчет снова прост: