Содержание
История веществ: веселящий газ — Mendeleev.info
…В химию автор этих строк пришёл через олимпиады. И уже в седьмом классе (у нас было десятилетнее образование) мы чертили структурно-валентные формулы разных простеньких веществ. Именно тогда, готовясь к олимпиадам, я с удивлением узнал, что в оксиде азота (I), знаменитом веселящем газе, о существовании которого я вообще узнал из песни Гребенщикова (помните – «из кухонных кранов бьёт веселящий газ»…) – в общем, там – азот не одновалентный, как нас учили в школе. Еще и волшебное слово «резонансная структура» появилось в лексиконе у нас, восьмиклассников, что заметно помогло нам впоследствии справиться с ароматическими соединениями.
Что же, давайте разберемся с этим интереснейшим соединением, которое совсем не так просто, как кажется из его брутто-формулы N2O.
Впервые человечество познакомил с нашим героем британский химик (впрочем, тогда было принято говорить «натурфилософ», первооткрыватель кислорода, Джозеф Пристли. В своей книге «Эксперименты и наблюдения за разными видами воздуха», вышедшей в 1775 году, он рассказал, как тремя годами ранее он получил «флогистинированный нитрозный воздух» нагреванием железных опилок, смоченных азотной кислотой. Кстати, тогда же он открыл и монооксид азота NO. Его Пристли назвал «селитряным возухом». Впрочем, сейчас не о «старшем брате» нашего героя.
В своей книге «Эксперименты и наблюдения за разными видами воздуха», вышедшей в 1775 году, он рассказал, как тремя годами ранее он получил «флогистинированный нитрозный воздух» нагреванием железных опилок, смоченных азотной кислотой. Кстати, тогда же он открыл и монооксид азота NO. Его Пристли назвал «селитряным возухом». Впрочем, сейчас не о «старшем брате» нашего героя.
Джозеф Пристли
Названий у N2O – множество. Закись азота, оксид азота (I), веселящий газ, оксонитрид азота (I), оксид диазота… «Химия ваша обильна и богата, а порядку в ней нет». Что же представляло собой открытие Пристли. Газ, бесцветный, негорючий, сладковатый приятный запах и даже привкус… Очень небольшая разница между температурами кипения и замерзания – при -88 С он еще веселящий газ, а при -91 С – это уже веселящий снег. Чуть больше двух градусов кельвина – интервал существования жидкой фазы!
Практического применения нашему герою довелось ждать чуть более двух десятков лет. В 1794 году вышла книга одного из изобретателей паровой машины Джеймса Уатта и реформатора медицины Томаса Беддоу «Соображения о медицинском использовании и производстве искусственных воздухов» (именно так, тогда воздухов было много – как мы помним, оксиды азота Пристли называл воздухами).
\
Томас Беддоу
В этой книге было два важных момента. Во-первых, Уатт в ней предложил «машину» для производства N2O, а также ингаляционный прибор для медицинского использования газов. А во-вторых, Беддоу представил новую теорию о том, что туберкулёз и другие легочные заболевания могут быть излечены ингаляциями «искусственных воздухов». Не сработало, конечно, зато способ употребления был найден.
Прошло еще полвека, и Горацио Уэллс, американский стоматолог, провел первое в истории удаление зуба с анестезией веселящим газом. Впрочем, наркотический качества веселящего газа стали понятны еще в XVIII веке. С 1799 года и минимум до 1863 года источники отмечают новую забаву среди высшего света в Великобритании – «вечеринки веселящего газа», где салонная публика собиралась для того, чтобы надышаться закисью азота до явления короля Артура.
Удаление зуба с анестезией веселящим газом Горацио Уэллсом
Интересно, что наркотический и обезболивающий эффекты оксида азота обеспечиваются двумя разными механизмами. Первый – активацией эндогенной опиоидной системы и взаимодействии ее с нисходящей норадренергической системой.
Первый – активацией эндогенной опиоидной системы и взаимодействии ее с нисходящей норадренергической системой.
Второй – воздействием N2O на мезолимбический путь и выделение избыточного дофамина в зоне награды. Такая маленькая молекула, а такое сложное действие!
Любителям автотюнинга наш герой тоже добавляет веселья. А точнее – бодрости двигателю их автомобиля. Впрыск N2O в цилиндры снижает температуру всасываемого в цилиндры воздуха, увеличивая плотность смеси и повышает скорость сгорания топлива. Кстати, любопытно, что и это применение оксида азота – не ново, первым в двигателях его использовал еще пионер ракетного дела Роберт Годдард, в прошлом году исполнилось ровно век со дня начала зажигательной карьеры веселящего газа.
Но вернёмся, в завершение нашей статьи, к олимпиаде и структурным формулам. Так как же выглядит на самом деле молекула оксида азота? Неужели кажущаяся логичной структурная формула N-O-N – неправильна?
Строение_молекулы_оксида_азота(I)
Совершенно верно. Молекула N2O cовсем не такая, и дело даже не в кратности связей. Даже топологически она устроена иначе – два атома азота соединены друг с другом, и к одному из них присоединён атом кислорода.
Молекула N2O cовсем не такая, и дело даже не в кратности связей. Даже топологически она устроена иначе – два атома азота соединены друг с другом, и к одному из них присоединён атом кислорода.
Более того, одной структурной формулой тут не обойтись. Есть целых четыре структуры, которые описывают эту молекулу и вносят в ее настоящий вид каждая свой вклад (рис.) Здесь нет одинарных, двойных и тройных связей, если выражаться точно, то связь азот-азот имеет кратность 2,73, а связь азот-кислород -1,61. Так что можно только поражаться, сколько сложностей, тонкостей и неожиданностей могут прятаться всего в трёх атомах – или трёх знаках знакомой со школы формулы N2O.
Электроотрицательность. Степень окисления и валентность.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО | Значение постоянной СО этого элемента |
Щелочные металлы, т.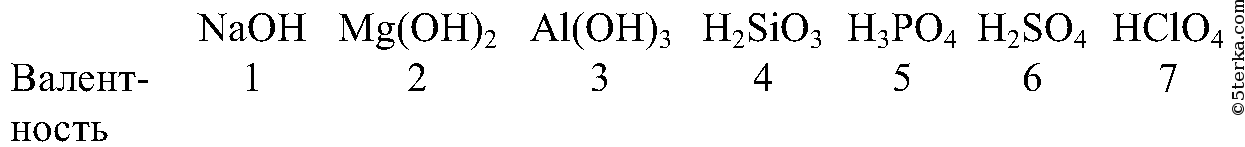 е. все металлы е. все металлыIA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент | Номер группы | Высшая степень окисления |
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | 0 |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.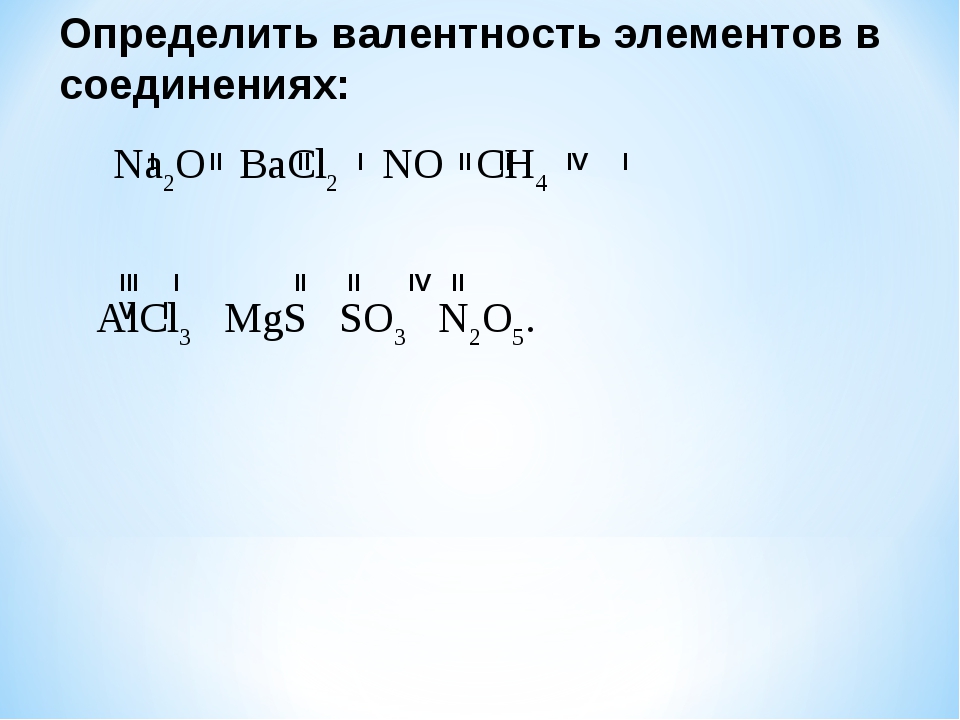
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т. д.
д.
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).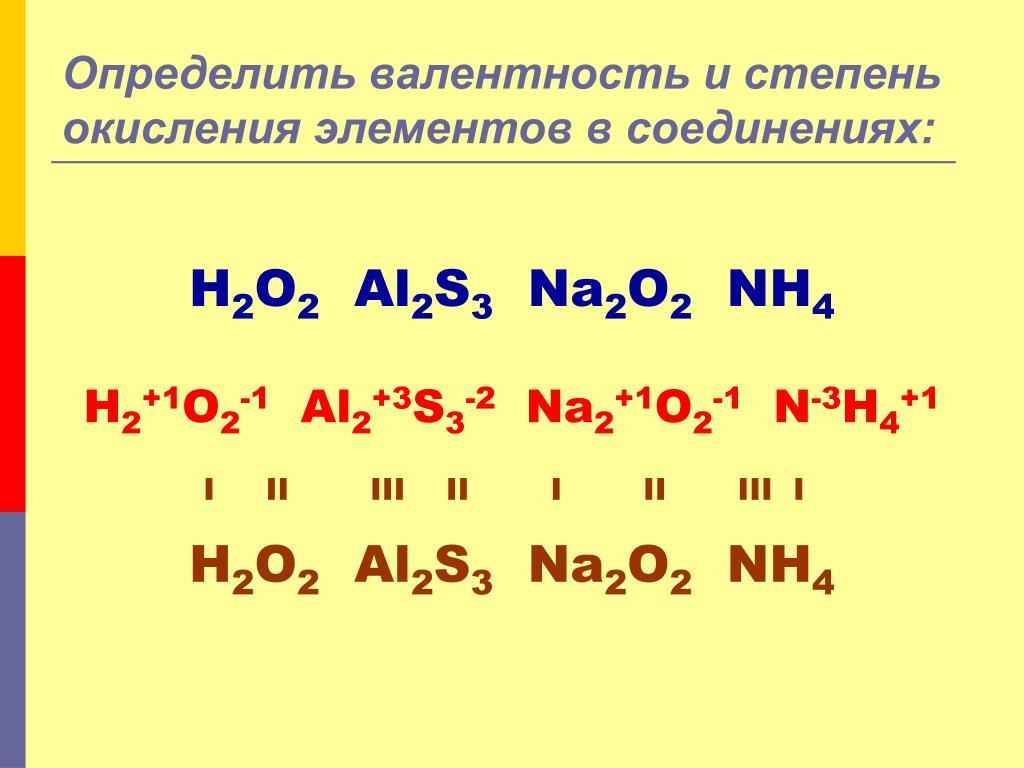
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Урок по химии в 8-м классе по теме: «Валентность. Определение валентности по формулам» | План-конспект урока по химии (8 класс) на тему:
Урок по химии в 8-м классе
по теме: «Валентность. Определение валентности по формулам»
Цели урока.
Дидактические:
опираясь на знания учащихся, повторить понятия “химическая формула”;
способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ;
акцентировать внимание школьников на возможности интеграции курсов химии, математики.
Развивающие:
продолжить формирование умений формулировать определения;
разъяснять смысл изученных понятий и объяснять последовательность действий при определении валентности по формуле вещества;
способствовать обогащению словарного запаса, развитию эмоций, творческих способностей;
развивать умение выделять главное, существенное, сравнивать, обобщать, развивать дикцию, речь.
Воспитательные:
воспитывать чувство товарищества, умение работать коллективно;
повысить уровень эстетического воспитания учащихся;
ориентировать учащихся на здоровый образ жизни.
Планируемые результаты обучения:
Учащиеся должны уметь формулировать определение “валентность”, знать валентность атомов водорода и кислорода в соединениях, определять по ней валентность атомов других элементов в бинарных соединениях,
Уметь разъяснять смысл понятия “валентность” и последовательность действий при определении валентности атомов элементов по формулам веществ.
Понятия, впервые вводимые на уроке: валентность, постоянная и переменная валентность.
Организационные формы: беседа, индивидуальные задания, самостоятельная работа.
Средства обучения: алгоритм определения валентности.
Демонстрационное оборудование: шаростержневые модели молекул хлороводорода, воды, аммиака, метана.
Оборудование для учащихся: на каждом столе “Алгоритм определения валентности”.
Опережающее задание: индивидуальное задание – подготовить сообщение на тему “Эволюция понятия “валентность”.
Ход урока
I. Ориентировочно-мотивационный этап.
1. Фронтальная беседа с учащимися по пройденной теме “Химическая формула”.
Задание: Что здесь написано? (Демонстрация учителем формул, отпечатанных на отдельных листах).
2. Индивидуальная работа по карточкам по теме “Относительная молекулярная масса”. Проверка учителем.
Карточка № 1. Рассчитайте относительную молекулярную массу данных веществ: NaCl, K2O.
Справочные данные:
Аr (Na) = 23
Аr (Cl) = 35,5
Аr (K) = 39
Аr (O) = 16
Карточка № 2. Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2.
Справочные данные:
Аr (Cu) = 64
Аr (O) = 16
Аr (S) =3 2
Карточка № 3. Рассчитайте относительную молекулярную массу данных веществ: Ch5, NO.
Справочные данные:
Аr (С) = 12
Аr (H) = 1
Аr (N) = 14
Аr (O) = 16
3. Самостоятельная работа учащихся в тетрадях.
Самостоятельная работа учащихся в тетрадях.
Задача информационно-вычислительного характера (условие записано в раздаточном материале).
Эффективность зубных паст в профилактике кариеса можно сравнить по содержанию в них активного фтора, способного взаимодействовать с зубной эмалью. Зубная паста “Crest” (производство США) содержит, как указано на упаковке, SnF2, а зубная паста “FM extra DENT” (производство Болгария) содержит NaF. Вычислите, какая из этих двух паст более сильнодействующее средство для профилактики кариеса.
Проверка.
II. Операционно-исполнительный этап.
1. Объяснение учителя. Постановка проблемы.
Понятие о валентности.
– До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: сравните качественный и количественный состав в молекулах:
HCl , h3O, Nh4, Ch5.
Беседа с учащимися:
– Что общего в составе молекул?
Предполагаемый ответ: Наличие атомов водорода.
– Чем они отличаются друг от друга?
Предполагаемый ответ:
HCl – один атом хлора удерживает один атом водорода,
h3O – один атом кислорода удерживает два атома водорода,
Nh4 – один атом азота удерживает три атома водорода,
Ch5 – один атом углерода удерживает четыре атома водорода.
Демонстрация шаростержневых моделей.
Проблема: Почему различные атомы удерживают различное количество атомов водорода?
(Выслушиваем варианты ответов учащихся).
Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это и называется валентностью. Слово “валентность” происходит от лат. valentia – сила.
Запись в тетради:
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность обозначается римскими цифрами.
Записи в тетрадях:
I I
HCl
I II
h3O
I III
h4N
I IV
h5C
Валентность атома водорода принята за единицу, а у кислорода – II.
Валентность атомов некоторых элементов | ||
Величина валентности | Металлы | Неметаллы |
Одновалентные Двухвалентные Трехвалентные Четырехвалентные Пятивалентные Шестивалентные | Na K Ag Cu Hg Mg Ca Ba Cu Hg Fe Zn Sn Pb Cr Al Cr Fe | H Cl O S N C Si S N P S |
Шрифтом выделены элементы с постоянной валентностью | ||
2. Эволюция понятия “валентность” (сообщение учащегося).
– В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т. д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А.С. Купер и А.Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В.Гейтлер и Ф.Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода h3.
3. Определение валентности атомов элементов в соединениях.
Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
Алгоритм определения валентности
Пример
1. Запишите формулу вещества. h3S, Cu2O
2. Обозначьте известную валентность элемента I
h3S,
II
Cu2O
3. Найдите число единиц валентности атомов известного элемента, умножив валентность элемента на количество его атомов 2
I
h3S
2
II
Cu2O
4. Поделите число единиц валентности атомов на количество атомов другого элемента. Полученный ответ и является искомой валентностью 2
Поделите число единиц валентности атомов на количество атомов другого элемента. Полученный ответ и является искомой валентностью 2
I II
h3S
2
I II
Cu2O
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента I II
h3S
(2=2) I II
Cu2O
(2=2)
4. Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). Задание в раздаточном материале.
Sih5, CrO3, h3S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, Sih5, Mn2O7, MnO, CuO, N2O3.
III. Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: Nh4, Au2O3, Sih5, CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe2O3 , CrO3, CuO, K2O, Саh3.
Творческий уровень (“5”). Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте валентности над каждым элементом.
Проверка выборочная. Консультант из числа учащихся по готовому шаблону проверяет 4 тетради учащихся.
Работа над ошибками. Ответы на обратной стороне доски.
IV. Подведение итогов урока.
Беседа с учащимися:
Какую проблему мы поставили в начале урока?
К какому выводу мы пришли?
Дать определение “валентности”.
Чему равна валентность атома водорода? Кислорода?
Как определить валентность атома в соединении?
Оценка работы учащихся в целом и отдельных учащихся.
Домашнее задание: § 4, стр. 23–25, упр. на стр. 25.
Д.з по теме «ВАЛЕНТНОСТЬ»
Валентность атомов некоторых элементов | ||
Величина валентности | Металлы | Неметаллы |
Одновалентные = I Двухвалентные =II Трехвалентные = III Четырехвалентные IV Пятивалентные V Шестивалентные VI | Na K Ag Cu Hg Mg Ca Ba Cu Hg Fe Zn Sn Pb Cr Al Cr Fe | H Cl O S N C Si S N P S |
Шрифтом выделены элементы с постоянной валентностью | ||
КАК СОСТАВИТЬ ФОРМУЛУ ХИМИЧЕСКОГО СОЕДИНЕНИЯ
1.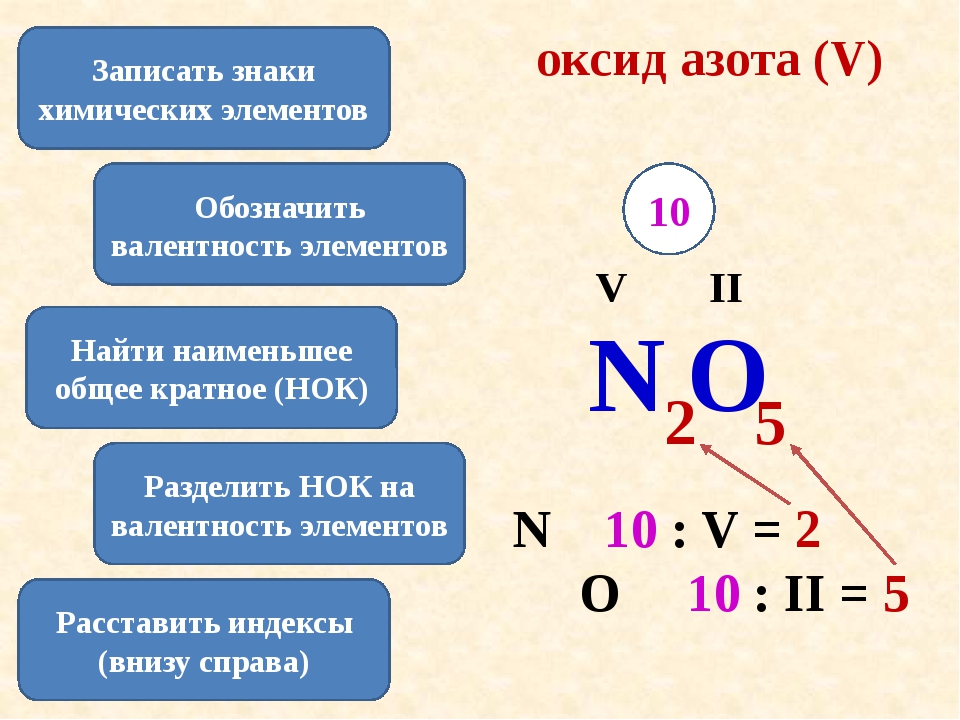 Напишем рядом знаки элементов, которые входят в состав соединения.
Напишем рядом знаки элементов, которые входят в состав соединения.
2. Над химическими знаками элементов обозначим их валентность.
З. Определим наименьшее общее кратное чисел, выражающих валентность обоих элементов
(это наименьшее число, которое делится на валентность обоих элементов).
4. Чтобы найти индексы (число атомов) каждого элемента, делим наименьшее общее
кратное валентностей на валентность каждого элемента.
5. Еще раз перемножаем число атомов каждого элемента на его валентность и проверяем,
одинаковы ли произведения.
Упражнение: определить валентность элементов в веществах
х I
Например: SiH 4 х= 4:1=4 валентность Si= 4
4=4
CrO3, h3S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O,
Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, Sih5, Mn2O7, MnO, CuO, N2O3.
Строение молекул. Метод валентных связей
Опишите строение молекулы кислорода с позиций метода валентных связей и метода молекулярных орбиталей. Начертите энергетическую диаграмму молекулярных орбиталей кислорода. Объясните парамагнетизм кислорода. [c.115]
Начертите энергетическую диаграмму молекулярных орбиталей кислорода. Объясните парамагнетизм кислорода. [c.115]
Строение молекул. Метод валентных связей [c.22]
Какую химическую связь называют ковалентной Чем можно объяснить направленность ковалентной связи Как метод валентных связей объясняет строение молекулы воды [c.380]
Учение о химической связи является центральной проблемой современной химии. Чтобы описать химическую связь в веществе, необходимо выяснить, как распределяется электронная плотность. Для этого требуется решение уравнения Шредингера. Как видно, подход к исследованию строения атомов и молекул одиТ) и тот же. Решение уравнения Шредингера осуществлено только для молекулярного иона водорода Нг , состоящего из двух протонов и одного электрона. Поскольку точное решение уравнения Шредингера для более сложных молекул невозможно, применяют приближенные методы расчета волновой функции Ф . Главными являются метод валентных связей (ВС) и метод молекулярных орбиталей (МО). [c.229]
Главными являются метод валентных связей (ВС) и метод молекулярных орбиталей (МО). [c.229]
Метод молекулярных орбиталей, как и метод валентных связей, является приближенным. Для молекул, к которым применим метод ВС, а метод МО дает аналогичные результаты, обычно применяют метод ВС, так как он наглядней. Метод МО является более общим по сравнению с методом ВС он менее нагляден, но позволяет описывать строение и физические свойства молекул тех соединений, которые не могут быть описаны по методу ВС. [c.112]
Опишите строение молекулы ЗО2 с позиций метода валентных связей. [c.122]
Мы рассмотрели представления о химической связи с позиций метода молекулярных орбиталей и метода валентных связей (схем). Пользуясь этими теориями, объяснили некоторые конкретные примеры строения молекул, рассмотрели влияние строения молекул на их свойства. Эти приближенные теории помогают ориентироваться в большом многообразии экспериментальных данных. Однако, несмотря на большие успехи в развитии учения о химической связи, теорию, способную количественно предсказать свойства огромного разнообразия веществ, еще предстоит разработать. [c.74]
Однако, несмотря на большие успехи в развитии учения о химической связи, теорию, способную количественно предсказать свойства огромного разнообразия веществ, еще предстоит разработать. [c.74]
Укажите, какие из следующих частиц являются реальными, а какие—гипотетическими с точки зрения учения о строении молекул (метод валентных связей) [c.54]
Появление определенной симметрии в молекулах было уже объяснено (разд. 6.3.2) на основе метода валентных связей при образовании ковалентной связи (гибридизация). Однако как чисто электростатические, так и геометрические соотношения могут привести к определенной симметрии в координационных соединениях, если исходить из ионной модели строения молекулы. Рассмотрим, например, координационный полиэдр А +Вр, в котором центральный ион с зарядом — п окружен р однозарядными лигандами. Потенциальная энергия комплекса складывается из отдельных членов, учитывающих кулоновское взаимодействие ионных пар. Сумма отрицательных (связывающих) членов тем больше, чем меньше расстояние между ионом и лигандом. Минимальное расстояние между ионом и лигандом равно гп+г (гп —радиус центрального иона, г —радиус лиганда). Для октаэдрического комплекса с симметрией Ол [c.121]
Минимальное расстояние между ионом и лигандом равно гп+г (гп —радиус центрального иона, г —радиус лиганда). Для октаэдрического комплекса с симметрией Ол [c.121]
Как указывалось выше, оба метода рассмотрения строения молекул метод валентных связей и метод молекулярных орбиталей — приводят к одинаковому результату и дают приблизительно верную картину образования химической связи. Химическая связь возникает за счет пары электронов с противоположно ориентированными спинами. Это утверждение отражает принцип Паули. Разница заключается в том, что в методе валентных связей пара электронов локализуется на связи, а в методе молекулярных орбиталей она занимает дозволенную молекулярную орбиталь. К сожалению, изложенные представления не могут целиком удовлетворить химика с практической точки зрения. Рассмотрим с этой стороны оба метода. [c.100]
Метод молекулярных орбит не противоречит рассматривавшемуся выше методу валентных связей, а скорее дополняет его. Для трактовки одних свойств молекул (например, пространственного строения) пригоднее метод валентных связей, других (например, электронных спектров) — метод молекулярных орбит. Последний менее нагляден, но легче поддается математической обработке, а потому более удобен для попыток теоретического расчета некоторых свойств, характерных для молекул в целом (например, энергий возбуждения). Вместе с тем один из главных недостатков орбитальной модели состоит в том, что она не в состоянии правильно — в количественном отношении — предсказать прочность химической связи (У о л). Метод молекулярных орбит более гибок в смысле возможности введения тех или иных специальных допущений (например, трехцентровых орбит), предназначенных для истолкования частных особенностей некоторых молекулярных структур. Однако общей теоретической основой химической практики был и остается метод валентных связей, наглядным выражением которого являются структурные формулы веществ. Только с их помощью удавалось и удается успешно решать задачи целенаправленного химического синтеза.
Для трактовки одних свойств молекул (например, пространственного строения) пригоднее метод валентных связей, других (например, электронных спектров) — метод молекулярных орбит. Последний менее нагляден, но легче поддается математической обработке, а потому более удобен для попыток теоретического расчета некоторых свойств, характерных для молекул в целом (например, энергий возбуждения). Вместе с тем один из главных недостатков орбитальной модели состоит в том, что она не в состоянии правильно — в количественном отношении — предсказать прочность химической связи (У о л). Метод молекулярных орбит более гибок в смысле возможности введения тех или иных специальных допущений (например, трехцентровых орбит), предназначенных для истолкования частных особенностей некоторых молекулярных структур. Однако общей теоретической основой химической практики был и остается метод валентных связей, наглядным выражением которого являются структурные формулы веществ. Только с их помощью удавалось и удается успешно решать задачи целенаправленного химического синтеза.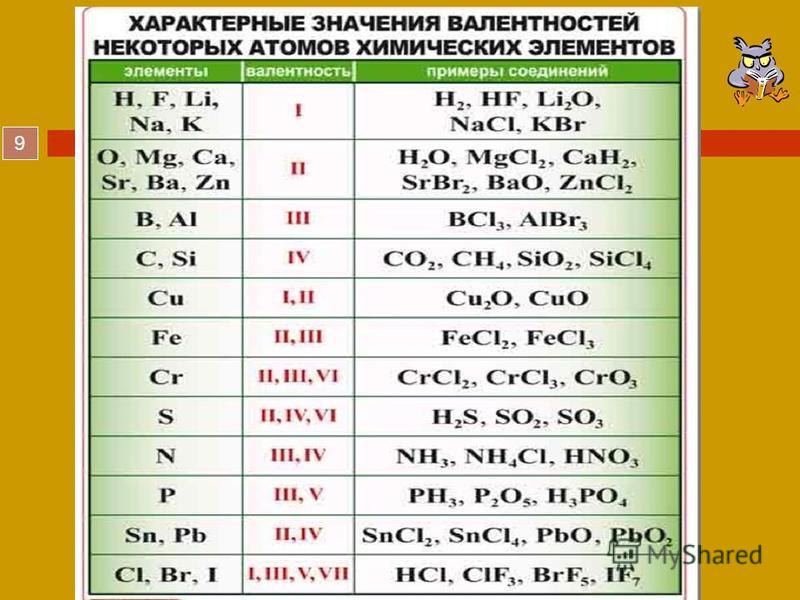 [c.233]
[c.233]
Метод молекулярных орбит не противоречит рассматривавшемуся выше методу валентных связей, а скорее дополняет его. Для трактовки одних свойств молекул (например, пространственного строения) пригоднее метод валентных связей, других (например, электронных спектров) — метод молекулярных орбит. Последний менее нагляден, но легче поддается математической обработке, а потому более удобен для попыток (пока — мало успешных) теоретического расчета некоторых свойств молекул. Он более гибок в смысле возможности введения тех или иных специальных допущений (например, трехцентровых орбит), предназначенных для истолкования частных особенностей некоторых молекулярных структур. Однако общей теоретической основой химической практики был и остается метод валентных связей, наглядным выражением которого являются структурные формулы веществ. Только с их помощью удавалось и удается успешно решать задачи целенаправленного химического синтеза. [c.235]
Разность энергии активированного комплекса и средней энергии исходных молекул и есть энергия активации. Ее природа была объяснена Лондоном (1928 г.) на основе метода валентных связей. Энергетический барьер создается в результате взаимного отталкивания химически не соединенных атомов (см. разд. 2.5). Следует подчеркнуть, что переходное состояние благодаря максимальной энергии (см. ниже) является неустойчивым, поэтому оно не может быть отождествлено с химическим соединением в обычном смысле слова (к нему неприменимы в полной мере такие понятия, как валентные углы, межатомные расстояния п т. д.). Состав и строение активированных комплексов известны только для немногих наиболее детально изученных реакций. [c.220]
Ее природа была объяснена Лондоном (1928 г.) на основе метода валентных связей. Энергетический барьер создается в результате взаимного отталкивания химически не соединенных атомов (см. разд. 2.5). Следует подчеркнуть, что переходное состояние благодаря максимальной энергии (см. ниже) является неустойчивым, поэтому оно не может быть отождествлено с химическим соединением в обычном смысле слова (к нему неприменимы в полной мере такие понятия, как валентные углы, межатомные расстояния п т. д.). Состав и строение активированных комплексов известны только для немногих наиболее детально изученных реакций. [c.220]
Следует всегда помнить, что таким образом отражается лишь-то обстоятельство, что метод валентных связей является приближенным и что валентные структуры, которые составляются с помощью черточек , следует понимать лишь как схему, условно отображающую действительное строение молекулы. В противном случае может сложиться опасное заблуждение, например, о том, что мезомерия — реальное явление. Однако следует также иметь в виду, что валентные структуры дают очень полезные указания о физико-химическом поведении молекул. Если строение молекулы можно представить в виде нескольких валентных структур, то говорят, что связи делокализованы . В рамках теории МО, которая не рассматривает локализованных связей, образованных парой электронов, а следовательно, и валентных связей, такого рода недоразумения невозможны,, в чем можно убедиться ниже. [c.95]
Однако следует также иметь в виду, что валентные структуры дают очень полезные указания о физико-химическом поведении молекул. Если строение молекулы можно представить в виде нескольких валентных структур, то говорят, что связи делокализованы . В рамках теории МО, которая не рассматривает локализованных связей, образованных парой электронов, а следовательно, и валентных связей, такого рода недоразумения невозможны,, в чем можно убедиться ниже. [c.95]
ВС-метод. В методе валентных связей результаты работы Гейтлера и Лондона обобщены и распространены на многоатомные молекулы. Поэтому характерные особенности двухэлектронной связи в молекуле На перенесены на связи в многоатомных молекулах типа СН4 и др. Принимается, что каждая связь осуществляется парой электронов с антипараллельными спинами, локализованной (сосредоточенной) между двумя определенными атомами. При этом атомные орбитали двух электронов перекрываются. Представление о локализованной паре электронов является квантовомеханическим аналогом более ранней идеи Льюиса о связи как о паре электронов, общей двум атомам.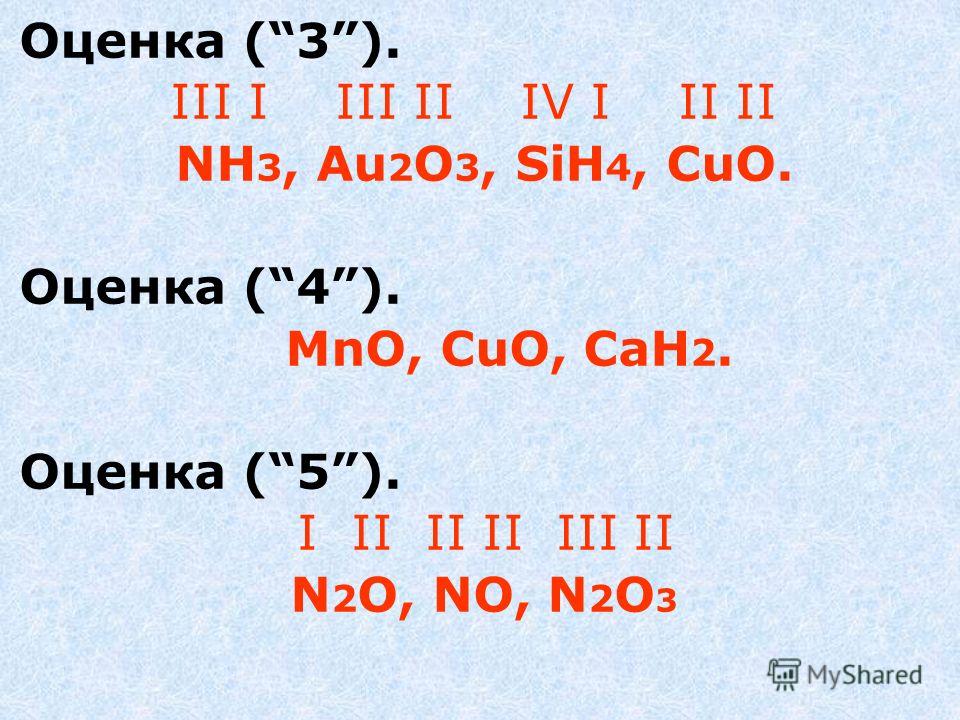 Уже на заре теории химического строения возникло и широко используется химиками по сей день понятие валентности атома. Каждому атому в соединении приписывалось определенное целое число единиц сродства к другим атомам. Это число и называлось валентностью. [c.56]
Уже на заре теории химического строения возникло и широко используется химиками по сей день понятие валентности атома. Каждому атому в соединении приписывалось определенное целое число единиц сродства к другим атомам. Это число и называлось валентностью. [c.56]
Метод молекулярных орбиталей. Расчет строения молекул по методу валентных связей очень сложен. Кроме того, этот метод не рассматривает вклад иеспаренных электронов в образование связи. [c.105]
Не следует таким же образом объяснять образование молекулы кислорода О2. Ее строение трудно поддается описанию методом валентных связей, которым мы пользуемся. Метод же молекулярных орбиталей, который в данном случае более применим, изучается только в высшей школе. [c.63]
При разработке теории строения молекул в начале 30-х годов возникли и затем развивались два метода —метод валентных связей, ВС-метод (разрабатывался Полингом, Слейтером и другими на основе работы Гейтлера и Лондона) и метод молекулярных орбиталей, МО-метод (развивался Малликеном, Гундом, Герцбергом, Хюкке-лем и др. ) В высших своих приближениях они приводят к практически одинаковым результатам, достигаемым, однако, разной ценой. В более простом приближении каждый из них обладает преимуществами в описании одних явлений и недостатками при описании других. [c.56]
) В высших своих приближениях они приводят к практически одинаковым результатам, достигаемым, однако, разной ценой. В более простом приближении каждый из них обладает преимуществами в описании одних явлений и недостатками при описании других. [c.56]
В настоящее время, как никогда ранее, в неорганической химии происходит своеобразный пересмотр основных понятий и теоретических воззрений. Так, на основе учения об электронном строении молекул представление о валентности атома в молекуле постепенно теряет определенность и значение. Если исходить из представления о валентности атома в молекуле как числе химических связей, которыми он связан с другими атомами, то на основании метода валентных связей валентность атома равна числу электронных пар, которыми он совместно с другими атомами обладает. Согласно этим представлениям, в ЫНз и валентность атома азота равна 3 и 4 [c.5]
Таким образом, при помощи метода молекулярных орбиталей успешно объясняют свойства различных молекул. Этот метод важен тем, что позволяет получить данные о свойствах молекул исходя из соответствующих характеристик атомов. Метод МО не исключает метода валентных связей, оба метода взаимно дополняют друг друга. В целом оба метода (и ВС, и МО) служат квантовомеханическим обоснованием и дальнейшим развитием теории химического строения А. М. Бутлерова. [c.62]
Этот метод важен тем, что позволяет получить данные о свойствах молекул исходя из соответствующих характеристик атомов. Метод МО не исключает метода валентных связей, оба метода взаимно дополняют друг друга. В целом оба метода (и ВС, и МО) служат квантовомеханическим обоснованием и дальнейшим развитием теории химического строения А. М. Бутлерова. [c.62]
В рамках метода валентных связей строение молекулы монооксида углерода передается формулой ( С=0 ), где атомы СиО имеют по одной неподеленной электронной паре, которая может стать донорной. Как Вы считаете, будут ли проявляться донорные свойства СО за счет электронной пары атома углерода (с образованием связей Э-образованием связей Э- -ОС) Ответ аргументируйте справочными данными, [c.80]
В рамках метода валентных связей строение молекулы N2O можно передать двумя формулами [c.91]
По методу валентных связей определите геометрическое строение и полярность этих молекул.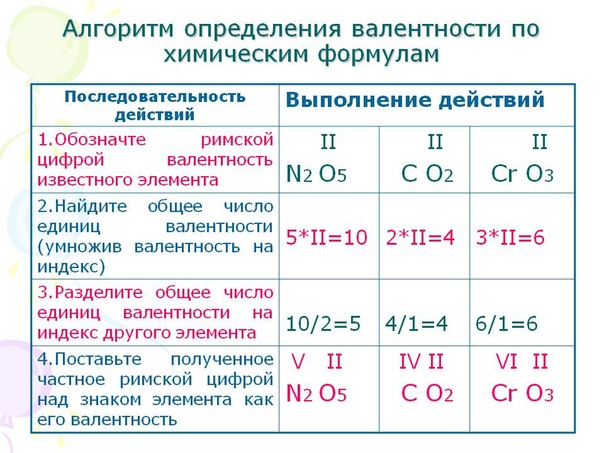 Ваши ответы подтвердите справочными данными. Являются ли все указанные вещества термодинамически устойчивыми Охарактеризуйте их реакционную способность по отношению к воде, распространенным сильным кислотам и щелочам, типичным окислителям и восстановителям. Рассмотрите склонность молекул к димеризации и к образованию аддуктов. Какими способами можно получать данные вещества в лаборатории и промышленности [c.154]
Ваши ответы подтвердите справочными данными. Являются ли все указанные вещества термодинамически устойчивыми Охарактеризуйте их реакционную способность по отношению к воде, распространенным сильным кислотам и щелочам, типичным окислителям и восстановителям. Рассмотрите склонность молекул к димеризации и к образованию аддуктов. Какими способами можно получать данные вещества в лаборатории и промышленности [c.154]
Руководствуясь справочными данными, охарактеризуйте термодинамическую стабильность этих веществ. По методу валентных связей предскажите геометрическое строение и полярность молекул. Обоснуйте реакционную активность (или пассивность) указанных веществ по отношению их к распространенным растворителям и реактивам (вода, сильные кислоты и щелочи, типичные окислители и восстановители), донорно-акцепторные свойства и склонность молекул к димеризации. Укажите возможные методы получения данных веществ в промышленности и в лаборатории. [c.155]
Книга всесторонне и доходчиво, а самое главное методологически правильно знакомит с теорией химической связи и результатами ее применения к описанию строения и свойств соединений различных классов. Сначала изложены доквантовые идеи Дж. Льюиса о валентных (льюис овых) структурах и показано, что уже на основе представлений об обобществлении электронных пар и простого правила октета при помощи логических рассуждений о кратности связей и формальных зарядах на атомах удается без сложных математических выкладок, как говорится на пальцах , объяснить строение и свойства многих молекул. По существу, с этого начинается ознакомление с пронизывающими всю современную химию воззрениями и терминами одного из двух основных подходов в квантовой теории химического строения-метода валентных связей (ВС). К сожалению, несмотря на простоту и интуитивную привлекательность этих представлений, метод ВС очень сложен в вычислительном отношении и не позволяет на качественном уровне решать вопрос об энергетике электронных состояний молекул, без чего нельзя судить о их строении. Поэтому далее квантовая теория химической связи излагается, в основном, в рамках другого подхода-метода молекулярных орбиталей (МО).
Сначала изложены доквантовые идеи Дж. Льюиса о валентных (льюис овых) структурах и показано, что уже на основе представлений об обобществлении электронных пар и простого правила октета при помощи логических рассуждений о кратности связей и формальных зарядах на атомах удается без сложных математических выкладок, как говорится на пальцах , объяснить строение и свойства многих молекул. По существу, с этого начинается ознакомление с пронизывающими всю современную химию воззрениями и терминами одного из двух основных подходов в квантовой теории химического строения-метода валентных связей (ВС). К сожалению, несмотря на простоту и интуитивную привлекательность этих представлений, метод ВС очень сложен в вычислительном отношении и не позволяет на качественном уровне решать вопрос об энергетике электронных состояний молекул, без чего нельзя судить о их строении. Поэтому далее квантовая теория химической связи излагается, в основном, в рамках другого подхода-метода молекулярных орбиталей (МО). На примере двухатомных молекул вводятся важнейшие представления теории МО об орбитальном перекрывании и энергетических уровнях МО, их связывающем характере и узловых свойствах, а также о симметрии МО. Все это завершается построением обобщенных диаграмм МО для гомоядерных и гете-роядерных двухатомных молекул и обсуждением с их помощью строения и свойств многих конкретных систем попутно выясняется, что некоторые свойства молекул (например, магнитные) удается объяснить только на основе квантовой теории МО. Далее теория МО применяется к многоатомным молекулам, причем в одних случаях это делается в терминах локализованных МО (сходных с представлениями о направленных связях метода ВС) и для их конструирования вводится гибридизация атомных орбиталей, а в других-приходится обращаться к делокализованным МО. Обсуждение всех этих вопросов завершается интересно написанным разделом о возможностях молекулярной спектроскопии при установленни строения соединений здесь поясняются принципы колебательной спектро- [c.
На примере двухатомных молекул вводятся важнейшие представления теории МО об орбитальном перекрывании и энергетических уровнях МО, их связывающем характере и узловых свойствах, а также о симметрии МО. Все это завершается построением обобщенных диаграмм МО для гомоядерных и гете-роядерных двухатомных молекул и обсуждением с их помощью строения и свойств многих конкретных систем попутно выясняется, что некоторые свойства молекул (например, магнитные) удается объяснить только на основе квантовой теории МО. Далее теория МО применяется к многоатомным молекулам, причем в одних случаях это делается в терминах локализованных МО (сходных с представлениями о направленных связях метода ВС) и для их конструирования вводится гибридизация атомных орбиталей, а в других-приходится обращаться к делокализованным МО. Обсуждение всех этих вопросов завершается интересно написанным разделом о возможностях молекулярной спектроскопии при установленни строения соединений здесь поясняются принципы колебательной спектро- [c. 6]
6]
Дли трактовки одиих свойств молекул (например, пространственного строения) пригоднее метод валентных связей, для других (например, электронных спектров) — метод молекулярных орбиталей. Последний менее нагляден, ио гораздо легче поддается математической обработке, а потому более удобен для попыток теоретического расчета свойств, характерных для молекул [c.181]
Для кванто1ю-,м( .чаничсского описания ковалентной связн и строения молекул могут быть примснсш, два подхода метод валентных связей н метод молекулярных орбиталей. [c.55]
Ковалентная связь. Метод валентных связей. Мы уже знаем, что устойчивая молекула может образоваться только при условии уменьшения потенциальной энергии системы взаимодействующих атомов. Для описания состояния электронов в молекуле следовало бы составить уравнение Шредингера для соответствующей системы электронов и атомных ядер и найти его решение, отвечающее минимальной энергии системы. Но, как указывалось, в 31, для мно-гоэлсктронных систем точное решение уравнения Шредингера получить не удалось.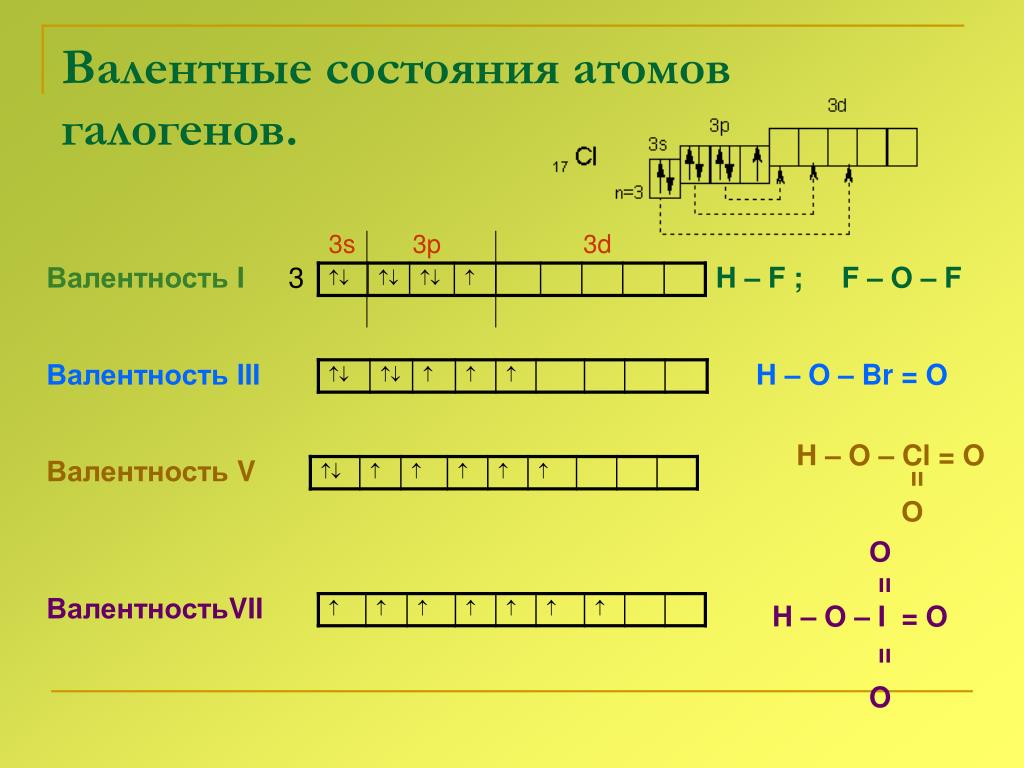 Поэтому квантово-механическое описание строения молекул получают, как и в случае многоэлектронных атомов, лишь на основе приближенных решений уравнения Шредингера. [c.119]
Поэтому квантово-механическое описание строения молекул получают, как и в случае многоэлектронных атомов, лишь на основе приближенных решений уравнения Шредингера. [c.119]
Представления о механизме образования химической связи, развитые Гейтлером и Лондоном на примере молекулы водорода, были распространены и на более сложные молекулы. Ра нработаи-ная на этой основе теория химической связи получила название метода валентных связей (метод ВС). Метод ВС дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул Хотя, как мы увидим ниже, этот метод не оказался универсальным и в ряде случаев не в состоянии правильно описать структуру и свойства молекул (см. 45), — все же он сыграл большую роль в разработке квантово-механической теории химическон связи и не потерял своего значения до настоящего времени. [c.121]
Как мы видели, тригонально-пирамидальное строение имеет молекула аммиака НаЫ. Согласно методу валентных связей в ней атом азота находится в состоянии 5р -гибридизации. Из четырех вр -гибридных орбиталей азота три участвуют в образовании трех ст-связей Ы—Н, а четвертую орбиталь занимает несвязывающая электронная пара. В терминах метода молекулярных орбиталей это соответствует заполнению трех связывающих и одной почти несвязывающей молекулярной ст-орбитали [c.100]
Согласно методу валентных связей в ней атом азота находится в состоянии 5р -гибридизации. Из четырех вр -гибридных орбиталей азота три участвуют в образовании трех ст-связей Ы—Н, а четвертую орбиталь занимает несвязывающая электронная пара. В терминах метода молекулярных орбиталей это соответствует заполнению трех связывающих и одной почти несвязывающей молекулярной ст-орбитали [c.100]
Молекула lFg полярна ( 1=0,55 D), так как имеет Т-образное строение (рис. 158). В рамках метода валентных связей это отвечает [c.306]
Опишите строение молекулы Вер2, используя метод валентных связей. Какой тип гибридизации у атома бериллия в молекуле и в кристалле [c.162]
В том случае, если строение двухатомной гомоядер-ной молекулы или иона рассматривают на основе метода молекулярных орбиталей, то число (порядок) связей определяют как полуразность между числами связывающих и разрыхляющих электронов. Согласно этой теории, в таких частицах, как Н2, Нг, Не , Сг, N2, Рг, Оа, Ог, Ог, О , число (порядок) связей (а значит, и валентность) равно 1 7г 2 3 1 2 1 7г 2 7г 1 соответственно, т. е. возможна дробная валентность, которую не допускает метод валентных связей. Таким образом эти два метода по-разному рассматривают понятие валентности атома в молекуле. [c.5]
е. возможна дробная валентность, которую не допускает метод валентных связей. Таким образом эти два метода по-разному рассматривают понятие валентности атома в молекуле. [c.5]
Метод валентных связей постепенно заменяется методом молекулярных орбиталей, который становится ведущим методом теоретического исследования строения молекул во многих областях химии, в частности в органической химии. Однако использование этого метода МО, даже в его простейшей форме ЛКАО (линейной комбинации атомных орбиталей), для трактовки природы молекул неорганических соединений еще только начинает приобретать всеобъемлющее значение как в научных исследованиях, так и в педагогической практике. Все сказанное делает понятным огромный интерес химиков, в особенности xи икoв-пeдaгoгoв, к современным воззрениям в неорганической химии. К сожалению, очень мало руководств или монографий на русском языке, излагающих новейшие теоретические представления о природе строения неорганических молекул и пути развития современной неорганической химии.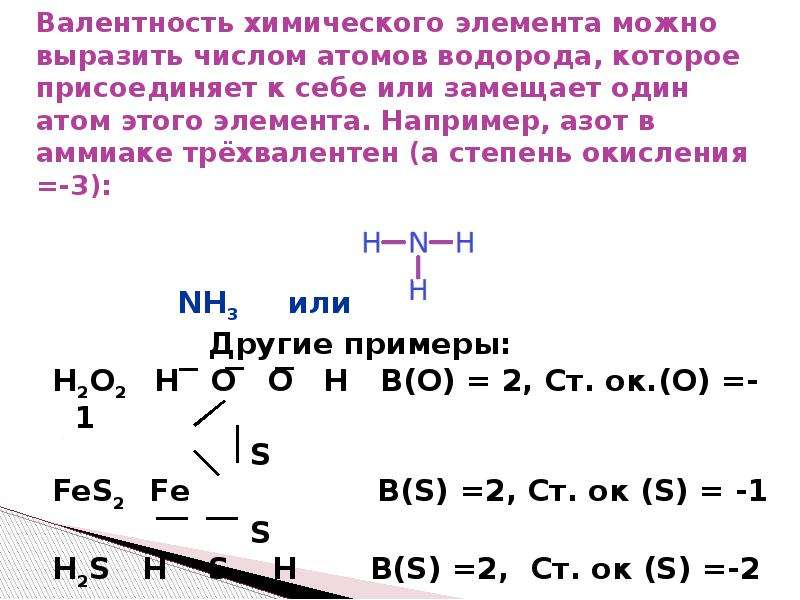 [c.6]
[c.6]
Помогите пожалуйста определить валентность у азота и ОБЪЯСНИТЬ КАК ЭТО СДЕЛАТЬ (ну ток… — Химия
KNO2 ЕСТЬ правило валентность металлов главных групп в таблице Менделеева равна номеру группы(или если говорим о степени окисления,то у металлов главных подгрупп степень окисления равна номеру группы и пишется с плюсом,например у натрия и всех металлов первой группы-щелочных металлов +1, у бериллия и всех металлов второй А группы +2 и т.д.) валентность пишется римскими цифрами и знака не имеет.
у кислорода основная валентность II ( или если говорить о степени окисления -2).Поэтому валентность азота равна количеству атомов соединившихся вокруг азота и в нитрите калия валентность равна трем,в нитрате калия четырем,в азотистой кислоте трём,в аммиаке валентность азота равна трем.Но лучше привыкайте работать со степенями окисления.Надо только выучить правило.
Степень окисления-это условный формальный заряд атомов или группы атомов,который присваивается при условии,в предположении, что
молекула полярная.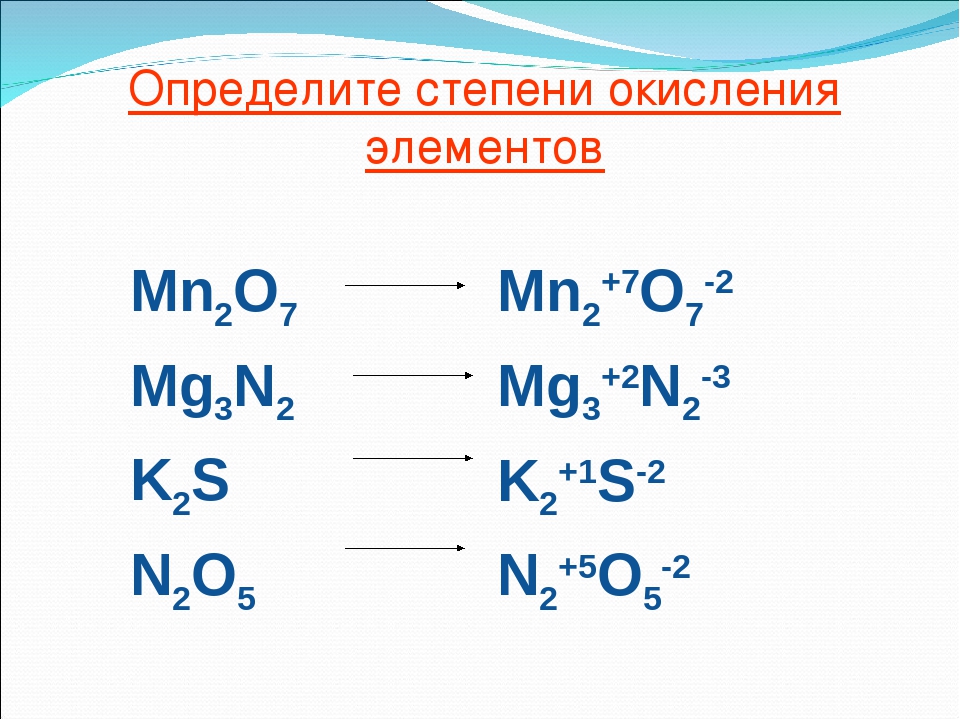 Но надо помнить,что есть случаи,когда валентность не совпадает со степенью окисления и как раз этот случай-азотная,азотистая кислота,их соединения.Почему удобно работать со степенью окисления,вы научитесь сами составлять формулы любого вещества,их не надо запоминать,надо знать правила.
Но надо помнить,что есть случаи,когда валентность не совпадает со степенью окисления и как раз этот случай-азотная,азотистая кислота,их соединения.Почему удобно работать со степенью окисления,вы научитесь сами составлять формулы любого вещества,их не надо запоминать,надо знать правила.
Символы надо учить по группам и тогда вы будете знать,какой элемент в какой группе и какая у него валентность или степень окисления.Валентность знака не имеет,а степень окисления знак имеет.
У неметаллов бывает и положительная степень окисления-высшая,равная номеру группы,и отрицательная то есть низшая равная 8 отнять номер группы.Например кислород +6 и -2,но чаще минус 2( исключение пероксиды там степень окисления кислорода -1 , в соединении OF2-степень окисления кислорода +2)
и ещё у фтора бывает степень окисления только -1,у водорода с металлами -1,с неметаллами +1. У металлов побочных подгрупп валентность(степень окисления ) переменная здесь поможет таблица растворимости.
|
1. |
Постоянная валентность
|
1 |
|
2. |
Наименьшее общее кратное
|
1 |
|
3. 
|
Степени окисления элементов
|
1 |
|
4. |
Валентность элемента в водородном соединении
|
2 |
|
5. 
|
Валентность элемента в соединении с кислородом
|
2 |
|
6. |
Формула кислородного соединения
|
2 |
|
7. 
|
Составь формулу по степеням окисления элементов
|
2 |
|
8. |
Составь формулу и вычисли относительную молекулярную массу
|
3 |
|
9. 
|
Исправь формулу
|
3 |
|
10. |
Расположи формулы по возрастанию валентности
|
4 |
Видео с вопросом: Определение структурной формулы закиси азота
Стенограмма видеозаписи
Закись азота, N2O, широко известная
как веселящий газ, используется как обезболивающее при небольших хирургических вмешательствах, таких как рутинные операции
удаление зубов мудрости.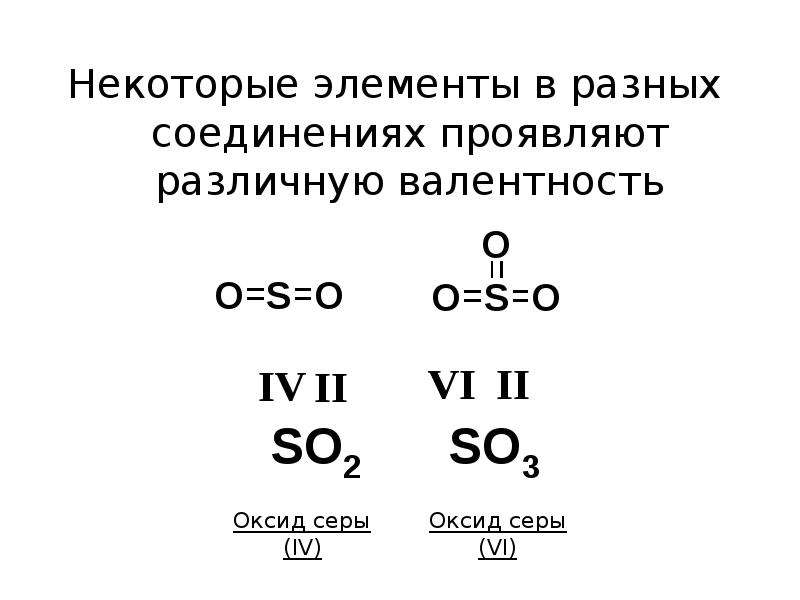 Включая одиночные пары, дайте
Включая одиночные пары, дайте
структурная формула закиси азота.
Нашим первым шагом будет определение
количество валентных электронов в закиси азота.Мы можем определить количество
валентные электроны для каждого атома с помощью периодической таблицы. Азот имеет пять валентностей
электроны. И есть два азота в
оксид азота. И кислород имеет шесть валентностей
электроны. Это дает нам в общей сложности 16 валентностей.
электроны.
Следующий шаг — разместить атомы
и соединить их одинарными связями. Атом, который мы поместили в центр
должно иметь как можно больше участков для склеивания.В общем, это будет атом
который имеет наименьшее количество валентных электронов, потому что ему нужно больше электронов
чтобы заполнить его внешнюю оболочку. Это означает, что мы должны поставить один
азота в центре.
Следующим шагом является распространение
оставшиеся электроны, чтобы каждый атом имел полный октет или восемь электронов, начиная с
концевые атомы или атомы, находящиеся вне структуры.Каждая одинарная связь содержит два
электроны, по одному от каждого атома, участвующего в связи. Итак, у нас уже есть четыре электрона
нарисовано в нашей структуре, что означает, что у нас осталось 12 электронов, чтобы
распространять.
Если распределить оставшиеся 12
сначала электроны к внешним атомам, у нас закончатся электроны раньше, чем азот
в центре есть полный октет. Если это произойдет, мы можем сформировать
множественные связи между атомами путем удаления неподеленной пары на одном из атомов, которые
уже есть полный октет.Таким образом, мы можем удалить один из одиноких
пары из кислорода и установить двойную связь между азотом и кислородом.
Но азот все еще не имеет
полный октет, давайте сделаем то же самое с другим азотом. Теперь мы удалили одинокую пару из
азот для создания двойной связи между азотом и азотом. Теперь каждый атом в нашей структуре
содержит полный октет. Итак, это структурная формула
закиси азота, включая ее неподеленные пары.(-) #
# 10 + 6 = 16 # всего доступных валентных электронов.
У нас есть два атома азота и один кислород, что говорит о том, что либо у нас кислород в середине, либо два атома азота подряд.
Обратите внимание, как если бы у вас был кислород в середине , формальные заряды обоих атомов азота не могли бы хорошо распределиться, не превышая 8 электронов для кислорода :
Один из способов определения официальных сборов:
# «Formal Charge» = «Ожидаемые электроны» — «Собственные электроны» #
Поскольку левый азот «владеет» пятью валентными электронами (две неподеленные пары и одна из связи # «N» — «O» #), и он ожидает пять , его формальный заряд составляет # 5-5.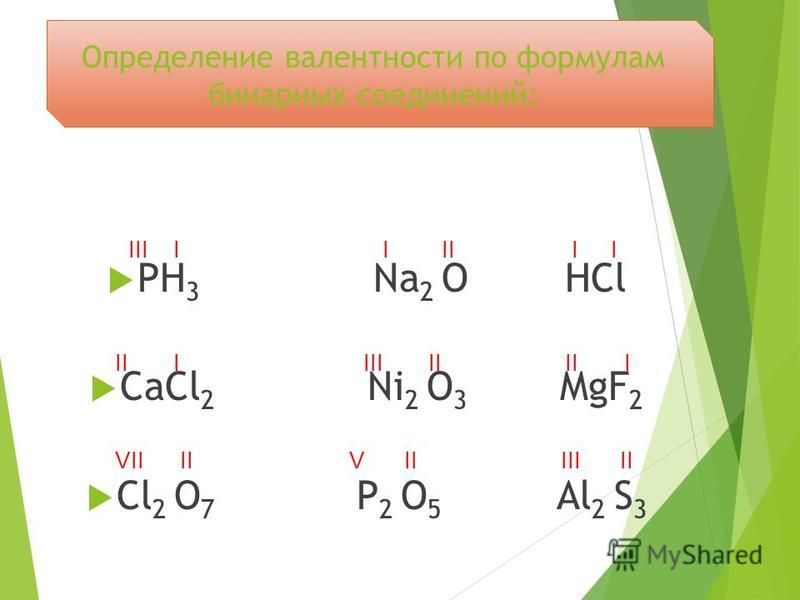 = цвет (синий) (0) #.
= цвет (синий) (0) #.
Поскольку правый азот «владеет» четырьмя валентными электронами (одна неподеленная пара дает два электрона; затем два электрона из двойной связи # «N» = «O» #), и он ожидает пять , его формальный заряд # 5 — 4 = цвет (синий) (+ 1) #.
Так как кислород «владеет» семью валентными электронами (две неподеленные пары дают четыре электрона; затем один электрон слева # «N» — «O» # одинарная связь и два электрона от # «N» = «O» # двойная связь), и он ожидает шесть , его формальный заряд # 6-7 = цвет (синий) (- 1) #.
Кислород имеет TEN, но он не может иметь более ВОСЕМЬ валентных электронов, поэтому такая структура исключена.
Таким образом, один из атомов азота должен находиться в середине .
Теперь мы можем получить две правдоподобные возможности, которые обе являются линейными молекулярными геометриями (НЕ изогнутыми !!! Две группы электронов!):
ЗАДАЧА: Можете ли вы определить, почему официальные обвинения такие, какие они есть? На основании разницы в электроотрицательности кислорода (# ~ 3. 5 #) и азот (# ~ 3,0 #), какая резонансная структура более предпочтительна?
5 #) и азот (# ~ 3,0 #), какая резонансная структура более предпочтительна?
CHEM 101 — Структуры Льюиса
ОБЩИЕ ТЕМЫ ХИМИИ
Структуры Льюиса
Примеры того, как рисовать структуры Льюиса:
Вода (H 2 O), окись азота (закись азота, N 2 O),
уксусная кислота (C 2 H 4 O 2 ).
Общие правила рисования структур Льюиса.
Структуры Льюиса представляют собой структурные формулы для молекул и многоатомных ионов.
которые представляют все валентные электроны. Поскольку валентные электроны обычно
Эти структурные формулы, представленные в виде точек, иногда называют точечными стойками Льюиса.
Здесь мы представляем несколько примеров того, как рисовать структуры Льюиса.
Общие правила рисования структур Льюиса приведены ниже.
Пример 1.Вода . Формула для
вода H 2 O.
Подсчет валентных электронов дает всего восемь (шесть от кислорода, по одному от двух атомов водорода).
Водород особенный, поскольку он может вместить только дуэт и, следовательно, может образовывать не более одной связи.
Атомы, которые могут образовывать только одну связь, должны быть концевыми (или периферийными) атомами в структуре.
Структура скелета для воды должна быть H O H, а не H H O,
хотя водород имеет более низкую
электроотрицательность
чем кислород (сравните этот случай с случаем N 2 O, который следует общему правилу, что меньше
электроотрицательные атомы обычно являются центральными атомами в структурах Льюиса).
На панели (а) скелетная структура воды показана с атомами, представленными их символами Льюиса.
Явно представлены восемь полных валентных электронов.
В (b) мы позволяем одиночным электронам — по одному от водорода и кислорода —
чтобы образовать связывающую пару между ядрами.
В (c) мы заменили обе пары связей линией (или тире), чтобы обозначить ковалентную связь.
образованный между атомами связанной электронной парой.Обратите внимание, что кислород окружен октетом электронов, удовлетворяющим правилу октетов.
Мы нарисовали допустимую структуру Льюиса для воды.
Пример 2. Окись азота (Закись азота, N 2 О) .
Поскольку центральным атомом может служить либо N, либо O, при выборе скелетной структуры
мы используем правило, согласно которому наименее электроотрицательный атом помещается в середину.
Имея соответствующую структуру скелета и правильное количество валентных электронов,
цель состоит в том, чтобы поместить электроны в связи или неподеленные пары так, чтобы каждый атом имел октет электронов.На рисунке слева показана процедура создания структур-кандидатов путем одиночного перемещения электронов.
или попарно, начиная с символов Льюиса для элементов.
Поскольку N и O являются элементами периода 2, ни один атом не может превышать октета.
В этом случае можно нарисовать три действительные структуры Льюиса.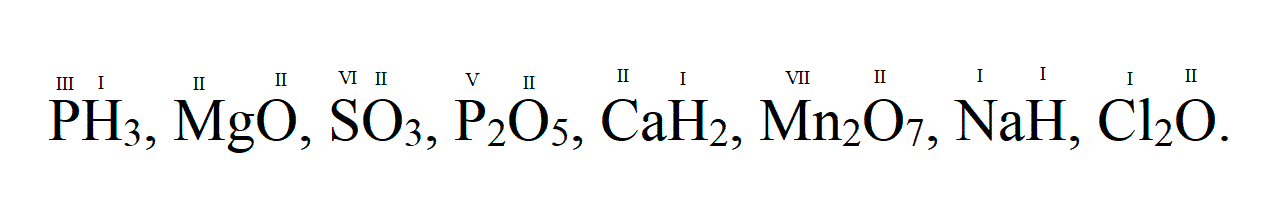
Эти три допустимые структуры Льюиса для оксида азота известны как
Неэквивалентные резонансные структуры . В качестве инструмента оценки
официальная плата
назначения могут быть использованы для прогнозирования относительных вкладов резонансных форм
резонансному гибриду, который представляет более реалистичную концепцию электронного
распределение внутри молекулы.
Пример 3. Уксусная кислота (C 2 H 4 O 2 ).
Бывают случаи, когда даже для очень простых молекул
есть несколько химически вероятных скелетных структур.
Для структур из более крупных молекул, в которых более одного атома соединены с двумя или более атомами,
больше не существует единственного центрального атома, и вероятность встречи изомеров резко возрастает.
Чтобы нарисовать структуру Льюиса для данного изомера,
необходима дополнительная информация о строении скелета.Так обстоит дело с большинством органических молекул, содержащих в основном углерод, водород и кислород.
с другими элементами, такими как азот, сера и фосфор, также распространены
в молекулах биологического значения.
Примером является уксусная кислота, важный пример слабой кислоты.
В случае уксусной кислоты скелетная структура сосредоточена на цепочке атомов, связанных вместе как C C O.
Первый атом углерода использует свои три оставшихся валентных электрона для образования связей с тремя из четырех атомов водорода.Ко второму атому углерода присоединен еще один атом кислорода.
Наконец, оставшийся атом водорода присоединяется к одному из атомов кислорода.
В этом примере, как только определена скелетная структура, довольно легко следует структура Льюиса.
Рисование связей вместо пар электронов, состоящих из одного электрона от каждого атома
дает скелетную структуру.
Правило октетов может быть выполнено для всех неводородных атомов, когда оставшиеся неспаренные электроны
перемещаются внутрь, образуя двойную связь между углеродом и кислородом.
Правила рисования структур Льюиса
Цель : Используя химическую формулу, соответствующую молекуле или молекулярному иону, нарисуйте структуру Льюиса.
1.
Прежде всего, необходим правильный подсчет всех валентных электронов.
Один из способов сделать это — написать символы Льюиса для всех атомов в формуле:
и сосчитайте все «точки».
Для молекулы (незаряженной) это число является правильным числом валентных электронов.Для многоатомных ионов суммируйте валентные электроны для всех атомов в формуле
и вычтите один электрон на каждый положительный заряд катиона, и добавьте один электрон
на каждую единицу отрицательного заряда аниона.
2.
Нарисуйте скелетную структуру. Это означает, что мы решаем, как атомы должны быть связаны.
Выберите центральный атом (мы начнем с примеров небольших молекул, для которых есть только один
центральный атом, а остальные атомы — периферийные атомы — все связаны с центральным атомом).Водород (H) и фтор (F) имеют валентность, равную 1, и обычно это не центральные атомы.
(связаны более чем с одним атомом).
Учитывая формулу, центральный атом обычно является первым атомом (пример ClF 4 ),
хотя это соглашение не всегда соблюдается (, например, . HNO 3 ).
HNO 3 ).
Еще один хороший способ выбора — выбрать атом с наименьшим электроотрицанием.
Неизбежно будут случаи, когда можно нарисовать более одной скелетной структуры.
3.
Нарисуйте связи в виде линий между атомами. Каждая облигация считается как 2 e — .
4.
Добавьте электроны в виде неподеленных пар, не связанных между собой, вокруг периферийных атомов, чтобы у них были октеты.
(всего восемь электронов). Обратите внимание, что это не относится к H, который может включать только дуэт.
(2 e — ).
5.
Добавьте оставшиеся пары электронов к центральному атому, чтобы его октет был полным.
(если еще не).Никогда не превышайте октет для периода 2 атома! Для периодов 3 и выше,
атомы достаточно велики, чтобы вместить в их оболочку валентных связей более одного октета.
Если больше нет доступных электронов, а центральный все еще не имеет полного октета,
неподеленная пара на периферийном атоме может быть вытолкнута в
вторая (или третья) связь с центральным атомом. Углерод и азот — элементы 2-го периода.
Углерод и азот — элементы 2-го периода.
которые обычно образуют двойные и тройные связи как центральные атомы, а кислород как периферийный атом
часто находится в двойной связи с центральным атомом.
6.
Если все атомы со 2-го периода и выше имеют хотя бы октет,
и ни один атом 2-го периода не превышает октета, а общее количество электронов в связях и неподеленных парах
равно общему количеству доступных валентных электронов, то действительная структура Льюиса была
произведено. Для ионов принято заключать структуру в скобки,
и укажите чистую стоимость в правом верхнем углу.
7 . Оценка, исключения и использование .
Обратите внимание, что есть несколько случаев, когда лучшая структура Льюиса имеет неполный октет на центральном атоме.
Поскольку часто можно нарисовать более одной допустимой структуры Льюиса для молекулы или
молекулярного иона, нам нужно будет оценить, какой из них более правдоподобен или имеет лучший химический смысл.
Как отмечалось выше, формальный сбор — это
используется в качестве ориентира в том, что общее количество формальных сборов, равное нулю или минимуму, обычно лучше,
формальный заряд атома рассматривается в зависимости от его электроотрицательности.Помните, что структура Льюиса — это не молекула, а только сокращенный символизм, который имеет в виду
чтобы передать некоторую информацию о нем.
Такая информация позволяет прогнозировать вероятные физические или химические свойства
реальная молекула или объемное вещество, состоящее из этих молекул.
Одно из наиболее распространенных применений действительной структуры Льюиса.
(и для этого нам не нужна лучшая структура Льюиса, просто любая действительная )
предсказывает форму молекулы
и полярность.
Правило октета
По возможности валентные электроны распределяются таким образом, что восемь электронов
(октет электронов) окружают каждый элемент основной группы (кроме водорода, который должен иметь
два электрона).
Совет : Никогда не превышайте октет для периода 2 атома.
Структура Льюиса N2O, молекулярная геометрия, гибридизация и MO-диаграмма
Все мы слышали о «Веселящем газе» много раз.Но пытались ли мы когда-нибудь узнать больше об этом газе, который может заставить людей смеяться? Думаю, нет!
Получив некоторые знания о веселящем газе, я решил поделиться им с вами, чтобы в следующий раз мы могли смеяться со знанием дела !!
N2O или закись азота широко известны как веселящий газ. Есть несколько других названий, под которыми это соединение известно как сладкий воздух, закись азота и т. Д.
N2O — бесцветный газ с молекулярной массой 44,013 г / моль. Температура кипения этого соединения -88.48 ℃, температура плавления -90,86 ℃.
Закись азота, от использования в качестве окислителя в ракетном двигателе до его использования в двигателях внутреннего сгорания, находит огромное применение в различных областях. Он также используется в аэрозольных пропеллентах.
Он также используется в аэрозольных пропеллентах.
Давайте теперь перейдем к приготовлению этого соединения.
Методы получения N2O
Закись азота можно получить несколькими способами. Вот некоторые из способов: —
Промышленные методы : — В промышленных масштабах нагревание нитрата аммония дает нам закись азота и водяной пар.
Nh5NO3 ——–> 2h3O + N2O
Лабораторные методы : — Приготовление закиси азота можно также проводить в лаборатории. Нагревание смеси нитрата натрия и сульфата аммония дает N2O
.
2 NaNO3 + (Nh5) 2SO4 ——-> Na2SO4 + 2N2O + 4 h3O
Также закись азота может быть образована реакцией мочевины, азотной кислоты и серной кислоты,
2 (Nh3) 2CO + 2 HNO3 + h3SO4 → 2 N2O + 2 CO2 + (Nh5) 2SO4 + 2h3O
Процесс Оствальда : — Окисление аммиака диоксидом марганца и оксидом висмута в качестве катализатора дает нам закись азота.
Этот процесс известен как процесс Оствальда.
2Nh4 + 2O2 ——> N2O + 3h3O
Есть еще много реакций, которые используются для получения N2O. Наряду с этим закись азота также является важным компонентом земной атмосферы. Концентрация составляет 0,330 ppm.
Более того, нитрификация и денитрификация — это два биологических или естественных процесса, которые могут производить закись азота.
Теперь, чтобы понять все остальные реакции с участием N2O, нам нужно знать его структуру Льюиса, гибридизацию и связывание.
Итак, давайте перейдем к этим частям по порядку.
N2O Структура Льюиса
Прежде чем углубляться в структуру Льюиса закиси азота, лучше узнать, как нарисовать структуру Льюиса.
Как нарисовать структуру Льюиса
Структура Льюиса помогает нам узнать о структуре соединения, типах и количестве связей, физических свойствах и о том, как соединение взаимодействует с другими соединениями.
Нарисовать структуру Льюиса довольно просто!
Есть общий способ, которым мы можем нарисовать структуру Льюиса любого соединения. Взгляните на шаги, записанные ниже: —
Взгляните на шаги, записанные ниже: —
- Рассчитайте общее количество валентных электронов в молекуле. Обратите внимание на знаки +, — при вычислении.
- Выберите центральный атом; обычно атом с наивысшими центрами связывания.
- Нарисуйте каркасную структуру только с одинарными связями.
- Заполните октет атомов оставшимися электронами. Не забывайте начинать с электроотрицательных атомов и переходить к электроположительным.
- Укажите кратные связи, если требуется для выполнения октета атомов.
- Наконец, убедитесь, что все атомы имеют минимально возможный формальный заряд. Вы можете рассчитать то же самое по формуле, приведенной ниже: —
Теперь давайте выясним структуру Льюиса N2O,
.
Валентные электроны атомов: —
- Азот = 5
- 2 * Азот = 5 * 2 = 10
- Кислород = 6
- Всего валентных электронов = 16
Затем нам нужно определиться с центральным атомом. В этом случае центральным атомом является азот с наивысшими центрами связывания. Итак, один из атомов азота — это средний атом.
В этом случае центральным атомом является азот с наивысшими центрами связывания. Итак, один из атомов азота — это средний атом.
После этого нам нужно нарисовать эскиз молекулы только с одинарными связями. Следующее прилагаемое изображение может объяснить это более четко,
После рисования эскиза мы видим, что оставшиеся электроны располагаются вокруг окружающих атомов (Структура 1). Здесь октет среднего азота не выполняется.
Итак, в структуре 2 одна из неподеленных пар бокового азота превращена в связывающую пару среднего азота.
Но все же не хватает 2-х электронов, для чего другая неподеленная пара превращается в пару связей.
Таким образом, структура 3 является окончательной структурой Льюиса закиси азота.
Как указано в правилах, мы можем видеть, что все атомы в окончательной структуре Льюиса имеют самый низкий формальный заряд. Обратите внимание, что в двух других структурах не было атомов с минимально возможным формальным зарядом.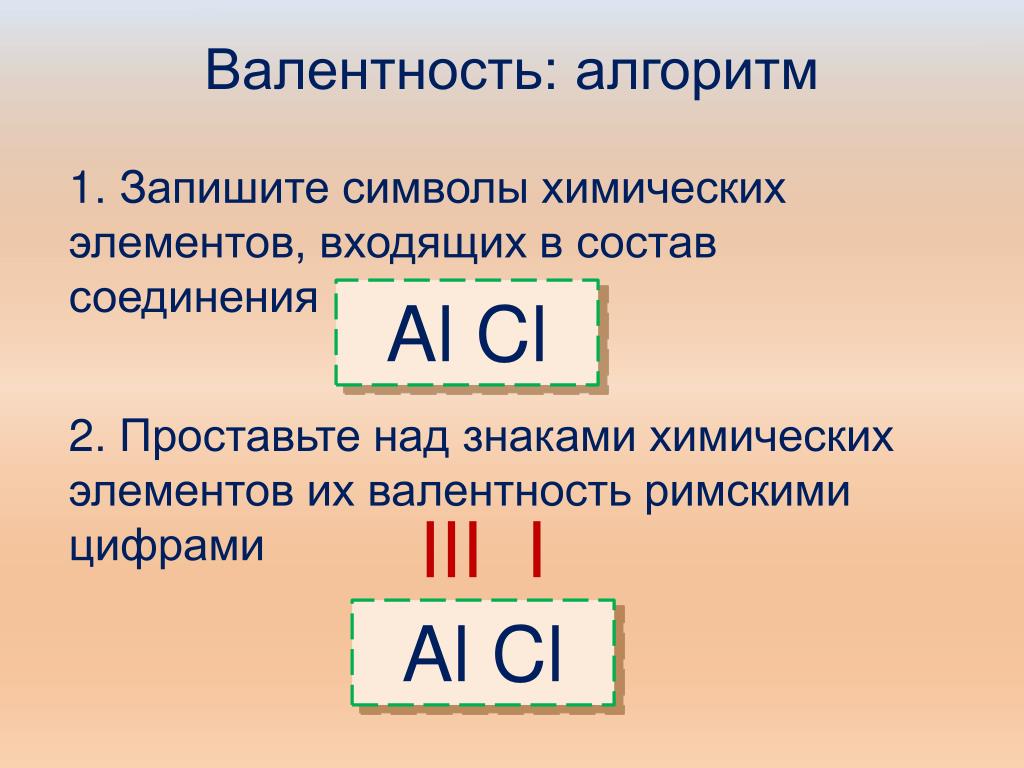
Теперь перейдем к молекулярной геометрии закиси азота!
N2O Молекулярная геометрия
Молекулярная геометрия N2O линейна.
Геометрия молекул может быть определена по диаграмме VSEPR. N2O похож на CO2. У него два окружающих атома и нет неподеленной пары.
Таким образом, это соединение представляет собой молекулу типа AX2.
Итак, мы видим, что у него также линейная геометрия молекулы и линейная электронная геометрия.
Может возникнуть путаница относительно геометрии электронов и геометрии молекул. Давай проясним это!
Молекулярная геометрия включает только атомы, тогда как электронная геометрия включает все электронные пары при определении структуры.
Проще говоря, неподеленные пары включены в геометрию электронов, а не в геометрию молекул.
Хотя форма молекулы N2O линейна, распределение электронов между атомами неодинаково. Интенсивность заряда в молекуле неоднородна.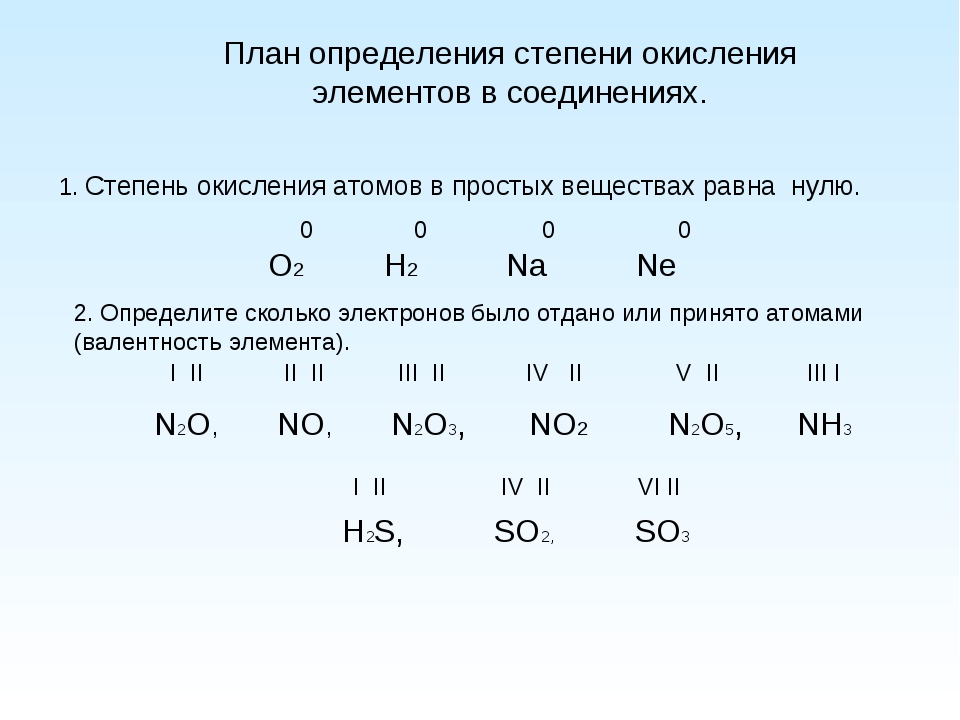
В результате получается чистый дипольный момент и считается полярной молекулой.
Из этой диаграммы VSEPR мы также можем определить гибридизацию любого соединения. Давайте перейдем к следующей части, чтобы узнать больше!
Гибридизация N2O
Оба атома азота sp-гибридизированы, а кислород sp3-гибридизован в N2O.
Объяснение гибридизации N2O заключается в том, что здесь концевой азот соединен с другим азотом тройной связью, таким образом, он гибридизуется sp.
То же самое относится и к следующему азоту. Атом кислорода связан с атомом азота одинарной связью и, таким образом, гибридизован Sp3.
Помимо видения связей, существует еще один способ определения гибридизации.
Гибридизацию любой молекулы можно найти с помощью формулы.
H = ½ [V + M-C + A]
Здесь
H = Гибридизация
V = Кол-во валентных электронов
M = Нет. одновалентного атома
C = заряд катиона
A = заряд аниона
If, H = 2 = Sp-гибридизация
H = 3 = Sp2-гибридизация
H = 4 = Sp3-гибридизация
H = 5 = Sp3d-гибридизация
H = 6 = Sp3d2-гибридизация
Все дело в гибридизации N2O.
Теперь следующая тема, которую нужно обсудить, — это диаграмма молекулярных орбиталей закиси азота.
Схема молекулярной орбиты N2O
Диаграммы молекулярных орбиталей говорят о смешивании орбиталей в соединении.
Используя диаграмму МО, можно определить порядок связи соединения, который дает нам представление о длине связи, а также стабильности связи.
МО закиси азота
можно легко определить, разбираясь в основах.
Итак, давайте посмотрим на MO NO
.
Здесь слева показана атомная орбиталь (АО) азота, а справа — АО кислорода.
В центре — молекулярная орбиталь соединения NO.
В случае N2O с левой стороны будет два AO азота.
Две атомные орбитали будут размещены рядом. Кислород останется таким же и в закиси азота.
И вы можете сформировать молекулярную орбиталь, объединив АО.
Заключение
Итак, теперь вы можете немного узнать о знаменитом «веселящем газе» !!
Эта статья посвящена основам химии, которые мы должны знать о закиси азота.
Есть много других реакций и более глубоких знаний, которые вы можете беспрепятственно усвоить после прочтения этого письма. Надеюсь, вам понравилась статья, и если у вас есть какие-либо вопросы, не стесняйтесь спрашивать меня в любое время!
N2O Структура Льюиса | Веселящий газ | 9 Ключевые моменты
В структуре Льюиса N2O есть два атома азота (N) и один атом кислорода (O). Число валентных электронов в N равно 5, а число валентных электронов в O равно 6. Общее количество валентных электронов в N 2 O равно 16.N 2 О или закись азота обычно называют веселящим газом. Также есть несколько других названий, под которыми это соединение известно, например, сладкий воздух, закись азота и т. Д.
Продолжайте читать, чтобы узнать больше о N 2 Структура Льюиса, веселящий газ, молярная масса закиси азота. , и формальный заряд N 2 O.
| Название молекулы | Закись азота ( N 2 O ) |
| Углы соединения | 180 градусов |
| Молекулярная геометрия N 2 O | Линейный |
| Количество валентных электронов в молекуле | 16 |
| 16 | |
| 16 9050 момент из Н 2 O | 0.160 880 D [Ссылка] |
Структура Льюиса N2O (пошаговое построение)
В структуре N 2 О-Льюиса общее отношение азота к атому кислорода составляет 2: 1. Ниже приведены шаги для построения структуры Льюиса.
Шаг-1:
Подсчитайте валентные электроны атомов
Для структуры Льюиса N 2 O нам нужно вычислить количество валентных электронов в отдельных атомах, как показано в таблице.
| Atom | Электронная конфигурация | Валентные электроны (VEs) |
| 8 O | 1S 2 2S 2 905 9050 9050 | |
| 7 N | 1S 2 2S 2 2P 3 . | 5 |
Валентные электроны (VE) в Закись азота = VE в атоме кислорода + VE в атомах азота
= 1 (6) +2 (5)
Валентные электроны = 16 электронов.
Шаг 2:
Определите центральный атом
Как правило, N помещается в середину, потому что он менее электроотрицателен, чем кислород.
Если мы проверим правильное расположение азота и кислорода в периодической таблице, мы обнаружим, что электроотрицательность N составляет 3,0, а электроотрицательность O — 3,5.
Шаг 3:
Поместите электронные пары между атомами
Нам нужно распределить 16 оставшихся валентных электронов. Сначала мы нарисуем каркасную структуру только с одинарными связями.
Из 16 электронов 4 будут использоваться парами между атомами. Теперь у нас есть 12 валентных электронов, которые нужно распределить. Азоту с 5 валентными электронами нужно еще 3 электрона, чтобы заполнить октет, тогда как кислороду с 6 валентными электронами нужно еще 2 электрона, чтобы заполнить октет.
Шаг 4: Полный октет
Укажите кратные связи, если это необходимо для выполнения октета атомов. Наконец, убедитесь, что все атомы имеют минимально возможный формальный заряд. На рисунке справа показаны три возможные структуры Льюиса.
Что такое закись азота
Закись азота (N 2 O), также известная как веселящий газ. Он важен для различных медицинских применений из-за его использования в качестве анестетика. Он не растворяется в воде и действует как мощный окислитель при более высоких температурах. Это бесцветный газ со слегка сладковатым запахом. При более высоких концентрациях он может вызвать наркотический эффект.
Почему закись азота называется веселящим газом?
Если вдыхать смесь закиси азота с небольшим количеством кислорода в течение достаточно длительного времени, это вызывает истерический смех, поэтому закись азота также известна как «веселящий газ».Вот почему закись азота называется веселящим газом.
Молярная масса Закись азота
Молярная масса O = 16,00 г / моль.
N 2 молярная масса = 14,01 x 2 = 28,02 г / моль.
Молярная масса = 44,013 г / моль
N2O Структура Льюиса — Ключевые моменты
- Простейшая формула закиси азота — N 2 O
- Это известный вдыхаемый анестетик, поскольку он действует как быстрое болеутоляющее.
- Молярная масса N 2 O составляет 44,013 г / моль
- Закись азота, от использования в качестве окислителя в ракетном двигателе до его использования в двигателях внутреннего сгорания, имеет огромное применение в различных областях. Он также используется в аэрозольных пропеллентах.
- Согласно N 2 O структура Льюиса, молекулярная геометрия N 2 O является линейной.
- Используется в производстве полупроводников
- Число электронов в валентной оболочке атома азота = 5
- Число электронов в валентной оболочке атома кислорода = 6
- Заряд центрального атома азота составляет +1 в молекуле N 2 O
N
2 O Формальный заряд
Формальный заряд = валентные электроны — несвязанные электроны — 0.5 связанных электронов
Валентные электроны в азоте = 5 электронов
Несвязанные электроны в азоте = 2 электрона
Половина связанных электронов в азоте = 6/2 = 3 электрона
Формальный заряд на азоте = 5-2-3 = 0
Валентность электроны в центральном азоте = 5 электронов
Несвязанные электроны в центральном азоте = 0 электронов
Половина связанных электронов в центральном азоте = 8/2 = 4 электрона
Формальный заряд на центральном азоте = 5 — 0 — 4 = 1 электрон
Валентность электроны в кислороде = 6 электронов
Несвязанные электроны в кислороде = 6 электронов
Половина связанных электронов в кислороде = 2/2 = 2 электрона
Формальный заряд в кислороде = 6-6-1 = -1 электрон
Ссылки по теме
CO
2 Структура Льюиса и молекулярная геометрия
HCN Структура Льюиса | Пошаговое строительство
SiO
2 Структура Льюиса | Пошаговое строительство
SO
2 (диоксид серы) Структура Льюиса
Часто задаваемые вопросы
Является ли оксид азота кислотным или основным?
Закись азота — нейтральный оксид.Он не образует соли при взаимодействии с кислотами или основаниями.
Что такое веселящий газ?
Если вдыхать смесь закиси азота с небольшим количеством кислорода в течение достаточно длительного времени, это вызывает истерический смех.
Почему важна структура Льюиса N2O?
Структура Льюиса N2O помогает нам узнать о структуре соединения, типах и количестве связей, физических свойствах и о том, как соединение взаимодействует с другими соединениями.
Автор
Умайр Джавед
Умайр работает в Whatsinsight с 2020 года в качестве автора контента.
Имеет степень магистра материаловедения.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Структуры валентных связей для N2O и HCNO с очевидно пятивалентными атомами азота
Примечательно, насколько современные структурные данные поддерживают точку зрения Льюиса о том, что понимание химического сродства необходимо искать в локализации зарядов 532, и насколько хорошо эта локализация зарядов является описывается графическими формулами классической структурной теории. Свойства насыщения и направленности относительно сильных межмолекулярных и внутримолекулярных взаимодействий теперь кажутся очевидным, если не полностью ожидаемым, следствием тетраэдрического распределения заряда вокруг объединенных атомов.Химически объединенные атомы не ведут себя во взаимодействии с соседними распределениями заряда, как простые ван-дер-ваальсовые сферы, отрезанные с тех сторон, где они связаны с другими атомами. При межмолекулярных и внутримолекулярных взаимодействиях атомы, по-видимому, ведут себя больше как сферы с углублениями, с выступами в их валентных оболочках, где есть неподеленные электроны, протонированные электроны и другие общие электроны, а между этими выступами — впадины на гранях скоординированной валентности. -оболочечные электронные многогранники.Задача природы при низких температурах — как лучше разместить нуклеофильные неровности в электрофильных впадинах. В конденсированных фазах молекулы, вероятно, используют, хотя бы в слабой степени, большую часть своих донорных и акцепторных центров в той или иной форме меж- и внутримолекулярных взаимодействий, минимизируя тем самым энергию электростатических полей своих случайных чувствительных силовых линий. Нейтрализация заряда в молекулах, классические октетные структуры которых содержат формальные заряды, по-видимому, «переполняют» атомы с положительными формальными зарядами.Внутримолекулярная нейтрализация заряда, по-видимому, часто происходит посредством вращения и наклона спиновых наборов таким образом, что неподеленные электроны приближаются к электрофильным центрам, образуя таким образом «внутримолекулярные донорно-акцепторные комплексы». Нейтрализация межмолекулярного заряда происходит за счет трансляции наборов спинов друг к другу, образуя, таким образом, межмолекулярные донорно-акцепторные комплексы. Как во внутримолекулярных, так и во внутримолекулярных донорно-акцепторных взаимодействиях эффект сокращения «связи» неподеленных электронов и уменьшения от «нормального» расстояния донор-акцептор D ⋯ A (рис. 38) или BC (18a) обычно намного больше, чем соответствующий эффект удлинения связи и увеличение от нормального расстояния между акцепторно-акцепторным заместителем AS (рис. 38) или AB (18a).Химия донорно-акцепторных взаимодействий — это прежде всего химия неподеленных электронов. Таинственный «период», разделяющий компоненты молекулярных соединений, этот «полный перерыв в мысли», как назвал его Ремсен 533, во многих случаях представляет собой пару электронов, разделенных поровну между двумя атомами. Обычно при объединении остаточных сродств неподеленная пара в первичной оболочке донорного атома проникает только до вторичной валентной оболочки акцепторного атома. Создание вторичной координационной оболочки электронов вокруг атомного остова акцепторного атома путем образования «пара-карман» или «гранецентрированных» связей A-Biii-C.. можно сравнить с созданием вторичной координационной оболочки анионов вокруг обычного катиона — просто с большим атомным ядром, перекрывающим грани первичного многогранника анионов вокруг катиона дополнительными анионами, как показано на примере ацетата бистиомочевины и цинка. complex534 на рисунке 88. Атомы кислорода O (2) и O (4) на рисунке 88 принадлежат второй координационной сфере Zn; они лежат на гранях O (1) -O (3) S (2) и O (3) S (1) O (1) согласованного тетраэдра. Атом серы S (1), например, соответствует уходящей группе A во внутримолекулярном взаимодействии указанного выше типа iii, цинк — акцепторному атому B, кислород O (3) — электронной паре связи BC, углеродному атому C (4) к донорному атому C, а атом кислорода O (4) к неподеленной паре на донорном атоме.(Представлен рисунок) Рисунок 88. — Структура комплекса бистиомочевина-ацетат цинка. Гранецентрированные связи представляют собой переходные межатомные взаимодействия. Они представляют собой модели взаимодействий между нормальными контактами Ван-дер-Ваальса и одинарными связями, для которых представляется подходящим представление пунктирными линиями, и взаимодействий, которые попадают между одинарными и двойными связями или двойными и тройными связями, для которых обычные валентные штрихи увеличиваются на были использованы фигурные стрелки (или зазубрины).

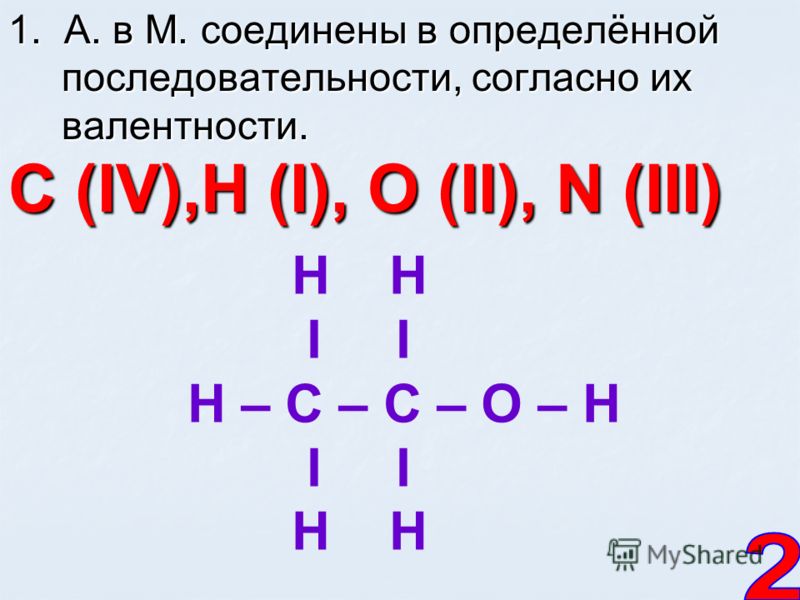 Степень окисления. Составление формул по валентностям и степеням окисления. Химия, 8–9 класс: уроки, тесты, задания.
Степень окисления. Составление формул по валентностям и степеням окисления. Химия, 8–9 класс: уроки, тесты, задания.