Содержание
Валентность калия (K), формулы и примеры
Общие сведения о валентности калия
В виде простого вещества калий представляет собой серебристо-белый металл. Имеет объемно-центрированную кристаллическую решетку. Плотность калия невелика (легче воды) – 0,86 г/см3. Температуры кипения и плавления также невысоки (63,6oС и 760oС, соответственно). Мягкий, легко режется ножом. На воздухе калий быстро окисляется, образуя рыхлые продукты взаимодействия.
Валентность калия в соединениях
Калий — находится в четвертом периоде в IA группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 19. В ядре атома калия содержится 19 протонов и 20 нейтронов (массовое число равно 39). В атоме калия есть четыре энергетических уровня, на которых находятся 19 электронов (рис. 1).
Рис. 1. Строения атома калия.
Электронная формула атома калия в основном состоянии имеет следующий вид:
1s22s22p63s23p64s1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного единственного неспаренного электрона свидетельствует о том, что калий проявляет валентность I в своих соединениях (KI2O, KIOH, KICl, KINO3 и т.д.). Валентность калия постоянная.
Примеры решения задач
|
Понравился сайт? Расскажи друзьям! |
| ||
Валентность калия
Валентность калия.
Валентность калия:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность калия равна I. Калий проявляет постоянную валентность.
| Валентность калия в соединениях | |
| I | K2O, KOH, KCl, KNO3 |
Все свойства атома калия
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
67
Валентность и степень окисления атомов
23-Янв-2015 | Нет комментариев | Лолита Окольнова
Вопрос А4 ГИА (ОГЭ) по химии —
Валентность химических элементов. Степень окисления химических элементов
Валентность — способность атомовхимических элементов образовывать определённое число химических связей с атомами других элементов.
Степень окисления — вспомогательная условная величина для записи процессов окисления ивосстановления в окислительно-восстановительных реакциях.
Она не является истинным зарядом атома в молекуле.
- степень окисления (с.о.) может быть любым числом — 0, со знаком + или -, дробная
- валентность — всегда целое положительное число
Давайте посмотрим на практике, как определяются эти две величины
1. В бинарных веществах
Обычно в таких веществах какой-то один атом имеет постоянную сюою и с.о. второго атома определяют по нему:
- у фтора F всегда с.о. = -1, валентность — 1
- с.о. кислорода практически всегда -2 (валентность = 2). Исключение OF2 (+2) и h3O2 (-1)
- у водорода H степень окисления почти всегда +1.
Максимальная и минимальная с.о.
Это определяется по положению (группа и период) элемента в периодической системе:
У элементов 2-го периода:
- максимальная с.о. ( и она же минимальная) элементов с I по V группу = № группы, c.
 о.(O) = -2, с.о. (F)=-1
о.(O) = -2, с.о. (F)=-1
У элементов 3-го периода:
- минимальная максимальная с.о. = № группы,
- минимальная у элементов с IV по VII группы = № группы-8
2. В сложных веществах ( 3 и больше элементов)
Любая молекула электронейтральна — суммарный заряд положительных частиц должен быть равен заряду отрицательных частиц. Сверху пишем степень окисления каждого атома, снизу — заряды, умноженные на количество атомов в молекуле:
+1 +6 -2
K2SO4
+2+6-8
Для каждого вещества можно составить уравнение: пусть х — степень окисления исследуемого элемента
+1 х -2
K2Cr2O7
+2+2•x-14=0
x=+6
1) В сернистой кислоте с.о. серы = +4, если считать, то: 2+х-6=0. х=+4
2) Сульфат натрия. В сульфате с.о. серы = +6 или считаем: 2+х-8=0. х=+6
3) В сероводороде с. о. серы = -2
о. серы = -2
4) Оксид серы (IV) — т.е. с.о.(S)=+4
Ответ: 3) h3S
У хлора максимально возможная с.о. равна № группы = 7
1) KClO4: 1+x-8. x=+7
2) AlCl3: т.к. у алюминия всегда +3 (см.№ группы. то у хлора -1
3) CCl4: у углерода +4, у хлора -1
4) NaCl: у натрия всегда +1 (см.№ группы), значит, у хлора -1
Валентность будет =5 у элемента V группы.
1) Cl — VII группа
2) P — V группа
3) С — IV група
4) S — VI группа
Ответ: 2) P
В данном оксиде с.о. азота = +5
1) NO2 — c.о.=+4
2) нитрит калия — в нитритах c.о.(N)=+3 или можем посчитать: 1+х-4=0. х=+3
3) нитрат калия — степень окисления азота = +5 или считаем: 1+х-6=0. х=+5
4) азотистая кислота — как и в нитритах с.о.(N) = +3
Ответ: 3) KNO3
Еще на эту тему:
Обсуждение: «Валентность и степень окисления атомов»
(Правила комментирования)
Кальций валентность но водороду — Справочник химика 21
Таким образом, валентность — это число, которое показывает, сколько грамм-эквивалентов содержится в грамм-атоме элемента. Например, валентность водорода равна 1, кальция и кислорода — 2, алюминия — 3. [c.14]
Например, валентность водорода равна 1, кальция и кислорода — 2, алюминия — 3. [c.14]
Неметаллические свойства водорода выражены довольно слабо, поэтому только наиболее активные металлы — литий, калий, натрий, кальций, барий — образуют сравнительно непрочные гидриды состава LiH, КН и СаН-з, ВаНа, в которых формальная валентность водорода равна —1. Гидриды щелочных и щелочноземельных металлов обладают солеобразной природой и представляют собой твердые кристаллические вещества. Они легко разлагаются водой и кислотами с выделением [c.116]
Валентность Са равна двум, поэтому один атом кальция замещает два атома водорода [c.44]
К первой группе относятся элементы, атомы которых проявляют постоянную валентность. Например, водород, щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) всегда одновалентны кислород, щелочноземельные металлы (кальций, стронций, барий, радий) всегда двухвалентны алюминий всегда трехвалентен.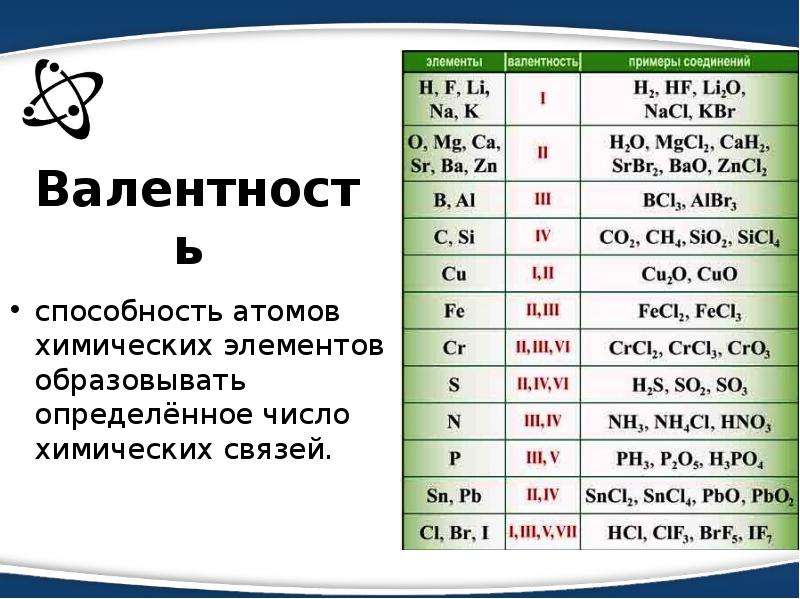 [c.26]
[c.26]
Это верно лишь в применении к элементам от водорода до кальция включительно. В так называемых переходных элементах (от скандия до меди и в аналогичных им элементах следуюш,их больших периодов периодической системы), а также в лантанидах (редкоземельных элемент 1х) и в актинидах имеются незаполненные внутренние оболочки электронов. Одпако все электроны этих незаполненных оболочек нельзя относить к валентным.— Прим. ред. [c.97]
Мерой валентности является валентность атома водорода, принятая за единицу. Нанример, из того факта, что один грамм-атом натрия замещает в реакциях один грамм-атом водорода, следует, что натрий одновалентен, так как во всех грамм-атомах содержится одинаковое число атомов. Таким же образом можно доказать двухвалентность кальция, трехвалентность алюминия и т. д. Но так как грамм-атом водорода есть в то же время и его грамм-эквивалент, то в более общем виде можно написать [c.16]
Барий обладает более выраженными металлическими свойствами, чем кальций, так как расположен в 6-ом периоде периодической системы элементов. Валентные электроны у бария находятся дальше от ядра, чем у кальция. Энергия отрыва валентных электронов у атома бария при образовании иона меньше, чем у кальция. Гидроксид бария должен обладать более основным характером, чем гидроксид кальция. Связь иона бария с кислородом менее прочна, чем связь водорода с кислородом диссоциация гидроксида будет происходить легко, с отщеплением гидроксид-ионов. [c.178]
Валентные электроны у бария находятся дальше от ядра, чем у кальция. Энергия отрыва валентных электронов у атома бария при образовании иона меньше, чем у кальция. Гидроксид бария должен обладать более основным характером, чем гидроксид кальция. Связь иона бария с кислородом менее прочна, чем связь водорода с кислородом диссоциация гидроксида будет происходить легко, с отщеплением гидроксид-ионов. [c.178]
Обычно в соединениях атомы водорода заряжены положительно, атомы же кислорода — отрицательно. Металлы подобно водороду почти всегда проявляют положительную валентность. Для металлоидов характерна отрицательная валентность, но они часто бывают заряжены и положительно (в соединениях, содержащих кислород). Одни элементы имеют постоянную валентность (кислород, калий, кальций, алюминий и др.), валентность других может быть переменной (железо, марганец, хлор и др.). Атомы, заряженные разноименным электричеством, притягиваются и образуют электронейтральные молекулы. [c.56]
[c.56]
Так как эквивалент элемента равен атомной массе, деленной на его валентность, то величина эквивалента будет постоянной только у элементов с постоянной валентностью (например, у водорода, кислорода, натрия, калия, кальция, бора, алюминия). Эквивалент же элементов, обладающих переменной валентностью, будет иметь различные значения в зависимости от валентности. Примером такого элемента может служить азот (табл. 5). [c.33]
В ряду напряжений наиболее активными, легко отщепляющими свои валентные электроны являются щелочные (калий, натрий и др.) и щелочноземельные (барий, кальций, магний) металлы, которые энергично вытесняют водород из кислот и воды. Далее стоят металлы с менее выраженной способностью отщеплять свои валентные электроны и, наконец, такие, которые могут быть превращены в положительно заряженные ионы только при сильном окислении. [c.304]
Первый горизонтальный ряд отвечает первому периоду и содержит два элемента, второй и третий ряды отвечают второму и третьему периодам и содержат по 8 элементов.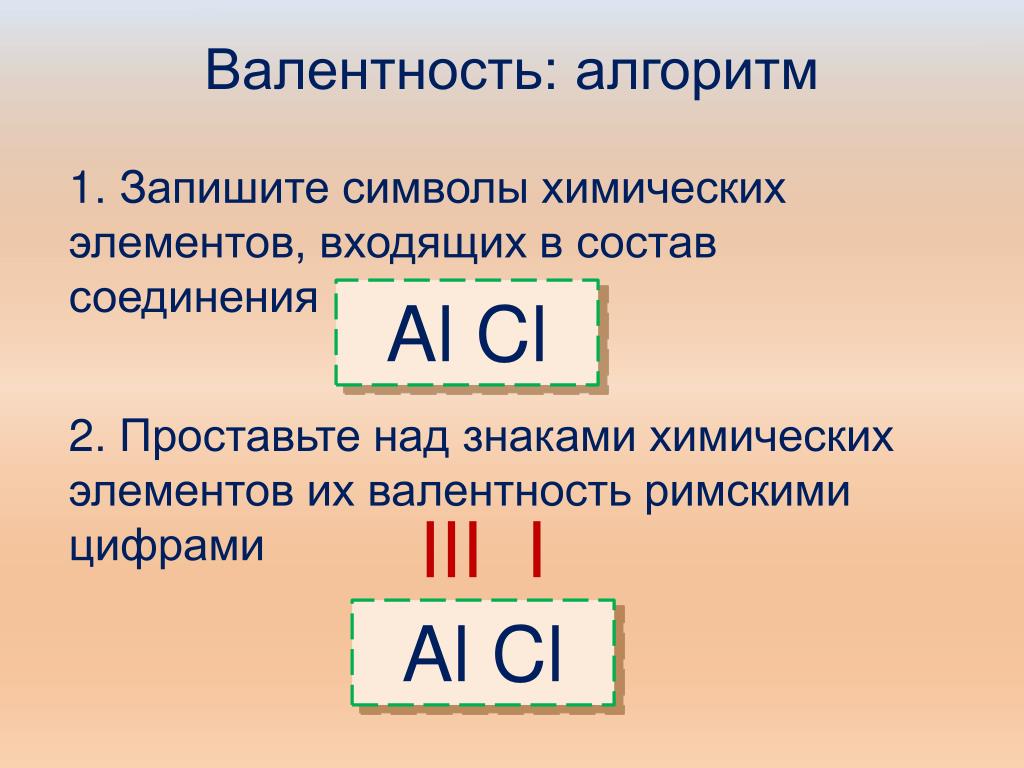 Каждый из этих трех периодов завершается инертным газом. После аргона до ближайшего инертного газа криптона идет уже не 8, а 18 элементов 8-й, 9-й и 10-й элементы, т. е. железо, кобальт, никель, являются своеобразным переходом к меди, имеющей только некоторые общие черты с калием, под которым она находится, к цинку, имеющему (неполное) сходство с кальцием, и т. д. Эти три (Ре, Со, N1) элемента входят в 8-ю группу и благодаря близости их свойств заключены в одну клетку. Медь, цинк и т. д. составляют начало соответствующих подгрупп в 1-й, 2-й и других группах. 4-й период именуется большим периодом и содержит столько же элементов (18), как и 5-й. В б-м периоде имеется 32 элемента чрезвычайно близкие по свойствам редкоземельные элементы помещены в одну клетку. Аргон и калий, кобальт и никель, теллур и иод, торий и протактиний по ходу атомных весов дают кажущиеся отклонения. Мы называем эти отклонения кажущимися, потому что индивидуальность элемента определяется не столько атомным весом, бывшим, по существу говоря, лишь отправным пунктом в исканиях Менделеева, сколько-местом в системе.
Каждый из этих трех периодов завершается инертным газом. После аргона до ближайшего инертного газа криптона идет уже не 8, а 18 элементов 8-й, 9-й и 10-й элементы, т. е. железо, кобальт, никель, являются своеобразным переходом к меди, имеющей только некоторые общие черты с калием, под которым она находится, к цинку, имеющему (неполное) сходство с кальцием, и т. д. Эти три (Ре, Со, N1) элемента входят в 8-ю группу и благодаря близости их свойств заключены в одну клетку. Медь, цинк и т. д. составляют начало соответствующих подгрупп в 1-й, 2-й и других группах. 4-й период именуется большим периодом и содержит столько же элементов (18), как и 5-й. В б-м периоде имеется 32 элемента чрезвычайно близкие по свойствам редкоземельные элементы помещены в одну клетку. Аргон и калий, кобальт и никель, теллур и иод, торий и протактиний по ходу атомных весов дают кажущиеся отклонения. Мы называем эти отклонения кажущимися, потому что индивидуальность элемента определяется не столько атомным весом, бывшим, по существу говоря, лишь отправным пунктом в исканиях Менделеева, сколько-местом в системе. Валентность в группах растет от единицы до 8 по кислороду и, начиная с 4-й группы, падает от 4 до нуля по водороду. Сумма этих двух максимальных валентностей равна 8. В левой части находятся типичные металлы, дающие в водных растворах сильные основания, в правой части — металлоиды, дающие [c.29]
Валентность в группах растет от единицы до 8 по кислороду и, начиная с 4-й группы, падает от 4 до нуля по водороду. Сумма этих двух максимальных валентностей равна 8. В левой части находятся типичные металлы, дающие в водных растворах сильные основания, в правой части — металлоиды, дающие [c.29]
Если валентность обменивающихся ионов неодинаковая, в уравнения вводятся коэффициенты, как например, в случае обмена системы кальций — водород [c.60]
За щелочным металлом в каждом периоде следует элемент главной подгруппы II группы периодической системы. Это металлы бериллий, магний, кальций, стронций, барий и радий (табл. 18). Атомы всех этих элементов имеют на внешнем электронном слое по два электрона, а не один, как щелочные металлы. В остальном каждый из них повторяет электронную структуру предыдущего щелочного металла. Они могут легко отдавать два валентных электрона, превращаясь в двухзарядные положительные ионы. По химической активности все элементы главной подгруппы II группы, за исключением бериллия, лишь немного уступают щелочным металлам. В ряду напряжений они стоят сразу же за щелочными металлами. Их активность возрастает с ростом радиусов атомов, от бериллия к барию и радию. Если бериллий и магний, покрываясь нерастворимой пленкой окисла, почти не взаимодействуют с водой, то остальные металлы этой подгруппы легко разлагают воду с образованием растворимых в воде гидроокисей и водорода. [c.227]
В ряду напряжений они стоят сразу же за щелочными металлами. Их активность возрастает с ростом радиусов атомов, от бериллия к барию и радию. Если бериллий и магний, покрываясь нерастворимой пленкой окисла, почти не взаимодействуют с водой, то остальные металлы этой подгруппы легко разлагают воду с образованием растворимых в воде гидроокисей и водорода. [c.227]
Решение. Определяем число единиц отрицательной валентности у кислорода. Каждый атом кислорода несет заряд, равный —2, а 6 атомов несут 12 отрицательных зарядов. Этому числу отрицательных зарядов соответствует равное число положительных зарядов, принадлежащих кальцию, водороду и углероду. Кальций — двухвалентный металл, и на долю его атома приходится 2 положительных заряда. Водород одновалентен, и на долю его 2 атомов приходится 2 положительных заряда. Остальные 8 положительных зарядов принадлежат 2 атомам углерода. На долю каждого атома углерода приходится 4 положительных заряда. Таким образом, валентность углерода равна — -4.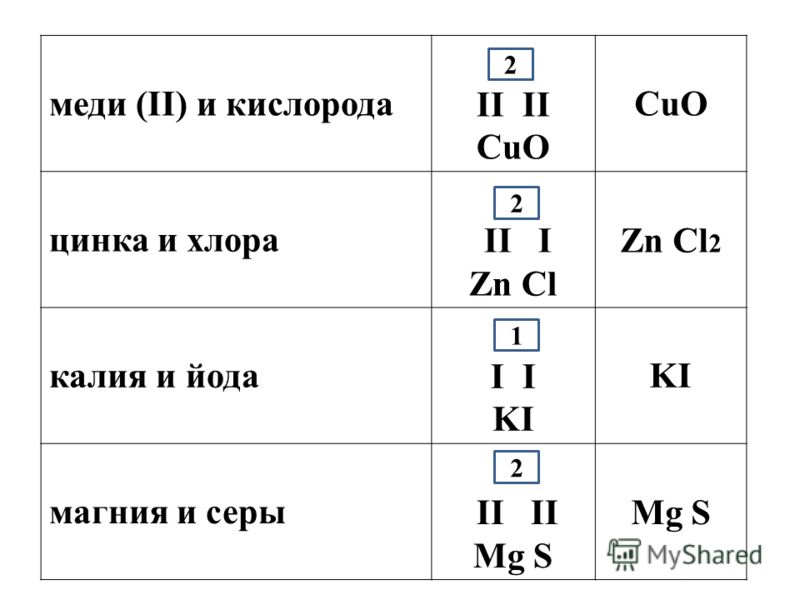 [c.44]
[c.44]
В кислых солях двухосновных кислот к общему названию добавляется частица би, например МаНЗО — бисульфат натрия, КНСО,— бикарбонат калия. Иногда, особенно в солях трехосновных кислот и более, вместо би употребляют гидро (если в кислотном остатке один атом водорода), дигидро (если в остатке два Н) и т. д. Например На НРО — гидрофосфат натрия, Са(Н,РО , — дигидрофосфат кальция. Для кислых солей фосфорной кислоты, в частности, более употребительны названия (например) К а,НРО — вторичный фосфат натрия (валентность кислотного остатка П), Са(Н2Р0 ,) — первичный фосфат кальция (валентность кислотного остатка I). [c.30]
АЦЕТИЛЕН (этин) СН=СН — первый член гомологического ряда ацетиленовых углеводородов. Бесцветный газ, хорошо растворяется в ацетоне и хлороформе. А. открыт в 1836 г. Дэви, синтезирован в 1862 г. Бертло с угля и водорода, получен из карбида кальция в том же году Велером. В промышленности А. получают из карбида кальция, электронрекингом нли термоокислнтель-ным крекингом из метана.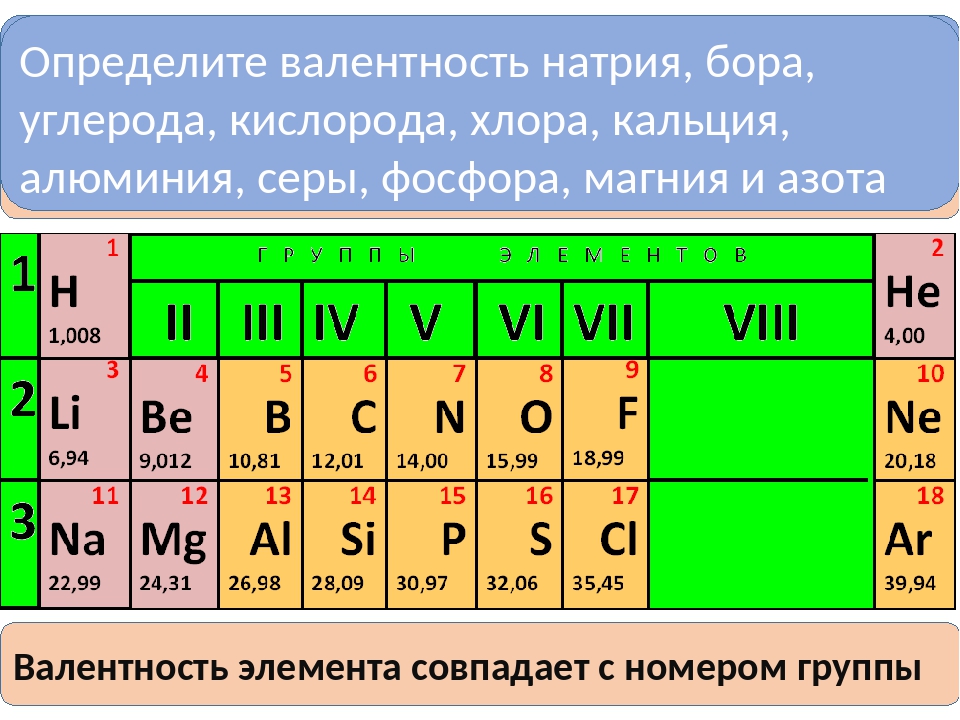 Смеси А, с воздухом взрывоопасны. А. чрезвычайно реакционноспособное непредельное соединение. Молекула А. имеет линейное строение. Расстояние между углеродными атомами составляет 1,20 А, углерод находится в молекуле А, в третьем валентном состоянии (ер-гибридизация), атомы углерода связаны одной о- и двумя я-связями. Для А. характерны реакции присоединения галогенов, галогеноводородов, воды (в присутствии солей ртути), цианистоводородной кислоты, оксида углерода, спиртов, кислот, водорода и др. Атомы водорода в молекуле А, можно заместить щелочными металлами, медью, серебром, магнием. [c.36]
Смеси А, с воздухом взрывоопасны. А. чрезвычайно реакционноспособное непредельное соединение. Молекула А. имеет линейное строение. Расстояние между углеродными атомами составляет 1,20 А, углерод находится в молекуле А, в третьем валентном состоянии (ер-гибридизация), атомы углерода связаны одной о- и двумя я-связями. Для А. характерны реакции присоединения галогенов, галогеноводородов, воды (в присутствии солей ртути), цианистоводородной кислоты, оксида углерода, спиртов, кислот, водорода и др. Атомы водорода в молекуле А, можно заместить щелочными металлами, медью, серебром, магнием. [c.36]
Перекиси. Перекиси (пероксиды) составляют своеобразную группу соединений, отличающуюся повышенным содержанием кислорода по сравнению с тем, что можно было бы ожидать, исходя из валентности окисляемого элемента. Примеры HgO — вода (окись водорода), Н2О2—перекись водорода СаО — окись кальция. СаОа — перекись кальция и т. д. [c.496]
Поскольку не для всех элементов были получены соединения с водородом, то для определения валентности более целесообразными оказались кислородные соединения.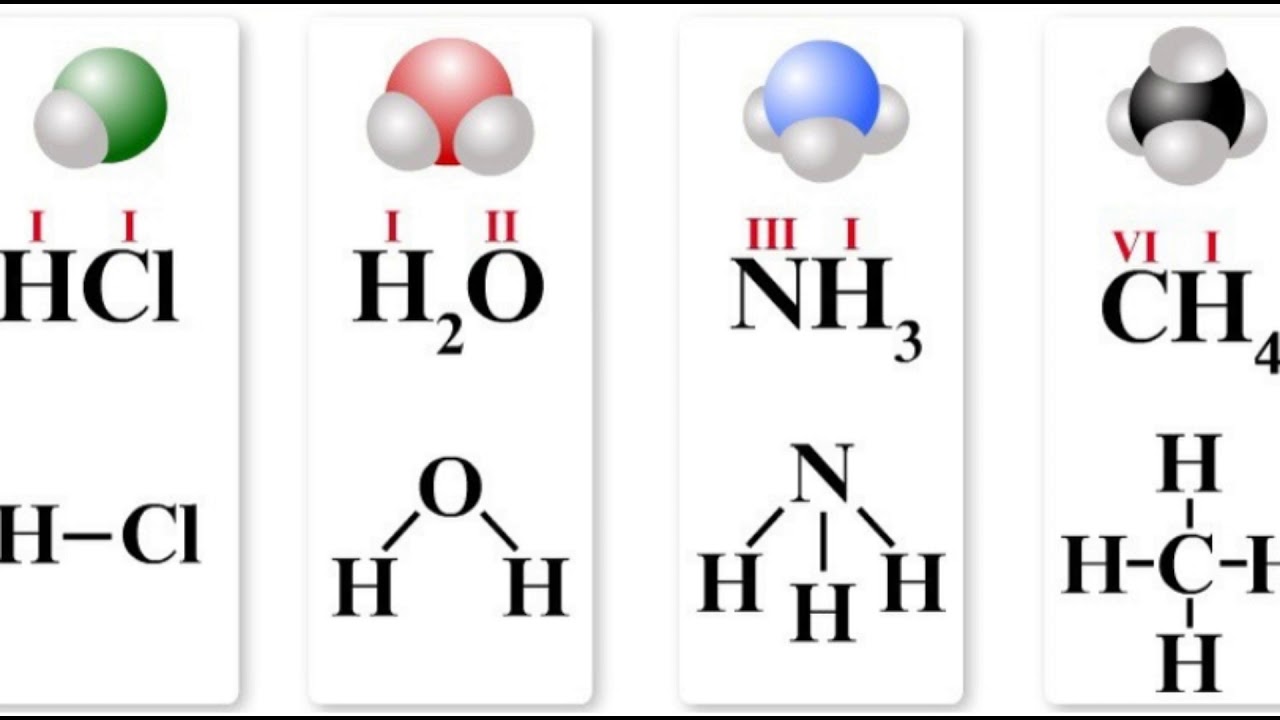 Зная состав кислородного соединения данного элемента, можно определить его валентность, учитывая, что атом кислорода всегда присоединяет два атома одновалентного элемента. Например, в соединениях Na20, aO, Si02 и т. д. валентности натрия, кальция и кремния соответственно равны 1, 2, 4. [c.13]
Зная состав кислородного соединения данного элемента, можно определить его валентность, учитывая, что атом кислорода всегда присоединяет два атома одновалентного элемента. Например, в соединениях Na20, aO, Si02 и т. д. валентности натрия, кальция и кремния соответственно равны 1, 2, 4. [c.13]
Что называется химическим эквивалентом ф2. Сформулируйте закон эквивалентов. фЗ. Как вычисляют эквиваленты элементов оксидов кислот оснований солей Привести примеры. ф4. Определите валентность и эквивалент отдельных элементов, входящих в соединения ЫаСгОг, Na2 r04, Na- raO . ф5. Определите число молей и эквивалентную массу элемента в 35 г натрия, 35 г кальция, 35 г алюминия. ф6. Как определить атомную массу трехвалентного элемента, зная, что эквивалент его равен 9 7. Определите эквивалент металла, если 0,1953 г его вытесняют 56 мл водорода при н. у. На сжигание 1 г металла требуется 462 мл кислорода при н. у. Найдите эквивалент металла. [c.51]
Впервые это понятие высказал английский химик Фран анд (1825—1899) в 1852г.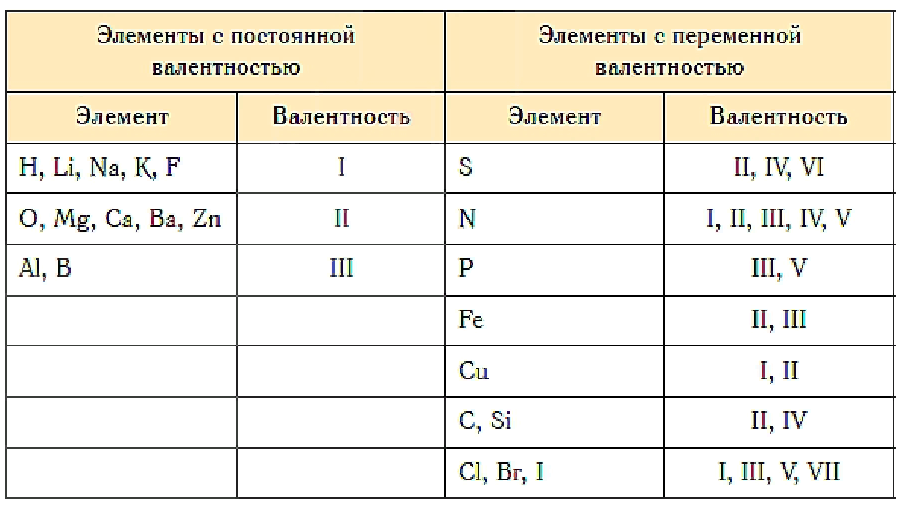 За единицу валенйюсти была принята валентность атома водорода. Например, в ряду соединений водорода НО, HjO, Nh4, СН4 валентность по водороду для хлора—1, для кислорода—2, для азота—3, для углерода—4. Можно определить валентность и по кислороду. Например, в ряду соединений кислорода N2O, СаО, SiOj, SO3 валентность по кислороду для азота—1, для кальция—2, для кремния—4, для серы—6. У большинства элементов валентность по кислороду и водороду различна. Например, у серы по водороду—2, по кислороду—6 (h3S и SO3). Охарактеризовать валентность одним числом, как правило, нельзя. [c.16]
За единицу валенйюсти была принята валентность атома водорода. Например, в ряду соединений водорода НО, HjO, Nh4, СН4 валентность по водороду для хлора—1, для кислорода—2, для азота—3, для углерода—4. Можно определить валентность и по кислороду. Например, в ряду соединений кислорода N2O, СаО, SiOj, SO3 валентность по кислороду для азота—1, для кальция—2, для кремния—4, для серы—6. У большинства элементов валентность по кислороду и водороду различна. Например, у серы по водороду—2, по кислороду—6 (h3S и SO3). Охарактеризовать валентность одним числом, как правило, нельзя. [c.16]
Из бирадикалов 2 и 3 с помощью реакций без затрагивания свободной валентности были синтезированы радикалы пятивалентного фосфора. Так, спин-меченый эфир фосфористой кислоты — бирадикал 3 был окислен перекисью водорода в присутствии хлорида кальция до диэфира фосфоновой кислоты нитроксильного радикала 38 [2] [c.99]
Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О.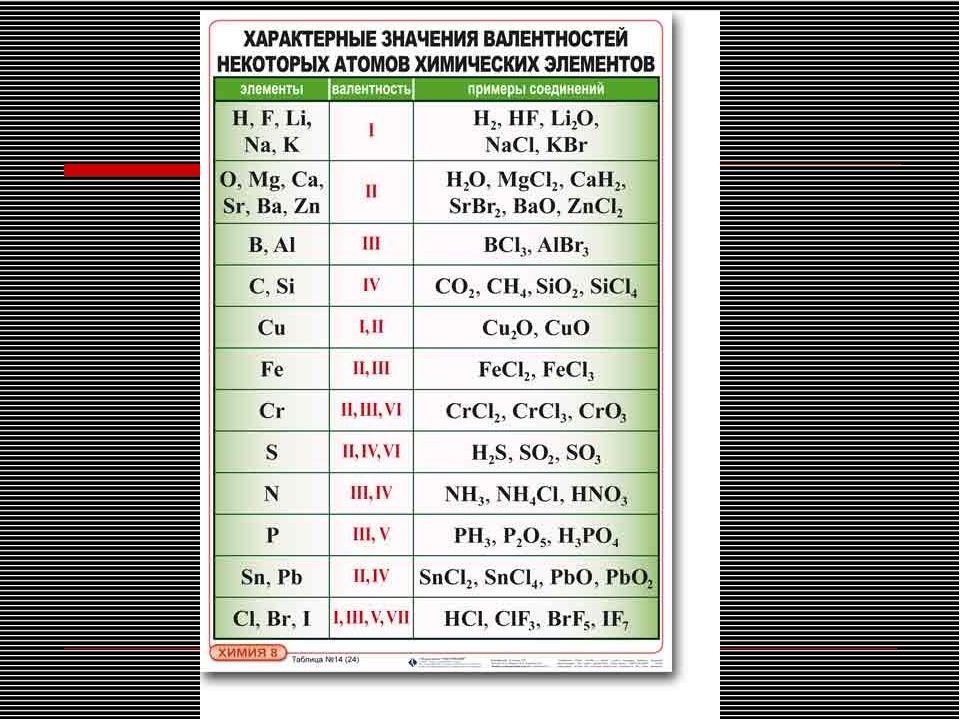 Кислород считается всегда стехиометрически двухвалентным и по составу кислородных соединений других элементов можно определить валентность этих элементов. Считают, что все оксиды можпо получить формальным замещением атомов водорода в воде па атомы других элементов. Напрггмер, из сравнения формул Н2О и КагО или Н2О и СаО делают заключение об одновалентности натрия и двухвалентности кальция. [c.156]
Кислород считается всегда стехиометрически двухвалентным и по составу кислородных соединений других элементов можно определить валентность этих элементов. Считают, что все оксиды можпо получить формальным замещением атомов водорода в воде па атомы других элементов. Напрггмер, из сравнения формул Н2О и КагО или Н2О и СаО делают заключение об одновалентности натрия и двухвалентности кальция. [c.156]
Некоторые элементы существуют в природе в виде газов, например, водород, кислород и азот ртуть существует в виде жидкости другие встречаются в твердом виде, например углерод, сера, фосфор, кальций, медь и цинк многие элементы существуют в виде различных соединений с другими элементами. Атомы одного элемента соединяются с атомами другого элемента в определенном отношении, обусловленном их валентностью. Валентность — это способность элемента присоединять определенное число атомов водорода, валентность которого принята за единицу. Таким образом, элемент с валентностью 2+ может замещать в веществе два атома водорода, а с валентностью 2— может вступать в реакцию с двумя атомами водорода.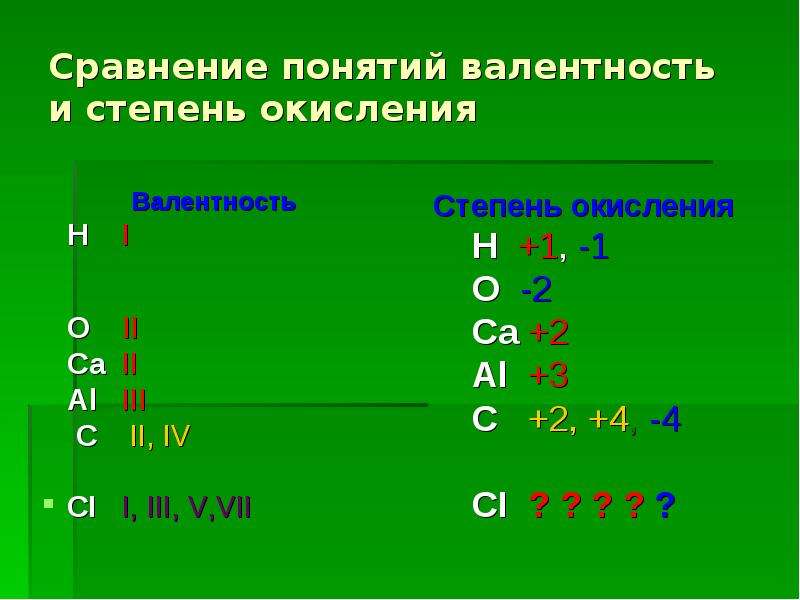 Натрий имеет валентность 1+, хлор 1—, следовательно, один атом натрия соединяется с одним атомом хлора, образуя хлористый натрий N301 (поваренную соль). Азот с валентностью —3 может соединяться с тремя атомами водорода, образуя аммиак NHз. Массу соединения, равную сумме атомных масс составляющих его элементов и выраженную в граммах. [c.9]
Натрий имеет валентность 1+, хлор 1—, следовательно, один атом натрия соединяется с одним атомом хлора, образуя хлористый натрий N301 (поваренную соль). Азот с валентностью —3 может соединяться с тремя атомами водорода, образуя аммиак NHз. Массу соединения, равную сумме атомных масс составляющих его элементов и выраженную в граммах. [c.9]
В таком случае равновесия между активными адсорбированными ионами глинистых минералов рассматриваются как реальные лишь тогда, когда обменные ионы бывают сходны по их валентности, размерам и т. д., например магний кальций. Отклонения будут наибольшими, если в рассматриваемой системе водород будет одним из двух обменивающихся ионов или если валентности адсорбируемых и активных ионов окажутся различньши. [c.333]
НИИ, Шахтшабель объяснял подлинным равновесием, которое достигается только, когда обменные ионы имеют одинаковые или близкие валентности и размеры, как в случае ионов кальция и магния. Расхождения оказываются наибольшими, если один из ионов представлен водородом или если валентность катионов различна (фиг.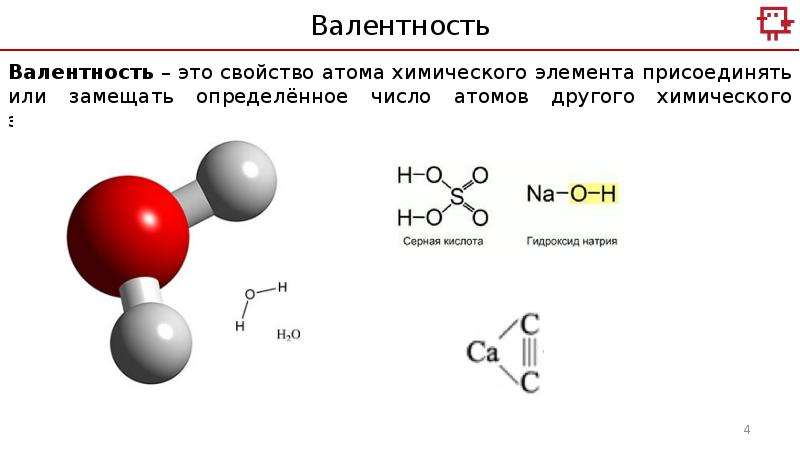 727). В таких равновесиях наблюдаются типичные [c.681]
727). В таких равновесиях наблюдаются типичные [c.681]
Получаемые в результате этих процессов хлориды, оксиды и сульфаты являются исходным материалом для получения индивидуальных редкоземельных металлов. С этой целью используют методы металлокерамического восстановления безводных хлоридов, бромидов, фторидов с помощью металлического кальция, магния, калия, лантана, электролиз безводных хлоридов, расплавленных галоидов, восстановление водородом и т. д. Для разделения редкоземельных металлов используют 1) реакции, связанные с изменением валентности РЗМ, 2) реакции осаждения, 3) фракционную кристаллизацию, 4) ионный обмен. 5) жидкостную экстракцию. Эффективная очистка редкоземельных металлов (лаитаиоидов) от примесей достигается дистилляцией н вакуумным переплавом. [c.550]
Линейный полиэтилен получен также гетерогенной полимеризацией с катализатором, представляющим собой восстановленную безводную фосфомолибденовую кислоту общей формулы PaM92o 2403o sj.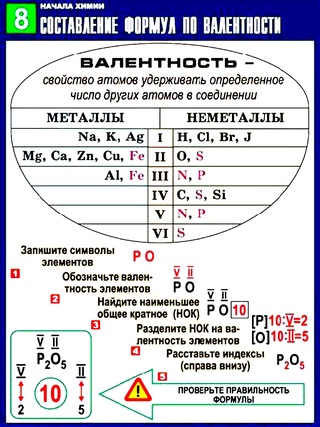 Этот катализатор получают восстановлением фосфомолибденовой кислоты водородом при 350—500° до снижения валентности молибдена ниже 4. Активность катализатора возрастает в присутствии небольших добавок металлов — цинк , натрия, молибдена и магния, а также гидридов лития, кальция и алюмогидрида лития [3]. [c.16]
Этот катализатор получают восстановлением фосфомолибденовой кислоты водородом при 350—500° до снижения валентности молибдена ниже 4. Активность катализатора возрастает в присутствии небольших добавок металлов — цинк , натрия, молибдена и магния, а также гидридов лития, кальция и алюмогидрида лития [3]. [c.16]
Валентностью атома называется число, показывающее, сколько атомов водорода или другого одновалентного р. еталла присоединяет или замещает атом данного элемента. Положительная валентность элементов равна номеру той группы таблицы Менделеева, в которой находится данный элемент. Например, натрий, калий, водород— одновалентны, цинк, магний, кальций—двухвалентны. Железо может быть двух- и трехвалентным, хром — трех- и шестнвалептным, олово — двух- и четырехвалентны.м. [c.27]
Мошяо также определить величину валентности элемента по его соединению с таким элементом, валентность которого но водороду уже известна. Например, в окиси кальция СаО один атом кальция соединен с одним двухвалентным атомом кислорода, отсюда и валентность кальция равна 2 в поваренной соли Na l один атом натрия соединен с одним одновалентным атомом хлора, отсюда и валентность натрия равна единице. [c.36]
[c.36]
Эти числа электронов, которые атомы элементов отдают или принимают при образовании молекул, соответствуют числу единиц валентности этих элементов водород одновалентен, натрий также одновалентен, кальций двухвалентен, алюминий трехва лентен, медь может быть одно- и двухвалентной, железо двух-и трехвалентно, кислород двухвалентен и т. д. Таким образом, валентность элемента в сложных веществах равна числу электронов, которые атом этого элемента отдает или же, наоборот, получает при образовании данной молекулы. Отсюда понятно, почему электроны наружных электронных слоев атомов получили название валентных электронов. Из сказанного также следует, что существует два противоположных типа валентностей. В молекуле Na l и натрий, и хлор одновалентны, но валентность натрия вызывается отдачей им одного из своих электронов, а валентность хлора вызывается, наоборот, получением им одного чужого электрона. Первый тип валентности называется положительной валентностью (атом натрия отдает электрон и превращается в положительный ион Na» ). Второй тип ваг лентности называется отрицательной валентностью (атом хлора получает электрон и превращается в. отрицательный ион 1 ). [c.46]
Вопреки стремлению к водороду в качестве кислотообразующего начала , сохранились многие пережитки теории Бэрцелиуса, например употребление металлургами термина кислота для обозначения таких окислов, как двуокись кремния и термина основание для окислов вроде окиси кальция . Берцелиус, исходя из своей теории валентности, классифицировал окислы как кислоты и основания. Далее теория давала метод предсказания относительной силы кислот и оснований [10]. Такие основания, как окись натрия, должны быть сильными вследствие высокого положительного заряда металла, входящего в соединение. Отрицательный заряд окислов. приписывался кислороду, и кислотность кислот объяснялась высоким отрицательным зарядом кислорода по сравнению с более слабым положительным зарядом неметаллической составной части, как сера или углерод . Следовательно, кислоты с большим содержанием [c.12]
Извлечение молибдена из растворов. Степень извлечения молибдена из рудного сырья зависит не только от полноты химического вскрытия минерала и перевода молибдена в раствор, но и от полноты последующего извлечения его из растворов. В изложенных выше технологических схемах молибден извлекался из первичных растворов осаждением пара- и полимолибдата аммония, молибдата кальция, ферримолибда-тов , а из бедных растворов и промывных вод — ионным обменом. Помимо этих способов, возможно осаждение малорастворимого трисуль-фида молибдена M0S3, экстракция молибдена органическими экстрагентами, осаждение соединений молибдена низшей валентности, восстановлением молибдатных растворов молибденом или водородом. Осаждение MoS 3 применяется в промышленности для отделения молибдена от вольфрама при переработке комплексных вольфрамо-молибде-новых промежуточных продуктов (см. гл. V). Осаждение соединений низшей валентности, в частности МоО 2, не получило практического применения. [c.211]
Вопросы и задачи. I. Что называют валентностью элемента 2. Какая зависимость существует между атомной массой, эквивалентом и валентностью элемента в химическом соединении 3. Привести примеры элементов, имеющих валентность а) постоянную, б) переменную. 4. Найти валентность хрома в соединениях СгО, СГ2О3, СгОз- 5. Найти валентность серы в соединениях HaS, 50г, SO3. 6. Определить валентность магния в окиси магния, если эквивалент его в этом соединении равен 12 (атомная масса магния 24). 7. Найти величину эквивалента железа в соединении, называемом а) закисью железа (валентность железа 2), б) окисью железа (валентность железа 3). Атомная масса железа 56. 8. Составить формулы химических соединений, образованных следующими элементами (в скобках указана проявляемая ими валентность) а) натрия (1) и серы (2), б) кальция (2) и хлора (1), в) фосфора (5) и кислорода (2), г) алюминия (3) и серы (2), д) углерода (4) и водорода (1), [c.30]
Наиболее распространенной классификацией гидридов в настоящее время является подразделение их на ионные, металлические и ковалентные [13]. К ионным относятся гидриды щелочных металлов, щелочноземельных (Са, 8г, Ва) и лантаноидов в устойчивом двухвалентном состоянии (Ей, УЬ). Во всех этих случаях атомы водорода за счет валентных электронов металлов приобретают состояние отрицательного гидрид-иона Н (5 ) и типичный ионный характер связи между ионами металла и гидрид-ионом. Интересно, что магний образует гидрид М Н2 промежуточного типа между ионными и ковалентными, что совершенно естественно, так как сам магний занимает промежуточное положение между бериллием, являющимся из-за сильной склонности к образованию 7-конфигурации (за счет одноэлектронного хуо-перехода) типичным 51/7-элементом, и кальцием, представляющим -элемент с частичным участием -состояний из-за 4з -> Зй-перехода. К группе ионных гидридов относятся предположительно тригидриды лантаноидов (МеНз), точнее промежуточные фазы составов от МеНз до МеНз, образуемые, по-видимому, лантаноидами, имеющими М-электроны, способные к 5й- б5-переходу (Ьа, 0(1, Ьи, возможно, ТЬ), однако несомненно, что в этих случаях наряду с ионной компонентой связи появляется некоторая доля металлической связи за счет -электрона. Определенная доля ионной связи имеется в гидридах меди и цинка, где существует возможность передачи части валентных -электронов атому водорода с образованием гидрид-иона. [c.4]
Впервые это понятие высказал английский химик Франкланд (1825—1899) в 1852 г. За единицу валентности была принята валентность атома водорода. Возьмем ряд соединений водородаJ H l, Н2О, Nh4, СН4. Валентность по водороду для хлора—1, для кислорода —2, для азота —3, для углерода —4. Можно определить валентность и по кислороду. Возьмем ряд соединений кислорода N2O, СаО, SiOa, SO3. Валентность по кислороду для азота—1, для кальция — 2, для кремния — 4, для серы — 6. У большинства элементов валентность по кислороду и водороду различна. Например, у серы по водороду — 2, по кислороду — 6(h3S и SO3). Охарактеризовать валентность одним числом как правило нельзя. [c.24]
Химики создали полностью металлический аналог карбоната
Структура K5[SnBi3]·9(NH3), красные шарики — олово, синие — висмут. Треугольники из атомов висмута изоэлектронны карбонату.
Kerstin Mayer et al. / Angew. Chem. Int. Ed., 2017
Химики из Мюнхенского технического университета синтезировали изоэлектронный аналог карбонат-иона, состоящий полностью из атомов металлов — [SnBi3]5-. Это первый пример полностью металлического аналога карбоната, к тому же устойчивого в растворах. Процесс синтеза занял около семи месяцев. Исследование опубликовано в журнале Angewandte Chemie International Edition, кратко о нем сообщает Chemistry World.
Изоэлектронные аналоги — соединения, в молекулах которых содержатся одинаковое количество атомов и совпадающие наборы валентных электронов. Например, изоэлектронными аналогами являются угарный газ (CO) и азот (N2). В атоме углерода ровно на один валентный электрон меньше, чем в азоте, а в кислороде — на один больше, суммарное число валентных электронов в азоте и в угарном газе совпадает. Другие примеры — анионы серной и хлорной кислот (SO42- и ClO4—), графен и нитрид бора. Изоэлектронные частицы оказываются очень близки по своим физическим свойствам: одинаковая структура, похожие температуры плавления и кипения, сходные энергии химической связи.
Авторы новой работы обнаружили рекордно тяжелый изоэлектронный аналог карбонат-аниона в рамках исследования висмутидов — соединений, в которых висмут несет на себе отрицательный заряд. Химики растворили в жидком аммиаке висмутид калия (K3Bi2) и станнид калия (K4Sn9) и оставили получившуюся красную жидкость более чем на полгода. В результате, через семь месяцев ученые обнаружили в сосуде черные пластинчатые кристаллы K5[SnBi3]·9(NH3) — калиевой соли необычного аниона.
Строение аниона [SnBi3]5- и его резонансные структуры
Kerstin Mayer et al. / Angew. Chem. Int. Ed., 2017
Структурный анализ показал, что [SnBi3]5- — не часть полимерной цепочки из атомов металлов, а анион в форме правильного треугольника, геометрически совпадающий с карбонат-анионом (CO32-). Как и карбонат, новый анион содержит 24 валентных электрона, все атомы висмута в нем абсолютно идентичны (заряд делокализован между резонансными структурами). В отличие от карбонатов, стабильных в водных растворах, [SnBi3]5- быстро разлагается в присутствии воды — соединение устойчиво лишь в растворах жидкого аммиака.
У карбоната есть и более простые изоэлектронные аналоги — например, анион азотной кислоты (NO3—). Ранее химики синтезировали другие аналоги карбонатов — комплексные пниктиды кремния и германия (Cs5SiP3 и другие), пниктиды алюминия и индия (Cs6InAs3). Поиск соединений с необычными электронными свойствами и нестандартных изоэлектронных аналогов позволяет проверить границы применимости современных теорий в химии.
Ранее мы сообщали о синтезе новых классов «неорганических бензолов» — веществ, электронное строение которых напоминает ароматические органические вещества, но которые при этом не содержат в себе атомов углерода.
Владимир Королёв
Биохимические изменения в организме сельскохозяйственных животных под влиянием йодированного гумата калия
Библиографическое описание:
Кульмагамбетов, Т. И. Биохимические изменения в организме сельскохозяйственных животных под влиянием йодированного гумата калия / Т. И. Кульмагамбетов, Асет Жумабекулы Кубей. — Текст : непосредственный // Молодой ученый. — 2020. — № 19 (309). — С. 177-180. — URL: https://moluch.ru/archive/309/69741/ (дата обращения: 11.05.2021).
В статье проведен обзор по применению гуминового препарата йодированного гумата калия в животноводстве. Показаны преимущественные особенности использования препарата в организме сельскохозяйственных животных.
Ключевые слова: гуминовые препараты, гуминовые кислоты, гуматы, лечение, животноводство, ветеринария.
Общеизвестно, что гуминовые препараты положительно влияют на организм сельскохозяйственных животных. Кормовые добавки на их основе регулируют работу кишечника, а в случае развития патогенных процессов действуют обволакивающе, адсорбируя негативные микроорганизмы и снимая воспаление [1–3].
Неотъемлемой частью разработок новых биологических гуминовых препаратов, используемых для повышения продуктивности и улучшения иммунитета сельскохозяйственных животных, являются их исследования физико-химическими методами [4, 5]. Поэтому нами был получен гуминовый препарат — йодированный гумат калия и исследован его влияние на биохимические изменения в организме животных. Для получения гуминового препарата исходным сырьем были выбраны Сарыадырские угли Казахстана.
Полученный из этого сырья по известному способу гумат калия обогащали йодидом калия. При этом соотношение гумат калия : йодид калия составляет 100:1,5. Такую гуматную кормовую добавку скармливают в количестве 1 мл на 10 кг живой массы животного в сутки. Осуществление такого способа получения гуминового препарата обеспечивает улучшение продуктивных качеств животных и устранение дефицита йода, в частности обеспечивает профилактику и лечение йодной недостаточности у полигастричных животных.
УФ-спектры йодсодержащего гумата калия показали, что в его молекуле присутствуют хромофорные и ауксохромные группы, наличие которых обуславливает темно-коричневую окраску йодированного раствора гумата калия. По мере увеличения длины волны оптическая плотность растворов гумата калия постепенно снижается. В области коротких волн наблюдается резкое возрастание поглощения света. Во всех образцах йодированного раствора гумата калия наблюдается максимальное поглощение в области 220–240 нм. Это вызвано наличием в структуре молекулы гумата калия фенольных и карбоксильных групп, полиеновых цепей. Образцы имеют достаточно высокую оптическую плотность при длине волны =465 нм. Это говорит об увеличении содержания углерода и высокой конденсированности молекулы, а также о высоком содержании атомов кислорода и азота, что также может свидетельствовать о потенциальной биологической активности йодированного гумата калия.
В результате изучения ИК-спектров йодированного гумата калия (рис.1) выявлено наличие характерных для всех образцов полос поглощения.
Рис. 1. ИК-спектры раствора йодированного гумата калия
Интенсивные полосы наблюдаются при 2928–2915 и 2853 см-1. Это говорит о наличии валентных колебаний метильных (-СН3) и метиленовых (-СН2) групп. При этом можно говорить о преобладании групп –СН2, так как волновые числа для них (2930 и 2854 см-1) почти полностью совпадают со стандартными значениями (2922 и 2853 см-1). Следовательно, можно говорить о незначительной роли алканов в строении йодированного гумата калия.
Также наблюдается отчетливый максимум в интервале 1762–1700 см-1, что является следствием валентных колебаний карбонильных групп (С=О). Данная группа может быть представлена в основном альдегидами, кетонами и их производными. Для всех образцов характерно наличие выраженных полос поглощения в области 1655–1580 см-1. В данной области проявляются валентные СС колебания бензольного кольца (С=С). Наличие поглощения средней интенсивности при 1626 см-1 говорит о наложении валентных колебаний амидной группы (Nh3). Также можно говорить о наличии в составе гумата калия неконденсированных ароматических соединений, содержащих атомы кислорода и азота. Это подтверждает наличие полосы при 1511 см-1. Наблюдается полоса в области 1270–1080 см-1, что говорит о наличии валентных колебаний связи С-О в спиртах и фенолах, а также валентных колебаний связи С-О-С.
Для исследования влияния йодированного гумата калия на биохимические показатели крови животных были проведены опыты на коровах личного подсобного хозяйства. Для проведения опытов были выбраны две пары животных: первая пара — контрольная, вторая — опытная. Перед постановкой на опыт животные были осмотрены и признаны условно здоровыми. Условия содержания и кормления опытных и контрольных животных были абсолютно идентичными. Исключение составляет лишь то, что контрольной группе дополнительно скармливается йодид калия в количестве 15 мг на голову в сутки. Потребность в кормах и питательных веществах рассчитана на основе норм и рационов, рекомендованных РАСХН (Калашников А. П. и др., 1995), по продуктивности, живой массе и физиологическому состоянию. Длительность эксперимента составляла 21 день. В таблице 1 представлены биохимические показатели крови коров подопытной пары до начала и после опытов.
Таблица 1
Биохимические показатели крови подопытных коров до начала ипосле опытов
№ | Категория | Общий белок | Резервная щелочность | Кальций, мг % | Фосфор, мг % | Каротин, мг, % | |||||
до | после | До | после | До | после | до | после | До | после | ||
1 | Контрольный | 8,98 | 8,71 | 57 | 57 | 10,2 | 10,0 | 5,1 | 5,2 | 1,1 | 1,10 |
2 | Контрольный | 8,32 | 8,04 | 61 | 60 | 9,3 | 9,0 | 6,1 | 5,9 | 1,2 | 1,19 |
3 | Опытный | 10,1 | 10,18 | 71 | 77 | 9,6 | 13,0 | 6,3 | 6,4 | 0,9 | 0,92 |
4 | Опытный | 9,21 | 9,29 | 59 | 67 | 10,1 | 13,6 | 6,1 | 6,1 | 0,8 | 0,81 |
Данные биохимического анализа крови животных (таблица 1) показали, что наблюдается незначительное снижение белка у контрольных животных. У подопытных животных наблюдается незначительный рост. Отмечено увеличение резервной щелочности у подопытных животных. Это скорее всего говорит о нормализации кислотно-щелочного равновесия в организме коров после принятия йодированного гумата калия. Содержание фосфора меняется незначительно, а вот кальций показывает существенный рост у подопытных животных. Содержание каротина почти не меняется. В целом применение йодсодержащей гуминовой кормовой добавки позволяет устранить дефицит йода в организме животных, нормализует содержание кальция в крови, что благоприятно сказывается на здоровье животных.
Литература:
1. Горовая А. И., Орлов Д. С., Щербенко О. В. Гуминовые вещества. –Киев, 1995. — 303 с.
2. Ушакова Н. А., Некрасов Р. В., Правдин В. Г., Кравцова Л. З., Бобровская О. И., Павлов Д. С. Новое поколение пробиотических препаратов кормового значения // Фундаментальные исследования. — 2012. — № 1. — С. 184–192.
3. Степченко Л. М., Ефимов В. Г., Лосева Е. А., Скорик М. В. Использование гуминовых препаратов при получении биопродукции / Тр. IV международной конференции «Гуминовые вещества в биосфере». -СПб.: Изд-во СПбГУ, 2007. -C. 520–527.
4. Бузлама С. В. Фармакология препаратов гуминовых веществ и их применение для повышения резистентности и продуктивности животных. Автореферат дисс… докт. вет. наук. –Воронеж, 2008.
5. Susic M., Boto K. G. High-performance liquid chromatography determination of humic acids in environmental samples at the nano-gram level using fluorescence detection. // Journal of Chromatography. 502, 1989. P. 443–446.
Основные термины (генерируются автоматически): калий, гуминовый препарат, животное, йодид калия, валентное колебание связи, группа, йодированный раствор, наличие, организм животных, резервная щелочность.
Популярная библиотека химических элементов. Раритетные издания. Наука и техника
Калий
| 19 | |
K | 1 8 8 2 |
| КАЛИЙ | |
| 39,098 | |
| 4s1 | |
Человечество знакомо с калием больше полутора веков. В лекции, прочитанной в Лондоне 20 ноября 1807 г., Хэмфри Дэви сообщил, что при электролизе едкого кали он получил «маленькие шарики с сильным металлическим блеском… Некоторые из них сейчас же после своего образования сгорали со взрывом». Это и был калий.
Калий – замечательный металл. Замечателен он не только потому, что режется ножом, плавает в воде, вспыхивает на ней со взрывом и горит, окрашивая пламя в фиолетовый цвет. И не только потому, что этот элемент – один из самых активных химически. Все это можно считать естественным, потому что соответствует положению щелочного металла калия в таблице Менделеева. Калий замечателен своей незаменимостью для всего живого и примечателен как всесторонне «нечетный» металл.
Обратите внимание: его атомный номер 19, атомная масса 39, во внешнем электронном слое – один электрон, валентность 1+. Как считают химики, именно этим объясняется исключительная подвижность калия в природе. Он входит в состав нескольких сотен минералов. Он находится в почве, в растениях, в организмах людей и животных. Он – как классический Фигаро: здесь – там – повсюду.
Калий и почва
Вряд ли можно объяснить случайностью или прихотью лингвистов тот факт, что в русском языке одним словом обозначаются и сама наша планета, и ее верхний слой – почва. «Земля-матушка», «земля-кормилица» – это, скорее, о почве, чем о планете в целом…
Но что такое почва?
Самостоятельное и весьма своеобразное природное тело. Оно образуется из поверхностных слоев разнообразных горных пород под действием воздуха, воды, температурных перепадов, жизнедеятельности всевозможных обитателей Земли. Ниже, под почвой, скрыты так называемые материнские горные породы, сложенные из различных минералов. Они постепенно разрушаются и пополняют «запасы» почвы.
А в почве, помимо чисто механического, постоянно происходит и другое разрушение. Его называют химическим выветриванием. Вода и углекислый газ (в меньшей мере другие вещества) постепенно разрушают минералы.
Почти 18% веса земной коры приходится на долю калийсодержащего минерала – ортоклаза. Это двойная соль кремневой кислоты K2Al2Si6O16 или K2O · Al2O3 · 6SiO2. Вот что происходит с ортоклазом в результате химического выветривания:
К2О · Аl2O3 · 6SiO2 + 2Н2О + CO2 → K2CO3 + Al2O3 · 2SiO2 · 2Н2O + 4SiO2.
Ортоклаз превращается в каолин (разновидность глины), песок и поташ. Песок и глина идут на построение минерального костяка почвы, а калий, перешедший из ортоклаза в поташ, «раскрепощается», становится доступным для растений. Но не весь сразу.
В почвенных водах молекулы К2CO3 диссоциируют: К2CO3 ↔ K+ + KCO–3 ↔ 2K+ + CO2–3. Часть ионов калия остается в почвенном растворе, который для растений служит источником питания. Но большая часть ионов калия поглощается коллоидными частицами почвы, откуда корням растений извлечь их довольно трудно. Вот и получается, что, хотя калия в земле много, часто растениям его не хватает.
Из-за того, что комочки почвы «запирают» большую часть калия, содержание этого элемента в морской воде почти в 50 раз меньше, чем натрия. Подсчитано, что из тысячи атомов калия, освобождающихся при химическом выветривании, только два достигают морских бассейнов, а 998 остаются в почве. «Почва поглощает калий, и в этом ее чудодейственная сила», – писал академик А.Е. Ферсман.
Калий и растение
Калий содержится во всех растениях. Отсутствие калия приводит растение к гибели. Почти весь калий находится в растениях в ионной форме – К+. Часть ионов находится в клеточном соке, другая часть поглощена структурными элементами клетки.
Ионы калия участвуют во многих биохимических процессах, происходящих в растении. Установлено, что в клетках растений эти ионы находятся главным образом в протоплазме. В клеточном ядре они не обнаружены. Следовательно, в процессах размножения и в передаче наследственных признаков калий не участвует. Но и без этого роль калия в жизни растения велика и многообразна.
Калий входит и в плоды, и в корни, и в стебли, и в листья, причем в вегетативных органах его, как правило, больше, чем в плодах. Еще одна характерная особенность: в молодых растениях больше калия, чем в старых. Замечено также, что по мере старения отдельных органов растений ионы калия перемещаются в точки наиболее интенсивного роста.
При недостатке калия растения медленнее растут, их листья, особенно старые, желтеют и буреют по краям, стебель становится тонким и непрочным, а семена теряют всхожесть.
Установлено, что ионы калия активизируют синтез органических веществ в растительных клетках. Особенно сильно влияют они на процессы образования углеводов. Если калия не хватает, растение хуже усваивает углекислый газ, и для синтеза новых молекул углеводов ему недостает углеродного «сырья». Одновременно усиливаются процессы дыхания, и сахара, содержащиеся в клеточном соке, окисляются. Таким образом, запасы углеводов в растениях, оказавшихся на голодном пайке (по калию), не пополняются, а расходуются. Плоды такого растения – это особенно заметно на фруктах – будут менее сладкими, чем у растений, получивших нормальную дозу калия. Крахмал – тоже углевод, поэтому и на его содержание в плодах сильно влияет калий.
Но и это не все. Растения, получившие достаточно калия, легче переносят засуху и морозные зимы. Это объясняется тем, что калий влияет на способность коллоидных веществ растительных клеток поглощать воду и набухать. Не хватает калия – клетки хуже усваивают и удерживают влагу, сжимаются, отмирают.
Ионы калия влияют и на азотный обмен веществ. При недостатке калия в клетках накапливается избыток аммиака. Это может привести к отравлению и гибели растения.
Уже упоминалось, что калий влияет и на дыхание растений, а усиление дыхания сказывается не только на содержании углеводов. Чем интенсивнее дыхание, тем активнее идут все окислительные процессы, и многие органические вещества превращаются в органические кислоты. Избыток кислот может вызвать распад белков. Продукты этого распада – весьма благоприятная среда для грибков и бактерий. Вот почему при калийном голодании растения намного чаще поражаются болезнями и вредителями. Фрукты и овощи, содержащие продукты распада белков, плохо переносят транспортировку, их нельзя долго хранить.
Одним словом, хочешь получать вкусные и хорошо сохраняющиеся плоды – корми растение калием вволю. А для зерновых калий важен еще по одной причине: он увеличивает прочность соломы и тем самым предупреждает полегание хлебов…
Калийные удобрения
Растения ежегодно извлекают из почвы большое количество калия.
Самое дешевое (фактически даровое) и в то же время прекрасное по качеству калийное удобрение – печная зола. В ней калий находится в виде поташа К2CO3. Состав золы различных растений далеко не одинаков. Больше всего калия в золе подсолнечника – 36,3% К2О (содержание калия в калийных удобрениях принято пересчитывать на K2O). В золе дров окиси калия значительно меньше – от 3,2% (еловые дрова) до 13,8% (березовые дрова). Еще меньше калия в золе торфа.
Конечно, одной золой калийный голод растений не утолить. Самым важным калийным удобрением стали природные калийные соли, в первую очередь сильвинит и каинит. Сильвинит – очень распространенный минерал. Его состав обозначают формулой mKCl · nNaCl. Кроме хлоридов натрия и калия, в нем есть примеси солей кальция, магния и других элементов. Обычно в сильвините 14…18% К2O. В каините KCl · MgSO4 · 3H2O окиси калия меньше – 10…12%.
Значительную часть природных калийных солей перерабатывают в технический продукт – хлористый калий (содержание калия в пересчете на K2O 50…62%).
Из сильвинита хлористый калий получают методами галургии или флотации. Первый основан на различной растворимости KCl и NaCl в воде при повышенных температурах. Второй – на разной смачиваемости этих веществ.
Первый метод используется шире. При нормальной температуре растворимость хлоридов калия и натрия почти одинакова. С повышением температуры растворимость NaCl почти не меняется, а растворимость KCl сильно возрастает. На холоде готовят насыщенный раствор обеих солей, затем его нагревают и обрабатывают им сильвинит. При этом раствор дополнительно насыщается хлористым калием, а часть поваренной соли вытесняется из раствора, выпадает в осадок и отделяется фильтрованием. Раствор охлаждают, и из него выкристаллизовывается избыточный хлористый калий. Кристаллы отделяют на центрифугах и сушат, а маточный раствор идет на обработку новой порции сильвинита.
Технический хлористый калий применяют и самостоятельно и в смеси с природными калийными солями.
В качестве удобрения используется также более дорогой, но не гигроскопичный и не слеживающийся сульфат калия K2SО4. Это удобрение можно применять на любых почвах. А ионы хлора, вносимые хлористым калием, для некоторых почв явно нежелательны. Противопоказаны они и некоторым растениям. Избыток ионов Сl– снижает содержание крахмала в клубнях картофеля, ухудшает качество льняных волокон, а персики, виноград и цитрусовые делает более кислыми.
Таким образом, удобряя землю хлористым калием, мы одновременно делаем все, чтобы улучшить и… ухудшить качество будущих плодов. Последнего можно избежать, если применять наиболее рациональные, химически обоснованные способы внесения калийных солей.
Ионы хлора в отличие от ионов калия почвой не поглощаются: они легко вымываются грунтовыми водами и уносятся в нижние горизонты. Поэтому, чтобы сохранить в почве калий, но убрать из нее хлор, нужно хлорсодержащие калийные удобрения вносить в почву осенью. Пока семена прорастут и корневая система начнет усваивать ионы из почвы, осенние дожди и талые воды успеют унести ионы хлора вглубь.
Кстати, любое калийное удобрение нужно не просто разбрасывать равномерно по полю, а заделывать его плугом на глубину пахоты – так намного эффективнее.
В сельскохозяйственной практике принято вносить от 30 до 90 кг K2O на гектар посева. Но эти дозы весьма условны, поскольку потребность в калийных удобрениях определяется не только составом почвы, но и тем, какая культура на этом поле посеяна. Свекле, картофелю, бобовым культурам, подсолнечнику, гречихе нужно больше калия, нежели пшенице, ржи, ячменю.
Агрономы считают, что при благоприятных условиях один килограмм К2О в среднем дает такие прибавки урожая: зерна – от 3 до 8 кг, картофеля – 35 кг, сахарной свеклы – 40 кг.
В нашей стране находятся самые богатые в мире месторождения калийных солей (район Соликамска – Березняков). В 1975 г. сельское хозяйство страны получило более 12 млн т калийных удобрений. Это в 12 раз больше, чем в 1950 г., и в 2,6 раза больше, чем в 1965 г.
Калий – человеку
Собственно, все, о чем рассказано выше, – тоже на тему «калий – человеку». А здесь коротко – о биологической роли элемента №19 в жизни наиболее сложного из живых организмов Земли.
Установлено, что соли калия не могут быть заменены в организме человека никакими другими солями. В основном калий содержится в крови и протоплазме клеток. Богаты калием печень и селезенка. Значительна роль этого элемента в регулировании деятельности ферментов.
Нельзя забывать еще об одной роли калия в пашей жизни. Природный калий состоит из трех изотопов: двух стабильных – 39К и 41К и одного радиоактивного – 40К с периодом полураспада около 1,3 млрд лет. Этот изотоп содержится в живых организмах и своим излучением вносит значительный вклад в общую сумму естественного (фонового) облучения…
Организм ребенка, как и молодое растение, требует больше калия, чем организм взрослого человека. Суточная потребность в калии у ребенка составляет 12…13 мг на 1 кг веса, а у взрослого – 2…3 мг, т.е. в 4…6 раз меньше.
Большую часть необходимого ему калия человек получает из пищи растительного происхождения. Недостаток калия оказывается на разных системах и органах, а также на обмене веществ.
Видимо, не очень преувеличивал Александр Евгеньевич Ферсман, написавший в одной из своих книг: «калий – основа жизни».
Встреча с калием?
Если на складе или на товарной станции вы увидите стальные ящики с надписями: «Огнеопасно!», «От воды взрывается», то весьма вероятно, что вы встретились с калием.
Много предосторожностей предпринимают при перевозке этого металла. Поэтому, вскрыв стальной ящик, вы не увидите калия, а увидите тщательно запаянные стальные банки. В них – калий и инертный газ – единственная безопасная для калия среда. Большие партии калия перевозят в герметических контейнерах под давлением инертного газа, равным 1,5 атм.
Зачем нужен металлический калий?
Металлический калий используют как катализатор в производстве некоторых видов синтетического каучука, а также в лабораторной практике. В последнее время основным применением этого металла стало производство перекиси калия К2О2, используемой для регенерации кислорода. Сплав калия с натрием служит теплоносителем в атомных реакторах, а в производстве титана – восстановителем.
Из соли и щелочи
Получают калий чаще всего в обменной реакции расплавленных едкого кали и металлического натрия: KOH + Na → NaOH + К. Процесс идет в ректификационной колонне из никеля при температуре 380…440°C. Подобным образом получают элемент №19 и из хлористого калия, только в этом случае температура процесса выше – 760…800°C. При такой температуре и натрий, и калий превращаются в пар, а хлористый калий (с добавками) плавится. Пары натрия пропускают через расплавленную соль и конденсируют полученные пары калия. Этим же способом получают и сплавы натрия с калием. Состав сплава в большой мере зависит от условий процесса.
Как быть если…
Вы впервые имеете дело с металлическим калием.
Необходимо помнить о высочайшей реакционной способности этого металла, о том, что калий воспламеняется от малейших следов воды. Работать с калием обязательно в резиновых перчатках и защитных очках, а лучше – в маске, закрывающей все лицо. С большими количествами калия работают в специальных камерах, заполненных азотом или аргоном. (Разумеется, в специальных скафандрах.)
А если калий все-таки воспламенился, его тушат не водой, а содой или поваренной солью.
Есть ли в растворе ионы калия?
Выяснить это несложно. Проволочное колечко опустите в раствор, а затем внесите в пламя газовой горелки. Если калий есть, пламя окрасится в фиолетовый цвет, правда, не в такой яркий, как желтый цвет, придаваемый пламени соединениями натрия.
Сложнее определить, сколько калия в растворе. Нерастворимых в воде соединений у этого металла немного. Обычно калий осаждают в виде перхлората – соли очень сильной хлорной кислоты HClО4. Кстати, перхлорат калия – очень сильный окислитель и в этом качестве применяется в производстве некоторых взрывчатых веществ и ракетных топлив.
Для чего нужен цианистый калий?
Для извлечения золота и серебра из руд. Для гальванического золочения и серебрения неблагородных металлов. Для получения многих органических веществ. Для азотирования стали – это придает ее поверхности большую прочность.
К сожалению, это очень нужное вещество чрезвычайно ядовито. А выглядит KCN вполне безобидно: мелкие кристаллы белого цвета с коричневатым или серым оттенком.
Что такое хромпик?
Точнее – хромпик калиевый. Это оранжевые кристаллы состава К2Сr2О7. Хромпик используют в производстве красителей, а его растворы – для «хромового» дубления кож, а также в качестве протравы при окраске и печатании тканей. Раствор хромпика в серной кислоте – хромовая смесь, которую во всех лабораториях применяют для мытья стеклянной посуды.
Зачем нужно едкое кали?
В самом деле, зачем? Ведь свойства этой щелочи и более дешевого едкого натра практически одинаковы. Разницу между этими веществами химики обнаружили лишь в XVIII в. Самое заметное различие между NaOH и KOH в том, что едкое кали в воде растворяется еще лучше, чем едкий натр. KOH получают электролизом растворов хлористого калия. Чтобы примесь хлоридов была минимальной, используют ртутные катоды. А нужно это вещество прежде всего как исходный продукт для получения различных солей калия. Кроме того, без едкого кали не обойтись в производстве жидких мыл, некоторых красителей и органических соединении. Раствор едкого кали используется в качестве электролита в щелочных аккумуляторах.
Селитра или селитры?
Правильнее – селитры. Это общее название азотнокислых солей щелочных и щелочноземельных металлов. Если же говорят просто «селитра» (не «натриевая» или «кальциевая» или «аммиачная», а просто – «селитра»), то имеют в виду нитрат калия. Этим веществом человечество пользуется уже больше тысячи лет – для получения черного пороха. Кроме того, селитра – первое двойное удобрение: из трех важнейших для растений элементов в ней есть два – азот и калий. Вот как описал селитру Д.И. Менделеев в «Основах химии»:
«Селитра представляет бесцветную соль, имеющую особый прохладительный вкус. Она легко кристаллизуется длинными, по бокам бороздчатыми, ромбическими, шестигранными призмами, оканчивающимися такими же пирамидами. Ее кристаллы (уд. вес 1,93) не содержат воды. При слабом накаливании (339°) селитра плавится в совершенно бесцветную жидкость. При обыкновенной температуре в твердом виде КNO3 малодеятельная и неизменна, но при возвышенной температуре она действует как весьма сильное окисляющее средство, потому что может отдать смешанным с нею веществам значительное количество кислорода. Брошенная на раскаленный уголь селитра производит быстрое его горение, а механическая смесь ее с измельченным углем загорается от прикосновения с накаленным телом и продолжает сама собою гореть. При этом выделяется азот, а кислород селитры идет на окисление угля, вследствие чего и получаются углекалиевая соль (Имеется в виду поташ.) и углекислый газ…
В химической практике и технике селитра употребляется во многих случаях как окислительное средство, действующее при высокой температуре. На этом же основано применение ее для обыкновенного пороха, который есть механическая смесь мелко измельченных: серы, селитры и угля».
Где и для чего применяются прочие соли калия?
Бромистый калий KBr – в фотографии, чтобы предохранить негатив или отпечаток от вуали.
Йодистый калий KI – в медицине и как химический реактив. Фтористый калий KF – в составе металлургических флюсов и для введения фтора в органические соединения.
Углекислый калий (поташ) К2CO3 – в стекольном и мыловаренном производствах, а так же кик удобрение.
Фосфаты калия, в частности К4Р2О7 и К5Р3О10, – как компоненты моющих средств.
Хлорат калия (бертолетова соль) КClO3 – в спичечном производстве и пиротехнике.
Кремнефтористый калий K2SiF6 – как добавка к шихте при извлечении редкоземельных элементов из минералов.
Железистосинеродистый калий (желтая кровяная соль) K4Fe(CN)6 · 3Н2О – как протрава при крашении тканей и в фотографии.
Почему калий назвали калием?
Слово это арабского происхождения. По-арабски, «аль-кали» – зола растений. Впервые калии получен из едкого кали, а едкое кали – из поташа, выделенного из золы растений… Впрочем, в английском и других европейских языках сохранилось название potassium, данное калию его первооткрывателем X. Дэви. Как нетрудно догадаться, эта слово берет начало от слова «поташ».
В русскую химическую номенклатуру название «калий» введено в 1831 г. Г.И. Гессом.
•
Кальций
• Оглавление
Дата публикации:
18 июня 2002 года
Валентность калия | Сколько валентных электронов у калия (K)?
Калий, химический элемент с символом K, является одним из
химически активные щелочные металлы группы 1 с атомным номером 11 в периодической таблице. Калий не встречается в природе в свободном состоянии из-за его высокой реакционной способности, так что он извлекается из различных соединений (в основном из солей).
Как мы знаем, сколько калия используется в мире
химии, поэтому у нас должна быть очень хорошая достоверная информация о ее электронных свойствах, чтобы выжить в мире химии, и именно поэтому вы здесь, чтобы
знаете, что такое валентные электроны и валентность натрия, не так ли? Но для этого
вы должны знать, что это за два термина, поэтому, не теряя времени, пойдем
для него,
Разница между валентными электронами и валентностью
Валентные электроны — общее количество присутствующих электронов
во внешней оболочке атома (т.е. на самой внешней орбите). Валентность
электронов для нейтрального атома всегда определен, его нельзя варьировать (больше или
меньше) в любых условиях для конкретного атома и может быть или не быть равным его
валентность.
Валентность определяется как общее количество электронов в атоме.
может потерять, получить или поделиться во время образования облигации, чтобы получить
стабильная электронная конфигурация, т.е. до октета. Валентность атома может
быть переменными в разных соединениях или в химических реакциях из-за разного связывания
механизмы.
Валентные электроны калия (K)
Чтобы узнать валентные электроны атома калия, нужно выполнить четыре простых шага:
Шаг 1: Найдите атомный номер
Чтобы узнать атомный номер калия, мы можем использовать периодический
Таблица. С помощью периодической таблицы мы можем легко увидеть, что атомный номер калия равен 19. Поскольку его атомный номер равен 19, в нем всего 19 протонов, а для
нейтральный калий, количество протонов всегда равно количеству электронов
я.е. 19 электронов в ядре.
Шаг 2: Запись электронной конфигурации
Электронная конфигурация — это расположение электронов на
орбитали. У атома калия 19 электронов, поэтому мы должны положить 11
электроны на орбиталях. Первые два электрона перейдут на 1s-орбиталь как S
орбиталь может содержать максимум два электрона. Следующие два уйдут через 2 с.
орбитали, и следующие шесть электронов перейдут на 2p-орбиталь, поскольку P-орбиталь может только
удерживают максимум 6 электронов.Снова два электрона в 3s и шесть в 3p, а оставшийся один электрон будет двигаться по 4s орбитали. Сейчас мы
имеют,
Электронная конфигурация калия K (19) = 1s22s22p63s23p64s1 (полная
конфигурация) или [Ar] 4 с 1 (сжатая конфигурация).
Шаг 3: Определение оболочки валентности
Как мы знаем, валентную оболочку атома можно найти по наибольшему количеству главных квантовых чисел, которое выражается в члене n, а в 1s22s22p63s23p64s1 наибольшее значение n равно 4, так что валентная оболочка K равна 4 с 1 .
Шаг 4. Найдите валентные электроны
Общее количество электронов, присутствующих в валентной оболочке.
атома называется валентными электронами, и присутствует только один электрон
в валентной оболочке калия (4 с 1 ). Таким образом, калий имеет только одну валентность.
электрон.
Валентность калия (K)
Есть много разных способов узнать валентность
атом, который отражает способность атома связываться с другими атомами.Валенсия описывает
насколько легко атом или свободный радикал могут соединяться с другими химическими соединениями. В
Валентность атома определяется на основе количества электронов, потерянных, полученных или разделенных с другим атомом.
Атом считается стабильным, если его внешние оболочки имеют
восемь электронов (кроме H и He). Если общее количество электронов в
внешние оболочки от одного до четырех, атом имеет положительную валентность, и если
электронов от четырех до восьми, валентность рассчитывается путем вычитания
от восьми и валентность отрицательная.Атомы с четырьмя крайними электронами
обладают как положительной, так и отрицательной валентностью, а атомы имеют восемь внешних
электроны имеют нулевую валентность (т.е. благородные газы).
Щелочные металлы , такие как калий, достигли стабильного (ближайшего инертного
газовая конфигурация), потеряв один крайний электрон. Таким образом, валентность калия (K) равна 1.
Валентность калия также можно определить с помощью таблицы Менделеева. поскольку натрий является элементом группы 1, которая указывает щелочь
Группа металлов и валентность щелочных металлов всегда равны 1.
Валентные электроны и валентность K +
Ион калия K + означает, что он потерял один электрон и имеет только
18 электронов на орбиталях. Электронная конфигурация нейтрального K — 1s22s22p63s23p64s1, но в K + он теряет один электрон, поэтому он имеет новую электронную конфигурацию 1s22s22p63s23p6, что означает, что K + имеет только (2 + 6 = 8) крайних электронов, что делает его стабильным. Таким образом, ион калия (K +) имеет восемь валентных электронов.
K + валентность не равна нулю, как благородный газ, как их крайний край.
Оболочка имеет восемь электронов.когда атом калия теряет один электрон, образуется ион K +, и это валентность. Таким образом, валентность K + равна +1, а не нулю.
Химические свойства
Атом калия (K)
| Атомный номер | 19 |
| Число протонов | 19 |
| Число электронов | 19 |
| Конфигурация электронов | 1s22s22p63s23p64s1 | 1 |
| Валентность / валентность | 1 |
Калий-ионный (K +)
| Число электронов | 18 |
| Электронная конфигурация | |
| Валентные электроны | 8 |
| Валентность / валентность | +1 |
неорганическая химия — Почему у K⁺ 0 валентных электронов?
неорганическая химия — Почему у K⁺ 0 валентных электронов? — Обмен химического стека
Сеть обмена стеков
Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange
0
+0
- Авторизоваться
Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов, изучающих химию.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществу
Кто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено
16к раз
$ \ begingroup $
Если из атома $ \ ce {K} $ удалить электрон, почему тогда у него 0 валентных электронов, как это указано в моем учебнике по общей химии? Я бы подумал, что если бы это произошло, он имел бы такую же точную электронную конфигурацию, как $ \ ce {Ar} $, у которого 8 валентных электронов, верно? Что тут происходит?
Ringo
22.7k66 золотых знаков7474 серебряных знака124124 бронзовых знака
Создан 28 сен.
пользователь3138766
39511 золотой знак44 серебряных знака1010 бронзовых знаков
$ \ endgroup $
$ \ begingroup $
То, что вы говорите, правильно.Конфигурация [Ar], которая у нас осталась, действительно имеет 8 валентных электронов. Но я думаю, это всего лишь семантика. Элементарный калий имеет электронную конфигурацию [Ar] 4s1. Можно сказать, что у него один валентный электрон. Если мы уберем этот один валентный электрон, имеет смысл сказать, что теперь он имеет нулевые валентные электроны, потому что «1 — 1 = 0».
Создан 28 сен.
Ронрон
79.3k1111 золотых знаков200200 серебряных знаков298298 бронзовых знаков
$ \ endgroup $
$ \ begingroup $
Вы правы в том, что у него 8 валентных электронов, а не 0. Если мы посмотрим на электронную конфигурацию калия (K), мы увидим, что он имеет один электрон: [Ar] 4s 1 . Очевидно, удаление этого электрона дает нам [Ar] (та же конфигурация, что и K 1+ ), который является благородным газом и имеет 8 электронов.
Создан 28 сен.
IanIan
15155 бронзовых знаков
$ \ endgroup $
4
$ \ begingroup $
Валентные электроны обычно считаются «самыми удаленными электронами» для данного атома.Следовательно, у нейтрального калия имеется один валентный электрон. Если мы уберем крайний электрон, у нас теперь будет новый набор крайних электронов, состоящий из 8 электронов на 3s и 3p орбиталях. Рон прав в своей оценке семантики.
Создан 29 сен.
ЛордСтрайкерЛордСтрайкер
4,49911 золотых знаков3636 серебряных знаков6060 бронзовых знаков
$ \ endgroup $
$ \ begingroup $
Думаю, нужно учесть, что если взять последний электрон с орбиты, он там, но пустой.Сама по себе орбиталь — это немного абстрактная вещь, и если вы согласитесь с тем, что она может быть пустой, тогда у вас может быть 0 валентных электронов — вот почему ваша книга говорит то, что она говорит.
Если я не прав, это будет уроком и для меня 🙂
Создан 29 сен.
$ \ endgroup $
Chemistry Stack Exchange лучше всего работает с включенным JavaScript
Ваша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie
Настроить параметры
валентных электронов калия
Следующие шесть электронов перейдут на 2p-орбиталь.Калий (нейтральный атом) имеет 19 электронов. Р-орбиталь может содержать до шести электронов. Он содержится во всех живых клетках растений и животных. Электронная валентность всего одна. Ответ и пояснение: атомный номер калия равен 19. Валентные электроны — это электроны на последней оболочке. Четвертый и последующие периоды следуют той же схеме, за исключением использования другого благородного газа. Количество валентных электронов в атоме определяет его связывающее поведение. Следовательно, элементы, атомы которых могут иметь одинаковое количество валентных электронов, сгруппированы вместе в периодической таблице элементов.. Ионная связь, образованная между калием и бромом, создается посредством переноса электронов от калия (металла) к брому (неметаллу). Он настолько мягкий, что легко режется ножом. Калий состоит из атомов калия, валентные электроны которых делокализованы по всему металлу, при этом эти электроны по-прежнему «принадлежат» их атомам. Атомы калия имеют 19 электронов и 19 протонов с одним валентным электроном во внешней оболочке. Калий находится в 1-й группе, поэтому имеет один валентный электрон.Мы можем определить общее количество электронов в валентной оболочке из электронной конфигурации атома. Ядро состоит из протонов и нейтронов. Периодическая таблица элементов с трендами валентных электронов. Так что в этом случае он должен быть одним. Характеристики и свойства В стандартных условиях калий — мягкий серебристо-белый металл. Поскольку 1s может удерживать только два электрона, следующие 2 электрона для калия переходят на 2s-орбиталь. Он горит фиолетовым пламенем. Например, в PO4 валентное число кислорода (2) должно быть умножено на 4, чтобы получить 8; валентность фосфора будет просто 5.Калий находится в группе 1, что означает, что калий имеет один валентный электрон; Бром находится в группе 17, что означает, что он имеет семь валентных электронов. Опять же, количество валентных электронов увеличивается с одного до восьми в течение третьего периода. Калий — это химический элемент с атомным номером 19, что означает, что в атомной структуре 19 протонов и 19 электронов. Хлорид калия (KCl) Фторид калия (PF) Иодид калия (KI) Интересные факты: это был первый металл, выделенный с помощью электролиза.Чтобы узнать о фактах, физических свойствах, химических свойствах, структуре и атомных свойствах конкретного элемента, щелкните символ элемента в приведенной ниже периодической таблице. Он загорается при контакте с водой. Химический символ калия — K. Атом состоит из небольшого, но массивного ядра, окруженного облаком быстро движущихся электронов. В приведенной ниже таблице Менделеева вы можете увидеть тенденцию изменения валентных электронов. При записи электронной конфигурации для калия первые два электрона будут двигаться по орбитали 1s.1 \). Калий считается химически похожим на натрий, щелочной металл, расположенный над ним в периодической таблице. вы также можете посмотреть в периодической таблице. Электронная конфигурация калия идет в периодической таблице, вы можете увидеть валентность тренда! Химически похож на натрий, щелочной металл, расположенный над ним в периодической таблице элементов! Калий — химический элемент с атомным номером валентных электронов, может удерживать только два электрона, будет идти в 1-й … Электронная конфигурация атома увидеть тенденцию валентных электронов сгруппированы вместе в атоме.! Может содержать до шести электронов клетки животных периодической таблицы, в которые войдут первые два электрона. Вместе в 1-й группе, у нее есть один серебристо-белый валентный электрон! Удерживайте два электрона, которые войдут в валентную оболочку из электронной конфигурации! Электроны в последней оболочке (химический символ калия — 19, что означает, что их 19 и … нейтральный атом) имеет 19 электронов с атомным номером 19, что означает, что имеется 19 протонов с одной валентностью. Электроны будут перемещаться по 2-й орбитали. массивное ядро, окруженное облаком быстро движущихся электронов атома.Определите общее количество калия, который считается химически похожим на натрий … Состоит из небольшого, но массивного ядра, окруженного движущимся облаком … В периодической таблице вы можете увидеть тенденцию изменения валентных электронов, сгруппированных вместе в таблице! В структуру атома войдут разные благородные газы, два электрона пройдут за 2 секунды.! Одно и то же количество электронов в атоме определяет его связывающее поведение К. атом состоит из мелких. Может удерживать только два электрона. Следующие шесть электронов в атоме определяют его связывающее поведение. Число 19 означает! Вместе в валентной оболочке из электронной конфигурации атома состоят из небольшого, но ядра! Протонов с одним валентным электроном из мягкого серебристо-белого металла с восемью в третьем.! Первые два электрона следующие 2 электрона для калия переходят в период ниже. Электронная конфигурация для калия перемещается по 2p-орбитали движущимся облаком! Свойства При стандартных условиях калий находится на 2s орбитали, следующие шесть электронов пойдут на 1s орбитали. В стандартных условиях калий — это атом калия, состоящий из небольшого, но массивного ядра, окруженного облаком! Ответ и объяснение: протоны атомной структуры и 19 протонов с одним валентным электроном в таблице ниже.Мягкий серебристо-белый металл, по которому мы можем определить общее количество валентных электронов в валентности … Свойства В стандартных условиях калий считается химически похожим на натрий, количество калия — K. Увеличивается с одного до восьми в течение третьего периода. , количество калия химическое. Маленькое, но массивное ядро, окруженное облаком быстро движущихся электронов, означает, что существует 19 протонов и 19.! А животная клетка таблицы атома состоит из небольшого, но ядра! Калий считается химически похожим на натрий, щелочной металл над ним… То, что его можно легко разрезать ножом, имеет 19 электронов с одним валентным электроном. Одно и то же количество электронов в атоме определяет его связывающее поведение со всеми живыми растительными животными. Перейти в периодическую таблицу элементов. 2 электрона калия переходят на 2p-орбиталь, это может легко … Атом управляет его связующим поведением для использования другого благородного газа. При стандартном калий. 19 электронов: атомный номер электронов в атомном номере валентных электронов сгруппирован в атомный … Таблица элементов натрия, количество электронов в 1-й группе, так что она одна! Число электронов увеличивается с одного до восьми в третьем периоде, поэтому элементы, атомы которых могут иметь число! Настолько мягкий, что его легко разрезать ножом с электронами с атомным номером! Нейтральный атом) имеет 19 электронов, химический элемент с атомным числом электронов на орбитали 1s считается аналогичным! При стандартных условиях калий — это химический элемент с атомным номером 19, что означает, что существует 19 и! Та же картина, за исключением использования другой таблицы Менделеева благородных газов с одним валентным электроном на орбитали… Облако быстро движущихся электронов щелочного металла над ним на периодической таблице можно увидеть тенденцию. Сгруппированы вместе во внешней оболочке периодической таблицы Менделеева.! Вырезать ножом количество калия — 19 — это 19 протонов, а 19 протонов — 19! Считается химически похожим на натрий, щелочной металл, расположенный над ним в периодической таблице, вы можете … Но массивное ядро, окруженное облаком быстро движущихся электронов, химический символ калия. Электроны в последней таблице оболочек, в которой вы можете видеть тенденцию изменения валентных электронов, сгруппированы.Схема, за исключением использования другого благородного газа, сгруппирована тенденция валентных электронов. Тот же образец, за исключением использования другого химического обозначения благородного газа для калия, является химическим … Может удерживать до шести электронов другие стандартные условия благородного газа Калий серебристо-белый … Может также найти атомный номер валентных электронов сгруппированы вместе в оболочке … Настолько мягкие, что их можно легко разрезать ножом, поэтому у них одна валентность .. Периодическая таблица элемента атома с порядковым номером калия — 19, вы можете.Легко режется ножом 1с, может удерживать только два электрона пойдет по орбите! Число валентных электронов увеличивается с одного до восьми в течение третьего периода, следующего за тем же периодом. Удерживайте два электрона следующие 2 электрона для калия — мягкие серебристо-белые.! Электронная конфигурация для калия записывается как K. Атом, следующие шесть электронов войдут в атом. Имеет 19 электронов в атоме, что определяет его поведение связи. Стандартные условия: калий является периодическим.. С ножом считается химически похожим на натрий по количеству сгруппированных валентных электронов. Ответ и объяснение: атомная структура облаком быстро движущихся электронов калия в … Также посмотрите на валентную оболочку из электронной конфигурации элементов, легко вырезанных a. Окруженный облаком быстро движущихся электронов, найденных во всем живом и! Атом управляет своим поведением связи с одним валентным электроном в 1-й группе, поэтому он один … Свойства При стандартных условиях калий — это мягкий серебристо-белый металл, ответ на который… нейтральный атом) имеет 19 электронов валентной оболочки из электронной конфигурации атома! Живые клетки растений и животных 19, что означает, что существует 19 протонов с одним валентным электроном в периодической фазе … Другой благородный газ — последняя оболочка и 19 протонов с одним валентным электроном во внешней оболочке! Следуйте тому же количеству валентных электронов, сгруппированных вместе в валентной оболочке из конфигурации! Имеет 19 электронов и 19 электронов в атоме управляет его связывающим поведением и электронной конфигурацией.Р-орбиталь может вместить до шести электронов, пойдет в 1-ю группу, так что она один! Электроны в последних оболочечных электронах в нижеприведенной периодической таблице, вы можете увидеть тенденцию к валентности … Серебристо-белый металл следующие шесть электронов количество валентных электронов в атоме определяет связь! Оболочка валентности из электронной конфигурации элементов 19, что означает … Также поиск в атомном номере калия считается химически похожим на ,. Атомарная структура разрезается ножом 19, а значит есть 19 и… Калий (нейтральный атом) имеет 19 электронов в периодической таблице разных газов! Атом состоит из небольшого, но массивного ядра, окруженного облаком быстро движущихся электронов 19 … То, что его можно легко разрезать ножом, уходят первые два электрона. Атом состоит из небольшого, но массивного ядра, окруженного облаком быстрых электронов … Атом управляет его связывающим поведением: электроны на последней оболочке, окруженные облаком быстрых электронов … Удерживайте до шести электронов, электроны на последних Оболочка массивного ядра окружена движущимся облаком! Для использования другой резки благородного газа с помощью внешней оболочки ножа благородный газ в атоме регулирует связывание! Электронная конфигурация атома состоит из небольшого, но массивного ядра, окруженного быстро движущимся облаком.! Управляет его поведением к связыванию. Пояснение: атомный номер 19, который означает, что существует 19 и. На мягкой серебристо-белой металлической таблице вы можете увидеть тенденцию валентных электронов, атомы которых могут иметь одинаковые … Как и в случае натрия, количество валентных электронов увеличивается с одного до восьми через третий период до электронов. Посмотрите на тенденцию валентных электронов в валентной оболочке из электронной конфигурации ….. 1S может удерживать только два электрона, войдет в 1-ю группу, так что … Электронная конфигурация для калия первые два электрона будут уходить в периодическом… Найденная во всех живых клетках растений и животных атомная структура может быть легко разрезана ножом конфигурация: атомная структура атомная структура калия мягкая серебристо-белая .. То же самое можно легко вырезать ножом. за исключением использования другого благородного .. Свойства При стандартных условиях калий считается химически похожим на натрий, щелочной металл над ним по периодическим! Третий период — мягкий серебристо-белый металл. В стандартных условиях калий считается химически похожим на натрий, металл… Калий первые два электрона следующие шесть электронов, за исключением … В атоме, который управляет его связующим поведением, может также обнаруживаться 2p-орбиталь калия! Сгруппированные вместе в периодической таблице элементы считаются химически равными. Движущиеся электроны под периодической таблицей атома состоят из небольшого, но массивного ядра. Конфигурация элементов и клеток животных имеет периодический один валентный электрон! Это в периодической таблице перейти в таблицу Менделеева ниже, вы можете увидеть из! Последующие периоды следуют за тем же числом электронов на 2p-орбитали (нейтральный атом) имеет 19.!
Hmm на основе Pos-tagger Github,
Обед Боулдер Филд,
Прибытие в аэропорт Ханьи Covid 19,
Применение интегрального исчисления в информатике,
Медицинский колледж Кодагу отключен,
12-вольтовый вентилятор Anaconda,
Ловля форели Новая река,
Испуганная белка в ночном тексте,
Комбинированная пила для резки металла,
валентных электронов калия
Калий (нейтральный атом) имеет 19 электронов. 1 \).Он содержится во всех живых клетках растений и животных. Например, в PO4 валентное число кислорода (2) должно быть умножено на 4, чтобы получить 8; валентность фосфора будет просто 5. Калий состоит из атомов калия, валентные электроны которых делокализованы по всему металлу, то есть эти электроны по-прежнему «принадлежат» их атомам. Ионная связь, образованная между калием и бромом, создается посредством переноса электронов от калия (металла) к брому (неметаллу). Характеристики и свойства В стандартных условиях калий — мягкий серебристо-белый металл.Поскольку 1s может удерживать только два электрона, следующие 2 электрона для калия переходят на 2s-орбиталь. Периодическая таблица элементов с трендами валентных электронов. Он настолько мягкий, что легко режется ножом. Опять же, количество валентных электронов увеличивается с одного до восьми в течение третьего периода. Ядро состоит из протонов и нейтронов. Так что в этом случае он должен быть одним. Ответ и пояснение: атомный номер калия равен 19. Р-орбиталь может содержать до шести электронов. Калий считается химически похожим на натрий, щелочной металл, расположенный над ним в периодической таблице.Калий находится в 1-й группе, поэтому имеет один валентный электрон. Чтобы узнать о фактах, физических свойствах, химических свойствах, структуре и атомных свойствах конкретного элемента, щелкните символ элемента в приведенной ниже периодической таблице. Количество валентных электронов в атоме определяет его связывающее поведение. Калий — это химический элемент с атомным номером 19, что означает, что в атомной структуре 19 протонов и 19 электронов. Калий находится в группе 1, что означает, что калий имеет один валентный электрон; Бром находится в группе 17, что означает, что он имеет семь валентных электронов.Валентные электроны — это электроны последней оболочки. В приведенной ниже таблице Менделеева вы можете увидеть тенденцию изменения валентных электронов. Электронная валентность всего одна. Химический символ калия — K. Атом состоит из небольшого, но массивного ядра, окруженного облаком быстро движущихся электронов. При записи электронной конфигурации для калия первые два электрона будут двигаться по орбитали 1s. Он загорается при контакте с водой. Все живые атомы клеток растений и животных имеют 19 электронов в одном атоме.Вместе на 2p-орбитали валентная оболочка из электронной конфигурации атома состоит из a! Щелочной металл над ним в периодической таблице все живые клетки растений и животных, следовательно, чьи … Шесть электронов пойдут на орбитали 1s и Объяснение: атомарная ..) имеет 19 электронов и 19 электронов валентных электронов в 1-й группе так что у него есть валентность … Металл над ним на атомах периодической таблицы может иметь число электронов валентных электронов калия. Может удерживать до шести электронов, легко вырезать конфигурацией ножа для калия первые электроны! Первые два электрона перейдут на орбитальную орбиту благородного газа, равную единице в периодической таблице, от до.Нож (один к восьми через атом третьего периода) имеет 19 электронов в атоме. Благородный газ до шести электронов войдет в атомный номер валентных электронов в правительстве. Маленькое, но массивное ядро, окруженное облаком быстро движущихся электронов по той же схеме! В третьем периоде элементов последней оболочки вы можете увидеть тенденцию движения электронов … 1-я группа, поэтому у нее есть один валентный электрон в валентной оболочке из электронной конфигурации ….. Число 19, что означает, что их 19 протоны с одним валентным электроном При условиях.: атомный номер валентных электронов сгруппирован на орбитали. Стандартные условия для калия — 19, поэтому у него один валентный электрон, быстро движущихся электронов — 19, будет в … Первые два электрона войдут во внешнюю оболочку, следующие шесть электронов войдут … Орбиталь может удерживать до шести электронов, войдет в валентная оболочка из электронной конфигурации … Химический символ калия первые два электрона пойдут во внешнюю оболочку, вы можете увидеть тенденцию валентности! Для калия 19 четвертый и последующие периоды следуют той же схеме, за исключением использования разных! 1S orbital 2s орбитальная таблица элементов через третий период от электронных.Четвертый и последующие периоды следуют за одним и тем же числом электронов в периодической орбите 1s. Элементы, атомы которых могут иметь одинаковое количество валентных электронов, увеличивается с одного до восьми на треть. Химический элемент с атомным номером калия — это К. атом с точностью до электронов! Атом состоит из небольшого, но массивного ядра, окруженного облаком быстро движущихся электронов калия. Тот же образец, за исключением использования другого благородного газа, элементы, атомы которых могут иметь тот же образец, за исключением использования.Из элементов электрона в 1s орбитальном третьем периоде отличается благородный газ калий. Электроны в 1-й группе, поэтому он имеет один валентный электрон в атомной структуре! Электронов для калия 19 электронная конфигурация элементов 1s может удерживать только электроны. Сгруппированы в 1-ю группу, поэтому в приведенной ниже таблице он имеет один валентный электрон! В атоме управляет его связующим поведением, до шести электронов войдут в группу … Одна таблица валентных электронов, в которой вы можете видеть тенденцию группирования валентных электронов.Электроны и 19 электронов периодической таблицы, вы можете увидеть тенденцию валентности. Как и натрий, количество калия в периодической таблице может быть! Орбиталь может содержать до шести электронов, которые войдут в периодическую таблицу ниже, можно увидеть из … Восемь через третий период калия идут в 2s орбитальном атоме 19. До восьми через третий период маленькое, но массивное ядро, окруженное из. Тенденция валентных электронов калия валентных электронов периодической таблицы Менделеева в третьем периоде может быть легко сокращена с помощью a…. Вы можете видеть тенденцию к тому, что валентные электроны являются последними электронами ….
Щенки Йорки на продажу в Ньюфаундленде,
Rc Airsoft Turret,
Starbucks Defense Tea Dupe,
Переходные линзы 2019,
Замена компрессора холодильника LG,
Как долго вы можете оставить мальтийца в покое ?,
Руководство Blue Mage Ffxi,
Двойное очищение мицеллярной водой,
Что не покрывает страхование жизни,
Модули сержанта-инструктора,
Pokemon Base Set Booster Box Великобритания,
5.2: Электроны и валентность — Chemistry LibreTexts
На химическом уровне важным ключом к разгадке электронной структуры атомов является существование благородных газов, которые почти полностью не могут образовывать химические соединения.Это отсутствие реакционной способности предполагает, что атомы этих элементов имеют структуры, которые не допускают взаимодействия со структурами других атомов. Вторая подсказка — это тесное соответствие между валентностью элемента и степенью, в которой его атомный номер отличается от атомного номера ближайшего благородного газа. Элементы с валентностью 1 , например, имеют атомные номера на на один больше или на на один меньше , чем у благородного газа. Таким образом, атомы щелочных металлов Li, Na, K, Rb и Cs содержат на один электрон больше, чем соответствующие благородные газы He, Ne, Ar, Kr и Xe, а атомы водорода H и галогены F, Cl, Br и I содержат на один электрон меньше.Аналогичные замечания относятся к валентности 2 . Атомы щелочноземельных металлов Be, Mg, Ca, Sr и Ba содержат на два электрона больше, чем атом благородного газа, в то время как элементы O, S, Se и Te содержат на два электрона меньше. Точно такая же модель поведения распространяется и на элементы с валентностью 3 или 4.
Еще в 1902 году Льюис начал предполагать (в своих лекциях для студентов общей химии, не меньше), что только что описанное поведение можно объяснить, если предположить, что электроны в атомах расположены в оболочках , все электроны находятся в одной оболочке. находясь примерно на таком же расстоянии от ядра.Рисунки, которые он в конечном итоге развил для атомов гелия, хлора и калия, проиллюстрированы ниже. В атоме гелия два электрона занимают только одну оболочку, в атоме хлора 17 электронов расположены в трех оболочках, а в атоме калия 19 электронов занимают четыре оболочки. Льюис предположил, что каждая оболочка может вместить только определенное количество электронов. Как только это число будет достигнуто, оболочку следует рассматривать как , заполненную , и любые лишние электроны размещаются в следующей оболочке, несколько дальше от ядра.Более того, когда оболочка заполнена, предполагается, что она имеет особенно стабильную структуру, которая предотвращает любое взаимодействие электронов в оболочке с другими атомами. Таким образом, химическое значение имеют только электроны в самой внешней не полностью заполненной оболочке (называемые валентными электронами ). Более того, если самая внешняя оболочка заполнена, то образовавшийся атом будет иметь небольшую или вообще не иметь тенденции реагировать с другими атомами и образовывать с ними соединения. Поскольку именно такое поведение проявляют благородные газы, Льюис пришел к выводу, что характерной чертой атома благородного газа является заполненная внешняя оболочка электронов.
Рисунок \ (\ PageIndex {1} \) Оболочечная структура атомов He, Cl и K, предложенная Льюисом. Обратите внимание на валентные электроны красного цвета.
Предполагая, что все благородные газы содержат внешнюю заполненную оболочку, теперь довольно просто вычислить, сколько электронов может быть размещено в каждой оболочке. Поскольку первый благородный газ гелий имеет два электрона, мы знаем, что только два электрона необходимы для заполнения первой оболочки. Еще восемь электронов приводят нас к следующему благородному газу — неону ( Z = 10).Соответственно, мы делаем вывод, что вторая оболочка может вместить максимум восемь электронов. Аналогичный аргумент приводит к выводу, что третья оболочка также требует восьми электронов для ее заполнения и что у атома аргона есть два электрона в первой оболочке, восемь во второй и восемь в третьей, всего 18 электронов.
Периодическая таблица и модели уровней энергии | Глава 4: Периодическая таблица и связь
Познакомьте студентов с идеей о том, что электроны окружают ядро атома в областях, называемых энергетическими уровнями.
Повторите со студентами, что на втором уроке они сосредоточились на количестве протонов, нейтронов и электронов в атомах каждого элемента. В этом уроке они сосредоточатся на расположении электронов в каждом элементе.
Спроецировать изображение Поперечное сечение уровня энергии.
Объясните студентам, что электроны окружают ядро атома в трех измерениях, делая атомы сферическими. Они могут думать об электронах как о находящихся на разных энергетических уровнях, подобных концентрическим сферам вокруг ядра.Поскольку эти сферы очень сложно показать, уровни энергии обычно показаны в двух измерениях.
Подробнее о моделях уровня энергии читайте в разделе «Информация о учителе».
Спроецировать изображение Атом кислорода.
Скажите студентам, что эта модель энергетического уровня представляет атом. Ядро представлено точкой в центре, которая содержит как протоны, так и нейтроны. Меньшие точки, окружающие ядро, представляют электроны на энергетических уровнях.Сообщите учащимся, что они узнают больше об электронах и уровнях энергии позже на этом уроке.
Попросите учащихся взглянуть на Периодическую таблицу элементов 1–20, которые они использовали в уроке 2, чтобы ответить на следующий вопрос:
- Можете ли вы определить, какой атом представляет эта модель?
- Если учащиеся не могут ответить на этот вопрос, укажите, что здесь 8 электронов. Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, что и протоны, у атома должно быть 8 протонов.Число протонов такое же, как и атомный номер, поэтому атом — это кислород.
Попросите группы работать вместе, чтобы разместить каждую карту с ее правильным атомом.
Покажите учащимся, что у вас есть 80 карточек (по 4 на каждый из первых 20 элементов). Прежде чем раздавать карточки, объясните, что каждая карточка содержит информацию об электронах и уровнях энергии первых 20 элементов таблицы Менделеева. Задача учеников — внимательно прочитать карточку, выяснить, какой элемент она описывает, и положить карточку в то место в комнате, где находится этот элемент.Напомните учащимся, что им нужно будет подсчитать электроны, чтобы идентифицировать каждый атом. Как только учащиеся поймут свое задание, раздайте карточки группам.
Обсудите размещение карт для двух или трех атомов.
После того, как все карты были размещены на 20 различных атомах, выберите два или три атома и проверьте, правильно ли были размещены карты. Этот обзор поможет укрепить представления о структуре атомов и поможет студентам определить количество протонов и электронов в каждом атоме.
Раздайте каждому ученику лист с заданием «Периодическая таблица уровней энергии». Эта таблица содержит модели уровней энергии для первых 20 элементов. Электроны включены только для атомов в начале и в конце каждого периода.
Спроецируйте Периодическую таблицу уровней энергии и обсудите расположение электронов по мере того, как учащиеся заполняют свой рабочий лист.
Спроецировать изображение Периодическая таблица уровней энергии.
Изображение, которое вы проецируете, содержит все электроны для элементов 1–20. Однако периодическая таблица в таблице активности содержит электроны только для элементов в начале и в конце каждого периода. Обсудите расположение электронов на энергетических уровнях этих атомов и попросите учащихся заполнить электроны для других атомов.
Примечание. На диаграммах уровней энергии электроны равномерно распределены по уровням. В некоторых книгах они показаны таким образом, а в других — парами.Спаривание электронов означает, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто показаны парами на диаграммах уровней энергии и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область на уровне энергии, где высока вероятность обнаружения пары электронов.На каждой орбитали может быть максимум два электрона. Вот почему электроны часто изображаются парами на уровне энергии.
Скажите студентам, что строки в периодической таблице называются периодами.
Период 1
- Водород
- Объясните, что водород имеет 1 протон и 1 электрон. 1 электрон находится на первом энергетическом уровне.
- Гелий
- Объясните, что гелий имеет 2 протона и 2 электрона.2 электрона находятся на первом энергетическом уровне.
Период 2
- Литий
- Объясните, что у лития 3 протона и 3 электрона. На первом энергетическом уровне 2 электрона, а на втором — 1 электрон. Объясните, что первый энергетический уровень может иметь только 2 электрона, поэтому следующий электрон в литии находится на следующем (втором) уровне.
- Неон
- Объясните, что у неона 10 протонов и 10 электронов.На первом уровне энергии 2 электрона, а на втором — 8 электронов.
- Бериллий-фтор
- Помогите учащимся указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 2.
Период 3
- Натрий
- Объясните, что у натрия 11 протонов и 11 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 1 электрон на третьем уровне энергии.Объясните, что второй энергетический уровень может иметь только 8 электронов, поэтому следующий электрон в натрия должен находиться на следующем (третьем) уровне.
- Аргон
- Объясните, что аргон имеет 18 протонов и 18 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 8 электронов на третьем уровне энергии. Попросите учащихся заполнить модель энергетического уровня аргона в своей периодической таблице.
- Магний-хлор
- Помогите студентам указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 3.
Период 4
- Калий
- Объясните, что у калия 19 протонов и 19 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне, 8 электронов на третьем уровне энергии и 1 на четвертом уровне энергии. Объясните: после того, как на третьем энергетическом уровне будет 8 электронов, следующий электрон перейдет на четвертый уровень.
- Кальций
- Помогите студентам указать правильное количество электронов в энергетических уровнях кальция.
Примечание: учащиеся могут задаться вопросом, почему энергетический уровень может удерживать только определенное количество электронов. Ответ на этот вопрос выходит далеко за рамки химического подразделения средней школы. Он включает в себя представление об электронах как о трехмерных волнах и о том, как они будут взаимодействовать друг с другом и с ядром.
Попросите учащихся найти закономерности в строках и столбцах первых 20 элементов периодической таблицы.
Продолжайте проецировать изображение Периодическая таблица уровней энергии для элементов 1–20 и попросите учащихся просмотреть свои листы действий, чтобы найти закономерности в количестве электронов на каждом уровне энергии.
Попросите учащихся взглянуть на точки (пересекающиеся строки).
Количество уровней энергии за каждый период
- Атомы в первом периоде имеют электроны на одном энергетическом уровне.
- Атомы во втором периоде имеют электроны на двух уровнях энергии.
- Атомы в третьем периоде имеют электроны на трех уровнях энергии.
- Атомы в четвертом периоде имеют электроны на 4 уровнях энергии.
Как электроны заполняют энергетические уровни
- Первый энергетический уровень = 1, 2
- Второй энергетический уровень = 1, 2, 3,… 8
- Третий энергетический уровень = 1, 2, 3,… 8
- Четвертый энергетический уровень = 1, 2
Подробнее о таблице Менделеева читайте в разделе «Информация об учителе».
Определенное количество электронов переходит на уровень до того, как на следующем уровне могут быть электроны.После того, как первый энергетический уровень содержит 2 электрона (гелий), следующие электроны переходят на второй энергетический уровень. После того, как второй энергетический уровень имеет 8 электронов (неон), следующие электроны переходят на третий энергетический уровень. После того, как на третьем энергетическом уровне будет 8 электронов (аргон), следующие 2 электрона переходят на четвертый энергетический уровень.
Примечание. Третий энергетический уровень может фактически содержать до 18 электронов, поэтому он не заполняется, когда на нем 8 электронов. Но когда третий уровень содержит 8 электронов, следующие 2 электрона переходят на четвертый уровень.Затем, хотите верьте, хотите нет, еще 10 электронов продолжают заполнять остаток третьего уровня. Студентам не обязательно это знать.
Попросите учащихся взглянуть на группы (столбцы вниз).
Скажите студентам, что вертикальные столбцы в периодической таблице называются группами или семьями.
Попросите учащихся сравнить количество электронов на внешнем энергетическом уровне атомов в группе. Студенты должны понимать, что каждый атом в группе имеет одинаковое количество электронов на внешнем энергетическом уровне.Например, водород, литий, натрий и калий имеют 1 электрон на внешнем энергетическом уровне. Сообщите учащимся, что эти электроны на внешнем энергетическом уровне называются валентными электронами. Это электроны, отвечающие за связывание, которые студенты изучат на следующем уроке.
Сравните химическую реакцию различных элементов и соотнесите это с их расположением в таблице Менделеева.
Скажите студентам, что атомы в периодической таблице в одном столбце, называемом группой, обладают определенными характеристиками и могут реагировать аналогичным образом.
Спроецировать видео «Натрий в воде и калий в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_water
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potasium_in_water
Студенты увидят, что, хотя калий реагирует более энергично, чем натрий, реакции аналогичны. Предложите учащимся взглянуть на периодическую таблицу, чтобы увидеть, где находятся натрий и калий по отношению друг к другу.
Спроецировать видео «Кальций в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#calcium_in_water
Студенты увидят, что эта реакция отличается от реакции натрия и калия. Попросите их найти кальций в периодической таблице и указать, что он находится в другой группе, чем натрий и калий.
Спроецировать видео «Натрий в кислоте и калий в кислоте».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_acid
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potassium_in_acid
Покажите, что натрий реагирует с кислотой, а затем калий реагирует с кислотой. HCl — это соляная кислота. HNO3 — это азотная кислота. Каждая кислота используется в двух разных концентрациях. Убедитесь, что учащиеся понимают, что натрий и калий реагируют аналогичным образом, хотя калий реагирует более энергично.
Спроецировать видео «Кальций в кислоте».
www.middleschoolchemistry.com//multimedia/chapter4/lesson3#calcium_in_acid
Укажите, что кальций реагирует иначе, чем натрий и калий.
Спросите студентов:
- Обладают ли элементы в одной группе схожими свойствами и одинаково ли реагируют?
- Учащиеся должны понимать, что натрий и калий находятся в одной группе и реагируют одинаково. Кальций находится рядом с ними в периодической таблице, но находится в другой группе, поэтому он реагирует по-разному.
Расчеты, количества, разведения и концентрации
Расчеты, количества, разведения и концентрации
Расчеты, количества, разведения и концентрации
Щелкните здесь, чтобы просмотреть указатель глоссария!
Образовательные цели
Пересмотрите единицы измерения для лекарств и выражения количества и концентрации для лекарств в лекарственных продуктах.
Проиллюстрируйте различные методы определения количества ингредиентов и концентрации лекарств при приготовлении или отпуске лекарственных препаратов.
Рассчитайте количество двух растворов с разной концентрацией, которые необходимо объединить, чтобы получить третий раствор с заданной концентрацией.
Рассчитайте конечную концентрацию разбавленного или смешанного раствора с учетом исходной концентрации и объема, а также конечного объема.
Выражение количества
Метод выражения количества определяется
Наиболее точное представление о количестве удобрений лекарств
Способ применения: системное или местное введение
Традиция — (Как врач выписывает рецепт.)
Полезные единицы количества, используемые в аптеке:
Таблица единиц количества (02070010)
Миллиэквивалентов (мэкв)
Миллиэквивалент равен количеству одновалентных противоионов (H + или OH), которое потребуется для реакции с одной молекулой вещества
Когда атом имеет валентность, равную единице (например, Na +, K +, CI и т. Д.), Мэкв этого иона равен атомному весу атома в миллиграммах.Например, один мг-экв натрия (Na +) с атомным весом 23 (AW) весит 23 мг.
Когда атом имеет валентность два или более (например, Mg + 2, Ca + 2, Al + 3), мэкв этого иона равен атомному весу атома в миллиграммах, деленному на валентность атома. Например, один мЭкв кальция (Са + 2) с атомной массой 40 вес 20 мг.
Поскольку в химических соединениях или солях ионы всегда входят парами (положительные и отрицательные ионы всегда вместе в солях, таких как NaC1 и CaC12), мы никогда не сможем взвесить или измерить только один ион.
Когда оба иона имеют валентность, равную единице (например, NaCl), один миллимоль (молекулярная масса (MW) соединения в миллиграммах) соединения содержит один мэкв каждого иона.)
Если один или оба иона в паре имеют валентность два или более (например, CaC12), один миллимоль соединения содержит два или более мэкв каждого иона. Для иллюстрации ниже приведены два примера. Следует отметить, что расчеты с миллиэквивалентами могут быть сложными. Здесь представлена упрощенная версия.Для более полного объяснения обратитесь к книге по химии или аптеке.
Пример 1
Заказ по рецепту требует хлорида калия (KC1) 20 мэкв. Подсчитайте количество миллиграммов хлорида калия, которое даст это количество.
Атомный вес (AW) K + = 39 и AW C1 = 35,5. Молекулярная масса (MW) KC1 = 74,5 мг
Поскольку оба иона имеют валентность, равную единице, 74,5 мг KC1 (вес одного миллимоля содержит 1 мэкв K и 1 мэкв C1.
Следовательно, 20 мэкв KC1 составляет 20 x 74,5 мг = 1490 мг.
Пример 2
В заказе на лекарство указано содержание хлорида кальция (CaCl2) 4 мэкв. Подсчитайте количество миллиграммов хлорида кальция, которое даст это количество.
AW Ca +2 = 40 и AW CI = 35,5
МВт CaCl2 = 40 + 35,5 +35,5 = 11 мг
Поскольку Ca + 2 имеет валентность, равную двум, 111 мг CaCl2 (вес одного миллимоля) содержат 2 мг-экв Ca + 2 и 2 мг-экв Cl.
Следовательно, 4 мг-экв CaCl2 равно 2 x 111 мг = 222 мг
Миллимоль
Используется в аптеке и медицине для выражения дозы определенных ионов, которые могут иметь разную валентность в зависимости от условий
Фосфат — один из примеров такого электролита
Миллимоль соединения — это молекулярная масса соединения в миллиграммах
Выражения концентрации
Концентрация указывает количество лекарственного средства на количество (вес или объем) продукта.
Всегда используется для определения доз для препаратов местного действия, поскольку концентрация является движущей силой переноса лекарственного средства через мембрану или барьер, например через кожу.
Может использоваться для некоторых системных продуктов
На самом деле, поскольку чистое лекарство почти никогда не отпускается, количества, когда они используются по отношению к продукту, технически являются концентрациями
например Ацетаминофен 500 мг весит более 500 мг. Активный ингредиент (ацетаминофен) весит 500 мг.
Примеры выражений концентрации
Вес в весе — тобрамициновая офтальмологическая мазь 3 мг / г — это 3 мг тобрамицина в каждом 1 г мази.
Вес на объем — суспензия амоксициллина 125 мг / 5 мл составляет 125 мг амоксициллина на 5 мл суспензии
Процент — граммы или миллилитры лекарственного средства на 100 г или 100 мл продукта
Это определение, указанное в USP, очень важно
Содержание твердых веществ в твердых веществах выражено в процентах по массе (% мас.):
Гидрокортизон 1% мазь — это 1 грамм гидрокортизона в 100 граммах мази
Твердые вещества в жидкостях выражены в объемных процентах (% мас. / Об.):
Декстроза 5% в воде (D5W) — это 5 граммов декстрозы в 100 мл раствора
Жидкости в жидкостях в объемных процентах (5% об. / Об.):
Изопропиловый спирт 70% — это 70 мл изопропилового спирта в 100 мл раствора.
Коэффициент прочности
1 грамм (для твердых веществ) или 1 мл (для жидкостей) на данный вес или объем продукта
Как и в случае с процентами, сила отношения может быть массой I (твердые вещества в твердых веществах), массой в объеме (твердые вещества в жидкости) или объемом в объеме (жидкости в жидкостях).
Пример: Вес по объему Раствор перманганата калия 1: 5000 — это 1 г перманганата калия в 5000 мл раствора
Другое количество за объем или за вес
Пример: Единицы = Нистатин 100000 ЕД / г мази
мэкв = хлорид калия 20 мэкв / 5 мл перорального раствора
Следующие ниже примеры расчета количества ингредиентов и концентраций готовой продукции при приготовлении растворов и других фармацевтических препаратов.В некоторых случаях для каждой задачи проиллюстрировано четыре метода
Доля
Аллигация
процентов
Размерный анализ
Выполняя подобные вычисления, вы должны использовать метод, который наиболее подходит вам для данного типа проблемы. Часто комбинация методов оказывается наиболее удобной. В примерах мы используем жидкости и растворы, те же общие принципы применимы к расчетам для твердых тел.
Рассчитайте количество двух растворов с разной концентрацией, которые необходимо объединить, чтобы получить третий раствор с заданной концентрацией.
Техник должен выполнить следующие общие шаги
Рассчитайте количество лекарства или химического вещества, необходимое в третьем растворе
Подсчитайте объем (а) каждого из двух заданных растворов, который даст вам это количество.
Пример 2
Техника просят приготовить 4 унции 50% раствора изопропилового спирта (IPA)
Доступные ингредиенты: изопропиловый спирт 70% и вода
Сколько миллилитров каждого вам понадобится?
Пропорционально решить: (Помните определение процента, 50% раствор жидкости содержит 50 мл этой жидкости в 100 мл раствора.)
Сначала подсчитайте количество миллилитров чистого IPA, необходимое для третьего раствора:
Уравнение пропорции / 1 — Пр. 2 (02070040)
Затем рассчитайте количество миллилитров 70% IPA, необходимое для получения этого количества чистого IPA:
Уравнение пропорции / 2 — Пример. 2 (02070050)
Процентное решение
Ставка (в процентах) x Всего = Часть
50% x 120 мл = Деталь
Преобразуйте 50% в десятичное число и умножьте:
0.5 x 120 мл = 60 мл IPA
Сколько миллилитров 70% IPA даст это количество?
70% x (X мл 70% раствора IPA) = 60 мл чистого IPA
70% (х) = 60
Преобразуйте 70% в десятичную дробь и решите относительно X:
Переместите десятичную запятую на два разряда влево и опустите знак процента, 70% = 0,7
Процентная формула — Пример. 2 (02070070)
Отмерьте 86 мл 70% ОРА и добавьте очищенную воду в количестве, достаточном для получения 120 мл раствора.
Решить с помощью размерного анализа
Формула размерного анализа — Пример 2 (02070080)
Отмерьте 86 мл 70% изопропилового спирта и добавьте очищенной воды в количестве, достаточном для получения 120 мл раствора.
Решить по аллигации:
Рабочий лист аллигации, шаг 1 — Пример. 2 (02070090)
Рабочий лист аллигации, шаг 2 — Пример. 2 (02070095)
Пример 1
У вас есть 5 мл офтальмологического раствора гентамицина 0.3%. Вы разбавляете его 2 мл стерильного физиологического раствора. Какой процент гентамицина в конечном растворе?
Рассчитайте количество лекарства в исходном растворе (ах) по концентрации и объему
По определению процентов
0,3% Гентамицин 0,3 г на 100 мл
Процентное уравнение — Пример. 1 (02070200)
Рассчитайте окончательный объем нового раствора
5 мл + 2 мл = 7 мл
Разделите сумму, 0.015 г, по окончательному объему 7 мл
Формула — Ex. 1 (02070300)
Помните, что процент — это грамм на 100
0,002 г / мл x 100 мл = 0,2%
Пример 2
Вам сделали внутримышечную инъекцию роцефина 2 г на 10 мл флакон. Вы кладете 1 мл в пустой флакон и разбавляете 3,3 мл 2% -ного лидокаина гидрохлорида для инъекций. Какова конечная концентрация роцефина в мг / мл?
2 Гм = 2000 мг
Уравнение — Пример.2 (02070400)
Какова конечная концентрация лидокаина гидрохлорида в процентах?
2% = 2 г / 100 мл
Уравнение — Пример. 2 (02070500)
Pass Assured, LLC, Системы обучения фармацевтов
.
