Содержание
Неметаллы: простые вещества — свойства неметаллов, история открытия — химия 9 класс
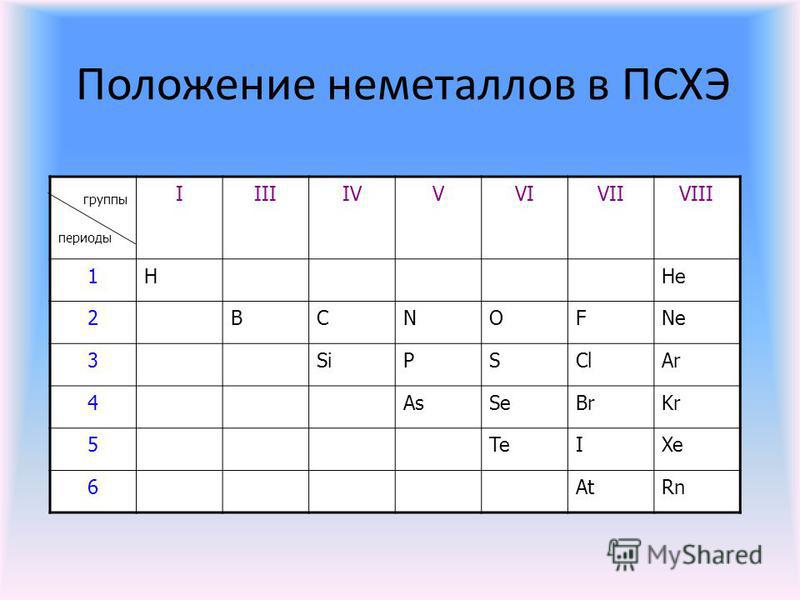
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
Физические свойства неметаллов.
 Аллотропия
Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + Сl2 = СаСl2
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
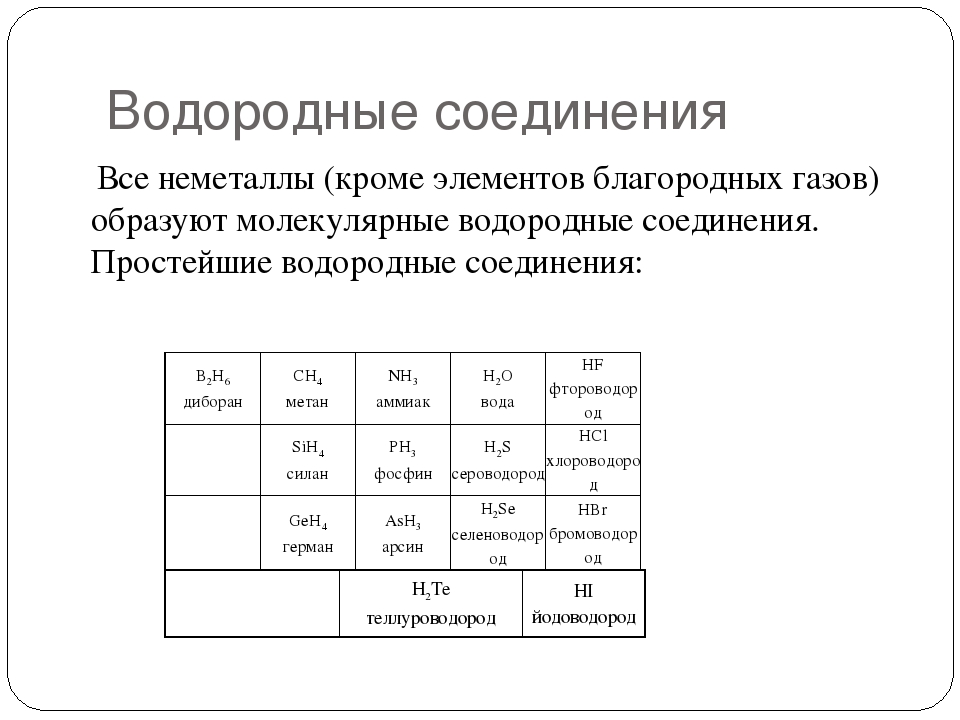
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
Неметаллы образуют кислотные или несолеобразующие оксиды.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева.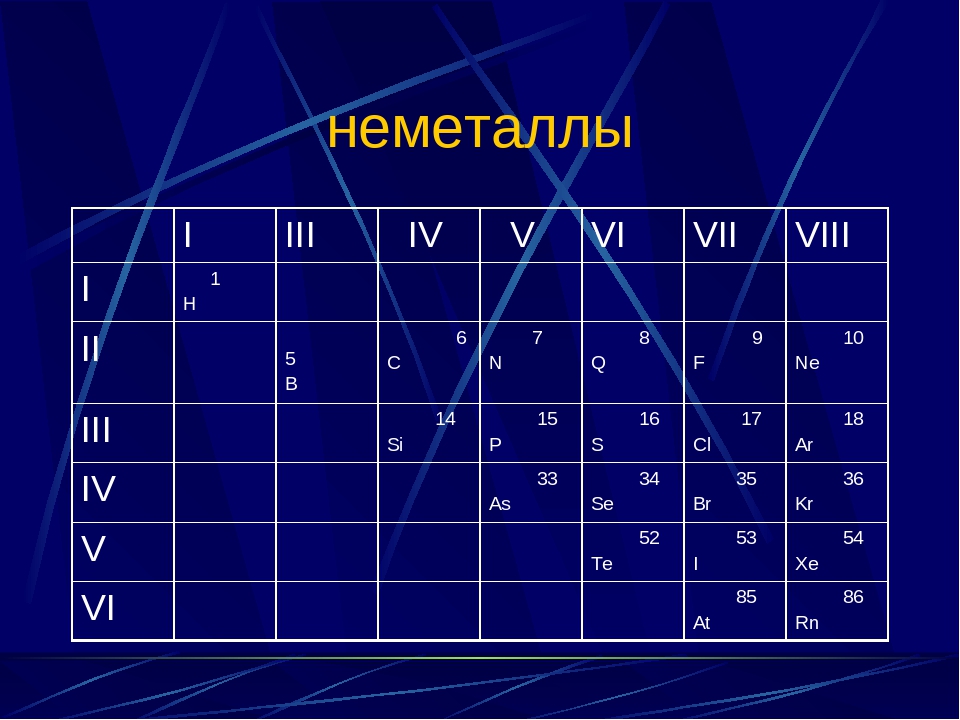 Интересные факты из жизни великого химика
Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
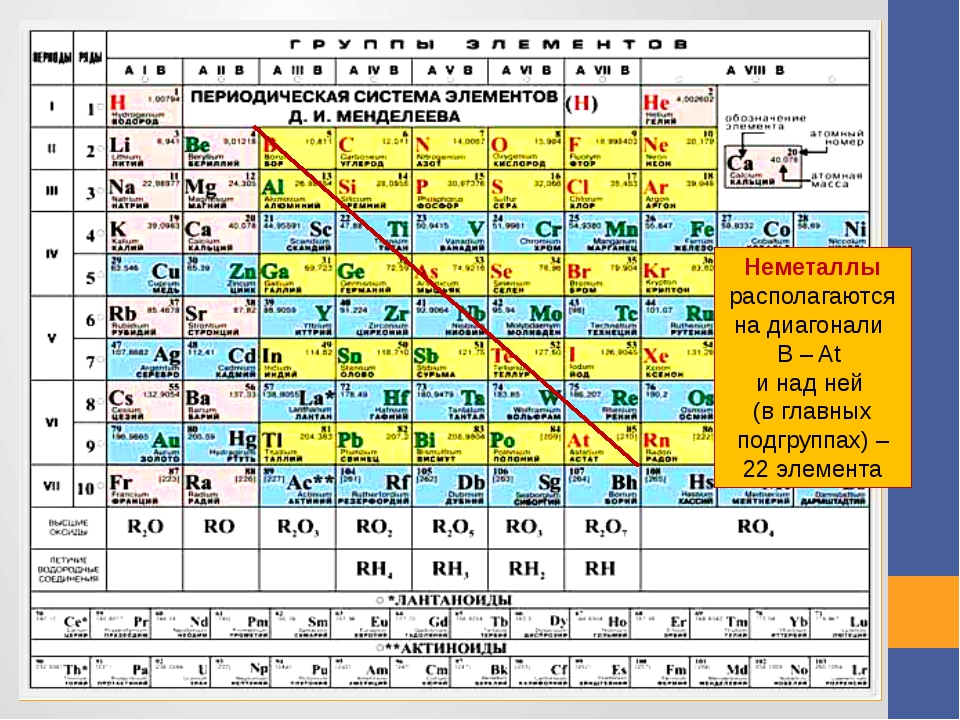
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
Неметаллы, свойства неметаллов, химия и характеристики неметаллов
Неметаллы, Неметаллы. Неметаллы — Категория неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал. Благодаря высоким значениям энергии ионизации неметаллов их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода четыре формы — графит, алмаз, карбин, фуллерен.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. Неметаллы существенно различаются по распространённости в земной различаются. Наиболее распространёнными являются кислород, кремний, водород, к редким относятся мышьяк, селен, иод.
Нас находят по запросам:
— неметаллы
— металлы и неметаллы
— свойства неметаллов
— химия неметаллы
— презентация неметаллы
— тема неметаллы
— характеристика неметаллов
— соединения неметаллов
— генетический ряд неметалла
— типичные неметаллы
— химические свойства неметаллов
Металлы и неметаллы — Химия
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra
а также вне определённых групп бериллий и магний
38 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
— La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi
7 в группе полуметаллов: B, Si, Ge, As, Sb, Te, Po
14 в группе лантаноиды + лантан (La):
Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Металличность).
Кроме того, в физике металлам [как проводникам] противоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника)).
Происхождение слова «металл»:
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова.
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).
Нахождение в природе:
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Свойства металлов:
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса:
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития пероксид натрия надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие кислот с металлами:
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
2. Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Страница не найдена — Саянский медицинский колледж
Я, субъект персональных данных, в соответствии с Федеральным законом от 27 июля 2006 года № 152 «О персональных данных» предоставляю ОГБПОУ «Саянский медицинский колледж» (далее — Оператор), расположенному по адресу Иркутская обл., г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
- Состав предоставляемых мной персональных данных является следующим: Имя, адрес электронной почты.
- Целями обработки моих персональных данных являются: обеспечение обмена короткими текстовыми сообщениями в режиме онлайн-диалога или обмена текстовыми сообщениями через электронную почту.
- Согласие предоставляется на совершение следующих действий (операций) с указанными в настоящем согласии персональными данными: сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, передачу (предоставление, доступ), блокирование, удаление, уничтожение, осуществляемых как с использованием средств автоматизации (автоматизированная обработка), так и без использования таких средств (неавтоматизированная обработка).
- Я понимаю и соглашаюсь с тем, что предоставление Оператору какой-либо информации о себе, не являющейся контактной и не относящейся к целям настоящего согласия, а равно предоставление информации, относящейся к государственной, банковской и/или коммерческой тайне, информации о расовой и/или национальной принадлежности, политических взглядах, религиозных или философских убеждениях, состоянии здоровья, интимной жизни запрещено.
- В случае принятия мной решения о предоставлении Оператору какой-либо информации (каких-либо данных), я обязуюсь предоставлять исключительно достоверную и актуальную информацию и не вправе вводить Оператора в заблуждение в отношении своей личности, сообщать ложную или недостоверную информацию о себе.

- Я понимаю и соглашаюсь с тем, что Оператор не проверяет достоверность персональных данных, предоставляемых мной, и не имеет возможности оценивать мою дееспособность и исходит из того, что я предоставляю достоверные персональные данные и поддерживаю такие данные в актуальном состоянии.
- Согласие действует по достижении целей обработки или в случае утраты необходимости в достижении этих целей, если иное не предусмотрено федеральным законом.
- Согласие может быть отозвано мною в любое время на основании моего письменного заявления.
Общая характеристика неметаллов » HimEge.ru
Химических элементов-неметаллов всего 16, но два из них, кислород и кремний составляют 76 % от массы земной коры. Неметаллы составляют 98,5 % от массы растений и 97,6 % от массы человека. Из углерода, водорода, кислорода, серы, фосфора и азота состоят все важнейшие органические вещества, они являются элементами жизни. Водород и гелий – основные элементы Вселенной из них состоят все космические объекты, включая наше Солнце.
Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7, для них характерны высокие значения электроотрицательности и окислительные свойства.
Если в Периодической системе провести диагональ от бериллия к астату, то справа вверх по диагонали будут находиться элементы-неметаллы, а слева снизу – металлы, к ним же относятся элементы всех побочных подгрупп, лантаноиды и актиноиды. Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма, обладают двойственным характером и относятся к металлоидам. Элементы 18 группы – инертные газы, имеют полностью завершенный внешний электронный слой, их иногда относят к неметаллам, но формально, по физическим признакам.
Электронные конфигурации валентных электронов элементов-неметаллов приведены в таблице:
1s1 | 2s22p1 | ns2np2 | ns2np3 | ns2np4 | ns2np5 |
H | |||||
B | C | N | O | F | |
Si | P | S | Cl | ||
As | Se | Br | |||
Te | I | ||||
At |
Закономерности в изменении свойств элементов-неметаллов
В периоде с ростом заряда ядра (слева направо):
- радиус атома уменьшается,
- число электронов на внешнем энергетическом уровне увеличивается,
- электроотрицательность увеличивается,
- окислительные свойства усиливаются,
- неметаллические свойства усиливаются.

В группе с ростом заряда ядра (сверху вниз):
- радиус атома увеличивается,
- число электронов на внешнем энергетическом уровне не изменяется,
- электроотрицательность уменьшается,
- окислительные свойства ослабевают,
- неметаллические свойства ослабевают.
Таким образом, чем правее и выше стоит элемент в Периодической системе, тем ярче выражены его неметаллические свойства.
Неметаллами в главной подгруппе IV группы Периодической системы Д.И. Менделеева являются углерод и кремний. На внешнем энергетическом уровне этих элементов находятся 4 электрона (ns2 np2). В своих неорганических соединениях углерод имеет степень окисления +2 (в невозбужденном состоянии) и +4 (в возбужденном состоянии). В органических соединениях степень окисления углерода может быть любой от –4 до +4.
Для кремния наиболее устойчива степень окисления +4. Углерод и кремний образуют кислотные оксиды общей формулы ЭО2 , а также летучие водородные соединения общей формулы ЭН4 .
Углерод и кремний образуют кислотные оксиды общей формулы ЭО2 , а также летучие водородные соединения общей формулы ЭН4 .
Неметаллами в V группе главной подгруппе Периодической системы Д.И. Менделеева являются азот, фосфор, мышьяк. На внешнем энергетическом уровне этих элементов находятся пять электронов: ns2 np3 . Азот в своих соединениях может проявлять степени окисления –3, –2, +1, +2, +3, +4, +5.
Для фосфора характерны степени окисления –3, +3, +5. Поскольку атом азота не имеет d-подуровня, он не может быть пятивалентным, но способен образовывать четвертую ковалентную связь по донорно-акцепторному механизму. С увеличением порядкового номера внутри подгруппы увеличиваются радиусы атомов и ионов, уменьшается энергия ионизации. Происходит ослабление неметаллических свойств и усиление металлических.
С кислородом элементы главной подгруппы V группы образуют высшие оксиды состава R2O5 . Все они являются кислотными оксидами. С водородом азот, фосфор и мышьяк образуют летучие газообразные соединения состава ЭН3 .
Все они являются кислотными оксидами. С водородом азот, фосфор и мышьяк образуют летучие газообразные соединения состава ЭН3 .
Неметаллами главной подгруппы VI группы Периодической системы Д.И. Менделеева являются кислород, сера, селен и теллур. Конфигурация внешнего электронного уровня этих элементов ns2 np4 . В своих соединениях они проявляют наиболее характерные степени окисления –2, +4, +6 (кроме кислорода). С возрастанием порядкового номера в пределах подгруппы уменьшается энергия ионизации, увеличиваются размеры атомов и ионов, ослабляются неметаллические признаки элементов и нарастают металлические. Сера и селен образуют высшие оксиды типа RO3 . Эти соединения являются типичными кислотными оксидами, которым соответствуют сильные кислоты типа H2RO4 . Для неметаллов главной подгруппы VI группы характерны летучие водородные соединения общей формулой H2R. При этом полярность и прочность связи ослабевает от H2O к H2Te. Все водородные соединения, кроме воды, являются газообразными веществами. Водные растворы H2S, H2Se, H2Te являются слабыми кислотами.
Все водородные соединения, кроме воды, являются газообразными веществами. Водные растворы H2S, H2Se, H2Te являются слабыми кислотами.
Элементы VII группы главной подгруппы — фтор, хлор, бром, иод являются типичными неметаллами. Групповое название этих элементов — галогены от греческого halos — соль и genes — рождающий. Конфигурация внешнего электронного уровня этих галогенов ns2 np5 . Наиболее характерная степень окисления галогенов –1. Кроме того, хлор, бром и иод могут проявлять степени окисления + 3, + 5, + 7. В пределах каждого периода галогены — наиболее электроотрицательные элементы. Внутри подгруппы при переходе от фтора к астату происходит увеличение радиуса атома, неметаллические свойства уменьшаются, происходит уменьшение окислительных и увеличение восстановительных свойств. Все галогены образуют простые вещества — двухатомные молекулы Hal2 . Фтор — самый электроотрицательный из химических элементов. Во всех своих соединениях имеет степени окисления –1. Высшие оксиды галогенов (кроме фтора) имеют общую формулу R2O7 , являются кислотными оксидами. Им соответствуют сильные кислоты общей формулы HRO4 (R = Cl, Br). Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI. Для галогенов существует закономерность: каждый предыдущий галоген способен вытеснять последующий из его соединений с металлами и водородом, например: Cl2 + 2KBr = 2KCl + Br2 .
Во всех своих соединениях имеет степени окисления –1. Высшие оксиды галогенов (кроме фтора) имеют общую формулу R2O7 , являются кислотными оксидами. Им соответствуют сильные кислоты общей формулы HRO4 (R = Cl, Br). Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI. Для галогенов существует закономерность: каждый предыдущий галоген способен вытеснять последующий из его соединений с металлами и водородом, например: Cl2 + 2KBr = 2KCl + Br2 .
Простые вещества — неметаллы. Строение. Физические свойства — Общая характеристика неметаллов
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов F2, Br2, I2), двойные (например, в молекулах серы S2), тройные (например, в молекулах азота N2) ковалентные связи.
— ЗАПОМНИ. Многие химические элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций.
Простые вещества — неметаллы могут иметь:
1. Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, F2, Cl2, O3) или твердые вещества (I2, P4, S8), и лишь один-единственный бром (Br2) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. Атомное строение. Эти вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
— ЗАПОМНИ. Все неметаллы — диэлектрики, т. к. их внешние электроны использованы на образование химических связей.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул (O2, О3), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Чтобы выявить свойства, характерные для всех неметаллов, надо обратить внимание на их расположение в периодической системе элементов и определить конфигурацию внешнего электронного слоя (табл. 5).
Таблица 5
Конфигурация внешнего электронного слоя атомов неметаллов
|
Номер периода
|
Номер группы
|
Элементы
|
Число электронов на внешнем слое
|
|
1
|
I
|
Н
|
1s1
|
|
2
|
III
|
В
|
2s22р1
|
|
3
|
IV
|
С, Si
|
ns2np2
|
|
4
|
V
|
N, P, As
|
ns2np3
|
|
5
|
VI
|
O, S, Se, Te
|
ns2np4
|
|
6
|
VII
|
F, Cl, Br, I, At
|
ns2np5
|
В периоде:
· заряд ядра увеличивается;
· радиус атома уменьшается;
· число электронов внешнего слоя увеличивается;
· электроотрицательность увеличивается;
· окислительные свойства усиливаются;
· неметаллические свойства усиливаются.
В главной подгруппе:
· заряд ядра увеличивается;
· радиус атома увеличивается;
· число электронов на внешнем слое не изменяется;
· электроотрицательность уменьшается;
· окислительные свойства ослабевают;
· неметаллические свойства ослабевают.
Для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: P, Seаморф. — желтые; Bаморф. — коричневый; О2(ж) — голубой; Si, Asмет. — серые; Р4 — бледно-желтый; I1(г.) — фиолетово-черный с металлическим блеском;Br2(ж.) — бурая жидкость; Cl2(г.) — желто-зеленый; F2(г.) — бледно-зеленый; S8(тв.) — желтая. Кристаллы неметаллов непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Металлы и неметаллы
Все металлы, кроме ртути, в обычных условиях твердые вещества, характеризующиеся «металлическим» блеском, хорошей тепло- и электропроводимостью, пластичностью. Типичными металлами являются щелочные (литий, натрий, калий, рубидий, цезий) и щелочноземельные (кальций, стронций, барий, магний) металлы.
Неметаллы в обычных условиях находятся в твердом (фосфор, сера, селен, углерод и др.), жидком (бром) и газообразном (кислород, водород, азот и др.) состояниях. Твердые неметаллы отличаются хрупкостью и, как правило, обладают плохой тепло- и электропроводимостью.
Типичными неметаллами являются галогены (фтор, хлор, бром, иод), сера, селен, теллур, азот, фосфор, углерод.
Резкой границы между металлами и неметаллами не существует. Некоторые элементы одновременно совмещают свойства металлов и неметаллов, причем и те и другие свойства у них выражены недостаточно резко. Например, цинк, бериллий, алюминий, хром, олово, свинец в кислой среде проявляют свойства металлов, а в щелочной — неметаллов.
Например, цинк, бериллий, алюминий, хром, олово, свинец в кислой среде проявляют свойства металлов, а в щелочной — неметаллов.
Все наиболее распространенные металлы и неметаллы как твердые, так и жидкие и газообразные, входят в ассортимент химических реактивов. Большинство металлов поступает в продажу в виде порошка, небольших слитков или кусков. Для облегчения работы с ними некоторые металлы переплавляют и выпускают в виде палочек (висмут, кадмий, олово, свинец), гранул (кадмий,, свинец, цинк), губки (олово), пыли (цинк, алюминий), листа или ленты (золото, медь), проволоки (алюминий, железо), стружки (железо) и т. п.
Некоторые металлы и неметаллы чрезвычайно легко окисляются на воздухе и поэтому их хранят в определенных условиях. Так, натрий и калий хранят под слоем керосина или другого углеводорода, а белый фосфор — под слоем воды.
Применение. Чистые металлы и неметаллы используют в неорганическом и органическом синтезе для получения химических реактивов и препаратов. Окислением некоторых металлов получают непосредственно окислы этих металлов реактивной чистоты, а растворением их в кислотах — соответствующие соли.
Окислением некоторых металлов получают непосредственно окислы этих металлов реактивной чистоты, а растворением их в кислотах — соответствующие соли.
В органическом синтезе металлы находят применение в качестве катализаторов (алюминий, медь, никель, палладий, платина, серебро и др.), при получении металлоорганических соединений и т. д.
Белый фосфор, сера и другие неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений. Бром, хлор, иод используются в органическом синтезе для получения галогенорганических производных, а также для получения некоторых галогенсодержащих кислот и их солей.
Металлы и неметаллы играют известную роль и в аналитической химии. Большая группа металлов — алюминий, железо, цинк, магний, олово, никель — применяются в качестве восстановителей. Натрий используют для определения хлора в органических веществах, при восстановлении и гидрировании многих органических соединений, для глубокой осушки органических жидкостей, для приготовления амальгам и т.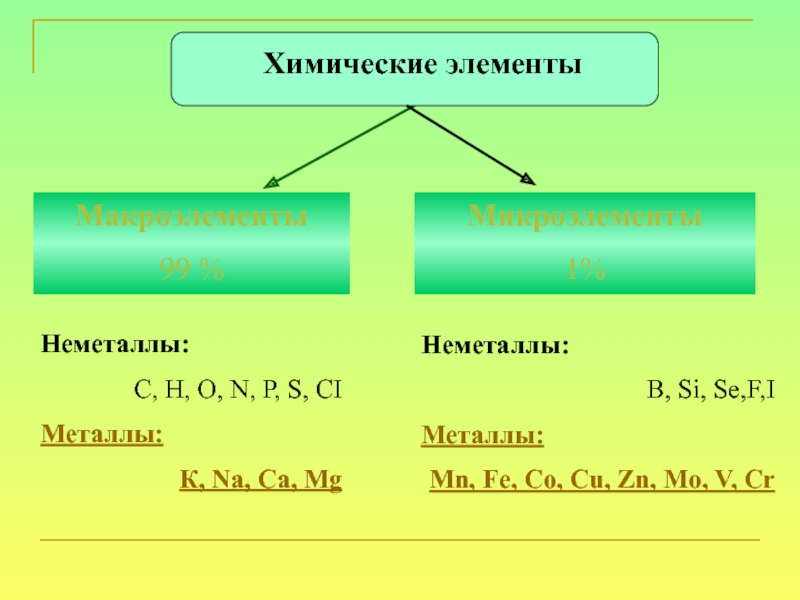 д. Бром служит окислителем при аналитических определениях марганца, никеля, хрома, висмута, железа, цианидов, роданидов, мочевины, муравьиной кислоты.
д. Бром служит окислителем при аналитических определениях марганца, никеля, хрома, висмута, железа, цианидов, роданидов, мочевины, муравьиной кислоты.
Чистые элементы, такие, как сера, свинец, алюминий, кобальт, медь, никель, олово, палладий, сурьма, цинк, характеризующиеся четкой температурой плавления, используются в термометрии для калибровки термометров и пирометров.
Список неметаллов
Выделенные элементы являются неметаллическими элементами.
Неметаллические элементы занимают верхний правый угол периодической таблицы. Неметаллы включают неметаллическую группу, галогены и благородные газы. Эти элементы имеют схожие химические свойства друг с другом, что отличает их от элементов, которые считаются металлами.
Группы неметаллов
Группа неметаллических элементов — это подмножество неметаллов. Группа неметаллических элементов состоит из водорода, углерода, азота, кислорода, фосфора, серы и селена.Водород действует как неметалл при нормальных температурах и давлении и обычно считается частью группы неметаллов.
Галогены — неметаллы 7 группы Периодической таблицы Менделеева. Атомы этих элементов имеют степень окисления -1. Элементы в верхней части группы — это газы, но они становятся жидкостями и твердыми телами, движущимися вниз по группе. Галогены — это фтор, хлор, бром, йод и астат. Свойства теннессина малоизвестны. Теннессин может быть галогеном или металлоидом.
Благородные газы — это относительно инертные газы, находящиеся в группе 8 (последний столбец) таблицы периодов. Благородные газы — гелий, неон, аргон, криптон, ксенон, радон и оганессон. Скорее всего, оганессон не является газом при комнатной температуре.
Список неметаллов
Это список неметаллических элементов в порядке возрастания атомного номера.
Свойства неметаллов
Свойства неметаллов включают:
- тусклый, не блестящий
- плохой проводник тепла
- плохой проводник электричества
- высокая энергия ионизации
- высокая электроотрицательность
- не податливый или пластичный, обычно хрупкий
- более низкая плотность (по сравнению с металлами)
- более низкая температура плавления и кипения (по сравнению с металлами)
- получение электронов в реакциях (отрицательная степень окисления)
- часто красочный в твердом состоянии
Список применений неметаллов
В отличие от металлов неметаллы не имеют универсального применения. Но в некоторых приложениях они встречаются вместе:
Но в некоторых приложениях они встречаются вместе:
- Необходимы для жизни (углерод, водород, азот, кислород, сера, хлор, фосфор)
- Удобрения (водород, азот, фосфор, сера, хлор, селен)
- Хладагенты и криогеника (водород, гелий, азот, кислород, фтор, неон)
- Промышленные кислоты (углерод, азот, фтор, фосфор, сера, хлор)
- Лазеры и лампы
- Медицина и фармацевтика
Неметаллы образуют множество соединений.Фактически, большинство соединений, с которыми вы сталкиваетесь, содержат неметаллы. Они встречаются в воде, продуктах питания, тканях, пластмассах и других предметах повседневного обихода.
Ссылки
- Аддисон, У. Э. (1964) Аллотропия элементов . Oldbourne Press: Лондон.
- Bettelheim, F.A .; Brown, W.H .; Кэмпбелл, М.К .; Farrell, S.O .; Торрес, О. (2016). Введение в общую, органическую и биохимию (11-е изд.). Cengage Learning: Бостон. ISBN 978-1-285-86975-9.
- Эмсли, Дж.
 (1971). Неорганическая химия неметаллов . Methuen Educational: Лондон. ISBN 0423861204.
(1971). Неорганическая химия неметаллов . Methuen Educational: Лондон. ISBN 0423861204. - Steudel, R. (1977). Химия неметаллов: введение в атомную структуру и химические связи . Английское издание F.C. Наход и Дж. Дж. Цукерман. Берлин: Вальтер де Грюйтер. ISBN 3110048825.
Список неметаллических элементов
Неметаллы или неметаллы — это группа элементов, расположенных в правой части периодической таблицы (за исключением водорода, который находится вверху слева).Эти элементы отличаются тем, что они обычно имеют низкие температуры плавления и кипения, плохо проводят тепло или электричество и, как правило, имеют высокие значения энергии ионизации и электроотрицательности. У них также нет блестящего «металлического» внешнего вида, присущего металлам.
Хотя металлы податливы и пластичны, неметаллы имеют тенденцию образовывать хрупкие твердые тела. Неметаллы имеют тенденцию легко получать электроны, чтобы заполнить свои оболочки валентных электронов, поэтому их атомы часто образуют отрицательно заряженные ионы.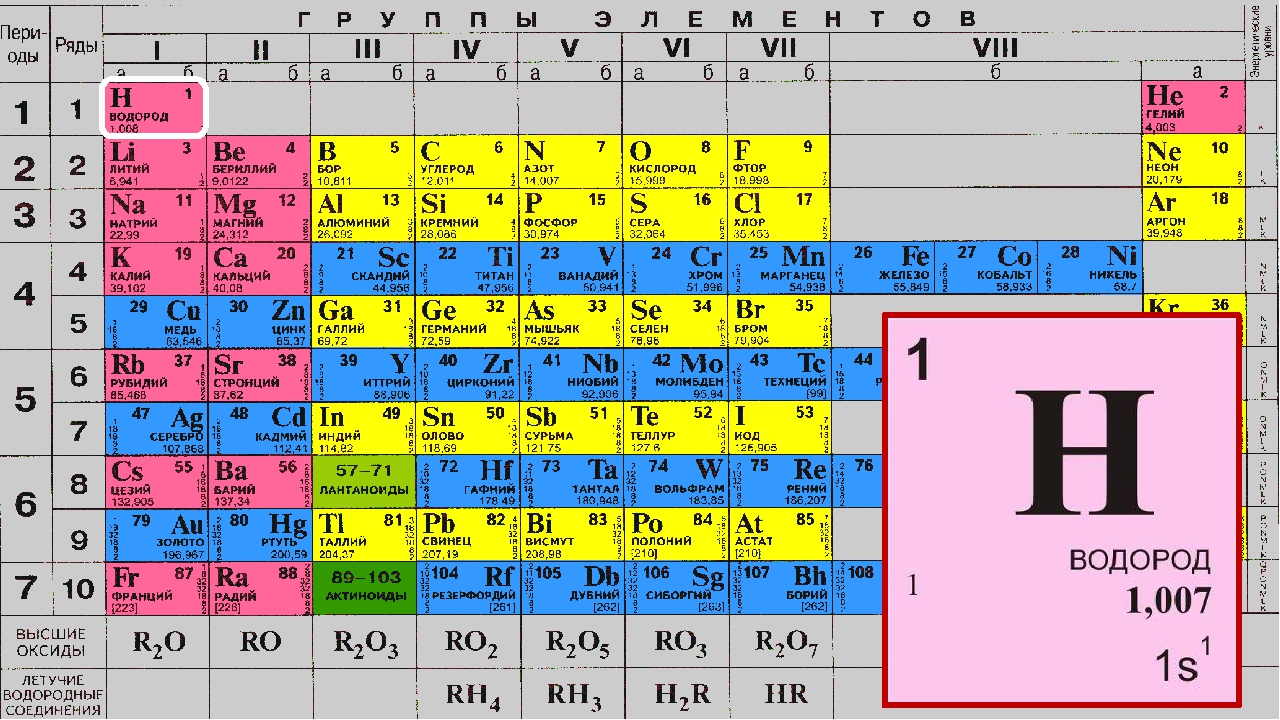 Атомы этих элементов имеют степени окисления +/- 4, -3 и -2.
Атомы этих элементов имеют степени окисления +/- 4, -3 и -2.
Список неметаллов (группа элементов)
К группе неметаллов относятся 7 элементов:
Хотя это элементы в группе неметаллов, , есть две дополнительные группы элементов, которые могут быть включены, поскольку галогены и благородные газы также являются типами неметаллов.
Список всех неметаллов
Итак, если мы включим группу неметаллов, галогены и благородные газы, все элементы, которые являются неметаллами:
- Водород (иногда)
- Углерод
- Азот
- Кислород
- фосфор
- Сера
- Селен
- фтор
- Хлор
- Бром
- Йод
- Астатин
- Теннессин (иногда считается галогеном или металлоидом)
- Гелий
- Неон
- Аргон
- Криптон
- Ксенон
- Радон
- Оганессон (возможно, ведет себя как «благородный газ», но в обычных условиях не будет газом)
Металлические неметаллы
Неметаллы классифицируются на основе их свойств в обычных условиях.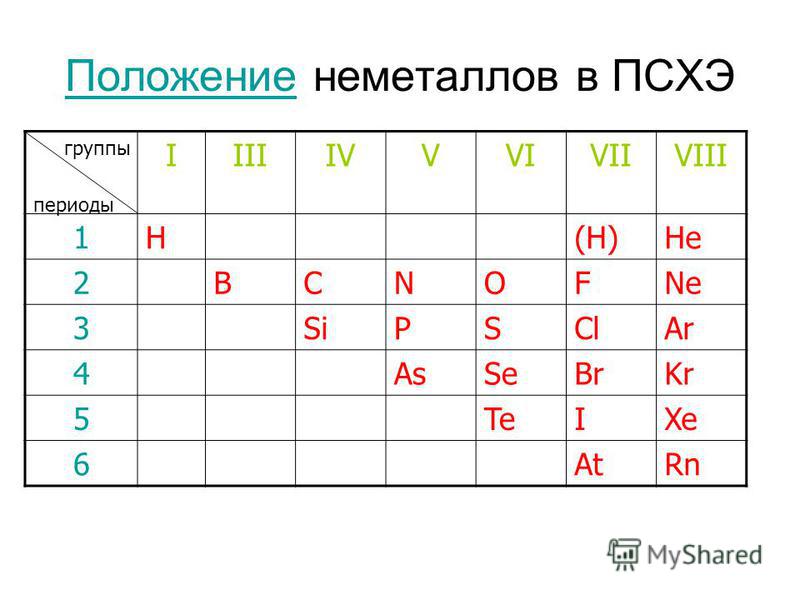 Металлический характер — это не свойство «все или ничего». У углерода, например, есть аллотропы, которые ведут себя больше как металлы, чем неметаллы. Иногда этот элемент считают металлоидом, а не неметаллом. Под экстремальным давлением водород действует как щелочной металл. Даже кислород имеет металлическую форму в твердом состоянии.
Металлический характер — это не свойство «все или ничего». У углерода, например, есть аллотропы, которые ведут себя больше как металлы, чем неметаллы. Иногда этот элемент считают металлоидом, а не неметаллом. Под экстремальным давлением водород действует как щелочной металл. Даже кислород имеет металлическую форму в твердом состоянии.
Значение группы «Неметаллы»
Несмотря на то, что в группе неметаллов всего 7 элементов, два из этих элементов (водород и гелий) составляют около 98% массы Вселенной.Неметаллы образуют больше соединений, чем металлы. Живые организмы состоят в основном из неметаллов.
неметаллов | Химия для неосновных специалистов
Цели обучения
- Определите неметалл.
- Перечислите типичные неметаллы и способы их использования.
Как мы сортируем вещи?
Когда мы сортируем детали в нашем магазине или гараже, мы часто классифицируем их по общим свойствам. Один контейнер может содержать все винты (возможно, разделенные по размеру и типу). Другой контейнер будет для гвоздей. Может быть, есть набор ящиков под сантехнические детали.
Другой контейнер будет для гвоздей. Может быть, есть набор ящиков под сантехнические детали.
Когда вы закончите, у вас также может быть набор вещей, которые не подходят под категорию. Вы определяете их с точки зрения того, чем они не являются. Они не являются электрическими компонентами, разбрызгивателями для двора или частями автомобиля. Эти части могут иметь некоторые общие свойства, но представляют собой различные элементы.
В химическом мире эти «запасные части» будут считаться неметаллами, в широком смысле не имеющими свойств металлов.Неметалл — это элемент, который обычно плохо проводит тепло и электричество. Большинство свойств неметаллов противоположны металлам. У неметаллов наблюдается более широкий разброс свойств, чем у металлов. Неметаллы существуют во всех трех состояниях материи. Большинство из них — это газы, такие как азот и кислород. Бром — жидкость. Некоторые из них представляют собой твердые вещества, такие как углерод и сера. В твердом состоянии неметаллы хрупкие , что означает, что они разобьются при ударе молотком. Твердые тела не блестящие. Точки плавления обычно намного ниже, чем у металлов. Зеленые элементы в таблице ниже — неметаллы.
Твердые тела не блестящие. Точки плавления обычно намного ниже, чем у металлов. Зеленые элементы в таблице ниже — неметаллы.
Неметаллы имеют множество применений. Сера может использоваться в порохе, фейерверках и спичках для облегчения воспламенения (см. , рис. 1, ). Этот элемент также широко используется в качестве инсектицида, фумиганта или средства от некоторых видов грибка. Сера играет важную роль в производстве резины для шин и других материалов.Впервые обнаруженный в 1839 году Чарльзом Гудиером, процесс вулканизации делает резину более гибкой и эластичной, а также более устойчивой к изменениям температуры. В основном сера используется для получения серосодержащих соединений, таких как серная кислота.
Бром — это универсальное соединение, используемое в основном в производстве огнестойких материалов, особенно важных для детской одежды (см. , рис. 2, ). Для обработки воды в плавательных бассейнах и гидромассажных ваннах бром начинает заменять хлор в качестве дезинфицирующего средства из-за его более высокой эффективности. При включении в соединения атомы брома играют важную роль в фармацевтических препаратах для лечения боли, рака и болезни Альцгеймера.
При включении в соединения атомы брома играют важную роль в фармацевтических препаратах для лечения боли, рака и болезни Альцгеймера.
Рисунок 1. Сера. | Рисунок 2. Бром. |
Гелий — один из многих неметаллов, который представляет собой газ. Другие неметаллические газы включают водород, фтор, хлор и все благородные (или инертные) газы группы восемнадцать. Гелий химически нереактивен, поэтому он полезен для таких применений, как воздушные шары (см. , рис. 3, ) и лазеры, где негорючесть чрезвычайно важна.Жидкий гелий существует при чрезвычайно низкой температуре и может использоваться для охлаждения сверхпроводящих магнитов для исследований изображений (МРТ, магнитно-резонансная томография). Утечки в сосудах и многих типах высоковакуумных аппаратов можно обнаружить с помощью гелия. Вдыхание гелия изменяет скорость звука, делая ваш голос более высоким. Это определенно небезопасная практика и может привести к физическим травмам и смерти.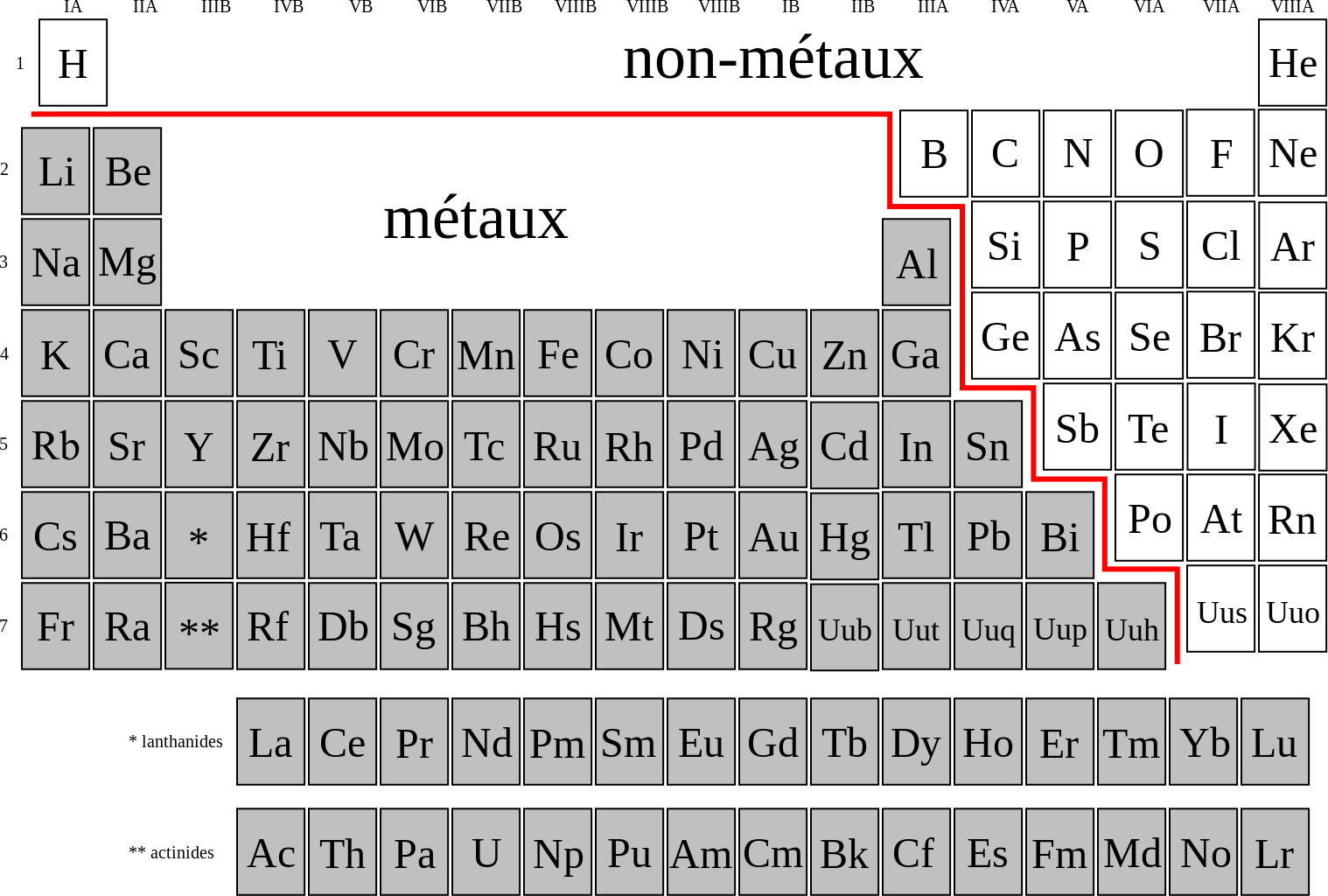
Рисунок 3. Дирижабль.
Сводка
- Неметаллы обычно плохо проводят тепло и электричество.
- Свойства неметаллов обычно противоположны свойствам металлов
- Неметаллы могут быть твердыми, жидкими или газообразными при комнатной температуре в зависимости от элемента.
- Сера, бром и гелий — типичные неметаллы.
Практика
Выберите два неметалла из периодической таблицы, которые не были упомянуты. Найдите информацию, чтобы ответить на следующие вопросы:
- Каковы физические свойства этого неметалла?
- Перечислите три текущих использования этого элемента.
Обзор
- Каковы свойства неметаллов?
- Перечислите состояния вещества, в которых могут существовать неметаллы, и приведите по одному примеру каждого состояния
- Каковы физические свойства и использование серы?
- Каковы физические свойства и использование брома?
- Каковы физические свойства и использование гелия?
Глоссарий
- неметалл: Элемент, который обычно плохо проводит тепло и электричество.
- хрупкое: Легко разрушается.
Показать ссылки
Ссылки
- Невилл-стрит. Застежки Huck.
- Фонд CK-12 — Кристофер Ауён. Периодическая таблица .
- Бен Миллс (Викимедиа: Benjah-bmm27). Сера.
- Пользователь: Jurii / Wikimedia Commons. Бром.
- Дерек Дженсен (Викимедиа: Tysto). Дирижабль.
«Список неметаллов с символами и их использование в Периодической таблице»
Привет, студенты! Список неметаллов доступен здесь для изучения.Теперь изучите этот список неметаллов и выучите их символы.
Список неметаллов и их использования
Это неметаллы, которые можно найти в периодической таблице;
- Азот — используется в производстве аммиака
- Кислород — используется в дыхательных баллонах.
- Neon — используется в различных типах огней.
- Хлор — используется в отбеливающем порошке и жидком отбеливателе.
- Аргон — Так же, как неон, он используется в освещении.
- Криптон — наряду с аргоном и неоном используется в освещении.
- Йод — используется для антибактериального бульканья.
- Карбон — производство резиновых покрышек.
Список неметаллов Периодической таблицы
Это список неметаллов в периодической таблице:
Список неметаллов и их обозначений
Список трех свойств неметаллов
- Плохие проводники тепла и электричества.
- Получить электрон легко.
- Высокая электроотрицательность
Найдите нашу таблицу Менделеева с пометкой.
Список неметаллов, используемых в повседневной жизни
Список неметаллов и металлов
Список металлов и неметаллов Вы можете увидеть в данной таблице:
| НАИМЕНОВАНИЕ | СИМВОЛ | АТОМ. |
| ВОДОРОД | H | 1 |
| ГЕЛИЙ | He | 2 |
| ЛИТИЙ | Li | 3 |
| БЕРИЛЛИЙ | Be | 4 |
| БОРОН | B | 5 |
| УГЛЕРОД | С | 6 |
| АЗОТ | N | 7 |
| КИСЛОРОД | O | 8 |
| ФТОР | F | 9 |
| НЕОН | Ne | 10 |
| НАТРИЙ | Na | 11 |
| МАГНИЙ | мг | 12 |
| АЛЮМИНИЙ | Al | 13 |
| КРЕМНИЙ | S | 14 |
| ФОСФОР | -п. | 15 |
| СЕРЫ | S | 16 |
| ХЛОР | Класс | 17 |
| АРГОН | Ar | 18 |
| КАЛИЙНЫЙ | К | 19 |
| КАЛЬЦИЙ | Ca | 20 |
| СКАНДИЙ | SC | 21 |
| ТИТАН | Ti | 22 |
| ВАНАД | В | 23 |
| ХРОМ | Cr | 24 |
| МАРГАНСКИЙ | Mn | 25 |
| утюг | Fe | 26 |
| КОБАЛЬТ | Co | 27 |
| НИКЕЛЬ | Ni | 28 |
| МЕДЬ | Cu | 29 |
| ЦИНК | Zn | 30 |
| ГАЛЛИЙ | Ga | 31 |
| ГЕРМАНИЯ | Ge | 32 |
| МЫШИ | как | 33 |
| СЕЛЕН | SE | 34 |
| БРОМ | Br | 35 |
| КРИПТОН | Кр | 36 |
| РУБИДИЙ | руб.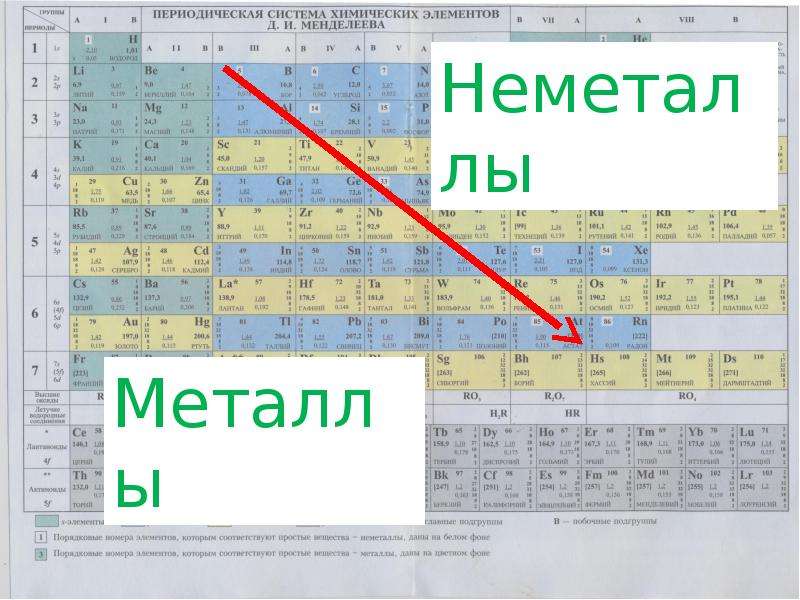 | 37 |
| СТРОНТИЙ | Sr | 38 |
| иттрий | Y | 39 |
| ЦИРКОНИЙ | Zr | 40 |
| НИОБИЙ | Nb | 41 |
| МОЛИБДЕН | Пн | 42 |
| ТЕХНЕТИУМ | TC | 43 |
| РУТЕНИЙ | Ру | 44 |
| РОДИУМ | Rh | 45 |
| ПАЛЛАДИЙ | Pd | 46 |
| СЕРЕБРЯНЫЙ | Ag | 47 |
| КАДМИЙ | Cd | 48 |
| ИНДИУМ | В | 49 |
| ИНН | Sn | 50 |
| СУРЬМЫ | Сб | 51 |
| ТЕЛЛУРИЙ | Te | 52 |
| ЙОД | я | 53 |
| КСЕНОН | Xe | 54 |
| ЦЕЗИЙ | CS | 55 |
| БАРИЙ | Ba | 56 |
| ЛАНТАН | La | 57 |
| ЦЕРИЙ | CE | 58 |
| PRASEODYMIUM | Pr | 59 |
| НЕОДИМ | Nd | 60 |
| ПРОМЕТИЙ | Pr | 61 |
| САМАРИЙ | см | 62 |
| ЕВРОПИЯ | Eu | 63 |
| ГАДОЛИНИЙ | Gd | 64 |
| ТЕРБИЙ | ТБ | 65 |
| ДИСПРОЗИЙ | DS | 66 |
| HOLMIUM | Ho | 67 |
| ЭРБИЙ | Er | 68 |
| ТУЛИЙ | Чт | 69 |
| ИТТЕРБИЙ | ТБ | 70 |
| ЛУТЕТИЙ | Лю | 71 |
| ГАФНИЙ | Hf | 72 |
| ТАНТАЛ | Ta | 73 |
| Вольфрам | Вт | 74 |
| РЕНИЙ | Re | 75 |
| OSMIUM | Ос | 76 |
| ИРИДИЙ | Ir | 77 |
| ПЛАТИНИЙ | Pt | 78 |
| ЗОЛОТО | Au | 79 |
| МЕРКУРИЙ | Hg | 80 |
| ТАЛИЙ | Ti | 81 |
| СВИНЦ | Пб | 82 |
| ВИСМУТ | Bi | 83 |
| ПОЛОНИЙ | По | 84 |
| АСТАТИН | по адресу | 85 |
| РАДОН | Rn | 86 |
| ФРАНЦИЯ | Fr | 87 |
| РАДИУМ | Ra | 88 |
| АКТИНИУМ | Ac | 89 |
| ТОРИЙ | Чт | 90 |
| ПРОТАКТИНИУМ | Па | 91 |
| УРАН | U | 92 |
| НЕПТУНИУМ | Np | 93 |
| ПЛУТОНИЙ | Pu | 94 |
| АМЕРИКА | Am | 95 |
| CURIUM | см | 96 |
| БЕРКЕЛИЙ | Bk | 97 |
| КАЛИФОРНИЙ | Cf | 98 |
| EINSTEINIUM | Es | 99 |
| ФЕРМИЯ | Fm | 100 |
| МЕНДЕЛЕВИУМ | Md | 101 |
| НОБЕЛИУМ | № | 102 |
| LAWRENCIUM | Lr | 103 |
| RUTHERFODIUM | Rf | 104 |
| ДУБНИЙ | Db | 105 |
| SEABORGIUM | Sg | 106 |
| БОГРИЙ | Rf | 107 |
| HASSIUM | HS | 108 |
| MEITNERIUM | Mt | 109 |
| ДАРМСТАДТИУМ | Db | 110 |
| ROENTGENIUM | Rg | 111 |
| КОПЕРМИЦИЙ | Cn | 112 |
| НИГОМИЕВ | Nh | 113 |
| ФЛЕВОРИЙ | Fl | 114 |
| МОСКОВСКИЙ | Mc | 115 |
| ЛИВЕРМОРИЙ | Уровень | 116 |
| ОГАНЕССОН | Og | 117 |
Список неметаллов, найденных дома
Вот список неметаллов, найденных дома:
Список металлов и неметаллов
Список металлов , составляющий периодическую таблицу, включает железо, свинец, золото, алюминий, платину, уран, цинк, литий, натрий, олово, серебро и т. Д.
Д.
неметаллов, т, составляющих периодическую таблицу, включают водород, гелий, углерод, серу, азот, кислород, радон, неон, другие галогены, благородные газы и т. Д.
Когда мы изучаем элементы, это важно чтобы знать, какие элементы являются металлами, а какие нет. Если вы пытаетесь научиться различать металлы и неметаллы, список и их использование — хороший способ разбить их и помочь запомнить разницу между ними. Хорошая новость в том, что большинство элементов — это металлы.Полезный способ подойти к изучению элементов — различать, металлические они или неметаллические. У металлов есть некоторые общие свойства. Итак, знание того, что это за свойства, — хороший способ начать наше исследование.
Что такое металл?
Как указано во введении, большинство элементов являются металлами или, по крайней мере, могут считаться таковыми. Знание того, какие из них есть, а какие нет, поможет нам правильно их сгруппировать. Прежде чем перейти к полному списку металлов, важно определить, что такое металл. Есть пять различных видов металлов:
Есть пять различных видов металлов:
Все металлические элементы помещены вместе в периодической таблице.
Нам нужно меньше запоминать — я никогда не запоминал периодическую таблицу элементов — я никогда не использовал ее, и я физик! Я могу это посмотреть. — Мичио Каку
Есть несколько свойств, которые делают большинство элементов металлами. Элемент должен обладать некоторыми из этих свойств, чтобы считаться металлом. Важно ознакомиться с этими различными свойствами.Не все свойства присущи всем металлам, но все элементы, которые обладают некоторыми из этих свойств, могут считаться металлами.
«Периодическая таблица блоков spdf (32 столбца)» от DePiep через Wikimedia Commons под лицензией CC-BY-SA 3.0.
Каковы общие свойства металлов?
Большинство металлов имеют твердое состояние, когда они находятся при комнатной температуре. Фактически, единственным исключением из этого свойства является ртуть.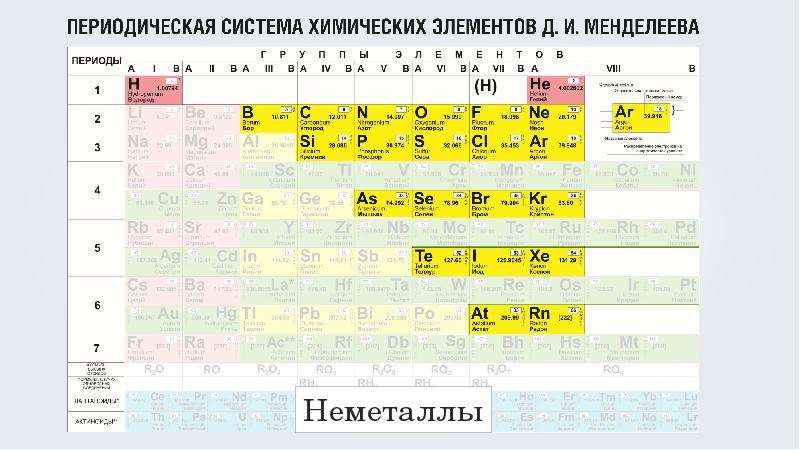 Ртуть — единственный металл, который всегда находится в жидком состоянии независимо от температуры.Таким образом, он остается жидким даже при комнатной температуре. Как правило, температура плавления металлов высокая.
Ртуть — единственный металл, который всегда находится в жидком состоянии независимо от температуры.Таким образом, он остается жидким даже при комнатной температуре. Как правило, температура плавления металлов высокая.
- Еще один способ распознать металл — это его сияние.
- Металлы также хорошо проводят тепло и электричество. Но имеют низкую энергию ионизации и низкую электроотрицательность. Еще одно важное свойство, которым обладают многие металлические элементы, — это их пластичность. Это означает, что металлы относительно легко разбить на листы.
- Кроме того, из большинства металлов можно производить проволоку.Это то, что мы называем пластичностью.
- За исключением калия, лития и натрия, большинство металлов имеют высокую плотность.
- Одним из общих и, пожалуй, наиболее заметных свойств, присущих большинству металлических элементов, является то, что они подвержены коррозии при воздействии морской воды или воздуха.
- Наконец, большинство металлических элементов теряют электроны во время реакций.

Есть один неметаллический элемент, который иногда может действовать как металл. Это водород, который при воздействии чрезвычайно высоких или чрезвычайно низких температур может проявлять некоторые из этих общих свойств.
Полный список металлов
Теперь, когда мы установили свойства, которые превращают большинство элементов периодической таблицы в металлы, мы можем теперь представить полный список металлических элементов:
| Элемент | Символ | Число в периодической таблице | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Литий | Li | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бериллий | Be | 4 | 9018 9018 9018 9018 Магний 9018 9018 9018 9018 Магний | Mg | 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алюминий | Al | 13 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Калий | K | 19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кальций | Ca | Sc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Титан | Ti | 22 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| V | 23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хром | Cr | 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Марганец | Mn | 25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Железо | Fe | 27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Никель | Ni | 28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Медь | Cu | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цинк | Zn | 30 | Rb | 37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стронций | Sr | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Иттрий | Y | 39 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zirconium 9018 9018 9018 N 9018 N 9018 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молибден | Мо | 42 | Технеций | Tc | 43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рутений | Ru | 44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Родий | Rh | 45 | Rh | 45 | 47 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кадмий | Cd | 48 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Индий | In | 49 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| олово | Sn | 9018 9018 Cd | 9018 Cd | 9018 Cd | Барий | Ba | 56 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лантан | La | 57 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Церий | Ce | 58 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Praseodymium 9018 9018 9018 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N0181 9018 Неодимий 9018 | 60 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прометий | PM | 61 90 186 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Самарий | Sm | 62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Европий | Eu | 63 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гадолиний | Gd | 64 | 9018 Тербиз | Dy | 66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гольмий | Ho | 67 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эрбий | Er | 68 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тулий | YY 9018 9018 9018 9018 9018 9018 9018 9018 9018 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лютеций | Lu | 71 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гафний | Hf | 72 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тантал | Ta | 73 | 9018 9018 9018 9018 9018 9018 9018 W2 Re | 75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Осмий | Os 901 86 | 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Иридий | Ir | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Платина | Pt | 78 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Золото | Au | 79 | 79 | Таллий | Tl | 81 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Свинец | PB | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Висмут | Bi | 83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9018 9018 9018 F19 9018 9018 9018 9018 Полоний | 87 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радий | Ra | 88 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Актиний | Ac | 89 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Торий | Th | U | 92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Нептуний | 93 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плутоний | Pu | 94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Америций | Am | 95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кюрий | Cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Калифорний | Cf | 98 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эйнштейний | Es | 99 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фермий | Fm | 100 | 101183 | 102 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лоуренсий | Lr | 103 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Резерфордий | Rf | 104 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дубний | Db196 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бориум | Bh | 107 90 186 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Калий | Hs | 108 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мейтнериум | Mt | 109 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дармштадций | Ds | 110 | Roent | Cn | 112 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ununtrium | Uut | 113 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flevorium | Fl | 114 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Livermorium |
| Элемент | Символ элемента | Номер в периодической таблице | |||
| Водород | H | H Helium | He | 2 | |
| Углерод | C | 6 | |||
| Азот | N | 7 | |||
| Кислород | O | 8 | |||
| O | 8 | ||||
| O | 8 | ||||
| Неон | Ne | 10 | |||
| Фосфор | P | 15 | |||
| Сера 9018 6 | S | 16 | |||
| Хлор | Cl | 17 | |||
| Аргон | Ar | 18 | |||
| Селен | Br | ||||
| Криптон | Kr | 36 | |||
| Йод | I | 53 | |||
| Ксенон | Xe | ||||
| Rn | 117 | ||||
| Oganesson | Og | 118 |
Мы надеемся, что этот список металлов и неметаллов в периодической таблице поможет. Дайте нам знать в комментариях ниже, какой именно вы искали.
Дайте нам знать в комментариях ниже, какой именно вы искали.
Была ли эта статья полезной?
😊 ☹️ Приятно слышать! Хотите больше научных тенденций? Подпишитесь на нашу рассылку новостей науки! Нам очень жаль это слышать! Мы любим отзывы 🙂 и хотим, чтобы вы внесли свой вклад в то, как сделать Science Trends еще лучше.
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции изменения металлических и неметаллических характеристик
- Атрибуция
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами.Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Податливый и пластичный (гибкий) в твердом состоянии | Хрупкие, твердые или мягкие |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая при комнатной температуре находится в жидком состоянии (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают способностью отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью выдерживать удары молотком и из них могут быть изготовлены тонкие листы, известные как фольга. Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле.
- Пластичность: Металлы можно втянуть в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.
- Точки плавления и кипения : Металлы имеют высокие точки плавления и кипения. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию иметь низкую энергию ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям реакциям Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в s подоболочке)
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), а также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1.{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами имеют тенденцию быть ионными по природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водный) \ rightarrow MgCl2 (водный) + h3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (вод.) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). Только бром существует в жидком виде при комнатной температуре.
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.
- Точки плавления и кипения : Точки плавления неметаллов на , как правило, на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют в стандартных условиях как двухатомных молекул : \ (\ ce {h3 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию приобретать электроны или делиться ими с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно достигают электронной конфигурации благородного газа) и становятся анионами:
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислые или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\ [\ ce {CO2 (г) + h3O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h3CO3 (aq)}} \ nonumber \]
Как вы знаете, газированная вода имеет слабокислую (угольную) кислоту.
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + H3O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут действовать как электрические проводники, поэтому их называют полупроводниками. Кремний, например, кажется блестящим, но не является ни ковким, ни пластичным ( хрупким, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента в этой группе может колебаться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Тенденции в металлических и неметаллических свойствах
Металлический характер является наиболее сильным для элементов в самой левой части периодической таблицы и имеет тенденцию к уменьшению при движении вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации).Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и авторство
Что такое 22 неметалла?
sites.google.com
17
10 неметаллов являются твердыми веществами: Важными твердыми неметаллами являются: бор (B), углерод (C), кремний (Si), фосфор (P), мышьяк (As), сера (S), йод (I).11 неметаллов являются газами: это водород (H), азот (N), кислород (O), фтор (F), неон (Ne), хлор (Cl), аргон (Ar), криптон (Kr), Ксенон (Xe), Радон (Rn).
Неметаллы или элементы неметаллические; водород (H), углерод (C), азот (N), кислород (O), фосфор (P), сера (sulfer) (S), селен (Se) (здесь может принадлежать Uuo) и благородные газы образуют относительно небольшая группа со ступенчатым узором в левой части таблицы Менделеева (водород является нечетным
Итак, если мы включим группу неметаллов, галогены и благородные газы, все элементы, которые являются неметаллами, будут:
- Водород (иногда)
- Карбон.
- Азот.
- Кислород.
- Фосфор.
- Сера.
- Селен.
- Фтор.
Металлоиды; бор (B), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Te), полоний (Po) и астатин (At) — элементы, расположенные вдоль ступенчатой линии между металлами. и неметаллы периодической таблицы.
Термин «металл и неметаллы» используется для обозначения элементов.Пластик — это не элемент, а полимер, состоящий из различных неметаллов, таких как углерод, водород, кислород, азот и т. Д. Некоторые пластики можно легко деформировать, а другие не могут и поэтому ломаются, когда их заставляют сгибаться. Они известны как термореактивные пластмассы.
Вода содержит водород и кислород, оба неметаллы, но мы бы не сказали, что вода неметалл. Он содержит элементы, углерод и водород, связанные друг с другом, и когда он сгорает, связи разрываются и образуются новые связи с кислородом, образуя воду и углекислый газ.
Что такое литий, металл, неметалл или металлоид? Литий — это самый легкий металл в периодической таблице с атомным номером 3. (Чуть больше, чем у водорода и гелия!)
Натрий — это химический элемент с символом Na (от латинского natrium) и атомным номером 11. Натрий — это щелочной металл, входящий в группу 1 периодической таблицы, поскольку у него есть единственный электрон на внешней оболочке, который он легко отдает , создавая положительно заряженный ион — катион Na +.Его единственный стабильный изотоп — 23Na.
Неметалл или неметалл — это химический элемент, не обладающий свойствами металла. Неметалл также является хорошим изолятором тепла и холода. Обычно неметаллами являются газы или хрупкие твердые вещества. Элементы в таблице Менделеева можно разделить на металлические, полуметаллические и неметаллические.
10 самых драгоценных металлов в мире
- Родий. Этот чрезвычайно редкий, ценный металл серебристого цвета обычно используется из-за его отражающих свойств.
- Платина. Платина зарекомендовала себя благодаря своей пластичности, плотности и неагрессивным свойствам.
- Золото.
- Рутений.
- Иридиум.
- Осмий.
- Палладий.
- Рений.
Неметаллические элементы:
- Водород.
- Карбон.
- Азот.
- Кислород.
- Фосфор.
- Сера.
- Селен.
Дерево определенно неметалл. Он состоит из смеси сложных молекул. Дерево неметаллическое. Металлы пластичные, пластичные, звонкие, хорошо проводят тепло и электричество.
Алмаз — это не металл, а всего лишь аллотроп углерода. Он не показывает никаких физических свойств или химических свойств металлов, таких как электропроводность, пластичность, пластичность, реакция с кислотами или солями и т. Д. Углерод на самом деле неметалл, если верить таблице Менделеева.

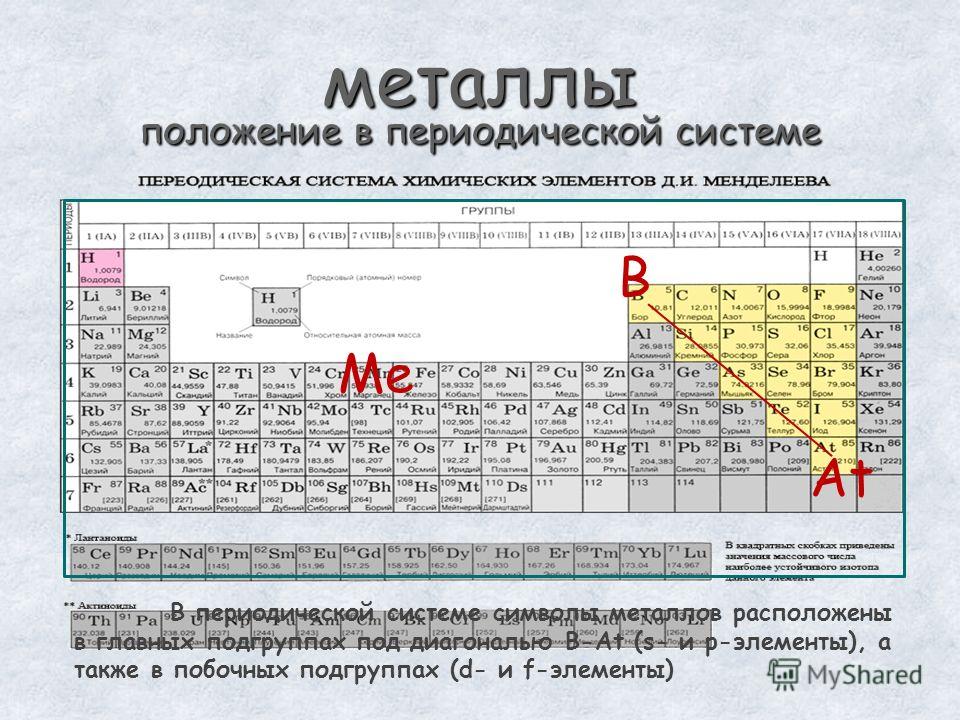 Например, они не податливы, у них относительно низкая плотность, они тусклые, плохо проводят тепло и электричество и т. Д.
Например, они не податливы, у них относительно низкая плотность, они тусклые, плохо проводят тепло и электричество и т. Д.