Содержание
Примеры реакций в жизни и в быту. Реакции по направлению процесса
1. Примеры реакций в жизни и в быту Реакции по направлению процесса
Яковлева Анастасия 9П-11
2. Обратимые и необратимые химические реакции Обратимые реакции :
Обратимые реакции — химические реакции, протекающие одновременно в двух
противоположных направлениях (прямом и обратном), например:
3h3 + N2 ⇆ 2Nh4
Направление обратимых реакций зависит от концентраций веществ — участников
реакции. По завершении обратимой реакции, т. е. при достижении химического
равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих
одновременно элементарных реакций, которые отличаются одна от другой лишь
направлением химического превращения. Направление доступной непосредственному
наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных
реакций имеет большую скорость. Например, простая реакция
Например, простая реакция
N2O4 ⇆ 2NO2
складывается из элементарных реакций
N2O4 ⇆ 2NO2 и 2NO2 ⇆ N2O4
Для обратимости сложной (многостадийной) реакции, необходимо, чтобы были
обратимы все составляющие её стадии.
Для обратимых реакций уравнение принято записывать следующим образом А + В АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же
условиях одновременно протекает как прямая, так и обратная реакция, например
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О
3. Пример обратимой реакции
4. Необратимые химические реакции
Необратимыми называют такие химические процессы,
продукты которых не способны реагировать друг с другом с
образованием исходных веществ. Примерами необратимых
реакций может служить разложение бертолетовой соли при
нагревании
2КСlО3 > 2КСl + ЗО2,
Необратимыми называются такие реакции, при протекании
которых:
1) образующиеся продукты уходят из сферы реакции выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + h3O
2) образуется малодиссоциированное соединение, например
вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии,
например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
какие реакции называются обратимыми а какие необратимыми? приведите примеры
Пожалуйста помогите срочно
Определите вид химической связи и укажите степени окисления каждого элемента в соединении
Al4C3, CaCO3, Ba(OH)2, Cl2, KBr,
…
Li3N, OF2, Ch5, Al, Fe2O3, FeF3, Na4C, Cu2O, Zn(NO)3, O2, Fe2(SO4)3, K2SiO3, P2O3, N2O5, HNO2, P4, Cu
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Ca (в степени 2+)+SO3 (в степени 2-)=CaSO3(
…
осадок)
1) СаО
2) Ca
3) CaCl2
4) K2SO3
5) Н2SO3
6) SO2
Запишите номера выбранных ответов.
В реакцию с каждым из растворов CuSO4 и Na2CO3 вступают
1) соляная кислота
2) гидроксид натрия
3) хлорид бария
4) нитрат алюминия
5) бромид кальция
6)
…
гидроксид меди(II)
Одно дерево за сутки в среднем превращает в углеводы углекислый газ массой 55г. Какая масса глюкозы при этом образуется?
Вычислите массовые доли Карбона(углерода) и воды в а) глюкозе б) в сахарозе. В каком из этих веществ больше Карбона, а в каком — воды?
Напишите пожалуйста реферат о «Менделееве»
CccccccррррррооооооччччччнннннноооооКристаллогидраты – это вещества, в состав которых входят соли и молекулы воды. По данным элементного химического а
…
нализа в составе кристаллогидрата массовая доля калия составляет 14,05 %, магния – 8,65 %, хлора – 38,34 %. Определи:а) число атомов калия в кристаллогидрате;б) число атомов магния в кристаллогидрате;в) число атомов хлора в кристаллогидрате;г) число молекул воды в кристалллогидрате.
Через точку М, що не належить прямій а: 1)провести пряму b, паралельну прямій а2) прямую m, перпендикулярну прямій а
1) введите химическую формулу вещества X
2) введите химическую формулу вещества Y
1. Какая масса хлороводородной кислоты расходуется на нейтрализацию 0,02 мольркальций гидроксида?2. Какая масса натрия гидроксида расходуется на нейтр
Какая масса хлороводородной кислоты расходуется на нейтрализацию 0,02 мольркальций гидроксида?2. Какая масса натрия гидроксида расходуется на нейтр
…
ализацию 0,1 моль сульфатной кислоты?
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов / Справочник :: Бингоскул
В химии есть обратимые и необратимые химические реакции. Они протекают по разному принципу и имеют свои особенности. Равновесие в реакции способно смещаться под воздействием определенных факторов.
Обратимые и необратимые химические реакции
Обратимые реакции – это процессы, которые протекают одинаково в обоих направлениях. Например:
- А+В=С+D (прямая),
- С+D=A+B (обратная).
Реакции протекают при одинаковых условиях, образуют продукты равных объемах.
Необратимые реакции характеризуются процессом, который протекает в одном направлении, практически до конца. В продуктах всегда образуется нерастворимое соединение или газ, либо слабый электролит. Например: С+О2=СО2. Поскольку углекислый газ является летучим веществом, то разложить его на кислород и углерод невозможно.
В продуктах всегда образуется нерастворимое соединение или газ, либо слабый электролит. Например: С+О2=СО2. Поскольку углекислый газ является летучим веществом, то разложить его на кислород и углерод невозможно.
Важно! Горение и взрывы в химии являются необратимыми процессами.
Химическое равновесие
Химическое равновесие – это состояние химических веществ, при котором устанавливается одинаковая скорость протекания процессов прямой и обратной стороны. Смещать равновесие можно воздействием температуры, давления или увеличением концентрации одного из веществ.
Равновесными называются реакции, в которых скорость прямой реакции равна скорости обратной реакции. То есть, образование продуктов происходит со скоростью расходования реагентов. Состояние равновесия характерно для любой обратимой реакции.
Равновесные реакции имеют одинаковые концентрации веществ. Рассмотрим подробный пример:
А+В=С+D – обратимая реакция. При взаимодействии веществ правой стороны их концентрация снижается, что снижает и скорость. Соответственно концентрация веществ левой стороны увеличивается. Постепенно эти показатели выравниваются и становятся равновесными. Это и называется равновесием.
Константа равновесия
Исходя из равновесия химических реакций, находят, что концентрации действующих веществ и полученных веществ остаются равными. Это называется равновесными концентрациями.
Константа равновесия является химическим выражением, описывающим закон действующих масс для равновесных систем. Для каждого реагента и продукта реакции обозначают равновесную концентрацию: [A], [B], [C], [D]. Каждое значение возводят в степень равную коэффициенту, находящемуся перед веществом.
K равн= [C]x×[D]y/[A]a×[B]b
От наличия в реакции катализатора значение остается неизменным. Он способен ускорить уравновешивание скорости и концентраций.
Катализатор – вещество, которое ускоряет ход как прямой, так и обратной реакции и на смещение химического равновесия влияния не оказывает.
Важно! Для каждого химического процесса константа равновесия является постоянным неизменным значением.
Смещение химического равновесия под действием различных факторов
О подвижности равновесия говорили ученые еще в XIX веке. В то же время активно проводились исследования, чтобы доказать свои предположения. Анри Ле-Шателье был первым, кто попытался рассказать об этом в своих трудах. Позже его исследования обобщил Карл Браун. Принцип Ле-Шателье говорит о:
Если на систему, находящуюся в равновесии оказывается влияние, то равновесие смещается в ту сторону, которое ослабляет это влияние
Влияние температуры
В обратимых реакциях прямая и обратная сторона процесса противоположны по температуре друг другу. В зависимости от температурного коэффициента реакции подразделяются на экзотермические (температура в процессе реакции выделяется). При повышении температуры в такой системе равновесие будет смещаться в сторону обратной реакции.
S +O2 = SO2 +Q
Эндотермические реакции (которые протекают при нагревании) наоборот, если нагревать такую реакцию, то будет протекать быстрее прямая реакция.
CaCO3 = CO2 + CaO — Q
Это значит, если в прямой стороне наблюдается показатель +Q-экзотермический процесс, то в обратной будет –Q – эндотермический процесс. Если увеличить температуру исходных продуктов, то химическое равновесие сместиться в ту сторону, в которой наблюдается пониженная температура.
Влияние концентрации
По принципу Ле-Шателье, увеличение концентрации реагентов вызывает смещение равновесие в сторону, где они расходуются, в прямом процессе. А если концентрация веществ понижается, то химическое равновесие снижается в сторону обратных процессов.
Такой же принцип действует и на увеличение концентрации продуктов реакции. Химическое равновесие смещает в ту сторону, где происходит расход реагентов, значит в сторону обратной реакции. Если концентрацию продуктов понизить, то равновесие сместиться в сторону прямого процесса.
Влияние давления
Давление меняет равновесие не во всех процессах. Это происходит в реакциях с газообразными продуктами. Сумма коэффициентов прямой и обратной реакции должны быть неравными.
Сумма коэффициентов прямой и обратной реакции должны быть неравными.
Важно! На состояние равновесия процессов с твердыми веществами давление не влияет.
При разной концентрации газообразных веществ слева и справа реакции, повышение давления приведет к смещению химического равновесия. Смещается в ту сторону, где количество газообразных веществ уменьшается, а показатели давления повышаются.
Влияние катализатора
Большинство химических реакций происходит под действием катализаторов. Это специальные добавки, в виде соединений и комплексов, которые ускоряют процесс образования продуктов. Их добавление никак не влияет на химическое равновесие. В некоторых процесс способствует быстрому уравновешиванию сторон.
Таблица химического равновесия
Т |
|
р |
|
с |
|
катализатор | Не влияет |
Обозначения:
- Т-температура,
- р-давление,
- с-концентрация,
- ↑-повышение,
- ↓-понижение.

Смотри также:
Что такое необратимые химические реакции. Обратимые и необратимые реакции — Гипермаркет знаний. Химическое равновесие. Принцип Ле–Шателье
Состояние равновесия характерно для обратимых химических реакций.
- Обратимая реакция — химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях.
- Необратимой называется реакция, которая идет практически до конца в одном направлении. Условия необратимости реакции – образование осадка, газа или слабого электролита. Например:BaCl 2 + H 2 SO 4 = BaSO 4 + 2HClK 2 S + 2HCl = 2KCl + H 2 SHCl + NaOH = NaCl + H 2 O.
- Химическое равновесие — состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются. Смещение равновесия в нужном направлении достигается изменением условий реакции.
Смещение равновесия в нужном направлении достигается изменением условий реакции.
Принцип Ле-Шателье
— внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
>> Химия: Обратимые и необратимые реакции
СО2+ h3O = h3CO3
Оставим полученный раствор кислоты стоять в штативе. Через некоторое время мы увидим, что раствор снова стал фиолетовым, так как кислота разложилась на исходные вещества.
Это процесс можно провести гораздо быстрее, если подо треть раствор угольной кислоты. Следовательно, реакция получения угольной кислоты протекает как в прямом, так н в обратном направлении, то есть является обратимой. Обратимость реакции обозначается двумя противоположно направленными стрелками:
Среди обратимых реакций, лежащих в основе получения важнейших химических продуктов, в качестве примера назо вем реакцию синтеза (соединения) оксида серы (VI) из оксида серы (IV) и кислорода.
1. Обратимые и необратимые реакции.
2. Правило Бертолле.
Запишите уравнения реакций горения, о которых говорилось в тексте параграфа, зияя, что в результате этих реакций образованы оксиды тех элементов, из которых построены исходные вещества.
Дайте характеристику трех последних реакций, проведенных а конце параграфа, по плану: а) характер и число реагентов и продуктов; б) агрегатное состояние; в) направление: г) наличие катализатора; д) выделение или поглощение теплоты
Какая неточность допущена в предложенной в тексте параграфа записи уравнения реакции обжига известняка?
Насколько справедливо утверждение, что реакции соединения будут, как правило, зкзотермическими реакциями? Обоснуйте свою точку зрения, пользуясь приведенными в тексте учебника фактами.
Содержание урока
конспект урока
опорный каркас
презентация урока
акселеративные методы
интерактивные технологии
Практика
задачи и упражнения
самопроверка
практикумы, тренинги, кейсы, квесты
домашние задания
дискуссионные вопросы
риторические вопросы от учеников
Иллюстрации
аудио-, видеоклипы и мультимедиа
фотографии, картинки
графики, таблицы, схемы
юмор, анекдоты, приколы, комиксы
притчи, поговорки, кроссворды, цитаты
Дополнения
рефераты
статьи
фишки для любознательных
шпаргалки
учебники основные и дополнительные
словарь терминов
прочие
Совершенствование учебников и уроков
исправление ошибок в учебнике
обновление фрагмента в учебнике
элементы новаторства на уроке
замена устаревших знаний новыми
Только для учителей
идеальные уроки
календарный план на год
методические рекомендации
программы
обсуждения
Интегрированные уроки
План изложения.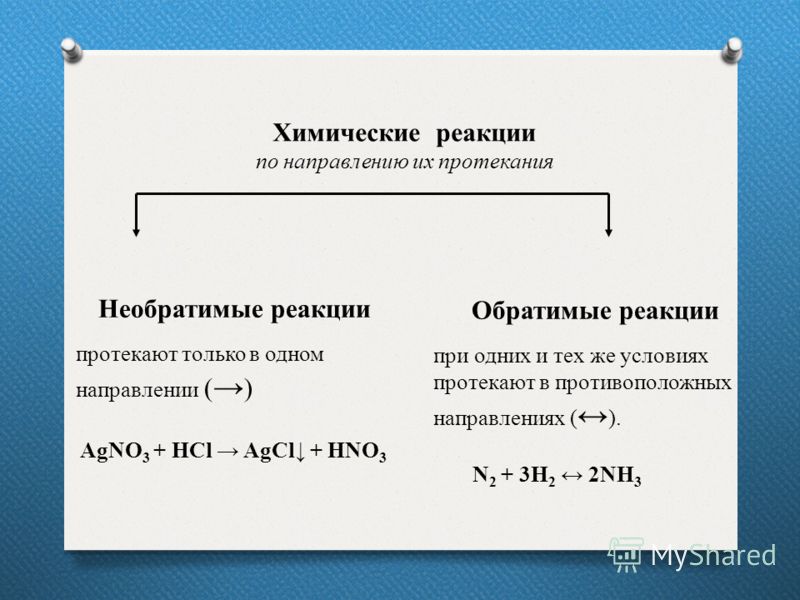
1.Реакции обратимые и необратимые. Признаки необратимости.
2. Химическое равновесие. Константа химического равновесия.
3.Факторы, вызывающие смещение химического равновесия. Принцип Ле Шателье. Эксперимент.
4. Применение Принципа Ле Шателье.
5. Решение заданий ЕГЭ.
Скачать:
Предварительный просмотр:
Ход урока
I. Организационный момент.
II
Актуализация знаний учащихся
(Слайд 4).
1
.
Определение скорости химической реакции.
2
.
Формулы выражения скорости и единицы измерения скорости: а) гомогенной реакции; б) гетерогенной реакции.
3
.
Перечислите факторы, влияющие на скорость химической реакции
.
4.
Как зависит скорость химической реакции от концентрации?
5
. Какие вещества называются катализаторами? Ингибиторами? В чем отличие их действия на скорость химической реакции? Значение катализаторов и ингибиторов на производстве, в жизни живых организмов.
6.
Что нужно знать о химической реакции, чтобы определить ее скорость?
III. Изучение нового материала
(Слайд 5).
План изложения.
1.
Реакции обратимые и необратимые. Признаки необратимости.
2.
Химическое равновесие. Константа химического равновесия.
3.
Факторы, вызывающие смещение химического равновесия. Принцип Ле Шателье. Эксперимент.
4.
Применение Принципа Ле Шателье.
5.
Решение заданий ЕГЭ.
Все химические реакции делятся на обратимые и необратимые.
(Слайд 6).
- Необратимые химические реакции – это реакции, протекающие в одном направлении до полного превращения реагирующих веществ в продукты реакции.
Например:
Na
2
SO
4
+ BaCl
2
à
BaSO
4
↓
+ 2NaCl
Необратимая реакция заканчивается тогда, когда полностью расходуется хотя бы одно из исходных веществ. Необратимыми являются реакции горения; многие реакции термического разложения сложных веществ; большинство реакций, в результате которых образуются осадки или выделяются газообразные вещества, и др. (Слайд
(Слайд
7).
CuCl
2
+ 2KOH=
Cu(OH)
2
↓
+2KOH – выпал осадок
Na
2
CO
3
+ 2HCl=2NaCl + H
2
O +
CO
2
– образовался слабый электролит, который разлагается на воду и углекислый газ.
H
2
SO
4
+ 2KOH = K
2
SO
4
+
2H
2
O
– образовалась вода – очень слабый электролит.
- Обратимые химические реакции – это реакции, одновременно протекающие в прямом и обратном направлениях в одних и тех же условиях.
Например:
H
2
+ I
2
↔ 2HI (1)
CaCO
3
↔ CaO + CO
2
(2)
Рассмотрим уравнение реакции синтеза йодоводорода из водорода и йода (Ур-е 1).
Через некоторое время после начала химической реакции в газовой смеси можно обнаружить не только конечные продукты реакции
HI
, но и исходные вещества –
H
2
и
I
2
.
Как бы долго не продолжалась химическая реакция, в реакционной смеси при 350°C всегда будет содержаться приблизительно 80% HI, 10% H
2
и 10% I
2.
Если в качест — ве исходного вещества взять HI и нагреть его до той же температуры, то можно обнаружить, что через некоторое время соотношение между количествами всех трех веществ будет таким же. Таким образом, при образовании йодоводорода из водорода и йода одновременно осу — ществляются прямая и обратная реакции.
Таким образом, при образовании йодоводорода из водорода и йода одновременно осу — ществляются прямая и обратная реакции.
Если в качестве исходных веществ взяты водород и йод в концентрациях и , то скорость прямой реакции в начальный момент времени была равна:
V
пр
=k
пр
.
Скорость обратной реакции
V
обр
=k
обр
²
в начальный момент времени равна ну- лю, так как йодоводород в реакционной смеси отсутству-ет. Постепенно скорость прямой реакции уменьшается, т.к. водород и йод вступают в реакцию и их концентра — ции понижаются.
При этом скорость обратной реакции увеличивается, потому что концентрация образующегося йодоводорода постепенно возрастает. Когда скорости прямой и обратной реакции станут одинаковыми, насту — пает химическое равновесие. В состоянии равновесия за определенный промежуток времени образуется столько же молекул HI ,
сколько их
распадается на
и .
Состояние обратимого процесса, при котором скорости прямой и обратной реакций равны, называют химическим равновесием.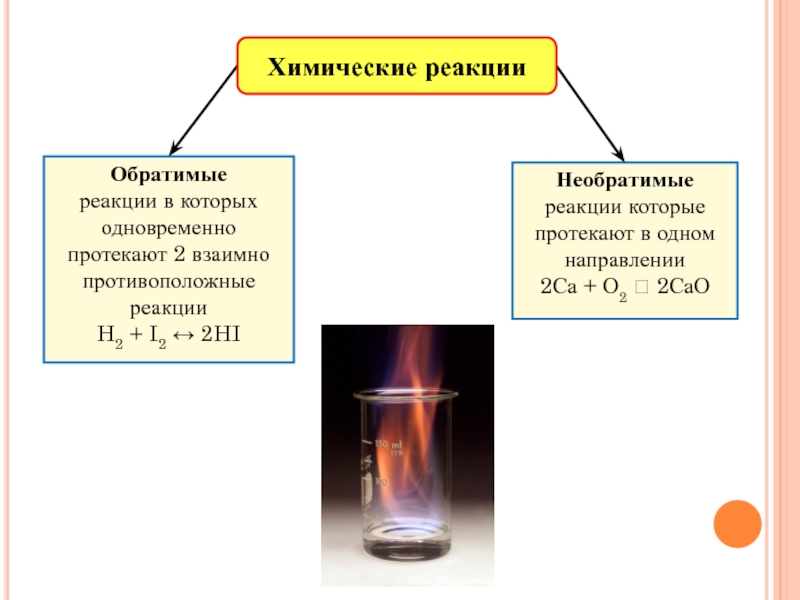
(Слайд 8, 9).
динамическим равнове —
сием
.
В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но т. к. скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются
равновесными
концентрациями.
Состояние химического равновесия характеризуется особой величиной –
константой равновесия
.
Для нашего примера константа равновесия имеет вид:
Кравн =²/
- Константа равновесия k равна отношению констант скоростей прямой и обратной реакции, или отношению
произведению равновесных концентраций продуктов и реагентов, возведенных в степени, равные коэффициентам в уравнении реакции.
Величина константы равновесия определяется приро — дой реагирующих веществ, и зависит от температуры. (Слайд 10).
Величина константы равновесия характеризует полноту протекания обратимой реакции. Если Кравн1, исходных реагентов в равно- весной системе практически не остается, равновесие смещено вправо. (Слайд 11).
Химическое равновесие является
подвижным
и может сохраняться долго при неизменных внешних условиях:
температуры, концентрации исходных веществ или конечных продуктов, давления
(если в реакции участвуют газы).
Если изменить эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям.
Такой переход называется
смещением
или
сдвигом
равновесия
. (Слайд 12).
Управление смещения можно предсказать, пользуясь принципом
Ле Шателье, 1884г.
Историческая справка.
Анри Луи Ле Шателье (1850- 1936), французский ученый — химик, занимался исследованиями процессов протекания химических реакций.
Принцип смещения равновесий — самое известное, но далеко не единственное научное достижение Ле Шателье.
Его научные исследования обеспечили ему широкую известность во всем мире. Он дожил до 86 лет.
(Слайд13)
.
- Известен всюду на Земле Анри Луи Де Шателье. Он не был королем и принцем, Зато открыл прекрасный принцип, Который химикам полезен
Для
сдвигов всяких равновесий.
- Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменить давление, концентрацию ве-ществ или температуру), то равновесие сместится в сторону преимущественного протекания того процесса, который ослабляет произведенное воздействие.
Принцип Ле Шателье — это принцип «вредности», принцип «наоборот». (Слайд 14) .
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются: а) концентрация реагирующих веществ;
б) температура;
в) давление.
Влияние концентрации реагирующих веществ.
Если в равновесную систему вводится какое – либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое – либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
Например
, рассмотрим, какие вещества следует вводить и какие выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо:
N
2(г)
+ H
2(г)
↔ 2 NH
3(г)
Для смещения равновесия вправо (в сторону прямой реак — ции образования аммиака) необходимо в равновесную смесь вводить азот и водород (т. е. увеличить их концентрации) и выводить из равновесной смеси аммиак (т.е. уменьшить его концентрацию).
е. увеличить их концентрации) и выводить из равновесной смеси аммиак (т.е. уменьшить его концентрацию).
Выводы:
(Слайд 15).
А) если увеличиваем концентрацию конечных продуктов, равновесие смещается в сторону образования исходных продуктов, т.е. преобладает обратная реакция.
Б) увеличиваем концентрацию исходных продуктов, равновесие смещается в сторону образования конечных продуктов, преобладает прямая реакция.
В) при уменьшении концентрации конечных продуктов реакция равновесия смещается в сторону их образования, преобладает прямая реакция.
Г) при уменьшении концентрации исходных продуктов реакции, преобладает обратная реакция
.
(Эксперимент (видео опыт) «Влияние концентрации реагирующих веществ на смещение химического равновесия») (Слайд 16)).
Влияние температуры.
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермичес – кая, то обратная реакция эндотермическая (и наоборот).
При нагревании системы (т. е. повышении ее температуры) равновесие смещается в сторону эндотер — мической реакции; при охлаждении (понижении тем — пературы) равновесие смещается в сторону экзотерми — ческой реакции.
е. повышении ее температуры) равновесие смещается в сторону эндотер — мической реакции; при охлаждении (понижении тем — пературы) равновесие смещается в сторону экзотерми — ческой реакции.
Например
, реакция синтеза аммиака является экзотерми-ческой:
N
2(г)
+ H
2(г)
→
2 NH
3(г)
+ 92
кДж,
а реакция разложения аммиака является
(обратная
реакция) является эндотермической:
2 NH
3(г)
→
N
2(г)
+ H
2(г)
— 92
кДж.
Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Выводы:
(Слайд 17).
А) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции.
Б) при понижении температуры химическое равновесие смещается в сторону экзотермической реакции.
(Эксперимент (видео опыт) «Влияние температуры на смещение химического равновесия») (Слайд 19)).
Влияние давления.
Давление влияет на равновесие реакции, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается.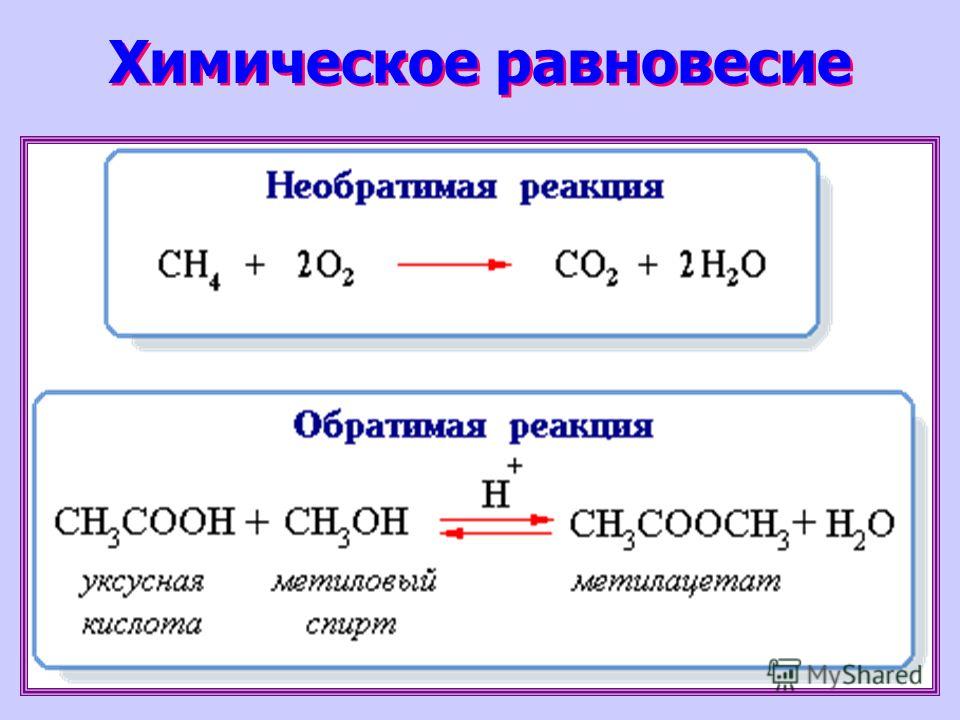 И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа газообразных веществ, то давление не влияет на равновесие в данной системе.
И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа газообразных веществ, то давление не влияет на равновесие в данной системе.
Например
:
для
увеличения выхода аммиака
(смещение
вправо
)
необходимо повышать давление
в системе обратимой реакции
N
2(г)
+ H
2(г)
↔ 2 NH
3(г)
,
т.к.
при протекании прямой реакции
число
газообразных молекул
уменьшается (из четырех молекул газов азота и водорода образуются две молекулы газа аммиака).
Выводы:
(Слайд 17).
- А) при увеличения давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов уменьшается.
- Б) при уменьшении давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов увеличивается.
Пример: 3H
2
+ N
2
↔ 2NH
3
- в) если объемы газообразных продуктов одинаковы как в прямой, так и в обратной реакции — изменение давления не оказывает смещения равновесия.

Пример: Н
2
+ Cl
2
=2HCl
2V=2V
(Эксперимент (видео опыт) «Влияние давления на смещение химического равновесия») (Слайд 18)).
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химического процесса, которые обеспечивают максимальный выход желаемого вещества.
(Слайд 20,21).
IV. Закрепление
(Слайд 22).
- Химик толкает реакцию в спину: «Давай-ка тебя я немного подвину!» Она отвечает: «Ты знаешь меня: Ни часа, ни дня не могу без огня! И чтобы улучшить мое настроение, Прошу, даже требую: выше давление! К тому же учти: я – такая реакция, Что мне реагентов важна концентрация». И химик подумал: «Теперь мне все ясно. Тепло поглощаешь – и это прекрасно! Как только под колбой зажгутся горелки, Ступай-ка, реакция, прямо по стрелке.
 Вот это цветочки, но будут и фрукты — Повысит давление выход продукта! Еще концентрация…Да, ты права: Побольше я выдам тебе вещества». Реакция стала работать послушно, Продукт образуя полезный и нужный. Такой вот привиделся химику сон. Какие же выводы сделает он?
Вот это цветочки, но будут и фрукты — Повысит давление выход продукта! Еще концентрация…Да, ты права: Побольше я выдам тебе вещества». Реакция стала работать послушно, Продукт образуя полезный и нужный. Такой вот привиделся химику сон. Какие же выводы сделает он?
V. Обобщение и выводы.
Таким образом, на данном уроке мы более углубленно изучили химическое равновесие — которое может возникнуть в обратимых химических реакциях, а также получили представление о факторах, вызывающих смещение химического равновесия в сторону прямой или обратной реакции, экспериментально убедились в этом.
VI
. Решение заданий ЕГЭ (часть А).
(Слайд 23,24).
1.
Условие необратимости химического превращения.
А) образование слабого электролита
Б) поглощение большого количества теплоты
В) взаимодействие слабого и сильного электролитов
Г) ослабление окраски раствора.
2.
Для смещения равновесия в системе
CaCO
3(т)
↔ CaO
(т)
+ CO
2(т)
– Q
В сторону продуктов реакции необходимо
А) увеличить давление б) увеличить температуру
В) ввести катализатор г) уменьшить температуру
3.
При увеличении давления химическое равновесие не смещается в системе
А) 2H
2
S
(г)
+ 3O
2(г)
= 2H
2
O
(г)
+ 2SO
2(г)
Б) 2H
2(г)
+ O
2(г)
= 2H
2
O
(г)
В) H
2(г)
+ I
2(г)
= 2HI
(г)
Г) SO
2(г)
+ CL
2(г)
= SO
2
CL
2(г)
4.
Верны ли следующие суждения о смещении химического равновесия в системе
2CO
(г)
+ O
2(г)
↔ 2CO
2(г)
+ Q ?
А. При понижении давления химическое равновесие в данной системе сместится в сторону продукта реакции.
Б. При увеличении концентрации углекислого газа химическое равновесие системы сместится в сторону продукта реакции.
а) верно только А в) верны оба суждения
б) верно только Б г) оба суждения неверны
5
. В системе
2SO
2(г)
+ O
2(г)
↔ 2SO
3(г)
+ Q
Смещению химического равновесия в сторону исходных веществ будет способствовать
а) уменьшение давления
б) уменьшение температуры
в) увеличение концентрации SO
2
г) уменьшение концентрацииSO
3
6.
Химическое равновесие в системе
C
4
H
10
(г)
↔ C
4
H
6(г)
+ 2H
2(г)
-Q
сторону обратной реакции, если
А) повысить температуру
Б) уменьшить концентрацию H
2
В) добавить катализатор
Г) повысить давление
А теперь проверьте правильность своих ответов. (Слайд 25).
1 –
а
2 –
б
3 –
в
4 –
а
5 –
а
6 –
г
VII.
§ 14, упр. 1-8. (Слайд 26).
Обратимость химических реакций.
Химическое равновесие.
11 класс
(профильный уровень)
Учитель химии МБОУ СОШ с.Кадгарон
Хетагурова Ф.А.
2012-2013 уч. год.
Используемая литература.
1.
О.С.Габриелян, Г.Г.Лысова «Химия» — М.: «Дрофа», 2009.
2.О.С.Габриелян, И.Г.Остроумов «Общая химия» — Олма-учебник, 2008.
3.
О.С.Габриелян, Г.Г.Лысова, А.Г.Введенская «Настольная книга учителя химии», ч.I, 11 кл. — М.: «Дрофа», 2009.
4.Т.П.Троегубов «Поурочные разработки по химии» — М.: «Вако», 2009.
5.А.С.Егоров «Репетитор по химии» — «Феникс», 2008.
6.С.А.Литвинова, Н.В.Манкевич «Неорганическая химия. Весь школьный курс в таблицах» — Минск: «Современная школа: Кузьма», 2009.
7.А.Н.Левкин, А.А.Карцова, С.Е.Домбровская, Е.Д.Крутецкая «Химия:ЕГЭ: Учебно-справочные материалы. (Серия «Итоговый контроль:ЕГЭ») – М.;СПб.:Просвещение, 2011.
8.Г.П.Хомченко «Пособие по химии для поступающих в ВУЗы» — М.: «Новая волна».,2004.
9.В.Н.Доронькин,А.Г.Бережная, Т.В.Сажнева, В.А.Февралева «Химия.Тематические тесты.Подготовка к ЕГЭ» — Ростов-на-Дону «Легион», 2010.
10.Д.М.Добротин,А.А.Каверина,М.Г.Снастина «ЕГЭ-2011 . Химия: типовые экзаменационные варианты: 30 вариантов.» — ФИПИ,М.; «Национальное образование». 2011.
Обратимость химических реакций. Химическое равновесие.
11 класс
Основные понятия: Обратимые и необратимые химические реакции, химическое равновесие, равновесные концентрации, константа равновесия, скорость реакции, принцип Ле Шателье. Оборудование: раствор F eCl 3; KNCS; KCl ; крахмальный клейстер; пробирки, вода, спиртовка,держатель.
Ход урока. Фронтальный опрос 1. Определение скорости химической реакции. 2. Формулы выражения скорости и единицы измерения скорости: а) гомогенной реакции; б)гетерогенной реакции. 3. Перечислите факторы, влияющие на скорость химической реакции. 4. Как зависит скорость химической реакции от концентрации? 5. Какие вещества называются катализаторами? Ингибиторами? В чем отличие их действия на скорость химической реакции? Значение катализаторов и ингибиторов на производстве, в жизни живых организмов. 6. Что нужно знать о химической реакции, чтобы определить ее скорость?
Изучение нового материала. План изложения. 1.Реакции обратимые и необра-тимые. Признаки необратимости 2. Химическое равновесие. Константа химического равнове-сия. 3.Факторы, вызывающие смеще-ние химического равновесия. Принцип Ле Шателье. Эксперимент. 4. Применение Принципа Ле Шателье. 5. Решение заданий ЕГЭ.
Обратимые и необратимые реакции. Обратимые химические реакции – это реакции, одновременно протека – ющие в прямом и обратном направлениях в одних и тех же условиях. Например: H 2 + I 2 ↔ 2HI CaCO 3 ↔ CaO + CO 2 Необратимые химические реакции –это реакции, протекающие в одном направлении до полного превращения реагирующих веществ в продукты реакции. Например: Na 2 SO 4 +BaCl 2 BaSO 4 ↓ + 2NaCl
Например: H 2 + I 2 ↔ 2HI CaCO 3 ↔ CaO + CO 2 Необратимые химические реакции –это реакции, протекающие в одном направлении до полного превращения реагирующих веществ в продукты реакции. Например: Na 2 SO 4 +BaCl 2 BaSO 4 ↓ + 2NaCl
Признаки необратимости. CuCl 2 + 2KOH= Cu(OH) 2 ↓ +2KOH – выпал осадок Na 2 CO 3 + 2HCl=2NaCl + H 2 O + CO 2 – образовался слабый электролит, который разла– гается на воду и углекислый газ. H 2 SO 4 + 2KOH = K 2 SO 4 + 2H 2 O – образовалась вода – очень слабый электролит.
Химическое равновесие. Вернемся к обратимой реакции водорода с парами йода. В соответствии с законом действующих масс кинетическое уравнение прямой реакции имеет вид: V пр = k пр С течением времени скорость прямой реакции уменьшается, т.к. исходные вещества расходуются. В то же время с накоплением в системе йодоводорода увеличивается скорость реакции его разложения: V обр = k обр [ HI] ² В любой обратимой реакции рано или поздно наступит такой момент, когда скорости прямого и обратного процессов становятся равными.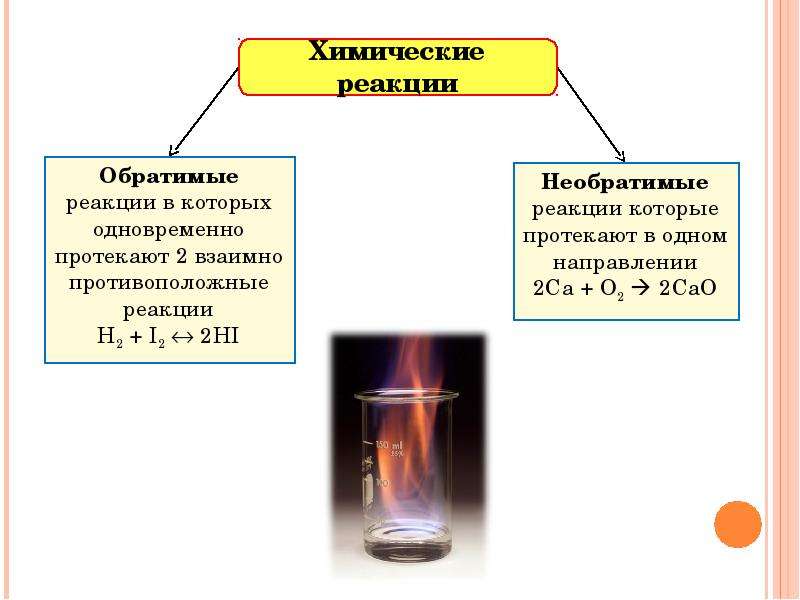 Состояние обратимого процесса, при котором скорости прямой и обратной реакций равны, называют химическим равновесием.
Состояние обратимого процесса, при котором скорости прямой и обратной реакций равны, называют химическим равновесием.
Константа химического равновесия. Состояние химического равновесия характеризуется особой величиной – константой равновесия. Для нашего примера константа равновесия имеет вид: К равн = ² / Константа равновесия k равна отношению констант скоростей прямой и обратной реакции, или отношению произведению равновесных концентраций продуктов и реагентов, возведенных в степени, равные коэффициентам в уравнении реакции. Величина константы равновесия определяется природой реаги- рующих веществ, и зависит от температуры.
Величина константы равновесия характеризует полноту протекания обрати- мой реакции. Если К равн 1 , исходных реагентов в равно- весной системе практически не остается, равновесие смещено вправо.
Факторы, вызывающие смещение химического равновесия. Состояние химического равновесия может сохранять-ся долго при неизменных внешних условиях: температуры, концентрации исходных веществ или конечных продуктов, давления (если в реакции участвуют газы). Если изменить эти условия, можно перевести систему из одного равновесного состояния в другое, отвечаю- щее новым условиям. Такой переход называется смещением или сдвигом равновесия. Управление смещения можно предска- зать, пользуясь принципом Ле Шателье, 1884г.
Если изменить эти условия, можно перевести систему из одного равновесного состояния в другое, отвечаю- щее новым условиям. Такой переход называется смещением или сдвигом равновесия. Управление смещения можно предска- зать, пользуясь принципом Ле Шателье, 1884г.
Историческая справка. Анри Луи Ле Шателье (1850- 1936), французский ученый- химик, занимался исследова-ниями процессов протекания химических реакций. Принцип смещения равнове-сий- самое известное, но далеко не единственное на-учное достижение Ле Ша- телье. Его научные исследования обеспечили ему широкую известность во всем мире. Он дожил до 86 лет.
Принцип Ле Шателье. Известен всюду на Земле Анри Луи Де Шателье. Он не был королем и принцем, Зато открыл прекрасный принцип, Который химикам полезен Для сдвигов всяких равновесий. Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменить давление, концентрацию ве-ществ или температуру), то равновесие сместится в сторону преимущественного протекания того процесса который ослабляет произведенное воздействие. Принцип Ле Шателье- это принцип «вредности», принцип «наоборот».
Принцип Ле Шателье- это принцип «вредности», принцип «наоборот».
Изменение концентрации: А) если увеличиваем концентрацию конечных продуктов, рав- новесие смещается в сторону образования исходных продуктов, т.е. преобладает обратная реакция. Б) увеличиваем концентрацию исходных продуктов, равновесие смещается в сторону образования конечных продуктов, преоб-ладает прямая реакция. В) при уменьшении концентрации конечных продуктов реакция равновесия смещается в сторону их образования, преобладает прямая реакция. Г) при уменьшении концентрации исходных продуктов реакции, преобладает обратная реакция.
Влияние изменения давления. А) при увеличения давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов уменьшается. Б) при уменьшении давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов увеличивается. Пример: 3H 2 + N 2 ↔ 2NH 3 в) если объемы газообразных продуктов одинаковы как в прямой, так и в обратной реакции- изменение давления не оказывает смещения равновесия. Пример: Н 2 + Cl 2 =2HCl 2V=2V
Пример: Н 2 + Cl 2 =2HCl 2V=2V
Влияние изменения температуры. А) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции. Б) при понижении темпера- туры химическое равновесие смещается в сторону экзо- термической реакции. Пример: N 2(г) + H 2(г) →2 NH 3(г) +92 кДж, 2 NH 3(г) → N 2(г) + H 2(г) — 92 кДж.
Значение принципа Ле Шателье.
Производство аммиака и метанола.
Закрепление. Химик толкает реакцию в спину: «Давай-ка тебя я немного подвину! » Она отвечает: «Ты знаешь меня: Ни часа, ни дня не могу без огня! И чтобы улучшить мое настроение, Прошу, даже требую: выше давление! К тому же учти: я – такая реакция, Что мне реагентов важна концентрация». И химик подумал: «Теперь мне все ясно. Тепло поглощаешь – и это прекрасно! Как только под колбой зажгутся горелки, Ступай-ка, реакция, прямо по стрелке. Вот это цветочки, но будут и фрукты — Повысит давление выход продукта! Еще концентрация … Да, ты права: Побольше я выдам тебе вещества». Реакция стала работать послушно, Продукт образуя полезный и нужный. Такой вот привиделся химику сон. Какие же выводы сделает он?
Реакция стала работать послушно, Продукт образуя полезный и нужный. Такой вот привиделся химику сон. Какие же выводы сделает он?
Задания ЕГЭ. 1. Условие необратимости химического превращения. а) образование слабого электролита б) поглощение большого количества теплоты в) взаимодействие слабого и сильного электролитов г) ослабление окраски раствора. 2. Для смещения равновесия в системе CaCO 3(т) ↔ CaO (т) + CO 2(т) – Q в сторону продуктов реакции необходимо а) увеличить давление б) увеличить температуру в) ввести катализатор г) уменьшить температуру 3. При увеличении давления химическое равновесие не смещается в системе а) 2H 2 S (г) + 3O 2 (г) = 2H 2 O (г) + 2SO 2 (г) б) 2H 2 (г) + O 2 (г) = 2H 2 O (г) в) H 2 (г) + I 2 (г) = 2HI (г) г) SO 2 (г) + CL 2 (г) = SO 2 CL 2 (г)
4. Верны ли следующие суждения о смещении химического равновесия в системе 2CO (г) + O 2 (г) ↔ 2CO 2 (г) + Q ? А. При понижении давления химическое равновесие в данной системе сместится в сторону продукта реакции. Б. При увеличении концентрации углекислого газа химическое равновесие системы сместится в сторону продукта реакции. а) верно только А в) верны оба суждения б) верно только Б г) оба суждения неверны 5. В системе 2 SO 2 (г) + O 2 (г) ↔ 2SO 3 (г) + Q смещению химического равновесия в сторону исходных веществ будет способ- ствовать а) уменьшение давления в) увеличение концентрации SO 2 б) уменьшение температуры г) уменьшение концентрации SO 3 6. Химическое равновесие в системе C 4 H 10 (г) ↔ C 4 H 6 (г) + 2H 2 (г) -Q сторону обратной реакции, если а) повысить температуру в) добавить катализатор б) уменьшить концентрацию H 2 г) повысить давление
Б. При увеличении концентрации углекислого газа химическое равновесие системы сместится в сторону продукта реакции. а) верно только А в) верны оба суждения б) верно только Б г) оба суждения неверны 5. В системе 2 SO 2 (г) + O 2 (г) ↔ 2SO 3 (г) + Q смещению химического равновесия в сторону исходных веществ будет способ- ствовать а) уменьшение давления в) увеличение концентрации SO 2 б) уменьшение температуры г) уменьшение концентрации SO 3 6. Химическое равновесие в системе C 4 H 10 (г) ↔ C 4 H 6 (г) + 2H 2 (г) -Q сторону обратной реакции, если а) повысить температуру в) добавить катализатор б) уменьшить концентрацию H 2 г) повысить давление
Проверь себя! 1 – а 2 – б 3 – в 4 – а 5 – а 6 – г
Домашнее задание. § 14 , упр. 1-8.
Химические реакции, протекающие в одном направлении, называют необратимыми
.
Большинство химических процессов являются обратимыми
. Это значит, что при одних и тех же условиях протекают и прямая, и обратная реакции (особенно если речь идет о замкнутых системах).
Например:
а) реакция
в открытой системе необратима
;
б) эта же реакция
в замкнутой системе обратима
.
Химическое равновесие
Рассмотрим более подробно процессы, протекающие при обратимых реакциях, например, для условной реакции:
На основании закона действующих масс скорость прямой реакции
:
Так как со временем концентрации веществ А и В уменьшаются, то и скорость прямой реакции тоже уменьшается.
Появление продуктов реакции означает возможность обратной реакции, причем со временем концентрации веществ С и D увеличиваются, а значит, увеличивается и скорость обратной реакции
.
Рано или поздно будет достигнуто состояние, при котором скорости прямой и обратной реакций станут равными = .
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием
.
При этом концентрации реагирующих веществ и продуктов реакции остаются без изменения. Их называют равновесными концентрациями. На макроуровне кажется, что в целом ничего не изменяется. Но на самом деле и прямой, и обратный процессы продолжают идти, но с равной скоростью. Поэтому такое равновесие в системе называют подвижным и динамическим.
Их называют равновесными концентрациями. На макроуровне кажется, что в целом ничего не изменяется. Но на самом деле и прямой, и обратный процессы продолжают идти, но с равной скоростью. Поэтому такое равновесие в системе называют подвижным и динамическим.
Обозначим равновесные концентрации веществ [A], [B], [C], [D]. Тогда так как = , k 1 [A] α
[B] β
= k 2 [C] γ
[D] δ
, откуда
где α, β, γ, δ — показатели степеней, равные коэффициентам в обратимой реакции
; К равн — константа химического равновесия
.
Полученное выражение количественно описывает состояние равновесия
и представляет собой математическое выражение закона действующих масс для равновесных систем.
При неизменной температуре константа равновесия — величина постоянная для данной обратимой реакции
. Она показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Константы равновесия рассчитывают из опытных данных, определяя равновесные концентрации исходных веществ и продуктов реакции при определенной температуре.
Значение константы равновесия характеризует выход продуктов реакции, полноту ее протекания. Если получают К » 1, это означает, что при равновесии [C] γ
[D] δ
» [A] α
[B] β
, т. е. концентрации продуктов реакции преобладают над концентрациями исходных веществ, а выход продуктов реакции большой.
При К равн « 1 соответственно выход продуктов реакции мал. Например, для реакции гидролиза этилового эфира уксусной кислоты
константа равновесия:
при 20 °C имеет значение 0,28 (то есть меньше 1).
Это означает, что значительная часть эфира не гидролизовалась.
В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
Константы равновесия выражается так:
Значение константы равновесия зависит от природы реагирующих веществ и температуры.
От присутствия катализатора константа не зависит
, поскольку он изменяет энергию активации и прямой, и обратной реакции на одну и ту же величину. Катализатор может лишь ускорить наступление равновесия, не влияя на значение константы равновесия.
Состояние равновесия сохраняется сколь угодно долго при неизменных внешних условиях: температуре, концентрации исходных веществ, давлении (если в реакции участвуют или образуются газы).
Изменяя эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям. Такой переход называют смещением
или сдвигом равновесия
.
Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака:
Влияние изменения концентрации веществ
При добавлении в реакционную смесь азота N 2 и водорода H 2 увеличивается концентрация этих газов, а значит, увеличивается скорость прямой реакции
. Равновесие смещается вправо, в сторону продукта реакции, то есть в сторону аммиака NH 3 .
Равновесие смещается вправо, в сторону продукта реакции, то есть в сторону аммиака NH 3 .
N 2 +3H 2 → 2NH 3
Этот же вывод можно сделать, анализируя выражение для константы равновесия. При увеличении концентрации азота и водорода знаменатель увеличивается, а так как K равн. — величина постоянная, должен увеличиваться числитель. Таким образом, в реакционной смеси увеличится количество продукта реакции NH 3 .
Увеличение же концентрации продукта реакции аммиака NH 3 приведет к смещению равновесия влево, в сторону образования исходных веществ. Этот вывод можно сделать на основании аналогичных рассуждений.
Влияние изменения давления
Изменение давления оказывает влияние только на те системы, где хотя бы одно из веществ находится в газообразном состоянии. При увеличении давления уменьшается объем газов, а значит, увеличивается их концентрация.
Предположим, что давление в замкнутой системе повысили, например, в 2 раза. Это значит, что концентрации всех газообразных веществ (N 2 , H 2 , NH 3) в рассматриваемой реакции возрастут в 2 раза. В этом случае числитель в выражении для К равн увеличится в 4 раза, а знаменатель — в 16 раз, т. е. равновесие нарушится. Для его восстановления должна увеличиться концентрация аммиака и должны уменьшиться концентрации азота и водорода. Равновесие сместится вправо. Изменение давления практически не сказывается на объеме жидких и твердых тел, т. е. не изменяет их концентрацию. Следовательно, состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления
В этом случае числитель в выражении для К равн увеличится в 4 раза, а знаменатель — в 16 раз, т. е. равновесие нарушится. Для его восстановления должна увеличиться концентрация аммиака и должны уменьшиться концентрации азота и водорода. Равновесие сместится вправо. Изменение давления практически не сказывается на объеме жидких и твердых тел, т. е. не изменяет их концентрацию. Следовательно, состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления
.
Влияние изменения температуры
При повышении температуры скорости всех реакций (экзо- и эндотермических) увеличиваются. Причем повышение температуры больше сказывается на скорости тех реакций, которые имеют большую энергию активации, а значит, эндотермических
.
Таким образом, скорость обратной реакции (эндотермической) увеличивается сильнее, чем скорость прямой. Равновесие сместится в сторону процесса, сопровождающегося поглощением энергии.
Направление смещения равновесия можно предсказать, пользуясь принципом Ле Шателье
:
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Таким образом:
При увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
При увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
При увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
При повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
При понижении температуры — в сторону экзотермического процесса.
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химических процессов, которые обеспечивают максимальный выход желаемого вещества.
Справочный материал для прохождения тестирования:
Таблица Менделеева
Таблица растворимости
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца — до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях.
Рассмотрим два примера.
Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению:
При достаточном количестве азотной кислоты реакция закончатся только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении — пропускать диоксид азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится — данная реакция не может протекать в обратном направлении. Таким образом, взаимодействие цинка с азотной кислотой — необратимая реакция.
Таким образом, взаимодействие цинка с азотной кислотой — необратимая реакция.
Пример 2. Синтез аммиака протекает согласно уравнению:
Если смешать один моль азота с тремя молями водорода, осуществить в системе условия, благоприятствующие протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород). Если теперь в те же условия в качестве исходного вещества поместить не азото-водородную смесь, а аммиак, то можно будет обнаружить, что часть аммиака разложится на азот и водород, причем конечное соотношение между количествами всех трех веществ будет такое же, как в том случае, когда исходили из смеси азота с водородом. Таким образом, синтез аммиака — обратимая реакция.
В уравнениях обратимых реакций вместо знака равенства можно ставить стрелки; они символизируют протекание реакции как в прямом, так и обратном направлениях.
На рис. 68 показано изменение скоростей прямой и обратной реакций с течением времени. Вначале, при смешении исходных веществ, скорость прямой реакции велика, а скорость обратной ракцни равна нулю, По мере протекания реакции исходные вещества расходуются и их концентрации падают.
Рис. 63. Изменение скорости прямой и обратной реакции с течением времени .
В результате этого уменьшается скорость прямой реакции. Одновременно появляются продукты реакции, и их концентрация возрастает. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. Так, в последнем примере устанавливается равновесие между азотом, водородом и аммиаком.
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодо-водорода:
Согласно закону действия масс, скорости прямой и обратной реакций выражаются уравнениями:
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К):
Отсюда окончательно
В левой части этого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии- равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину.
Можно показать, что в общем случае обратимой реакции
константа равновесия выразится уравнением:
Здесь большие буквы обозначают формулы веществ, а маленькие — коэффициенты в уравнении реакции.
Таким образом, при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собою. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Численное значение константы равновесия в первом приближении характеризует выход данной реакции. Например, при выход реакции велик, потому что при этом
т. е. при равновесии концентрации продуктов реакции много больше концентраций исходных веществ, а это и означает, что выход реакции велик. При (по аналогичной причине) выход реакции мал.
В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс (см. § 58), входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
константа равновесия имеет вид:
Величина константы равновесия зависит от природы реагирующих веществ и от температуры. От присутствия катализаторов она не зависит. Как уже сказано, константа равновесия равна отношению констант скорости прямой и обратной реакции. Поскольку катализатор изменяет энергию активации и прямой, и обратной реакций на одну и ту же величину (см. § 60), то на отношение констант их скорости он не оказывает влияния.
От присутствия катализаторов она не зависит. Как уже сказано, константа равновесия равна отношению констант скорости прямой и обратной реакции. Поскольку катализатор изменяет энергию активации и прямой, и обратной реакций на одну и ту же величину (см. § 60), то на отношение констант их скорости он не оказывает влияния.
Поэтому катализатор не влияет на величину константы равновесия и, следовательно, не может ни увеличить, ни снизить выход реакции. Он может лишь ускорить или замедлить наступление равновесия.
Необратимые и обратимые реакции — HimHelp.ru
Примером/>/> такой/>/> реакции/>/> может/>/> служить/> разложение/>/> хлората/>/> калия/> (бертолетовой/>/> соли/>)/> при/> нагревании: />
2/>KClO 3/> = 2/>KCl + 3/>O 2/> ↑/>
Реакция/> прекратится/>/> тогда/>,/> когда/> весь/>/> хлорат/>/> калия/> превратится в хлорид/> калия/>/> и кислород/>. /> Необратимых/> />реакций/>/> не так много. Большинство/>/> реакций/> являются/> обратимыми. />
/> Необратимых/> />реакций/>/> не так много. Большинство/>/> реакций/> являются/> обратимыми. />
Обратимыми/> называются/> такие/>/> реакции/>,/> которые одновременно протекают в/> двух/>/> взаимно противоположных/> направлениях/>./>
В/>/> уравнениях/>/> обратимых/> реакций/>/> между/> левой/>/> и/>/> правой/> частями ставят две/> стрелки,/> направленные/> />в/> />противоположные/>/> стороны./> Примером/> такой/> реакции/>/> может/> служить/> синтез/> аммиака/> из/> водорода/> и азота:/>
,
∆/>H = -46,2 />кДж/> //> моль/>
В/>/> технике/> обратимые/> реакции/>,/> как/> правило,/> невыгодны./> Поэтому различными/>/> методами/> (изменение/> />температуры,/> давления/> и/>/> др.) их делают практически/> необратимыми. />
/>
Необратимыми/> называются/> такие/>/> реакции,/> при/> протекании/> />которых:/>
1) образующиеся/> />продукты/> />уходят/> />из/> />сферы реакции/> – выпадают/> в виде/> осадка,/> выделяются/> в виде/> />газа, например/>
ВаС/>l2 + />Н/> 2/>SО/> 4/> = />Ва/>SО4/>↓ + 2НС/>l
Na 2/>CO 3/> + 2/>HCl = 2/>NaCl + />CO2/> ↓/> + />H2/>O
2) образуется/> />малодиссоциированное соединение/>, например/> вода:/>
НС/>l + />NаОН/> =/> Н2О/> + />NаСl/>
3) реакция/>/> сопровождается/> большим/>/> выделением/> энергии,/> например/>/> горение/> магния/>
Mg/> + 1/2/> О/>2/> = />М/>gО, ∆/>H = -602,5 />кДж/> //> моль/>
В/> />уравнениях/> />необратимых реакций между/>/> левой/>/> и/> правой/>/> частями ставится/>/> знак/> равенства/> или/> стрелка. 3}$
3}$
Влияние изменения концентрации веществ
При добавлении в реакционную смесь азота $N_2$ и водорода $Н_2$ увеличивается концентрация этих газов, а значит, увеличивается скорость прямой реакции. Равновесие смещается вправо, в сторону продукта реакции, т.е. в сторону аммиака $NH_3$.
Этот же вывод можно сделать, анализируя выражение для константы равновесия. При увеличении концентрации азота и водорода знаменатель увеличивается, а так как $K_{равн.}$ — величина постоянная, должен увеличиваться числитель. Таким образом, в реакционной смеси увеличится количество продукта реакции $NH_3$.
Увеличение же концентрации продукта реакции аммиака $NH_3$ приведет к смещению равновесия влево, в сторону образования исходных веществ. Этот вывод можно сделать на основании аналогичных рассуждений.
Влияние изменения давления
Изменение давления оказывает влияние только на те системы, где хотя бы одно из веществ находится в газообразном состоянии. При увеличении давления уменьшается объем газов, а значит, увеличивается их концентрация.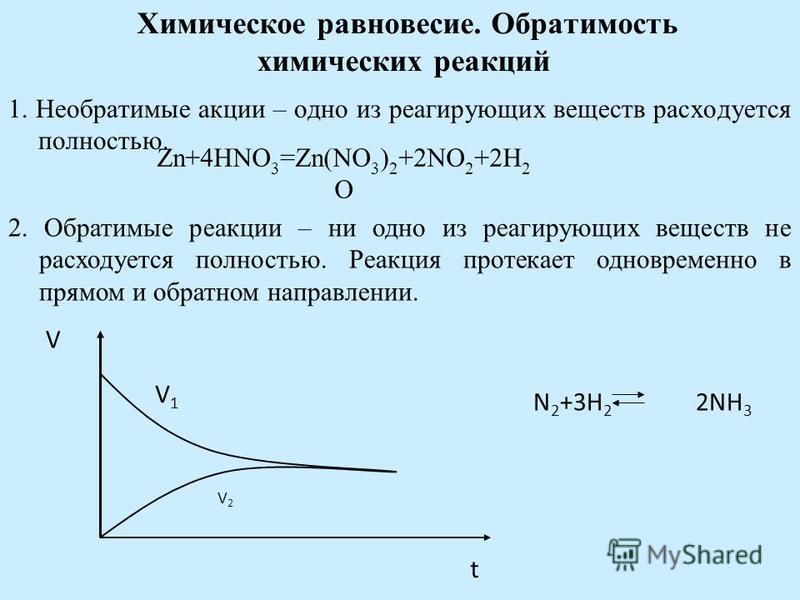
Предположим, что давление в замкнутой системе повысили, например, в $2$ раза. Это значит, что концентрации всех газообразных веществ ($N_2, H_2, NH_3$) в рассматриваемой нами реакции возрастут в $2$ раза. В этом случае числитель в выражении для $K_{равн.}$ увеличится в 4 раза, а знаменатель — в $16$ раз, т.е. равновесие нарушится. Для его восстановления должна увеличиться концентрация аммиака и должны уменьшиться концентрации азота и водорода. Равновесие сместится вправо. Изменение давления практически не сказывается на объеме жидких и твердых тел, т.е. не изменяет их концентрацию. Следовательно, состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления.
Влияние изменения температуры
При повышении температуры, как вы знаете, скорости всех реакций (экзо- и эндотермических) увеличиваются. Причем повышение температуры больше сказывается на скорости тех реакций, которые имеют большую энергию активации, а значит, эндотермических.
Таким образом, скорость обратной реакции (в нашем примере эндотермической) увеличивается сильнее, чем скорость прямой. Равновесие сместится в сторону процесса, сопровождающегося поглощением энергии.
Направление смещения равновесия можно предсказать, пользуясь принципом Ле Шателье (1884 г.):
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Сделаем выводы:
- при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
- при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
- при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
- при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
- при понижении температуры — в сторону экзотермического процесса.

Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химических процессов, которые обеспечивают максимальный выход желаемого вещества.
Классификация реакций, подготовка к ЕГЭ по химии
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
- Разложения
- Замещения
- Обмена
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно
сложное вещество. Примеры:
4Na + O2 = 2Na2O
P2O5 + 3H2O = 2H3PO4
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
Примеры:
2KMnO4 = K2MnO4 + MnO2 + 2O2
Сa(OH)2 = CaO + H2O
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
CuSO4 + Fe = FeSO4 + Cu
2KI + Cl2 = 2KCl + I2
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами.
Часто обмен происходит анионами/катионами:
2KOH + MgCl2 = Mg(OH)2↓ + 2KCl
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав
исходных веществ. ОВР подразделяются на:
ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
- Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
- Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K2SO3 + K2Cr2O7 + H2SO4 → K2SO4
+ Cr2(SO4)3 + H2O
KMnO4 → K2MnO4 + MnO2 + O2
KClO3 → KCl + O2
KOH + Cl2 → (t) KCl + KClO3 + H2O
KOH + Cl2 → KCl + KClO + H2O
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО,
принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив
эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном.
При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
N2 + 3H2 ⇆ 2NH3
CH3COOH + C2H5OH ⇆ CH3COOC2H5 + H2O
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от
Главное отличие их от
обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение.
В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl (выпадает осадок)
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому
составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой,
Фаза бывает жидкой,
твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на
границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество,
твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Zn(тв.) + 2HCl(р-р.) = ZnCl2(р-р.) + H2(газ.)↑
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером
Примером
такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
NaOH(р-р.) + CH3COOH(р-р.) = CH3COONa(р-р.) + H2O(р-р.)
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся
или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются
воспламенением или взрывом (натрий с водой).
- Экзотермические реакции
- Эндотермические реакции
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой
энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное
количество выделяющегося тепла. Например:
Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
4NH3 + 5O2 = 4NO + 6H2O + Q
Исключением является взаимодействие азота и кислорода, при
котором тепло поглощается:
N2 + O2 ⇄ 2NO — Q
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому
не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания»
Иногда с целью «запутывания»
в реакции вместо явного +Q при экзотермической реакции могут написать ΔH
2Na + 2H2O = 2NaOH + H2; ΔH
Эндотермические реакции (греч. ἔνδον — внутри) — химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются
вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).
К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят «-Q», либо указывают точное
количество поглощенной энергии. Примеры таких реакций:
2HgO = Hg + O2 — Q
CaCO3 = CaO + CO2↑ — Q
С целью «запутывания» может быть дана энтальпия, она при таких реакциях всегда: ΔH > 0, так как внутренняя
энергия веществ увеличивается. Например:
Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик»)
является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Обратимые и необратимые реакции | Забавная наука
Обычно мы обнаружили, что после того, как реагенты превращаются в продукт, продукт не может быть снова превращен в реагенты. Итак, эти реакции представлены одинарной стрелкой () между реагентами и продуктами. Например,
Кухонный газ (LPG), используемый на кухне, в основном представляет собой бутан, который при сжигании с воздухом выделяет в качестве продуктов углекислый газ и воду.
C 4 H 10 (г) + O 2 (г) CO 2 (г) + H 2 O (г) + тепло
В этой реакции мы не можем объединить диоксид углерода и воду для восстановления бутана, поэтому это необратимая реакция.
Эти реакции представлены двойной стрелкой () между реагентами и продуктами. Например,
1) Газообразный азот может реагировать с газообразным водородом с образованием аммиака. Эта реакция может быть представлена как:
N 2 (г) + 3H 2 (г) 2NH 3 (г)
Однако было обнаружено, что как только в вышеуказанной реакции образуется газообразный аммиак, он начинает распадаться на газообразный азот и газообразный водород в обратном направлении, как указано ниже:
2NH 3 (г) N 2 (г) + 3H 2 (г)
Теперь, потому что реакция идет в обоих направлениях i. е. в прямом и обратном направлении, поэтому мы заключаем, что эта реакция обратима по своей природе, и ее можно представить как:
е. в прямом и обратном направлении, поэтому мы заключаем, что эта реакция обратима по своей природе, и ее можно представить как:
N 2 (г) + 3H 2 (г) 2NH 3 (г)
2) Дегидратация гидратированной соли сульфата меди также является примером обратимой реакции. Химическая формула гидратированного сульфата меди: CuSO 4 .5H 2 O. В формуле сульфата меди присутствует 5 молекул кристаллизационной воды.Из-за наличия молекул воды в кристаллах сульфата меди его цвет синий
Когда мы нагреваем кристаллы сульфата меди, 5 молекул воды испаряются, а синие кристаллы сульфата меди меняют цвет на белый, как показано ниже:
Однако эту реакцию можно обратить вспять, если дать белым кристаллам сульфата меди остыть. При охлаждении кристаллы сульфата меди поглотят пары воды, присутствующие в воздухе, и снова появится синий цвет.
Итак, эту реакцию можно представить как:
3) Процесс транспортировки газообразного кислорода белком гемоглобином, присутствующим в крови в нашем организме, также является обратимой реакцией. Когда мы вдыхаем кислород в нашем теле, гемоглобин крови присоединяет газообразный кислород к себе, образуя в нашем теле комплекс, называемый оксигемоглобином. Затем эта насыщенная кислородом кровь достигает всех частей тела. Здесь этот оксигемоглобиновый комплекс разрушается, и кислород поступает в ткани и клетки организма.
Кислород + гемоглобин оксигемоглобин
Таким образом, мы заключаем, что транспортировка кислорода в нашем организме — обратимая реакция.
Примечания об обратимых и необратимых реакциях и химическом равновесии
Химическая реакция может быть обратимой или необратимой.
Необратимая химическая реакция:
При необратимой химической реакции реагенты объединяются с образованием продуктов, но эти продукты не могут производить реагенты в аналогичных условиях.
Все реагенты полностью реагируют с образованием продуктов.
Пример:
Обратимая химическая реакция
В обратимой химической реакции реагенты объединяются, образуя продукты, и эти продукты вступают в реакцию внутри самих себя, снова образуя реагенты.
Поскольку продукты и реагенты постоянно вступают в реакцию, обратимые реакции никогда не доходят до состояния завершения.
Пример:
В обратимой реакции прямая реакция: превращение реагентов в продукты часто бывает неполной даже после того, как реакция протекает в течение длительного времени.
Рассмотрим обратимую реакцию с реагентами
Первоначально прямая реакция протекает с высокой скоростью, при этом реагенты превращаются в продукты. Как только продукт образуется, они снова начинают реагировать с образованием реагентов, тем самым начиная обратную реакцию. В этом случае обратная реакция происходит с высокой скоростью, а прямая реакция замедляется.
По прошествии длительного времени достигается стадия, когда и прямая, и обратная реакции происходят с одинаковой скоростью.
Равновесие бывает двух типов: физическое и химическое.
Когда между физическими формами химического вещества существует равновесие, это называется физическим равновесием.
Пример: разжижение льда в воду
Когда в химической реакции существует равновесие, это называется химическим равновесием. Это динамическое равновесие, что означает, что в замкнутой системе протекает непрерывная реакция.
Пример:
Реакция хлорида железа с раствором тиоцианата аммония.
Условия химического равновесия:
Химическая реакция должна происходить в закрытом сосуде.
Химическая реакция должна быть обратимой.
Скорость прямой реакции и обратной реакции должны быть равны.
Такие факторы, как концентрация, давление и температура компонентов, которые влияют на химическое равновесие, должны оставаться постоянными.
Факторы, влияющие на химическое равновесие:
Химическое равновесие зависит от многих факторов, таких как концентрация, давление и температура.Все эти факторы объясняются на основе принципа Ле Шателье.
Согласно принципу Ле Шателье, если система в состоянии равновесия подвергается напряжению, то равновесие всегда будет двигаться таким образом, чтобы уменьшить напряжение.
В обратимой реакции увеличение концентрации реагентов способствует прямой реакции, тогда как увеличение концентрации продуктов способствует обратной реакции.
В обратимой реакции увеличение давления способствует реакции, в которой количество молей уменьшается.В реакции, в которой реагенты и продукты имеют равное количество молей, на равновесие не влияет какое-либо изменение давления.
Понижение температуры способствует эндотермической реакции, тогда как повышение температуры способствует экзотермической реакции.
Получение аммиака в процессе Габера — одно из применений принципа Ле Шателье. Здесь приведены условия, благоприятные для этой реакции.
Равновесие
Равновесие
Равновесие
Что такое равновесие?
Когда химическая реакция происходит в замкнутой системе, которая предотвращает ввод или удаление любого из компонентов, участвующих в реакции, количество этих химикатов изменяется по мере того, как одни расходуются, а другие образуются.
В конце концов это изменение прекратится, после чего реакционный состав останется неизменным до тех пор, пока система не будет нарушена. В этом случае говорят, что система находится в состоянии равновесия или, проще говоря, «в равновесии». Химическая реакция находится в равновесии, когда нет тенденции к изменению количества реагентов и продуктов .
Направление, в котором мы пишем химическую реакцию (и, таким образом, какие компоненты считаются реагентами, а какие продукты), произвольно.Возьмите следующие два уравнения:
Na 2 CO 3 + CaCl 2 -> CaCO 3 + 2 NaCl и CaCO 3 + 2 NaCl -> Na 2 CO 3 + CaCl 2
Они представляют собой одну и ту же систему химических реакций, в которой роли компонентов меняются, и обе дают одну и ту же смесь компонентов, когда изменение завершено. Последний пункт является центральным в концепции химического равновесия.Не имеет значения, с каких реагентов мы начинаем; как только реакция завершится, количества этих двух компонентов будут одинаковыми. В общем, тогда мы можем сказать, что состав химической реакционной системы будет иметь тенденцию изменяться в направлении, которое приближает его к равновесному составу. После достижения этого равновесного состава никаких дальнейших изменений в количествах компонентов не произойдет, пока система остается нетронутой.
Состояние равновесия не зависит от направления, с которого оно достигается.
Что такое обратимая реакция?
Большинство химических реакций обратимы. Что это значит? Это означает, что продукты химической реакции при определенных условиях могут быть объединены для преобразования реагентов. В 1045 году мы узнали в основном о реакциях, которые продолжаются до завершения. Эти реакции считаются необратимыми, потому что энергия, которая потребовалась бы для обращения вспять процесса прямой реакции, недопустима.
Примеры «необратимых» реакций:
- Реакции осаждения
- Сильные кислотно-щелочные реакции (образование воды, ковалентного соединения)
- Сильные окислительно-восстановительные реакции
- Образование газообразного продукта
Все остальные реакции можно считать обратимыми.
Запись выражений равновесия:
- Даже если химические реакции, которые достигают равновесия, происходят в обоих направлениях, реагенты в правой части уравнения считаются «продуктами» реакции, а реагенты в левой части уравнения считаются « реагенты «.
- Продукты реакции всегда указываются над строкой в числителе.
- Реагенты всегда записываются под чертой в знаменателе.
- Для гомогенных систем выражение константы равновесия содержит член для каждого реагента и каждого продукта реакции.
- Числитель выражения константы равновесия — это произведение концентраций «продуктов» реакции в степени, равной коэффициенту для этого компонента в сбалансированном уравнении реакции.
- Знаменатель выражения константы равновесия — это произведение концентраций «реагентов», возведенных в степень, равную коэффициенту для этого компонента в сбалансированном уравнении реакции.
Пример:
Константа равновесия (K c ):
Числовые значения констант равновесия связаны с природой реагентов и продуктов в реакции. Числовые значения для «K» взяты из экспериментов по измерению равновесных концентраций. Значение K указывает на равновесное отношение продуктов к реагентам. В равновесной смеси сосуществуют и реагенты, и продукты.
Large K> 1 товары в категории «избранные»
K = 1 ни реагенты, ни продукты не являются предпочтительными
Малые реагенты с K <1 "предпочтительны"
Термин «предпочтительный» означает, что сторона уравнения имеет большее число молей и более высокие концентрации, чем другая.
Как использовать равновесные концентрации для определения констант равновесия:
Какова константа равновесия следующей реакции?
2 NO 2 (г) <=> 2 N 2 O 4 (г)
Концентрации в состоянии равновесия [NO 2 ] = 0.025М; [N 2 O 4 ] = 0,0869M. Какова равновесная концентрация NO 2 , если концентрация N 2 O 4 составляет 0,12 моль / литр? Помните, что константа равновесия — это просто константа. Это не меняется.
Ответ:
Шаг 1: Запишите выражение равновесия:
Шаг 2: Подставьте равновесные концентрации в выражение равновесия. Если константа равновесия больше «1» Предпочтение отдается продуктам. Эта реакция имеет тенденцию к развитию продуктов.
Шаг 3: Теперь, когда значение K известно, задайте выражение для равновесия.
Шаг 4: Преобразуйте уравнение и решите относительно x 2 .
Стол ICE:
Таблица ICE или диаграмма ICE — это табличная система для отслеживания изменений концентраций в равновесной реакции.ICE расшифровывается как «Начальное, изменение, равновесие». Он используется в химии для отслеживания изменений количества вещества в реагентах, а также для организации набора условий, которые нужно решить.
Пример:
Для реакции AB <=> A + B таблица ICE будет выглядеть так:
XY | Х | Y | |
|---|---|---|---|
| Начальный | с 0 | 0 | 0 |
| Изменить | -х | + х | + х |
| Равновесие | в 0 — х | х | х |
Константа равновесия тогда будет рассчитана как
Это уравнение затем можно рассчитать как x 2 + Kx -Kc 0 = 0 или, если известна константа равновесия, то можно вычислить x.В любом случае это вычисление по квадратичной формуле .
Квадратичная формула:
Обзор решения задач с использованием константы равновесия
1. Напишите химическое уравнение и настройте таблицу ICE.
2. Начните заполнение таблицы ICE, записав начальную концентрацию каждого вида, указанного в задаче, реагентах и продуктах. (Заполните строку «I» — первую строку под химическим уравнением).
3. Заполните строку C таблицы ICE, изменение концентраций всех видов.
4. Заполните строку E таблицы ICE, концентрацию компонентов, когда система находится в равновесии.
5. Напишите выражение равновесия (это математическое уравнение) и подставьте равновесные концентрации, как они представлены в строке «E» в таблице ICE.
6. Делайте любые предположения, если это удобно.
7. Определите числовое значение x.
8. Проверьте все предположения, сделанные на шаге 6. Если предположение было неверным, используйте квадратное уравнение или метод последовательного предположения для определения x.
9. Используйте значение x, чтобы определить равновесные концентрации всех видов. Для этого следует использовать уравнения, записанные в строке E таблицы ICE.
10. Перечитайте задачу еще раз, чтобы убедиться, что вы ответили на все части вопроса, потому что к этому времени вы, возможно, уже полностью забыли цель проблемы!
Практические задачи:
Практические задачи
Напишите выражение равновесия для каждой из следующих реакций.
1) 3 O 2 <===> 2 O 3
2) N 2 + 3 H 2 <===> 2 NH 3
3) H 2 + I 2 <===> 2 HI
4) PCl 5 <===> PCl 3 + Cl 2
5) SO 2 + (1/2) O 2 <===> SO 3
Ответы
Что такое необратимые реакции Привести примеры по химии 11 класс CBSE
Подсказка: Поскольку мы знаем, что химическая реакция может быть реакцией, которая может привести к образованию продукта, и реакция не прекращается, скорее она может снова привести к реагентам, а также химическая реакция может быть такой, при которой образуются только продукты и реакция прекращается только тогда.
Полный ответ: Как известно, химическая реакция может быть обратимой и необратимой. В обратимых реакциях реагенты, а также продукты никогда полностью не расходуются в ходе реакции, а, скорее, они постоянно реагируют друг с другом и производятся. Другими словами, мы можем сказать, что реагенты образуют продукты, а продукты реагируют с образованием реагентов.
Но когда мы говорим о необратимых реакциях, как следует из названия, они не являются обратными по своей природе, что означает, что если реакция имеет место, она будет двигаться только в прямом направлении, и когда образуются конечные продукты, реакция автоматически останавливается.
Таким образом, мы можем сказать, что необратимые реакции являются однонаправленными, когда реагенты могут быть преобразованы в продукты, но продукты не могут быть преобразованы обратно в реагенты. Например: реакция горения является необратимой реакцией, которая включает сжигание органического соединения, такого как углеводород и кислород, с образованием диоксида углерода и молекул воды. Поскольку вода и углекислый газ являются стабильными молекулами, они не вступают в реакцию друг с другом с образованием кислорода и углеводорода.Мы можем представить эту реакцию как:
\ [{C_x} {H_y} + {O_2} \ to C {O_2} + {H_2} O \]
Примечание: Всегда помните, что обратимая реакция — это та, которая двунаправленный означает, что реакция может протекать как в прямом, так и в обратном направлении, а необратимая реакция является однонаправленной и протекает только в прямом направлении, и все количество реагентов расходуется на производство продуктов.
Примеры обратимой и необратимой реакции
Ответ:
Пояснение:
Необратимые реакции
: —
Некоторые химические реакции могут протекать только в одном направлении.Эти реакции называются необратимыми реакциями. Реагенты могут превратиться в продукты, но продукты не могут превратиться обратно в реагенты. Эти реакции похожи на приготовление торта. Ингредиенты пирога, такие как яйца и мука, являются реагентами. Их смешивают и выпекают, чтобы сформировать торт, который и является продуктом. Пирог нельзя «не испечь» или «несмешать», чтобы заменить его на сырые яйца, муку и другие ингредиенты. Так что приготовление торта необратимо.
Реакции горения обычно необратимы.Возгорание происходит всякий раз, когда горит топливо. В этом типе реакции топливо может соединяться с кислородом (в воздухе) и производить углекислый газ и водяной пар. Химическое уравнение реакции горения:
Топливо + O2 → CO2 + h3O
В реакции полного сгорания реагентами являются топливо и кислород, а продуктами — диоксид углерода и вода. Эти два продукта не могут реагировать с преобразованием топлива и кислорода, поэтому реакция необратима. Односторонняя стрелка в уравнении показывает, что реакция может идти только в одном направлении.
Обратимые реакции: —
Многие химические реакции могут протекать в обоих направлениях. Эти реакции называются обратимыми. Не только реагенты могут превратиться в продукты, но и продукты могут снова превратиться в реагенты, по крайней мере, при определенных условиях. Рассмотрим снова реакцию, в которой газообразный водород и газообразный кислород объединяются с образованием воды. Эта реакция обратима, если к производимой воде приложить электрический ток. Вы можете увидеть, как это делается, на рисунке ниже.Ток заставляет молекулы воды распадаться на отдельные атомы водорода и кислорода. Затем эти атомы рекомбинируют, образуя молекулы газообразного водорода и газообразного кислорода.
h3 + O2 —> h3O
это обратимая реакция
Необратимый процесс — обзор
5 Липиды в CAC, AVC и MVC: патогенные эффекторы и потенциальные терапевтические цели
Поскольку кальцификация является необратимым процессом, его предотвращение или уменьшение прогрессирования представляют собой основные цели будущих терапевтических планов.Гиперлипидемия, вероятно, оказывает как прямое, так и косвенное влияние на кальцификацию сосудов и модулирует как остеобластическую, так и остеокластическую активность [93,94]. Учитывая тесную взаимосвязь между липидами и сердечно-сосудистой кальцификацией, гиполипидемические статины, которые, как было показано, снижают сердечно-сосудистую смертность и другие неблагоприятные исходы, считаются эффективной целью уменьшения кальцификации.
Тем не менее, в последние годы многие клинические результаты свидетельствуют об обратном эффекте, по сути, о том, что статины могут способствовать кальцификации сосудов [20].И это несмотря на то, что сохраняются условия, согласно которым кальцификация сосудов увеличивает смертность от сердечно-сосудистых заболеваний, а статины снижают смертность от сердечно-сосудистых заболеваний. Этот конфликт, по-видимому, разрешается за счет наличия некоторых результатов, свидетельствующих о том, что статины могут положительно влиять на состав бляшки и / или что стимулирование кальцификации само по себе является механизмом положительного воздействия статинов на смертность, в частности, в отношении генерации Связанные со статинами макроскопические отложения кальция, связанные со стабильностью бляшек [20,95].Этот последний момент важен с учетом того факта, что использование статинов не показало какого-либо значительного влияния на кальцификацию или функциональность клапанов, особенно на средних и поздних стадиях заболевания [24,96].
Было высказано предположение, что статин, вероятно, оказывает двойное действие, которое, несомненно, включает противодействие прогрессированию атеросклеротического поражения и увеличению макроскопических отложений кальция. Это происходит за счет плейотропных эффектов, включая антиоксидантные и противовоспалительные свойства, а также сохранение функции эндотелия и целостности.Более того, статины могут также оказывать стабилизирующее действие, усиливая поляризацию макрофагов M2. Однако существует ли вероятность того, что те же связанные со статинами фиброкальцифические пути, способные предотвращать острые события на сосудистом уровне, с более высоким риском, когда они характеризуются богатыми липидами бляшками и воспалением, могут способствовать и ускорять патологическое ремоделирование створок клапана? характеризуется костно-подобными клетками и более минерализованными (рис. 4). В течение жизни кальцификация клапанов и атеросклероз прогрессируют медленно в течение длительного периода времени.На ранних стадиях обоих заболеваний, вероятно, возникновение и прогрессирование повреждения происходит по схожим механизмам, включая рекрутирование лейкоцитов, эндотелиальную дисфункцию и воспаление. Однако по мере прогрессирования заболевания прогрессирующие атеросклеротические поражения характеризуются накоплением липидов с умеренной минерализацией, большим накоплением пенистых клеток и воспалительной активностью, чем при кальцификации клапанов. Эти данные могут свидетельствовать о том, что, хотя ранние стадии прогрессирования заболевания схожи на уровне клапанов и сосудов, состояния на средних и поздних стадиях сохраняют различные характеристики и развиваются разными путями.Следовательно, пациенты с высоким риском атеросклероза или порока клапанов сердца могут получить пользу от назначения терапии статинами на ранних стадиях, но применение гиполипидемических и противовоспалительных статинов может быть неэффективным на поздних стадиях кальцификации клапанов. Это говорит о том, что конкретные целевые терапевтические подходы, вероятно, будут отличаться по мере развития этих двух заболеваний. Важно отметить, что эти различия между клапанами и сосудами, связанные с фиброкальцифическим ремоделированием, могут определять неверный расчет рисков и преимуществ терапевтической стратегии, такой как гиполипидемическая терапия.В частности, поскольку ИБС и АВК часто сосуществуют у одного и того же пациента, особенно с возрастом, использование хронических статинов может предотвратить острые коронарные и церебральные события, способствующие хронизации ИБС, но потенциально стимулирует прогрессирование от фиброза к кальцификации на уровне клапанов (рис. 4). ). Таким образом, в частности, в этой группе пациентов, при отсутствии (но ожидании) доступных биохимических маркеров, кальций-КТ остается наиболее надежным инструментом для оценки и отслеживания с течением времени бремени кальциевых бляшек, а также прогрессирования кальциевых клапанов в первичной профилактике. к оценке клапанной функции (ультразвуковая допплерография или магнитный резонанс), к подходу точной медицины и лучшему медицинскому обслуживанию пациентов (рис.4).
Рис. 4. Панель (A) возможные двойные эффекты статинов во время прогрессирования заболеваний кальцификации аорты и клапанов. Панель (B) Бессимптомный мужчина 75 лет с сосуществующими коронарными и клапанными кальцификациями и недостаточностью статинов. В этой группе пациентов, в отсутствие подтвержденных биохимических маркеров, бесконтрастный КТ-мониторинг кальция представляет собой основной инструмент для отслеживания прогрессирования кальция в коронарных и клапанных артериях с течением времени в двух анатомических участках для наилучшего ведения пациента.
В этом контексте известно, что липопротеин (а) (Lp (a)) усиливает окисление и несет в себе прокальцифицирующие и провоспалительные факторы (например,g., oxPL, аутотаксин, провоспалительный фермент) в места повреждения эндотелия [97]. В частности, большинство oxPL переносятся Lp (a). Однонуклеотидный полиморфизм (SNP) в локусе LPA, кодирующем Lp (a) (rs10455872), показал общегеномное значение для наличия кальцификации и стеноза аортального клапана [98]. Это наблюдение было последовательно подтверждено в других исследованиях [99–101]. Более того, у пациентов с уже существующей AVC высокий уровень Lp (a) является основным фактором более быстрого прогрессирования заболевания [102].Поскольку есть некоторые доказательства того, что статины могут повышать уровни Lp (a) и oxPL / apoB, низкая эффективность статинов в улучшении стеноза аортального клапана может быть связана с этими эффектами [103]. Таким образом, в этой ситуации возможно нацеливание на Lp (a) для терапевтического вмешательства [104].
К сожалению, текущие фармакологические средства, доступные для снижения Lp (a), очень ограничены, потому что доступные лекарства имеют неопределенную эффективность и не одобрены специально для снижения Lp (a). Некоторые доступные данные о снижающем эффекте ниацина и ингибиторов PCSK9 (пропротеинконвертаза субтилизин / кексин типа 9) на уровни Lp (a) предполагают, что эти препараты могут быть многообещающими также в качестве терапевтических средств против стеноза аортального клапана [105, 106].Более того, в недавнем исследовании (фаза I исследования) антисмысловой олигонуклеотид, нацеленный на мРНК Apo (a), был способен снижать уровни Lp (a) и oxPL дозозависимым образом, что предполагает его возможное применение в качестве нового потенциального дополнительного терапевтического инструмента. при заболевании аортального клапана [107]. В любом случае, поскольку теперь у нас есть лекарства, которые позволяют проверить, эффективны ли эти препараты в снижении высоких уровней Lp (a), мы также можем проверить в ближайшем будущем, действительно ли снижение Lp (a) защищает или полезно против кальцификации клапана аорты.
Страница не найдена | MIT
Перейти к содержанию ↓
- Образование
- Исследовать
- Инновации
- Прием + помощь
- Студенческая жизнь
- Новости
- Выпускников
- О MIT
- Подробнее ↓
- Прием + помощь
- Студенческая жизнь
- Новости
- Выпускников
- О MIT
Меню ↓
Поиск
Меню
Ой, похоже, мы не смогли найти то, что вы искали!
Попробуйте поискать что-нибудь еще!
Что вы ищете?
Увидеть больше результатов
Предложения или отзывы?
.
