Содержание
Урок 3. непредельные углеводороды – алкены — Химия — 10 класс
Химия, 10 класс
Урок № 3 Непредельные углеводороды – алкены
Перечень вопросов, рассматриваемых в теме
Урок посвящён непредельным углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека. В ходе урока учащиеся познакомятся с представителями данного класса органических веществ.
Глоссарий
Алкены – непредельные углеводороды ряда этилена, имеющие одну двойную углерод-углеродную связь
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся дуг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.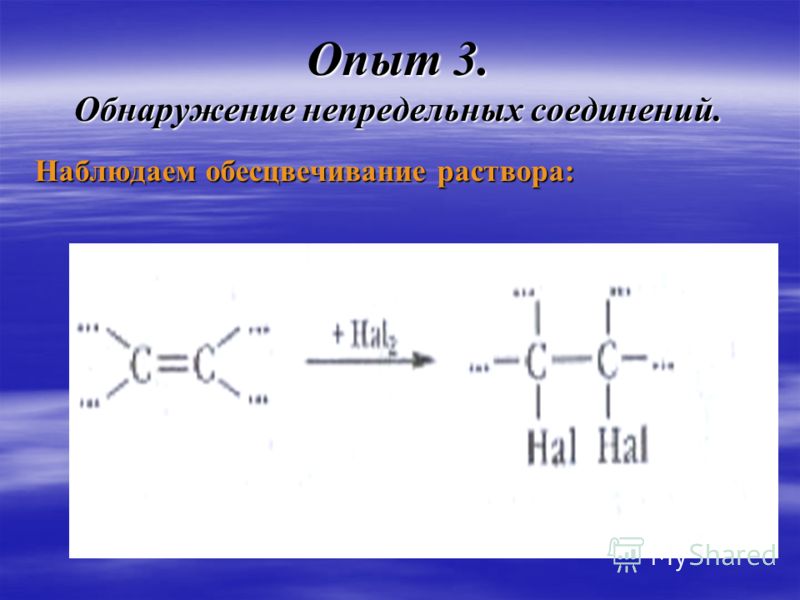
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Полимеризация – реакция, при которой одинаковые молекулы соединяются между собой в более крупную молекулу
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Формула структурная – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия.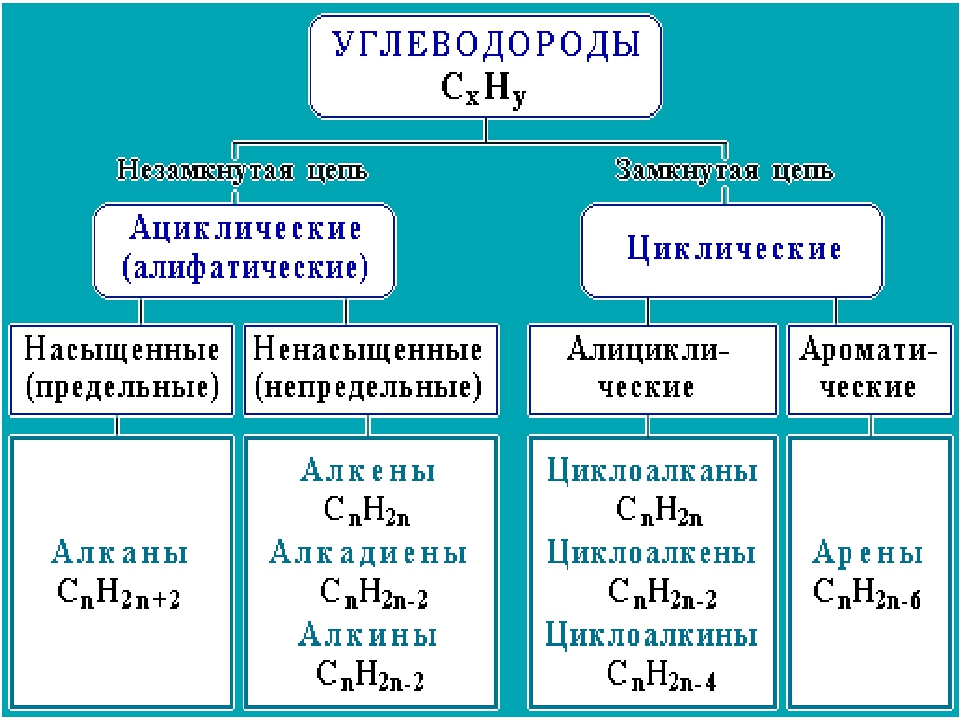 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется одна двойная углерод-углеродная связь. Общая формула алкенов СnH2n, где n≥2.
Простейшим представителем алкенов является этен, или этилен С2Н4.
Структурная формула этилена:
(сокращенная: СН2=СН2).
Особенности пространственного и электронного строения алкенов на примере молекулы этилена
Рассмотрим особенности электронного и пространственного строения алкенов на примере молекулы этилена. Все атомы углерода в молекуле этилена находятся в состоянии sp2-гибридизации. Три гибридных орбитали участвуют в образовании трех достаточно прочных сигма связей (по две связи у каждого атома углерода с атомами водорода и одна общая между собой). Оставшаяся негибридная р-орбиталь образует менее прочную пи-связь между атомами углерода. Таким образом, в молекуле этилена присутствуют 5 сигма-связей и одна пи-связь, причем двойная связь между атомами углерода образована одной сигма и и одно пи-связями. Наличие пи-связей в молекулах алкенов делает невозможным вращение атомов углерода друг относительно друга (имеются ввиду те атомы, при которых находится двойная связь)
Все атомы углерода в молекуле этилена находятся в состоянии sp2-гибридизации. Три гибридных орбитали участвуют в образовании трех достаточно прочных сигма связей (по две связи у каждого атома углерода с атомами водорода и одна общая между собой). Оставшаяся негибридная р-орбиталь образует менее прочную пи-связь между атомами углерода. Таким образом, в молекуле этилена присутствуют 5 сигма-связей и одна пи-связь, причем двойная связь между атомами углерода образована одной сигма и и одно пи-связями. Наличие пи-связей в молекулах алкенов делает невозможным вращение атомов углерода друг относительно друга (имеются ввиду те атомы, при которых находится двойная связь)
Каждый атом углерода в молекуле этилена имеет треугольное строение.
Номенклатура алкенов
Особенности номенклатуры алкенов заключаются в следующем:
1. Нумерация углеродной цепи начинается с того конца, где ближе расположена двойная связь
2. В конце названия изменяется суффикс -ан соответствующего предельного углеводорода на -ен или -илен, и, если это необходимо, указывается атом углерода, при котором находится двойная связь
Рассмотрим пример:
1. Нумерация главной цепи начинается слева направо, так как двойная связь ближе к левой части молекулы.
Нумерация главной цепи начинается слева направо, так как двойная связь ближе к левой части молекулы.
2. Называем радикал, расположенный у второго атома углерода: 2-метил
3. В главной цепи находится четыре атома углерода, следовательно, она соответствует предельному углеводороду – бутану.
4. Так как присутствует двойная связь, то суффикс – ан меняется на суффикс -ен и указывается положение двойной связи: бутен-1.
5. Соединяем суффикc с корнем и получаем название 2-матилбутен-1.
Гомология алкенов и изомерия алкенов.
Ближайшие гомологи этилена:
С3Н6 пропен (пропилен)
С4Н8 бутен (бутилен)
С5Н10 пентен (амилен)
Для алкенов характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Изомерия положения кратной связи
3. Пространственная геометрическая изомерия
4. Межклассовая (с циклоалканами)
Рассмотрим каждый вид изомерии на примере вещества состава С4Н8:
При построении структурной формулы данного вещества возможно расположение двойной связи как между первым и вторым атомами углерода, так и между вторым и третьим, тогда возможно получить две структурные формулы
Данный вид изомерии называется изомерией положения кратных связей.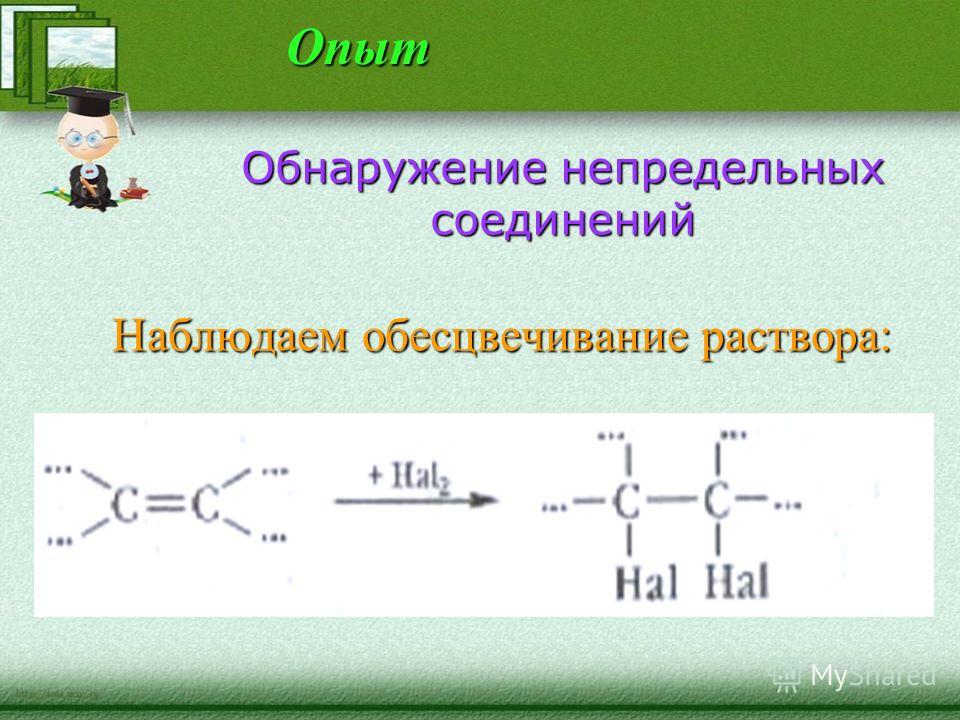
Для данного вещества возможно построить единственный разветвлённый изомер – изомер углеродного скелета – 2-метилпропен:
Межклассовый изомер бутена – циклобутан:
Также для бутена-2 возможно существование геометрических изомеров, это связано с тем, что метильная группа СН3— может располагаться относительно плоскости двойной связи в двух разных положениях, что приводит к образованию цис- (если эти группы расположены по одну линию связи) и транс-изомеров (если метильные группы расположены по разные линии связи):
Физические свойства алкенов
Этилен – бесцветный газ, почти без запаха, легче воздуха, плохо растворим в воде. Пропен и бутен – также газы. От пентена до октадецена – жидкости. Остальные – твердые вещества. Все агрегатные состояния указаны при нормальных условиях.
Способы получения алкенов
1. Внутримолекулярная дегидратация спиртов:
Данный способ является основным способом получения этилена в лабораторных условиях. Реакция протекает при температуре выше 140 градусов и в присутствии концентрированной серной кислоты, выполняющей роль катализатора. При дегидратации этанола получают этилен, а при дегидратации пропанола – пропилен:
Реакция протекает при температуре выше 140 градусов и в присутствии концентрированной серной кислоты, выполняющей роль катализатора. При дегидратации этанола получают этилен, а при дегидратации пропанола – пропилен:
2. Дегидрирование предельных углеводородов.
Данная реакция протекает при нагревании в присутствии катализаторов: никеля, платины, оксида хрома (III). При этом получают соответствующие алкены:
Химические свойства алкенов
Химические свойства алкенов обусловлены наличием в их молекулах двойных углерод-углеродных связей. Дело в том, что пи-связь, как было сказано ранее, является менее устойчивой, чем сигма связь. Поэтому при атаке её каким-либо реагентом она легко разрывается. Это объясняет основные химические свойства алкенов: они способны вступать в реакции присоединения и окисления.
Реакции присоединения
Гидрирование – присоединение водорода | Протекает при нагревании в присутствии катализаторов: платина, никель, оксид хрома (III). | |
Галогенирование – присоединение галогенов | Реакция протекает при обычных условиях. Продукт реакции – дигалогеналкан (1,2 — дибромэтан) | Признак реакции – обесцвечивание раствора брома, поэтому данную реакцию используют как качественную на двойную связь. |
Гидрогалогенирование – присоединение галогенводородов | Продукт реакции – галогеналкан (хлорэтан) | |
Гидратация – присоединение воды | Продукт реакции — спирт |
Реакция полимеризации
Полимеризация – реакция, при которой одинаковые молекулы соединяются в более крупные молекулы. | Условия реакции – высокая температура и давление Продукт реакции – полимер (полиэтилен) | Продукты реакции полимеризации используются для производства пластмасс и синтетических волокон |
Окисление
«Мягкое» — реакция Вагнера: взаимодействие с водным раствором перманганата калия | Продукт реакции – многоатомный спирт (этиленгликоль) | Признак реакции – обесцвечивание раствора перманганата калия , поэтому данную реакцию используют как качественную на двойную связь. |
Каталитическое – окисление кислородом в присутствии катализаторов | Продукт реакции – оксид алкена (оксид этилена) | |
Горение | Продуктами полного горения алкенов являются углекислый газ и вода |
Особенности реакций гидрогалогенирования и гидратации у пропилена и других гомологов этилена
Реакции присоединения галогеналканов и воды у гомологов этилена протекают по правилу Марковникова: водород присоединяется по месту разрыва двойной связи к более гидрированному атому углерода. Например, при присоединении хлороводорода к молекуле пропилена, образуется не 1-хлорпропан, а 2-хлорпропан:
Аналогично протекает реакция гидратации:
Применение этилена и его соединений
Производство пластмасс, взрывчатых веществ, антифриза, растворителей, синтетического каучука, ацетальдегида, для ускорения созревания плодов.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на нахождение массы раствора.

Масса 2%-го раствора бромной воды, которая вступает в реакцию с 2,24 л пропилена равна
Шаг первый: Составляем уравнение химической реакции С2Н4 + Br2 = C2H4Br2
Шаг второй: Находим количество вещества пропилена по формуле n=V\Vm= 2,24 л / 22,4 л/моль = 0,1 моль
Шаг третий: По уравнению реакции количество вещества пропилена равно количеству вещества брома: n(С2Н4)=n(Br2)=0,1 моль
Шаг четвёртый: Находим массу брома по формуле: m=Mn=160 г/моль*0,1 моль= 16 г
Шаг пятый: Находим массу раствора бромной воды по формуле: m (раствора)=m/ω = 16г / 0,02 = 800г
- Решение упражнения на химические свойства алкенов
Вставьте в таблицу пропущенные продукты реакции
H2 | Br2 | H2O | HCl | |
этилен | ||||
пропилен |
Варианты ответов: этан, пропан, бутан, 1,2-дибромэтан, 1,2-дибромпропан, 1,3-дибромпропан, этанол, пропанол-1, пропанол-2, хлорэтан, 1-хлорпропан, 2-хлорпропан.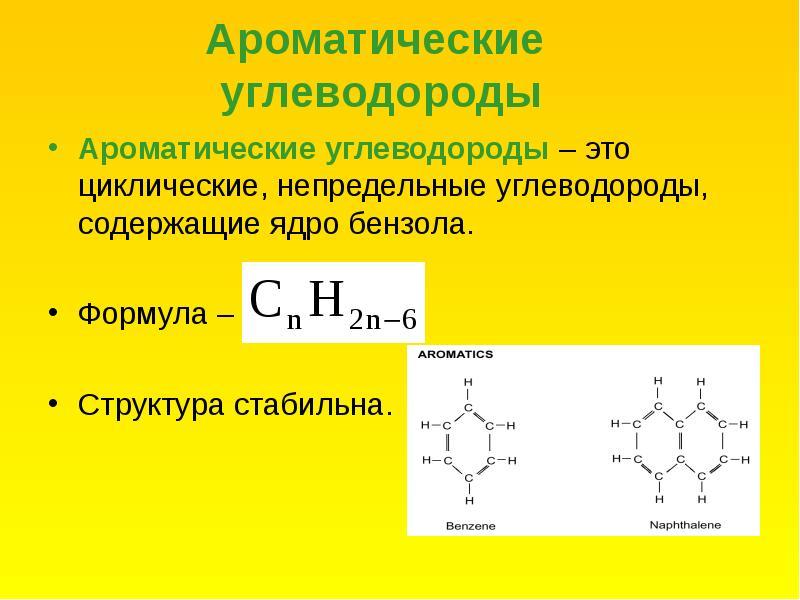
Решение:
Первый шаг: При гидрировании алкенов водородом образуются предельные углеводороды – алканы с соответствующим числом атомов углерода. Поэтому первая колонка заполняется продуктами реакции – этан и пропан:
Второй шаг: При галогенировании алкенов галогены, в данном случае бром, присоединяются по месту разрыва двойной связи, образуя дигалогенпроизводные, например:
Поэтому второй столбец заполняется следующими веществами: 1,2-дибромэтан, 1,2-дибромпропан.
Третий шаг: При гидратации (присоединении воды) образуются спирты. При реакции пропилена с водой важно помнить о правиле Марковникова, поэтому продуктами реакции будут этанол и пропанол-2:
4. При гидрогалогенировании алкенов продуктом реакции будут галогеналканы. И опять нужно помнить о правиле Марковникова для гидрогалогенирования пропилена:
Поэтому правильный ответ в этом задании: хлорэтан и 2-хлорпропан
Урок 29. непредельные (ненасыщенные) углеводороды.
 — Химия — 9 класс
— Химия — 9 класс
Непредельные углеводороды – это углеводороды, в молекулах которых имеются атомы углерода, связанные между собой двойными (алкены) и тройными (алкины) связями. Непредельные углеводороды также называют ненасыщенными, так как они содержат меньшее число атомов водорода, чем насыщенные
Алкены – непредельные углеводороды, в молекулах которых имеется одна двойная связь. Имеют общую формулу CnH2n, где n – больше или равно двум. Первый представитель – этен или этилен имеющий формулу C2H4. Этилен – газ без запаха, плохо растворим в воде. Применяется в синтезе полиэтилена, уксусной кислоты, этилового спирта, используется в сельском хозяйстве для ускорения созревания плодов.
Алкены, за счет наличия двойной связи в молекулах, являются реакционноспособными веществами.
1. Легко вступают в реакции присоединения:
а). c галогенами, например, с бромом: C2H4 + Br2 → C2H4Br2 (дибромэтан)
Признаком данной реакции является обесцвечивание раствора брома, поэтому данная реакция используется как качественная на двойную связь.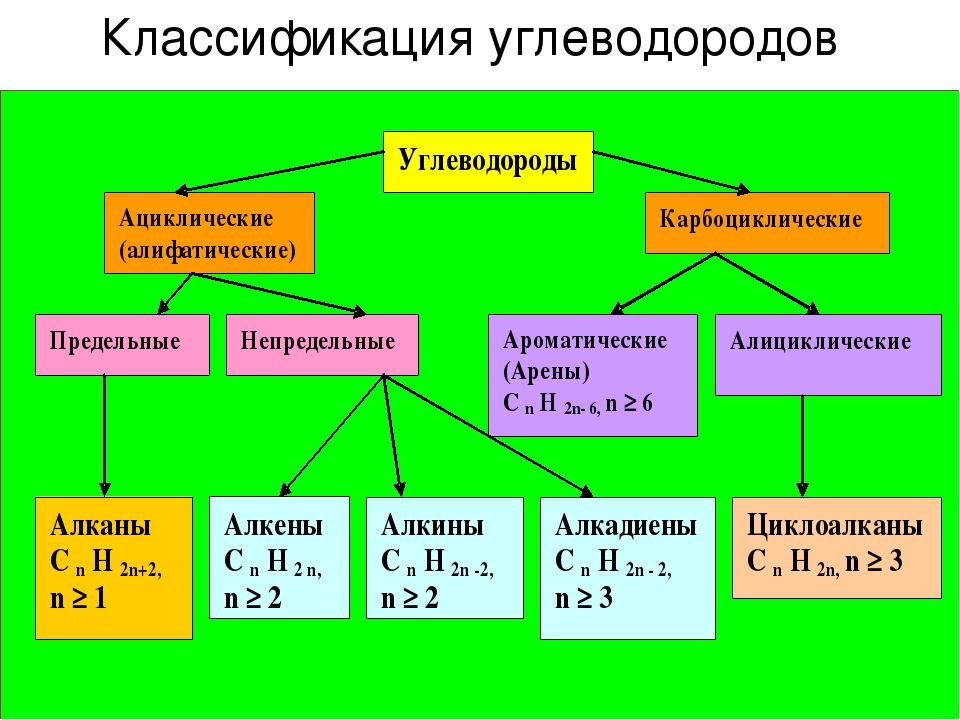
б). c водородом, при этом образуются предельные углеводороды: C2H4 + Н2 → C2H6 (этан)
в). c водой при этом образуются спирты: C2H4 + Н2О → C2H5ОН (этиловый спирт)
г). молекулы этилена могут соединяться друг с другом, то есть вступать в реакцию полимеризации: nCH2 = CH2 → (-CH2-CH2-)n
При этом образуется полиэтилен, из которого изготавливают целлофановые пакеты, упаковки, изоляционный материал.
2. Все непредельные углеводороды, как и предельные, горят на воздухе, при полном сгорании образуя углекислый газ и воду: C2H4 + 3O2 → 2CO2↑ + 2H2O
Алкины – непредельные углеводороды, в молекулах которых имеется одна тройная связь между атомами углерода. Имеют общую формулу Cnh3n-2 где n – больше или равно двум. Первый представитель – этин или ацетилен имеющий формулу C2H2. Ацетилен – газ без запаха, плохо растворим в воде. Применяется в ацетиленкислородных горелках для сварки и резки металлов.
Ацетилен – газ без запаха, плохо растворим в воде. Применяется в ацетиленкислородных горелках для сварки и резки металлов.
Алкины, за счет наличия тройной связи в молекулах, также как и алкены, являются реакционноспособными веществами.
1. Легко вступают в реакции присоединения:
а). с галогенами, например, с бромом: C2H2 + 2Br2 → C2H2Br4 (тетрабромэтан)
Признаком данной реакции является обесцвечивание раствора брома, поэтому данная реакция используется как качественная на тройную связь.
б). с водородом, при этом образуются предельные углеводороды: C2H2 + 2Н2 → C2H6 этан
2. Алкины, как и алкены, горят на воздухе, при полном сгорании образуя углекислый газ и воду: 2C2H2 + 5O2 → 4CO2↑ + 2H2O
Особенностью реакции горения ацетилена является то, что температура пламени может достигать трех тысяч градусов.
Урок №61. Непредельные (ненасыщенные) углеводороды
АЛКЕНЫ
Углеводородами ряда этилена, или
этиленовыми углеводородами (олефинами
или алкенами) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной
двойной связи между углеродными атомами, т.е. – группировки
>C=C<.
Этиленовые углеводороды образуют
гомологический ряд, состав каждого члена которого выражается общей эмпирической
формулой CnH2n.
Родоначальником этого ряда является углеводород этилен состава С2Н4,
строение которого может быть представлено следующей структурной и упрощенной
структурной формулами:
Гомологический
ряд алкенов
СnH2n алкен | Названия, |
C2Н4 | этен, этилен |
C3H6 | пропен |
C4H8 | бутен |
C5H10 | пентен |
C6H12 | гексен |
Тренажёр — Гомологический ряд этилена
Физические
свойства
С2 – С4 (газы)
С5 – С18 (жидкости)
С19 … – (твёрдые)
- Алкены не
растворяются в воде, растворимы в органических растворителях (бензин,
бензол и др. )
) - Легче воды
- С увеличением Mr температуры плавления и кипения
увеличиваются - ЭТИЛЕН — в природе этилен
практически не встречается. Это бесцветный горючий газ со слабым запахом.
Химические
свойства
В отличие от насыщенных углеводородов
для углеводородов ряда этилена характерны разнообразные реакции присоединения по месту двойной связи; при этом они
значительно легче вступают во взаимодействие с различными реагентами.
Благодаря двойной связи
молекулы алкенов могут соединяться между собой, т.е. полимеризоваться.
Как и предельные
углеводороды, алкены горят на воздухе:
C2H4 + 3O2 t→ 2CO2 + 2H2O + Q (пламя
ярко светящее)
Применение
Этилен является
одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек
синтеза. Основное направление использования этилена — в качестве мономера
при получении полиэтилена
Этилен — исходное соединение для получения полиэтилена
высокого и низкого давления и олигомеров этилена, являющихся основой ряда
синтетических смазочных масел.
Этилен применяют
как исходный материал для производства ацетальдегида и синтетического
этилового спирта. Также он используется для синтеза этилацетата, стирола,
винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого
этила.
Этилен
используют для ускорения созревания плодов — например, помидоров, дынь,
апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения
предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к
материнским растениям, что облегчает механизированную уборку урожая.
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
(АЛКИНЫ)
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные)
углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2.
Родоначальником гомологического ряда этих углеводородов является ацетилен H-C≡C-H.
Алкины – это
непредельные углеводороды с одной тройной углерод-углеродной связью в цепи и
общей формулой СnH2n-2
Физические
свойства
С2Н2 – газ без
цвета и почти без запаха, технический ацетилен обладает неприятным запахом,
легче воздуха, мало растворим в воде
Свойства гомологов изменяются аналогично
алкенам.
Получение в лаборатории: из карбида
кальция гидролизом (взаимодействие с водой)
CaC2 + 2H2O →
Ca(OH)2 + H-C≡C-H
Получение в промышленности: термическим разложением метана (пиролиз)
2CH4 1500˚С→ HC≡CH + 3H2
Применение
Из всех ацетиленовых углеводородов
серьёзное промышленное значение имеет только ацетилен, который является
важнейшим химическим сырьём. При горении ацетилена выделяется много
тепла, что используется для резки и сварки металлов в ацетилен-кислородной
сварке (расходуется до 30 % всего производимого ацетилена).
В конце 19-го — начале 20-го века
широкой популярностью пользовались многочисленные ацетиленовые светильники
(источником ацетилена служил дешевый карбид кальция), используемые на
железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на
то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их
выпуск и потребление не прекратились. Они производятся в небольших количествах
Они производятся в небольших количествах
как походное снаряжение
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ)
Диеновые углеводороды или алкадиены – это
непредельные углеводороды, содержащие две двойные углерод — углеродные связи.
Общая формула алкадиенов CnH2n-2.Наибольший интерес представляют
углеводороды с сопряженными двойными связями, их используют для производства
синтетических каучуков.
Бутадиен -1,3 — легко сжижающийся газ, с неприятным
запахом
Изопрен — легкокипящая жидкость
Наиболее массовое применение
каучуков — это производство резин для автомобильных, авиационных и
велосипедных шин.
Из каучуков изготавливаются специальные
резины огромного разнообразия уплотнений для целей тепло- звуко- воздухо-
гидроизоляции разъёмных элементов зданий, в санитарной и вентиляционной
технике, в гидравлической, пневматической и вакуумной технике.
Каучуки применяют для электроизоляции,
производства медицинских приборов.
ЦИКЛОАЛКАНЫ
(ЦИКЛОПАРАФИНЫ)
В отличие от предельных углеводородов,
характеризующихся наличием открытых углеродных цепей, существуют углеводороды с
замкнутыми цепями (циклами). По своим свойствам они напоминают обычные
предельные углеводороды алканы (парафины), отсюда и произошло их название –
циклоалканы (циклопарафины). Общая формула гомологического ряда циклоалканов CnH2n,
то есть циклоалканы изомерны этиленовым углеводородам. В природе встречаются в
составе нефти.
Представителями этого ряда соединений
являются циклопропан, циклопентан, циклогексан.
Наибольшее практическое значение имеют
циклогексан, этилциклогексан. Циклогексан используется в химическом синтезе, а
также в качестве растворителя. Циклопропан используется в медицинской практике
в качестве ингаляционного анестезирующего средства.
АРОМАТИЧЕСКИЕ
УГЛЕВОДОРОДЫ (АРЕНЫ)
Типичными представителями ароматических
углеводородов являются производные бензола, т. е. такие карбоциклические
е. такие карбоциклические
соединения, в молекулах которых имеется особая циклическая группировка из шести
атомов углерода, называемая бензольным или ароматическим ядром.
Общая формула ароматических
углеводородов CnH2n-6.
·
С6H6 – бензол, родоначальник гомологического ряда
аренов
·
С6H5 – CH3 – толуол (метилбензол)
·
С6H5 – CH=СH2 – стирол (винилбензол)
Физические
свойства:
1. Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не
растворяется в воде
2. Внимание! Бензол – яд, действует на
почки, изменяет формулу крови (при длительном воздействии), может нарушать
структуру хромосом.
3. Большинство
ароматических углеводородов опасны для жизни, токсичны.
Применение
Ароматические
углеводороды являются важным сырьем для производства различных синтетических
материалов, красителей, физиологически активных веществ. Так, бензол – продукт
для получения красителей, медикаментов, средств защиты растений и др. Толуол
используется как сырье в производстве взрывчатых веществ, фармацевтических
препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется
для получения полимерного материала – полистирола.
Применение УГЛЕВОДОРОДОВ
Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения
Соединения непредельные — Справочник химика 21
Альдегиды и кетоны. Строение карбонильной группы. Изомерия и номенклатура. Способы получения. Химические свойства. Реакции нуклеофильного присоединения. Реакции замещения и окисления. Функциональные производные оксосоединений ацетали, оксимы, гидразоны, азины. Альдольная и кротоновая конденсации. Дикарбонильные соединения. Непредельные альдегиды и кетоны. Кетены. УФ и ИК спектры альдегидов и кетонов. [c.170]
Цель гидроочистки — улучшение качества продукта или фракции за счет удаления нежелательных примесей, таких, как сера, азот, кислород, смолистые соединения, непредельные углеводороды. [c.7]
Повышение качества продукта пли фракции в процессе гидро-очистки достигается за счет удаления нежелательных иримесей, таких, как сера, азот, кислород, смолистые соединения, непредельные углеводороды. Процесс осуществляется па стационарном катализаторе в среде водородсодержащего газа в условиях, при которых 97—99% (масс.) исходного сырья превращается в очищенный продукт. Одновременно образуется незначительное количество бензина. Катализатор периодически регенерируют. [c.4]
В бензинах нежелательными примесями являются сернистые соединения, непредельные углеводороды, нафтеновые кислоты, твердые парафины и смолы. Эти примеси вызывают коррозию аппаратуры и двигателя, а также ухудшают качество бензина. [c.261]
Легко вступают в обменную реакцию с магнийорганическими соединениями непредельные галогениды с подвижным атомом галоида — аллилгалогениды и их гомологи если в реакцию вводят хлористый, бромистый или йодистый аллил, то с хорошими выходами получаются а-этиленовые углеводороды [c.238]
Если непредельное соединение и водород предоставить самим себе, то реакция между ними будет идти очень медленно. Однако химик может ускорить ее, прибавив немного мелкого порошка определенного металла. Сам металл в реакции не участвует — просто поверхность его крупинок, по-видимому, представляет србой идеальное место для соединения непредельного углеводорода с водородом. Поэтому в присутствии металла гидрогенизация идет в миллионы раз быстрее, чем без него. [c.39]
Некоторые олефины при окислении образуют эпоксидные соединения . Непредельные углеводороды с сопряженными двойными связями, а также олефины при температуре выше 80 °С при окислении могут образовывать циклические 0-0 1 1 / [c.54]
С развитием термических процессов встает вопрос об облагораживании и квалифицированном использовании дистиллятных продуктов этих процессов в связи о особенностями их физико-химического состава — высокой концентрацией серо- и азотсодержащих соединений, непредельных углеводородов, в том числе диеновых. Для облагораживания бензинов термических процессов могут использоваться [234, 235, 236 [c.228]
При неглубокой гидроочистке сырья более или менее полно удаляются сернистые соединения, непредельные углеводороды гидрируются. При глубокой гидроочистке происходит также частичное гидрирование ароматических углеводородов до нафтеновых полициклические ароматические и нафтеновые углеводороды превращаются в углеводороды того же ряда с меньшим числом колец. Причем даже при неглубокой гидроочистке, осуществляемой при 3—5 МПа, наблюдается образование углеводородного газа и фракций, выкипающих ниже начала кипения сырья, т. е. продуктов гидрокрекинга. —- [c.61]
Производство компонентов из исходных масляных фракций — сложный многоступенчатый процесс. Основное назначение каждой ступени — полное или частичное удаление определенных групп соединений, отрицательно влияющих на эксплуатационные свойства масел. Из нефтяных фракций необходимо удалять все кислые соединения, непредельные углеводороды, частично сернистые и смолистые соединения, полициклические ароматические углеводороды с короткими боковыми цепями, твердые парафины. [c.322]
Адсорбционная очистка масел основана на способности адсорбентов избирательно извлекать из масел смолистые и сернистые соединения, непредельные и полициклические ароматические углеводороды, а также органические кислоты, остатки серной кислоты и растворителей. В результате очистки улучшаются цвет масла, его стабильность, индекс вязкости, коксуемость. [c.356]
Алкены, алкины и алкадиены относятся к непредельным органическим соединениям. Непредельными (нена-сыш,енными) называются соединения, молекулы которых содержат атомы углерода, связанные двойными и тройными связями. [c.314]
Поскольку при гидрировании соединения А образуется соединение Б, которое присоединяет бром, это соединение — непредельный углеводород. [c.246]
Ациклические соединения непредельные с=с/ Н-С=С-Н [c.223]
Из нефтяных углеводородов путем последовательной химической переработки получают целый ряд различных химических соединений непредельные углеводороды, спирты, кислоты, эфиры, альдегиды—продукты, играющие огромную роль как для изготовления предметов бытового потребления, так и для развития современной техники. Так, содержащийся в газах крекинга этилен при взаимодействии с хлором образует дихлорэтан, являющийся исходным сырьем для получения поливинилхлорида. Гидратацией этилена под действием катализаторов получается синтетический этиловый спирт, являющийся важным исходным сырьем для ряда химических процессов. Эта реакция, открытая А. М. Бутлеровым и В. Горяйновым, сохранила важное техническое значение и до настоящего времени. [c.69]
Параметры гидроочистки. Для получения качественных дизельных топлив необходимо исходную дизельную фракцию достаточно полно освободить от сернистых и смолхгетых соединений, непредельных углеводородов и в некоторых случаях частично от ароматхгче-скпх углеводородов. [c.41]
Эти результаты рассматривались как указание на то, что реакция гидрогюлимеризации (смешанная полимеризация) характерна для олефиновых углеводородов и что гидронолимеры образовались в результате гидрирования образующихся в качестве промежуточных соединений непредельных полимеров. Кроме того, изучался вопрос об источниках водорода в этой реакции. Некоторые из 1шдивидуальных предельных полимеров не удалось получить в чистом виде из-за недостаточной чистоты взятых в реакцию исходных олефиновых углеводородов и трудностей удаления последних следов пепредельных полимеров. [c.192]
Выделение бутадиена из фракции углеводородов С4 с помощью хемосорбента — водно-аммиачного раствора ацетата меди — основано на том, что хемосорбенты образуют с непредельными соединениями на холоду нестойкие сложные комплексные соединения, которые при последующем нагревании выделяют высококонцентрированные непредельные соединения. Чем больше непредельность углеводорода, тем выше его растворимость в хемосорбенте. Так, например, бутадиен в 10—50 раз более растворим, чем н-бутилены. Комплексные соединения непредельных соединений с ацетатом меди очень чувствительны к температуре и при нагревании до определенной температуры выделяют концентрированное непредельное соединение. [c.60]
Назначение. Улучшение качества дистиллятов путем удаления серы, азота, кислорода, смолистых соединений, непредельных соединений в среде водорода на катализаторах. При этом осуществляется ряд параллельных и последовательных реакций каталитического гидрогенолиза сераорганических и азотистых соединений, гидрирования ароматических и олефиновых углеЕОДоро-дов, гидроизомеризации, гидрокрекинга и др. [c.136]
Препаративный органический синтез, основанный на принципах структурной химии, требует в качестве исходных веществ дефицитные кислород- или галогенсодержащие соединения, непредельные углеводороды или сырьс сельскохозяйственного происхождения, в том числе зерно, корнеплоды, жиры, молочные продукты пищевого назначения. Совершенно ясно, что привлечение такого сырья крайне невыгодно в экономическом отношении. [c.102]
Выход первичной смолы из бурых углей изменяется в значительных пределах в зависимости от степени их химической зрелости. Например, челябинские угли высокой степени зрелости дают 3 %, а александрийские низкой степени зрелости угли 9—12 % первичной смолы. В состав первичной смолы входят ароматические, парафиновые, непредельные и нафтеновые углеводороды. Ароматические углеводороды — это многокольчатые соединения с боковыми заместителями. Парафины являются значительной составной частью первичной буроугольной смолы и представлены от легкокипящих жидких до твердых соединений. Непредельные углеводороды в первичной смоле содержатся в количестве 10-20 %, в их состав входят углеводороды с длинной цепочкой и двойной связью в конце цепи. В состав буроугольной смолы входит значительное количество фенолов, а также 3—4 % пиридиновых оснований. [c.224]
Большое значение имеет чистота исходного сырья. Чем чище исходный изопропилбензол, тем больше скорость реакции, проводимой при умеренных температурах и малых количествах катализатора или даже в его отсутствие. В связи с этим к качеству изопропилбензола предъявляются высокие требования. Он не должен содержать примесей сернистых соединений, непредельных углеводородов, фенола, стирола и а-метилстирола. Применяемый изопропилбензол должен иметь и = 1,4912 и 90% его должно выкипать в интервале 152,1—152,8° С. [c.237]
Введение в мышьяковистые соединения непредельных углеродистых радикалов с двойной или тройной связью, как обычно, сильно отражается на токсичности, повышая ее (см, главу непредельные мышьяковистые соединения ). [c.153]
Химическая деструкция лучше всего изучена и наиболее часто наблюдается у гетероцепных полимеров она протекает избирательно за счет разрыва связи между углеродом и гетероатомом. Конеч-ны м продуктом реакции является мономер. Карбоцепные полимеры, макромолекулы которых не содержат кратной связи, обычно мало склонны к химической деструкции, так как связь С—С устойчива к наиболее ходовым реагентам. Только при очень жестких условиях или наличии в макромолекуле групп, снижающих прочность связей С—С в цепи полимера, происходит химическая деструкция карбоцепных высокомолекулярных соединений. Непредельные карбоцепные полимеры, например натуральный каучук, очень чувствительны к различным окислителям, но в этом случае деструкция [c.621]
Нежелательными примесями, содержащимися в дистиллятах светлых нефтепродуктов, являются сернистые соединения, непредельные соединения, смолы, нафтеновые кислоты, твердые парафины. Наличие в моторных топливах сернистых соединений обусловливает коррозию деталей двигателей нафтеновые кислоты также агрессивны в отношении ряда металлов (железо, [c.265]
Простейшим представителем этого ряда, его родоначальником, является этилен С2Н4. По названию этого соединения непредельные углеводороды такого ряда называются еще этиленовыми. [c.61]
Предельные и непредельные жирные кислоты играют важную роль в живой природе. Они входят в состав глицеридов, образующих основу клеточных мембран, и их следует классифицировать как биологически важные соединения. Непредельные алифатические кислоты — линолевая, линоленовая и арахидоновая, кроме этой функции, выполняют и другую, не менее важную. Освобождаясь из состава глицеридов и подвергаясь действию окислительных ферментов, они дают начало последовательностям реакций, приводящих в конечном счете к гидроксилированным непредельным соединениям с высокой биологической активностью. Из линолевой и линоленовой кислот образуются метаболиты с восемнадцатью углеродными атомами в цепи, из арахидоновой — двадцатизвенные. Много биологически активных веществ встречается также среди окисленных производных специфических разветвленных длинноцепных кислот, продуцируемых отдельными организмами. [c.28]
В процессе хайдил [67—72] используют, по-видимому, алюмо-кобальтмолибденовый катализатор. Он не отравляется сернистыми соединениями, непредельными углеводородами и водой. Регенерируют катализатор каждые 3—4 месяца. Гидродеалнилироваине толуола проводят при 600—650 °С, 3,5—4 МПа (35—40 кгс/см ), около 0,5 ч»1 парциальное давление водорода примерно 3 МПа (30 кгс/см2). [c.259]
Глубина переохлаждения возрастает с увеличением содержания аренов, некоторых гетероорганических соединений, непредельных, а также мельчайших частиц твердых зафязнений. Удаление воды из нефтепродуктов при низких температурах эффективно лишь в том случае, если кристаллы льда удаляются при этой же температуре, поскольку при повьшю-нии температуры выпавшие кристаллы льда вновь растворяются в топливе. Удаление кристал.тов льда связано с большими трудностями. [c.72]
Другие важнейшие требования к реактивному топливу относятся к обеспечению бесперебойной подачи его в зону горения, термоокислительной стабильности и высоким антикоррозийным свойствам. Реактивное топливо не должно выделять смол и других осадков, могуш,их засорить фильтры, клапаны и другую топливоподающую аппаратуру создавать газовые пробки терять текучесть при низких температурах выделять кристаллы углеводородов и льда. Топливо должно быть хорошо очищено и не содержать коррозионно агрессивных сернистых и кислородных соединений непредельных углеводородов высших парафинов с высокой температурой застывания а также механических примесей и воды. [c.91]
Нежелательными примесями в сырье являются сернистые соединения, непредельные углеводороды, а также фенол, стирол и а-метилсгирол, поэтому к качеству исходного изопропилбензола предъявляют высокие требования. [c.100]
Важно отметить, что вода при О °С, как правило, не замерзает из-за способности к переохлаждению гетерогенных смесей микрокапель воды с нефтепродуктами. Глубина переохлаждения зависит от химического состава топлив и масел, их физических свойств, содержания загрязнений и внешних условий —скорости охлаждения, давления и др. Переохлаждение возрастает с увеличением содержания аренов, некоторых гетероорганических соединений, непредельных, а также мельчайших частиц твердых загрязнений. [c.290]
Ароматические дигалоидпроизводные, содержащие оба га лоида в боковой цепи, с роданистыми калием и аммонием реагируют аналогично соответствующим производным жирного ряда, образуя дироданпроизводные [261, 262, 317, 3181. Однако иногда происходит отщепление галоидов и образование соединений непредельного характера [2611. Это наблюдается при реакции роданистого калия с 1-фенил-1,2-дибромпропаном, 1-(2,4-динитро-фенил)-2-фенил-1,2-дибромэтаном и нитрилом 1,2-дифенил-1,2-ди-бромпропионовой кислоты [261]. [c.18]
При работе с фенолами, галогенонитросоедине-ниями, непредельными карбонильными соединениями, непредельными кислотами, алифатическими галогенокислог тами, гидразинами и другими необходимо работать в перчатках, защитных очках, так как многие из этих веществ вызывают раздрал ение и ожоги кожи и слизистых оболочек. Работу проводить в вытяжном шкафу. [c.10]
Перечень деполяризаторов, содержащих электрофорные группы, включает почти все классы органических соединений непредельные углеводороды, галогенпроизводные, нитро- и серосодер- [c.461]
В связи с тем что процесс молекс проводится при относительно нпзких температурах, сернистые и азотистые соединения, непредельные углеводороды, если они присутствуют в сырье, необратимо сорбируются цеолитами, снижая их адсорбционную емкость. Поэтому сырье, поступающее в адсорбционную установку молекс , подвергают тщательной гидроочистке. В этих условиях длительность эксплуатации цеолитов оценивается в 2 года. [c.466]
Преимущества жидкофазных процессов обнаруншваются в тех случаях, когда адсорбируемый компонент содержится в исходной смеси в низкой концентрации и когда требования к чистоте экстракта не высоки. Следует также учитывать, что нри относительно низких температурах, характерных для жидкофазного процесса, примеси сернистых, азотистых соединений, непредельных углеводородов необратимо адсорбируются цеолитами, не удаляются в стадии десорбции и дезактивируют адсорбент. Поэтому при депарафинизации сырья в жидкой фазе исходные углеводороды должны подвергаться особенно тщательной гидроочистке. [c.497]
Производство минералы1ых масел. Сырьем для производства минеральных масел являются дистилляты вакуумной перегонки мазута и гудрон. Масла получают в результате последовательной очистки сырья от нежелательных соединений непредельных, асфальтено-смолистых, сернистых, парафиновых, кислых. [c.28]
Алкены (олефины, этиленовые углеводороды) — Что такое Алкены (олефины, этиленовые углеводороды)?
Алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода
Алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие 1 двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°.
Простейшим алкеном является этилен (C2H4).
По номенклатуре IUPAC:
- названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»;
- положение двойной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил».
Тривиальные названия: CH2=CH- «винил», CH2=CH-CH2— «аллил».
Алкены, число атомов углерода в которых больше 2х, (т.е. кроме этилена) имеют изомеры.
Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная.
Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии.
Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2).
С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алкены химически активны.
Их химические свойства во многом определяются наличием двойной связи.
Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения.
Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению.
Алкены являются важнейшим химическим сырьем.
Промышленное использование этилена
Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты.
Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
Мировое производство этилена составляет порядка 100 млн тонн/год (по данным на 2005 г: 107 млн тонн).
Промышленное использование пропилена
Пропилен в промышленности применяется, в основном, для синтеза полипропилена (62 % процента всего выпускаемого объема).
Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.
В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн т/год.
По прогнозам специалистов, потребность в пропилене в ближайшем будущем будет существенно превышать объемы его производства, причем, ожидается, что к 2010 г объем его мирового выпуска достигнет 90 млн т/год.
Промышленное использование прочих алкенов
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и пр.
Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ.
Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С10 -С18 применяют при синтезе ПАВ, а также для получения высших спиртов.
Непредельные углеводороды | План-конспект урока по химии (9 класс) по теме:
Непредельные углеводороды
Непредельными называются углеводороды в молекулах ,которых имеются атомы углерода,, связанные между собой двойной или тройной связью.
Алкены. Олефины . углеводороды ряда этилена.
1.Непредельные углеводороды в молекулах которых имеются два атома углерода, связанные двойной связью.
2. Строение изучим в 10 классе.
3. Cn h3n
4. Изомерия :
а) структурная — изомерия цепи
Ch4-CH=CH-Ch3-Ch4
Ch4–C=CH-Ch4
|
CH
б) изомерия по положению двойной связи
CH 2=CH – Ch3 – Ch3 – Ch4
Ch4 – CH=CH – CH 2- Ch4
Гомологический ряд
МНК Рациональная номенклатура
Ch3=Ch3 этен этелен
Ch3=CH-Ch4 пропен пропилен
Ch3=CH-Ch3-Ch4 бутен бутилен
C5h20 пентен амилен
C6h22 гексен гексилен
C7H!4 гептен гептилен
C8h26 октен октилен
C9h28 нонен нонилен
C10h30 деден децилен
Название некоторых радикалов Ch3=CH- винил
Сh3=CH-Ch3 — аллил
5. Номенклатура
6 5 4 3 2 1
Ch4-CH-Ch3-C =CH-Ch4
| |
Ch4 Ch3
|
Ch4 5-метил-3-этилгексен-2
Нумеруем с того конца, где двойная связь, называть начинаем с младшего радикала-заместителя
6. Получение углеводородов ряда этилена
1. крекинг или пиролиз нефти
2. крекинг угля
3. крекинг предельных углеводородов
C18h48 t C9h28+C9h30
нонен нонан
4. из спиртов
t=350 конц. серная кислоиа
Ch3 — Ch3 Ch3 = Ch3 + h3O
| |
H OH
5.Дегидрированием алканов
t=500
Ch4 — CH — Ch4 Ch3= C –Ch4 + h3
| |
Ch4 Ch4
7. Физические свойства
С2h5 до C4H8 — газы
C5 h20 до C18h46 — жидкости
C19h48 и т.д. – твердые вещества.
С ростом числа атомов углерода возрастает tкип, tпл и плотность. Все алкены плохо растворяются в воде
8..Химические свойства :
Химические свойства определяются наличием двойной связи.
Х а р а к т е р н ы е р е а к ц и и — присоединение , окисление , полимеризация.
Реакции присоединения:
1. гидрогенизации или гидрирования
Ni 30-500C
CH 3 — CH = Ch3 + h3 Ch4 — CH 2 — Ch4
2. реакция галогенирования — характерная реакция на алкены , обесцвечивание бромной воды
h3O
Ch3=Ch3 + Br2 Ch3 — Ch3
| |
Br Br
Этен 1.2-дибромэтан
3. реакция гидрогалогенирования – реакция протекает по ионному механизму H+Br –
Ch4 – CH=Ch3 + HBr Ch4– CHBr – Ch4
Правило Морковникова:
Атом водорода присоединяется к наиболее гидрированному атому углерода
H Н H
| | |
H — C – C= C-H + HBr Ch4– CHBr – Ch4
|
H
4.реакция гидратации
Сh3=Ch3+ h3O 600 C ZnCl Ch4 – Ch3 – OH
Этен этиловый спирт
Сделаем вывод: Присоединяются Н2, галогены, галогеноводороды, вода
Реакции окисления
5.мягкое окисление – характерная реакция , обесцвечивание раствора марганцовки.
KMnO4
Ch3 =Ch3 + [ O ] + h3O Ch3 ==Ch3
| |
OH OH
Этандиол или этиленгликоль (двухатомный спирт)
(3Ch3=Ch3 + 2KMnO4 + 4h3O 3Ch3=Ch3 + 2MnO2 + 2KOH) реакция Вагнера
| |
OH OH
6. горение
Ch3=Ch3 + 3O2 2 CO2 + 2h3O +Q
7. реакции полимеризации
процесс соединения одинаковых молекул в более крупные называется п о л и м е р и з а ц и е й , а продукт этой реакции полимером.
Сh3=Ch3 + Ch3=Ch3 + Ch3=Ch3 + …… k 200C -Ch3-Ch3-Ch3-Ch3-Ch3-Ch3-….
nCH=CH (-CH-CH-)n
Сh3=Ch3 — мономер (-Ch3-Ch3-)n-полимер [-Ch3-Ch3- ] структурное звено
n – степень полимеризации
9.Отдельный представитель -Этен или этилен
а) в природе находится в небольших количествах в природном и светильном газе
б) в лабораториях получают реакцией дегидратации этилового спирта
в) физические свойства- газ, без цвета, запах сладковатый. горит светящимся слабо коптящим пламенем.
г) при смешивании с воздухом образует взрывчатую смесь
д) обладает наркотическими свойствами
е) сырье для получения спирта
ж) используется для получения иприта – сильного отравляющего вещества
з) используется для ускорения созревания фруктов
Муниципальное бюджетное общеобразовательное учреждение средняя школа № 33
Дорогие друзья!
Уважаемые родители, коллеги!
Дорогие ребята!
Начался новый учебный год, время анализировать, корректировать, время извлекать уроки, чтобы расти и развиваться. На установочном, первом в новом учебном году, августовском педсовете педагогический коллектив школы обсудил итоги прошедшего года и определил цели и задачи на новый учебный год в соответствии со стратегией государства в области образования.
Воспитание — стратегический национальный приоритет. Это осознало государство, общество и профессиональное сообщество педагогов. В нашем городе этот приоритет будет реализовываться через городскую воспитательную акцию «Культурный код липчанина». Участие всей нашей школьной семьи: детей, родителей, педагогов — в проектах акции позволит нам развивать культурные особенности липчанина, накапливать в своём сознании лучшие образцы, стереотипы россиянина.
«Бережное отношение к Родине, забота о ней, верность искренней дружбе — наш генетический и культурный код», — подчёркивает В. В. Путин.
Позаботимся о нашем родном городе, откроем для себя его культурные, исторические сокровищницы, научимся бережно относиться не только к реликвиям, но и ко всему, что в Липецке создаётся сегодня руками наших соотечественников для нашего комфортного проживания.
И очень важным для реализации стратегического национального приоритета считаю коммуникации: детей друг с другом и взрослыми, взрослых друг с другом, что возможно лишь при традиционной организации учебно-воспитательного процесса в школе. А значит, здоровье вновь в приоритете!
Берегите себя и своих близких! Здорового, успешного всем нам нового учебного года!
Ирина Владимировна Знаменщикова, директор школы
Электронное обучение и
дистанционные образовательные технологии
Ненасыщенное соединение — обзор
1.15.3.2 Данные ЯМР
Единственным ненасыщенным соединением, наблюдаемым с помощью ЯМР-спектроскопии, является 3 (R = Ph) в качестве промежуточного продукта реакции с некоординирующим противоанионом CF3SO3–. Анализ реакционной смеси методом ЯМР 31 P показал, что она содержит единственный резонансный сигнал при 350 ppm ( 1 J SeP 315 Гц) <1997PS23>, согласующийся с химическим сдвигом, наблюдаемым для катиона фосфиренилия. (309.7 частей на миллион).
Большинство насыщенных гетероселенирановых и гетеротеллурирановых колец, исследованных с помощью ЯМР-спектроскопии, содержат элементы группы 15, имеющие общую формулу, показанную на схеме 4 . Наиболее важные свойства ЯМР приведены в таблице . К сожалению, в спектре ЯМР 125 Te 40 сигнал не наблюдался, вероятно, из-за значительного уширения пика, вызванного двумя соседними атомами висмута, имеющими ядерные спины 9/2. Было отмечено, что сдвиг Te и P в сильном поле характерен для небольшого дифосфателлуриранового кольца 37 <1993ZFA1083>.
Схема 4. Замещенные дипниктоген-селенираны.
Таблица 4. Наиболее важные данные ЯМР замещенных дипниктоген-селениранов и -теллуриранов показаны на схеме 4
| № | Ch | X | R 1 | R 2 | δ Ch (ppm) | δ Ea (ppm) | δ Eb (ppm) | 1 J ChEa (Гц) | 1 J ChEb ( Гц) | Ссылка |
|---|---|---|---|---|---|---|---|---|---|---|
| 18 | Se | P | Cp * | Cp * | 379.1 | 88,9 | 88,9 | 124,7 | 124,7 | 1994CB997 |
| 18 | Se | P | Mes * | OMes * | 27,6 | −1 76,6 | 103,0 | 236,2 | 1995HAC33 | |
| 18 | Se | P | R 1 | R 1 | 152.2 | −3,7 | −3,7 | 90,0 | 90,0 | 1995CB1207 |
| 18 | Se | P | Bbt | Bbt | −14,6 ,3 Bbt | −14,6 ,3 −55,3 | 126 | 126 | 2003JPO450 | |
| 20 | Se | SB | Bbt | Bbt | 95.0 | a | a | a | a | 1998CL725 |
| 37 | Te | P | Bu t − | Bu t | −70 | −70 | 229 | 229 | 1993ZAAC1083 | |
| 39 | Te | Sb | Bbt | Bbt | −622.3 | a | a | a | a | 2005AG (E) 3717 |
| 40 | Te | Bi | Bbt | Bbt | a | a | a | a | a | 2005AG (E) 3717 |
R 1 : –C (SiMe 3 ) PPh 3 .
Различие химических сдвигов между арилом и O -арил-замещенными атомами фосфора, а также константы взаимодействия Se – P приписывают увеличению sp 2 характера фосфора, который несет кислородный заместитель <1995HAC33>.К сожалению, для этих соединений нет рентгеновской структуры, хотя было бы интересно посмотреть, был ли также структурно заметен усиленный s-характер фосфора. Такое изменение гибридизации, вероятно, повлияет на углы связывания относительно фосфора; кроме того, это может повлиять на π-комплексный характер (A, Схема 3 ) трехчленного кольца.
Константа связи 1 J SeP была замечена как необычно мала; однако он считался характерным для трехчленных колец <1995CB1207>.Динамическое поведение лигандов Cp * может быть ясно видно с помощью спектроскопии ЯМР -1 H. При комнатной температуре можно было обнаружить три широких сигнала при δ = 1,93, 1,78 и 0,78 м.д. при -15 ° C, пять синглетов наблюдались в результате диастереотропии метильных групп <1994CB997>.
Селенафосфиран 8a охарактеризован с помощью многоядерной ЯМР-спектроскопии; однако данных о химическом сдвиге 77 Se не поступало. Химический сдвиг δ = -41,1 м.д. для фосфора и константа взаимодействия 1 J PSe 125 Гц (, таблица 5, ) близки к значениям, наблюдаемым для арилзамещенных дифосфазелениранов (, таблица 4, ). , и хорошо согласуются с его предложенной структурой.Конфигурация атома Se была определена на основе констант взаимодействия J PC <2000T6259>.
Таблица 5. Данные ЯМР-спектроскопии для 8a и 8b , наблюдаемых в различных растворителях
| № | Растворитель | δ Se (ppm) | δ P (ppm) | 1 J PSe (Гц) | Каталожный номер |
|---|---|---|---|---|---|
| 8a | C 6 D 6 | a | −41.1 | 125 | 2000T6259 |
| 8b | Твердотельный | a | −26,1 | b | 2002JA9706 |
| 8b | C 6 | −26,6 | b | 2002JA9706 | |
| 8b | CD 3 CN | 144,3 | −20,2 | b | 2002JA9706 |
| CD 8b Класс 2 | 138.3 | −19,3 | b | 2002JA9706 | |
| 8b | CDCl 3 | 129,9 | −13,6 | b | 2002JA9706 |
5 селена-фосфиран 8b <2002JA9706> имеет характеристики ЯМР, отличные от известных 1,2σ 3 -селена-фосфиранов (например, 8a ). Химический сдвиг δ P = -26,1 м.д. Таблица 5 в твердотельном спектре ЯМР 31 P (δ P = -26.6 ppm в C 6 D 6 ) является типичным для пятикоординированного фосфора. В спектре ЯМР 77 Se (растворитель C 6 D 6 ) синглет наблюдается при δ Se = 147,5 м.д. В отличие от 1,2σ 3 -селена-фосфиранов, связывания между ядрами селена и фосфора не наблюдалось. Спектр демонстрирует сильную зависимость от растворителя, как это обобщено в Таблица 5 . С увеличением акцепторного числа растворителя химические сдвиги 31 P ЯМР и 77 Se изменяются в сторону более высоких и более низких полей соответственно.Однако сигнал ЯМР 31 P все еще находится в области сильного поля, и, таким образом, утверждалось <2002JA9706>, что пентакоординированное состояние фосфора сохраняется во всех растворителях, используемых для исследования. Мало того, что сигналы фосфора и селена показывают зависимость от растворителя, α-протон арильного кольца, присоединенный к фосфору, также чувствителен к растворителю, демонстрируя сдвиг в сторону более низких полей, когда акцепторное число растворителя становится больше. Все эти наблюдения были приписаны увеличивающемуся разделению зарядов Se – P (особенно возрастающему отрицательному заряду селена) с увеличением акцепторного числа растворителя.Вместе с большим расстоянием Se – P и сильно искаженной природой тригональной байпирамиды фосфора (вывод из рентгеновских данных 8b , как обсуждалось выше) кажется, что эта необычная связь и, следовательно, сама 8b скорее уязвимый.
Структура 31 (Tip2SiTePSiPr3i) была охарактеризована с помощью многоядерной ЯМР-спектроскопии (δ P = −267,6, δ Si = −66,5 и δ Te = −1124 м.д., 1 Дж. PTe = 483 Гц) <1996OM1845>.Хотя значения ЯМР 31 P значительно отличаются от значений, наблюдаемых в дифосфателлуриранах (, таблица 4, ), это наблюдение может быть объяснено разным типом заместителей. Характеристики ЯМР 30 (Te (SiPh, SiBu3t) 2 ) аналогичны характеристикам соединения 31 (δ Si = −81,09, δ Te = −1285,4 м.д., 1 Дж. SiTe = 173,9 / 179,4 Гц; расщепление сигналов связано с заторможенным вращением) <2002CEJ2730>.
Данные ЯМР-спектроскопии доступных стан- <1997JA11124> и силадиселенирана <2002CL34> собраны в таблице 6 . Было отмечено, что высокополевые сигналы станнадиселенирана как в спектрах ЯМР 119 Sn, так и в спектрах ЯМР 77 Se являются характерными для трехчленных циклов и хорошо согласуются с характеристиками ЯМР ранее опубликованных селенадистанниранов (см. 1996CHEC-II (1) 457).
Таблица 6. Данные ЯМР-спектроскопии известного силла 13 — и станнадиселенирана 16
| No. | Элемент группы 14 (X) с заместителями | δ Se (ppm) | δ X (ppm) | Ссылка |
| 13 | Si (Tbt, Dip) | −174 | −44 | 2002CL34 |
| 16 | Sn (Tbt, Dip) | −193 | −406 | 1997JA11124 |
0 Насыщенные и ненасыщенные химические соединения органических соединений
- Насыщенное соединение: органическая молекула, в которой все ковалентные связи между атомами углерода представляют собой одинарные связи (C − C)
- Ненасыщенное соединение: органическая молекула, в которой по крайней мере одна из ковалентных связей между атомами углерода представляет собой двойную связь (C = C) или тройную связь (C≡C)
- Углеводород: органическая молекула, состоящая только из атомов углерода (C) и атомов водорода (H).
⚛ Насыщенный углеводород: молекула углеводорода, в которой все связи между атомами углерода представляют собой одинарные связи (C − C)
Алканы — предельные углеводороды.
⚛ Ненасыщенный углеводород: молекула углеводорода, в которой есть хотя бы один:
(i) двойная связь (C = C), алкены — ненасыщенные углеводороды
(ii) тройная связь (C≡C), алкины ненасыщенные углеводороды
- Если известно, что соединение является углеводородом, мы можем использовать бромную воду или раствор перманганата калия для проверки насыщения:
Испытания на насыщение углеводородами Тип Описание Пример Тесты Насыщенный ТОЛЬКО
C − C алканы Не обесцвечивает бромную воду (остается окрашенной, желто-коричневой). Не обесцвечивает раствор перманганата калия (остается окрашенным, розово-пурпурным).
ненасыщенные либо C = C
, либо C≡Cалкены
алкиныОбесцвечивает бромную воду. Раствор перманганата калия обесцвечивает.
Подробнее о реакции с бромной водой см. В разделе «Галогенирование углеводородов». Подробнее о реакции с перманганатом см. В разделе окисление алкенов.
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Насыщенные углеводороды
Углеводород — это соединение, состоящее только из атомов углерода (C) и атомов водорода (H).
Связи между атомами углерода, а также между атомами углерода и водорода являются ковалентными связями.
Каждый атом углерода может образовывать 4 ковалентные связи.
Эти связи могут относиться к атомам водорода или другим атомам углерода.
Если все ковалентные связи между атомами углерода в молекуле углеводорода представляют собой одинарные связи, C-C, то молекула углеводорода называется насыщенной.
Ряд гомологов алканов (C n H 2n + 2 ) предоставляет множество примеров насыщенных углеводородов:
| Примеры насыщенных углеводородных соединений (только одинарные связи между атомами углерода) | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Молекулярная структура | Молекулярная формула | Имя | |||||||||||||||||||||||||||||||||
| CH 4 | метан | |||||||||||||||||||||||||||||||||
| С 2 В 6 | этан | |||||||||||||||||||||||||||||||||
| С 3 В 8 | пропан | |||||||||||||||||||||||||||||||||
| С 4 В 10 | бутан | |||||||||||||||||||||||||||||||||
| С 5 В 12 | пентан | |||||||||||||||||||||||||||||||||
Даже алканы с разветвленной цепью являются насыщенными, потому что все ковалентные связи между атомами углерода являются одинарными:
| Примеры насыщенных углеводородов с разветвленной цепью (только одинарные связи между атомами углерода) | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Молекулярная структура | Молекулярная формула | Имя | |||||||||||||||||||||||||||||||||||||||||||||
| С 4 В 10 | 2-метилпропан | |||||||||||||||||||||||||||||||||||||||||||||
| С 5 В 12 | 2-метилбутан | |||||||||||||||||||||||||||||||||||||||||||||
Даже если атомы углерода образуют «кольцо», а не «цепочку», молекулы все равно будут насыщенными, пока все ковалентные связи между атомами углерода являются одинарными.Когда все атомы углерода объединяются в кольцо, мы называем их циклическими соединениями.
Мы называем эти циклические алканы, помещая префикс «цикло» перед названием алкана.
| Примеры насыщенных циклических углеводородных соединений (только одинарные связи между атомами углерода) | ||
|---|---|---|
| Молекулярная структура | Молекулярная формула | Имя |
| С 3 В 6 | циклопропан | |
| С 4 В 8 | циклобутан | |
| С 5 В 10 | циклопентан | |
| С 6 В 12 | циклогексан | |
Насыщенный углеводород представляет собой алкан и может быть:
- алкан с прямой цепью
- алкан с разветвленной цепью
- циклический алкан
Ненасыщенные углеводороды
Ненасыщенный углеводород — это молекула, состоящая только из атомов углерода и водорода, но одна или несколько ковалентных связей между атомами углерода не являются одинарной связью, это либо двойная связь (C = C), либо тройная связь ( C≡C). (1)
Если молекула углеводорода содержит двойную связь, это алкен.
Если молекула углеводорода содержит тройную связь, это алкин.
Молекула, принадлежащая либо к алкеновому, либо к гомологическому ряду алкинов, представляет собой ненасыщенный углеводород.
Атомы углерода могут быть расположены в виде прямых, разветвленных цепей или колец (циклические соединения), если в молекуле присутствует как минимум 1 двойная связь (C = C) и / или 1 тройная связь (C≡C). будет ненасыщенным. (2)
| Примеры ненасыщенных органических соединений (двойная или тройная связь между атомами углерода) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Гомологическая серия | Молекулярная структура | Молекулярная формула | Имя | |||||||||||||||||||||||||||||||||||||||||||||||||
| Алкен |
| С 2 В 4 | этилен (этен) | |||||||||||||||||||||||||||||||||||||||||||||||||
| С 3 В 6 | пропен (пропилен) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| С 4 В 8 | бутен-1-ен (1-бутен) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| С 4 В 8 | 2-метилпропен (изобутилен) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкин | С 2 В 2 | ацетилен (этин) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| С 3 В 4 | пропин (проп-1-ин) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| С 4 В 6 | бут-1-ин (1-бутин) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкен циклический | С 6 В 10 | циклогексен | ||||||||||||||||||||||||||||||||||||||||||||||||||
Ненасыщенный углеводород — это соединение, состоящее только из атомов углерода и водорода, и содержащее по крайней мере одну двойную и / или тройную связь между двумя атомами углерода.
Ненасыщенные углеводороды могут быть:
- алкены с прямой цепью
- алкены с разветвленной цепью
- циклические алкены
- алкинов с прямой цепью
- алкинов с разветвленной цепью
Тесты на насыщенные и ненасыщенные углеводороды
Насыщенные углеводороды можно отличить от ненасыщенных углеводородов в лаборатории, потому что насыщенные углеводороды менее химически активны (реакционны), чем ненасыщенные углеводороды.Это означает, что алкены и алкины с большей вероятностью будут реагировать с химическим реагентом, чем с алканом.
Для качественного теста (3) на ненасыщенность, теста на наличие, отсутствие или ненасыщенность, мы хотим выбрать химическую реакцию, которая дает эффект, который легко наблюдать, например изменение цвета.
Два общих реагента, используемых для определения, является ли углеводород насыщенным или ненасыщенным:
- бромная вода, Br 2 (водн.): Цвет от желтого до коричневого в зависимости от концентрации
- раствор перманганата калия, KMnO 4 (водн.): Цвет от розового до пурпурного в зависимости от концентрации
Тест на бромную воду
В предпочтительном тесте на ненасыщенность используется бромная вода, Br 2 (водн.) (4) .Бромная вода — это водный раствор брома, который имеет коричневый цвет, если раствор концентрируется, но постепенно меняет цвет на оранжевый, а затем на желтый при увеличении разбавления.
Углеводороды с низкой молекулярной массой — бесцветные газы. Через бромную воду можно барботировать газы, если происходит химическая реакция, цвет бромной воды «выцветает», мы говорим, что бромная вода обесцвечивается.
Обесцвечивание бромной воды указывает на ненасыщенность углеводорода.
Если бромная вода не обесцвечивается, это указывает на присутствие насыщенного углеводорода. (5)
Некоторые углеводороды представляют собой бесцветные жидкости при комнатной температуре и давлении. Плотность этих углеводородов меньше плотности воды, поэтому эти жидкие углеводороды плавают в слое над бромной водой.
Если добавить несколько капель бромной воды в насыщенный жидкий углеводород, такой как циклогексан, и встряхнуть, обесцвечивание бромной воды НЕ наблюдается в стандартных лабораторных условиях.Смесь разделится на 2 отдельных слоя: бесцветный слой циклогексана, плавающий поверх желто-коричневого слоя бромной воды внизу.
Если несколько капель бромной воды добавить к ненасыщенному жидкому углеводороду, такому как циклогексен, и встряхнуть, бромная вода легко обесцвечивается (становится все менее окрашенной, пока она не станет бесцветной).
Если имеется избыток ненасыщенного углеводорода, тогда смесь осядет на 2 отдельных, но бесцветных слоя, причем бесцветный органический слой будет плавать над бесцветным водным слоем.
Тест на перманганат калия
Концентрированные водные растворы перманганата калия имеют пурпурный цвет, переходящий в розовый по мере того, как раствор становится все более разбавленным.
Газообразные углеводороды с низкой молекулярной массой можно барботировать через раствор перманганата калия.
Если углеводород является насыщенным, видимого изменения цвета не будет (раствор перманганата калия останется розово-фиолетовым).
Если углеводород является ненасыщенным, раствор перманганата калия обесцвечивается (розовый цвет становится бесцветным).
Для бесцветных жидких углеводородов добавьте несколько капель раствора перманганата калия и встряхните.
Если углеводород является насыщенным, видимого изменения цвета не будет (раствор перманганата калия останется розово-фиолетовым).
Если углеводород ненасыщенный, раствор перманганата калия обесцвечивается (розовый цвет становится бесцветным).
Другие насыщенные и ненасыщенные органические соединения
Термин «насыщенная» может применяться к любой органической молекуле, которая содержит только одинарные связи между атомами углерода (C-C), даже если в молекуле присутствует другая функциональная группа.
Так, например, у нас может быть
- насыщенные спирты, алканы, в которых 1 или несколько гидроксильных функциональных групп (ОН) замещены атомом водорода в исходном алкане.
H
|OH
|H
|H- С – С – С -H |
H|
H|
HH
|H
|H
|HO− С – С – С -H |
H|
H|
HЭти соединения являются спиртами из-за наличия функциональной группы ОН.
Эти соединения являются насыщенными, потому что между атомами углерода (C − C) присутствуют только одинарные связи.
- насыщенных карбоновых кислот, алканов, в которых карбоксильная функциональная группа (COOH) замещена атомом водорода в исходном алкане.
H
|H
|O
||H- С – С – С -ОН |
H|
HO
||H
|O
||HO− С – С – С -ОН |
HЭти соединения являются карбоновыми кислотами из-за наличия карбоксильных функциональных групп (COOH).
Эти соединения являются насыщенными, потому что между атомами углерода (C − C) присутствуют только одинарные связи.
Термин «ненасыщенная» может применяться к любой органической молекуле, которая содержит двойную связь (C = C) или тройную связь (C≡C), даже если в молекуле присутствует другая функциональная группа.
Так, например, у нас может быть
- ненасыщенных спиртов, таких как алкен или алкин, в которых одна или несколько гидроксильных функциональных групп (ОН) замещены атомом водорода в исходном ненасыщенном углеводороде.
H H H \ | | С = С – С -ОН / | H H H
|HO− С – С ≡ С -H |
HЭти соединения являются спиртами из-за наличия функциональной группы ОН.
Эти соединения являются ненасыщенными, потому что первая молекула содержит двойную связь (C = C), а вторая молекула содержит тройную связь (C≡C).
- ненасыщенных карбоновых кислот, алкенов или алкинов, в которых карбоксильная функциональная группа (COOH) замещена атомом водорода в исходном алкене или алкине.
H
|H
|O
||H- С = С – С -ОН |
HH
|H
|H
|H
|O
||H- С = С – С = С – С -ОН Эти соединения являются карбоновыми кислотами из-за наличия карбоксильных функциональных групп (COOH).
Эти соединения являются ненасыщенными, поскольку первая молекула содержит одну двойную связь (C = C), а вторая молекула содержит две двойные связи (C = C).
Качественные тесты на насыщение становятся немного сложнее, когда присутствует функциональная группа, отличная от двойной или тройной связи. (6)
Сноски:
(1) Вы можете иметь двойную связь и тройную связь в одной и той же молекуле, их часто называют «енинами», или, если имеется более одной двойной и / или тройной связи, их называют «полиенинами».
(2) Это хорошо работает для алифатических углеводородов, но, конечно, ароматические соединения немного сложнее … обратитесь к руководству по бензолу, чтобы узнать об этом.
(3) Качественный тест на насыщение скажет нам, является ли соединение насыщенным или ненасыщенным, но если оно ненасыщенное, то качественный тест не скажет нам, сколько двойных и / или тройных связей присутствует.
Количественный анализ ненасыщенного соединения покажет нам, сколько двойных и / или тройных связей присутствует в соединении.
(4) Вместо воды можно также использовать бром, растворенный в органическом растворителе, таком как тетрахлорметан (четыреххлористый углерод). Обратите внимание, что и бром, и углеводороды растворимы в тетрахлорметане, поэтому отдельные слои не образуются.
При воздействии сильного света алканы вступают в реакцию замещения с бромом, в результате чего образуется бромистый водород, HBr, который лишь слабо растворяется в тетрахлорметане, поэтому вы можете проверить пар, образовавшийся над раствором, в пробирке с голубой лакмусовой бумагой. бумага, которая станет красной из-за присутствия HBr.Реакция между бромом и ненасыщенным углеводородом является реакцией присоединения, поэтому бромистый водород (HBr) не образуется, поэтому, если вы проверяете газ над раствором в пробирке с помощью синей лакмусовой бумаги, лакмусовая бумага не изменит цвет.
Этот раствор брома обычно не используется в школах, поскольку тетрахлорметан является известным канцерогеном.
(5) Это верно до тех пор, пока вы не подвергаете реакционную смесь воздействию сильного солнечного света и даже не ставите ее рядом с яркой лампочкой!
Воздействие яркого света вызовет химическую реакцию (реакцию замещения) с насыщенными углеводородами.
(6) Даже наличие конъюгации в молекуле изменяет ее стабильность (и, следовательно, реакционную способность).
Обсуждение возможных типов реакций выходит за рамки этого вводного руководства.
Имейте в виду, что термины «насыщенный» и «ненасыщенный» на данный момент могут применяться к органическим соединениям, кроме углеводородов.
Правило А-3. Ненасыщенные соединения и одновалентные радикалы (АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ)
Правило A-3.Ненасыщенные соединения и одновалентные радикалы (АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ)
Используйте возможности именования IUPAC на вашем рабочем столе!
ACD / Name (версия для химиков) предлагает стандартизированный набор функций для быстрого и простого создания имен IUPAC и структур на основе имен. Это усовершенствованная версия нашего популярного программного обеспечения ACD / Name.
Посмотрите полное описание и цены в нашем интернет-магазине.
Ациклические углеводороды
Правило А-3. Ненасыщенные соединения и одновалентные радикалы
3.1 — Ненасыщенные неразветвленные ациклические углеводороды, содержащие одну двойную связь, получают путем замены окончания «-ан» в названии соответствующего насыщенного углеводорода на окончание «-ен». Если есть две или более двойных связей, окончание будет «-адиен», «-атриен», и т. Д. Общее название этих углеводородов (разветвленных или неразветвленных) — «алкен», «алкадиен», «алкатриен». , и т. Д. Цепь пронумерована таким образом, чтобы давать минимально возможные номера двойным связям.Когда в циклических соединениях или продуктах их замещения локанты двойной связи различаются на единицу, в названии цитируется только нижний локант; когда они отличаются более чем на единицу, один локант помещается в скобки после другого (см. Правила A-31.3 и A-31.4).
Примеры Правил A-3.1
2-гексен 1,4-гексадиен
Сохранены следующие несистематические названия:
| Этилен | |
| Аллен |
3.2 — Ненасыщенные неразветвленные ациклические углеводороды, имеющие одну тройную связь, называются заменой конца «-ан» в названии соответствующего насыщенного
углеводород с окончанием «-yne». Если имеется две или более тройных связей, окончание будет «-адийн», «атриин», и т. Д. Общие названия этих углеводородов (разветвленные или неразветвленные):
«алкин», «алкадиин», «алкатриин» и т. д. Цепь пронумерована таким образом, чтобы давать минимально возможные номера тройным связям.В названии цитируется только нижний локант тройной связи.
соединение.
Название «ацетилен» сохраняется.
3,3 — Ненасыщенные неразветвленные ациклические углеводороды, содержащие как двойные, так и тройные связи, называют заменой окончания «-ан» в названии соответствующего насыщенного углеводорода на
окончание «-enyne», «-adienyne», «-atrienyne», «-enediyne» и т. д. Двойным и тройным связям присваиваются как можно более низкие числа, даже если это может иногда давать «-yne» меньшее число, чем
«-ене».При выборе нумерации двойным связям присваиваются наименьшие номера.
Примеры правила A-3.3
1,3-гексадиен-5-ин 3-Penten-1-yne 1-пентен-4-ин
3,4 — Ненасыщенные разветвленные ациклические углеводороды называются производными неразветвленных углеводородов, которые содержат максимальное количество двойных и тройных связей.Если есть два или более
цепи, конкурирующие за выбор, как цепь с максимальным количеством ненасыщенных связей, тогда выбор переходит к (1) той, которая имеет наибольшее количество атомов углерода; (2) количество атомов углерода
при равных условиях тот, который содержит максимальное количество двойных связей. В остальном применимы те же принципы, что и для обозначения насыщенных разветвленных ациклических углеводородов. Цепочка пронумерована так, чтобы
присвойте минимально возможное количество двойным и тройным связям в соответствии с Правилом A-3.3.
Примеры Правил A-3.4
Следующее название сохраняется только для незамещенного соединения:
3,5 — Названия одновалентных радикалов, полученных из ненасыщенных ациклических углеводородов, имеют окончания «-енил», «-инил», «-диенил» и т. Д. ., положения
при необходимости указываются двойные и тройные связи.Атом углерода со свободной валентностью имеет номер 1.
Примеры Правил A-3.5
Исключения:
Следующие названия сохранены (только для незамещенного радикала):
| Винил (для этенила) | |
| Аллил (для 2-пропенила) | |
| Изопропенил (для 1-метилвинила) |
3.6 — Когда есть выбор для основной цепи радикала, выбирается та цепь, которая содержит (1) максимальное количество двойных и тройных связей; (2)
наибольшее количество атомов углерода; и (3) наибольшее количество двойных связей.
Примеры Правил A-3.6
См. Рекомендации’93 R-3.1.1
- Далее:
- Двухвалентные и многовалентные радикалы
Это HTML-воспроизведение разделов A, B и C «Синей книги» ИЮПАК максимально приближено к
опубликованная версия [см. Номенклатура органической химии, разделы A, B, C, D, E, F и H , Pergamon Press, Oxford, 1979.Copyright 1979 IUPAC.] Если вам нужно процитировать эти правила, пожалуйста, укажите эту ссылку как их источник.
Опубликовано с разрешения IUPAC Advanced Chemistry Development, Inc. , www.acdlabs.com, +1(416)368-3435 тел, +1(416)368-5596 факс. С комментариями или предложениями обращайтесь по адресу [email protected]
8.10: Ненасыщенные углеводороды — химия LibreTexts
Два важных семейства углеводородов, которые не встречаются в нефти, — это алкены (также называемые олефинами) и алкины ( также называется ацетиленом).Как уже видно, часто бывает два названия простых органических соединений. С 1930 года Международный союз теоретической и прикладной химии (IUPAC) разработал систематический метод наименования всех органических соединений, но многие из более ранних названий все еще существуют, особенно среди промышленных химиков. Где необходимо, будут даны оба имени, старое имя заключено в круглые скобки. Молекулы алкенов похожи на молекулы алканов, за исключением того, что они содержат двойную связь углерод-углерод () и на два атома H меньше.Таким образом, они имеют общую формулу C n H 2 n . Молекулы алкинов содержат тройные связи () и на четыре атома H меньше, чем у соответствующего алкана. Их общая формула, таким образом, C n H 2 n –2 . Соединения, содержащие двойные или тройные связи, часто вместе называют ненасыщенными соединениями . Из-за их множественных связей алкены и алкины обычно более химически активны, чем алканы и ароматические углеводороды.
Наличие двойной или тройной связи в молекуле открывает гораздо больше возможностей для изомерии, чем в случае алканов. Обычно существует несколько альтернативных мест для множественной связи, а в случае двойной связи существует возможность цис-транс-изомерии. Таким образом, хотя возможны только две молекулы алкана с четырьмя атомами углерода, возможны четыре молекулы алкена:
Рисунок 1), соединяющие два атома вместе. При изготовлении такой модели необходимо изрядно согнуть пружины, чтобы они вошли в соответствующие отверстия в шариках.Способность сгибаться или растягиваться характерна для всех химических связей, а не только между атомами с двойной связью. Таким образом, каждый атом может колебаться в наиболее стабильном положении. Возможно, во всех случаях модели с шариковой пружиной будут более подходящими, чем модели с шариковой ручкой.
Картина изогнутой связи позволяет легко объяснить некоторые характеристики двойных связей. Как отмечалось в статье «Химическая связь — электронные пары и октеты», расстояние между двумя атомными ядрами, соединенными двойной связью, короче, чем если бы они были соединены одинарной связью.В случае углерод-углеродных связей, например, расстояние составляет 133 пм, а расстояние C — C составляет 156 пм. Это имеет смысл, когда мы понимаем, что каждая изогнутая связь проходит по кривой. Расстояние между концами такого пути (ядрами C) обязательно короче самого пути.
Рис. \ (\ PageIndex {1} \) Шариковые модели для трех изомерных форм C 2 H 2 F 2 . Атомы углерода темно-серые, атомы водорода светло-красные, а атомы фтора светло-серые.Обратите внимание, что все три структуры различны, хотя молекулярная формула всегда C 2 H 2 F 2 . Структуры (b) и (c) различаются только из-за барьера для вращения вокруг двойной связи углерод-углерод.
Другая особенность двойных связей состоит в том, что они затрудняют скручивание одного конца молекулы относительно другого. Это явление обычно называют барьером вращения . Такой барьер объясняет тот факт, что можно получить три различных соединения с формулой C 2 H 2 F 2 .Их структуры показаны на рисунке 2. Структура ( a ) уникальна, потому что оба атома F присоединены к одному и тому же атому C, но ( b ) и ( c ) отличаются только поворотом на 180 ° вправо. -ручная группа. Если бы не было барьера для вращения вокруг двойной связи, структуры ( b ) и ( c ) могли бы очень быстро взаимопревращаться всякий раз, когда они сталкиваются с другими молекулами. Тогда было бы невозможно приготовить образец, содержащий только молекулы типа ( b ) или только молекулы типа ( c ).
Поскольку они имеют одинаковую молекулярную формулу, ( a ), ( b ) и ( c ) являются изомерами. Структура ( b ), в которой два атома F находятся на противоположных сторонах двойной связи, называется транс-изомером , тогда как структура ( c ), в которой два одинаковых атома находятся на той же стороне , является называется цис-изомер . Легко объяснить, почему существует барьер для вращения, предотвращающий взаимное превращение этих цис- и транс-изомеров в рамках нашей модели изогнутой связи.Вращение одной части молекулы вокруг линии, проходящей через атомы C, заставит одно из электронных облаков с изогнутыми связями закручиваться вокруг другого. Если не разорвется половина двойной связи, невозможно повернуть молекулу на очень большой угол.
Хотя алкены не присутствуют в сырой нефти, они производятся в больших количествах при переработке нефти . Многие углеводороды в сырой нефти имеют очень длинные цепи и представляют собой твердые вещества или густые сиропообразные жидкости при обычных температурах из-за их относительно больших межмолекулярных сил.Самый важный нефтепродукт — бензин — требует молекул, содержащих от 6 до 12 атомов углерода. Их можно получить путем нагревания соединений с более длинной цепью. Эти большие молекулы извиваются так быстро при более высоких температурах, что «трескаются» или распадаются на более мелкие фрагменты. Обычно катализатор добавляют для ускорения реакции, которая называется каталитическим крекингом . Когда происходит крекинг, образуется одна молекула алкена и одна молекула алкана:
С промышленной точки зрения наиболее важными алкенами являются два самых простых: этен (этилен) и пропен (пропилен).Почти 1,11 × 10 11 кг этена и 6,9 × 10 10 кг пропена были потреблены во всем мире в 2006 г. [1] . Оба используются при производстве пластмасс. Они также являются сырьем для производства моющих средств, антифризов, эластичных материалов и смазочных масел.
Среди алкинов только два самых простых имеют какое-либо промышленное значение. И этин (ацетилен), и пропин (метилацетилен) используются при сварке и резке стали, где они сжигаются вместе с чистым кислородом в кислородно-ацетиленовой горелке.Однако по мере того, как запасы нефти сокращаются, ацетилен может стать более важным в качестве исходного материала для производства других химикатов, поскольку его можно производить из угля.
- ↑ Томассон, А. «CMAI объявляет о завершении мировых анализов олефинов; анализа мировых легких олефинов и анализа мирового бутадиена». Chemical Market Associates, Inc., 5 декабря 2006 г. www.cmaiglobal.com/Marketing/…WLOA_WBA07.pdf
13: Ненасыщенные и ароматические углеводороды
- Последнее обновление
- Сохранить как PDF
Без заголовков
Наше современное общество в значительной степени основано на химических веществах, которые мы обсуждаем в этой главе.Большинство из них сделано из нефти. Алканы — насыщенные углеводороды — обладают относительно небольшим количеством важных химических свойств, кроме того, что они подвергаются горению и реагируют с галогенами. С другой стороны, ненасыщенные углеводороды — углеводороды с двойными или тройными связями — весьма реакционноспособны. Фактически, они служат строительными блоками для многих известных пластмасс — полиэтилена, виниловых пластиков, акрила — и других важных синтетических материалов (например, спиртов, антифриза и моющих средств). Ароматические углеводороды имеют формулы, которые можно представить как циклические алкены, что делает их ненасыщенными, но их структура и свойства, как правило, совершенно разные, поэтому они не считаются алкенами.Ароматические соединения служат основой для многих лекарств, антисептиков, взрывчатых веществ, растворителей и пластмасс (например, полиэфиров и полистирола). Два простейших ненасыщенных соединения — этилен (этен) и ацетилен (этин) — когда-то использовались в качестве анестетиков и были введены в область медицины в 1924 году. Однако было обнаружено, что ацетилен образует взрывчатые смеси с воздухом, поэтому его медицинское применение было прекращено. в 1925 году. Считалось, что этилен более безопасен, но он также был причастен к многочисленным смертельным пожарам и взрывам во время наркоза.Несмотря на это, он оставался важным анестетиком до 1960-х годов, когда его заменили негорючие анестетики, такие как галотан (\ (\ mathrm {CHBrClCF_3} \)).
- 13.0: Введение к ненасыщенным и ароматическим углеводородам
- Два простейших ненасыщенных соединения — этилен (этен) и ацетилен (этин) — когда-то использовались в качестве анестетиков и были введены в медицину в 1924 году. Однако они были открыты. что ацетилен образует взрывоопасные смеси с воздухом, поэтому в 1925 году его медицинское использование было прекращено.Этилен считался более безопасным, но он также был причастен к многочисленным смертельным пожарам и взрывам во время наркоза. Несмотря на это, он оставался важным анестетиком до 1960-х годов, когда его заменили негорючими анами.
- 13.1: Алкены — структуры и названия
- Алкены — это углеводороды с двойной связью углерод-углерод.
- 13.2: Цис-транс-изомеры (геометрические изомеры)
- Цис-транс (геометрическая) изомерия существует, когда в молекуле ограничено вращение и есть две неидентичные группы на каждом атоме углерода с двойной связью.
- 13.3: Физические свойства алкенов
- Физические свойства алкенов очень похожи на свойства алканов: их точки кипения увеличиваются с увеличением молярной массы, и они нерастворимы в воде.
- 13.4: Химические свойства алкенов
- Алкены претерпевают реакции присоединения, добавляя такие вещества, как водород, бром и вода, по двойной связи углерод-углерод.
- 13.5: Полимеры
- Молекулы, имеющие двойные связи углерод-углерод, могут подвергаться аддитивной полимеризации.
- 13,6: Алкины
- Алкины похожи на алкены как по физическим, так и по химическим свойствам. Например, алкины подвергаются многим типичным реакциям присоединения алкенов. Международный союз чистой и прикладной химии (IUPAC) называет алкины аналогами алкенов, за исключением того, что окончание семейства — -yne, а не -ene. Название ацетилена по ИЮПАК — этин.Названия других алкинов проиллюстрированы в следующих упражнениях.
- 13,7: Ароматические соединения — бензол
- Ароматические углеводороды кажутся ненасыщенными, но они имеют особый тип связывания и не подвергаются реакциям присоединения.
- 13.8: Структура и номенклатура ароматических соединений
- Ароматические соединения содержат бензольное кольцо или обладают определенными бензольноподобными свойствами; для наших целей вы можете распознать ароматические соединения по наличию в их структуре одного или нескольких бензольных колец.
- 13.E: Ненасыщенные и ароматические углеводороды (упражнения)
- Выберите проблемы и решения для главы.
- 13.S: ненасыщенные и ароматические углеводороды (резюме)
- Краткое содержание главы.
Насыщенные и ненасыщенные углеводороды
Насыщенные и ненасыщенные углеводороды
Углеводороды или молекулы, которые содержат атомы водорода и атомы углерода, которые связаны друг с другом и могут содержать или не содержать другие атомы, подразделяются на две отдельные категории: насыщенные и ненасыщенные.Эти углеводороды, входящие в состав органических соединений, имеют отличные характеристики, основанные на этой дополнительной классификации.
В отличие от насыщенных углеводородов, в которых все атомы водорода и атомы углерода связаны одинарными связями, у ненасыщенных углеводородов есть двойные или даже тройные связи между атомами углерода. Это делает ненасыщенные углеводороды даже более активными, чем насыщенные углеводороды, а также имеет меньше атомов водорода, связанных с атомами углерода, чем насыщенные углеводороды.
1. Алканы — это насыщенные углеводороды, которые, следовательно, содержат только атомы водорода и углерода, связанные друг с другом, и обычно имеют химическую формулу C n H 2n + 2 . Типичный пример — парафин.
2. Алкены. Эти ненасыщенные углеводороды представляют собой молекулы, содержащие по крайней мере одну двойную связь углерод-углерод. Благодаря химической формуле, состоящей из молекул C n H 2n , алкены очень распространены в нефтехимической промышленности; простейший алкен — этилен или этан.
3. Алкины — углеводороды этой категории являются ненасыщенными и содержат по крайней мере одну тройную связь углерод-углерод. Гидрофобные ацетилены являются обычными примерами алкинов.
4. Циклоалканы. Насыщенные углеводороды образуют не только связи углерод-водород, но и связи углерод-углерод, к которым затем должны быть добавлены атомы водорода. Эти алканы должны иметь префикс «цикло» из-за конфигурации колец атомов углерода в их структуре.
5.Ароматические углеводороды — эти ненасыщенные углеводороды имеют в своих молекулах чередующиеся одинарные или двойные связи углерод-углерод. Термин «ароматические» применялся к этой категории углеводородов до того, как была открыта химическая природа ароматичности, и поэтому они были названы ароматическими просто потому, что эти соединения имели приятный запах.
Насыщенные и ненасыщенные углеводороды
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.

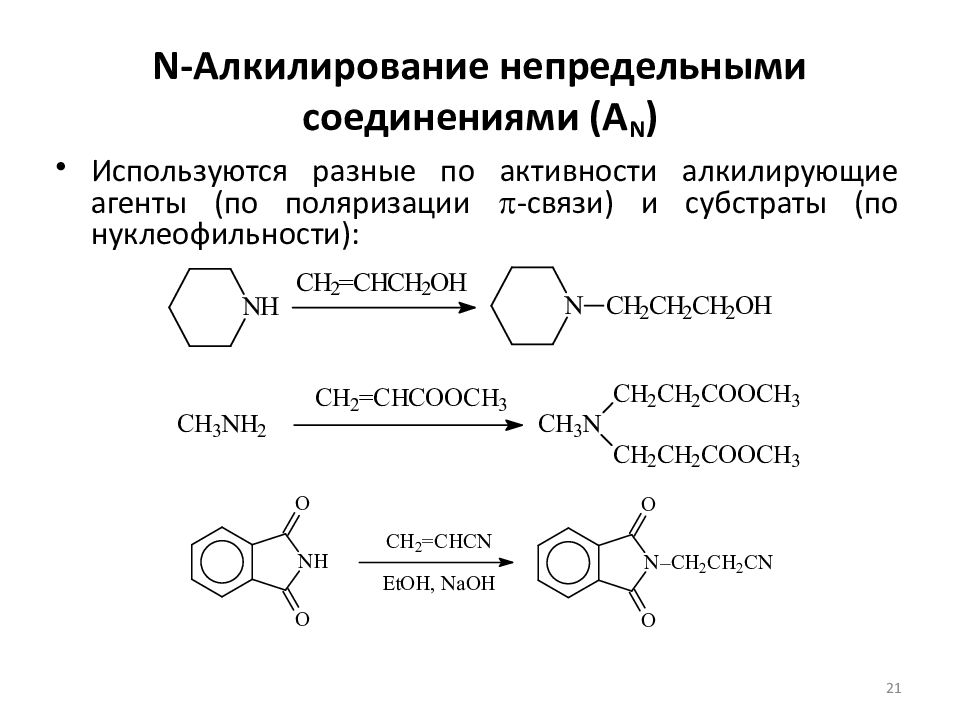 Продуктом реакции всегда является алкан.
Продуктом реакции всегда является алкан.