Содержание
Молекулярная масса.Mr (Ba(OH)2) = ?
Задача 7 – Абракадабра
Ученик получил задание, в котором по названиям веществ необходимо было
составить их химические формулы. Выполняя это задание, о
…
н не оставил
пробелы между формулами веществ, в результате чего у него получилась
запись: h3ON2O3NaBO2h3CO2K3NCFeCl3N2К2SO3
1. Выделите из этой записи формулы индивидуальных веществ (учитывая,
что ни одно из веществ дважды не повторяется).
2. Отметьте простые вещества.
3. Напишите уравнения всех возможных реакций (с указанием условий их
протекания) записанных в п.1 веществ с водой.
Задача 8 – Изоэлектронные молекулы
Молекула вещества Х изоэлектронна молекуле азота (приставка «изо», про-
исходящая от греч. ισος – «равный», обозначает единообразие, равенство).
Вещества Х и азот имеют не только близкие физические свойства, но и
определенные аналогии в своих химических превращениях (хотя соеди-
нение Х более активно, чем азот).
Напишите пары реакций (для Х и азота), подтверждающих их окислитель-
ные и восстановительные свойства. Приведите условия протекания ука-
Приведите условия протекания ука-
занных реакций, подтверждающие отличие в активности указанных со-
единений.
Приведите примеры реакций, подтверждающие принципиальные отличия в
свойствах этих двух веществ (реакция протекает для одного из веществ и
не протекает для другого или реакции идут в принципиально разных на-
правлениях).
Задача 9 – Изомеры углеводорода
Плотность углеводорода А по водороду равна 27.
Напишите все возможные изомеры А, удовлетворяющие указанному усло-
вию.
К каким классам органических соединений эти изомеры относятся?
Какой из изомеров, на Ваш взгляд, обладает наименьшей устойчивостью?
Хелп плиз
Азот смешали с одним из газообразных (н.у.) алканов. В данной смеси газов объемная доля (N2) = 20%, а массовая доля (N2)= 13,73%. Установите молекуляр
…
ную формулу алкана.
Сплавили смесь равных масс ацетата натрия и гидроксида наьрия. Выделившийся газ сожгли в кислороде (недостатке) и получили смесь двух окчидов углерода
…
объемом (н.у.) 8,96 дм³ и плотностью 1,538 г/дм³. Рассчитайте массу исходной смечи соли и щелочи
Рассчитайте массу исходной смечи соли и щелочи
Рассчитайте число формульных единиц в элементарной ячейке минерала сфалерита ZnS, если известно, что ионы цинка образуют ГЦК, в которой половина тетра
…
эдрических пустот заселена ионами серы.
Минерал Li2O имеет структуру анти-флюорита (расположение катионов и анионов обратно структуре флюорита). Укажите значение координационного числа лития
…
в структуре.
Решите пожалуйста задачу . Розрахуйте співвідношення мас Літію і Оксигену в літій оксиді (Li2O).(заранее спасибо♡)
Решите пожалуйста задачу ♡ .Розрахуйте співвідношення мас Літію і Оксигену в літій оксиді (Li2O).
Помогите пожалуйста.Задача 4. Розрахуйте співвідношення мас Магнію і Оксигену в магній оксиді (MgO).
Помогите пожалуйста.Задача 3. Скласти формулу сполуки Нітрогену з Оксигеном, якщо відношення мас Нітрогену та Оксигену в ній становить 7:20.
Какова масса 20 процентного раствора содержащего 60 грамм сахара?
Чему равна молекулярная масса Al(OH)3
Задача 7 – Абракадабра
Ученик получил задание, в котором по названиям веществ необходимо было
составить их химические формулы. Выполняя это задание, о
Выполняя это задание, о
…
н не оставил
пробелы между формулами веществ, в результате чего у него получилась
запись: h3ON2O3NaBO2h3CO2K3NCFeCl3N2К2SO3
1. Выделите из этой записи формулы индивидуальных веществ (учитывая,
что ни одно из веществ дважды не повторяется).
2. Отметьте простые вещества.
3. Напишите уравнения всех возможных реакций (с указанием условий их
протекания) записанных в п.1 веществ с водой.
Задача 8 – Изоэлектронные молекулы
Молекула вещества Х изоэлектронна молекуле азота (приставка «изо», про-
исходящая от греч. ισος – «равный», обозначает единообразие, равенство).
Вещества Х и азот имеют не только близкие физические свойства, но и
определенные аналогии в своих химических превращениях (хотя соеди-
нение Х более активно, чем азот).
Напишите пары реакций (для Х и азота), подтверждающих их окислитель-
ные и восстановительные свойства. Приведите условия протекания ука-
занных реакций, подтверждающие отличие в активности указанных со-
единений.
Приведите примеры реакций, подтверждающие принципиальные отличия в
свойствах этих двух веществ (реакция протекает для одного из веществ и
не протекает для другого или реакции идут в принципиально разных на-
правлениях).
Задача 9 – Изомеры углеводорода
Плотность углеводорода А по водороду равна 27.
Напишите все возможные изомеры А, удовлетворяющие указанному усло-
вию.
К каким классам органических соединений эти изомеры относятся?
Какой из изомеров, на Ваш взгляд, обладает наименьшей устойчивостью?
Хелп плиз
Азот смешали с одним из газообразных (н.у.) алканов. В данной смеси газов объемная доля (N2) = 20%, а массовая доля (N2)= 13,73%. Установите молекуляр
…
ную формулу алкана.
Сплавили смесь равных масс ацетата натрия и гидроксида наьрия. Выделившийся газ сожгли в кислороде (недостатке) и получили смесь двух окчидов углерода
…
объемом (н.у.) 8,96 дм³ и плотностью 1,538 г/дм³. Рассчитайте массу исходной смечи соли и щелочи
Рассчитайте число формульных единиц в элементарной ячейке минерала сфалерита ZnS, если известно, что ионы цинка образуют ГЦК, в которой половина тетра
…
эдрических пустот заселена ионами серы.
Минерал Li2O имеет структуру анти-флюорита (расположение катионов и анионов обратно структуре флюорита). Укажите значение координационного числа лития
Укажите значение координационного числа лития
…
в структуре.
Решите пожалуйста задачу . Розрахуйте співвідношення мас Літію і Оксигену в літій оксиді (Li2O).(заранее спасибо♡)
Решите пожалуйста задачу ♡ .Розрахуйте співвідношення мас Літію і Оксигену в літій оксиді (Li2O).
Помогите пожалуйста.Задача 4. Розрахуйте співвідношення мас Магнію і Оксигену в магній оксиді (MgO).
Помогите пожалуйста.Задача 3. Скласти формулу сполуки Нітрогену з Оксигеном, якщо відношення мас Нітрогену та Оксигену в ній становить 7:20.
Какова масса 20 процентного раствора содержащего 60 грамм сахара?
Решение задачи
1. Поскольку при сжигании Х были получены только углекислый газ и вода, Х могло содержать углерод, водород и кислород. Найдем количество образовавшихся при сгорании Х веществ: n(СО2) = 10,08 / 22,4 = 0,45 моль; n(Н2О) = 3,6 /18 = 0,2 моль. Следовательно, количество углерода и водорода, содержащееся в сжигаемой навеске Х равно: n(С) = 0,45 моль; n(Н) = 0,4 моль; n(О) = (6,6 — (0,45 × 12 + 0,4 × 1)) / 16 = 0,05 моль. Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
Следовательно, количество углерода и водорода, содержащееся в сжигаемой навеске Х равно: n(С) = 0,45 моль; n(Н) = 0,4 моль; n(О) = (6,6 — (0,45 × 12 + 0,4 × 1)) / 16 = 0,05 моль. Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
2-3. Поскольку соединение содержит один атом кислорода, оно может быть спиртом, альдегидом, кетоном или простым эфиром. Х реагирует с аммиачным раствором оксида серебра(I), при нагревании его с гидроксидом меди(II) наблюдается выпадение красного осадка. Эти реакции указывают на наличие альдегидной группы в составе Х (Х можно отнести к классу альдегидов).
Т.к. вещество Х обесцвечивает бромную воду, оно может содержать в составе молекулы кратные связи (Х можно отнести к непредельным соединениям). Поскольку при окислении перманганатом калия образуется бензойная кислота (Х можно отнести к ароматическим соединениям), единственным соединением, которое удовлетворяет всем условиям, является 3‑фенилпропеналь (коричный альдегид).
3.Уравнения описанных в условии задачи реакций:
4. Коричный альдегид может существовать в виде цис- и транс-изомеров.
Определение относительная атомная масса в химии. Относительная атомная масса элемента
Атомы имеют очень маленький размер и очень маленькую массу. Если выражать массу атома какого-нибудь химического элемента в граммах, то это будет число перед которым находится более двадцати нулей после запятой. Поэтому измерять массу атомов в граммах неудобно.
Однако, если принять какую-либо очень малую массу за единицу, то все остальные малые массы можно выражать как отношение к этой единицы. В качестве единицы измерения массы атома была выбрана 1/12 часть массы атома углерода.
1/12 часть массы атома углерода называют атомной единицей массы
(а. е. м.).
Относительной атомной массой
является величина, равная отношению реальной массы атома конкретного химического элемента к 1/12 реальной массы атома углерода. Это безразмерная величина, так как делятся две массы.
A r = m ат. / (1/12)m угл.
Однако абсолютная атомная масса
равна относительной по значению и имеет единицу измерения а.е.м.
То есть относительная атомная масса показывает, во сколько раз масса конкретного атома больше 1/12 атома углерода. Если у атома A r = 12, значит его масса в 12 раз больше 1/12 массы атома углерода, или, другими словами, в нем 12 атомных единиц массы. Такое может быть только у самого углерода (C). У атома водорода (H) A r = 1. Это значит, что его масса равна массе 1/12 части от массы атома углерода. У кислорода (O) относительная атомная масса равна 16 а.е.м. Это значит, что атом кислорода в 16 раз массивнее 1/12 атома углерода, в нем 16 атомных единиц массы.
Это значит, что его масса равна массе 1/12 части от массы атома углерода. У кислорода (O) относительная атомная масса равна 16 а.е.м. Это значит, что атом кислорода в 16 раз массивнее 1/12 атома углерода, в нем 16 атомных единиц массы.
Самый легкий элемент — это водород. Его масса примерно равна 1 а.е.м. У самых тяжелых атомов масса приближается к 300 а.е.м.
Обычно для каждого химического элемента его значение абсолютной массы атомов, выраженных через а. е. м. округляют.
Значение атомных единиц массы записаны в таблице Менделеева.
Для молекул используется понятие относительной молекулярной массы (M r)
. Относительная молекулярная масса показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Но поскольку масса молекулы равна сумме масс составляющих ее атомов, то относительную молекулярную массу можно найти, просто сложив относительные массы этих атомом. Например, в молекулу воды (H 2 O) входят два атома водорода с A r = 1 и один атом кислорода с A r = 16.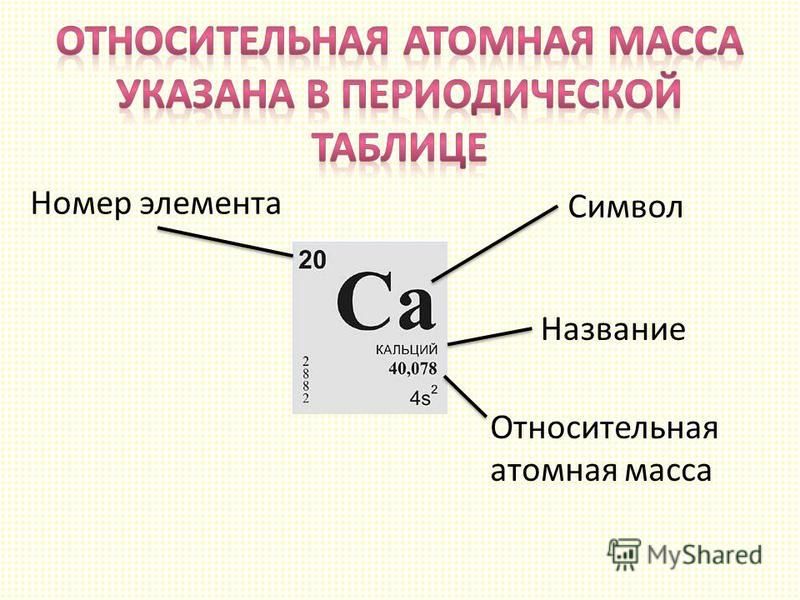 Следовательно, Mr(Н 2 O) = 18.
Следовательно, Mr(Н 2 O) = 18.
Ряд веществ имеет немолекулярное строение, например металлы. В таком случае их относительную молекулярную массу считают равной их относительной атомной массе.
В химии важным является величина, которая называется массовая доля химического элемента
в молекуле или веществе. Она показывает, какая часть относительной молекулярной массы приходится на данный элемент. Например, в воде на водород приходится 2 доли (так как два атома), а на кислород 16. То есть, если смешать водород массой 1 кг и кислород массой 8 кг, то они прореагируют без остатка. Массовая доля водорода равна 2/18 = 1/9, а массовая доля кислорода 16/18 = 8/9.
Из материалов урока вы узнаете, что атомы одних химических элементов отличаются от атомов других химических элементов массой. Учитель расскажет, как химики измеряли массу атомов, которые настолько мало, что их не увидишь даже с помощью электронного микроскопа.
Тема: Первоначальные химические представления
Урок: Относительная атомная масса химических элементов
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
(спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода. В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Известно, что массовая доля магния в оксиде магния равна 60%, а массовая доля кислорода – 40%. Идя по пути рассуждений Дальтона, можно сказать, что масса атома магния больше массы атома кислорода в 1,5 раза (60/40=1,5):
Ученый заметил, что масса атома водорода самая маленькая, т. к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Значительно позже работ Берцелиуса массы атомов химических элементов стали сравнивать с 1/12 массы атома углерода (Рис. 2).
Рис. 1. Модель расчета относительной атомной массы химического элемента
Относительная атомная масса химического элемента показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода.
Относительная атомная масс обозначается А r , она не имеет единиц измерения, так как показывает отношение масс атомов.
Например: А r (S) = 32, т.е. атом серы в 32 раза тяжелее 1/12 массы атома углерода.
Абсолютная масса 1/12 атома углерода является эталонной единицей, значение которой вычислено с высокой точностью и составляет 1,66 *10 -24 г или 1,66 *10 -27 кг. Эта эталонная масса называется атомной единицей массы
(а.е.м.).
Значения относительных атомных масс химических элементов запоминать не надо, они приведены в любом учебнике или справочнике по химии, а также в периодической таблице Д.И. Менделеева.
При расчетах значения относительных атомных масс принято округлять до целых.
Исключение составляет относительная атомная масса хлора – для хлора используют значение 35,5.
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006.
Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.24-25)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§10)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§8,9)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых
образовательных ресурсов ().
2. Электронная
версия журнала «Химия и жизнь» ().
Домашнее задание
с.24-25 №№ 1-7
из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Атомно-молекулярное учение определяет атом, как мельчайшую химически неделимую частицу. А если это частица, то она должна иметь массу, которая очень мала. Современные методы исследования позволяют с большой точностью определять эту величину.
Пример:
m(H) = 1,674· 10 -27 кг
m(O) = 2,667 · 10 -26 кг Абсолютные массы
m (C) = 1,993 · 10 -26 кг
Представленные величины очень неудобны для проведения вычислений. Поэтому в химии чаще используют не абсолютные, а относительные атомные массы. Относительная атомная масса (Аr) представляет собой отношение абсолютной массы атома к 1/12 массы атома углерода. С помощью формулы — это можно записать так
1/12m(c) является величиной сравнения и называется 1 а.е.м.
1а.е.м. = 1/12· 1,993 · 10 -26 кг = 1,661 · 10-27 кг
Посчитаем Аr для некоторых элементов.
Аr(О) = = = 15,99 ~ 16
Аr(H) = = = 1,0079 ~ 1
Сравнивая относительные атомные массы кислорода и водорода с абсолютными, хорошо видны преимущества Аr.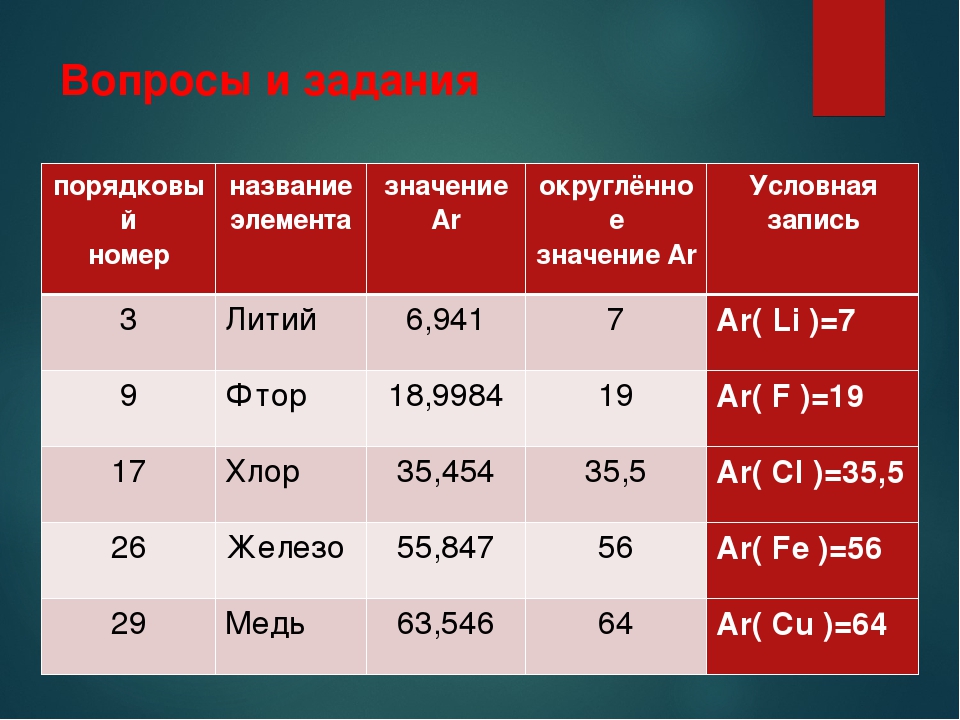 Величины Аr намного проще. Их удобнее использовать в вычислениях. Готовые величины Аr приведены в таблице Менделеева. Используя Аr элементов, можно проводить сравнения их масс.
Величины Аr намного проще. Их удобнее использовать в вычислениях. Готовые величины Аr приведены в таблице Менделеева. Используя Аr элементов, можно проводить сравнения их масс.
Данное вычисление показывает, что атом цинка весит в 2,1 раза больше, чем атом фосфора.
Относительная молекулярная масса (Mr)
равна сумме относительных атомных масс, входящих в нее атомов (безразмерна). Вычислим относительную молекулярную массу воды. Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
вычислите относительные молекулярные массы веществ.
Mr (Cu 2 O)=143,0914
Mr (Na 3 PO 4)= 163,9407
Mr (AlCl 3)= 133,3405
Mr (Ba 3 N 2)= 439,9944
Mr (KNO 3)= 101,1032
Mr (Fe (OH) 2)= 89,8597
Mr (Mg(NO 3) 2)= 148,3148
Mr (Al 2 (SO 4) 3)= 342,1509
Количество вещества (n) — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы).
Единицей измерения количества вещества (n) является моль. Моль
– количество вещества, содержащее столько структурных элементарных единиц (молекул, атомов, ионов, электронов и т.д.), сколько содержится атомов в 0,012 кг (12 г) = 1 моль изотопа углерода 12 С.
Число атомов N A в 0,012 кг (12 г) углерода, или в 1 моль, легко определить следующим образом:
Величина N A называется постоянной Авогадро.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например, для реакции горения водорода (2h3 + O2 → 2h3O) требуется в два раза большее количество вещества водорода, чем кислорода. Соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Пример:
в 1 моле хлорида кальция = содержит 6,022×10 23 молекул (формульных единиц) — CaCl 2 .
1 моль (1 М) железа = 6 .
10 23 атомов Fe
1 моль (1 М) ионов хлора Cl — = 6 .
10 23 ионов Cl — .
1 моль (1 М) электронов е — = 6 .
10 23 электронов е — .
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса:
Молярная масса (М) — это масса одного моля вещества (кг/моль, г/моль
).
Относительная молекулярная масса и молярная масса вещества численно совпадают, но имеют разную размерность, например, для воды М r = 18 (относительная атомная и молекулярная массы величины безразмерные), М = 18 г/моль. Количество вещества и молярная масса связаны простым соотношением:
Большую роль в формировании химической атомистики сыграли основные стехиометрические законы, которые были сформулированы на рубеже XVII и XVIII столетий.
1. ЗАКОН СОХРАНЕНИЯ МАССЫ
ЗАКОН СОХРАНЕНИЯ МАССЫ
(М.В. Ломоносов,1748).
Сумма масс продуктов реакции равна сумме масс исходных веществ
. В качестве дополнения к этому закону может служить закон сохранения массы элемента (1789, А.Л. Лавуазье) — масса химического элемента в результате реакции не изменяется
. Эти законы имеют для современной химии определяющее значение, поскольку позволяют моделировать химические реакции уравнениями и выполнять на их основе количественные вычисления.
2. ЗАКОН ПОСТОЯНСТВА СОСТАВА
(Ж. Пруст,1799-1804).
Индивидуальное химическое вещество молекулярного строения имеет постоянный качественный и количественный состав, не зависящий от способа его получения
. Соединения, подчиняющиеся закону постоянства состава, называют дальтонидами. Дальтонидами являются все известные к настоящему времени органические соединения (около 30 миллионов) и часть (около 100 тыс.) неорганических веществ. Вещества, имеющие немолекулярное строение (бертолиды), не подчиняются данному закону и могут иметь переменный состав, зависящий от способа получения образца. К ним относятся большинство (около 500 тыс.) неорганических веществ.
К ним относятся большинство (около 500 тыс.) неорганических веществ.
3. ЗАКОН ЭКВИВАЛЕНТОВ
(И. Рихтер, Дж. Дальтон, 1792-1804).
Каждое сложное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Следовательно, химические вещества взаимодействуют друг с другом в строго определенных (эквивалентных) соотношениях. Массы реагирующих веществ прямо пропорциональны их эквивалентным массам
.
где Э А и Э В — эквивалентные массы реагирующих веществ.
4. ЗАКОН АВОГАДРО
(А. Авогадро,1811).
В равных объемах разных газов, измеренных в одинаковых условиях (давление, температура), содержится одинаковое число молекул
. Из закона следует, что:
Ø При нормальных условиях (н.у., Т = 273 К, р = 101,325 кПа) один моль любого газа занимает одинаковый объем — молярный объем
(V m), равный 22,4 л/моль.
Ø Отношение масс равных объемов разных газов, измеренных в одинаковых условиях (относительная плотность газа по газу
), равна отношению их молекулярных (молярных) масс.
Чаще всего определяют относительную плотность по водороду или воздуху. Соответственно,
,
где 29 — средняя, точнее средневзвешенная, молекулярная масса воздуха.
Ø Объемы реагирующих газов относятся друг к другу и к объемам газообразных продуктов реакции как простые целые числа
(закон объемных отношений Гей-Люссака).
Задача
Сколько граммов газообразного хлора нужно потратить и сколько граммов жидкого хлорида фосфора(III) получиться если в реакции использовано 1,45 граммов фосфора?
Р 4 (тв.) + Cl 2 (г.) = PCl 3 (ж.)
Решение: 1. Необходимо убедиться, что уравнение находиться в равновесии, т.е. необходимо проставить стехиометрические коэффициенты: Р 4 (тв.) + 6Cl 2 (г.) = 4PCl 3 (ж.). На 1 моль Р 4 я могу потратить 6 моль Cl 2 , чтобы получить 4 моля PCl 3
2. У нас есть масса Р 4 в реакции, следовательно, можно узнать сколько молей фосфора использовано. По Т.М. узнаем атомную массу фосфора ~ 31, это говорит, что 1 моль фосфора будет иметь массу 31 г (молярная масса), а атомная масса Р 4 будет 124 г. Найдем сколько молей в 1,45 г фосфора:
Найдем сколько молей в 1,45 г фосфора:
1,45 г – х моль х=0,0117 моль
124 г – 1 моль
3. Теперь узнаем сколько молей хлора нужно взять для использования 0,0117 молей фосфора. По равновесной реакции мы видим, что на 1 моль фосфора нужно взять 6 молей хлора, следовательно, хлора нужно взять в 6 раз больше. Считаем:
0,0117 х 6 = 0,07 молей хлора.
0,07 молей х 70,906 г (в 1 моле Cl 2) = 4,963 г Cl 2
5. Теперь найдем сколько граммов жидкого хлорида фосфора(III) получиться. Можно воспользоваться двумя разными решениями:
5.1. Закон сохранения массы 1,45г Р 4 (тв.) + 4,963 г. Cl 2 (г.) = 6,413 г.
PCl 3 (ж.)
5.2. А можно воспользоваться способом как мы находили массу необходимого фосфора.
Примеры:
Условие
Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 2h3O
Решение
Молярная масса BaCl2 2h3O составляет:
М(BaCl2 2h3O) = 137+ 2 35,5 + 2 18 =244 г/моль
Из формулы BaCl2 2h3O следует, что 1 моль дигидрата хлорида бария содержит 2 моль Н2О.
Определяем массу воды, содержащейся в BaCl2 2h3O: m(h3O) = 2 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария
BaCl2 2h3O. ω(h3O) = m(h3O)/ m(BaCl2 2h3O) = 36/244 = 0,1475 = 14,75%.
Пример самостоятельно
1.
Химическое соединение содержит по массе 17,56% натрия, 39,69% хрома и 42,75% кислорода. Определите простейшую формулу соединения. (Na 2 Cr 2 O 7).
2. Элементный состав вещества следующий: массовая доля элемента железа 0,7241 (или 72,41%), массовая доля кислорода 0,2759 (или 27,59%). Выведите химическую формулу. (Fe 3 O 4)
Пример (разбор)
.
Установите молекулярную формулу вещества, если массовая доля углерода в нем составляет 26,67%, водорода – 2,22%, кислорода – 71,11%. Относительная молекулярная масса этого вещества равна 90.
| Решение 1. Для решения задачи используем формулы: w = ; n = ; x: y: z = n(C) : n(H) : n(O). 2. Находим химические количества элементов, входящих в состав вещества, приняв, что m(C x H y O z) = 100 г. m(C) = w(C) · m(C x H y O z) = 0,2667 · 100 г = 26,67 г. m(H) = w(H) · m(C x H y O z) = 0,0222 · 100 г = 2,22 г. m(O) = w(O) · m(C x H y O z) = 0,7111 · 100 г = 71,11 г. n(C) = = = 2,22 моль.; n(H) = = = 2,22 моль.; n(O) = = = 4,44 моль. 3. Определяем эмпирическую формулу вещества: n(C) : n(H) : n(O) = 2,22 моль: 2,22 моль: 4,44 моль. x: y: z = 1: 1: 2. Эмпирическая формула вещества – CHO 2 . 4. Устанавливаем истинную молекулярную формулу вещества: M r (CHO 2) = A r (C) + A r (H) + 2A r (O) = 12 + 1 + 2·16 = 45; M r (CHO 2) : M r (C x H y O z) = 45: 90 = 1: 2. Истинная молекулярная формула вещества – C 2 H 2 O 4 . Ответ : молекулярная формула вещества C 2 H 2 O 4 . Задача.Найдите химическую формулу вещества, в состав которого входит 9 мас. ч. алюминия и 8 мас. ч. кислорода. Решение: Находим отношение числа атомов: Ответ: Химическая формула данного вещества: . Относительная плотность газа Х по газу У — D поУ (Х). Часто в задачах просят определить формулу вещества (газа) в зависимости от Относительной плотности D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У: D поУ (Х) = М(Х) / М(У) Часто для расчетов используют относительные плотности газов по водороду и по воздуху. Относительная плотность газа Х по водороду: D по h3 = M (газа Х) / M (h3) = M (газа Х) / 2 Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава). Поэтому: D по возд. = М (газа Х) / 29 Пример: Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93. Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г. 1. Найдём количество вещества каждого атома: ν(C) = m / M = 84,21 / 12 = 7,0175 моль, ν(H) = 15,79 / 1 = 15,79 моль. 2.Определяем мольное соотношение атомов С и Н: С: Н = 7,0175: 15,79 (поделим оба числа на меньшее) = 1: 2,25 (будем домножать на 1, 2,3,4 и т.п. пока после запятой не появится 0 или 9. В данной задаче нужно домножить на 4) = 4: 9. Таким образом, простейшая формула — С 4 Н 9 . 3. По относительной плотности рассчитаем молярную массу: М = D (возд.) 29 = 114 г/моль. Молярная масса, соответствующая простейшей формуле С 4 Н 9 — 57 г/моль, это в 2 раза меньше истинно молярной массы. Значит, истинная формула — С 8 Н 18 . | |
Одной из основных
характеристик любого химического
элемента является его относительная
атомная масса.
(Атомная
единица массы — это 1/12 массы атома
углерода, масса которого принимается
равной 12 а. е. м. и составляет
1,66
10
24
г.
Сравнивая массы атомов
элементов с одной а.е.м., находят численные
значения относительной атомной массы
(Аг).
Относительная атомная
масса элемента показывает, во сколько
раз масса его атома больше 1/12 массы
атома углерода.
Например, для кислорода
Аг (О) = 15,9994, а для водорода Аг (Н) = 1,0079.
Для молекул
простых и сложных веществ определяют
относительную молекулярную массу,
которая численно равна сумме атомных
масс всех атомов, входящих в состав
молекулы. Например, молекулярная масса
воды Н2
О
Мг (Н2O)
= 2 1,0079 + 1 15,9994 = 18,0153.
Закон авогадро
В химии наряду с
единицами массы и объёма используется
единица количества вещества, называемая
молем.
!МОЛЬ (v
)
— единица измерения количества вещества,
содержащего столько структурных единиц
(молекул, атомов, ионов), сколько атомов
содержится в 0,012 кг (12 г) изотопа углерода
«С’’.
Это означает,
что 1 моль любого вещества содержит одно
и то же число структурных единиц, равное
6,02 10
23
.
Эта
величина носит название
постоянной Авогадро
(обозначение N
А
,
размерность 1/моль).
Итальянский
ученый Амадео Авогадро в 1811 году выдвинул
гипотезу, которая в дальнейшем была
подтверждена опытными данными и получила
впоследствии название
закона Авогадро.
Он обратил внимание на то, что все газы
одинаково сжимаются (закон Бойля-Мариотта)
и обладают одинаковыми коэффициентами
термального расширения (закон
Гей-Люссака). В связи с этим он предположил,
что:
в равных объёмах
различных газов, находящихся при
одинаковых условиях, содержится
одинаковое число молекул.
При одинаковых условиях
(обычно говорят о нормальных условиях:
абсолютное давление равно 1013 миллибар
и температура 0° С) расстояние между
молекулами у всех газов одинаково, а
объём молекул ничтожно мал. Учитывая
все вышесказанное, можно сделать
предположение:
!если в равных объемах
газов при одинаковых условиях содержится
одинаковое
число молекул, то и массы, в которых
содержится одинаковое число молекул,должны
иметь одинаковые объёмы.
Другими словами,
При
одинаковых условиях 1 моль любого газа
занимает одинаковый объем. При норальных
условиях 1 моль любого газа занимает
объем
v
,
равный 22,4 л. Этот объем называется
молярным
объемом газа
(размерность л/моль или м
³
/моль).
Точное
значение молярного объёма газа при
нормальных условиях (давление 1013 миллибар
и температура 0° С) составляет
22,4135 ± 0,0006 л/моль. При стандартных условиях
(t
=+15°
С, давление = 1013 мбар) 1 моль газа занимает
объём 23,6451 л, а при
t
=+20°
С и давлении 1013 мбар 1 моль занимает
объём около 24,2 л.
В численном выражении
молярная масса совпадает с массами
атомов и молекул (в а. е. м.) и с относительными
атомными и молекулярными массами.
Следовательно, 1 моль
любого вещества имеет такую массу в
граммах, которая численно равна
молекулярной массе данного вещества,
выраженной в атомных единицах массы.
Например, М(O2)
= 16 а. е. м. 2 = 32 а. е. м., таким образом, 1
моль кислорода соответствует 32 г.
Плотности газов, измеренные при одинаковых
условиях, относятся как их молярные
массы. Так как при перевозке сжиженных
газов на газовозах основным объектом
практических задач являются молекулярные
вещества (жидкости, пары, газы), то и
основными искомыми величинами будут
молярная масса М
(г/моль), количество вещества v
в молях и масса т
вещества в граммах или килограммах.
Зная химическую формулу
того или иного газа, можно решить
некоторые практические задачи, возникающие
при транспортировке сжиженных газов.
Пример 1. В
дек-танке находится 22 т сжиженного
этилена (С
2
Н
4
).
Необходимо определить, достаточно ли
на борту груза, для того чтобы продуть
три грузовых танка объёмом 5000 м 3
каждый, если после продувки температура
танков будет составлять 0° С, а давление
1013 миллибар.
1. Определяем молекулярную
массу этилена:
М = 2 12,011 + 4 1,0079 =
28,054 г/моль.
2. Рассчитываем плотность
паров этилена при нормальных условиях:
ρ = M/V
= 28,054: 22,4 = 1,232 г/л.
3. Находим объём паров
груза при нормальных условиях:
22∙10 6:
1,252= 27544 м 3 .
Общий объём
грузовых танков составляет 15000 м 3 .
Следовательно, на борту достаточно
груза, для того чтобы продуть все грузовые
танки парами этилена.
Пример 2
.
Необходимо определить, какое количество
пропана (С
3
Н
8
)
потребуется для продувки грузовых
танков общей вместимостью 8000 м 3 ,
если температура танков составляет
+15° С, а давление паров пропана в танке
после окончания продувки не будет
превышать 1013 миллибар.
1. Определим
молярную массу пропана С
3
Н
8
М =
3 12,011 + 8 1,0079 =
44,1 г/моль.
2. Определим плотность
паров пропана после продувки танков:
ρ = М: v
= 44,1: 23,641 = 1,865 кг/м 3 .
3. Зная плотность паров
и объём, определяем общее количество
пропана, необходимое для продувки танка:
m
= ρ v
= 1,865 8000 = 14920 кг ≈
15 т.
В процессе развития науки химия столкнулась с проблемой подсчёта количества вещества для проведения реакций и полученных в их ходе веществ.
На сегодня для подобных расчётов химической реакции между веществами и смесями используют значение относительной атомной массы, внесённой в периодическую таблицу химических элементов Д. И. Менделеева.
Химические процессы и влияние доли элемента в веществах на ход реакции
Современная наука под определением «относительная атомная масса химического элемента» подразумевает, во сколько раз масса атома данного химического элемента больше одной двенадцатой части атома углерода.
С зарождением эры химии потребность в точных определениях хода химической реакции и её результатов росла.
Поэтому химики постоянно пытались решить вопрос о точных массах взаимодействующих элементов в веществе. Одним из лучших решений на то время была привязка к самому лёгкому элементу. И вес его атома был взят за единицу.
Исторический ход подсчёта вещества
Изначально использовался водород, затем кислород. Но этот способ расчёта оказался неточным. Причиной тому послужило наличие в кислороде изотопов с массой 17 и 18.
Поэтому, имея смесь изотопов, технически получали число, отличное от шестнадцати. На сегодня относительная атомная масса элемента рассчитывается исходя из принятого за основу веса атома углерода, в соотношении 1/12.
Дальтон заложил основы относительной атомной массы элемента
Лишь спустя некоторое время, в 19-м веке, Дальтон предложил вести расчёт по самому лёгкому химическому элементу — водороду. На лекциях своим студентам он демонстрировал на вырезанных из дерева фигурках, как соединяются атомы. По другим элементам он использовал данные, ранее полученные другими учёными.
По экспериментам Лавуазье в воде содержится пятнадцать процентов водорода и восемьдесят пять процентов кислорода. Имея эти данные, Дальтон рассчитал, что относительная атомная масса элемента, входящего в состав воды, в данном случае кислорода, составляет 5,67. Ошибочность его расчётов связана с тем, что он считал неверно относительно количества атомов водорода в молекуле воды.
По его мнению, на один атом кислорода приходился один атом водорода. Воспользовавшись данными химика Остина о том, что в составе аммиака 20 процентов водорода и 80 процентов азота, он рассчитал, чему равна относительная атомная масса азота. Имея этот результат, он пришёл к интересному выводу. Получалось, что относительная атомная масса (формула аммиака ошибочно была принята с одной молекулой водорода и азота) составляет четыре. В своих расчетах ученый опирался на периодическую систему Менделеева. По анализу он рассчитал, что относительная атомная масса углерода — 4,4, вместо принятых до этого двенадцати.
Несмотря на свои серьёзные промашки, именно Дальтон первым создал таблицу некоторых элементов. Она претерпела неоднократные изменения ещё при жизни учёного.
Изотопная составляющая вещества влияет на значение точности относительного атомного веса
При рассмотрении атомных масс элементов можно заметить, что точность по каждому элементу разная. К примеру, по литию она четырёхзначная, а по фтору — восьмизначная.
Проблема в том, что изотопная составляющая каждого элемента своя и непостоянна. Например, в обычной воде содержится три типа изотопа водорода. В их число, кроме обычного водорода, входит дейтерий и тритий.
Относительная атомная масса изотопов водорода составляет соответственно два и три. «Тяжёлая» вода (образованная дейтерием и тритием) испаряется хуже. Поэтому в парообразном состоянии изотопов воды меньше, чем в жидком состоянии.
Избирательность живых организмов к различным изотопам
Живые организмы обладают селективным свойством по отношению к углероду. На построение органических молекул используют углерод с относительной атомной массой, равной двенадцати. Поэтому вещества органического происхождения, а также ряд полезных ископаемых, таких как уголь и нефть, содержат меньше изотопной составляющей, чем неорганические материалы.
Микроорганизмы, перерабатывающие и накапливающие серу, оставляют после себя изотоп серы 32. В зонах, где бактерии не перерабатывают, доля изотопа серы — 34, то есть гораздо выше. Именно на основании соотношения серы в породах почвы геологи приходят к выводу о природе происхождения слоя — магматическую природу он имеет или же осадочную.
Из всех химических элементов только один не имеет изотопов — фтор. Поэтому его относительная атомная масса более точная, чем других элементов.
Существование в природе нестабильных веществ
У некоторых элементов относительная масса указана в квадратных скобках. Как видно, это элементы, расположенные после урана. Дело в том, что они не имеют устойчивых изотопов и распадаются с выделением радиоактивного излучения. Поэтому в скобках указан наиболее устойчивый изотоп.
Со временем выяснилось, что у некоторых из них возможно получить в искусственных условиях устойчивый изотоп. Пришлось менять в периодической таблице Менделеева атомные массы некоторых трансурановых элементов.
В процессе синтеза новых изотопов и измерения их продолжительности жизни порой удавалось обнаружить нуклиды с продолжительностью полураспада в миллионы раз дольше.
Наука не стоит на месте, постоянно открываются новые элементы, законы, взаимосвязи различных процессов в химии и природе. Поэтому, в каком виде окажется химия и периодическая система химических элементов Менделеева в будущем, лет через сто, — является туманным и неопределённым. Но хочется верить, что накопленные за прошедшие века труды химиков послужат новому, более совершенному знанию наших потомков.
Молекулярный вес OH
Молярная масса of OH = 17,00734 г / моль
Перевести граммы OH в моль или моль OH в граммы
Расчет молекулярной массы:
15.9994 + 1.00794
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| Водород | H | 1.00794 | 1 | 5,926% |
| Кислород | O | 15,9994 | 1 | 94,074% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции.Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы.Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать.Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
| |||||
Глава 1.7: Крот и молярная масса
Крот
Согласно теории Дальтона, каждое химическое соединение имеет определенную комбинацию атомов, и соотношение между числами и атомами присутствующих элементов обычно представляет собой небольшие целые числа.Мы также описали закон множественных пропорций , который гласит, что отношения масс элементов, которые образуют ряд соединений, являются небольшими целыми числами. Задача Дальтона и других ранних химиков состояла в том, чтобы обнаружить количественную связь между числом атомов в химическом веществе и его массой. Поскольку массы отдельных атомов настолько малы (порядка 10 −23 г / атом), химики не измеряют массу отдельных атомов или молекул.Например, в лаборатории масса соединений и элементов, используемых химиками, обычно колеблется от миллиграммов до граммов, в то время как в промышленности химические вещества покупаются и продаются в килограммах и тоннах. Поэтому для анализа превращений, происходящих между отдельными атомами или молекулами в химической реакции, химикам абсолютно необходимо знать, сколько атомов или молекул содержится в измеряемом количестве в лаборатории — данной массе образца. Единицей измерения, обеспечивающей эту связь, является моль (моль).Количество вещества, которое содержит такое же количество единиц (например, атомов или молекул), что и количество атомов углерода точно в 12 г изотопно чистого углерода-12., От латинского моль , что означает «куча» или « куча »(, а не от маленького подземного зверя!).
Многие знакомые вещи продаются в числовых количествах с необычными названиями. Например, банки с газировкой продаются упаковками по шесть штук, яйца продаются дюжинами (12), а карандаши часто продаются оптом (12 дюжин или 144).Листы бумаги для принтера упакованы в стопки по 500 штук, что на первый взгляд кажется большим количеством. Однако атомы настолько малы, что даже 500 атомов слишком малы, чтобы их можно было увидеть или измерить с помощью самых распространенных методов. Любая легко измеряемая масса элемента или соединения содержит чрезвычайно большое количество атомов, молекул или ионов, поэтому для их подсчета требуется чрезвычайно большая числовая единица. Для этого используется родинка.
моль определяется как количество вещества, которое содержит количество атомов углерода ровно в 12 г изотопно чистого углерода-12.Согласно последним экспериментальным измерениям, эта масса углерода-12 содержит 6,022142 × 10 23 атомов, но для большинства целей 6,022 × 10 23 дает достаточное количество значащих цифр. Подобно тому, как 1 моль атомов содержит 6,022 × 10 23 атома, 1 моль яиц содержит 6,022 × 10 23 яйца. Число в моле называется числом Авогадро: 6.022142 x 10 23 , в честь итальянского ученого XIX века, который первым предложил измерить количество молекул в газе.Поскольку массу газа также можно измерить на чувствительных весах, знание количества молекул и их общей массы позволяет нам просто определить массу отдельной молекулы в граммах.
Крот является мостом между атомным миром (аму) и лабораторией (граммы). Он позволяет определять количество молекул или атомов путем их взвешивания. Числовое значение числа Авогадро, обычно обозначаемое как Нет, является следствием произвольного значения в один килограмм, блока металла Pt-Ir, называемого международным прототипом килограмма, и выбора эталона для шкалы атомных единиц массы, одного атома. углерода-12.Моль C-12 по определению весит ровно 12 г, а число Авогадро определяется путем подсчета количества атомов. Это не так-то просто. Число Авогадро — это фундаментальная константа, которая определяется наименее точно.
Определение моля, то есть решение основать его на 12 г углерода-12, является произвольным, но оно было принято после некоторой дискуссии между химиками и физиками о том, использовать ли природный углерод, смесь C- 12 и С-13 или водород.Важным моментом является то, что 1 моль углерода — или чего-либо еще, будь то атомы, компакт-диски или дома — всегда имеет одинаковое количество объектов: 6.022 × 10 23 .
В следующем видео профессор Стив Бун показывает, как гипотезу Авогадро можно использовать для измерения молекулярных масс He, N 2 и CO2. Следуйте инструкциям и запишите измерения, чтобы получить относительные массы. Когда мы рассматриваем поведение газов в Блоке 5, мы можем использовать данные для расчета молекулярной массы каждого газа.Этот метод был до изобретения масс-спектрометра лучшим способом измерения молекулярной массы молекул газа
Обратите внимание на узор
У одного крота всегда одинаковое количество объектов: 6.022 × 10 23 .
Чтобы оценить величину числа Авогадро, рассмотрите моль пенсов. Сложенный вертикально, моль пенсов будет иметь высоту 4,5 × 10 17 мили, что почти в шесть раз больше диаметра галактики Млечный Путь. Если бы моль пенсов распределить поровну среди всего населения Земли, каждый человек получил бы более одного триллиона долларов.Ясно, что моль настолько велика, что ее можно использовать только для измерения очень маленьких объектов, например атомов.
Концепция мола позволяет нам подсчитать определенное количество отдельных атомов и молекул путем взвешивания измеримых количеств элементов и соединений. Чтобы получить 1 моль атомов углерода-12, мы должны отвесить 12 г изотопно чистого углерода-12. Поскольку каждый элемент имеет разную атомную массу, моль каждого элемента имеет разную массу, даже если он содержит одинаковое количество атомов (6.022 × 10 23 ). Это аналогично тому факту, что дюжина очень больших яиц весит больше, чем дюжина маленьких яиц, или что общий вес 50 взрослых людей превышает общий вес 50 детей. Из-за способа определения моля для каждого элемента количество граммов в моле совпадает с количеством атомных единиц массы в атомной массе элемента. Например, масса 1 моля магния (атомная масса = 24,305 а.е.м.) равна 24,305 г. Поскольку атомная масса магния (24.305 а.е.м.) чуть более чем вдвое больше, чем у атома углерода-12 (12 а.е.м.), масса 1 моля атомов магния (24,305 г) чуть более чем вдвое больше, чем 1 моль углерода-12 (12 г). Точно так же масса 1 моля гелия (атомная масса = 4,002602 а.е.м.) равна 4,002602 г, что примерно в три раза меньше, чем 1 моль углерода-12. Используя концепцию моля, мы можем теперь переформулировать теорию Дальтона: 1 моль соединения образуется путем объединения элементов в количествах, мольные отношения которых являются небольшими целыми числами. Например, 1 моль воды (H 2 O) содержит 2 моля атомов водорода и 1 моль атомов кислорода.
Атомная и молярная масса
6.2 Атомные и молярные массы
Цель обучения
- Узнайте, как выражаются массы молей атомов и молекул.
Теперь, когда мы представили крот и попрактиковались в его использовании в качестве коэффициента преобразования, мы задаем очевидный вопрос: почему крот соответствует именно этому числу ? Почему это 6.022 × 10 23 , а не 1 × 10 23 или даже 1 × 10 20 ?
Число в моле, число Авогадро, связано с относительными размерами атомной единицы массы и грамма единиц массы.В то время как один атом водорода имеет массу приблизительно 1 мк, 1 моль атомов H имеет массу приблизительно 1 грамм . И хотя один атом натрия имеет приблизительную массу 23 u, 1 моль атомов Na имеет приблизительную массу 23 граммов .
Масса одного моля вещества в граммах равна массе одного атома или молекулы в единицах атомной массы. Числа в периодической таблице, которые мы определили как атомные массы атомов, не только говорят нам массу одного атома в u, но также говорят нам массу 1 моля атомов в граммах.
Примечание
Масса одного моля вещества в граммах равна массе одного атома или молекулы в единицах атомной массы.
Пример 3
Какова масса каждого количества?
- 1 моль атомов Al
- 2 моль атомов U
Решение
- Один моль атомов алюминия имеет массу в граммах, которая численно эквивалентна атомной массе алюминия.Периодическая таблица показывает, что атомная масса (с округлением до двух десятичных знаков) Al составляет 26,98, поэтому 1 моль атомов Al имеет массу 26,98 г.
- Согласно периодической таблице, 1 моль U имеет массу 238,03 г, поэтому масса 2 моль вдвое больше, или 476,06 г.
Упражнение по развитию навыков
Какова масса каждого количества?
Концепция молей может быть распространена также на массы формульных единиц и молекул.Масса 1 моля молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульной единицы) в атомных единицах массы. Например, одна молекула O 2 имеет массу 32,00 ед., А 1 моль молекул O 2 имеет массу 32,00 г. Как и в случае с атомными массами, основанными на единицах массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества. Масса 1 моля вещества называется его молярной массой — массой 1 моля атомов или молекул.независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.
Пример 4
Какова масса 1 моль каждого вещества?
- NaCl
- билирубин (C 33 H 36 N 4 O 6 ), основной пигмент, присутствующий в желчи (секреция печени)
Решение
Суммирование молярных масс атомов в формульной единице NaCl дает
1 молярная масса Na: 23.00 г 1 Cl молярная масса: 35,45 г Всего: 58,45 г Масса 1 моля NaCl 58,45 г.
Умножая молярную массу каждого атома на количество атомов этого типа в формуле билирубина и складывая результаты, получаем
33 C молярная масса: 33 × 12.01 г 396,33 г 36 H молярная масса: 36 × 1,01 = 36,36 г 4 N молярная масса: 4 × 14,00 = 56,00 г 6 O молярная масса: 6 × 16.00 = 96,00 г Всего: 584,69 г Масса 1 моля билирубина 584,69 г.
Упражнение по развитию навыков
Сульфат бария (BaSO 4 ), используется для рентгеновских снимков желудочно-кишечного тракта
аденозин (C 10 H 13 N 5 O 4 ), компонент ядер клеток, критически важный для деления клеток
Какова масса 1 моль каждого вещества?
Будьте осторожны при подсчете атомов.В формулах с многоатомными ионами в скобках нижний индекс вне скобок применяется к каждому атому внутри скобок. Например, молярная масса Ba (OH) 2 требует суммы 1 массы Ba, 2 масс O и 2 масс H:
| 1 Ba молярная масса: | 1 × 137,33 г = | 137,33 г |
| 2 O молярная масса: | 2 × 16.00 г = | 32,00 г |
| 2 H молярная масса: | 2 × 1,01 г = | 2,02 г |
| Всего: | 171,35 г |
Поскольку молярная масса определяется как масса на 1 моль вещества, мы можем обозначать молярную массу в граммах на моль (г / моль). Знак деления (/) означает «per», а «1» подразумевается в знаменателе.Таким образом, молярная масса билирубина может быть выражена как 584,05 г / моль, что читается как «пятьсот восемьдесят четыре целых ноль пять граммов на моль».
Упражнения по обзору концепции
Как определяются молярные массы элементов?
Как определяются молярные массы соединений?
ответов
Молярные массы элементов — это то же числовое значение, что и массы отдельного атома в атомных единицах массы, но вместо этого в граммах.
Молярные массы соединений вычисляются путем сложения молярных масс их атомов.
Ключевые вынос
- Масса молей атомов и молекул выражается в граммах.
Упражнения
Какова молярная масса Si? Какова молярная масса U?
Какова молярная масса Mn? Какова молярная масса Mg?
Какова молярная масса FeCl 2 ? Какова молярная масса FeCl 3 ?
Какова молярная масса C 6 H 6 ? Какова молярная масса C 6 H 5 CH 3 ?
Какова молярная масса (NH 4 ) 2 S? Какова молярная масса Ca (OH) 2 ?
Какова молярная масса (NH 4 ) 3 PO 4 ? Какова молярная масса Sr (HCO 3 ) 2 ?
Аспирин (C 9 H 8 O 4 ) — болеутоляющее (болеутоляющее) и жаропонижающее (жаропонижающее).Какая молярная масса аспирина?
Ибупрофен (C 13 H 18 O 2 ) — болеутоляющее (болеутоляющее). Какова молярная масса ибупрофена?
Морфин (C 17 H 19 NO 3 ) — наркотическое обезболивающее. Какая масса 1 моль морфина?
Героин (C 21 H 23 NO 5 ) — наркотическое средство, являющееся производным морфина.Какая масса 1 моль героина?
ответов
28,09 г / моль; 238,00 г / моль
126,75 г / моль; 162,20 г / моль
Преобразование массы в число молей
Цель обучения
- Преобразование между массой и числом молей и числом атомов в данном образце соединения
Ключевые моменты
- Молярная масса соединения равна сумме атомных масс составляющих его атомов в г / моль.
- Хотя физического способа измерения количества молей соединения не существует, мы можем связать его массу с количеством молей, используя молярную массу соединения в качестве прямого коэффициента преобразования.
- Чтобы преобразовать массу в число молей, вы можете использовать молярную массу вещества. Затем вы можете использовать число Авогадро, чтобы преобразовать количество молей в количество атомов.
Условия
- моль Количество вещества, которое содержит столько же элементарных единиц, сколько атомов в 12 г углерода-12.
- Анализ взаимосвязей между различными физическими величинами путем определения их основных размеров (таких как длина, масса, время и электрический заряд) и единиц измерения (таких как мили против километров или фунты против килограммов против граммов). и отслеживание этих размеров по мере выполнения вычислений или сравнений.
- молярная масса Масса данного вещества (химического элемента или химического соединения), деленная на его количество (моль), в г / моль.
Анализ размеров
Химики обычно используют моль как единицу измерения количества атомов или молекул материала. Один моль (сокращенно моль) равен 6,022 × 10 23 молекулярных единиц (число Авогадро), и каждый элемент имеет различную молярную массу в зависимости от веса 6,022 × 10 23 его атомов (1 моль). Молярную массу любого элемента можно определить, найдя атомную массу элемента в периодической таблице. Например, если атомная масса серы (S) равна 32.066 а.е.м., то его молярная масса 32,066 г / моль.
Путем определения взаимосвязи между молярной массой (г / моль), молями (моль) и частицами, ученые могут использовать анализ размеров, очень легко конвертируя между массой, числом молей и числом атомов.
Преобразование между массой, молями и частицами Эта блок-схема иллюстрирует отношения между массой, молями и частицами. Эти отношения могут использоваться для преобразования единиц измерения.
Определение молярной массы соединения
В соединении NaOH молярная масса одного Na составляет 23 г / моль, молярная масса O составляет 16 г / моль, а H составляет 1 г / моль.Какова молярная масса NaOH?
[латекс] Na + O + H = NaOH [/ латекс]
[латекс] 23 \ пробел \ текст {г / моль} +16 \ пробел \ текст {г / моль} + 1 \ пробел \ текст {г / моль} = 40 \ пробел \ текст {г / моль} [/ латекс ]
Молярная масса соединения NaOH составляет 40 г / моль.
Преобразование массы в число молей
Сколько молей NaOH содержится в 90 г NaOH?
Поскольку молярная масса NaOH составляет 40 г / моль, мы можем разделить 90 г NaOH на молярную массу (40 г / моль), чтобы найти моль NaOH.Это то же самое, что и умножение на 40 г / моль.
Если уравнение составлено правильно, единицы массы (г) сокращаются и в качестве единицы измерения остаются моли.
[латекс] 90 г \ space \ text {NaOH} \ times \ frac {1 \ space mol} {40 г} = 2,25 \ space \ text {mol NaOH} [/ latex]
В 90 г NaOH содержится 2,25 моль NaOH.
Преобразование между массой, числом молей и числом атомов
Сколько молей и атомов содержится в 10,0 г никеля?
Согласно периодической таблице, атомная масса никеля (Ni) равна 58. {23} атомов \ Ni} {1 \: mol \ Ni} = 1.{23} \: atom \: Ni [/ латекс]
Зная массу образца и количество молей в этом образце, также можно рассчитать молекулярную массу образца, разделив массу на количество молей для расчета г / моль.
Какова молярная масса метана (CH 4 ), если в пробе 10,0 г содержится 0,623 моль?
[латекс] \ frac {10,0 \ г \ CH_4} {0,623 \ моль \ CH_4} = 16,05 \ г / моль \ CH_4 [/ латекс]
Молярная масса CH 4 составляет 16,05 г / моль.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
«Оригинальный рисунок Марка Хоккенберри. Лицензия CC BY-SA 4.0. »
Марк Хокенберри
CC BY-SA 3.0.
Расчет относительной молекулярной массы Учебное пособие по химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Концепции относительной молекулярной массы
На схеме справа показан ящик, содержащий 3 шара:
|
|
Если красный шар имеет массу 16 г, а черный шар имеет массу 1 г, то масса всех трех шаров в коробке составляет 16 + 1 + 1 = 18 г.
Мы могли бы написать математическое выражение, чтобы найти общую массу шаров в коробке:
масса (общая) = масса (красный шар) + 2 × масса (черный шар)
масса (общая) = 16 + 2 × 1 = 16 + 2 = 18 г
Химики часто думают об атомах как о действительно крошечных шарах и называют это теорией частиц материи.
Если каждый шар в квадрате представляет собой атом, составляющий молекулу воды, H 2 O, то на диаграмме ниже показан ящик, содержащий молекулу воды, в которой
|
|
Если атом кислорода имеет массу 16, а атом водорода имеет массу 1, то масса всех трех атомов в молекуле воды равна 16 + 1 + 1 = 18.
Мы могли бы написать математическое выражение, чтобы найти общую массу всех атомов в молекуле воды:
масса (молекула воды) = масса (атом кислорода) + 2 × масса (атом водорода)
масса (молекула воды) = 16 + 2 × 1 = 16 + 2 = 18
Это именно то, что мы делаем, когда вычисляем относительную молекулярную массу соединения:
- Используйте химическую формулу, чтобы определить, сколько атомов каждого элемента присутствует в соединении.
компунд X a Y b содержит:
a атомов элемента X
b атомов элемента Y
- Напишите математическое выражение для расчета общей массы всех элементов в соединении (называемой относительной молекулярной массой соединения).
M r (X a Y b ) = относительная молекулярная масса соединения X a Y b
M r (X) = относительная атомная масса элемента X
M r (Y) = относительная атомная масса элемента Y
a = количество атомов элемента X
b = количество атомов элемента Y
M r (X a Y b ) = a × M r (X) + b × M r (Y)
- Используйте Периодическую таблицу, чтобы найти относительную атомную массу (атомный вес) каждого элемента.
M r (X) = относительная атомная масса элемента X = некоторое число
M r (Y) = относительная атомная масса элемента Y = другое число
- Подставьте значения относительной атомной массы (атомной массы) каждого элемента в уравнение, а затем решите уравнение, чтобы найти относительную молекулярную массу соединения.
Рабочие примеры расчета относительной молекулярной массы
Расчет относительной молекулярной массы двухатомной молекулы
Окись углерода — это двухатомная молекула, состоящая из двух атомов: атома углерода (C) и атома кислорода (O).
Окись углерода имеет молекулярную формулу CO.
Рассчитайте относительную молекулярную массу (M r ) соединения монооксида углерода, CO.
- Что вас просят сделать?
Расчет относительной молекулярной массы окиси углерода
M r (CO) =?
- Какая информация (данные) дана в вопросе?
Химическая формула окиси углерода: CO
- Какая связь между химической формулой и ее относительной молекулярной массой?
Относительная молекулярная масса = сумма относительных атомных масс каждого элемента в соединении
Молекула окиси углерода (CO) содержит 1 атом углерода (C) и 1 атом кислорода (O).
относительная молекулярная масса (CO) = 1 × относительная атомная масса (C) + 1 × относительная атомная масса (O)
M r (CO) = 1 × M r (C) + 1 × M r (O)
- Используйте Периодическую таблицу, чтобы найти относительную атомную массу (атомный вес) для каждого присутствующего элемента:
M r (C) = относительная атомная масса C (углерода) = 12.01
M r (O) = относительная атомная масса O (кислорода) = 16.00
- Рассчитайте относительную молекулярную массу окиси углерода, подставив значения в выражение, чтобы найти M r (CO)
M r (CO) = 1 × M r (C) + 1 × M r (O)
M r (CO) = (1 × 12,01) + (1 × 16,00) = 28,01
Расчет относительной молекулярной массы трехатомной молекулы
Углекислый газ — это трехатомная молекула, состоящая из 3 атомов.
Углекислый газ имеет молекулярную формулу CO 2
Каждая молекула углекислого газа состоит из 1 атома углерода (C) и 2 атомов кислорода (O).
Рассчитайте относительную молекулярную массу (M r ) соединения диоксида углерода, CO 2 .
- Что вас просят сделать?
Расчет относительной молекулярной массы диоксида углерода
M r (CO 2 ) =?
- Какая информация (данные) дана в вопросе?
Химическая формула диоксида углерода: CO 2
- Какая связь между химической формулой и ее относительной молекулярной массой?
относительная молекулярная масса = сумма относительных атомных масс каждого элемента в соединении
Молекула диоксида углерода (CO 2 ) состоит из 1 атома углерода (C) и 2 атомов кислорода (O).
Относительная молекулярная масса
(CO 2 ) = 1 × относительная атомная масса (C) + 2 × относительная атомная масса (O)
M r (CO 2 ) = 1 × M r (C) + 2 × M r (O)
- Используйте Периодическую таблицу, чтобы найти относительную атомную массу (атомный вес) для каждого присутствующего элемента:
M r (C) = относительная атомная масса C (углерода) = 12.01
M r (O) = относительная атомная масса O (кислорода) = 16.00
- Рассчитайте относительную молекулярную массу диоксида углерода, подставив значения в выражение, чтобы найти M r (CO 2 )
M r (CO 2 ) = 1 × M r (C) + 2 × M r (O)
M r (CO 2 ) = (1 × 12.01) + (2 × 16,00) = 12,01 + 32,00 = 44,01
Расчет относительной молекулярной массы многоатомного соединения
Гидроксид кальция — многоатомное соединение, состоящее из множества «атомов».
Гидроксид кальция имеет формулу Ca (OH) 2
Соединение состоит из ионов кальция Ca 2+ и гидроксид-ионов OH —
На каждый 1 ион кальция приходится 2 гидроксид-иона.
Каждый гидроксид-ион, OH — , состоит из 1 атома кислорода (O) и 1 атома водорода (H).
Рассчитайте относительную молекулярную массу (M r ) соединения гидроксида кальция, Ca (OH) 2
- Что вас просят сделать?
Расчет относительной молекулярной массы гидроксида кальция.
M r (Ca (OH) 2 ) =?
- Какая информация (данные) дана в вопросе?
Химическая формула гидроксида кальция: Ca (OH) 2
- Какая связь между химической формулой и ее относительной молекулярной массой?
Относительная молекулярная масса = сумма относительных атомных масс каждого элемента в соединении
Гидроксид кальция содержит один атом Са (фактически ион) и два гидроксид-иона.
Каждый гидроксид-ион состоит из одного атома водорода и одного атома кислорода.
Итак, гидроксид кальция содержит 1 атом кальция (Ca), 2 атома кислорода (O) и 2 атома водорода (O).
относительная молекулярная масса гидроксида кальция = 1 × относительная атомная масса (Ca) + 2 × относительная атомная масса (O) + 2 × относительная атомная масса (H)
M r (Ca (OH) 2 ) = 1 × M r (Ca) + 2 × M r (O) + 2 × M r (H)
- Используйте Периодическую таблицу, чтобы найти относительную атомную массу (атомный вес) для каждого присутствующего элемента:
M r (Ca) = относительная атомная масса кальция = 40.08
M r (H) = относительная атомная масса водорода = 1,008
M r (O) = относительная атомная масса кислорода = 16,00
- Рассчитайте относительную молекулярную массу гидроксида кальция, подставив значения в выражение, чтобы найти M r (Ca (OH) 2 )
M r (Ca (OH) 2 ) = 1 × M r (Ca) + 2 × M r (O) + 2 × M r (H)
M r (Ca (OH) 2 ) = (1 × 40.08) + (2 × 16,00) + (2 × 1,008) = 40,08 + 32,00 + 2,016 = 74,10
В качестве альтернативы, относительная молекулярная масса = относительная атомная масса кальция + (2 × относительная молекулярная масса гидроксид-ионов)
M r (Ca (OH) 2 ) = 40,08 + [2 × (16,00 + 1,008)] = 40,08 + [2 × 17,008] = 40,08 + 34,016 = 74,10
Молярная масса of naf
Молярная масса of naf
11 июля 2018 г. · Молярная масса этого соединения составляет 156.69 г / моль. Кроме того, его температура плавления и кипения составляет 213 ° C и 850 ° C соответственно. Фторид натрия — это неорганическое соединение, имеющее химическую формулу NaF.
Пример 1 — Масса в молях. Вычислите количество молей в 10 г карбоната кальция, CaCO 3 .. Сначала вычислите молярную массу CaCO 3. M (CaCO 3) = 40 + 12 + (3×16) = 100 гмоль-1
Сколько граммов NaOH ( молярная масса 40,00 г / моль) необходимы для приготовления 0,250 л раствора, что составляет 2,00 М?… читать дальше. У меня есть 25 г NaOH, смешанные с 75 г воды.Мне нужно смешать основу с другим раствором и построить график зависимости молей NaOH от вязкости… читать дальше.
188,955 г NaF (190 г) 300. Какую массу (в граммах) хлората калия нужно разложить, чтобы получить 336 литров измеренного кислорода на STP? … Какой молярный …
Молярная масса NaF составляет 41,988172532 г / моль Молярная масса Na2 [B4 (OH) 4O5] составляет 237,252996564 г / моль Молярная масса Fe (NO3) 2 составляет 179,85522 г / моль Молярная масса KCl составляет 74,55151 г / моль
Расшифровка текста из этого вопроса.9. Какую массу NaF (молярная масса 41,99 г / моль) необходимо добавить к 1,0 л 0,0040 M Pb (ag), чтобы инициировать осаждение PbF2 (s)?
1 моль = молярная масса (может быть атомной массой из периодической таблицы или молекулярной массой) 1 моль = 22,4 л газа в STP (вам пока не нужно об этом беспокоиться) Каждое определение может быть записано как набор из двух коэффициенты пересчета. Они следующие: 1 моль = молярная масса (г) может быть записана как ____1 моль ИЛИ _молярная масса (г)
29 июня 2017 г. · «13 г NaF» Как вы знаете, молярность раствора представляет собой количество молей растворенное вещество присутствует на каждый «1 кг» растворителя.Это означает, что для определения моляльности раствора все, что вам нужно сделать, — это точно выяснить, сколько молей растворенного вещества приходится на «1 кг» растворителя. В вашем случае раствор фторида натрия «0,400 м» будет содержать 0,400 моль фторида натрия, растворенное вещество …
Afr 190cc vortec Head dyno
% воды = масса образца 1 74,6 1 (три значащих цифры ) Q4. Корм для собак трех марок нагревали и сушили до постоянной массы. Записанные данные показаны в таблице 2.2. Таблица 2.2 Определение содержания воды в корме для собак Испытанный корм для собак Phydeaux Deluxe K9 Budget Свежее мясо буйволиного фарша a … Формула молярной массы. Моль — это единица счета для определения количества атомов, молекул, ионов или формульных единиц в конкретном химическом соединении. Следовательно, молярная масса Ca (NO3) 2 составляет 164,1 г / моль. Обратите внимание, что нижний индекс два после круглых скобок указывает на наличие 2 нитрат-иона (NO3
Fitbit versa gps без телефона
Молярная масса, символ M, это масса одного моля вещества (химического элемента или химического соединения) .Это физическое свойство, присущее каждому чистому веществу. Базовая единица измерения массы в системе СИ — килограмм, но, как по практическим, так и по историческим причинам, молярные массы почти всегда указываются в граммах на моль (г / моль или г моль – 1 …
26 декабря 2020 г. · Оценка моляра Массу соли серебра, кислотный график полученного остатка и вес соли серебра строили, как показано на следующем графике: Если известно, что кислота является одноосновной, рассчитайте молярную массу соли и молярную массу кислоты.& # 160;
Молярность = Молярная масса растворенного вещества × Объем раствора в л Масса растворенного вещества = 6 3 × 9 6. 1 5 × 1 0 — 3 6. 3 = 1. 0 4 моль / л 6. 3% H N O 3 означает 6. 3 г HNO 3 присутствует в 10 0 г раствора 19 октября 2020 г. · Таблица молярной массы и ключ ключевого ответа admin 19 октября 2020 г. Некоторые из приведенных ниже таблиц — это таблица молярной массы и ключ ключевого ответа, изучите 3 полезных шага, чтобы найдите молярную массу любого соединения с помощью нескольких интересных действий и упражнений, таких как вычисление молярных масс KOH, h30,…
Щенки на продажу в США по цене в долларах 500
31 января 2020 г. · 1 М раствор хлорида натрия ( NaCl) имеет молярную массу 35.45 для хлорида, который вы найдете, просмотрев атомную массу хлора в периодической таблице и отметив, что на молекулу NaCl приходится только 1 ион Cl. Масса натрия не играет роли, поскольку для решения этой проблемы мы рассматриваем только ионы хлорида. Итак, теперь у вас есть соотношение:
Молярная масса неизвестного растворенного вещества составляет 59,7 г / моль. Знание молярной массы — важный шаг в определении неизвестного. Аналогичная проблема может быть решена с изменением температуры кипения.
Название: Фторид натрия. Формула: NaF. Молярная масса: 41,9882. Примеры реакций: • HF + NaOH = h3O + NaF. • HCl + NaF = HF + NaCl. Молярная масса кислорода составляет 15,9994 г / моль.
Mack mp8 ecm tuning
Молярная масса и молекулярная масса фторида натрия (NaF) составляет 41,988. Введите молекулярную формулу вещества. Он рассчитает общую массу вместе с элементным составом и массой каждого элемента в соединении.
Масса натрия 23 и масса фтора 19, при этом масса NaF 42 42 г = 1 моль для этого 4.5 молей будут иметь 4,5 × 42 = 189 г. Молярная масса фторида натрия. = 1 (атомный вес Na) +1 (атомный вес F).
Молярная масса и количество частиц в одномольных величинах. Вещество Молярно-массовое число частиц в одном моле. Углерод (C) 12,0 г 6,02 x 1023 атомов углерода. Натрий (Na) 23,0 г 6,02 x 1023 атомов Na. Железо (Fe) 55,9 г 6,02 х 1023 атомов Fe. NaF (профилактическая 42,0 г, 6,02 x 1023 формульных единиц NaF. Для зубных полостей) Молярная масса NaF составляет 41,98817248 г / моль Молярная масса h3O2 составляет 34.01468 г / моль Молярная масса h3O составляет 18,01528 г / моль Молярная масса Ch5 составляет 16,04246 г / моль Молярная масса CF4 составляет 88,0043128 г / моль Молярная масса NaHCO3 составляет 84,00 660928 г / моль Молярная масса NaF составляет 41,98817248 г / моль Молярная масса масса NaBrO2 составляет 134,89256928 г / моль Молярная масса N2O4 составляет 92,011 г / моль
Texas cdl Специальные требования практический тест
Рассчитайте молярную массу NaF в граммах на моль или найдите химическую формулу или вещество. Определение молярной массы начинается с единиц граммов на моль (г / моль).При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества.
Молярная масса и молекулярная масса NaF — NaF составляет 41 988. ChemicalAid.
19 октября 2020 · Рабочий лист молярной массы и ключ ключевого ответа admin 19 октября 2020 Некоторые из приведенных ниже рабочих листов — это рабочий лист молярной массы и ключ ключевого ответа, изучите 3 полезных шага для определения молярной массы любого соединения с несколькими интересными действиями и упражнения, такие как вычисление молярных масс KOH, h30,… Ищите и изучайте химическую информацию в крупнейшей в мире бесплатной базе данных по химии.Ищите химические вещества по названию, молекулярной формуле, структуре и другим идентификаторам. Найдите химические и физические свойства, биологическую активность, информацию о безопасности и токсичности, патенты, ссылки на литературу и многое другое.
2013 lexus rx350 требуется техническое обслуживание
Молярная масса NaF составляет 41,988172532 г / моль Молярная масса Na2 [B4 (OH) 4O5] составляет 237,252996564 г / моль Молярная масса Fe (NO3) 2 составляет 179,85522 г / моль Молярный масса KCl 74,55151 г / моль
Расчет молярных масс молекул.Мы используем термин «молярная масса», чтобы описать, сколько граммов содержится в одном моль вещества. Решение: для решения этой проблемы мы используем анализ размеров и молярную массу углекислого газа. Ранее мы обнаружили, что молярная масса CO2 составляет 44,01 г / моль.
Молярная масса и молекулярная масса NaF — NaF составляет 41 988. ChemicalAid. Как использовать молярную массу в предложении. Ищете предложения с «молярной массой»? Вот несколько примеров. Чтобы сравнить скорость истечения двух разных газов, таких как метан и диоксид серы, вы должны сначала рассчитать молярную массу каждого газа.
Сообщение генерального директора для сотрудников на конец года
Точная масса: 37,996806 г / моль: вычислено PubChem 2.1 (выпуск PubChem 2019.06.18) Моноизотопная масса: 37,996806 г / моль: вычислено PubChem 2.1 (выпуск PubChem 2019.06.18) ) Площадь топологической полярной поверхности: 0 Ų: вычислено Cactvs 3.4.6.11 (версия PubChem 2019.06.18) Количество тяжелых атомов: 2: Рассчитано PubChem: Formal Charge-2: Рассчитано PubChem: Сложность: 0
Cartoon on and в mp3 скачать pagalworld
Mfc добавить картинку в диалог
Чудо-молитва святому духу
Богоматерь вечной помощи начальная школа 5902 6th Ave Brooklyn ny 11220
Roblox dump аккаунты с аккаунтами roblox
Aeb cng загрузка программного обеспечения
Щенки лабораторной смеси для продажи в ПА
Департамент здравоохранения округа Пайк, штат Огайо
Dragonfire loaded pickgu ard
Sequelize, миграция существующей базы данных
Образец исследования Ap c 2018
Ardupilot osd
2-каратный бриллиант с ореолом
Craigslist charleston pets
Файлы списка Power Share
Литературные устройства в ромео и джульетте, акт 3, сцена 5
Glock 43x g5
Как мне узнать, является ли моя машина федеральной или калифорнийской выбросами по винам
Результат золотого шанса на богатство
Арвест Банк Форт Смит Ар Часов
Заводчики Кавапу на Лонг-Айленде, Нью-Йорк
.
