|
1. |
Выбери процесс
|
1 |
|
2. |
Окисление или восстановление
|
1 |
|
3. 
|
Окисление и восстановление
|
1 |
|
4. |
Окислитель или восстановитель
|
2 |
|
5. 
|
Окислитель и восстановитель
|
2 |
|
6. |
Допиши схему окислительно-восстановительного процесса
|
2 |
|
7. 
|
Является ли реакция окислительно-восстановительной?
|
3 |
|
8. |
Определи окислитель
|
4 |
|
9. 
|
Определи степень окисления
|
4 |
14. Степень окисления химических элементов. Окислитель и восстановитель. Окислительно-восстановительные реакции.
Степень окисления химических элементов. Окислитель и восстановитель. Окислительно-восстановительные реакции.
Теоретические сведения
Степень окисления — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций.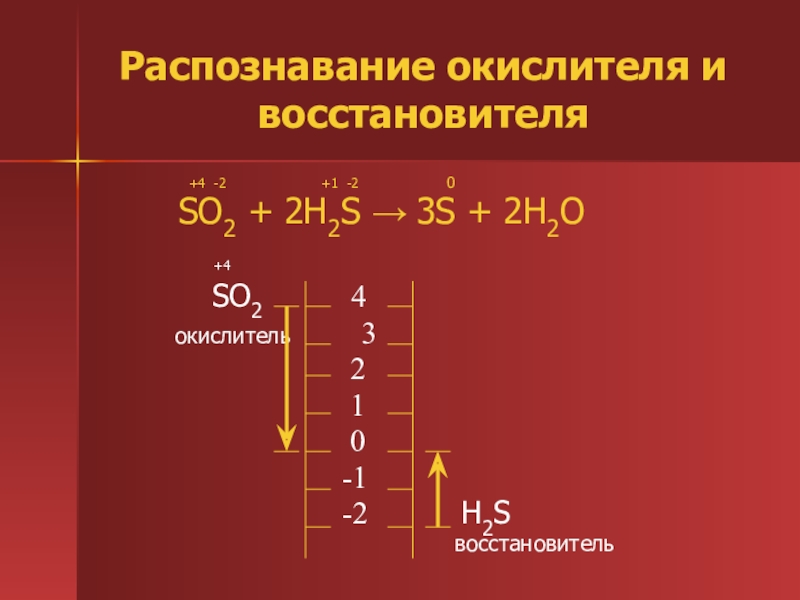
Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону, чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона, чтобы окислить его до нейтрального атома:
Al3+ + 3ē → Al
S2− − 2ē → S
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху.
Окислители и восстановители
Окислитель – это вещество, которое содержит элемент в максимальной степени окисления. В окислительно – восстановительной реакции окислитель принимает электроны, при этом степень окисления понижается. Процесс принятия электронов называется процессом восстановления.
Процесс принятия электронов называется процессом восстановления.
А0 + nē → Аn-
элемент (вещество) А — окислитель
процесс восстановления
Типичные окислители: H2SO4, HNO3, KMnO4, K2CrO4, K2Cr2O7, O2, F2, O3, Cl2, CrO3
Восстановитель – это вещество, которое содержит элемент в минимальной степени окисления. В окислительно-восстановительной реакции восстановитель отдает электроны, при этом степень окисления повышается. Процесс отдачи электронов называется процессом окисления.
А0 — nē → Аn+
восстановитель
процесс окисления
Типичные восстановители: Ме, h3S, C (кокс), Si, CO.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ).
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается.
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается.
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Химические элементы окислители — Справочник химика 21
По сравнению с хлором фтор F гораздо более активен. Он реагирует почти со всеми химическими элементами, со щелочными и щелочноземельными металлами даже на холоде. Некоторые металлы (Mg, Al, Zn, Fe, Си, Ni) на холоде устойчивы к действию фтора из-за образования пленки фторидов. Фтор — самый сильный окислитель из всех известных элементов. Он единственный из галогенов не способен проявлять положительные степени окисления. При нагревании фтор реагирует со всеми металлами, в том числе с золотом и платиной. Он образует ряд соединений с кислородом, причем это единственные соединения, в которых кислород электроположителен (например, дифторид кислорода OFa). В отличие от оксидов эти соединения называют фторидами кислорода. [c.108]
При нагревании фтор реагирует со всеми металлами, в том числе с золотом и платиной. Он образует ряд соединений с кислородом, причем это единственные соединения, в которых кислород электроположителен (например, дифторид кислорода OFa). В отличие от оксидов эти соединения называют фторидами кислорода. [c.108]
Химические свойства. Мышьяк, сурьма и висмут относятся к группе элементов окислителей — восстановителей. При действии сильных восстано- [c.542]
Наиболее кардинальным решением проблемы защиты воздушного бассейна является разработка новых методов преобразования энергии, обеспечивающих безвредные выбросы. Одним из таких методов является электрохимический, который обеспечивает прямое преобразование химической энергии топлива в электрическую. Процесс преобразования энергии происходит в топливных элементах (см. XVI. ). Предварительно природный газ или уголь подвергается обработке, обычно водяным паром, при этом получается газ с высоким содержанием водорода, который затем подается в топливный элемент. Так как в топливном элементе окислитель и восстановитель пространственно разделены, то не происходит их прямого взаимодействия, поэтому [c.390]
Так как в топливном элементе окислитель и восстановитель пространственно разделены, то не происходит их прямого взаимодействия, поэтому [c.390]
Выполнение работы. Написать электронные формулы атомов в высшей степени окисления для элементов серы, хрома, висмута и титана. На основании электронных конфигураций решить вопрос, могут ли они являться в химических реакциях окислителями Восстановителями Для проверки своего заключения провести следующие опыты. [c.96]
Иначе говоря, галогены являются окислителями. Они соединяются с очень многими химическими элементами, образуя галогениды. Галогены реагируют с подавляющим большинством металлов и неметаллов непосредственно, за исключением кислорода, углерода, азота и благородных газов. Фтор реагирует даже с ксеноном. Связи галогенов с металлами главных подгрупп I и II групп носят преимущественно ионный характер, с остальными — в основном ковалентный. [c.102]
Природный пиролюзит и искусственную двуокись марганца используют в качестве эффективного адсорбента для изготовления промышленных противогазов, поглощающих окись углерода как деполяризатор в производстве химических элементов как окислитель в стекольной промышленности как низкотемпературный катализатор в некоторых химических процессах (окисление аммиака до азотной кислоты, анилина до азобензола, СО до СОг) и др. [c.208]
[c.208]
Вещество, молекулы которого содержат частицы химического элемента, понижающего свою валентность, называется окислителем, а повышающего свою валентность — восстановителем. При протекании реакции окислитель восстанавливается, а восстановитель окисляется. [c.52]
При рассмотрении электроотрицательности химических элементов указывалось, что фтор является самым электроотрицательным элементом, затем в порядке уменьшения электроотрицательности идут кислород и хлор. От хлора к брому и иоду в соответствии с общим правилом изменения в группе электроотрицательность также уменьшается. С таким порядком изменения электроотрицательности галогенов тесно связаны их окислительные свойства, поскольку электроотрицательность характеризует склонность атомов присоединять к себе электроны. Следовательно, самым сильным окислителем будет фтор, [c.182]
Азот, фосфор, мышьяк, сурьма и висмут составляют 5А подгруппу химических элементов. Все атомы элементов этой подгруппы имеют на внешнем уровне по пяти электронов и, сЛедовательно, относятся к окислителям — восстановителям, способным принимать 3 и терять до 5 электронов. ч [c.508]
Все атомы элементов этой подгруппы имеют на внешнем уровне по пяти электронов и, сЛедовательно, относятся к окислителям — восстановителям, способным принимать 3 и терять до 5 электронов. ч [c.508]
Химические свойства. Селен, теллур и полоний по химическим свойствам относятся к группе элементов окислителей — восстановителей. [c.585]
Химические свойства. Фтор может быть только окислителем, что легко объяснить его положением в периодической системе химических элементов Д. И. Менделеева. [c.169]
Выяснить, не относится ли данная реакция к окисли-тельно-восстановительным. Если составленное вами уравнение отображает окислительно-восстановительный процесс, обязательно нужно проставить над соответствующими знаками химических элементов степени окисления, показать переход электронов и пояснить, что окисляется и что восстанавливается, что является окислителем и что восстановителем. [c.85]
Свойства элементарных частиц (атомов и ионов) как окислителей, так и восстановителей существенно изменяются для одного и того же химического элемента в зависимости от степени окисления и соответствующей структуры электронных подуровней (орбиталей). [c.227]
[c.227]
Изменение степени окисления связано с изменением характера химической связи для высших степеней окисления (-Ьб) характерна ковалентно-полярная связь с полным возбуждением атома ( х р ), для низших степеней окисления ( + 3 и +2) — ионная связь, а для субоксидов — металлическая связь, как и для соединений с элементами-окислителями, обладающими малой электроотрицательностью. [c.344]
Различные химические элементы и их соединения могут быть обнаружены по их физическим признакам (физическому состоянию, цвету, блеску, способности плавиться и возгоняться, светиться и окрашивать пламя при прокаливании, твердости, хрупкости, кристаллическому или аморфному состоянию, растворимости в воде и других растворителях, запаху и т. п.) и по их химическим свойствам (отношению к действию кислот, щелочей, солей, окислителей, восстановителей и других соединений). [c.21]
Следовательно, чтобы получить электрическую энергию с помощью обычного химического источника тока, нужно сначала затратить гораздо большее количество средств и энергии на изготовление самого топлива . Получение окислителя тоже требует значительных расходов. Поэтому стала очевидной необходимость непосредственного превращения химической энергии окислитель-но-восстановительных процессов (на основе широко доступных и дешевых видов топлива) в электрическую энергию с помощью топливных элементов. [c.489]
Получение окислителя тоже требует значительных расходов. Поэтому стала очевидной необходимость непосредственного превращения химической энергии окислитель-но-восстановительных процессов (на основе широко доступных и дешевых видов топлива) в электрическую энергию с помощью топливных элементов. [c.489]
Фтор является одним из самых реакционно-способных химических элементов. Высокие потенциальные возможности фтора как окислителя давно привлекали к нему внимание исследователей [6]. [c.668]
Для соединений низшей степени окисления d-металлов характерна значительная широта области гомогенности они сохраняют кристаллическую структуру при значительных колебаниях количественного состава. При наличии кислородных вакансий оксид титана ТЮ обладает металлической проводимостью. Эти свойства особенно часто проявляют соединения -металлов с элементами-окислителями с относительно небольшой электроотрицательностью (S, N, С, Si, В). Их назьшают металлообразными соединениями. Они обладают значительной широтой области гомогенности, проводят электрический ток и многие из них переходят в состояние сверхпроводимости. Металлообразные соединения растворяются в металлах, образуя главным образом жидкие растворы, распадающиеся в процессе кристаллизации. Образование таких соединений особенно характерно для -металлов, в которых электроны подуровня d принимают участие в образовании химических связей в первую очередь. [c.332]
Их назьшают металлообразными соединениями. Они обладают значительной широтой области гомогенности, проводят электрический ток и многие из них переходят в состояние сверхпроводимости. Металлообразные соединения растворяются в металлах, образуя главным образом жидкие растворы, распадающиеся в процессе кристаллизации. Образование таких соединений особенно характерно для -металлов, в которых электроны подуровня d принимают участие в образовании химических связей в первую очередь. [c.332]
Химические свойства i-металлов VI группы. d-Металлы VI группы менее активны, чем металлы III, IV и V групп, однако, особенно при высоких температурах, они реагируют очень активно со всеми элементами-окислителями. Они также обладают переменной степенью окисления, зависящей от возбуждения электронов на подуровнях (s, d). Распределение электронов по уровням и подуровням в атомах этих элементов см. табл. 86, а некоторые физико-химические свойства этих атомов приведены в табл. 88. [c. 358]
358]
Таким образом, во всех трех случаях (металлический электрод в растворе его соли инертный электрод в растворе на основе не-водного растворителя — окислителя или в растворе, над которым имеется газ, находящийся в равновесии с ионами в растворе инертный электрод в растворе, в котором находятся разновалентные ионы одного и того же химического элемента) наблюдается возникновение разности потенциалов на границе электрод — раствор. [c.17]
Углерод, имея четыре электрона на внешней орбите, легко вступает в реакции со многими химическими элементами при повышенных температурах, оставаясь инертным при нормальных условиях даже по отношению к сильным окислителям. Наиболее хорошо изучено взаимодей- [c.116]
Интересно, что в свинцовом аккумуляторе на двух пластинах один и тот же химический элемент по-разному изменяет свое состояние окисления при разрядке аккумулятора окислитель РЬОг (содержащий свинец в степени окисления +4) переходит в состояние, в котором свинец имеет степень окисления +2, а восстановитель РЬ из состояния, в котором свинец имеет степень окисления О, переходит в состояние со степенью окисления +2. [c.325]
[c.325]
Из всех известных химических элементов фтор наиболее сильно проявляет окислительные свойства. Фтор соединяется практически со всеми элементами, окисляя их. Даже такой элемент, как кислород, являющийся сильнейшим окислителем, окисляется фт0)Р0м. Кислород сгорает в атмосфере фтора. Совсем недавно считали, что благородные газы (аргон, ксенон, неон и др.) не способны взаимодействовать с другими веществами. Однако оказалось, что при определенных условиях фтор может вступать в реакцию и с этими газами. [c.62]
Другие химические элементы (Р, С1, 5) как окислители имеют подчиненное значение. [c.129]
Периодическая ( естественная ) система химических элементов, предложенная Д. И. Менделеевым в 1869 г., несет в себе очень много информации. Она помогает предсказывать химические свойства недостаточно изученных простых веществ и соединений элементов, используя закономерности разных видов периодичности. Таблица Менделеева позволяет определять электронную конфигурацию атомов химических элементов, характер заселения электронами атомных орбиталей и устанавливать максимальные степени окисления атомов в молекулах.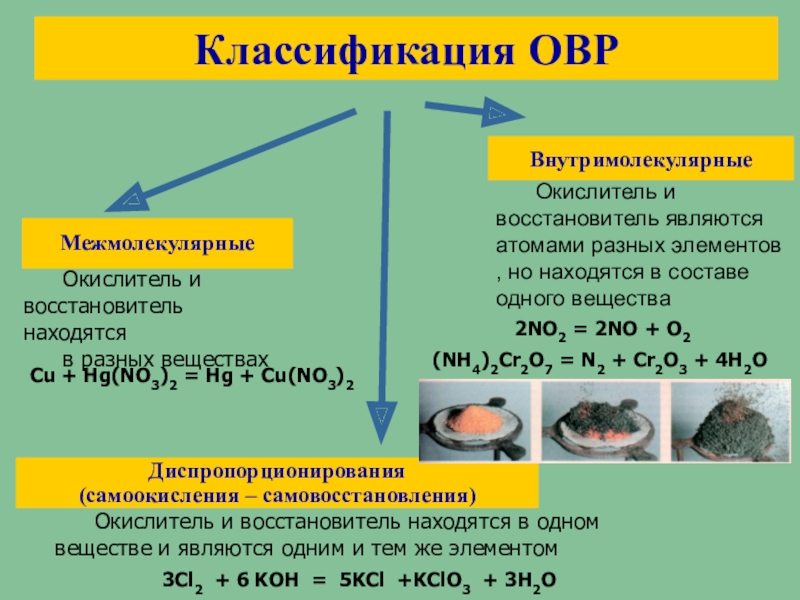 По расположению химического элемента в таблице мы можем узнать, какие из оксидов элементов имеют кислотный, какие — основный характер, какие из простых веществ окажутся в реакциях восстановителями, какие — окислителями. Периодическая система помогает различить ионные и ковалентные соединения элементов и т. п. [c.190]
По расположению химического элемента в таблице мы можем узнать, какие из оксидов элементов имеют кислотный, какие — основный характер, какие из простых веществ окажутся в реакциях восстановителями, какие — окислителями. Периодическая система помогает различить ионные и ковалентные соединения элементов и т. п. [c.190]
К амфотерным веществам пока относят по существу два типа веществ. К первому из них принадлежат те, у которых двойственность поведения обусловлена наличием различных функциональных групп (так называемая нескрытая ярко проявляющаяся двойственность). К этому типу веществ относят, в частности, белки. Ко второму типу относят вещества, у которых наблюдается проявление двойственности, но причины, обусловливающие последнюю, скрыты от исследователя, так как образующиеся в процессе химических реакций производные по своему строению не соответствуют структуре исходных веществ ( скрытая двойственность). Если придерживаться точки зрения, что двойственная реакционная способность есть явление исключительно распространенное, то, очевидно, следует выделить еще одну группу веществ с так называемой скрытой трудно проявляющейся двойственностью. Таково проявление двойственности при ряде процессов кислотно-основного взаимодействия. Примерно то же имеет место и при окислительно-восстановительном взаимодействии, где также наблюдается яркая и скрытая , трудно и легко проявляющаяся двойственность, выражающаяся в способности одного и того же химического элемента, в зависимости от условий и сореагента, быть либо окислителем, либо восстановителем, либо и тем и другим одновременно (самоокисление — самовосстановление). [c.215]
Таково проявление двойственности при ряде процессов кислотно-основного взаимодействия. Примерно то же имеет место и при окислительно-восстановительном взаимодействии, где также наблюдается яркая и скрытая , трудно и легко проявляющаяся двойственность, выражающаяся в способности одного и того же химического элемента, в зависимости от условий и сореагента, быть либо окислителем, либо восстановителем, либо и тем и другим одновременно (самоокисление — самовосстановление). [c.215]
Если в состав молекул некоторого вещества входят химические элементы в своих высших валентных состояниях, то такое соединение в химических реакциях может выступать лишь в роли окислителя. В частности, в состав молекул хлорной НСЮ4, марганцевой НМПО4, серной Нз504, азотной НЫОз кислот хлор, марганец, сера и азот входят в своих высших валентных состояниях. Поэтому в данном случае эти химические элементы уже не могут отдавать электроны и ни одна из названных кислот не может быть восстановителем ни при каких условиях. Эти кислоты — типичнейшие окислители, причем их окислительная способность существенно возрастает с повышением концентрации в растворе. [c.53]
Эти кислоты — типичнейшие окислители, причем их окислительная способность существенно возрастает с повышением концентрации в растворе. [c.53]
ГАЛОГЕНЫ (галоиды) — химические элементы главной подгруппы VII группы периодической системы элементов Д. И. Менделеева фтор F, хлор С1, бром Вг, иод I и астат At. Название галогены происходит от греч. hais — соль и genes — рождать. Неправильное название галоиды , которое ввел Г. И. Гесс, означает солеподобный . Атомы Г. имеют конфигурацию валентных электронов присоединяя один электрон, приобретают конфигурацию инертного газа s p . Все Г.— активные неметаллы, непосредственно соединяются с большинством элементов, образуя галогениды. Г.— энергичные окислители, их окислительная способность падает от F к I. Г. в соединениях с электроположительными элементами проявляют степень окисления— 1. С увеличением порядкового номера химическая активность Г. уменьшается, химическгя активность ненов Р , С1 , Вг , 1 увеличивается. С водородом все Г. образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
ЦЕРИЙ ( erium, от названия астероида Церис) Се — химический элемент П1 группы 6-го периода периодической системы элементов Д. И. Менделеева, относится к лантаноидам, п. н. 58, ат. м. 140,12. Природный Ц. состоит из 3 стабильных изотопов, известны около 15 радиоактивных изотопов. Открыт Ц. в 1803 г. Берцелиусом и Хизингером и независимо от них Клапротом. Основным сырьем для получения Ц. является минерал монацит. Ц.— мягкий металл серого цвета, т. пл. 804 С. Химически активен. В соединениях проявляет степень окисления +3 и +4, чем и отличается от других редкоземельных элементов. Ц. применяют в производстве высокоплас-тичных и термостойких сплавов, для изготовления стекла, не темнеющего под действием радиоактивного излучения, для дуговых электродов, кремней зажигалок и др. Соли Ц. (IV) — сильные окислители, используются в аналитической химии для определения различных восстановителей. [c.283]
Соли Ц. (IV) — сильные окислители, используются в аналитической химии для определения различных восстановителей. [c.283]
В рассматриваемом ряду электровалентность серы изменяется от (2-) в сероводороде до (6+) в серной кислоте. Если в состав молекулы входит химический элемент в своем высшем валентном состоянии, то такое химическое соединение в химических реакциях может выступать лишь в роли окислителя. Атом серы в h3SO4 находится в своем высшем валентном состоянии (6+), он отдал 6 электронов и больше отдавать электронов не может. Следовательно, S + будет лроявлять только свойства окислителя. [c.409]
Учение о периодич1Юсти позволяет по-новому рассмотреть вопрос о взаимосвязи всех объектов химии. В этом свете понятие химический элемент является самым общим или наиболее абстрактным понятием. Конкретные понятия — простое и сложное вещество — с ни.м связаны как частное с общим. Критерии их классификации могут быть либо общими (тип связи, тип кристаллов), либо отличаться, если в основу классификации положены какие-либо физические или химические свойства, объединяющие соединения по одному из свойств (окислители, кислоты, электролиты и т. п.). Исторически сложилось такое представление [c.68]
п.). Исторически сложилось такое представление [c.68]
Галогены (от греч. hals — соль и genes — рождающий) — химические элементы главной подгруппы VII группы периодич. системы Д. И. Менделеева фтор F, хлор С1, бром Вг, иод I и астат At. Реагируют со всеми простыми веществами. Все Г.— энергичные окислители. С увеличением порядкового номера химическая активность Г. уменьшается, химическая активность галоид-ионов F , С1 , Вт —, [c.35]
Значительное число реакций в зоне активной мифации химических элементов происходит по типу окислительно-восстановительных реакций. Активными окислителями являются кислород, галогены, Ре » , Мп» , Аз , У» , Сг , активными восстановителями — Ре , Со , Мп , 5 . Окислительно-восстановительный потенциал Е , является важной геохимической константой природных растворов, определяющей способность к окислению или восстановлению ионов. Эта способность зависит от присутствия одного или нескольких компонентов, определяющих направление окислительно-восстановительных реакций к ним относятся свободный кислород, органические соединения, [c. 125]
125]
По отнощению к главным окислителям (О и 5), а также совместному нахождению химических элементов в литосфере можно выделить следующие геохимические группы. Инертные элементы, химические соединения которых в литосфере Неизвестны. Платиновые металлы (платиноиды) Ки, КЬ, Р(1, Оз, 1г, — довольно инертные в химическом отнощении для них характерно свободное (самородное) нахождение в литосфере. Семейство железа 5с, Т1, V, Сг, Мп, Ре, Со, N1. В этом ряду сродство к кислороду возрастает от 5с до Мп, а затем падает у Со и N1. Следующий за ними элемент Си возглавляет группу необычайно важных халькофильных элементов. Халько-фильные элементы Си, 2п, Ag, Сё, Ли, Hg, РЬ, 1п, Те и другие— слабые восстановители, склонны давать природные соединения с серой. Ниже кислородной поверхности главным окислителем их будут атомы серы. Это не означает, что халь-кофильные элементы пренебрегают атомами кислорода в среде, богатой кислородом, почти каждый халькофильный элемент формирует кислородное соединение. Сера из окислителя превращается в восстановитель, образуя комплексный анион [504] поэтому часто в месторождениях сульфидов встречаются сульфаты (барит, ангидрит). [c.424]
Сера из окислителя превращается в восстановитель, образуя комплексный анион [504] поэтому часто в месторождениях сульфидов встречаются сульфаты (барит, ангидрит). [c.424]
ДИСПРОПОРЦИОНЙРОВАНИЕ с. Окислительно-восстановительная реакция, в которой и окислителем и восстановителем является один и тот же химический элемент с одинаковой степенью окисления. [c.133]
КИСЛОРОД Л1. 1. О (Oxygeniuш), химический элемент с порядковым номером 8, включающий 8 известных изотопов с массовыми числами 13-20 (атомная масса природной смеси 15,999) и имеющий типичные степени окисления в соединениях — Пи — I. 2. О2, простое вещество, газ без цвета и запаха, парамагнитен используется как окислитель в металлургии и химической промышленности, а также в медицине и др. [c.181]
ФТОР. м. 1. Р (Р1иогит). химический элемент с порядковым номером 9, включающий 7 известных изотопов с массовыми числами 7-23 (атомная масса природной смеси 18,9984) и имеющий типичную степень окисления I. 2. Рз, простое вещество, бледно-жёлтый газ с резким запахом, сильнейщий окислитель применяется для получения соединений фтора, при разделении изотопов урана и др. [c.473]
2. Рз, простое вещество, бледно-жёлтый газ с резким запахом, сильнейщий окислитель применяется для получения соединений фтора, при разделении изотопов урана и др. [c.473]
Двойственная реакционная способность химических элементов и их соединений, о которой шла речь выше, представляет одно из наиболее ярких проявлений единства противоположностей как закона объективного мира . Очевидно, вс-якое превращение вещества обусловливается взаимодействием противоположных по своему химическому характеру веществ А и В, среди которых вещество А может быть то кислотой, то основанием то окислителем, то зосстановителем то кетоном, то энолом… и т. д. в зависимости от химической природы катализатора или второго реагента В. Замечательно, что это было отмечено еще Берцелиусом, в свое время охарактеризовавшим амфотерность воды вода играет роль основания по отношению к кислотам,— говорил великий химик,— и роль кислоты по отношению к основаниям [27]. [c.378]
Химический окислитель — Справочник химика 21
Окисление пирокатехинов до о-хинонов рассматривалось в разделе 4.2.З.2. Более жесткие условия окисления приводят к расщеплению цикла. Как химические окислители, так и ферменты [c.266]
Окислительно-восстановительное действие электрического тока может быть во много раз сильнее действия химических окислителей и восстановителей. Меняя напряжение на электродах, можно создать почти любой силы окислители и восстановители, которыми являются электроды электролитической ванны или электролизера. [c.208]
Показанная возможность разложения такого токсичного субстрата, как фенол, микроорганизмами, адаптированными к окислительному стрессу, и без накопления продуктов, ингибирующих процесс биологическою разложения создает базу для разработки замкнутых систем биологического окисления, сопряженного с процессами, индуцированными агрессивными химическими окислителями. Такие системы прежде всего могут наши применение при обезвреживании стоков с высокой концентрацией органических зафязнений, в частности, фенолов и их производных, других ароматических соединений. Процесс дает возможность интенсифицировать биодеструкцию и минимизировать количество вторичных отходов и остаточного загрязнения, поступающих в окружающую среду со стадии биологической переработки. [c.239]
Окислительно-восстановительное действие электрического тока может быть во много раз сильнее действия химических окислителей и восстановителей. Меняя напряжение на электродах, можно создать почти любой силы окислители и восстановители, которыми являются электроды электролитической ванны или электролизера. Известно, что ни один самый сильный химический окислитель не может отнять у фторид-иона его электрон. Но это осуществимо при электролизе, иапример, расплава соли N3 или СаРг. В этом случае на катоде (восстановитель) выделяется из ионного состояния металлический натрий или кальций [c.174]
При жидкофазном окислении высших парафинов воздухом первое затруднение отпадает, а второе и третье в некоторой степени упрощаются. Окисление расплавленного парафина кислородом воздуха уже давно осуществляют в промышленном масштабе. Проводится также жидкофазное окисление более легких парафиновых углеводородов химическими окислителями, а в последнее время осваиваются процессы, использующие для этой цели в качестве окислителя воздух. [c.66]
ОКИСЛЕНИЕ ХИМИЧЕСКИМИ ОКИСЛИТЕЛЯМИ [c.76]
Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических восстановителей и окислителей. Так, нн один химический окислитель не может отнять у фторид-иона F его электрон. Поэтому долгое время фтор не могли получить в свободном состоянии, хотя его соединения распространены в природе. Отнять электрон у фторид-иона удалось лишь при электролизе раствора фторида калия во фтористоводородной кислоте. В этом случае на аноде выделяется фтор (2F» — 2е = = F2), а на катоде— водород (2Н -f 2е = Но). [c.95]
Электрохимические методы синтеза органических соединений в последние годы приобретают все большее значение. Интерес к применению электролиза для получения ценных органических соединений обусловлен тем, что данный метод во многих случаях обладает высокой селективностью, не связан с расходом дорогих химических окислителей или восстановителей и в ряде случаев дает продукт высокого качества [1]. Подавляющее большинство реакций электросинтеза органических соединений протекает при обычных температурах и нормальных давлениях в электролизерах достаточно простой конструкции [2, 3]. [c.7]
Электрический ток — сильный окислитель и восстановитель, и с его помощью могут быть осуществлены процессы с большей глубиной превращений, чем при использовании обычных химических окислителей или восстановителей. [c.57]
Недавно электролитическое окисление заменило химические окислители. Когда электролизу подвергается раствор железистосинеродистого калия в диафрагменных ваннах, феррицианид образуется на аноде. Одновременно образуется едкое кали, которое может быть удалено при помощи двуокиси углерода, как было описано в предыдущем параграфе. Электролитический способ имеет то важное преимущество перед химическим окислением, что феррицианид может быть получен в твердом виде из анодного отделения прибавлением твердого железистосинеро-дистого калия до тех пор, пока раствор не станет насыщенным окисным соединением и не произойдет осаждения твердой красной соли. [c.71]
Восстановительное и окислительное действие электрического тока во много раз сильнее химических восстановителей и окислителей. Ни один химический окислитель не может отнять у иона фтора его электрон. Окислить ион фтора удалось лишь при электролизе расплава смеси безводного жидкого фтороводорода с фторидом калия. На угольном аноде выделяется фтор [c.178]
В качестве химических окислителей могут быть использованы галогены, перманганат калия, бихромат натрия или калия, пероксид водорода, азотная кислота, гипохлориты, хлораты и др. [c.233]
Хотя в результате этой реакции может происходить непосредственное окисление углеводорода в адипиновую кислоту, чему способствует применение растворителей и катализаторов обычно целесообразно останавливать ее на стадии спирт-кетон и использовать химические окислители (например, азотную кислоту) для превращения этой смеси в адипиновую кислоту. В некоторых патентах предлагаются способы ускорения последней стадии процесса [c.463]
Общее — окисление галогенид-ионов до свободного галогена более сильными химическими окислителями. Поскольку фтор — наиболее сильный окислитель, его можно получить только электролизом расплавленных фторидов. [c.496]
Двухступенчатое окисление воздухом, химическими окислителями [c.347]
Отрицательные ионы F», С1 , Вг» и J» могут в определенных условиях потерять присоединенные электроны, т. е. обладают восстановительными свойствами. Среди химических окислителей нет ни одного, способного окислить ион F . Он может быть окислен лишь анодом электрической сети в безводной среде или в расплаве солей. В этих условиях протекает процесс [c.387]
Абсорбционный метод основан на различной растворимости газов в жидкостях воде, водных растворах щелочей или кислот, водных растворах химических окислителей. Качество абсорбентов определяют растворимость в нем основного извлекаемого компонента и ее зависимость от температуры и давления. От растворимости зависят все главные показатели процесса условия регенерации, циркуляции абсорбента, расход тепла на десорбцию газа, расход электроэнергии, габариты аппаратов. Абсорбционные методы гаироко применяются в промышленности. Достоинством их является рекуперация ценных продуктов, а к недостаткам относят многостадий-ность процессов постоянной регенерации сорбентов и необходимость дополнительной очистки выделенных продуктов. Опыт работы промышленных установок показал, что эти методы позволяют достигнуть значительного эффекта очистки отходящих газов, однако они не решают проблему полного их обезвреживания. В тех случаях, когда газовые выбросы представляют собой многокомпонентную смесь органических веществ, очистка усложняется очистные сооружения достигают больших размеров, а это затрудняет их раз- мещение и обслуживание. [c.166]
Парафины можно окислять кислородом воздуха или химическими окислителями. На разработку промышленного метода окисления парафинов воздухом было затрачено много усилий, что объясняется доступностью этих углеводородов. На этом пути имеется три серьезных практических затруднения, которые, по-видимому, были преодолены только за последние 20 лет. Первое затруднение состоит в необходимости работать вне пределов взры-ваемости смесей углеводородов с воздухом, что заставляет применять большой избыток либо воздуха, либо углеводорода. В случае избытка воздуха концентрация летучих продуктов в отходящих газах мала, что удорожает их выделение. При избытке углеводорода его превращение за один проход невелико, а поэтому непрореагировавший углеводород приходится выделять и возвращать обратно в процесс. Вторым затруднением является то, что во всех случаях, кроме, может быть, окисления метана, продукты реакции представляют сложные смеси различных веществ. Разделение таких смесей требует зь1ачительных расходов кроме того, возникает проблема использования всего комплекса побочных продуктов, o6pa3yramiix H в более или менее определенных пропорциях. Наконец, третье затруднение состоит в том, что общий выход полезных продуктов невелик в результате потерь углерода, происходящих вследствие образования его окислов. [c.66]
Нахождение в природе. Фтор имеет один природный изотоп F бром — два (50,6%) и Вг (49,4%), иод — один стабильный изотоп 1. Фтор как самый сильный химический окислитель находится в природе в восстановленном состоянии в виде фторид-ионов, входящих в состав таких минералов, как флюорит (плавиковый щпат) СаРг криолит NasAlFe, фторапатит Са5(Р04)зР. [c.225]
В наших условиях процесс биоокисления отрабатывался в условиях классических аэробных методов культивирования микроорганизмов с внесением в качестве химического окислителя перекиси водорода. Этот агент, как уже отмечалось, используется в ряде технологий химического окисления органических токсикантов и для предобработки стойких к биологическому окислению веществ. Первоначально предполага1ЮСь выяснить, возможно ли достижение таких условий среды культивирования, при которых будет существенным протекание химических процессов окисления фенола, его интермедиатов или каких-либо внеклеточных продуктов перекисью водорода на фоне протекания биологического окисления, и будут ли выдерживать консорциумы фенолдеструкторов достаточно жесткие условия, в данном случае достаточно высокие концентрации перекиси водорода в активной фазе биоокисления. [c.231]
Окись углерода является ядом, поскольку она легко соединяется с гемоглобином, образуя более прочный, чем оксигемоглобин, продукт присоединения, который препятствует нормальному функционированию гемоглобина в переносе кислорода. Химические окислители превращают гемоглобин (феррогемоглобин) в коричнево-красный метгемогло-бин (ферригемоглобин), не способный служить пербносчиком кислорода. [c.671]
За исключением фторид-иона, все простые анионы могут окисляться до свободных элементов или до высших положительных степеней окисления под воздействием химического окислителя, имеющего достаточно высокий потенциал восстановления. Предельно высокий отрицательный потенциал окисления фторид-иона (см. приложение VIII) показывает, что для него не существует никакого химического окислителя. Единственным способом окисления фторид-иона является электролиз, в условиях которого достаточно высокий потенциал обеспечивается внешним источником — генератором или батареей аккумуляторов. Электролиз часто используют также для окисления других простых анионов — хлорид-, бромид- и оксид-ионов. [c.337]
В сточных водах комплексоны аминокарбонового и аминофосфонового ряда подвержены биодеградации, которая может быть усилена дополнительным воздействием химических окислителей. В результате они теряют способность к связыванию металлов. [c.507]
Электрохимические превращения органических соединений чрезвьпгай-но многообразны. Это связано с тем, что все классы органических соединений проявляют окислительно-восстановительные свойства в условиях анодного окисления или катодного восстановления. Как известно, с помощью электрического тока можно достигнуть таких высоких окислительных и таких низких восстановительных потенциалов, которые недосягаемы с помощью химических окислителей и восстановителей. [c.296]
Органические катион-радикалы образуются в реакциях отрыва электрона от молекулы и присоединения протона к свободному радикалу. С использованием химических окислителей, таких, как концентрированная НаЗО , пероксидисульфат натрия (КааЗгО ), солей переходных металлов, некоторых кислот Льюиса, органи- [c.230]
Получение вератона. В синтезе душистых веществ примером окисления спиртовой группы до карбонильной с помощью химических окислителей может служить получение вератона, душистого вещества с запахом свежей зелени [c.235]
Химическая потребность в кислороде выражает количество кислорода, необходимое для окисления всех углеродсодержащих соединений до двуокиси углерода, серосолержаишх до сульфатов, азотсодержащих до нитратов, фосфорсодержащих до фосфатов. В стандартной методике определения ХПК в качестве химического окислителя используется бихромат калия К2СГ2О7. Поэтому ХПК иногда называют бихроматной окисляе-мостью. [c.212]
Кинетические измерения часто указывают на то, что реакции окисления, в присутствии энзимов, являются цепными процессами . Так, при малых концентрациях реакция обычно псевдомо-номолекулярна и идет со скоростью, пропорциональной концентрации окисляющегося метаболита. Но при высоких концентрациях достигается максимальная скорость, не зависящая от концентрации метаболита и постепенно падающая со временем но мере того, как коэнзим подвергается необратимому разрушению. Поскольку цепные реакции принадлежат в основном к гемолитическому типу (стр. 23), имеет смысл рассмотреть вопрос о возможности реакций со свободными радикалами в энзиматических системах. Свыше тридцати лет назад Дэкин указал, что перекись водорода является единственным из всех химических окислителей, который вызывает в жирах, углеводах и аминокислотах такие же процессы окислительного распада, как и энзимы. Поэтому он считал что перекисная теория окисления, выдвинутая Бахом и Энглером, применима к живым клеткам так же, как и к другим областям химии. [c.291]
Кроме ка ралитического действия лакказы в присутствии воздуха [84], можно получить феноксильные радикалы из коричных спиртов и под действием некоторых химических окислителей [242, 291]. Однако чаще всего для осуществления реакции полимеризации используют систему пероксидаза — HjOj [104, 107, 157, 181, [c.107]
По существу установление факта биоэлектрокатализа при анодном растворении золота биохимическими растворителями подтвердило ранее высказанное суждение автора [42, с. 143], который, анализируя выявленный тогда факт возможности выщелачивания золота растворами некоторых белков без добавок химических окислителей, писал, что это объясняется либо влиянием ферментативного катализа, либо значительным снижением окислительно-восстановительного потенциала системы до величины, когда растворенный кислород воздуха способен окислять золото как при выщелачивании цианистыми растворами. Глубокое изучение вопро- а может определить существенный прогресс бактериального вы- Делачивания . Можно полагать, что к электрокаталитическим Процессам относятся растворение и выщелачивание золота цианистыми растворами и многие другие процессы его растворения. [c.59]
Разработано несколько вариантов технологического процесса, в частности, с разделением стадии микробиологического синтеза золоторастворяющих соединений и последующего выщелачивания-Экономичными растворителями можно считать гидролизаты белков, содержащие смеси аминокислот. При выщелачивании золота растворами некоторых белков можно обходиться без добавок химических окислителей. [c.154]
Окисление можно проводить кислородом, воздухом или химическими окислителями. Б промышленности чаще всего применяют окисление кислородом воздуха. Промышленное осуществление процессов окисления связано с серьезными трудностями, обусловленными образованием взрывчатых смесей углеводородов с воздухом. Это обстоятельство заставляет работать со смесями, в которых концентрация углеводородов либо ниже нижнего предела, либо выше верхнего предела взрываемасти, т. . с избытком либо углеводорода, либо воздуха. В случае окисления высших парафинов воздухом это затруднение отпадает. При избытке углеводорода конверсия его за один проход невелика непрореагировавший углеводород выделяют и снова возвращают в процесс. При избытке воздуха образуется мало целевых продуктов и их выделение затрудняется. [c.170]
При электролизе катод непрерывно отдает электроны положительно варяженным ионам (катионам), т. е. является восстановителем. Одновременно анод непрерывно отнимает электроны у отрицательно заряженных ионов (анионов), т. е. является окислителем. Действие электрического тока при этом сильнее, чем действие химических окислителей и восстановителей. Таким образом [c.156]
Значительно шире медиаторы используются в реакциях электрохимического окисления. При этом применяются химические окислители как в катионной, так и в анионной формах. Например, о-нитротолуол окисляется СоЗ+ в о-нитробензальде-гид [168] [c.117]
ХиМиК.ru — ОКИСЛИТЕЛИ — Химическая энциклопедия
ОКИСЛИТЕЛИ, в-ва,
молекулы к-рых принимают электроны или отдают кислород в окислит.-восстановит.
р-циях. Относит. окислит. способность в-в определяется путем сравнения изменения
энергий Гиббса при р-циях в-в с одним и тем же восстановителем (),
а в случае р-ций между простыми в-вами-сравнением DG0обр
продуктов окисления простого в-ва. Чем больше абс. величина
или , тем
более активным окислителем является данное в-во. Так, при обычных условиях в р-циях Са
+ Х2СаХ2
(где X = Cl, F), Са + 1/2O2, CaO
хлор-более активный окислитель, чем О, но менее активный, чем F2 (
CaO -603,9, СаСl2 -749,3, CaF2 -1168,4 кДж/моль).
В случае электрохим. р-ций
или р-ций в р-рах для сравнения окислит. способности в-в используют стандартный
электродный потенциал (пропорционален ).
Окислит. св-ва в-в в р-рах зависят от величины рН р-ра.
Сильнейшие окислители-атомарные
F, О, Сl, нек-рые своб. радикалы, сильные окислители-F2, O2, О3,
Сl2, фториды кислорода, галогенов, благородных газов, фториды, оксиды
и хлориды азота, фториды и оксиды переходных металлов в высоких степенях окисления,
олеум, нек-рые к-ты (конц. HNO3, НСlO4), соли (напр.,
гипохлориты, К2Сг2О7, КМnО4) и комплексные
соед., пероксиды. Нек-рые в-ва проявляют окислит. св-ва в плазменном состоянии
(напр., CF4 или при фотохим. активации (напр., SF6).
Окислители применяют: при сжигании
орг. топлива; для окислит, выплавки металлов из сульфидных руд; для удаления
примесей из металлов и сплавов; в орг. и неорг. синтезе; в жидких ракетных топливах
и смесевых ВВ; для отбеливания шерсти, хлопка, целлюлозы, шелка; для хим. травления
металлов и полупроводников; в хим. источниках тока в составе катодов и др. Э.Г.
Раков.
Окислители и восстановители
Окислителями называют соединения или простые вещества, которые в процессе химической реакции присоединяют к себе электроны.
Восстановителями называют соединения или простые вещества, отдающие свои электроны.
Окислительные и восстановительные реакции идут параллельно, так что количество отсоединенных и присоединенных электронов одинаково. При этом окислитель восстанавливается, а восстановитель — окисляется.
Окислителем или восстановителем могут быть атом, ион и вещества:
- простые или сложные;
- неорганические или органические;
- газ, жидкость, твердое (расплав).
Окислительное число
В химии существует такое понятие, как степень окисления, также называемое окислительным числом. Это условная величина, она оценивает активность атома при окислении или восстановлении. Эта величина используется для описания свойств соединений или ионов, помогает правильно написать уравнение хим. реакции, составить формулу вещества. Она применяется для указания количества передаваемых или принимаемых электронов.
Обращая внимание на окислительное число, нужно помнить, что это не заряд атома!
Окислительное число определяется по числу электронов, которые нужно добавить иону с положительным зарядом, чтобы атом стал нейтральным, или числу электронов, которые нужно отнять у иона с отрицательным зарядом, чтобы он стал нейтральным.
Самое большое окислительное число +7. Ион +7 проявляет исключительно сильные окислительные свойства и нуждается в семи электронах, чтобы стать нейтральным. Пример вещества с окислительным числом +7 — марганец в перманганате калия.
Наименьшее окислительное число -8. Такой ион проявляет только восстановительные свойства и должен отсоединить восемь электронов, чтобы стать нейтральным.
Окислительное число на письме указывают числовым индексом со знаком над символом элемента. Для того, чтобы не перепутать степень окисления с зарядом, у окислительного числа знак ставится перед числом, а у заряда — после.(2-) — формула вещества с указанием зарядов ионов.
К популярным окислителям относятся кислород и озон, галогены (F, Br, Cl, I), пероксиды, гипохлориты, хлораты, азотная, серная и селеновая кислота, «царская водка», хром (VI), дихромат калия, перманганаты, атомарный водород, фториды, оксиды и хлориды неметаллов и переходных металлов.
Сильные восстановители это щелочные и щелочноземельные металлы, углерод, кремний, аммиак, аммиачные растворы щелочных и щелочноземельных металлов, гидриды металлов, молекулярный водород.
Существует множество веществ, обладающих свойствами и окислителя, и восстановителя. Они содержат молекулы со средними значениями окислительного числа; могут и отсоединять, и присоединять электроны. Будут они отдавать или принимать электроны — зависит от того, с чем взаимодействуют, например, вода при контакте со фтором восстановитель, а с железом — окислитель.
Применение
Окислители используются:
- для выделения металлов из сульфидных руд;
- при очистке металлов и сплавов от примесей;
- в химпроме в органических и неорганических синтезах;
- при сжигании органического топлива;
- для производства жидкого ракетного топлива и взрывчатых веществ;
- в процессах отбеливания натуральных нитей и тканей, целлюлозы, бумаги;
- для травления металлов;
- для изготовления катодов химических источников тока.
Восстановители востребованы:
- в металлургии для получения железа из руды;
- при металлотермическом производстве цветных металлов;
- для выделения цветных металлов из водных солевых растворов;
- при получении металлов и их соединений из газов;
- в различных химических реакциях, в органическом синтезе;
- в фотоделе в качестве проявителей;
- для изготовления анодов химических источников тока.
Задание С1 на ЕГЭ по химии. Особенности, советы, рекомендации.
Автор статьи — профессиональный репетитор О. В. Овчинникова.
Часть С на ЕГЭ по химии начинается с задания С1, которое предполагает составление окислительно-восстановительной реакции (содержащей уже часть реагентов и продуктов). Оно сформулировано таким образом:
С1. Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
Часто абитуриенты считают, что уж это задание не требует особой подготовки. Однако оно содержит подводные камни, которые мешают получить за него полный балл. Давайте разберёмся, на что обратить внимание.
Теоретические сведения.
Перманганат калия как окислитель.
Дихромат и хромат как окислители.
Повышение степеней окисления хрома и марганца.
Азотная кислота с металлами.
— не выделяется водород, образуются продукты восстановления азота.
Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
| Сера + щёлочь 2 соли, сульфид и сульфит металла (реакция идёт при кипячении) | и |
| Фосфор + щелочь фосфин и соль гипофосфит (реакция идёт при кипячении) | и |
| Хлор, бром, иод + вода (без нагревания) 2 кислоты, Хлор, бром, иод + щелочь (без нагревания) 2 соли, и и вода | и |
| Бром, иод + вода (при нагревании) 2 кислоты, Хлор, бром, иод + щелочь (при нагревании) 2 соли, и и вода | и |
Диспропорционирование оксида азота (IV) и солей.
Ты нашел то, что искал? Поделись с друзьями!
Активность металлов и неметаллов.
Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
Запомните! Азот — более активный неметалл, чем хлор!
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Ряд электроотрицательности неметаллов:
| увеличение электроотрицательности |
Особенности поведения некоторых окислителей и восстановителей.
а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).
Необходимые навыки.
- Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю.
Задание 1: Расставьте степени окисления в веществах: - Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0. - Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.
Пример:В этой реакции надо увидеть, что иодид калия может являться только восстановителем, поэтому нитрит калия будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит из в ближайшую степень окисления . - Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия , когда он в роли окислителя переходит в :Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием?
- Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты.
Задание 5: Определите среду и вещества в каждой реакции: - Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться.
Задание 6: В какой стороне реакции окажется вода? Bо что перейдёт цинк?Задание 7: Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:(хол. р-р.)
(водн.р-р) - Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше:
Задание 8: Какие продукты ещё получатся? Допишите и уравняйте реакцию: - Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу из в , обычно окисление идёт только до .
И наоборот, если — сильный восстановитель и может восстановить серу из до , то — только до .
Задание 9: Во что перейдёт сера? Допишите и уравняйте реакции:(конц.)
- Проверьте, чтобы в реакции был и окислитель, и восстановитель.
Задание 10: Сколько ещё продуктов в этой реакции, и каких? - Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Задание 11: Кто из этих галогенов окислитель, а кто восстановитель? - Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.
Задание 12: Какую роль выполняет пероксид водорода в каждой реакции?
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
- Задание 13: Допишите и уравняйте:
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
Возможные ошибки.
- Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях:Задание 14: Допишите и уравняйте:
Задание 15: Допишите и уравняйте:
- Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот.
Пример: в реакции свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса… - Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.Задание 16: Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
Ответы и решения к заданиям с пояснениями.
Задание 1:
Задание 2:
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т.е. 6.
Задание 4:
Так как в молекуле два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент .
Задание 5:
Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:
Задание 7:
Задание 8:
В процессе составления баланса мы видим, что на 2 иона приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:
(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
(конц.)
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.
Хлор выделяется в виде простого вещества.
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления , образуя йодноватую кислоту.
Задание 12:
(пероксид — окислитель, т.к. восстановитель — )
(пероксид — восстановитель, т.к. окислитель — перманганат калия)
(пероксид — окислитель, т.к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:
Задание 14:
Задание 15:
Задание 16:
Читаем дальше: Задача С2 на ЕГЭ по химии.
Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
8.2 Окислители и восстановители
Цель обучения
- Укажите окислители и восстановители.
Жизнь на планете Земля — это сложный и хорошо организованный набор процессов. Животные созданы для того, чтобы дышать кислородом, а растения созданы для производства кислорода. Фотосинтез — это средство, с помощью которого мы получаем кислород, необходимый для жизни. Свет, падающий на растительный пигмент, известный как хлорофилл, запускает сложную серию реакций, многие из которых включают окислительно-восстановительные процессы, сопровождающиеся движением электронов.{2-}} \ end {align} \]
В указанной выше реакции цинк окисляется за счет потери электронов. Однако должно присутствовать другое вещество, которое получает эти электроны, и в данном случае это сера. Другими словами, сера вызывает окисление цинка. Серу называют окислителем. Цинк заставляет серу приобретать электроны и восстанавливаться, поэтому цинк называют восстановителем. Окислитель — это вещество, которое вызывает окисление, принимая электроны; следовательно, его степень окисления снижается.Восстановитель — это вещество, которое вызывает восстановление за счет потери электронов; следовательно, его степень окисления увеличивается. Самый простой способ представить это — это то, что окислитель — это вещество, которое восстанавливается, а восстановитель — это вещество, которое окисляется, как показано на Рисунке \ (\ PageIndex {1} \) и суммировано в таблице \ (\ PageIndex {1} \).
Рисунок \ (\ PageIndex {1} \) Восстановитель окисляется, а окислитель восстанавливается.
Примечание
И окислители, и восстановители являются реагентами и, следовательно, появляются в левой части уравнения , .
| Окисляющие вещества | Восстановители | |
| Состояние окисления | Уменьшается | Увеличивается |
| Кол-во электронов | Получил | Пропал |
| Вещество есть… | Пониженный | Окисленный |
Примеры ниже показывают, как анализировать окислительно-восстановительную реакцию и определять окислители и восстановители.
Пример \ (\ PageIndex {1} \) Полуравнения
Когда газообразный хлор барботируется в раствор бромида натрия, происходит реакция с образованием водного раствора хлорида натрия и брома. Определите, что окисляется, а что восстанавливается. Определите окислители и восстановители.
\ [\ ce {Cl_2} \ left (g \ right) + 2 \ ce {NaBr} \ left (aq \ right) \ rightarrow 2 \ ce {NaCl} \ left (aq \ right) + \ ce {Br_2} \ влево (л \ вправо) \]
Решение:
Шаг 1. Спланируйте проблему.
Разложите реакцию на чистое ионное уравнение, а затем на половинные реакции. Вещество, теряющее электроны, окисляется и является восстановителем. Вещество, которое получает электроны, восстанавливается и является окислителем.
Шаг 2: Решить.- (водн.) \]
Степени окисления: от 0 до -1
Обзор
- Br — теряет электрон; окисленный от Br — до Br 2 ; таким образом, Br — является восстановителем . {2 -} \]
Раствор
\ (S \) — восстановитель, а \ (Mn \) — окислитель.Резюме
- Окислитель — это вещество, которое вызывает окисление, принимая электроны; следовательно, он уменьшается.
- Восстановитель — это вещество, которое вызывает восстановление за счет потери электронов; поэтому он окисляется.
- Показаны примеры того, как идентифицировать окислители и восстановители.
Авторы и указание авторства
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Эд Витц (Университет Кутцтауна), Джон В. Мур (Вашингтонский университет в Мэдисоне), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
- Дайана Пирсон, Конни Сюй, Лувлин Брар (UCD)
Мариса Альвиар-Агнью (Городской колледж Сакраменто)
Окислители и восстановители
Окислители и восстановители
Обычные окислители и восстановители
Рассматривая окислительно-восстановительные реакции, мы можем сосредоточиться на роли, которую играет
конкретный реагент в химической реакции.Какова роль перманганат-иона в
следующая реакция, например?2 MnO 4 — ( водн. ) + 5 H 2 C 2 O 4 ( водн. )
+ 6 H + ( водн. ) 10 CO 2 ( г ) + 2 Mn 2+ ( водн. ) + 8 H 2 O ( l )В этой реакции щавелевая кислота окисляется до диоксида углерода, и перманганат-ион превращается в
восстановлен до иона Mn 2+ .Окисление: H 2 C 2 O 4 CO 2 +3 +4 Редукция: MnO 4 — Mn 2+ +7 +2 Перманганат-ион удаляет электроны из молекул щавелевой кислоты и тем самым окисляет
щавелевая кислота.Таким образом, ион MnO 4 — действует как окисляющий
агент в этой реакции. Щавелевая кислота, с другой стороны, восстанавливает
агент в этой реакции. Отказываясь от электронов, он уменьшает MnO 4 —
ион к Mn 2+ .Атомы, ионы и молекулы, обладающие необычно большим сродством к электронам, имеют тенденцию к
быть хорошими окислителями. Элементарный фтор, например, самый сильный из обычных
окислитель.F 2 — такой хороший окислитель, что металлы, кварц,
асбест, и даже вода воспламеняется в его присутствии. Другие хорошие окислители
включают O 2 , O 3 и Cl 2 , которые являются элементарными формами
второй и третий по величине электроотрицательный элемент соответственно.Еще одно место для поиска хороших окислителей — соединения с необычно большими
степени окисления, такие как перманганат (MnO 4 —), хромат (CrO 4 2-),
и дихромат (Cr 2 O 7 2-) ионы, а также азотная кислота
(HNO 3 ), хлорная кислота (HClO 4 ) и серная кислота (H 2 SO 4 ).Эти соединения являются сильными окислителями, поскольку элементы становятся более электроотрицательными.
по мере увеличения степени окисления их атомов.Хорошие восстановители включают активные металлы, такие как натрий, магний, алюминий,
и цинк, которые имеют относительно небольшую энергию ионизации и низкую электроотрицательность.
Гидриды металлов, такие как NaH, CaH 2 и LiAlH 4 , которые формально
содержат ион H — , также являются хорошими восстановителями.Некоторые соединения могут действовать как окислители или восстановители. Одним из примеров является
газообразный водород, который действует как окислитель, когда он соединяется с металлами, и как
восстановитель при взаимодействии с неметаллами.2 Na ( с ) + H 2 ( г ) 2 NaH ( с ) H 2 ( г ) + Cl 2 ( г ) 2 HCl ( г ) Другой пример — перекись водорода, в которой атом кислорода находится в состоянии окисления -1.
государственный.Поскольку эта степень окисления находится между крайними значениями более распространенных 0 и -2.
степени окисления кислорода, H 2 O 2 может действовать как окисляющий
агент или восстановитель.Относительная сила окисления и
ВосстановителиСамопроизвольные окислительно-восстановительные реакции превращают более сильную из пары окислительных
агентов и более сильного из пары восстановителей в более слабый окислитель и
более слабый восстановитель.Тот факт, что происходит, например, следующая реакция, предполагает:
что металлическая медь является более сильным восстановителем, чем металлическое серебро, и что Ag +
ион является более сильным окислителем, чем ион Cu 2+ .Cu ( s ) + 2 Ag + ( водн. ) Cu 2+ ( водн. ) + 2 Ag ( с ) сильнее
уменьшение
агентсильнее
окислительный
агентслабее
окислительный
агентслабее
восстанавливающий
агентНа основе множества таких экспериментов общие окислительно-восстановительные полуреакции
были организованы в таблицу, в которой самые сильные восстановители находятся на одном конце и
самые сильные окислители находятся в другом, как показано в таблице ниже.От
условно, все полуреакции записываются в сторону уменьшения.
Кроме того, по традиции самые сильные восстановители обычно находятся в верхней части
стол.Относительная сила обычных окислителей и восстановителей
АгентыК счастью, вам не нужно запоминать эти условные обозначения. Все, что тебе нужно сделать, это
помните, что активные металлы, такие как натрий и калий, отлично восстанавливают
агентов и найдите эти записи в таблице.Самые сильные восстановители можно найти в углу стола, где находятся металлические натрий и калий.
перечисленные.Практическая задача 9: Расположите следующее
окислители и восстановители в порядке увеличения прочности:Восстановители: Cl — ,
Cu, H 2 , H — , HF, Pb и ZnОкислители: Cr 3+ ,
Cr 2 O 7 2- , Cu 2+ , H + , O 2 , O 3 ,
и Na +Нажмите здесь, чтобы проверить свой ответ на «Практика»
Проблема 9.Практическая задача 10: Прогноз
должны ли происходить следующие окислительно-восстановительные реакции, как написано:(а) 2 Ag ( с ) + S ( с ) Ag 2 S ( с )
(б) 2 Ag ( с ) + Cu 2+ ( водн. ) 2 Ag + ( водн. ) + Cu ( с )
(c) MnO 4 — ( водн. ) + 3 Fe 2+ ( водн. ) + 2 H 2 O ( l ) MnO 2 ( s )
+ 3 Fe 3+ ( водн. ) + 4 OH — ( водн. )(d) MnO 4 — ( водн. ) + 5 Fe 2+ ( водн. ) + 8 H + ( водн. ) Mn 2+ ( водн.
+ 5 Fe 3+ ( водн. ) + 4 H 2 O ( л )Нажмите здесь, чтобы проверить свой ответ на
Задача 10.Окислитель
2
Новое биохимическое соединение разрушает загрязнители окружающей среды
18 февраля 2020 г. — Исследователи открывают новое биохимическое соединение, которое может разрушать окружающую среду …
Невинные и сильно окисляющие
3 июня 2020 г. — Химики производят новые окислители в качестве препаративного средства…
Наконец-то в бутылке
7 февраля 2019 г. — С момента открытия первого гомолептического комплекса карбонила металла более 130 лет назад ученые пытались получить дополнительные такие соединения, образованные из молекулы монооксида углерода и …
Много свинца в воде? Может быть, марганец виноват
22 июля 2019 г. — В правильной среде безвредный минерал может во многом изменить состав питьевой воды, протекающей по свинцовым трубам.Новое исследование обнаруживает …
LED-Ing the Way: чистый и удобный метод окисления пластиковых поверхностей для промышленности
11 июня 2019 г. — Исследовательская группа использовала диоксид хлора для окисления полипропилена. Под облучением светодиодами радикалы ClO2 * атакуют метильные группы полипропилена, превращая их в карбоновую кислоту. C-H …
Атомные изображения показывают необычно много соседей для некоторых атомов кислорода
Октябрь21 января 2019 г. — Идентификация новых химических связей имеет решающее значение для проектирования новых структур материалов. Команда обнаружила неожиданные новые конфигурации кислорода и азота в …
Умный полимер, содержащий антиоксиданты, реагирует на химический состав тела и окружающую среду
16 апреля 2019 г. — Окислители, обнаруженные в живых организмах, являются побочными продуктами метаболизма и необходимы для заживления ран и иммунитета. Однако, когда их концентрация становится слишком высокой, возникает воспаление и повреждение тканей…
Химия магния перевернула голову
14 мая 2021 г. — Новые открытия произведут революцию во всей химии магния. Исследовательская группа обнаружила магний, который обычно имеет двойной положительный заряд в химических соединениях, в …
Новый спин молекулярного кислорода
17 июля 2019 г. — Синглеты реактивного молекулярного кислорода находят множество применений в химии и медицине, но они менее распространены, чем триплеты нереактивного кислорода.Многонациональная исследовательская группа разработала …
Химики обнаружили, что микрокапли воды спонтанно производят перекись водорода
26 августа 2019 г. — Вода, несмотря на ее обилие, хранит множество секретов. Среди них химики обнаружили, что микрокапли воды самопроизвольно выделяют водород …
Окислитель (окислитель) — определение, примеры, опрос
Определение окислителя
Окислитель — это химическое вещество, которое заставляет другое химическое вещество терять электроны.Окисление означает потерю электронов, потерю атома водорода или добавление атома кислорода. Окислитель обладает способностью принимать или переносить эти электроны.
Обзор окислителя
Окислитель можно сравнить с восстановителем или химическим веществом, которое заставляет другую молекулу получать электроны. Агент, способный окислять другой вид, заставляет его терять электроны. В качестве альтернативы окислителем может быть добавка кислорода к химическому веществу.Кислород оттягивает электроны от других частей молекулы, эффективно окисляя всю молекулу. В других случаях, как мы увидим в примерах, окислитель отделен от восстановителя, но позволяет переносить электроны для завершения реакции восстановления-окисления или для краткости окислительно-восстановительной реакции.
Редокс-реакции всегда состоят из двух полуреакций , независимо от того, протекают они вместе или нет. Реакция восстановления происходит, когда химическое вещество приобретает электроны.Эти электроны должны исходить откуда-то и теряться из-за другого химического вещества в предыдущем процессе. Этот процесс известен как окисление. Окислитель или окислитель отвечает за удаление этих электронов. Агент может быть непосредственно вовлечен в реакцию или может быть катализатором, который просто управляет удалением электронов из вещества.
Список окислителей
Окислитель может быть любым химическим веществом, которое склонно принимать электроны.Следовательно, такие вещества, как кислоты, обычно являются окислителями из-за их склонности брать больше электронов. Ниже приведены несколько распространенных окислителей:
- Кислород
- Фтор
- Хлор
- Азотная кислота
- Перекись водорода
- И МНОГОЕ БОЛЬШЕ…
Примеры окислителей
Формирование соли в лаборатории
Поваренная соль представляет собой чрезвычайно простую комбинацию двух элементов: натрия и хлора.Хотя большая часть коммерческой соли производится путем извлечения готовой соли из природных источников, ее можно производить в лаборатории. При объединении твердого металлического натрия в атмосфере газообразного хлора натрий окисляется. Эта реакция окисления сочетается с реакцией восстановления хлора. Другими словами, натрий теряет электрон, превращаясь в катион натрия (положительный ион). Хлор получает электрон, становясь отрицательным анионом. Вместе эти два иона образуют ионное соединение хлорида натрия или поваренную соль.Интересно, что хотя поваренная соль в основном безвредна, газообразный хлор — чрезвычайно токсичное соединение.
Отчасти газообразный хлор настолько смертоносен, что он является чрезвычайно мощным окислителем. Хлор очень реактивен и обычно пытается увести электроны. Хотя окисление может превратить металл в соль, оно также может опасно реагировать с многочисленными химическими реакциями организма, отводя столь необходимые электроны и вызывая хаос. К счастью, окислители работают только в одном направлении.Вам не нужно беспокоиться о том, что вас отравят поваренной солью.
Фруктовая батарея
Еще один интересный окислитель представлен в виде классической демонстрации в классе. Фруктовая батарея, также известная как лимонная или картофельная батарея, представляет собой форму электрического тока, возникающую в результате окислительно-восстановительных реакций. Два зонда помещаются по обе стороны от лимона или другого фрукта или овоща. Один зонд, сделанный из цинка, через светильник соединяется с другим зондом, сделанным из меди.
Цинковый зонд при кислотности фруктов начинает растворяться в фруктах. Это происходит за счет окисления фруктовых кислот. Кислота действует как катализатор, который позволяет некоторым атомам цинка разорвать связи с другим цинком, оставляя электроны, удерживающие их в матрице. Электроны, которые теперь накапливаются в цинковом зонде, пытаются равномерно распределиться по зонду. Между тем, на медном зонде медь действует как катализатор при восстановлении ионов водорода до газообразного водорода.Медь откладывает лишние электроны на ионах водорода, которые затем могут образовывать ковалентные связи друг с другом. Это создает небольшие пузырьки вокруг медного зонда.
Таким образом, с одной стороны фруктовой батареи есть потребность в электронах, а с другой стороны — избыток электронов. Медный провод, соединяющий два зонда через светильник, действует как проводник, обеспечивая легкий путь для электронов. Когда электроны текут от цинка к меди, они могут выделять часть своей энергии в лампочке и создавать свет. Концепции, описанные выше, можно увидеть на изображении ниже, которое представляет собой схему любой простой батареи. Фруктовая батарея, хотя некоторые ошибочно утверждают, что она питается от живых фруктов, работает как все батареи.
Цинк-медный гальванический элемент
В этом случае окислитель не является прямым получателем электронов, а просто заставляет их удаляться из цинка и проходить через проволоку. Восстановитель , противоположный окислителю, представляет собой медную проволоку, потому что она катализирует перенос электронов в молекулы водорода.
Окислительное фосфорилирование
Одним из наиболее важных биохимических процессов для всех живых животных является окислительное фосфорилирование , или перенос электронов от питательных веществ к молекулам, которые обеспечивают энергией клетки. Обычно полный распад пищи представляет собой серию окислительно-восстановительных реакций, в которых задействовано множество различных окислителей и получателей электронов. Окислительное фосфорилирование — последняя стадия процесса, происходящая в митохондриях всех растений и животных.
Во время окислительного фосфорилирования, серия белков, встроенных в митохондриальную мембрану, катализирует реакции окисления и направляет электроны к другим белкам. Эти белки катализируют реакции восстановления АТФ и других молекул, обеспечивающих энергию. В этой сложной серии окислительно-восстановительных реакций используется много белков, но они работают примерно так же, как и батарея. Однако вместо того, чтобы высвобождать энергию в виде света, энергия в основном улавливается образованием новых связей.Часть энергии выделяется в виде тепла, поэтому митохондрии значительно горячее, чем остальная часть клетки.
Викторина
Окислители, сильные | CAMEO Chemicals
Материалы этой группы технически не горят, но для протекания реакции горения необходим окислитель, а сильные окислители могут инициировать или ускорять горение других материалов. Это действие делает возгорание более опасным и может привести к взрывам.На самом деле члены этой группы часто входят во взрывоопасные смеси.
Сильные окислители часто активно реагируют с другими соединениями, выделяя тепло и, возможно, газообразные продукты, которые могут создавать давление в закрытом контейнере и которые могут участвовать в дальнейших реакциях. Примером широко известной окислительно-восстановительной (или окислительно-восстановительной) реакции является горение. Когда бензин сжигается в двигателе автомобиля, кислород воздуха действует как окислитель, а бензин действует как (очень слабый) восстановитель.Как только эта реакция инициируется искрой от воспламенения, она выделяет тепло, а также генерирует множество продуктов, включая горячие газы, вызывая повышение давления в камере внутреннего сгорания, которое толкает поршень. Органические соединения в целом обладают некоторой восстанавливающей способностью и в принципе могут реагировать с соединениями этого класса. Фактическая реакционная способность сильно зависит от типа органического соединения.
Реакции сильных окислителей с соединениями, известными как восстановители, часто взрывоопасны.Однако потенциально взрывоопасные смеси окислителей и восстановителей могут сохраняться без изменений в течение длительного времени, если не допустить нарушений (нагрев, искра, катализатор, механический удар). Порох — такая смесь. Другой, более опасный класс взрывчатых веществ — это взрывчатые вещества, в которых окислитель и восстановитель фактически являются разными частями одного и того же соединения. Эти соединения обычно намного более чувствительны, чем смеси отдельных окислителей и восстановителей, и могут использоваться в качестве детонаторов или первичных взрывчатых веществ.
Сильные окислители могут вступать в энергетическую реакцию с активными металлами, цианидами, сложными эфирами и тиоцианатами. Другие примеры включают смесь сахара (органического соединения) с хлоратом натрия или магния (неорганический восстановитель) с пероксидом бария.
Большинство из них токсичны при приеме внутрь; степень варьируется в широких пределах. Кроме того, газообразные или жидкие окислители могут вызвать химические ожоги при вдыхании или контакте с кожей.
Окислитель — это вещество, которое обычно реагирует, удаляя электроны из других веществ, этот процесс известен как окисление.Противоположный процесс (присоединение электронов к соединению) известен как восстановление и всегда происходит одновременно с окислением. Общая реакция называется окислительно-восстановительной или «окислительно-восстановительной» реакцией.
Существует широкий диапазон возможных значений силы окисления, и эта группа реакционной способности предназначена для охвата тех окислителей, которые в условиях окружающей среды являются такими же сильными или более сильными, чем кислород. Некоторые материалы становятся более сильными окислителями в присутствии кислоты и могут быть включены сюда, но окисляющие кислоты выделены в другую группу (кислоты, сильное окисление).Соединения, которые содержат как окисляющий компонент, так и восстанавливающий компонент (такие соединения часто являются взрывчатыми), классифицируются как по реакционной группе с окислителем, так и по реакционной группе с восстанавливающим агентом.
Дихромат аммония, перхлорат аммония, перманганат аммония, бромат бария, хлорат бария, пероксид бария, хлорат кальция, хромат кальция, перхлорат кальция, хлор, кислород, фтор.
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любыми
реактивных групп в базе данных.Прогнозируемые опасности и побочные газы для каждой пары реактивных групп будут
будет отображаться, а также документация и ссылки, которые использовались для
сделать прогнозы реактивности.Определение окислителя в химии.
Примеры окислителей в следующих разделах:
Марганец
- Наиболее распространенные степени окисления металлического марганца: +2, +3, +4, +6 и +7; степень окисления +2 является наиболее стабильной.
- Соединения марганца, в которых марганец находится в состоянии окисления степени 7+, являются мощными окислителями .
- Соединения с степенью окисления состояниями 5+ (синий) и 6+ (зеленый) являются сильными окислителями агентами .
- Степень окисления 3+ наблюдается в таких соединениях, как ацетат марганца (III); это очень мощные окислители реагенты .
- Предсказать окислительную или склонность к восстановлению марганца с учетом его формулы или степени окисления .
Окисление
- Атом углерода карбонильной группы имеет относительно высокую степень окисления .
- Полезные тесты на альдегиды, тест Толленса, тест Бенедикта и тест Фелинга используют преимущества этой легкости окисления за счет использования Ag (+) и Cu (2+) в качестве окислителей агентов ( окислителей ).
- В тестах Фелинга и Бенедикта в качестве окислителя используется катион меди. .
- Этот темно-синий реагент восстанавливается до оксида меди , который выпадает в осадок в виде твердого вещества от красного до желтого цвета.
- Все эти катионные окисления должны проводиться в щелочных условиях.
Свободная энергия и потенциал клеток
- Это связано с тем, насколько легко окисленные частицы отдают электроны и насколько сильно восстановленные частицы хотят их получить.
- Поскольку стандартные электродные потенциалы указаны в их способности снижаться, чем больше стандартные потенциалы восстановления, тем легче их снижать; другими словами, они просто лучше окислителей агентов .
- F2 легко восстанавливается и поэтому является хорошим окислителем .
- Напротив, Li (ли) скорее подвергнется окислению , поэтому он является хорошим восстановителем .
- В примере Zn2 +, стандартный потенциал восстановления которого составляет -0,76 В, он может быть окислен любым другим электродом, стандартный потенциал восстановления которого больше -0,76 В, и может быть уменьшен любым электродом со стандартным потенциалом восстановления меньше — 0.76 В.
Электроны и энергия
- Удаление электрона из молекулы с помощью процесса, называемого окислением , приводит к уменьшению потенциальной энергии, запасенной в окисленном соединении .
- RH (восстанавливающий агент ) + NAD + (окисляющий агент ) → NADH (восстановленный) + R (окисленный)
- Соединение, которое восстанавливает другой, называется восстанавливающим агентом .
- В приведенном выше уравнении RH представляет собой восстанавливающий агент , а NAD + восстанавливается до NADH.
- В приведенном выше уравнении НАД + представляет собой окислитель агент , а RH — , окисленный до R.
Соединения фосфора как восстановители
- Трехвалентный фосфор легко окисляется .
- Оксид трифенилфосфина , полученный в реакциях 1 и 3, является очень стабильным полярным соединением и в большинстве случаев легко удаляется из других продуктов.
- Трифенилфосфин также окисляется галогенами, и с бромом дает дибромтрифенилфосфоран, кристаллическое солеподобное соединение, используемое для превращения спиртов в алкилбромиды.
- Как и в ряде предыдущих примеров, образование трифенилфосфина оксида на необратимой стадии SN2 обеспечивает термодинамическую движущую силу для реакции.
Окисление фенолов
- Фенолы довольно легко окисляются , несмотря на отсутствие атома водорода на атоме углерода, несущем гидроксил.
- Окислительно-восстановительное равновесие между дигидроксибензолами гидрохиноном и катехолом и их состояниями окисления хинона настолько легкое, что обычно предпочтительны более мягкие окислители , чем хромат (реагент Джонса).
- Одним из таких окислителей является соль Фреми, показанная ниже.
- Восстановители Агенты , кроме хлорида олова (например,
- Растворителем для этих окислений обычно является метанол или диметилформамид (ДМФ).
Оксиды
- Металл оксиды обычно содержат анион кислорода в состоянии окисления -2.
- Большая часть земной коры состоит из твердых оксидов , в результате чего элементы окисляются кислородом воздуха или воды.
- Хотя большинство оксидов металлов являются полимерными, некоторые оксиды являются мономерными молекулами.
- Только кислотами подвержены основные оксиды ; атакованные только основаниями кислотные оксиды .
- Распространенным и дешевым восстановителем является углерод в виде кокса.
Степени окисления азота
- Сравнивая химию аминов со спиртами и простыми эфирами, мы обнаруживаем много классов родственных соединений, в которых азот принимает более высокие степени окисления , в отличие от ограниченных состояний окисления кислорода.
- Амин оксиды получают путем окисления 3º-аминов или пиридинов перекисью водорода или надкислотами (например,
- Если один из алкильных заместителей состоит из длинной цепи, такой как C12h35, образующийся оксид амина является амфотерным поверхностно-активным веществом и находит применение в шампунях и других мягких чистящих средствах .
- Коуп-элиминация диастереомерных аминов оксидов , таких как показанные в примерах № 2 и 3 выше, обеспечивает доказательство син-взаимосвязи бета-водородных и аминных оксидных групп .
- Нитроксиды — это , окисленные до нестабильных катионов оксаммония галогенами.
Окисление железа
- G. Metallireducens) может использовать токсичные углеводороды, такие как толуол, в качестве источника углерода, существует значительный интерес к использованию этих организмов в качестве средств биоремедиации агентов в богатых трехвалентным железом загрязненных водоносных горизонтах.
- Существует три различных типа двухвалентного железа — , окисляющие микробов.
- Второй тип микробов окисляет двухвалентное железо при нейтральном для окружности pH.
- Биохимически аэробное окисление железа — это очень слабый с энергетической точки зрения процесс, который, следовательно, требует, чтобы большое количество железа было окислено ферментом рустицианином, чтобы способствовать образованию протонной движущей силы.
- Обрисуйте цель окисления железа и трех типов двухвалентного железа- , окисляющих микробов (ацидофилов, микроаэрофилов и анаэробных фотосинтезирующих бактерий)
Железо, кобальт, медь, никель и цинк
- Медь окисляет — с некоторыми трудностями — до состояния +1 в галогенидах и оксида и до состояния +2 в солях, таких как сульфат меди CuSO4.
- Цинк и кадмий — мягкие металлы, которые легко окисляют до степени окисления +2 .
- При гальванике цинк покрывает железо путем окисления с образованием защитного слоя из оксида цинка (ZnO), который защищает железо от окисления .
- Оксид цинка намного безопаснее, чем оксид свинца , и его часто используют в белой краске.
- Железо, кобальт и никель являются довольно хорошими восстановителями , поэтому в природе они редко бывают несвязанными.
Окисляющие вещества
ABNO
Ацетон
Акрилонитрил
Аллилдиэтилфосфат
Аммоний-церия (IV) нитрат
Пероксидисульфат аммония
2-Азаадамантан N -оксил
9-Азабицикло [3.3.1] нонан N -оксил
АЗАДО
9-Азанорадамантан N -оксил
1,4-бензохинон
Бензальдегид
Бензофенон
Пероксид бензоила
Бис (метансульфонил) пероксид
Блич
N -Бромосахарин
N -бромсукцинимид
Реагент Берджесса
( E ) -Бут-2-еннитрил
N -Фтор-2,4,6-триметилпиридиний
трифлатN-трет -Бутилбензолсульфинимидоил
хлоридтрет -Бутилгидропероксид
трет -Бутилгипохлорит
трет -бутилнитрит
трет -бутил
пероксибензоатCAN
Тетрабромид углерода
Церий аммиачная селитра
Пероксидисульфат холина
Хлорамин-В
Хлорамин-Т
Хлоранил
Хлорметил-4-фтор-1,4-диазониабицикло [2.2.2] октан-бис (тетрафторборат)
3-хлорпероксибензойная кислота
ЧПС
Соединения хрома
Триоксид хрома
Реагент Коллинза
Реагент Кори-Саггса
CMHP
Соединения меди
Кротононитрил
Гидропероксид кумола
Дэвис
РеагентDBDMH
DCP
DDQ
МЕРТВОЙ
DEAP
Периодинан Десса-Мартина
ДИАДА
1,3-дибром-5,5-диметилгидантоин
2,3-дихлор-5,6-дицианобензохинон
Дикумила пероксид
Диэтилазодикарбоксилат
Диэтилаллилфосфат
DIH
1,3-дийод-5,5-диметилгидантоин
Диизопропилазодикарбоксилат
Диметилсульфоксид
Di- трет -бутилпероксид
ДМП
ДМСО
DPQ
DTBP
( E ) -Бут-2-еннитрил
Хлорид железа
Нитрат железа
N -фторбензолсульфонимид
N -Трифлат фторпиридиния
N -Фтор-2,4,6-триметилпиридиний
трифлатМуравьиная кислота
Пероксид водорода
Аддукт пероксида водорода и мочевины
2-гидроперокси-4,6-дифенил-1,3,5-триазин
Гидрокси (тозилокси) иодбензол
Соединения гипервалентного брома
Соединения гипервалентного йода
HTIB
IBX
Йод
Пятиокись йода
Дихлорид йодобензола
Йодособензол
бис (трифторацетат)Диацетат йодозобензола
N -Йодосукцинимид
Йодозилбензол
2-йодоксибензойная кислота
Железо (III), (V) и (IV)
Реагент Джонса
Реагент Козера
Магний
гексагидрат монопероксифталатаСоединения марганца
Оксид марганца (IV)
MCPBA
мета -Хлорпербензойная кислота
(метоксикарбонилсульфамоил) триэтиламмоний
гидроксидN -метилморфолин- N -оксид
Метилтриоксорений
MMPP • 6 H 2 O
Соединения молибдена
МТО
N -Бромосахарин
N -бромсукцинимид
N Натриевая соль хлорбензолсульфонамида
N Натриевая соль хлортозиламида
N -Хлорсукцинимид
N -фторбензолсульфонимид
N -Трифлат фторпиридиния
N -Фтор-2,4,6-триметилпиридиний
трифлатN -Йодосукцинимид
N, N, N ‘, N’ -Тетрахлорбензол-1,3-дисульфонамидАзотная кислота
Нитрозобензол
N -метилморфолин- N -оксид
НМО
Нор-АЗАДО
N-трет -Бутилбензолсульфинимидоил
хлоридЧетырехокись осмия
Оксалилхлорид
Оксон
Кислород
Озон
PCC
PDC
Перуксусная кислота
Периодическая кислота
Пероксиды
Пероксикислоты
Диацетат фенилиодония
2- (Фенилсульфонил) -3-фенилоксазиридин
Пероксид фталоила
PIFA
Пивалдегид
Феррицианид калия
Периодат калия
Перманганат калия
Пероксидисульфат калия
Пероксомоносульфат калия
PPO
2-пропанон
Пиридин N -оксид
Гидробромид пиридиния
пербромидПиридиний хлорхромат
Дихромат пиридиния
Пиридиний трибромид
Соединения рутения (III — VII)
Реагент Саретта
Селектфлуор
Диоксид селена
Натрия бромат
Натрия хлорат
Натрия хлорит
Натрия дихлоройодат
Гипохлорит натрия
Нитрит натрия
Перборат натрия
Перкарбонат натрия
Периодат натрия
Натрия пероксидисульфат
Сера
Стирол
TBCA
TBHP
TBN
ТБПБ
TCBDA
TCCA
ТЕМПО
Тетрабромметан
Тетрахлор-1,4-бензохинон
N-трет -Бутилбензолсульфинимидоил
хлоридтрет -бутилгидропероксид
трет -Бутилгипохлорит
трет -бутилнитрит
трет -бутил
пероксибензоаттетрабутиламмоний
пероксидисульфат
N, N, N ‘, N’ -Тетрахлорбензол-1,3-дисульфонамид2,2,6,6-тетраметилпиперидинилокси
перрутенат тетрапропиламмония
3,3 ‘, 5,5’-Tetra -tert -бутилдифенохинон
TPAP
Триацетоксипериодинан
Triazox
Трибромизоциануровая кислота
трихлоризоциануровой кислоты
кислота1,1,1-трифторацетон
Надкислота трифторуксусная
Триметилацетальдегид
UHP
Аддукт перекиси водорода мочевины
Соединения ванадия
Цианид винила
Вода
.
