Содержание
Оксид калия | справочник Пестициды.ru
Информация
Традиционно содержание Калия в удобрениях выражают содержанием Оксида калия. Все свойства Калия, как питательного элемента описаны в статье Калий.
Подробнее »
Химические и физические свойства
Оксид калия – твердое кристаллическое вещество, образующее бесцветные кристаллы. Имеет две устойчивые кристаллические модификации: кубическую (до 372°С) и гексагональную (выше 372°С).
- Температура плавления – 740°С.
- Плотность – 2,32 г/см3.
Оксид калия на воздухе расплавляется и, поглощая CO2, дает K2CO3. Бурно взаимодействует с водой с образованием КОН. Реагирует с эфиром и спиртом.
При температуре 250°С вступает в реакцию с H2. При этом образуются КОН. При этой же температуре взаимодействует с NH3, образуя КОН и KNH2.
Трехмерная модель молекулы
Трехмерная модель молекулы
Энергично вступает в реакции взаимодействия с галогенами, расплавленной серой, различными кислотами. При нагревании с оксидами бора, алюминия, кремния образует соответственно бораты, алюминаты и полисиликаты.
При нагревании с NO2 образуется смесь KNO3 и KNO2.
Оксид калия получают:
- Нагреванием К с твердыми КОН, K2O2, KNO2. Например, 2KNO2+ 6К → 4К2O+ N2.
- При нагревании смеси KN3 и KNO2. 3KN3 + KNO2 → 2K2O + 5N2
- Окислением K, растворенного в жидком аммиаке, кислородом. 2K + O2 → 2K2O[3]
Содержание оксида калия в почве и удобрениях
Доступность калия для растений зависит от формы доступности калия в почве.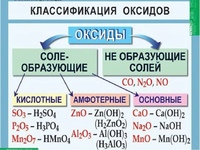 Катионы ППК и водорастворимые соединения калия являются основными источниками калийного питания растений. В этой связи степень обеспеченности почвы калием для нужд питания растений выражают содержанием в подвижной форме и через оксид калия K2O. Эта величина обозначает суммарное количество обменного и водорастворимого кальция в мг/кг почвы.[1]
Катионы ППК и водорастворимые соединения калия являются основными источниками калийного питания растений. В этой связи степень обеспеченности почвы калием для нужд питания растений выражают содержанием в подвижной форме и через оксид калия K2O. Эта величина обозначает суммарное количество обменного и водорастворимого кальция в мг/кг почвы.[1]
Удобрения содержат различное количество оксида калия. Например, хлористый калий включает в себя 57–60 % калия в пересчете на K2O. Фиксированный почвой калий из удобрений доступен для растений. При этом степень его доступности тем выше, чем больше его фиксировано почвой.[2]
Калийные удобрения отличаются высокой растворимостью в воде. При внесении в почву они быстро растворяются и на основании обменных реакций вступают во взаимодействие с ППК. Часть калия удобрений переходит в необменные фиксированные почвенные соединения.[2]
Оксид калия, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ICSC 0769 — ОКСИД КАЛИЯ
ICSC 0769 — ОКСИД КАЛИЯ
| ОКСИД КАЛИЯ | ICSC: 0769 |
| Октябрь 2006 |
| CAS #: 12136-45-7 | |
| UN #: 2033 | |
| EINECS #: 235-227-6 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. | Использовать порошок, двуокись углерода. НЕ использовать водные агенты. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боли в горле. Кашель. Ощущения жжения. Затрудненное дыхание. Сбивчивое дыхание. | Применять местную вытяжку. Применять средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Может потребоваться искусственное дыхание. Немедленно обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. Серьезные ожоги кожи. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. Обратиться за медицинской помощью. Промыть кожу большим количеством воды или принять душ. Обратиться за медицинской помощью. |
| Глаза | Покраснение. Боль. Ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). Немедленно обратиться за медицинской помощью. |
| Проглатывание | Боль в горле. Ощущение жжения в горле и груди. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: костюм химической защиты, включая автономный дыхательный аппарат. Сухие пластиковыеСмести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. Сухие пластиковыеСмести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН
ОПАСНО
Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных кислот и пищевых продуктов и кормов. Хранить сухим. | |
| УПАКОВКА | |
| Герметичная. Не перевозить с продуктами питания и кормами для животных. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ОКСИД КАЛИЯ | ICSC: 0769 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: K2O |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Бурно реагирует с такими средствами пожаротушения, как вода. Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. См. карту ICSC 0357. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Оксид калия, характеристика, свойства и получение, химические реакции
Оксид калия, характеристика, свойства и получение, химические реакции.

Оксид калия – неорганическое вещество, имеет химическую формулу K2O.
Краткая характеристика оксида калия
Физические свойства оксида калия
Получение оксида калия
Химические свойства оксида калия
Химические реакции оксида калия
Применение и использование оксида калия
Краткая характеристика оксида калия:
Оксид калия – неорганическое вещество бесцветного либо бледно-желтого цвета.
Так как валентность калия равна одному, то оксид калия содержит один атом кислорода и два атома калия.
Химическая формула оксида калия K2O.
В воде не растворяется, а вступает в реакцию с ней.
Растворим в органических растворителях.
Обладает высокой гигроскопичностью.
Физические свойства оксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | K2O |
| Синонимы и названия иностранном языке | potassium oxide (англ.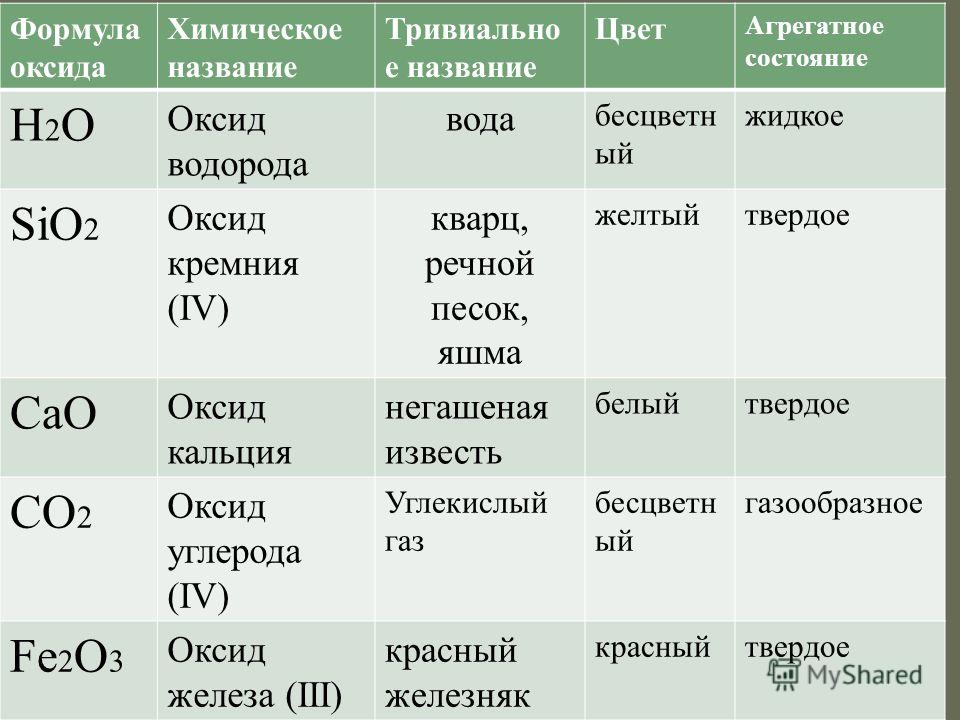 ) )калия окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные (иногда бледно-желтый) кубические кристаллы |
| Цвет | бесцветный, иногда – бледно-желтый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2320 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,32 |
| Температура кипения, °C | — |
| Температура плавления, °C | 740 |
| Температура разложения, °C | 300 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 94,196 |
* Примечание:
— нет данных.
Получение оксида калия:
Оксид калия получается в результате следующих химических реакций:
- 1.
 из пероксида калия:
из пероксида калия:
Вначале получают пероксид калия.
2К + О2 → К2О2.
Затем пероксид калия обогащают калием.
К2О2 + 2К → 2К2О.
Напрямую оксид калия путем окисления самого калия не получается.
Химические свойства оксида калия. Химические реакции оксида калия:
Химически активное вещество.
Химические свойства оксида калия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида калия с галогенами:
К2О + СІ2 → КСІ + КСІО;
К2О + Br2 → КBr + КBrО;
К2О + I2 → КI + КIО.
Оксид калия бурно реагирует с галогенами, образуя соответственно две соли:
– хлорид калия и гипохлорит калия,
– бромид калия и гипобромит калия,
– йодид калия и гипойодит калия.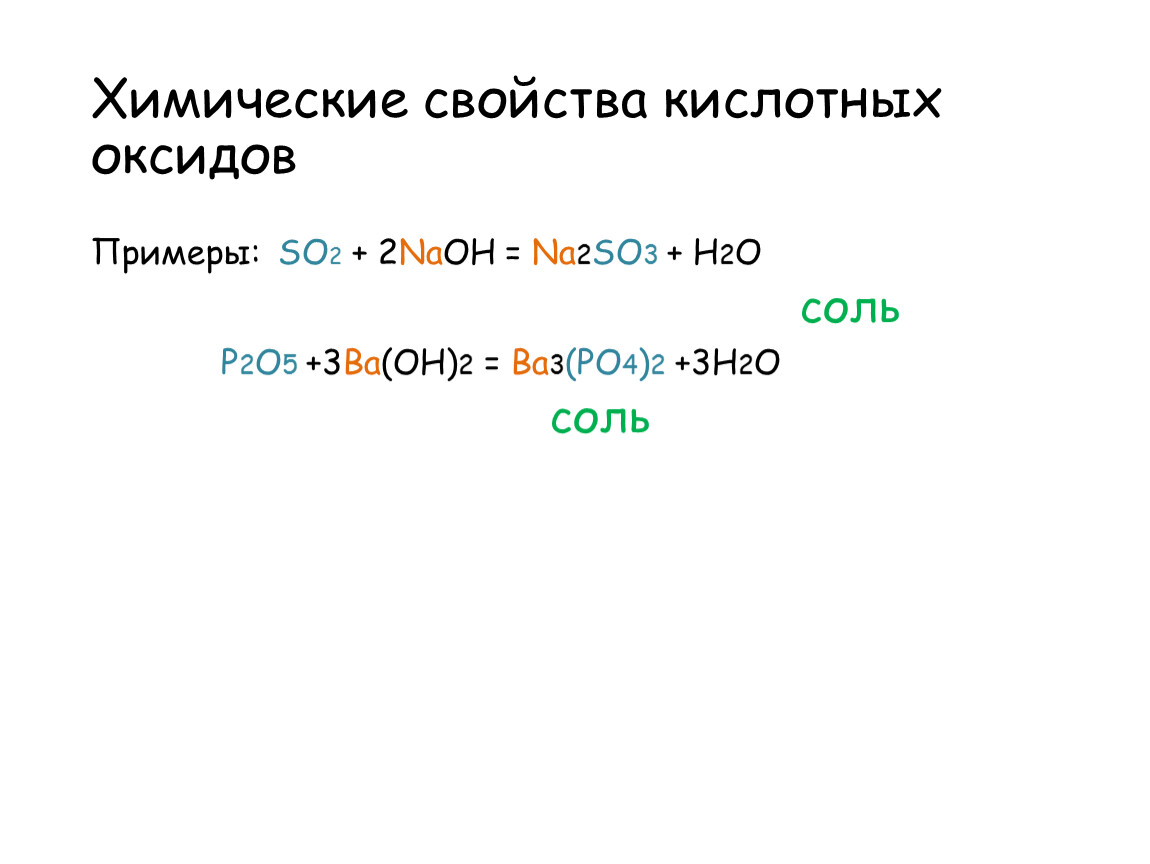
2. реакция оксида калия с водой:
К2О + Н2О → 2КОН.
Оксид калия бурно реагирует с водой, образуя гидроксид калия.
3. реакция оксида калия с оксидом углерода (углекислым газом):
К2О + СО2 → К2СО3.
Оксид калия на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат калия.
4. реакция оксида калия с оксидом серы:
К2О + SО2 → К2SО3;
К2О + SО3 → К2SО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит калия, во втором случае – сульфат калия.
5. реакция оксида калия с оксидом кремния:
К2О + SiО2 → К2SiО3.
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат калия.
В результате реакции образуется соль – силикат калия.
Аналогично проходят реакции оксида калия и с другими кислотными оксидами.
6. реакция оксида калия с оксидом цинка:
К2О + ZnО → К2ZnО2.
Оксид цинка является амфотерным оксидом. Это значит, что как амфотерный оксид оксид цинка проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – цинкат калия.
Аналогично проходят реакции оксида калия и с другими амфотерными оксидами.
7. реакция оксида калия с плавиковой кислотой:
K2O + 2HF → 2KF + H2O.
В результате химической реакции получается соль – фторид калия и вода.
Аналогично проходят реакции оксида калия и с другими кислотами.
8. реакция оксида калия с бромистым водородом (бромоводородом):
K2O + 2HBr → 2KBr + H2O.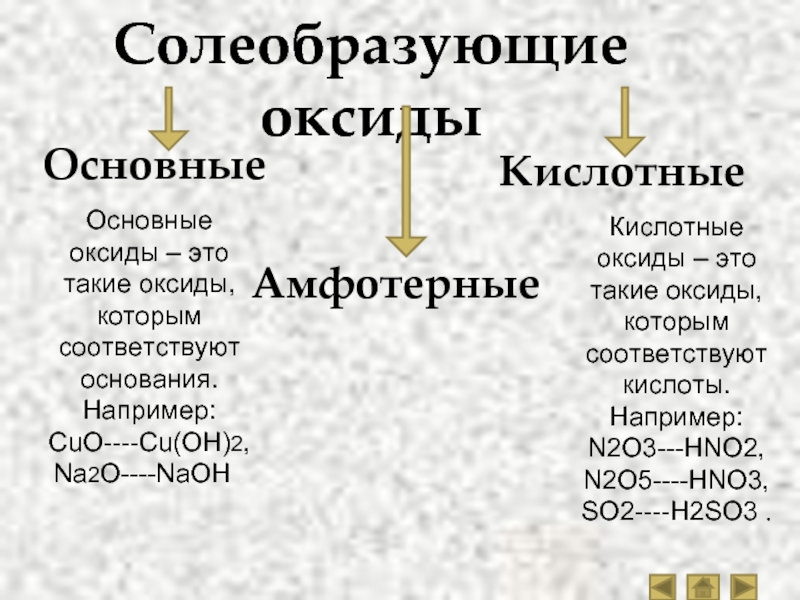
В результате химической реакции получается соль – бромид калия и вода.
9. реакция оксида калия с йодоводородом:
K2O + 2HI → 2KI + H2O.
В результате химической реакции получается соль – йодид калия и вода.
10. реакция оксида калия с жидким аммиаком:
K2O + NH3 → КОН + KNH2 (t = -50 oC).
В результате химической реакции получается гидроксид калия и амид калия.
Применение и использование оксида калия:
Оксид калия используется в сельском хозяйстве в качестве компонента минеральных удобрений, в строительстве в составе цемента, а также в химической промышленности для получения других соединений калия.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида калия
реакции с оксидом калия
Коэффициент востребованности
6 824
Калий
|
| |
|---|---|
|
Атомный номер |
|
|
Внешний вид простого вещества |
|
|
Свойства атома | |
|
Атомная масса (молярная масса) |
|
|
Радиус атома |
|
|
Энергия ионизации (первый электрон) |
|
|
Электронная конфигурация |
|
|
Химические свойства | |
|
Ковалентный радиус |
|
|
Радиус иона |
|
|
Электроотрицательность (по Полингу) |
|
|
Электродный потенциал |
|
|
Степени окисления |
|
|
Термодинамические свойства простого вещества | |
|
Плотность |
|
|
Молярная теплоёмкость |
|
|
Теплопроводность |
|
|
Температура плавления |
|
|
Теплота плавления |
|
|
Температура кипения |
|
|
Теплота испарения |
|
|
Молярный объём |
|
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
|
|
Параметры решётки |
|
|
Отношение c/a |
— |
|
Температура Дебая |
|
|
K |
19 |
|
39,0983 | |
|
4s1 | |
|
Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.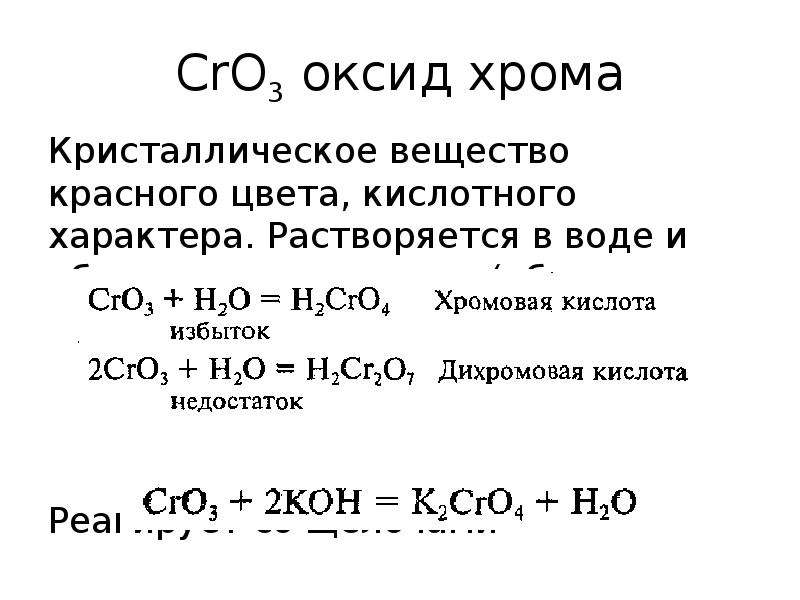
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K+ + e− → K
2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
-
Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
-
Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений. -
Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
-
Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы. -
Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов. -
Карбонат калия (поташ) — используется как удобрение, при варке стекла. -
Хлорид калия (сильвин, «калийная соль») — используется как удобрение. -
Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
-
Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике. -
Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина. -
Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода. -
Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика. -
Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике. -
Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
-
Фтороборат калия — важный флюс для пайки сталей и цветных металлов. -
Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали. -
Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
-
Создание условий для возникновения мембранного потенциала и мышечных сокращений. -
Поддержание осмотической концентрации крови. -
Поддержание кислотно-щелочного баланса. -
Нормализация водного баланса. -
Обеспечение мембранного транспорта. -
Активация различных ферментов. -
Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Дополнительная информация
Соединения калия
Щелочные металлы
Натрий, по химическим свойствам очень схожий с калием
Оксиды
По агрегатному состоянию
оксиды делятся на твёрдые, как оксид калия, оксид алюминия, оксид
фосфора пять и другие; на жидкие, как оксид серы шесть, оксид
марганца семь и газообразные, как оксид углерода четыре, оксид
азота четыре, оксид серы четыре и другие.
По растворимости в воде
оксиды делятся на растворимые, как оксид серы четыре, оксид
углерода четыре, оксид калия и другие; и нерастворимые, как оксид
меди два, оксид железа два, оксид кремния четыре, оксид алюминия и другие.
Все кислотные оксиды,
кроме оксида кремния четыре, растворимы в воде. Среди основных оксидов
растворимыми являются только оксиды щелочных металлов (оксид лития, оксид
натрия, оксид калия и так далее) и щелочноземельных металлов (оксид кальция,
оксид стронция, оксид бария). Амфотэрные оксиды не растворяются в воде.
Оксиды имеют различный
цвет: так, оксид меди два – чёрный, оксид никеля два – зелёный, оксид кальция –
белый.
Рассмотрим химические
свойства основных оксидов.
Основные оксиды реагируют
с кислотами с образованием соли и воды.
Так, в реакции оксида
магния с соляной кислотой образуется соль – хлорид магния и вода.
В реакции оксида железа
три с серной кислотой образуется соль – сульфат железа три и вода.
В реакции оксида кальция
с серной кислотой образуется соль – сульфат кальция и вода.
Кристаллы этой соль
известны под названием «гипс».
Основные оксиды
взаимодействуют с кислотными оксидами с образованием солей.
Так, в реакции оксида
кальция с оксидом углерода четыре образуется соль – карбонат кальция. Эту соль
известная под названием «мел».
В реакции оксида натрия с
оксидом фосфора пять образуется соль – фосфат натрия.
Оксиды щелочных и
щелочноземельных металлов взаимодействуют с водой с образованием растворимых
оснований – щелочей.
Так, в реакции оксида
калия с водой образуется щёлочь – гидроксид калия; в реакции оксида кальция с
водой образуется гидроксид кальция.
Эта реакция – гашение
извести, которая сопровождается выделением большого количества тепла.
Оксиды других металлов в
воде не растворяются и с ней не взаимодействуют. Как например, оксид меди два,
или оксид железа три и другие.
Общим свойством всех
кислотных оксидов является их способность взаимодействовать с основаниями с
образованием соли и воды.
Так, в реакции оксида
углерода четыре с гидроксидом натрия образуется соль – карбонат натрия и вода.
В реакции оксида фосфора
пять с гидроксидом бария образуется соль – фосфат бария и вода.
Кислотные оксиды
взаимодействуют с основными оксидами с образованием солей. Так, в реакции
оксида серы шесть с оксидом калия образуется соль – сульфат калия.
Большинство кислотных
оксидов взаимодействуют с водой с образованием кислот.
Например, в реакции
оксида серы шесть с водой образуется серная кислота.
Амфотэрные оксиды
взаимодействуют с кислотами с образованием соли и воды.
Так, в реакции оксида
цинка с азотной кислотой образуется соль – нитрат цинка и вода.
В этих реакциях амфотэрные
оксиды играют роль основных оксидов.
Амфотэрные оксиды
взаимодействуют со щелочами с образованием солей и воды.
Так, в реакции оксида
цинка с гидроксидом калия образуется соль – цинкат калия и вода.
В этих реакциях амфотэрные
оксиды играют роль кислотных оксидов.
Амфотэрные оксиды при
нагревании взаимодействуют с кислотными оксидами с образованием солей.
Так, в реакции оксида
цинка с оксидом углерода четыре образуется соль – карбонат цинка.
Амфотэрные оксиды при
нагревании взаимодействуют с основными оксидами с образованием солей.
Например, в реакции
оксида цинка с оксидом натрия образуется соль – цинкат натрия.
Некоторые оксиды имеют
специфические свойства. У хлора известны такие
оксиды, как оксид хлора один, оксид хлора четыре, оксид хора семь и другие.
В реакции с водой оксид
хлора один, образует хлорноватистую кислоту, оксид хлора четыре в реакции с
водой образует хлорноватистую и хлорноватую кислоты; оксид хлора семь в реакции
с водой образует хлорную кислоту.
Оксиды могут быть
получены различными способами.
Это взаимодействие
простых веществ с кислородом.
Например, в реакции
магния с кислородом образуется оксид магния; в реакции углерода с кислородом
образуется оксид углерода четыре, в реакции цинка с кислородом образуется оксид
цинка.
Оксиды можно получить и
при горении сложных веществ. Так, в реакции горения сероводорода
образуется оксид серы четыре и вода; в реакции горения метана образуется оксид
углерода четыре и вода.
При разложение некоторых
оксокислот также образуются оксиды.
Так, в реакции разложения
сернистой кислоты образуется оксид серы четыре и вода. В реакции разложения
угольной кислоты образуется оксид углерода четыре и вода.
Оксиды можно получить и
при разложении нерастворимых оснований.
Например, при разложении
гидроксида меди два образуется оксид меди два и вода. При разложении гидроксида
железа два образуется оксид железа два и вода. При разложении гидроксида
алюминия образуется оксид алюминия и вода.
При разложении некоторых
солей также образуются оксиды.
Так, при разложении
карбоната кальция образуется оксид кальция и оксид углерода четыре.
При разложении нитрата меди
два образуется оксид меди два (чёрного цвета), оксид азота четыре (бурого
цвета) и кислород.
Ещё одним
способом, которым можно осуществить получение оксидов – это окислительно-восстановительные реакции.
Например, в реакции меди
с концентрированной азотной кислотой образуется нитрат меди два, оксид азота
четыре и вода; в реакции серы с концентрированной азотной кислотой образуется
оксид серы четыре и вода.
Таким образом, некоторые
основные оксиды реагируют с водой, с образованием щелочей, основные оксиды
реагируют с кислотными и амфотэрными оксидами, реагируют с кислотами;
большинство кислотных оксидов реагируют с водой, кислотные оксиды реагируют с
основными и амфотэрными оксидами, с основаниям; амфотэрные оксиды реагируют с
основными и кислотными оксидами, реагируют с основаниями и кислотами.
Оксиды можно получить в
реакции простых веществ с кислородом, горением сложных веществ, разложением
солей, нерастворимых оснований, а также разложением некоторых кислот и в
окислительно-восстановительных реакциях.
Химические свойства оксидов
Оксиды бывают:
- солеобразующие
- основные (Na2O, MgO),
- кислотные (SO3, CO2, Mn2O7),
- амфотерные (Al2O3, ZnO)
- несолеобразующие (NO, N2O, CO)
1. Основные оксиды реагируют с кислотами, кислотными оксидами, водой (только оксиды активных металлов)
2. Кислотные оксиды реагируют с водой (кроме SiO2), щелочами, основными оксидами.
3. Амфотерные оксиды реагируют с кислотами, щелочами, кислоными оксидами, основными оксидами (при сплавлении)
4. Несолеобразующие оксиды — не реагируют ни с водой, ни с кислотами, ни со щелочами.
Давайте порассуждаем вместе
1. Какое из веществ взаимодействует с водой при комнатной температуре?
1) оксид кремния (IV)
2) оксид меди (II)
3) оксид серы (VI)
4) сера
Ответ: №3, т.к. SO3 + H2O = H2SO4 , кислотные оксиды реагируют с водой с образованием кислот, исключение SiO2.
2. Какое из веществ не взаимодействует с соляной кислотой
1) оксид углерода (IV)
2) оксид кальция
3) нитрат серебра
4) кальций
Ответ: №1, т.к. с кислотами не взаимодействует кислотный оксид CO2
3. Оксид кальция не взаимодействует с
1) оксидом углерода (IV)
2) гидроксидом натрия
3) водой
4) хлороводородом
Ответ: №2, т.к. основные оксиды не реагируют со щелочами.
4. Соляная кислота реагирует с каждым из оксидов
1) CaO и CO2
2) SO3 и SiO2
3) CO и NO
4) MgO и ZnO
Ответ: №4 с кислотами реагируют основные (MgO) и амфотерные оксиды (ZnO)
MgO + 2HCl = MgCl2 + H2O
ZnO + 2HCl = ZnCl2 + H2O
5. Оксид магния реагирует с каждым из веществ
1) HCl и SO3
2) SO3 и NaOH
3) NaOH и H2О
4) H2SO4 и KCl
Ответ: №1, т.к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3)
MgO + 2HCl = MgCl2 + H2O
MgO + SO3 = MgSO4
6. Оксид серы (IV) реагирует с
1) NaOH
2) NaCl
3) H2SO4
4) P2O5
Ответ: №1, т.к. оксид серы (IV) является кислотным оксидом и может реагировать со щелочью
NaOH + SO2 = Na2SO3 + H2O
7. С водным раствором гидроксида калия реагируют
1) алюминий
2) медь
3) натрий
4) сульфат меди (II)
5) сульфат натрия
Ответ: 1, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
CuSO4 — растворимая соль, со щелочью дает осадок Cu(OH)2 синего цвета CuSO4 + 2KOH = Cu(OH)2 + K2SO4
8. С разбавленным водным раствором серной кислоты реагируют
1) алюминий
2) медь
3) оксид меди (II)
4) хлорид калия
5) хлорид бария
Ответ: 1, 3, 5, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
CuO — основный оксид, реагирует с кислотами CuO + H2SO4 = CuSO4 + H2O
BaCl2 — растворимая соль, дает с серной кислотой белый осадок сульфата бария BaCl2 + H2SO4 = 2HCl + BaSO4
9. С водными растворами каких веществ реагирует углекислый газ
1) хлорид натрия
2) карбонат натрия
3) гидроксид кальция
4) соляная кислота
5) гидроксид натрия
Ответ: 2, 3, 5, т.к. CO2 — кислотный оксид, он реагирует с растворами карбонатов с образованием кислых солей Na2CO3 + CO2 + H2O = 2NaHCO3
Ca(OH)2 и NaOH — щелочи реагируют с кислотными оксидами Ca(OH)2 + CO2 = CaCO3 + H2O ; 2NaOH + CO2 = Na2CO3 + H2O
10. С водным раствором гидроксида натрия реагируют
1) алюминий
2) хлор
3) оксид железа (II)
4) оксид серы (IV)
5) серебро
Ответ: 1, 2, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Cl2 — активный неметалл — галоген реагирует со щелочью и на холоду и при нагревании
Cl2 + 2NaOH = NaCl + NaClO + h3O (холод)
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O (нагрев)
SO2 — кислотный оксид реагирует со щелочью SO2 + 2NaOH = Na2SO3 + H2O
11. С водным раствором азотной кислоты реагируют
1) медь
2) углекислый газ
3) оксид магния
4) серная кислота
5) оксид алюминия
Ответ: 1,3, 5, т.к. азотная кислота сильный окислитель, она реагирует даже с металлами, стоящими после водорода, выделяя оксиды азота
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
MgO и Al2O3 — основный и амфотерный оксиды соответственно, они реагируют с кислотами с образованием соли и воды
MgO + 2HNO3 = Mg(NO3)2 + H2O
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
12. Оксид железа (II) взаимодействует с раствором
1) аммиака
2) бромоводорода
3) карбоната калия
4) хлорида натрия
Ответ: №2, т.к. основные оксиды реагируют с кислотами
FeO + 2HBr = FeBr2 = H2O
Оксид калия — обзор
Биостекла
Биоактивные стекла или биостекла — это группа синтетической керамики на силикатной основе. На момент открытия в 1970-х годах состав Bioglass® состоял из 45 мас.% Диоксида кремния (SiO 2 ), 24,5 мас.% Оксида натрия (Na 2 O), 24,5 мас.% Оксида кальция (CaO) и 6 мас. % пятиокиси фосфора (P 2 O 5 ). Впоследствии были добавлены некоторые добавки, такие как оксид калия (K 2 O), оксид магния (MgO) и оксид бора (B 2 O), чтобы получить более стабильную композицию (de Grado et al ., 2018; Ван и Юнг, 2017а).
Подобно керамике из СаР и сульфата кальция, биостекла биосовместимы, остеокондуктивны, не вызывают воспалительной реакции и часто имеют пористую структуру, способствующую резорбции и прорастанию костной ткани. Действительно, после имплантации между биостеклами и костями хозяина возникает прочная физическая связь, вероятно, вызванная выщелачиванием и накоплением кремния и образованием слоя гидроксикарбоната-апатита (ГКА) на поверхности стекла.Фактически, поверхность биостеклов, подвергнутая воздействию водного раствора или жидкостей организма, начинает растворяться и превращаться в слой геля, богатого кремнеземом-CaO / P 2 O 5 , который затем минерализуется в гидроксикарбонат апатит в несколько часов. Гидроксикарбонат-апатит похож на костный минерал и взаимодействует с фибриллами коллагена, создавая связь с костью хозяина. Эта тонкая пленка HCA поглощает белки, привлекает клетки-предшественники остеоартрита и частично замещается костью в процессе замещения.Биостекла относительно быстро всасываются in vivo и полностью рассасываются за шесть месяцев. Чем больше пористость, тем быстрее резорбция после отложения новой кости (Jones, 2013; de Grado et al ., 2018; Wang and Yeung, 2017a; Rahamana et al ., 2011).
Продукты растворения стекла, растворимые ионы кремния и кальция стимулируют остеогенные клетки к образованию костного матрикса и придают биостеклам остеоиндуктивные свойства. В отличие от керамики CaP, которая является только остеокондуктивной, потому что она поддерживает рост новой кости, биостекла являются остеокондуктивными, а также остеоиндуктивными.Действительно, они поддерживают рост новой кости вдоль границы раздела кость-имплантат, а также внутри имплантата вдали от границы раздела кость-имплант (Jones, 2013; Rahamana et al ., 2011).
В настоящее время существует несколько типов биоактивного стекла: обычные силикаты, такие как Bioglass® 45S5, стекла на фосфатной основе и стекла на боратной основе. Фосфатные стекла обладают очень высокой растворимостью, и эту растворимость можно контролировать, изменяя их состав. Боратные очки имеют действительно обнадеживающие клинические результаты заживления хронических ран, их легко обрабатывать, и они демонстрируют более быстрое разложение, чем биостекла на основе диоксида кремния (Jones, 2013; de Grado et al ., 2018).
Существуют различные методы изготовления матриц из пористого биоактивного стекла. Обычный способ закалки в расплаве состоит в формировании стеклянных частиц из стекла, полученного из расплава, в конструкцию с желаемой архитектурой и геометрией. После этого этапа формования механически надежная трехмерная сеть с взаимосвязанной пористостью формируется путем спекания структуры, в которой частицы связаны друг с другом. Другие методы, такие как золь-гель обработка, электроспиннинг или обработка вязкого расплава, также использовались для изготовления складных каркасов из биоактивного стекла (Jones, 2013; Rahamana et al ., 2011).
Что касается биомедицинских применений биостеклов, оригинальное стекло Bioglass 45S5 широко используется для восстановления костных дефектов челюсти и в ортопедии. Однако биостекла довольно хрупкие, обладают низкой механической прочностью и пониженным сопротивлением разрушению. По этим причинам пористые каркасы из биоактивного стекла могут использоваться только на участках, где есть небольшая нагрузка или только сжимающая нагрузка, например, при реконструкции лицевых дефектов (de Grado et al ., 2018; Jones, 2013; Wang and Yeung , 2017a; Рахамана и др. ., 2011).
02.0 Кислотно-щелочная нейтрализация
2.1 Кислоты
Если вы хотите разбавить кислоту водой перед нейтрализацией ее основанием (например, гидроксидом натрия, гидроксидом калия или бикарбонатом натрия), всегда добавляйте кислоту в воду; никогда не добавляйте воду к кислоте .
Выполняйте все нейтрализации в вытяжном шкафу, надев перчатки из нитриловой резины, лабораторный халат и защитные очки.
2.1.1 Соляная кислота
- Медленно добавьте соляную кислоту в емкость с холодной водой, чтобы получить раствор кислоты в воде 1:10.
- Медленно добавляйте 1M раствор гидроксида калия, гидроксида натрия или карбоната натрия, пока pH не станет в диапазоне от 6,0 до 8,0.
- Смойте в канализацию избытком холодной воды.
2.1.2 Серная кислота
- Медленно добавьте серную кислоту в емкость с ледяной водой, чтобы получить раствор кислоты в воде 1:10.
- Медленно добавляйте карбонат натрия, пока pH не станет в диапазоне от 6,0 до 8,0.
- Смойте в канализацию избытком холодной воды.
2.1.3 Уксусная кислота
- Медленно добавьте уксусную кислоту в емкость с холодной водой, чтобы получить раствор кислоты в воде 1:10.
- Медленно добавляйте 1M раствор гидроксида натрия или карбоната натрия, пока pH не станет в диапазоне от 6,0 до 8,0.
- Смойте в канализацию избытком холодной воды.
2.1.4 Фосфорная кислота
- Медленно добавьте фосфорную кислоту в емкость с холодной водой, чтобы получить раствор кислоты в воде 1:10.
- При перемешивании медленно добавляйте карбонат натрия, пока pH не станет в диапазоне от 6,0 до 8,0.
- Смойте в канализацию избытком холодной воды.
2.2 Основания
2.2.1 Гидроксид калия
- При перемешивании медленно добавьте гидроксид калия в емкость с ледяной водой, чтобы получить раствор основания к воде 1:10.
- Медленно добавляйте 1M соляную кислоту примерно по 1 мл за раз, пока pH не станет между 6,0 и 8,0.
- Смойте в канализацию избытком холодной воды.
2.2.2 Гидроксид натрия
- При перемешивании медленно добавьте гидроксид натрия в емкость с ледяной водой, чтобы получить раствор основания к воде 1:10.
- Медленно добавляйте 1M соляную кислоту примерно по 1 мл за раз, пока pH не станет между 6,0 и 8,0.
- Смойте в канализацию избытком холодной воды.
2.2.3 Гидроксид кальция
- При перемешивании медленно добавьте гидроксид кальция в емкость с ледяной водой, чтобы получить раствор основания к воде 1:10.
- Медленно добавляйте 1M соляную кислоту примерно по 1 мл за раз, пока pH не станет между 6,0 и 8,0.
- Смойте в канализацию избытком холодной воды.
Соли сильных кислот и сильных основанийПри сочетании азотной кислоты с гидроксидом калия образуется нитрат калия: HNO 3 + КОН Завершено
К + НЕТ 3 — А Если Хорошо! Соли сильных оснований и слабых кислотПри реакции муравьиной кислоты с гидроксидом калия образуется формиат натрия: HCO 2 H + КОН Вы уже определили, что K + является очень слабой сопряженной кислотой КОН и не влияет на pH раствора. А как насчет HCO 2 — ? Завершено HCO 2 — Как Если Хорошо! Соли сильных кислот и слабых основанийПри реакции азотной кислоты с аммиаком образуется нитрат аммония: HNO 3 + NH 3 Вы уже определили, что NO 3 — является очень слабым конъюгированным основанием HNO 3 и не влияет на pH раствора.А как насчет NH 4 + ? Завершено NH 4 + Как Если Хорошо! |
Реакции нейтрализации и чистые ионные уравнения для реакций нейтрализации
Цели обучения
- Определите реакцию нейтрализации.
- Напишите сбалансированные уравнения реакций нейтрализации.
- Напишите чистые ионные уравнения для реакций нейтрализации.
Кто убирает потом?
Заливать бетон и обрабатывать его — грязная работа. При этом образуется много сточных вод с щелочным pH.Часто правила требуют, чтобы эти сточные воды очищались на месте. Практический способ нейтрализовать щелочной pH — это барботаж CO 2 в воду. Двуокись углерода образует слабую кислоту (угольная кислота, H 2 CO 3 ) в растворе, которая служит для снижения щелочного pH до более близкого к нейтральному.
Реакции нейтрализации и чистые ионные уравнения для реакций нейтрализации
Реакция нейтрализации представляет собой реакцию, в которой кислота и основание реагируют в водном растворе с образованием соли и воды.Водный хлорид натрия, который образуется в реакции, называется солью. Соль представляет собой ионное соединение, состоящее из катиона основания и аниона кислоты. Соль — это по существу любое ионное соединение, которое не является ни кислотой, ни основанием.
Реакции сильной кислоты и сильного основания
Когда равные количества сильной кислоты, такой как соляная кислота, смешиваются с сильным основанием, таким как гидроксид натрия, получается нейтральный раствор. Продукты реакции не обладают характеристиками ни кислоты, ни основания.Вот сбалансированное молекулярное уравнение.
Химические реакции, протекающие в водном растворе, более точно представляются чистым ионным уравнением. Полное ионное уравнение нейтрализации соляной кислоты гидроксидом натрия записывается следующим образом:
Так как кислота и основание сильны, они полностью ионизированы и записываются как ионы, как и NaCl, образующийся как продукт. Ионы натрия и хлора являются ионами-наблюдателями в реакции, оставляя следующее в качестве чистой ионной реакции.
Все реакции нейтрализации сильной кислоты с сильным основанием упрощаются до чистой ионной реакции соединения иона водорода с ионом гидроксида с образованием воды.
Что делать, если кислота является дипротоновой кислотой, например серной? Сбалансированное молекулярное уравнение теперь включает соотношение 1: 2 между кислотой и основанием.
Для того, чтобы реакция была полной нейтрализацией, вдвое большее количество молей NaOH должно прореагировать с H 2 SO 4 . Соль сульфата натрия растворима, поэтому итоговая ионная реакция остается такой же.Для других полипротонных кислот или оснований с множеством гидроксидов, таких как Ca (OH) 2 , встречаются различные мольные отношения.
Реакции с участием слабой кислоты или слабого основания
Реакции, в которых хотя бы один из компонентов является слабым, обычно не приводят к нейтральному раствору. Ниже показана реакция между слабой азотистой кислотой и сильным гидроксидом калия.
Чтобы написать чистое ионное уравнение, слабую кислоту необходимо записать в виде молекулы, поскольку она не ионизируется в воде в значительной степени.Основание и соль полностью диссоциируют.
Единственным ионом-наблюдателем является ион калия, в результате чего получается чистое ионное уравнение:
Сильный гидроксид-ион по существу «заставляет» слабую азотистую кислоту ионизироваться. Ион водорода из кислоты соединяется с ионом гидроксида с образованием воды, оставляя нитрит-ион в качестве другого продукта. Полученный раствор не является нейтральным (pH = 7), а скорее слегка щелочным.
Реакции также могут включать слабое основание и сильную кислоту, в результате чего получается слабокислый раствор.Молекулярные и чистые ионные уравнения реакции соляной кислоты и аммиака показаны ниже.
Слабые реакции между кислотами и основаниями могут привести к образованию нейтральных, кислых или основных растворов.
Сводка
- Нейтрализация определена.
- Приведены уравнения кислотно-щелочной нейтрализации.
- Приведены чистые ионные уравнения для реакций нейтрализации.
Практика
Задачи на листе по ссылке ниже:
http: // www.bbc.co.uk/bitesize/standard/chemistry/acids/reactions/revision/4/
Обзор
- Что такое реакция нейтрализации?
- Что такое соль?
- Напишите чистое ионное уравнение для нейтрализации сильной кислоты и сильного основания.
Глоссарий
- реакция нейтрализации: Реакция, в которой кислота и основание реагируют в водном растворе с образованием соли и воды.
- соль: Ионное соединение, состоящее из катиона основания и аниона кислоты.
WebElements Периодическая таблица элементов »Калий» реакции элементов
Реакция калия с воздухом
Калий очень мягкий и легко режется. В результате поверхность будет яркой и блестящей. Однако эта поверхность вскоре тускнеет из-за реакции с кислородом и влагой воздуха. Если калий сжигается на воздухе, в результате образуется в основном оранжевый супероксид калия, KO 2 .
К (с) + O 2 (г) → KO 2 (с)
Реакция калия с водой
Металлический калий очень быстро реагирует с водой с образованием бесцветного раствора гидроксида калия (КОН) и газообразного водорода (H 2 ).Полученный раствор является щелочным из-за растворенного гидроксида. Реакция экзотермическая. В начале реакции металлический калий становится настолько горячим, что загорается и горит характерным бледно-сиреневым цветом. Реакция медленнее, чем у рубидия (непосредственно ниже калия в периодической таблице), но быстрее, чем у натрия (непосредственно выше калия в периодической таблице).
2К (с) + 2H 2 O → 2KOH (водн.) + H 2 (г)
Реакция калия с галогенами
Металлический калий активно реагирует со всеми галогенами с образованием галогенидов калия.Таким образом, он реагирует с фтором, F 2 , хлором, Cl 2 , бромом, I 2 , и йодом, I 2 , с образованием соответственно бромида калия (I), KF, хлорида калия (I). , KCl, бромид калия (I), KBr, и иодид калия (I), KI.
2К (с) + F 2 (г) → КФ (с)
2K (т) + Cl 2 (г) → KCl (т)
2К (т) + Br 2 (г) → KBr (т)
2К (с) + I 2 (г) → КИ (с)
Реакция калия с кислотами
Металлический калий легко растворяется в разбавленной серной кислоте с образованием растворов, содержащих водородный ион K (I) вместе с газообразным водородом, H 2 .
2K (s) + H 2 SO 4 (вод.) → 2K + (вод.) + SO 4 2- (вод.) + H 2 (g)
Реакция калия с основаниями
Металлический калий очень быстро реагирует с водой с образованием бесцветного щелочного раствора гидроксида калия (КОН) и газообразного водорода (H 2 ). Реакция продолжается даже тогда, когда раствор становится основным. Полученный раствор является щелочным из-за растворенного гидроксида. Реакция экзотермическая.В начале реакции металлический калий становится настолько горячим, что загорается и горит характерным бледно-сиреневым цветом. Реакция медленнее, чем у рубидия (непосредственно ниже калия в периодической таблице), но быстрее, чем у натрия (непосредственно выше калия в периодической таблице). По мере продолжения реакции концентрация основания увеличивается.
2К (с) + 2H 2 O → 2KOH (водн.) + H 2 (г)
Yahoo Answers закрылся | Справка Yahoo
Yahoo Answers прекратил работу с 4 мая 2021 года.Yahoo Answers когда-то был ключевой частью продуктов и услуг Yahoo, но с годами его популярность снизилась по мере изменения потребностей наших участников. Мы решили переместить наши ресурсы с Yahoo Answers, чтобы сосредоточиться на продуктах, которые лучше обслуживают наших участников и выполняют обещание Yahoo по предоставлению надежного контента премиум-класса.
С 4 мая 2021 года вы больше не можете получить доступ к сайту, но вы все равно можете запросить загрузку ваших данных Yahoo Answers до 30 июня 2021 года. Чтобы помочь вам с этим переходом, мы составили список вопросов, которые могут возникают во время этого процесса.
Повлияет ли это на мою учетную запись Yahoo или другие службы Yahoo?
Нет, эти изменения относятся к Yahoo Answers. Они не повлияют на вашу учетную запись Yahoo или другие службы Yahoo.
Куда мне обратиться, если у меня возникнут вопросы в будущем?
Yahoo Search можно использовать для поиска ответов и информации в Интернете. Наша страница Yahoo COVID предоставляет информацию и ресурсы о пандемии коронавируса.
Могу ли я загрузить свой контент Yahoo Answers?
Какой контент мне доступен?
При загрузке данных Yahoo Answers будет возвращен весь пользовательский контент, включая ваши вопросы, ответы и изображения. Вы не сможете загружать контент, вопросы или ответы других пользователей.
Нужно ли мне скачивать мой контент?
Нет, загрузка содержимого не обязательна. Однако, если вы решите загрузить свой контент, вы должны сделать это до 30 июня 2021 года.
Когда я получу контент Yahoo Answers?
Наша команда работает как можно быстрее, чтобы сделать данные доступными, но загрузка вашего контента может занять до 30 дней.
Я загрузил свой контент Yahoo Answers, как мне его просмотреть?
Ваш контент будет отформатирован в JSON (нотация объектов JavaScript), и его может быть сложно просмотреть с первого взгляда. У нас есть ресурсы по просмотру и управлению данными вашей учетной записи, которые помогут вам понять, как загружаются ваши данные.
Как я могу поделиться своими комментариями / отзывами об этом изменении?
Присылайте любые комментарии или отзывы относительно этого решения по адресу [email protected]. Спасибо, что нашли время поделиться с нами своими мыслями.
Гидроксид калия требует специального раствора для хранения
Если вы храните гидроксид калия, у вас есть химическое вещество, к которому нельзя относиться легкомысленно. Для хранения гидроксида калия и обращения с ним требуется система резервуаров для химикатов, которая выдержит суровые условия эксплуатации опасного вещества без возможности катастрофического отказа в случае утечки.
Наличие надлежащего метода хранения дает уверенность в том, что у вас не будет неожиданных происшествий или несчастных случаев.
Давайте подробнее рассмотрим гидроксид калия, способы его использования и способы его правильного хранения, чтобы обеспечить безопасность ваших сотрудников.
Проблемы гидроксида калия
Гидроксид калия, химически известный как КОН, чаще известен как щелочь, поташ или едкий калий. Это химическое вещество используется в широком спектре промышленных применений, таких как водоочистные сооружения — часто, чтобы отрегулировать уровень pH кислой воды, чтобы сделать ее более щелочной.
Гидроксид калия также содержится в самых разных отраслях промышленности, от производства продуктов питания до удобрений, красителей, пигментов и т. Д. Он также используется для производства калиевого мыла, моющих средств и других калиевых химикатов. Наиболее распространенным из них является карбонат калия, который используется в основном при производстве специальных очков, таких как телевизионные экраны.
При растворении в воде или нейтрализации кислотой гидроксид калия выделяет значительное количество тепла. Это может вызвать бурную экзотермическую реакцию, если это не сделать должным образом, что может привести к воспламенению горючих материалов.
Каустический калий во всех формах очень агрессивен и химически активен. В виде раствора он вступает в реакцию со многими металлами и легко вступает в реакцию с органическими тканями, такими как кожа или глаза человека. Гидроксид калия также является сильным раздражителем, который может вызвать серьезное повреждение верхних дыхательных путей. Он токсичен при проглатывании и вызывает разъедание кожи. По этой причине очень важно обеспечить правильное обращение и хранение едкого калия.
При оценке вариантов хранения убедитесь, что вы учитываете вторичную систему сдерживания.Из-за потенциальных опасностей вторичная защитная оболочка является абсолютным приоритетом для окружающей среды и безопасности.
Безопасное хранение гидроксида калия
Гидроксид калия очень абсорбирует влагу из воздуха, поэтому его следует хранить в прохладном и сухом месте. Мы рекомендуем плотно закрытый резервуар для хранения химикатов, расположенный в хорошо вентилируемом помещении, чтобы предотвратить проблемы с их вдыханием. Поскольку он классифицируется как опасный материал, вы должны принять соответствующие меры предосторожности при хранении гидроксида калия.
Хотя существует множество вариантов хранения гидроксида калия, идеально подойдет резервуар из сшитого полиэтилена, полученный ротационным формованием. В результате получается цельный резервуар, в результате чего химикат практически не может найти утечки. Эта система дает вам непревзойденную долговечность и душевное спокойствие, зная, что резервуар создан для гидроксида калия с нуля.
Из-за его опасной и высококоррозионной природы важно иметь систему изоляции с двойными стенками для каустического калия.Система SAFE-Tank® от Poly Processing представляет собой «резервуар в резервуаре», который обеспечивает большую безопасность, предлагая вторичную герметизацию, которая полностью закрыта. БЕЗОПАСНЫЙ резервуар обеспечивает 110-процентную герметичность при той же занимаемой площади, что и вертикальный резервуар для хранения, что позволяет легко хранить химикат там, где это наиболее эффективно и удобно.
Гидроксид калия можно приобрести как химическое вещество, одобренное NSF 60. Это химикат, одобренный NSF / ANSI 61 с концентрацией 50% или менее для резервуарных систем Poly Processing.Система резервуаров представляет собой систему резервуаров из сшитого полиэтилена 1.


 2
2
 е. м. (г/моль)
е. м. (г/моль)