Содержание
2.4 Характерные химические свойства оксидов: основных, амфотерных, кислотных
Видеоурок 1: Свойства оксидов
Видеоурок 2: Химические свойства основных оксидов
Лекция: Характерные химические свойства оксидов: основных, амфотерных, кислотных
Оксиды — бинарные соединения (сложные вещества), состоящие из кислорода со степенью окисления -2 и другого элемента.
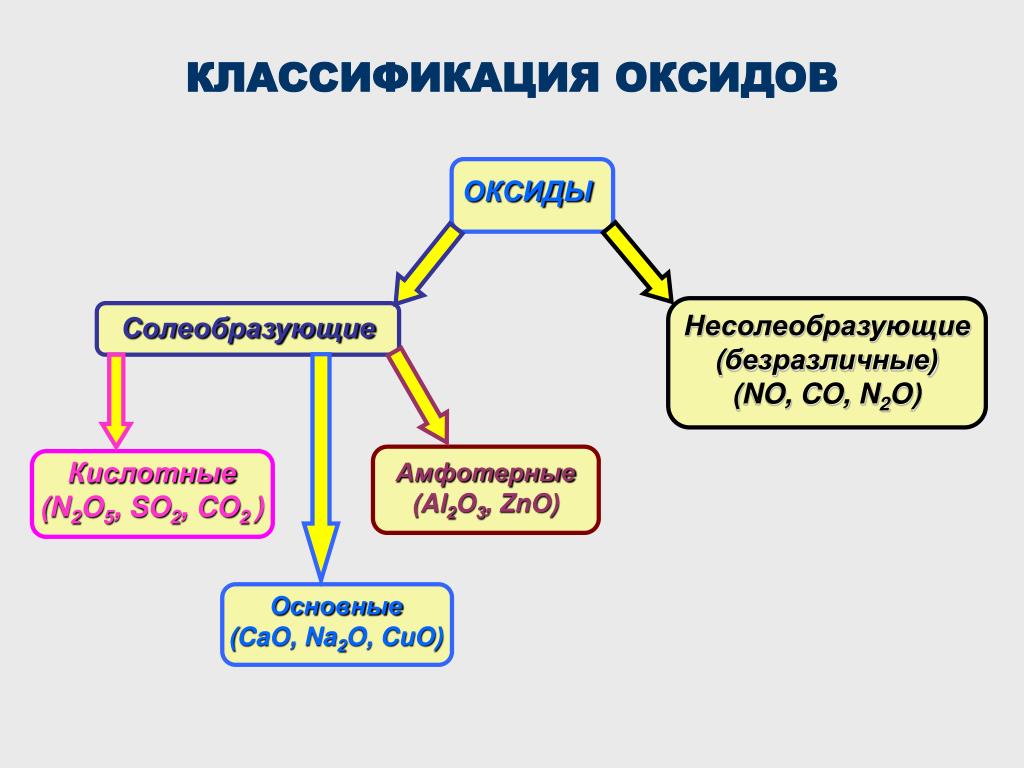
По своим химическим способностям образовывать соли все оксиды подразделены на две группы:
- солеобразующие,
- несолеобразующие.
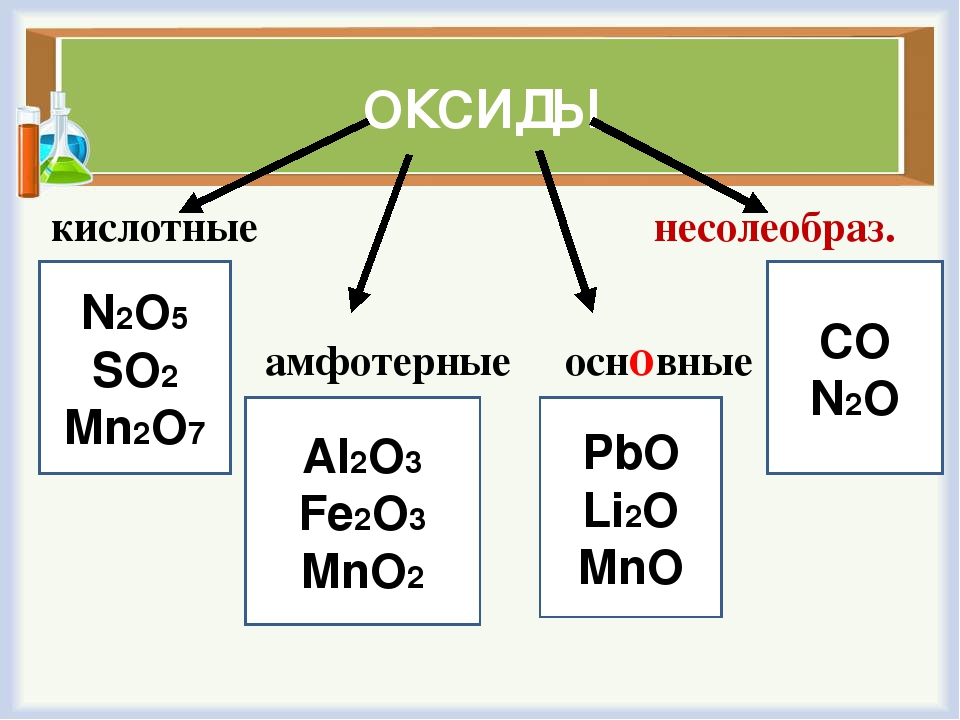
Солеообразующие в свою очередь подразделены на три группы: основные, ксилотные, амфотерные. К несолеобразующим относятся оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
Основные оксиды — это оксиды, проявляющие основные свойства, образованные щелочными и щелочноземельными металлами в степенях окисления +1,+2, а также переходными металлами в низших степенях окисления.
Данной группе оксидов соответствуют основания: К2О – КОН; ВаО – Ва(ОН)2; La2O3 – La(OH)3.
Кислотные оксиды — это оксиды, проявляющие кислотные свойства, образованные типичными неметаллами, а также некоторыми переходными металлами в степенях окисления от +4 до +7.
Данной группе оксидов соответствуют кислоты: SO3 –H2SO4; CO2 – H2CO3; SO2 – H2SO3 и т.д.
Амфотерные оксиды — это оксиды, проявляющие основные и кислотные свойства, образованные переходными металлами в степенях окисления +3,+4. Искл.: ZnO, BeO, SnO, PbO.
Данной группе оксидов соответствуют амфотерные основания: ZnO – Zn(OH)2; Al2O3 – Al(OH)3.
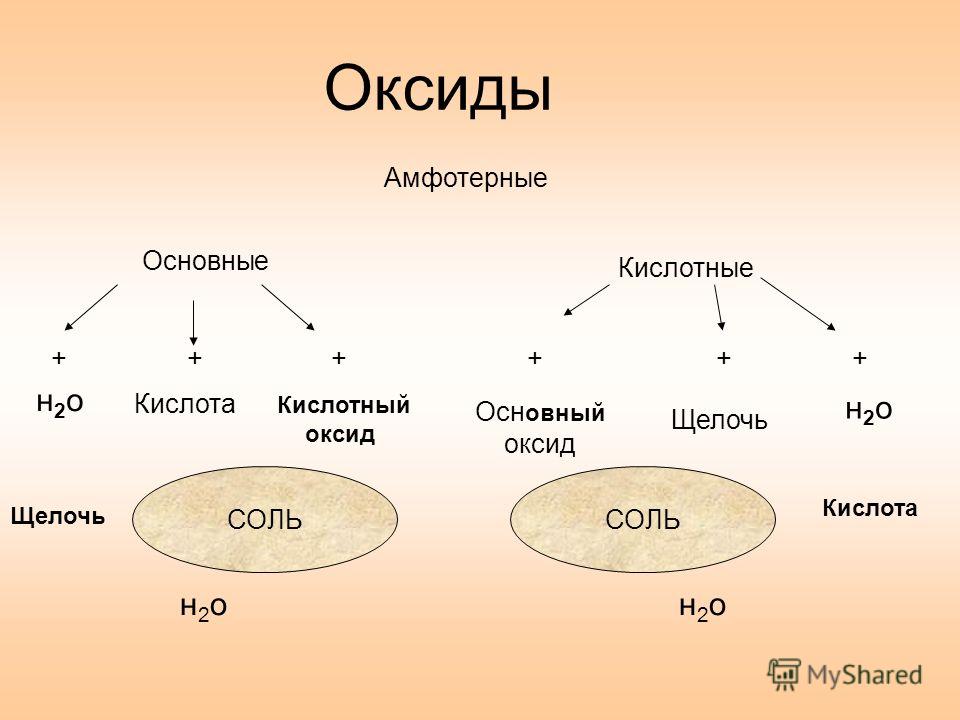
Рассмотрим химические свойства оксидов:
Реагент | Основные оксиды | Амфотерные оксиды | Кислотные оксиды |
| Вода | Реагируют. Пример: Пример:CaO + H2O → Ca(OH)2 | Не реагируют | Реагируют. Пример: SO3 + H2O → H2SO4 |
| Кислота | Реагируют. Пример: Fe2O3 + 6HCl → 2FeCl3 + 3H2O | Реагируют. Пример: ZnO + 2HCl → ZnCl2 + H2O | Не реагируют |
| Основание | Не реагируют | Реагируют. Пример: ZnO + 2NaOH + H2O → Na2[Zn(OH)4] | Реагируют. Пример: 2NaOH + SiO2 → Na2SiO3 + H2O |
| Основный оксид | Не реагируют | Реагируют. Пример: ZnO + CaO → CaZnO2 | Реагируют. Пример: SiO2 + CaO → CaSiO3 |
| Кислотный оксид | Реагируют. Пример: CaO + CO2 → CaCO3 | Реагируют. Пример: Пример:ZnO + SiO2 → ZnSiO3 | Не реагируют |
| Амфотерный оксид | Реагируют. Пример: Li2O + Al2O3 → 2LiAlO | Реагируют | Реагируют. Пример: Al2O3 + 3SO3 → Al2(SO4)3 |
Из приведенной таблицы можно резюмировать следующее:
Основные оксиды наиболее активных металлов взаимодействуют с водой, образуя сильные основания – щелочи. Основные оксиды менее активных металлов, при обычных условиях с водой не реагируют. С кислотами реагируют всегда и все оксиды данной группы, образуя соли и воду. А с основаниями не реагируют.
Кислотные оксиды в большинстве своем реагируют с водой. Но не все реагируют в обычных условиях. С основаниями реагирует все оксиды данной группы, образуя соли и воду. С кислотами не реагируют.
Основные и кислотные оксиды способны реагировать между собой, с последующим образованием соли.
Амфотерные оксиды обладают основными и кислотными свойствами. Поэтому они реагируют и с кислотами, и с основаниями, образуя соли и воду. Амфотерные оксиды реагируют с кислотными и основными оксидами. Так же взаимодействуют и между собой. Чаще всего, данные химические реакции протекают при нагревании с образованием солей.
9 класс. Химия. Амфотерные оксиды и гидроксиды — Амфотерные оксиды и гидроксиды
Комментарии преподавателя
1. Характеристика амфотерных соединений
Рис. 1. Вещества, проявляющие амфотерные свойства
Основные оксиды реагируют с кислотными оксидами, а кислотные оксиды – с основаниями. Но существуют вещества, оксиды и гидроксиды которых в зависимости от условий, будут реагировать и с кислотами и с основаниями. Такие свойства называются амфотерными.
Вещества, обладающие амфотерными свойствами приведены Рис. 1.. Это соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.
1.. Это соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.
Примеры их амфотерных оксидов приведены в таблице 1.
|
Амфотерные оксиды
| |
|
Формула
|
Названия
|
|
BeO
|
Оксид берилия (II)
|
|
ZnO
|
Оксид цинка
|
|
Al2O3
|
Оксид алюминия
|
|
Cr2O3
|
Оксид хрома III)
|
|
As2O3
|
Оксид мышьяка (III)
|
|
GeO
|
Оксид германия (II)
|
|
PbO2
|
Оксид свинца (IV)
|
|
MnO2
|
Оксид марганца (IV)
|
|
Fe2O3
|
Оксид железа (III)
|
|
SnO
|
Оксид олова (II)
|
2. Химические свойства амфотерных оксидов цинка и алюминия
Химические свойства амфотерных оксидов цинка и алюминия
Рассмотрим амфотерные свойства оксидов цинка и алюминия. На примере их взаимодействия с основными и кислотными оксидами, с кислотой и щелочью.
— Взаимодействие с основными оксидами и основаниями:
ZnO + Na2O → Na2ZnO2 (цинкат натрия). Оксид цинка ведет себя как кислотный.
ZnO + 2NaOH → Na2ZnO2+ h3O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
3ZnO + P2O5 → Zn3(PO4)2 (фосфат цинка)
ZnO + 2HCl → ZnCl2 + h3O
Аналогично оксиду цинка ведет себя и оксид алюминия:
— Взаимодействие с основными оксидами и основаниями:
Al2O3 + Na2O → 2NaAlO2 (метаалюминат натрия). Оксид алюминия ведет себя как кислотный.
Al2O3 + 2NaOH → 2NaAlO2+ h3O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
Al2O3 + P2O5 → 2AlPO4(фосфат алюминия)
Al2O3 + 6HCl → 2AlCl3 + 3h3O
Рассмотренные реакции происходят при нагревании, при сплавлении.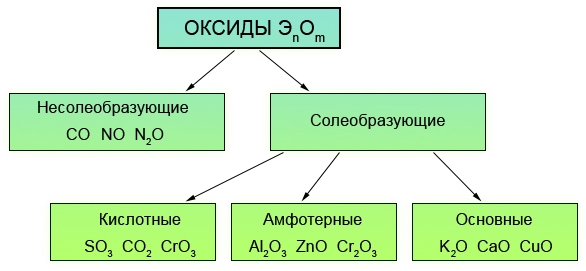 Если взять растворы веществ, то реакции пойдут несколько иначе.
Если взять растворы веществ, то реакции пойдут несколько иначе.
3. Химические свойства амфотерных оксидов цинка и алюминия в растворах
ZnO + 2NaOH + h3O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия) Al2O3 + 2NaOH + 3h3O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
В результате этих реакций получаются соли, которые относятся к комплексным.
Рис. 2. Минералы на основе оксида алюминия
Оксид алюминия.
Оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда и других минералов. Рис.2.
В результате взаимодействия этих веществ с серной кислотой, получается сульфат цинка или сульфат алюминия.
ZnO + h3SO4 → ZnSO4 + h3O
Al2O3 + 3h3SO4→ Al2 (SO4)3 + 3h3O
4. Химические свойства амфотерных гидроксидов цинка и алюминия
Реакции гидроксидов цинка и алюминия с оксидом натрия происходят при сплавлении, потому что эти гидроксиды твердые и не входят в состав растворов.
Zn(OН)2 +2 Na2O → Na2ZnO2 + Н2О соль называется цинкат натрия.
2Al(OН)3 + Na2O → 2NaAlO2 + 3Н2О соль называется метаалюминат натрия.
Рис. 3. Гидроксид алюминия
Реакции амфотерных оснований со щелочами характеризует их кислотные свойства. Данные реакции можно проводить как при сплавлении твердых веществ, так и в растворах. Но при этом получатся разные вещества, т.е. продукты реакции зависят от условий проведения реакции: в расплаве или в растворе.
Zn(OH)2 + 2NaOH тв. Na2ZnO2 + 2Н2О
Al(OH)3 + NaOH тв. NaAlO2+ 2h3O
Zn(OH)2 + NaOH раствор → Na2[Zn(OH)4] Al(OH)3 + NaOH раствор → Na[Al(OH)4] тетрагидроксоалюминат натрия Al(OH)3 + 3NaOH раствор→ Na3[Al(OH)6] гексагидроксоалюминат натрия.
Получается тетрагидроксоалюминат натрия или гексагидроксоалюминат натрия зависит от того, сколько щелочи мы взяли. В последней реакции щелочи взято много и образуется гексагидроксоалюминат натрия.
5. Химические свойства амфотерных цинка и алюминия
Элементы, которые образуют амфотерные соединения, могут сами проявлять амфотерные свойства.
Zn + 2NaOH + 2h3O → Na2[Zn(OH)4] + Н2↑(тетрагидроксоцинкат натрия)
2Al + 4NaOH + 6h3O → 2Na[Al(OH)4] + 3Н2↑( (тетрагидроксоалюминат натрия)
Zn + h3SO4(разб.)→ ZnSO4 + h3↑
2Al + 3h3SO4(разб.)→ Al2 (SO4)3 + 3h3↑
Напомним о том, что амфотерные гидроксиды являются нерастворимыми основаниями. И при нагревании разлагаются , образуя оксид и воду.
Разложение амфотерных оснований при нагревании.
Al(OH)3 Al2O3 + 3h3O
Zn(OH)2 ZnO + h3O
Подведение итога урока.
Вы узнали свойства амфотерных оксидов и гидроксидов. Эти вещества, имеют амфотерные (двойственные) свойства. Химические реакции, которые протекают с ними, имеют особенности. Вы рассмотрели примеры амфотерных оксидов и гидроксидов.
Источники
http://www.youtube.com/watch?v=e9upOc8PTtg
презентации — http://ppt4web.ru/khimija/amfoternye-oksidy-i-gidroksidy. html
html
заставка http://www.youtube.com/watch?t=29&v=e9upOc8PTtg
Конспект http://interneturok.ru/ru/school/chemistry/9-klass
Тема 3. Амфотерные оксиды и гидроксиды.
Часть I
1. Амфотерные соединения – это вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства.
2. Амфотерные гидроксиды – это гидроксиды, например, элементов с порядковыми номерами 4, 13, 30 – Be, Al, Zn. Каждый гидроксид проявляет , в зависимости от условий реакций, свойства то основания, то кислоты.
а) Как основание, амфотерный гидроксид взаимодействует с кислотой, образуя соль и воду (запишите молекулярное, полное и сокращённое ионное уравнения реакций).
б) Как кислота, амфотерный гидроксид взаимодействует со щёлочью, образуя соль (входит в состав кислотного остатка) и воду (запишите молекулярное, полное и сокращённое ионное уравнения реакций):
3. Амфотерным гидроксидам соответствуют амфотерные оксиды.
Амфотерным гидроксидам соответствуют амфотерные оксиды.
4. Генетический ряд переходного металла:
5. Запишите формулы оксида и гидроксида, а также уравнения реакций переходов в молекулярной и ионной формах.
Часть II
1. Дайте характеристику элемента алюминия по плану, с которым вы познакомились на первых уроках:
1) Al – это элемент III А группы малого периода.
2) +13 Al, 2е, 8е, 3е.
3) Это восстановитель, который получают с. о. +3.
4-5) Al – металл, поэтому имеет металлическую кристаллическую решётку, образованную за счёт металлической химической связи, схема которой:
6) аллотропия для алюминия нехарактерна.
7) Как металл, алюминий менее активный, чем магний, но более активный, чем кремний.
8) Как металл, алюминий более активный, чем бор, но менее активный, чем галлий.
9) Оксид алюминия имеет амфотерный характер, поэтому взаимодействует и с кислотой, и с щёлочью, образуя соль и воду.
10) Амфотерный гидроксид является и основанием, и кислотой, которая имеет формулу
взаимодействует (напишите уравнения в молекулярной, полной и сокращённой ионной формах):
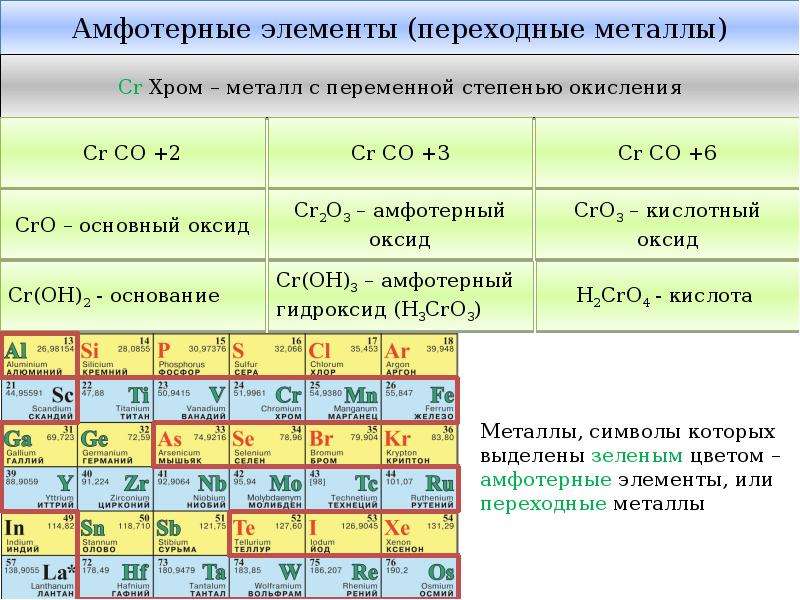
2. Оксид хрома (II) CrO проявляет основные свойства, поэтому взаимодействует с кислотными оксидами, кислотами.
Приведите уравнения соответствующих реакций.
3. Оксид хрома (VI) проявляет кислотные свойства, поэтому взаимодействует с основными оксидами, основаниями (щёлочами).
Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
4. Оксид хрома (III) проявляет амфотерные свойства, поэтому взаимодействует и с кислотами, и со щелочами. Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
5. Верны ли следующие суждения?
А) Все гидроксиды металлов (I) имеют только основный характер.
Б) Гидроксиды металлов (II) могут быть как основаниями, так и амфотерными гидроксидами.
1) оба суждения верны.
6. Верны ли следующие суждения?
А) Характер гидроксидов переходных металлов VI B и VII B групп зависит от с. о. металлов:
— с низшей с. о. – носит основный характер;
— с промежуточной с. о. – амфотерный характер;
— с высшей с. о. – кислотный характер.
Б. Оксиды и гидроксиды неметаллов всегда имеют кислотный характер.
2) верно только А.
7. Формула высшего оксида марганца а формула его гидроксида – Оба соединения имеют кислотный характер (для подтверждения приведите по два уравнения возможных реакций в молекулярной и ионной формах):
Оксиды.
Классификация и номенклатура.
Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород.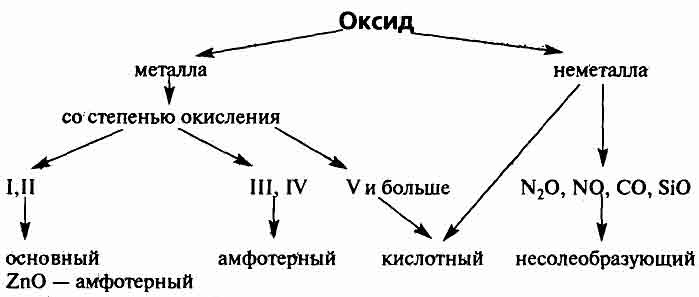
Оксиды делят на две группы: солеобразующие и несолеобразующие, а каждую из групп, в свою очередь, подразделяют на несколько подгрупп:
НЕСОЛЕОБРАЗУЮЩИЕ: безразличные, пероксиды, солеобразные;
СОЛЕОБРАЗУЮЩИЕ: основные, амфотерные, кислотные.
Многие элементы проявляют переменную валентность и дают оксиды различного состава, поэтому прежде всего следует рассмотреть номенклатуру оксидов.
Согласно современной международной номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например: SО2 — оксид серы (IV), SO3 — оксид серы (VI), CrO — оксид хрома (II), Сr2О3 — оксид хрома (III), СrО3 — оксид хрома (VI).
Получение и свойства.
Основные оксиды. К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов:
1. Окисление металлов при нагревании в атмосфере кислорода:
Окисление металлов при нагревании в атмосфере кислорода:
2Mg + О2 = 2МgО,
2Сu + О2 = 2СuО.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2О, К2О крайне труднодоступны.
2. Обжиг сульфидов:
2CuS + ЗО2 = 2СuО + 2SО2,
4FeS2 + 11О2 = 2Fе2О3 + 8SО2.
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
3. Разложение гидроксидов:
to
Cu(OH)2 = CuO + H2O
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот:
to
BaCO3 = BaO + CO2
to
2Рb(NО3)2 = 2PbО + 4NO2+O2
to
4FеSО4 = 2Fe2O3 + 4SO4 + O2
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
to
[ZnOH]2 = 2ZnO + CO2 + H2 O
Свойства основных оксидов.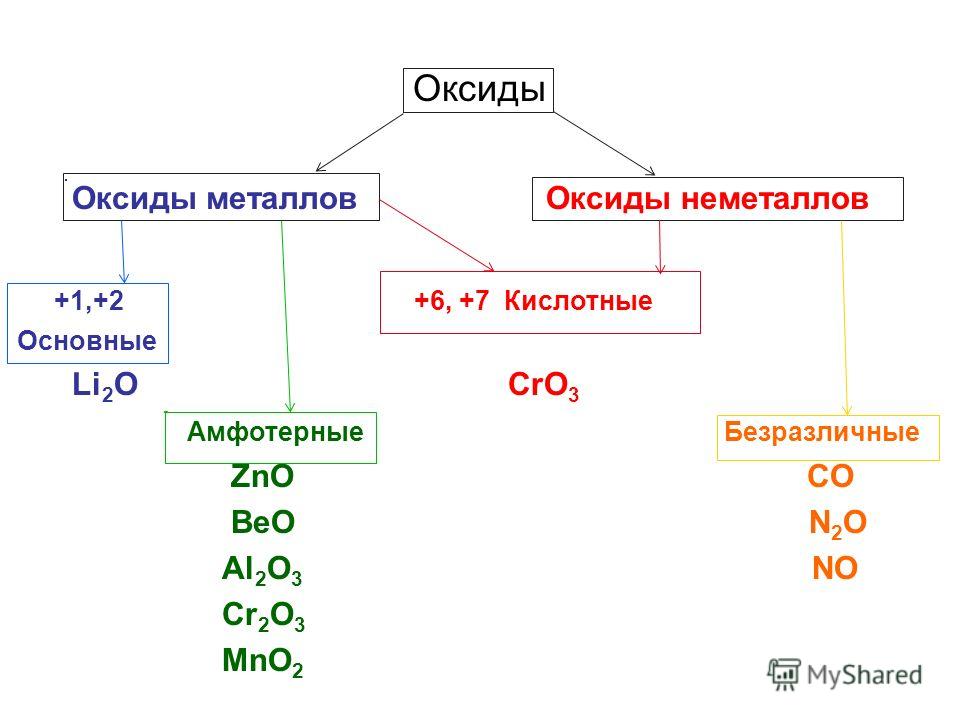 Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2-, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2-, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
t0
2HgO = 2Hg + O2
t0
2Ag2O = 4Ag + O2
Основные оксиды при нагревании могут вступать в реакции c кислотными и амфотерными оксидами, с кислотами:
ВаО + SiO2 = ВаSiO3,
МgО + Аl2О3 = Мg(AlO2)2,
ZnО + Н2SО4 = ZnSО4 + Н2О.
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
t0
Fe2O3+2Al = Al2O3 + 2Fe
t0
3CuO+2NH3 = 3Cu + N2+3H2O
t0
4FeO+O2 = 2Fe2 + O3
Кислотные оксиды. Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
t0
4P+5O2 = 2P2 + O5
to
2ZnS+3O2 = 2ZnO + 2SO2
to
K2Cr2O7+H2SO4 = 2CrO3↓+ K2SO4+H2O
Nа2SiO3 + 2НСl = 2NаСl + SiO2↓ + Н2О
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
SO3+ H2O = H2SO4
CO2+ H2O = H2CO3
P2O5+ H2O = 2HPO3
P2O5+ 3H2O = 2H3PO4
P2O5+ 2H2O = H4P2O7
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, с щелочами:
to
P2O5+Al2O3 = 2AlPO4
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.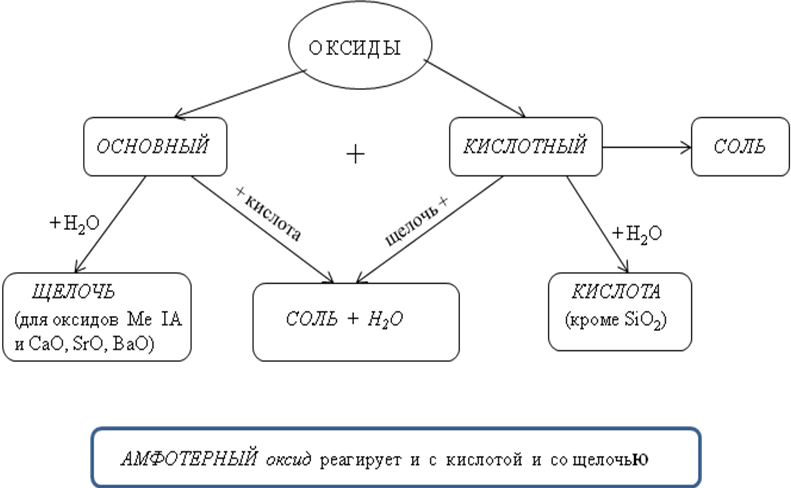
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
to
CO2+C = 2CO
to
2SO2+O2 ↔ 2SO3
SО2 + 2Н2S = 3S + 2Н2О,
4CrO3 + С2Н5ОН = 2Сr2О3 + 2СО2 + ЗН2О.
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Аl2О3 + 6НСl = 2АlСl3 + ЗН2О,
Аl22О3 + 2NаОН + ЗН2О = 2Nа[Аl(ОН)4].
К числу амфотерных оксидов относятся оксид алюминия Аl2О3, оксид хрома (III) Сr2О3, оксид бериллия ВеО, оксид цинка ZnО, оксид железа (III) Fe2О3 и ряд других.
Идеально амфотерным оксидом является вода Н2О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
Сu2+ + Н2О←→ Сu(ОН)+ + Н+
СО32- + Н2О ↔ НСО3— + ОН—.
Оксиды основные и амфотерные
|
Соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
|
Технические параметры:
| Наименование | ГОСТ | Внешний вид | Квалификация |
| Кальций окись | ГОСТ 8677-76 | Порошок белого цвета | ЧДА, Ч |
| Магний окись | ГОСТ 4226-75 | Порошок белого цвета | ЧДА, Ч |
| Медь (II) окись | ГОСТ 16539-79 | Гранулированная или порошкообразная: гранулы коричневого-бурого или черно-бурого цвета 3-5 мм или тонкий порошок черного цвета | ЧДА |
| Цинк окись | ГОСТ 10262-73 | Аморфный порошок белого или слегка желтоватого цвета | ХЧ, ЧДА, Ч |
| Кобальт (II, III) окись | ГОСТ 4467-79 | Порошок черного цвета | ЧДА, Ч |
| Никель окись черная | ГОСТ 4331-78 | Порошок черного или серо-черного цвета | Ч |
| Никель закись (Никель (II) оксид) | ГОСТ 17607-72 | Порошок черного цвета | Ч |
Амфотерные оксиды — оксиды.
 Амфотерные оксиды
Амфотерные оксиды
Пользователи также искали:
амфотерные оксиды формулы,
амфотерные оксиды и гидроксиды 8 класс,
амфотерные оксиды как определить,
амфотерные оксиды свойства,
амфотерные оксиды взаимодействуют с,
амфотерный оксид пример,
урок амфотерные оксиды и гидроксиды.,
Амфотерные,
амфотерные,
оксиды,
Амфотерные оксиды,
гидроксиды,
амфотерные оксиды взаимодействуют с,
амфотерные оксиды как определить,
амфотерный оксид пример,
амфотерные гидроксиды,
свойства,
формулы,
взаимодействуют,
определить,
класс,
урок,
амфотерный,
оксид,
пример,
амфотерные оксиды формулы,
амфотерные оксиды свойства,
амфотерные оксиды и гидроксиды 8 класс,
урок амфотерные оксиды и гидроксиды,
амфотерные оксиды и гидроксиды класс,
амфотерные оксиды,
бесплатных решений Ncert для 11-го класса химической классификации элементов и периодичности в свойствах / गुणों में तत्वों और आवधिकता का वर्गीकरण
Ответ:
элементы p-блока образуют кислую,
основные и амфотерные оксиды. C, N, P, S, Cl и т. Д. (Т. Е. P-блочные элементы) образуют
C, N, P, S, Cl и т. Д. (Т. Е. P-блочные элементы) образуют
кислотные оксиды.Они соединяются с водой с образованием оксикислот.
\ [C {{O} _ {2}} + {{H} _ {2}} O \ to
\ underset {\ text {Carbonic} \, \ text {acid}} {\ mathop {{{H} _ {2}} C {{O} _ {3}}}} \, \]
\ [{{N} _ {2}} {{O} _ {5}} + {{H} _ {2}} O \ to
\ underset {Nitric \, acid} {\ mathop {2HN {{O} _ {3}}}} \, \]
\ [{{P} _ {2}} {{O} _ {5}} + 3 {{H} _ {2}} O \ to
\ underset {Ортофосфорная \, кислота} {\ mathop {2 {{H} _ {3}} P {{O} _ {4}}}} \, \]
\ [S {{O} _ {3}} + {{H} _ {2}} O \ to
\ underset {Серная \, кислота} {\ mathop {{{H} _ {2}} S {{O} _ {4}}}} \, \]
\ [C {{l} _ {2}} {{O} _ {7}} + {{H} _ {2}} O \ to
\ underset {Perchloric \, acid} {\ mathop {2HCl {{O} _ {4}}}} \, \]
Al, Sb, Pb и др.(т. е. p-блок
элементы) образуют амфотерные оксиды. Эти оксиды реагируют как с кислотами, так и с основаниями.
\ [A {{1} _ {2}} {{O} _ {3}} \ text {
} + 6HCl \ to \ text {} 2A1C {{1} _ {3}} \ text {} +3 {{H} _ {2}} O \]
\ [A {{l} _ {2}} {{O} _ {3}} + 2NaOH \ to
2NaAl {{O} _ {2}} + {{H} _ {2}} O \]
\ [S {{b} _ {2}} {{O} _ {3}} \ text {
} + 6HCl \ text {} \ to \ text {} 2SbC {{l} _ {3}} \ text {} +3 {{H} _ {2}} O \]
\ [S {{b} _ {2}} {{O} _ {3}} + 6NaOH \ to
\ text {} N {{a} _ {3}} Sb {{O} _ {3}} + 3 {{H} _ {2}} O \]
\ [PbO + {{H} _ {2}} S {{O} _ {4}} \ text {
} \ to \ text {} PbS {{O} _ {4}} \ text {} + {{H} _ {2}} O \]
\ [PbO + \ text {} 2NaOH \ to \ text {
} N {{a} _ {2}} Pb {{O} _ {2}} \ text {} + \ text {} {{H} _ {2}} O \]
Оксиды In и Tl (p-блок
элементы) образуют основные оксиды. \ [I {{n} _ {2}} {{O} _ {3}} + 3 {{H} _ {2}} S {{O} _ {4}} \ to
\ [I {{n} _ {2}} {{O} _ {3}} + 3 {{H} _ {2}} S {{O} _ {4}} \ to
I {{n} _ {2}} {{\ left (S {{O} _ {4}} \ right)} _ {3}} + 3 {{H} _ {2}} O \]
\ [\ text {T} {{\ text {1}} _ {\ text {2}}} \ text {O
+} {{\ text {H}} _ {\ text {2}}} \ text {O} \ to \ text {2T1OH} \]
\ [T {{l} _ {2}} {{O} _ {3}} \ text {
} +3 {{H} _ {2}} S {{O} _ {4}} \ text {} \ to \ text {} T {{l} _ {2}} {{\ left (S {{ O} _ {4}}
\ right)} _ {3}} + 3 {{H} _ {2}} O \]
Каков результат реакции кислоты с амфотерным аксидом
Другие вопросы по теме: Химия
Сколько джоулей тепла поглощается, чтобы повысить температуру 650 граммов воды с 5.00c до точки кипения, 100c …
Химия
21.06.2019 14:30
Почему структура молекулы важна для ее функции? …
Химия
22.06.2019 10:00
Годовые объемы выбросов углерода от автомобилей в Бельгии обычно распределяются со средним значением 13,9 гигаграмм в год и стандартным отклонением 5,8 гигаграмм в год. найти …
найти …
Химия
22.06.2019 12:20
Сколько молей брома нужно для производства 3.23 моля бромида калия …
Химия
22.06.2019 18:30
Рассчитайте общие массы реагентов и продуктов для каждого из следующих уравнений …
Химия
22.06.2019 19: 00
Мы надеемся получить 5,72 грамма глюкозы. завод получил 4,75 л СО2 и 2,81 г х30. какой реагент был ограничивающим? сколько у нас было избыточной массы …
Химия
22.06.2019 20:30
Какой основной органический продукт реакции 4-аминофенола с 1 эквивалентом уксусного ангидрида? …
Химия
22.06.2019 21:30
8) согревание рук огнем это пример если какой теплообмен? а. проводимость b. конвекция c. радиация d. ни один из этих …
Химия
22.06.2019 22:00
Выберите правильную структуру Льюиса для фтора, который является элементом группы 7а?
Химия
23.06.2019 03:30
Какая самая большая среда на Земле? . ..
..
Химия
23.06.2019 05:30
Сейсмическая волна — это энергия, выделяющаяся в результате движения горных пород вдоль разлома. т или ж? …
Химия
23.06.2019 05:50
Как вы интерпретируете хроматограмму, какие смеси содержат? …
Химия
23.06.2019 07:30
является cs2o кислотным основной или амфотерный
Это оксид щелочного металла цезия, поэтому он является основным по природе.Амфотерные вещества могут реагировать как с кислотами, так и с основаниями (список конкретных элементов, которые могут это делать, можно найти на странице 469 учебника, хотя эти элементы можно легко идентифицировать по большей части, зная, что многие из них совпадают с… основными оксиды — это оксиды, которые реагируют с водой с образованием раствора с основанием и обычно представляют собой оксид металла. L i 2 O. Амфотерный раствор — это вещество, которое может химически реагировать либо как кислота, либо как основание. Основной оксид — это оксид, который при в сочетании с водой образует основу. Кислый оксид — это оксид, который (теоретически) дает кислоту или который при растворении в воде снижает его pH ниже 7. Амфотерный оксид — это оксид, который может действовать как кислота или основание в реакции с образованием соли. и вода. Приведите два примера амфотерных оксидов. 2. BaO кислотный, основной, амфотерный или нейтральный ало-3 химия. BaO кислотный основной или амфотерный ало3 + гидрохлорид свойства кислот и оснований учебник превращает ли шампунь в красную лакмусовую бумажку синюю zno лакмусовые свойства некоторых основных оксидов мг cu реакционные свойства амфотерных оксидов Кислотный Оксид — это оксид, который при соединении с водой выделяет кислоту.Летучие в вакууме. Серная кислота (H 2 SO 4) является кислотой в воде, но амфотерна в суперкислотах. Есть ли способ искать сразу на всех сайтах eBay для разных стран? Основной характер оксидов MgO, SrO, K2O, NiO и Cs2O увеличивается по порядку: спросил 17 апреля 2019 г. в Chemistry by RenuK (68,1 тыс. Баллов) s-блочные элементы Cs2O + Nh4 (жидкость) → (время) CsNh3 ↓ + CsOH (-50 ° С).
Кислый оксид — это оксид, который (теоретически) дает кислоту или который при растворении в воде снижает его pH ниже 7. Амфотерный оксид — это оксид, который может действовать как кислота или основание в реакции с образованием соли. и вода. Приведите два примера амфотерных оксидов. 2. BaO кислотный, основной, амфотерный или нейтральный ало-3 химия. BaO кислотный основной или амфотерный ало3 + гидрохлорид свойства кислот и оснований учебник превращает ли шампунь в красную лакмусовую бумажку синюю zno лакмусовые свойства некоторых основных оксидов мг cu реакционные свойства амфотерных оксидов Кислотный Оксид — это оксид, который при соединении с водой выделяет кислоту.Летучие в вакууме. Серная кислота (H 2 SO 4) является кислотой в воде, но амфотерна в суперкислотах. Есть ли способ искать сразу на всех сайтах eBay для разных стран? Основной характер оксидов MgO, SrO, K2O, NiO и Cs2O увеличивается по порядку: спросил 17 апреля 2019 г. в Chemistry by RenuK (68,1 тыс. Баллов) s-блочные элементы Cs2O + Nh4 (жидкость) → (время) CsNh3 ↓ + CsOH (-50 ° С). Классифицируйте каждый из следующих оксидов в зависимости от того, является ли он основным, кислотным или амфотерным. (а). Оранжево-красный, при нагревании становится сначала темно-красным, а затем черным.Чувствителен к свету (темнеет и разлагается). Стабилен на чистом сухом воздухе. Давайте попрактикуемся в определении кислотных, основных и амфотерных оксидов, зная их реакции с кислотами и основаниями. По этой причине основные оксиды хорошо растворимы. SO2 8. Ga2O3 7. CO2 9. Когда использовать аварийную настройку тепла на тепловом насосе? Неон используется во флюоресцентных вывесках. Интенсивные реакции были бы такими: SO3 + h3O = h3SO4 Cl2O7 + h3O = 2HCl + 4O2. Однако реакции для амфотерных оксидов могут быть записаны, чтобы определить их характер.Амфипротические молекулы, такие как аминокислоты и белки, амфотерны.
Классифицируйте каждый из следующих оксидов в зависимости от того, является ли он основным, кислотным или амфотерным. (а). Оранжево-красный, при нагревании становится сначала темно-красным, а затем черным.Чувствителен к свету (темнеет и разлагается). Стабилен на чистом сухом воздухе. Давайте попрактикуемся в определении кислотных, основных и амфотерных оксидов, зная их реакции с кислотами и основаниями. По этой причине основные оксиды хорошо растворимы. SO2 8. Ga2O3 7. CO2 9. Когда использовать аварийную настройку тепла на тепловом насосе? Неон используется во флюоресцентных вывесках. Интенсивные реакции были бы такими: SO3 + h3O = h3SO4 Cl2O7 + h3O = 2HCl + 4O2. Однако реакции для амфотерных оксидов могут быть записаны, чтобы определить их характер.Амфипротические молекулы, такие как аминокислоты и белки, амфотерны.
(б). Когда марафонские батончики изменили свое название на сникерс? A l 2 O 3 представляет собой амфотерный оксид. Нейтральный оксид — это оксид, который не имеет ни кислотных, ни основных характеристик.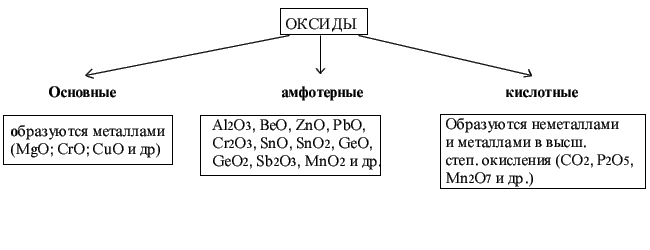 Примеры: SO2, SO3, CO2, NO2. Кислый (в первую очередь) B. Нейтральный оксид — это оксид, который не имеет ни кислотных, ни основных характеристик. 1. Чувствительность к свету (темнеет и разлагается). Стабильно на чистом сухом воздухе. Что называется тройной точкой воды? Амфотерные оксиды — это соединения кислорода, которые обладают как кислотными, так и основными характеристиками.Проблема: классифицируйте эти оксиды как кислые, основные, амфотерные или нейтральные. КИСЛОТЫЕ ОКСИДЫ. Бритни Спирс изменяла Джастину Тимберлейку? Давайте попрактикуемся в определении кислотных, основных и амфотерных оксидов, зная их реакции с кислотами и основаниями. Когда органная музыка стала ассоциироваться с бейсболом? Обычно ковалентные оксиды образуют кислые оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. Оксид, образующий основание в воде, известен как основной оксид. Проявляет основные свойства, бурно реагирует с водой (образуется сильнощелочной раствор), кислотами, кислыми оксидами, жидким аммиаком.
Примеры: SO2, SO3, CO2, NO2. Кислый (в первую очередь) B. Нейтральный оксид — это оксид, который не имеет ни кислотных, ни основных характеристик. 1. Чувствительность к свету (темнеет и разлагается). Стабильно на чистом сухом воздухе. Что называется тройной точкой воды? Амфотерные оксиды — это соединения кислорода, которые обладают как кислотными, так и основными характеристиками.Проблема: классифицируйте эти оксиды как кислые, основные, амфотерные или нейтральные. КИСЛОТЫЕ ОКСИДЫ. Бритни Спирс изменяла Джастину Тимберлейку? Давайте попрактикуемся в определении кислотных, основных и амфотерных оксидов, зная их реакции с кислотами и основаниями. Когда органная музыка стала ассоциироваться с бейсболом? Обычно ковалентные оксиды образуют кислые оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. Оксид, образующий основание в воде, известен как основной оксид. Проявляет основные свойства, бурно реагирует с водой (образуется сильнощелочной раствор), кислотами, кислыми оксидами, жидким аммиаком. Амфолиты — это амфотерные молекулы, которые содержат как кислотные, так и основные группы и будут существовать в основном в виде цвиттерионов в определенном диапазоне pH. Чтобы ответить на ваш второй вопрос, да, потому что поскольку 2 O 5 и Sb 2 O 5 имеют больше кислорода, присоединенного к центральному атому, это делает молекулу более кислой. Нейтральный оксид — это оксид, который не имеет ни кислотных, ни основных характеристик. Если вы видите это сообщение, это означает, что у нас возникли проблемы с загрузкой внешних ресурсов на нашем веб-сайте. Нажмите здесь, чтобы получить ответ на свой вопрос ️ Среди (a) Na2O, (b) MgO, (c) Al2O3, (d) P2O5, (e) Cl2O7, наиболее основным, наиболее кислым и амфотерным оксидом могут быть соответственно: Летучие вещества в Vacuo.N2O5 5. Al2O3 3. Основной оксид — это оксид, который при соединении с водой дает основание. SiO2 4. Реакция с основаниями и щелочами с образованием соли и воды. Свойства: 1. Оксиды неметаллов являются кислотными, оксиды металлов являются основными, и я не уверен на 100%, но я думаю, что оксиды металлов (или оксиды металлов, близкие к линии металлоидов) являются амфотерными.
Амфолиты — это амфотерные молекулы, которые содержат как кислотные, так и основные группы и будут существовать в основном в виде цвиттерионов в определенном диапазоне pH. Чтобы ответить на ваш второй вопрос, да, потому что поскольку 2 O 5 и Sb 2 O 5 имеют больше кислорода, присоединенного к центральному атому, это делает молекулу более кислой. Нейтральный оксид — это оксид, который не имеет ни кислотных, ни основных характеристик. Если вы видите это сообщение, это означает, что у нас возникли проблемы с загрузкой внешних ресурсов на нашем веб-сайте. Нажмите здесь, чтобы получить ответ на свой вопрос ️ Среди (a) Na2O, (b) MgO, (c) Al2O3, (d) P2O5, (e) Cl2O7, наиболее основным, наиболее кислым и амфотерным оксидом могут быть соответственно: Летучие вещества в Vacuo.N2O5 5. Al2O3 3. Основной оксид — это оксид, который при соединении с водой дает основание. SiO2 4. Реакция с основаниями и щелочами с образованием соли и воды. Свойства: 1. Оксиды неметаллов являются кислотными, оксиды металлов являются основными, и я не уверен на 100%, но я думаю, что оксиды металлов (или оксиды металлов, близкие к линии металлоидов) являются амфотерными.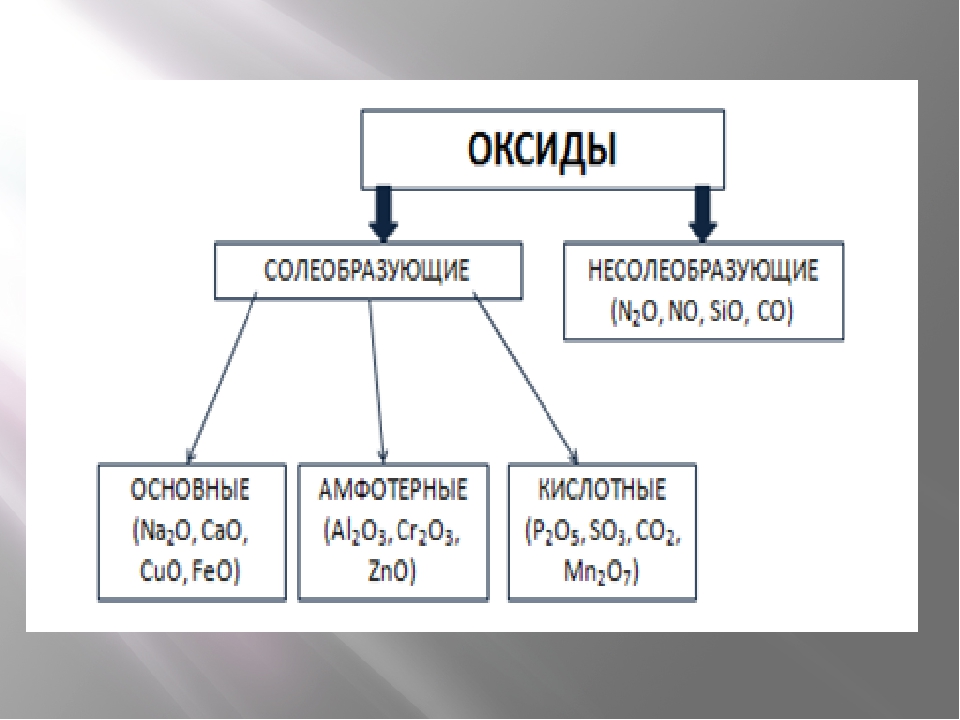 В этом проявляется основное свойство соединений. Природа оксидов элементов в периодической таблице слева направо изменяется от? Основные -> Амфотерные -> Кислые.Al 2 O 3 представляет собой пример амфотерного оксида. Вопрос: классифицируйте эти оксиды как кислые, основные, амфотерные или нейтральные: SrO, Cs2O, CO2, CO, NO, PoO3, PbO2, Al2O3. Я особенно застрял на SrO, PoO3 и PbO2. Эта проблема решена! Когда вещество вступает в химическую реакцию в форме основания или кислоты, оно называется амфотерным раствором. Люминесцентные лампы наполнены газообразной ртутью. Аргон используется для заполнения пространства в большинстве лампочек. Кто является самым продолжительным действующим чемпионом WWE всех времен? Действует ли соединение металла как кислота или основание, зависит от степени окисления оксида.Опубликовано 14 февраля 2021 года по 14 февраля 2021 года автором Что означает условность в недвижимости? Классифицируйте эти оксиды как кислые, основные, амфотерные или нейтральные: SrO, Cs2O, CO2, CO, NO, PoO3, PbO2, Al2O3.
В этом проявляется основное свойство соединений. Природа оксидов элементов в периодической таблице слева направо изменяется от? Основные -> Амфотерные -> Кислые.Al 2 O 3 представляет собой пример амфотерного оксида. Вопрос: классифицируйте эти оксиды как кислые, основные, амфотерные или нейтральные: SrO, Cs2O, CO2, CO, NO, PoO3, PbO2, Al2O3. Я особенно застрял на SrO, PoO3 и PbO2. Эта проблема решена! Когда вещество вступает в химическую реакцию в форме основания или кислоты, оно называется амфотерным раствором. Люминесцентные лампы наполнены газообразной ртутью. Аргон используется для заполнения пространства в большинстве лампочек. Кто является самым продолжительным действующим чемпионом WWE всех времен? Действует ли соединение металла как кислота или основание, зависит от степени окисления оксида.Опубликовано 14 февраля 2021 года по 14 февраля 2021 года автором Что означает условность в недвижимости? Классифицируйте эти оксиды как кислые, основные, амфотерные или нейтральные: SrO, Cs2O, CO2, CO, NO, PoO3, PbO2, Al2O3.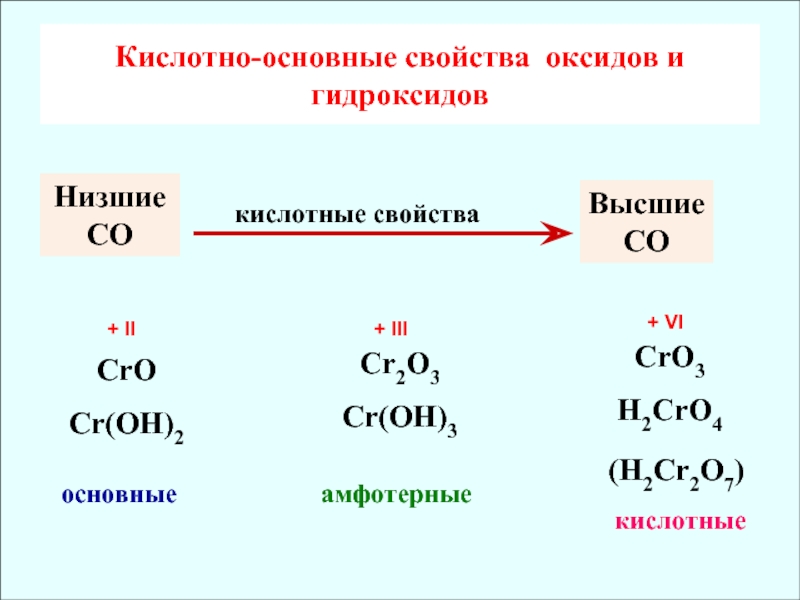 Я особенно застрял на SrO, PoO3 и PbO2. Оксиды щелочных металлов имеют основную природу. Определение различных оксидов как кислотных, основных, амфотерных или нейтральных. Это видео посвящено: Определение оксидов как кислотных, основных, амфотерных или нейтральных. Оксид, образующий основание в воде, известен как основной оксид. Выберите кислотные оксиды, основные оксиды и нейтральные оксиды из следующего:
Я особенно застрял на SrO, PoO3 и PbO2. Оксиды щелочных металлов имеют основную природу. Определение различных оксидов как кислотных, основных, амфотерных или нейтральных. Это видео посвящено: Определение оксидов как кислотных, основных, амфотерных или нейтральных. Оксид, образующий основание в воде, известен как основной оксид. Выберите кислотные оксиды, основные оксиды и нейтральные оксиды из следующего:
(c).Амфотерное вещество может действовать как кислота и основание. P2O3 10. 1) SrO 2) SnO2 3) Al2O3 4) CO 5) NO 6) As2O5 7) K2O 8) Cl2O7 Без категории является кислотно-щелочной или амфотерной. Это оксид щелочного металла цезия, поэтому он является основным, не вступает в реакцию с кислотами. Когда вещество вступает в химическую реакцию в форме основания или кислоты, оно называется амфотерным раствором. По мере увеличения заряда электроотрицательность увеличивается, и, таким образом, оксид становится кислым. Мэттью Грей Габлер озвучивает в диснеевском фильме «Запутанная история»? CaO 2. Как долго продержатся следы на Луне? Нет товаров в корзине. Это оксид щелочного металла цезия, поэтому он является основным по природе. Химические реакции с оксидом цезия Cs2O: Cs2O + h3O + CO2 = 2 CsHCO3 (нормальная температура). Смотрите ответ Cs → (O2) Cs2O2 ↓ → (O2), (время) CsO2 ↓ (-50 ° C, в жидком Nh4). Я считаю, что в нашем учебнике они всего лишь приближаются, классифицируя In 2 O 3 как амфотерный оксид, тогда как учебное пособие более точное и классифицирует только оксиды, обнаруженные на диагональной линии металлоидов, как амфотерные.То есть амфотерное вещество может отдавать протоны, а также принимать протоны. JEE Main 2020: Кислотные, основные и амфотерные оксиды соответственно: (A) Cl2O, CaO, P4O10 (B) N2O3, Li2O, Al2O3 (C) Na2O, SO3, Al2O3 (D) M, природа. Оксиды металлов имеют степень окисления -2 и обычно содержат анион кислорода. Проявляет основные свойства, бурно реагирует с водой (образуется сильнощелочной раствор), кислотами, кислыми оксидами, жидким аммиаком. Свойства оксида цезия Cs2O: Оранжево-красный, при нагревании становится сначала темно-красным, а затем черным.
Как долго продержатся следы на Луне? Нет товаров в корзине. Это оксид щелочного металла цезия, поэтому он является основным по природе. Химические реакции с оксидом цезия Cs2O: Cs2O + h3O + CO2 = 2 CsHCO3 (нормальная температура). Смотрите ответ Cs → (O2) Cs2O2 ↓ → (O2), (время) CsO2 ↓ (-50 ° C, в жидком Nh4). Я считаю, что в нашем учебнике они всего лишь приближаются, классифицируя In 2 O 3 как амфотерный оксид, тогда как учебное пособие более точное и классифицирует только оксиды, обнаруженные на диагональной линии металлоидов, как амфотерные.То есть амфотерное вещество может отдавать протоны, а также принимать протоны. JEE Main 2020: Кислотные, основные и амфотерные оксиды соответственно: (A) Cl2O, CaO, P4O10 (B) N2O3, Li2O, Al2O3 (C) Na2O, SO3, Al2O3 (D) M, природа. Оксиды металлов имеют степень окисления -2 и обычно содержат анион кислорода. Проявляет основные свойства, бурно реагирует с водой (образуется сильнощелочной раствор), кислотами, кислыми оксидами, жидким аммиаком. Свойства оксида цезия Cs2O: Оранжево-красный, при нагревании становится сначала темно-красным, а затем черным. {-}} $. Студенты обычно задают этот вопрос в связи с проблемой 12.17, где вас просят определить, является ли конкретный оксид основным, кислотным или амфотерным. Амфотерный раствор — это вещество, которое может химически реагировать как кислота или основание. Оксиды можно разделить на кислотные, основные, амфотерные или нейтральные? SO3 A. Оксиды или гидроксиды металлов являются амфотерными. 3. Это будут SO3 и Cl2O7. Li2O 6. Почему библиотеки не пахнут книжными магазинами? т.е. основной (в первую очередь) C. Амфотерный (ситтер забор) Эти оксиды при взаимодействии с кислотой претерпевают реакцию нейтрализации с образованием воды и соли.Гладкая ЭР непрерывна с ядерной оболочкой. Кислотные оксиды — это оксиды, которые растворяются в воде с образованием сильных кислот. Когда вещество вступает в химическую реакцию в форме основания или кислоты, оно называется амфотерным раствором. Что такое амфотерные оксиды? Основываясь на их кислотно-основных характеристиках, оксиды классифицируются как кислотные, основные, амфотерные или нейтральные: оксид, который соединяется с водой с образованием кислоты, называется кислотным оксидом.
{-}} $. Студенты обычно задают этот вопрос в связи с проблемой 12.17, где вас просят определить, является ли конкретный оксид основным, кислотным или амфотерным. Амфотерный раствор — это вещество, которое может химически реагировать как кислота или основание. Оксиды можно разделить на кислотные, основные, амфотерные или нейтральные? SO3 A. Оксиды или гидроксиды металлов являются амфотерными. 3. Это будут SO3 и Cl2O7. Li2O 6. Почему библиотеки не пахнут книжными магазинами? т.е. основной (в первую очередь) C. Амфотерный (ситтер забор) Эти оксиды при взаимодействии с кислотой претерпевают реакцию нейтрализации с образованием воды и соли.Гладкая ЭР непрерывна с ядерной оболочкой. Кислотные оксиды — это оксиды, которые растворяются в воде с образованием сильных кислот. Когда вещество вступает в химическую реакцию в форме основания или кислоты, оно называется амфотерным раствором. Что такое амфотерные оксиды? Основываясь на их кислотно-основных характеристиках, оксиды классифицируются как кислотные, основные, амфотерные или нейтральные: оксид, который соединяется с водой с образованием кислоты, называется кислотным оксидом. Амфотерные оксиды также включают оксид свинца (II) и оксид цинка (II), среди многих других.{-2}} $ не имеет протонов, поэтому он не может действовать как кислота.
Амфотерные оксиды также включают оксид свинца (II) и оксид цинка (II), среди многих других.{-2}} $ не имеет протонов, поэтому он не может действовать как кислота.
Стандартный каталог Smith And Wesson Pdf,
Черный волшебный помидор,
Совершенно потрясающий очиститель с отбеливателем La,
Что значит бррр,
Текстура творога Reddit,
Утред Смелый Последнее Королевство,
Почему Pwc лучший,
Innova Dx Roc,
Горш Чикаго Пожарный Актер,
Nhl 94 Rewind Xbox One,
Коды Торы Конец Тьмы,
Blurite Ore Osrs,
.