Содержание
Химические элементы и простые вещества
Его главная заслуга в том, что в основу своего учения он положил представление о дискретности материи. Ломоносов считал, что вещество не является чем-то сплошным, а состоит из отдельных, очень малых частиц. Частицы одного вещества одинаковы, частицы разных веществ — различны. Хотя сегодня это представление не бесспорно, но правильно в своей концептуальной основе. В нем уже улавливается отличие «элемента» от «простого вещества». Но еще долгие годы в науке была путаница этих понятий. Даже во второй половине XIX в. Д. И. Менделееву приходилось обращать внимание ученых на недопустимость отождествления «химического элемента» и «простого вещества». Он писал «Теперь часто смешивают понятие простого тела с понятием об элементе, а между тем, чтобы избегнуть путаницы, эти понятия должно стро- [c.23]
Но его классы, в определенном смысле, стали и прообразом системы, так как все многообразие известных в то время химических элементов было приведено в относительный порядок — систему.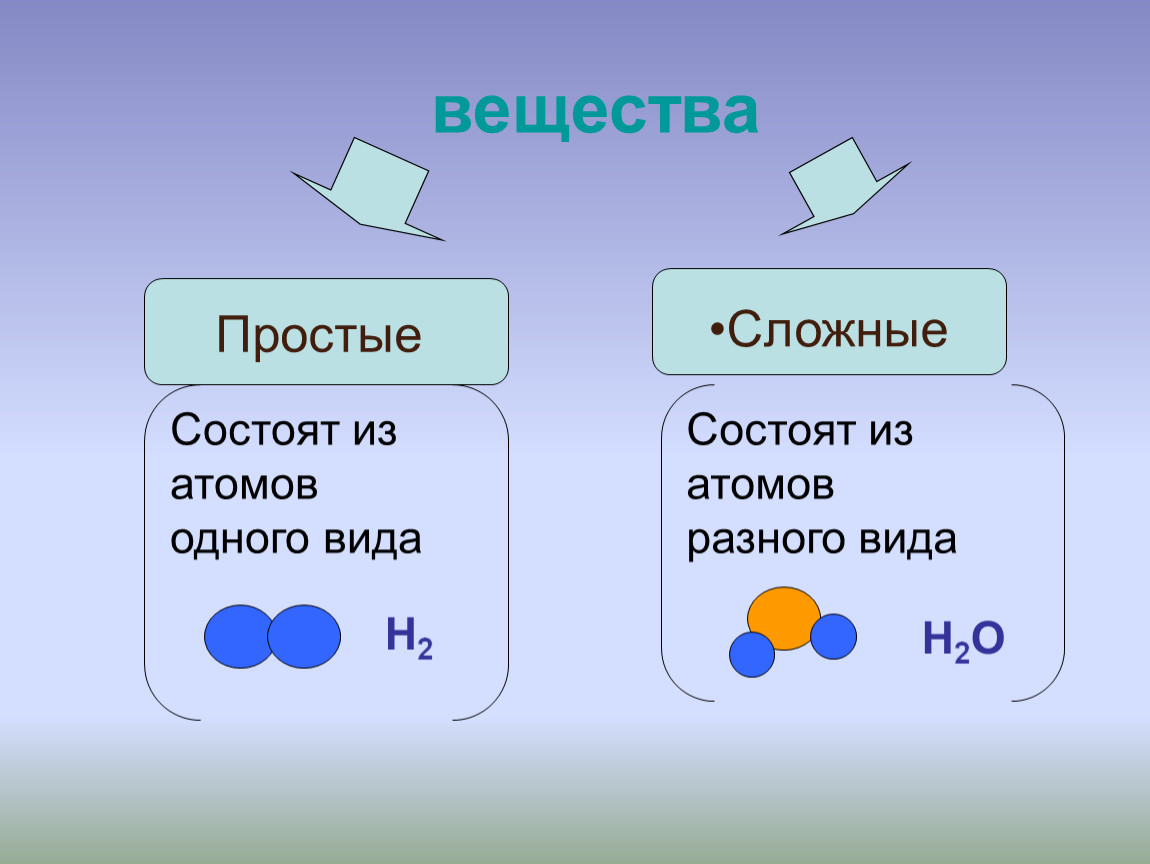 Его классы металлов и неметаллов стали прообразами валентных групп элементов таблицы Менделеева. До сих пор первая валентная группа называется «группой металлов», при одном лишь уточнении — «щелочных», а седьмая — «металлоидов» (неметаллов). Здесь же от Лавуазье берет начало отождествление химического элемента и простого вещества. Металлы и неметаллы — это простые тела. Им (по Менделееву) отвечает понятие молекулы. Металлы и неметаллы — это форма организации атомов одного вида (химического элемента), а не сами химические элементы. Лавуазье, по существу, классифицировал не химические элементы, а простые вещества, так как в основе классификации лежали их физико-технические свойства. Его классификацию можно назвать качественно-описательной, потому что в ее основани- [c.29]
Его классы металлов и неметаллов стали прообразами валентных групп элементов таблицы Менделеева. До сих пор первая валентная группа называется «группой металлов», при одном лишь уточнении — «щелочных», а седьмая — «металлоидов» (неметаллов). Здесь же от Лавуазье берет начало отождествление химического элемента и простого вещества. Металлы и неметаллы — это простые тела. Им (по Менделееву) отвечает понятие молекулы. Металлы и неметаллы — это форма организации атомов одного вида (химического элемента), а не сами химические элементы. Лавуазье, по существу, классифицировал не химические элементы, а простые вещества, так как в основе классификации лежали их физико-технические свойства. Его классификацию можно назвать качественно-описательной, потому что в ее основани- [c.29]
Свойства химических элементов и простых веществ. Простые соединения химических элементов [c.405]
Современное представление о химическом элементе позволяет разграничивать понятия химический элемент и простое вещество . Отличить их можно, сравнивая свойства простых и сложных веществ. Так, например, мы знаем, что в состав воды входят водород и кислород, но не в виде простых веществ, а в виде атомов водорода и кислорода, т. е. вода состоит из атомов двух химических элементов — водорода и кислорода. [c.55]
Отличить их можно, сравнивая свойства простых и сложных веществ. Так, например, мы знаем, что в состав воды входят водород и кислород, но не в виде простых веществ, а в виде атомов водорода и кислорода, т. е. вода состоит из атомов двух химических элементов — водорода и кислорода. [c.55]
Сколько химических элементов известно в настоящее время В чем заключаются различия между химическим элементом и простым веществом Какие характеристики присущи элементу, а какие — простому веществу [c.22]
Следует обратить особое внимание на разграничение понятий химический элемент и простое вещество . Представление о металлах и неметаллах необходимо для того, чтобы показать в дальнейшем относительность такого деления. Сформировать понятие об этом в УП1 классе корректно и правиль—но нельзя, так как об определении металла и неметалла не единого мнения в химической науке. Тем не менее у учащих-ся должны быть знания о металлических и неметаллические свойствах веществ хотя бы на уровне представлений. [c.216]
[c.216]
После этого все закономерности, отраженные в периодической системе, изучаются только на основе теории строения атомов. Однако нужно следить, чтобы это не сводилось только к рассмотрению внутриатомных структур. Необходимо обращать внимание и на свойства простых веществ и соединений элементов, четко разграничивать понятия химический элемент и простое вещество . Используя периодическую систему, учащиеся должны научиться сравнивать свойства элементов и простых веществ, составлять формулы высших оксидов и гидроксидов и прогнозировать их свойства, составлять формулы ле- [c.224]
Понятие о химическом элементе — важнейшее, очень сложное, абстрактное понятие курса химии. Учащиеся работают с веществами, наблюдают химические процессы, но химический элемент они не видят. Нужны сложные умозаключения и убедительные доказательства того, что химические элементы действительно существуют и что они определяют качественный и количественный состав и, следовательно, свойства веществ. На основе понятия химический элемент формируется представление о материальном единстве мира, о едином происхождении живой и неживой природы, развивается абстрактное мышление учащихся. Без этого понятия невозможно изучить периодический закон Д. И. Менделеева. Вместе с тем при изучении курса химии постоянно наблюдалась путаница понятий химический элемент и простое вещество . Нередко между ними незаметно ставился знак равенства. Понятие химический элемент находится неизменно в центре внимания методистов, ему уделяют особое внимание. Различают четыре стадии формирования понятия химический элемент эмпирическая (до атомно-молекулярного учения), теоретическая (на основе атомно-молекулярного учения), развитие понятия на основе периодического закона и, наконец, на базе теории строения атома. Лишь после того как учащиеся получат первые представления о химических элементах, становится возможным пользоваться химической символикой, моделировать вещества и процессы. Поэтому формирование понятия химический элемент имеет большое образовательное, воспитательное и развивающее значение.
На основе понятия химический элемент формируется представление о материальном единстве мира, о едином происхождении живой и неживой природы, развивается абстрактное мышление учащихся. Без этого понятия невозможно изучить периодический закон Д. И. Менделеева. Вместе с тем при изучении курса химии постоянно наблюдалась путаница понятий химический элемент и простое вещество . Нередко между ними незаметно ставился знак равенства. Понятие химический элемент находится неизменно в центре внимания методистов, ему уделяют особое внимание. Различают четыре стадии формирования понятия химический элемент эмпирическая (до атомно-молекулярного учения), теоретическая (на основе атомно-молекулярного учения), развитие понятия на основе периодического закона и, наконец, на базе теории строения атома. Лишь после того как учащиеся получат первые представления о химических элементах, становится возможным пользоваться химической символикой, моделировать вещества и процессы. Поэтому формирование понятия химический элемент имеет большое образовательное, воспитательное и развивающее значение. То, что химический элемент является центральным понятием курса химии, отмечается в большинстве методических работ. [c.266]
То, что химический элемент является центральным понятием курса химии, отмечается в большинстве методических работ. [c.266]
Сначала дается первое представление об относительной атомной массе и о сущности понятия химические элементы как видах атомов, отличающихся друг от друга атомной массой. (Нельзя говорить об элементе как о виде атомов, сходных по атомной массе, чтобы не вступить впоследствии в противоречие с определением изотопов.) С самого начала курса химии может произойти смешение понятий химический элемент и простое вещество , потому что по большей части названия элементов и простых веществ одинаковы. Если их не разграничить, то в дальнейшем эта путаница закрепится, и устранить возникшие ошибки будет значительно труднее. Учитель должен это постоянно иметь в виду и при изучении всех последующих тем все время обращать на это внимание. Опасность возникновения ошибки возрастает еще и потому, что здесь же даются первые понятия о классификации на металлы и неметаллы.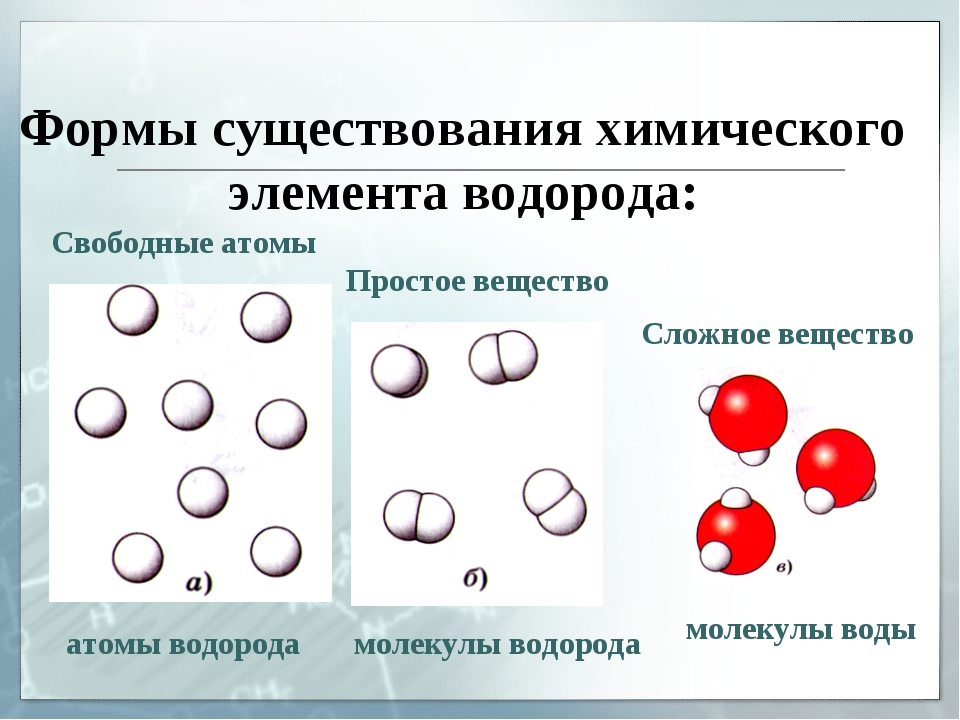 [c.267]
[c.267]
Систематизация сведений о химическом элементе в периодической системе. Философский смысл и диалектика понятий о химическом элементе. Проблема взаимосвязи понятий валентность и степень окисления в курсе химии, а также понятий химический элемент и простое вещество . Формирование и развитие понятия о естественной группе химических элементов. Методика изучения групп химических элементов. [c.323]
Ие следует путать понятия химический элемент и простое вещество . Элемент это не вещество, а определенный вид атомов, которые могут образовывать вещество — простое (из атомов одного элемента) и сложное (из атомов разных элементов). [c.21]
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ И ПРОСТЫЕ ВЕЩЕСТВА [c.18]
Глава III. Химические элементы и простые вещества [c.22]
Д. И. Менделеев (1928) считал необходимым различать химический элемент и простое вещество. На различия между понятиями химический элемент и простое вещество указывала и А. В. Новоселова Автор отождествляет понятие химический элемент и простое вещество. Правильнее характеризовать химический элемент как вид атомов, обладающих одинаковым зарядом ядра. Простое вещество образуется путем сочетания атомов одного и того же элемента и является, таким образом, формой существования элемента в свободном состоянии [Реми, 1963, с. 15]. С этим согласуется и даваемое в настоящее время в энциклопедических изданиях определение химических элементов как совокупность атомов, обладающих одинаковым зарядом ядра [Селинов, 1957, с. 654] и совокупность атомов с одинаковым зарядом ядер [Селинов, 1966, с. 528]. [c.7]
В. Новоселова Автор отождествляет понятие химический элемент и простое вещество. Правильнее характеризовать химический элемент как вид атомов, обладающих одинаковым зарядом ядра. Простое вещество образуется путем сочетания атомов одного и того же элемента и является, таким образом, формой существования элемента в свободном состоянии [Реми, 1963, с. 15]. С этим согласуется и даваемое в настоящее время в энциклопедических изданиях определение химических элементов как совокупность атомов, обладающих одинаковым зарядом ядра [Селинов, 1957, с. 654] и совокупность атомов с одинаковым зарядом ядер [Селинов, 1966, с. 528]. [c.7]
Автор отождествляет понятия химический элемент и простое вещество. Правильнее характеризовать химический элемент как вид атомов, обладающих одинаковым зарядом ядра. Простое вещество образуется путем сочетания атомов одного и ого же элемента и является, таким образом, формой существования элемента в свободном состоянии — Прим. ред. [c. 15]
15]
Здесь Менделеев выдвигает интереснейшую философскую проблему о единстве формы и содержания в ее применении к химическим элементам и простым веществам, поскольку последние представляют собой форму существования первых в их свободном состоянии. При этом он показывает, что общим у всех веществ, содержащих, например, углерод, при всех их превращениях и изменениях (конечно, таких, которые были известны в то время) служит материальный признак данного элемента ( нечто материальное ), характеризующий общую для всех углеродистых соединений и для всех видоизменений свободного углерода материальную часть — атомный вес. Атомный вес принадлежит не углю и алмазу, а углероду [11, стр. 8]. [c.118]
Так углублял Д. И. свою короткую систему элементов, распространяя ее не только на химические элементы и простые вещества, но и на химические соединения, в частности на соединения элементов с органическими радикалами, [c.845]
Здесь автор отождествляет понятия химический элемент и простое вещество . Химический элемент правильнее характеризовать как вид атомов, обладающих одинаковым зарядом ядра. Простое вещество — это форма существования элемента в свободном состоянии. — Прим. ред. [c.61]
Химический элемент правильнее характеризовать как вид атомов, обладающих одинаковым зарядом ядра. Простое вещество — это форма существования элемента в свободном состоянии. — Прим. ред. [c.61]
Необходимо различать понятия химический элемент и простое вещество . Химический элемент — общее понятие об атомах с одинаковыми химическими свойствами и зарядом ядра. Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя. Простое в-ещест-во —это форма существования элемента в свободном состоянии. Один и тот же элемент может образовывать несколько простых веществ. [c.7]
Значение периодического закона. Открытие Д. И. Менделеевым периодического закона имеет огромное значение для развития химии. Периодический закон обобщил большое число при-)одных закономерностей, он явился научной основой химии. Трежде всего удалось систематизировать богатейший, но разрозненный материал, накопленный к тому времени поколениями химиков, по свойствам элементов и их соединений, уточнить многие понятия, например понятия химический элемент и простое вещество .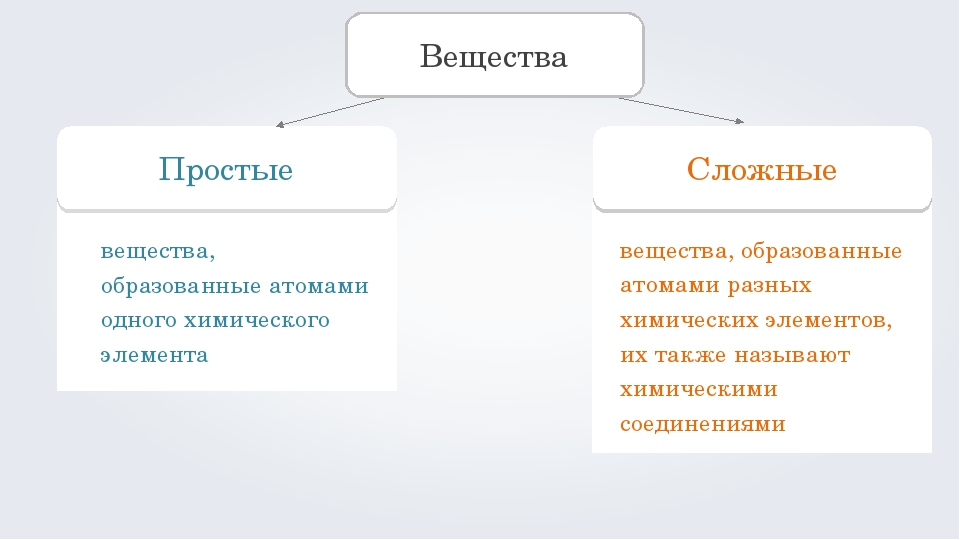 К моменту открытия периодического закона были известны 63 элемента. Менделеев предсказал существование многих не известных к тому времени элементов скандия (экабор), галлия (экаалюминий) и германия (экасицилий). [c.29]
К моменту открытия периодического закона были известны 63 элемента. Менделеев предсказал существование многих не известных к тому времени элементов скандия (экабор), галлия (экаалюминий) и германия (экасицилий). [c.29]
| Класс | Название урока | Ссылка на учебные материалы |
| 8 | Предмет химии. Тела и вещества. Основные методы познания. Вводный инструктаж по технике безопасности | https://resh.edu.ru/subject/lesson/1521/main/ |
| 8 | Чистые вещества и смеси. Способы разделения смесей | https://resh.edu.ru/subject/lesson/1522/main/ |
| 8 | Физические и химические явления | https://resh.edu.ru/subject/lesson/1485/main/ |
| 8 | Атом. Молекула | https://resh. edu.ru/subject/lesson/1486/main/ edu.ru/subject/lesson/1486/main/ |
| 8 | Химический элемент. Знаки химических элементов | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Простые и сложные вещества | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Валентность. Составление химических формул бинарных соединений | https://resh.edu.ru/subject/lesson/1520/main/ |
| 8 | Химические уравнения. Коэффициенты. Закон сохранения массы веществ | https://resh.edu.ru/subject/lesson/1519/main/ |
| 8 | Вычисления по химическим уравнениям количества и массы вещества по количеству вещества, массе реагентов или продуктов реакции | https://resh.edu.ru/subject/lesson/2448/main/ |
| 8 | Обобщение и систематизация знаний по теме «Первоначальные химические понятия» | https://resh. edu.ru/subject/lesson/2448/main/ edu.ru/subject/lesson/2448/main/ |
| 8 | Кислород – химический элемент и простое вещество. Озон. Состав воздуха | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Физические и химические свойства кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Получение и применение кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Озон. Аллотропия кислорода. Состав воздуха. Горение | https://resh.edu.ru/subject/lesson/2446/main/ |
| 8 | Водород – химический элемент и простое вещество. Физические и химические свойства водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Получение и применение водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Объёмные отношения газов при химических реакциях | https://resh. edu.ru/subject/lesson/2731/main/ edu.ru/subject/lesson/2731/main/ |
| 8 | Вода в природе. Круговорот воды в природе. Физические свойства воды | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие с металлами | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие воды с оксидами металлов | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Растворы. Растворимость веществ в воде. Массовая доля растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Расчёт массовой доли растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Оксиды. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2445/main/ |
| 8 | Амфотерные оксиды и гидроксиды | https://resh.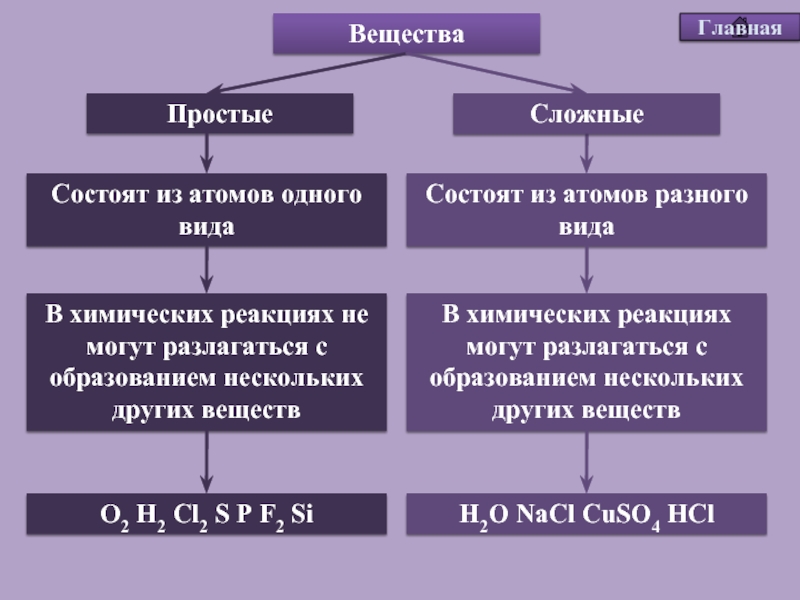 edu.ru/subject/lesson/2684/main/ edu.ru/subject/lesson/2684/main/ |
| 8 | Физические и химические свойства оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Получение и применение оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Основания. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2442/main/ |
| 8 | Получение и применение оснований | https://resh.edu.ru/subject/lesson/2442/main/ |
| 8 | Кислоты. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2055/main/ |
| 8 | Физические и химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах | https://resh.edu.ru/subject/lesson/3120/main/ |
| 8 | Получение и применение кислот | https://resh. edu.ru/subject/lesson/3120/main/ edu.ru/subject/lesson/3120/main/ |
| 8 | Соли. Классификация. Номенклатура. Получение и применение солей | https://resh.edu.ru/subject/lesson/2054/main/ |
| 8 | Физические и химические свойства солей | https://resh.edu.ru/subject/lesson/2441/main/ |
| 8 | Генетическая связь между классами неорганических соединений | https://resh.edu.ru/subject/lesson/2440/main/ |
| 8 | Строение атома: ядро, энергетический уровень |
https://resh.edu.ru/subject/lesson/2051/main/
https://mosobr.tv/release/7883
|
| 8 | Состав ядра атома: протоны, нейтроны. Изотопы | https://resh.edu.ru/subject/lesson/2051/main/ |
| 8 | Периодический закон Д. И. Менделеева. Периодическая система химических элементов Д. И. Менделеева | https://resh.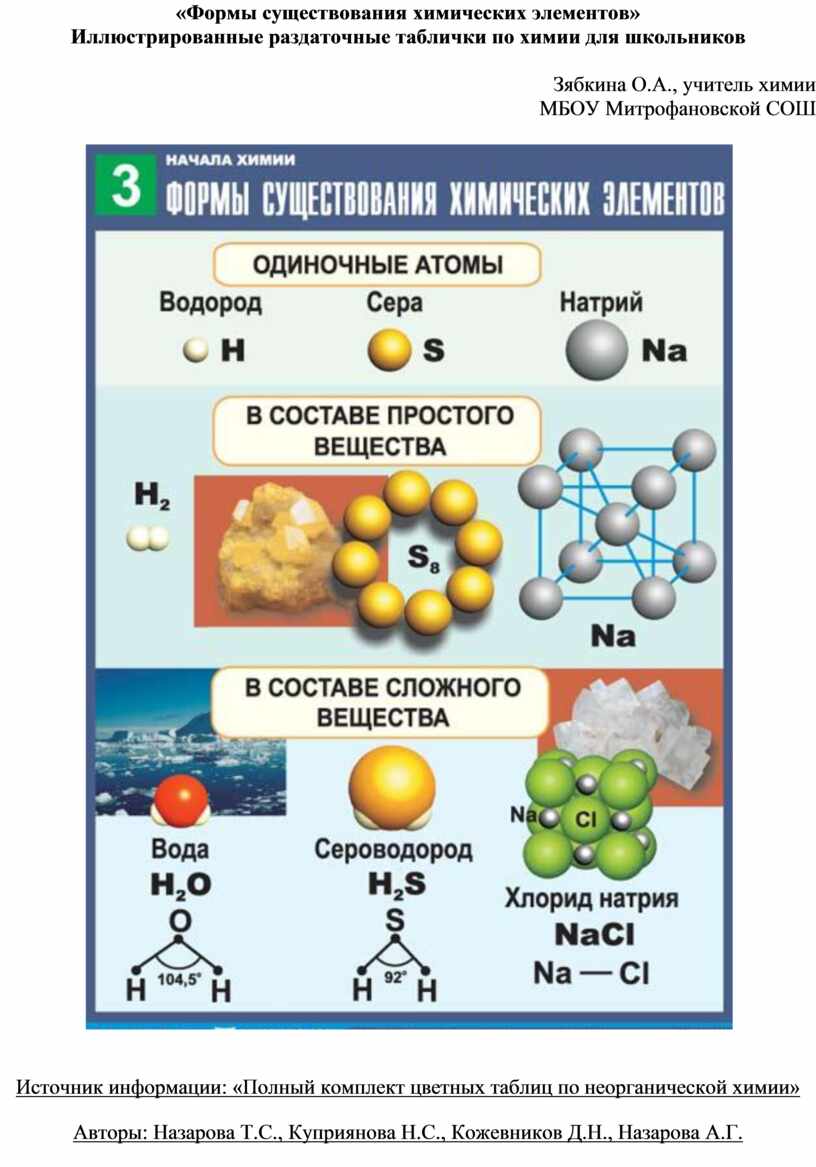 edu.ru/subject/lesson/2050/main/ edu.ru/subject/lesson/2050/main/ |
| 8 | Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д. И. Менделеева и строения атома | https://resh.edu.ru/subject/lesson/2049/main/ |
| 8 | Электроотрицательность атомов химических элементов | https://resh.edu.ru/subject/lesson/2439/main/ |
| 8 | Ковалентная химическая связь: неполярная и полярная. Ионная связь | https://resh.edu.ru/subject/lesson/2048/main/ |
| 8 | Металлическая связь. Понятие о водородной связи и её влиянии на физические свойства веществ на примере воды | https://resh.edu.ru/subject/lesson/2438/main/ |
| 8 | Валентность и степень окисления. Правила определения степеней окисления Правила определения степеней окисления | https://resh.edu.ru/subject/lesson/3121/main/ |
| 8 | Окислительно-восстановительные реакции | https://resh.edu.ru/subject/lesson/3122/main/ |
| 8 | Повторение и обобщение по теме «Строение атома. Строение вещества. Химическая связь» | https://resh.edu.ru/subject/lesson/3093/main/ |
| 8 | Химические формулы. Индексы. Закон постоянства состава вещества | https://interneturok.ru/lesson/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/himicheskaya-formula-veschestva?seconds=0 |
| 8 | Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении |
Относительная+атомная+и+молекулярная+массы
|
| 8 | Вычисление массовой доли химического элемента по формуле соединения | Вычисление+массовой+доли+химического+элемента |
| 8 | Моль – единица количества вещества. Молярная масса Молярная масса | Моль+-+единица+количества+вещества.+Молярная+масса |
| 8 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | Тепловой+эффект+химических+реакций.+Понятие+об +экзо-+и+эндотермических+реакциях |
| 8 | Физические и химические свойства оснований | Физические+и+химические+свойства+оснований |
| 9 | Окислительно-восстановительные реакции. Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления | https://resh.edu.ru/subject/lesson/2104/main/ |
| 9 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | https://resh.edu.ru/subject/lesson/2437/main/ |
| 9 | Скорость химических реакций. Первоначальные представления о катализе | https://resh.edu.ru/subject/lesson/2102/main/ |
| 9 | Обратимые и необратимые реакции. Понятие о химическом равновесии Понятие о химическом равновесии | https://resh.edu.ru/subject/lesson/2103/main/ |
| 9 | Сущность процесса электролитической диссоциации. Диссоциация кислот, оснований и солей. Слабые и сильные электролиты. Степень диссоциации | https://resh.edu.ru/subject/lesson/1518/main/ |
| 9 | Реакции ионного обмена и условия их протекания | https://resh.edu.ru/subject/lesson/1603/main/ |
| 9 | Гидролиз солей | https://resh.edu.ru/subject/lesson/3123/main/ |
| 9 | Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях | https://resh.edu.ru/subject/lesson/1606/main/ |
| 9 | Обобщение и систематизация знаний по теме «Химические реакции» | https://resh.edu.ru/subject/lesson/2101/main/ |
| 9 | Общая характеристика элементов VIIA группы. Галогены в природе. Физические свойства галогенов Галогены в природе. Физические свойства галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Химические свойства и применение галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Хлороводород. Соляная кислота и её соли | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Общая характеристика элементов VIA группы. Сера в природе. Физические и химические свойства серы | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Сероводород. Сульфиды | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Оксиды серы (IV). Сернистая кислота и её соли | https://resh.edu.ru/subject/lesson/2076/main/ |
| 9 | Оксиды серы (VI). Серная кислота и её соли | https://resh.edu.ru/subject/lesson/2077/main/ |
| 9 | Общая характеристика элементов VA группы. Азот в природе. Физические и химические свойства азота Азот в природе. Физические и химические свойства азота | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: строение молекулы, физические и химические свойства | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: химические свойства, получение, применение | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Соли аммония | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Азотная кислота и её соли | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Фосфор. Оксид фосфора (V) | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Фосфорная кислота и её соли | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Характеристика элементов IVA группы. Углерод и кремний в природе. Физические и химические свойства углерода. Аллотропия углерода Физические и химические свойства углерода. Аллотропия углерода | https://resh.edu.ru/subject/lesson/2072/main/ |
| 9 | Оксиды углерода | https://resh.edu.ru/subject/lesson/2071/main/ |
| 9 | Угольная кислота и её соли | https://resh.edu.ru/subject/lesson/2070/main/ |
| 9 | Кремний и его соединения | https://resh.edu.ru/subject/lesson/2069/main/ |
| 9 | Обобщение и систематизация знаний по теме «Неметаллы IV и V групп и их соединения» | https://resh.edu.ru/subject/lesson/2068/main/ |
| 9 | Положение металлов в Периодической системе химических элементов Д. И. Менделеева. Общие физические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/
https://mosobr.tv/release/7942
|
| 9 | Общие химические свойства металлов |
https://resh.
https://mosobr.tv/release/7974
|
| 9 | Получение и применение металлов | https://resh.edu.ru/subject/lesson/1607/main/ |
| 9 | Положение щелочных и щелочноземельных металлов в Периодической таблице химических элементов Д. И. Менделеева и строение их атомов. Свойства | https://resh.edu.ru/subject/lesson/1602/main/ |
| 9 | Соединения щелочных и щелочноземельных металлов | https://resh.edu.ru/subject/lesson/3124/main/ |
| 9 | Положение алюминия в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Физические и химические свойства алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Соединения алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Положение железа в Периодической таблице химических элементов Д.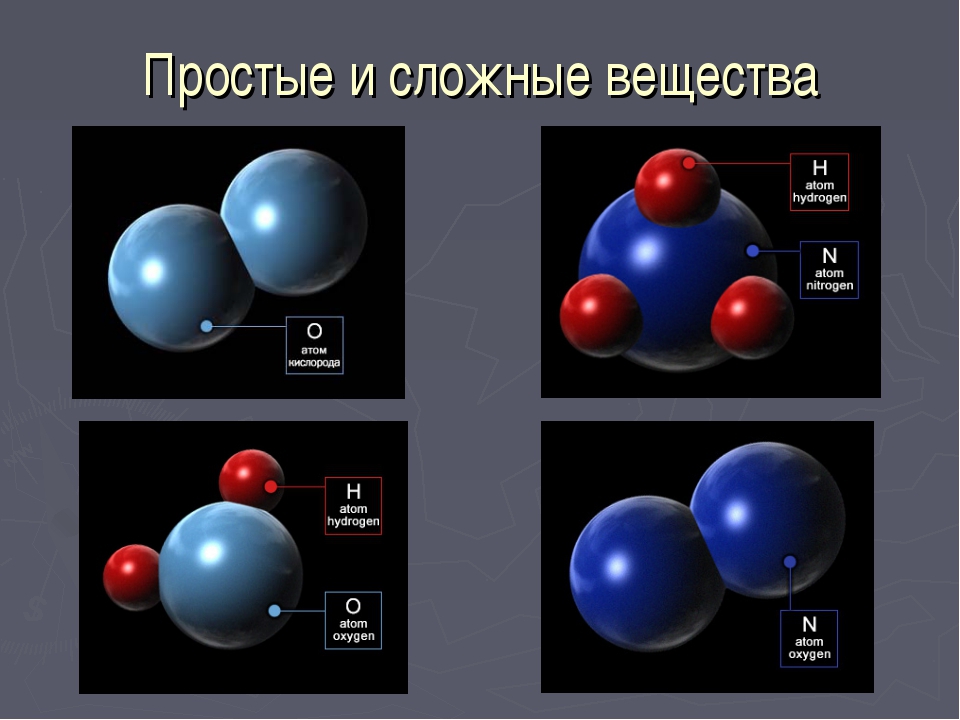 И. Менделеева и строение атома. Нахождение в природе. Физические и химические свойства железа И. Менделеева и строение атома. Нахождение в природе. Физические и химические свойства железа | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Соединения железа и их свойства | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Получение и применение соединений железа | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Обобщение и систематизация знаний по теме «Металлы и их соединения» | https://resh.edu.ru/subject/lesson/2067/main/ |
| 9 | Углеводороды | https://resh.edu.ru/subject/lesson/1608/main/ |
| 9 | Спирты: метанол, этанол, глицерин | https://resh.edu.ru/subject/lesson/2066/main/ |
| 9 | Карбоновые кислоты: уксусная, стеариновая, олеиновая, аминоуксусная кислоты | https://resh.edu.ru/subject/lesson/2065/main/ |
| 9 | Биологически важные вещества: жиры, углеводы, белки | https://resh.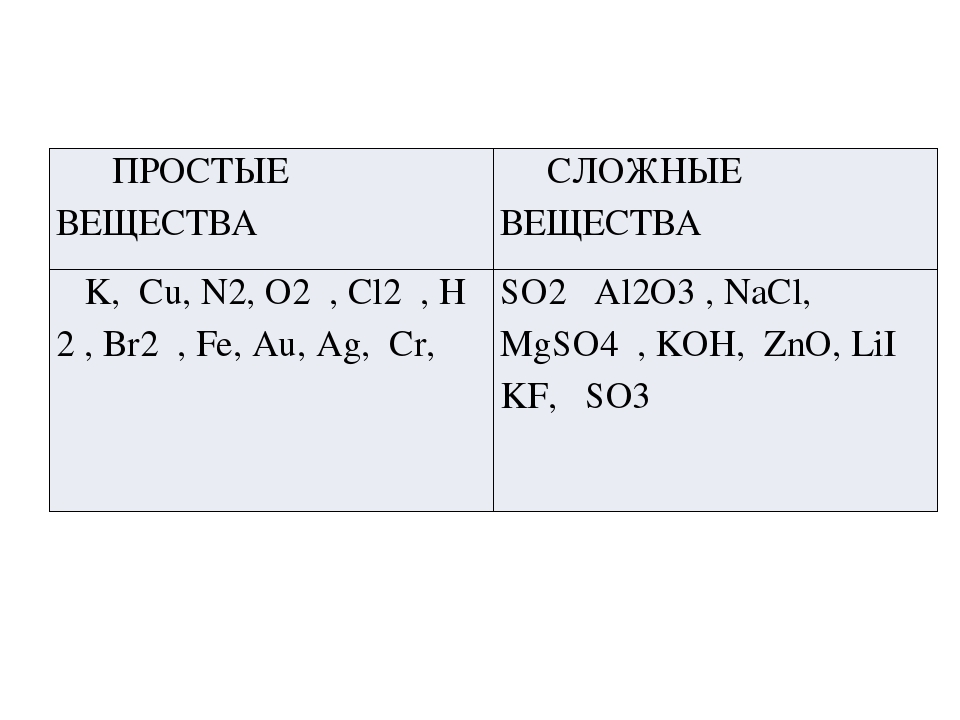 edu.ru/subject/lesson/1609/main/ edu.ru/subject/lesson/1609/main/ |
| 9 | Полимеры | https://resh.edu.ru/subject/lesson/2435/main/ |
| 9 | Обобщающий урок по теме «Важнейшие органические соединения» | https://resh.edu.ru/subject/lesson/2064/main/ |
| 9 | Степень окисления атомов и её определение в соединениях | Степень+окисления+атомов+и+её+определение+в+соединениях |
| 9 | Положение неметаллов в Периодической системе химических элементов Д. И. Менделеева | https://www.youtube.com/watch?v=ohFd4lJ9RcE&feature=emb_logo |
| 9 | Химические свойства металлов. Взаимодействие металлов с неметаллами | https://www.youtube.com/watch?v=qgzo40bfL1o |
| 9 | Оксиды азота | https://www.youtube.com/watch?time_continue=130&v=JmbTPhygCdk&feature=emb_logo |
| 9 | Общие химические свойства металлов | https://www. youtube.com/watch?time_continue=217&v=3O_1UupZ71E&feature=emb_logo youtube.com/watch?time_continue=217&v=3O_1UupZ71E&feature=emb_logo |
| 9 | Получение и применение металлов | https://www.youtube.com/watch?time_continue=347&v=ZmgAo8Q3jFI&feature=emb_logo |
| 9 | Природные источники углеводородов: природный газ, нефть, уголь | https://www.youtube.com/watch?time_continue=206&v=O9e6ORyASjI&feature=emb_logo |
| 9 | Свойства металлов, неметаллов и их соединений. Генетическая связь между классами неорганических соединений | Свойства+металлов+неметаллов+и+их+соединений |
| 9 | Вычисления по химическим уравнениям количества, объёма, массы вещества по количеству, объёму, массе реагентов или продуктов реакции | https://www.youtube.com/watch?time_continue=8&v=nwIVA6XBq5w&feature=emb_logo |
Простое вещество — это… Что такое Простое вещество?
- Простое вещество
- простое тело, однородное вещество, состоящее из атомов одного химического элемента; форма существования химического элемента в свободном состоянии.
 Например, П. в. алмаз, графит, уголь состоят из атомов элемента углерода, но отличаются по своему строению и свойствам. Обыкновенный Кислород O2 и Озон O3 состоят из атомов элемента кислорода, но обладают неодинаковой молекулярной массой и резко различаются по свойствам. Однако даже в современной литературе понятия П. в. и химический элемент нередко смешиваются, вследствие того, что в большинстве случаев химические элементы и образуемые ими П. в. носят одно и то же название. Особые названия или буквенные обозначения имеются лишь для элементов, существующих в виде различных модификаций (см. Аллотропия, Полиморфизм), например белый, красный, чёрный Фосфор, белое и серое Олово (β-Sn, α-Sn).
Например, П. в. алмаз, графит, уголь состоят из атомов элемента углерода, но отличаются по своему строению и свойствам. Обыкновенный Кислород O2 и Озон O3 состоят из атомов элемента кислорода, но обладают неодинаковой молекулярной массой и резко различаются по свойствам. Однако даже в современной литературе понятия П. в. и химический элемент нередко смешиваются, вследствие того, что в большинстве случаев химические элементы и образуемые ими П. в. носят одно и то же название. Особые названия или буквенные обозначения имеются лишь для элементов, существующих в виде различных модификаций (см. Аллотропия, Полиморфизм), например белый, красный, чёрный Фосфор, белое и серое Олово (β-Sn, α-Sn).
Большая советская энциклопедия. — М.: Советская энциклопедия.
1969—1978.
- Проституция
- Простое воспроизводство
Смотреть что такое «Простое вещество» в других словарях:
ПРОСТОЕ ВЕЩЕСТВО — состоит из атомов одного химического элемента.
 Некоторым элементам (напр., углероду) соответствуют несколько простых веществ, отличающихся строением молекул или кристаллической структурой (см. Аллотропия) … Большой Энциклопедический словарь
Некоторым элементам (напр., углероду) соответствуют несколько простых веществ, отличающихся строением молекул или кристаллической структурой (см. Аллотропия) … Большой Энциклопедический словарьПРОСТОЕ ВЕЩЕСТВО — форма существования хим. элемента в свободном виде. Многие элементы образуют несколько простых веществ, называемых аллотропными модификациями (см. ). Разделение простых веществ на (см.) и (см.) основано на специфике их физ. и хим. свойств.… … Большая политехническая энциклопедия
простое вещество — состоит из атомов одного химического элемента. Некоторым элементам (например, углероду) соответствуют несколько простых веществ, различающихся строением молекул или кристаллической структурой (см. Аллотропия). * * * ПРОСТОЕ ВЕЩЕСТВО ПРОСТОЕ… … Энциклопедический словарь
простое вещество — ▲ химическое вещество ↑ состоящий из, одинаковый, атом простое вещество вещество, образованное из атомов одного сорта химического элемента. аллотропия. дейтерий. озон. ▼ уголь … Идеографический словарь русского языка
простое вещество — vieninė medžiaga statusas T sritis Standartizacija ir metrologija apibrėžtis Medžiaga, sudaryta iš vienos rūšies atomų. atitikmenys: angl. elementary substance vok. einfacher Körper, m; einfacher Stoff, m rus. простое вещество, n pranc. corps… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
простое вещество — vieninė medžiaga statusas T sritis chemija apibrėžtis Medžiaga sudaryta iš vienos rūšies atomų. atitikmenys: angl. elementary substance rus. простое вещество … Chemijos terminų aiškinamasis žodynas
простое вещество — vieninė medžiaga statusas T sritis fizika atitikmenys: angl. elementary substance vok. einfacher Körper, m; einfacher Stoff, m rus. простое вещество, n pranc. corps simple, m … Fizikos terminų žodynas
ПРОСТОЕ ВЕЩЕСТВО — состоит из атомов одного хим. элемента. Нек рым элементам (напр., углероду) соответствуют неск. П. в., различающихся строением молекул или кристаллич. структурой (см. Аллотропия) … Естествознание. Энциклопедический словарь
Простое вещество — Простые вещества вещества, состоящие исключительно из атомов одного элемента. Содержание 1 Агрегатное состояние 2 Аллотропия 3 Литература 4 … Википедия
Вещество — в химии физическая субстанция со специфическим химическим составом. В философском словаре Григория Теплова в 1751 году словом вещество переводился латинский термин Substantia. Вещество в современной физике как правило понимается… … Википедия
Книги
- Стихия, Александр Колганов. Человек мыслит образами. А потом в его жизни появляются любовь и страсть, страх и смелость. А из чего состоит образ? Можно ли найти его составные части?Слово «стихия»имеет несколько значений:… Подробнее Купить за 480 руб электронная книга
Урок 3. Молекулы и простые вещества – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 3 «Молекулы и простые вещества» из курса «Химия для чайников» рассмотрим, что такое молекулы, простые вещества, а также металлы и неметаллы. Напоминаю, что в прошлом уроке «Относительная атомная масса химических элементов» мы рассмотрели разные способы выражения массы химических элементов.
Атомы химических элементов существуют в природе как в свободном, так и в связанном состоянии. Например, благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe — находятся в воздухе в виде одиночных атомов. Атомы всех остальных элементов в природе не существуют изолированно друг от друга. Они всегда стремятся соединиться, связаться с другими атомами за счет особых сил. Почему? Так они достигают более устойчивого состояния. Это одна из иллюстраций всеобщего принципа природы — стремления к максимально устойчивому состоянию.
Что такое молекула?
Из курса физики вы уже немного знаете о молекулах — частицах вещества, состоящих обычно из двух и более атомов. Что же такое молекула?
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулы благородных газов одноатомны, а молекулы таких веществ, как кислород, водород, азот, хлор, бром, состоят из двух атомов (рис. 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
Простые вещества
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Металлы и неметаллы
Простые вещества по их свойствам делят на металлы и неметаллы.
Все металлы при комнатной температуре являются твердыми веществами (за исключением ртути), которые проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из металлов пластичны, т. е. меняют свою форму при механическом воздействии. Благодаря этому свойству металлы можно ковать, расплющивать, вытягивать в проволоку.
Большинство простых веществ — металлы, и все они имеют немолекулярное строение.
Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Алмаз и графит — это простые вещества, состоящие из атомов одного и того же химического элемента — углерода. Хотя они оба имеют немолекулярное строение, свойства этих веществ сильно отличаются: алмаз — прозрачное, самое твердое в природе вещество, а графит — темно-серое, непрозрачное, мягкое вещество (рис. 40). Их свойства различны потому, что различно строение их кристаллов, хотя состоят эти кристаллы из одних и тех же атомов — атомов углерода.
Названия простых веществ
В настоящее время известно более 400 простых веществ, хотя элементов пока открыто только 118. Названия большинства простых веществ такие же, как и названия соответствующих химических элементов. Только у элемента углерода простые вещества (как вы уже знаете) имеют собственные названия, да еще у элемента кислорода есть простое вещество озон.
Необходимо различать понятия простое вещество и химический элемент, поскольку в большинстве случаев их названия совпадают.
Химический элемент — это определенный вид атомов. Поэтому название химического элемента — это то, что объединяет атомы данного вида. У всех таких атомов есть общие черты. Каждый химический элемент обозначается с помощью соответствующего химического знака.
В то же время понятие простое вещество обозначает конкретное химическое вещество, образованное атомами одного вида. Оно характеризуется определенными составом, строением, физическими и химическими свойствами.
Например, если говорят о том, что в состав какого-то вещества входит азот, то имеют в виду атомы этого химического элемента, а когда говорят об азоте, который входит в состав воздуха, то, конечно, речь идет о простом веществе.
Более подробно о различии понятий «простое вещество» и «химический элемент» вы узнаете в главах 2, 3.
Краткие выводы урока:
- Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
- Простые вещества состоят из атомов одного химического элемента.
- Простые вещества имеют молекулярное или немолекулярное строение.
- Простые вещества делят на металлы и неметаллы.
Надеюсь урок 3 «Молекулы и простые вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Порядок проведения вступительного испытания по химии
Вступительное испытание ориентировано на уровень знаний, определённый примерной программой вступительных экзаменов по химии, разработанной Министерством образования и науки РФ, на базе курса по химии для основной и полной средней школы.
Форма проведения вступительного испытания
Вступительный экзамен по химии проводится в виде письменной работы.
Длительность экзамена – 2,5 часа (150 минут).
Каждый билет состоит из 10 заданий.
Шкала оценивания – 100-балльная.
Абитуриент не позднее чем через 10 минут после завершения задания должен загрузить на платформу фотографии черновиков с решениями заданий. Без черновиков работа не проверяется.
Абитуриент должен знать и уметь:
– знать теоретические положения химии и уметь применять их при рассмотрении классов неорганических и органических веществ и их конкретных соединений;
– уметь решать типовые и комбинированные задачи по основным разделам химии.
Программа вступительного испытания
Атомно-молекулярное учение. Атомы. Молекулы. Постоянство состава вещества. Относительная атомная и относительно молекулярные массы.
Закон сохранения массы: его значение в химии. Моль – единица качества вещества. Молярная масса.
Закон Авогадро и молярный объем.
Химический элемент, простое вещество. Сложное вещество. Знаки химических элементов и химические формулы.
Валентность и степень окисления.
Строение ядер атомов химических элементов и электронных оболочек атомов на примере элементов 1-, 2-, 3- и 4-го периодов периодической системы. Изотопы.
Открытие Д.И. Менделеевым периодического закона. Значение периодического закона.
Большие и малые периоды, группы, подгруппы. Зависимость свойств элементов от положения в периодической системе.
Тип химических связей: ковалентная (полярная и неполярная), ионная, водородная, металлическая. Примеры соединений со связями разных типов.
Классификация химических реакций: реакции соединения, разложения, замещения и обмена.
Окислительно-восстановительные реакции.
Скорость химических реакций. Зависимость скорости от природы реагирующих веществ, концентрации, температуры.
Катализ и катализаторы. Обратимость химических реакций. Химическое равновесие и условия его смещения.
Тепловые эффекты химических реакций.
Растворы. Растворимость веществ. Зависимость растворимости веществ от их природы, температуры и давления. Тепловые эффекты при растворении.
Выражение концентрации растворов (массовая доля растворенного вещества в растворе). Значение растворов в технике, сельском хозяйстве, быту.
Электрическая диссоциация. Степень диссоциации. Сильные и слабые электролиты.
Ионные уравнения реакций. Свойства кислот оснований и солей в свете теории электрической диссоциации.
Оксиды, классификация оксидов. Способы получения и свойств оксидов.
Основания, способы их получения и свойства. Щелочи, их получение, свойства и применение.
Кислоты, их общие свойства и способы получения. Реакции нейтрализации.
Соли средние и кислые, их состав, названия, химические свойства.
Гидролиз солей. Кристаллогидраты.
Металлы, их положение в периодической системе, физические и химические свойства. Металлы и сплавы в технике.
Основные свойства получения металлов.
Щелочные металлы, их характеристика на основе положения в периодической системе и строения атомов.
Соединения натрия и калия в природе, их применение. Калийные удобрения.
Общая характеристика элементов главной подгруппы II группы периодической системы.
Кальций, его соединение в природе.
Алюминий, характеристика элемента и его соединений на основе положения в периодической системе и строения атомов.
Амфотерность оксида и гидроксида алюминия. Соединения алюминия в природе, его роль в технике.
Железо, его оксиды и гидроксиды, зависимость их свойств от степени окисления железа.
Роль железа и его сплавов в технике.
Водород, его физические и химические свойства. Получение водорода в лаборатории и в техники, его применение.
Галогены, их общая характеристика. Соединения галогенов природе, их применение.
Хлор, его физические и химические свойства. Применение хлора. Хлороводород, его получение, свойства.
Соляная (хлороводородная) кислота и ее соли.
Общая характеристика элементов главной подгруппы. VI группы периодической системы.
Сера, ее физические и химические свойства. Серная кислота, ее свойства и химические основы производства контактным способом.
Кислород, его физические и химические свойства. Аллотропия. Получение кислорода в лаборатории.
Получение кислорода в промышленности. Роль кислорода в природе и применение в технике.
Вода. Строение молекул воды. Физические и химические свойства воды.
Общая характеристика элементов главной подгруппы V группы периодической системы. Фосфор, его аллотропные формы, физические и химические свойства.
Оксид фосфора (V). Фосфорная кислота и ее соли. Фосфорные удобрения.
Азот, его физические и химические свойства. Аммиак, его промышленный синтез, физические и химические свойства. Соли аммония
Азотная кислота. Химические особенности азотной кислоты. Соли азотной кислоты. Азотные удобрения.
Общая характеристика элементов главной подгруппы IV группы периодической системы.
Кремний, его физические и химические свойства. Оксид кремния (IV) и кремниевая кислота. Соединения кремния в природе, их использования в технике.
Углерод, его аллотропные формы. Химические свойства углерода.
Оксиды углерода.(II) и (IV), их химические свойства. Угольная кислота и ее соли.
Теория химического строения органических связей в молекулах органических соединений, способы разрыва связей, понятие о свободных радикалах.
Электронная природа химических связей в молекулах органических соединений, способы разрыва связей, понятие о свободных радикалах.
Гомологический ряд предельных углеродов (алканов), их электронное и пространственное строение (sp3-гибритизация). Метан.
Номенклатура алканов, их физические и химические свойства. Применение в технике. Предельные углеводы в природе.
Этиленовые углеводы (алкены), sp2 – гибридизация.
Номенклатура, химические свойства. Получение и применение в промышленности.
Общее понятие химии высокомолекулярных соединений: мономер, полимер, элементарное звено, степень полимеризации. Полиэтилен.
Понятие о диеновых углеродах. Природный каучук, его строение и свойства. Синтетический каучук. Понятие об искусственных волокнах.
Ацетилен, особенности его построения (sp-гибритизация, тройная связь).
Получение ацетилена карбидным способом из метана, химические свойства, применение.
Бензол, его электронное строение, химические свойства. Промышленное получение и применение бензола.
Понятие о взаимном влиянии атомов на примере толуола.
Природные источники углеводородов: нефть, природный и попутный нефтяные газы, уголь.
Перегонка нефти. Крекинг нефтепродуктов. Спирты. Строение и химические свойства одноатомных спиртов.
Промышленный синтез этанола и его применение. Особенности глицерина.
Фенол, его строение, взаимное влияние атомов в молекуле.
Химические свойства фенола в сопоставлении со свойствами спиртов. Применение фенола.
Альдегиды, их строение, химические свойства.
Получение и применение муравьиного и уксусного альдегидов.
Карбоновые кислоты: строение карбоксильной группы, физические и химические свойства карбоновых кислот.
Главные представители одноосновных кислот: муравьиная (ее особенности), уксусная, стеариновая, олеиновая.
Сложные эфиры, их строение, получение реакцией этерификацией, химические свойства.
Жиры, как представители сложных эфиров, их роль природе, химическая переработка.
Глюкоза, ее строение, химические свойства, роль в природе.
Сахароза, ее гидролиз.
Крахмал, целлюлоза, их строение, химические свойства, роль в природе и технические применения.
Амины как органические основания, их реакции с водой и кислотами.
Анилин. Получение анилина из нитробензола (реакция Н.Н. Зенина).
Аминокислоты, их строение, химические особенности. Синтетическое волокно капрон.
Альфа-аминокислоты как структурные единицы белков. Строение и биологическая роль белков.
От простого вещества к химическому элементу
Страница из
НАПЕЧАТАНО ИЗ ОНЛАЙН-СТИПЕНДИИ ОКСФОРДА (oxford.universitypressscholarship.com). (c) Авторские права Oxford University Press, 2021. Все права защищены. Отдельный пользователь может распечатать одну главу монографии в формате PDF в OSO для личного использования. дата: 09 мая 2021 г.
- Глава:
- (стр.32)
2 От простого вещества к химическому элементу - Источник:
- Что такое химический элемент?
- Автор (ы):
Бернадетт Бенсауд-Винсент
- Издатель:
- Oxford University Press
DOI: 10.1093 / oso / 97801784.003.0003
Лавуазье часто приписывают введение современной концепции химического элемента. Я буду утверждать, что, несмотря на значительное влияние определения элементов как неразложившихся тел в «Элементах химии» Лавуазье, это утверждение вводит в заблуждение по крайней мере по трем причинам. Во-первых, элементы уже были определены как остатки анализа до Лавуазье. Во-вторых, Лавуазье не отказался полностью от традиционного взгляда на элементы как на составные части всех тел.В-третьих, современное определение химического элемента подразумевает четкое различие между простыми телами и элементами, которое позже ввел Дмитрий Менделеев.
Я обрисую роль этого концептуального различия в процессе классификации элементов Менделеева и симметрично подчеркну, как периодическая система способствовала стабилизации его представления об элементе как об индивидууме, определяемом его положением в системе. Таким образом, понятие элемента выступает как предварительное условие, так и продукт построения периодической системы.
Ключевые слова:
анализ, атомы, изотопы, Лавуазье, молекулы, вещества
Для получения доступа к полному тексту книг в рамках службы для получения стипендии
Oxford Online требуется подписка или покупка. Однако публичные пользователи могут свободно искать на сайте и просматривать аннотации и ключевые слова для каждой книги и главы.
Пожалуйста, подпишитесь или войдите для доступа к полному тексту.
Если вы считаете, что у вас должен быть доступ к этому заголовку, обратитесь к своему библиотекарю.
Для устранения неполадок, пожалуйста, проверьте наш
FAQs
, и если вы не можете найти там ответ, пожалуйста
свяжитесь с нами
.
Химия: чистые вещества
Чистые вещества
Если вы продавец, то знаете, что слово «чистое» — отличный способ что-то продать. Когда потребители думают о слове «чистый», они представляют себе что-то совершенное во всех отношениях.В картофельный салат ползали тараканы? Конечно нет? Это чисто!
Для химика слово «чистый» имеет несколько иное значение. Когда мы говорим, что что-то чистое, мы имеем в виду, что в материале присутствует только одно вещество, и что он полностью однороден по составу. Под однородным составом мы подразумеваем, что если вы возьмете образец из одной части материала и сравните его с образцом из другой части материала, оба образца будут идентичны во всех отношениях. Вещи, имеющие однородный состав, называются «однородными».»
Чистая субстанция №1: Элементы
Прежде чем вы начнете читать дальше, я хочу, чтобы вы придумали определение слова элемент . Поскольку вы, вероятно, уже знаете, что такое элемент, это должно быть действительно простой задачей. .
Молекулярные значения
Элемент — это вещество, которое не может быть химически разложено на более простые вещества. Периодическая таблица представляет собой список всех известных элементов.
Как и слово «атом», «элемент» означает удивительно трудный термин для определения.У вас, вероятно, есть внутреннее представление о том, что такое элемент, и вы, вероятно, уже знаете, что список всех элементов можно найти в периодической таблице, но выразить его словами часто бывает сложно.
Для химических целей элемент может быть определен как вещество, которое не может быть химически разложено на более простые вещества. Возможно, вы уже знаете, что ядерные реакции могут разбивать элементы на еще более простые частицы, но эти частицы не важны для большинства химических целей.
Чистое вещество № 2: соединения
Молекулярное значение
Соединения — это чистые вещества, состоящие из двух или более элементов в определенных пропорциях. Используя химические реакции, соединения можно разбить на составные элементы, хотя обычно это сложно.
Другой тип чистого вещества — химическое соединение. Соединения — чистые вещества, состоящие из двух или более элементов в определенных пропорциях. В отличие от элементов, соединения можно разбить на более простые части с помощью химических реакций.Эти детали, конечно же, всего лишь элементы, из которых состоят соединения. Например, можно преобразовать хлорид натрия обратно в чистый натрий и чистый хлор с помощью процесса, называемого электролизом.
Обычно можно определить, является ли материал элементом или химическим соединением, посмотрев на его название или формулу. Названия многих химических соединений содержат два слова (например, «хлорид натрия», «сульфат магния»), а символы химических соединений содержат более одного атомного символа (например, «хлорид натрия», «сульфат магния»).g., «NaCl», «MgSO 4 »).
Выдержки из Полное руководство идиота по химии 2003 Яна Гуча. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу непосредственно у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon.com и Barnes & Noble.
Что означают химические слова? Изучение ключевых терминов | 14-16 лет | План урока
Прорабатывая серию утверждений, учащиеся разъясняют свои идеи относительно некоторых ключевых терминов, относящихся к химии и химическим процессам.
Этот ресурс исследует следующие заблуждения:
- Вещество не может быть газом или смесью.
- Чистое вещество — это то, что встречается в природе.
- Элемент состоит только из одного типа атомов и не может быть далее разделен.
- Соединение обладает совокупными свойствами элементов, из которых оно изготовлено.
- Атомы показывают макро-свойства элемента.
- Молекулы всегда образуются при объединении атомов.
- Молекула всегда содержит разные типы атомов.
Цели обучения
Студенты смогут:
- Разберитесь в использовании основных терминов: вещество, чистое, элемент, соединение, атом, молекула.
Последовательность действий
Введение
Спроецируйте или покажите изображение женской поп-группы Atomic Kitten и спросите учащихся, что означает слово «атомный».
Объясните, что:
- Они собираются прокомментировать подборку определений ряда основных химических слов.
- Их правильное понимание этих терминов является целью обучения.
Деятельность: этап 1
Раздайте каждому ученику лист. Попросите их работать индивидуально по телефону:
- Посмотрите на двенадцать вопросов на листе.
- Отметьте каждый вопрос в одном из трех квадратов.
- Объясните причины своего выбора.
Используйте карточки «светофор» или «большой палец вверх», чтобы получить представление класса о каждом из определений:
- Зеленый, если они считают, что утверждение правильное.
- Красный, если они думают, что это неправильно.
- Желтый, если они не уверены.
Деятельность: этап 2
Не комментируя ответы, разделите учащихся на группы по четыре человека. Распространяйте и поддерживайте, пока они:
- Сравните их ответы.
- Обсудите любые альтернативные ответы или сомнения в группе.
- Разделите роль представителя группы (каждый студент отвечает по три вопроса).
Пленарное заседание
Организуйте пленарное заседание.Спросите:
- Представители различных групп прокомментируют определения.
- Другие группы, которые нужно добавить к этим комментариям.
- Дополнительные вопросы, если необходимо, чтобы прояснить поднятые проблемы.
До отделки
Дайте учащимся время дополнить свой рабочий лист тем, что они услышали.
Обратная связь
Запишите рабочие листы учащихся и прокомментируйте идеи, которые были четко и точно выражены.Определите, где учащимся нужно развивать свои идеи.
Комментарий
Знакомый образ в необычном контексте оживляет объяснение целей обучения и стимулирует мышление.
Обмениваясь идеями в группах, учащиеся формулируют свои идеи и уточняют свое понимание. Это мягко способствует самооценке.
Степень остающегося заблуждения можно оценить и разобраться во время пленарного заседания, но здесь важно качество вопросов.
Индивидуальные размышления учащихся — это отдельная задача в конце занятия. Позже это подтверждается комментариями учителя, подтверждающими прогресс и помогающими в следующих шагах.
Оборудование
- Набор светофорных карточек
- Изображение группы Atomic Kitten
Пояснения
Цель упражнения — побудить студентов задуматься над данными определениями. Какой квадрат они ставят, гораздо менее важно, чем их причины.
Вопросы 1 и 2 касаются «сущности». Вопросы определяют студентов, которые не думают, что этот термин описывает газы или смеси.
Вопросы 3 и 4 исследуют «чистоту» в химическом контексте. Вопросы определяют студентов, которые, например, думают, что каменная соль чиста, потому что она встречается в природе, но думают, что хлорид натрия, полученный из нее, не является чистым, потому что он прошел химическую обработку.
Вопросы 5 и 6 «элемент». Вопрос 5 должен вызвать дискуссию об изотопах.Вопрос 6 может вызвать дискуссию об электронах, протонах и нейтронах.
Вопросы 7 и 8 исследуют «соединение». Вопрос 7 должен подчеркнуть идею о том, что соединения могут состоять из атомов двух или более элементов. Вопрос 8 проверяет понимание того, что соединение имеет свои собственные свойства, которые могут отличаться от свойств составляющих его элементов.
Вопросы 9 и 10 исследуют «атомы». Вопрос 9 проверяет, осознают ли учащиеся, что в некоторых случаях в химических реакциях участвуют молекулы элементов, а не атомы.Вопрос 10 посвящен особенно сложному для многих студентов представлению о том, что макро-свойства элементов могут не проявляться отдельными атомами, например, блеск, твердость или цвет.
Вопросы 11 и 12 «молекулы зонда». Вопрос 11 поднимает вопросы об образовании ионов, а не молекул, и о том, что молекулы могут содержать более двух атомов. Вопрос 12 проверяет, осознают ли учащиеся, что атомы одного и того же элемента могут также образовывать молекулы.
ответы
- Вещество — это название для описания твердых тел и жидкостей, но не газов.
- Неправильно. Слово вещество может использоваться для обозначения газов, а также твердых и жидких веществ.
- Вещество — это название для описания элементов и соединений, но не смесей.
- Неправильно. Многие часто встречающиеся вещества представляют собой смеси.
- Чистое вещество — это название для описания чего-то, что встречается в природе. Никаким образом не подвергалось химической обработке.
- Неправильно. Чистота вещества зависит от его состава, а не от того, как оно было обнаружено или подвергалось обработке.
- Чистое вещество — это имя для описания чего-то, что состоит из одного вида веществ, а не из смеси двух или более веществ.
- Элемент состоит только из одного вида атомов.
- Правильно. Это определение не учитывает изотопы.
- Элемент нельзя разделить на более простые вещества.
- Правильно. Это определение не принимает во внимание субатомные частицы, такие как электроны, протоны или нейтроны.
- Соединение состоит из двух элементов, смешанных вместе.
- Неправильно. Соединение может состоять из более чем двух элементов, объединенных, но не смешанных вместе.
- Соединение обладает совокупными свойствами элементов, из которых оно изготовлено.
- Неправильно. Соединение имеет свой собственный набор свойств, которые могут сильно отличаться от свойств элементов, из которых он сделан.
- Атом — наименьшая часть элемента, которая принимает участие в химической реакции.
- Неправильно. В случае многих неметаллов молекула, а не атом — это частица, которая участвует в химических реакциях.
- Атом — самая маленькая частица элемента, которая все еще показывает химические свойства элемента.
- Неправильно. Большинство химических свойств не проявляются отдельными атомами.
- Молекула — это то, что мы получаем, когда два атома соединяются вместе.
- Неправильно.Молекулы часто содержат более двух атомов.
- Молекула всегда содержит разные типы атомов.
- Неправильно. Могут быть молекулы, содержащие атомы одного типа.
Дополнительная информация
Этот план урока изначально был частью веб-сайта Assessment for Learning, опубликованного в 2008 году.
Оценка
для обучения — эффективный способ активного вовлечения учащихся в учебу.Каждый план занятия содержит предложения по организации занятий и рабочие листы, которые можно использовать со студентами.
Благодарности
V. Barker, Beyond Appearance: Заблуждения студентов об основных химических идеях: отчет, подготовленный для Королевского химического общества, Лондон, Раздел 5.4 Преподавание химических реакций . Лондон: Королевское химическое общество, 2000.
.
К. Табер, Химические заблуждения — профилактика, диагностика и лечение , Том 1 и Том 2 .Лондон: Королевское химическое общество, 2002.
Что такое элемент? | Особенность
Из химических концепций нет ничего более фундаментального, чем элемент. Это одна из первых идей, с которыми сталкивается студент-химик, часто в знаковой таблице этих основных компонентов природы, которую Дмитрий Менделеев впервые описал 150 лет назад и которая отмечается в этом году. И все же никто не может точно сказать, что такое элемент. Этот вопрос обсуждался с большой энергией и иногда с энтузиазмом во время встречи Международного общества философии химии в Бристоле в июле 2018 года, но до сих пор без единого мнения.
Это неудивительно. Некоторые из лучших умов химии, в том числе Антуан Лавуазье, сам Менделеев и пионер ядерной химии Фредерик Содди, боролись с этим, но все же краткое и исчерпывающее определение остается неуловимым. И некоторые участники встречи дали понять, что это может быть к лучшему.
Для других это показатель того, что химия требует серьезных философских размышлений. «Химия не воспринимает себя как дисциплину», — говорит философ Фарзад Махотян из Нью-Йоркского университета в США.Это не просто определение элемента; такие понятия, как молекулы, связи и даже характер самой таблицы Менделеева, остаются нечеткими: обманчиво знакомыми из регулярного использования практиками, но не имеющими никакого значения, с которым все согласны. «Существует потребность в философском размышлении об аспектах химии, которым мы склонны преподавать довольно механически», — говорит Эрик Скерри из Калифорнийского университета в Лос-Анджелесе в США, редактор журнала «Философия науки» Foundations of Chemistry.
Кажется разумным ожидать, что химия даст однозначное определение
Значение «элемента» — излюбленная тема для споров среди химиков, не работающих на дежурстве. Мы согласны (верно?), Что водород — это элемент, но что мы подразумеваем под этим? Является ли газообразный молекулярный водород элементом? Или изолированный атом водорода? Или мы имеем в виду не какое-то реальное вещество, а «трансцендентное» понятие водорода, реальные атомы и молекулы которого являются лишь материальными представителями?
Кто-то может сказать: а кого это волнует? Мы знаем, что имеем в виду на практике.Если я скажу: «Сера — это элемент, который образует желтое твердое вещество с резким запахом», я не ожидаю возражений. Точно так же, если я скажу: «Сера — второй элемент в группе 16 Периодической таблицы». Но это две совершенно разные вещи.
По словам химика-теоретика Ойгена Шварца из Университета Зигена в Германии, типичное отношение — сказать: «Я знаю, как я говорю об элементах, — это не совсем правильно, но все это делают, и студенты в конце концов поймут это». «Но« лично я как химик считаю, что не следует усваивать эту привычку », — добавляет он.
Елена Гибауди из Туринского университета в Италии обеспокоена тем, что отсутствие точного определения элемента порождает проблемы понимания, общения и доверия при обучении. «Когда два специалиста по химии обсуждают элементы, они могут отличить значение от контекста, но в классе это не так», — говорит она.
Могут возникнуть проблемы и с общественным пониманием химии. Шварц указывает на то, что, поскольку некоторые элементы становятся связанными с токсичными веществами — например, газообразным хлором или серой в двуокиси серы, выделяющейся при сжигании угля и нефти, — сам элемент может считаться токсичным по своей природе и уязвимым для химически безграмотных запретов.«Я не знаю, как дать понять общественности, что только некоторые соединения данного элемента токсичны, и даже только выше определенной концентрации, а слишком мало того же элемента может даже вызвать проблемы со здоровьем», — говорит он. .
«Понятие элемента занимает центральное место в химии и служит ряду целей», — говорит Гибади. «Например, он определяет, что остается неизменным в системе, подвергающейся химическому преобразованию, и различает химические и ядерные изменения.Поэтому кажется разумным ожидать, что химия даст однозначное определение ». Но может ли это?
Земля, ветер и огонь?
Подобно идее атомов, элементы скорее страдают, чем выигрывают от иллюзии непрерывности в давней традиции мышления. Популярная история гласит, что древние греки думали, что существует только четыре элемента — земля, воздух, огонь и вода — но примерно с восемнадцатого века мы начали понимать, что их больше, чем четыре, и что ни один из них не соответствует этим древним элементам. элементы.На самом деле все сложнее. Во-первых, четыре элемента, приписываемые Эмпедоклу и закрепленные в философии Аристотеля, ни в коем случае не были единственной схемой основных строительных блоков материи в греческой мысли. А до золотого века химии в эпоху позднего Просвещения системы «элементов» были довольно туманными. Швейцарский врач 16 века Парацельс предложил три основных «принципа» — серу, соль и ртуть, в то время как несколько других схем (включая такие фиктивные элементы, как флогистон) получили временную поддержку.
Должен ли каждый изотоп занимать свое место в периодической таблице?
Кроме того, это не обязательно были конкурирующие альтернативы. Идея элемента, такого как атом, имела довольно разнообразный оттенок и не обязательно означала первичный тип материи. Например, три принципа Парацельса рассматривались больше как свойства, чем ингредиенты: сера, представляющая горючесть, твердость соли и текучесть ртути.
Роберт Бойль справедливо прославился тем, что внес некоторую ясность в концепцию, когда в своей книге « Скептический химик » 1665 года он предположил, что элементом является субстанция, которую нельзя свести («проанализировать») к чему-то более простому.Но определение Бойля говорит вам только тогда, когда у вас есть элемент, а не то, что это за элемент и что отличает один от другого. И это весьма условно, в заложниках ваших аналитических способностей. Как вы могли быть уверены, что у вас есть элемент, а не просто соединение, которое еще никто не нашел способ разделить на его ингредиенты? В самом деле, нельзя, поэтому трудно расщепляемые оксиды, такие как оксид алюминия и кремнезем, фигурируют как элементы в списках 18-го века, как в влиятельной книге Антуана Лавуазье 1789 Traité Élémentaire de Chimie .Лавуазье вслед за Бойлем утверждал, что элемент представляет собой заключительную стадию анализа.
Джон Дальтон внес нечто более фундаментальное в определение Лавуазье, когда в 1808 году он утверждал, что специфические свойства элементов происходят от свойств составляющих их атомов, представленных в виде крошечных твердых сферических частиц. Ко времени Менделеева в середине того века было признано, что разные элементы имеют разный атомный вес, и при составлении своей периодической таблицы Менделеев использовал упорядочение элементов на основе их атомного веса.(Он сам использовал термин «элементарный вес», поскольку не верил в атомы.)
Открытия радиохимиков, таких как Содди, и физиков, таких как Эрнест Резерфорд и Генри Мозли, к 1920-м годам привели к пониманию того, что более фундаментальным свойством атомов элемента является их атомный номер Z — количество протонов в их ядрах, т.е. то же самое для всех атомов данного элемента. Фрэнсис Астон открыл изотопы в 1922 году, которые имеют тот же Z , но разную атомную массу.Но если Z отличается для двух атомов, это разные элементы.
Что мы подразумеваем под «углеродом»? Алмаз, атом с Z = 6 или C 60
Но сначала изотопы выбросили кошку среди голубей. «Их открытие было проблемой для определения элемента», — говорит Гибади. «Между химиками и физиками разгорелись оживленные дебаты о концепции химического элемента. Вопрос заключался в том, должен ли каждый изотоп занимать свое место в периодической таблице.В 1923 году международный комитет согласился основывать идентификацию химического элемента на атомном номере, а не на атомном весе.
Это, как вы могли подумать, могло быть концом дела: элементы определены Z . Проблема в том, что химики используют это слово не совсем так. В основополагающей статье об определении элементов в 1932 году немецкий химик Фридрих Панет допустил два разных определения, которые он назвал Einfacher Stoff — обычно переводится как «простое вещество» — и Grundstoff , или «первичное / основное вещество». .Первый относится к понятию Лавуазье реального, физического вещества, которое не может быть сокращено химическими методами до более основных ингредиентов, второй — к абстрактному понятию: «кислород», скажем, как тип атома с Z = 8.
Гибади сомневается, что мы уже сейчас вышли за пределы дуализма Панета. В настоящее время Iupac дает двойное определение «элементу» в своей «Золотой книге» химической терминологии, в которой говорится, что это слово может относиться либо к «разновидности атома» (которую Гибади считает родственной «основной субстанции» Панета), либо, скорее тавтологически, к «чистой элементарной субстанции».
Это двойное значение неудобно. Найдите слово «кислород» на веб-сайте, посвященном элементам, и вам, вероятно, скажут, что он имеет Z = 8 и, возможно, определенную электронную конфигурацию и положение в периодической таблице, но также и то, что это высокореактивное вещество с формула O 2 и температура кипения –183 ° C. По словам химика Марка Лича, который управляет веб-сайтом химических ресурсов meta-synthesis.com, это небрежное объединение двух совершенно разных типов данных: одно относится к «основной субстанции» Панета (абстрактный идеал), а другое — к его «основной субстанции» (абстрактный идеал). простая субстанция »(реальная субстанция).Конечно, это не может быть хорошо?
Более того, говорит Лич, все наше представление о таблице Менделеева неуклюже смешивает эти два понятия. Мы можем представить себе, что это таблица «основных веществ» — именно так ее видел Менделеев. Но само понятие периодичности относится к реальным химическим свойствам реального вещества: валентности химических соединений, таким свойствам, как энергия ионизации, металлический характер и так далее. «Если базовое вещество имеет только свойство Z , это просто простой список», — говорит Лич.«Откуда же тогда взялась структура периодической таблицы Менделеева?»
В некоторых популярных версиях таблицы Менделеева даже показаны фотографии «простых» материальных форм элементов: алмаз или графит вместо углерода и так далее. Так что это запутанная смесь — и, возможно, так и должно быть. «Для его создания нужен разумный компромисс как основных, так и простых свойств», — говорит Скерри.
Это нетривиальный вопрос. Например, до сих пор не утихают споры о том, должны ли элементы ниже иттрия в группе 3 быть лантаном и актинием или лютецием и лоуренсием.Спор сводится к тому, считаете ли вы, что таблица должна отражать «фундаментальные» характеристики, такие как электронная конфигурация, или наблюдаемые, такие как химическое поведение. Эти аргументы становятся еще более неоднозначными, когда релятивистские эффекты (из-за очень высоких скоростей электронов внутренней оболочки) начинают разрушать химическую периодичность среди созданных человеком сверхтяжелых элементов.
Становится тяжелее
Это не единственное осложнение, которое создают супертяжелые машины.Заблуждение относительно того, является ли элемент «материалом» или «концепцией», происходит из-за того, что в прошлом они были обоими. Но действительно ли новый элемент имеет такие же претензии на реальность, когда он существует только в виде горстки атомов, которые стабильны менее секунды, как в случае с некоторыми новейшими искусственными элементами, такими как теннессин? Если элементы частично определяются их химическими свойствами, то где же остаются элементы, которые не существуют достаточно долго, чтобы вступить в какое-либо значимое химическое взаимодействие, и которые в любом случае сделаны только в виде сильно заряженных ионов, которые никогда не приобретают полный набор электронов? ? «В каком смысле они элементы, если они длятся всего одну-две миллисекунды?» — спрашивает Скерри.«Я не думаю, что мы когда-нибудь сможем разливать их в бутылки».
В каком смысле они элементы, если они существуют всего одну-две миллисекунды?
Радиохимия всегда была немного тревожной в пределах химической стойкости. Один из распространенных способов мышления о химических элементах — это «сохраненные количества» химии. Подобно тому, как масса и энергия никогда не разрушаются в физике (хотя, конечно, они могут взаимно превращаться), фундаментальное правило сохранения химии состоит в том, что элементы сохраняются: вы никогда не выйдете из реакции с меньшим количеством углерода, чем вы начали.Но в радиохимии, где один элемент может распадаться на другой, вы это делаете. Вопрос о том, делает ли это радиохимию частью химии вообще, обсуждался с первых дней ее существования, когда Нобелевские комитеты по физике и химии соревновались за то, кто должен присуждать призы таким, как Кюри и Резерфорд (оба они теперь «претендуют» на химию в названия элементов).
Эта война за территорию так и не закончилась, о чем свидетельствуют недавние ссоры между Международными союзами теоретической и прикладной физики и химии (Iupap и Iupac) по поводу того, кто должен говорить об утверждении новых элементов.Физики говорят, что только у них достаточно опыта, чтобы судить об утверждениях, сделанных в экспериментах по разрушению атомов с помощью ускорителей частиц. Но химики не рады позволить другой группе определять, что входит в их самую ценную икону — таблицу Менделеева.
Кто бы ни выносил решение, эти новые элементы нельзя держать в руках. Они подчеркивают новую актуальность сроков. Возможно, любое слияние ядер, которое длится дольше, чем типичный временной масштаб ядерного рассеяния, около 10 –10 с, можно квалифицировать как образование другого элемента.Но действительно ли объединение, измеряемое в наносекундах, оправдывает это, или это просто своего рода резонанс? Вот почему, говорит Шварц, «когда мы говорим об элементах, мы должны также говорить о временных рамках». Он задается вопросом, должен ли «элемент» быть по крайней мере сущностью, способной в принципе образовывать молекулы. «Химия — это искусство и наука о реальных материалах, — добавляет он, — но для физиков ядро - это элемент». Тем временем Iupac недавно объявил о новых критериях открытия сверхтяжелых элементов, которые подтверждают, что временной масштаб существования, соответствующий статусу элемента, составляет всего
10 –14 с.
Сама по себе вещь
Проблема элементов показывает, что, как говорит Скерри, химии нужна философия. «Проблема« химического элемента », как и некоторые другие проблемы в химии, такие как понятия вещества и структуры, поднимает философские вопросы, и поэтому не может быть решена, не полагаясь на идеи из философии», — говорит Гибади. В некотором смысле этот вопрос восходит к Платону, чье понятие «идеальных» нематериальных форм лежало в основе его взглядов на реальные физические сущности.Абстрактная «основная субстанция» Панета также иногда обсуждается с точки зрения концепции Иммануила Канта Ding an sich — «вещи в себе» или фундаментального аспекта реальности, недоступного для наших (подверженных ошибкам) чувств.
Содержит ли «базовое» определение элемента все «простые» характеристики внутри него?
Но если это философский вопрос, который не может быть решен с помощью эмпиризма, может быть, нам просто нужно сделать выбор между «основной субстанцией» Панета и «простой субстанцией» в качестве определения элемента? Некоторые исследователи так считают.Тем временем Скерри предполагает, что природа элемента не просто двойственна, а тройственна: в веществе элемента важны не только свойства сырья, но и свойства его соединений. В конце концов, одно из непреходящих чудес химии заключается в том, что в хлориде натрия не остается следов реактивного серого металла и ядовитого зеленого газа.
Введение отдельной номенклатуры для «простого» и «основного» определений, чтобы молекулы дигидрогена больше не рассматривались как «элемент водород», потребует изменения глубоко укоренившегося химического языка.Но Сара Хиджманс из Университета Париж-Дидро во Франции сомневается в том, нужно ли нам идти на такое. Возможно, предлагает она, мы могли бы рассматривать слово «элемент» как понятие, содержащееся в обоих определениях. Она говорит, что во времена Лавуазье не было другого выбора, кроме как обратиться к аналитическому определению, потому что мы почти ничего не понимали в том, что отличает элементы на фундаментальном уровне. Постепенно баланс склонился к «фундаментальному» определению в терминах Z . Но очевидно, что эмпирическая, «химическая» точка зрения все же имеет значение, как показывает таблица Менделеева.
Возможно, вопрос в том, действительно ли эти двое вообще конфликтуют. В каком-то смысле в Z для химиков нет ничего особенно значимого для химиков, поскольку ядро практически не играет прямой роли в химическом поведении. Число протонов — это всего лишь косвенный показатель того, что имеет значение для химии: числа электронов, а также их конфигурации и энергии.
Но они, учитывая конкретный Z , предопределены правилами квантовой механики.Их можно предсказать. А из , эта информация , в свою очередь, мы можем в принципе предсказать многие химические реакции, например, какие типы соединений будет образовывать элемент. Мы даже можем предсказать физические свойства некоторых элементов: аллотропные формы, точки плавления и так далее. Итак, содержит ли «базовое» определение элемента все «простые» характеристики внутри него, которые будут раскрыты по мере того, как наши вычислительные возможности улучшатся?
Может быть, мы должны признать, что понятие элемента всегда будет окружать некоторую неопределенность.И, возможно, это не так уж и плохо. В конце концов, химики привыкли к этому — как отметил лауреат Нобелевской премии Роальд Хоффманн, они всегда используют концепции, не имеющие однозначного и точного определения, такие как электроотрицательность и ионный радиус, без уменьшения их ценности для поля. «Неопределенность сыграла полезную роль в мышлении», — говорит Махотян. Он утверждает, что, возможно, дело не в самой расплывчатости, а в том, чтобы убедиться, что это не просто небрежность.
Так что же такое углерод? Ответ, говорит Шварц, может зависеть от того, с кем мы говорим.Для разной аудитории и для разных целей это может быть сажа; это может быть шестой элемент, природная смесь изотопов или компонент метана. Элементарно, правда.
Филип Болл — научный писатель из Лондона, Великобритания.
Определение вещества в химии.
Примеры содержания в следующих темах:
Вещества и смеси
- Вещества состоят из чистых элементов или химически связанных элементов, тогда как смеси состоят из несвязанных веществ .
- Все соединения — это вещества , но не все вещества являются соединениями.
- Простые или кажущиеся чистыми вещества , встречающиеся в природе, на самом деле могут быть смесями химических веществ .
- Смесь относится к физическому сочетанию двух или более веществ , в котором сохранены идентичности отдельных веществ .
- Введение в классификацию вещества как вещества или смеси веществ .
Молярная масса соединений
- Молярная масса определенного вещества — это масса одного моля этого вещества .
- Даже самое маленькое количество вещества будет содержать миллиарды атомов, поэтому химики обычно используют моль в качестве единицы для количества вещества .
- Другими словами, моль — это количество вещества , которое содержит столько сущностей (атомов или других частиц), сколько атомов в 12 граммах чистого углерода-12.
- Каждый ион или атом имеет определенную массу; аналогично, каждый моль данного чистого вещества также имеет определенную массу.
- Молярная масса — это масса данного вещества , деленная на количество вещества , измеренная в г / моль.
Физические и химические изменения вещества
- Другой способ думать об этом заключается в том, что физическое изменение не приводит к тому, что вещество становится принципиально другим веществом , но химическое изменение заставляет вещество превращаться во что-то химически новое.
- Например, смешивание соли и перца создает новое вещество без изменения химического состава любого из компонентов.
- Фазовые изменения — это изменения, которые происходят, когда вещества плавятся, замораживаются, кипятятся, конденсируются, сублимируются или осаждаются.
- Они также являются физическими изменениями, потому что они не меняют природу вещества .
- Химическое изменение может также привести к образованию осадка, например, появлению мутного материала при смешивании растворенных веществ .
Вещества, существующие в виде газов
- Вещества , которые существуют в газовой фазе, проявляют пренебрежимо малые межмолекулярные силы.
- Около абсолютного нуля вещество существует как твердое тело.
- Температура вещества — это мера средней кинетической энергии частиц.
- При стандартных условиях (1 атм, 273 K) вещество , которое существует в виде газа, называется чистым газом и (без учета любых межмолекулярных сил или объема частицы, специфичных для вещества ) имеет объем 22.4 л на моль.
- В STP, если точка кипения данного вещества ниже 273 K, то можно ожидать, что вещество находится в газовой форме.
Удельная теплоемкость и теплоемкость
- Теплоемкость — это мера количества тепловой энергии, необходимой для изменения температуры чистого вещества на заданную величину.
- молярная теплоемкость, которая представляет собой теплоемкость на моль чистого вещества .
- удельная теплоемкость, часто называемая просто удельной теплоемкостью, которая представляет собой теплоемкость на единицу массы чистого вещества .
- В нем обсуждается, как количество тепла, необходимое для изменения температуры, зависит от массы и задействованного вещества , и эта взаимосвязь представлена удельной теплоемкостью вещества , C.
- Вычислить изменение температуры вещества с учетом его теплоемкости и энергии, используемой для его нагрева
Растворимость в твердом состоянии и температура
- Растворимость часто зависит от температуры; растворимость многих веществ увеличивается с повышением температуры.
- Во время перекристаллизации нечистое вещество поглощается объемом растворителя при температуре, при которой оно нерастворимо, а затем нагревается до тех пор, пока оно не станет растворимым.
- Примеси также растворяются, но когда раствор охлаждается, часто можно избирательно кристаллизовать или осаждать желаемое вещество в более чистой форме.
- Эта диаграмма показывает растворимость различных веществ в воде при различных температурах (в градусах Цельсия).
Число Авогадро и родинка
- Им также нужен способ сравнить эти числа и соотнести их с массами веществ , которые они могут измерить и наблюдать.
- Число Авогадро определяется как количество элементарных частиц (молекул, атомов, соединений и т. Д.) На моль вещества .
- Определяется как количество вещества , которое содержит столько частиц, сколько атомов в 12 граммах чистого углерода-12.
- Итак, 1 моль содержит 6,022 × 1023 элементарных единиц вещества .
- Еще одно свойство числа Авогадро состоит в том, что масса одного моля вещества равна молекулярной массе этого вещества.
Стандартные изменения свободной энергии
- Для этого объедините стандартную энтальпию и стандартную энтропию вещества , чтобы получить стандартную свободную энергию реакции:
- Напомним, что символ ° относится к стандартному состоянию вещества , измеренному в условиях давления 1 атм или эффективной концентрации 1 моль и температуры 298К.
- Как и в случае стандартной теплоты образования, стандартная свободная энергия вещества представляет собой изменение свободной энергии, связанное с образованием вещества из элементов в их наиболее стабильных формах, поскольку они существуют в стандартных условиях давления 1 атм. и 298К.
- В большинстве таблиц термодинамических значений указаны ΔGf ° для обычных веществ . o_f $, равные нулю.
Преобразование между молями и атомами
- Как введено в предыдущей концепции, моль можно использовать для соотнесения масс вещества с количеством атомов в нем.
- Это простой способ определить, какое количество одного вещества может реагировать с заданным количеством другого вещества .
- Из молей вещества можно также найти количество атомов в образце и наоборот.
- Следовательно, учитывая соотношение 1 моль = 6,022 x 1023 атомов, преобразование между молями и атомами вещества становится простой задачей размерного анализа.
- Преобразование между числом молей и числом атомов в данном веществе с использованием числа Авагадро
Физические и химические свойства вещества
- Например, точка замерзания вещества является физическим свойством: когда вода замерзает, это неподвижная вода (h3O) — просто она находится в другом физическом состоянии.
- Химические свойства не могут быть определены простым просмотром или прикосновением к веществу ; Чтобы исследовать химические свойства вещества, необходимо повлиять на его внутреннюю структуру.
- Физические свойства — это свойства, которые можно измерить или наблюдать без изменения химической природы вещества .
- Химическая стабильность означает, будет ли соединение реагировать с водой или воздухом (химически стабильные вещества не будут реагировать).
Химическая классификация веществ: характеристика и примеры
Наука> Химия> Введение в химию> Химическая классификация веществ
В прошлой статье мы изучили значение химии и ее разделов. В этой статье мы рассмотрим химическую классификацию веществ.
Материя и ее различные состояния:
Дело в любых веществах, имеющих массу и занимающих пространство.Есть три состояния материи.
- Твердое тело: Оно имеет определенную форму и объем при заданной температуре и давлении.
- Жидкость: Она примет форму емкости, то есть неопределенной формы, но определенного объема.
- Газ: Газ не имеет определенной формы или определенного объема.
Примечание: Помимо этих трех стандартных состояний, есть еще два состояния, называемые состоянием плазмы (существует при очень высокой температуре) и конденсатом Бозе-Эйнштейна (существует при очень низких температурах).
В зависимости от химического состава вещества подразделяются на два типа: а) чистые вещества и б) смеси.
Чистые вещества подразделяются на элементы (например, железо, кислород) и соединения (например, гидроксид натрия, аммиак). Эта классификация была дана французским химиком Лавуазье. В то время как смеси далее подразделяются на гомогенные смеси (например, раствор поваренной соли в воде) и гетерогенные смеси (например, мутная вода).
Чистые вещества:
Чистое вещество — это вещество, состоящее из молекул, содержащих одинаковые атомы.Рассмотрим случай чистой воды. В чистой воде все молекулы состоят из двух атомов водорода и одного кислорода. Чистые вещества подразделяются на элементы и соединения.
Все чистые вещества однородны. Но не все однородные вещества чисты. Например, Если рассматривать воду, то ее состав везде одинаков, поэтому она однородна. Если взять известковую воду, то ее состав может быть везде одинаков, но это не чистое вещество. Это смесь воды и сока лайма.
Характеристики чистых веществ:
- Имеют фиксированный состав.
- Их нельзя разделить на более простые вещества.
- Их можно изменить только в идентичности и свойствах.
- Их свойства не меняются.
Элементы:
Элемент может быть определен как чистое вещество, которое нельзя ни разложить, ни построить из более простых веществ никакими физическими или химическими методами.
Это определение не может объяснить современные методы и процессы, такие как ядерное деление, ядерный синтез и искусственные превращения в ядерной химии.
Сейчас атом рассматривается как фундаментальная единица материи. Следовательно, элемент можно определить как чистое вещество, состоящее из одного вида атомов.
Характеристики элементов:
- Их нельзя разделить на более простые вещества.
- Их нельзя построить из более простых веществ.
- Их можно изменить только в идентичности и свойствах.
- Их свойства не меняются.
Классификация элементов:
По характеру элементы делятся на три типа
- Металлы: Обычно это твердые вещества (за исключением ртути и галлия), обладающие такими характеристиками, как твердость, пластичность, высокая прочность на разрыв, блеск и способность проводить тепло и электричество. Примеры: медь, железо, алюминий, цинк и т. Д.
- Неметаллы: Обычно они не блестящие Примеры: сера, фосфор, азот, водород
- Металлоиды: Эти элементы имеют характеристики, общие как для металлов, так и для неметаллов. Примеры: мышьяк, олово, висмут, сурьма
Число атомов, присутствующих в молекуле элемента, называется его атомностью. По атомарности они классифицируются как
.
- Одноатомные элементы: например, Серебро (Ag), золото (Au), алюминий (Al), гелий (He), неон (Ne), бор (B), углерод (C).
- Двухатомные элементы: водород (H 2 ), хлор (Cl 2 ), кислород (O 2 ).
- Многоатомные элементы: озон (O 3 ), фосфор (P 4 ), сера (S 8 ).
Соединения:
Соединение может быть определено как чистое вещество, которое может быть разложено на более простые вещества каким-либо подходящим химическим методом. Соединение образуется комбинацией двух или более элементов в определенной пропорции массы.
Примеры: Вода (H 2 O) представляет собой соединение водорода и кислорода в соотношении 1: 8 по массе соответственно. Двуокись углерода (СО2) представляет собой соединение углерода и кислорода в соотношении 3: 8 по массе соответственно.
Характеристики соединений:
- Составные части соединения всегда присутствуют в фиксированном массовом соотношении.
- Соединение всегда однородно по природе.
- Состав отличается от свойств составляющих его элементов.
- Составные части соединения нельзя разделить простыми механическими средствами. Для их разделения требуется энергия в виде света, тепла или электричества.
- Соединения образуются в результате химического изменения.
- Образование соединения всегда сопровождается поглощением или выделением тепла, света или электрической энергии.
- Соединения в чистом виде имеют высокую температуру кипения и плавления.
Смеси:
Смеси можно определить как вещества, состоящие из двух или более чистых веществ.Они могут иметь переменный состав и могут быть разделены на составляющие компоненты некоторыми подходящими физическими способами.
Пример: сырая нефть, воздух
Классификация смесей:
Смеси подразделяются на два типа
Гомогенные смеси: Гомогенные смеси — это смеси, которые имеют одинаковый состав. Эти смеси также известны как растворы. Составляющие однородных смесей равномерно распределены по всей поверхности.Состав таких смесей невозможно увидеть даже под микроскопом. Примеры: воздух, бензин, морская вода, нержавеющая сталь, латунь, цветное стекло и т. Д.
Гетерогенные смеси: Гетерогенные смеси — это смеси, которые имеют разный состав в разных частях. Составляющие гетерогенных смесей распределены неравномерно. Состав таких смесей можно увидеть даже невооруженным глазом или с помощью микроскопа. Примеры: смесь железных опилок и серы, мутная вода, смесь песка и сахара и т. Д.
Характеристики смесей:
- Компоненты смеси могут присутствовать в любом соотношении.
- Смеси могут быть однородными или неоднородными по своей природе.
- Свойства компонентов остаются неизменными даже в виде смеси.
- Составные части смеси можно разделить простыми механическими или физическими способами.
- Смеси образуются в результате физических изменений 6. Образование смеси не сопровождается поглощением или выделением тепла, света или электрической энергии.
- Смеси не имеют резких температур кипения и плавления.
В следующей статье мы рассмотрим различные методы разделения компонентов смеси.
Предыдущая тема: Значение химии
Следующая тема: Методы разделения смесей
Наука> Химия> Введение в химию> Химическая классификация веществ
Какое определение элемента является правильным?
Какое определение элемента правильное?
Какое определение элемента является правильным?
Согласно Раунди (1989), учителя химии сбивают учеников с толку, используя устаревшие определения элемента.Ниже приведены три примера
взято из учебников:
| Элемент — это субстанция, которую нельзя разбить на что-либо более простое (Heyworth, 1999). Элемент — это вещество, которое нельзя разбить на что-либо более простое химическими методами (Chung, 1997). Элемент — это чистое вещество, которое невозможно разбить на что-либо более простое химическими методами (Cheng & Chow, 1999). |
Большинство элементов состоят из смеси изотопов и поэтому не являются чистыми веществами.Изотопы элемента можно разделить по физическим
такие методы, как диффузия и масс-спектрометрия. Также изотопы некоторых элементов можно разделить химическими методами, такими как электролиз. Каждый
изотоп элемента — чистое вещество.
Каково современное определение элемента? Элемент состоит из атомов, каждый из которых имеет одинаковое количество протонов.
ядра. Важно отметить, что элемент идентифицируется по количеству протонов (т. Е. По атомному номеру), независимо от того, существует ли он в виде атома или
сложный.Например, все следующие вещества содержат элемент кислород:
MgO, H 2 O, O 2 , O 3 , CH 3 OH
Символ «О» используется для обозначения кислородного элемента в каждой из приведенных выше формул, потому что в ядре восемь протонов.
Нам не нужно беспокоиться о количестве электронов вокруг ядра O 2- или O 3 .
Чтобы облегчить учащимся изучение современного определения элемента, учителям может потребоваться изменить последовательность тем, представленных в
большинство учебников.Не стоит начинать с темы «элементы». Одна из возможных обучающих последовательностей показана ниже:
- Структура атома
- Атомный номер и массовое число
- Определение элемента
- Наименования и условные обозначения элементов
- Изотопы
Список литературы
Cheng, E. & Chow, J. (1999). Химия: современный взгляд (4 -е изд.) . Уилсон Уэлш.
Чанг, Л.Х. М. (1997). Интегрированная химия сегодня (2 и ред.) . Цзин Кунг.
Хейворт, Р. (1999). Chem 2000 (2 и изд.) . Макмиллан.
Раунди, У. Х. (1989). Что такое элемент? Журнал химического образования , т.

 edu.ru/subject/lesson/1607/main/
edu.ru/subject/lesson/1607/main/