Содержание
Сера. Описание, свойства, происхождение и применение минерала
- Главная
- Другое
- Сера. Описание, свойства, происхождение и применение минерала
НОВОСТИ ГОРНОДОБЫВАЮЩЕЙ ОТРАСЛИ
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
- Структура
- Свойства
- Морфология
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
СТРУКТУРА
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
СВОЙСТВА
Самородная сера
Самородная сера жёлтого цвета, при наличии примесей — жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см3, хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и h3SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в h3SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см3, хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и h3SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в h3SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.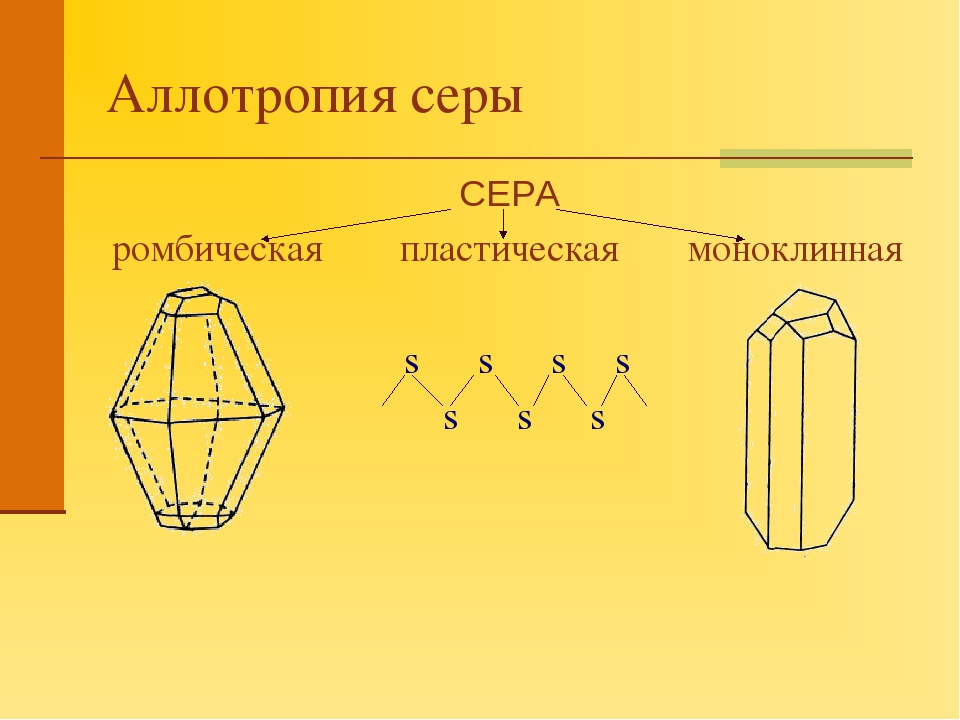
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ
Самородная сера
Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты.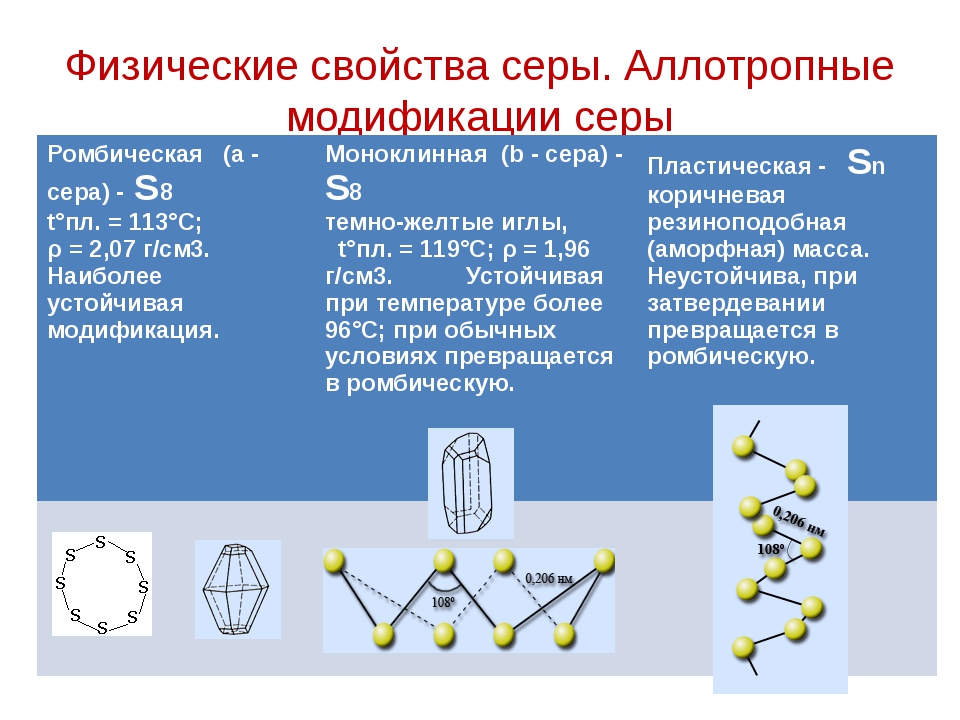 Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ
Самородная сера
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления h3S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.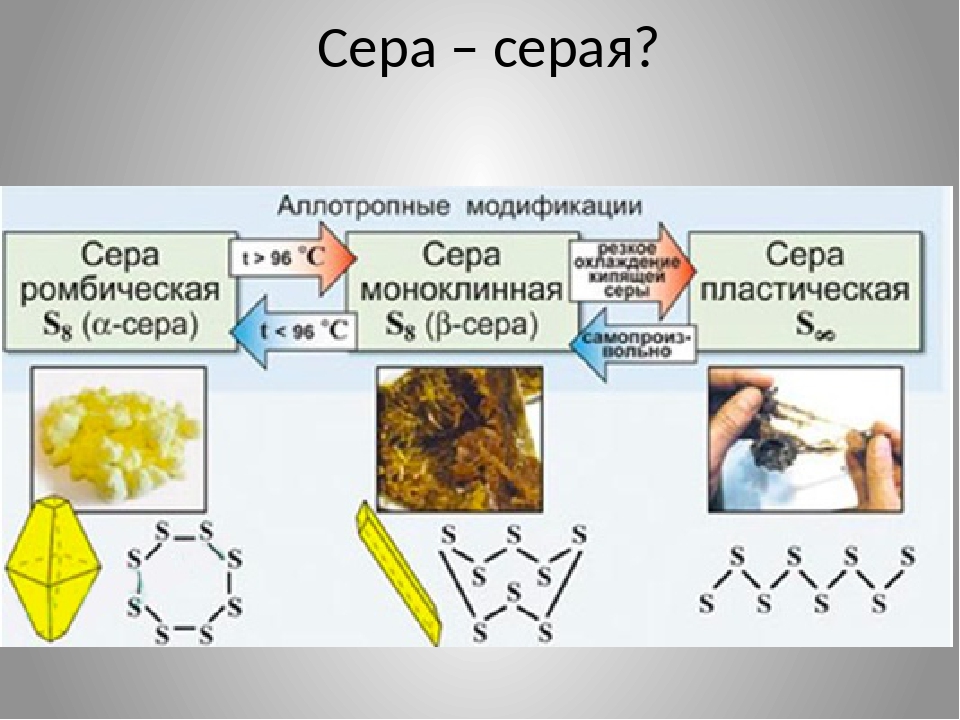
ПРИМЕНЕНИЕ
Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (англ. Sulphur) — S
| Молекулярный вес | 32.06 г/моль |
| Происхождение названия | Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B. 03-10 03-10 |
| Nickel-Strunz (10-ое издание) | 1.CC.05 |
| Dana (7-ое издание) | 1.3.4.1 |
| Dana (8-ое издание) | 1.3.5.1 |
| Hey’s CIM Ref. | 1.51 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | жёлтый, серно-жёлтый, коричневато- или зеленовато-жёлтый, оранжевый, белый |
| Цвет черты | бесцветный |
| Прозрачность | прозрачный, полупрозрачный |
| Блеск | смоляной, жирный |
| Спайность | несовершенная по {001}, {110} и {111} |
| Твердость (шкала Мооса) | 1.5 — 2.5 |
| Излом | неровный, раковистый |
| Прочность | очень хрупкая |
| Отдельность | отдельность по {111} |
| Плотность (измеренная) | 2.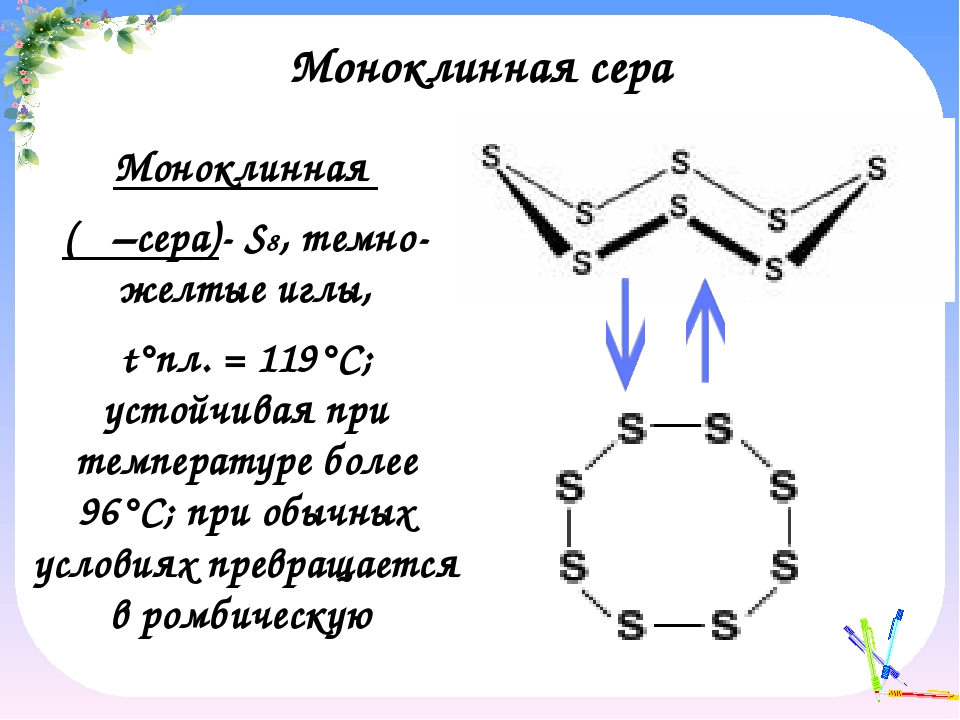 07 г/см3 07 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | двухосный (+) |
| Показатели преломления | nα = 1.958 nβ = 2.038 nγ = 2.245 |
| Максимальное двулучепреломление | δ = 0.287 |
| Оптический рельеф | очень высокий |
| Плеохроизм | видимый |
| Рассеивание | относительно слабое r<v |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | mmm (2/m 2/m 2/m) — ромбо-дипирамидальный |
| Пространственная группа | Fddd |
| Сингония | Ромбическая (орторомбическая) |
| Параметры ячейки | a = 10. 468Å, b = 12.870Å, c = 24.49Å 468Å, b = 12.870Å, c = 24.49Å |
| Двойникование | Двойники по {101}, {011}, {110} довольно редки |
29804
ПРИСОЕДИНЯЙТЕСЬ К НАМ В СОЦСЕТЯХ:
Сера пластическая — Справочник химика 21
К высокомолекулярным неорганическим веществам с цепным строением молекулы можно отнести, например, одну из модификаций серы ( пластическая сера), получаемую быстрым охлаждением расплава серы, нагретого выше 300 °С. Благодаря цепному строению молекулы высокомолекулярная сера обладает каучукоподобной эластичностью. [c.421]
Если расплавленную серу, нагретую до кипения, вылить тонкой струей в холодную воду, то она превращается в мягкую резиноподобную коричневую массу, растягивающуюся в нити. Эта модификация серы называется пластической серой. Пластическая сера уже через несколько часов становится хрупкой, приобретает желтый цвет и постепенно превращается в ромбическую. [c.361]
Эта модификация серы называется пластической серой. Пластическая сера уже через несколько часов становится хрупкой, приобретает желтый цвет и постепенно превращается в ромбическую. [c.361]
Из того факта, что содержание 5(1, находящейся в равновесии с ЗА, в расплаве, возрастает с повышением температуры, следует, что образование 3 из Зд является эндотермическим процессом (принцип Ле Шателье). Поэтому аморфная сера (пластическая сера) неустойчива. После нескольких часов или дней хранения при обыкновенной температуре она переходит в ромбическую серу, которая при этих температурах является устойчивой формой. Путем добавления малых количеств иода или других веществ можно-задержать процесс превращения, увеличивая тем самым устойчивость пластической серы. Было установлено, что длина макромолекул меньше в присутствии иода или сероводорода. [c.367]
Полибутилентерефталат. Обзорная информация. Серия пластические массы и синтетические смолы, НИИТЭХИМ.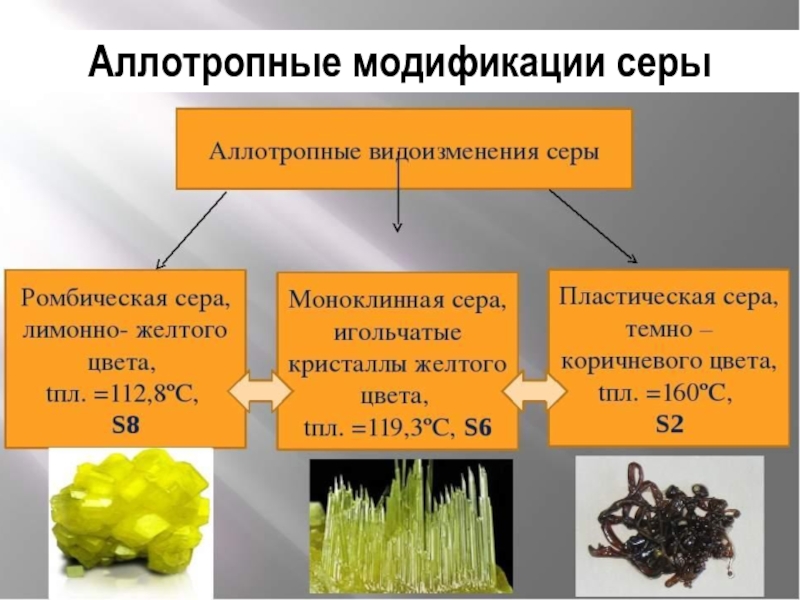 М. [c.285]
М. [c.285]
В процессе отложения этой серии пластических осадков вследствие изменений в скорости опускания коры и скорости седиментации возникла так называемая ритмичность осадочных пород (фиг. 72 и 73), вполне сходная с ритмичностью, обнаруженной в более молодых осадочных бассейнах. [c.251]
В производстве эмульсионных масел с высокими концентрациями серы крекинг-лигроины [737], изобутилен и диизобутилен [359, 738] сульфуризуются элементарной серой. Пластические вяжущие вещества получают при помощи реакции серы на сольвент-экстракты из масляных фракций [739]. [c.150]
Производство олнгоамидов за рубежом. Обзорн. инф. Сер. Пластические массы и синтетические смолы. — М. НИИТЭхим, 1979, с. 2. [c.30]
Третье видоизменение серы — пластическа.ч сера — образуется при быстром застывании расплавленной серы. Пластическая сера превращается постепенно в аморфную (не кристаллическую), а затем в наиболее устойчивое видоизменение серы — октаэдрическую серу.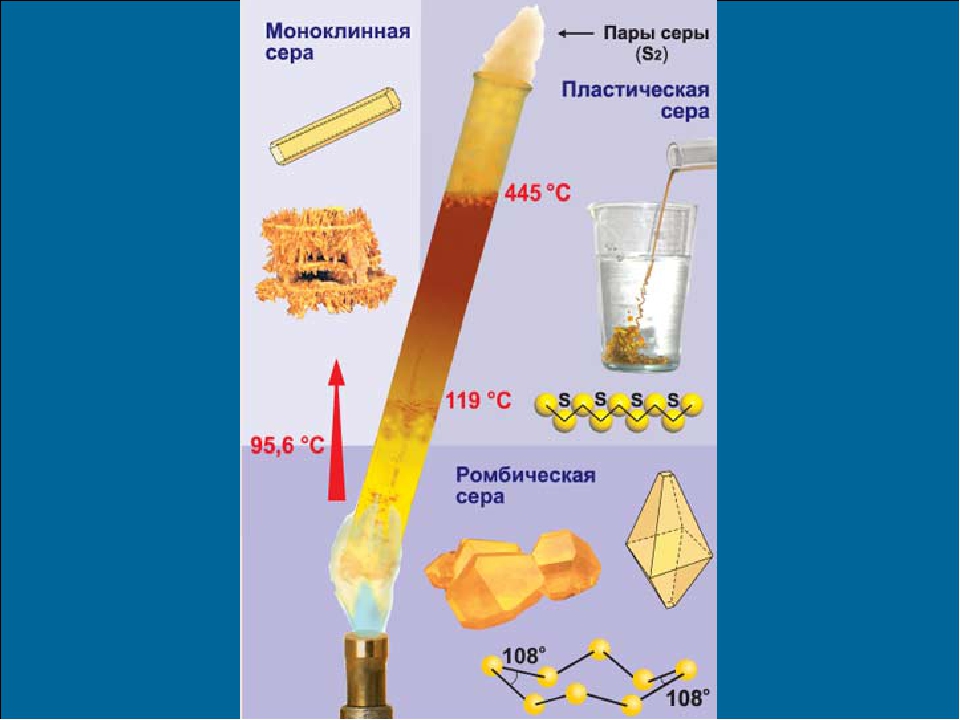 [c.81]
[c.81]
Рассмотрим подробнее явление аллотропии. Различают несколько видов ее. Аллотропия строения зависит от различного состава (а отсюда и от различного строения) молекул. Наблюдается она в чистом виде лишь у неметаллов в их газообразном или парообразном состоянии, например собственно кислород (О2) и озон (О3). А л лотропия формы зависит от различия кристаллит ческих форм (проявление полиморфизма). В чистом виде она наблюдается лишь у металлов (у неметаллов в их твердом состоянии аллотропия формы по суш,еству совпадает с алло-тропией строения, то есть молекулам разного со става обычно отвечают разные кристаллические формы). Примеры а-Ре, -Ре, 8-Ре (центриро ванная кубическая решетка) и у-Ре (центрогранная кубическая) сера ромбическая (58), сера призматическая и сера пластическая (5 ) алмаз—графит белый фосфор (Р4) — черный фосфор. [c.324]
Формула пластической серы в химии
Определение и формула пластической серы
Пластическая сера представляет собой замкнутые или открытые цепи соединяющейся между собой серы. Это вещество коричневого цвета (рис. 1), получаемое при резком охлаждении расплава серы. Через несколько часов после получения пластическая сера становится хрупкой и приобретает желтый цвет постепенно превращаясь в ромбическую модификацию.
Это вещество коричневого цвета (рис. 1), получаемое при резком охлаждении расплава серы. Через несколько часов после получения пластическая сера становится хрупкой и приобретает желтый цвет постепенно превращаясь в ромбическую модификацию.
Рис. 1. Пластическая сера. Внешний вид.
Химическая формула пластической серы
Химическая формула пластической серы может иметь вид S4 или S6. Она показывает, что в составе молекулы этого вещества находится четыре или шесть атомов серы (Ar = 32 а.е.м.). По химической формуле можно вычислить молекулярную массу пластической серы:
Mr(S4) = 4×Ar(S) = 4×32 = 128;
Mr(S6) = 6×Ar(S) = 6×32 = 192.
Структурная (графическая) формула пластической серы
Более наглядной является структурная (графическая) формула пластической серы. Она показывает то, как связаны атомы между собой внутри молекулы. Структурная формула белого фосфора имеет вид:
Электронная формула
Электронная формула пластической серы показывает распределение электронов в атоме по энергетическим подуровням:
16S 1s22s22p63s23p4.
Она также показывает, что сера относится к элементам р-семейства, а также число валентных электронов — на внешнем энергетическом уровне находится 6 электронов (3s23p4).
Примеры решения задач
|
Понравился сайт? Расскажи друзьям! |
| ||
Сера — урок. Химия, 8–9 класс.
Химический элемент
Сера — химический элемент № \(16\). Она расположена в VIА группе третьем периоде Периодической системы.
S16+16)2e)8e)6e
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления \(–2\). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная (\(+4\) или \(+6\)).
Поэтому в соединениях с металлами и водородом сера проявляет степень окисления \(–2\). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная (\(+4\) или \(+6\)).
В земной коре сера встречается в самородном виде или в виде минералов и горных пород: (пирит — FeS2, цинковая обманка — ZnS, свинцовый блеск — PbS, гипс — CaSO4⋅2h3O, глауберова соль — Na2SO4⋅10h3O).
Самородная сера
Свинцовый блеск
Сера относится к макроэлементам живых организмов. Она содержится в белках. Особенно много серы в белках волос, рогов, шерсти. Входит она также в состав некоторых витаминов и гормонов.
Простое вещество
Сера образует несколько аллотропных модификаций. Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.
Молекулы образуют кристаллы разного строения, и поэтому существуют аллотропные видоизменения: ромбическая и моноклинная сера. Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются (\(+112,8\) °С и \(+119,3\) °С).
Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются (\(+112,8\) °С и \(+119,3\) °С).
При нагревании сера плавится, превращается в лёгкую жидкость, а затем начинает темнеть и становится вязкой. Образуется пластическая сера, состоящая из длинных линейных молекул.
В воде сера не растворяется и ею не смачивается. Поэтому порошок серы не тонет в воде, несмотря на более высокую плотность (\(2,07\) г/см³). Такое явление называется флотацией.
Подожжённая сера реагирует с кислородом, и образуется сернистый газ. Сера в этой реакции — восстановитель.
S0+O20=tS+4O2−2.
Окислительные свойства сера проявляет в реакциях с металлами и водородом.
С активными металлами и ртутью реагирует при комнатной температуре:
Hg0+S0=Hg+2S−2.
При нагревании сера вступает в реакцию с большинством металлов — железом, алюминием, цинком и другими, кроме золота и платины.
2Al0+3S0=tAl+32S−23.
В реакциях с металлами образуются сульфиды.
При повышенной температуре сера реагирует с водородом. Образуется сероводород:
h30+S0=th3+1S−2.
Применение серы
- Используется в химической промышленности для производства серной кислоты;
- находит применение в сельском хозяйстве для обеззараживания помещений;
- входит в состав некоторых мазей;
- используется в производстве спичек и бумаги;
- с её помощью каучук превращают в резину;
- входит в состав взрывчатых веществ.
Сера
|
Сера / Sulphur (S) | |
|---|---|
|
Атомный номер |
16 |
|
Внешний вид простого вещества |
светло-желтое хрупкое твердое вещество, в чистом виде без запаха |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
32,066 а. 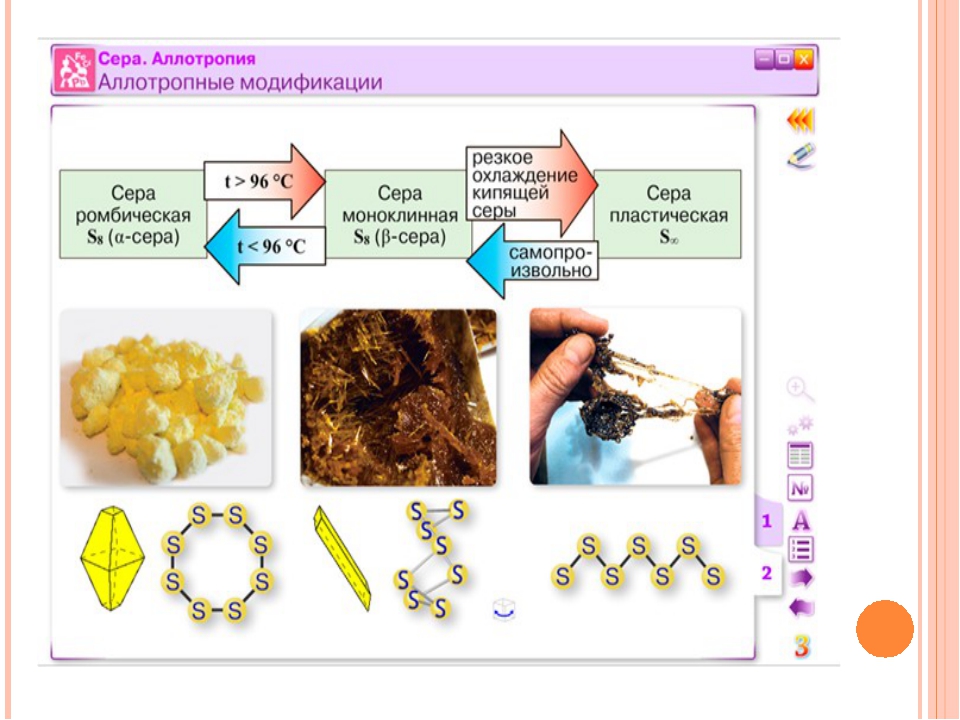 е. м. (г/моль) е. м. (г/моль) |
|
Радиус атома |
127 пм |
|
Энергия ионизации (первый электрон) |
999,0 (10,35) кДж/моль (эВ) |
|
Электронная конфигурация |
[Ne] 3s2 3p4 |
|
Химические свойства | |
|
Ковалентный радиус |
102 пм |
|
Радиус иона |
30 (+6e) 184 (-2e) пм |
|
Электроотрицательность (по Полингу) |
2,58 |
|
Электродный потенциал |
0 |
|
Степени окисления |
6, 4, 2, -2 |
|
Термодинамические свойства простого вещества | |
|
Плотность |
2,070 г/см³ |
|
Молярная теплоёмкость |
22,61 Дж/(K·моль) |
|
Теплопроводность |
0,27 Вт/(м·K) |
|
Температура плавления |
386 K |
|
Теплота плавления |
1,23 кДж/моль |
|
Температура кипения |
717,824 K |
|
Теплота испарения |
10,5 кДж/моль |
|
Молярный объём |
15,5 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
орторомбическая |
|
Параметры решётки |
a=10,437 b=12,845 c=24,369 Å |
|
Отношение c/a |
— |
|
Температура Дебая |
n/a K |
|
S |
16 |
|
32,066 | |
|
[Ne]3s23p4 | |
|
Сера | |
Се́ра (Sulphur — обозн.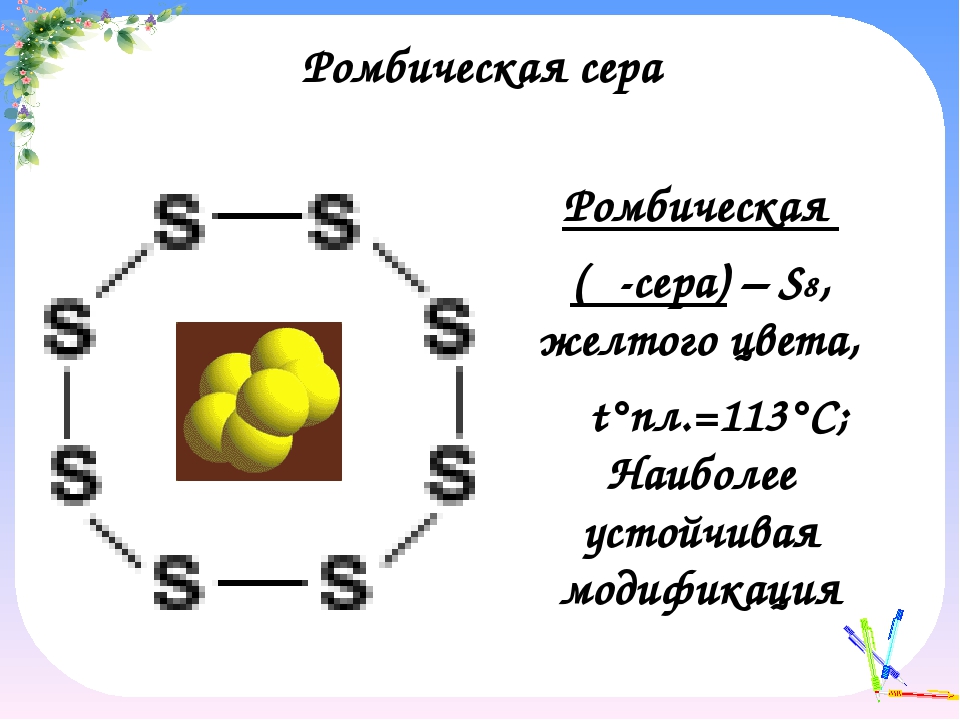 «S» в таблице Менделеева) — высокоэлектроотрицательный элемент, проявляет неметаллические свойства. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде
«S» в таблице Менделеева) — высокоэлектроотрицательный элемент, проявляет неметаллические свойства. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде
Природные минералы серы
Схема атома серы
Сера является шестнадцатым по химической распространенности элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде. Важнейшие природные соединения серы FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.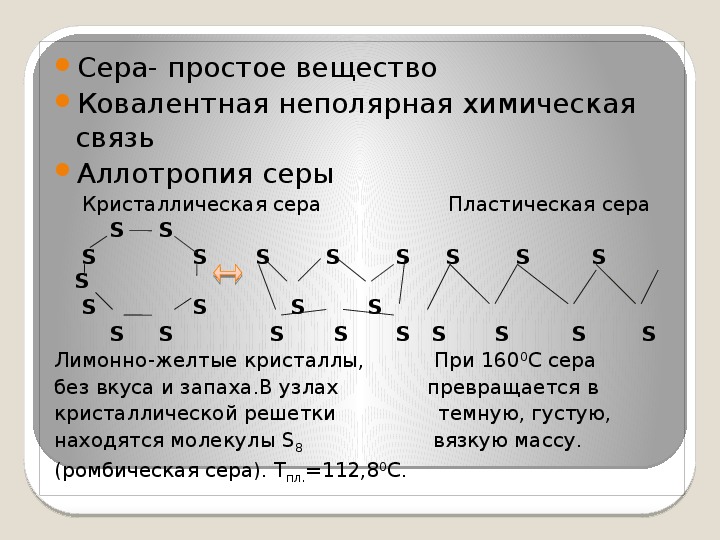
История открытия и происхождение названия
Сера (Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте.
Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте.
В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трех принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом точно происхождение серы не установлено, но как сказано выше этот элемент использовался до Рождества Христова, а значит знаком людям с давних времен.
Происхождение названия
Происхождение латинского sulfur неизвестно. Русское название элемента обычно производят от санскритского «сира» — светло-желтый. Возможно родство «серы» с древнееврейским «серафим» — множественным числом от «сераф» — букв. сгорающий, а сера хорошо горит. В древнерусском и старославянском «сера» — вообще горючее вещество, в том числе и жир.
Возможно родство «серы» с древнееврейским «серафим» — множественным числом от «сераф» — букв. сгорающий, а сера хорошо горит. В древнерусском и старославянском «сера» — вообще горючее вещество, в том числе и жир.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями чистой серы.
Когда образовались эти вкрапления — одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (то есть одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (в переводе с греческого «метасоматоз» означает замещение). Согласно ей в недрах постоянно происходит превращение гипса CaSO4-h3O и ангидрита CaSО4 в серу и кальцит СаСО3.
Данная теория создана в 1935 году советскими учеными Л. М. Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов — среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной.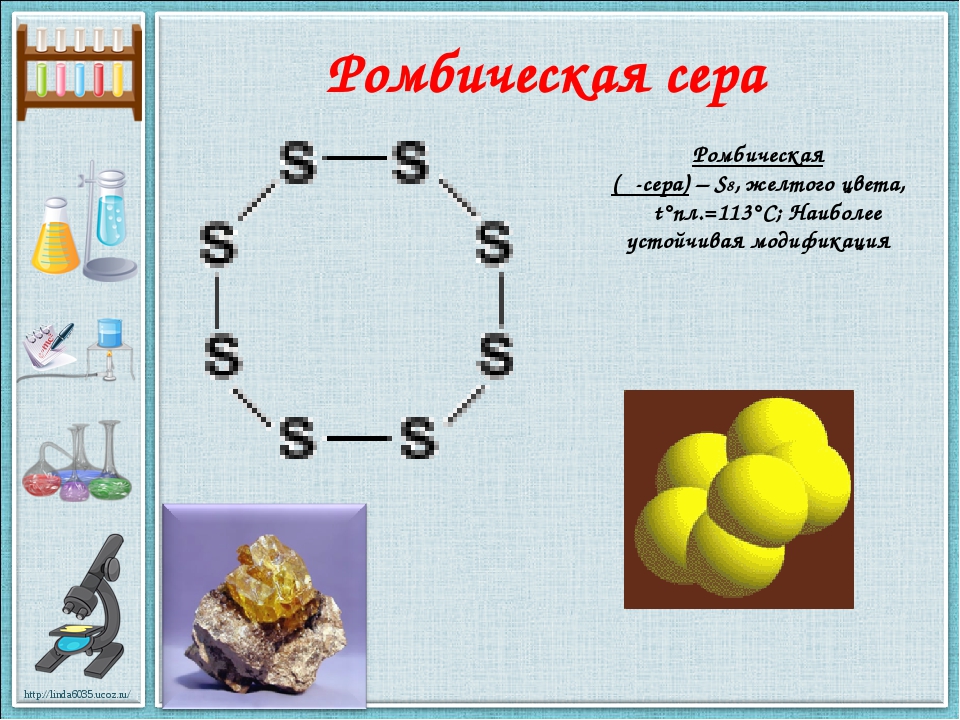 На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Разнообразие теорий и гипотез о происхождении самородной серы — результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Получение
Серу получают главным образом выплавкой самородной серы непосредственно в местах её залегания под землей. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда.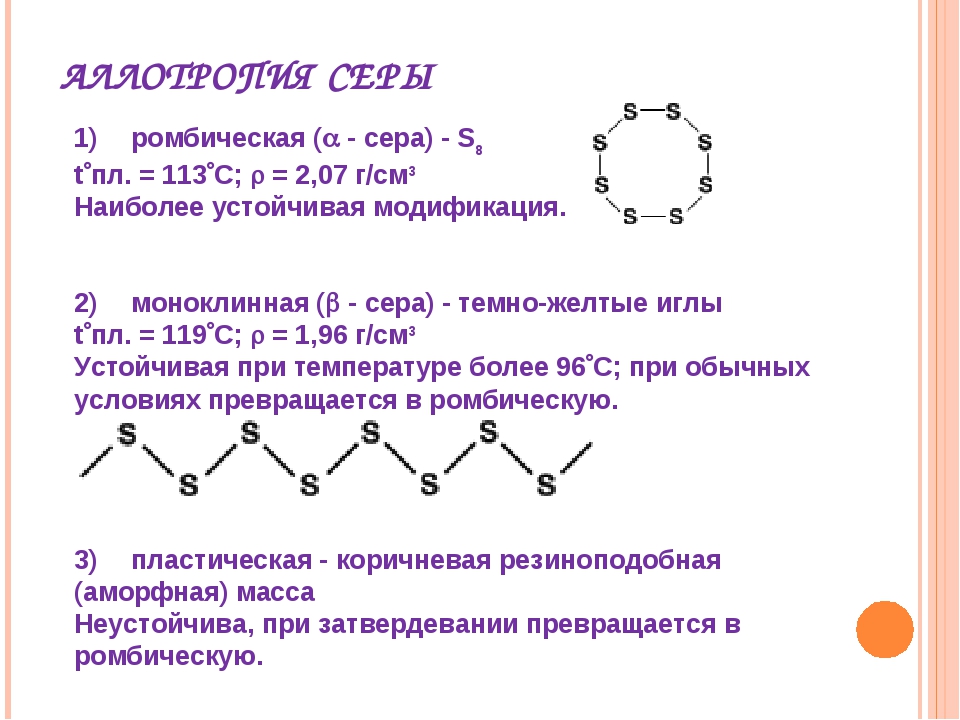 Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
В 1890 г. Герман Фраш, предложил плавить серу под землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (113°C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Также сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Производители
Основными производителями серы в России являются предприятия ОАО Газпром: ООО Газпром добыча Астрахань и ООО Газпром добыча Оренбург, получающие ее как побочный продукт при очистке газа.
Физические свойства
Природный сросток кристаллов самородной серы
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов серы. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество желтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета. Формулу пластической серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде. Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Химические свойства
Горение серы
При комнатной температуре сера реагирует со фтором и хлором, проявляя восстановительные свойства:
S + 3F2 = SF6
S + Cl2 = SCl2
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании, окисляясь:
S + 6HNO3(конц.) = H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4(конц.) = 3SO2 ↑ + 2H2O
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
S + O2 = SO2
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.
При взаимодействии с металлами образует сульфиды. 2Na + S = Na2S
При добавлении к этим сульфидам серы образуются полисульфиды: Na2S + S = Na2S2
При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом:
C + 2S = CS2 (сероуглерод)
Сера при нагревании растворяется в щёлочах — реакция диспропорционирования
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Пожароопасные свойства серы
Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углем, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: распыленная вода, воздушно-механическая пена.
Обнаружение горения серы является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Горение происходит при низкой температуре. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространенными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы.
Так как воздух по объему состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объема кислорода получается один объем SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха и объемное содержание SO2 в газовой смеси меньше теоретически возможного составляя обычно 14…15 %.
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабосветящееся пламя высотой до 5 см. Температура пламени при горении серы составляет 1820 °C
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет Вест Западной Капской провинции Южно-Африканской Республики произошел крупный пожар, погибли два человека.
16 января 2006 г. около пяти вечера на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250-ти квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет.
15 марта 2007 рано утром на ООО «Балаковский завод волоконных материалов» произошел пожар на закрытом складе серы. Площадь пожара составила 20 кв.м. На пожаре работало 4 пожарных расчета с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал.
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Объём горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составил более 9 тысяч килограммов.
В апреле 2008 недалеко от поселка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчетов и спасатели. В тот момент, когда пожарные оказались около склада, горела еще не вся сера, а только ее небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землей и залиты водой.
В июле 2009 в Днепродзержинске горела сера. Пожар произошел на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал.
1. Сера
Лекция
4
Тема.
Сера, азот, фосфор, углерод, кремний, их
соединения, применение
1.1.
Историческая справка
Сера
– одно из немногих веществ, которое
было известно с древнейших времен, её
использовали первые химики. Одна из
причин известности серы – распространенность
самородной серы в странах древнейших
цивилизаций. Её разрабатывали греки и
римляне, производство серы значительно
увеличилось после изобретения пороха.
1.2.
Место серы в Периодической системе
химических элементов Менделеева
Сера
расположена в 16 группе Периодической
системы химических элементов Менделеева.
На
внешнем энергетическом уровне атома
серы содержится 6 электронов, которые
имеют электронную конфигурацию 3s23p4.
В соединениях с металлами сера проявляет
отрицательную степень окисления
элементов -2, в соединениях с кислородом
и другими активными неметаллами –
положительные +2, +4, +6. Сера – типичный
неметалл, в зависимости от типа превращения
может быть окислителем и восстановителем.
1.3.
Распространенность в природе
Сера
довольно широко распространена в
природе. Её содержание в земной коре
составляет 0,0048 %.Значительная часть
серы встречается в самородном состоянии.
Также
сера встречается в форме сульфидов:
пирит, халькопирит и сульфатов: гипс,
целестин и барит.
Много
соединений серы содержится в нефти
(тиофен C4H4S,
органические сульфиды) и нефтяных газах
(сероводород).
1.4.
Аллотропные модификации серы
Существование
аллотропных модификаций серы связано
с её способностью образовывать устойчивые
гомоцепи – S – S –. Устойчивость цепей
объясняется тем, что связи – S – S –
оказываются прочнее, чем связь в молекуле
S2.
Гомоцепи серы имеют зигзагообразную
форму, поскольку в их образовании
принимают участие электроны взаимно
перпендикулярных р-орбиталей.
Существует
три аллотропные модификации серы:
ромбическая, моноклинная и пластическая.
Ромбическая и моноклинная модификации
построены из циклических молекул S8,
размещенных по узлам ромбической и
моноклинной решеток.
Молекула
S8
имеет форму короны, длины всех связей
– S – S – равны 0,206 нм и углы близки к
тетраэдрическим 108°.
В
ромбической сере наименьший элементарный
объем имеет форму прямоугольного
параллелепипеда, а в случае моноклинной
серы элементарный объем выделяется в
виде скошенного параллелепипеда.
Кристалл
ромбической серы Кристалл моноклинной
серы
Пластическая
модификация серы образована спиральными
цепями из атомов серы с левой и правой
осями вращения. Эти цепочки скручены и
вытянуты в одном направлении.
При
комнатной температуре устойчива
ромбическая сера. При нагревании она
плавится, превращаясь в желтую
легкоподвижную жидкость, при дальнейшем
нагревании жидкость загустевает, так
как в ней образуются длинные полимерные
цепочки. При медленном охлаждении
расплава образуются темно-желтые
игольчатые кристаллы моноклинной серы,
а если вылить расплавленную серу в
холодную воду, получится пластическая
сера – резиноподобная структура,
состоящая из полимерных цепочек.
Пластическая и моноклинная сера
неустойчивы и самопроизвольно превращаются
в ромбическую.
1.5. Физические свойства серы
Сера представляет
собой твердое хрупкое вещество желтого
цвета, в воде практически нерастворима,
не смачивается водой и плавает на её
поверхности. Хорошо растворяется в
сероуглероде и других органических
растворителях, плохо проводит тепло и
электрический ток. При плавлении сера
образует легкоподвижную жидкость
желтого цвета, которая при 160°С темнеет,
её вязкость повышается, и при 200°С сера
становится темно-коричневой и вязкой,
как смола. Это объясняется разрушением
кольцевых молекул и образованием
полимерных цепей. Дальнейшее нагревание
ведет к разрыву цепей, и жидкая сера
снова становится более подвижной. Пары
серы имеют цвет от оранжево-желтого до
соломенно-желтого цвета. Пар состоит
из молекул состава S8,
S6,
S4,
S2.
При температуре выше 150 °С молекула
S2 диссоциирует
на атомы.
Физические
свойства аллотропных модификаций серы
приведены в таблице:
Свойство | Ромбическая сера | Моноклинная сера | Пластическая сера | ||||||
Цвет |
|
|
| ||||||
Плотность, | 2,07 | 1,96 | — | ||||||
Температура | 112,8 | 119,3 | — | ||||||
Температура | 444,6 | ||||||||
Серная пробка может спровоцировать головокружение и нарушение координации движений
Обычно, мы просто чистим уши, избавляясь от избытка ушной серы с помощью ватных палочек, не задумываясь о предназначении этой субстанции. Но, отоларингологи утверждают, что внешний вид ушной серы может многое рассказать о состоянии здоровья человека. Мы подготовили подборку фактов об ушной сере, многие из которых удивляют и заставляют обратить более пристальное внимание на «ушную смазку»
Защита от развития грибковых инфекций и воспалений
Ушная сера — это вещество, которое вырабатывается серозными железами, расположенными в наружном слуховом проходе. Ее основная миссия — чистка и защита слуховых каналов. Сера не допускает попадания в ухо мелких предметов, пыли и насекомых, защищает от развития грибковых инфекций и воспалений. Если бы наши органы слуха не вырабатывали достаточное количество серы, то людям грозила бы неизбежная глухота.
В состав ушной серы входят минералы и аминокислоты
В состав этой липкой субстанции входят жироподобные вещества, белки, минералы и аминокислоты. Когда сера попадает в наружную часть уха, ее состав несколько меняется за счет частиц кожи, мелких волосков, пыли.
Ватные палочки вред или польза?
Этот секрет – отличное смазочное вещество наружных слуховых каналов, предотвращающее их пересыхание. Исследователи отметили, что влажность серы у обитателей разных климатических зон сильно отличается. Феномен объясняется тем, что выработка липидов у обитателей южных широт значительно ниже, чем у северян. Вторая не менее важная функция серы — самоочищение ушей. Вы наверняка слышали о том, что некоторые врачи выступают против использования ватных палочек для гигиены ушных раковин. По их мнению, такой способ санации приводит к тому, что сера накапливается в глубине слухового канала и формирует ушные пробки. Эскулапы считают, что стоит позволить сере свободно покидать уши, без помощи со стороны.
Жидкая «ушная смазка» укажет на воспалительный процесс
Если Ваше здоровье в норме, то сера будет иметь вязкую консистенцию. Чересчур жидкая, вытекающая «ушная смазка» указывает на воспалительный процесс, либо на травму уха. В данном случае не стоит заниматься самолечением — обратитесь за консультацией к лору. Очень сухая сера говорит о том, что вашему организму не хватает жиров. Если после изменения рациона сера не приобрела нормальной консистенции, это признак развития дерматита или грибковой инфекции. Слоистая структура ушной серы может указывать и на возрастные изменения. Дело в том, что с годами железы организма постепенно уменьшают интенсивность работы, поэтому количество и консистенция серы у людей за 50 меняется. Это естественные процессы и опасаться их не стоит.
Прослушивание музыки на высокой громкости провоцирует грибковую инфекцию
Начнем с того, что оптимальный цвет серы светло-коричневый. Однако бывают ситуации, когда выделения из уха приобретают несвойственный оттенок. Потемнение ушной серы в купе с носовыми кровотечениями – симптомы опасного заболевания, синдрома Рандю-Ослера. Немедленно обратитесь к врачу! Желтый цвет серы указывает на гнойное воспаление уха. Обычно такое изменение цвета серы сопровождается повышением температуры, слабостью. При прикосновении ухо сильно болит. Опытный отоларинголог выявит возбудитель инфекции и назначит необходимые для лечения препараты — антибиотики или противовирусные. Сера черного цвета указывает на грибковую инфекцию. Дополнительные симптомы этого недуга: боль внутри уха, ухудшение слуха, сильный зуд, неприятный запах (тухлой рыбы, гнилостный). Спровоцировать грибковую инфекцию может микротравма от ушной палочки, прослушивание музыки на высокой громкости, использование наушников неподходящего размера. Ушная сера серого цвета довольно часто бывает у жителей больших городов. Серый цвет – это обыкновенная пыль. Такой цвет ушной серы не должен Вас пугать. Сера может приобретать белый цвет, что указывает на недостаток в организме важных микроэлементов. Скорее всего, лор назначит Вам прием курса витаминов и диету, обогащенную необходимыми минералами. Во время чистки ушей Вы заметили кровь? Необходимо как можно скорее обратиться к врачу! Речь может идти о нарушении целостности барабанной перепонки. Такая травма чревата отитом и ухудшением слуха.
Неприятный запах ушной серы и хронический отит
Вернемся к неприятному запаху. Он может указывать на наличие инфекции среднего уха. Это заболевание специалисты называют «хроническим отитом». Помимо сильного запаха ушной серы, он сопровождается ухудшением слуха, звоном в ушах, ощущением заложенности уха. Безусловно, если Вы наблюдаете у себя вышеупомянутые симптомы, необходимо запланировать визит к отоларингологу на ближайшее время.
Перекись водорода для чистки ушей
Говоря об ушной сере, мы не можем обойти тему серных пробок. От их образования никто не застрахован. Обычно, причиной формирования серных пробок бывают инфекционные заболевания, которые стимулируют активную выработку серы. Бактерии и инфекции меняют структуру серы, делая ее более вязкой, липкой. Из-за этого сера не может естественным образом покинуть ушной канал и, скапливаясь там, закупоривает его. Как было сказано выше, бытует мнение, что чистить уши ватными палочками неправильно. Таким способом мы извлекаем лишь малую часть серы, — остальная проталкивается вглубь, смещаясь в направлении барабанной перепонки. Отоларингологи рекомендуют использовать трехпроцентную перекись водорода для чистки ушей. Ее нужно закапать в уши (по паре капель в каждый слуховой проход). Через несколько минут жидкость удаляют с помощью ватных дисков, попеременно потряхивая головой то в одну, то в другую сторону. Обратите внимание, что температура перекиси водорода должна быть комнатной. Ушная пробка провоцирует снижение слуха, боль и ощущение дискомфорта в ухе. Серная пробка может провоцировать подташнивание, головокружение, укачивание и нарушение координации движений, потому что уши отвечают не только за слух, но и за чувство равновесия. Вестибулярный аппарат находится во внутреннем ухе. Специалисты не рекомендуют пытаться самостоятельно справиться с серной пробкой. Эту проблему сможет решить только врач в амбулаторных условиях. Помните, что игнорировать серную пробку нельзя, так как она провоцирует серьезное воспаление ушных каналов, которое со временем может привести к поражению тканей мозга!
Посещение медицинского центра «Актив-Медикал» поможет справиться с этой неприятной, но не критичной ситуацией в кратчайшие сроки. Серная пробка будет вымыта оториноларингологом, Вы избавитесь от дискомфорта, слух нормализуется, серные железы буду работать в «штатном режиме». На прием и консультацию к нашим специалистам можно записать по телефону (0512) 777-888.
Лучший способ сделать пластмассу из серы — ScienceDaily
Ученые из Ливерпульского университета открыли новый процесс производства полимеров из серы, который может обеспечить способ изготовления пластмассы, менее вредной для окружающей среды.
Сера — это химический элемент в большом количестве, который можно найти в виде месторождения полезных ископаемых по всему миру. Это также отходы переработки сырой нефти и газа в нефтехимической промышленности, которые создают огромные запасы серы за пределами нефтеперерабатывающих заводов.
Несмотря на то, что сера идентифицирована как интересная возможная альтернатива углю при производстве полимеров, сама по себе сера не может образовывать стабильный полимер, но, как показывает процесс, называемый «обратная вулканизация», она должна реагировать с молекулами органического сшивающего агента, чтобы сделать его стабильным. . Этот процесс может потребовать высоких температур, длительного времени реакции и образования вредных побочных продуктов.
Однако исследователи из Института возобновляемых источников энергии Стивенсона Ливерпульского университета, работающие в области химии материалов, сделали открытие, которое может изменить правила игры.
В исследовании, опубликованном в Nature Communications , они сообщают об открытии нового каталитического процесса обратной вулканизации, который сокращает необходимое время реакции и температуру, предотвращая при этом образование вредных побочных продуктов. Это также увеличивает выход реакции, улучшает физические свойства полимеров и позволяет использовать более широкий диапазон сшивающих агентов.
Синтетические полимеры повсеместно используются в жизни человека и являются одними из самых широко производимых материалов на Земле.Однако с учетом того, что ежегодно производится почти 350 миллионов тонн пластика, в сочетании с растущими экологическими проблемами и сокращением нефтехимических ресурсов, существует острая необходимость в разработке новых более устойчивых полимеров.
Доктор Том Хэзелл, научный сотрудник Королевского общества при университете, группа которого проводила исследование, сказал: «Производство полимеров (пластмасс) из серы может изменить правила игры. -продукт из нефти, может уменьшить зависимость общества от полимеров, сделанных из самой нефти.Кроме того, эти полимеры серы может быть легче переработать, что открывает захватывающие возможности для сокращения текущего использования пластмасс.
«Есть также возможности для создания уникальных новых полимеров с беспрецедентными свойствами. Сера по своим свойствам сильно отличается от углерода, и это уже открыло мир возможных применений серных полимеров, включая тепловизионные линзы, батареи, очистку воды и человека. здоровья.
«Мы сделали ключевое открытие, когда решили вдохновиться ускорением традиционной вулканизации резины.В настоящее время это исследование знаменует собой значительный шаг вперед в разработке полимеров с обратной вулканизацией. Это делает обратную вулканизацию более широко применяемой, эффективной, экологичной и производительной, чем предыдущие способы, не только расширяя саму фундаментальную химию, но также открывая двери для индустриализации и широкого применения этих увлекательных новых материалов во многих областях химической и химической промышленности. материаловедение ».
История Источник:
Материалы предоставлены Ливерпульским университетом . Примечание. Содержимое можно редактировать по стилю и длине.
Пластмассы будущего могут быть сделаны из серы, а не из нефти, что позволит эффективно использовать отходы
Вы спросите, что для меня когда-либо сделала химия? Как сказал Дастину Хоффману один из его потенциальных наставников в «Выпускнике», один ответ — пластмассы — одно из величайших химических инноваций 20-го века.
Большинство пластиковых изделий изготовлено из таких химикатов, как полиэтилен (ПЭТ), полипропилен (ПП), полиуретан или поливинилхлорид (ПВХ), которые все производятся из нефти.Эти мономеры получают промышленным способом путем фракционной перегонки сырой нефти и полимеризуются в больших количествах с помощью катализаторов в процессе, разработанном в 1950-х и 60-х годах. Химики Карл Циглер и Джулио Натта разделили Нобелевскую премию по химии 1963 года за свой процесс титанового катализатора, который с точки зрения рентабельности еще предстоит улучшить.
Таким образом, промышленное сырье и методы производства пластмасс не претерпели существенных изменений за более чем 60 лет. Но ситуация сложилась: нефть труднее достать и (обычно) дороже, а давление на окружающую среду растет.Если мы хотим сохранить пластмассы, нам нужно будет найти новые способы их производства.
Сера — важный для здоровья минерал, твердый, но ядовитый, как газ. Сера обычно вызывает в воображении яркие образы огня, вулканов и даже самого ада из-за своего архаичного названия сера. Но на самом деле сера является отходом многих промышленных процессов и может быть альтернативой маслу для производства пластмасс.
При правильных условиях, первоначально открытых Джеффри Пьюном, сера может изменить свою обычную кольцевую химическую структуру и вместо этого образовать длинные цепочки.Эти цепочки серы можно соединить вместе, чтобы создать твердый пластик или резину, используя другие органические молекулы, чтобы связать их вместе. Этот процесс называют обратной вулканизацией, поскольку он противоположен процессу вулканизации, применяемому к углю для производства резины.
Запатентованный Чарльзом Гудиером в 1844 году, процесс вулканизации соединяет длинные цепочки молекул углерода с использованием серы, превращая жидкое масло в твердый каучук. Таким образом, в то время как резина в основном состоит из углерода с небольшим количеством серы, пластмассы на основе серы, наоборот, в основном состоят из серы с небольшим количеством углерода.Если мы заменим большую часть пластмасс, изготовленных из нефти, пластиками, сделанными из серы, это снизит спрос на нефть и в то же время приведет к использованию огромного количества отработанной серы — пирамиды серы, изображенные выше, являются побочными продуктами переработки битуминозных песков Альберты.
В ходе нашего исследования было изучено, как изменить способ действия полимеров серы, чтобы сделать их пригодными для различных целей. Например, мы можем изменить свойства и пропорцию углерода в зависимости от того, что требуется: твердый пластик содержит больше молекул углерода, а мягкий — меньше.Мы также можем добавить в смесь наночастицы, которые обладают свойствами, которые мы хотим, чтобы пластик имел, поскольку они передают свои характеристики конечному пластическому результату.
Нефтяные компании уже тратят миллиарды долларов на удаление сернистых соединений из нефти каждый год для соблюдения экологических норм, поскольку сера в воздухе образует серную и азотную кислоту, которая выпадает в виде разрушительных кислотных дождей. А по мере того, как нефтяная промышленность обращается к добыче нефти из богатых серой битуминозных песков, количество серы в отходах значительно возрастает.
Созданные из битуминозных песков, серные пирамиды Альберты имеют высоту до десяти этажей.
Эшли Купер / tarsandssolutions.org, CC BY-NC
Процессы, разработанные нами и другими, показали, что полимеры с обратной вулканизацией не только жизнеспособны, но и могут быть адаптированы для различных областей применения, просто путем нагревания расплавленной серы и органических молекул при 185 ° C в течение 8-10 минут без нагрева. нужен катализатор. Исследование того, как это будет работать в больших масштабах, показало, что даже более низких температур может быть достаточно.
Что касается настраиваемых физических свойств, полимерам можно придавать различные формы, и возможна удивительная детализация. Варьируя органическое содержание, полимеры могут производить твердые стеклоподобные пластмассы или липкие, податливые вещества, которые могут использоваться в качестве адгезивов. Эта физическая настраиваемость привела к их использованию даже в качестве катодного материала для нового поколения литий-серных батарей. Полимеры серы также демонстрируют замечательные оптические свойства, приобретая естественный прозрачный рубиново-красный цвет.Это может быть использовано для инфракрасных линз и / или оптических фильтров. На этом раннем этапе ученые лишь поверхностно оценивают то, что может быть возможным.
Серно-полимерные материалы находятся в зачаточном состоянии. Но если учесть масштабы и скорость развития пластмасс за последние 60 лет, эти материалы могут стать прорывом в сокращении потребления ископаемого топлива и направить нас на путь к ответственному энергетическому будущему. А кто знает? Возможно, вы откроете для себя еще много удивительных мест.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Аллотропы серы | Эксперимент
В этом эксперименте ученики наблюдают, что происходит, когда сера медленно и постепенно нагревается от комнатной температуры до тех пор, пока она не плавится и не закипает.
Свежий образец серы нагревают до температуры чуть выше точки плавления, затем дают ему остыть и медленно кристаллизовать в виде моноклинной серы. Следующий образец нагревается до точки кипения, и жидкость быстро охлаждается в холодной воде с образованием пластичной серы. Третий образец растворяют в теплом растворителе, и раствору дают остыть и испаряться, оставляя кристаллы ромбической серы.
Все наблюдаемые изменения свойств могут быть связаны с различными структурными формами трех твердых образцов серы (аллотропов). Учащиеся могут увидеть, как происходят эти изменения в структуре по мере постепенного повышения температуры жидкой серы.
Практика описана здесь в качестве демонстрации. Однако некоторые учителя могут пожелать подумать, можно ли использовать определенные части в качестве практических занятий с должным образом квалифицированными и надежными классами.
Демонстрация без сопутствующего обсуждения возможных причин структурных изменений свойств займет до 45 минут.Однако, чтобы получить максимальную пользу от эксперимента, необходимо выделить больше времени на такое обсуждение.
Оборудование
Аппарат
- Защита глаз
- Термостойкие перчатки
- Доступ к вытяжному шкафу
- Flexicam или аналогичный фотоаппарат, цифровой микроскоп, цифровой проектор и экран (или другой метод проецирования изображений мелких кристаллов в класс, если таковой имеется)
- Варочные трубы, 4 шт. (См. Примечание 7 ниже)
- Держатели для пробирок, 2 шт.
- Штатив для пробирок
- Стойки и зажимы, 2 шт.
- Колба коническая, 250 см 3
- Пробка для конической колбы
- Стакан, 250 см 3 , x2
- Стакан, 1 дм 3 (см. Примечание 8)
- Термометр, 0–250 ° C
- Чашки Петри или очки, 4 шт. (Или более)
- Горелка Бунзена, штатив и марля или электрические конфорки, 2 шт. (Опция, если имеется)
- Термостойкие маты, 2 шт.
- Фильтровальная бумага диаметром 18–20 см
- Шпатель
- Скрепки
- Влажная ткань (для тушения небольших возгораний серы)
Химическая промышленность
- Сера в порошке в рулоне, 100 г
- Диметилбензол (ксилол), (ВРЕДНО), 100 см 3
- Растительное масло, 700 см 3
Примечания по технике безопасности и охране труда
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Используйте средства защиты глаз во всем.
- Sulfur, S 8 (s) — см. CLEAPSS Hazcard HC096A. Используемая сера должна быть рулонной серой, измельченной до порошка. Чтобы раздавить рулоны серы, поместите их в прочный полиэтиленовый пакет на твердую поверхность. Используйте молоток или тиски, чтобы разбить серу на мелкие кусочки, затем растолочь в ступке пестиком. «Цветки серы» не подходят, так как содержат много нерастворимой аморфной серы.
- Диметилбензол (ксилол), (CH 3 ) 2 C 6 H 4 (l), (ВРЕДНО) — см. CLEAPSS Hazcard HC046a.Хотя другие углеводородные растворители, такие как метилбензол, могут использоваться для растворения серы и образования моноклинной серы, диметилбензол (ксилол) является наименее опасным.
- Кулинарное масло — Если подходящего кулинарного масла нет, можно использовать другие прозрачные высококипящие масла, например парафиновое масло — см. CLEAPSS Hazcard HC045b.
- Во время экспериментов сера может загореться с выделением диоксида серы (ТОКСИЧНЫЙ — см. CLEAPSS Hazcard HC097), что может вызвать затруднение дыхания у некоторых студентов.В этом случае быстро потушите, накрыв рот пробирки влажной тканью. Если возгорание не удается быстро погасить, пробирку следует поместить в вытяжной шкаф, а вентилятор оставить работающим.
- Это большие (150 x 25 мм) пробирки, которые должны быть чистыми и сухими. Пробирки, в которых была нагрета сера, бывает трудно очистить при обычном использовании. Для этого эксперимента, возможно, стоит из года в год хранить набор таких трубок.
- Большой стакан, содержащий масло для жарки, действует как масляная ванна для медленного и равномерного нагрева серы, позволяя студентам ясно видеть, что происходит с серой.Для масляной ванны могут быть предпочтительны другие контейнеры, при условии сохранения видимости, например, с помощью веб-камеры и цифрового проектора.
Процедура
Перед демонстрацией
- Предварительно нагрейте масляную баню примерно до 130 ° C и поддерживайте эту температуру.
- Зажмите одну из серосодержащих трубок в масляной ванне так, чтобы сера была ниже уровня масла в ванне.
- Наполовину заполните стакан 250 см 3 холодной водой.
- Из вытяжного шкафа налейте около 10 г порошковой серы в коническую колбу и добавьте около 100 см 3 диметилбензола.
- Приготовьте конус фильтровальной бумаги, скрепленный скрепкой и поддерживаемый в стакане, как показано ниже:
Показать полноэкранный режим
Демонстрация
- Две трети наполняют две пробирки порошкообразной рулонной серой (около 20 г в каждой пробирке) и помещают в масляную баню. Сера превратится в прозрачную подвижную жидкость янтарного цвета примерно за 15 минут.
- Выньте одну трубку из масляной бани и вылейте расплавленную серу в конус фильтровальной бумаги. Дайте сере медленно остыть и затвердеть, образуя корку.
- Разбейте корку шпателем и, удерживая конус фильтровальной бумаги в термостойких перчатках, наклоните его так, чтобы оставшаяся жидкость вытекла из конуса затвердевающей серы на кусок макулатуры или картона (для утилизации). Внутри полого конуса будут видны игольчатые кристаллы моноклинной серы. Когда остынет, конус можно передавать по классу.Возможно, потребуется сломать конус, чтобы легче было рассмотреть кристаллы.
- В течение следующего дня или двух время от времени внимательно смотрите на игольчатые кристаллы. Они будут медленно помутнеть, но сохранят свою форму иглы, поскольку моноклинная форма медленно превращается в более стабильную ромбическую серу — каждая игла становится массой крошечных ромбических кристаллов.
Сера жидкая
- Извлеките вторую трубку из горячего масла с помощью надежного держателя для пробирок и вытрите масло бумажным полотенцем.Осторожно нагрейте расплавленную серу на небольшом пламени Бунзена, поддерживая движение содержимого во избежание локального перегрева. Жидкость темнеет и довольно внезапно становится вязкой гелеобразной субстанцией. Это происходит при температуре около 200 ° C.
- Трубку можно перевернуть, в ней останется сера. Покажите, что подвижная жидкость повторно образуется при охлаждении.
- Теперь медленно и равномерно нагрейте серу до гелеобразной стадии. Сера снова превращается в жидкость очень темного красно-коричневого цвета.Обратите внимание, что во время этого нагревания сера может загореться и образоваться диоксид серы. Приготовьте термостойкий коврик или влажную ткань, чтобы накрыть горлышко трубки, чтобы погасить синее пламя.
- Когда сера закипит (441 ° C), медленно вылейте жидкую серу в стакан с холодной водой. Сформируется запутанная масса коричневой пластичной серы.
- Дайте ему полностью остыть. Внутренняя часть пластичной серы может оставаться расплавленной после того, как внешняя часть затвердеет.
- Удалите пластичную серу из воды и покажите, что она эластичная — она может растягиваться и вернется к своей первоначальной форме.
- Блестящая поверхность пластичной серы начинает тускнеть, и в течение 30 минут теряется часть эластичности, поскольку она снова начинает превращаться в более стабильную ромбическую серу.
- Оставьте пластиковую серу до следующего урока, чтобы следить за ходом этого изменения. Это будет очень заметно примерно через неделю, но полное изменение займет много времени.Он станет хрупким.
Сера ромбическая
- Осторожно нагрейте коническую колбу, содержащую серу и диметилбензол, примерно до 50 ° C (предпочтительно на электрической плитке) для полного растворения серы. Некоторые учителя могут предпочесть сделать это до демонстрации, чтобы сэкономить время.
- Налейте немного раствора в каждую из чашек Петри или стаканов для часов и оставьте их в вытяжном шкафу, чтобы растворитель испарился. Это займет около 10 минут.
- Образовавшиеся маленькие кристаллы ромбической серы по возможности следует рассматривать путем проецирования изображения на экран.
Учебные заметки
Некоторые этапы этой демонстрации требуют много времени, например, плавление серы в масляной ванне, растворение серы в диметилбензоле и испарение растворителя. Некоторые учителя могут предпочесть растопить немного серы перед уроком и приготовить ромбические кристаллы перед уроком, чтобы сэкономить время. В последнем случае более медленное испарение (которое может быть вызвано накрытием чашки Петри фильтровальной бумагой с несколькими отверстиями) приведет к образованию более крупных кристаллов.Особенно крупные и / или хорошо сформированные кристаллы можно сохранить в качестве примеров для будущего использования.
Моноклинные кристаллы могут быть образованы путем охлаждения горячего раствора серы в кипящем диметилбензоле, так что кристаллизация начинается при температуре выше 96 ° C.
Сероуглерод в прошлом использовался в качестве лучшего растворителя для получения ромбической серы, однако его запах, токсичность и высокая воспламеняемость делают его непригодным для использования в школах — см. CLEAPSS Hazcard HC020b.
Очень медленный нагрев необходим, чтобы все изменения нагрева серы были четко видны.Сера является плохим проводником тепла, поэтому изменения могут накладываться друг на друга, если нагревание происходит слишком быстро. С помощью горелки Бунзена сложно нагревать достаточно медленно — отсюда и использование масляной ванны.
Сера кристаллическая состоит из сморщенных колец S 8 в форме коронок. Их можно упаковать вместе двумя способами — для образования ромбических кристаллов и для образования игольчатых моноклинных кристаллов, как показано ниже:
Показать в полноэкранном режиме
Ниже 96 ° C ромбическая сера является более стабильным аллотропом.При плавлении при температуре около 118 ° C сера сначала образует подвижную жидкость янтарного цвета, содержащую кольца S 8 . Если дать ему остыть, образуется моноклинная сера, поскольку кристаллизация происходит при температуре выше 96 ° C.
Моноклинная сера будет медленно превращаться в более стабильную ромбическую форму при выдерживании ниже 96 ° C.
Дальнейшее нагревание жидкости, содержащей S 8 , разбивает кольца на цепочки S 8 . Они могут соединяться, образуя более длинные цепочки, которые запутываются, вызывая увеличение вязкости.При более высоких температурах эти цепочки разрываются на более короткие, возможно, такие короткие, как S 2 , и вязкость снова уменьшается.
При быстром охлаждении этой жидкости образующаяся твердая сера улавливается в виде запутанной цепочки — это пластичная сера. При растяжении цепи разматываются, а при снятии напряжения они возвращаются в частично свернутое состояние (см. Диаграмму ниже).
Если твердая сера образуется при температуре ниже 96 ° C путем кристаллизации из раствора, образуется стабильная ромбическая форма.
Показать в полноэкранном режиме
Улучшенный процесс производства пластмасс из серы — Новости
УЧЕНЫЕ во главе с Ливерпульским университетом, Великобритания, открыли новый каталитический процесс производства пластмасс из серы. Такой подход может обеспечить способ производства более экологически чистых пластмасс, потенциально с новыми применениями.
Синтетические полимеры — одни из самых широко производимых материалов на Земле.Ежегодно производится почти 380 млн т пластика. Подавляющее большинство синтетических полимеров производится из ограниченных ресурсов, полученных из нефтехимии, ресурсы сокращаются, а экологические проблемы усиливаются. В настоящее время существует острая потребность в новых, более устойчивых полимерах.
Сера — элемент в большом количестве. Он обнаружен как месторождение полезных ископаемых по всему миру и является отходом переработки сырой нефти и газа в нефтехимической промышленности. Более 70 млн т / год образуется в виде отходов.Сера была определена как альтернатива углю для производства полимеров, и стабильные полимеры могут быть получены с помощью процесса обратной вулканизации, в котором используются органические сшивающие агенты для стабилизации полимеров. Однако этот процесс требует высоких температур и длительного времени реакции и приводит к образованию вредных побочных продуктов.
Исследователи использовали диэтилдитиокарбамат цинка (Zn-DTC) 2 в качестве катализатора или ускорителя. Это позволило проводить полимеризацию серы при пониженных температурах и времени реакции.Катализация также значительно снизила производство высокотоксичного побочного продукта, газа H 2 S, при каталитических реакциях, производящих до семи раз меньше H 2 S. Эти факторы в значительной степени позволяют масштабировать и использовать эти уникальные материалы.
Обычно для индукции полимеризации серы требуются температуры более 160 ° C. Для некоторых реакций требуются даже более жесткие условия — 180 ° C или выше. Катализ позволил реакциям начать протекать при 135 ° C.
Кроме того, катализированные реакции обычно требуют значительно меньше времени для завершения по сравнению с некаталитическими реакциями.Например, с использованием сшивающего агента 1,3-диизопропенилбензола (DIB) время реакции было сокращено с 12-24 часов до 6,5 часов за счет добавления 1 мас.% Zn-DTC 2 . Реакции регистрировали от начала до затвердевания смеси. Время реакции для DIB было дополнительно сокращено до 1 часа за счет использования 5 мас.% Zn-DTC 2 .
Кроме того, катализ позволил исследователям создать полимеры серы (тиополимеры), о которых ранее не сообщалось, в том числе тиополимеры, содержащие сшивающие агенты, которые не вступают в реакцию без катализа.Таким образом, спектр возможных полимеров, богатых серой, расширяется.
Катализ также увеличивает выход и улучшает физические свойства полимеров. И следует отметить, что в реакции участвовал ряд катализаторов, в том числе недорогие и нетоксичные металлы.
«Производство полимеров (пластмасс) из серы может изменить правила игры», — сказал Том Хассел, научный сотрудник Королевского общества университета химического факультета Ливерпуля.
Он добавил: «Свойства серы очень отличаются от углерода, и это уже открыло мир возможных применений для полимеров серы, включая тепловизионные линзы, батареи, очистку воды и здоровье человека.”
Это открытие может расширить фундаментальную химию тиополимеров за счет изучения других сшивающих агентов, а будущие исследования альтернативных катализаторов могут улучшить и оптимизировать использование тиополимеров. Кроме того, он делает обратную вулканизацию более широко применяемой, эффективной, экологичной и производительной, чем предыдущие способы.
Исследование проводилось Ливерпульским университетом в сотрудничестве с Ланкастерским университетом.
Nature Communications : http: // doi.org / c2tm
Как производится пластмасса
Основы производства пластмассы
Термин «пластмассы» включает материалы, состоящие из различных элементов, таких как углерод, водород, кислород, азот, хлор и сера. Пластмассы обычно имеют высокую молекулярную массу, что означает, что каждая молекула может иметь тысячи связанных вместе атомов. Природные материалы, такие как дерево, рог и канифоль, также состоят из молекул с высокой молекулярной массой.Промышленные или синтетические пластмассы часто предназначены для имитации свойств натуральных материалов. Пластмассы, также называемые полимерами, производятся путем преобразования природных продуктов или синтеза первичных химикатов, обычно получаемых из нефти, природного газа или угля.
В основе большинства пластиков лежит атом углерода. Исключение составляют силиконы, в основе которых лежит атом кремния. Атом углерода может соединяться с другими атомами максимум четырьмя химическими связями. Когда все связи связаны с другими атомами углерода, могут образоваться алмазы, графит или сажа.Для пластиков атомы углерода также связаны с вышеупомянутым водородом, кислородом, азотом, хлором или серой. Когда соединения атомов образуют длинные цепочки, как жемчуг на нити жемчуга, полимер называют термопластом. Термопласты отличаются плавкостью. Все термопласты имеют повторяющиеся звенья, наименьший идентичный участок цепи. Мы называем эти повторяющиеся единицы элементарными ячейками. Подавляющее большинство пластмасс, около 92%, являются термопластами 1 .
Группы атомов, из которых образуются элементарные ячейки, называются мономерами. Для некоторых пластиков, таких как полиэтилен, повторяющаяся единица может состоять только из одного атома углерода и двух атомов водорода. Для других пластиков, таких как нейлон, повторяющееся звено может включать 38 или более атомов. Когда мы комбинируем мономеры, мы получаем полимеры или пластмассы. Сырье образует мономеры, которые могут быть использованы или используются для образования элементарных ячеек. Мономеры используются в виде полимеров или пластмасс
Когда соединение атомов углерода образует двумерные и трехмерные сети вместо одномерных цепочек, полимер будет термореактивным пластиком.Термореактивные пластмассы не плавятся. Термореактивные пластмассы, такие как эпоксидные клеи или корпуса лодок и ванн из ненасыщенного полиэстера, или фенольные клеи, используемые для изготовления фанеры, создаются пользователем, смешивая два химиката и немедленно используя смесь до того, как пластик «схватится» или застынет.
Образование повторяющихся звеньев для термопластов обычно начинается с образования небольших молекул на основе углерода, которые могут объединяться с образованием мономеров. Мономеры, в свою очередь, соединяются вместе с помощью механизмов химической полимеризации с образованием полимеров.Формирование сырья может начинаться с разделения углеводородных химикатов из природного газа, нефти или угля на чистые потоки химикатов. Некоторые из них затем обрабатываются в «процессе взлома». Здесь в присутствии катализатора молекулы сырья превращаются в мономеры, такие как этилен (этен) C2h5, пропилен (пропен) C3H6, бутен C4H8 и другие. Все эти мономеры содержат двойные связи между атомами углерода, так что атомы углерода могут впоследствии реагировать с образованием полимеров.
Другие химические сырьевые материалы, такие как бензол и ксилолы, выделяются из нефти. Эти химические вещества вступают в реакцию с другими с образованием мономеров полистирола, нейлона и полиэфиров. Сырье было преобразовано в мономеры и больше не содержит нефтяных фракций. Еще одно сырье можно получить из возобновляемых ресурсов, например целлюлозу из древесины для производства бутирата целлюлозы. Чтобы стадия полимеризации работала эффективно, мономеры должны быть очень чистыми.Все производители очищают сырье и мономеры, улавливая неиспользованное сырье для повторного использования, а побочные продукты — для надлежащей утилизации.
Затем мономеры химически связываются в цепи, называемые полимерами. Существует два основных механизма полимеризации: реакции присоединения и реакции конденсации. Для реакций присоединения добавляется специальный катализатор, часто пероксид, который заставляет один мономер связываться с другим, а другой с другим и так далее. Катализаторы не вызывают реакции, но заставляют реакции происходить быстрее.Аддитивная полимеризация, используемая, среди прочего, для полиэтилена, полистирола и поливинилхлорида, не приводит к образованию побочных продуктов. Реакции можно проводить в газовой фазе, диспергированной в жидкостях. Второй механизм полимеризации, конденсационная полимеризация, использует катализаторы, чтобы все мономеры реагировали с любым соседним мономером. В результате реакции два мономера образуют димеры (две элементарные ячейки) плюс побочный продукт. Димеры могут объединяться с образованием тетрамеров (четырех элементарных ячеек) и так далее. Для конденсационной полимеризации необходимо удалить побочные продукты, чтобы химическая реакция произвела полезные продукты.Некоторыми побочными продуктами является вода, которую обрабатывают и утилизируют. Другие побочные продукты — это сырье, которое перерабатывается для повторного использования в процессе. Удаление побочных продуктов проводится таким образом, чтобы ценное переработанное сырье не терялось в окружающей среде или не подвергалось воздействию населения. Реакции конденсации обычно проводят в массе расплавленного полимера. Полиэфиры и нейлоны производятся методом конденсационной полимеризации.
Из различных комбинаций мономеров можно получить пластмассовые смолы с разными свойствами и характеристиками.Когда все мономеры одинаковы, полимер называется гомополимером. Когда используется более одного мономера, полимер называется сополимером. Пластиковые кувшины для молока являются примером гомополимерного полиэтилена высокой плотности. Молоко удовлетворительно упаковывается в менее дорогой гомополимерный HDPE. Бутылки для стирального порошка являются примером сополимера HDPE. Агрессивный характер моющего средства делает сополимер правильным выбором для наилучшего обслуживания. Каждый мономер дает пластичную смолу с определенными свойствами и характеристиками.Комбинации мономеров дают сополимеры с другими вариациями свойств. Таким образом, в пределах каждого типа полимера, такого как нейлон, полиэфир, полиэтилен и т. Д., Производители могут производить пластмассы, обладающие особыми характеристиками. Полиэтилены могут быть жесткими или гибкими. Полиэфиры могут быть изготовлены из клеев, плавящихся при низкой температуре, или для автомобильных деталей, устойчивых к высоким температурам. Полученные термопластичные полимеры можно плавить с образованием множества различных видов пластмассовых изделий, которые можно найти на многих основных рынках.Разнообразие пластика как в пределах одного семейства пластмасс, так и среди типов семейств позволяет адаптировать пластик к конкретным требованиям к конструкции и характеристикам. Вот почему одни пластмассы лучше всего подходят для одних применений, а другие — для совершенно иных. Ни один пластик не подходит для всех нужд.
Вот некоторые примеры свойств материалов для пластмассовых изделий:
- Упаковка горячего розлива, используемая для таких продуктов, как кетчуп
- Химически стойкая упаковка, используемая для таких продуктов, как отбеливатель
- Ударная вязкость автомобильных бамперов
Структура полимеров
Как мы уже говорили, полимеры могут быть гомополимерами или сополимерами.Если длинные цепи показывают непрерывную связь атомов углерода с углеродом, структура называется однородной. Длинная цепочка называется позвоночником. Полипропилен, полибутилен, полистирол и полиметилпентен являются примерами полимеров с однородной углеродной структурой в основной цепи. Если цепочки атомов углерода периодически прерываются кислородом или азотом, структура называется гетерогенной. Полиэфиры, нейлон и
поликарбонаты являются примерами полимеров с неоднородной структурой.Гетерогенные полимеры как класс имеют тенденцию быть менее химически стойкими, чем гомогенные полимеры, хотя примеры обратного многочисленны.
К углеродно-углеродной основе могут быть прикреплены различные элементы.
Поливинилхлорид (ПВХ) содержит присоединенные атомы хлора. Тефлон содержит присоединенные атомы фтора.
Расположение звеньев в термопластах также может изменять структуру и свойства пластмасс. Некоторые пластмассы собираются из мономеров, так что имеется преднамеренная случайность в появлении присоединенных элементов и химических групп.У других прикрепленные группы расположены в очень предсказуемом порядке. Пластмассы, если структура позволяет, образовывать кристаллы. Некоторые пластмассы легко и быстро образуют кристаллы, например HDPE — полиэтилен высокой плотности. HDPE может казаться мутным из-за кристаллов и проявлять жесткость и прочность. Другие пластмассы сконструированы так, что они не могут соединяться друг с другом с образованием кристаллов, например полиэтилен низкой плотности, LDPE. Аморфный пластик обычно имеет прозрачный внешний вид. Регулируя пространственное расположение атомов в основных цепях, производитель пластмасс может изменять эксплуатационные свойства пластика.
Химическая структура основы, использование сополимеров и химическое связывание различных элементов и соединений с основной цепью, а также способность к кристаллизации могут изменить технологические, эстетические и эксплуатационные свойства пластмасс. Пластмассы также могут быть изменены добавлением добавок.
Присадки
Когда пластмассы выходят из реакторов, они могут иметь желаемые свойства для коммерческого продукта или нет.Включение добавок может придавать пластмассам особые свойства. Некоторые полимеры включают добавки во время производства. Другие полимеры включают добавки во время переработки в готовые детали. Добавки включают в полимеры для изменения и улучшения основных механических, физических или химических свойств. Добавки также используются для защиты полимера от разрушающего воздействия света, тепла или бактерий; для изменения таких технологических свойств полимера, как текучесть расплава; обеспечить цвет продукта; и для обеспечения особых характеристик, таких как улучшенный внешний вид поверхности, снижение трения и огнестойкость.
Типы добавок:
- Антиоксиданты: для обработки пластмасс и вне помещений, где требуется устойчивость к атмосферным воздействиям
- Красители: для цветных пластиковых деталей
- Пенообразователи: для пенополистирольных стаканов и строительных плит, а также для полиуретанового коврового покрытия
- Пластификаторы: используются для изоляции проводов, полов, водостоков и некоторых пленок
- Смазочные материалы: используются для изготовления волокон
- Anti-stats: для уменьшения пылеулавливания за счет статического электричества
- Противомикробные средства: используются для занавесок для душа и настенных покрытий
- Антипирены: для повышения безопасности покрытий проводов и кабелей и искусственного мрамора
Два типа пластика, в зависимости от обработки
A Thermoset — это полимер, который необратимо затвердевает или «застывает» при нагревании или отверждении.Подобно отношениям между сырым и вареным яйцом, вареное яйцо не может вернуться к своей первоначальной форме после нагревания, а термореактивный полимер не может быть размягчен после «застывания». Термореактивные материалы ценятся за их долговечность и прочность и широко используются в автомобилях и строительстве, в том числе в клеях, чернилах и покрытиях. Самый распространенный термореактивный материал — резиновые грузовые и легковые шины. Некоторые примеры термореактивных пластмасс и их применения в продуктах:
Полиуретаны:
• Матрасы
• Подушки
• ИзоляцияНенасыщенные полиэфиры:
• Корпуса лодок
• Ванны и душевые кабины
• МебельЭпоксидные смолы:
• Адгезионные клеи
• Покрытие для электрических устройств.
• Лопасти вертолетных и реактивных двигателейФенолформальдегид:
• Ориентированно-стружечная плита
• Фанера
• Электрические приборы
• Платы и переключатели электрические
A Термопласт — это полимер, в котором молекулы удерживаются вместе слабыми вторичными силами связи, которые размягчаются при воздействии тепла и возвращаются в исходное состояние при охлаждении до комнатной температуры.Когда термопласт размягчается при нагревании, ему можно придать форму путем экструзии, формования или прессования. Кубики льда — обычные предметы домашнего обихода, которые воплощают принцип термопластичности. Лед тает при нагревании, но быстро затвердевает при охлаждении. Подобно полимеру, этот процесс можно повторять много раз. Термопласты обладают универсальностью и широким спектром применения. Они обычно используются в упаковке пищевых продуктов, поскольку им можно быстро и экономично придать любую форму, необходимую для выполнения упаковочной функции.Примеры включают кувшины для молока и бутылки для газированных безалкогольных напитков. Другие примеры термопластов:
Полиэтилен:
• Упаковка
• Электроизоляция
• Бутылки для молока и воды
• Упаковочная пленка
• Домашняя пленка
• Сельскохозяйственная пленкаПолипропилен:
• Ковровые волокна
• Автомобильные бамперы
• Микроволновые контейнеры
• Наружные протезыПоливинилхлорид (ПВХ):
• Оболочка для электрических кабелей.
• Напольные и настенные покрытия
• Сайдинг
• Автомобильные приборные панели
Способы обработки термопластов и термореактивных материалов
Для превращения полимеров в готовую продукцию используется множество различных методов обработки.Некоторые включают:
Экструзия — Этот непрерывный процесс используется для производства пленок, листов, профилей, труб и труб. Пластиковый материал в виде гранул, пеллет или порошка сначала загружается в бункер, а затем подается в длинную нагретую камеру, через которую он перемещается под действием непрерывно вращающегося винта. Камера представляет собой цилиндр и называется экструдером. Экструдеры могут иметь один или два вращающихся винта. Пластик плавится за счет механической работы шнека и тепла от стенки экструдера.В конце нагретой камеры расплавленный пластик вытесняется через небольшое отверстие, называемое матрицей, для придания формы готовому продукту. По мере того, как пластик выдавливается из фильеры, он подается на конвейерную ленту для охлаждения, на ролики для охлаждения или путем погружения в воду для охлаждения. Принцип работы такой же, как у мясорубки, но с добавленными нагревателями в стенке экструдера и охлаждением продукта. Примеры экструдированных продуктов включают кромку газона, трубы, пленку, бумагу с покрытием, изоляцию электрических проводов, водосточные желоба и водосточные желоба, пластиковые пиломатериалы и оконную отделку.Термопласты перерабатываются методом непрерывной экструзии. Термореактивный эластомер может быть экструдирован для получения водоотталкивающего материала путем добавления катализаторов к каучуковому материалу, когда он подается в экструдер.
Каландрирование — Этот непрерывный процесс является продолжением экструзии пленки. Еще теплый экструдат охлаждают на полированных холодных валках для получения листа толщиной от 0,005 дюйма до 0,500 дюйма. Благодаря полированным роликам толщина поддерживается в хорошем состоянии, а поверхность становится гладкой. Каландрирование используется для получения высокой производительности и способности справляться с низкой прочностью расплава.Тяжелые полиэтиленовые пленки, используемые для строительства паро и жидких барьеров, каландрированы. Пленки ПВХ в больших объемах обычно изготавливают с использованием календарей.
Выдувание пленки — Этот процесс непрерывно выдавливает кольцо полурасплавленного полимера в вертикальном направлении вверх, как фонтан. Поддерживается пузырь воздуха, который вытягивает пластик в осевом и радиальном направлении в трубку, во много раз превышающую диаметр кольца. Диаметр трубки зависит от обрабатываемого пластика и условий обработки.Трубка охлаждается воздухом, зажимается и наматывается непрерывно, как сплющенная трубка. Трубка может быть обработана для формирования товарных пакетов или разрезана для формирования рулонов пленки толщиной от 0,0003 до 0,005 дюйма. Для изготовления трубки можно использовать несколько слоев разных смол.
Литье под давлением — Этот процесс позволяет изготавливать сложные трехмерные детали высокого качества с высокой воспроизводимостью. Он преимущественно используется для термопластов, но некоторые термореактивные материалы и эластомеры также перерабатываются методом литья под давлением.При литье под давлением пластмассовый материал подается в бункер, который подается в экструдер. Шнек экструдера проталкивает пластик через камеру нагрева, в которой материал затем плавится. В конце экструдера расплавленный пластик под высоким давлением выдавливается в закрытую холодную форму. Высокое давление необходимо для того, чтобы форма была полностью заполнена. Как только пластик остывает до твердого состояния, форма открывается, и готовый продукт выгружается. Этот процесс используется для изготовления таких предметов, как масляные ванны, емкости для йогурта, крышки для бутылок, игрушки, аксессуары и стулья для газонов.Могут быть добавлены специальные катализаторы для создания изделий из термореактивного пластика во время обработки, например деталей из вулканизированной силиконовой резины. Литье под давлением — это прерывистый процесс, так как детали формуются в формах и должны быть охлаждены или отверждены перед удалением. Экономичность определяется тем, сколько деталей может быть изготовлено за цикл и насколько короткими могут быть циклы.
Выдувное формование — Выдувное формование — это процесс, используемый в сочетании с экструзией или литьем под давлением. В одной из форм, экструзии с раздувом, фильера образует непрерывную полурасплавленную трубу из термопластического материала.Охлажденная форма зажимается вокруг трубки, и затем в трубку вдувается сжатый воздух, чтобы подогнать трубку к внутренней части формы и затвердеть растянутой трубке. В целом цель состоит в том, чтобы получить однородный расплав, сформировать из него трубу с желаемым поперечным сечением и придать ей точную форму продукта. Этот процесс используется для производства полых пластмассовых изделий, и его основным преимуществом является возможность изготавливать полые формы без необходимости соединения двух или более отдельных деталей, полученных литьем под давлением.Этот метод используется для изготовления таких предметов, как коммерческие бочки и бутылки для молока. Другой метод выдувного формования заключается в литье под давлением промежуточной формы, называемой преформой, с последующим нагревом преформы и выдуванием размягченного при нагревании пластика в окончательную форму в охлажденной форме. Это процесс изготовления бутылок для газированных безалкогольных напитков.
Выдувание расширенных шариков — Этот процесс начинается с того, что отмеренный объем шариков пластика помещается в форму. Гранулы содержат пенообразователь или газ, обычно пентан, растворенный в пластике.Закрытая форма нагревается для размягчения пластика, и газ расширяется, или вспенивающий агент выделяет газ. В результате получается структура из вспененного пластика с закрытыми ячейками, соответствующая форме, например стаканчики из пенополистирола. Теплоизоляционная плита из пенополистирола Styrofoam ™ производится в процессе непрерывной экструзии с использованием раздувания вспененных гранул.
Ротационное формование — Ротационное формование состоит из формы, установленной на машине, способной вращаться одновременно по двум осям.Твердая или жидкая смола помещается в форму и нагревается. Вращение распределяет пластик в однородное покрытие внутри формы, затем форма охлаждается до тех пор, пока пластмассовая часть не остынет и не затвердеет. Этот процесс используется для создания полых конфигураций. Обычные продукты ротационного формования включают транспортировочные бочки, резервуары для хранения и некоторую потребительскую мебель и игрушки.
Компрессионное формование — В этом процессе подготовленный объем пластика помещается в полость формы, а затем применяется вторая форма или заглушка, чтобы придать пластику желаемую форму.Пластик может быть полуотвержденным термореактивным материалом, таким как автомобильная шина, или термопластом, или матом из термореактивной смолы и длинных стекловолокон, например, для корпуса лодки. Компрессионное формование может быть автоматизировано или требует значительного ручного труда. Трансферное формование — это усовершенствованная форма компрессионного формования. Трансферное формование используется для герметизации деталей, например, для производства полупроводников
Формование фанеры или ориентированно-стружечных плит с использованием термореактивных клеев является вариантом компрессионного формования.Деревянный шпон или нити покрывают катализированной термореактивной фенолформальдегидной смолой и сжимают и нагревают, чтобы термореактивный пластик превратился в жесткий, неплавкий клей.
Литье — Этот процесс представляет собой добавление жидких смол в форму под низким давлением, часто просто заливка. Катализированным термореактивным пластмассам можно придавать сложные формы путем литья. Расплавленный полиметилметакрилатный термопласт можно заливать в плиты для формирования окон для коммерческих аквариумов.Отливка позволяет получить толстый лист толщиной от 0,500 дюймов до многих дюймов.
Термоформование — Пленки термопласта нагреваются для размягчения пленки, а затем мягкая пленка вытягивается под действием вакуума или толкается давлением, чтобы соответствовать форме, или вдавливается с заглушкой в форму. Детали термоформовываются либо из отрезков для толстого листа более 0,100 дюйма, либо из рулонов тонкого листа. Готовые детали вырезаются из листа, а отходы листового материала используются повторно для производства нового листа.Этот процесс может быть автоматизирован для крупносерийного производства пищевых контейнеров-раскладушек или может представлять собой простой ручной труд для изготовления отдельных поделок.
1 Американский химический совет, Группа статистики производителей пластмасс, 2005 г.
Полимеры серы для экологически чистых пластиков
Новый каталитический процесс производства полимеров из серы может обеспечить более экологически безопасное производство пластмасс.
В настоящее время процесс реакции серы с молекулами органического сшивающего агента для придания ей стабильности — известный как обратная вулканизация — включает длительное время реакции и высокие температуры и приводит к образованию вредных побочных продуктов.
Исследователи из Ливерпульского университета обнаружили, что добавление небольшого количества диэтилдитиокарбамата цинка в процесс снижает температуру и время реакции. Он также увеличивает выход реакции, улучшает физические свойства полимеров и предотвращает образование вредных побочных продуктов.
Доктор Том Хэзелл, группа которого проводила исследование, сказал: «Это делает обратную вулканизацию более применимой, эффективной, экологичной и продуктивной, чем предыдущие способы, не только расширяя саму фундаментальную химию, но и открывая двери для индустриализация и широкое применение этих удивительных новых материалов во многих областях химии и материаловедения.”
Сера удаляется из сырой нефти и природного газа, когда они очищаются для использования, например, в нефтехимической промышленности. Однако таким способом производится гораздо больше серы — около 70 миллионов тонн в год — чем мы фактически используем, что приводит к огромным запасам.
Между тем, ежегодно производится 350 миллионов тонн пластика, и сера может помочь в разработке более устойчивых полимеров перед лицом кризиса пластмасс.
«Возможность производить полезные пластмассовые материалы из серы, побочного продукта нефти, может уменьшить зависимость общества от полимеров, сделанных из самой нефти», — сказал Хазелл.
«Кроме того, эти полимеры серы может быть легче переработать, что открывает захватывающие возможности для сокращения текущего использования пластмасс».
Хэзелл сообщил Laboratory News, что изготовление пластмасс из серы, а не из обычно используемого углерода, имеет очень разные свойства, что приводит к более широкому применению.
«В настоящее время почти все пластмассы имеют углеродную основу и сами производятся из ограниченных нефтехимических ресурсов. В то время как углеродные полимеры блокируют инфракрасный свет, полимеры серы прозрачны для инфракрасного света, поэтому их можно использовать для изготовления тепловизионных линз », — сказал он.
Полимеры серы могут также использоваться в батареях и очистке воды.
Статья исследователей, Катлитическая обратная вулканизация , была опубликована в Nature Communications .
