Содержание
Интересная органическая химия. Интересные факты о химии.
В эту самую минуту
Пока Вы читаете данную статью, Ваши глаза используют органическое соединение – ретиналь, который преобразует световую энергию в нервные импульсы. Пока Вы сидите в удобной позе, мышцы спины поддерживают правильную осанку благодаря химическому расщеплению глюкозы с высвобождением требуемой энергии. Как Вы понимаете, пробелы между нервными клетками так же заполнены органическими веществами – медиаторами (или нейространсмиттерами), которые помогают всем нейронам стать одним целым. И данная слаженная система работает без участия Вашего сознания! Так глубоко, как биологи, только химики-органики понимают, насколько филигранно создан человек, как логично устроены внутренние системы органов и их жизненный цикл. Отсюда следует, что изучение органической химии – основа понимания нашей жизни! А качественное изучение – это путь в будущее, ибо новые лекарства создаются прежде всего в химических лабораториях.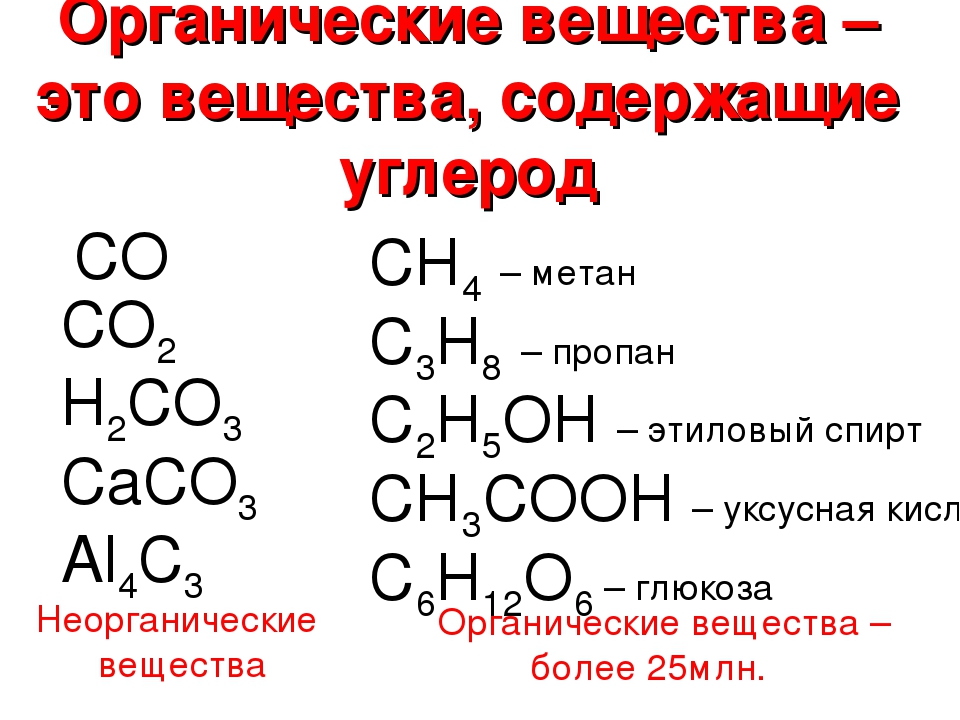 Наша кафедра желает познакомить Вас поближе с этой прекрасной наукой.
Наша кафедра желает познакомить Вас поближе с этой прекрасной наукой.
11-цис-ретиналь, поглощает свет
серотонин – нейромедиатор
Органическая химия как наука
Органическая химия как наука возникла в конце девятнадцатого века. Она возникла на перекрещивании разных сфер жизни – от получения пищи до лечения миллионов людей, не подозревающих о роли химии в их жизни. Химия занимает уникальное место в структуре понимания Вселенной. Это наука о молекулах, но органическая химия является чем-то большим, чем это определение. Органическая химия в буквальном смысле сама себя создает, словно растет. Органическая химия, занимаясь изучением не только природных молекул имеет возможность самой создавать новые вещества, структуры, материи. Данная особенность подарила человечеству полимеры, красители для одежды, новые лекарства, духи. Некоторые считают, что синтетические материалы могут нанести вред человеку, либо быть экологически опасными.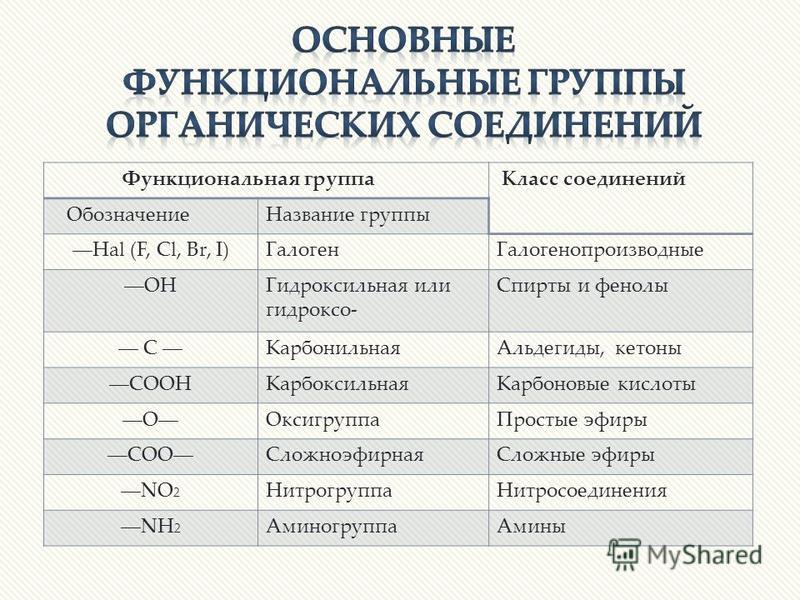 Однако, как порой отличить черное от белого, так и установить тонкую грань между «опасностью для человека» и «коммерческой выгодой» очень сложно. В этом вопросе так же поможет кафедра Органического синтеза и нанотехнологий (ОСиНТ).
Однако, как порой отличить черное от белого, так и установить тонкую грань между «опасностью для человека» и «коммерческой выгодой» очень сложно. В этом вопросе так же поможет кафедра Органического синтеза и нанотехнологий (ОСиНТ).
Органические соединения
Органическая химия формировалась, как наука о жизни, ранее считалось, что она сильно отличается от неорганической химии в лаборатории. Затем ученые полагали, что органическая химия – это химия Углерода, особенно соединений каменного угля. В наше время органическая химия объединяет все соединения Углерода как живой, так и не живой природы.
Доступные для нас органические соединения получаются либо из живых организмов, либо из ископаемых материалов (нефть, уголь). Примером субстанций из природных источников являются эфирные масла – ментол (вкус мяты) и цис-жасмон (аромат цветков жасмина). Эфирные масла получают перегонкой с водяным паром; подробности раскроются при обучении на нашей кафедре.
- Ментол
- Цис-жасмон
- Хинин
Уже в 16 веке был известен алкалоид – хинин, который получают из коры хинного дерева (Южная Америка) и используют против малярии.
Иезуиты, что открыли данное свойство хинина, конечно же не знали его структуры. Тем более в те времена не стоял вопрос о синтетическом получении хинина – что удалось осуществить только в 20 столетии! Ещё любопытная история, связанная с хинином – это открытие фиолетового пигмента мовеина Уильямом Перкиным в 1856 году. Зачем он это сделал и какие результаты его открытия – так же можно узнать на нашей кафедре.
Но вернемся к истории становления органической химии. В 19 веке (времена У. Перкина) основным источником сырья для химической промышленности был уголь. Сухая перегонка угля давала коксовый газ, который использовался для обогрева и приготовления пищи, каменноугольную смолу, богатую на ароматические карбоциклические и гетероциклические соединения (бензол, фенол, анилин, тиофен, пиридин). На нашей кафедре Вам расскажут, чем они отличаются и какое они имеют значение в органическом синтезе.
На нашей кафедре Вам расскажут, чем они отличаются и какое они имеют значение в органическом синтезе.
Бензол, пиридин, фенол, анилин, тиофен
Фенол обладает антисептическими свойствами (тривиальное название – карболовая кислота), а анилин стал основой развития красочной промышленности (получение анилиновых красителей). Данные красящие вещества по-прежнему коммерчески доступны, например, Бисмарк-Браун (коричневый) показывает, что большая часть ранних трудов по химии была проведена в Германии:
Бисмарк-Браун
Однако в 20 столетии, нефть опередила уголь в качестве основного источника органического сырья и энергии, поэтому газообразные метан (природный газ), этан, пропан стали доступным энергетическим ресурсом.
В тоже время, химическая промышленность разделилась на массовую и тонкую. Первая занимается производством красок, полимеров – веществ, не имеющих сложное строение, однако, производимых в огромном количестве. А тонкая химическая промышленность, правильнее сказать – тонкий органический синтез занимается получением лекарств, ароматов, вкусовых добавок, в гораздо меньших объемах, что, однако более прибыльно. В настоящее время известно около 16 миллионов органических соединений. Сколько ещё возможно? В этой области, органический синтез не имеет ограничений. Представьте себе, что Вы создали самую длинную алкильную цепь, однако Вы можете легко добавить ещё один углеродный атом. Этот процесс бесконечен. Но не следует думать, что все эти миллионы соединений – обычные линейные углеводороды; они охватывают все виды молекул с удивительно разнообразными свойствами.
А тонкая химическая промышленность, правильнее сказать – тонкий органический синтез занимается получением лекарств, ароматов, вкусовых добавок, в гораздо меньших объемах, что, однако более прибыльно. В настоящее время известно около 16 миллионов органических соединений. Сколько ещё возможно? В этой области, органический синтез не имеет ограничений. Представьте себе, что Вы создали самую длинную алкильную цепь, однако Вы можете легко добавить ещё один углеродный атом. Этот процесс бесконечен. Но не следует думать, что все эти миллионы соединений – обычные линейные углеводороды; они охватывают все виды молекул с удивительно разнообразными свойствами.
Алифатические соединения
Свойства органических соединений
Каковы же физические свойства органических соединений?
Они могут быть кристаллическими как сахар, или пластичными как парафин, взрывоопасными как изооктан, летучими как ацетон.
- Сахароза
- Изооктан (2,3,5-триметилпентан)
Окраска соединений так же может быть самая разнообразная. Человечество уже столько синтезировало красителей, что создается впечатление, что уже не осталось таких цветов, какие нельзя получить с помощью синтетических красителей.
К примеру, можно составить такую таблицу ярко окрашенных веществ:
Однако кроме этих характеристик, органические вещества обладают запахом, который помогает их дифференцировать. Любопытный пример – защитная реакция скунсов. Запах секрета скунсов обуславливают сернистые соединения – тиолы:
Компоненты секретов скунсов
Но самый ужасный запах был «унюхан» в городе Фрайбурге (1889), во время попытки синтеза тиоацетона разложением тримера, когда пришлось эвакуировать население города, поскольку «неприятный запах, которых быстро распространился по большой площади в городе, вызывает обмороки, рвоту и тревожные состояния».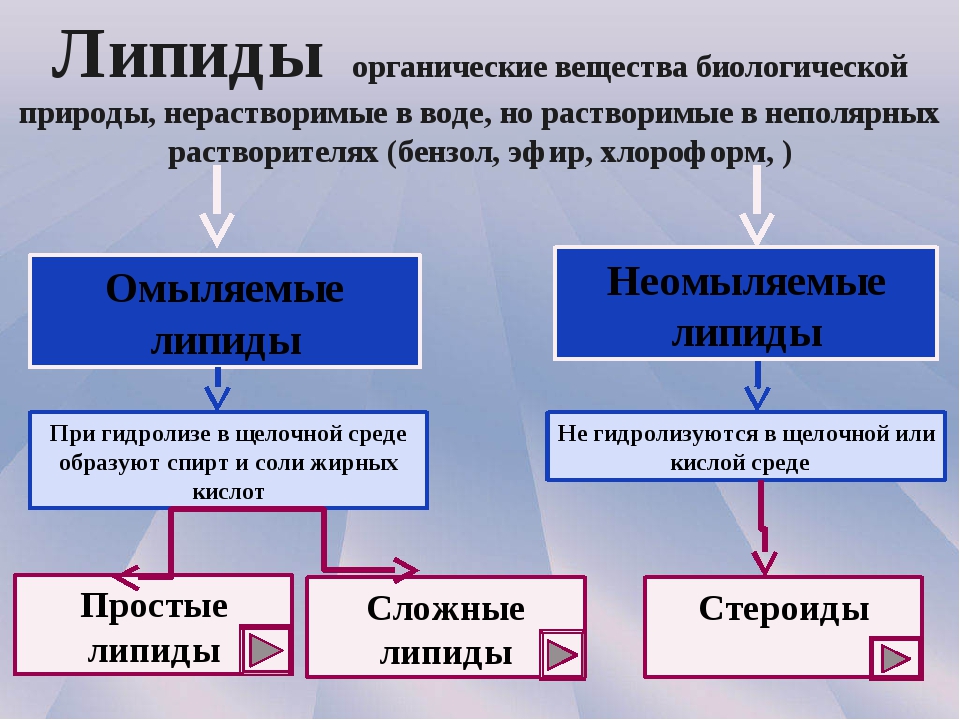 Лабораторию закрыли.
Лабораторию закрыли.
Но этот опыт решили повторить химики научной станции Ессо (Esso) к югу от Оксфорда. Передадим им слово:
«В последнее время, проблемы запаха вышли за пределы наших худших ожиданий. Во времена ранних экспериментов, пробка выскочила из бутылки с отходами и сразу была заменена, а наши колеги из соседней лаборатории (200 ярдов) немедленно почувствовали тошноту и рвоту.
Двое из наших химиков, которые просто изучали крекинг незначительных количеств тритиоацетона нашли себя как объект враждебных взглядов в ресторане и были посрамлены, когда официантка распылила дезодорант вокруг них. Запахи «бросили вызов» ожидаемым эффектам разбавления, поскольку работники лаборатории не считали запахи невыносимыми… и по-настоящему отрицали свою ответственность, так как они работали в закрытых системах. Чтобы убедить их в обратном, они были распределены с другими наблюдателями по всей территории лаборатории на расстояниях до четверти мили.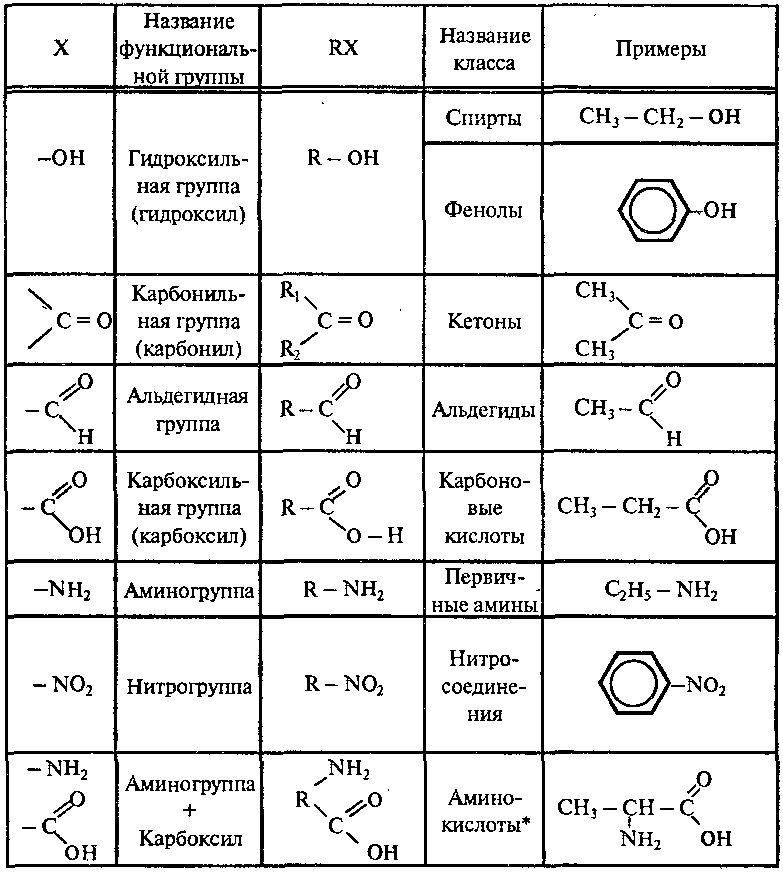 Затем одна капля ацетон гем-дитиола, а позже маточного раствора перекристаллизации тритиоацетона была размещена на часовом стекле в вытяжном шкафу. Запах был обнаружен по ветру в считанные секунды». Т.е. запах этих соединений усиливается при понижении концентрации.
Затем одна капля ацетон гем-дитиола, а позже маточного раствора перекристаллизации тритиоацетона была размещена на часовом стекле в вытяжном шкафу. Запах был обнаружен по ветру в считанные секунды». Т.е. запах этих соединений усиливается при понижении концентрации.
Существует два претендета на эту ужасную вонь – дитиол пропан (вышеуказанный гем-дитиол), либо 4-метил-4сульфанил-пентанон-2:
Вряд ли кто-то найдется чтобы определить из них лидера.
Однако, неприятный запах имеет свою область применения. Природный газ, что поступает в наши дома содержит небольшое количество ароматизатора – третбутил тиола. Небольшое количество – это столько, что люди способны почувствовать одну часть тиола в 50 миллиардах частей метана.
Напротив, некоторые другие соединения имеют восхитительные запахи. Чтобы искупить честь сернистых соединений мы должны сослаться на трюфель, который хрюшки могут унюхать через метр почвы и чей вкус и запах настолько восхитительны что они стоят дороже, чем золото. За аромат роз отвечают дамаскеноны. Если Вы имеете возможность понюхать запах одной капли, то Вы, вероятно, будете разочарованы, так как она пахнет как скипидар, или камфора. А на следующее утро Ваша одежда (и Вы в том числе) будете очень сильно благоухать розами. Так же, как и тритиоацетон, этот запах усиливается при разведении.
За аромат роз отвечают дамаскеноны. Если Вы имеете возможность понюхать запах одной капли, то Вы, вероятно, будете разочарованы, так как она пахнет как скипидар, или камфора. А на следующее утро Ваша одежда (и Вы в том числе) будете очень сильно благоухать розами. Так же, как и тритиоацетон, этот запах усиливается при разведении.
Компонент аромата трюфелей
Демаскенон – аромат роз
А как насчет вкуса?
Всем известно, что дети могут попробовать на вкус бытовую химию (средство для чистки ванны, туалета и т.д.). Перед химиками встала задача, чтобы несчастные дети больше не захотели попробовать какую-то химию в яркой упакове. Обратите внимание, что это сложное соединение является солью:
Битрекс денатониум бензоат
Некоторые другие вещества оказывают «странное» воздействие на человека, вызывая комплексы психических ощущений – галюцинации, эйфорию и т.д. К ним относятся наркотики, этиловый спирт. Они очень опасны, т.к. вызывают зависимость и уничтожают человека как личность.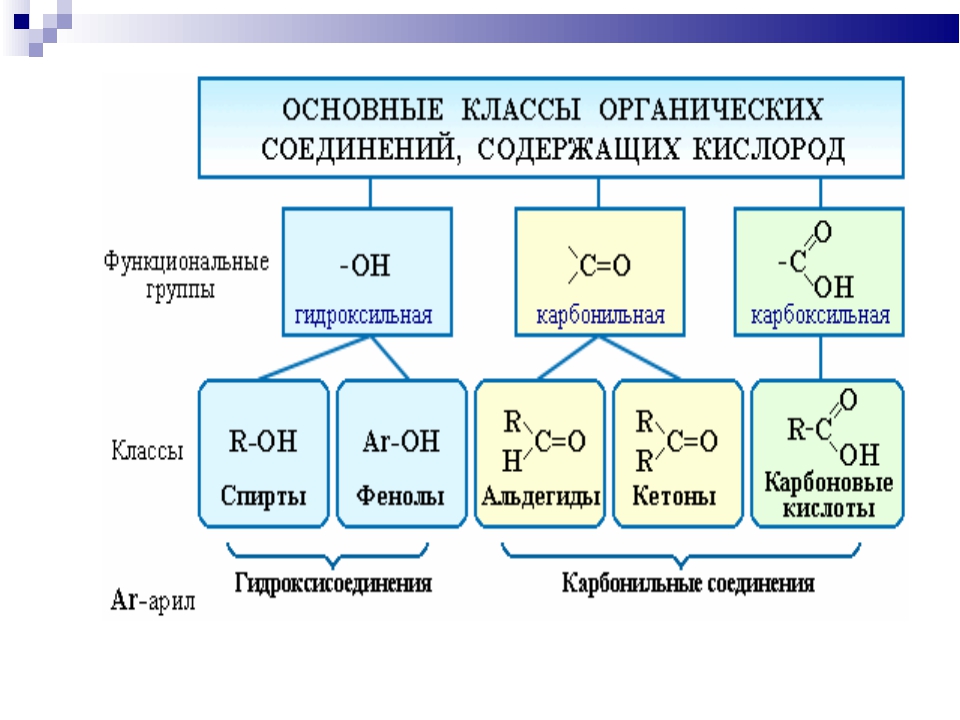
Давайте не забывать и о других существах. Известно, что кошки любят спать в любое время. Недавно ученые получили из спинномозговой жидкости бедных кошек вещество, позволяющее им быстро засыпать. Оно так же действует и на человека. Это удивительно простое соединение:
Инициатор сна – цис-9,10-октадеценоамид
Подобная структура, носящая название Коньюгированная Линолевая Кислота (КЛК) обладает противоопухолевыми свойствми:
КЛК- противораковое средство цис-9-транс-11 сопряженная линолевая кислота
Ещё одна любопытная молекула – ресвератол, может быть отвечает за благотворное влияние красного вина в профилактике сердечных заболеваний:
Ресвератол из шкурки виноградинок
В качестве третьего примера «съедобных» молекул (после КЛК и ресвератрола) возьмем витамин С. Моряки дальнего плавания времен эпохи Великих Географических Открытий страдали заболеванием скорбут (цингой), когда происходят дегенеративные процессы мягких тканей, особенно ротовой полости. Нехватка данного витамина и вызывает цингу. Аскорбиновая кислота (тривиальное название витамина С) является универсальным антиоксидантом, она нейтрализует свободные радикалы, защищая людей от рака. Некоторые считают, что большие дозы витамина С защищают нас от простуды, но это ещё не доказано.
Нехватка данного витамина и вызывает цингу. Аскорбиновая кислота (тривиальное название витамина С) является универсальным антиоксидантом, она нейтрализует свободные радикалы, защищая людей от рака. Некоторые считают, что большие дозы витамина С защищают нас от простуды, но это ещё не доказано.
Витамин С
Органическая химия и промышленность
Витами С в больших колличествах получают в Швейцарии, на фармацевтическом заводе Roshe (не путать с РошеноМ). Во всем мире объемы промышленности органического синтеза исчисляются как килограмами (мелкотоннажные производства), так и миллионами тонн (крупнотоннажные производства). Это хорошая новость для студентов-органиков, т.к. дефицита рабочих мест (равно как и переизбытка выпускников) тут нет. Другими словами профессия инженера-химика очень актуальна.
Некоторые простые соединения можно получать как из нефти, так и из растений. Этиловый спирт используют в качестве сырья для получения резины, пластмасс, других органических соединений. Его можно получить каталитической гидратацией этилена (из нефти), либо путем ферментации отходов сахарной промышленности (как в Бразилии, где использование этанола в качестве топлива позволило улучшить экологическую ситуацию).
Его можно получить каталитической гидратацией этилена (из нефти), либо путем ферментации отходов сахарной промышленности (как в Бразилии, где использование этанола в качестве топлива позволило улучшить экологическую ситуацию).
Стоит отдельно упомянуть полимерную промышленность. Она поглощает наибольшую часть продуктов переработки нефти в виде мономеров (стирол, акрилаты, винилхлорид, этилен). Производство синтетических волокон имеет оборот более чем 25 миллионов тонн в год. В получение поливинилхлорида вовлечено около 50 000 людей с годовым выпуском 20 миллионов тонн.
Следует так же упомянуть производство клеев, герметиков, покрытий. Например, известным суперклеем (на основе метил цианоакрилата) Вы можете приклеить почти все.
Цианоакрилат – основной компонент суперклея
Пожалуй, наиболее известным красителем является индиго, который раньше выделяли из растений, а сейчас получают синтетически. Индиго – это цвет синих джинсов. Для окраски полиэфирных волокон используются, к примеру, бензодифураноны (как дисперсол), которые придают ткани отличный красный цвет. Для окрашивания полимеров используют фталоцианины в виде комплексов с железом, или медью. Они так же находят применение в качестве компонента активного слоя CD, DVD, Blu Ray дисков. Новый класс «высокопроизводительных» красителей на основе DPP (1,4-diketopyrrolo[3,4-c]pyrroles) разработан Ciba-Geidy.
Индиго – это цвет синих джинсов. Для окраски полиэфирных волокон используются, к примеру, бензодифураноны (как дисперсол), которые придают ткани отличный красный цвет. Для окрашивания полимеров используют фталоцианины в виде комплексов с железом, или медью. Они так же находят применение в качестве компонента активного слоя CD, DVD, Blu Ray дисков. Новый класс «высокопроизводительных» красителей на основе DPP (1,4-diketopyrrolo[3,4-c]pyrroles) разработан Ciba-Geidy.
Индиго
Фотография сначала была черно-белой: галоиды серебра взаимодействуя со светом высвобождали атомы металла, которые и воспроизводили изображение. Окрашенные фотографии в цветной пленке марки Кодак возникали как следствие химической реакции между двумя бесцветными реагентами. Один из них, как правило ароматический амин:
От фотоискусства можно легко перейти в сладкую жизнь.
Подсластители, такие как классический сахар получают в огромных масштабах. Другие подсластители, как аспартам (1965) и сахарин (1879) производятся в аналогичных объемах. Аспартам представляет собой дипептид из двух натуральных аминокислот:
Другие подсластители, как аспартам (1965) и сахарин (1879) производятся в аналогичных объемах. Аспартам представляет собой дипептид из двух натуральных аминокислот:
Фармацевтические компании производят лекарственные субстанции от многих болезней. Примером коммерчески успешного, революционного препарата является Ранитидин (от язвенной болезни) и Силденафил (Виагра, надеемся Вы в курсе кому и зачем она нужна).
Успех этих препаратов связан как с лечебной эффективностью, так и прибыльностью:
Это еще не всё. Это только начало
Ещё осталось много интересного об органической химии, поэтому обучение на кафедре ОСиНТ является приоритетным не только для любителей химии, но и для абитуриентов, которым интересен окружающий мир, которые желают расширить рамки своего восприятия и раскрыть свой потенциал.
Всё о поступлении на специальность Химические технологии и инженерия
Поступление
на 1 курс
Все самое важное для абитуриента
смотрите здесь
Подробнее
Продолжение обучения
Поступление на 2-4 курс, в магистратуру и аспирантуру. Все формы обучения!
Все формы обучения!
Подробнее
Наши
галереи
Лучше 1 раз увидеть
Чем 100 раз услышать!
Смотрите наши фотографии
Подробнее
Вот несколько последних статей:
Говорили о том какой бывает этиловый спирт из чего его делают, как фальсифицируют и проводят анализы, и чего стоит остерегаться.…
Глицерин применение – пищевые продукты, косметика и взрывчатые вещества Читая этикетки косметических средств, мы зачастую замечаем в их составе глицерин.…
Не так давно Пепси объявила, что они больше не будут использовать подсластитель аспартам, искусственный сахарозаменитель, в диетической Пепси (на территории…
По доброй традиции встреча Нового года у большинства людей не обходится без открытой бутылки шампанского.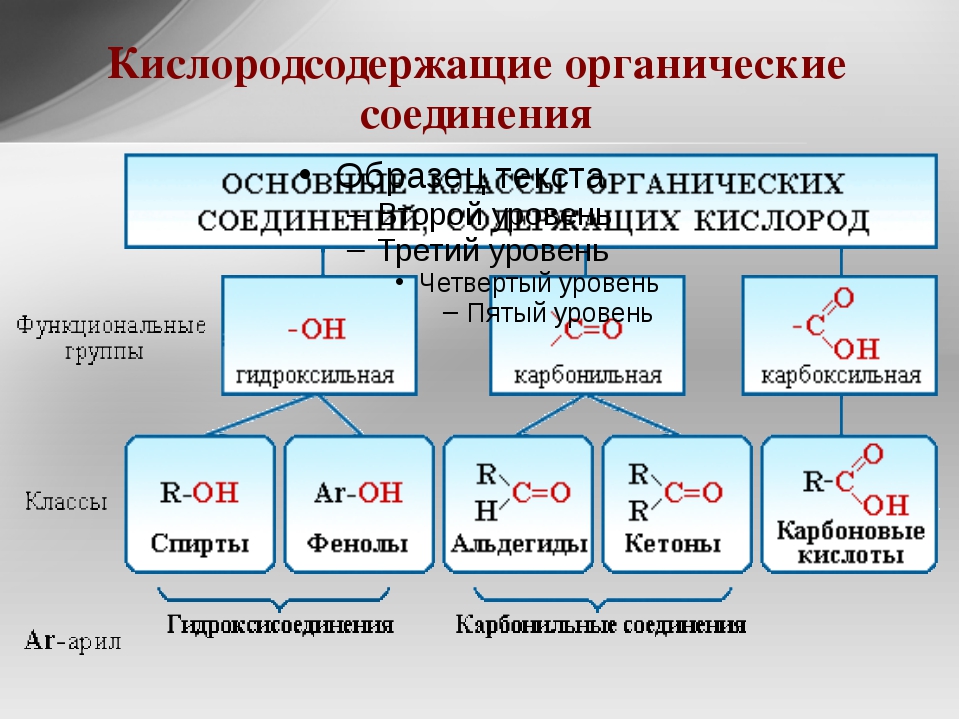 Напиток в бокале с его…
Напиток в бокале с его…
СОСТАВ КРАСКИ ДЛЯ ВОЛОС КРАСИТЕЛИ И ПИГМЕНТЫ Сегодня, стойкая краска для волос широко используются, либо чтобы прикрыть седые волосы, либо…
Поделиться
Материал для проведения 1 урока по теме «Классификация органических соединений (углеводороды)»
Классификация органических соединений. Номенклатура
Задание №1. В чем уникальность атома углерода? Почему органических соединений так много на планете?
Задание №2. Что такое углеводородный скелет молекулы органического соединения?
Заполните таблицу:
Классификация органических соединений по строению углеводородного скелета
Алифатические соединения | Циклические соединения | Гетероциклические соединения |
ПРИМЕРЫ СОЕДИНЕНИЙ: | ||
Дополните схему:
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Ароматические
Предельные
Циклические
Задание №3. Что такое брутто-формула вещества?
Что такое брутто-формула вещества?
Чем структурная формула отличается от брутто-формулы?
Чем отличается подробная структурная формула вещества от сокращенной?
Задание №4. Какие вещества называются гомологами? Что такое гомологическая разность? Как её вычислить?
Задание №5. Какие вещества называются изомерами? Какие типы изомерии Вы знаете?
Задание №6. Заполните пропуски в таблице?
Классификация органических соединений. Углеводороды
Наименование класса | Общая формула | Суффикс и префикс | Существенное отличие | Пример. Название |
АЛКАНЫ | Все связи одинарные | |||
ЕН | C5h20 Пентен | |||
Циклическая структура | С6Н12 Циклогексан | |||
Одна тройная связь | ||||
АЛКАДИЕНЫ | ||||
— | Ароматическое кольцо | С6Н5-СН3 Толуол |
Задание №7.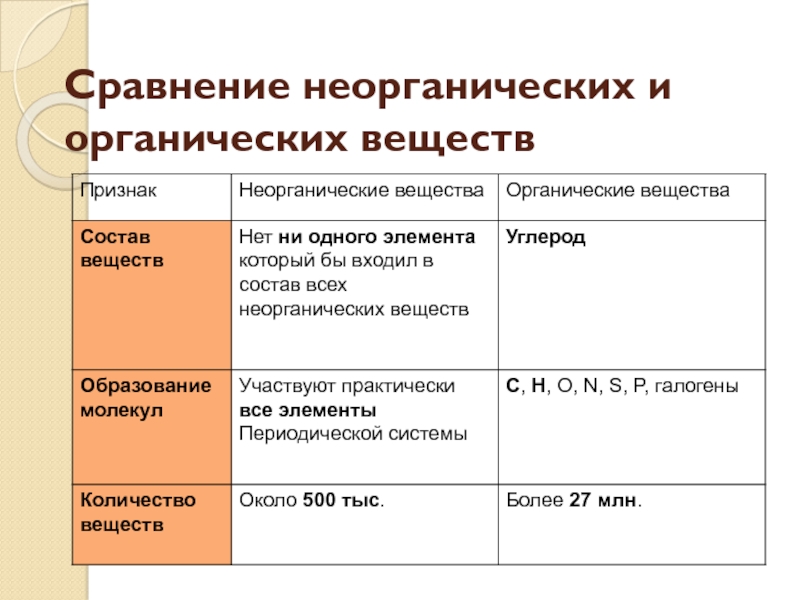 Изобразите в пространстве следующие вещества? (в рабочей тетради). Назовите приведенные вещества.
Изобразите в пространстве следующие вещества? (в рабочей тетради). Назовите приведенные вещества.
Задание №8. Что такое номенклатура ИЮПАК? Какие еще номенклатуры существуют? Назовите следующие соединения по международной номенклатуре?
Формула соединения | Наименование соединения |
Задание №9. По названиям соединений напишите их структурные формулы:
Наименование соединения | Формула соединения |
2,3-диметилпентен-1 |
Органические соединения — Справочник химика 21
Первоначально свойства и поведение поляризованного света интересовали исключительно физиков. Однако в 1815 г, французский физик Жан Батист Био (1774—1862) показал, что при прохождении поляризованного света через некоторые кристаллы происходит поворот плоскости колебаний (плоскости поляризации) световых волн. В одних случаях она поворачивается по часовой стрелке (правое вращение), в других — против часовой стрелки (левое вращение). К числу кристаллов, обладающих указанным свойством,— оптической активностью, относятся и кристаллы ряда органических соединений. Белее того, некоторые из этих органических соединений, например различные сахара, оптически активны и в растворах. [c.86]
Однако в 1815 г, французский физик Жан Батист Био (1774—1862) показал, что при прохождении поляризованного света через некоторые кристаллы происходит поворот плоскости колебаний (плоскости поляризации) световых волн. В одних случаях она поворачивается по часовой стрелке (правое вращение), в других — против часовой стрелки (левое вращение). К числу кристаллов, обладающих указанным свойством,— оптической активностью, относятся и кристаллы ряда органических соединений. Белее того, некоторые из этих органических соединений, например различные сахара, оптически активны и в растворах. [c.86]
Главные положения теории строения высказал А. М. Бутлеров в докладе О химическом строении вещества , сделанном 9 сентября 1861 г. на съезде немецких естествоиспытателей и врачей. Бутлеровым были сформулированы правила, которыми можно было руководствоваться при определении строения органических соединений, а также было объяснено явление изомерии, А. Кекуле в 1865 г. распространил положения теории строения на ароматические соединения. Экспериментальное подтверждение теории химического строения Бутлеровым и его учениками имело огромное значение для ее утверждения.— Прим. ред. [c.82]
Кекуле в 1865 г. распространил положения теории строения на ароматические соединения. Экспериментальное подтверждение теории химического строения Бутлеровым и его учениками имело огромное значение для ее утверждения.— Прим. ред. [c.82]
В то же время в молекулах даже простейших органических соединений содержится десять и более атомов, а нередко число атомов в молекуле органического соединения измеряется несколькими десятками. Молекулы же таких соединений, как крахмал или белок, можно без всякого преувеличения назвать гигантскими в них насчитываются тысячи и даже сотни тысяч атомов. [c.73]
Немецкий химик Иоганн Фридрих Вильгельм Адольф фон Байер (1835—1917) использовал в 1885 г. идею трехмерного строения молекул для изображения пространственного строения циклических соединений (в виде плоских колец). Если четыре связи атомов углерода направлены к четырем углам тетраэдра, то угол между любыми двумя связями составляет 109°28. Байер утверждал, что в любом органическом соединении атомы располагаются, как правило, так, что углы между связями атома углерода примерно соответствуют приведенному значению. Если же по какой-либо причине угол меняется, то атом оказывается в напряженном состоянии. [c.90]
Если же по какой-либо причине угол меняется, то атом оказывается в напряженном состоянии. [c.90]
Пропан и бутан — тоже газы. Однако по мере увеличения числа углеродных атомов в молекуле углеводорода он все легче превращается в жидкость. Это правило — общее для органических соединений. Холода антарктической зимы достаточно, чтобы превратить в жидкость [c.21]
В состав многих органических соединений входят только углерод, водород и кислород, поэтому, определив содержание углерода и водорода, во многих случаях можно было установить эмпирическую формулу соединения. В 1811 г. Гей-Люссак и Тенар составили эмпирические формулы около двадцати органических соединений, в том числе некоторых простых сахаров. [c.75]
Кроме того, все без исключения органические соединения имеют своих молекулах один или более атомов углерода-. Почти все молекулы содержат также атомы водорода. Поскольку углерод и водород сами по себе горючи, то вполне можно предположить, что соединения, Б которых эти элементы играют такую важную роль, также относятся к числу горючих. [c.73]
[c.73]
Доказать наличие положительно и отрицательно заряженных компонентов в простых неорганических соединениях типа хлорида натрия со временем, действительно, удалось (см. гл. 12). Однако распространить это на органические соединения оказалось значительно сложнее. Так, Берцелиус должен был настойчиво утверждать, что радикалы состоят только из углерода и водорода, причем углерод заряжен отрицательно, а водород — положительно. Он считал, что радикал бензоил (С,НбО) не содержит и не может содержать кислород, который искажает действие, оказываемое этим радикалом. Берцелиус был также уверен, что замещение отрицательно заряженного компонента на положительно заряженный обязательно приведет к резкому изменению свойств соединения. [c.78]
В соответствии с представлениями этой теории в молекуле воды (Н О) к центральному атому кислорода — ядру присоединены два атома водорода. Замещая один из атомов водорода на радикалы какого-либо ряда, можно получить группу соединений, в число которых входят и вода, и различные органические соединения. [c.79]
[c.79]
Теория типов завоевывала все большую популярность, поскольку она позволила систематизировать органические соединения, а список все новых и новых органических соединений в то время очень быстро увеличивался. Русский химик Федор Федорович Бейльштейн (1838—1906) опубликовал в 1880 г. обширное руководство по органическим соединениям, в котором использовал теорию типов Лорана для размещения этих соединений в рациональном порядке. [c.80]
И тем не менее теория типов в том виде, в каком она вытекала нз работ Лорана, оставалась незавершенной. По-прежнему предполагалось, что органические соединения построены из радикалов, вопрос о молекулярной структуре обходился стороной. Ответить на него можно было, только выяснив, как в действительности располагаются атомы в самих радикалах. [c.80]
ВО много раз ускоряет присоединение водорода к кислороду и к различным органическим соединениям. А Кирхгоф в 1812 г. показал, что кислота значительно ускоряет расщепление ряда органических соединений. Причем ни платина, ни кислота в процессе реакции не расходуются, количество их остается неизменным. [c.115]
Причем ни платина, ни кислота в процессе реакции не расходуются, количество их остается неизменным. [c.115]
В истории развития органической и неорганической химии XIX столетия наблюдается любопытная параллель. В первые десятилетия число вновь открытых органических соединений, а также элементов увеличивалось ошеломляюще быстро. В третьей четверти столетия органические соединения были в определенной степени систематизированы благодаря введению структурных формул. До некоторой степени упорядочены были и элементы отчасти этому способствовали итоги Международного химического конгресса, который состоялся в начале сентября 1860 г. в г. Карлсруэ. [c.92]
В начале XIX столетия, когда Дэви (см. гл. 5) разрабатывал классификацию молекул неорганических соединений, а Бертло (см. гл. 5) — классификацию молекул органических соединений, физики изучали потоки теплоты, другими словами — термодинамику (от греческого — движение тепла). [c.108]
Несколько лет спустя после поразительного успеха Перкина химики познакомились со структурными формулами органических соединений. Эти формулы могли служить химикам своего рода картой территории , на которой им предстояло действовать. Используя эту карту, можно было вывести логические схемы реакций, подобрать методы, позволяющие, постепенно меняя строение молекул, превратить одну молекулу в другую и, наконец, синтезировать новые органические соединения не случайно, как это вышло у Перкина, а целенаправленно. [c.124]
Эти формулы могли служить химикам своего рода картой территории , на которой им предстояло действовать. Используя эту карту, можно было вывести логические схемы реакций, подобрать методы, позволяющие, постепенно меняя строение молекул, превратить одну молекулу в другую и, наконец, синтезировать новые органические соединения не случайно, как это вышло у Перкина, а целенаправленно. [c.124]
С органическими соединениями, молекулы которых отличались внушительными размерами, дело обстояло сложнее. Используя методы начала XIX в., было очень тяжело, вероятно и невозможно, установить точную эмпирическую формулу даже такого довольно простого по сравнению, например, с белками органического соединения, как морфин. В настоящее время известно, что в молекуле морфина содержатся 17 атомов углерода, 19 атомов водорода, 3 атома кислорода и 1 атом азота ( ijHisNOa). Эмпирическая формула уксусной кислоты (С2Н4О2) намного проще, чем формула морфина, но и относительно этой формулы в первой половине XIX в. не было единога мнения. Однако, поскольку химики собирались изучать строение молекул органических веществ, начинать им необходимо было с установления эмпирических формул. [c.74]
не было единога мнения. Однако, поскольку химики собирались изучать строение молекул органических веществ, начинать им необходимо было с установления эмпирических формул. [c.74]
В XX в. начала приоткрываться завеса над обширной областью, прилегающей к границе органической и неорганической химии В 1899 г. английский химик Фредерик Стенли Киппинг (1863— 1949) занялся изучением органических соединений, содержащих кремний — самый распространенный после кислорода элемент земной коры. Киппинг посвятил изучению кремния более сорока лет и синтезировал множество органических соединений, содержащих один или несколько атомов кремния. Как выяснилось, можно получать бесконечно длинные цепи, состоящие из чередующихся атомов кремния и кислорода. [c.143]
Теория Льюиса — Ленгмюра позволяет объяснить, как образуются связи между атомами углерода или между атомами углерода и атомами водорода в органических соединениях. Большинство органических молекул можно легко представить электронными фор-мулами, в которых прежние штрихи формул Кекуле (см. гл. 7) — зто обобществленные пары электронов. [c.160]
гл. 7) — зто обобществленные пары электронов. [c.160]
Начиная со времен Лавуазье химики могли предсказывать, в каком направлении пойдут те или иные быстрые ионные реакции относительно небольших молекул, и могли модифицировать эти реакции с целью их практического использования. Изучать сложные молекулы было гораздо труднее. Медленные реакции органических соединений также гораздо труднее поддавались анализу. Часто реакции могли идти несколькими путями, и направить реакцию по нужному пути химику позволяли его мастерство экспериментатора и интуиция, а не глубокое понимание процесса. [c.161]
Это соединение напоминало один из тех радикалов, представление о которых было введено в XIX в. для объяснения строения органических соединений (см. гл. 6). Однако, в отличие от радикалов старой теории, обнаруженная Гомбергом молекула существовала в изолированном виде, а не как фрагмент другого соединения, поэтому она была названа свободным радикалом. [c.163]
[c.163]
Для выброоов нефтепереработки и нефтехимик характерно большое разнообразив токсичных веществ. Особенно вредны такие вещества, как хлор, сероводород, моносксид углерода, ртуть, фв -нол, тиофос, ДДТ, многие металлы и органические соединения. Целый ряд токсичных веществ хииичвс. ие предприятия сбрасывают в больших количеотвах. например, диоксид серы, туман серной кислоты, хдор, хлористый водород, оксиды азота и др. [c.22]
В этой книге я расскажу о различных органических соединениях. Вы поймете, какое они имеют значение и как расширение наших знаний о них помогает нам в нашей жизни. [c.13]
Прежде всего мы должны поговорить об одной проблеме, которую нельзя обойти, если мы собираемся иметь дело с большими молекулами. К середине прошлого века органических соединений уже накопилось много сотен и даже тысяч. Но к к химику описать то или иное соединение, чтобы дру гие химики могли понять, каково его строение [c. 14]
14]
САМОЕ ПРОСТОЕ ОРГАНИЧЕСКОЕ СОЕДИНЕНИЕ [c.19]
Начать, я думаю, лучше всего с чего-нибудь попроще. Есть такие соединения, молекулы которых состоят только из атомов углерода и водорода. Эти два вида атомов чаще всего встречаются в органических соединениях, поэтому вполне логично начать именно с них. Соединения, состоящие из атомов углерода и водорода, называются углеводородами. [c.19]
Расчеты показывают, что для соединения с 40 атомами углерода могут существовать больше 60 триллионов разновидностей, и каждая из них будет отличаться от других. Химики, конечно, не занимаются изучением всех этих изомеров и не пытаются выделить. их поодиночке. Но это еще раз показывает, почему органических соединений существует так много. [c.25]
Если углеродная цепочка достаточно длинна, двойная связь может находиться в любом ее месте. А если цепочка разветвлена, то двойная связь может оказаться в одной из ее ветвей. Кроме того, в молекуле может быть не одна, а несколько двойных связей. Есть такие вещества, в которых их дюжина или даже больше. И каждый новый вариант, каждое новое расположение двойной связи — это новое вещество. Еще изомеры, еще миллиарды органических соединений [c.38]
Кроме того, в молекуле может быть не одна, а несколько двойных связей. Есть такие вещества, в которых их дюжина или даже больше. И каждый новый вариант, каждое новое расположение двойной связи — это новое вещество. Еще изомеры, еще миллиарды органических соединений [c.38]
Замечая, что происходит при взаимодействии определенных веществ с органическим соединением, химики устанавливают, есть в нем двойная связь или нет. А разрывая цепочку и изучая ее обрывки, они могут сказать, где именно располагалась двойная связь. [c.38]
Даже после глубокого обессоливвния нефти в процессе её переработки образуется значительное количество хлористого водорода, достаточное для снижения pH конденсационных вод не установках АВа. до 2…3. Кроме того,источником хлористого водорода могут служить Xлороодоржвщио органические соединения. Поэтому для снижения кио-дотности, а, следовательно,значительного подавления коррозии. [c.54]
Французский химик Пьер Эжен Марселей БертАо (1827—1907) в 50-е годы XIX в. начал систематическую разработку синтеза органических соединений и достиг больших успехов. Он синтезировал, в частности, такие хорошо известные и важные соединения, как метиловый и этиловый спирты, метан, бензол, ацетилен. Бертло — нарушил границу между неорганической и органической химией, покончив с пресловутым запретом . В дальнейшем такое нарушение границ стало обычным. [c.71]
начал систематическую разработку синтеза органических соединений и достиг больших успехов. Он синтезировал, в частности, такие хорошо известные и важные соединения, как метиловый и этиловый спирты, метан, бензол, ацетилен. Бертло — нарушил границу между неорганической и органической химией, покончив с пресловутым запретом . В дальнейшем такое нарушение границ стало обычным. [c.71]
Вёлер, Кольбе и Бертло синтезировали относительно простые органические соединения, тогда как для живой природы характерны значительно более сложные соединения типа крахмала, жиров и белков. Изучать такие соединения гораздо труднее непросто даже установить их точный элементный состав. В целом изучение органических веществ обещало разгадку многих проблем, но подступиться к этим веществам химику прошлого века было совсем непросто. [c.71]
К середине XIX в. стало уже непопулярным причислять то или иное соединение к органическим или неорганическим, исходя лишь яз того, является или не является оно продуктом живой ткани.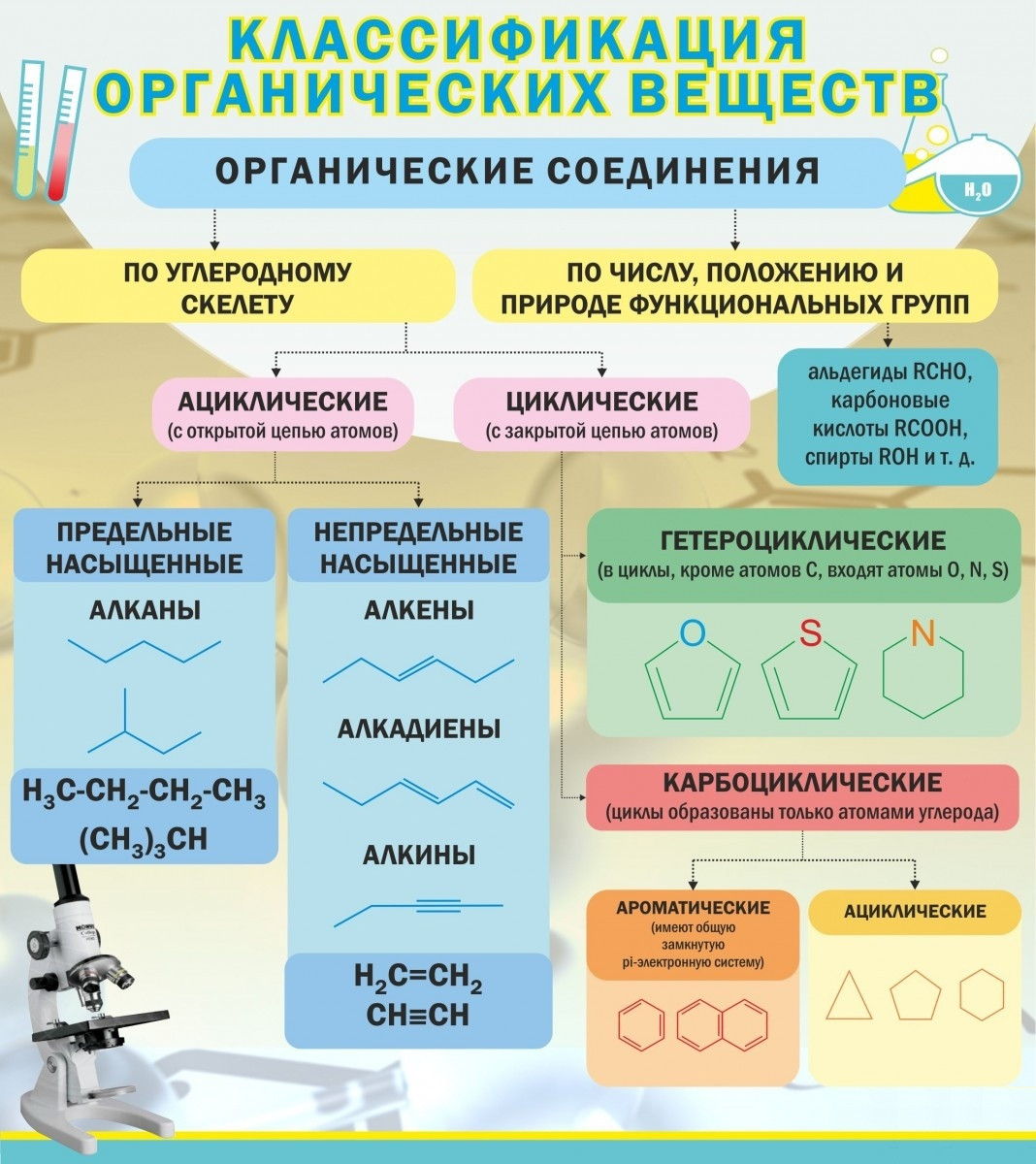 В то время уже были известны такие органические соединения, оторые никак не могли быть продуктами жизнедеятельности организмов. Тем не менее деление соединений на органические и неорга-инческие имело смысл. Свойства соединений этих классов, как выяснилось, настолько различаются, что даже приемы работы химика-органика и химика-неорганика совершенно различны. [c.73]
В то время уже были известны такие органические соединения, оторые никак не могли быть продуктами жизнедеятельности организмов. Тем не менее деление соединений на органические и неорга-инческие имело смысл. Свойства соединений этих классов, как выяснилось, настолько различаются, что даже приемы работы химика-органика и химика-неорганика совершенно различны. [c.73]
В 80-х годах XVIII столетия Лавуазье пытался определить относительное содержание углерода и водорода в органических соединениях. Он сжигал изучаемое соединение и взвешивал выделившиеся углекислый газ и воду. Результаты такого определения были не очень точными. В первые годы XIX в. Гей-Люссак (автор закона объемных отношений, см. гл. 5) и его коллега французский химик Луи Жак Тенар (1777—1857) усовершенствовал этот метод. Они сначала смешивали изучаемое органическое соединение с окислителем и лишь потом сжигали. Окислитель, например хлорат калия, при нагревании выделяет кислород, который хорошо смешивается с органическим веществом, в результате чего сгорание происходит быстрее и полнее. Собирая выделяющиеся при сгорании углекислый газ и воду, Гей-Люссак и Тенар могли определить соотношение углерода и водорода в исходном соединении. С помощью усовершенствованной к тому времени теории Дальтона это соотношение можно было выразить в атомных величинах. [c.74]
Собирая выделяющиеся при сгорании углекислый газ и воду, Гей-Люссак и Тенар могли определить соотношение углерода и водорода в исходном соединении. С помощью усовершенствованной к тому времени теории Дальтона это соотношение можно было выразить в атомных величинах. [c.74]
Размышляя над строением органических соединений, Берцелиуо пришел к выводу, что радикалы могут быть теми кирпичиками , из которых построены органические соединения. Подобно тому как неорганические соединения построены из отдельных атомов, органические соединения построены из радикалов, которые, по мнению Берцелиуса, почти так же, как и отдельные атомы, недоступны и неделимы . [c.78]
Между 1850 и 1852 гг. английский химик Александр Уильям Уильямсон (1824—1904) показал, что органические соединения, относящиеся к классу простых эфиров, можно также построить по типу воды . Простые эфиры можно получить, заместив на органические радикалы оба атома водорода воды. В обычном эфире, который в то время начали применять как анестезирующее средство, оба атома водорода замещены на этильные группы, так что его формула записывается как С2Н5ОС2Н5. [c.80]
[c.80]
Русский химик Александр Михайлович Бутлеров (1823—1886) использовал эту новую систему структурных формул в разработанной им теории строения органических соединений В 60-х годах прошлого столетия он показал, как с помощью структурных формул можно наглядно объяснить причины существования изомеров (см. гл. 5). Так, например, у этилового спирта и диметилового эфира одна и та же эмпирическая формула СгНпО, однако структурные формулы этих соединений значительно различаются [c.84]
В ходе синтеза сложных органических соединений необходи,мо время от времени проводить анализ с целью иден ификации продуктов, образующихся на разных стадиях процесса. Количество вещества, которое можно было бы отобрать для анализа, как правило, весьма невелико, и поэтому анализ в лучшем случае давал неточные результаты, а в худшем и вовсе был невозможен. [c.127]
Почти все органические соединения, перечисленные в предыдущем разделе, состоят из молекул, количество атомов в которых чаще всего не превышает пятидесяти эти атомы с трудом распадаются в условиях умеренной химической обработки. Однако существуют органические соединения с поистине гигантскими молекулами, построенными из тысяч и даже миллионов атомов. Эти молекулы состоят из сравнительно небольших строительн ых блоков Такие гигантские молекулы легко разложить на образующие их блоки, которые можно исследовать. Так, например, поступил Левин, изучая нуклеотиды (см, предыдущий раздел). Предпринимались также попытки изучать эти гигантские молекулы как таковые, не разрушая их предварительно. Первые шаги в этом направлении предпринял шотландский химик Томас Грэхем (1805— [c.127]
Однако существуют органические соединения с поистине гигантскими молекулами, построенными из тысяч и даже миллионов атомов. Эти молекулы состоят из сравнительно небольших строительн ых блоков Такие гигантские молекулы легко разложить на образующие их блоки, которые можно исследовать. Так, например, поступил Левин, изучая нуклеотиды (см, предыдущий раздел). Предпринимались также попытки изучать эти гигантские молекулы как таковые, не разрушая их предварительно. Первые шаги в этом направлении предпринял шотландский химик Томас Грэхем (1805— [c.127]
Одним из главных источников основных органических соединений, необходимых для производства новых синтетических продуктов, является нефть. Эта жидкость известна с античных времен, но чтобы использовать ее в больших количествах, необходимо было открыть способ выкачивания нефти из обширных подземных месторождений. Американский изобретатель Эдвин Лаурентин Дрейк (1819—1880) первым в 1859 г. начал бурить нефтяные скважины.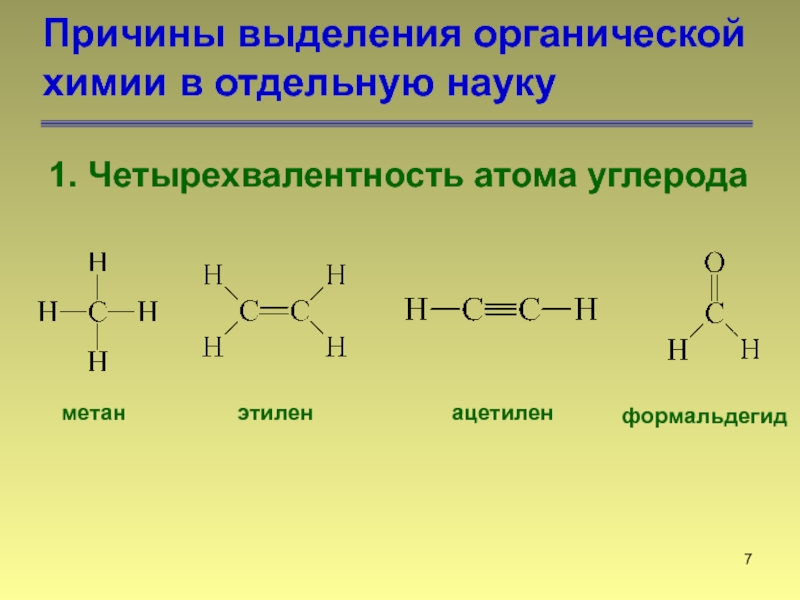 Столетие спустя нефть стала основным источником органических соединений, источником тепла и энергии. [c.136]
Столетие спустя нефть стала основным источником органических соединений, источником тепла и энергии. [c.136]
Обычные органические соединения состоят из атомов углерода, к которым присоединены другие атомы. Как правило, другие атомы — это атомы водорода, поэтому об органических соединениях можно говорить как об углеводородах и их производных. Однако известно, что атом фтора почти столь же мал, как и атом водорода. В связи с этим резонно было предположить, что там, где подходит атом водорода, подойдет и атом фтора, т. е. наряду о семейством углеводородов существует семейство фторуглеродоа и их производных. [c.143]
А, Азимов лишь очень кратко касается развития одной иэ важнейших и в познавательном, и практическом смысле областей химии — химии элементоорганических соединений. Не упоминает он и о работах Виктора Гриньяра (1871 — 1935), получившего в 1900 г. магний-галогенорганические соединения (реактивы Гриньяра). Вклад советских ученых П. П. Шорыгина, А. Е. Арбузова, А. Н. Несмеянова, К. А. Кочеткова, К. А. Андрианова в развитие элементоорганической химии особенно велик. Достаточно упомянуть о синтезе кремнийорганических соединений, проведенном К. А. Андриановым, уже в 30-х годах запатентовавшим свои открытия. Не упоминает А. Азимов и об открытии органических соединений переходных металлов. Вместе с тем синтез ферроцена, дибензилхрома был своеобразной химической сенсацией и стимулировал многочисленные теоретические и экспериментальные исследования. См. Соловьев Ю. И., Трифонов Д. Н., Шамин А. Н. Истор я химии (примечание 13 к гл. 10). [c.186]
П. Шорыгина, А. Е. Арбузова, А. Н. Несмеянова, К. А. Кочеткова, К. А. Андрианова в развитие элементоорганической химии особенно велик. Достаточно упомянуть о синтезе кремнийорганических соединений, проведенном К. А. Андриановым, уже в 30-х годах запатентовавшим свои открытия. Не упоминает А. Азимов и об открытии органических соединений переходных металлов. Вместе с тем синтез ферроцена, дибензилхрома был своеобразной химической сенсацией и стимулировал многочисленные теоретические и экспериментальные исследования. См. Соловьев Ю. И., Трифонов Д. Н., Шамин А. Н. Истор я химии (примечание 13 к гл. 10). [c.186]
Эти половины и в самом деле неравны. Однако дело Х)6стоит овее не так, как вы думаете. В действительности более многочисленнь ми оказались органические соединения. Соединений, содержащих атом углерода, намного больше, чем его не содержащих. Сейчас известно по меньшей мере 1700 000 углеродсодержащих соединений, и каждый день обнаруживают в природе или продолжают синтезировать в лабораториях все новые органические соединения. И этому процессу, по-видимому, не будет конца. Общее число известных на сегодня неорганиче- [c.12]
И этому процессу, по-видимому, не будет конца. Общее число известных на сегодня неорганиче- [c.12]
Представьте себе двух детей, у каждого из которых есть набор кубиков. У одного в наборе, скажем, около девяноста разных типов кубиков, и он может строить из них дома, но при этом должен каждый раз ограничиваться всего десятью-двенадцатью кубиками. У другого в наборе всего четыре или пять разных типов куШков но он может, строя свой дом, использовать сколько угодно ИХ — хоть миллион. Ясно, что второй может (юстро-ить больше разных домов. И именно поэтому органических соединений гораздо больше, чем неорганических. [c.13]
Но все это не годится, когда речь идет об органических веществах. Их так много, что часто у двух или нескольких разных соединений молекулы состоят из одних и тех же атомов в одних и тех же количествах. Например, у двух органических соединений — этилового спирта и диметилового эфира — молекулы состоят из двух атомов углерода, шести атомов водорода и одного атома, кислорода. Формула обоих соединений оказывается одинаковой — СаНбО (такие вeцie твa получили [c.14]
Формула обоих соединений оказывается одинаковой — СаНбО (такие вeцie твa получили [c.14]
Вообще говоря, горят почти все органические соединения, если их в достаточной степени нагреть. А боль-шииетва неорганических соединений, наоборот, не горит. [c.20]
Учебник общей химии (1981) — [
c.306
]
Аналитическая химия. Кн.2 (1990) — [
c.0
]
Пособие по химии для поступающих в вузы 1972 (1972) — [
c.0
]
Общая химия (1987) — [
c.0
]
Курс органической химии (1965) — [
c.15
,
c.17
]
Химический энциклопедический словарь (1983) — [
c.414
]
Химия кремнезема Ч.1 (1982) — [
c. 0
0
]
Аналитическая химия серы (1975) — [
c.0
]
Основы полярографии (1965) — [
c.0
]
Большой энциклопедический словарь Химия изд.2 (1998) — [
c.414
]
Химический анализ (1966) — [
c.0
]
Химическое разделение и измерение теория и практика аналитической химии (1978) — [
c.0
]
Практическое руководство по неорганическому анализу (1966) — [
c.0
]
Курс теоретических основ органической химии издание 2 (1962) — [
c.0
]
Основные начала органической химии том 1 (1963) — [
c.0
]
Физическая химия силикатов (1962) — [
c. 0
0
]
Курс химии Часть 1 (1972) — [
c.304
]
Основы биохимии Т 1,2,3 (1985) — [
c.58
]
Радиохимия (1972) — [
c.0
]
Курс органической химии (1967) — [
c.15
,
c.17
]
Курс общей химии (1964) — [
c.276
,
c.351
]
Краткая химическая энциклопедия Том 1 (1961) — [
c.0
]
Капельный анализ (1951) — [
c.0
]
Курс теоретических основ органической химии (1959) — [
c.0
]
Основные начала органической химии Том 1 Издание 6 (1954) — [
c. 0
0
]
Общая химия 1982 (1982) — [
c.39
,
c.450
]
Общая химия 1986 (1986) — [
c.37
,
c.435
]
Краткий справочник по химии (1965) — [
c.178
]
Учебник общей химии 1963 (0) — [
c.286
,
c.300
]
Фото-люминесценция растворов (1972) — [
c.0
]
Радиационная химия органических соединений (1963) — [
c.0
]
Молекулярный масс спектральный анализ органических соединений (1983) — [
c.0
]
Основы аналитической химии Часть 2 (1979) — [
c.0
]
Общая химия Издание 18 (1976) — [
c. 36
36
,
c.446
]
Общая химия Издание 22 (1982) — [
c.39
,
c.450
]
Краткий справочник химика Издание 6 (1963) — [
c.0
]
Методы разложения в аналитической химии (1984) — [
c.0
]
Общая технология синтетических каучуков (1952) — [
c.50
]
Общая технология синтетических каучуков Издание 2 (1954) — [
c.19
]
Стереохимия (1949) — [
c.346
,
c.349
]
Органическая химия Издание 3 (1980) — [
c.0
]
Практическое руководство по неорганическому анализу (1960) — [
c. 0
0
]
Микрокристаллоскопия (1955) — [
c.0
]
Основы общей химии Том 2 (1967) — [
c.46
]
Основы общей химии Том 2 Издание 3 (1973) — [
c.535
,
c.569
]
Краткий справочник химика Издание 7 (1964) — [
c.0
]
Курс органической химии (1955) — [
c.5
,
c.6
,
c.8
,
c.12
,
c.13
]
Биохимия Издание 2 (1962) — [
c.229
]
Курс общей химии (0) — [
c.297
]
Курс общей химии (0) — [
c. 297
297
]
Происхождение жизни Естественным путем (1973) — [
c.14
,
c.15
,
c.71
,
c.74
,
c.76
,
c.81
,
c.85
,
c.94
,
c.96
,
c.104
,
c.107
,
c.114
,
c.118
,
c.119
,
c.130
,
c.134
,
c.147
,
c.150
,
c.159
,
c. 168
168
,
c.193
,
c.204
,
c.219
,
c.220
,
c.221
,
c.273
,
c.287
,
c.290
,
c.304
,
c.343
,
c.362
,
c.367
,
c.368
,
c.381
,
c.382
,
c.385
,
c.389
,
c.393
]
Предмет химии (0) — [
c.297
]
Биология с общей генетикой (2006) — [
c. 40
40
]
Кафедра органической химии | Пятигорский медико-фармацевтический институт (ПМФИ)
Кафедра занимается изучением химии природных и синтетических биологически активных соединений с целью создания на их основе лечебных и лечебно-профилактических средств. Начиная с 1983 года, проводятся исследования по изучению закономерностей взаимосвязи между структурой и фармакологической активностью. Данное направление в настоящее время имеет большое значение для целенаправленного синтеза или поиска в природе структур с заданными биологическими свойствами.
Развитие научных исследований кафедры в первую очередь связано с именем доктора фармацевтических наук, профессора А.Л. Шинкаренко. В нашей стране она возглавила исследования по изучению биологически активных соединений лечебных грязей Тамбуканского озера, грязи Мойнакского, Санайского и Одесского районов и сапропелей Тюменских озёр. Из пелоидов лечебной грязи Тамбуканского озера ею был получен биологически активный комплекс, который оказался эффективным противовоспалительным, противоожоговым и биогенным средством. Позже ею было доказано, что аналогичные препараты могут быть получены из лечебных грязей других районов нашей страны.
Позже ею было доказано, что аналогичные препараты могут быть получены из лечебных грязей других районов нашей страны.
Профессор А.Л. Шинкаренко большое внимание уделяла также исследованию биологически активных соединений в растениях флоры Северного Кавказа. Так, совместно с ассистентом Л.Д. Сунцовой, аспирантами Н.В. Бондаренко и Г.И. Геращенко были изучены алкалоиды цемерицы Лобеля и предложена субстанция «Ловерат» гипотензивного действия, которая была положительно апробирована в клиниках Ростовского и Курского медицинских институтов, на кафедре лечебного факультета I Московского медицинского института, а также Новокузнецкого института усовершенствования врачей и Украинского института клинической медицины.
В 1954 году на кафедре, под руководством А.Л. Шинкаренко были начаты исследования по изучению таких природных биологически активных соединений, как флавоноиды, фенолкарбоновые кислоты, тритерпеноиды, липиды грязей сине-зелёных водорослей, пыльцы-обножки.
Были созданы и опубликованы 6 методических пособий, которые используются в научно-методической работе ряда институтов СНГ (профессор А.Л. Шинкаренко, профессор В.А. Бандюкова, профессор Э.Т. Оганесян, профессор А.Л. Казаков, доцент А.В. Симонян, доцент И.И. Озимина). Разработанные методики анализа были внедрены в работу контрольно-аналитических лабораторий фармацевтических фабрик г. Краснодара и г. Пятигорска (старший преподаватель Н.В. Сергеева, аспирант Ильма Деста).
Профессор В.А. Бандюкова, изучив состав флавоноидов более чем в 300 растениях, выявила новые источники получения лекарственных препаратов рутина, кверцетина и нарингина. Полученные ею статистико-вероятностные характеристики обнаружения определённых структур позволяют вести целенаправленный поиск биологически-активных флавоноидов в неизученном растительном сырье. По результатам анализа распространения флавоноидов в высших растениях опубликованы монографии «Флавоноиды растений» (Алма-Ата, 1978), «Биологически активные вещества пищевых продуктов» (совместно с профессором А. Л. Казаковым и др.), а по результатам изучения пыльцы-обножки опубликована брошюра «Пыльца – концентрат биологически активных соединений», которая на Всесоюзном конкурсе на лучшее произведение научно-популярной литературы награждена Поощрительным дипломом (1966 г.).
Л. Казаковым и др.), а по результатам изучения пыльцы-обножки опубликована брошюра «Пыльца – концентрат биологически активных соединений», которая на Всесоюзном конкурсе на лучшее произведение научно-популярной литературы награждена Поощрительным дипломом (1966 г.).
В 70-х годах В.А. Компанцевым был разработан лабораторный регламент получения рутина из отходов дубильной промышленности, который был одобрен Московским витаминным институтом и витаминным отделом Министерства медицинской промышленности. Ассистент Л.В. Лигай разработала технологическую схему получения рутина из надземной части сиды многолетней, которая апробирована на опытной установке Нарткалинского химкомбината Минмедпрома России.
Способы получения других биологически активных соединений внедрены в работу научных лабораторий различных институтов СНГ. Из растений выделено свыше 500 соединений, впервые установлена структура новых гликозидов флавоноидной и тритерпеноидной природы (профессор В. А. Бандюкова, кандидат фармац. наук Г.Н. Земцова, профессор Э.Т. Оганесян, кандидат хим. наук З.С. Давидянц, Л.В. Лигай). Продолжаются исследования биологически активных компонентов отходов пищевого и фармацевтического производства.
А. Бандюкова, кандидат фармац. наук Г.Н. Земцова, профессор Э.Т. Оганесян, кандидат хим. наук З.С. Давидянц, Л.В. Лигай). Продолжаются исследования биологически активных компонентов отходов пищевого и фармацевтического производства.
Помимо изучения природных соединений на кафедре интенсивно развиваются такие направления, как:
• целенаправленный синтез биологически активных соединений;
• исследование качественных и количественных соотношений взаимосвязи структура – фармакологическая активность;
• компьютерное моделирование и априорная оценка фармакологической активности виртуальных соединений.
В ходе исследований по целенаправленному синтезу биологически активных соединений получены следующие результаты:
• Предложен алгоритм и комплексный подход к молекулярному конструированию производных 1,3-диазинона-4. На основе логико-структурного подхода, а также расчётов энергетических составляющих взаимодействия лиганд-рецептор обосновано строение структур и осуществлён целенаправленный синтез целевых соединений, обладающих нейропротекторной активностью. Всего получено 139 производных 1,4-дигидро-4-оксопиримидина, 2-фенилбензоксазинона-4, 2-метил-6,7-диметоксихиназолинонов-4, амидов о-бензоиламинобензойной кислота и N-ацетиламидов-2-фенилкротоновой кислоты.
На основе логико-структурного подхода, а также расчётов энергетических составляющих взаимодействия лиганд-рецептор обосновано строение структур и осуществлён целенаправленный синтез целевых соединений, обладающих нейропротекторной активностью. Всего получено 139 производных 1,4-дигидро-4-оксопиримидина, 2-фенилбензоксазинона-4, 2-метил-6,7-диметоксихиназолинонов-4, амидов о-бензоиламинобензойной кислота и N-ацетиламидов-2-фенилкротоновой кислоты.
• Модифицированы одностадийные методы синтеза производных N-ацетиламидов-2-фенилкротоновой кислоты и амидов о-бензоиламинобензойной кислоты путём использования полярных апротонных растворителей, что позволило в дальнейшем получить, труднодоступные производные 4-оксопиримидина и хиназолинона-4.
• Оптимизированы условия проведения реакции циклоконденсации N-ацил-β-кетоамидов со слабыми нуклеофилами, а также модифицирована методика синтеза N-замещённых производных 1,4-дигидро-4-оксопиримидина, позволяющая увеличить выход целевых продуктов до 90%.
• Изучен механизм взаимодействия производных бензоксазинона с аминами в условиях кислотного катализа и на этой основе разработаны условия синтеза N-замещённых 2-фенилхиназолинонов-4, 2-метил-6,7-диметоксихиназолинонов-4 и их ациклических предшественников. Сопоставление экспериментальных данных с квантово-химическими расчетами всех стадий взаимодействия 2-фенилбензоксазинона-4 с аминами позволило объяснить протекание конкурентной реакции с образованием диамидов. Суть заключается в направлении атаки со стороны аминного компонента двух вероятных карбкатионов, а также стерических эффектов производных 1,3-бензоксазинона-4.
• Исследование биологической активности показало, что из общего числа синтезированных соединений 107 обладают прогнозируемыми биологическими свойствами: психотропными – 43, противовоспалительными – 27, актопротекторными – 7, антигипоксическими – 18, антигипертензивными – 15, гипогликемическими – 2, диуретическими – 9, иммуностимулирующими – 14. Все эти данные подтверждают достоверность предварительного прогноза.
Все эти данные подтверждают достоверность предварительного прогноза.
• Исследование психотропной активности производных 1,3-диазинона-4 с остатками нейромедиаторных аминокислот и пептидов подтверждает их влияние на ЦНС; а для 4-(2,6-диметил-5-фенил-4-оксо-1,4-дигидропиримидил-1)-бутановой кислоты (PDMGAB) помимо этого выявлена также церебропротекторная и антигипоксическая активность. Экспериментально, с использованием бикукулина и гидрастина доказано взаимодействие PDMGAB с ГАМКА- рецептором, чем и можно объяснить его ГАМК-ергическое действие.
• Выявлены «соединения-лидеры», обладающие соизмеримой или превосходящей по фармакологической активности препараты сравнения: вещество PDMGAB по церебропротекторному действию превосходит препараты ГАМК на 35,5% и ноотропил на 10,5%; QPhpHas2Br превосходит аминазин в угнетении ЦНС на 15%; QphAnp соизмеримо по действию с феназепамом; PDMD превосходит кофеин в стимуляции ЦНС на 47%; PDEAnes увеличивает двигательную активность в 19 раз; NcQPhD по противовоспалительной активности превосходит диклофенак-натрия в 2,3 раза; BisPDMD по гипогликемическому действию соизмеримо с глибенкламидом; NcQPhGAB по диуретической активности превосходит диакарб в 2 раза; вещество PDMBenzIm5,6DM превосходит метилурацил в стимуляции клеточного иммунитета в 2,2 раза, а гуморального – в 2,5 раз; PDMD превосходит папаверин по гипотензивному действию в 2,7 раза и нормализует АД в случае гипотензий.
• Строение синтезированных соединений доказаны современными методами анализа — УФ-, ИК- и 1Н ЯМР-спектроскопии. Установлено, что 2-стирилпроизводные 1,4-дигидро-4-оксопиримидина имеют трансоидную конфигурацию.
• Для синтезированных веществ осуществлен корреляционный анализ взаимосвязи между квантово-химическими параметрами и данными поведенческих тестов, что позволило выявить наиболее значимые дескрипторы влияющие на психотропную активность.
• Выявлены следующие молекулярные дескрипторы: энергии НСМО, характерны для производных 4-оксопиримидина, минимальное значение электротопологического состояния атома водорода и автокорреляции Морана на основе поляризуемости атомов следует использовать для конструирования производных 4-оксопиримидина и хиназолинона-4, влияющих на ЦНС. Дескрипторы автокорреляции Морана и Гири на основе Ван-дер-ваальсовых объемов атомов в качестве межрядовых целесообразно использовать в прогнозе психотропной активности для производных 1,3-диазинона-4 и их ациклических предшественников.
За время существования кафедры её сотрудниками опубликовано свыше 1000 научных статей, 6 монографий, получено более 250 авторских свидетельств и патентов РФ, в ВНЦ по безопасности лекарств зарегистрировано более 500 новых соединений.
Учёными кафедры органической химии созданы следующие лекарственные средства:
Препарат тамбуканской грязи – лекарственный препарат, полученный из грязи Тамбуканского озера. Обладает противовоспалительным, биогенным, ранозаживляющим и противоожоговым действием.
Терисерп – лекарственный препарат, вырабатываемый из промышленных отходов травы чабреца (регистрационное удостоверение 97/202/11 и 97/202/10 от 14.07.1997). Характеризуется гиполипидемическим и противоатеросклеротическим действием.
Кавехол – лекарственный препарат, получаемый из продуктов переработки какао бобов (какаовеллы) (регистрационное удостоверение 97/335/10 и 97/335/10 от 14. 11.1997). Обладает гепатозащитным, желчегонным и радиопротекторным действием.
11.1997). Обладает гепатозащитным, желчегонным и радиопротекторным действием.
Гипурсол – лекарственный препарат, полученный из отходов переработки плодов облепихи (регистрационное удостоверение 2000/137/9 и 2000/137/10 от 24.04.2000). Проявляет гипохолестерическое, противоатеросклеротическое, противоишемическое действие.
За период с 2008 по 2017 гг. на кафедре были защищены следующие диссертации:
Докторская:
1. Кодониди И.П. «Молекулярное конструирование и целенаправленный синтез N-производных 1,3-диазинона-4», 2011 г.
Кандидатские:
2. Подгорная Ж.В. «Исследование цветков бархатцев распростертых (Tagetes patula L.) с целью получения биологически активных соединений», 2008 г.;
3. Кодониди М.И. «Химическое исследование цветков хризантемы корейской (Chrysanthemum x korefnum Makai) с целью получения фармакологически активных суммарных фитокомплексов», 2009 г.
4. Агаджанян В.С. «Целенаправленный поиск индивидуальных веществ и суммарных композиций, характеризующихся антирадикальной активностью в отношении супероксидного анион-радикала», 2009 г.;
5. Золотых Д.С. «Синтез и изучение взаимосвязи «структура-активность» производных 1,3-диазинона-4, содержащих остатки аминокислот и дипептидов», 2011 г.;
6. Ананьина Н.А. «Использование клубней георгины простой как альтернативного источника получения инулина», 2011 г.;
7. Гаранян Г.С. «Исследования по созданию биологически активного гидролизата на основе молочнокислых бактерий», 2011 г.;
8. Волкова А.А. «Исследование полифенольных соединений одно- и двулетних побегов вишни обыкновенной», 2011 г.
9. Жогло Е.Н. «Синтез и изучение взаимосвязи «структура-активность» N-арилзамещенных проиводных 1,3-диазинона-4», 2013 г.
10. Бандура А.Ф. «Синтез и изучение взаимосвязи «структура-активность» гетерилпроизводных 1,3-диазинона-4», 2015 г.
11. Сочнев В.С. «Синтез и изучение взаимосвязи «структура-активность» серосодержащих производных 1,3-диазинона-4», 2016 г.
12. Аджиахметова С.Л. «Химическое исследование крыжовника отклоненного (Grossularia reclinata (L.) Mill.) семейства Крыжовниковые (Grossulariaceae DС.) с целью получения фармакологически активных веществ», 2017 г.
13. Сивцева О.С. «Получение флаванонов и синтезы на их основе», 2017г.
14. Червонная Н.М. «Химический состав и биологическая активность гидрофильных фракций из соцветий бархатцев распростертых (Tagetes patula L.)», 2018 г.
Подготовка научно-педагогических кадров
Подготовка научно-педагогических кадров кафедры осуществляется через аспирантуру и докторантуру. На кафедре органической химии с момента её создания защищено 11 докторских диссертаций:
На кафедре органической химии с момента её создания защищено 11 докторских диссертаций:
• А.Л. Шинкаренко – 1953 г.,
• С.С. Пахомов – 1968 г.,
• Б.М. Копытин– 1970 г.,
• В.А. Бандюкова – 1975 г.,
• А.Л. Казаков– 1981 г.,
• Э.Т. Оганесян – 1981 г.,
• А.С. Сараф – 1993 г.,
• А.В. Симонян – 1993 г.,
• А.В. Кузнецов – 2002 г.,
• А.В. Погребняк – 2004 г.,
• И.П. Кодониди – 2011 г.
Защищено 95 кандидатские диссертации.
Ежегодно в аспирантуре на кафедре обучаются 3-5 аспирантов.
Учебный процесс на кафедре проводится на очном отделени.
Основным направлением учебно-методической работы является:
За время существования кафедры профессором Э.Т. Оганесяном опубликовано 4 учебника, 8 пособий для поступающих в ВУЗы, 2 справочника по химии.
Подготовлены и изданы для внутривузовского использования:
Учебная, методическая и учебно-методическая литература, подготовленная сотрудниками кафедры
1. Органическая химия специальность «Фармация»;
2. Медицинская химия специальность «Фармация»;
3. Органическая химия специальность «Медицинская биохимия»;
4. Биоорганическая химия специальность «Лечебное дело».
Органические соединения германия — уникальные запатентованные составляющие косметических средств FEMEGYL ®
26.02.2016
к.м.н. А.Д. Исаев , И.В. Амбросов, к.м.н. С.К.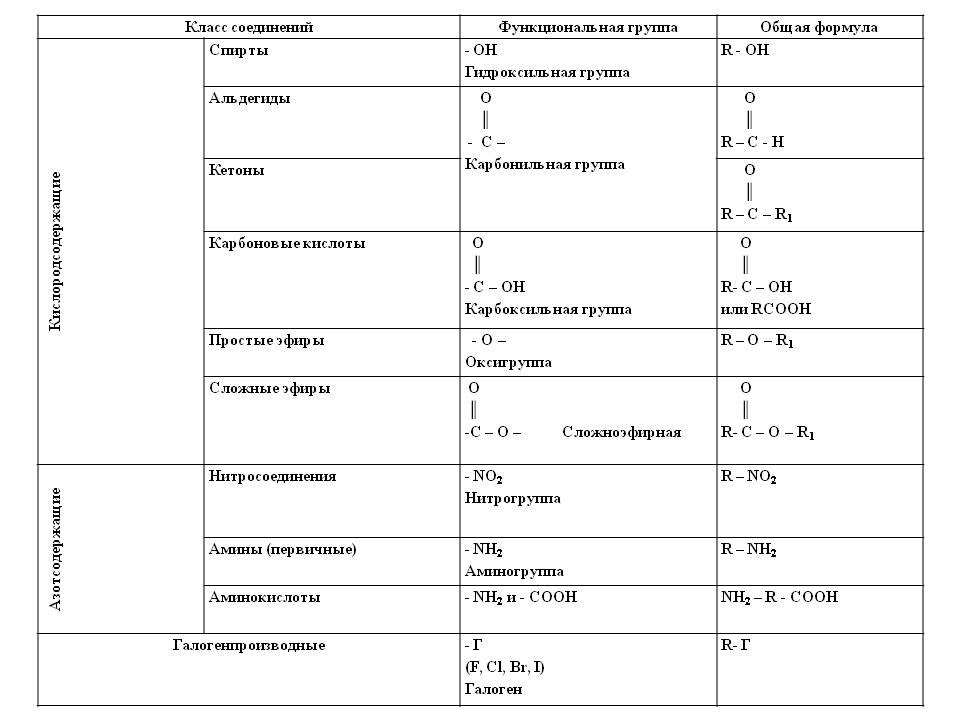 Матело,
Матело,
к.м.н. Н.Ю. Уколова, к.м.н. А.В. Дирш
Немного истории
В 1871 г. Д.И.Менделеев на основе периодического закона предсказал существование неизвестного аналога кремния. «Словесный портрет» нового элемента, прогноз основных его физических и химических свойств были весьма точны. Предвиденье подтвердилось через 15 лет, когда профессор К. Винклер выделил неизвестный элемент, свойства которого почти точно совпали с предсказанными Д.И.Менделеевым. По праву первооткрывателя К.Винклер назвал новый элемент в честь своей родины германием.
Германий — элемент достаточно редкий. Известно лишь несколько экзотических минералов, в которых содержание германия составляет от одного до нескольких процентов.
В очень небольших количествах его обнаружили в воде минеральных источников, в почве, в организмах растений и животных. Еще в первой половине XX века было установлено, что германий в количестве до 0,1% содержится в некоторых разновидностях каменного угля.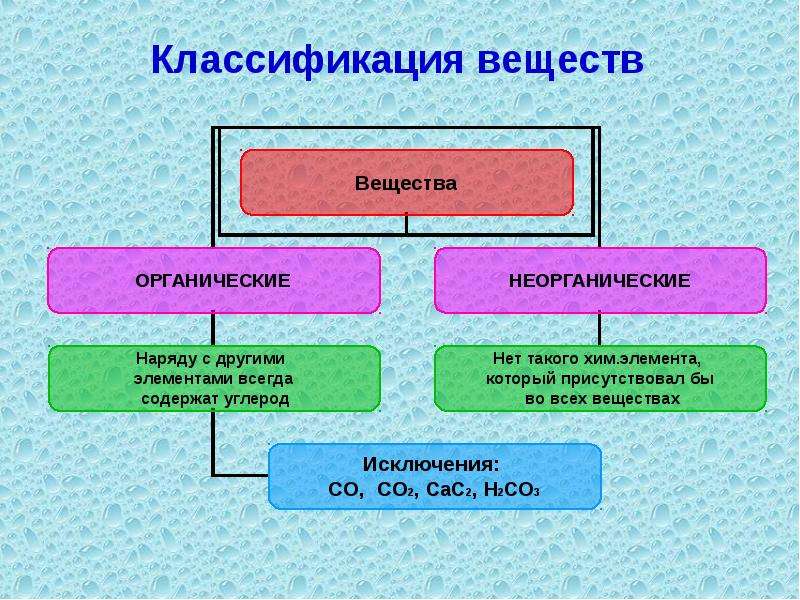
Биологическая роль германия
Для животных и человека германий является биологическим активным микроэлементом. Обнаружена жизненная необходимость ультрамикродоз германия для нормального функционирования иммунной системы (ВОЗ, 1998, 2001).[1] Германий является одним из микроэлементов, участвующих в обменных процессах в организме человека (рекомендуемая суточная доза германия 0,4 — 1,5 мг). Он является биологически активным микроэлементом и присутствует практически во всех органах и тканях (мышечная ткань, кровь, мозг, легкие, селезенка, желудок, печень, поджелудочная железа, щитовидная железа, почки и т.д.)
Впервые проблема германия заинтересовала в 1940 гг. японского ученого Dr. Kazuhiko Asai, считающегося основоположником германий-органической медицины.
Dr. Kazuhiko Asai и его сотрудники определили содержание германия во многих полезных растениях, в том числе и тех, которые употребляются в пищу или используются как лекарственное сырье. Они с удивлением обнаружили повышенное содержание германия во многих растениях, издавна применяемых в китайской и тибетской медицине. Оказалось, что в некоторых растениях концентрация германия составляет всего 0,0015-0,0020 %, но, например, в трубчатых грибах, германия в 50-100 раз больше. До 0,02-0,07% германия было обнаружено в женьшене, чайном листе, алоэ, бамбуке, хлорелле, чесноке. Кстати, некоторые богатые германием трубчатые грибы и лишайники народная медицина издавна применяет как противораковые средства.
Они с удивлением обнаружили повышенное содержание германия во многих растениях, издавна применяемых в китайской и тибетской медицине. Оказалось, что в некоторых растениях концентрация германия составляет всего 0,0015-0,0020 %, но, например, в трубчатых грибах, германия в 50-100 раз больше. До 0,02-0,07% германия было обнаружено в женьшене, чайном листе, алоэ, бамбуке, хлорелле, чесноке. Кстати, некоторые богатые германием трубчатые грибы и лишайники народная медицина издавна применяет как противораковые средства.
На Корейском полуострове, впрочем, как и во многих других местах на Востоке, население ежедневно употребляет в пищу очень много (по европейским меркам) чеснока, как известно, богатого германием. Вполне возможно, что с этим связан такой удивительный факт: раковые заболевания встречаются там далеко не так часто, как в промышленно развитых странах.
Однако проведенный недавно в России анализ нескольких видов пищевых продуктов по содержанию в них германия показал, что за 40 лет количество германия в продуктах питания упало в сотни раз (см. таблицу), т.е. наблюдается существенный дефицит данного ультрамикроэлемента.
таблицу), т.е. наблюдается существенный дефицит данного ультрамикроэлемента.
Продукт питания Содержание германия, мкг /грамм 1967 г.[23] 2007 г. Томатный сок 5,76 0,051 Молоко 1,51 0,082 Чеснок 0,75 0,25 Кофе 0,5 0,05 Женское грудное молоко — 0,17 «Чванпранша» (Индия) — 1,9
Таблица 1. Сравнительная оценка содержания германия в различных продуктах питания.
Во многом это связано с рафинированностью пищи, обеднением почв. Однако,достаточно высокое содержание германия остается в ряде дикорастущих лечебных трав, грибов, произрастающих на Востоке, особенно на Тибете (гриб Линчжи, женьшень) и в Индии (Чванпранша).
В растениях (и живых организмах) атомы германия связаны с органическими молекулами и существуют в природных, в том числе биологически активных веществах в виде германий-органических соединений или комплексов.
В научных лабораториях Японии, Германии, Франции, Кореи и ряда других стран продолжаются активные исследования по изучению новых германий-органических соединений и методов их получения, особенно с акцентом на получение водорастворимых форм, что является залогом высокой биодоступности и позволяет также создавать лекарственные препараты на их основе с низкими лечебными концентрациями.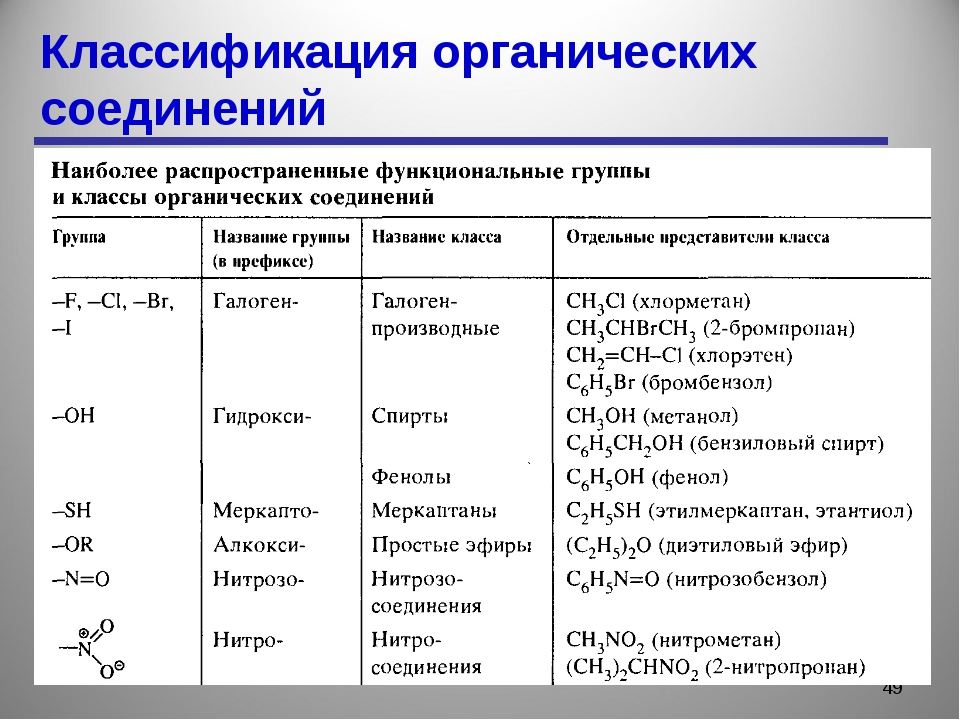
Клинический опыт применения
Клинический опыт применения германия насчитывает более 40 лет. Для медицинских целей германий-органические соединения первыми начали применять японцы.
В 1967 г. Dr Kazuhiko Asai синтезировал органическое соединение германия, известное сегодня как германий-132 (Яп. пат. 46-2964 (1971), Яп. пат. 60-41472 (1985), Яп. Пат. 59-25677 (1984)).
Однако у истоков этого научно-медицинского направления стояли советские ученые, в частности член-корреспондент АН СССР М.Г.Воронков и профессор В.Ф.Миронов, который в конце 1960-х гг. в СССР впервые в мире синтезировал германий-органические соединения, которые впоследствии легли в основу препарата Германий-132.[2] К сожалению, в СССР дальнейшего развития изучение германий-органических соединений не получило и данная разработка оказалась в Японии, специалисты которой детально изучили и развили это перспективное направление.[3]
Dr Kazuhiko Asai доказал, что новое соединение германия биологически активно: оно задерживает развитие некоторых злокачественных образований, действует как обезболивающее, в какой-то степени защищает от радиоактивного излучения.
Противоопухолевая активность германия-132 была обнаружена в 1968 г. и в последующем многократно подтверждена.[4,5] Дальнейшие многочисленные исследования в различных странах мира показали и ряд других активностей (противовирусную, интерферониндуцирующую, адаптогенную, кардио- и гепатопротективную, антитоксичную, анальгезирующую, гипотензивную, антианемическую и другие[6-9]). Благодаря уникальным свойствам германий может также влиять на различные биохимические процессы, в частности стимулировать насыщение тканей кислородом, помогает очистить организм от ядов и токсинов, ускоряет заживление ран, благотворно действуют на состав крови, укрепляет иммунную систему и пр.
Однако было показано, что соединение германий-132 склонно к полимеризации, его высокомолекулярные соединения слабо растворимы в воде.
В 70-х гг. в США был разработан и запатентован другой германий-органический противоопухолевый препарат спирогерманий. Однако его применение было связано с повышенной нейротоксичностью, и в настоящее время он практически не применяется.
В середине 1980-х годах активные работы по изучению германий органических соединений были начаты в Южной Корее Dr. Tsang Uk Sohn. В результате этой деятельности появился препарат Био-германий. [10]
Таким образом, все исследования, проведенные как самими разработчиками-производителями, так и другими исследователями также показывают высокую биологическую активность (противоопухолевую, иммуномодулирующую, антитоксическую, противовирусную и др.) различных германий-органических соединений и возможность их практического применения в различных терапевтических областях.
Теория одного из механизмов действия германия в организме человека
Высокое содержание органического германия в крови позволило выдвинуть Dr. Kazuhiko Asai следующую теорию. Предполагается, что в крови органический германий ведет себя аналогично гемоглобину, также несущему в себе отрицательный заряд, и подобно гемоглобину участвует в процессе переноса кислорода в тканях организма. Тем самым предупреждается развитие гипоксии на тканевом уровне.
Тем самым предупреждается развитие гипоксии на тканевом уровне.
В процессе изучения поврежденных тканей было установлено, что они всегда характеризуются недостатком кислорода и присутствием положительно заряженных радикалов водорода Н+. Ионы Н+ оказывают крайне негативное воздействие на клетки организма человека, вплоть до их гибели. Ионы кислорода, обладая способностью объединяться с ионами водорода, позволяют выборочно и локально компенсировать повреждения клеток и тканей, которые наносят им ионы водорода.
Гарантией нормального функционирования всех систем организма должна быть беспрепятственная транспортировка кислорода в тканях. Органический германий обладает ярко выраженной способностью доставлять кислород в любую точку организма и обеспечивать его взаимодействие с ионами водорода. При этом органические соединения германия нетоксичны, не дают побочных реакций и функционируют в организме достаточно долго, что позволяет рассматривать их как чрезвычайно перспективные для медицины.
Уникальные германий-органические комплексы в составе косметических средств Femegyl
В составе косметических средств германий выполняет роль антигипоксанта и мощного антиоксиданта, ускоряет процессы регенерации, способствует запуску механизмов защиты от внешних воздействий (т.е. повышает иммунный статус организма, проявляя антибактериальный эффект и бактерицидные свойства), обладает мягким обезболивающим эффектом.
В косметических средствах Femegyl используются уникальные германий-органические комплексы, которые увеличивают растворимость, биодоступность компонентов, активируют тканевое дыхание и обладают свойствами антиоксидантов.
Их наличие выгодно отличает линейку FEMEGYL от других производителей, представленных в этом косметологическом сегменте.
Линейка Femegyl представлена двумя пилингами на основе германия
FEMEGYL ® Деликатный пилинг Лактогерманий с гиалуроновой кислотой
FEMEGYL ® Деликатный пилинг Азелогерманий с гиалуроновой кислотой
В составе Деликатного пилинга Азелогерманий с гиалуроновой кислотой азелаиновая кислота выступает в качестве одного из активных ингредиентов.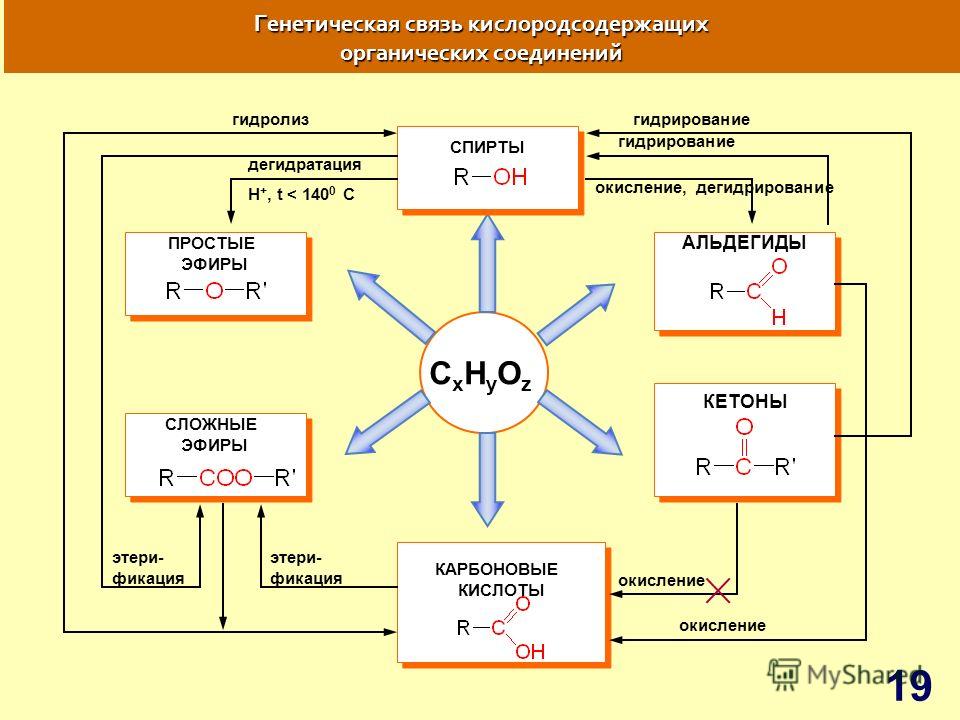
Азелаиновая кислота относится к классу дикарбоновых кислот, проявляет антимикробные свойства и уменьшает продукцию кератина, природного вещества, которое может привести к развитию акне. [11] Точный механизм ее действия до конца не ясен. Антибактериальная активность может быть связана с ингибированием синтеза белка в микробной клетке. При исследовании механизма действия in vitro, показано, что азелаиновая кислота является обратимым ингибитором тирозиназы. И в опытах in vitro, и в естественных условиях она проявляет противомикробное действие как в отношении аэробных, так и анаэробных (Propionibacterium) микроорганизмов.
Азелаиновой кислота обладает как противовоспалительным действием, так и антимикробными свойствами. Многолетнее применение в клинической практике показало благотворное ее влияние на различные формы акне. В тоже время азелаиновая кислота имеет низкую растворимость (0,2%) и биодоступность. Так как концентрации в препаратах для местного применения составляет 15-20%, их применение часто может вызывать раздражение и жжение в месте нанесения.
Для повышения биодоступности азелаиновой кислоты ведутся исследования по получению ее химических производных.
В частности, в результате многолетних исследований специалистами компании WDS Pharma были созданы уникальные германий-органические производные. [12]
В комплексе с азелаиновой кислотой они были введены сначала в состав крема и геля WDS-3 в разных концентрациях. Затем в эксперименте in vitro была произведена сравнительная оценка чувствительности Propionibacterium acnes к препаратам азелаиновой кислоты. Исследования проводились в Испытательной лаборатории ООО «Олфарм» (г. Москва) на базе Государственного научного центра по антибиотикам (Аттестат аккредитации №РОСС RU.0001.21ФЛ10 от 09.10.2009). При постановке эксперимента методом диффузии в агар лекарственные формы WDS-3 гель и крем, содержащие комплекс германия и азелаиновой кислоты, проявили большую активность в отношении Propionibacterium acnes, чем препараты сравнения. Результаты сравнительной оценки представлены в таблице 2.
Таблица 2. Результаты сравнительной оценки антибактериальной активности лекарственных форм на основе азелаиновой кислоты методом диффузии в агар в отношении Propionibacterium acnes (разведение препаратов 1:5)
Тест-микроорганизмы Диаметр зон подавления роста тест-микроорганизмов в присутствии препаратов (мм) «Препарат сравнения» гель 15% «Препарат сравнения» крем 20% WDS-3 гель 3% WDS-3 гель 5% WDS-3 крем 3% WDS-3 крем 5% 1 2 3 4 5 6 7 Propionibacterium acnes 5592 12,5 15,5 17,5 22 18,5 27 Propionibacterium acnes А-1 15,5 15 25 17 24 30
При этом необходимо отметить, что эквивалентное содержание непосредственно азелаиновой кислоты в соединении WDS-3 существенно меньше, чем использованные в препаратах сравнения.
Вероятно, что одним из факторов, способных влиять на высокую активность препарата в отношении Propionibacterium acnes, может являться более высокая водная растворимость (>10%) субстанции WDS-3 по сравнению с обычной азелаиновой кислотой (0,2%). Кроме этого, также усиление действия возможно за счет присутствия органического фрагмента германия, оптимизирующего структуру азелаиновой кислоты.
Это позволило назвать азелогерманий новым антимикробным агентом против акне и разработать на его основе высокоэффективный деликатный пилинг FEMEGYL .
В составе уникального Деликатного пилинга Азелогерманий с гиалуроновой кислотой FEMEGYL азелогерманий работает в комплексе с гиалуроновой кислотой. Пилинг очень деликатно воздействует на кожу, не раздражая и не травмируя ее. Оказывает отшелушивающее, отбеливающее и увлажняющее действие. Стимулирует работу клеток кожи, в том числе синтез коллагена. Улучшает микроциркуляцию и восстанавливает кожу, эффективно борется с различными проявлениями акне.
Отличительной особенностью пилинга является отсутствие периода реабилитации кожи после проведения процедуры и возможность проведения его вне зависимости от периода солнечной инсоляции.
FEMEGYL
® Деликатный пилинг Лактогерманий с гиалуроновой кислотой
Входящий в состав лактогерманиевый комплекс и гиалуроновая кислота, очень деликатно воздействует на кожу, не раздражая и не травмируя ее. Пилинг оказывает мягкое эксфолиирующее и глубокое увлажняющие действие, стимулируя работу клеток кожи, в том числе синтез коллагена. Улучшает микроциркуляцию кожи и тканевое дыхание. Эффективно восстанавливает кожу в период постакне.
Помимо пилингов косметическая линия FEMEGYL представлена Увлажняющим лосьоном-тоником для кожи лица, шеи, зоны декольте
Он также разработан на основе германий-органического соединения. Позволяет восстановить естественный баланс и защитную функцию кожи, обладает выраженными антиоксидантными свойствами. Оказывает смягчающее и увлажняющее действие. Устраняет раздражение и стянутость кожи. Это высокоэффективное средство позволяет завершить процесс очищения кожи и показано в качестве ежедневного ухода, для профилактики и коррекции возрастных изменений кожи.
В ближайшее время линейка FEMEGYL пополнится новыми препаратами на основе германий-органических соединений. FEMEGYL по праву можно считать уникальным сочетанием передовых научных разработок, реализованных на базе высокотехнологичного производства, с мировым косметологическим опытом практикующих врачей -дерматологов, косметологов, химиков-технологов.
Литература
1. Ребров В.Г., Громова О.А. Витамины и микроэлементы: Москва, 2003 г.
2. Mironov V. F., E. M. Berliner, and T. K. Gar, «Reactions of trichlorogermane with acrylic acid and its derivatives,» Zhurnal Obshchei Khimii, vol. 37, pp. 911–912, 1967.
3. K. Asai, Miracle Cure: Organic Germanium, Japan Publications, New York, NY, USA, 1980.
4. Suzuki F. Antitumor mechanisms of carboxyethyl-germanium sesquioxide (Ge-132) in mice bearing Ehrlich ascites tumors. Gan To Kagaku Ryoho 1987;14(1):127-134.
5. Shangguan G., F. Xing, X. Qu, et al., «DNA binding specificity and cytotoxicity of novel antitumor agent Ge132 derivatives,» Bioorganic & Medicinal Chemistry Letters, vol. 15, no. 12, pp. 2962–2965, 2005.
6. Aso, H., Suzuki, F., Ebina, T. And Ishida, N., ’Antiviral activity of carboxyethylgermanium ses quioxide (Ge-132) in mice infected with influenza virus‘. J. Biol. Response Mod., 8(2), 180-9, 1989.
7. Unakar NJ, Tsui J, Johnson M. Effect of pretreatment of germanium-132 on Na(+)-K(+)-ATPase and galactose cataracts. Current Eye Research 1997;16(8):832-837.
8. Chang Ki, K., Cha Ho, J. and Jong Ku, K., ’Effects of Geranti (Biosynthesized Organic Germanium) on the Anticancer and Immuno-enhancement‘. Chungbuk National University, Korea, Research Institute of Animal Medicine, 1995.
9. Germanium: the health and life enhancer. Sandra Goodman http://www.drsgoodman.com/books-goodman/51-germanium-book
10. Chang Ki, K., Cha Ho, J. and Jong Ku, K., ’Effects of Geranti (Biosynthesized Organic Germanium) on the Anticancer and Immuno-enhancement‘. Chungbuk National University, Korea, Research Institute of Animal Medicine, 1995.
11. Christian Krolla, Andreas Langnera, Hans-Hubert Borcherta; Nitroxide metabolism in the human keratinocyte cell line HaCaT, Free Radical Biology and Medicine, Volume 26, Issues 7–8, April 1999, Pages 850–857.
12. Исаев А.Д., Манашеров Т.О., Амбросов И.В., Матело С.К. Комплексные соединения германия с аминокислотами и карбоновыми кислотами. Патент на изобретение № 2476436. Зарегистрирован 27 февраля 2013 г.
Происхождение нефти, ее состав и основные свойства
Нефтяные месторождения — уникальное хранилище энергии, образованной и накопленной на протяжении миллионов лет в недрах нашей планеты. В этом материале — о том, какой путь проделала нефть, прежде чем там оказаться, из чего она состоит и какими свойствами обладает
Две гипотезы
У ученых до сих пор нет единого мнения о том, как образовалась нефть. Существуют две принципиально разные теории происхождения нефти. Согласно первой — органической, или биогенной, — из останков древних организмов и растений, которые на протяжении миллионов лет осаждались на дне морей или захоронялись в континентальных условиях. Затем перерабатывались сообществами микроорганизмов и преобразовывались под действием температуры и давлений в результате тектонического опускания вглубь недр, формируя богатые органическим веществом нефтематеринские породы.
Необходимые условия для превращения органики в нефть возникают на глубине 1,5–6 км в так называемом нефтяном окне — при температуре от 70 до 190°C. В верхней его части температура недостаточно высока — и нефть получается «тяжелой»: вязкой, густой, с высоким содержанием смол и асфальтенов. Внизу же температура пластов поднимается настолько, что молекулы органического вещества дробятся на самые простые углеводороды — образуется природный газ. Затем под воздействием различных сил, в том числе
градиента
характеризует степень изменения давления в пространстве, в данном случае — в зависимости от глубины пласта
давления, углеводороды мигрируют из нефтематеринского пласта в выше- или нижележащие породы.
60 млн лет может занимать природный процесс образования нефти из органических останков
Природный процесс образования нефти из органических останков занимает в среднем от 10 до 60 млн лет, но если для органического вещества искусственно создать соответствующий температурный режим, то на его переход в растворимое состояние с образованием всех основных классов углеводородов достаточно часа. Подобные опыты сторонники органической гипотезы толкуют в свою пользу: преобразование органики в нефть налицо. В пользу биогенного происхождения нефти есть и другие аргументы. Так, большинство промышленных скоплений нефти связано с осадочными породами. Мало того — живая материя и нефть сходны по элементному и изотопному составу. В частности, в большинстве нефтяных месторождений обнаруживаются биомаркеры, такие как порфирины — пигменты хлорофилла, широко распространенные в живой природе. Еще более убедительным можно считать совпадение изотопного состава углерода биомаркеров и других углеводородов нефти.
Состав и свойства нефти
ХАРАКТЕРИСТИКИ НЕФТИ МОГУТ ЗНАЧИТЕЛЬНО РАЗЛИЧАТЬСЯ ДЛЯ РАЗНЫХ МЕСТОРОЖДЕНИЙ
Основные химические элементы, из которых состоит нефть: углерод — 83–87%, водород — 12–14% и сера — до 7%. Последняя обычно присутствует в виде сероводорода или меркаптанов, которые могут вызывать коррозию оборудования. Также в нефтях присутствует до 1,7% азота и до 3,5% кислорода в виде разнообразных соединений. В очень небольших количествах в нефтях содержатся редкие металлы (например, V, Ni и др.).
От месторождения к месторождению характеристики и состав нефти могут различаться очень значительно. Ее плотность колеблется от 0,77 до 1,1 г/см³. Чаще всего встречаются нефти с плотностью 0,82–0,92 г/см³.Температура кипения варьирует от 30 до 600°C в зависимости от химического состава. На этом свойстве основана разгонка нефтей на фракции. Вязкость сильно меняется в зависимости от температуры. Поверхностное натяжение может быть различным, но всегда меньше, чем у воды: это свойство используется для вытеснения нефти водой из пор пород-коллекторов.
Большинство ученых сегодня объясняют происхождение нефти биогенной теорией. Однако и неорганики приводят ряд аргументов в пользу своей точки зрения. Есть различные версии возможного неорганического происхождения нефти в недрах земли и других космических тел, но все они опираются на одни и те же факты. Во-первых, многие, хотя и не все месторождения связаны с зонами разломов. Через эти разломы, по мнению сторонников неорганической концепции, нефть и поднимается с больших глубин ближе к поверхности Земли. Во-вторых, месторождения бывают не только в осадочных, но также в магматических и метаморфических горных породах (впрочем, они могли оказаться там и в результате миграции). Кроме того, углеводороды встречаются в веществе, извергающемся из вулканов. Наконец, третий, наиболее весомый аргумент в пользу неорганической теории состоит в том, что углеводороды есть не только на Земле, но и в метеоритах, хвостах комет, в атмосфере других планет и в рассеянном космическом веществе. Так, присутствие метана отмечено на Юпитере, Сатурне, Уране и Нептуне. На Титане, спутнике Сатурна, обнаружены реки и озера, состоящие из смеси метана, этана, пропана, этилена и ацетилена. Если на других планетах Солнечной системы эти вещества могут образовываться без участия биологических объектов, почему это невозможно на Земле?
С точки зрения современных сторонников неорганической, или минеральной, гипотезы, углеводороды образуются из содержащихся в мантии Земли воды и углекислого газа в присутствии закисных соединений металлов на глубинах 100–200 км. Высокое давление в недрах земли препятствует термической деструкции сложных молекул углеводородов. В свою очередь сторонники органики не отрицают, что простые углеводороды, например метан, могут иметь и неорганическое происхождение. Опыты, направленные на подтверждение абиогенной теории, показали, что получаемые углеводороды могут содержать не более пяти атомов углерода, а нефть представляет собой смесь более тяжелых соединений. Этому противоречию объяснений пока нет.
Этапы образования нефти
СТАДИИ ОБРАЗОВАНИЯ ОСАДОЧНЫХ ПОРОД И ПРЕОБРАЗОВАНИЯ НЕФТИ
- осадконакопление (седиментогенез) — в процессе накопления осадка остатки живых организмов выпадают на дно водных бассейнов или захороняются в континентальной обстановке;
- биохимическая (диагенез) — происходит уплотнение, обезвоживание осадка и биохимические процессы в условиях ограниченного доступа кислорода;
- протокатагенез — опускание пласта органических остатков на глубину до 1,5–2 км при медленном подъеме температуры и давления;
- мезокатагенез, или главная фаза нефтеобразования (ГФ Н), — опускание пласта органических остатков на глубину до 3–4 км при подъеме температуры до 150°C. При этом органические вещества подвергаются термокаталитической деструкции, в результате чего образуются битуминозные вещества, составляющие основную массу микронефти. Далее происходит «отжим» нефти за счет перепада давления и эмиграционный вынос микронефти в пласты-коллекторы, а по ним — в ловушки;
- апокатагенез керогена, или главная фаза газообразования (ГФГ ), — опускание пласта органических остатков на глубину (как правило, более 4,5 км) при подъеме температуры до 180—250°C. При этом органическое вещество теряет нефтегенерирующий потенциал и генерирует газ.
В ловушке
Помимо чисто научного интереса гипотезы, объясняющие происхождение нефти и газа, имеют еще и политическое звучание. Действительно, раз уж нефть может получаться из неорганических веществ и темпы ее образования не десятки миллионов лет, как предполагает биогенная концепция, а во много тысяч раз выше, значит, проблема скорого исчерпания запасов становится как минимум не столь однозначной. Однако для нефтяников вопрос о том, откуда берется нефть, принципиален скорее с той точки зрения, может ли теория предсказать, где именно нужно искать месторождения. С этой задачей органики справляются лучше.
В сугубо прагматическом отношении для добычи важно знать даже не то, где нефть зародилась, а где она находится сейчас и откуда ее можно извлечь. Дело в том, что в земной коре большая часть нефти не остается в материнской породе, а перемещается и скапливается в особых геологических объектах, называемых ловушками. Даже если предположить, что нефть имеет неорганическое происхождение, ловушки для нее все равно за редким исключением находятся в осадочных бассейнах.
Под действием различных факторов углеводороды отжимаются из нефтематеринских пород в породы-коллекторы, способные вмещать флюиды (нефть, природный газ, воду). Таким образом, нефтяное месторождение — вовсе не подземное «озеро», заполненное жидкостью, а достаточно плотная структура. Коллекторы характеризуются пористостью (долей содержащихся в них пустот) и проницаемостью (способностью пропускать через себя флюид). Для эффективного извлечения нефти из коллектора важно благоприятное сочетание обоих этих параметров.
Типы коллекторов
БОЛЬШАЯ ЧАСТЬ ЗАПАСОВ НЕФТИ СОДЕРЖИТСЯ В ДВУХ ТИПАХ КОЛЛЕКТОРОВ
Терригенные (пески, песчаники, алевролиты, некоторые глинистые породы и др.) состоят из обломков горных пород и минералов. Этот тип коллекторов наиболее распространен: на них приходится 58% мировых запасов нефти и 77% газа. В качестве пустотного пространства, в котором накапливается нефть, в основном выступают поры — свободное пространство между зернами, из которых состоит коллектор.
Карбонатные (в основном известняки и доломиты) занимают второе место по распространенности (42% запасов нефти и 23% газа). Имеют сложную трещиноватую структуру. Нефть обычно содержится в кавернах, появившихся в результате выветривания и вымывания твердой породы, а также в трещинах. Наличие трещин влияет и на фильтрационные свойства коллектора, обеспечивая проводимость жидкости.
Вулканогенные и вулканогенно-осадочные (кислые эффузивы и интрузивы, пемзы, туфы, туфопесчаники и др.) коллекторы отличаются характером пустотного пространства — в основном это трещины, — резкой изменчивостью свойств в пределах месторождений.
Глинисто-кремнисто-битуминозные отличаются значительной изменчивостью состава, неодинаковой обогащенностью органическим веществом. Промышленная нефтеносность глинисто-кремнисто-битуминозных пород установлена в баженовской (Западная Сибирь) и пиленгской (Сахалин) свитах.
Двигаясь по коллектору, флюид в какой-то момент может упереться в непроницаемый для него экран — флюидоупор. Слои такой породы называют покрышками, а вместе с коллектором они формируют ловушки, удерживающие нефть и газ в месторождении. В классическом варианте в верхней части ловушки может присутствовать газ (он легче). Снизу залежь подстилается более плотной, чем нефть, водой.
Классификации ловушек чрезвычайно разнообразны (часть из них см. на рис.). Наиболее простая и с точки зрения геологоразведки, и для дальнейшей добычи — антиклинальная ловушка (сводовое поднятие), перекрытая сверху пластом флюидоупора. Такие ловушки образуются в результате изгибов пластов осадочного чехла. Однако помимо изгибов внутренние пласты претерпевают и множество других деформаций. В результате тектонических движений, например, пластколлектор может деформироваться и потерять свою однородность. В этом случае процессы геологоразведки и добычи оказываются намного сложнее. Еще одна неприятность, которая поджидает нефтяников со стороны ловушек, — замещение проницаемых пород, обладающих хорошими коллекторскими свойствами, например песчаников, непроницаемыми. Такие ловушки называются литологическими.
Антиклиналь
Тектоническая экранированная ловушка
Соляной купол
Стратиграфическая ловушка
Ровесница динозавров
Когда же образовались те структуры, в которых сегодня находят нефть? Основные ее ресурсы сосредоточены в относительно молодых мезозойских и кайнозойских отложениях, сформировавшихся от нескольких десятков млн до 250 млн лет назад. Однако добыча нефти ведется и из палеозойских отложений (до 500 млн лет назад), а в Восточной Сибири — даже из отложений верхнего протерозоя, которым более полумиллиарда лет.
Многочисленные нефтяные месторождения встречаются в отложениях девона (420–360 млн лет назад). В этот период на Земле появились насекомые и земноводные, в морях большого разнообразия достигли рыбы и кораллы. Во время пермского периода (300–250 млн лет назад) климат стал более засушливым, в результате чего высыхали моря и образовывались мощные соляные толщи, ставшие впоследствии идеальными флюидоупорами.
Эпоха господства динозавров — юрский (200–145 млн лет назад) и меловой (145–66 млн лет назад) периоды мезозоя — характеризуется максимальным расцветом жизни и связана с высоким осадконакоплением. Некоторые гигантские и крупные месторождения (Иран, Ирак) нефти находят в отложениях палеогена(66—23 млн лет назад). Известны месторождения нефти в четвертичных породах возрастом менее 2 млн лет (Азербайджан).
Впрочем, связь между возрастом пород-коллекторов и временем образования нефти не прямолинейна. Этот процесс может быть последовательным: в юрском или меловом периоде органический осадок начал опускаться вниз и преобразовываться в нефть, которая по прошествии нескольких десятков миллионов лет мигрировала в коллекторы, принадлежащие к более молодым комплексам пород. С другой стороны, древние нефтематеринские породы, образованные в палеозое, могли опуститься на достаточную для созревания нефти глубину намного позднее. Таким образом, в одних и тех же коллекторах можно найти и более молодую, и древнюю нефть, значительно различающиеся по своим свойствам.
Смешанные свойства
Между тем моментом, когда на дно морского бассейна опускается отмерший планктон, и тем, когда накопившийся слой органики, погрузившись на несколько километров вниз, отдает нефть, миллионы лет и целый ряд химических и физических преобразований. Поэтому нет ничего удивительного в том, что состав нефти крайне разнообразен и неоднороден. Именно поэтому сами нефтяники привыкли употреблять это слово во множественном числе — говоря о разведке или добыче нефтей и подразумевая, что каждый раз извлекаемая жидкость будет уникальной, отличающейся от всего, что было добыто ранее.
В своей основе нефть — сложная смесь углеводородов различной молекулярной массы. Преобладают в ней алканы, нафтены и арены. Наиболее простые из них — алканы (парафиновые углеводороды), у которых к атомам углерода присоединено максимальное количество атомов водорода. К алканам относятся метан, этан, пропан, бутан, пентан и т. д. Они могут быть представлены газами, жидкостями и твердыми кристаллическими веществами. Количество алканов в нефти колеблется от четверти до семидесяти процентов объема. При большом проценте алканов нефть считается парафинистой. С точки зрения добычи такое свойство считается проблемным — при подъеме нефти из скважины и соответственном уменьшении температуры парафины могут кристаллизоваться и выпадать на стенки скважин.
Нафтены — соединения, в которых атомы углерода соединяются в циклическое кольцо (циклопропан, циклобутан, циклопентан и др.). Все связи углерода и водорода здесь насыщены, поэтому нафтеновые нефти обладают устойчивыми свойствами. Нафтены могут иметь от 2 до 5 циклов в молекуле, по их составу химики пытаются определять зрелость и другие свойства нефти.
В составе аренов, или ароматических углеводородов, также есть циклические структуры — бензольные ядра. Для них характерны большая растворяемость, более высокая плотность и температура кипения. Обычно нефть содержит 10–20% аренов, а в ароматических нефтях их содержание доходит до 35%. Наиболее богаты аренами молодые нефти. Арены — ценное сырье при производстве синтетических каучуков, пластмасс, синтетических волокон, анилино-красочных и взрывчатых веществ, фармацевтических препаратов.
Нефть любят называть черным золотом, однако чистые углеводороды бесцветны. Цвет нефтям придают разнообразные примеси, в основном смолы. Асфальтосмолистая часть нефтей — вещество темного цвета. Входящие в ее состав асфальтены растворяются в бензине.
Нефтяные смолы, напротив, не растворяются. Они представляют собой вязкую или твердую, но легкоплавкую массу. Наибольшее количество смол отмечается в тяжелых темных нефтях, богатых ароматическими углеводородами. Такие нефти обладают повышенной вязкостью, что затрудняет их извлечение из пласта.
химия и технология органических соединений азота в РХТУ
Чем хороша и плоха стобалльная система в вузах, какие предметы нравятся студентам «до поросячьего визга» и почему на лабораторных работах может заболеть голова? Обо всем этом рассказала студентка РХТУ имени Менделеева Алина Белая.
Алина Белая Российский химико-технологический университет имени Д. И. Менделеева, Инженерный химико-технологический факультет
Как у тебя возникла идея поступать в РХТУ и почему ты выбрала именно этот факультет?
Идея, на самом деле, возникла в последнюю минуту. Мои родные, особенно бабушка, очень хотели моего поступления в МГТУ имени Баумана. И все мои силы шли на подготовку к ЕГЭ по физике. Однако на экзамене что-то пошло не так, и я провалила его. К счастью, я на всякий случай сдавала еще и химию. С ней у меня особенных проблем не было. Я понимала ее и без зубрежки. В тот момент, когда узнала о провале экзамена по физике, я подумала: «А, может, это судьба? Почему бы не попробовать поступить в РХТУ? К тому же, я живу рядом». С выбором факультета мне помогло небольшое разнообразие специальностей с математическим уклоном. Тем более, взрывчатка и все, что с ней связано, — это же так интересно.
А как изначально зародился твой интерес к химии и физике?
По-моему, мой интерес к этим предметам — это заслуга моих очень хороших учителей в школе. Хочется сказать им огромное спасибо за это. Кроме того, наверное, здесь сыграла моя предрасположенность не к гуманитарным предметам, а к точным. Мне намного проще и интереснее что-то вычислять, подставлять, получать,чем учить историю и экономику, например.
Сложно было поступить в РХТУ?
Возможно, было бы очень сложно, но благодаря целевому направлению я, как говорится, «сидела на попе ровно». Главным было успеть найти и взять это направление. Ведь оно — это гарантированное поступление и бесценный опыт работы после учебы, который сейчас так нужен при трудоустройстве. В итоге я взяла его и спокойно поехала на отдых, зная, что, когда я вернусь, я буду числиться в списках поступивших.
Не пожалела о поступлении? Тебе нравится там учиться?
Не пожалела. Хотя бывают мысли бросить все и отчислиться. Но это, наверное, свойственно почти каждому студенту. Естественно, есть предметы, которые мне очень нравятся и очень интересны, и есть нудные, скучные, на которых и делать ничего не хочется. По большей части, всё, как мне кажется, зависит от преподавателей: от того, насколько они сами любят свой предмет и как преподносят его. Для меня недавно стало шоком, что мне понравилось правоведение. Преподаватель очень грамотно провел лекцию-семинар. Но очень жаль, что остается все меньше и меньше людей, прививающих любовь к своему предмету.
Какие еще плюсы и минусы обучения ты могла бы выделить?
Довольно сложный вопрос. Относительно недавно была введена стобалльная система. И наш университет не был исключением. Ее можно отнести и к плюсам, и к минусам. С одной стороны, она довольно проста и понятна как для студентов, так и для преподавателей, а с другой — вызывает частые споры и становится причиной борьбы за эти самые баллы и оценки, вытекающие из них. Кроме того, я очень рада появлению с третьего курса специального предмета по нашему направлению. Благодаря ему хотя бы понимаешь, что тебе предстоит делать и изучать. Лабораторные работы — это тоже, на мой взгляд, очень интересные штуки. Смешивать, кипятить, измерять, зарисовывать и просто наблюдать, как происходят чудеса у тебя на глазах (особенно это касается различных направлений химии). Из минусов я могу отметить первые пары. Хотя, это беда всех студентов, которые не могут спать полночи, а с утра любят поспать подольше.
А что вы делаете на занятиях по специальному предмету?
Пока занятия по нему — это только лекции, на которых нам рассказывают об основных понятиях, явлениях, устройстве оружия, а также о том, где и как применяют взрывчатые вещества и как их можно исследовать. Иногда нам не только рассказывают, но и уводят в лаборатории и показывают все это. Естественно, студентам до поросячьего визга нравится, когда что-то взрывается, горит и искрится.
На какие предметы делается акцент в обучении?
Акцент на свой предмет делает 90% преподавателей и, конечно же, считает его самым важным и нужным. А в итоге студенты учатся по принципу «все предметы нам важны, все предметы нам нужны». Но каждый решает для себя, на какие занятия ходить, а на какие — нет. Главное — нести ответственность за свои решения. Для меня же лекции мало интересны, причем практически по всем предметам. Намного интереснее лабораторные работы, ведь они содержат не только теорию, но и практику, тем более, мы все на них делаем своими руками. Сейчас у нас проводятся три лабораторные работы в неделю: по физической химии, коллоидной химии, процессам и аппаратам химической технологии. Все на них было бы довольно весело и легко, если бы не нужно было учить теорию (из учебников и лекций) в огромных объемах перед каждой из них. Также следует отметить, что, например, тот же специальный курс нельзя понять до конца, не зная химию и физику. Получается, что одни занятия связаны с другими, а предметы перетекают из одного в другой, то есть мнение преподавателей о важности каждого предмета подтверждается.
А что конкретно вы делаете на этих лабораторных работах?
По каждому предмету были разные лабораторные работы. Например, на первом курсе на лабораторных по неорганической химии мы получали различные неорганические соединения при смешении веществ. На работах по химии элементов мы делали обратное: с помощью множества способов нужно было понять, какие элементы входят в данное соединение или, другими словами, понять, что это за соединение. На занятиях по органической химии мы проводили синтезы различных веществ с помощью довольно необычных для незнающего человека установок. Был один минус: «ароматы» стояли те еще, и вытяжки с ними не справлялись. Бывало, что спустя несколько часов в лаборатории начинала болеть голова. На третьем курсе мы познакомились с физической химией. На этих лабораторных работах уже идет работа с цифрами и аппаратурой, которая выдает данные по тому или иному опыту. Обо всем, наверное, и не рассказать в двух словах, тем более, что многое еще ждет нас впереди.
Как тебе преподавательский состав?
У каждого своя методика, свои требования и свое отношение к студентам. Бывают чересчур требовательные преподаватели, и с такими чаще всего происходят разногласия. Бывают и такие, с которыми очень приятно иметь дело, хочется работать. К сожалению, сейчас все быстрее и быстрее меняется преподавательский состав. Пожилым все тяжелее работать, и они уходят, а на смену им приходят молодые. Остается надеяться,что при этом уровень обучения останется высоким.
Есть ли те, кого ты особенно хотела бы выделить?
Конечно, расскажу по порядку, по семестрам. Может кто-то не согласится со мной, но я бы выделила именно этих людей (в хорошем смысле, конечно же). Леонид Шматко — наверное, один из любимейших преподавателей на кафедре истории у многих студентов. Что-то в нем есть такое, что всех «цепляет». Неонилла Соломонова — не просто женщина, а просто «богиня» университета, которая всегда может решить любой вопрос помимо инженерной графики, которую преподает. Наталия Лясникова — одна из немногих преподавателей, которая свой предмет (механику) преподносит, раскладывая по полочкам так, что даже двоечник его поймет. Трудно сказать, сколько Наталья Подхалюзина «вбивала» в наши пустые головы знания по органике, сколько ругала нас. Тем не менее, спустя три семестра с ней, хочется сказать огромное спасибо за полученные знания. Всех преподавателей и не перечислить: уж очень много тех, кто запоминается. Причем каждый запоминается по-своему.
А что из себя представляют твои однокурсники?
При поступлении я боялась, что этот вуз полон «ботаников» в привычном для них образе. Однако, таких людей в РХТУ 3-5 процентов. Еще я боялась, что будет группа, состоящая из одних девочек (я не люблю эти «змеиные гнезда»). А ведь этот университет все-таки больше подходит для девушек. Но и с этим мне на моем инженерно-химико-технологическом факультете повезло, так как у нас учится больше мальчиков, да и девочки в большинстве попались очень хорошие. Однокурсники подобрались очень разносторонние, из всех уголков страны. Очень приятно общаться с ними: узнаешь много нового. Можно, не стесняясь, просить о помощи не только по учебе, но и по личным делам. Сейчас все вместе думаем, как и где отмечать «экватор».
Как думаешь, каковы перспективы вашей будущей профессии в целом?
Уже сейчас можно заметить все большую и большую востребованность именно в инженерах в различных областях. Поэтому не исключено,что, когда я закончу университет, стране нужны будут такие люди. Есть еще возможность уехать за границу: там толковые инженеры тоже пригодятся. А химия, в целом, — очень интересное направление. Как недавно сказал один преподаватель: «То, что мы изучаем давным-давно, сейчас называют нанотехнологиями». Наверное, это дает понять, что дальше ждет мою профессию.
А как ты видишь свое будущее в идеале?
Вижу дом на берегу моря или океана, любящего мужа, детей, играющих на лужайке. А, если серьезно, я стараюсь в будущее далеко не заглядывать. Ведь никто не знает, как все сложится наверняка. И куда приятнее радоваться незапланированным победам, чем расстраиваться из-за несбывшихся планов.
И все же, где бы ты хотела работать в идеале?
На данный момент я знаю, что первые три года после окончания вуза я буду работать в НИИ по контракту. А дальше будет видно, понравится мне это дело или нет, и куда меня «унесет»: в другой район, другой город или, может, даже страну.
Источник: www.ucheba.ru
Углерод — Почему углерод особенный — Атомы, атомы, молекулы и электроны
В настоящее время химикам известно более десяти миллионов органических соединений. Несомненно, в природе существует гораздо больше, и химики-органики постоянно создают (синтезируют) новые. Углерод — единственный элемент, который может образовывать так много разных соединений, потому что каждый атом углерода может образовывать четыре химические связи с другими атомами, и потому что атом углерода имеет именно тот маленький размер, который удобно помещается в состав очень больших молекул.
Имея атомный номер 6, каждый атом углерода имеет в общей сложности шесть электронов. Два находятся на завершенной внутренней орбите , а остальные четыре имеют валентность электронов — внешние электроны, которые доступны для образования связей с другими атомами.
Четыре валентных электрона атома углерода могут быть общими для других атомов, у которых есть общие электроны, таким образом образуя ковалентные (разделяемые электронами) связи. Они могут быть общими для других атомов углерода, которые, в свою очередь, могут делить электроны с другими атомами углерода и так далее, образуя длинные цепочки атомов углерода, связанные друг с другом, как звенья в цепи.Кремний (Si), еще один элемент в группе 14 периодической таблицы, также имеет четыре валентных электрона и может образовывать большие молекулы, называемые силиконами, но его атомы слишком велики, чтобы вместиться в такое же множество молекул, как атомы углерода.
Способность углерода образовывать длинные углеродно-углеродные цепочки — первая из пяти причин, по которым может быть так много различных углеродных соединений; молекула, которая отличается даже одним атомом, конечно же, является молекулой другого соединения. Вторая причина поразительной способности углерода образовывать соединения заключается в том, что атомы углерода могут связываться друг с другом не только прямыми цепями, но и сложными разветвлениями, такими как ветви дерева .Они даже могут соединяться «голова к хвосту», чтобы образовать кольца из атомов углерода. Практически нет ограничений на количество или сложность ветвей или количество колец, которые могут быть присоединены к ним, и, следовательно, нет ограничений на количество различных молекул, которые могут быть образованы.
Третья причина заключается в том, что атомы углерода могут разделять не только один электрон с другим атомом, образуя одинарную связь, но он также может разделять два или три электрона, образуя двойную или тройную связь. Это создает огромное количество возможных комбинаций связей в разных местах, создавая огромное количество различных возможных молекул.А молекула, которая отличается даже одним атомом или одним положением связи, является молекулой другого соединения.
Четвертая причина заключается в том, что тот же набор атомов и связей, но в другом геометрическом расположении внутри молекулы, создает молекулу с другой формой и, следовательно, с другими свойствами. Эти разные молекулы называются изомерами.
Пятая причина заключается в том, что все электроны, которые не используются для связывания атомов углерода в цепочки и кольца, могут быть использованы для образования связей с атомами нескольких других элементов.Другой наиболее распространенный элемент — водород, из-за которого семейство соединений известно как углеводороды. Но азот, кислород, фосфор , сера , галогены и несколько других типов атомов также могут быть присоединены как часть органической молекулы. Существует огромное количество способов, которыми они могут быть присоединены к ответвлениям из атомов углерода, и каждый вариант дает молекулу другого соединения. Это как если бы перемещение украшения елки с одной ветки на другую привело к созданию совершенно другого дерева.
органических соединений | BioNinja
Понимание:
• Атомы углерода могут образовывать четыре ковалентные связи, позволяя существовать разнообразным стабильным соединениям
Органические соединения
Органическое соединение — это соединение, которое содержит углерода и обнаружено в живых существах
- Исключения включают карбиды (например, карбиды).грамм. CaC 2 ), карбонаты (CO 3 2–), оксиды углерода (CO, CO 2 ) и цианиды (CN –)
Углерод
Углерод составляет основу органическая жизнь благодаря своей способности образовывать большие и сложные молекулы посредством ковалентных связей
Атомы углерода могут образовывать четыре ковалентных связи , причем связи между атомами углерода особенно стабильны (катенация)
- Эти свойства позволяют углероду образовывать самые разные органических соединений, которые являются химически стабильными
Схема атома углерода
Понимание:
• Жизнь основана на углеродных соединениях, включая углеводы, липиды, белки и нуклеиновые кислоты
Основные классы соединений углерода
Существуют четыре основные группы органических соединений, которые во многом определяют структуру и функции клетки
Углеводы
- Наиболее распространенные органические соединения, встречающиеся в природе, состоит в основном из атомов C, H и O в общем соотношении — (CH 2 O) n
- Принципиально функционирует как источник энергии (и как вариант кратковременного накопления энергии)
- Также важен как молекула узнавания (например,грамм. гликопротеины) и как структурный компонент (часть ДНК / РНК)
Липиды
- Неполярные гидрофобные молекулы, которые могут иметь различные формы (простые, сложные или производные)
- Липиды служат основным компонентом клеточных мембран (фосфолипиды и холестерин)
- Они могут использоваться в качестве молекулы длительного хранения энергии (жиры и масла)
- Также могут функционировать как сигнальная молекула (стероиды)
Нуклеиновые кислоты
- Генетический материал всех клеток и определяет унаследованные особенности организма
- ДНК функционирует как главный код для сборки белка, в то время как РНК играет активную роль в производстве белков
Белки
- Составляет более 50% сухой массы клеток; состоят из атомов C, H, O и N (некоторые могут включать S)
- Основные регуляторные молекулы, участвующие в катализе (все ферменты являются белками)
- Могут также функционировать как структурные молекулы или играть роль в передаче сигналов в клетках (пути трансдукции)
Основные классы органических соединений в клетках
химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
молекула метана
Метан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения. На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Британская энциклопедия, Inc.
Британская викторина
Типы химических реакций
Можете ли вы определить, какой тип химической реакции показан? Проверьте свои знания с помощью этой викторины!
Вся материя Вселенной состоит из атомов более 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях.Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно.Символ железа — Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом, образуя химические соединения. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит отдельные молекулы CH 4 . Формула соединения, например CH 4 , указывает типы присутствующих атомов, с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
молекула воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Одиночный атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.
Изучите магнитоподобную ионную связь, образующуюся при передаче электронов от одного атома к другому
Ионы — атомы с положительным или отрицательным суммарным зарядом — связываются вместе, образуя ионные соединения.
Encyclopdia Britannica, Inc. См. Все видео для этой статьи
Посмотрите, как работают молекулярные связи, когда два атома водорода присоединяются к атому серы, образуя сероводород
Молекулярные соединения образуются при образовании молекул, таких как молекулы метана или воды , соединяются вместе, деля электроны.
Encyclopædia Britannica, Inc. Посмотреть все видео по этой статье
Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O.Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl — ). ( См. Ниже Тенденции в химических свойствах элементов для обсуждения процесса превращения незаряженных атомов в ионы [i.е., виды с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества представляют два основных типа химических соединений: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются в тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .На самом деле известны миллионы химических соединений, и еще многие миллионы возможны, но еще не открыты и не синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не меняют способ агрегирования атомов в соединениях. Соединения можно разбить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором изменяется организация атомов. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Химические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые — жидкостями, а некоторые — газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
ртуть (Hg)
Ртуть (химический символ: Hg) — единственный металлический элемент, который находится в жидком состоянии при комнатной температуре.
© marcel / Fotolia
В рамках широкой классификации органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и т. Д.Подклассы органических соединений включают спирты (содержащие группу OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития химии было обнаружено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью.Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. Когда были раскрыты детали атомной структуры, стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. Атом ). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Таблица Менделеева
Периодическая таблица элементов.
Encyclopædia Britannica, Inc.
Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, заключается в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части таблицы Менделеева имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e —.Калий, расположенный непосредственно под натрием в группе 1, также образует в своих реакциях +1 ион (K + ), как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку. Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в двух дополнительных электронах, чтобы завершить его внешнюю оболочку. Кислород достигает этой договоренности, реагируя с элементами, которые могут терять или делиться электронами.Например, атом кислорода может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2-. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающиеся в результате Mg 2+ и O 2- затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, у него нет чистого заряда, потому что он содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами в группе 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов — на металлы, которые составляют большинство элементов, и неметаллы.Типичными физическими свойствами металлов являются блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная теплопроводность и электрическая проводимость. Самым важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Например, медь (Cu) — типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно мало, находятся в верхнем правом углу периодической таблицы, за исключением водорода, единственного неметаллического члена Группы 1.У неметаллов отсутствуют физические свойства, характерные для металлов. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — это типичный неметалл. При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Разделение элементов на металлы и неметаллы является приблизительным. Некоторые элементы вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Органическая химия:
Органическая химия:
Состав и номенклатура углеводородов
Что такое органическое соединение?
Когда вы подъезжаете к насосу на некоторых заправках, вы сталкиваетесь с множеством
выбор.
Вы можете купить «этилированный» газ или различные формы «неэтилированного» газа,
имеют разные октановые числа. Когда вы наполняете резервуар, вы можете задаться вопросом: «Что такое
«этилированный» газ, и почему они добавляют свинец в газ? »Или:« Что я получу за свой
денег, если я купил бензин премиум-класса с более высоким октановым числом? »
Затем вы прекращаете покупать лекарства от боли в спине, которая вас беспокоит.
с тех пор, как вы помогли другу переехать в новую квартиру. И снова вы столкнулись с
варианты (см. рисунок ниже).Вы можете купить аспирин, который использовался почти
сотня лет. Или Тайленол, который содержит ацетаминофен. Или более современное обезболивающее,
например ибупрофен. Пока вы решаете, какой препарат купить, вы можете задаться вопросом: «Что
Чем отличаются эти препараты? »и даже« Как они действуют? »
Затем вы едете в кампус, где сидите на «пластиковом» стуле, чтобы съесть
сэндвич, завернутый в «пластик», не беспокоясь о том, почему один из
эти пластмассы гибкие, а другие жесткие.Пока вы едите, друг останавливается
и начинает дразнить вас о влиянии вашей диеты на уровень холестерина в
ваша кровь, которая вызывает вопросы: «Что такое холестерин?» и почему
неужели так много людей беспокоятся об этом? »
Ответы на каждый из этих вопросов относятся к области, известной как органических
Химия . Более 200 лет химики разделили материалы на два
категории. Те, которые были выделены из растений и животных, были классифицированы как органических ,
в то время как те, которые восходят к минералам, были неорганическими .В свое время химики
считали, что органические соединения принципиально отличаются от тех, которые были
неорганические, потому что органические соединения содержат жизненной силы , которая была только
найдено в живых системах.
Первый шаг в упадке теории жизненной силы произошел в 1828 году, когда
Фридрих Велер синтезировал мочевину из неорганических исходных материалов. Волер пытался
сделать цианат аммония (NH 4 OCN) из цианата серебра (AgOCN) и аммония
хлорид (NH 4 Cl).То, что он ожидал, описывается следующим уравнением.
AgOCN ( водн. ) + NH 4 Cl ( водн. ) AgCl ( с ) + NH 4 OCN ( водн. )
Продукт, который он выделил в этой реакции, не имел свойств цианата.
соединения. Это был белый кристаллический материал, идентичный мочевине, H 2 NCONH 2 ,
которые можно выделить из мочи.
Ни Велер, ни его современники не утверждали, что его результаты опровергают жизненно важные
теория силы.Но его результаты привели в действие серию экспериментов, которые привели к
синтез различных органических соединений из неорганических исходных материалов. Этот
неизбежно привело к исчезновению «жизненной силы» из списка теорий.
это имело какое-либо отношение к химии, хотя и не привело к смерти теории,
у которого все еще были сторонники более 90 лет спустя.
Если разница между органическими и неорганическими соединениями не в наличии
таинственная жизненная сила, необходимая для их синтеза, на чем основано различение
между этими классами соединений? Большинство соединений, извлеченных из живых организмов, содержат
углерод.Поэтому возникает соблазн идентифицировать органическую химию как химию углерода.
Но это определение будет включать такие соединения, как карбонат кальция (CaCO 3 ),
а также элементарные формы углеродного алмаза
и графит, которые явно неорганические.
Поэтому мы определим органическую химию как химию соединений, содержащих
как углерод, так и водород .
Хотя органическая химия фокусируется на соединениях, содержащих углерод и водород,
более 95% соединений, выделенных из природных источников или синтезированных в
лаборатории органические.Особая роль углерода в химии элементов заключается в
результат комбинации факторов, включая количество валентных электронов на
нейтральный атом углерода, электроотрицательность углерода и атомный радиус углерода
атомов (см. таблицу ниже).
Физические свойства углерода
| Электронная конфигурация | 1 с 2 2 с 2 2 с 2 | |
| Электроотрицательность | 2.55 | |
| Ковалентный радиус | 0,077 нм |
Углерод имеет четыре валентных электрона 2 с 2
2 p 2 и он должен
либо получить четыре электрона, либо потерять четыре электрона, чтобы достичь конфигурации инертного газа. В
электроотрицательность углерода слишком мала, чтобы углерод мог получать электроны от большинства элементов
для образования ионов C 4-, и слишком большие, чтобы углерод терял электроны с образованием C 4+
ионы.Таким образом, углерод образует ковалентные связи с большим количеством других элементов,
включая водород, азот, кислород, фосфор и серу, обнаруженные в живых системах.
Поскольку они относительно малы, атомы углерода могут подходить достаточно близко друг к другу, чтобы образовать
сильные двойные связи C = C или даже CC
тройные связи. Углерод также образует прочные двойные и тройные связи с азотом и кислородом. Это
может даже образовывать двойные связи с такими элементами, как фосфор или сера, которые не образуют
двойные связи с собой.
Несколько лет назад беспилотный космический корабль «Викинг» проводил эксперименты, призванные
поиск свидетельств жизни на Марсе. Эти эксперименты основывались на предположении, что
живые системы содержат углерод, и отсутствие каких-либо доказательств существования углеродной жизни на
Предполагалось, что эта планета означает, что жизни не существует. Несколько факторов делают углерод
необходимо для жизни.
- Легкость, с которой атомы углерода образуют связи с другими атомами углерода.
- Прочность одинарных связей CC и
ковалентные связи углерода с другими неметаллами, такими как N, O, P и S. - Способность углерода образовывать множественные связи с другими неметаллами, включая C, N, O, P,
и атомы S.
Эти факторы обеспечивают почти бесконечное разнообразие потенциальных структур для органических
соединения, такие как витамин C, показаны на рисунке ниже.
Никакой другой элемент не может обеспечить разнообразие комбинаций и перестановок, необходимых для
жизнь существовать.
Насыщенные углеводороды или алканы
Соединения, содержащие только углерод и водород, известны как углеводородов .
Те, которые содержат как можно больше атомов водорода, называются насыщенными .
Насыщенные углеводороды также известны как алканов .
Самый простой алкан — метан: CH 4 . Структура Льюиса метана может быть
генерируется путем объединения четырех электронов в валентной оболочке нейтрального атома углерода
с четырьмя атомами водорода, чтобы сформировать соединение, в котором атом углерода разделяет в общей сложности
восемь валентных электронов с четырьмя атомами водорода.
Метан является примером общего правила, согласно которому углерод четырехвалентный ; Это
образует в общей сложности четыре связи почти во всех своих соединениях. Чтобы свести к минимуму отталкивание
между парами электронов в четырех КД
связей, геометрия вокруг атома углерода тетраэдрическая, как показано на рисунке ниже.
Алкан, содержащий три атома углерода, известен как пропан, имеющий формулу
C 3 H 8 и следующую структуру скелета.
Четырехуглеродный алкан представляет собой бутан с формулой C 4 H 10 .
Названия, формулы и физические свойства различных алканов с общим
Формула C n H 2 n +2 приведены в таблице ниже. В
точки кипения алканов постепенно увеличиваются с увеличением молекулярной массы этих алканов.
соединения. При комнатной температуре более легкие алканы являются газами; средние алканы
жидкости; а более тяжелые алканы — твердые вещества или смолы.
Насыщенные углеводороды или алканы
| Имя | Молекулярный Формула | Плавка Точка ( o C) | Кипячение Точка ( o C) | Состояние при 25 o C | ||||
| метан | CH 4 | -182.5 | –164 | газ | ||||
| этан | С 2 В 6 | -183,3 | -88,6 | газ | ||||
| пропан | С 3 В 8 | -189.7 | -42,1 | газ | ||||
| бутан | С 4 В 10 | -138,4 | -0,5 | газ | ||||
| пентан | С 5 В 12 | -129.7 | 36,1 | жидкость | ||||
| гексан | С 6 В 14 | -95 | 68,9 | жидкость | ||||
| гептан | С 7 В 16 | -90.6 | 98,4 | жидкость | ||||
| октановое число | С 8 В 18 | -56,8 | 124,7 | жидкость | ||||
| нонан | С 9 В 20 | -51 | 150.8 | жидкость | ||||
| декан | С 10 В 22 | -29,7 | 174,1 | жидкость | ||||
| ундекан | С 11 В 24 | -24,6 | 195.9 | жидкость | ||||
| додекан | С 12 В 26 | -9,6 | 216,3 | жидкость | ||||
| эйкозан | С 20 В 42 | 36,8 | 343 | цельный | ||||
| триаконтан | С 30 В 62 | 65.8 | 449,7 | цельный |
Все алканы в приведенной выше таблице представляют собой углеводороды с прямой цепью , в
атомы углерода образуют цепочку, идущую от одного конца молекулы до другого.
Общую формулу этих соединений можно понять, если предположить, что они содержат
цепочки групп CH 2 с дополнительным атомом водорода, блокирующим любой конец
цепь.Таким образом, на каждые n атомов углерода должно приходиться 2 n + 2 водорода.
атомы: C n H 2 n +2 .
Поскольку две точки определяют линию, углеродный скелет молекулы этана является линейным,
как показано на рисунке ниже.
Поскольку валентный угол в тетраэдре равен 109,5, молекулы алканов, содержащие три
или четыре атома углерода больше нельзя рассматривать как «линейные», как показано на
рисунок ниже.
| Пропан | Бутан |
В дополнение к примерам с прямой цепью, рассмотренным до сих пор, алканы также образуют разветвленные
конструкции. Наименьший углеводород, в котором может быть разветвление, имеет четыре атома углерода.
Это соединение имеет ту же формулу, что и бутан (C 4 H 10 ), но
разная структура.Соединения с одинаковой формулой и разными структурами известны как
изомеров (от греческого isos , «равный» и meros ,
«части»). Когда он был впервые обнаружен, разветвленный изомер с формулой C 4 H 10
поэтому было дано название изобутан .
Изобутан
Лучший способ понять разницу между структурами бутана и
изобутан предназначен для сравнения шаровых моделей этих соединений, показанных на рисунке.
ниже.
| Бутан | Изобутан |
Бутан и изобутан называются конституциональными изомерами , потому что они
буквально различаются по своему телосложению. Один содержит две группы CH 3 и две группы CH 2
группы; другой содержит три группы CH 3 и одну группу CH.
Существует три структурных изомера пентана: C 5 H 12 . В
первый — это «нормальный» пентан или n -пентан.
Также возможен разветвленный изомер, первоначально названный изопентаном. Когда больше
был открыт сильно разветвленный изомер, названный неопентаном (новый изомер
пентан).
Шаровидные модели трех изомеров пентана показаны на рисунке ниже.
| н-пентан | Изопентан |
| Неопентан |
Имеются два структурных изомера с формулой C 4 H 10 ,
три изомера C 5 H 12 и пять изомеров C 6 H 14 .Число изомеров соединения быстро увеличивается с добавлением дополнительных атомов углерода. Там
составляют более 4 миллиардов изомеров, например, для C 30 H 62 .
Циклоалканы
Если углеродная цепь, образующая основную цепь углеводорода с прямой цепью, длинная
достаточно, мы можем представить, как два конца соединяются, образуя циклоалкан .
Для образования связи CC, замыкающей кольцо, необходимо удалить по одному атому водорода с каждого конца углеводородной цепи.Циклоалканы
следовательно, имеют на два атома водорода меньше, чем исходный алкан, и общая формула C n H 2n .
Самым маленьким алканом, который может образовывать кольцо, является циклопропан, C 3 H 6 ,
в котором три атома углерода лежат в одной плоскости. Угол между соседними связями CC составляет всего 60, что очень много.
меньше угла 109,5 в тетраэдре, как показано на рисунке ниже.
Циклопропан, следовательно, подвержен химическим реакциям, которые могут открыть
трехчленное кольцо.
Любая попытка заставить четыре атома углерода, которые образуют циклобутановое кольцо, перейти в плоскость
атомы образуют структуру, показанную на рисунке ниже, в которой угол между
смежные облигации СС будут 90.
Таким образом, один из четырех атомов углерода в циклобутановом кольце смещен из
плоскости остальных трех, чтобы сформировать «сморщенную» структуру, которая нечетко
напоминает крылья бабочки.
Угол между соседними связями CC в
плоская молекула циклопентана будет 108, что близко к идеальному углу вокруг
тетраэдрический атом углерода.Циклопентан не является плоской молекулой, как показано на рисунке.
ниже, потому что смещение двух атомов углерода из плоскости трех других
образует сморщенную структуру, которая частично снижает отталкивание между водородом.
атомы на соседних атомах углерода в кольце.
К тому времени, когда мы дойдем до шестичленного кольца в циклогексане, сморщенная структура может быть
образуется путем смещения пары атомов углерода на обоих концах кольца из плоскости
остальные четыре члена кольца.Один из этих атомов углерода наклонен вверх из
кольцо, в то время как другой наклонен вниз, чтобы сформировать структуру «стул», показанную на
рисунок ниже.
Вращение вокруг C C Связи
Если посмотреть на структуру молекулы этана, легко попасть в ловушку.
думать об этой молекуле, как если бы она была статичной. Ничего не может быть дальше от
правда.При комнатной температуре средняя скорость молекулы этана примерно на 500 м / с более чем в два раза превышает скорость Boeing 747.
Пока она движется в пространстве, молекула кувыркается вокруг своего центра тяжести, как
самолет вышел из-под контроля. В то же время связи CH и CC колеблются.
как пружина со скоростью 9 x 10 13 с -1 .
Молекула этана может двигаться еще по одному пути. Группы CH 3
на любом конце молекулы может вращаться относительно каждого вокруг связи CC.Когда это происходит, молекула проходит
через бесконечное количество конформаций , которые имеют немного разные
энергии. Наивысшая энергетическая конформация соответствует структуре, в которой водород
атомы «затмеваются». Если рассматривать молекулу вдоль связи CC, атомы водорода на одной CH 3
группа закроет другие, как показано на рисунке ниже.
Конформация с наименьшей энергией — это структура, в которой атомы водорода
«в шахматном порядке», как показано на рисунке ниже.
Разница между затменной и шахматной конформациями этана наилучшая.
проиллюстрировано просмотром этих молекул вдоль связи CC, как показано на рисунке ниже.
| Затмение | В шахматном порядке |
Разница между энергиями этих конформаций относительно
маленький, всего около 12 кДж / моль.Но он достаточно велик, чтобы вращение вокруг связи CC не было плавным. Хотя частота
этого вращения составляет порядка 10 10 оборотов в секунду, этан
молекула проводит немного больший процент времени в шахматной конформации.
Различные конформации молекулы часто описываются в терминах Newman
Ашхабад . Эти линейные рисунки показывают шесть заместителей на связи CC, как если бы структура молекулы
проецируется на лист бумаги, направляя яркий свет вдоль CC-связи в шарообразной модели
молекула.Показаны проекции Ньюмана для различных ступенчатых конформаций бутана.
на рисунке ниже.
Из-за легкости вращения вокруг связей CC, существует несколько конформаций некоторых циклоалканов.
описано в предыдущем разделе. Циклогексан, например, образует как
Соответствие «кресло» и «лодка» показано на рисунке ниже.
| Стул | Лодка |
Разница между энергиями конформации кресла, в котором водород
атомы расположены в шахматном порядке, и форма лодочки, в которой они затмеваются, составляет около 30
кДж / моль.В результате, даже если скорость, с которой эти две конформации обмениваются, равна
примерно 1 x 10 5 с -1 , можно предположить, что большинство молекул циклогексана на
в любой момент времени находятся в конформации стула.
Номенклатура алканов
Распространенных названий, таких как пентан, изопентан и неопентан, достаточно для
различают три изомера по формуле C 5 H 12 .Они
становятся менее полезными, однако, по мере увеличения размера углеводородной цепи.
Международный союз теоретической и прикладной химии (IUPAC) разработал
Системный подход к названию алканов и циклоалканов основан на следующих этапах.
- Найдите самую длинную непрерывную цепочку атомов углерода в структуре скелета. Назовите
соединение как производное алкана с таким числом атомов углерода. Следующие
соединение, например, является производным пентана, потому что самая длинная цепь содержит пять
атомы углерода.
- Назовите заместители в цепи. Заместители, производные от алканов, названы
замена — ane заканчивая — yl . Это соединение содержит метил (CH 3 -)
заместитель.
- Пронумеруйте цепь, начиная с конца, ближайшего к первому заместителю, и укажите
атомы углерода, на которых расположены заместители. Используйте минимально возможные числа.Этот
соединение, например, 2-метилпентан, а не 4-метилпентан.
- Используйте префиксы di -, tri — и tetra — для описания
заместители, которые встречаются два, три или четыре раза в одной и той же цепи атомов углерода. - Расположите названия заместителей в алфавитном порядке.
Ненасыщенные углеводороды: алкены
и Алкины
Карбон не только образует прочный CC
одинарные связи, обнаруженные в алканах, он также образует прочные двойные связи C = C.Соединения, которые
содержат двойные связи C = C, когда-то были известны как олефины (буквально, «чтобы образовать
масло «), потому что они трудно кристаллизоваться (они, как правило, остаются маслянистыми жидкостями, когда
охлаждение.) Эти соединения теперь называются алкенами . Простейший алкен имеет
формула C 2 H 4 и следующая структура Льюиса.
Связь между алканами и алкенами можно понять с помощью
думаю о следующей гипотетической реакции.Начнем с разрыва связи в H 2
молекулы так, чтобы один из электронов оказался на каждом из атомов водорода. Мы делаем то же самое
к одной из связей между атомами углерода в алкене. Затем мы позволяем
неспаренный электрон на каждом атоме водорода для взаимодействия с неспаренным электроном на углероде
атома с образованием новой связи CH.
Таким образом, теоретически мы можем превратить алкен в исходный алкан, добавив H 2
молекула через двойную связь C = C.На практике эта реакция происходит только при высоком
давления в присутствии подходящего катализатора, такого как кусок металлического никеля.
Поскольку алкен можно рассматривать как производное алкана, из которого H 2
молекула была удалена, общая формула для алкена с одной двойной связью C = C: C n H 2n .
Алкены являются примерами ненасыщенных углеводородов , поскольку они имеют
меньше атомов водорода, чем у соответствующих алканов.Когда-то они были названы добавлением
суффикс — ene к имени заместителя, имеющего такое же количество углерода
атомы.
В номенклатуре алкенов ИЮПАК эти соединения называются производными от исходного
алканы. На наличие двойной связи C = C указывает изменение — ane
оканчивается на название исходного алкана на -ен .
Расположение двойной связи C = C в каркасной структуре соединения
обозначается указанием номера атома углерода, с которого начинается связь C = C.
Названия заместителей затем добавляются в качестве префиксов к названию алкена.
Соединения, содержащие тройные связи CC, называются алкинами . Эти соединения имеют четыре
меньше атомов водорода, чем в исходных алканах, поэтому общая формула алкина с
одиночный CC
тройная связь — C n H 2n-2 . Простейший алкин имеет формулу C 2 H 2
и известен под общим названием ацетилен .
В номенклатуре IUPAC для алкинов эти соединения называются производными от исходного
алкан, с окончанием -yne вместо -ane .
Помимо соединений, содержащих одну двойную связь ( алкенов, ) или одну тройную
связь ( алкинов ), мы также можем представить себе соединения с двумя двойными связями ( диенов ),
три двойные связи ( триенов ) или комбинация двойных и тройных связей.
Органическая химия: структура и номенклатура углеводородов
Состав и номенклатура
Углеводороды |
Изомеры
| Реакции алканов, алкенов и алкинов
| Углеводороды
| Нефть и уголь
|
Хиральность и оптическая активность
Периодический
Стол |
Периодическая таблица |
Глоссарий
| Классные Апплеты
Обзор темы
Gen Chem
|
Главная страница справки по общей химии
|
Поиск:
веб-сайт общей химии.
Примеры органических соединений
Органическое соединение имеет молекулы, которые содержат ковалентно связанные атомы углерода и водорода. Они могут содержать дополнительные элементы. Некоторые из них возникают в естественных условиях, а другие синтезируются в лабораторных условиях. Эти соединения могут быть газообразными, жидкими или твердыми. Есть четыре основных категории органических соединений. Откройте для себя примеры органических соединений и их молекулярные формулы.
Углеводы
Многие органические соединения представляют собой углеводы.Химическая формула углеводов: (CH 2 O) n. В этой формуле «n» представляет количество атомов углерода в молекуле. Есть три категории углеводов: моносахариды, дисахариды и полисахариды.
Моносахариды
Углеводы из категории моносахаридов представляют собой простые сахара. Многие, но не все, имеют молекулярную формулу (C 6 H 12 O 6 ).
- фруктоза (C 6 H 12 O 6 )
- глюкоза (C₆H₁₂O₆)
- аллоза (C₆H₁₂O₆)
- альтроза (C₆H₁₂O₆)
- галактоза (C₆H₁₂O₆)
- гулоза (C₆H₁₂52)
- гулоза (C₆H₁₂O52) (C 5 H 10 O 5 )
- эритроза (C 4 H 8 O 4 )
Дисахариды
Дисахариды — это пары моносахаридов, то есть два простых сахара.Эти примеры образованы соединением двух моносахаридов с химической формулой (C 6 H 12 O 6 ), поэтому они имеют одинаковую молекулярную формулу (C₁₂H₂₂O₁₁).
- лактоза (C₁₂H₂₂O₁₁) — включает глюкозу и галактозу
- сахароза (C₁₂H₂₂O₁₁) — включает глюкозу и фруктозу
- мальтоза (C₁₂H₂₂O₁₁) — состоящая из двух молекул глюкозы, соединенных полосой
- трегалоза (C₁₂H₂₂O₁₁), состоящая из двух молекулы глюкозы; также называется тремалозой или микозой
- мелибиоза (C₁₂H₂₂O₁₁) — включает глюкозу и галактозу
- целлобиоза (C (H₂₂O₁₁) — образована из двух молекул глюкозы
Полисахариды
Полисахариды — это группа углеводов, которые содержат несколько моносахаридов.Это могут быть мономеры (отдельные молекулы) или полимеры (несколько молекул, которые связаны вместе) сахаров. Крахмалы включены в эту категорию.
- гликоген (C 6 H 10 O 5 ) n
- целлюлоза (C 6 H 10 O 5 ) n
- амилоза (C 6 H 10 O 5 ) n
- ксантановая камедь (C 35 H 49 O 29 )
- каррагинан (C 24 H 36 O 25 S 2 -2 )
- алактоманнан (C 18 H 32 O 16 )
Липиды
Липид — это жирное или воскообразное органическое соединение.Они преимущественно состоят из углеводородов. Существуют десятки липидов, многие из которых имеют чрезвычайно сложные молекулярные формулы.
- триглицериды — глицерин (C 3 H 8 O 3 ) в сочетании с жирными кислотами; существует множество типов триглицеридов с различными молекулярными формулами, включая насыщенные, ненасыщенные и трансжиры
- диглицерид (C 43 H 68 O 5 )
- цитрат моноглицерида (C 9 H 14 O 9 )
- фосфоглицериды (CH 2 OH – CHOH – CH 2 OH)
- глицериды (C 16 H 32 O 4 )
- церамид (C 36 H 71 NO 4 )
- археол (C 43 H 88 O 3 )
- алдархеол (C 86 H 172 O 6 )
- Интралипид (C 60 H 115 НЕТ 10 P + )
Белки
Белки чрезвычайно сложны.Все органы и ткани содержат белки, которые представляют собой молекулы с полимерами аминокислот, скрепленных пептидными связями. Белки состоят из аминокислот. Помимо углерода и водорода они также содержат азот и кислород.
- инсулин (C 257 H 383 N 65 O 77 S 6 )
- коллаген (C 65 H 102 N 18 O 21 )
- эластин ( C 27 H 48 N 6 O 6 )
- кератин (C 28 H 48 N2O 32 S 4 )
- окситоцин (C 43 H 66 N 12 O 12 S 2 )
- тромбин (C 12 H 10 ClN 3 S)
- актин (C 25 H 34 ClN 5 O 6 )
Нуклеотиды
Нуклеотиды — это органические соединения, содержащие азотистое основание, рибозу или дезоксирибозу (моносахариды с пятью атомами углерода), по крайней мере, одну фосфатную группу и водород.Все нуклеотиды, кроме одного, являются нуклеиновыми кислотами. Аденозинтрифосфат также является нуклеотидом.
Нуклеиновые кислоты
Нуклеиновые кислоты необходимы для всех форм жизни. Дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК) являются примерами нуклеиновых кислот. Примеры модифицированных нуклеотидов, из которых состоят нуклеиновые кислоты, включают:
- инозин (C 10 H 12 N 4 O 5 )
- псевдоуридин (C 9 H 12 N 2 O 6 )
- квевозин (C 17 H 23 N 5 O 7 )
- дигидроуридин (C 9 H 14 N 2 O 6 )
- вибутозин (C 21 H 28 N 6 O 9 )
- 3-метилцитидин (C 10 H 15 N 3 O 5 )
- 5-метилцитидин (C 10 H 15 N 3 O 5 )
- 2-тиуридин (C 9 H 12 N 2 O 5 S)
- 4-тиуридин (C 9 H 12 N 2 O 5 S)
Аденозинтрифосфат
Аденозинтрифосфат (C 10 H 16 N 5 O 13 P 3 ), обычно называемый аббревиатурой АТФ, является источником энергии, используемой и запасаемой клетками.Фосфаты в АТФ хранят потенциальную энергию, поэтому его описывают как «высокоэнергетическое» органическое соединение.
Органические соединения повсюду
Это несколько примеров из множества существующих органических соединений. Эти соединения лежат в основе органической химии, которая является «изучением структуры, свойств, состава, реакций и получения углеродсодержащих соединений». Они играют роль во всех аспектах жизни. Существуют миллионы и миллионы известных органических соединений, и, вероятно, еще больше еще предстоит обнаружить или идентифицировать.
Расширьте свои знания в области химии
Независимо от того, изучаете ли вы курс общей химии или изучаете органическую химию, есть вероятность, что вам нужно уметь перечислить или идентифицировать хотя бы некоторые органические соединения. Теперь, когда вы рассмотрели, что такое органическое соединение, несколько примеров органических соединений в разных категориях и их химические формулы, самое время расширить свои знания в области химии другими способами.
Начните с изучения 20 распространенных примеров основ повседневной жизни.Если это не так сложно, изучите несколько примеров катализаторов. Чем больше вы узнаете сейчас, тем лучше вы будете подготовлены к следующему уроку химии или даже к профессиональной карьере химика или другого занятия, связанного с наукой.
Органическая химия — Энциклопедия Нового Света
Органическая химия — это научное исследование структур, свойств и методов синтеза химических соединений на основе углерода. Эта область находится в дополнительных отношениях с неорганической химией, которая охватывает изучение соединений всех других элементов, а также самих элементов. [1] Эти две дисциплины обычно рассматриваются по отдельности, но они во многом пересекаются, например, в субдисциплине металлоорганической химии.
Органические соединения в основном состоят из углерода и водорода и могут содержать любое количество других элементов, наиболее распространенными из которых являются азот и кислород. Каждый атом углерода с его образцом четырех ковалентных связей может соединяться с другими атомами углерода различными способами, давая огромное разнообразие обнаруженных органических соединений.Каждая молекула часто описывается как имеющая «скелет» из атомов углерода. Существенное указание на существование и взаимосвязь, присущее четырехосновным структурам, подходит для углерода, поскольку он является одной из основ самой жизни.
Важные классы органических соединений включают алканы, алкены, алкины, ароматические соединения, спирты, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, простые эфиры, амины и амиды. Многие органические соединения, такие как углеводы, аминокислоты, белки, липиды, нуклеотиды и нуклеиновые кислоты, находятся в живых системах.Изучение органической химии принесло огромные преимущества в практическом плане, например, в производстве текстиля, красок, пластмасс, топлива и фармацевтических препаратов.
История
Когда-то считалось, что определенные соединения, называемые «органическими соединениями», производятся только живыми организмами. Поэтому исследование таких соединений было названо органической химии . Однако определение органических соединений оказалось ложным в 1828 году, когда Фридрих Вёлер случайно синтезировал биологически значимое соединение мочевину путем испарения водного раствора цианата аммония (NH 4 OCN).Позже термин «органическая химия» был переопределен, чтобы обозначать химию соединений углерода.
Характеристики органических веществ
Органические соединения связаны ковалентными связями и, следовательно, их связи являются направленными. Это позволяет создавать уникальные структуры, такие как длинные углеродные цепи и кольца. Причина, по которой углерод превосходно формирует уникальные структуры и так много углеродных соединений, заключается в том, что атомы углерода образуют очень стабильные ковалентные связи друг с другом (катенация).В отличие от неорганических материалов, органические соединения обычно плавятся, возгоняются или разлагаются при температуре ниже 300 ° C. Нейтральные органические соединения, как правило, менее растворимы в воде по сравнению со многими неорганическими солями, за исключением некоторых соединений, таких как ионные органические соединения и низкомолекулярные спирты и карбоновые кислоты, в которых присутствует водородная связь. Органические соединения, как правило, гораздо более растворимы в органических растворителях, таких как эфир или спирт, но растворимость в каждом растворенном веществе зависит от присутствующих функциональных групп и общей структуры.
Органическая номенклатура
Органическая номенклатура — это система, установленная для наименования и группировки органических соединений.
Алифатические соединения
Алифатические соединения — это органические молекулы, не содержащие ароматических систем. Обычно они содержат углеводородные цепи.
Углеводороды — Алканы — Алкены — Диены или Алкадиены — Алкины — Галоалканы
Ароматические соединения
Ароматические соединения — это органические молекулы, которые содержат одну или несколько ароматических кольцевых систем.Обычно это означает, но не ограничивается ими, те соединения, которые содержат бензольное кольцо.
Бензол — Толуол — Стирол — Ксилол — Анилин — Фенол — Ацетофенон — Бензонитрил — Галоарены — Нафталин — Антрацен — Фенантрен — Бензопирен — Коронен — Азулен — Бифенил
Гетероциклические соединения
9000, молекулы которых представляют собой циклические гетероциклические соединения
9000 содержат по крайней мере один гетероатом. Эти гетероатомы могут включать кислород, азот, фосфор и серу.
Имидазол — Индол — Пиридин — Пиррол — Тиофен — Фуран — Пурины
Функциональные группы
Это части органической молекулы, характеризующиеся определенным составом и связанной структурой составляющих атомов. Каждая функциональная группа имеет определенный набор свойств и реакций, характеризующих соединение. Некоторые общие функциональные группы: спирты, альдегиды, амиды, амины, карбоновые кислоты, сложные эфиры, простые эфиры, кетоны, нитрилы.
Полимеры
Полимеры образуют особую группу молекул.Обычно считается «большими» молекулами, полимеры получили свою репутацию в отношении размера, потому что они представляют собой молекулы, которые состоят из множества более мелких сегментов. Сегменты могут быть химически идентичными, что сделало бы такую молекулу гомополимером. Или сегменты могут различаться по химической структуре, что делает эту молекулу гетерополимером. Полимеры — это подмножество «макромолекул», которое представляет собой всего лишь классификацию всех молекул, которые считаются большими.
Полимеры могут быть органическими или неорганическими.Обычно встречающиеся полимеры обычно являются органическими (такими как полиэтилен, полипропилен или оргстекло). Но неорганические полимеры (например, силикон) также являются частью привычных предметов.
Важные биологические молекулы, такие как белки, нуклеиновые кислоты и полисахариды, также являются полимерами (биополимерами).
Определение молекулярной структуры органического соединения
В настоящее время существует несколько методов определения характеристик органического соединения. Обычно используется (в алфавитном порядке):
- Кристаллография: это наиболее точный метод; однако очень трудно вырастить кристаллы достаточного размера и высокого качества, чтобы получить четкую картину, поэтому это остается вторичной формой анализа.
- Элементный анализ: разрушающий метод, используемый для определения элементного состава молекулы.
- Инфракрасная спектроскопия: в основном используется для определения наличия (или отсутствия) определенных функциональных групп.
- Масс-спектрометрия: используется для определения молекулярной массы соединения и характера фрагментации.
- Спектрометрия ядерного магнитного резонанса (ЯМР)
- УФ / видимая спектроскопия: Используется для определения степени сопряжения в системе
Органические реакции
Из-за огромного количества возможных органических соединений понимание важной части органической химии синтез и реакции органических соединений.Существуют различные модели, основанные на функциональной группе и структуре углерода, которые могут быть применены к классам соединений, см. «Органические реакции». Многие типы реакций носят имя человека, открывшего их, например, реакции Гриньяра или синтез эфиров Вильямсона. Современная органическая химия также пытается понять механизм или процесс на молекулярном уровне для каждого типа реакции.
См. Также
Примечания
- ↑ Изучение некоторых соединений углерода, таких как диоксид углерода, карбонаты и цианиды, считается частью неорганической химии.
Ссылки
- McMurry, John. 2004. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс / Коул. ISBN 0534420052.
- Моррисон, Роберт Т. и Роберт Н. Бойд. 1992. Органическая химия, 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0136436692.
- Solomons, T.W. Грэхем и Крейг Б. Фрайл 2004. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: Джон Вили. ISBN 0471417998.
Внешние ссылки
Все ссылки получены 3 января 2019 г.
Источники
Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия.
Все ли летучие органические соединения?
Многие опасные вещества могут ухудшить качество воздуха.Эти загрязнители окружающей среды обладают различными характеристиками и вызывают уникальные побочные эффекты у людей, страдающих астмой, и у населения в целом. Хотя хорошо понимать такие вещи, как единицы измерения летучих органических соединений или ЛОС, уровни безопасности, также разумно знать, чем такие вещества отличаются от других химических веществ. Вот практический учебник по науке.
Органические соединения
В химии термин «органический» относится к большинству химических соединений, которые включают атомы углерода, таких как многие из строительных блоков жизни.Из этого правила есть ряд важных исключений, таких как диоксид углерода и монооксид углерода, которые классифицируются как неорганические.
Волатильность
Чтобы вещество было летучим, оно должно иметь тенденцию к изменению состояния без особых дополнительных подсказок или особых условий. Многие углеродсодержащие органические соединения, такие как краски и покрытия, которые могут быть причиной умного монитора качества воздуха в помещении, проявляют эту тенденцию, испаряясь из жидкостей и твердых веществ в газы, казалось бы, без всякой подсказки.Например, автомобили, которые используют углеводородное ископаемое топливо, известны тем, что наполняют воздух летучими загрязнителями, такими как бензол и другие известные канцерогены.
Технические характеристики летучих органических соединений
Правительственные постановления могут запутать эти вопросы. Например, хлористый метилен, широко используемый в аэрозольных красках и некоторых растворителях, как известно, оказывает негативное воздействие на здоровье, но поскольку вероятность его разложения не так велика, правительство США дает ему разрешение, исключив его из своего списка контролируемых ЛОС. .
В США многие другие известные опасные вещества, такие как несколько CFC и ацетон, также попадают в эту менее строгую категорию соответствия. Однако важно помнить, что это небезопасно для людей подвергаться воздействию этих химикатов, особенно если у них астма.
Ситуационные риски воздействия
Те, кто хочет защитить свое здоровье, не могут основывать свои решения только на нормативном статусе летучих органических соединений.Такие факторы, как условия жизни и работы людей, имеют важное влияние на то, какие летучие органические соединения являются наиболее опасными. Например, данные EPA * предполагают, что внутренние помещения часто содержат значительно более высокие концентрации многих опасных органических химикатов. Определенные действия, например снятие краски, могут вызвать резкие скачки концентрации.
Также существует большая разница между опасными летучими органическими соединениями и углеводородами, которые включают только атомы углерода и водорода. В то время как углеводороды, такие как нефть и бензин, могут не представлять огромных рисков в обычном домашнем хозяйстве, бензол и другие вещества особенно склонны накапливаться и вызывать проблемы как побочный эффект такого поведения, как курение сигарет.Некоторые строительные материалы вызывают проблемы с выбросами ЛОС, например, некоторые типы ламината, покрытия, подложки, клея и основы ковров.
Не все органические соединения летучие. Кроме того, понимание уровней концентрации ЛОС — лишь один из аспектов активной стратегии защиты окружающей среды внутри помещений. Например, воздействие всего, от оксидов азота до химикатов для химической чистки в отделе розничной торговли одеждой, может быть проблематичным для людей, страдающих астмой. Другими словами, лучше всего получить полную картину соблюдения экологических требований.
Источники
https://www.epa.gov/indoor-air-quality-iaq/volatile-organic-compounds-impact-indoor-air-quality
https://www.woodandbeyond.com/blog/what-are-vocs-and-what-is-the-connection-with-flooring/
.
