Содержание
Агрегатные состояния вещества. Переходы из одного состояния в другое
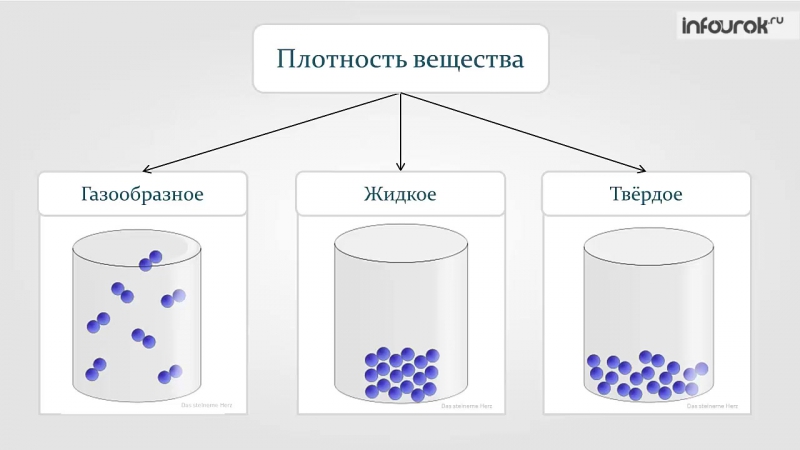
Агрегатное состояние — это состояние вещества, которое зависит от температуры и давления. В природе вещества встречаются в трёх агрегатных состояниях: твёрдом, жидком и газообразном.
Вещество, находящееся при стандартных условиях в твёрдом состоянии, называется твёрдым веществом, в жидком состоянии — жидким веществом или жидкостью, в газообразном — газообразным веществом или газом.
При одинаковых условиях (температуре и давлении) различные вещества могут находиться в разных агрегатных состояниях.
Пример. В стандартных условиях:
- железо, сера, алюминий — твёрдые вещества.
- вода, бензол, ртуть — жидкости.
- кислород, аргон, углекислый газ — газы.
Переходы между агрегатными состояниями
Многие вещества при изменении условий могут переходить из одного агрегатного состояния в другое.
Пример. При температуре ниже 0 °C вода превращается в лёд, т. е. переходит из жидкого состояния в твёрдое.
Переход вещества из газообразного состояния в жидкое называется конденсацией. Переход вещества из жидкого состояния в газообразное называется испарением.
При увеличении температуры вещества испарение становится интенсивнее. И, наконец, при определённой температуре испарение становится настолько интенсивным, что жидкость закипает. Такая температура называется температурой кипения вещества. Испарение и кипение — это два способа перехода жидкости в газообразное состояние.
Испарение происходит с поверхности жидкости, а при кипении жидкость переходит в газообразное состояние, как с поверхности, так и внутри неё.
Когда говорят о веществах в газообразном состоянии, иногда помимо термина газ используется и слово пар. Газ и пар очень похожи между собой. Они представляют собой разновидности газообразного состояния вещества.
Разница между газом и паром в том, что газ имеет температуру выше критической или равную ей, а пар — ниже.
Пример. Критическая температура воды равна примерно 374 °C. Вода в газообразном состоянии, которая имеет температуру ниже критической, например, 5 °C или 120 °С, будет именно паром, а не газом. А вот, например, кислород, гелий и азот – газы, так как они имеют температуру выше критической (у каждого из них критическая температура ниже -100 °C).
В быту под словом пар обычно подразумевают именно водяной пар.
Переход вещества из жидкого состояния в твёрдое называется кристаллизацией. Переход вещества из твёрдого состояния в жидкое называется плавлением.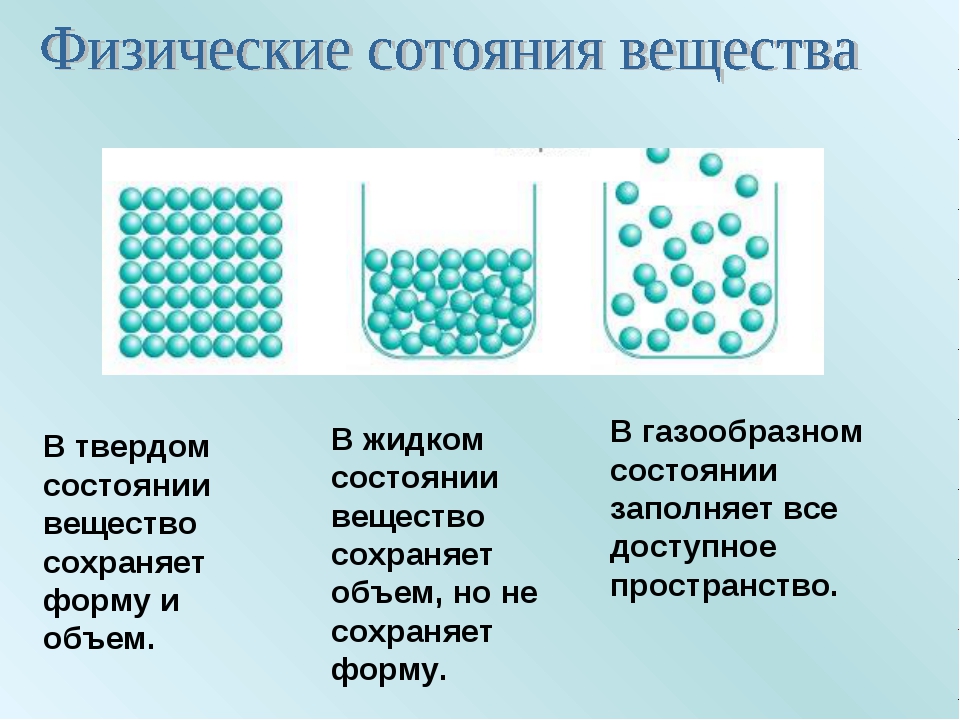
Переход вещества из твёрдого состояния сразу в газообразное называется возгонкой или сублимацией. Переход из газообразного состояния в твёрдое называется десублимацией.
При всех этих явлениях частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое вещество.
Одни вещества могут иметь любое из трёх агрегатных состояний, другие — нет.
Пример. Вода может находиться в твёрдом состоянии (лёд), жидком (вода) и газообразном (водяной пар). Для сахара известны только два агрегатных состояния: твёрдое и жидкое.
При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует.
Взаимные переходы веществ из одного агрегатного состояния в другое в виде схемы:
Агрегатные состояния вещества, теория и примеры
Вещества имеют сложное строение. Частицы в веществе взаимодействуют между собой. Характер взаимодействия частиц в веществе определяет его агрегатное состояние.
Частицы в веществе взаимодействуют между собой. Характер взаимодействия частиц в веществе определяет его агрегатное состояние.
Виды агрегатных состояний
Выделяют следующие агрегатные состояния: твердое, жидкое, газ, плазма.
В твердом состоянии частицы, как правило, объединены в правильную геометрическую структуру. Энергия связей частиц больше, чем энергия их тепловых колебаний.
Если температуру тела увеличивать, увеличивается энергия тепловых колебаний частиц. При некоторой температуре энергия тепловых колебаний становится больше, чем энергия связей. При такой температуре связи между частицами разрушаются и образуются снова. При этом частицы совершают различные виды движений (колебания, вращения, перемещения друг относительно друга и т.д.). При этом они еще контактируют между собой. Правильная геометрическая структура нарушена. Вещество находится в жидком состоянии.
При дальнейшем росте температуры тепловые колебания усиливаются, связи между частицами становятся еще слабее и практически отсутствуют. Вещество находится в газообразном состоянии. Самой простой моделью вещества является идеальный газ, в котором считается, что частицы движутся в любых направлениях свободно, взаимодействуют между собой только в момент соударений, при этом выполняются законы упругого удара.
Вещество находится в газообразном состоянии. Самой простой моделью вещества является идеальный газ, в котором считается, что частицы движутся в любых направлениях свободно, взаимодействуют между собой только в момент соударений, при этом выполняются законы упругого удара.
Можно сделать вывод о том, что с ростом температуры вещество переходит от упорядоченной структуры в неупорядоченное состояние.
Плазма – это газообразное вещество, состоящее из смеси нейтральных частиц ионов и электронов.
Температура и давление в разных агрегатных состояниях вещества
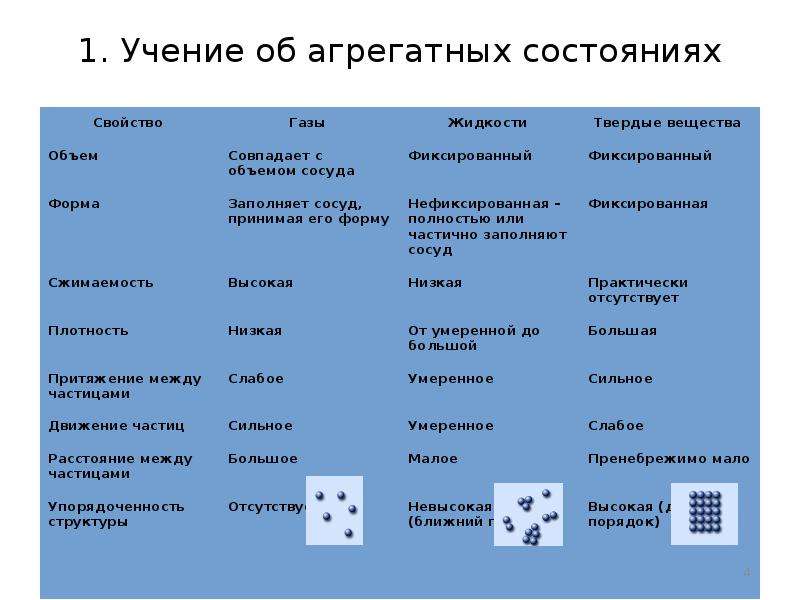
Разные агрегатные состояния вещества определяют: температура и давление. Низкое давление и высокая температура соответствуют газам. При низких температурах, обычно вещество находится в твердом состоянии. Промежуточные температуры относят к веществам в жидком состоянии. Для характеристики агрегатных состояний вещества часто применяется фазовая диаграмма. Это диаграмма, отражающая зависимость агрегатного состояния от давления и температуры.
Основной особенностью газов является их способность к расширению и сжимаемость. Газы не обладают формой, принимают форму сосуда, в который помещены. Объем газа определяет объем сосуда. Газы могут смешиваться между собой в любых пропорциях.
Жидкость не имеет формы, но имеют объем. Сжимаются жидкости плохо, только при высоком давлении.
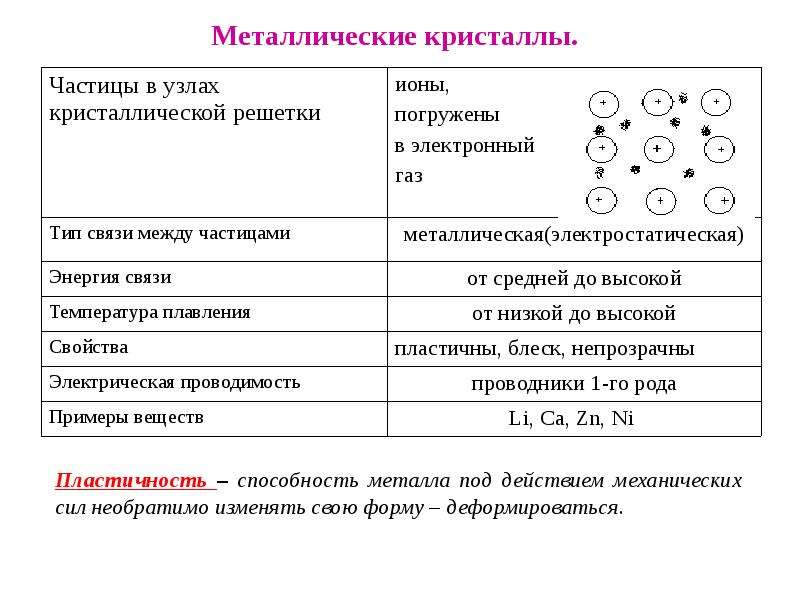
Твердые вещества имеют форму и объем. В твердом состоянии могут находиться соединения с металлическими, ионными и ковалентными связями.
Примеры решения задач
Агрегатные состояния вещества | Физика
Зимой вода на поверхности озер и рек замерзает, превращаясь в лед. Подо льдом вода остается жидкой. Здесь одновременно существуют два различных агрегатных состояния воды -твердое (лед) и жидкое (вода). Существует и третье состояние воды — газообразное: невидимый водяной пар находится в окружающем нас воздухе.
Различные агрегатные состояния существуют у каждого вещества. Отличаются эти состояния друг от друга не молекулами, а тем, как эти молекулы расположены и как движутся. Особенности расположения молекул в различных агрегатных состояниях одного и того же вещества — воды — иллюстрирует рисунок 76.
Особенности расположения молекул в различных агрегатных состояниях одного и того же вещества — воды — иллюстрирует рисунок 76.
При определенных условиях вещества могут переходить из одного состояния в другое. Все возможные при этом превращения отображены на рисунке 77. Буквы Т, Ж и Г обозначают соответственно твердое, жидкое и газообразное состояния вещества; стрелки указывают направление, в котором протекает тот или иной процесс.
Всего различают шесть процессов, при которых происходят агрегатные превращения вещества.
Переход вещества из твердого (кристаллического) состояния в жидкое называется плавлением, обратный процесс называется кристаллизацией или отвердеванием. Пример плавления — таяние льда, обратный процесс происходит при замерзании воды.
Переход вещества из жидкого состояния в газообразное называется парообразованием, обратный процесс называется конденсацией (от латинского слова «конденсатио» — уплотнение, сгущение).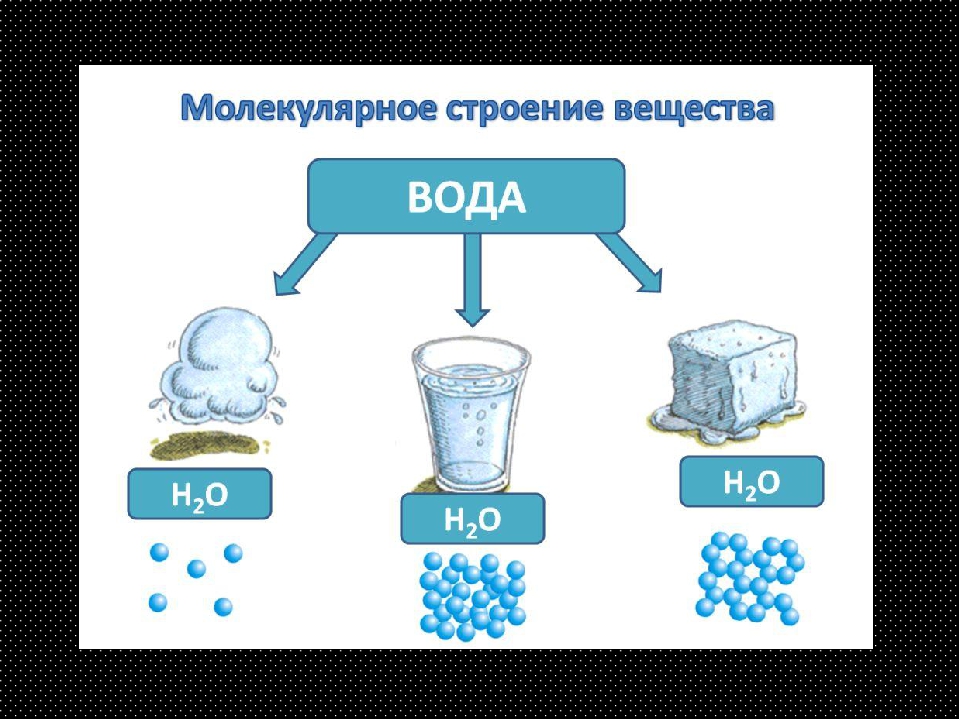 Пример парообразования—испарение воды, конденсацию можно наблюдать при образовании росы.
Пример парообразования—испарение воды, конденсацию можно наблюдать при образовании росы.
Переход вещества из твердого состояния в газообразное (минуя жидкое) называется сублимацией (от латинского слова «сублимо» — возношу) или возгонкой, обратный процесс называется десублимацией. Например, графит можно нагреть до тысячи, двух тысяч и даже трех тысяч градусов, и тем не менее в жидкость он не превратится: он будет сублимироваться, т. е. из твердого состояния сразу переходить в газообразное. Сразу в газообразное состояние (минуя жидкое) переходит и так называемый «сухой лед» (твердый оксид углерода СО2), который можно увидеть в контейнерах для хранения и транспортировки мороженого. Все запахи, которыми обладают твердые тела (например, нафталин), также обусловлены возгонкой: вылетая из твердого тела, молекулы образуют над ним газ (или пар), который и вызывает ощущение запаха.
Примером десублимации может служить образование на окнах зимой узоров из кристалликов льда. Эти красивые узоры являются результатом десублимации водяного пара, находящегося в воздухе.
Эти красивые узоры являются результатом десублимации водяного пара, находящегося в воздухе.
Переходы вещества из одного агрегатного состояния в другое играют важную роль не только в природе, но и в технике. Так, например, превратив воду в пар, мы можем использовать его затем в паровых турбинах на электростанциях. Расплавляя металлы на заводах, мы получаем возможность изготовить из них различные сплавы: сталь, чугун, латунь и т. д. Для понимания всех этих процессов надо знать, что происходит с веществом при изменении его агрегатного состояния и при каких условиях это изменение возможно. Об этом и пойдет речь в следующих параграфах.
1. Назовите три агрегатных состояния вещества. 2. Перечислите все возможные процессы, при которых вещество переходит из одного агрегатного состояния в другое. 3. Приведите примеры возгонки и десублимации. 4. Какие практические применения агрегатных превращений вы знаете? 5. Какой буквой (а, 6 или в) на рисунке 76 обозначено твердое состояние воды, жидкое и газообразное?
Агрегатные состояния вещества | Физика
Зимой вода на поверхности озер и рек замерзает, превращаясь в лед.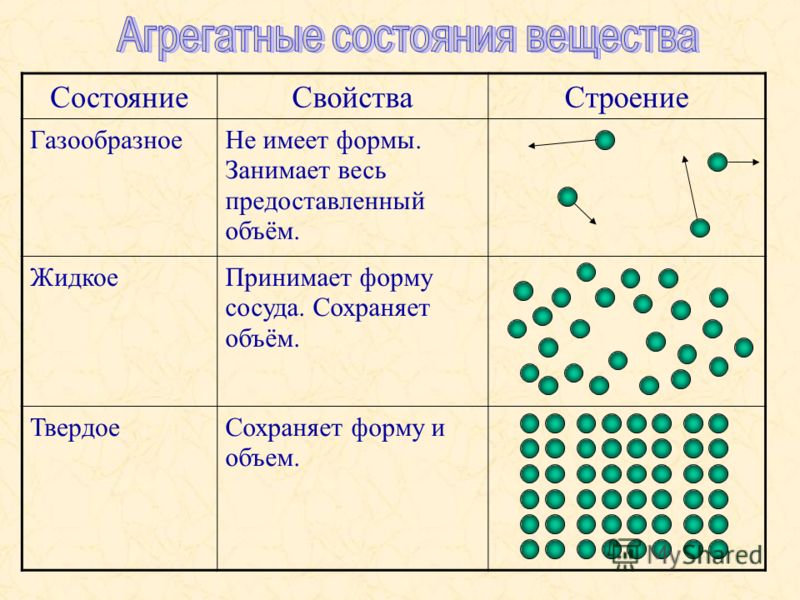 Подо льдом вода остается жидкой (рис. 76). Здесь одновременно существуют два различных состояния воды — твердое (лед) и жидкое (вода). Существует и третье состояние воды — газообразное: невидимый водяной пар находится в окружающем нас воздухе.На примере воды мы видим, что вещества могут находиться в трех агрегатных состояниях — твердом, жидком и газообразном.
Подо льдом вода остается жидкой (рис. 76). Здесь одновременно существуют два различных состояния воды — твердое (лед) и жидкое (вода). Существует и третье состояние воды — газообразное: невидимый водяной пар находится в окружающем нас воздухе.На примере воды мы видим, что вещества могут находиться в трех агрегатных состояниях — твердом, жидком и газообразном.
Жидкую ртуть можно увидеть в резервуаре термометра. Над поверхностью ртути находятся ее пары, которые представляют собой газообразное состояние ртути. При температуре -39 °С ртуть замерзает, переходя в твердое состояние.
Кислород в окружающем нас воздухе представляет собой газ. Но при температуре -193 °С он превращается в жидкость. Охладив эту жидкость до -219 °С, мы получим твердый кислород.
И наоборот, железо в обычных условиях твердое. Однако при температуре 1535 °С железо плавится и превращается в жидкость. Над расплавленным железом будет находиться газ — пар из атомов железа.
Свойства вещества в различных агрегатных состояниях различны.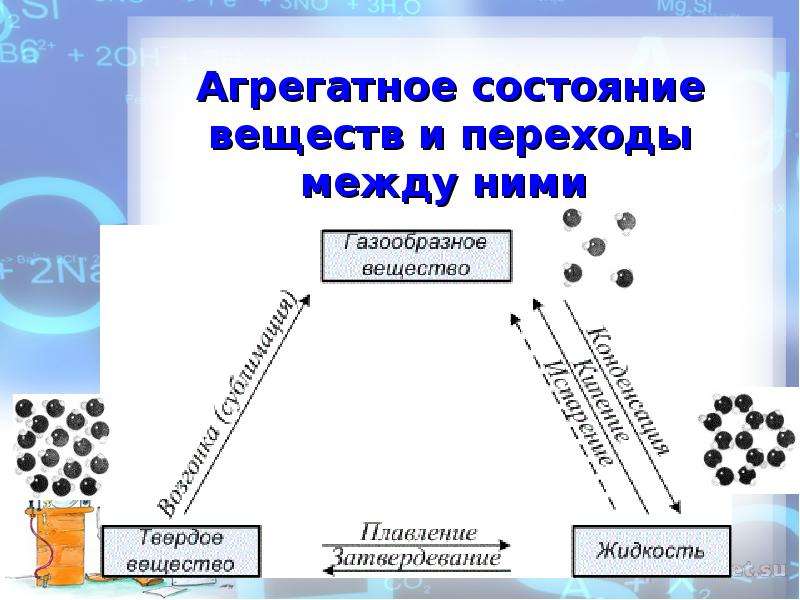
Твердое тело в обычных условиях трудно сжать или растянуть. В отсутствие внешних воздействий оно сохраняет свою форму и объем.
Жидкость легко меняет свою форму. В обычных условиях она принимает форму сосуда, в котором находится (рис. 77). Но в состоянии невесомости (например, на орбитальной космической станции) жидкость характеризуется своей собственной — сферической — формой. Сферическую форму (форму шарика) имеют и маленькие дождевые капельки.
Свойство жидкости легко изменять свою форму учитывают, когда изготавливают посуду из расплавленного стекла (рис. 78).
Форму жидкости изменить легко, но объем ее изменить трудно. Сохранилось описание одного исторического опыта, в котором воду пробовали сжать таким способом. Ее налили в свинцовый шар и шар запаяли, чтобы вода не могла выливаться при сжатии. После этого ударили по свинцовому шару тяжелым молотом. И что же? Вода не сжалась вместе с шаром, а просочилась сквозь его стенки.
Итак, жидкости легко меняют свою форму, но сохраняют свой объем.
Газ не имеет своего собственного объема и не обладает собственной формой. Он всегда заполняет всю предоставленную ему емкость.
Чтобы исследовать свойства газов, необязательно располагать газом, имеющим цвет. Воздух, например, бесцветен, и мы его не видим. Но при быстром движении, находясь у окна автомобиля или поезда, а также когда дует ветер, мы замечаем присутствие воздуха вокруг нас. Его можно обнаружить и при помощи опытов.
Опустим в воду перевернутый вверх дном стакан — вода не заполнит стакан, так как в нем останется воздух. Если опускать в воду воронку, соединенную резиновым шлангом со стеклянной трубкой (рис. 79), то воздух начнет выходить из нее наружу.Объем газа изменить нетрудно. Нажав на резиновый мяч, мы заметно уменьшим объем воздуха, находящегося в мяче.
Попав в какой-нибудь сосуд или помещение, газ заполняет их целиком, принимая как их форму, так и объем.
1. В каких трех агрегатных состояниях может находиться любое вещество? Приведите примеры. 2. Тело сохраняет свой объем, но легко меняет форму. В каком состоянии находится это тело? 3. Тело сохраняет свою форму и объем. В каком состоянии находится это тело? 4. Что вы можете сказать о форме и объеме газа?
2. Тело сохраняет свой объем, но легко меняет форму. В каком состоянии находится это тело? 3. Тело сохраняет свою форму и объем. В каком состоянии находится это тело? 4. Что вы можете сказать о форме и объеме газа?
Агрегатные состояния вещества
Определение 1
Агрегатные состояния вещества (от лат. “aggrego” означает “присоединяю”, “связываю”) – это состояния одного и того же вещества в твердом, жидком и газообразном виде.
При переходе из одного состояния в другое наблюдается скачкообразное изменение энергии, энтропии, плотности и прочих свойств вещества.
Твердые и жидкие тела
Определение 2
Твердые тела – это тела, которые отличаются постоянством своей формы и объема.
В твердых телах межмолекулярные расстояния маленькие, а потенциальную энергию молекул можно сравнить с кинетической.
Твёрдые тела подразделяются на 2 вида:
- Кристаллические;
- Аморфные.
В состоянии термодинамического равновесия находятся только лишь кристаллические тела. Аморфные же тела по факту представляют собой метастабильные состояния, которые по строению схожи с неравновесными, медленно кристаллизующимися жидкостями. В аморфном теле происходит чересчур медленный процесс кристаллизации, процесс постепенного преобразования вещества в кристаллическую фазу. Разница кристалла от аморфного твердого тела состоит, в первую очередь, в анизотропии его свойств. Свойства кристаллического тела определяются в зависимости от направления в пространстве. Разнообразные процессы (например, теплопроводность, электропроводность, свет, звук) распространяются в разных направлениях твердого тела по-разному. А вот аморфные тела (например, стекло, смолы, пластмассы) изотропные, как и жидкости. Разница аморфных тел от жидкостей заключается лишь только в том, что последние текучие, в них не происходят статические деформации сдвига.
У кристаллических тел правильное молекулярное строение.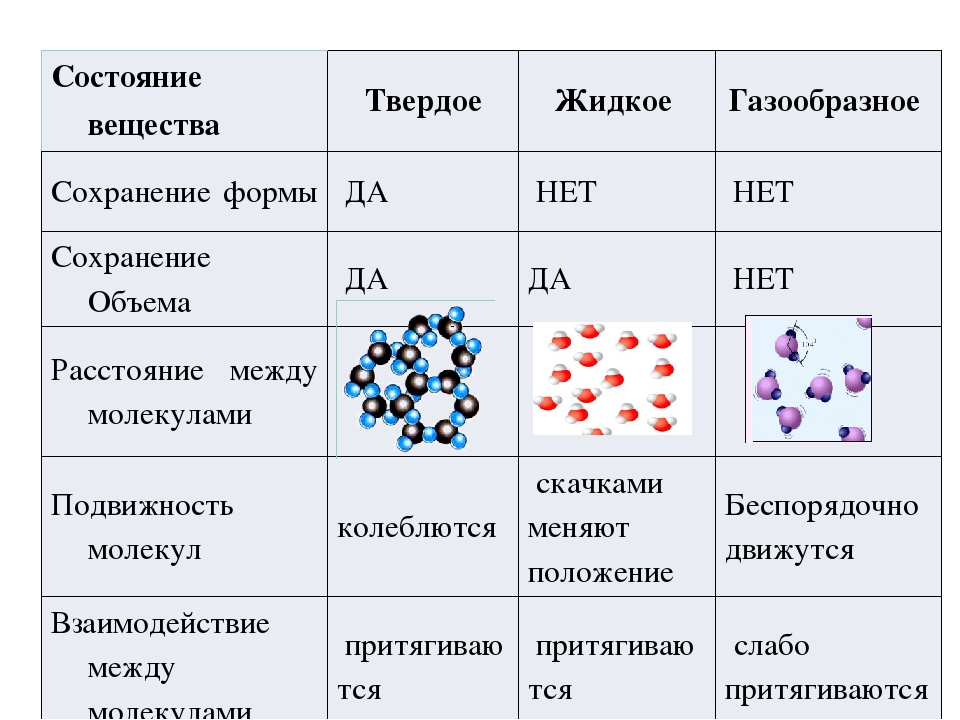 Именно за счет правильного строения кристалл имеет анизотропные свойства. Правильное расположение атомов кристалла создает так называемую кристаллическую решетку. В разных направлениях месторасположение атомов в решетке различное, что и приводит к анизотропии. Атомы (ионы либо целые молекулы) в кристаллической решетке совершают беспорядочное колебательное движение возле средних положений, которые и рассматриваются в качестве узлов кристаллической решетки. Чем выше температура, тем выше энергия колебаний, а значит, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний определяется размер кристалла. Увеличение амплитуды колебаний приводит к увеличению размеров тела. Таким образом, объясняется тепловое расширение твердых тел.
Именно за счет правильного строения кристалл имеет анизотропные свойства. Правильное расположение атомов кристалла создает так называемую кристаллическую решетку. В разных направлениях месторасположение атомов в решетке различное, что и приводит к анизотропии. Атомы (ионы либо целые молекулы) в кристаллической решетке совершают беспорядочное колебательное движение возле средних положений, которые и рассматриваются в качестве узлов кристаллической решетки. Чем выше температура, тем выше энергия колебаний, а значит, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний определяется размер кристалла. Увеличение амплитуды колебаний приводит к увеличению размеров тела. Таким образом, объясняется тепловое расширение твердых тел.
Определение 3
Жидкие тела – это тела, имеющие определенный объем, но не имеющие упругой формы.
Для вещества в жидком состоянии характерно сильное межмолекулярное взаимодействие и малая сжимаемость. Жидкость занимает промежуточное положение между твердым телом и газом.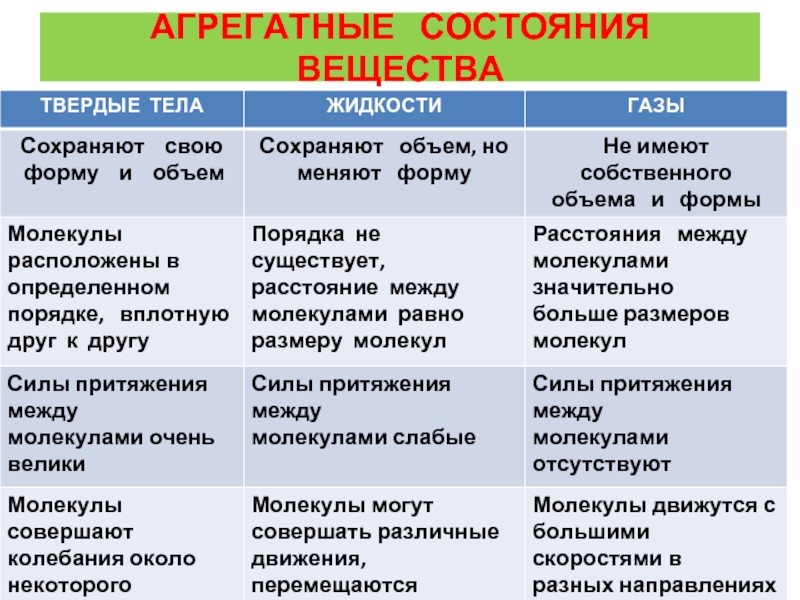 Жидкости, также как и газы, обладают изотpопными свойствами. Помимо этого, жидкость обладает свойством текучести. В ней, как и в газах, нет касательного напряжения (напряжения на сдвиг) тел. Жидкости тяжелые, то есть их удельные веса можно сравнить с удельными весами твердых тел. Вблизи температур кристаллизации их теплоемкости и прочие тепловые свойства близки к соответствующим свойствам твердых тел. В жидкостях наблюдается до заданной степени правильное расположение атомов, но только лишь в маленьких областях. Здесь атомы также проделывают колебательное движение около узлов квазикристаллической ячейки, однако в отличие от атомов твердого тела они периодически перескакивают от одного узла к другому. В итоге движение атомов будет весьма сложное: колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Жидкости, также как и газы, обладают изотpопными свойствами. Помимо этого, жидкость обладает свойством текучести. В ней, как и в газах, нет касательного напряжения (напряжения на сдвиг) тел. Жидкости тяжелые, то есть их удельные веса можно сравнить с удельными весами твердых тел. Вблизи температур кристаллизации их теплоемкости и прочие тепловые свойства близки к соответствующим свойствам твердых тел. В жидкостях наблюдается до заданной степени правильное расположение атомов, но только лишь в маленьких областях. Здесь атомы также проделывают колебательное движение около узлов квазикристаллической ячейки, однако в отличие от атомов твердого тела они периодически перескакивают от одного узла к другому. В итоге движение атомов будет весьма сложное: колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Газ, испарение, конденсация и плавление
Определение 4
Газ – это такое состояние вещества, при котором расстояния между молекулами огромны.
Силами взаимодействия между молекулами при небольших давлениях можно пренебречь. Частицы газа заполоняют весь объем, который предоставлен для газа. Газы рассматривают как сильно перегретые либо ненасыщенные пары. Особый вид газа – плазма (частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов почти одинаковые). То есть плазма – это газ из заряженных частиц, взаимодействующих между собой при помощи электрических сил на большом расстоянии, но не имеющих ближнего и дальнего расположения частиц.
Частицы газа заполоняют весь объем, который предоставлен для газа. Газы рассматривают как сильно перегретые либо ненасыщенные пары. Особый вид газа – плазма (частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов почти одинаковые). То есть плазма – это газ из заряженных частиц, взаимодействующих между собой при помощи электрических сил на большом расстоянии, но не имеющих ближнего и дальнего расположения частиц.
Как известно, вещества способны переходить из одного агрегатного состояния в другое.
Определение 5
Испарение – это процесс изменения агрегатного состояния вещества, при котором с поверхности жидкости либо твердого тела вылетают молекулы, кинетическая энергия которых преобразовывает потенциальную энергию взаимодействия молекул.
Испарение является фазовым переходом. При испарении часть жидкости или твердого тела преобразуется в пар.
Определение 6
Вещество в газообразном состоянии, которое находится в динамическом равновесии с жидкостью, называется насыщенным паром. При этом изменение внутренней энергии тела равняется:
При этом изменение внутренней энергии тела равняется:
∆U=±mr (1),
где m – это масса тела, r – это удельная теплота парообразования (Дж/кг).
Определение 7
Конденсация представляет собой процесс, обратный парообразованию.
Изменение внутренней энергии рассчитывается по формуле (1).
Определение 8
Плавление – это процесс преобразования вещества из твердого состояния в жидкое, процесс изменения агрегатного состояния вещества.
Нужна помощь преподавателя?
Опиши задание — и наши эксперты тебе помогут!
Описать задание
При нагревании вещества растет его внутренняя энергия, поэтому увеличивается скорость теплового движения молекул. При достижении веществом своей температуры плавления кристаллическая решетка твердого тела разрушается. Связи между частицами также разрушаются, растет энергия взаимодействия между частицами. Теплота, которая передается телу, идет на увеличение внутренней энергии данного тела, и часть энергии расходуется на совершение работы по изменению объема тела при его плавлении.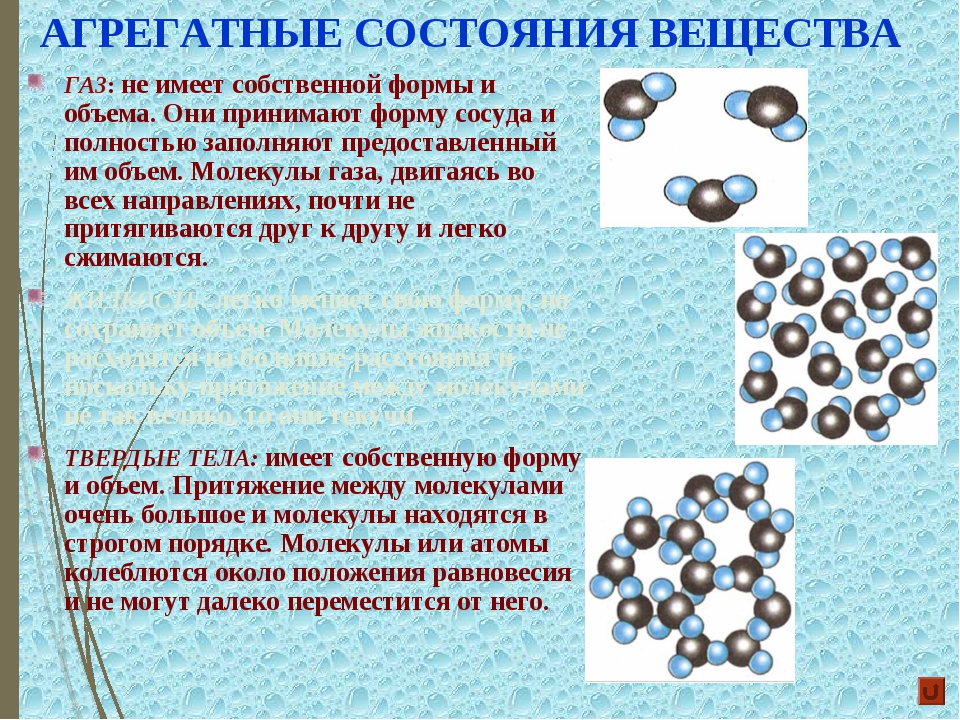 У многих кристаллических тел объем увеличивается при плавлении, однако есть исключения (к примеру, лед, чугун). Аморфные тела не обладают определенной температурой плавления. Плавление представляет собой фазовый переход, который характеризуется скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она остается неизменной в ходе процесса. Тогда изменение внутренней энергии тела равняется:
У многих кристаллических тел объем увеличивается при плавлении, однако есть исключения (к примеру, лед, чугун). Аморфные тела не обладают определенной температурой плавления. Плавление представляет собой фазовый переход, который характеризуется скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она остается неизменной в ходе процесса. Тогда изменение внутренней энергии тела равняется:
∆U=±mλ (2),
где λ – это удельная теплота плавления (Дж/кг).
Определение 9
Кристаллизация представляет собой процесс, обратный плавлению.
Изменение внутренней энергии рассчитывается по формуле (2).
Изменение внутренней энергии каждого тела системы при нагревании или охлаждении вычисляется по формуле:
∆U=mc∆T (3),
где c – это удельная теплоемкость вещества, ДжкгК, △T – это изменение температуры тела.
Определение 10
При рассматривании преобразований веществ из одних агрегатных состояний в другие нельзя обойтись без так называемого уравнения теплового баланса: суммарное количество теплоты, выделяемое в теплоизолированной системе, равняется количеству теплоты (суммарному), которое в данной системе поглощается.
Q1+Q2+Q3+…+Qn=Q’1+Q’2+Q’3+…+Q’k.
По сути, уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
Пример 1
В теплоизолированном сосуде находятся вода и лед с температурой ti=0°C. Масса воды mυ и льда mi соответственно равняется 0,5 кг и 60 г. В воду впускают водяной пар массой mp=10 г при температуре tp=100°C. Какой будет температура воды в сосуде после того, как установится тепловое равновесие? При этом теплоемкость сосуда учитывать не нужно.
Рисунок 1
Решение
Определим, какие процессы осуществляются в системе, какие агрегатные состояния вещества мы наблюдали и какие получили.
Водяной пар конденсируется, отдавая при этом тепло.
Тепловая энергия идет на плавление льда и, может быть, нагревание имеющейся и полученной изо льда воды.
Прежде всего, проверим, сколько теплоты выделяется при конденсации имеющейся массы пара:
Qp=-rmp;Qp=2,26·106·10-2=2,26·104 (Дж),
здесь из справочных материалов у нас есть r=2,26·106 Джкг – удельная теплота парообразования (применяется и для конденсации).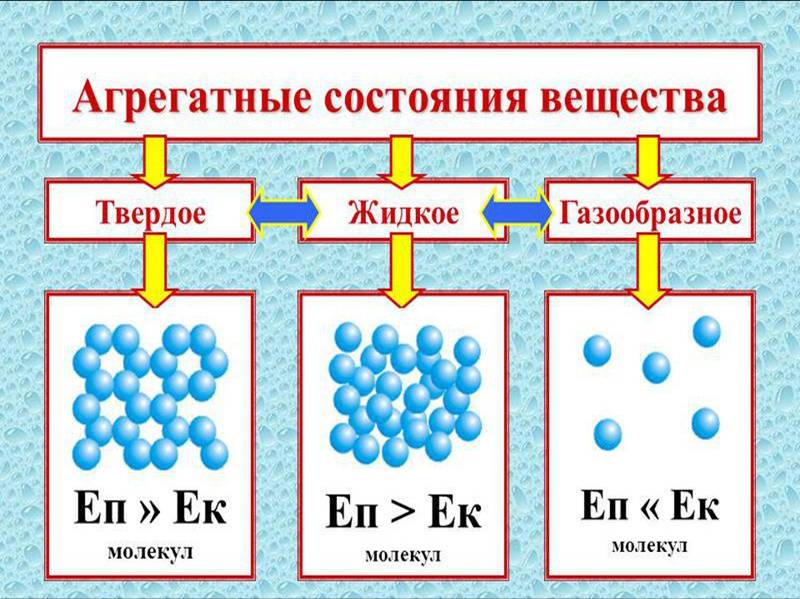
Для плавления льда понадобится следующее количество тепла:
Qi=λmiQi=6·10-2·3,3·105≈2·104 (Дж),
здесь из справочных материалов у нас есть λ=3,3·105 Джкг – удельная теплота плавления льда.
Выходит, что пар отдает тепла больше, чем необходимо, только для расплавления имеющегося льда, значит, уравнение теплового баланса запишем следующим образом:
rmp+cmp(Tp-T)=λmi+c(mυ+mi)(T-Ti).
Теплота выделяется при конденсации пара массой mp и остывании воды, образуемой из пара от температуры Tp до искомой T. Теплота поглощается при плавлении льда массой mi и нагревании воды массой mυ+mi от температуры Ti до T. Обозначим T-Ti=∆T для разности Tp-T получаем:
Tp-T=Tp-Ti-∆T=100-∆T.
Уравнение теплового баланса будет иметь вид:
rmp+cmp(100-∆T)=λmi+c(mυ+mi)∆T;c(mυ+mi+mp)∆T=rmp+cmp100-λmi;∆T=rmp+cmp100-λmicmυ+mi+mp.
Сделаем вычисления с учетом того, что теплоемкость воды табличная
c=4,2·103 ДжкгК, Tp=tp+273=373 К, Ti=ti+273=273 К:∆T=2,26·106·10-2+4,2·103·10-2·102-6·10-2·3,3·1054,2·103·5,7·10-1≈3 (К),
тогда T=273+3=276 К
Ответ: Температура воды в сосуде после установления теплового равновесия будет равняться 276 К.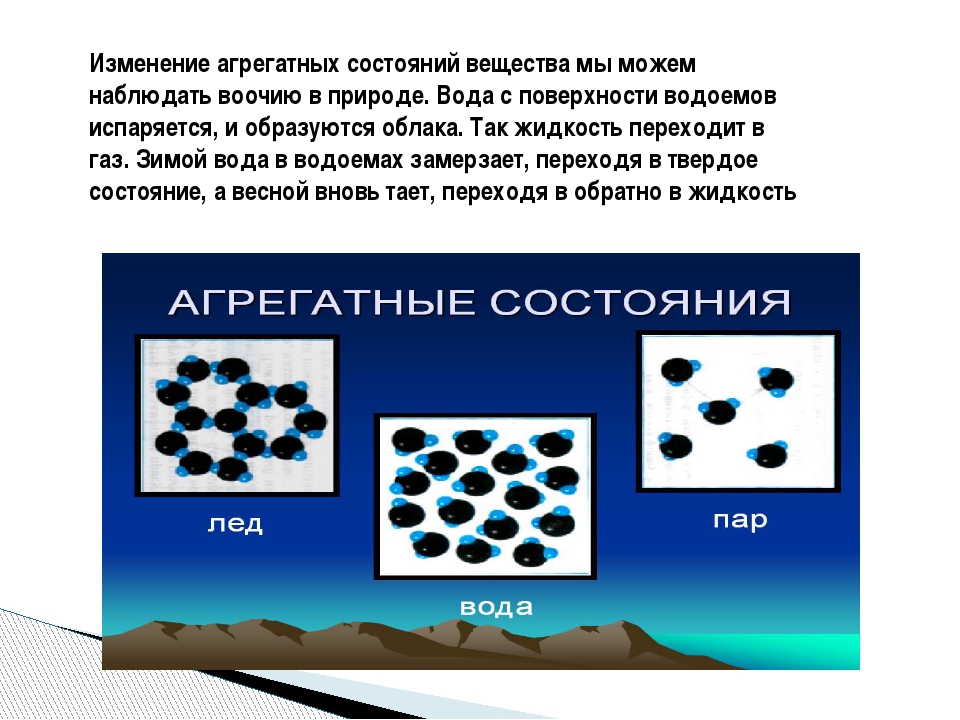
Пример 2
На рисунке 2 изображен участок изотермы, который отвечает переходу вещества из кристаллического в жидкое состояние. Что соответствует данному участку на диаграмме p,T?
Рисунок 2
Ответ: Вся совокупность состояний, которые изображены на диаграмме p,V горизонтальным отрезком прямой на диаграмме p,T показано одной точкой, которая определяет значения p и T, при которых происходит преобразование из одного агрегатного состояния в другое.
Агрегатные состояния вещества • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Движение в настоящий момент остаётся прошлым в изменениях движений других носителей.
[quote=»AnaLog»]
Гы-гы-гы…
Какая может быть тонкость там, где всё измеряется одной линейкой? «Тонкость» возникает в одном случае, если в глазах двоится!
Вот пример:
[quote]Противостояния размерностей рождают точку равновесия с [b]двумя сторонами-личиками[/b], а давления в их затылки, в спины, сталкивают за линию равновесия, нарушая её, возбуждая стремление к восстановлению равенства размерных частей пространства и равновесия центробежных (+) и центростремительных (-) движений- сдвигов их размерных частей структурного пространства, что вдоль вертикали действия сил тяжести и антитяжести, как вдоль радиусов, сходящихся к центру кривизны, как к нулевой точке координат, своим нарушением создаёт поступательно-возвратные, откатные движения, гравитационные, которые принимают форму орбит разной геометрической формы-эллипсов. А измеряется размерность пространства линейкой с разными масштабами.[/quote] [quote]«Неуловимое время измеряется уловимым, закольцованным в орбиты разных радиусов, движением…[/quote]
А измеряется размерность пространства линейкой с разными масштабами.[/quote] [quote]«Неуловимое время измеряется уловимым, закольцованным в орбиты разных радиусов, движением…[/quote]
Я устал хохотать! А песочных часов вам недостаточно? Для вас песочные часы, это слишком мелко? А орбиты одного радиуса тоже недостаточно? А электронные часы с кварцевым стабилизатором частоты тоже не годятся,но есть же часы, которые считаются эталонными… Ядерные кажется… на ядерном переходе работают. Так нет, вам две орбиты нужны… Выпил наверное, мало 🙁
ладно, возьмите всё, что вам нужно, и проведите измерения, которые можно повторить и в вашем отсутствии и которые докажут существование эээээ
прошлого движения, которое является массой, кажется , нонешней.
Тока не смешите заявлениями о том, что инерция -это тоже прошлое движение.
Пивень, вы пустозвон, который ничего не может доказать, или показать что-либо в научном плане новое, повторяемое…
Начните измерения и окажется, что всё давно измерено и всё давно просчитано!
Прошлое движение, говорите? Возьмите настояшее движение и через мгновение оно станет прошлым! И что изменилось? где новая масса? Блин, все просчитывается известными кинематическими формулами, а вы при этом тут со своей теорией лишний!!! [/quote]
Если Вы не принимаете моё объяснение, то сами объясните, как рождается первичное движение? Как первичное неуловимое движение закольцовывается и в таком состоянии повторяется много раз, как и обращение Земли с повторениями лета и зимы, что мы воспринимаем массой-симбиозом движения и части пространства? Прошлое движение проявляется, материализуется через труд-инерцию, перелетающую на препятствие и изменяющее его форму и направленность движения.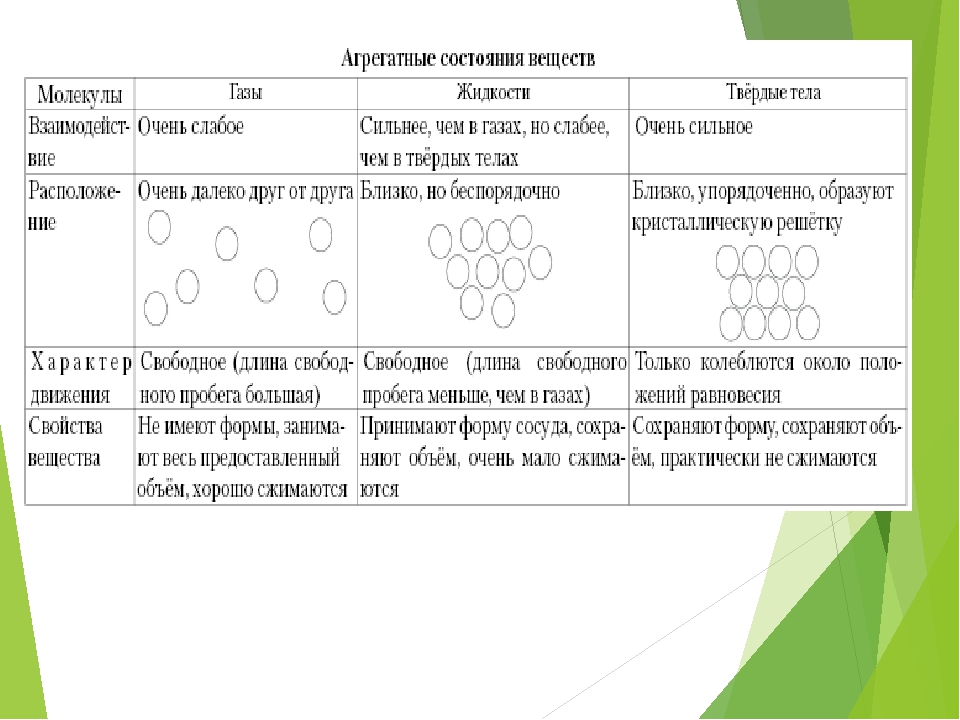 Настоящее движение (например, автомобиля, который своим движением перевозит груз с одного места на другое) работой переносится на объект, когда инерцией движение от одного носителя (хозяина) переходит к другому носителю (хозяину). Движения работают в момент настоящего времени, но настоящее время сменяется очередным настоящим временем, а предыдущее настоящее становится прошлым временем и его движением. Если время остановить невозможно, то движения останавливаются там, где затихает их инерция в результате торможения-передачи движения от одного тела другим телам среды.
Настоящее движение (например, автомобиля, который своим движением перевозит груз с одного места на другое) работой переносится на объект, когда инерцией движение от одного носителя (хозяина) переходит к другому носителю (хозяину). Движения работают в момент настоящего времени, но настоящее время сменяется очередным настоящим временем, а предыдущее настоящее становится прошлым временем и его движением. Если время остановить невозможно, то движения останавливаются там, где затихает их инерция в результате торможения-передачи движения от одного тела другим телам среды.
2.5.2015г. Пивень Григорий.
агрегатное состояние вещества – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
Агрегатное состояние — состояние какого-либо вещества, имеющее определенные свойства: способность сохранять форму и объем, иметь дальний или ближний порядок и другие. При изменении агрегатного состояния вещества происходит изменение физических свойств, а также плотности, энтропии и свободной энергии.
Как и почему происходят эти удивительные превращения? Чтобы разобраться в этом, вспомним, что все вокруг состоит из атомов и молекул. Атомы и молекулы различных веществ взаимодействуют друг с другом, и именно связь между ними определяет, какое у вещества агрегатное состояние.
Выделяют четыре типа агрегатных веществ:
Кажется, что химия открывает нам свои тайны в этих удивительных превращениях. Однако это не так. Переход из одного агрегатного состояния в другое, а также броуновское движение или диффузия относятся к физическим явлениям, поскольку в этих превращениях не происходит изменений молекул вещества и сохраняется их химический состав.
Газообразное состояние
На молекулярном уровне газ представляет собой хаотически движущиеся, сталкивающиеся со стенками сосуда и между собой молекулы, которые друг с другом практически не взаимодействуют. Поскольку молекулы газа между собой не связаны, то газ заполняет весь предоставленный ему объем, взаимодействуя и изменяя направление только при ударах друг о друга.
К сожалению, невооруженным глазом и даже с помощью светового микроскопа увидеть молекулы газа невозможно. Однако газ можно потрогать. Конечно, если вы просто попробуете ловить молекулы газов, летающие вокруг, в ладони, то у вас ничего не получится. Но наверняка все видели (или делали это сами), как кто-то накачивал воздухом шину автомобиля или велосипеда, и из мягкой и сморщенной она становилась накачанной и упругой. А кажущуюся «невесомость» газов опровергнет опыт, описанный на странице 39 учебника «Химия 7 класс» под редакцией О.С. Габриеляна.
Это происходит потому, что в замкнутый ограниченный объем шины попадает большое количество молекул, которым становится тесно, и они начинают чаще ударяться друг о друга и о стенки шины, а в результате суммарное воздействие миллионов молекул на стенки воспринимается нами как давление.
Но если газ занимает весь предоставленный ему объем, почему тогда он не улетает в космос и не распространяется по всей вселенной, заполняя межзвездное пространство? Значит, что-то все-таки удерживает и ограничивает газы атмосферой планеты?
Совершенно верно. И это — сила земного тяготения. Для того чтобы оторваться от планеты и улететь, молекулам нужно развить скорость, превышающую «скорость убегания» или вторую космическую скорость, а подавляющее большинство молекул движутся значительно медленнее.
И это — сила земного тяготения. Для того чтобы оторваться от планеты и улететь, молекулам нужно развить скорость, превышающую «скорость убегания» или вторую космическую скорость, а подавляющее большинство молекул движутся значительно медленнее.
Тогда возникает следующий вопрос: почему молекулы газов не падают на землю, а продолжают летать? Оказывается, благодаря солнечной энергии молекулы воздуха имеют солидный запас кинетической энергии, который позволяет им двигаться против сил земного притяжения.
Сборник вопросов и задач. Физика. 9 класс
В сборнике приведены вопросы и задачи различной направленности:расчетные, качественные и графические; технического, практического и исторического характера. Задания распределены по темам в соответствии со структурой учебника «Физика. 9 класс» авторов А. В. Перышкина, Е. М. Гутник и позволяют реализовать требования, заявленные ФГОС к метапредметным, предметным и личностным результатам обучения.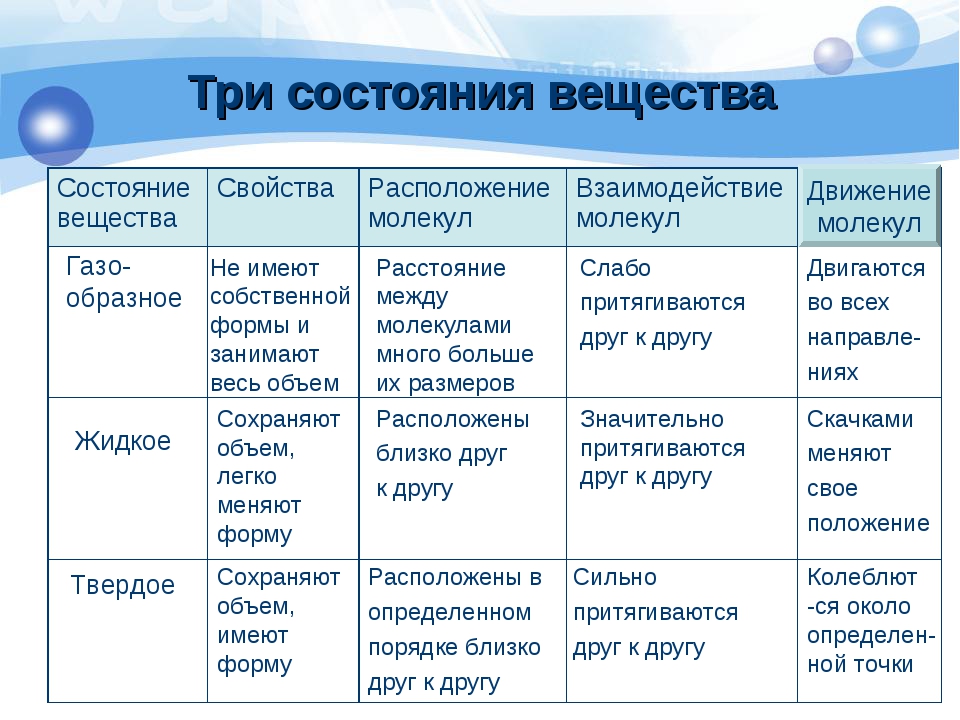
Купить
Жидкое состояние
При повышении давления и/или снижении температуры газы можно перевести в жидкое состояние. Еще на заре ХIХ века английскому физику и химику Майклу Фарадею удалось перевести в жидкое состояние хлор и углекислый газ, сжимая их при очень низких температурах. Однако некоторые из газов не поддались ученым в то время, и, как оказалось, дело было не в недостаточном давлении, а в неспособности снизить температуру до необходимого минимума.
Жидкость, в отличие от газа, занимает определенный объем, однако она также принимает форму заполняемого сосуда ниже уровня поверхности. Наглядно жидкость можно представить как круглые бусины или крупу в банке. Молекулы жидкости находятся в тесном взаимодействии друг с другом, однако свободно перемещаются относительно друг друга.
Если на поверхности останется капля воды, через какое-то время она исчезнет. Но мы же помним, что благодаря закону сохранения массы-энергии, ничто не пропадает и не исчезает бесследно.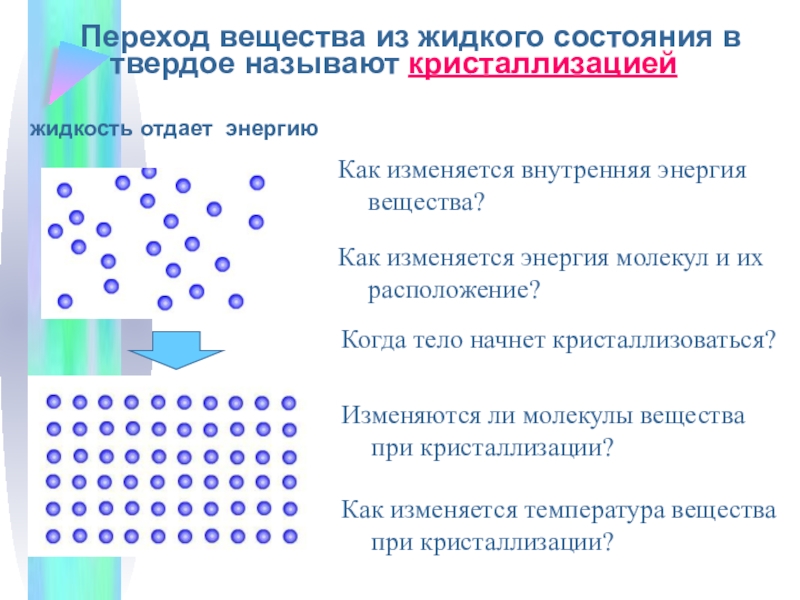 Жидкость испарится, т.е. изменит свое агрегатное состояние на газообразное.
Жидкость испарится, т.е. изменит свое агрегатное состояние на газообразное.
Испарение — это процесс преобразования агрегатного состояния вещества, при котором молекулы, чья кинетическая энергия превышает потенциальную энергию межмолекулярного взаимодействия, поднимаются с поверхности жидкости или твердого тела.
Испарение с поверхности твердых тел называется сублимацией или возгонкой. Наиболее простым способом наблюдать возгонку является использование нафталина для борьбы с молью. Если вы ощущаете запах жидкости или твердого тела, значит происходит испарение. Ведь нос как раз и улавливает ароматные молекулы вещества.
Жидкости окружают человека повсеместно. Свойства жидкостей также знакомы всем — это вязкость, текучесть. Когда заходит разговор о форме жидкости, то многие говорят, что жидкость не имеет определенной формы. Но так происходит только на Земле. Благодаря силе земного притяжения капля воды деформируется.
Однако многие видели как космонавты в условиях невесомости ловят водяные шарики разного размера. В условиях отсутствия гравитации жидкость принимает форму шара. А обеспечивает жидкости шарообразную форму сила поверхностного натяжения. Мыльные пузыри – отличный способ познакомиться с силой поверхностного натяжения на Земле.
Еще одно свойство жидкости — вязкость. Вязкость зависит от давления, химического состава и температуры. Большинство жидкостей подчиняются закону вязкости Ньютона, открытому в ХIХ веке. Однако есть ряд жидкостей с высокой вязкостью, которые при определенных условиях начинают вести себя как твердые тела и не подчиняются закону вязкости Ньютона. Такие растворы называются неньютоновскими жидкостями. Самый простой пример неньютоновской жидкости — взвесь крахмала в воде. Если воздействовать на неньютоновскую жидкость механическими усилиями, жидкость начнет принимать свойства твердых тел и вести себя как твердое тело.
Что ещё почитать?
Твёрдое состояние
Если у жидкости, в отличие от газа, молекулы движутся уже не хаотически, а вокруг определенных центров, то в твёрдом агрегатном состоянии вещества атомы и молекулы имеют четкую структуру и похожи на построенных солдат на параде. И благодаря кристаллической решетке твердые вещества занимают определенный объем и имеют постоянную форму.
И благодаря кристаллической решетке твердые вещества занимают определенный объем и имеют постоянную форму.
Между твердыми и жидкими телами существует промежуточная группа аморфных веществ, представители которой с одной стороны за счет высокой вязкости долго сохраняют свою форму, а с другой – частицы в нем строго не упорядочены и находятся в особом конденсированном состоянии. К аморфным веществам относится целый ряд веществ: смола, стекло, янтарь, каучук, полиэтилен, поливинилхлорид, полимеры, сургуч, различные клеи, эбонит и пластмассы. Про аморфные тела подробно можно прочитать на странице 40 учебника «Химия 7 класс» под редакцией О.С. Габриеляна.
При определенных условиях вещества, находящиеся в агрегатном состоянии жидкости, могут переходить в твердое, а твердые тела, наоборот, при нагревании плавиться и переходить в жидкое.
Это происходит потому, что при нагревании увеличивается внутренняя энергия, соответственно молекулы начинают двигаться быстрее, а при достижении температуры плавления кристаллическая решетка начинает разрушаться и изменяется агрегатное состояние вещества. У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например – лед, чугун.
У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например – лед, чугун.
В зависимости от вида частиц, образующих кристаллическую решетку твердого тела, выделяют следующую структуру:
-
молекулярную, -
атомную, -
ионную -
металлическую.
У одних веществ изменение агрегатных состояний происходит легко, как, например, у воды, для других веществ нужны особые условия (давление, температура). Но в современной физике ученые выделяют еще одно независимое состояние вещества — плазма.
Плазма — ионизированный газ с одинаковой плотностью как положительных, так и отрицательных зарядов. В живой природе плазма есть на солнце, или при вспышке молнии. Северное сияние и даже привычный нам костер, согревающий своим теплом во время вылазки на природу, также относится к плазме.
Искусственно созданная плазма добавляет яркости любому городу. Огни неоновой рекламы — это всего лишь низкотемпературная плазма в стеклянных трубках. Привычные нам лампы дневного света тоже заполнены плазмой.
Плазму делят на низкотемпературную — со степенью ионизации около 1% и температурой до 100 тысяч градусов, и высокотемпературную — ионизация около 100% и температурой в 100 млн градусов (именно в таком состоянии находится плазма в звездах).
Низкотемпературная плазма в привычных нам лампах дневного света широко применяется в быту.
Высокотемпературная плазма используется в реакциях термоядерного синтеза и ученые не теряют надежду использовать ее в качестве замены атомной энергии, однако контроль в этих реакциях очень сложен. А неконтролируемая термоядерная реакция зарекомендовала себя как оружие колоссальной мощности, когда 12 августа 1953 года СССР испытал термоядерную бомбу.
Физика.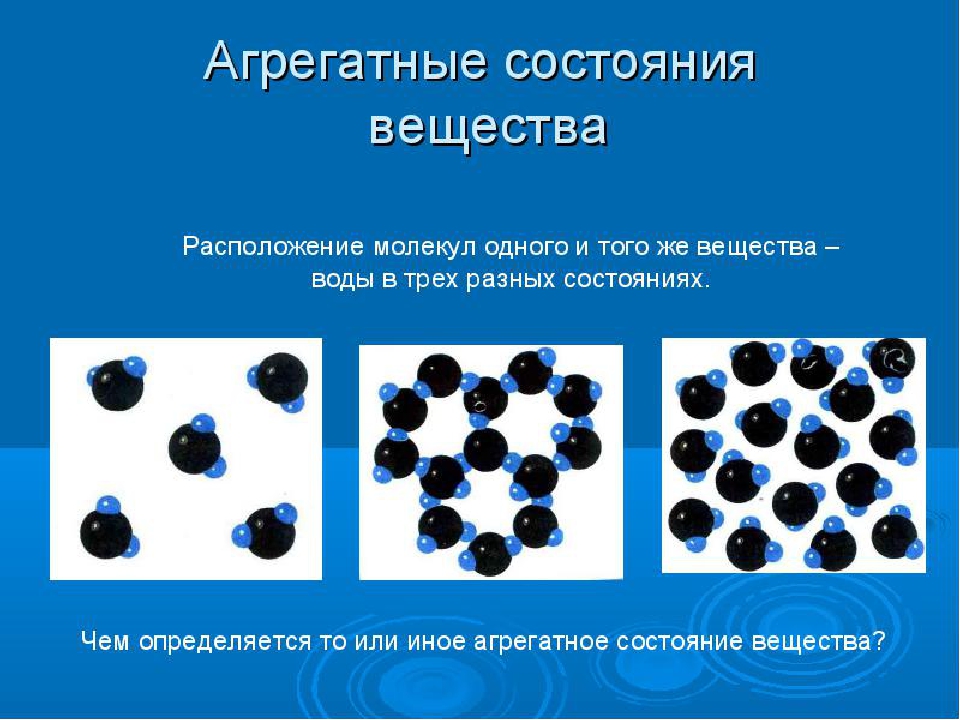 7 класс. Дидактические материалы
7 класс. Дидактические материалы
Данное пособие включает тренировочные задания, тесты для самоконтроля, самостоятельные работы, контрольные работы и примеры решения типовых задач. Всего в предлагаемом комплекте дидактических материалов содержится более 1000 задач и заданий по следующим темам: «Первоначальные сведения о строении вещества», «Взаимодействие тел», «Давление твердых тел, жидкостей и газов» и «Работа и мощность. Энергия». Пособие адресовано учителям и учашимся образовательных школ и может использоваться при работе с учебником А. В. Перышкина «Физика. 7 класс».
Купить
Для проверки усвоения материала предлагаем небольшой тест.
1. Что не относится к агрегатным состояниям:
-
жидкость -
газ -
свет +
2. Вязкость ньютоновских жидкостей подчиняется:
-
закону Бойля-Мариотта -
закону Архимеда -
закону вязкости Ньютона +
3. Почему атмосфера Земли не улетает в открытый космос:
Почему атмосфера Земли не улетает в открытый космос:
-
потому что молекулы газа не могут развить вторую космическую скорость -
потому что на молекулы газа воздействует сила земного притяжения + -
оба ответа правильные
4. Что не относится к аморфным веществам:
- сургуч
-
стекло -
железо +
5.При охлаждении объем увеличивается у:
-
янтаря -
льда + -
сахара
#ADVERTISING_INSERT#
Состояния (фазы) материи (агрегация) — x-engineer.org
Все окружающие нас объекты состоят из материи . Вселенная также содержит материю, но в другом масштабе. Материя может существовать в нескольких состояниях (также называемых фазами). Наиболее распространенными фундаментальными состояниями материи являются:
Вселенная также содержит материю, но в другом масштабе. Материя может существовать в нескольких состояниях (также называемых фазами). Наиболее распространенными фундаментальными состояниями материи являются:
Существует также четвертое состояние, тоже довольно распространенное, но менее интуитивно понятное:
Состояние, в котором находится объект, зависит от двух физических атрибутов: давления и температуры .Возьмем для примера воду. На Земле наиболее распространенным состоянием воды является жидкое состояние. Это связано с тем, что глобальная средняя годовая температура составляет 15 ° C , а атмосферное давление составляет 1 бар . В этих условиях вода будет в жидком состоянии.
Чем выше температура (теплота, энтальпия) вещества, тем выше кинетическая энергия молекул. Это заставит молекулы колебаться с более высокими амплитудами и частотами, что нарушит межмолекулярные силы и отделит молекулы друг от друга.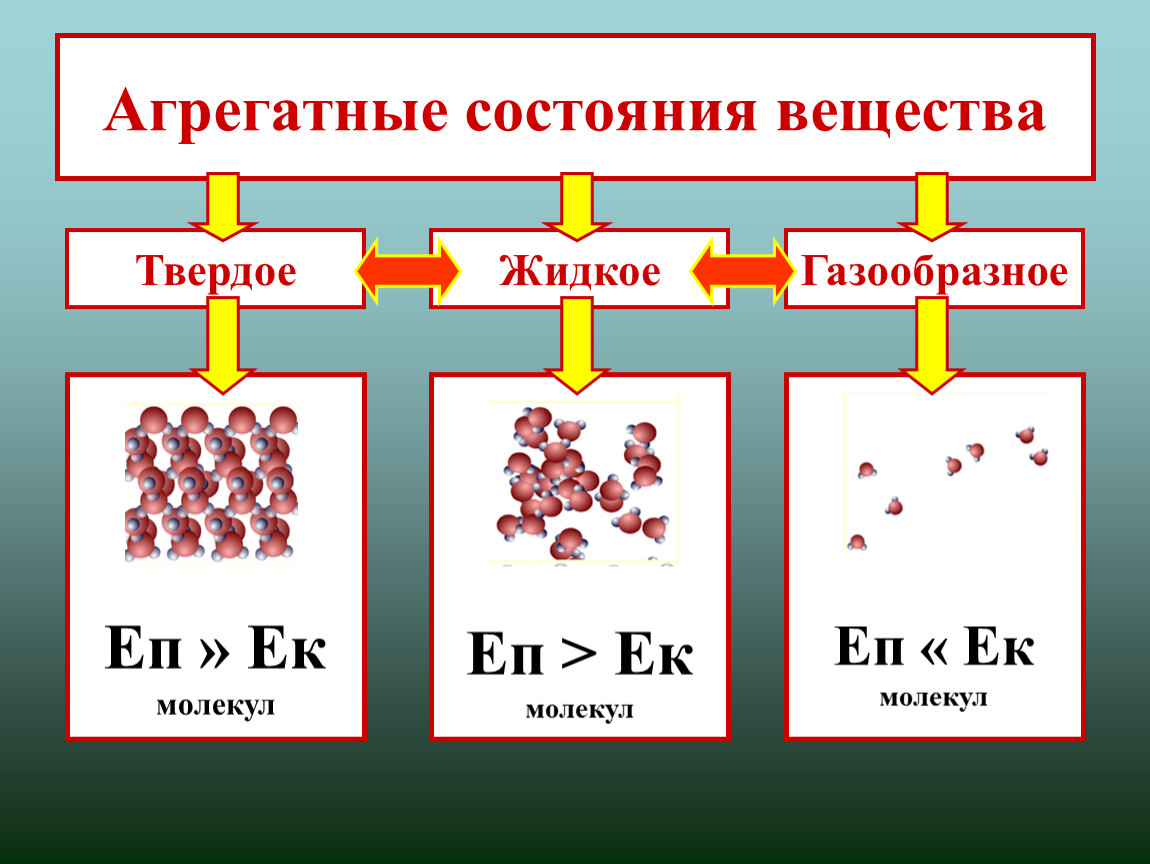 Поэтому, как правило, чем выше температура, тем ниже плотность.
Поэтому, как правило, чем выше температура, тем ниже плотность.
В зависимости от температуры (при постоянном давлении) вещество может находиться в твердом, жидком или газообразном состоянии.
Изображение: наиболее распространенные фазы вещества
ТВЕРДЫЕ
Материя в твердом состоянии имеет самую высокую плотность, а молекулы плотно упакованы вместе. По сравнению с другими состояниями кинетическая энергия в твердом теле мала. Твердые тела имеют определенную форму и объем, если их поместить в контейнер, они не соответствуют геометрии контейнера.Имея определенный объем, даже если сжатие при высоком давлении не сжимает их в меньшем объеме, твердые вещества не сжимаются.
Твердое тело может стать жидкостью, процесс называется плавлением или плавлением. Например, лед (твердый) при температуре выше 0 ° C тает и превращается в жидкую воду. Тот же процесс применяется и к железу, которое становится жидким при температуре выше 1500 ºC.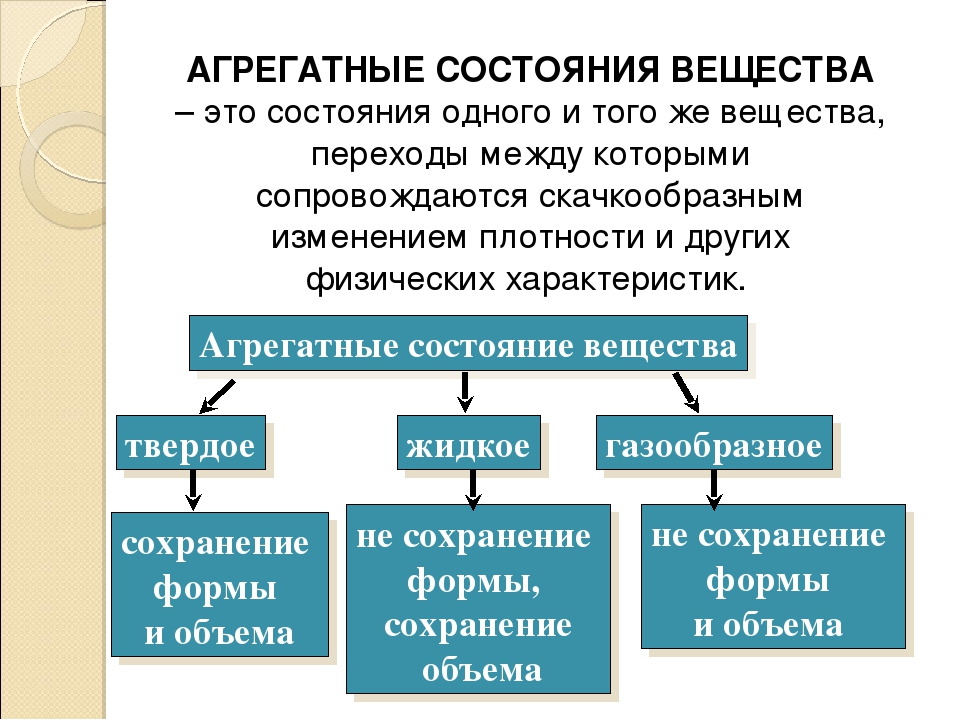
Твердые вещества также могут напрямую переходить в газы, этот процесс называется сублимацией .Нафталин, основной ингредиент традиционных нафталиновых шариков, представляет собой органическое соединение с формулой C 10 H 8 . Это твердое вещество, которое возгоняется при стандартной температуре воздуха и низких температурах.
ЖИДКОСТИ
Жидкости имеют меньшую плотность, чем твердые тела (кроме воды), но более высокую кинетическую энергию. У них также есть определенный объем, поэтому их нельзя сжать. Молекулы воды более рыхлые, чем твердые тела, и они могут перемещаться относительно друг друга.Жидкость не имеет определенной формы и, будучи помещенной в емкость, принимает ее форму.
Жидкость может переходить в твердое состояние посредством процесса, называемого затвердеванием (или кристаллизацией). Вода, если ее охладить ниже 0 ° C, становится твердой (лед).
Процесс превращения жидкости в газ называется испарение .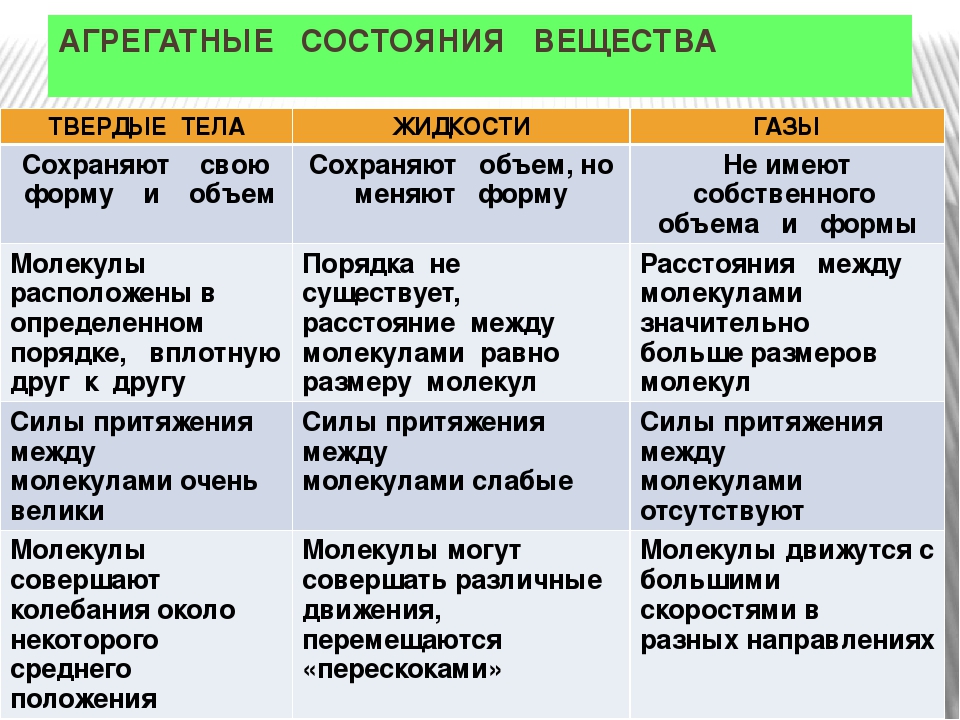 В случае с водой, если нагреться до 100 ° C, она закипает и превращается в пар.
В случае с водой, если нагреться до 100 ° C, она закипает и превращается в пар.
Изображение: Фазы воды в зависимости от температуры (тепла)
ГАЗЫ
По сравнению с другими состояниями вещества, газов имеют самую низкую плотность и самую высокую кинетическую энергию.Молекулы в газе имеют много места между собой и, если их не удерживать, будут распространяться бесконечно. Если поместить в контейнер, газ занимает весь объем. Под давлением пространство между молекулами станет меньше, а объем газа уменьшится. Газ сжимаемый.
Газ может быть преобразован в жидкость с помощью процесса, называемого конденсация . Если газ достаточно охладиться, кинетическая энергия молекулы больше не сможет преодолевать межмолекулярные силы.Это приведет к скоплению молекул, которые образуют жидкость. Например, водяные пары (пар) при охлаждении ниже 100 ° C начнут конденсироваться в жидкую воду.
Превращение газа непосредственно в твердое тело называется осаждением .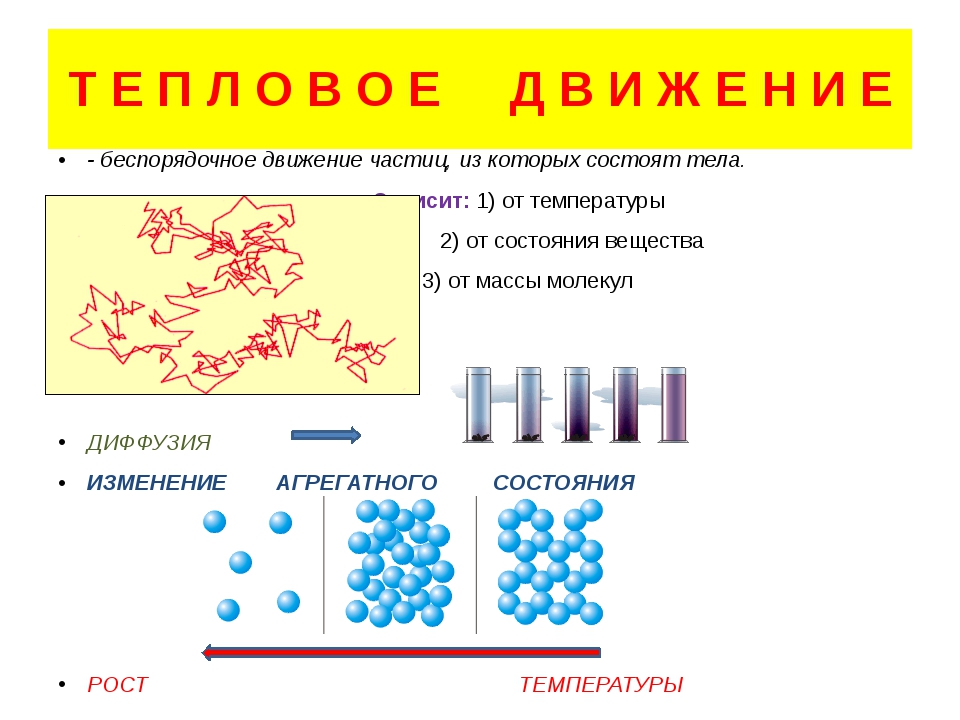 Если поместить газ непосредственно в очень холодную среду, он превратится в крошечные твердые частицы. Например, пары воды превращаются в кристаллы льда при температуре ниже 0 ° C.
Если поместить газ непосредственно в очень холодную среду, он превратится в крошечные твердые частицы. Например, пары воды превращаются в кристаллы льда при температуре ниже 0 ° C.
Изображение: Физика перехода между состояниями материи
ПЛАЗМА
Плазма является наиболее распространенным состоянием материи во Вселенной, но не очень распространенным на Земле.При очень большом количестве тепла газ может превратиться в плазму. В плазменном состоянии атомы ионизированы, , что отделяет электроны (отрицательный заряд) от ионов (положительный заряд).
Примеры плазмы в природе: молния, неоновый свет и электрические искры. Плазма также может быть произведена искусственно, наиболее распространенной технологией является приложение электрического тока через диэлектрический газ или жидкость.
Изображение: плазменная струя
Плазма может быть получена только из газов, а обратный процесс — только из плазмы в газ, посредством деионизации .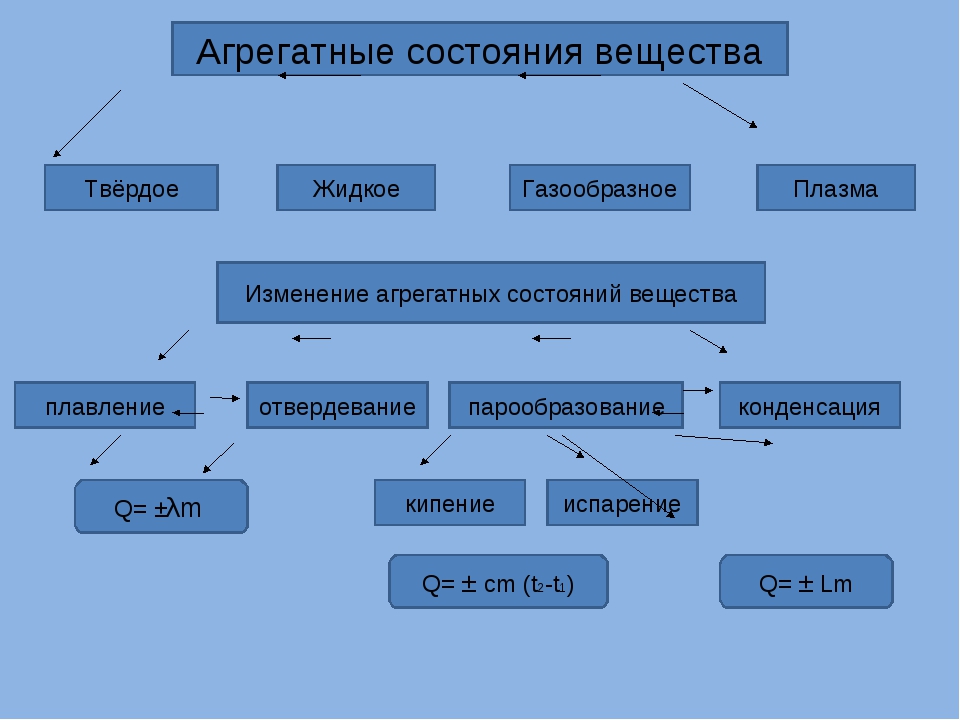
ФАЗОВЫЕ ДИАГРАММЫ
Превращение вещества лучше всего описывается на фазовых диаграммах . Эти диаграммы показывают равновесные фазы в зависимости от температуры и давления или состава вещества.
Простые фазовые диаграммы (2-D), которые легко понять, представляют собой диаграммы давление-температура одного простого вещества, например воды . Вертикальная ось соответствует давлению, а горизонтальная — температуре.Фазовая диаграмма показывает в пространстве давление – температура линии равновесия или фазовых границ между тремя фазами: твердым телом, жидкостью и газом.
Изображение: диаграмма фазовых границ материи (2-D)
Тройная точка представлена значением температуры ( T tp ) и давления ( p tp ), при которых все три фазы (газ, жидкость и твердое тело) этого вещества сосуществуют в термодинамическом равновесии. Для воды координаты тройной точки: 0. 01 ° C и 0,0061166 бар. На этом этапе, при небольших изменениях давления и температуры, можно превратить все вещество в лед, воду или пар.
01 ° C и 0,0061166 бар. На этом этапе, при небольших изменениях давления и температуры, можно превратить все вещество в лед, воду или пар.
Изображение: Фазовая диаграмма воды
Критическая точка определяет конец границы жидкости и пара. Он определяется критической температурой ( T cr ) и критическим давлением ( p cr ). В критической точке фазовая граница исчезает, жидкость и ее пар могут сосуществовать в одном и том же состоянии.Критическая точка для воды находится при 374 ° C и 220,888 бар. Вблизи критической точки вода становится сжимаемой, расширяемой, с плохой диэлектрической проницаемостью и плохим растворителем для электролитов. Выше критической точки вода становится сверхкритической жидкостью . Вещество в этом состоянии сочетает в себе свойства как жидкости, так и газа, и с помощью точной настройки температуры и давления можно управлять поведением, чтобы оно было более жидким или газообразным.
Вода (H 2 O) и диоксид углерода (CO 2 ) являются наиболее часто используемыми сверхкритическими жидкостями.
Изображение: Фазовая диаграмма давление-температура углекислого газа
Особым состоянием вещества являются конденсаты Бозе-Эйнштейна (БЭК) . При охлаждении вещества при чрезвычайно низких температурах (близких к абсолютному нулю, 0 K = -273,15 ° C) молекулярная вибрация почти полностью прекращается. Все атомы вещества собираются вместе, потому что нет кинетической энергии, чтобы разделить их, создав «суператом». Вещества BEC в основном используются для моделирования условий, которые могут возникнуть в черных дырах.
Для любых вопросов или замечаний относительно этого руководства, пожалуйста, используйте форму комментариев ниже.
Не забывайте ставить лайки, делиться и подписываться!
Материя: определение и пять состояний материи
Материя — это «вещество», из которого состоит Вселенная.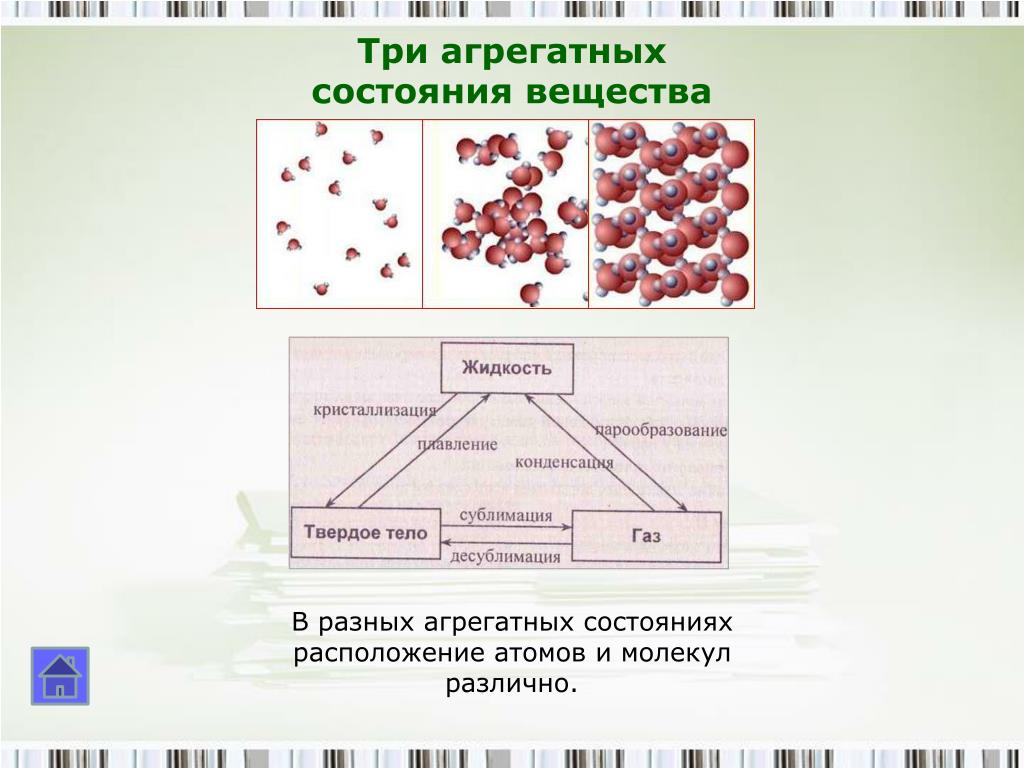 Все, что занимает пространство и имеет массу, является материей.
Все, что занимает пространство и имеет массу, является материей.
Вся материя состоит из атомов , которые, в свою очередь, состоят из протонов, нейтронов и электронов.
Атомы объединяются в молекулы, которые являются строительными блоками для всех типов материи, согласно Вашингтонского государственного университета .И атомы, и молекулы удерживаются вместе с помощью формы потенциальной энергии, называемой химической энергией. В отличие от кинетической энергии , , которая представляет собой энергию движущегося объекта, потенциальная энергия представляет собой энергию, запасенную в объекте.
Пять фаз материи
Существует четыре естественных состояния материи: твердые тела, жидкости, газы и плазма. Пятое состояние — это искусственные конденсаты Бозе-Эйнштейна.
Твердые тела
В твердом теле частицы плотно упакованы вместе, поэтому они мало двигаются.Электроны каждого атома постоянно находятся в движении, поэтому атомы имеют небольшую вибрацию, но они фиксируются в своем положении.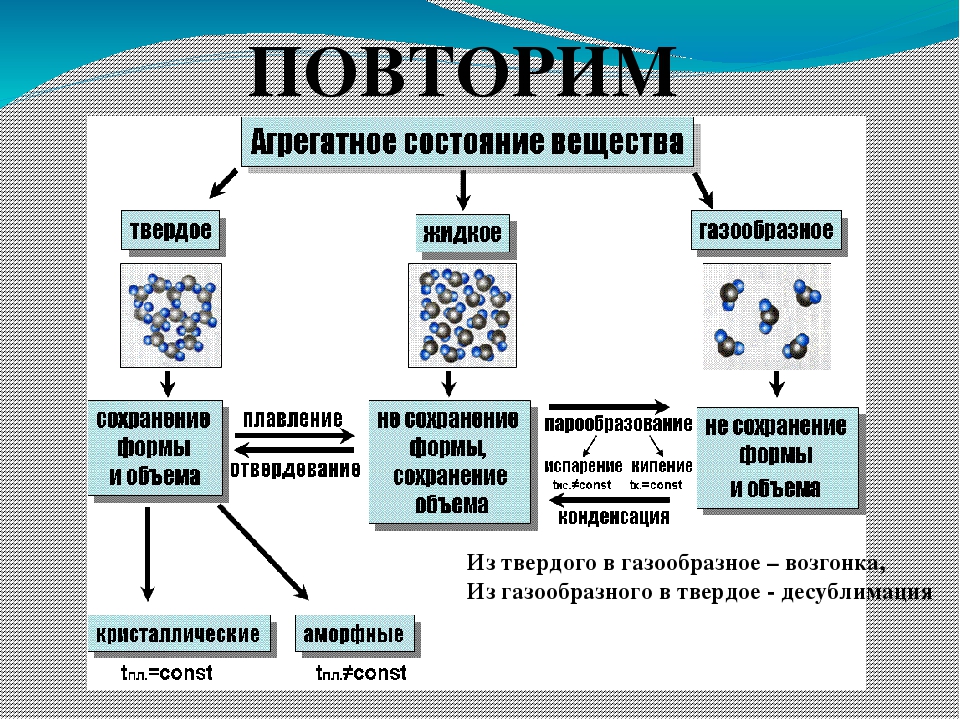 Из-за этого частицы в твердом теле имеют очень низкую кинетическую энергию.
Из-за этого частицы в твердом теле имеют очень низкую кинетическую энергию.
Твердые тела имеют определенную форму, а также массу и объем и не соответствуют форме контейнера, в который они помещены. Твердые вещества также имеют высокую плотность, что означает, что частицы плотно упакованы вместе.
Жидкости
В жидкости частицы плотнее упакованы, чем в твердом теле, и могут обтекать друг друга, придавая жидкости неопределенную форму.Таким образом, жидкость будет соответствовать форме емкости.
Как и твердые тела, жидкости (большинство из которых имеет более низкую плотность, чем твердые тела) невероятно трудно сжимать.
Газы
В газе частицы имеют большое пространство между собой и обладают высокой кинетической энергией. У газа нет определенной формы или объема. Если не ограничен, частицы газа будут распространяться бесконечно; если он ограничен, газ расширится, чтобы заполнить свой контейнер.Когда газ подвергается давлению за счет уменьшения объема контейнера, пространство между частицами уменьшается, и газ сжимается.
Плазма
Плазма не является обычным состоянием материи здесь, на Земле, но, по данным лаборатории Джефферсона , это может быть наиболее распространенное состояние материи во Вселенной. Звезды — это, по сути, перегретые шары плазмы.
Плазма состоит из сильно заряженных частиц с чрезвычайно высокой кинетической энергией.Благородные газы (гелий, неон, аргон, криптон, ксенон и радон) часто используются для создания светящихся знаков с помощью электричества для ионизации их до состояния плазмы.
Конденсат Бозе-Эйнштейна
Конденсат Бозе-Эйнштейна (BEC) был создан учеными в 1995 году. Используя комбинацию лазеров и магнитов, Эрик Корнелл и Карл Вейман, ученые Объединенного института лабораторной астрофизики ( JILA) в Боулдере, штат Колорадо, охладил образец рубидия с точностью до нескольких градусов от абсолютного нуля.При такой чрезвычайно низкой температуре движение молекул почти прекращается. Поскольку кинетическая энергия почти не передается от одного атома к другому, атомы начинают слипаться. Больше нет тысяч отдельных атомов, есть только один «суператом».
Поскольку кинетическая энергия почти не передается от одного атома к другому, атомы начинают слипаться. Больше нет тысяч отдельных атомов, есть только один «суператом».
BEC используется для изучения квантовой механики на макроскопическом уровне. Кажется, что свет замедляется при прохождении через BEC, что позволяет ученым изучать парадокс частицы / волны. БЭК также обладает многими свойствами сверхтекучей жидкости или жидкости, которая течет без трения.BEC также используются для моделирования условий, которые могут существовать в черных дырах.
Прохождение фазы
Добавление или удаление энергии из материи вызывает физическое изменение, когда материя перемещается из одного состояния в другое. Например, добавление тепловой энергии (тепла) к жидкой воде превращает ее в пар или пар (газ). А удаление энергии из жидкой воды превращает ее в лед (твердое тело). Физические изменения также могут быть вызваны движением и давлением.
Плавление и замерзание
Когда твердое тело нагревается, его частицы начинают вибрировать быстрее и отдаляться друг от друга. Когда вещество достигает определенной комбинации температуры и давления, его точка плавления , твердое вещество начинает плавиться и превращаться в жидкость.
Когда вещество достигает определенной комбинации температуры и давления, его точка плавления , твердое вещество начинает плавиться и превращаться в жидкость.
Когда два состояния вещества, например твердое и жидкое, находятся при равновесной температуре и давлении, дополнительное тепло, добавленное в систему, не приведет к увеличению общей температуры вещества до тех пор, пока весь образец не достигнет одинакового физического состояния. Например, если вы положите лед в стакан с водой и оставите его при комнатной температуре, лед и вода в конечном итоге достигнут одинаковой температуры.Поскольку лед тает от тепла, исходящего от воды, он будет оставаться при нуле градусов по Цельсию, пока весь кубик льда не растает, а затем продолжит нагреваться.
Когда тепло отводится от жидкости, ее частицы замедляются и начинают оседать в одном месте внутри вещества. Когда вещество достигает достаточно прохладной температуры при определенном давлении, точке замерзания, жидкость становится твердой.
Большинство жидкостей сжимаются при замерзании. Вода, однако, расширяется, когда замерзает в лед, заставляя молекулы раздвигаться дальше и уменьшать плотность, поэтому лед плавает поверх воды .
Добавление дополнительных веществ, таких как соль в воду, может изменить как температуру плавления, так и температуру замерзания. Например, добавление соли в снег снизит температуру замерзания воды на дорогах, что сделает его более безопасным для водителей.
Существует также точка, известная как тройная точка , где твердые тела, жидкости и газы существуют одновременно. Например, вода существует во всех трех состояниях при температуре 273,16 Кельвина и давлении 611,2 Па.
Большинство жидкостей сжимаются при замерзании, но вода расширяется, делая ее менее плотной, когда она становится льдом.Эта уникальная характеристика позволяет льду плавать в воде, как этот массивный айсберг в Антарктиде. (Изображение предоставлено NASA / Operation Icebridge)
Сублимация
Когда твердое вещество превращается непосредственно в газ, минуя жидкую фазу, этот процесс известен как сублимация.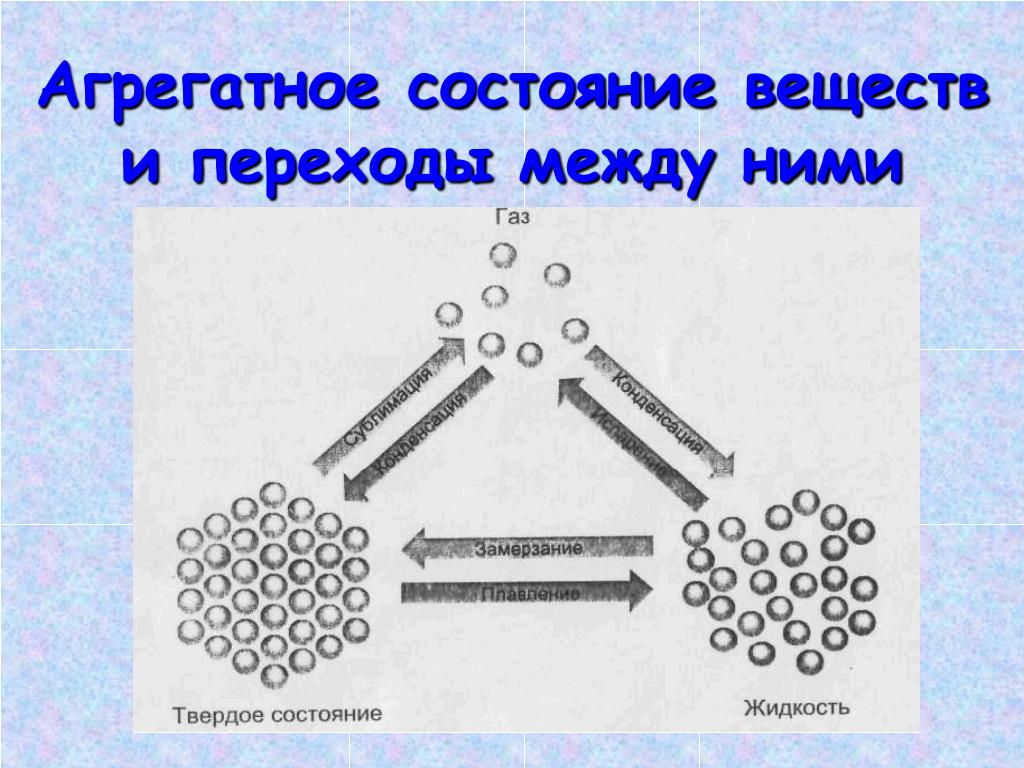 Это может происходить либо при быстром повышении температуры образца выше точки кипения (мгновенное испарение), либо при «лиофилизации» вещества путем охлаждения в условиях вакуума, так что вода в веществе подвергается сублимации и удаляется из него. пример.Некоторые летучие вещества подвергаются сублимации при комнатной температуре и давлении , например замороженный диоксид углерода или сухой лед.
Это может происходить либо при быстром повышении температуры образца выше точки кипения (мгновенное испарение), либо при «лиофилизации» вещества путем охлаждения в условиях вакуума, так что вода в веществе подвергается сублимации и удаляется из него. пример.Некоторые летучие вещества подвергаются сублимации при комнатной температуре и давлении , например замороженный диоксид углерода или сухой лед.
Испарение
Испарение — это превращение жидкости в газ, которое может происходить либо при испарении, либо при кипении.
Поскольку частицы жидкости находятся в постоянном движении, они часто сталкиваются друг с другом. Каждое столкновение также вызывает передачу энергии, и когда достаточно энергии передается частицам у поверхности, они могут быть полностью выбиты от образца в виде свободных частиц газа.По мере испарения жидкости охлаждаются, потому что энергия, передаваемая поверхностным молекулам, вызывающая их утечку, уносится вместе с ними.
Жидкость закипает, когда к жидкости добавляется достаточно тепла, чтобы вызвать образование пузырьков пара под поверхностью. Эта точка кипения представляет собой температуру и давление, при которых жидкость становится газом.
Эта точка кипения представляет собой температуру и давление, при которых жидкость становится газом.
Конденсация и осаждение
Конденсация происходит, когда газ теряет энергию и объединяется с образованием жидкости.Например, водяной пар конденсируется в жидкую воду .
Осаждение происходит, когда газ превращается непосредственно в твердое тело, минуя жидкую фазу. Водяной пар превращается в лед или иней, когда воздух, соприкасающийся с твердым телом, например травинкой, холоднее, чем остальной воздух.
Дополнительные ресурсы:
Эта статья была обновлена 21 августа 2019 г. участником Live Science Рэйчел Росс.
Теория химических расчетов | Агрегированные состояния вещества | Упражнения по химии
Вещество присутствует в природе в трех различных агрегатных состояниях вещества: твердом, жидком и газообразном.Твердые тела имеют фиксированную форму и объем. Жидкости имеют фиксированный объем, но их форма соответствует форме их контейнера. Газы не имеют выхода или определенного объема, регулируя в обоих случаях их емкость. Эти два свойства, форма и объем, которые служат для различения трех агрегатных состояний, зависят от сил притяжения между составляющими частицами вещества и относительного упорядочения указанных частиц.
Газы не имеют выхода или определенного объема, регулируя в обоих случаях их емкость. Эти два свойства, форма и объем, которые служат для различения трех агрегатных состояний, зависят от сил притяжения между составляющими частицами вещества и относительного упорядочения указанных частиц.
ЗАКОНЫ О ГАЗАХ
Объем V любого вещества (твердого, жидкого или газообразного) является функцией количества вещества, которое может быть выражено через число молей n давления p и температуры T.
Закон Бойля-Мариотта
«При постоянной температуре и фиксированной массе газа занимаемый объем обратно пропорционален давлению».
Bioprofe | Теория агрегации состояний вещества | 01
Это более известно по выражению:
Bioprofe | Теория агрегации состояний вещества | 02
Где V — объем, занимаемый при давлении P, а V´ — объем, занимаемый при давлении P ’.
Закон Шарля-Гэя Люссака
«При постоянном давлении и фиксированной массе газа занимаемый объем прямо пропорционален температуре».
Bioprofe | Теория агрегации состояний вещества | 03
«При постоянном объеме и фиксированной массе газа давление прямо пропорционально температуре».
Bioprofe | Теория агрегации состояний вещества | 04
Уравнение состояния идеальных газов.
Законы Бойля-Мариотта и Шарля-Гей-Люссака можно объединить в одно выражение, получив таким образом соотношение между объемом данной массы газа, давлением и температурой.
Bioprofe | Теория агрегации состояний вещества | 05
Применение закона Авогадро:
Bioprofe | Теория агрегации состояний вещества | 06
Bioprofe | Теория агрегации состояний вещества | 07
Закон Дальтона.
«Общее давление p, оказываемое смесью газов, равно сумме парциальных давлений p I , которые оказывал бы каждый газ, если бы он был только компонентом в том же контейнере».
Bioprofe | Теория агрегации состояний вещества | 08
(p = общее давление смеси; p i = парциальное давление каждого газа x i = мольная доля каждого газа).
Кажущаяся молекулярная масса газовой смеси, М:
Bioprofe | Теория агрегации состояний вещества | 09
(M i = молекулярная масса каждого газа; n i = количество молей каждого газа; V i = объем для каждого газа; V = объем смеси).
Кинетическая энергия 1 моля идеального газа:
Bioprofe | Теория агрегации состояний вещества | 10
СКОРОСТНЫЕ МОЛЕКУЛЫ
Среднеквадратичная скорость газа:
Bioprofe | Теория агрегации состояний вещества | 11
Средняя скорость газа:
Bioprofe | Теория агрегации состояний вещества | 12
Наиболее вероятная скорость газа:
Bioprofe | Теория агрегации состояний вещества | 13
Взаимосвязь между различными скоростями:
Bioprofe | Теория агрегации состояний вещества | 14
ТРАНСЛЯЦИЯ ГАЗА
Закон Грэма:
«Скорость диффузии или истечения газов, v, обратно пропорциональна квадратным корням из их плотностей или молекулярных масс».
Bioprofe | Теория агрегации состояний вещества | 15
РЕАЛЬНЫЕ ГАЗЫ
Уравнение Ван-дер-Ваальса для 1 моля газа:
Bioprofe | Теория агрегации состояний вещества | 17
(a / V 2 = внутреннее давление газа; b = covolume).
Связь между a, b и R и постоянная критика:
Bioprofe | Теория агрегации состояний вещества | 16
ФАЗЫ ГИББСА ПРАВИЛО:
F + L = C + 2
(F = количество фаз; L = количество степеней свободы; C = количество компонентов).
Твердое, жидкое, газовое и плазменное
Материя находится в четырех состояниях: твердое тело, жидкость, газ и плазма. Часто состояние вещества вещества можно изменить, добавляя или удаляя от него тепловую энергию. Например, добавление тепла может растопить лед в жидкую воду и превратить воду в пар.
Ключевые выводы: состояния материи
- Материя имеет массу и занимает место.
- Четыре основных состояния материи: твердое тело, жидкость, газ и плазма.
- В исключительных условиях существуют и другие состояния материи.
- Твердое тело имеет определенную форму и объем. Жидкость имеет определенный объем, но принимает форму своего сосуда. У газа нет определенной формы или объема. Плазма похожа на газ тем, что ее частицы очень далеко друг от друга, но газ электрически нейтрален, а плазма имеет заряд.
Что такое состояние вещества?
Слово «материя» относится ко всему во Вселенной, имеющему массу и занимающему пространство.Вся материя состоит из атомов элементов. Иногда атомы тесно связаны друг с другом, а в других случаях они широко разбросаны.
Состояния материи обычно описываются на основе качеств, которые можно увидеть или почувствовать. Материя, которая на ощупь тверда и сохраняет фиксированную форму, называется твердым телом; Вещество, которое на ощупь влажное и сохраняет свой объем, но не форму, называется жидкостью. Вещество, которое может изменять форму и объем, называется газом.
Некоторые вводные тексты по химии называют твердые тела, жидкости и газы тремя состояниями материи, но тексты более высокого уровня признают плазму как четвертое состояние материи.Подобно газу, плазма может изменять свой объем и форму, но, в отличие от газа, она также может изменять свой электрический заряд.
Один и тот же элемент, соединение или раствор могут вести себя по-разному в зависимости от состояния вещества. Например, твердая вода (лед) кажется жесткой и холодной, а жидкая вода влажной и подвижной. Однако важно отметить, что вода — это очень необычный тип вещества: вместо того, чтобы сжиматься, когда она образует кристаллическую структуру, она фактически расширяется.
Твердые
Твердое тело имеет определенную форму и объем, потому что молекулы, составляющие твердое тело, плотно упакованы вместе и медленно движутся.Твердые вещества часто бывают кристаллическими; примеры кристаллических твердых веществ включают поваренную соль, сахар, алмазы и многие другие минералы. Иногда при охлаждении жидкостей или газов образуются твердые вещества; лед — это пример застывшей охлажденной жидкости. Другие примеры твердых тел включают дерево, металл и камень при комнатной температуре.
Жидкости
Жидкость имеет определенный объем, но принимает форму своего сосуда. Примеры жидкостей включают воду и масло. При охлаждении газы могут переходить в жидкое состояние, как в случае водяного пара.Это происходит, когда молекулы газа замедляются и теряют энергию. Твердые вещества могут разжижаться при нагревании; Расплавленная лава является примером твердой породы, которая стала жидкой в результате сильной жары.
Газы
У газа нет ни определенного объема, ни определенной формы. Некоторые газы можно увидеть и почувствовать, в то время как другие неосязаемы для человека. Примеры газов: воздух, кислород и гелий. Атмосфера Земли состоит из газов, включая азот, кислород и углекислый газ.
Плазма
Плазма не имеет определенного объема и определенной формы. Плазма часто встречается в ионизированных газах, но она отличается от газа, потому что обладает уникальными свойствами. Свободные электрические заряды (не связанные с атомами или ионами) делают плазму электропроводной. Плазма может быть образована путем нагревания и ионизации газа. Примеры плазмы включают звезды, молнии, флуоресцентные лампы и неоновые вывески.
Другие состояния материи
Ученые постоянно открывают новые состояния материи! В дополнение к четырем основным состояниям материи, другие состояния включают сверхтекучесть, конденсат Бозе-Эйнштейна, фермионный конденсат, ридберговские молекулы, квантовое состояние Холла, фотонную материю и капельницу.
Источники
- Гудштейн, Д.Л. (1985). Состояния Материи . Дувр Феникс. ISBN 978-0-486-49506-4.
- Murthy, G .; и другие. (1997). «Сверхтекучие жидкости и сверхтвердые тела на фрустрированных двумерных решетках». Физический обзор B . 55 (5): 3104. DOI: 10.1103 / PhysRevB.55.3104
- Саттон, А.П. (1993). Электронная структура материалов . Оксфордские научные публикации. ISBN 978-0-19-851754-2.
- Вахаб, М.А. (2005). Физика твердого тела: структура и свойства материалов . Альфа-наука. ISBN 978-1-84265-218-3.
Твердое, жидкое и газообразное агрегатное состояние — пример содержания …
Контекст 1
… химия и естественные науки в целом, экспериментальная и лабораторная работа является одним из наиболее эффективных методов получения знание. Экспериментальные работы можно разделить на реальные и виртуальные.Классическая экспериментальная работа — это самый известный метод практической работы, который чаще используется при преподавании естественных наук и химии в начальной школе. Ученики тренируются, используя свои ручные навыки, развивая свои способности описывать химические изменения, узнавая о физических и химических свойствах материи, развивая навыки безопасности на работе в школьной лаборатории, укрепляя и дополняя свои знания, умения и навыки, а также разрабатывая экспериментальные подход как форма исследовательской работы.Однако материально-технические ограничения (особенно связанные с финансированием школьной науки) существенно ограничивают возможности школ поддерживать высококачественный практический опыт. Количество экспериментов, проводимых в школах и университетах, обычно ограничено из-за соображений безопасности, отсутствия адекватной инфраструктуры, оборудования, из-за ограничений во времени и пространстве, а также из-за низкой точности выполнения экспериментальных упражнений (Sokoutis 2003). Всего этого можно избежать, экспериментируя с виртуальной лабораторией.Виртуальные лабораторные занятия проводятся в виртуальном мире. Виртуальная лаборатория дает много преимуществ. Вы можете проводить опасные эксперименты, не подвергая опасности себя и других. Симуляторы доступны по цене. После разработки их можно выполнять без дополнительных затрат столько раз, сколько вы захотите. Результаты всегда одни и те же. Виртуальная лаборатория позволяет выполнять независимую или совместную работу, которая не обязательно связана только с уроком, школьной лабораторией или доступными химическими веществами и лабораторным оборудованием.Использование виртуальных лабораторий на уроках естествознания, особенно на уроках химии, обеспечивает определенные преимущества и возможность представить учебный материал на макроскопическом, символическом и субмикроскопическом уровнях. Нет явного преимущества виртуальных экспериментов над экспериментами в реальном мире. Некоторые исследователи предполагают, что виртуальные эксперименты, используемые с практическими экспериментами в реальном мире, могут дать лучший опыт (Martinez-Jimenez et al., 2003; Georgiou et al., 2008; Domingues et al., 2010). Многие исследования (Hartley 1988; Baker 1991; Lelouche, 1998) показали полезность компьютеров в процессе естественнонаучного образования: в качестве интерактивного средства коммуникации, обеспечивающего доступ ко всем видам информации (текстам, изображениям, различным типам данных, графике и т. Д.) . Большинство исследователей, использующих компьютер, при изучении науки получали лучшие результаты и улучшали отношение к науке, если они проводили компьютерные классы. (Дори и Барнеа 1997; Чу и Люнг 2003; Кочьянчич и О’Салливан 2004; Келлер 2005; Раджендран и др.2010; Барак и Дори 2011). Мультимедийное отображение эксперимента помогает ученикам достичь более высоких когнитивных уровней, таких как оценка, анализ и синтез знаний (Kirscher and Huisman 1998). Соответственно, Барак и Дори (2005) обнаружили, что использование визуальных представлений, таких как компьютеризированные молекулярные модели, улучшило способности учащихся к визуализации, концептуальному пониманию и навыкам моделирования. То же самое утверждал Хан (2011). Более того, анимация субмикроскопического мира частиц гораздо более пригодна, чем статические субмикропрезентации (Williamson & Abraham, 1995; Russell et al., 1997; Sanger et al., 2000; Ян и др., 2003). Шноц и Раш (2005) утверждали, что анимация может нести в себе потенциал неправильных представлений, поскольку в большинстве случаев они представляют собой упрощенную версию явления. Виртуальные химические лаборатории предлагают новую форму обучения. Цель виртуальной реальности — обеспечить реалистичное моделирование химических процессов, чтобы учащиеся активно участвовали в процессе обучения и запоминали больше благодаря собственному активному участию. Crocodile Clips разрабатывает образовательное программное обеспечение для начальных и средних школ.Препараты Crocodile Clips рекомендуются учителями во всем мире как новаторские подходы к обучению. Новое поколение образовательных инструментов представляет Енка. Виртуальная химическая лаборатория Crocodile Clips Chemistry обеспечивает безопасную демонстрацию экспериментов. Программа может служить педагогическим инструментом для демонстрации экспериментов при фронтальном методе обучения. Он адаптирован для работы на интерактивной доске. Эта программа также позволяет ученикам работать независимо или в группах, где интерфейс постепенно ведет их шаг за шагом через виртуальный эксперимент.Учащиеся или учителя могут найти готовые сборники экспериментов (рис. 1). Можно также использовать оборудование, стеклянную посуду и химикаты для постановки эксперимента. В программе есть возможность изменять существующие эксперименты. Ученики или учителя могут адаптировать существующий эксперимент, изменяя различные параметры, такие как температура, масса и концентрация элементов. Можно обнаружить более сотни различных химикатов, слишком опасных для школьной лаборатории. Тем не менее, это приложение по сравнению с виртуальной реальностью имеет некоторые недостатки, такие как: ограничения во взаимодействии и навигации, а также нереалистичное представление моделей.В представленном исследовании изучалось влияние виртуальной лаборатории на химические знания школьников 12-13 лет, посещающих научные классы в Словении. Исследование ограничивалось двумя темами изучения химии: свойствами и изменениями веществ и чистыми веществами и соединениями, которые ученики седьмого класса изучают и понимают на субмикроскопическом уровне. Согласно словенской системе образования, понятие чистых веществ, соединений и веществ, их свойств и изменений вводится в 4 классе (9 лет) младшей начальной школы на макроскопическом уровне, а затем повышается до 7 класса (12 лет). где тема затем вводится на субмикроскопическом уровне.Обязанность учителя — представить эти темы химического обучения на субмикроскопическом уровне. На субмикроскопическом уровне соответствующие изображения атомов, ионов или молекул можно увидеть с помощью виртуальной лабораторной анимации. На рисунке 2 показана роль виртуальной лаборатории и ее визуализационный материал, который объединяет все три уровня интерактивной формы. Отображение изменений на динамическом субмикроскопическом уровне и использование элементов визуализации может преодолеть разрыв между макро- и микромирами, что приведет к лучшему пониманию учебного материала.Мы можем визуализировать субмикро-демонстрации с помощью статического 2D или 3D изображения. Мы можем продемонстрировать с помощью анимации субмикро-презентации как динамические или даже h2: мы предположили, что студенты экспериментальной группы (ЭГ), где субмикроуровень был представлен динамически с помощью виртуальной лаборатории, будут иметь преимущество. по сравнению с учащимися контрольной группы (КГ) в отношении знания выбранных тем в химической науке h3: мы предположили, что ученики ЭГ по сравнению с учениками КГ будут иметь преимущество по воспроизводству знаний h4: мы предположили, что ученики ЭГ по сравнению с КГ ученики будут иметь преимущество в соответствии с пониманием концепций h5: мы предположили, что студенты EC / EG по сравнению со студентами CG будут иметь преимущество в соответствии с использованием химических знаний на уроках естествознания.Чтобы изучить влияние результатов занятий при использовании виртуальных лабораторий, мы использовали экспериментальный метод из традиционных эмпирически-аналитических исследований в области образования. Нас интересовало влияние на знания учеников, когда субмикроуровень представлен динамически с помощью виртуальной лаборатории. Знания отражаются на трех уровнях: воспроизведение, понимание и применение знаний. На уроках естествознания был проведен образовательный эксперимент, включающий химический состав, который ученики изучают в седьмом классе: 1.Вещества, их свойства и изменения и 2. Чистые вещества и соединения. Мы разработали однофакторный эксперимент с параллельными классами сравниваемых групп (экспериментальные (EG) и контрольные группы (CG)) и одним неэкспериментальным фактором (предыдущий socre). На основе предыдущей оценки мы составили экспериментальную и контрольную группы таким образом, чтобы их было равным. Обе группы студентов изучали новые материальные соединения с точки зрения их научных знаний (химическая часть), выраженных как: их общие баллы в тесте по естественным наукам, и их результаты проверки научных знаний по трем уровням таксономии Блума. : знание, понимание и применение знаний.В этом дидактическом эксперименте приняли участие 109 учеников (N = 109) из пяти разных школ на северо-востоке Словении (Таблица 1). Мы включили учеников седьмого класса в возрасте одиннадцати и двенадцати лет. Модель, использованная во время дидактического эксперимента, не была случайной. Ученики были разделены на экспериментальную (ЭГ) и контрольную группы (КГ). Отобранная группа студентов представляла в контексте проверки статистических гипотез случайную выборку из гипотетической совокупности. Данные были собраны путем проверки знаний учащихся после уроков.Кроме того, мы провели рациональную и эмпирическую проверку тестов. Рациональная проверка была основана на оценке соответствия содержания и дизайна теста. Для эмпирической проверки мы использовали решение факторного анализа, а именно процент вариаций, объясненных первым общим фактором (%, например, вариация F1). Учитывая, что первый фактор объяснил 24,5% дисперсии и был выше предела критерия для нижнего предела (20%), мы …
Состояния Материи Факты | Интересные факты о детях
Отправьте эту статью по электронной почте или поделитесь ею!
Давайте узнаем некоторые факты о состояниях материи.Когда вы закончите читать статью, просмотрите наш лист вопросов в разделе действий, чтобы проверить свои знания.
Matter — это все, с чем мы сталкиваемся в своей жизни, например, воздух, которым вы дышите, одежда, которую вы носите, прохладительные напитки — буквально все!
На самом деле, знаете ли вы, что вы тоже сделаны из материи?
Когда мы говорим о состояниях материи, мы в основном говорим о твердых телах, жидкостях и газах.
Есть и менее распространенные, их называют плазменными и лучевыми.
Понимание некоторых задействованных слов
Когда мы говорим о состояниях материи, для вас важно понимать, что означают некоторые слова, которые используются довольно часто. Одно из этих слов — молекула .
Молекулы состоят из двух или более атомов. Атомы — это крошечные частицы или строительные блоки, из которых состоит вещество. Все, что вы видите или представляете, состоит из чего-то.
Итак, атомы, собранные вместе, образуют молекулы, которые образуют клетки, из которых формируются наши органы, наше население, наши планеты и галактики и так далее.
Еще одно слово для объяснения — электрон. Электрон — это крошечный кусок электричества, который слишком мал, чтобы его можно было увидеть даже в микроскоп.
Каковы различные состояния материи?
Твердые вещества
Твердые тела — это объекты, которые сохраняют свою форму и не текут при заданной температуре. Лед твердый, но когда он тает, он становится жидкостью. Другими примерами твердых тел являются автомобили, книги и одежда.
Твердые тела могут быть разного цвета и текстуры, и им можно придать разные формы, например глину.Твердые тела состоят из молекул, которые группируются и не перемещаются.
Жидкости
Жидкости не имеют собственной формы, но могут принимать форму емкости, в которой они находятся, и могут течь при заданной температуре. Примеры жидкостей — чай, вода и кровь.
Они могут быть разного цвета и толщины; например, заварной крем — более густая жидкость, чем чай, и течет не так быстро, как чай.
Вы можете отмерить жидкость чашкой или ложкой.Жидкости состоят из молекул, которые расположены дальше друг от друга, чем в твердых телах, и могут легко перемещаться.
Газы
Газы представляют собой воздухоподобные вещества, которые могут свободно перемещаться или течь, чтобы поместиться в контейнер, и они не имеют собственной формы. Вы можете пропустить рукой газы, и вы их не почувствуете.
Если они достанут свой контейнер, они могут легко распространиться. В воздухе, которым мы дышим, нас окружают разные газы.
Нельзя залить газ в мерный стакан, чтобы измерить его объем; это должно быть вычислено с использованием математической формулы.Их молекулы разнесены и покачиваются.
Плазма
Плазма не встречается в обычной повседневной жизни, в отличие от твердых тел, жидкостей и газов, и это газы, но не совсем то же самое.
Плазма называется ионизированным газом, что означает, что при нагревании до очень высоких температур некоторые электроны отрываются от ядра атомов (ядер) или молекул, чтобы присоединиться к другим ядрам.
Это меняет способ построения атома или молекулы, и они ведут себя по-другому и непредсказуемо.
Балка
Луч — это состояние материи, которого ученые на самом деле не понимают. Самая важная вещь о материи пучка заключается в том, что способ ее создания отличается от твердых тел, жидкостей, газа и плазмы.
Их частицы действуют бессмысленно, тогда как в состоянии пучка частицы действуют вместе для достижения одного и того же конца. Также отсутствует обмен тепловой энергией, как с твердыми телами, жидкостями, газом и плазмой.
Теперь это все, что вам нужно знать о материи.Вы можете впечатлить своего учителя естествознанием своими новыми знаниями!
Время активности — проверьте свои знания!
Проверьте свои знания по этому предмету с помощью нашей инструкции для использования в классе или дома: Вопросы о состояниях материи (все ответы на этой странице)
Следующая тема: Слои Земли Факты
Химия
Физическое состояние — zxc.wiki
Состояния агрегации — это различные состояния вещества, которые могут преобразовываться друг в друга посредством простых изменений температуры или давления.Существует три классических состояния агрегации , твердое тело , жидкое и газообразное, , а также другие неклассические состояния в физике, такие как B. плазма.
Фаза, используемая в термодинамике, имеет более узкое определение, в частности, она подразделяет твердое состояние в соответствии с его внутренней структурой.
Какое агрегатное состояние или какая фаза является стабильной в зависимости от давления и температуры, показано на фазовой диаграмме.
Три классических агрегатных состояния
Частота агрегатных состояний элементов в зависимости от температуры (синий: твердое тело, красный: жидкость, зеленый: газообразное состояние)
Существует три классических агрегатных состояния:
- твердый ( f альтернативно s ): В этом состоянии вещество обычно сохраняет как форму, так и объем; см. твердые тела .
- жидкость ( fl альтернативно l ): здесь сохраняется объем, но форма нестабильна и адаптируется к окружающему пространству; см. жидкость .
- газообразный ( г ): Здесь тоже нет стабильности объема, газ полностью заполняет доступное пространство; см. газ .
Для твердых и жидких веществ существует собирательный термин «конденсированное вещество».
В случае твердых тел различие проводится также по другим характеристикам:
Частичная модель состояний
Классические агрегатные состояния можно объяснить с помощью модели частиц, которая сводит мельчайшие частицы вещества (атомы, молекулы, ионы) к маленьким сферам.
Средняя кинетическая энергия всех частиц является мерой температуры во всех состояниях. Тип движения в трех агрегатных состояниях совершенно разный. В газе частицы движутся по прямой, как бильярдные шары, пока не столкнутся с другим или со стенкой сосуда. В жидкости частицы должны протискиваться через промежутки между своими соседями (диффузия, броуновское движение молекул). В твердом теле частицы колеблются только вокруг своего положения покоя.
Крепко
Модель кристаллического твердого тела
Move
Мельчайшие частицы твердого тела движутся незначительно. Они вращаются вокруг фиксированного положения, своего положения на сетке, и в основном вращаются вокруг своих осей. Чем выше температура, тем сильнее они вибрируют или вращаются, и расстояние между частицами (обычно) увеличивается. Исключение: аномалия плотности.
- Форма твердого тела не изменилась.
- Вещества в твердом агрегатном состоянии трудно расщепить.
- Они трудно деформируются (плохая деформируемость, хрупкость).
Примечание. Если взглянуть на частицы с помощью принципов квантовой механики, то из-за принципа неопределенности Гейзенберга частицы никогда не должны стоять на месте. У них есть небольшие колебания, которые также известны как колебания нулевой точки. Это соответствует основному состоянию гармонического осциллятора.
аттракцион
Между мельчайшими частицами действуют различные силы, а именно силы Ван-дер-Ваальса, электростатические силы между ионами, водородными связями или ковалентными связями.Тип силы определяется атомной структурой частиц (ионы, молекулы, диполи …). Притяжение особенно сильно к материалам, твердым даже при высоких температурах.
расположение
Из-за слабого движения и прочного сцепления частицы располагаются равномерно.
- Таким образом, большинство твердых веществ имеют правильную структуру (кристалл), лишь некоторые из них являются аморфными.
- Расположение частиц в аморфном твердом теле неупорядочено так же, как и в жидкости, но оно стабильно по размерам, поскольку движения частиц друг относительно друга в значительной степени заморожены.
расстояние
Из-за сильного притяжения частицы расположены близко друг к другу (высокая плотность упаковки)
Жидкость
Модель частиц жидкости или аморфного твердого тела
Move
Частицы не неподвижны, как в случае с твердыми телами, но могут перемещаться друг с другом. Когда температура повышается, частицы движутся все быстрее и быстрее.
аттракцион
Из-за нагрева движение частиц настолько велико, что сил взаимодействия уже недостаточно, чтобы удерживать частицы на своем месте.Теперь частицы могут двигаться свободно.
- Жидкое вещество распространяется само по себе, если оно не находится в контейнере.
- Краситель распределяется в жидкости (диффузия).
расстояние
Хотя более быстрое движение увеличивает расстояние между частицами (большинство твердых тел при плавлении занимают большее пространство), частицы остаются прикрепленными друг к другу. То же самое относится к уменьшению объема жидкости за счет сжатия, как и в случае твердого тела, в результате чего задействуется соответствующий модуль сжатия жидкости.При понижении температуры объем также становится меньше, но в случае воды только до температуры 4 ° C (аномалия воды), а ниже объем снова увеличивается до 0 ° C.
расположение
Хотя частицы постоянно перестраиваются и дрожат / вращаются, их расположение можно определить. Этот ближний порядок аналогичен таковому в аморфном твердом теле, но его вязкость намного ниже, т.е. частицы H более подвижны.
Газообразный
Move
В случае веществ в газообразном состоянии частицы перемещаются быстро.Газ или газообразное вещество быстро распространяется в помещении. В замкнутом пространстве удары мельчайших частиц о стенки приводят к давлению газа.
аттракцион
В газообразном состоянии кинетическая энергия мельчайших частиц настолько высока, что они не слипаются. Мельчайшие частицы газообразного вещества равномерно распределяются по всему доступному пространству.
расстояние
Быстрое движение частиц в газе означает, что они далеко друг от друга.Они только время от времени сталкиваются друг с другом, но остаются на большом расстоянии по сравнению с жидкой фазой. Газообразное вещество можно сжимать, т.е. Х. громкость можно уменьшить.
расположение
Из-за движения частицы неупорядочены.
В физической химии проводится различие между паром и газом. С физической точки зрения оба являются не чем иным, как газообразным агрегатным состоянием; термины также не имеют прямого отношения к реальному газу и идеальному газу.То, что в просторечии называется как «пар», с физической точки зрения представляет собой смесь жидких и газообразных компонентов, которая в случае воды называется влажным паром.
Пар в более узком смысле — это состояние равновесия между жидкой и газовой фазами. Его можно сжижать без необходимости выполнять какую-либо работу, то есть при его сжижении давление не увеличивается. В технике этот тип пара называется влажным паром, в отличие от так называемого перегретого пара или перегретого пара, который на самом деле представляет собой настоящий газ, состоящий из молекул воды, и температура которого выше температуры конденсации жидкой фазы при соответствующем давлении. .
Избранные основные вещества в качестве примеров
Чистые вещества называются твердыми, жидкими или газообразными в зависимости от их физического состояния при температуре 20 ° C (см. Комнатная температура) и давлении 1013,25 гПа (нормальное давление). Пример: бром находится в жидком состоянии при комнатной температуре и нормальном давлении (см. Таблицу), поэтому бром считается жидкостью.
Эти обозначения (твердое тело, жидкость, газ) также используются, когда вещества принимают другое физическое состояние при изменившихся условиях.Однако в более узком смысле классификация относится к стандартным условиям, упомянутым выше; тогда каждое вещество относится к одной из категорий.
| материал | Температура плавления 1 | Точка кипения 1 | Физическое состояние в морозильной камере (−10 ° C) 1 | Физическое состояние при комнатной температуре (25 ° C) 1 | Физическое состояние в духовке (150 ° C) 1 |
|---|---|---|---|---|---|
| утюг | 1535 ° С | 2750 ° С | твердо | твердо | твердо |
| медь | 1084 ° С | 2567 ° С | твердо | твердо | твердо |
| Цезий | 28 ° С | 671 ° С | твердо | твердо | жидкость |
| кислород | −219 ° С | −183 ° С | газообразный | газообразный | газообразный |
| гелий | −272 ° С | −269 ° С | газообразный | газообразный | газообразный |
| бром | −7 ° С | 59 ° С | твердо | жидкость | газообразный |
| хлор | −101 ° С | −35 ° С | газообразный | газообразный | газообразный |
| вода | 0 ° С | 100 ° С | твердо | жидкость | газообразный |
1 при нормальном давлении
Физические состояния в смесях
При смешивании веществ образуются характерные смеси, например туман или пена, в зависимости от физического состояния компонентов и их количественного соотношения.
Изменение физического состояния
Переходы между различными агрегатными состояниями имеют специальные названия (eoc, omc, eon) и особые условия перехода, которые в случае чистых веществ состоят из давления и температуры. Эти условия перехода соответствуют точкам на линиях фазовых границ фазовых диаграмм. Определенное количество тепла требуется для каждого фазового перехода или выделяется в процессе.
Сублимация и испарение также происходят ниже точки сублимации или кипения.Здесь говорится об испарении.
Примеры на каждый день
Сроки изменения агрегатного состояния воды
Все переходы можно наблюдать на примере воды в повседневной жизни (см. Рисунок):
Расплав
Снег или лед начинают становиться жидкими весной, как только температура поднимается выше температуры таяния.
Заморозить
Если вода в озерах охлаждается ниже точки замерзания, образуются кристаллы льда, которые со временем становятся все больше и больше, пока поверхность не покроется слоем льда.
Испарение
Если вода в кастрюле нагревается выше точки кипения, вода становится газообразной. «Пузырьки» в кастрюле возникают из-за того, что вода на горячем дне кастрюли сначала достигает температуры кипения — поднимающиеся пузырьки представляют собой водяной пар, который (как и большинство газообразных веществ) невидим. Испарение , переход из жидкой в газообразную форму без достижения точки кипения, можно легко наблюдать при потоотделении на коже.
Конденсированный
Отчетливо видимый туман над кипящей водой, который обычно в просторечии называют «паром», представляет собой водяной пар, сконденсированный в крошечные капли воды. Роса и облака также создаются за счет конденсации водяного пара.
сублимация
Замерзшие лужи могут постепенно «высыхать» в результате сублимации зимой даже при температурах значительно ниже точки замерзания, пока лед полностью не сублимируется и лужа не исчезнет.
Повторная сублимация
Иней или ледяные цветы, образующиеся зимой, вызваны водяным паром, который повторно сублимируется из окружающего воздуха.
Частичная модель фазовых переходов
Расплав
При повышении температуры (добавлении тепловой энергии) мельчайшие частицы перемещаются все более и более сильно, и их расстояние друг от друга (обычно) увеличивается. Силы Ван-дер-Ваальса по-прежнему удерживают их на своих местах, в своих решетках. Только из-за так называемой температуры плавления амплитуда колебаний частиц становится настолько большой, что структура решетки частично разрушается. Создаются группы частиц, которые могут свободно перемещаться.В них существует ближний порядок, в отличие от дальнего порядка частиц внутри кристаллической решетки твердых веществ.
Заморозить
При понижении температуры движение частиц уменьшается, и их расстояние друг от друга становится все меньше и меньше. Энергия вращения также уменьшается. При так называемой температуре затвердевания расстояние становится настолько маленьким, что частицы блокируют друг друга и взаимодействуют друг с другом более привлекательным образом — они занимают фиксированное положение в трехмерной решетке.
Есть жидкости, которые расширяются при понижении температуры, например вода. Такое поведение известно как аномалия плотности.
Испарение и сублимация
Скорость мельчайших частиц не одинакова. Часть быстрее, часть медленнее, чем в среднем. Частицы постоянно меняют свою текущую скорость из-за столкновений.
На границе твердого тела или жидкости, при переходе фазы в газообразную, может случиться так, что частица получит такой сильный импульс от своих соседей, что она вырвется из области влияния когезионной сила .Затем эта частица переходит в газообразное состояние и забирает с собой некоторую тепловую энергию в виде кинетической энергии, то есть твердая или жидкая фаза немного остывает.
Если в систему подводится тепловая энергия и температура достигает температуры сублимации или кипения, этот процесс происходит непрерывно, пока все мельчайшие частицы не перейдут в газовую фазу. В этом случае температура в испаряющейся фазе обычно остается неизменной до тех пор, пока все частицы с более высокой температурой не исчезнут из системы.Таким образом, подача тепла преобразуется в увеличение энтропии.
Если силы сцепления очень велики, или если это на самом деле гораздо более прочная металлическая или ионная связь, то испарения нет.
Сильное увеличение объема вещества из-за испарения может привести к физическому взрыву, если внезапно приложить много тепла.
Конденсация и повторная сублимация
Обратный процесс — это конденсация или повторная сублимация. Крошечная частица сталкивается с твердым или жидким веществом, передает свой импульс и удерживается на месте силами сцепления.В результате тело нагревается энергией, которую мельчайшая частица несет больше, чем среднее значение мельчайших частиц в твердой или жидкой фазе.
Однако, если частица исходит из газообразного вещества при этой температуре, силы сцепления слишком слабы, чтобы удерживать ее на месте. Даже если он потерял столько энергии, что был связан, следующее столкновение с соседними крошечными частицами отбросит его обратно в газовую фазу. Понижая температуру, можно отбирать энергию у мельчайших частиц.В результате, когда температура опускается ниже температуры сублимации или затвердевания, силы взаимодействия с другими частицами заставляют их слипаться вместе и снова образовывать твердое тело или жидкость.
Фазовые диаграммы
Фазовая диаграмма pT вещества описывает, в зависимости от давления и температуры, в скольких фазах находится вещество и в каком агрегатном состоянии они находятся. Линии показывают давление и температуру, при которых вещества меняют свое физическое состояние.В определенной степени переход между агрегатными состояниями происходит по линиям, поэтому их также называют линиями границы раздела фаз. Соответствующие агрегатные состояния присутствуют на них в виде динамического равновесия рядом друг с другом в разных фазах.
- При определенном давлении и температуре, так называемой тройной точке, все три физических состояния могут существовать одновременно. Это точка в «середине» фазовой диаграммы, в которой встречаются все три линии границы раздела фаз.Таким образом, тройная точка подходит в качестве отправной точки для этих линий и для определения многих температурных шкал.
- Выше определенного давления и определенной температуры, так называемая критическая точка, газ и жидкость больше не могут быть различимы из-за их одинаковой плотности. Следовательно, в этом пространстве состояний нельзя установить границу раздела фаз.
- Для давлений ниже давления тройной точки вещество может стать твердым только при понижении температуры или только газообразным при повышении температуры.Разделительная линия между двумя областями называется кривой сублимации . На нем могут сосуществовать твердая и газовая фазы. Теоретически кривая сублимации начинается с абсолютного нуля и заканчивается в тройной точке.
- Для давлений выше давления тройной точки вещество является твердым при температурах ниже точки плавления, жидкостью между точкой плавления и точкой кипения и газообразным веществом выше точки кипения. Разделительная линия между твердой и жидкой фазами, то есть кривая точек плавления, называется кривой плавления , разделительная линия между жидкостью и газом называется кривой точки кипения .Обе кривые также начинаются в тройной точке, причем кривая плавления теоретически продолжается до бесконечности, а кривая точки кипения заканчивается в критической точке.
- Степени свободы на фазовой диаграмме зависят от рассматриваемой плоскости. В тройной точке и в критической точке нет степени свободы, поскольку и давление, и температура имеют фиксированные значения, которые зависят только от вещества. Либо давление, либо температура могут быть свободно выбраны на линиях границы раздела фаз и являются взаимозависимыми, следовательно, существует определенная степень свободы.В пространстве чистых состояний, т.е. в областях фазовой диаграммы, можно свободно выбирать давление и температуру, что соответствует двум степеням свободы.
Неклассические физические состояния
В дополнение к трем классическим агрегатным состояниям существуют и другие состояния вещества, некоторые из которых возникают только в экстремальных условиях (отсортированных по температуре, от более высоких к более низким).
- Состояние плазмы: встречается, например, в электрических дугах, в звездах и в термоядерных реакторах.При очень высоких температурах атомы распадаются на ядро и оболочку; создаются свободные электроны.
- Атомарный газ: В нем больше нет молекул, поскольку постоянные столкновения разрушают связи, но электроны все еще прочно связаны.
- Сверхкритическое состояние возникает при превышении критической точки и представляет собой смешанное состояние между жидкостью и газом.
- Мезоморфное состояние: оно занимает промежуточное положение между агрегатными состояниями, жидким и твердым, и встречается в различных формах, например, в жидких кристаллах или пластичных кристаллах.
- Конденсат Бозе-Эйнштейна: это набор чрезвычайно холодных атомов, которые имеют одинаковое квантово-механическое состояние, что делает их неотличимыми и, следовательно, ведет себя совершенно согласованно.
- Фермионный конденсат: сверххолодное состояние фермионов, которые отличаются от бозонов (целочисленный спин) своим полуцелым спином.
- Сверхтекучая жидкость: жидкость без внутреннего трения.
- Супрасолид: состояние, которое достигается с помощью сверххолодного гелия-4.Материя одновременно проявляет свойства твердых и сверхтекучих тел.
литература
- Питер Курцвейл, Пауль Шайперс: Химия: основы, дополнительные знания, приложения и эксперименты . Springer, 2010, ISBN 978-3-8348-0341-2 (ограниченный предварительный просмотр в поиске книг Google).
- Гвидо Кикельбик: Химия для инженеров . Pearson Germany, 2008, ISBN 978-3-8273-7267-3 (ограниченный предварительный просмотр в поиске книг Google).
- Б.Энгельс, К. Шмук, Т. Ширмейстер, Р. Финк: Химия для медицинских работников . Pearson Germany, 2008, ISBN 978-3-8273-7286-4 (ограниченный предварительный просмотр в поиске книг Google).
- Compact Silver Line: Физика: базовые знания формул и законов . Compact Verlag, 2010, ISBN 978-3-8174-7891-0 (ограниченный предварительный просмотр в поиске книг Google).
