Содержание
5. Простые и сложные вещества.
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений.
Дополнительные видеоуроки, рекомендуемые к изучению
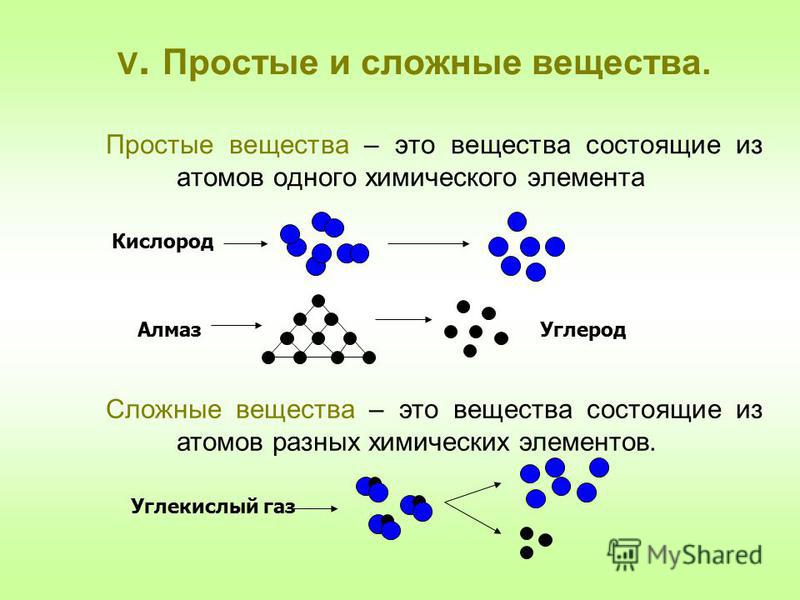
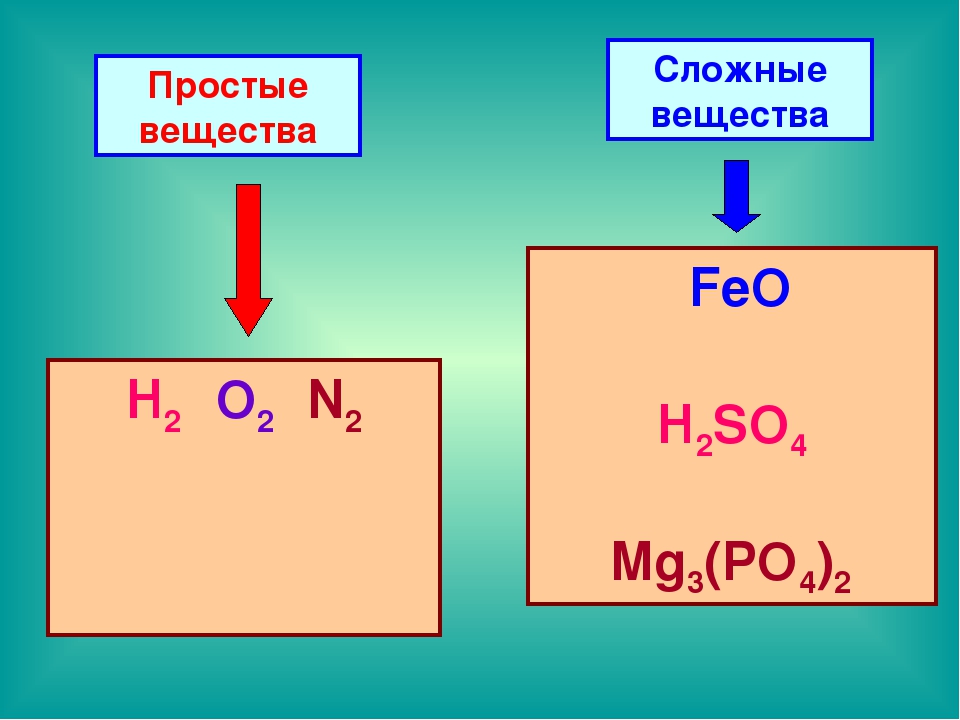
Простые вещества — молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения) — молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
С — алмаз, графит, карбин, фуллерен.
O — кислород, озон.
S — ромбическая, моноклинная, пластическая.
P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
1. Различным числом атомов в молекуле, например кислород O2 и озон O3.
2. Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
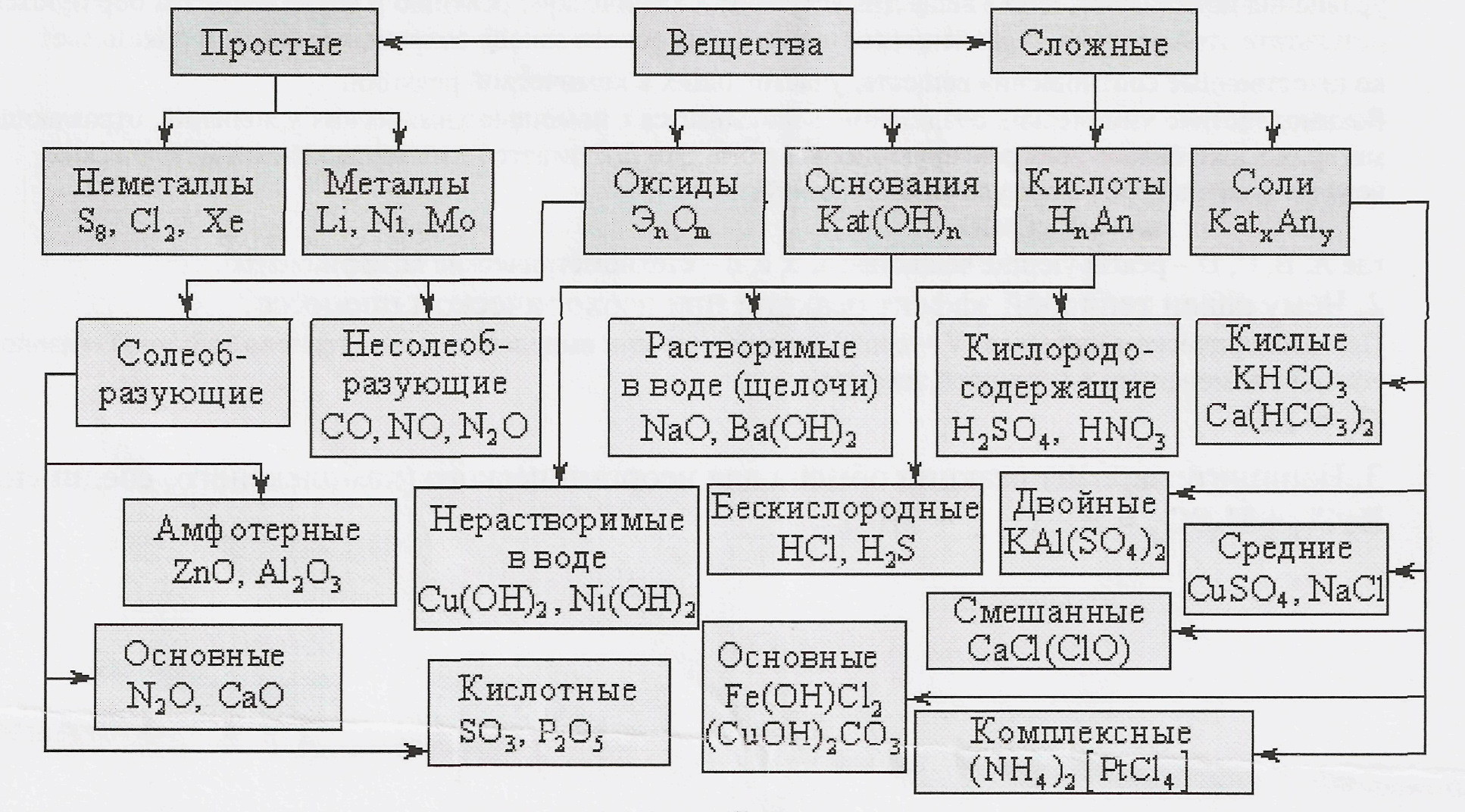
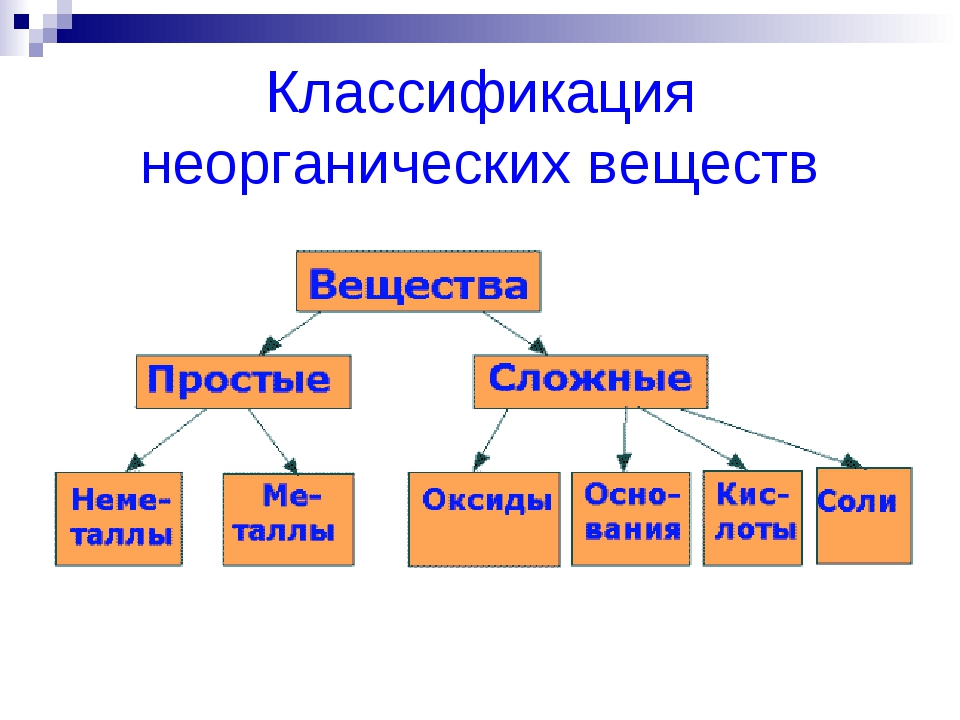
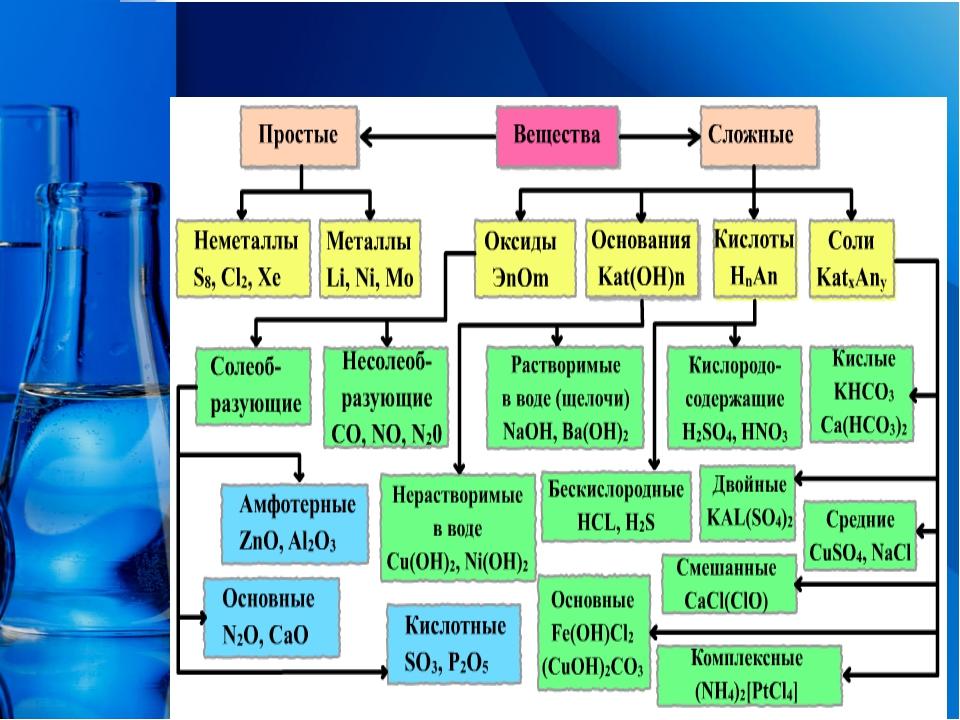
Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.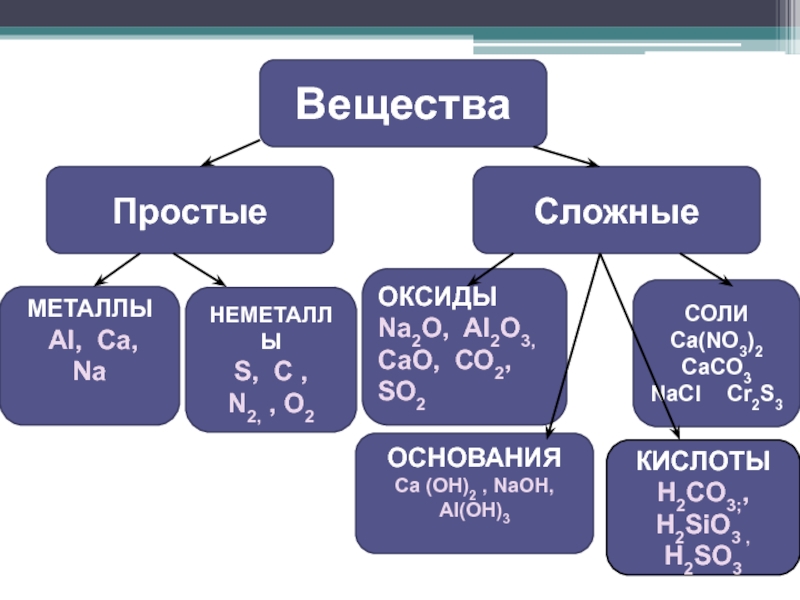 Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
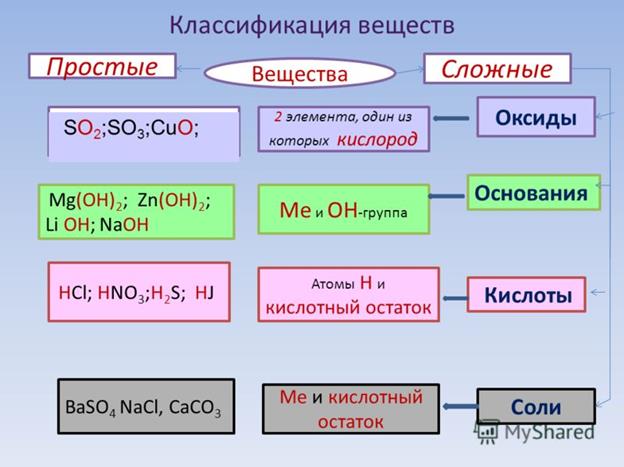
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример:
Na2+1O-2, Mg+2O-2, Fe+2O-2, Mn+2O-2.
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример:
Al2+3O3-2, Fe2+3O3-2, Mn+4O2-2, Zn+2O-2, Be+2O-2.
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример:
S+6O3-2, N2+5O5-2, Cr+6O3-2, Mn2+7O7-2
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания – сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН—).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Вещества простые и сложные. Химические элементы » HimEge.ru
Три агрегатных состояния воды
Окружающий мир материален. Материя бывает двух видов: вещество и поле. Объект химии – вещество (в том числе и влияние на вещество различных полей – звуковых, магнитных, электромагнитных и др.)
Вещество — все, что имеет массу покоя (т.е. характеризуется наличием массы тогда, когда не движется). Так, хотя масса покоя одного электрона (масса не движущегося электрона) очень мала – около 10-27 г, но даже один электрон – это вещество.
Вещество бывает в трех агрегатных состояниях – газообразном, жидком и твердом. Есть еще одно состояние вещества – плазма (например, плазма есть в грозовой и шаровой молнии), но в школьном курсе химию плазмы почти не рассматривают.
Есть еще одно состояние вещества – плазма (например, плазма есть в грозовой и шаровой молнии), но в школьном курсе химию плазмы почти не рассматривают.
Вещества могут быть чистыми, очень чистыми (нужными, например, для создания волоконной оптики), могут содержать заметные количества примесей, могут быть смесями.
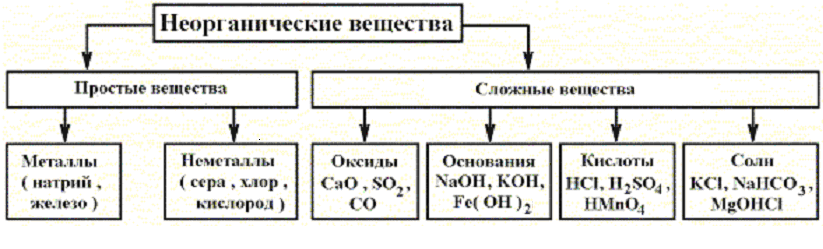
Все вещества состоят из мельчайших частиц – атомов. Вещества, состоящие из атомов одного вида (из атомов одного элемента), называют простыми (например, древесный уголь, кислород, азот, серебро и др.). Вещества, которые содержат связанные между собой атомы разных элементов, называют сложными.
Если в веществе (например, в воздухе) присутствуют два или большее число простых веществ, и их атомы не связаны между собой, то его называют не сложным, а смесью простых веществ. Число простых веществ сравнительно невелико (около пятисот), а число сложных веществ огромно. К настоящему времени известны десятки миллионов разных сложных веществ.
Вещества способны вступать между собой во взаимодействие, причем возникают новые вещества.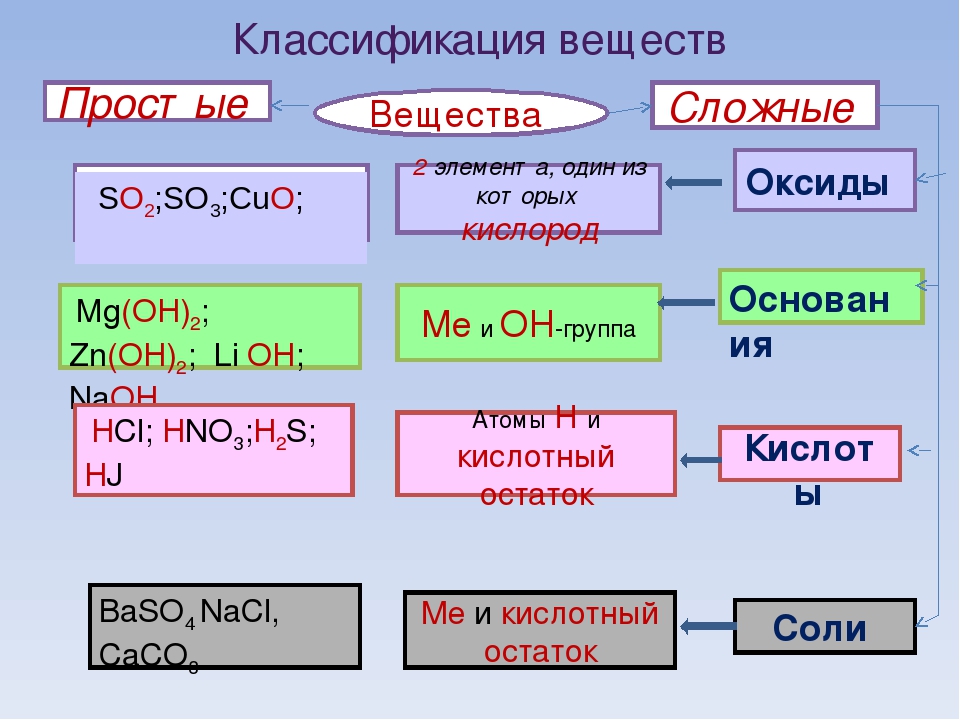 Такие превращения называют химическими. Например, простое вещество уголь взаимодействует (химики говорят – реагирует) с другим простым веществом – кислородом, в результате образуется сложное вещество – углекислый газ, в котором атомы углерода и кислорода связаны между собой. Такие превращения одних веществ в другие называют химическими. Химические превращения – это химические реакции. Так, при нагревании сахара на воздухе сложное сладкое вещество – сахароза (из которого состоит сахар) – превращается в простое вещество – уголь и сложное вещество – воду.
Такие превращения называют химическими. Например, простое вещество уголь взаимодействует (химики говорят – реагирует) с другим простым веществом – кислородом, в результате образуется сложное вещество – углекислый газ, в котором атомы углерода и кислорода связаны между собой. Такие превращения одних веществ в другие называют химическими. Химические превращения – это химические реакции. Так, при нагревании сахара на воздухе сложное сладкое вещество – сахароза (из которого состоит сахар) – превращается в простое вещество – уголь и сложное вещество – воду.
Химия изучает превращения одних веществ в другие. Задача химии – выяснить, с какими именно веществами может при данных условиях взаимодействовать (реагировать) то или иное вещество, что при этом образуется. Кроме того, важно выяснить, при каких именно условиях может протекать то или иное превращение и можно получить нужное вещество.
Каждое вещество характеризуется совокупностью физических и химических свойств.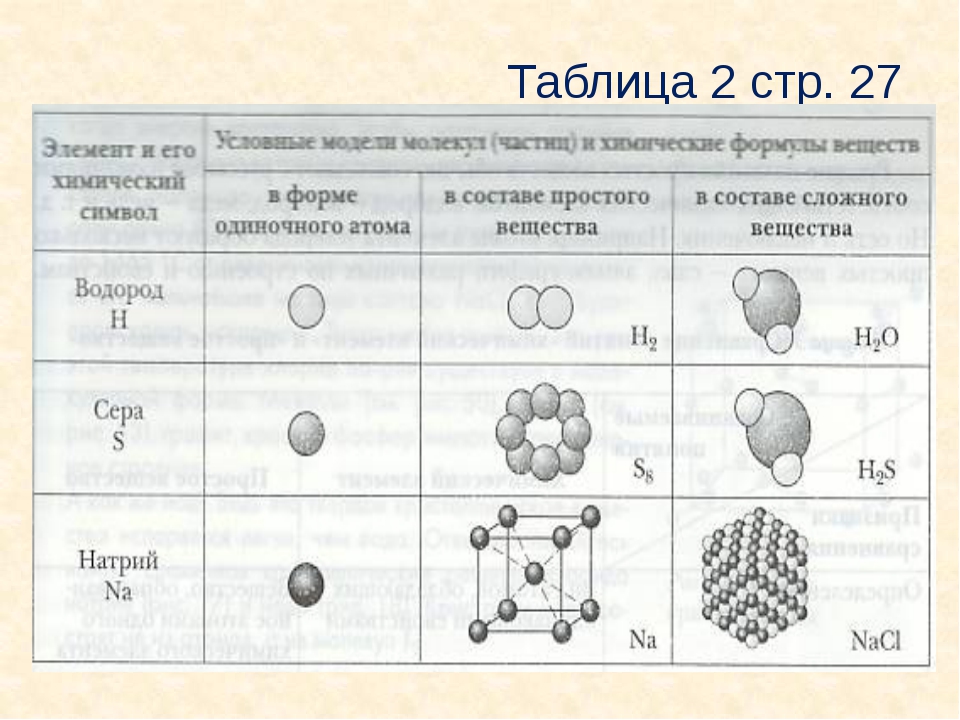 Физические свойства – это свойства, которые можно охарактеризовать с помощью физических приборов. Например, с помощью термометра можно определить температуру плавления и кипения воды. Физическими методами можно охарактеризовать способность вещества проводить электрический ток, определить плотность вещества, его твердость и т.д. При физических процессах вещества остаются неизменными по составу.
Физические свойства – это свойства, которые можно охарактеризовать с помощью физических приборов. Например, с помощью термометра можно определить температуру плавления и кипения воды. Физическими методами можно охарактеризовать способность вещества проводить электрический ток, определить плотность вещества, его твердость и т.д. При физических процессах вещества остаются неизменными по составу.
Физические свойства веществ подразделяют на счислимые (те, которые можно охарактеризовать с помощью тех или иных физических приборов числом, например, указанием плотности, температур плавления и кипения, растворимости в воде и др.) и несчислимые (те, которые охарактеризовать числом нельзя или очень трудно – такие, как цвет, запах, вкус и др.).
Химические свойства вещества – это совокупность сведений о том, с какими другими веществами и при каких условиях вступает в химические взаимодействия данное вещество. Важнейшая задача химии – выявление химических свойств веществ.
В химических превращениях участвуют мельчайшие частицы веществ – атомы. При химических превращениях из одних веществ образуются другие вещества, и исходные вещества исчезают, а вместо них образуются новые вещества (продукты реакции). А атомы при всех химических превращениях сохраняются. Происходит их перегруппировка, при химических превращениях старые связи между атомами разрушаются и возникают новые связи.
Число различных веществ огромно (и у каждого из них своя совокупность физических и химических свойств). Атомов, отличающихся друг от друга по важнейшим характеристикам, в окружающем нас материальном мире сравнительно невелико – около ста. Каждому виду атомов отвечает свой химический элемент. Химический элемент – это совокупность атомов с одинаковыми или близкими характеристиками. В природе встречается около 90 различных химических элементов. К настоящему времени физики научились создавать новые, отсутствующие на Земле виды атомов. Такие атомы (и, соответственно, такие химические элементы) называют искусственными (по-английски – man-made elements).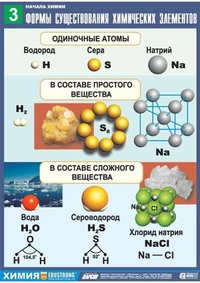 Искусственно полученных элементов к настоящему времени синтезировано более двух десятков.
Искусственно полученных элементов к настоящему времени синтезировано более двух десятков.
Каждый элемент имеет латинское название и одно- или двух-буквенный символ. В русскоязычной химической литературе нет четких правил произношения символов химических элементов. Одни произносят так: называют элемент по-русски (символы натрия, магния и др.), другие – по латинским буквам (символы углерода, фосфора, серы), третьи – как звучит название элемента по-латыни (железо, серебро, золото, ртуть). Символ элемента водорода Н у нас принято произносить так, как эту букву произносят по-французски.
Сравнение важнейших характеристик химических элементов и простых веществ приведено в таблице ниже. Одному элементу может отвечать несколько простых веществ (явление аллотропии: углерод, кислород и др.), а может – и одно (аргон и др. инертные газы).
| Х и м и ч е с к и й э л е м е н т | П р о с т о е в е щ е с т в о |
1. Заряд ядра Заряд ядра | 1. Совокупность физических свойств(цвет, запах, растворимость в воде, температуры плавления, кипения, разложения, тип кристаллической решетки и др.) 2. Совокупность химических свойств (с чем реагирует и при каких условиях) |
| 2. Значение электроотрицательности | |
| 3. Совокупность степеней окисления | |
| 4. Для элементов, встречающихся в природе: постоянство изотопного состава,и как следствие, постоянство атомной массы |
Простые и сложные вещества — Основы химии на Ида Тен
Содержание статьи
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода –
Н + Н = Н2
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т. д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
Например, алмаз и углерод – не одно и тоже.
Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде. Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл.
Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте
Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические. В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Сложные вещества и их классификация
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О.
Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Сложные вещества – вещества, в состав которых входят атомы различных видов
Проведем следующий эксперимент. Смешаем порошки серы и цинка.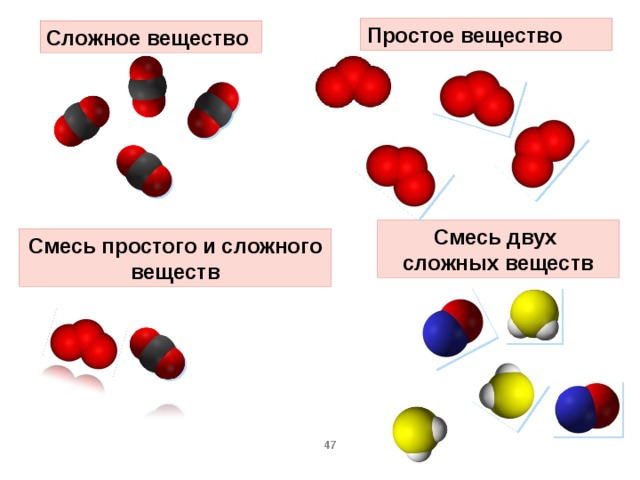 Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество.
Типы строения веществ
По типу частиц, входящих в состав веществ, вещества делят на вещества молекулярного и немолекулярного строения. В состав вещества могут входить различные структурные частицы, такие как атомы, молекулы, ионы. Следовательно, существует три типа веществ: вещества атомного, ионного и молекулярного строения. Вещества различного типа строения будут иметь различные свойства.
Вещества различного типа строения будут иметь различные свойства.
Вещества атомного строения
Примером веществ атомного строения могут быть вещества, образованные элементом углеродом: графит и алмаз. В состав этих веществ входят только атомы углерода, но свойства этих веществ очень сильно отличаются. Графит – хрупкое, легко расслаивающееся вещество серо-черного цвета. Алмаз – прозрачный, один из самых твердых на планете, минерал. Почему вещества, состоящие из одного типа атомов, имеют различные свойства? Все дело в строении этих веществ. Атомы углерода в графите и алмазе соединяются различным способом. Вещества атомного строения имеют высокие температуры кипения и плавления, как правило, нерастворимы в воде, нелетучи. Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Вещества молекулярного строения
Вещества молекулярного строения – это практически все жидкости и большинство газообразных веществ.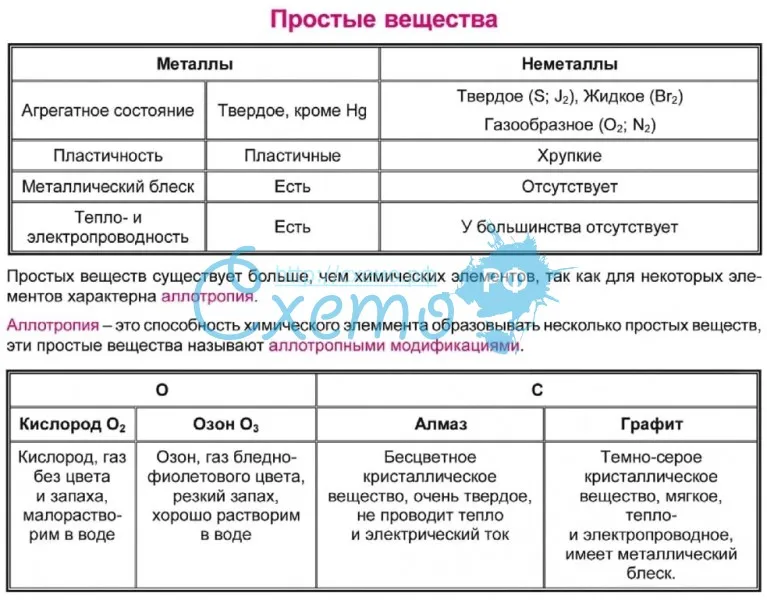 Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Вещества ионного строения
Вещества ионного строения – это твердые кристаллические вещества. Примером вещества ионного соединения может быть поваренная соль. Ее химическая формула NaCl. Как видим, NaCl состоит из ионов Na+ и Cl⎺, чередующихся в определенных местах (узлах) кристаллической решетки. Вещества ионного строения имеют высокие температуры плавления и кипения, хрупкие, как правило, хорошо растворимы в воде, не проводят электрический ток. Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать.
- «Атом» – конкретное понятие, так как атомы существуют реально.

- «Химический элемент» – это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Когда мы говорим о материале или компоненте смеси – например, колба наполнена газообразным хлором, водный раствор брома, возьмём кусочек фосфора, – мы говорим о простом веществе. Если же мы говорим, что в атоме хлора содержится 17 электронов, вещество содержит фосфор, молекула состоит из двух атомов брома, то имеем в виду химический элемент.
Нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже:
| Характеристики химического элемента | Характеристики простого вещества |
|
|
Сложные вещества необходимо отличать от смесей, которые тоже состоят из разных элементов. Количественное соотношение компонентов смеси может быть переменным, а химические соединения имеют постоянный состав. Например, в стакан чая вы можете внести одну ложку сахара, или несколько, а молекулы сахарозы С12Н22О11 содержит точно 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Количественное соотношение компонентов смеси может быть переменным, а химические соединения имеют постоянный состав. Например, в стакан чая вы можете внести одну ложку сахара, или несколько, а молекулы сахарозы С12Н22О11 содержит точно 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Таким образом, состав соединений можно описать одной химической формулой, а состав смеси – нет. Компоненты смеси сохраняют свои физические и химические свойства. Например, если смешать железный порошок с серой, то образуется смесь двух веществ.
И сера, и железо в этой смеси сохраняют свои свойства: железо притягивается магнитом, а сера не смачивается водой и плавает по ее поверхности. Если же сера и железо прореагируют друг с другом, образуется новое соединение с формулой FeS, не имеющее свойств ни железа, ни серы, но обладающее набором собственных свойств. В соединении FeS железо и сера связаны друг с другом, и разделить их методами, которыми разделяют смеси, нельзя.
Выводы из статьи по теме Простые и сложные вещества
- Простые вещества – вещества, в состав которых входят атомы одного вида
- Простые вещества делят на металлы и неметаллы
- Сложные вещества – вещества, в состав которых входят атомы различных видов
- Сложные вещества делят на органические и неорганические
- Существуют вещества атомного, молекулярного и ионного строения, их свойства различны
- Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Простые и сложные вещества — получение и свойства
Все вещества, о которых мы говорим в
школьном курсе химии, принято делить
на простые и сложные. Простые
вещества — это такие вещества, в
состав молекул которых входят атомы
одного и того же элемента.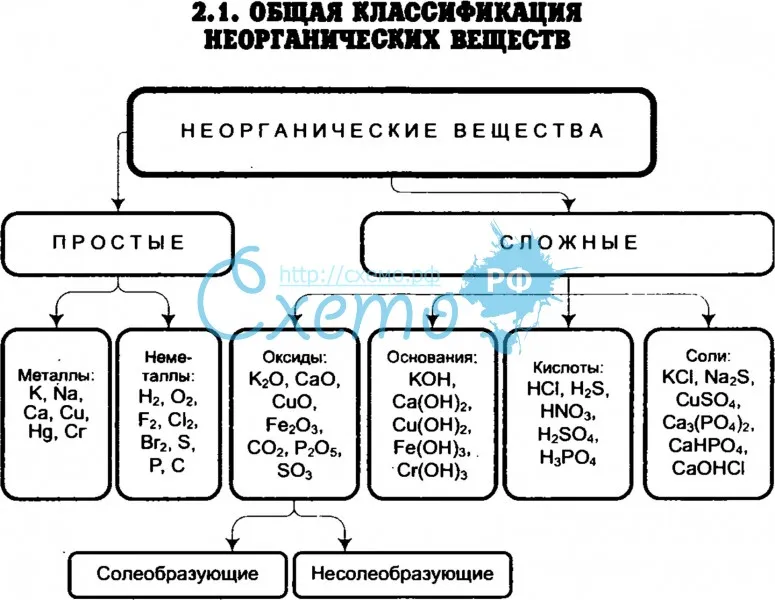 Атомарный
Атомарный
кислород (O), молекулярный кислород
(O2) или просто кислород, озон (O3),
графит, алмаз — это примеры простых
веществ, которые образуют
химические элементы кислород и
углерод. Сложные вещества делятся на
органические и неорганические. Среди
неорганических веществ, прежде всего
выделяют следующие четыре класса:
окислы (или оксиды), кислоты
(кислродные и безкислородные),
основания (растворимые в воде
основания называются щелочами) и
соли. Соединения неметаллов
(исключая кислород и водород) не
входят в эти четыре класса, мы будем
их называть условно «и другие сложные
вещества».
Простые вещества принято делить на
металлы, неметаллы и инертные газы. К
металлам относятся все химические
элементы, у которых идет заполнение
d- и f-подуровней, это в 4-ом периоде
элементы: Sc — Zn, в 5-ом периоде: Y —
Cd, в 6-ом периоде: La — Hg, Ce — Lu, в 7
периоде Ac — Th — Lr. Если теперь среди
Если теперь среди
оставшихся элементов провести линию
от Be к At, то слева и внизу от нее
будут расположены металлы, а справа
и вверху — неметаллы. В 8 группе
Периодической системы расположены
инертные газы. Элементы,
расположенные на диагонали: Al, Ge,
Sb, Po (и некоторые другие. Например,
Zn) в свободном состоянии обладают
свойствами металлов, а гидроксиды
обладают свойствами и оснований, и
кислот, т.е. являются амфотерными
гидроксидами. Поэтому эти элементы
можно считать металло-неметаллами,
занимающими промежуточное
положение между металлами и
неметаллами. Таким образом,
классификация химических элементов
зависит от того, какими свойствами
будут обладать их гидроксиды:
основными — значит это металл,
кислотными — неметалл, и теми и
другими (в зависимости от условий) —
металло-неметалл.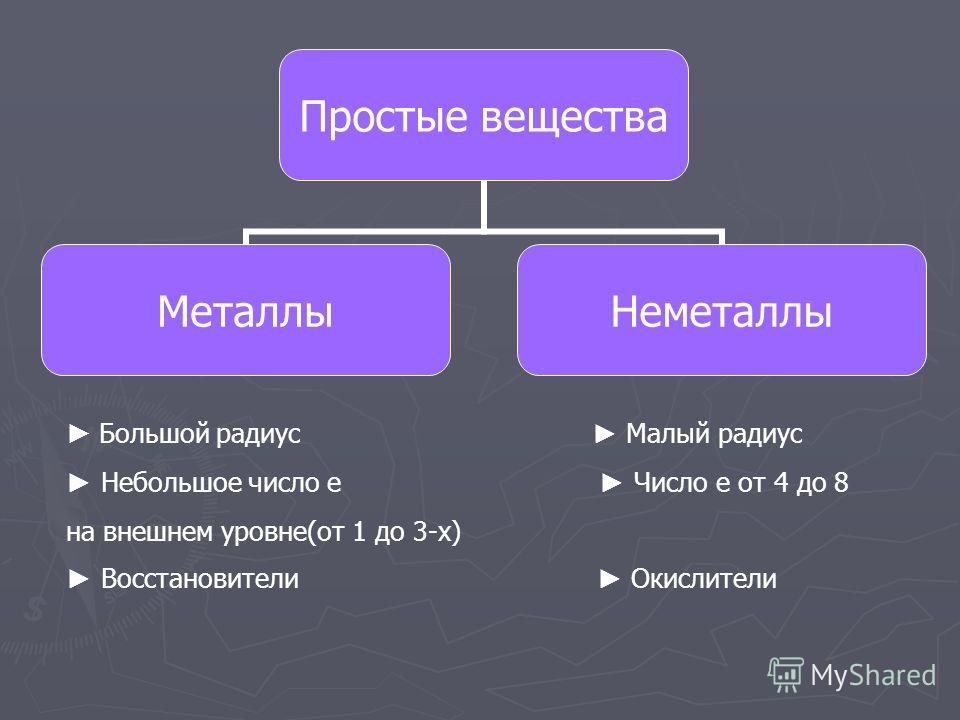 Один и тот же
Один и тот же
химический элемент в соединениях с
низшей положительной степенью
окисления (Mn+2, Cr+2) проявляет ярко
выраженные «металлические» свойства,
а в соединениях с максимальной
положительной степенью окисления
(Mn+7, Cr+6) проявляет свойства
типичного неметалла. Чтобы увидеть
взаимосвязь простых веществ, оксидов,
гидроксидов и солей приведем сводную
таблицу.
Урок на тему «Простые и сложные вещества». 8-й класс, химия
Цель урока:
- Знать определение атома, молекулы, простого и сложного вещества.
- Уметь различать простые и сложные вещества; смеси и сложные вещества.
- Знать отличие смеси и сложного вещества.
Оборудование: Шаровые модели молекул воды, Штатив с пробирками, реактивы (железо, вода, сера, карбонат кальция).
демонстрация соединение железа с серой.
Лабораторные опыты: Ознакомление с образцами простых и сложных веществ.
Ход урока
1. Повторение и обобщение знаний.
1) Проверка домашнего задания:
Упражнение упр. 8, 9, 10, на стр. 22. (Взаимопроверка).
2) Выполните тестовое задание. Подберите соответствие: термин – определение понятия.
(Приложение №1). Самопроверка.
3) Приведите примеры смесей (не менее двух), которые можно разделить:
1 вариант:
А) фильтрованием————————————————————————————-
Б) отстаиванием—————————————————————————————-
2 вариант:
А) выпариванием—————————————————————————————
Б) дистилляцией——————————————————————————————
2. Изучение нового материала
Изучение нового материала
1. Фронтальный опрос:
Какие виды смесей вам известны?
Какие смеси называются однородными, неоднородными?
Какое вещество называется чистым? Что такое «вещество»? Из курса физики вам известно, что многие вещества состоят из молекул.
Дайте определения понятиям «молекула» и «атом». (Приложение №2).
Рассмотрите шаровые модели некоторых веществ, укажите состав данного вещества. Чем молекула озона отличается от молекулы оксида кальция? Чем водород отличается от соляной кислоты? Учащиеся могут ответить, что молекулы водорода, фосфора, азота образованы атомами одного вида. – Простые вещества.
Вещества соляная кислота, оксид кальция, метан, оксид натрия образованы атомами разного вида. Сложные вещества.
Выпишите в словарь новые понятия, со страниц 15,16.
Заполните схему:
2. Лабораторный опыт.
Инструкция к лабораторному опыту.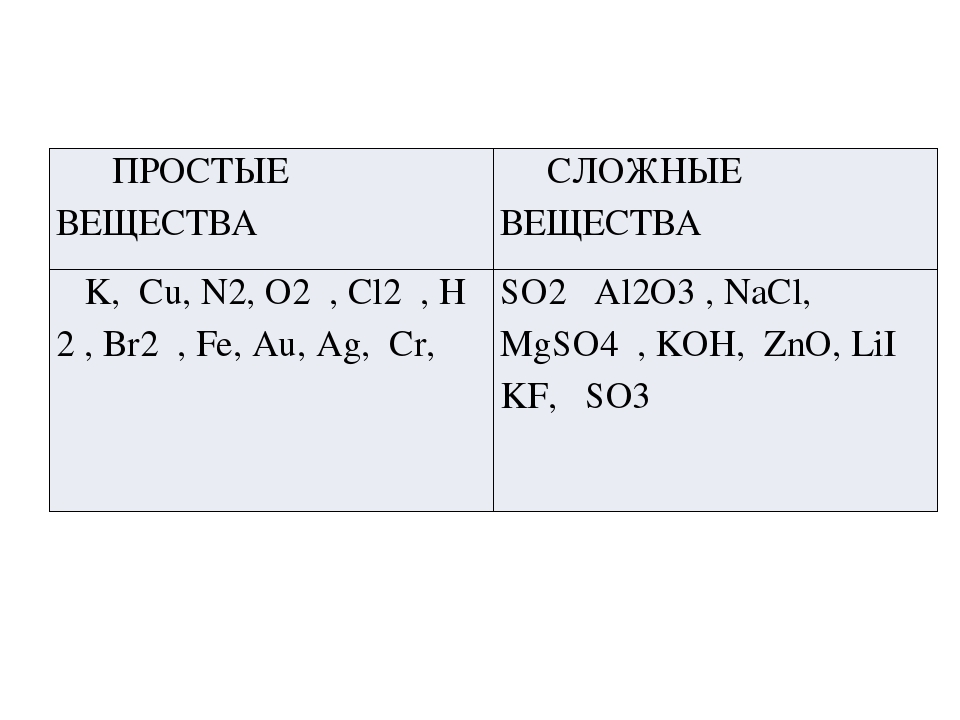
- Прослушайте инструктаж по охране труда.
- Выполните опыт: рассмотрите выданные вам образцы веществ: железо, вода, сера, карбонат кальция.
- Опишите их физические свойства.
- Оформите результаты в таблицу. (Приложение №3).
| Физические свойства | железо | вода | сера | Карбонат кальция |
Агрегатное состояние (твердое, жидкое, газообразное) |
|
|
|
|
Цвет |
|
|
|
|
Блеск |
|
|
|
|
Растворимость в воде |
|
|
|
|
Хрупкость (пластичность) |
|
|
|
|
Теплоэлектропроводность |
|
|
|
|
Температура кипения, температура плавления. |
|
|
|
|
Простое (сложное) вещество |
|
|
|
|
Вывод к работе: о физических свойствах веществ, о составе простых и сложных веществах.
3. Чем смесь отличается от сложного вещества.
Напомнив, как готовиться смесь железа и серы, учитель отмечает, что сера — простое вещество, молекулы ее состоят из одинаковых атомов одного вида, железо тоже простое вещество, состоящее из одинаковых атомов другого вида. Можно ли назвать то, что получилось при перемешивании порошков, сложным веществом? Разделим смесь при помощи магнита. После обсуждения делаем вывод, что смесь можно разделить физическими способами и получить чистые вещества, из которых она состояла.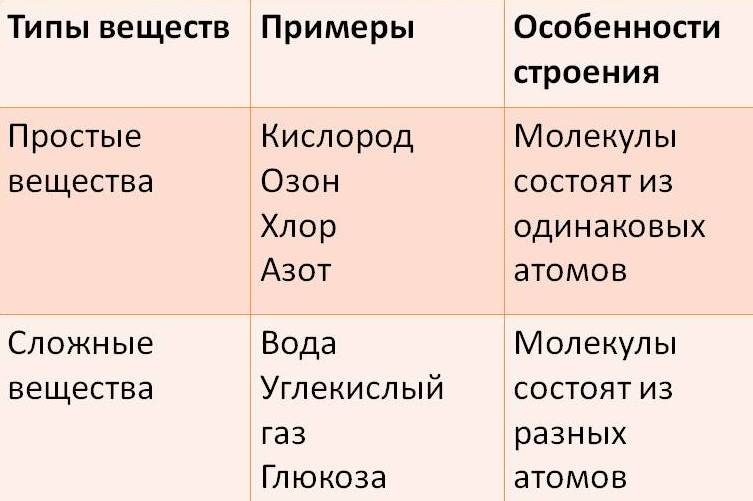 Нагреваем железо с опилками. Образовалось новое вещество, которое невозможно разделить, не действует на него магнит. Сульфид железа – это чистое сложное вещество.
Нагреваем железо с опилками. Образовалось новое вещество, которое невозможно разделить, не действует на него магнит. Сульфид железа – это чистое сложное вещество.
Таблица №1. Сравнение смесей и сложных веществ.
Смесь | Сложное вещество |
1. Вещества сохраняют свои свойства. | 1. Свойства исходных веществ не сохраняются. |
2. Вещества можно разделить физическими методами. | 2. Сложное вещество нельзя разделить физическими методами. |
3. Количественный состав может быть произвольным. | 3. Количественный состав химического соединения всегда одинаков независимо от места нахождения и способа получения. |
3. Закрепление.
1. Выпишите простые вещества: сталь, чугун, железо, морская вода, дистиллированная вода, алюминий, лимонад, спиртовая настойка йода, нефть, глюкоза, поваренная соль, воздух, кислород, бронза.
2. Простые вещества состоят из атомов … химического элемента.
Сложные вещества состоят из атомов … Химических элементов. Сложные вещества иначе называют … .
Простое вещество, в отличие от сложного, нельзя … .
3. Чем морская вода отличается от дистиллированной воды?
4. Сравнить смесь со сложным веществом.
Вопросы и задания | Вещества | |
вода | Водород и кислород (смесь) | |
Можно ли разделить эти вещества на более простые компоненты. |
|
|
Сохраняется ли способность молекул кислорода поддерживать горение? Почему? |
|
|
Рефлексия и подведение итогов.
Что нового узнали на уроке?
Какие вопросы вызвали затруднение?
Какие знания вы сегодня приобрели?
Домашнее задание: Читать стр. 15-17.
Выполнить упражнения 11-13 на стр.22.
Литература: Г.Е. Рудзитис, Ф.Г. Фельдман. «Химия 8 класс».
Презентация — Простые и сложные вещества
Текст этой презентации
Слайд 1
Простые и сложные вещества
Мидакова Наталья Васильевна учитель I квалификационной категории
МБОУ «Красночетайская СОШ» Красночетайский район Республика Чувашия
Слайд 2
Содержание
Опорная схема
Алгоритм определения веществ
Проверь себя
Классификация
Строение молекулы
Физические свойства
Простые вещества
Химический словарик
Отличие между сложными и простыми вещ-ми
Классификация
Строение и свойства
Аллотропия
Сложные вещества
Источники
Отличие между сложными вещ-ми и смесями
Приложение
Слайд 3
Классификация простых веществ
Простые вещества
Металлы
Неметаллы
Na K Au Fe Cu
N2 O2 h3 Cl2 P S
Главная
Слайд 4
Металлы Неметаллы
Немолекулярное строение Молекулярное строение
Немолекулярное строение
Графит
Кислород
Сера
Медь
Железо
Главная
Слайд 5
Металлы Неметаллы
Кислород О
Углерод С
Кристаллическая
Пластическая
Олово Sn
Серое α-форма
Белое (β-форма)
Сера S
Главная
Слайд 6
Металлы Неметаллы
1. Агрегатное состояние
Агрегатное состояние
Тв. Hg – жидкий металл
– O2, N2, h3
– I2, C, Si
– Br2
2. Цвет
От серебристо-белого до темно-серого. Au (желтый) и Cu (красно-коричневый).
3. Электропроводность
г
тв
ж
Электропроводны
Диэлектрики
Главная
Слайд 7
Металлы Неметаллы
От серебристо-белого до серого
бериллий
германий
литий
золото
графит
мышьяк
алмаз
кремний
сера
фосфор
Главная
медь
Слайд 8
Металлы Неметаллы
4. Твердость / мягкость
Пластичные (Au, Ag, Cu, Al и др.), кроме. Sn (серое).
Хрупкие (S, уголь, I2, др.) При ударе рассыпаются.
5. Пластичность/ хрупкость
Существуют твердые (Cr, Fe) и мягкие (Au, Na, K).
Существуют твердые (Салмаз, Si) и мягкие (Cграфит).
6. Температура плавления
Самая высокая:
Tпл.(W)= +3380°С
Самая низкая?
Tпл.(Hg)= — 38,8°С
Высокая:
Tпл.(алмаза)= +3600°С
Низкая:
Tпл.(азота)= -210°С
Главная
Слайд 9
Главная
Сложные вещества
Оксиды
Соли
Оксид кальция СаО
Хлорид натрия NaCl
(Поваренная соль)
Кислоты
Гидроксид натрия NaОН
Неорганические
Органические
Основания
(Гидроксиды)
Серная кислота h3SO4
Фенол
Жиры
Полиэтилен
Уксусная кислота
Слайд 10
Сложные вещества состоят из атомов разных химических элементов
В химических реакциях могут разлагаться с образованием нескольких других веществ
Главная
Слайд 11
Вещества
Простые
Состоят из атомов одного вида
Состоят из атомов разного вида
В химических реакциях не могут разлагаться с образованием нескольких других веществ
В химических реакциях могут разлагаться с образованием нескольких других веществ
О2 Н2 Cl2 S P F2 Si
h3O NaCl CuSO4 HCl
Главная
Сложные
Слайд 12
Сложные вещества Смесь
1. Образуется с помощью химической реакции (синтез из простых веществ) 2. Свойства простых веществ, из которых получено сложное вещество, в последнем не сохраняются
3. Элементы, входящие в состав сложного вещества, всегда находятся в определенном массовом отношении
4. Может быть разложено на составные части (элементы в виде простых веществ) только с помощью химической реакции (анализ) 1. Образуется с помощью физического процесса (смешивание чистых веществ)
2. Свойства чистых веществ, из которых составлена смесь, остаются неизменными
3. Чистые вещества (простые и сложные) могут находиться в смеси в любом массовом соотношении
4. Может быть разделена на составные части (чистые вещества) с помощью физических методов
Образуется с помощью химической реакции (синтез из простых веществ) 2. Свойства простых веществ, из которых получено сложное вещество, в последнем не сохраняются
3. Элементы, входящие в состав сложного вещества, всегда находятся в определенном массовом отношении
4. Может быть разложено на составные части (элементы в виде простых веществ) только с помощью химической реакции (анализ) 1. Образуется с помощью физического процесса (смешивание чистых веществ)
2. Свойства чистых веществ, из которых составлена смесь, остаются неизменными
3. Чистые вещества (простые и сложные) могут находиться в смеси в любом массовом соотношении
4. Может быть разделена на составные части (чистые вещества) с помощью физических методов
Главная
Слайд 13
Название вещества
Состоит из одного слова
Состоит из двух слов
Сложное вещество
Название вещества совпадает с названием
химического элемента
Название вещества не совпадает с названием
химического элемента
Простое вещество
Чаще всего сложное
Простое или сложное вещество?
Главная
Слайд 14
Главная
Слайд 15
Ошибка
Ошибка
Ошибка
Молодец
Ошибка
Ошибка
Ошибка
Ошибка
Ошибка
Ошибка
Молодец
Ошибка
Ошибка
Ошибка
Молодец
Хлор
Аммиак
Колодезная вода
Воздух
Лёд
Фосфор
Сера
Смеси
Молодец
Сложные
вещества
Вода
Бор
Кислород
Медь
Хлорид натрия
Кремний
Хром
Веберите правильные ответы
Водород
Алюминий
Главная
Тренажер
Слайд 16
Ошибка
Ошибка
Молодец
Ошибка
Состоят из атомов разных химических элементов
Ошибка
Молодец
Ошибка
Ошибка
Имеют аморфные модификации
Ошибка
Ошибка
Ошибка
Молодец
Смесь
Ошибка
Ошибка
Молодец
Ошибка
Простое вещество
Ошибка
Ошибка
Ошибка
Молодец
Сложное вещество
Главная
Тест
Выберите один правильный ответ
Слайд 17
1. http://www.himhelp.ru/section24/section8/section48/
http://www.himhelp.ru/section24/section8/section48/
2. http://ru.wikipedia.org/wiki/Простые вещества
3. http://biolabyrinth.narod.ru/chem/general/basic/chem-bas.htm
Главная
4. http://school-collection.edu.ru/catalog/res/c90b7e4a-ece0-1df5-2e83-66ce2d07ae9d/?from=eb17b17a-6bcc-01ab-0e3a-a1cd26d56d67&interface=themcol
5. http://school-collection.edu.ru/catalog/res/0A22315C-8AAD-C506-5565-CB501F201476/?interface=catalog&class=Array&subject=Array
Интернет ресурсы
1. Бочарова С.И. Занимательные материалы по химии. Издательство Корифей; 2. Габриелян О.С. Химия: 8 кл. – М: Дрофа, 2003; 3. Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. – М: БЛИК и К0, 2004; 4. Еремина Е.А., Еремин В.В, Кузьменко Н.Е. Справочник школьника по химии. М. Дрофа, 1996. 5. Рудзитис Г.Е., Фельдман Ф.Г. Химия 9 кл. -М.: Просвещение, 2007
Литература
CD ресурсы
Виртуальная химическая лаборатория. 9 кл. (CD компания «Новый диск»).
Слайд 18
Главная
Приложение
Слайд 19
Простое вещество Tплавл.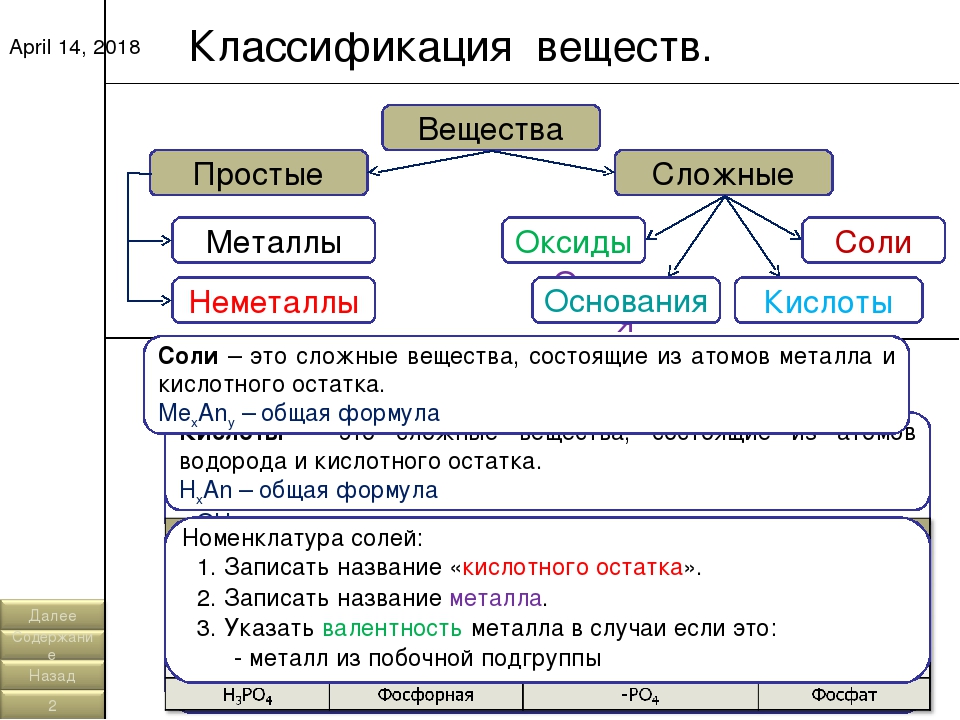 Простое вещество Tплавл.
Простое вещество Tплавл.
Азот
Алюминий
Барий
Бром
Водород
Вольфрам
Железо
Золото -210ºС
660 ºС
767 ºС
-7,2 ºС
-252,6 ºС
3410 ºС
1535 ºС
1064 ºС Иод
Калий
Кальций
Кислород
Кремний
Медь
Ртуть
Сера 113,5 ºС
63,15 ºС
842 ºС
-182,9 ºС
1415 ºС
1084 ºС
-38,9 ºС
112 ºС
№ Название неметалла Химическая формула неметалла Цвет Агрегатное состояние
Лабораторный опыт
«Свойства простых веществ – металлов и неметаллов»
Внимание: вспомните правила ТБ при обращении с веществами.
Рассмотрите выданные вам в пробирках и чашках Петри вещества.
Разделите их на 2 группы: металлы и неметаллы
Обратите внимание на цвет, наличие металлического блеска у металлов. Заполните таблицу 1.
Возьмите полоску алюминиевую ложку, один конец нагрейте в пламени спиртовки. Заметьте время, через сколько секунд вы почувствуете ее нагревание. О чем это свидетельствует?
Испытайте отношение металлов к воде. Опустите гранулу алюминия и цинка в воду. Что наблюдаете?
Пользуясь приведенной ниже таблицей, проанализируйте температуры плавления металлов.
Рассмотрите неметаллы. Что можно сказать об их цвете, агрегатном состоянии. Поместите немного серы в воду. Что наблюдаете? Заполните таблицу 2.
Пользуясь приведенной ниже таблицей, проанализируйте температуры плавления неметаллов
Сделайте вывод о различиях в свойствах простых веществ металлов и неметаллов.
Таблица 1.
Таблица 2.
Опустите гранулу алюминия и цинка в воду. Что наблюдаете?
Пользуясь приведенной ниже таблицей, проанализируйте температуры плавления металлов.
Рассмотрите неметаллы. Что можно сказать об их цвете, агрегатном состоянии. Поместите немного серы в воду. Что наблюдаете? Заполните таблицу 2.
Пользуясь приведенной ниже таблицей, проанализируйте температуры плавления неметаллов
Сделайте вывод о различиях в свойствах простых веществ металлов и неметаллов.
Таблица 1.
Таблица 2.
Главная
Слайд 20
Определите местоположение неметаллов в периодической системе.
Неметаллов больше или меньше в периодической системе?
Почему неметаллы относят к простым веществам?
Металлы Металлы Неметаллы Неметаллы
Химический знак Название элемента Химический знак Название элемента
Карточки-задания
Вопросы 1 группе.
При помощи периодической таблицы, ответьте на вопросы:
Вопросы 2 группе.
При помощи периодической таблицы, ответьте на вопросы: Вопросы 3 группе.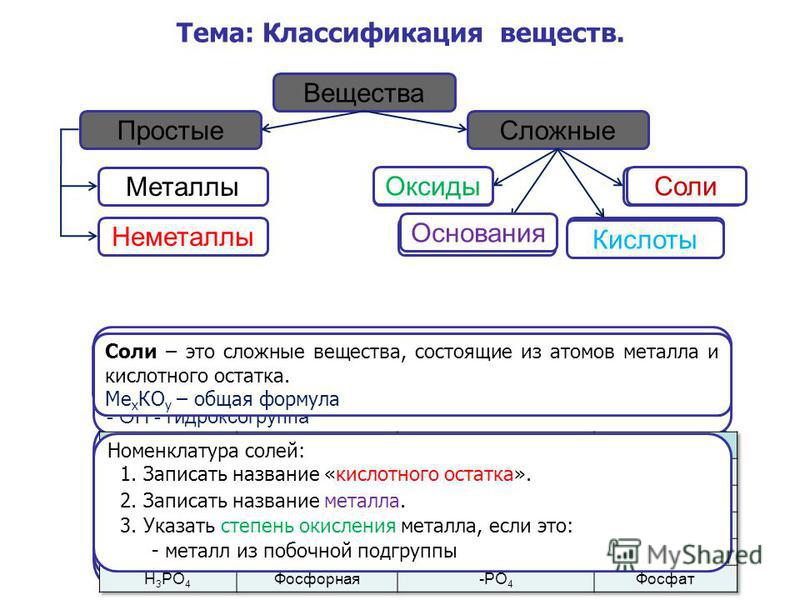 Даны следующие химические элементы: Cu, Sn, Au, Ag, Cl, Br, Pb , H, N, Ni, As, He, Fe. 1.Найдите среди них металлы и неметаллы. 2.Укажите название элементов 3.Результаты занесите в таблицу.
Даны следующие химические элементы: Cu, Sn, Au, Ag, Cl, Br, Pb , H, N, Ni, As, He, Fe. 1.Найдите среди них металлы и неметаллы. 2.Укажите название элементов 3.Результаты занесите в таблицу.
Главная
Слайд 21
Главная
Физкультминутка Представьте, что мы высадились на берег, и идем по пустыне. Под ногами зыбучий песок, и мы вязнем в нем по щиколотку. (музыка)
А теперь представьте, что песок нагрелся до такой степени, что ноги просто обжигает, необходимо как можно быстрее пройти этот путь. Музыка.
Опять препятствие, на нашем пути встретились высыхающее болото, но можно замочить ноги. Передвигаемся по кочкам. Скорей, скорей. Музыка.
Вдруг кочки закончились, наши ноги стали вязнуть в болоте, нам трудно передвигаться, но мы справляемся и с этим испытанием. Музыка.
Перед нами река. Давайте посмотрим, что же там за этим мостиком. Идем по деревянному мосту. Ой, он старый, шатается. Осторожно, не упадите в пропасть, держите равновесие.
Музыка. Какая красота. Мы попали в загадочный лес, в котором поют птицы, лес шумит. Можно немного отдохнуть. Звучит тихая музыка.
Молодцы. Открыть страничку с сайта http://priroda.inc.ru/relax/relax24.html с шумом моря. (Включить звук и настроить регуляторы).
Мы попали в загадочный лес, в котором поют птицы, лес шумит. Можно немного отдохнуть. Звучит тихая музыка.
Молодцы. Открыть страничку с сайта http://priroda.inc.ru/relax/relax24.html с шумом моря. (Включить звук и настроить регуляторы).
Слайд 22
Главная
Опорная схема
Слайд 23
Главная
Вариант 1.
1. В химической лаборатории нельзя:
1) проводить опыты;
2) смешивать жидкости;
3) принимать пищу;
4) работать в халате.
2. Жидкости фильтруются с помощью:
1) выпарительной чашки и спиртовки;
2) воронки и фильтровальной бумаги;
3) ступки и пестика;
4) кристаллизатора и стеклянной палочки.
3. Знак химического элемента железо:
1) F; 2) Fе; 3) Gе; 4) Cu.
4. Атомы различных элементов различаются:
1) только по массе;
2) только по цвету;
3) по массе и по цвету;
4) по массе и по объему.
5. Для разделения несмешивающихся жидкостей используют:
1) делительную воронку;
2) обычную воронку;
3) ступку и пестик;
4) круглодонную колбу и холодильник.
Проверка знаний. Тест
Задание. Выберите один правильный ответ.
Слайд 24
6. Вещество – это:
1) стакан; 2) гвоздь;
3) железо; 4) конверт.
7. Смесь представляет собой:
1) вода; 2) сахар;
3) соляная кислота; 4) медь.
8. Моль – это:
1) число частиц, содержащихся в 1 г любого вещества;
2) 1/12 часть массы изотопа углерода 12С;
3) единица измерения физической величины – количества вещества;
4) число молекул, содержащихся в 22,4 л газа при нормальных условиях (н.у.).
9. Если воду добавить к серной кислоте, то:
1) эти жидкости не будут смешиваться;
2) произойдет сильное охлаждение раствора;
3) возможно вскипание и разбрызгивание раствора серной кислоты;
4) серная кислота вступит в реакцию обмена с водой.
10. Химический элемент – это:
1) разновидность атомов;
2) тип вещества;
3) класс молекул;
4) то же, что и простое вещество.
Главная
Слайд 25
Главная
Вариант 2
1. В химической лаборатории можно:
1) употреблять пищу;
2) склоняться для лучшего обзора над приборами при проведении опыта;
3) выливать реактивы в раковину;
4) выполнять опыты согласно инструкции.
2. Вещества в химической лаборатории растирают с помощью:
1) ступки и пестика;
2) стеклянной палочки и кристаллизатора;
3) любых подручных средств;
4) выпарительной чашки и штатива.
3. Знак химического элемента гелий:
1) Ge; 2) He; 3) Ga; 4) Hg.
4. Газообразные вещества, такие, как кислород, азот, водород, состоят из мельчайших частиц, называемых:
1) атомы; 2) молекулы;
3) химические элементы; 4) ионы.
5. Для разделения смешивающихся жидкостей используют:
1) круглодонную колбу, холодильник, приемник, штатив, электрическую плитку;
2) делительную воронку;
3) обычную воронку, фильтровальную бумагу и стакан;
4) плоскодонную колбу, дефлегматор, холодильник, спиртовку, приемник.
В химической лаборатории можно:
1) употреблять пищу;
2) склоняться для лучшего обзора над приборами при проведении опыта;
3) выливать реактивы в раковину;
4) выполнять опыты согласно инструкции.
2. Вещества в химической лаборатории растирают с помощью:
1) ступки и пестика;
2) стеклянной палочки и кристаллизатора;
3) любых подручных средств;
4) выпарительной чашки и штатива.
3. Знак химического элемента гелий:
1) Ge; 2) He; 3) Ga; 4) Hg.
4. Газообразные вещества, такие, как кислород, азот, водород, состоят из мельчайших частиц, называемых:
1) атомы; 2) молекулы;
3) химические элементы; 4) ионы.
5. Для разделения смешивающихся жидкостей используют:
1) круглодонную колбу, холодильник, приемник, штатив, электрическую плитку;
2) делительную воронку;
3) обычную воронку, фильтровальную бумагу и стакан;
4) плоскодонную колбу, дефлегматор, холодильник, спиртовку, приемник.
Слайд 26
6. Телом является:
1) графит; 2) алмаз;
3) бумага; 4) гвоздь.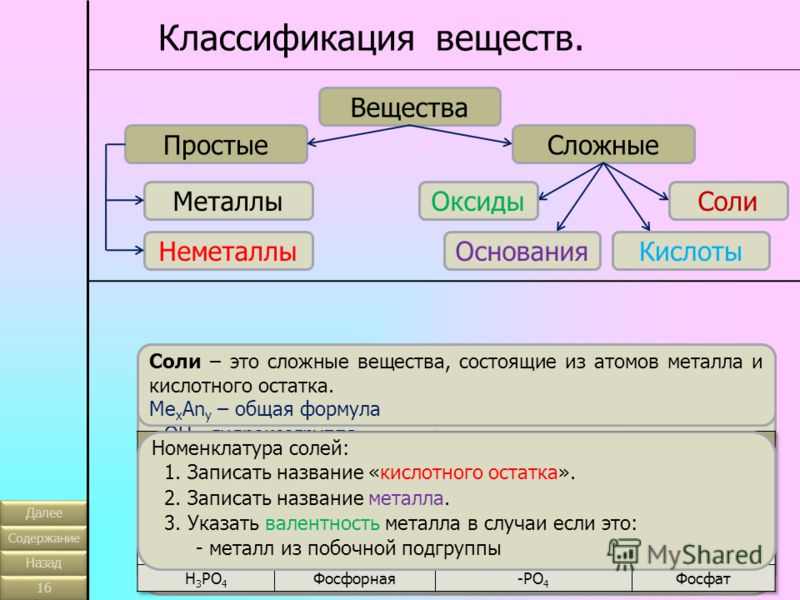 7. Смесь, которую можно разделить с помощью магнита:
1) сера и сахар;
2) медь и стекло;
3) песок и мел;
4) медные и стальные опилки.
8. Одинаковые количества вещества (в моль) различных веществ имеют также одинаковую:
1) массу:
2) объем;
3) число структурных единиц;
4) число атомов.
9. Емкости с кислотой вместимостью более 3 л категорически запрещено переносить в:
1) металлическом ведре;
2) руках;
3) корзине с прокладками из поролона или стружек;
4) пластмассовом ведре.
10. Химический элемент – это:
1) то же, что и простое вещество;
2) наименьшая химически неделимая частица;
3) то, из чего состоит вещество;
4) вид атомов.
7. Смесь, которую можно разделить с помощью магнита:
1) сера и сахар;
2) медь и стекло;
3) песок и мел;
4) медные и стальные опилки.
8. Одинаковые количества вещества (в моль) различных веществ имеют также одинаковую:
1) массу:
2) объем;
3) число структурных единиц;
4) число атомов.
9. Емкости с кислотой вместимостью более 3 л категорически запрещено переносить в:
1) металлическом ведре;
2) руках;
3) корзине с прокладками из поролона или стружек;
4) пластмассовом ведре.
10. Химический элемент – это:
1) то же, что и простое вещество;
2) наименьшая химически неделимая частица;
3) то, из чего состоит вещество;
4) вид атомов.
Главная
Слайд 27
Химический словарик
Аллотропия
Смесь
Простое вещество
Сложное вещество
Химическое соединение
Главная
Слайд 28
Тест
«Простые и сложные вещества»
Образовательный портал «Мой университет» Факультет «Реформа образования»
Мидакова Наталья Васильевна учитель I квалификационной категории
МОУ «Красночетайская СОШ» Красночетайский район Республика Чувашия
Выход
Старт
Слайд 29
По моделям молекул определите простое вещество
Задание. Выберите один правильный ответ.
Выберите один правильный ответ.
Слайд 30
2
По кристаллической решетке определите сложное вещество
Слайд 31
Выберите простое вещество
1. h3O
2. h3
3. h3O2
4. Nh4
0
Слайд 32
1. h3O
2. h3
3. h3O2
4. Nh4
1
Выберите простое вещество
Слайд 33
1. h3O
2. h3
3. h3O2
4. Nh4
2
Выберите простое вещество
Слайд 34
1. h3O
2. h3
3. h3O2
4. Nh4
3
Выберите простое вещество
Слайд 35
1. азот
2. кислород
3. молоко
4. хлор
0
Смесью является:
Слайд 36
1. азот
2. кислород
3. молоко
4. хлор
1
Смесью является:
Слайд 37
1. азот
2. кислород
3. молоко
4. хлор
2
Смесью является:
Слайд 38
1. кислород
2. азот
3. молоко
4. хлор
3
Смесью является:
Слайд 39
1. кислород
2. азот
3. молоко
4. хлор
хлор
4
Смесью является:
Слайд 40
1. сложное вещество
2. аллотропия
3. химическое соединение
4. молекула
0
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 41
1. сложное вещество
2. аллотропия
3. химическое соединение
4. молекула
1
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 42
1. сложное вещество
2. аллотропия
3. химическое соединение
4. молекула
2
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 43
1. сложное вещество
2. аллотропия
3. химическое
соединение
4. молекула
3
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 44
1. сложное вещество
2. аллотропия
аллотропия
3. химическое
соединение
4. молекула
4
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 45
1. сложное вещество
2. аллотропия
3. химическое соединение
4. молекула
5
Способность атомов химических элементов образовывать несколько простых веществ с разными свойствами называется
Слайд 46
1. отдельные атомы
2. молекула
3. сложное вещество
4. химическая связь
0
Что изображено на рисунке?
Слайд 47
1. отдельные атомы
2. молекула
3. сложное вещество
4. химическая связь
1
Что изображено на рисунке?
Слайд 48
1. отдельные атомы
2. молекула
3. сложное вещество
4. химическая связь
2
Что изображено на рисунке?
Слайд 49
1. отдельные атомы
2. молекула
3. сложное вещество
4. химическая связь
3
Что изображено на рисунке?
Слайд 50
1. отдельные атомы
отдельные атомы
2. молекула
3. химическая связь
4. сложное вещество
4
Что изображено на рисунке?
Слайд 51
1. отдельные атомы
2. молекула
3. химическая связь
4. сложное вещество
5
Что изображено на рисунке?
Слайд 52
1. отдельные атомы
2. молекула
3. химическая связь
4. сложное вещество
6
Что изображено на рисунке?
Слайд 53
1. иона
2. сложного вещества
4. молекулы
3. атома
0
Какая модель изображена на рисунке?
водород
Слайд 54
1. иона
2. сложного вещества
4. молекулы
3. атома
1
Какая модель изображена на рисунке?
водород
Слайд 55
1. иона
2. сложного вещества
4. молекулы
3. атома
2
Какая модель изображена на рисунке?
водород
Слайд 56
1 иона
2. сложного вещества
4. молекулы
3. атома
3
Какая модель изображена на рисунке?
водород
Слайд 57
1. иона
иона
2. сложного вещества
4. молекулы
3. атома
4
Какая модель изображена на рисунке?
водород
Слайд 58
1. иона
2. сложного вещества
4. молекулы
3. атома
5
Какая модель изображена на рисунке?
водород
Слайд 59
1. иона
2. сложного вещества
4. молекулы
3. атома
6
Какая модель изображена на рисунке?
водород
Слайд 60
1. иона
2. сложного вещества
4. молекулы
3. атома
7
Какая модель изображена на рисунке?
водород
Слайд 61
Начало
ОТЛИЧНО
Выход
Слайд 62
ХОРОШО
Выход
Начало
Слайд 63
УДОВЛЕТВОРИТЕЛЬНО
Выход
Начало
Слайд 64
ВАША ОЦЕНКА
Выход
Попробуйте снова
Слайд 65
Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
Модификации фосфора
Главная
Слайд 66
Просты́е вещества́ — вещества, состоящие исключительно из атомов одного химического элемента (в отличие от сложных веществ). Являются формой существования химических элементов в свободном виде, или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
Алмаз
Графит
Главная
Слайд 67
Сложные вещества — это химические вещества, которые состоят из атомов двух или более химических элементов. Сложными веществами являются большинство неорганических веществ и все органические.
Вода
Галит
Сильвинит
Главная
Слайд 68
Смесь — Продукт смешения, механического соединения каких-либо веществ. Например: горючая смесь, гелиево-кислородная смесь.
Молоко
Воздух
Главная
Слайд 69
Хими́ческое соедине́ние— сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов. Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами.
Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами.
Главная
Урок «Разнообразие веществ. Простые и сложные вещества»
УРОК № ___
Тема | Разнообразие веществ. Простые и сложные вещества
|
Цель | обучающая: углубить знания учеников о разнообразии веществ, их классификацию, расширить представление о простых и сложных веществах; формировать умение разделять вещества на простые и сложные, показать отличие строения и физических свойств простых веществ металлов и неметаллов; развивающая: развивать умение анализировать, сравнивать, строить обобщающие заключения, различать понятия, находить причинно-следственные связи; формировать практические знания и умения во время выполнения лабораторного опыта; воспитательная: воспитывать наблюдательность, умение работать самостоятельно.
|
Оборудование | учебник, карточки с заданиями, ноутбук, мультимедийный проектор, мультимедийная презентация «Разнообразие веществ. Простые и сложные вещества», периодическая система химических элементов Д. И. Менделеева, образцы металлов и неметаллов (медь, алюминий, график, сера), магнит, смесь серы и железа, пирит
|
Базовые понятия и термины | атомы, молекулы, химический элемент, простые и сложные вещества, смесь, металлы и неметаллы.
|
Тип урока | комбинированный |
ХОД УРОКА
- Организационный этап
- АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ УЧАЩИХСЯ
1. «Вспомни определение» (Слайд 1)
Атом, молекула, ион, химический элемент
Учитель. Вещества состоят из атомов, и, наверное, не было бы в природе такого многообразия веществ, если бы атомы не имели способности соединяться между собой. Из курса природоведения 5-6 классов вам известно, что вещества, в состав которых входят одинаковые атомы,- это простые вещества. Вещества, в состав которых входят разные атомы химических элементов,- сложные вещества.
Вещества состоят из атомов, и, наверное, не было бы в природе такого многообразия веществ, если бы атомы не имели способности соединяться между собой. Из курса природоведения 5-6 классов вам известно, что вещества, в состав которых входят одинаковые атомы,- это простые вещества. Вещества, в состав которых входят разные атомы химических элементов,- сложные вещества.
2. Интерактивное упражнение «Я — простое вещество; Я — сложное вещество» (Слайд 2)
На мультимедийном экране — таблица. Ученики анализируют строение веществ (из одинаковых или разных атомов они состоят) и после этого в определенных квадратиках «Я — простое вещество» или «Я — сложное вещество» появляются правильные ответы.
- МОТИВАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ
Проблемные вопросы: на уроке мы должны выяснить, во-первых, совершенна ли классификация химических элементов на металлы и неметаллы, и, во-вторых, чем обусловлено разнообразие веществ.
- СООБЩЕНИЕ ТЕМЫ И ЦЕЛИ УРОКА (Слайд 3)
- ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛ (Слайд 4)
На мультимедийном экране — «План изучения материала урока»:
- Классификация веществ на простые и сложные.
- Классификация простых веществ на металлы и неметаллы.
- Лабораторный опыт № 4 «Ознакомление с образцами простых и сложных веществ».
Учитель. Сегодня мы с вами усовершенствуем знания о простых и сложных веществах. В 7 классе определения формулируются так:
Простое вещество — это вещество, образованное атомами одного и того самого химического элемента.
Сложное вещество — это вещество, образованное атомами разных химических элементов.
Эти определения находятся у вас в учебнике на стр. 54. Прочтите их про себя.
1. Задача (Слайд 5)
Задача (Слайд 5)
Среди перечня химических формул в один столбик выписать простые вещества, во второй — сложные.
Вещества: Fe, CO, C3H8O3, H2, B, O3, KNO3, Zn, Al2O3, Pb
Простые вещества | Сложные вещества |
Fe, H2, B, O3, Zn, Pb | CO, C3H8O3, KNO3, Al2O3, |
Учитель. Все химические элементы периодической системы Д. И. Менделеева условно разделяют на две большие группы — «Металлы» и «Неметаллы». Они образуют простые вещества — металлы и неметаллы. Названия химических элементов и простых веществ могут совпадать и отличаться. Давайте рассмотрим некоторые примеры.
2. Работа с таблицей «Названия простых веществ и химических элементов» (Слайд 6)
Название простого вещества | Название химического элемента |
Азот | Нитроген |
Кислород | Оксиген |
Хлор | Хлор |
Кальций | Кальций |
Железо | Ферум |
Алюминий | Алюминий |
Медь | Купрум |
Вы должны помнить, что химический элемент — это вид атомов, а простое вещество — это соединение одинаковых атомов.
Учитель демонстрирует образцы металлов (меди, алюминия, цинка) и неметаллов (графита, серы, йода). Что общего для них и чем они отличаются? (Слайд 7)
3. Сообщение учеников о физических свойствах, строении металлов и неметаллов
(Демонстрация мультимедийной презентации с использованием ноутбука, мультимедийного экрана и проектора) (Слайд 8 — 22)
Сообщение 1-го ученика
Химические элементы металлы образуют простые вещества — металлы, например алюминий, железо, медь, хром и т.д. Металлы при обычных условиях твердые, кроме ртути. Имеют металлический блеск. Много металлов имеют серебристо-белый цвет, кроме некоторых. Например, золото — это желтый металл, медь — красно-желтый металл.
Металлы хорошо проводят электрический ток и тепло, в воде практически не растворяются. Все металлы имеют немолекулярное строение.
Сообщение 2-го ученика
Химические элементы неметаллы образуют простые вещества — неметаллы, например сера, фосфор, кислород, хлор и т.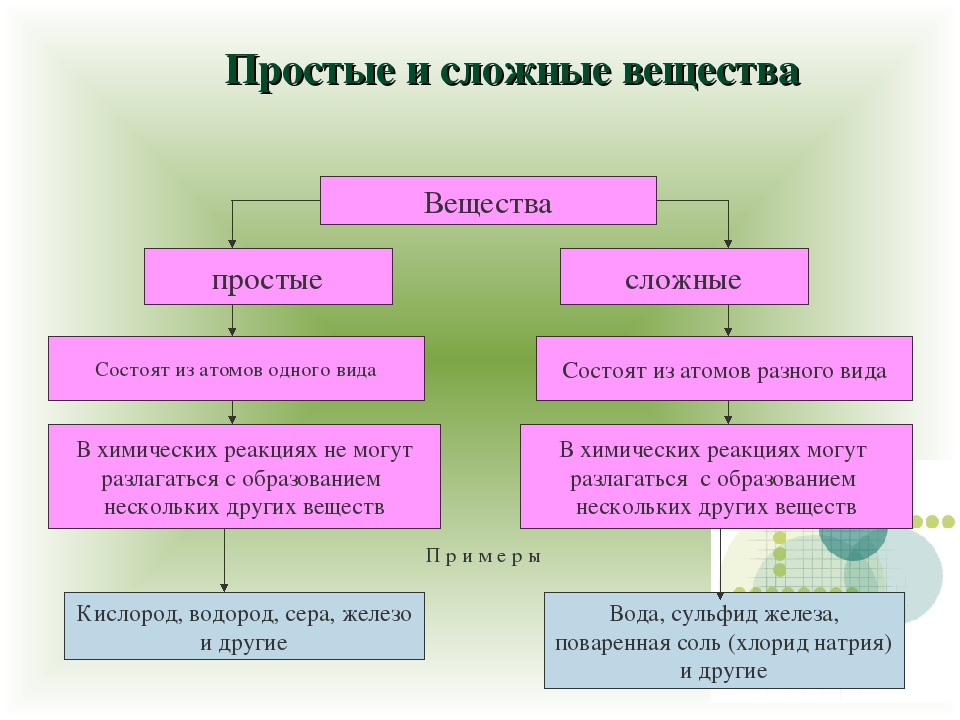 д. Неметаллические вещества имеют разное агрегатное состояние при обычных условиях (кислород — газ, бром — жидкость, сера — твердое вещество), разный цвет (сера — желтая, хлор — желто-зеленый, фосфор — белый или красный). Много неметаллических веществ имеют характерный запах, по-разному растворяются в воде (кислород — плохо, хлор — хорошо). Неметаллы преимущественно неэлектропроводные, имеют разное физиологическое действие (отравляющие — белый фосфор, хлор; неядовитые — азот, водород). Неметаллические вещества имеют как молекулярную (кислород, хлор, азот, водород), так и немолекулярное строение (красный фосфор, алмаз, кремний).
д. Неметаллические вещества имеют разное агрегатное состояние при обычных условиях (кислород — газ, бром — жидкость, сера — твердое вещество), разный цвет (сера — желтая, хлор — желто-зеленый, фосфор — белый или красный). Много неметаллических веществ имеют характерный запах, по-разному растворяются в воде (кислород — плохо, хлор — хорошо). Неметаллы преимущественно неэлектропроводные, имеют разное физиологическое действие (отравляющие — белый фосфор, хлор; неядовитые — азот, водород). Неметаллические вещества имеют как молекулярную (кислород, хлор, азот, водород), так и немолекулярное строение (красный фосфор, алмаз, кремний).
Учитель. Почему классификация химических элементов на металлы и неметаллы является условной? (Так же, как металлы могут проявлять некоторые неметаллические свойства, так и неметаллы — металлические)
4.Задача (Слайд 23)
Простые вещества из задачи 1 распределить на две группы — металлы и неметаллы.
Простые вещества | |
Fe, H2, B, O3, Zn, Pb | |
Металлы | Неметаллы |
Fe, Zn, Pb | H2, B, O3 |
Учитель. Чем объяснить большое разнообразие веществ? (Возможностью атомов химических элементов соединяться между собой в разнообразнейших соединениях и количественных соотношениях)
Вы должны четко различать понятия «сложное вещество» и «смесь». Например, если смешать порошки железа и серы, то мы увидим в этой смеси желтые частички серы и серые частички железа. (Демонстрирует) Каким образом можно разделить эту смесь? (С помощью магнита удалить частички железа) Теперь рассмотрим сложное вещество — естественное соединение Ферума и Сульфура — пирит. (Демонстрирует. ) Какого оно цвета и является ли однородным? (Однородное вещество темно-серого цвета) Попробуем его разделить с помощью магнита. Получилось ли это сделать? Если нет, то почему? (Потому что в сложном веществе свойства простых веществ, из которых оно состоит, не сохраняются)
) Какого оно цвета и является ли однородным? (Однородное вещество темно-серого цвета) Попробуем его разделить с помощью магнита. Получилось ли это сделать? Если нет, то почему? (Потому что в сложном веществе свойства простых веществ, из которых оно состоит, не сохраняются)
5. Работа с таблицей «Сложные вещества и смеси» (Слайд 24)
Признаки | Сложные вещества | Смеси |
Состав | Постоянный | Переменный |
Свойства | Постоянные | Зависят от состава |
Возможность разделения | Физически неразделимые | Можно разделить физическим способом |
6. Лабораторный опыт № 4 «Ознакомление с образцами простых и сложных веществ» (Слайд 25 — 26)
Тема. | Ознакомление с образцами простых и сложных веществ |
Цель: | ознакомиться с образцами простых и сложных веществ, научиться различать их |
Реактивы: І вариант натрий хлорид (поваренная соль — NaCl), медь (Cu), графит (С), кальций карбонат (мел — CaCO3).
IІ вариант алюминий (Al), графит (С), натрий гидрогенкарбонат (пищевая сода – NaHCO3),сахар (С12Н22О11).
Задание: 1. Рассмотрите выданные вам вещества в соответствии с вариантом. Опишите их физические свойства: агрегатное состояние, цвет, блеск, запах, кристалличность, твердость.
2. Внесите в таблицу название каждого вещества, описание физических свойств.
3. Распределите вещества на простые и сложные, а простые на металлы и неметаллы, поставив знак «+» в соответствующий столбец таблицы.
Название вещества, формула | Физические свойства | Простое вещество | Сложное вещество | |
Металл | Неметалл | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
- На основе изученного на уроке материала устно заполнить схему «Классификация веществ»: (Слайд 27)
- Выполнение теста с последующей взаимопроверкой.
 Один правильный ответ – 1 балл.
Один правильный ответ – 1 балл.
Тесты (Слайд 28)
- Выбрать простое вещество:
а) МgO; б)O2; в) NaCl.
- Указать неметалл:
а) водород; б) ртуть; в) хром.
- Указать название химического элемента металла, который не совпадает с названием простой вещества металла:
а) Плюмбум; б) Алюминий; в) Цинк.
4. Среди неметаллов есть вещества:
а) отравляющие;
б) неядовитые;
в) как отравляющие, так и неядовитые.
- Металлы преимущественно имеют цвет:
а) белый;
б) серебристо-белый;
в) желтый.
- Все неметаллы имеют агрегатное состояние:
а) твердое и жидкое;
б) жидкое и газообразное;
в) твердое, жидкое, газообразное.
- Жидкое агрегатное состояние при обычных условиях имеет металл:
а) свинец; б) ртуть; в) медь.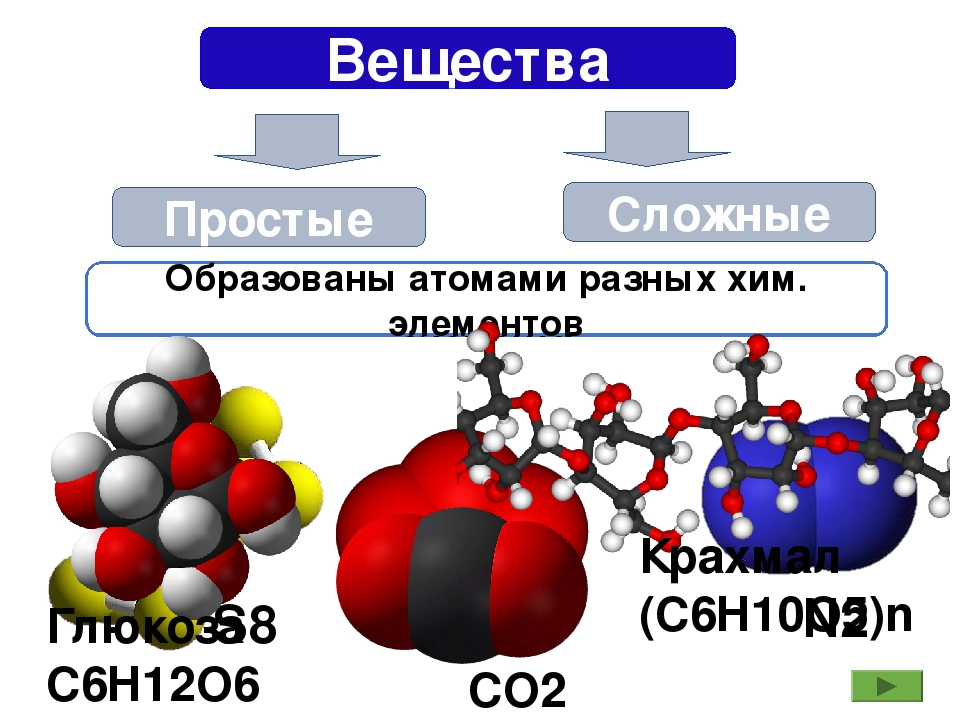
- Неметаллы в воде:
а) все растворимые;
б) все нерастворимые;
в) как растворимые, так и нерастворимые.
- Металлы имеют строение:
а) только молекулярную;
б) только немолекулярную;
в) как молекулярную, так и немолекулярную.
- Неметаллы:
а) все электропроводные;
б) все неэлектропроводные;
в) как электропроводные, так и неэлектропроводные.
- Выбрать строку, в которой металлы имеют разный цвет:
а) золото, медь, ртуть;
б) хром, вольфрам, свинец;
в) железо, алюминий, цинк.
Ответ
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
б | а | а | в | б | в | б | в | б | в | а |
- ПОДВЕДЕНИЕ ИТОГОВ УРОКА.

Выставление оценок
- ДОМАШНЕЕ ЗАДАНИЕ (Слайд 29)
- Читать § 11
- Выучить определения стр. 88
- Письменно в тетради упр. 2, 3, 5 с 89
- Творческое задание: подумайте и ответьте на вопрос какие вещества более важные в жизни: просты или сложные?
элементов и соединений | Введение в химию
Цель обучения
- Различать элементы и соединения и изучать методы разделения
Ключевые моменты
- Элементы — это простейшие законченные химические вещества. Каждый элемент соответствует одной записи в периодической таблице. Элемент — это материал, состоящий из одного типа атомов. Каждый тип атома содержит одинаковое количество протонов.
- Химические связи соединяют элементы вместе, образуя более сложные молекулы, называемые соединениями. Соединение состоит из двух или более типов элементов, удерживаемых вместе ковалентными или ионными связями.
- Элементы не могут быть разделены на более мелкие части без большого количества энергии. Соединения, с другой стороны, могут быть разорваны с помощью практического количества энергии, например тепла от огня.
- Вещество можно разделить на две категории: чистые вещества и смеси.Чистые вещества далее разбиваются на элементы и соединения. Смеси представляют собой физически комбинированные структуры, которые можно снова разделить на их исходные компоненты.
Условия
- элемент: Любое одно из простейших химических веществ, которое нельзя изменить с помощью химической реакции или каких-либо химических средств. Состоит из атомов, имеющих одинаковое количество протонов.
- соединение: Вещество, состоящее из двух или более элементов. Состоит из фиксированного соотношения химически связанных атомов.Обладает уникальными свойствами, которые отличаются от свойств отдельных его элементов.
- химическая связь: Любая из нескольких сил притяжения, которые служат для связывания атомов вместе с образованием молекул.
Элементы
Химический элемент — это чистое вещество, состоящее из одного типа атомов. У каждого атома есть атомный номер, который представляет количество протонов, находящихся в ядре одного атома этого элемента. Периодическая таблица элементов упорядочена по возрастанию атомного номера.
Химические элементы делятся на металлы, металлоиды и неметаллы. Металлы, обычно встречающиеся в левой части таблицы Менделеева:
- часто проводит к электричеству
- податливый
- блестящий
- иногда магнитный.
Алюминий, железо, медь, золото, ртуть и свинец являются металлами.
В отличие от неметаллов, которые можно найти в правой части таблицы Менделеева (справа от лестницы):
- обычно непроводящий
- не податливый
- тусклый (не блестящий)
- немагнитный.
Примеры элементарных неметаллов включают углерод и кислород.
Металлоиды обладают некоторыми характеристиками металлов и некоторыми характеристиками неметаллов. Кремний и мышьяк — металлоиды.
Кремний и мышьяк — металлоиды.
По состоянию на ноябрь 2011 г. было идентифицировано 118 элементов (самым последним из них был идентифицирован ununseptium в 2010 г.). Из этих 118 известных элементов только первые 98 встречаются на Земле в естественных условиях. Элементы, которые не встречаются в природе на Земле, являются синтетическими продуктами ядерных реакций, созданных человеком.80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
Периодическая таблица Периодическая таблица Менделеева содержит 118 элементов, включая металлы (синий), неметаллы (красный) и металлоиды (зеленый).
Водород и гелий — самые распространенные элементы во Вселенной. Однако железо является самым распространенным элементом (по массе) в составе Земли, а кислород — наиболее распространенным элементом в слое земной коры.
Хотя вся известная химическая материя состоит из этих элементов, сама химическая материя составляет лишь около 15% материи во Вселенной.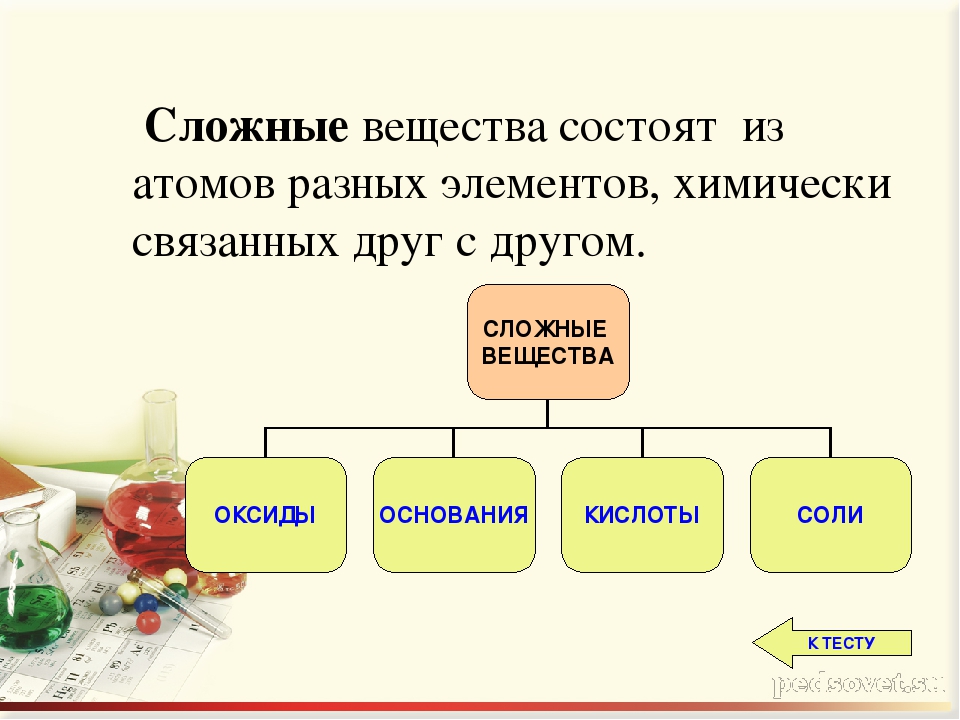 Остальное — темная материя, загадочная субстанция, не состоящая из химических элементов. Темной материи не хватает протонов, нейтронов или электронов.
Остальное — темная материя, загадочная субстанция, не состоящая из химических элементов. Темной материи не хватает протонов, нейтронов или электронов.
Соединения
Чистые образцы изолированных элементов редко встречаются в природе. В то время как 98 природных элементов были идентифицированы в образцах минералов из земной коры, лишь небольшая часть из них может быть обнаружена как узнаваемые, относительно чистые минералы.Среди наиболее распространенных таких «самородных элементов» — медь, серебро, золото и сера. Углерод также обычно встречается в форме угля, графита и алмазов. Благородные газы (например, неон) и благородные металлы (например, ртуть) также можно найти в их чистых, несвязанных формах в природе. Тем не менее, большинство этих элементов находится в смесях.
Когда два различных элемента химически объединены, то есть между их атомами образуются химические связи, результат называется химическим соединением. Большинство элементов на Земле связываются с другими элементами, образуя химические соединения, такие как натрий (Na) и хлорид (Cl), которые вместе образуют поваренную соль (NaCl). Вода — еще один пример химического соединения. Два или более компонентов соединения можно разделить с помощью химических реакций.
Вода — еще один пример химического соединения. Два или более компонентов соединения можно разделить с помощью химических реакций.
Химические соединения имеют уникальную и определенную структуру, которая состоит из фиксированного соотношения атомов, удерживаемых вместе в определенном пространственном расположении химическими связями. Химические соединения могут быть:
- молекулярные соединения, удерживаемые вместе ковалентными связями
- солей, удерживаемых ионными связями
- интерметаллические соединения, удерживаемые металлическими связями
- комплексов, скрепленных координатными ковалентными связями.
Чистые химические элементы не считаются химическими соединениями, даже если они состоят из двухатомных или многоатомных молекул (молекул, содержащих только несколько атомов одного элемента, например H 2 или S 8 ).
Chemistry 1.2 Classification Matter (Part 2 of 3) — YouTube В этом видео обсуждаются чистые вещества, сравниваются элементы и соединения, а также химические изменения противопоставляются физическим изменениям.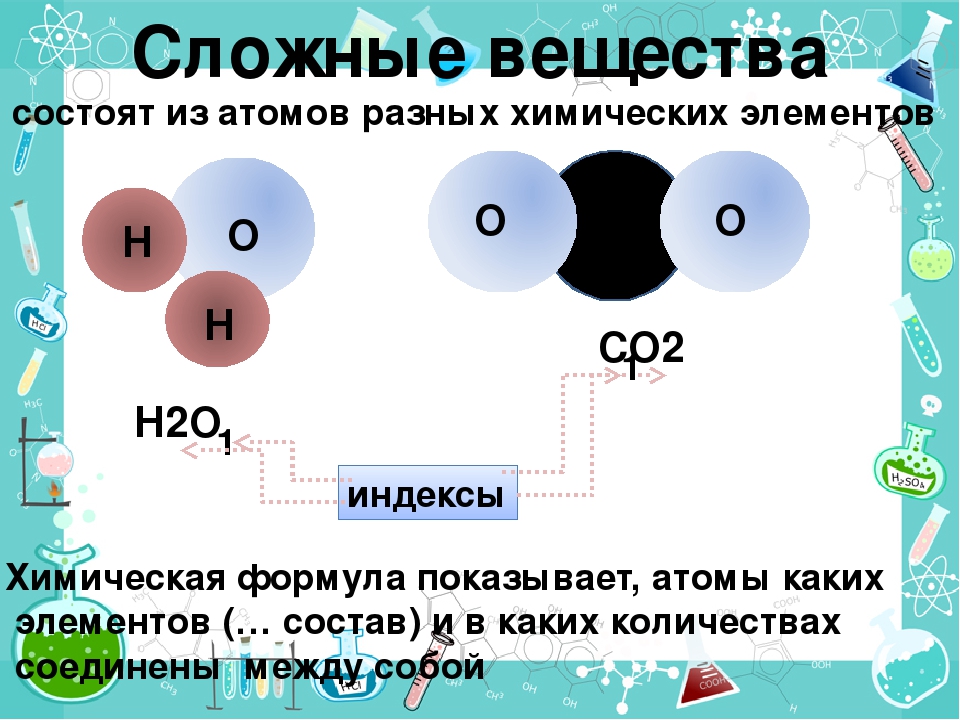
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Элементы и соединения Вводное пособие по химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Элементы
Элемент определяется как чистое вещество, которое не может быть разложено (разложено) на более простые вещества.
Например, если вы нагреете газообразный азот, он станет горячее, но не разложится (разложится) на что-либо более простое, чем азот.
Есть 92 встречающихся в природе элемента.
Кроме того, существует более 20 искусственных элементов (синтетические элементы или искусственные элементы).
Все известные элементы, как природные, так и синтетические, перечислены в Периодической таблице элементов.
Каждому элементу дано уникальное имя и уникальный химический символ.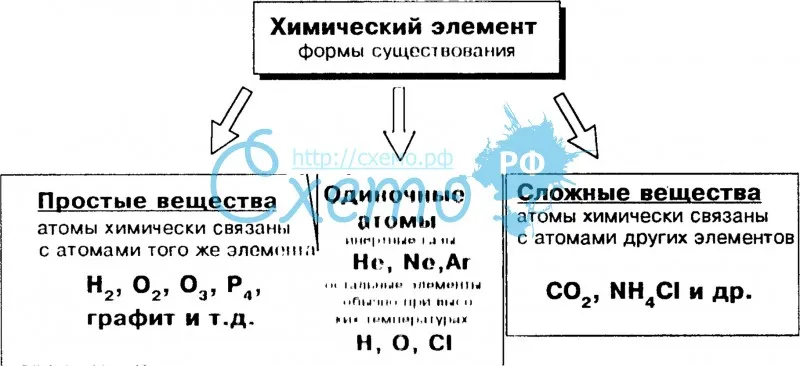
Этот химический символ элемента чаще всего основан на текущем названии элемента или, в некоторых случаях, на более старом названии элемента. (1)
Химический символ элемента может состоять из 1 или 2 букв:
- первая буква химического символа элемента всегда заглавная буква (заглавная буква)
Например:
h водород — элемент с химическим обозначением H
c arbon — элемент с химическим обозначением C
n итроген — элемент с химическим обозначением N - , если в химическом символе элемента есть вторая буква, это всегда строчная буква
Например:
he lium — элемент с химическим обозначением He
ca lcium — элемент с химическим обозначением Ca
ne on has — это элемент с химическим обозначением Ne
Учителя химии часто просят своих учеников запомнить названия и химические символы первых 20 элементов периодической таблицы элементов, поэтому вот они: (2)
| H водород | He гелий | ||||||
| Li литий | Be бериллий | B бор | C углерод | N азот | O кислород | F фтор | Ne неон |
| Na натрий | мг магний | Al алюминий | Si кремний | P фосфор | S сера | Cl хлор | Ar аргон |
| K калий | Ca кальций | ||||||
Вас также могут попросить запомнить названия и химические символы некоторых распространенных полезных элементов, таких как:
| Fe железо | Ni никель | Cu медь | Zn цинк | Ag серебристый |
| Sn банка | Pt платина | Au золото | Hg ртуть | Pb свинец |
Элементы могут присутствовать в природе в виде твердых тел, жидкостей или газов.
Из 92 встречающихся в природе элементов:
- 2 элемента существуют как жидкости
- 11 элементов существуют в виде газов
- остальные 79 природных элементов существуют в виде твердых тел.
Названия и химические символы элементов, которые встречаются в природе в виде твердых тел, жидкостей и газов, приведены в таблице ниже:
| Жидкие элементы | Газообразные элементы | Сплошные элементы (некоторые примеры ниже) |
|---|---|---|
|
|
|
Наиболее распространенные элементы во вселенной:
- водород (H)
- гелий (He)
- кислород (O)
- углерод (C)
Атмосфера Земли состоит из смеси разных газов, но в основном состоит из двух элементов:
- азот (что составляет около 78% атмосферы)
- кислорода (что составляет около 21% атмосферы)
Общие элементы, обнаруженные в земной коре:
- кислород (O)
- кремний (Si)
- алюминий (Al)
- железо (Fe)
- кальций (Ca)
- натрия (Na)
- калий (К)
- магний (мг)
- водород (H)
Наиболее распространенные элементы, встречающиеся в живых существах:
- углерод (C)
- водород (H)
- кислород (O)
- азот (N)
- фосфор (P)
- серы (S)
Рабочие примеры
(Использование модели StoPGoPS для решения проблем.)
Вопрос 1
Газообразный кислород (химическая формула O 2 ) составляет около 21% атмосферы Земли.
Кислород — это элемент или соединение?
Что вас просят сделать?
Определите, является ли газообразный кислород элементом или соединением.
Какую информацию вы дали в вопросе?
Название: газообразный кислород
Химическая формула: O 2
Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
(i) Элементы не могут быть разложены на более простые вещества, потому что они состоят только из одного элемента.
(ii) Соединения можно разложить на более простые вещества, поскольку они состоят из 2 или более элементов.
Ответьте на вопрос.
Газообразный кислород (химическая формула O 2 ) состоит ТОЛЬКО из элемента кислород (химический символ O)
Газообразный кислород должен быть элементом.
Ваш ответ правдоподобен?
Если вы посмотрите в периодической таблице элементов, вы найдете кислород (O), указанный как элемент.
Следовательно, кислород — это элемент. Неважно, называете ли вы его газообразным кислородом, жидким кислородом или твердым кислородом, все это относится к элементу кислород.
Укажите свой ответ.
Кислород — это элемент.
Вопрос 2
Карбонат кальция (химическая формула CaCO 3 ) содержится в известняке.
Назовите элементы, входящие в состав карбоната кальция.
Что вас просят сделать?
Назовите элементы, содержащиеся в карбонате кальция, CaCO 3
Какую информацию вы дали в вопросе?
Название соединения: карбонат кальция.
Химическая формула соединения: CaCO 3
Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
(i) Соединения состоят из 2 или более элементов.
(ii) Химическая формула соединения включает символ каждого элемента, присутствующего в соединении.
Ответьте на вопрос.
(i) Разбейте химическую формулу на символы элементов:
Химическая формула: CaCO 3 Обозначение каждого элемента Ca С O (ii) Используйте периодическую таблицу элементов, чтобы найти название элемента, соответствующего каждому химическому символу:
Химическая формула: CaCO 3 Обозначение каждого элемента Ca С O Название каждого элемента кальций углерод кислород
Ваш ответ правдоподобен?
Работа в обратном направлении.
Используйте периодическую таблицу, чтобы найти символ каждого элемента, который вы назвали:
кальций, Ca
углерод, C
кислород, OПосмотрите, сможете ли вы расположить эти химические символы так, как они отображаются в химической формуле:
CaCOПоскольку это соответствует тому же порядку, который мы находим в химической формуле (CaCO 3 : CaCO) без добавленных и пропущенных символов, мы достаточно уверены, что наш ответ правдоподобен.
Укажите свой ответ.
Карбонат кальция состоит из элементов кальция, углерода и кислорода.
химический элемент | Определение, происхождение, распространение и факты
Химический элемент , также называемый элементом , любое вещество, которое не может быть разложено на более простые вещества обычными химическими процессами. Элементы — это фундаментальные материалы, из которых состоит вся материя.
Британская викторина
Подводки к химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
В этой статье рассматривается происхождение элементов и их распространенность во Вселенной.Подробно рассматривается геохимическое распределение этих элементарных веществ в земной коре и недрах, а также их присутствие в гидросфере и атмосфере. В статье также рассматривается периодический закон и табличное расположение элементов на его основе. Для получения подробной информации о соединениях элементов, см. химическое соединение.
Редакция Британской энциклопедии
Общие наблюдения
В настоящее время известно 118 химических элементов.Около 20 процентов из них не существуют в природе (или присутствуют только в следовых количествах) и известны только потому, что были синтетически получены в лаборатории. Из известных элементов 11 (водород, азот, кислород, фтор, хлор и шесть благородных газов) являются газами при обычных условиях, два (бром и ртуть) являются жидкостями (еще два, цезий и галлий, плавятся примерно при температуре выше комнатной температуры), а остальное — твердые частицы. Элементы могут объединяться друг с другом, образуя широкий спектр более сложных веществ, называемых соединениями.Число возможных соединений практически бесконечно; возможно, известен миллион, и каждый день открывается все больше. Когда два или более элемента объединяются в соединение, они теряют свою индивидуальность, и продукт имеет характеристики, совершенно отличные от характеристик составляющих элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут объединяться с образованием сложной воды, которая имеет совершенно другие свойства, чем кислород или водород.Очевидно, что вода не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и фактически может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества никаким известным химическим процессом. Большинство образцов естественного вещества представляют собой физические смеси соединений. Например, морская вода представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других компонентов морской воды.
Историческое развитие концепции элемента
Современная концепция элемента однозначна, поскольку она зависит от использования химических и физических процессов в качестве средства отделения элементов от соединений и смесей. Однако существование фундаментальных веществ, из которых состоит вся материя, было основой многих теоретических предположений с самого начала истории. Древнегреческие философы Фалес, Анаксимен и Гераклит предполагали, что вся материя состоит из одного существенного принципа — элемента.Фалес считал, что этот элемент — вода; Анаксимен предложил воздух; и Гераклит, огонь. Другой греческий философ, Эмпедокл, выразил иную веру — что все вещества состоят из четырех элементов: воздуха, земли, огня и воды. Аристотель согласился и подчеркнул, что эти четыре элемента являются носителями фундаментальных свойств: сухость и тепло связаны с огнем, тепло и влага — с воздухом, влажность и холод — с водой, а холод и сухость — с землей. В мышлении этих философов все другие вещества должны были быть комбинациями четырех элементов, и считалось, что свойства веществ отражают их элементный состав.Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята в терминах элементарных качеств; в этом смысле сами элементы считались нематериальными. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Во второй половине средневековья, когда алхимики стали более изощренными в своих знаниях о химических процессах, греческие концепции состава материи стали менее удовлетворительными.Были введены дополнительные элементарные качества, чтобы приспособиться к недавно обнаруженным химическим превращениям. Таким образом, сера стала олицетворять горючесть, ртуть — летучесть или текучесть, а соль — стойкость в огне (или негорючесть). Эти три алхимических элемента или принципа также представляют собой абстракции свойств, отражающих природу материи, а не физических субстанций.
Важное различие между смесью и химическим соединением в конце концов было понято, и в 1661 году английский химик Роберт Бойль осознал фундаментальную природу химического элемента.Он утверждал, что четыре греческих элемента не могут быть настоящими химическими элементами, потому что они не могут соединяться с образованием других веществ и не могут быть извлечены из других веществ. Бойль подчеркивал физическую природу элементов и соотносил их с соединениями, которые они образуют, современными методами.
В 1789 году французский химик Антуан-Лоран Лавуазье опубликовал то, что можно считать первым списком элементарных веществ, основанным на определении Бойля. Список элементов Лавуазье был составлен на основе тщательного количественного исследования реакций разложения и рекомбинации.Поскольку он не мог проводить эксперименты по разложению определенных веществ или формированию их из известных элементов, Лавуазье включил в свой список элементов такие вещества, как известь, глинозем и кремнезем, которые, как теперь известно, являются очень стабильными соединениями. На то, что Лавуазье все еще сохранилось влияние древнегреческой концепции элементов, указывает его включение света и тепла (калорийности) в число элементов.
Семь веществ, признанных сегодня элементами, — золото, серебро, медь, железо, свинец, олово и ртуть — были известны древним, поскольку встречаются в природе в относительно чистой форме.Они упоминаются в Библии и в раннем индуистском медицинском трактате Caraka-samhita . Шестнадцать других элементов были открыты во второй половине 18 века, когда методы отделения элементов от их соединений стали более понятными. Еще восемьдесят два последовали после внедрения количественных аналитических методов.
Пищеварение и другие связанные процессы
Пищеварение и другие связанные процессы
Автор сайта Ричард Стейн | Веб-сайт BioTopics предоставляет доступ к интерактивным ресурсным материалам, разработанным для поддержки | |
В настоящее время в вашем браузере не включен javascript. Это ограничит некоторые интерактивные возможности этих страниц.
В следующем разделе рассматриваются следующие процессы:
прием внутрь, пищеварение, пищеварение, абсорбция, ассимиляция, дыхание, выделение, дефекация
Большая часть нашей пищи попадает в организм ( глотает ed) в твердой форме , но она должна быть преобразована в жидкую форму [как раствор], прежде чем она попадет в кровоток ( абсорбирует ред) и передается по разным частям внутри него.Хотя обычно мы пьем много воды одновременно, маловероятно, что большинство
пища просто растворяется, поэтому она должна быть расщеплена химически и физически ( переваривать ed) на более простые вещества [с более мелкими молекулами], которые будут растворяться. Затем более простые вещества могут быть доставлены в клетки организма и использованы либо в качестве топлива для получения энергии ( respir, ed), либо в качестве сырья , чтобы снова создать для роста и восстановления ( assimilat ed), но что угодно который не используется организмом, избавляется при опорожнении кишечника ( defaecat ion или egest ion).
Не следует путать с выделением иона , который представляет собой удаление продуктов жизнедеятельности, образующихся внутри клеток.
Как называется [целая] трубка, в которой происходят эти процессы?
кишечник или пищеварительный тракт
Каковы основные причины:
а) физическое расщепление пищи? [ подсказка — обычно их 20-32 ]
> зубьев
б) химический распад пищи на более простые вещества?
> ферментов
Что переносит более простые вещества по телу?
> кровь / кровоток
Каково биологическое название конечных отходов процесса?
> фекалий
Почему вероятно, что пищевые волокна будут частью этого?
> не растворяется / не переваривается
Назовите некоторые классы пищевых веществ или ингредиентов, которые не нужно разбивать (на более простые субъединицы) перед употреблением:
> минералов / витаминов / (простых) сахаров
Измерьте расстояние между сиденьем и ртом с помощью линейки: ? 70 см.
Используя это и цифру из книги, оцените, сколько раз ваш кишечник свернулся. .
> примерно в 10 раз
Объясните, почему даже это значение может быть заниженным. .
[clue: Через какие основные области тела проходит кишечник? Там много места? ]
> Пищевод (глотка) проходит прямо через грудную клетку
ПИЩЕВЫЕ ФЕРМЕНТЫ
В разных частях кишечника выделяются различные пищеварительные соки. Они содержат несколько различных типов ферментов , каждый из которых имеет конкретную цель : расщепление определенного типа основных пищевых компонентов (углеводов, жиров, белков) на более простые вещества, которые могут легко усваиваться.
Заполните приведенную ниже таблицу, суммируя эффекты различных типов ферментов. Эти термины могут быть общими (*) или конкретными (@) — см. Примеры, уже добавленные в верхние 2 строки ниже.
Было бы полезно вернуться к работе по основным классам продуктов .
| Класс ПИЩЕВЫХ ПРОДУКТОВ: | с разбивкой на УПРОЩЕННЫЕ ПОДБОРНИКИ: | от ENZYMES по телефону: |
|---|---|---|
| * Углеводы @ e.грамм. крахмал | — простые сахара, например глюкоза — мальтоза (2 единицы глюкозы, соединенные) | карбогидразы амилазы (см. Более позднюю работу) |
| Жиры и масла | > жирных кислот и глицерина | > липазы |
| Белки | > аминокислот | > протеаз |
Ферменты сами по себе являются белками , и им нужны особые условия для работы: теплая температура, много воды и определенный pH — некоторым нужны нейтральные условия (значение pH около 7 ), а другим нуждаются в кислых условиях (значения pH ниже 7 ), а другие нуждаются в щелочных условиях (значения pH выше 7 ).Каждая часть кишечника обычно обеспечивает правильные условия для ферментов, которые там находятся.
Однако важно понимать, что пищеварительные соки, содержащие кислоты и щелочи, а также эмульгирующие агенты, просто обеспечивают идеальные условия для действия ферментов . Например, кислота, содержащаяся в желудке, не
сама по себе расщепляющая (белковая) пища; это фермент пепсин, который расщепляет белок в кислой среде желудка.
Ферменты иногда называют биологическими катализаторами , потому что они ускоряют реакции , и требуются лишь небольшие количества.Пищеварительные ферменты ускоряют расщепление сложных пищевых веществ на более простые субъединицы. Расщепление пищи в процессе пищеварения на самом деле вызвано химическим расщеплением водой сложных молекул пищи, процессом, называемым гидролизом (но это не то же самое, что простое растворение).
Обратите внимание, что пищеварительные ферменты не расщепляют пищу на элементы, из которых она состоит, и не выделяют энергию из пищи. Это происходит, когда более простые пищевые вещества вдыхаются отдельными клетками.
Назовите некоторые пищевые вещества, которые почти полностью состоят из крахмала:
> рис > хлеб > картофель, макароны и т. Д.
Какие молекулы крахмала состоят из молекул более простых веществ? ( 2 возможных ответа )
> глюкоза > мальтоза
Какие 2 структуры должны пройти небольшие молекулы, чтобы попасть в кровоток?
> стенка кишечника > кровеносный капилляр
Демонстрация: переваривание Quavers
Эту закуску, состоящую в основном из крахмала, помещают в 2 жидкости при 2 разных температурах и оставляют на некоторое время.
Переваривание проявляется, если продукт распадается. Это больше, чем просто промокнуть!
Заполните результаты в соответствующее время в таблице ниже:
Quavers размещены в
водяная баня
водяная баня
Что это говорит вам о комбинации факторов, которые необходимы для переваривания дрожжевого теста?
> Должны присутствовать и амилаза, и тепло
Периодическая таблица элементов — Введение в химию — 1-е канадское издание
Дэвид В.Мяч
Глава 17 Приложение: Периодическая таблица элементов
В этой главе мы приводим некоторые данные о химических элементах. В периодической таблице, представленной в главе 3 «Атомы, молекулы и ионы», перечислены все известные химические элементы, упорядоченные по атомному номеру (то есть количеству протонов в ядре). Периодическая таблица Менделеева, возможно, лучший инструмент во всей науке; никакая другая отрасль науки не может резюмировать свои фундаментальные составляющие таким кратким и полезным образом.Многие физические и химические свойства элементов известны или понятны в зависимости от их положения в периодической таблице. Доступны периодические таблицы с различными химическими и физическими свойствами, указанными в поле каждого элемента. Далее следует более сложная версия таблицы Менделеева, чем та, что была представлена в главе 3 «Атомы, молекулы и ионы». Интернет — отличное место для поиска периодических таблиц, содержащих дополнительную информацию.
Одним из пунктов большинства периодических таблиц является атомная масса каждого элемента.Для многих приложений для атомной массы необходимы только один или два десятичных знака. Однако в некоторых приложениях (особенно в ядерной химии; см. Главу 15 «Ядерная химия») требуется больше десятичных знаков. Атомные массы в Таблице 17.1 «Основы элементов Периодической таблицы» представляют количество десятичных знаков, признанных Международным союзом чистой и прикладной химии, всемирной организацией, которая разрабатывает стандарты для химии. Атомные массы некоторых элементов известны очень точно, с точностью до большого числа десятичных знаков.Атомные массы других элементов, особенно радиоактивных, точно не известны. Некоторые элементы, такие как литий, могут иметь различные атомные массы в зависимости от того, как изолированы их изотопы.
Интернет предлагает множество интерактивных ресурсов по периодической таблице. Например, см. Http://www.ptable.com.
Таблица 17.1 Основы элементов Периодической таблицы
| Имя | Атомный символ | Атомный номер | Атомная масса | Сноски | |
|---|---|---|---|---|---|
| актиний * | Ac | 89 | |||
| алюминий | Al | 13 | 26.9815386 (8) | ||
| америций * | Am | 95 | |||
| сурьма | Сб | 51 | 121.760 (1) | г | |
| аргон | Ar | 18 | 39,948 (1) | г, р | |
| мышьяк | как | 33 | 74. | ||
| астатин * | по адресу | 85 | |||
| барий | Ba | 56 | 137.327 (7) | ||
| берклий * | Bk | 97 | |||
| бериллий | Be | 4 | 9.012182 (3) | ||
| висмут | Bi | 83 | 208.98040 (1) | ||
| бориум * | Bh | 107 | |||
| бор | B | 5 | 10.811 (7) | г, м, r | |
| бром | руб. | 35 | 79,904 (1) | ||
| кадмий | Cd | 48 | 112.411 (8) | г | |
| цезий (цезий) | CS | 55 | 132. | ||
| кальций | Ca | 20 | 40.078 (4) | г | |
| калифорний * | Cf | 98 | |||
| угольный | С | 6 | 12.0107 (8) | г, р | |
| церий | CE | 58 | 140.116 (1) | г | |
| хлор | Класс | 17 | 35,453 (2) | г, м, r | |
| хром | Cr | 24 | 51,9961 (6) | ||
| кобальт | Co | 27 | 58. 5 (5) | ||
| коперниций * | Cn | 112 | |||
| медь | Cu | 29 | 63.546 (3) | r | |
| кюрий * | см | 96 | |||
| дармштадтиум * | DS | 110 | |||
| дубний * | Db | 105 | |||
| диспрозий | Dy | 66 | 162,500 (1) | г | |
| эйнштейний * | Es | 99 | |||
| эрбий | Er | 68 | 167.259 (3) | г | |
| европий | Eu | 63 | 151.964 (1) | г | |
| фермий * | Fm | 100 | |||
| фтор | F | 9 | 18.9984032 (5) | ||
| франций * | Fr | 87 | |||
| гадолиний | Gd | 64 | 157.25 (3) | г | |
| галлий | Ga | 31 | 69,723 (1) | ||
| германий | Ge | 32 | 72,64 (1) | ||
| золото | Au | 79 | 196.966569 (4) | ||
| гафний | Hf | 72 | 178,49 (2) | ||
| хассий * | HS | 108 | |||
| гелий | He | 2 | 4.002602 (2) | г, р | |
| гольмий | Ho | 67 | 164. (2) | ||
| водород | H | 1 | 1,00794 (7) | г, м, r | |
| индий | В | 49 | 114,818 (3) | ||
| йод | I | 53 | 126.
| ||
| иридий | Ir | 77 | 192.217 (3) | ||
| утюг | Fe | 26 | 55,845 (2) | ||
| криптон | Кр | 36 | 83,798 (2) | г, м | |
| лантан | La | 57 | 138. | (7) | г |
| лоуренсий * | Lr | 103 | |||
| свинец | Пб | 82 | 207.2 (1) | г, р | |
| литий | Li | 3 | [6,941 (2)] † | г, м, r | |
| лютеций | Лю | 71 | 174,967 (1) | г | |
| магний | мг | 12 | 24,3050 (6) | ||
| марганец | Mn | 25 | 54.938045 (5) | ||
| мейтнерий * | Mt | 109 | |||
| менделевий * | Md | 101 | |||
| ртуть | Hg | 80 | 200.59 (2) | ||
| молибден | Пн | 42 | 95,94 (2) | г | |
| неодим | Nd | 60 | 144,242 (3) | г | |
| неон | Ne | 10 | 20,1797 (6) | г, м | |
| нептуний * | Np | 93 | |||
| никель | Ni | 28 | 58.6934 (2) | ||
| ниобий | Nb | 41 | 92. | ||
| азот | N | 7 | 14,0067 (2) | г, р | |
| нобелий * | № | 102 | |||
| осмий | Ос | 76 | 190,23 (3) | г | |
| кислород | O | 8 | 15.9994 (3) | г, р | |
| палладий | Pd | 46 | 106,42 (1) | г | |
| фосфор | -П, | 15 | 30,973762 (2) | ||
| платина | Pt | 78 | 195.084 (9) | ||
| плутоний * | Pu | 94 | |||
| полоний * | Po | 84 | |||
| калий | К | 19 | 39.0983 (1) | ||
| празеодим | Пр | 59 | 140. (2) | ||
| прометий * | вечера | 61 | |||
| протактиний * | Па | 91 | 231.03588 (2) | ||
| радий * | Ra | 88 | |||
| радон * | Rn | 86 | |||
| рентген * | Rg | 111 | |||
| рений | Re | 75 | 186.207 (1) | ||
| родий | Rh | 45 | 102, | ||
| рубидий | руб. | 37 | 85,4678 (3) | г | |
| рутений | Ру | 44 | 101,07 (2) | г | |
| резерфорд * | Rf | 104 | |||
| самарий | см | 62 | 150.36 (2) | г | |
| скандий | SC | 21 | 44.955912 (6) | ||
| сиборгий * | Sg | 106 | |||
| селен | SE | 34 | 78,96 (3) | r | |
| кремний | Si | 14 | 28.0855 (3) | r | |
| серебристый | Ag | 47 | 107.8682 (2) | г | |
| натрий | Na | 11 | 22.98976928 (2) | ||
| стронций | Sr | 38 | 87,62 (1) | г, р | |
| сера | S | 16 | 32,065 (5) | г, р | |
| тантал | Ta | 73 | 180.94788 (2) | ||
| технеций * | Tc | 43 | |||
| теллур | Te | 52 | 127.60 (3) | г | |
| тербий | ТБ | 65 | 158. (2) | ||
| таллий | Тл | 81 | 204,3833 (2) | ||
| торий * | Чт | 90 | 232.03806 (2) | г | |
| тулий | ТМ | 69 | 168. (2) | ||
| банка | Sn | 50 | 118.710 (7) | г | |
| титан | Ti | 22 | 47,867 (1) | ||
| вольфрам | Вт | 74 | 183,84 (1) | ||
| унунгексий * | Uuh | 116 | |||
| унунокций * | Uuo | 118 | |||
| унунпентиум * | Uup | 115 | |||
| унунквадиум * | Uuq | 114 | |||
| унантриум * | Уут | 113 | |||
| уран * | U | 92 | 238.02891 (3) | г, м | |
| ванадий | В | 23 | 50.9415 (1) | ||
| ксенон | Xe | 54 | 131,293 (6) | г, м | |
| иттербий | Yb | 70 | 173,04 (3) | г | |
| иттрий | Y | 39 | 88, (2) | ||
| цинк | Zn | 30 | 65.409 (4) | ||
| цирконий | Zr | 40 | 91,224 (2) | г | |
| * Элемент не содержит стабильных нуклидов. Однако три таких элемента (Th, Pa и U) имеют характерный земной изотопный состав, и для них атомная масса сведена в таблицу. | |||||
| † Имеющиеся в продаже материалы Li имеют атомный вес в диапазоне от 6,939 до 6,996; если требуется более точное значение, оно должно быть определено для конкретного материала. | |||||
| г Известны геологические образцы, в которых элемент имеет изотопный состав, выходящий за пределы нормального материала. Разница между атомной массой элемента в таких образцах и массой, приведенной в таблице, может превышать указанную погрешность. | |||||
| m Модифицированные изотопные композиции могут быть обнаружены в коммерчески доступном материале, поскольку он был подвергнут нераскрытому или непреднамеренному изотопному фракционированию. Возможны существенные отклонения атомной массы элемента от указанной в таблице. | |||||
| r Диапазон изотопного состава нормального земного материала не позволяет дать более точное значение A r (E); Табличные значения A r (E) и погрешность должны применяться к нормальному материалу. | |||||
Источник: по материалам Pure and Applied Chemistry 78, no. 11 (2005): 2051–66. © IUPAC (Международный союз теоретической и прикладной химии).
Периодическая таблица — обзор
I.A Элементарные и атомные концепции
Периодическая таблица, великая классификационная схема химии, основана на двух самых фундаментальных концепциях в физической науке — элементах и атомах.В своих зачаточных формах обе эти идеи были изобретением досократических греческих философов. Первым из этих мыслителей был Фалес Милетский (ок. 624–545 до н. Э.), Который разделял идею о том, что вся материя происходит из одной субстанции. В то время как он считал воду элементарной субстанцией, другие, такие как Анаксимен, Гераклит и Анаксимандр, отдавали предпочтение воздуху, огню и апейрону (вечному, неограниченному элементу) соответственно.
Примерно в 450 г. до н.э., Эмпедокл (ок.490–430 гг. До н.э.), по-видимому, синтезировал некоторые из этих идей в своем аргументе о том, что вся материя состоит из различных смесей четырех первичных веществ — земли, воздуха, огня и воды. Два величайших философа классической античности, Платон (428–347 гг. До н.э.) и Аристотель (384–322 гг. До н.э.), переняли четыре элемента Эмпедокла, хотя Аристотель добавил пятый, quita essentia , который составлял кристаллические сферы неба. . Хотя некоторые ученые признали эти элементы еще в 17 веке, важно понимать, что эти четыре элемента были скорее философскими конструкциями, чем конкретными сущностями с химическими последствиями.
Точно так же древние греки предложили атомы не столько для объяснения конкретных природных явлений, сколько для объяснения постоянства среди изменений. Такие атомисты, как Демокрит из Абдеры (ок. 460–370 до н. Э.), Утверждали, что тело не может быть бесконечно разделено на части. В конечном итоге процесс должен был остановиться на уровне «неразрезанной» частицы, буквально ατ oμ os. Римский поэт Лукреций (ок. 100–55 до н. Э.) Утверждал, что атомы и пустота составляют все вещи, и развил эту идею для объяснения метеорологии и геологии, ощущений и секса, космологии и социологии и даже жизни и разума.Несмотря на столь амбициозную всесторонность, атомы не получили такого широкого признания, как четыре земных элемента, в основном потому, что Аристотель отверг их. Тем не менее, концепция элементарных частиц материи иногда использовалась в качестве рабочей гипотезы такими учеными, как Гассенди, Галилей, Бойль и Ньютон. Действительно, Ньютон зашел так далеко, что выразил это мнение: «Мне кажется вероятным, что Бог в Начальной форме имел Материю в твердых, массивных, твердых, непроницаемых, подвижных Частицах».
Таким образом, к 1700 году успехи химии поставили идею четырех элементов под серьезный вопрос, в то время как идея атомов получила научное распространение.Последовавший за этим век сделал многое для дальнейшего утверждения последнего и свержения первого. Антуан Лоран Лавуазье (1743–1794), француз, которого часто считают «отцом современной химии», сформулировал рабочее определение «простой субстанции» в своем тексте 1789 года, Traité Élementaire de Chimie . Первое издание включало таблицу из 33 элементарных веществ, которые не могли быть разложены химическими операциями. В этой таблице элементы были разделены на группы, такие как métalliques и non métalliques .Большинство металлов, перечисленных Лавуазье (например, сурьма, серебро, медь и железо), были известны и использовались веками. То же самое и с некоторыми неметаллами, такими как углерод и сера. Однако список Лавуазье также включал водород, кислород и азот — три газа, которые были недавно изолированы и, благодаря его теоретической системе, правильно идентифицированы как специфические элементарные вещества. По сути, все 33 исходных вещества Лавуазье все еще присутствуют в современной периодической таблице.Предположение Лавуазье о том, что пять «земель», которые он включает — известь, магнезия, барита, алюмний и кремнезем, — на самом деле могут быть сложными веществами, подтвердилось. Теперь мы знаем, что это оксиды кальция, магния, бария, алюминия и кремния. Две его записи, свет и тепло, вообще не являются материалами. Тем не менее концепция простых веществ Лавуазье и его предварительный список оказались очень важными для развития химии и периодической классификации элементов.
Например, четко определенная рабочая концепция элемента была необходима для разработки атомной теории Джоном Далтоном (1766–1844). В 1808 году этот английский школьный учитель опубликовал A New System of Chemical Philosophy , в котором изложил свои постулаты о структуре материи. Каждый элемент, утверждал Дальтон, состоит из идентичных, неизменных и уникально характерных атомов. Когда элементы объединяются в соединения, их атомы объединяются в фиксированном соотношении, которое характерно для соединения.Поскольку эти числа фиксированы, элементарный состав соединения по массе также постоянен. Это последнее свойство можно было довольно точно определить даже во времена Далтона. Однако у Дальтона не было прямого способа установить правильное атомное соотношение элементов любого соединения. Как следствие, он не мог с уверенностью вычислить относительные массы атомов различных элементов — их атомные массы или атомные веса. Атомные массы элементов и атомные отношения, характерные для конкретных соединений, проявляются в элементарном массовом составе соединений.Как только правильное атомное соотношение известно, атомные массы могут быть легко вычислены на основе массового состава. В качестве альтернативы, знание атомных масс позволяет преобразовать состав по массе в состав по атомному соотношению. Однако Далтон столкнулся с дилеммой уравнения с двумя неизвестными.
Эта дилемма продолжала преследовать химию в течение 50 лет и, следовательно, ограничивала полезность атомной теории. Из-за важности массовых соотношений в химических реакциях был консенсус, что характерная атомная масса элемента была важным свойством.Однако не было единого мнения о том, какие значения были правильными. Водород обычно считался самым «легким» элементом и, следовательно, ему обычно приписывалась атомная масса 1. По отношению к этому стандарту атомная масса кислорода составляла примерно 8, по мнению одних ученых, или 16, по мнению других. Ситуация зашла в такой печальный тупик, что развитие химии тормозится. Поэтому в 1860 году в Карлсруэ, Германия, была созвана специальная международная конференция с явной целью разрешить путаницу вокруг атомных масс.Примечательно, что два ученых, наиболее явно связанных с разработкой периодической таблицы Менделеева, россиянин Дмитрий Иванович Менделеев и немец Юлия Лотар Мейер, были среди присутствующих. Как только набор надежных атомных масс был принят научным сообществом [в значительной степени благодаря применению гипотезы Амадео Авогадро Станислао Канниццаро (1826–1910)], настало время для формулировки периодического закона и таблицы, основанной на в теме.
Что показывает Периодическая таблица?
Периодическая таблица химических элементов является одновременно культурной иконой и необычным объектом в научном пространстве.Эта страница исследует, что такое таблица Менделеева с точки зрения философии науки .
Введение
Хемогенез
Интернет-книга исследует, как химическая реактивность возникает из периодического
таблица элементов, использующая метафору химического дерева корень-ствол-ветвь, с периодической таблицей, расположенной в основании ствола:
Возникает вопрос: что на самом деле периодическая таблица , и что показывает ? Выясняется, что дело немного сложнее, чем может быть на
сначала появляются …
Во-первых, , длинная форма , периодическая таблица из 32 столбцов (по мнению автора, это предпочтительная формулировка):
Периодическая таблица из 32 столбцов [полная форма]
Но, PT обычно сокращается до «классической» 18-колоночной средней формы периодической таблицы, используемой WebElements и большинством других веб-сайтов и учебников:
WebElements 18 Столбец [средняя форма] Периодическая таблица
Существует многих других возможных формулировок, которые рассматриваются на следующей странице этой веб-книги.
Философия | Химия | Периодическая таблица
«[В 1913 году], когда Генри Мозли экспериментально определил и проанализировал рентгеновские спектры атомной внутренней оболочки, а Нильс Бор изобрел свою атомную модель, эмпирическая и теоретическая основа для числа элементов была найдена как число протонов в ядро для физика и как число электронов нейтрального атома для химика. «Это отражает концептуальную разницу:
«[Атомный номер] Z оказался полезным в качестве порядкового номера для упорядочивания ядер на изотопной [Segrè] диаграмме, а также для получения химически значимого порядка химических элементов». От: Физическое происхождение химических периодичностей в системе элементов , Чистая и прикладная химия | Том 91: выпуск 12, 2019 г., Li & Schwarz et al. al. |
Философы химической науки считают
элементы по-разному:
- Во-первых, есть
химический элемент как «основное вещество» ,
то есть абстрактный или трансцендентный элемент , сущность элемента , элемент как «носитель свойств», но не имеющий фактических
свойства, кроме атомного номера Z.Химические символы,
такие как H и Cu, и названия присваиваются элементу как основному веществу. - Изотопный состав ядра — консервативный , и различные ядерные свойства изменяются вместе с элементом, когда он подвергается химическим превращениям и химическим реакциям: средняя атомная масса, радиоактивность, ядерный спин, электроотрицательность и потому что Z = n (атомный номер равен главному квантовому числу в нейтральном атоме), квантовые числа и электроотрицательность.
- В-третьих, есть
это элемент как простая субстанция . Настоящий физический кусок медного металла весом 5,00 г () имеет множество,
измеримые внутренние свойства, такие как: плотность, проводимость,
цвет, чистота и т. д. Важно отметить, что эти свойства НЕ сохраняются, когда медь подвергается химическим реакциям, таким как растворение в концентрированной азотной кислоте.[В этой теме есть языковая проблема, и она касается использования технических терминов: «базовый» и «простой».Эти слова используются в таком большом количестве контекстов, что может быть очень трудно вспомнить, что здесь они имеют очень специфические значения.]
Важно, только
основное вещество и ядерные свойства сохраняются в соединении. Эти идеи можно проиллюстрировать с помощью утверждения:
«Натрий металлик
свойства и хлор, зеленый газ , не существуют в бесцветной кристаллической ионной соли,
натрия хлорид .»Другими словами, «серебристый металлический аспект натрия» и «зеленый газовый аспект хлора» не существуют в бинарном соединении хлорида натрия.
Эти вопросы обсуждаются
в статье Эрика
Scerri, HYLE — Международный журнал философии химии, Vol. 11, № 2 (2005), стр. 127-145: Некоторые аспекты метафизики химии и природы
элементов
Обобщая аргументы Шерри:
- Существует метафизический взгляд на природу элементов как основных веществ и носителей
собственности , которая восходит к древним грекам, задолго до
открытие атомов. - Менделеев настаивал
что его периодическая система классификации относилась к элементам как к основным
вещества, обладающие только одним атрибутом — атомным весом. - Панет, один из
основоположники современной радиохимии разделяли мнение Менделеева о
природа основной и простой субстанции, но изменено основное / трансцендентальное / абстрактное свойство
элемента от атомной массы / массы к атомному номеру, Z. - Элементы как базовые
вещество представляют естественных видов , хорошо понимаемый философский
позиция относительно характера классификации.Элементы как простые
вещества не проходят тест на естественный вид из-за наличия изотопов
и аллотропы и др.
Эрик Скерри указывает, что периодическая таблица Менделеева иногда характеризовалась как:
- представление, упорядоченная область, система классификации, модель, закон и / или теория
Автор соглашается с Шерри в том, что периодическая таблица Менделеева представляет собой упорядоченный домен . Но таблица Менделеева также является схемой .Данные, информация и знания о химических элементах могут быть отображены на периодической таблицы.
Периодические таблицы на стенах и в книгах: Что они показывают ? Почему проблема ? Периодические таблицы используют дизайн в качестве организующей схемы для перечисления химических элементов и представления физических данных и свойств материалов элементов. В своей простейшей форме периодические таблицы показывают элементы только с атомным номером Z и символом элемента. Строго говоря, , это показывает элементы как основную [трансцендентную, абстрактную] субстанцию. Тем не менее, они могут указать:
По мнению автора, здесь была логическая ловкость рук . Метафизическая периодическая таблица абстрактных основных веществ выдается за периодическую таблицу материальных свойств простых веществ, что совсем не одно и то же. Это вызывает путаницу относительно того, что именно представляет собой конкретная таблица Менделеева и что она показывает. |
Морфинг нескольких периодических таблиц
По крайней мере, три таблицы Менделеева могут быть легко идентифицированы (но, как мы увидим, на самом деле их намного больше ):
- Периодическая таблица из основных элементов с атомным номером Z и соответствующим атомным символом: H, He, Li и т. Д.
- Периодическая таблица из атома газовой фазы с соответствующими энергиями ионизации, спектрами и т. Д.
- Тогда есть периодическая таблица химикатов в бутылках , реальные материалы при стандартных [комнатных] условиях температуры и давления.
При перемещении через этих трех периодических таблиц сложность системы и количество свойств резко возрастают.
- Элементы периодической таблицы основных веществ обладают только свойством: атомным номером Z.
- Атомы в газовой фазе обладают следующими свойствами: энергия ионизации, сродство к электрону, атомный радиус, спектр излучения атомов и т. Д.
- Стандартные элементы состояния имеют множество свойств: электропроводность, плотность, молярные объемы, цвет, кристаллическую структуру, энтальпию гидратации и т. Д. В качестве веществ элементы могут присутствовать в виде: металлов, молекулярных материалов Ван-дер-Ваальса, сетчатых ковалентных веществ и даже промежуточные металлоиды.
А еще еще таблицы Менделеева:
Периодические таблицы могут отображать фазовое (твердое, жидкое или газовое) состояние элементарных материалов при стандартной температуре 25 ° C и при других температурах, например 2025 ° C (из pTable):
или:
- Даты открытия
- Страны, в которых было сделано открытие
- использует
- Свойства ЯМР
- и др…
Все эти многих и различных периодических таблиц трансформируются друг в друга , чтобы получить составной объект, который обычно известен как [и представляется] Периодическая таблица .
- Периодическая таблица в веб-пространстве, которая лучше всего иллюстрирует эту склонность к мультиморфизму, — это динамическая таблица pTable Майкла Дайя.
Периодическая таблица элементов как основных веществ
Полная периодическая таблица основных, абстрактных, трансцендентных субстанций, показывающая единственное свойство, атомный номер Z, которое ведет себя как порядковый номер:
Периодическая таблица основных веществ (атомный номер Z)
Символы и имена элементов: присвоено атомному номеру Z:
Периодическая таблица основных веществ (атомный символ)
В основной формулировке вещества атомный номер кислорода 8 — «O», а не обычная молекула «O 2 ».Точно так же сера (Z = 16) представляет собой S, а не желтое твердое вещество S 8 .
Обычная схема периодической таблицы просто показывает символы элементов в их
соответствующие периоды, группы и блоки.
Это или аналогичная формулировка — периодическая таблица Менделеева.
задумал: схема, показывающая элементы как базовые субстанции с их
позиции в схеме с акцентом на периодические
закон:
« Периодический
закон — это принцип, согласно которому определенные свойства элементов проявляются периодически.
при расположении по атомному номеру.Эти сходства можно отразить
лучше всего по таблице, так что общие черты между элементами появляются как в
строк и столбцов таблицы ». Википедия
Периодическая таблица сохраненных [ядерных] свойств
Сохраненные ядерные свойства являются следствием изотопного состава элемента, который напрямую определяет относительную атомную массу (определяемую как отношение средней массы атомов химического элемента в данном образце к 1/12 массы атома углерода – 12.)
Относительная атомная масса сохраняется в химических реакциях:
Na (масса = 22,99) + Cl (масса = 35,45) → NaCl (масса = 22,99 + 34,45 = 58,44)
Аналогичным образом радиоактивность передается с атомами. Радиоактивно меченый натрий будет реагировать с хлором с образованием радиоактивно меченного хлорида натрия.
Существует незначительный (но важный) кинетический изотопный эффект или KIE. Более тяжелые изотопы очень слабо реагируют на , чем более легкие изотопы, просто потому, что они менее подвижны.Эффект KIE наиболее заметен с водородом, где дейтерий, 2 H, имеет удвоенную массу протия, 1 H. Однако в первом приближении , KIE можно игнорировать.
В элементе базовой (абстрактной) субстанции атомный номер Z является просто порядковым (порядковым) номером. В периодической таблице сохраняемых [ядерных] свойств Z — это заряд атомного ядра, в нейтральном атоме это также число электронов, и, следовательно, оно напрямую определяет главное квантовое число n .
Квантовые числа, n , ℓ , m ℓ и m s , привести † к соответствующим электронным (орбитальным) конфигурациям:
Нейтральные атомы: n = Z Ионы: n = ( Z — заряд)
| символ | Z | n = (Z — заряд) | n | электронная структура |
| Na | 11 | 11-0 | 11 | 1 с 2 , 2 с 2 , 2 п 6 , 3 с 1 |
| Na + | 11 | 11-1 | 10 | 1 с 2 , 2 с 2 , 2 с 6 |
| Класс | 17 | 17-0 | 17 | 1 с 2 , 2 с 2 , 2 p 6 , 3 s 2 , 3 p 5 |
| Класс — | 17 | 17 — –1 = 17 + 1 | 18 | 1 с 2 , 2 с 2 , 2 p 6 , 3 s 2 , 3 p 6 |
† Обратите внимание, что не все атомные электронные структуры можно так легко вывести: упрощенные искусственные правила, такие как принцип aufbau Бора и правило Маделунга, подходят для более легких элементов основной группы, но они не всегда дают правильные результаты. с более тяжелыми d -блочными элементами.
Ядерный спин — это изотопное свойство, которое используется в ЯМР-спектроскопии, особенно с изотопами 1 H и 13 C. Ядерный спин сохраняется и передается с атомом от элементарного вещества к его соединениям.
Для электроотрицательности автор использует определение:
« Электроотрицательность — это мера, интегрированная по многочисленным физическим параметрам, способности газовой фазы или связанного атома притягивать электроны к себе .«
Натрий — это большой атом, который легко ионизируется. В реакциях натрий обычно реагирует с образованием иона натрия Na + . Эти особенности позволяют сделать вывод, что натрий является электроположительным элементом .
Хлор представляет собой небольшой атом с высоким сродством к электрону и склонностью к образованию ионов хлора, Cl — . Эти особенности позволяют сделать вывод, что хлор является электроотрицательным элементом .
Электроотрицательность — это не «простое» свойство элементарного вещества, такое как металлический блеск натрия или хлора, представленного в виде зеленого газа, но присущее каждому аспекту химии элемента, и оно перемещается вместе с атомом.Электроотрицательность — это сохраняющееся свойство, которое является следствием из Z .
Периодическая таблица газовой фазы
Атомы
Химические элементы как реальные, простые
элементарные вещества могут быть физически нормализованы в подобный набор, исследуя одноатомные атомы газовой фазы основного состояния материального вещества.
- Для некоторых элементов
переход в одноатомную газовую фазу тривиальный : инертные газы группы 18, He, Ar, Ne, Kr, Xe и Rn уже одноатомные, газ
фазовые объекты при стандартных условиях 298K и 100 кПа (25 ° C и 1.0 атм). Другими словами, они естественно
в желаемом состоянии. - Хлор и кислород двухатомные молекулярные
газы при комнатной температуре, но их можно легко превратить в атомарный газ путем нагревания при низком давлении. - Углеродные кипения
при 4027 ° C, что затрудняет получение пара в основном состоянии
атомы углерода — углеродный газ, C (г) — но это возможно. Вольфрам кипит при 5930 ° C. - Перемещение элемента из стандартного состояния в газовую фазу приравнивает энтальпию распыления, Δ при H
Периодическая таблица Земли
состояние атомов газовой фазы известно, и оно представляет собой периодическую таблицу самого
простейшие простые вещества:
Периодическая таблица атомов газовой фазы
Помимо названия, рисунок
точно такая же, как и периодическая таблица основных веществ, но эта таблица Менделеева представляет собой
реальные химические объекты с фактическими измеримыми физическими свойствами, в том числе:
- Средняя атомная
масса - Атомный радиус
- Точная масса и содержание составляющих изотопов
- Эффективная ядерная
заряд - Сродство к электрону
- Связывание электронов
энергия - Энергии ионизации: 1 st , 2 nd , 3 rd …
- Эмиссионные спектры. Университет штата Пенсильвания имеет динамическую спектральную периодическую таблицу, здесь,
который показывает атомные спектры всех элементов в газовой фазе:
Многие современные технологии используют
атомы газовой фазы, в том числе:
- Лампы натриевые для уличного освещения
- Цезий атомный
часы - Большинство тяжелых и короткоживущих антропогенных трансурановых
элементы, 104 — 118, известны только как короткоживущие атомы газовой фазы. - Атомно-адсорбционная спектроскопия (AAS) и ICP-OES [оптическая эмиссионная спектроскопия] используют атомы газовой фазы в основном состоянии для элементного анализа.
- В масс-спектрометрии атомы [или молекулы] превращаются в атомы газа, а затем в ионы газовой фазы, обычно ионы M + , в вакууме. Ионы ускоряются с использованием разности потенциалов, и определяется отношение массы к заряду частиц анализируемого вещества, масс-спектр.
- При изучении атома [или молекулы] in silico (построенного или математически смоделированного на компьютере) атом , фактически, изучается как изолированная газовая фаза.
Что особенно важно, , когда мы рассматриваем электронную структуру атома [или орбитальную структуру молекулы, если на то пошло], мы рассматриваем атом как изолированную сущность, точно так же, как это было бы в газе. фаза. Например, когда мы говорим «натрий имеет электронную структуру 1 s 2 , 2 s 2 , 2 p 6 , 3 s 1 », мы имеем в виду натрий атом газовой фазы, Na (г), а не натрий в твердом, металлическом состоянии, Na (т).
Периодическая таблица химических веществ при стандартных условиях
При стандартных условиях, 298К и 100кПа (25 ° C и 1,0 атм), химические элементы как простые вещества — настоящие химические вещества, химические реактивы, химические вещества в бутылках — представлены как:
- Металлы, металлоиды
или неметаллы
Примечание:
- Несколько элементов групп 3, 4, 5 и 6 (13, 14, 15 и 16) имеют несколько аллотропов (структурных форм).Есть много аллотропов B, P, S, Si и т. Д. Есть много металлических фаз Pu и т. Д.
- Углерод имеет бесчисленное количество аллотропов: графит, алмаз, бакминстерфуллерен C 60 , одностенные нанотрубки, многостенные нанотрубки и т.д.
- Форма фосфора P 4 определяется как стандартное состояние элемента, хотя на самом деле это не самый стабильный аллотроп в стандартных условиях.
- Строение астата неизвестно. Он может быть изоструктурным с йодом или может быть металлоидом.
Химические элементы как материал
вещества обладают множеством свойств, в том числе [из WebElements,
медь]:
- Стандартная недвижимость
условия 25 ° C и 1,0 атм: кристаллическая структура, молярный объем, твердость,
пр. - Изменения фаз под
нестандартные условия: температура кипения, аллотропы и др. - История
- Биология
- и т. Д.
Обилие | Твердость — по Виккерсу | Относительная чувствительность ЯМР |
Квантовая механика,
Спектры излучения и аксиоматическая периодическая таблица
В первой половине ХХ в.
века, много усилий было потрачено на то, чтобы составить периодическую таблицу
элементы аксиоматические («самоочевидные» или «неоспоримые»), т.е.пытаясь полностью понять
система Менделеева с точки зрения
квантовая механика.
В 1929 г. Павел
Дирак, как известно, утверждал, что эта ситуация была полностью и полностью достигнута в
принцип :
« Базовый
физические законы, необходимые для математической теории большей части
физики и всей химии, таким образом, полностью известны и
трудность только в том, что точное применение этих законов приводит к
к уравнениям слишком сложным, чтобы быть разрешимыми. «
P.A.M. Dirac, Proc.R.Soc.Lond.Ser.A
123 (1929) 714
Мы обязательно учим школу
и студенты университетов, что « периодическая таблица полностью понятна с точки зрения электронной теории », и эта линия рассуждений
продвинутый в другом месте этой веб-книги, здесь и на сайте HyperPhysics, здесь.
Аргумент выдвинут
что:
- Каждый элемент газовой фазы создает уникальный набор спектральных линий.
- Спектральные линии действуют как отпечаток пальца на наличие элемента (а сигнатура является количественной).
- Выкройка
спектральных линий можно полностью понять с точки зрения квантовой механики
через волновое уравнение Шредингера и его развитие: релятивистское уравнение Дирака, лэмбовский сдвиг и квантовая электродинамика (КЭД).
Да, существует эмпирическое (экспериментальное) соответствие между атомами газовой фазы и их спектрами, но есть ли соответствие 1: 1: 1 между: периодической таблицей, атомными спектрами и квантовой механикой?
Эрик Шерри: химик | Философ | Теоретик | Автор
Эрик
Шерри:
Эрик Скерри, Периодическая таблица: история и значение , Oxford University Press, 2006.Читайте интервью с автором здесь, а обзор книги здесь. |
оспаривает
полное и полное аксиоматическое отображение между теорией и периодической таблицей:
« Электронный
конфигурации не сводятся ни к квантовой механике, ни к квантовой механике [полностью]
могут ли они быть получены из любого другого теоретического подхода. Они получаются
сочетанием спектроскопических наблюдений и полуэмпирических методов
как aufbau схема Бора «. Полностью ли аксиоматизирована Периодическая таблица? Erkenntnis , 47 , 229-243, 1997
Причина несоответствия
касается сложности работы с многоэлектронными атомами (ионами и молекулами).
- Шредингер
волновое уравнение может быть решено только аналитически для одноэлектронных систем
как атом водорода, H • , и другие одноэлектронные системы: He + ,
Li 2+ , Be 3+ и т. Д., Википедия. Для многоэлектронных
системы, приближения в математике должны быть сделаны, чтобы иметь дело с электронно-электронным
взаимодействия и корреляции. Многоэлектронные атомы сложны
объекты в системном смысле. Математический
методы, используемые для описания химических систем, обычно прагматичны.
скорее, чем строгие, и они часто являются полуэмпирическими: т.е. частично
на основании экспериментальных данных. - Из Википедии: «Для атомов с двумя или более электронами определяющие уравнения могут быть решены только с использованием методов итерационного приближения.Орбитали многоэлектронных атомов качественно аналогичны орбиталям водорода, и в простейших моделях принято, что они имеют такую же форму. Для более строгого и точного анализа необходимо использовать численные приближения. Атомные орбитали часто расширяются в базисный набор орбиталей типа Слейтера, которые являются орбиталями водородоподобных атомов с произвольным зарядом ядра Z ».
Эффект заключается в том, чтобы
создавать хороший быстрый компьютерный код, который может эффективно предсказывать такие свойства, как атомная и молекулярная энергия, геометрия и спектры и т. д., но за счет
теории, являющейся полностью аксиоматической: формально логика лежащей в основе
теория становится размытой. В результате мы
получить полезную модель, но не математическое доказательство. - Действительно, существует глубокая разница между « квантовой химией », методами, методологиями и компьютерным программным обеспечением, используемыми физическими химиками и физиками-химиками, и лежащей в основе квантовой механикой в форме квантовой электродинамики ( QED ), самая точная и точная теория, известная человечеству.Химические проблемы просто слишком сложны [в настоящее время], чтобы их могла изучать QED, хотя в принципе могут быть .
- Итак, хотя можно объяснить и смоделировать спектры элементов газовой фазы, используя методы квантовой химии, анализ не является математическим доказательством.
Подробнее здесь: Физическое происхождение химических периодичностей в системе элементов , Теоретическая и прикладная химия | Том 91: выпуск 12, 2019 г., Li & Schwarz et al.al.
Более того, есть даже проблема с концепцией атомной орбиты :
Источник: Философия химии «Орбитали невозможно наблюдать, поскольку, строго говоря, их не существует». Дискуссия [об орбиталиях] является проявлением проблемы, которая имеет глубокие последствия для преподавания химии, поскольку учителя этой дисциплины не могут обойтись без концепции орбиталей в своем обучении [ включая в этой веб-книге ! ]. Некоторые авторы указали, что эта позиция противоречит предположению о том, что последнее слово по этому поводу за квантовой механикой: законна только концепция волновой функции; термин «орбитальный» не имеет никакого отношения к реальному миру. В частности, реалистичный взгляд на орбитали, принятый учителями химии, оказывается несовместимым с их собственной позицией, когда они вводят квантовую механику как основную объяснительную теорию химических явлений. На эту проблему явно указал Скерри, когда он задал вопрос: «Могут ли орбитали быть реальными в химии, но не в физике?» Совершенно очевидно, что эта парадоксальная ситуация имеет негативные последствия для глубокого понимания дисциплины по следующим причинам:
|
Базовый и простой
Вещество | Теоретическая и практическая химия: Имеет ли значение что-нибудь из этого ?
Читатель может подумать, что
концепция элемент-как-основная-субстанция и -элемент-как-простая-субстанция должна быть загадочным отвлечением .Однако анализ действительно влияет на то, как мы понимаем и
преподаю предмет химии.
Начинающим студентам-химикам всегда доступна таблица Менделеева, но, к сожалению, это не тот PT , который им действительно нужен . Студенты должны знать и понимать, что все уравнения реакций, включающие химические элементы, скорее всего, будут включать химическое вещество , химическое вещество в бутылке, реагент .Таким образом, реакции с водородом включают и должны показывать молекулярного водорода , H 2 и, следовательно, должны быть записаны как:
2H 2 + O 2 → 2H 2 O
, а НЕ:
2Н + О → Н 2 О
Аналогично: азот N 2 , кислород O 2 , фтор F 2 , хлор Cl 2 , бром Br 2 и йод I 2 .Реакции с участием этих объектов всегда следует записывать так, чтобы указывать на димерные частицы. Однако каким-то образом студенты также должны знать , что молекулярная сера, S 8 , и фосфор, P 4 , обычно записываются как связанные с S и P.
| QN к PT | ИНТЕРНЕТ База данных периодических таблиц |
© Марк Р. Лич 1999-
Запросы,
Предложения, ошибки, ошибки, опечатки…
Если есть:
Запросы
Комментарии
Предложения
Предложения по ссылкам
Отчеты об ошибках, опечатках или грамматических ошибках на этой странице,пожалуйста, свяжитесь с Марком Р. Личем, автором, используя [email protected]
Это бесплатно, открыто
Доступ к веб-книге — это продолжающийся проект , и мы будем благодарны за ваш вклад.


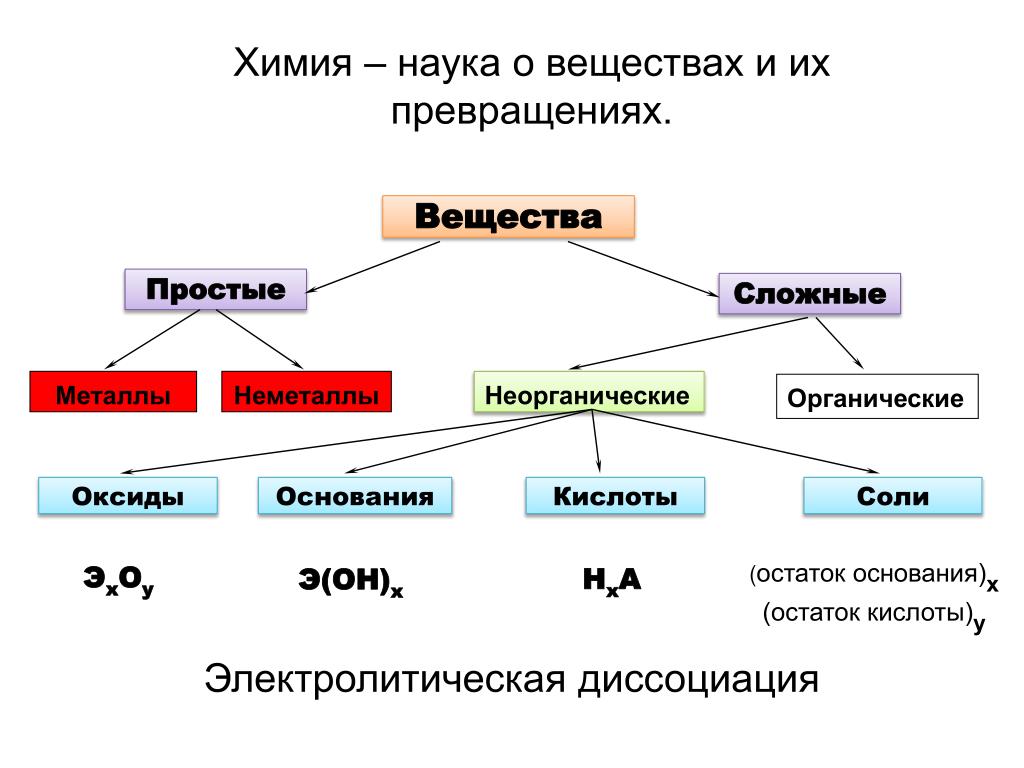
 Не разрушая молекул? Почему?
Не разрушая молекул? Почему?
